STUD!
FUSl PROTOPLAS
Solanurn khasianum
Clarke
D E N G A N
P ROTOPLAS
Solanum mammosum
L.
1
Olah
BUDHI
PRIYANTOPROORAM PASCASARJANA
INBTITUT PLRTANIAN BOOOR
Ringkasan
BUDHI PRIYANTO. Studi Fusi Protoplas S khasianum Clarke dengan protoplas
S mammosum L. (Di bawah bimbingan Prof. Dr Ir G. A. WATTIMENA, MSc., se- /
bagai ketua, Dr Ir L I W WINATA GUNAWAN, Dt Ir H. A. A. MATTJIK, Dr Ir M.
P
A. CHOZTN, MAgr. dan Prof. Dr G. WENZEL sebagai anggota).
Tujuan dari penelitian ini adalah mendapatkan hibrida somatik S. khasia-
w(+)&
mammosum yang fertil melalui elektrofusi protoplas.Protoplas diisolasi dari daun tanaman in vitro dengan campuran enzim selu-
lase 0.8% dan maserozim 0.1% dalam medium yang mengandung sukrosa 14%. Pe-
murnian protoplas dengan pengapungan di atas medium sukrosa 14% diikuti dengan
dua kali pencucian dalam larutan NaCL dan manito10.5 M ternyata tidak mengurangi
viabilitas protoplas. Dari satu gram daun segar S; khasianum dan S, mammosum
h
diperoleh masing-masing 3.5 juta dan 7.4 juta protoplas. Elektrofusi dilakukan
dengan menerapkan parameter fusi: frequensi medan
K
1 000 lcHz dengan kuatmedan 100 V/cm dan pulsa tunggal atau ganda selama 20 atau 30 ps pada kuat medan
1 200 hingga 2 000 Vlcm. Protoplas hasil fusi diregenerasikan dalam medium SKM
dan K8p yang dimodifikasi dengan mengubah susunan zat pengatur tumbuh dan os-
motikumnya. Medium SKMT, SKMB, KMS, dan KMBA didapati mendorong per-
tumbuhan dan perkembangan sel dan mikrokalus. Regenerasi tanaman diperoleh
Komposisi dan kadar zat pengatur tumbuh pada medium pembesaran tunas temyata
kritis bagi perkembangan kalus yang lebih lanjut. Kalus yang regeneratif lebih ban-
yak dihasilkan dalam medium pembesaran kalus PR yang mengandung zat pengatur 1 tumbuh tunggal zeatin sebesar 0.1 mgll daripada medium PK yang mengandung BAP
dan NAA. Kombinasi zeatin (2 mg/l) dan IAA (0.1 mg/l) dalam medium regenerasi r
tanarnan RS lebih mendorong regenerasi tanaman lengkap dibanding dengan medium
RMB yang mengandung kombinasi zeatin ( 1 mgll), BAP (0.5 mgll), IAA (0.5 mg/l)
dan GA, (0.2 mg/l). Zeatin tampaknya mutlak hams tersedia pada medium pembesa-
ran kalus dan regenerasi tanaman agar diperoleh laju regenerasi yang tinggi. Secara
rata-rata laju regenerasi tanaman lengkap adalah 10.4% dari kalus yang ditanam da-
lam medium regenerasi. Jalur pemindahan kultur SKMT ke PR ke RS dan SKMB ke
PR ke RS memberikan laju regenerasi tanaman tertinggi, yaitu masing-masing 22.9%
dan 33.3%. Jalur pemindahan melewati PK hanya menghasilkan laju regenersi 3.6%.
Analisis isozim untuk menduga hibrida somatik dilakukan dengan sistem en-
zim peroksidase, glutarnat oksaloasetat transaminase, leusin aminopeptidase, malat
dehidrogenase, isositrat dehidrogenase, dan esterase. Elektroforesis dijalankan pada
gel poliakrilamida bergradien konsentrasi akrilamida 8-14.5% dengan sistem discon-
a.
Dari sistem enzim yang dicoba diketahui, bahwa hanya esterase yang mem-berikan resolusi pita yang jelas. Sebanyak 44 tanaman regeneran diperiksa dengan
sistem enzim esterase dan diketahui, bahwa 25 (56.8%) di antaranya adalah hibrida
somatik. Angka ini setara dengan yang dilaporkan dalam literatur (Sihachakr
et
d.,
- -
dapat memperkirakan sifat hibrida regeneran dengan tepat karena semua tanaman
yang menunjukkan pola isozim gabungan kedua tetua (hibrida) ternyata terbukti hi-
brida pula di lapang.
/
Hasil pengamatan di lapang menunjukkan adanya keragaman morfologi di
antara hibrida soamtik. Hampir semua tanaman tub*da membentuk buah tetapi I
hanya sebagian yang berbiji. Enam genotipe, yaitu R34, R57, R58, R8 1, R83, dan
R102 menunjukkan fertilitas yang lebih tinggi daripada regeneran hibrida lainnya.
Solasodin dalam buah masak diekstrak denga metanol dan dianalisis secara
kuantitatif dengan HPLC pada kolom =versed dan eluen bufer Tris.HC1 dalam
asetonitril. Kandungan solasodin buah hibrida somatik ternyata hampir setara dengan
kandungan solasodin buah S. fiasianum dan jelas lebih besar dibanding dengan buah
S. mammosum. Tanaman hibrida somatik mempunyai potensi resistensi terhadap
-
penyakit layu.
Dari hasil yang diperoleh, 6 tanaman hibrida somatik, yaitu R34,
R57,
R58,R81, R83, dan R102, dapat direkomendasikan sebagai sumber keragaman genetik
barn dalam pemuliaan
S.
U s i a n u m . Kandungan solasodin buah tanaman-tanamantersebut mendekati kandungan solasodin buah S. khasianum dan lebih resisten ter-
hadap penyakit layu. Regeneran nomor R57 dan R83 mernpunyai keunggulan, yaitu
pertumbuhannya cepat dan tegar serta fertil. Selain itu duri pada nomor R57 relatif
STUD1 FUSI PROTOPLAS Solanum khasianum Clarke DENGAN
PROTOPLAS S o l a ~ ~ u m mammosun~ L.
oleh
BUDHI PRIYANTO
Disertasi sebagai salah satu syarat untuk mernperoleh
gelar Doktor
pada
Program Pascasarjana, Institut Pertanian Bogor
PROGRAM PASCASARJANA
INSTITUT PEIlTANIAN BOGOR
Bogor
Judul Disertasi
Narna Mahasiswa
Nornor Pokok
: STUD1 FUSI PROIOPLAS Solanum khasianum
Clarke DENGAN P R W P L A S Solanum
mamrnosum L.
: BUDHI PRIYANTO
: 90509 AGR
Menyetujui
I . Komisi Pembimbing
Dr Ir H. A. A. Mattiik Prof. Dr G. Wenzel Prof.Dr Ir G. A. Wattimena, MSc.
Ketua
( I L L ;
Anggota Anggota
Pascasarjana D r Ir Livy Winata Gunawan Dr Ir M.
Anggota
Tanggal lulus: --
A. Chozin, MAgr. Anggota
Judul Disertasi
Nama Mahasiswa
Nomor Pokok
: STUD1 FUSI PROIQPLAS S o l a n u ~ ~ l khasianum
Clarke DENGAN PROTOPLAS Solanum
mammosum L.
: BUDHI PRlYANTO
: 90509 AGR
Menyetujui 1. Komisi Pembimbing
Prof Dr Ir G. A. Wattimena, MSc. Ketua
p r Ir Livy Winata Gunawan Dr Ir M. A . Chozin, MAgr.
Anggota Anggota
Dr Ir H. A. A. Mattjik
Anggota Anggota
2. Ketiia Program Studi 3. Direktur Program Pascasarjana
A
-Prof Dr Ir A. Surkati
P E T E ~ F ~ G -
-
?/
Penulis dilahlrkan di Jakarta pada tanggal 5 September 1955 dari orang tua
Soenarni dan Soepardjo Pnjopoespito. Menikah derigan Taruni Sri Prawasti dan di-
,
karuniai dua orang anak, Wirasmi Primadiyanti (Iyas) dan Rizky Wirastomo (Uki).
Pendidikan SD hingga SMA diselesaikannya di Jakarta. Pada tahun 1974 penulis lu-
lus SMAN VI Jakarta.
Penulis memperoleh gelar kesarjanaan dalan Ilmu-ilmu Pertanian dari Fakul-
tas Pertanian Universitas Gadjah Mada di Yogyakarta pada tahun 1981. Pendidikan
pascasa jana diselesaikannya pada tahun 1987 di University College London dengan
memperoleh gelar Master of Science dalam Biochemical Engineering.
UCAPAN TERIMA KASIH
Pertama-tama penulis mengucapkan segala pujian bagi Allah, Tuhan Penguasa
,
Alam dan Yang Menguasai Pengetahuan.3 Dalam kesempatan ini penulis ingin mempersembahkan karya ini sebagai
penghargaan dan rasa terimakasih yang mendalam kepada kedua orangtua, ibunda
Soenarni Prijopoespito dan almarhum ayahanda Soepardjo Pnjopoespito. Karya ini
merupakan buah dari usaha beliau berdua dalam mendidik dan mengarahkan anak-
anaknya. Penulis ingin pula mempersembahkan karya ini kepada kedua mertua, Ba-
pak Condronagoro dan almarhumah Ibu Condronagoro. Dorongan dan doa mereka
menguatkan penulis dalam usaha menyelesaikan karya ini. Karya ini juga merupakan
kenangan kepada almarhumah Ibu Condronagoro karena material Solanum mamrno-
9 yang digunakan dalam karya ini adalah atas usaha beliau.
Penulis ingin menyampaikan rasa terimakasih yang mendalam dan pengharga:
an setinggi-tingginya kepada Komisi Pembimbing. Nasehat, saran, dan kritik dari
Prof. Dr Ir Wattimena, MSc. selaku Ketua, dan Dr Ir Livy Winata Gunawan, Dr Ir H.
A. A. Mattjik, Dr Ir M. A Chozin, dan Prof. Dr G. Wenzel, selaku Anggota, telah
membentuk dan mewarnai disertasi ini. Oleh karena itu penghargaan atas karya ini
pantas disampaikan kepada beliau semua. Demikian pula penulis menyampaikan ter-
imakasih kepada Dr Makin Ibnu Hadjar dan Prof Dr Ir Jajah Koswara selaku Penguji
Penelitian ini dilaksanakan di berbagai laboratorium dan lapang. Untuk itu
penulis ingin menyampaikan terimakasih kepada Direktur PAU Bioteknologi IPB,
Ketua Jumsan Biologi FMIPA IPB, Direktur Teknologi Pemukiman dan Lingkungan
Hidup (TPLH) BPPT dan Direktur Institute for Resistance Genetics di Griinbach, Jer-
man, atas fasilitas yang disediakan untuk penelitian ini.
,
Ucapan terimakasih dan penghargaan ingin penulis tujukan pada kolega di
Direktorat TPLH, BPPT, khususnya kepada Dominikus dan Joko atas bantuan peng-
amatan di lapang dan analisis isozim; kepada Saeful clan Tuti yang telah membantu
analisis solasodin; kepada Titin Handayani atas saran-sarannya dalam analisis kromo-
som; dan kepada Sati, Mardi dan Atang yang telah tekun memelihara kultur dan me-
laksanakan aklimatisasi. Penulis ingin meyampaikan terimakasih dan penghargaan
kepada kolega Institute for Resistance Genetics di G ~ n b a c h : E. Gerrick, M.
Stattmann, A. Lossl, U. Frei, dan N. Q. Thach, atas saran dalam fusi protoplas clan
analisis isozim serta kromosom.
Bantuan teman-teman di IPB telah melancarkan penyelesaian karya ini. Oleh
karena itu perkenankan penulis menyampaikan ucapan terimakasih dan penghargaan
khusus kepada Dr M. Jusuf dan kolega: Ibu Utut, Pak Ence, Pak Miftah, Pak Soni dan
Pak Aris di Lab Genetika; Dr Alex Hartana di PAU Ilmu Hayati; Pak Ikin Mansyoer
dan rekan-rekan di Lab Zoologi: Pak Bambang, Pak Joko, Pak Dedi dan Pak Faraja-
lah. Komentar, saran serta kritik dan keleluasaan dalam menggunakan fasilitas yang
tersedia di laboratorium-laboratorium tersebut telah membantu kelancaran penelitian.
Terimakasih clan penghargaan juga disampaikan kepada teman-teman Laboran
dan Teknisi, khususnya Helmiah dan Pak Ajat di PAU Bioteknologi IPB, Pak Nunuk
di Lab Zoologi, dan Pak Nana, Pak Kosasih, serta Pak Tijan di Kebun IPB di Tajur. 1 Penetitian ini didukung oleh dana dari berbagai sumber. Untuk itu perkenan-
kan penulis menyampaikan terimakasih kepada Deputi Ketua BPPT Bidang Adminis- 8
trasi atas dana untuk pelatihan di Jerman dan beasiswa PPKP bagi disertasi ini; serta
kepada Direktur Teknologi Pemukiman dan Lingkungan Hidup, BPPT, Pimpro P.P.
Biotek dan Proiect Leader BTIG yang telah mengusahakan darn bag1 penelitian ini.
Ucapan terimakasih dan penghargaan disampaikan pula kepada Rektor IPB,
Direktur Program Pascasarjana, dan Ketua Program Studi Agronomi yang telah mem-
berikan kesempatan dan fasilitas bagi penulis selama menempuh pendidikan di IPB.
Kepada semua pihak yang telah membantu penelitian ini, baik langsung mau-
pun tidak langsung, diucapkan terimakasih dan penghargaan
.
Kemudahan yang penulis nikmati selama penelitian ini tidak lepas dari kelua-
san pergaulan isteri penulis, Tamni Sri Prawasti. Semangat dan dorongan - kadang-
kadang menjadi setengah pemaksaan
-
yang diberikannya merupakan api pendorongbagi penulis untuk menyelesaikan disertasi ini. Kenakalan dan kelucuan serta
komentar anak-anak, Iyas dan Uki, telah sering mengendorkan ketegangan dalam
masa-masa yang sulit selama penulis menyelesaikan disertasi ini. Untuk jasa yang
demikian besar, penulis tidak dapat menemukan rangkaian kata-kata yang sepadan.
Akhimya penulis mohon maaf atas kekhilafan selama penelitian dan penyu-
DAFTAR IS1
Halaman
DAFTAR TABEL
. . .
viiiDAFTAR GAMBAR
. . .
x/
. . .
I
.
PENDAHULUAN 1. . .
.
I1 TINJAUAN PUSTAKA 4
A
.
Isolasi dan Regenerasi Protoplas. . .
B.
Fusi Protoplas. . .
. . .
.
111 BAHAN DAN METODE
. . .
A
.
Sumber Eksplan. . .
B
.
Isolasi dan Kultur Protoplas. . .
C . Elektrofusi Protoplas
D
.
Seleksi Dini Tanarnan Hasil Fusi Protoplas. . .
E.
Keragaan Fenotipik Tanaman Hasil Fusi di Lapang. . .
F.
Analisis Solasodin. . .
. . .
IV
.
HASIL DAN PEMBAHASAN. . .
A
.
Percobaan AwalB
.
Regenerasi Tanaman Hasil Fusi Protoplas. . .
C.
Identifikasi Tanaman Regeneran In Vitro. . .
D.
Keragaan Fenotipik Tanaman di Lapang. . .
E
.
Analisis Kandungan Solasodin. . .
V
.
PEMBAHASAN UMUM. . .
.
. . .
VI KESIMPULAN
. . .
DAFTAR PUSTAKA
. . .
DAFTAR TABEL
Nomor Halaman
/
. . .
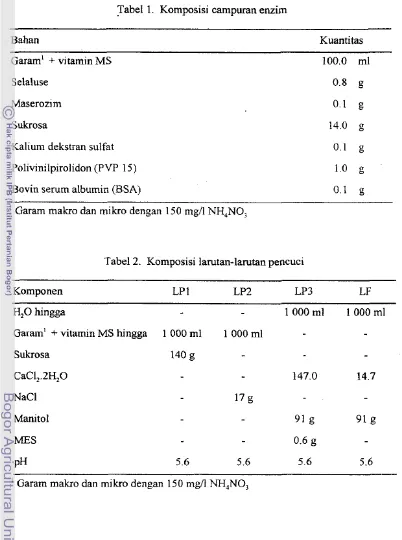
Komposisi campuran enzim 39
39
. . .
Komposisi larutan pencuci
,
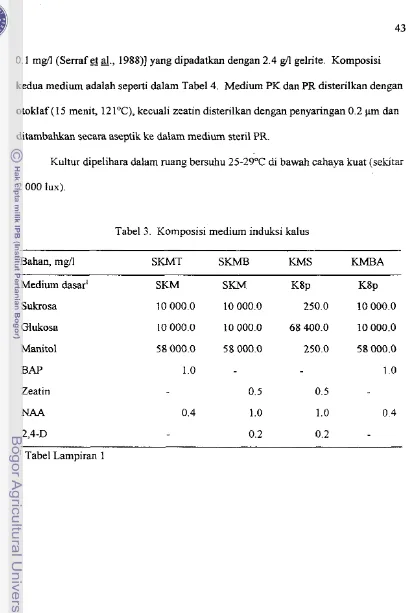
Komposisi medium induksi kalus
. . .
43 Komposisi medium pembesaran kalus dan regenerasi tanaman 45 Viabilitas protoplas S, khasianum pada tiga langkah isolasi dan 57 pemurnian protoplas. . .
Daya hasil dan viabilitas protoplas & khasianum dan S. mam-
mosum
. . .
57 Pertumbuhan sel dan mikrokalus dari protoplasS,
khasianumyang ditanam di dalam medium induksi kalus SKM dan K8p
. . .
dengan berbagai kerapatan awal 59
Jumlah kalus yang tumbuh pada medium pembesaran kalus PK
satu minggu setelah pernindahan kultur induksi kalus
. . .
60 Kenampakan hasil fiisi pada berbagai kuat medan clan lamapulsa
. . .
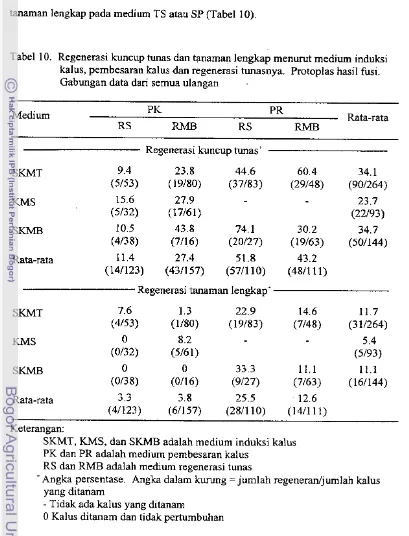
65 Regenerasi kuncup tunas dan tanaman lengkap menurut me-dium induksi kalus, pembesaran kalus dan regenerasi tunasnya 72
Pengelompokan regeneran hasil fusi protoplas berdasarkan
.
.
.
pola pita isozim EST
. . .
82Jumlah kromosom pada S, khasianum, S, mammosurn dan
regeneran hasil fusi
. . .
83 Besaran kuantitatif berbagai karakter morfologiS.
khasianum,S. mammosum, clan regeneran hasil fusi protoplas
. . .
- 93
Eigenvalue dan nilai koefisien komponen utarna dari
peubah-peubah tipe pola EST dan karakter morfologi tanaman . .
dilapang
. . .
109 Beberapa karakter morfologi terpilih pada kelompok genotipeHl/A
. . .
113 Kadar solasodin pada buah S, khasianum, S, mammosum, danLampiran
1. Komposisi medium SKM dan K8p
. . .
138 /2. Pola pita EST regeneran hasil fusi protoplas dan penamaan tipe
polapita
. . .
140 Data kuantitatif karakter morfologi regeneran hasil fusi3.
,
DAFTAR GAMBAR
Nomor Halaman
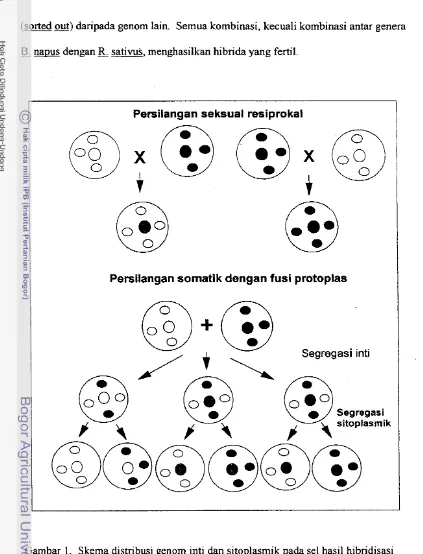
Skema distribusi genom inti dan sitoplasmik pada sel hasil hi- bridisasi seksual dan fusi protoplas . .
.
. .. .'.
.. . .
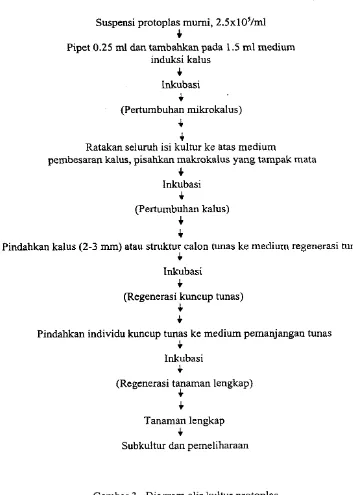
Diagram alir isolasi dan pemwnian protoplas. . .
Diagram alir kultur protoplas. .
.
.
. .
. . .
. .
.
Diagram alir fusi protoplas
. . .
. .
. .
. . .
.
Pelepasan protoplas dari jaringan daun S, khasianum
. . .
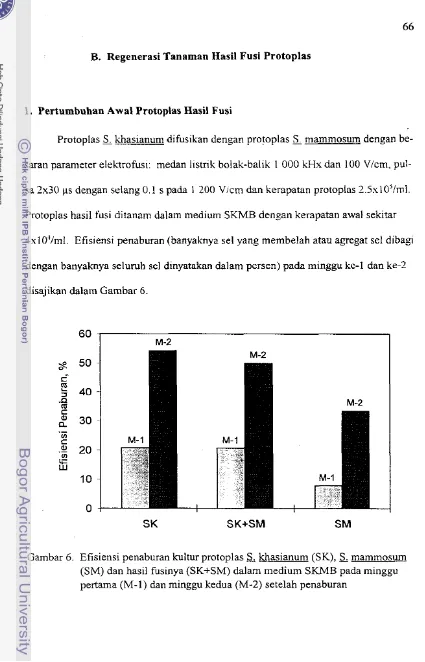
Efisiensi penaburan kultur protoplas S, khasianum, S, mammo-sum,
clan hasil fusinya dalam medium SKMB. . .
.
. . .
Perkembangan kulturprotoplas dalam medium induksi kalus
.
Perkembangan kalus dan organogenesis tunas pada medium pembesaran kalus dan regenerasi tunas
.
. .
.
. .
.
. . .
Tanaman in vitro tetua dan regeneran hasil fusinya.
. . .
Pola pita isozim EST dan MDH
. . .
. . .
. .
. .
.
Karakter morfologi organ generatif tanaman .& khasianum
. .
.
Karakter morfologi organ generatif tanaman
S,
mammosum. .
Habitus tanaman tetua dan regeneran hasil fusi protoplas
. . .
Ketidakberaturan bentuk daun pada beberapa genotipe kelom- pokH1
. . .
Perkembangan pucuk tunas tidak normal tanaman hasil fusi protoplas S, khasianurn dengan S: mammosum . ..
.. . .
Bentuk dan sebaran dun S, khasianum, S, mammosum, dan regeneran hasil fusi protoplas .. .
.. .
. ..
.. . .
. . . . Morfologi bunga % khasianum, S. mamrnosum, dan regeneran hasil fusi protoplas. . .
. . .. . .
. . ..
. . . ..
..
.. .
Stmktur tidak normal pada bunga tanaman kelompok H1 . . .. .
Morfologi polen dewasa
. . .
. . .. .
.. . .
..
. .. . .
. . . Buah masak dari regeneran kelompok H1 . . ..
. .. . .
.Buah masak dari regeneran kelompok H2
. .
..
. . .. . .
.. . .
Irisan melintang buah regeneran hasil fusi protoplas S , khasia-23
.
Viabilitas polen danpersentase buah yang berbiji dari S.
kha-mammosum dan regeneran hasil fusi protoplas
. . . .
105/
24
.
Morfologi biji S. khasianum. S, mammosum. dan regeneran. . .
hasil fusi protoplasnya 107
25
.
Proyeksi genotipe hasil fusi pada sumbu 1 clan sumbu 2. . .
110.
. . .
26: Proyeksi genotipe hasil fusi pada sumbu 1 dan sumbu 3 110
. . .
27
.
Proyeksi genotipe hasil fusi pada sumbu 2 clan surnbu 3 1 1 12 8 Dendogram regeneran hasil fusi protoplas S, khasianum den-
I. PENDAHULUAN
Latar belakang
/
Solanum khasianum Clarke diintroduksi ke Indonesia dan India sebagai tana-
,
man penghasil alkaloid solasdin pada tahun 1977 (Rosita, Rostiana, Wahid, dan
Sitepu, 1991). Menurut Sudiarto, Chairani, Rosita, dan Wahid (1985), spesies ini le-
bih unggul dalam ha1 produksi alkaloid per satuan luas lahan dan waktu dibanding
dengan spesies penghasil diosgenin, Dioscorea composita dan Q@@ speciosus.
Budidaya S, khasianum menghadapi kendala karena tanaman ini berduri dan
rentan terhadap penyakit layu, terutama di dataran rendah (Sudiarto
a
d.,
1985;Supriadi, 1985; Januwati dan Poerba, 1985). Penyambungan dengan batang bawah
S. sanitwongsai dan S. torvum dapat menekan infeksi bakteri pada pembuluh kayu
-
(Supriadi, 1985). Namun penyambungan dipandang tidak praktis mengingat S, &
sianum adalah tanaman semusim dengan populasi 25 000 tanaman per ha (Sudiarto
et
al., 1985). Selain itu ketidaksesuaian sambungan antara S, khasianum dengan species
-
Solanum lain dapat menurunkan daya hasil (Rosita
d.,
1991).Resistensi S. khasianurn terhadap penyakit layu dapat ditingkatkan dengan
rekombinasi genetik dengan spesies yang resisten melalui upaya persilangan, trans-
formasi genetik dan fusi protoplas. Sifat resistensi dapat ditransfer dari satu kultivar
ke kultivar lain melalui wahana fusi protoplas (Thach, Frei dan Wenzel, 1993). Salah
satu sumber resistensi terhadap penyakit l a p adalah S. torvum (McCammon dan
-
:yaitu 0.1% (Mann, 1978). S, mamrnosum L. resisten terhadap penyakit layu (Boma,
1990). Spesies ini telah beradaptasi dengan lingkungan Indonesia, berbuah besar, dan
kandungan solasodin buahnya tinggi, yaitu 2% Wann, 1978). Dengan demikian S,
/
mammosum mempunyai potensi sebagai sumber sifat resistensi yang dapat ditransfer
ke
S,
khasianum. >Masalah penelitian
Kendala terbesar dalam usaha menyilangkan S, khasianurq dengan S. mammo-
sum
adalah inkompatibilitas seksual (Boma, 1990). Fusi protoplas dapat mengatasimasalah ini karena mampu menghasilkan hibrida dari spesies yang secara seksual in-
kompatibel (Gleba dan Shlumukov, 1990; Grosser, Gmitter, Jr., Tusa, dan Chandler,
1990).
Keberhasilan kultur protoplas antara lain ditentukan oleh genotipe donor.
Dengan demikian untuk merealisasi pembentukan hibrida somatik antara S. khasia-
num
dan S. mammosum diperlukan pengetahuan mengenai isolasi, fusi protoplas danregenerasi protoplas serta hasil fusinya.
Sarnpai sekarang informasi rnengenai kuitur dan fusi protoplas S, khasianum
dengan spesies Solanum lain masih langka. Dan pustaka-pustaka diketahui, bahwa
hibrida dapat diperoleh melalui fusi protoplas
L
hasianum dengan S. melongena (Si-hachakr, Haicour, Serraf, Barrientos, Herbreteau, Ducreux, Rossignol dan Souvanna-
Wenzel, 1994). Namun penulis belurn mengetahui adanya publikasi mengenai fusi
protoplas S, khasianum dengan S. mammosum.
Tujuan penelitian
Tujuan utama penelitian ini adalah mendapatkan tanaman hibrida hasil fusi
protoplas S, khasianum dengan S. mammosum. Hibrida somatik ini diharapkan fertil.
Untuk mencapai tujuan itu diperlukan mempelajari:
1. Metode isolasi dan regenerasi protoplas S. khasianum dan protoplas S. mam-
mosum
2. Metode fusi protoplas S. khasianum dengan protoplas S. mammosum serta re-
generasinya menjadi tanarnan yang lengkap
3. Metode pembuktian secara dini hibrida somatik yang terbentuk
It.
TINJAUAN PUSTAKAFusi protoplas dapat menghasilkan hibrida-hibrida somatik yang mempunyai
keragaman genom inti dan sitoplasmik yang luas. Manfaat praktis dari fusi protoplas
/
antara lain pemindahan resistensi antar kultivar (Thach aJ., 1993) atau bahkan antar
genera (Lelivelt dan Krens, 1992). Keragaman sitoplasmik dari hibrida yang dihasil- >
kan yang berkaitan dengan sifat mandul jantan ( cvto~lasnic male sterilitv [c.m.s.l)
(Pelletier, Primard, Ferault, Vedel, Chetrit, Renard dan Delounne, 1987) dapat di-
manfaatkan secara praktis. Akhir-akhir ini ditunjukkan, bahwa daya hasil umbi
tanaman kentang hasil fusi protoplas berhubungan dengan komposisi tipe mitokon-
drianya (Lbssl, Frei dan Wenzel, 1994).
Dalam beberapa kasus, hibrida somatik bersifat fertil (Stattrnann
g
d.,
1994;Sundberg, Landgren dan Glimelius, 1987). Dibanding dengan hibrida
SI
aculeatis--(x)L khasianum yang praktis steril (Titin Handayani, 1996), viahilitas polen
hibrida somatik
&
aculeatissimum(+)S, khasianum sebesar 87% (Stattrnann gtaJ.,
,1994) jelas menunjukkan tingkat fertilitas yang lebih besar. Namun pada beberapa
kasus lain fertilitas hibrida somatik rendah (Guri dan Sink, 1988; Kirti, Narasimhulu,
Prakash dan Chopra, 1992; Sihachakr
g
aJ.,
1988). Hal ini menjadi masalah padaspesies yang diperbanyak dengan biji. Pada tanaman yang dibiakkan secara vegetatif,
misalnya kentang, fertilitas rendah tidak menjadi masalah.
A. lsolasi dan Regenerasi Protoplas
1. Sumber Protoplas
/
Protoplas dapat diisolasi dari suspensi sel (Chand, Davey dan Power, 1990;
Gleddie, Keller dan Setterfield, 1985) atau organ tanaman seperti hipokotil (Dupuis, r
Pean dan Chagvardieff, 1990), daun (Binding, Nehls, Kock, Finger dan Mordhorst,
1981; Kowalczyk, Mackenzie dan Cocking, 1983; Serraf, Sihachakr, Chi, Herbre-
teau, Rossignol dan Ducreux, 1988), keping kotiledon biji muda (Wei dan Xu, 1988;
Dhir, Dhir dan Widholm, 1991), daun kotiledon pada kecambah (Jia, Fu dan Lin,
1986), tangkai daun (Eilers, Sullivan dan Skirvin, 1988) danpolen (Yang dan Zhou,
1992). D a m merupakan sumber yang lebih umum digunakan karena lebih mudah
diperoleh dan menghasilkan protoplas yang seragam (Ferreira dan Zelcer, 1989;
Eriksson, 1985).
Tanarnan in vitro merupakan sumber protoplas yang digunakan oleh banyak
peneliti. Dengan kultur in vitro, jaringan tanaman dapat dimudakan kembali melalui
pemindahan ke medium baru. Tanaman ini secara fisiologis seragam sehingga dapat
menghasilkan protoplas dengan daya hasil
(m)
dan daya regenerasi yang lebih be-sar (Binding, 1975; Binding@
d.,
1981; Binding dan Nehls, 1977; Haberlach, Co-hen, Reichert, Baer, Towill dan Helgeson, 1985). Keuntungan lain dari kultur in vitro
sebagai sumber eksplan adalah penghindaran kontaminasi sehingga organ tanaman ti-
dak perlu disterilkan. Sterilisasi, yang merupakan keharusan bila menggunakan
sumber tanaman dari rumah kaca, dapat merugikan viabilitas protoplas yang di-
peroleh (Eriksson, 1985; Scott, Chin dan Wood, 1981; Shahin, 1985).
Tanaman in vitro pada umumnya ditumbuhkan dengan lama penyinaran
/
antara 12 dan 16 jam. Intensitas cahaya yang diperlukan antara 2 000 hingga 6 000
lux (Binding gt &I., 1981; Haberlach
a
aJ., 1985; Serrafa
&I., 1988). Kadang- >kadang intensitas setinggi 12 000 hingga 23 000 lux diterapkan (Masson, Lecerf,
Rousselle, Perennec dan Pelletier, 1987; Thomas, 198 1) dengan alasan penempatan
tanaman di bawah cahaya berintensitas kuat dengan lama penyinaran yang lebih
pendek dapat memperbaiki pertumbuhan protoplas kentang.
Daya hasil dan viabilitas protoplas yang diisolasi dari tanaman yang dikultur
dalam wadah bertutup rapat adalah rendah (Cassels, 1980; Perl, Aviv dan Galun,
1988). Cekaman
(w)
etilen di dalam wadah diduga menjadi penyebabnya. De-ngan penambahan antietilena (perak tiosulfat) ke dalam medium, daya hasii dan via-
bilitas protoplas dapat diperbaiki (Mbllers, Zhang dan Wenzel, 1992; Perl gt
d.,
1988; Rethmeier, Jansen, Snel, Nijkamp dan Hille, 199 1 ; Xu, Pehu, Malone clan
Jones, 199 1).
2. Isolasi Protoplas
Pelaksanaan isolasi protoplas dapat dibagi menjadi tiga tahap, yaitu praplas-
molisis, perlakuan enzim, dan pemumian protoplas. Setiap langkah selalu menggu-
- :
yang tinggi ini penting untuk menjaga agar protoplas tetap utuh. Karena dengan hi-
langnya dinding sel yang berfungsi sebagai penguat mekanik, integritas protoplas
menjadi sangat bergantung pada osmolalitas medium,
a. Pravlasmolisis
Manfaat praplasmolisis adalah untuk mengurangi penyerapan enzim melalui
endositosis selama pengerutan sel (Eriksson, 1985) dan mencegah pengaruh toksik
dari enzim pektolisis, yaitu enzim yang menyebabkan maserasi jaringan, terhadap sel
(Bateman dan Basham, 1976). Praplasmolisis dilakukan dengan perendaman bahan di
dalam larutan garam (Dupuis a!., 1990) atau gula, misalnya manitol 0.4 - 0.7 M
atau sukrosa 0.3 M (Binding, 1975; Diaz, Moreno, dan Power, 1988; Kowalczyk
al., 1983; Mollers, 1990; Rethmeier
d.,
199 1; Shahin, 1985).-
Langkah praplasmolisis kadang-kadang diganti dengan pengkondisian bahan
di dalam medium yang mengandung BAP dan NAA selama 24 jam pada 4'C (Haber-
lach
a
d.,
1985; Shepard dan Totten, 1977). Hal ini diyakini dapat meningkatkankestabilan protoplas.
Dalam beberapa protokol, langkah praplasmolisis dihilangkan sama sekali
(Perl
a
gl., 1988; Scott &a!., 1981) karena praplasmolisis dianggap tidak memper-Dinding sel terdiri atas tiga bagian, yaitu lamela tengah, dinding primer,
dan
dinding sekunder (Bateman dan Basham, 1976). Lamela tengah tersusun sebagian be-
sar atas pektin. Dinding primer clan sekunder disusun terutama oleh selulosa dan
hemiselulosa. Oleh karena itu pada umumnya komposisi medium enzim mengan- J
dung aktivitas pektinase (maserase), hemiselulase, dan selulase.
Ada dua pendekatan yang dapat diterapkan dalam perlakuan enzim, yaitu me-
tode satu tahap dan metode dua tahap (Eriksson, 1985; Keller, Setterfield, Douglas,
Gleddie, dan Nakamura, 1982). Pada metode satu tahap, maserase (mengandung ak-
tivitas pektinase dan hemiselulase) dan selulase diberikan sekaligus di dalam medium
enzim. Pada metode dua tahap, jaringan mula-mula diberi enzim maserase atau pek-
tinase yang menghancurkan iamela tengah sehingga sel terpisah satu sama lain. Sel-
sel bebas itu kemudian diberi selulase yang melarutkan dinding sel sehingga terben-
tuk protoplas. Metode satu tahap banyak diterapkan karena praktis, walaupun cara
itu, dengan bahan berupa daun, menghasiikan lebih sedikit protoplas karena hanya sel
palisade yang terikut.
Jenis enzim yang dipakai ditentukan oleh jenis jaringan tanamannya. Carn-
puran maserozim R-10 dan selulase R-10 digunakan untuk isolasi protoplas dari me-
sofil daun tanaman in vitro S. khasianum &
X
J
S.
laciniatum (Serrafa
4,
1988),S. melon~ena, S. tonzlm (Sihachakr
g
d.,
1988; Sihachakr, Haicour, Chaput, Barri--
tanaman pot dibutuhkan campuran enzim yang lebih kuat aktivitasnya, misalnya pek-
toliase Y-23 untuk S. khasianum (Kowalczyk
g
A,,
1983) dan campuran selulisin clan driselase untuk S. t o m (Guri, Volokita dan Sink, 1987)./
Selain osmotikum, di dalam campuran enzim biasanya ditarnbahkan garam
sederhana seperti CaCl, (Binding dan Nehls, 1977; Kowalczyk gt
d.,
1983) atau >campuran beberapa garam seperti CPW (Frearson, Power dan Cocking, 1973; Serraf
et al, 1988; Sihachakr
g
A,,
1988) clan garam makro dan mikro suatu medium (Guri--
et al., 1987; Haberlach
a
al, 1985; Mbllers, 1990; Shepard dan Totten, 1977).--
Senyawa lain sexing ditambahkan, misalnya albumin serum anak sapi (BSA)
(Hunt dan Helgeson, 1989), polivinilpirolidon (PVP) (Haberlach gt
&
1985; Shepirddan Totten, 1977), natrium tiosulfat (Zaghmout, Holland, Torrello dan Polacco,
1990), kalium dekstran sulfat (Moilers, 1990) dan zat pengatur turnbuh (Haberlach
g
al., 1985; Masson &&I, 1987; Shahin, 1985). Manfaat kaliurn dekstran sulfat adalah
-
untuk menghllangkan pengaruh toksik beberapa unsur yang dikandung enzim atau
dilepas oleh protoplas, misalnya ribonuklease (Keller
g
d.,
1982). BSA dan PVP di-yakini berfiungsi mengikat senyawa fenol dan fenoloksidase. Penambahan auksin dan
sitokinin dipercaya dapat mencegah kekurangan zat pengatur tumbuh selama inkubasi
semalam sehingga diperoleh daya hasil protoplas yang konsisten (Masson
g
aJ.,c. Pemurnian Proto~las
Pemurnian protoplas dilakukan untuk membuang sisa enzim dan memisahkan
protoplas dari serasah sel. Prosedur pemurnian biasanya terdiri atas beberapa langkah
/
penyaringan dan sentrifugasi. Larutan pencuci yang digunakan bersifat hipertonik
dan biasanya mengandung garam, terutama Ca-- yang berfungsi menstabilkan mem- >
bran plasma (Eriksson, 1985). Untuk memisahkan protoplas dari serasah besar, cam-
puran enzim dan protoplas disaring dengan saringan halus (50 sampai 100 pm) yang
terbuat dari nilon atau baja tak berkarat. Untuk memisahkan protoplas dari serasah
halus dapat diterapkan beberapa metode, antara lain pengapungan, sentrifugasi dan
pencucian berulang, dan pengendapan tanpa sentrifugasi (Larkin, 1976). Metode
pengapungan biasanya memberikan hasil yang lebih konsisten.
Metode pengapungan dikembangkan berdasarkan prinsip pemisahan diferen-
sial karena adanya perbedaan kerapatan jenis. Protoplas mesofil daun, yang bewaku-
ola banyak, mempunyai kerapatan jenis yang lebih kecil
dari
serasah sel sehingga bilacampuran disentrifugasi dalam lamtan berkerapatan jenis tertentu, protoplas akan
mengapung. Larutan yang berkerapatan jenis besar dapat diciptakan dari larutan su-
krosa 11 -2 1 % (rapat jenis 1.044
-
1.09 g/ml) (Wolf, Brown dan Prentiss, 1989), Lym-phoprep (rapat jenis 1.077 g/ml) (Larkin, 1976; Guri &I., 1987), atau campuran
isoosmotik yang bergradien kerapatan jenis 1.01 - 1.06 g/ml (Harms dan Potrykus,
1978a, 1978b; Poulsen, 1987). Bergantung pada tujuan mengisolasi protoplasnya,
dengan sukrosa 11-18% (Frearson
g
gl., 1973; Haberlachg
gl., 1985; Kowalczykg
al., 1983; Shahin, 1985) atau pencucian dengan larutan garam atau manitol (Diaz
g
-
al., 1988; Guri gt
d.,
1987; Mdllers 1990; Rethmeierg
gl., 1991; Sihachakref
gl.,-
/
1988; Zaghmout gtgl., 1990).
Kemurnian protoplas dapat dilihat dengan mengetahui viabilitasnya. Viabili- I
tas protoplas dapat ditetapkan dengan metode eksklusi zat wama dan fluoresensi.
Pada metode eksklusi, protoplas yang mati dengan cepat menyerap zat warna karena
membran protoplas mati tidak selektif terhadap zat wama tersebut. Sebaliknya,
membran protoplas hidup menolak zat wama tersebut sehingga protoplasnya tidak
tenvamai (Gaff dam Okong'O-ogola, 1971; Larkin, 1976; Widholm, 1972). Pada me-
tode fluoresensi dengan fluoresein diasetat (FDA), membran protoplas hidup bersifat
permeabel terhadap FDA tetapi tidak permeabel terhadap fluoresein, yaitu senyawa
hasil pemecahan FDA oleh esterase yang terdapat dalam protoplas. Hasilnya, proto-
plas viabel berfluoresensi hijau-kuning karena mengakumulasi fluoresein sedangkan
protoplas mati tidak (Larkin, 1976; Widholm, 1972).
3. Regenerasi
Regenerasi protoplas menjadi tanaman lengkap adalah proses perkembangan
yang bertahap. Proses regenerasi diawali dengan pembentukan dinding sel. Tahap
perkembangan ini merupakan tahap yang sangat kritis karena integritas protoplas
osmolalitasnya. Setelah dinding sel terbentuk, perkembangan sel selanjutnya adalah
seperti pada kultur seI lainnya. Di dalam Mtur, sel membelah dan membentuk
koloni sel yang berkembang dari individu protopias. Koloni sel ini berkembang lebih
/
lanjut menjadi mikrokalus. Pada medium yang sesuai mikrokalus berkembang men-
jadi kalus yang regeneratif dan akhrnya menjadi tanaman lengkap. I
a. Induksi Kalus
(i) Komposisi Medium Kultur
Protoplas dapat dikulturkan dalam medium sederhana yang tersusun atas ga-
ram makro dan mikro, vitamin, zat pengatur turnbuh, dan gula sebagai osmotikum
(Durand, Potrykus dan Donn, 1973; Frearson aJ., 1973; Masson
a
aJ., 1987; Na-gata dan Takebe, 1971; Per1
g.,
1988; Shepard, 1980; Shepard dan Totten, 1977;Thomas, 1981). Namun dalam medium yang lebih kaya, efisiensi pembelahan sel
dan pembentukan kalus dari protoplas
&
aviculare sertaS.
sisvmbriifolium (Gleddieet a]., 1985) dan
S,
khasianum (Kowalczyk gtd.,
1983) meningkat.--
Komposisi medium kompleks pada umurnnya diturunkan dari medium K8p
(Kao dan Michayluk, 1975). Modifikasinya antara lain dengan mengubah kadar glu-
kosa, sukrosa serta komposisi zat pengatur tumbuh (Chand
e
aJ., 1990; Kowalczyk gtal., 1983). Menurut Kowalczykgt
d.
(1983), kadar sukrosa yang tinggi dapat mence--
gah penurunan pH yang mengganggu pertumbuhan sel semasa awal kultur protoplas
.
.
S. khasianum. Bufer lemah MES dapat digunakan untuk mencegah perubahan pH di
dalam medium K8p (Tan, Rietveld, van Marrewijk dan Kool, 1987; Serraf @
d.,
1988; Sihachakr @ aJ, 1988).
Dua medium lain, yaitu VKM dan SKM, banyak digunakan untuk berbagai
/
spesies Solanaceae. Medium VKM (Binding dan Nehls, i977) disusun berdasarkan
komposisi bahan organik dari K8p dan garam anorganik dari V-47 (Binding, 1974).
Medium VKM dan modifikasinya digunakan untuk regenerasi protoplas herba dikotil
(Binding gl., 198 l), kentang (Binding, Nehls, Schieder, Sopory dan Wenzel, 1978;
Mbilers, 1990; Mallers
g
d.,
1992; Serraf, Sihachakr, Ducreux, Brown, Allot, Bar-g h ~ dan Rossignol, 1991; Thach @
d.,
1993), dan hasil fusi protoplas S, khasianum dengan&.
aculeatissimum (Stattrnann @aJ.,
1994). Modifikasi yang diterapkan meli-puti pengurangan glukosa dan penambahan sukrosa.
Medium SKM menurut Hunt dan Helgeson (1989) disusun berdasar K8p de-
ngan perubahan kadar beberapa unsur tertentu termasuk gula. Pada medium ini asam
organik dihilangkan sama sekali, sedangkan albumin serum anak sapi (BSA) ditam-
bahkan dengan kadar 0.2%. BSA dinyatakan sebagai unsur yang sangat mendukung
perkembangan sel sehingga tidak dapat dihlangkan dari komposisi ini tanpa meng-
ganggu pertumbuhan dan perkernbangan protoplas. Beberapa vitamin dikurangi ka-
damya atau dihilangkan sama sekali dan kadar fosfat dinaikkan menjadi empat kali
kadar semula di dalam K8p. Dengan susunan medium baru ini, protoplas dan sel
tunggal Solanum dapat dikulturkan dengan kerapatan sangat rendah. Thach
4.
(1993) memodifikasi lebih lanjut medium SKM dengan menambahkan 0.1 M manitol
Selain ketiga komposisi tersebut, para peneliti menyusun komposisi medium
yang khas untuk regenerasi genotipe tertentu. Medium TM dikembangkan
untuk
re-generasi protoplas tomat oleh Shahin (1985). Medium ini dilaporkan sesuai pula un-
/
tuk kultur protoplas kentang (Lillo, 1989). Medium khas yang mengandung asam
organik dari K8p mgunakan untuk regenerasi protoplas S. torvum (Guri
a
&.
(1987)'
dan Guri dan Sink (1988),
(ii) Zat Pengatur Tumbuh
Medium yang digunakan dalarn kultur protoplas mengandung kombinasi zat
pengatur tumbuh, terutama auksin dan sitokinin, yang diperlukan untuk mendorong
pembelahan dan pertumbuhan protoplas (Eriksson, 1975). Tidak adanya auksin dan
sitokinin dalam medium kultur protoplas tomat mengakibatkan gagalnya pembelahan
sel (Shahin, 1985).
Kebutuhan akan jenis dan konsentrasi zat pengatur tumbuhan ditentukan oleh
spesies atau kultivar. Secara umum kombinasi NAA dan 2,4-D dengan zeatin atau
BAP banyak diterapkan, terutama untuk regenerasi protoplas Solanum. Kolnbinasi
zat pengatur tumbuh yang sering digunakan antara lain NAA + 2,4-D + zeatin (Bin-
ding dan Nehls, 1977; Kowalczyk gt
d.,
1983; Serraf @d.,
1988; Sihachakrs
d.,
1988), NAA + 2,4-D
+
BAP (Lillo, 1989), NAA + BAP (Frearsong
&.,
1973; Huntdan Helgeson, 1985; Nagata dan Takebe, 197 1 ; Shepard dan Totten, 1977; Shepard,
.
.
1980), NAA +