KERUSAKAN SEGMENTAL PADA TULANG DOMBA YANG
DIIMPLAN DENGAN KOMPOSIT
HIDROKSIAPATIT-KITOSAN (HA-K)
AYU BERLIANTY
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa skripsi Kajian Morfologi Proses
Persembuhan Kerusakan Segmental pada Tulang Domba yang Diimplan dengan
Komposit Hidroksiapatit-Kitosan (HA-K) adalah karya saya dengan arahan dari
pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi
mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan
maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan
dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Februari 2011
on Sheep’s Bone Implanted with Hydroxyapatite-Chitosan (HA-C) Composite. Under direction of SRIHADI AGUNGPRIYONO and KIAGUS DAHLAN.
This research was aimed to study the morphology of healing process on sheep’s bone implanted with hydroxyapatite-chitosan (HA-C) composite. This research would also present information about the potency of HA-C composite as synthetic bone graft biomaterial or bone implant. Three local sheeps were used in this study. HA-C composite was implanted on the medial of the left tibia bone while the same part of right tibia was treated as control without implant. All implant were harvested at 30, 60, and 90 days post-operation. The observation parameters were the condition, shape, and degradation degree of the implant, bonding between implant and host bone, new bone ingrowth into the implant, and signs of inflammation reaction around the implant. The result showed that the healing process on control bone was faster than those of the implanted bone. As far as 90 days observation in this present study was concerned, HA-C implant did not show characteristics for biodegradability, bioresorbability, osteoconductivity, and bioactivity. However, it showed biocompatibility properties for host body. It is suggested that the implant used in this study is more suitable to be developed as synthetic bone graft biomaterial for application on large defects with healing time longer than 90 days.
Keywords: hydroxyapatite, chitosan, bone implant, bone healing, tibia bone, sheep.
Segmental pada Tulang Domba yang Diimplan dengan Komposit Hidroksiapatit-Kitosan (HA-K). Dibimbing oleh SRIHADI AGUNGPRIYONO dan KIAGUS DAHLAN.
Penelitian ini bertujuan untuk mengkaji morfologi proses persembuhan pada tulang domba yang diimplan dengan komposit hidroksiapatit-kitosan (HA-K). Penelitian ini akan memberikan informasi mengenai potensi komposit HA-K sebagai biomaterial pengganti tulang sintetis atau implan tulang. Tiga ekor domba lokal digunakan dalam penelitian ini. HA-K diimplantasikan pada bagian medial dari tulang tibia kiri, sementara bagian yang sama dari tibia kanan diperlakukan sebagai kontrol tanpa implan. Seluruh implan kemudian dipanen pada hari ke-30, 60, dan 90 pascaoperasi. Parameter pengamatan antara lain keadaan, bentuk, dan tingkat degradasi implan, ikatan antara implan dengan tulang, pertumbuhan tulang baru ke dalam implan, dan tanda-tanda reaksi inflamasi di sekitar implan. Hasil penelitian ini menunjukkan bahwa proses persembuhan pada tulang kontrol berlangsung lebih cepat dibandingkan dengan tulang yang diberi perlakuan implan. Sejauh waktu pengamatan 90 hari pada penelitian ini, implan HA-K belum menunjukkan sifat biodegradabilitas, bioresorbabilitas, osteokonduktivitas, dan bioaktivitas, namun telah menunjukkan sifat biokompatibilitas bagi tubuh. Oleh karena itu, implan yang digunakan dalam penelitian ini lebih tepat dikembangkan sebagai biomaterial sintetik pengganti tulang untuk aplikasi pada defek berukuran besar yang membutuhkan waktu persembuhan lebih lama dari 90 hari.
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
HIDROKSIAPATIT-KITOSAN (HA-K)
AYU BERLIANTY
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Nama : Ayu Berlianty
NIM : B04062278
Disetujui
drh. Srihadi Agungpriyono, Ph.D, PAVet(K) Pembimbing I
Dr. Ir. Kiagus Dahlan, M.Sc. Pembimbing II
Diketahui
Dr. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan
Nya sehingga skripsi ini berhasil diselesaikan. Penelitian ini dimulai bulan April
2009 hingga Agustus 2010 dengan judul Kajian Morfologi Proses Persembuhan
Kerusakan Segmental pada Tulang Domba yang Diimplan dengan Komposit
Hidroksiapatit-Kitosan (HA-K).
Penyelesaian skripsi ini tidak terlepas dari bantuan berbagai pihak. Penulis
ingin mengucapkan terima kasih kepada:
1. Keluarga tersayang (Ayah Suwoto, Ibu Widya Thaher, dan adik Fadjaruddin
Qadr) atas segala dukungan, dan kasih sayang yang telah diberikan.
2. drh. Srihadi Agungpriyono, Ph.D, PAVet(K) dan Dr. Ir. Kiagus Dahlan, M.Sc.
selaku pembimbing skripsi atas segala bimbingan, arahan, dan waktu yang
telah diberikan kepada penulis.
3. Dr. drh. Hj. Gunanti, MS atas saran dan arahan pada prosedur bedah tulang.
4. drh. Riki Siswandi, drh. M. Fakhrul Ulum, Bapak Engkos, Bapak Katim, dan
seluruh staf di Laboratorium Bedah dan Radiologi, Laboratorium Patologi,
dan Laboratorium Anatomi Fakultas Kedokteran Hewan IPB atas bantuannya.
5. drh. Usamah Afiff, M.Sc. selaku dosen pembimbing akademik.
6. Tim penelitian “Domba-Shaker”: Asmawati, Rachmat Ayu Dewi Haryati, Gendis Aurum Paradisa, Dwi Kolina Pratiwi, Santi Purwanti, dan Raditya
Pradana Putra atas kerjasama dan bantuannya selama ini.
7. Ibnu Habibi Rahman atas dukungan, doa, dan kasih sayangnya selama ini.
8. Nurussifa, drh. Winda, Gita, drh. Zhouzh, Astria, Putra, Bakhtiar, Hadi, Edo,
Galuh, Fiona, Sekar, Sonni, Kak Agus, warga kost “Bateng 69”, dan Angkatan
“43sculapius” atas bantuan dan persahabatannya.
Akhir kata penulis menyadari bahwa skripsi ini masih jauh dari kata
sempurna sehingga penulis terbuka terhadap saran dan kritik yang diberikan.
Semoga skripsi ini dapat berguna dan bermanfaat bagi kemajuan ilmu maupun
bagi para pembacanya.
Bogor, Februari 2011
Penulis dilahirkan di Jakarta pada tanggal 28 Mei 1988
dari ayah yang bernama Suwoto dan ibu yang bernama Widya
Thaher. Penulis merupakan anak sulung dari dua bersaudara.
Tahun 1994 penulis lulus dari TK Taman Indria Depok. Tahun
2000 penulis lulus dari SD Negeri Depok Baru 3, kemudian
pada tahun 2003 penulis lulus dari SLTP Negeri 2 Depok.
Selanjutnya pada tahun 2006 penulis lulus dari SMA Negeri 1 Depok dan pada
tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk
IPB (USMI). Penulis memilih Fakultas Kedokteran Hewan.
Selama mengikuti perkuliahan, penulis aktif dalam berbagai kepanitiaan
dan organisasi internal kampus. Penulis juga aktif dalam Himpunan Minat Profesi
Hewan Kesayangan dan Satwa Akuatik (Himpro HKSA), Ikatan Mahasiswa
Kedokteran Hewan Indonesia (IMAKAHI), dan Komunitas Seni Steril (KSS)
DAFTAR ISI
Halaman
DAFTAR ISI ……… x
DAFTAR TABEL ……… xi
DAFTAR GAMBAR……… xii
PENDAHULUAN………..….. 1
Latar Belakang ………. 1
Tujuan Penelitian ………. 3
Manfaat Penelitian ………..…. 3
TINJAUAN PUSTAKA……….….. 4
Tulang ……….. 4
Matriks Ekstraseluler Tulang (Bone Extracellular Matrix) ………….… 5
Klasifikasi Tulang ……… 6
Proses Histogenesis Tulang ………. 8
Proses Modeling dan Remodeling Tulang ……… 10
Persembuhan Kerusakan Tulang………. …. 11
Biomaterial Pengganti Tulang……….. 14
Hidroksiapatit (HA)……….. 15
Kitosan (K)………..…. 16
Komposit Hidroksiapatit dan Kitosan (HA-K).……… 17
Domba Lokal (Ovis ammon aries) Sebagai Hewan Coba….………..…. 18
MATERI DAN METODE PENELITIAN ………..…. 20
Waktu dan Tempat Penelitian ……….……. 20
Materi Penelitian………. …. 20
Metode Penelitian………. 21
HASIL DAN PEMBAHASAN……… 26
Gambaran Makroskopis Tulang……….. …. 26
Gambaran Mikroskopis Preparat Tulang Gosok………. …. 29
Gambaran Mikroskopis Preparat Tulang Dekalsifikasi……… 32
SIMPULAN DAN SARAN……….….… 48
DAFTAR TABEL
Halaman 1. Persembuhan tulang pada fraktur tulang sederhana………... 12
2. Format data hasil pengamatan evaluasi histologi terhadap preparat
dekalsifikasi………...………. 24
3. Hasil pengamatan makroskopis terhadap tulang perlakuan pada
berbagai periode pengamatan……….……… 26
4. Hasil evaluasi histologi terhadap preparat dekalsifikasi pada
DAFTAR GAMBAR
Halaman
1. Struktur kanalikuli dan osteosit yang terkurung dalam lakuna………….... 5
2. Osteon yang merupakan unit struktural primer tulang. Terdiri atas lamel-lamel konsentris dan saluran Havers………... 7
3. Berbagai gambaran struktur tulang. Tulang kompak dan cancellous (A), dan potongan melintang tulang panjang (B)………... 8
4. Proses osifikasi intrakartilagenous………... 9
5. Proses remodeling tulang………...….……….…… 10
6. Proses persembuhan tulang………...………...… 11
7. Struktur kimia kitosan…...………...……….………... 17
8. Diagram prosedur penelitian………...………....…. 25
9. Sayatan melintang dari tulang tibia yang diberi perlakuan implan selama 30 hari (A), 60 hari (C), dan 90 hari (E), serta tulang tibia kontrol selama 30 hari (B), 60 hari (D), dan 90 hari (F) pascaoperasi. Tanda panah merah menunjukkan lokasi defek tulang. Sayatan ini menunjukkan bagian struktur tulang: i = implan, j = jaringan ikat, n = pertumbuhan jaringan baru yang menutupi defek, dan s = sumsum tulang. Bar A, B, C, dan D = 2,5 mm; E dan F = 2 mm………. 28
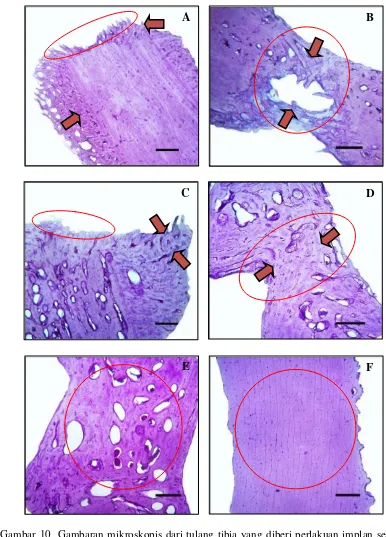
10.Gambaran mikroskopis dari tulang tibia yang diberi perlakuan implan selama 30 hari (A), 60 hari (C), dan 90 hari (E), serta tulang tibia kontrol selama 30 hari (B), 60 hari (D), dan 90 hari (F) pascaoperasi. Tanda panah merah menunjukkan daerah pertumbuhan tulang baru. Lingkaran merah menunjukkan lokasi defek tulang. Pewarnaan Hematoksilin. Bar = 0,5 mm………. 31
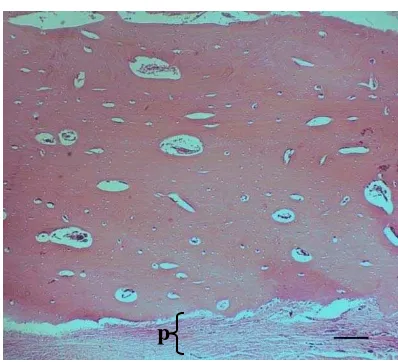
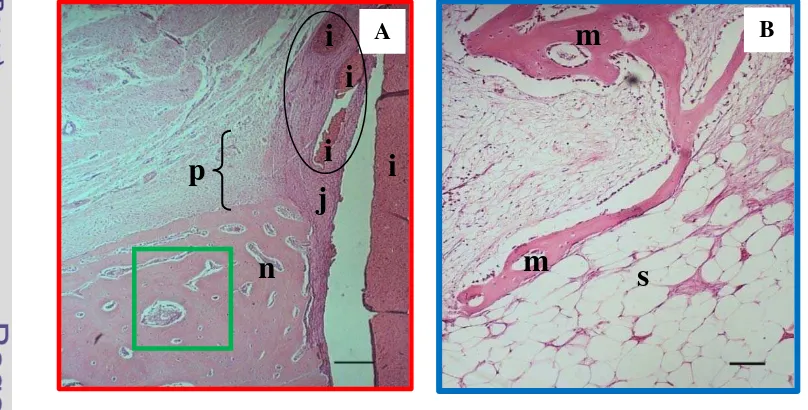
11.Gambaran mikroskopis tulang tibia yang diberi perlakuan implan selama 30 hari pascaoperasi. Gambar ini memperlihatkan kondisi implan yang masih utuh serta bagian struktur tulang: i = implan, j = jaringan ikat, n = woven bone, p = periosteum, dan s = bagian sumsum tulang. Pewarnaan HE. Bar = 2 mm………... 34
12.Gambaran mikroskopis daerah yang dibatasi oleh kotak merah di gambar 11. Gambar ini memperlihatkan daerah perbatasan antara implan dengan jaringan tulang baru (woven bone) yang dibatasi oleh jaringan ikat. Keterangan gambar: i = implan, j = jaringan ikat, dan n = woven bone. Pewarnaan HE. Bar = 10 µm………... 34
14.Gambaran mikroskopis daerah yang dibatasi oleh kotak hijau di gambar 11. Gambar ini memperlihatkan daerah sumsum tulang yang sel-selnya berproliferasi dan bertransformasi menjadi sel-sel osteogenik. Pada daerah tersebut juga terdapat struktur tulang rawan. Keterangan: c = tulang rawan, o = sel-sel osteogenik, dan v = pembuluh darah. Pewarnaan HE. Bar = 10 µm……….. 35
15.Gambaran mikroskopis tulang tibia kontrol selama 30 hari pascaoperasi. Gambar ini memperlihatkan daerah defek tulang yang telah menutup serta bagian periosteumnya (p). Pewarnaan HE. Bar = 20 µm……… 36
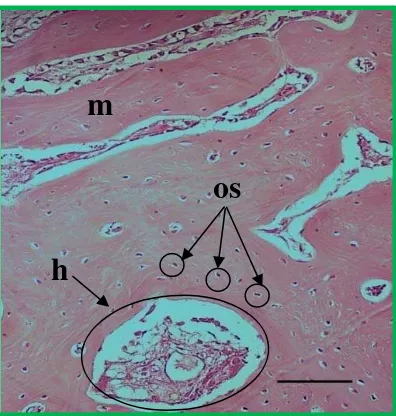
16.Gambaran mikroskopis daerah defek tulang tibia kontrol selama 30 hari pascaoperasi, yang memperlihatkan struktur tulang baru yang terdiri atas: os = osteosit, h = saluran Havers, dan m = matriks tulang. Pewarnaan HE.
Bar = 10 µm………. 36
17.Gambaran mikroskopis tulang tibia yang diberi perlakuan implan selama 60 hari pascaoperasi. Gambar ini memperlihatkan kondisi implan yang masih utuh serta bagian struktur tulang: i = implan, j = jaringan ikat, n = jaringan tulang baru, p = periosteum, dan s = sumsum tulang. Pewarnaan HE. Bar = 2 mm………... 38
18.Gambaran mikroskopis daerah yang dibatasi oleh kotak merah (A) dan kotak biru (B) di gambar 17. Gambar A memperlihatkan daerah perbatasan antara implan dengan jaringan tulang baru yang dibatasi oleh jaringan ikat. Lingkaran di Gambar A memperlihatkan serpihan implan yang diinfiltrasi oleh jaringan ikat. Gambar B memperlihatkan terbentuknya matriks tulang baru pada daerah sumsum tulang. Keterangan gambar: i = implan, j = jaringan ikat, s = sumsum tulang, n = jaringan tulang baru, m = matriks tulang, dan p = periosteum. Pewarnaan HE. Bar A = 20 µm; B = 10 µm………... 38
19.Gambaran mikroskopis daerah yang dibatasi oleh kotak hijau di gambar 18 A. Gambar ini memperlihatkan struktur tulang baru yang terbentuk di daerah pinggir defek tulang, yang terdiri atas: os = osteosit, h = saluran Havers, dan m = matriks tulang. Pewarnaan HE. Bar = 10 µm…………... 39
20.Gambaran mikroskopis tulang tibia kontrol selama 60 hari pascaoperasi. Gambar ini memperlihatkan daerah defek tulang yang telah menutup serta bagian periosteumnya (p). Pewarnaan HE. Bar = 20 µm……… 40
21.Gambaran mikroskopis daerah defek tulang tibia kontrol selama 60 hari pascaoperasi, yang memperlihatkan struktur tulang baru yang terdiri atas: os = osteosit, h = saluran Havers, dan m = matriks tulang. Pewarnaan HE.
Bar = 10 µm………... 40
22.Gambaran mikroskopis tulang tibia yang diberi perlakuan implan selama 90 hari pascaoperasi. Gambar ini memperlihatkan kondisi implan yang masih utuh serta bagian struktur tulang: i = implan, j = jaringan ikat, dan n = jaringan tulang baru. Pewarnaan HE. Bar = 2 mm………..….. 41
perbatasan antara implan dengan jaringan tulang baru. Gambar B memperlihatkan daerah jaringan ikat yang membungkus implan. Keterangan gambar: i = implan, j = jaringan ikat, v = pembuluh darah, dan n = jaringan tulang baru yang terbentuk. Pewarnaan HE. Bar A = 20
µm; B = 10 µm………. 42
24.Gambaran mikroskopis daerah yang dibatasi oleh kotak biru di gambar 22. Gambar ini memperlihatkan jaringan tulang baru yang telah menutupi lokasi defek tulang yang seharusnya terisi implan. Struktur tulang ini terdiri atas: os = osteosit, h = saluran Havers, dan m = matriks tulang.
Pewarnaan HE. Bar = 10 µm………... 42
25.Gambaran mikroskopis tulang tibia kontrol selama 90 hari pascaoperasi. Gambar ini memperlihatkan daerah defek tulang yang telah menutup.
Pewarnaan HE. Bar = 20 µm………... 43
26.Gambaran mikroskopis daerah defek tulang tibia kontrol selama 90 hari pascaoperasi, yang memperlihatkan struktur tulang baru yang terdiri atas: os = osteosit, h = saluran Havers, dan m = matriks tulang. Pewarnaan HE.
PENDAHULUAN
Latar Belakang
Setiap tahun jutaan orang di dunia menderita berbagai penyakit tulang
yang diakibatkan oleh trauma, tumor, atau patah tulang (Murugan & Ramakrishna
2004). Di Indonesia, berbagai kasus penyakit seperti kanker tulang, penyakit
periodontis, trauma, patah tulang, dan lain-lain terus meningkat dewasa ini
(Darwis 2008). Salah satu tindakan terapi pada kasus penyakit tulang adalah
dengan teknik implantasi untuk menggantikan jaringan tulang yang hilang atau
rusak. Banyaknya kerusakan tulang yang substansial pada berbagai kasus di atas
semakin meningkatkan kebutuhan akan bahan implan atau biomaterial yang
mampu menggantikan fungsi dari jaringan tulang yang rusak (Bhat 2002).
Biomaterial merupakan suatu material, baik bersifat alamiah maupun
buatan, yang dapat berinteraksi dengan sistem tubuh dengan tujuan untuk
memperbaiki, memulihkan, dan menggantikan jaringan yang rusak atau sebagai
penghubung dengan lingkungan fisiologis tubuh (Darwis 2008).
Biomaterial pengganti tulang yang ideal harus memiliki sifat antara lain:
osteoinduktif, osteokonduktif, biokompatibel, bioaktif, stabil secara biomekanis,
bebas dari agen penyakit, serta mengandung faktor antigen minimal (Kalfas
2001), bioresorbabel (Samsiah 2009) dan biodegradabel (Pane 2008). Sifat-sifat
tersebut hadir dalam biomaterial alamiah yaitu autograft. Autograft adalah biomaterial yang berasal dari bagian lain tubuh pasien itu sendiri. Namun
autograft memiliki keterbatasan karena membutuhkan sayatan tambahan, waktu operasi yang lebih lama, serta meningkatkan kehilangan darah bagi pasien.
Sedangkan allograft, yaitu biomaterial yang berasal dari spesies yang sama, berpotensi menularkan berbagai penyakit dan menimbulkan reaksi penolakan
jaringan bagi individu penerima donor (Kalfas 2001). Adapun jenis biomaterial
pengganti tulang lainnya yaitu xenograft, yang berasal dari spesies berbeda misalnya sapi, memiliki keterbatasan dalam kemungkinan perbedaan karakter
mineral tulangnya (Stavropoulos 2008). Oleh karena itu, salah satu solusinya
adalah pengembangan biomaterial sintetik yang sesuai untuk mengatasi berbagai
Biomaterial sintetik pengganti tulang (synthetic bone graft) harus memiliki struktur serta komposisi yang mendekati tulang asli. Komposisi tulang terdiri atas
mineral tulang dan bahan organik (Samuelson 2007). Mineral tulang sebagian
besar tersusun oleh mineral apatit yang komponen utamanya adalah kalsium fosfat
yang memiliki berbagai fase. Hidroksiapatit (HA) merupakan fase paling stabil
dibandingkan dengan yang lainnya (Saraswathy et al. 2001). HA dapat diperoleh secara sintetik dengan mereaksikan kalsium dengan fosfat (Nurlaela 2009).
Sumber kalsium banyak dijumpai di alam, antara lain pada cangkang telur
(Prabakaran et al. 2005), ganggang laut (Fernandes & Laranjeira 2000), dan batu koral (Sivakumar et al. 1996). Sedangkan komponen organik tulang terdiri atas molekul-molekul proteoglikan seperti glycosaminoglycan (Samuelson 2007). Kitosan (K) merupakan polimer dari D-glucosamine yang terdapat dalam jumlah melimpah di alam, yang dapat dimanfaatkan sebagai komponen organik pada
pembuatan biomaterial sintetik pengganti tulang (Hua et al. 2005).
Penggabungan HA dengan K (komposit HA-K) diharapkan dapat
mendekati struktur asli tulang serta dapat meningkatkan sinergisme dari
masing-masing bahan sehingga berpotensi sebagai biomaterial sintetik pengganti tulang
yang ideal. Murugan dan Ramakrishna (2004) telah meneliti komposit HA-K
secara in vitro dengan menggunakan cairan phosphate buffered saline dibawah kondisi fisiologis. Hasilnya menunjukkan bahwa komposit tersebut dapat
digunakan sebagai bahan pengganti tulang. Penelitian tersebut diperkuat oleh uji
in vivo yang dilakukan oleh Shin et al. (2009) tentang efek penggunaan komposit HA-K pada regenerasi kerusakan tulang calvarial tikus menunjukkan hasil bahwa komposit ini dapat berfungsi sebagai biomaterial yang efektif untuk proses
regenerasi tulang periodontal.
Biomaterial sintetik yang ada di Indonesia sekarang ini merupakan
produksi impor dengan harga yang relatif mahal (Darwis 2008). Oleh karena itu,
tim peneliti dari Institut Pertanian Bogor terpacu untuk memanfaatkan bahan baku
alami yang murah dan mudah didapatkan, yaitu cangkang telur sebagai sumber
kalsium untuk pembuatan HA. Penelitian oleh Departemen Fisika, Fakultas
Matematika dan Ilmu Pengetahuan Alam IPB menunjukkan bahwa komposit
substitusi tulang (Nurlaela 2009). Berdasarkan hasil tersebut maka dilakukan
penelitian lanjutan secara in vivo untuk menguji potensi dari komposit HA-K tersebut sebagai bahan implan tulang sintetik. Material yang telah mengalami
proses karakterisasi baik secara fisika, mekanik, dan kimia kemudian diimplankan
pada tulang tibia dari tiga ekor domba lokal untuk kemudian dievaluasi tingkat
serta kecepatan pertumbuhan tulang pada kasus persembuhan kerusakan
segmental tulang. Hasil dari penelitian ini akan terus dikembangkan sehingga
dapat memberikan kontribusi pada kesehatan manusia.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji secara morfologi proses
persembuhan kerusakan segmental pada tulang domba yang diimplan dengan
implan komposit HA-K berbasis cangkang telur ayam dan mengetahui potensi
dari implan tersebut sebagai biomaterial sintetik pengganti tulang.
Manfaat Penelitian
Melalui penelitian ini dapat diperoleh informasi mengenai potensi implan
komposit HA-K berbasis cangkang telur ayam sebagai biomaterial sintetik
pengganti tulang. Informasi ini akan berguna sebagai informasi awal untuk
penelitian-penelitian aplikatif selanjutnya sebagai upaya penyiapan biomaterial
TINJAUAN PUSTAKA
Tulang
Tulang merupakan jaringan ikat khusus yang berfungsi sebagai alat
penyokong, pelekatan, perlindungan, dan penyimpanan mineral. Konsekuensinya,
jaringan ini dilengkapi dengan rigiditas, kekuatan yang sangat besar, serta
elastisitas yang sangat terbatas. Kemampuan jaringan ini untuk menyimpan
mineral terutama kalsium (Ca), kebanyakan dalam bentuk kristal hidroksiapatit,
merupakan sifat utama yang membedakan tulang dari jaringan ikat lainnya
(Samuelson 2007).
Tulang secara eksternal diselaputi oleh sebuah jaringan bernama
periosteum. Periosteum berisi pembuluh darah, lapisan tebal serabut kolagen yang
tersusun padat tidak beraturan, dan sel-sel yang mampu berdiferensiasi menjadi
osteoblas (sel osteogenik). Semua bagian tulang diselaputi oleh periosteum,
kecuali bagian yang terdapat artikulasi dengan tulang lainnya. Tulang memiliki
ruang internal di bagian tengahnya yaitu rongga sumsum, yang di dalamnya
terdapat sel stem dari sel darah. Rongga sumsum dilapisi oleh selapis jaringan ikat
tipis tervaskularisasi bernama endosteum. Endosteum juga memiliki sel-sel
osteogenik seperti halnya periosteum (Kalfas 2001; Samuelson 2007).
Tulang tersusun atas tiga jenis sel utama yaitu osteoblas, osteosit, dan
osteoklas. Osteoblas adalah sel yang berperan dalam aktivitas sintesis komponen
organik tulang, yang disebut sebagai prebone atau osteoid. Osteoblas terletak dalam suatu garis di sepanjang permukaan jaringan tulang. Saat aktif, osteoblas
cenderung berbentuk kubus dan bersifat basofilik. Sedangkan saat kurang aktif,
maka bentuknya akan menjadi lebih kempis dan kurang basofilik. Ketika aktivitas
sintesis matriks berhenti dan osteoblas telah memasuki matriks tersebut maka
osteoblas berubah namanya menjadi osteosit.
Osteosit berada di dalam suatu ruangan berbentuk oval bernama lakuna
yang terletak di dalam matriks yang telah termineralisasi. Lakuna memiliki
penjuluran halus yang disebut kanalikuli. Kanalikuli menghubungkan antar lakuna
yang berdekatan sehingga osteosit mampu mencapai pembuluh darah untuk
Sitoplasma osteosit memiliki ukuran yang lebih kecil bila dibandingkan
dengan sitoplasma osteoblas, serta memiliki organel sel yang lebih sedikit
sehubungan dengan aktivitas metaboliknya. Osteosit memfasilitasi pemeliharaan
lingkungan ekstraseluler yang telah termineralisasi. Saat terstimulasi oleh hormon
paratiroid (PTH), osteosit mampu segera melepaskan mineral (termasuk Ca) dari
matriks ekstraseluler dengan menyekresikan hidrolase. Proses ini dikenal sebagai
osteocytic osteolysis yang berperan penting dalam pelepasan Ca secara cepat. Osteoklas merupakan sel raksasa multinukleus (≥ 6-50 inti) yang terlibat dalam resorpsi dan remodeling tulang. Sel ini, yang terlihat asidofilik secara sitologi, memiliki banyak lisosom serta organel sel lainnya yang berkembang
baik. Osteoklas yang diketahui berasal dari sumsum tulang, merupakan turunan
dari sejumlah gabungan monosit. Pada proses pertumbuhan dan remodeling
tulang, osteoklas secara kontinu akan melakukan penyerapan (osteoclasia). Proses
osteoclasia merupakan hasil dari sekresi beberapa macam material termasuk asam dan enzim hidrolitik. Asam yang disekresikan seperti asam laktat dan sitrat,
memiliki pH rendah sehingga memudahkan pelepasan mineral. Sedangkan enzim
hidrolitik, seperti acid hydrolase, collagenase, dan lainnya, mampu mencerna matriks ekstraseluler. Osteoclasia terutama diatur oleh sistem endokrin, antara lain: kelenjar tiroid yang menyekresikan hormon kalsitonin dan kelenjar paratiroid
yang menyekresikan hormon paratiroid (Samuelson 2007).
Matriks Ekstraseluler Tulang (Bone Extracellular Matrix)
Sebagian besar jaringan tulang terdiri atas matriks ekstraseluler, yang
kurang lebih 2/3 bagiannya berupa material anorganik dan sisanya berupa material
organik. Sebagian besar material organik terdiri atas serabut kolagen tipe I
(~94%) dan sejumlah kecil bahan dasar (Samuelson 2007; IOF 2009). Secara Kanalikuli
Osteosit
umum tulang tersusun oleh 30% substansi organik, 55% substansi anorganik
(mineral), dan 15% air (Aoki 1991).
Material anorganik tulang seperti kalsium (Ca) dan fosfor (P) tersedia
dalam jumlah yang sangat banyak. Sebagian besar Ca dan P membentuk kristal
hidroksiapatit, yang terletak berdampingan dengan serabut kolagen. Selain itu,
beberapa mineral lain juga terdapat dalam jumlah sedikit antara lain: bikarbonat
(HCO3-), magnesium (Mg), natrium (Na), kalium (K), tembaga (Cu), seng (Zn),
mangan (Mn), dan lainnya. Kristal hidroksiapatit tersusun di sepanjang serabut
kolagen dan di dalam celah serabut tersebut. Bahan dasar matriks tulang terdiri
atas protein non-kolagenous, glikoprotein, proteoglikan, peptida, karbohidrat, dan
lemak (Kalfas 2001). Molekul-molekul proteoglikan kecil terutama terdiri atas
sulfated glycosaminoglycans, chondroitin 4-sulfate, dan keratan sulfate, melekat pada hyaluronans, membentuk suatu satuan komposit yaitu hyaluronic proteoglycan aggregate yang melapisi kristal hidroksiapatit (Samuelson 2007).
Proteoglikan dalam komposit tersebut bersifat instrumental dalam inisiasi
dan inhibisi proses mineralisasi tulang. Selama proses mineralisasi normal
berlangsung, jumlah dari proteoglikan dalam ECM (Extracellular Matrix) relatif menurun. Jadi terdapat suatu hubungan timbal balik dalam jumlah proteoglikan
dan derajat mineralisasi dalam tulang yang sedang tumbuh. Bahan dasar yang
terutama terdiri atas satuan komposit tersebut, memungkinkan air untuk
bersentuhan dengan kristal sehingga terjadi pertukaran ion. Sejumlah kecil
glikoprotein dan protein matriks hadir dalam bahan dasar ECM dan berfungsi
sebagai bahan pelekat (Samuelson 2007).
Klasifikasi Tulang
Terdapat tiga tipe utama tulang yaitu woven bone, cortical bone, dan
cancellous bone. Woven bone terdapat selama perkembangan embrio, selama persembuhan fraktur (pembentukan kalus), dan pada beberapa kasus patologis
seperti hiperparatiroidisme. Tulang ini tersusun atas berkas kolagen yang tersusun
acak serta ruang vaskular yang tidak beraturan dan dilapisi deretan sel osteoblas.
Remodeling terjadi akibat infiltrasi pembuluh darah ke dalam woven bone melalui permukaan periosteal dan endosteal tulang. Unit struktural primer tulang kompak
dinamakan osteon atau sistem Haversian. Osteon tersusun oleh osteosit, lakuna,
dan kanalikuli yang tersusun dalam matriks ekstraseluler tulang yang
berlapis-lapis membentuk lamel-lamel tulang (Gambar 2). Lamel-lamel tulang berbentuk
silinder mengelilingi sebuah saluran longitudinal yang disebut saluran Havers
(Kalfas 2001; Samuelson 2007). Saluran Havers mengandung pembuluh darah,
nervus vasomotorik, sel-sel osteoblas dan osteoprogenitor. Osteon-osteon dapat
saling berhubungan melalui suatu saluran horisontal yang bernama saluran
Volkmann. Melalui saluran Volkmann, pembuluh darah dan syaraf dari
periosteum dan endosteum dapat mencapai saluran Havers sehingga pertukaran
nutrisi dan sisa metabolisme dapat terjadi (Samuelson 2007).
Gambar 2 Osteon yang merupakan unit struktural primer tulang. Terdiri atas lamel-lamel konsentris dan saluran Havers (IOF 2009).
Osteon terbentuk di sepanjang pinggiran tulang kompak dengan
pembentukan asimetris lamel-lamel interstitial yang mengelilingi sebuah
pembuluh darah. Lamel dan jaringan osteogenik terdekat kemudian mengelilingi
pembuluh darah tersebut dan osteon muda terbentuk. Osteoblas, yang sekarang
merupakan bagian dari endosteum, mensekresikan matriks osteoid secara
konsentris, dan osteosit menjadi terbenam dalam matriks tersebut. Ukuran osteon
semakin mengecil dan sejumlah kecil jaringan osteogenik, syaraf, dan pembuluh
darah tinggal di dalamnya (Samuelson 2007). Kekuatan mekanik dari tulang
kompak bergantung pada kepadatan susunan osteonnya (Kalfas 2001).
Cancellous bone (trabecular bone) terletak di antara permukaan bagian dalam tulang kompak. Cancellous bone berisi elemen hematopoietik dan bony trabeculae (Kalfas 2001). Bony trabeculae (trabekula tulang) merupakan spikula
Osteosit Kanalikuli
tulang yang saling berhubungan membentuk jaring-jaring yang saling
berhubungan (Dorland 2002). Jaring-jaring yang saling berhubungan tersebut
terisi oleh sumsum tulang. Trabekula terutama terdapat pada bagian ujung tulang
panjang. Cancellous bone secara berkelanjutan akan mengalami remodeling pada permukaan internal lapisan endosteum tulang (Kalfas 2001).
Gambaran struktur tulang trabekular dan tulang kompak dapat terlihat jelas
pada tulang panjang. Bila tulang panjang dipotong (Gambar 3 A dan B), maka
akan terlihat bagian tulang kompak dan tulang trabekular. Bagian luarnya
dibentuk oleh tulang kompak, sedangkan bagian dalamnya dibentuk oleh tulang
trabekular yang mirip bunga karang (spongy). Bagian tengah tulang panjang dinamakan sebagai diafise, dan kedua ujungnya dinamakan epifise. Antara epifise
dan diafise terdapat daerah pertumbuhan tulang yaitu metafise, yang
memungkinkan pertumbuhan memanjang tulang. Diafise hampir seluruhnya
tersusun atas tulang kompak, dan sedikit tulang trabekular pada bagian tengah
yang berbatasan dengan sumsum tulang. Sedangkan epifise, hampir seluruhnya
terdiri atas tulang trabekular dan selapis tipis tulang kompak pada bagian luarnya
(Mills 2007).
Gambar 3 Berbagai gambaran struktur tulang. Tulang kompak dan cancellous (A), dan potongan melintang tulang panjang (B) (IOF 2009).
Proses Histogenesis Tulang
Pertumbuhan tulang terbentuk dari jaringan ikat, baik pada masa embrio
maupun pascanatal. Dilihat dari proses perkembangannya, tulang dibedakan
menjadi dua pola, yakni osifikasi intramembranous dan intrakartilagenous. Epifise
Epifise Diafise
(B)
Tulang spongy
Pada osifikasi intramembranous, tulang langsung berkembang dari
jaringan ikat, yang dimulai dari tengah mesenkim yang disebut “pusat
pertulangan”. Mesenkim akan mengalami peningkatan vaskularisasi dan
proliferasi. Selanjutnya terjadi perubahan bentuk sel yang menghasilkan sel
osteogenik dan osteoblas. Osteoblas kemudian menjadi aktif menghasilkan
matriks dan serabut kolagen, yang mula-mula masih lunak (osteoid). Osteoid
tersebut kemudian mengalami kalsifikasi oleh garam Ca berupa kristal
hidroksiapatit (Hartono 1989). Tulang-tulang yang mengalami proses ini adalah
sejumlah tulang yang berfungsi sebagai pelindung seperti tulang frontal dan
parietal tengkorak, tulang rahang bawah, dan rahang atas (Samuelson 2007).
Pada osifikasi intrakartilagenous (Gambar 4), jaringan ikat mula-mula
menumbuhkan “tulang rawan miniatur”, yaitu suatu tulang rawan hialin,
bentuknya mirip tulang dewasa hanya formatnya kecil. Tulang rawan ini
selanjutnya akan dirombak, dan digantikan dengan tulang. Osifikasi dimulai dari
tengah tulang rawan dan meluas ke seluruh arah sesuai dengan pertumbuhan
tulang rawan (Hartono 1989). Proses pembentukan tulang ini terjadi pada
pembentukan tulang panjang dan tulang pendek (tulang-tulang penahan bobot
tubuh) seperti tulang femur, tibia, dan lain-lainnya. Pada masa fetus, hampir
semua tulang tubuh merupakan tulang rawan. Namun seiring dengan
perkembangan fetus dan setelah kelahiran, tulang rawan tersebut berkembang
menjadi tulang untuk menyediakan kekuatan terhadap tekanan-tekanan yang
makin bertambah (Mills 2007; Samuelson 2007).
Proses Modeling dan Remodeling Tulang
Modeling tulang adalah suatu kondisi saat proses resorpsi dan pembentukan tulang terjadi pada permukaan tulang yang berlainan (pembentukan
dan resorpsi tidak berpasangan). Contohnya pada pertambahan panjang dan
diameter tulang panjang. Modeling tulang terjadi sejak kelahiran hingga dewasa dan proses ini berperan dalam penambahan massa dan perubahan bentuk
kerangka. Pada kondisi ini proses pembentukan tulang lebih dominan terjadi
daripada proses resorpsi tulang.
Remodeling tulang adalah pergantian jaringan tulang tua dengan jaringan tulang muda. Kondisi ini sebagian besar terjadi pada kerangka hewan dewasa
untuk mempertahankan massa tulang. Proses ini mencakup pembentukan dan
resorpsi tulang secara bersamaan (berpasangan). Remodeling merupakan sebuah proses yang dinamis termasuk penggantian dan pengisian kembali baik tulang
kompak maupun trabekular. Proses ini terus-menerus terjadi untuk
mempertahankan massa tulang serta integritas dan fungsi kerangka. Proses ini
kompleks dan dikendalikan oleh susunan syaraf pusat melalui hormon dan oleh
tekanan mekanis. Proses ini bergantung pada keterpaduan aksi dari osteoblas,
osteosit, dan osteoklas. Secara bersamaan, ketiga sel ini membentuk BMU (Basic Multicellular Unit) atau unit remodeling tulang yang berperan dalam proses
remodeling pada hewan dewasa (Mills 2007).
Proses remodeling tulang terjadi dalam beberapa fase (Gambar 5), yaitu: 1. Aktivasi: pre-osteoklas terstimulasi menjadi
osteoklas dewasa yang aktif.
2. Resorpsi: osteoklas mencerna matriks tulang tua.
3. Pembalikan: akhir dari proses resorpsi, saat
osteoklas digantikan oleh osteoblas.
4. Pembentukan: osteoblas menghasilkan matriks
tulang yang baru.
5. Fase pasif: osteoblas selesai menghasilkan
matriks dan terbenam di dalamnya. Beberapa
osteoblas membentuk sederet sel yang berjejer
di permukaan tulang yang baru. Gambar 5 Proses remodeling
Persembuhan Kerusakan Tulang
Kerusakan segmental tulang akibat defek pengeboran prinsipnya hampir
sama dengan kerusakan pada patah tulang (fraktur). Namun dalam persembuhan
kerusakan segmental tersebut, di dalam defek pengeboran diberi suatu
biomaterial/implan tulang. Boden et al. (1995) menyebutkan bahwa proses penyatuan implan tulang dalam spinal fusion model hampir sama dengan proses persembuhan tulang yang terjadi dalam keadaan persembuhan fraktur.
Fraktur merupakan kerusakan dalam suatu jaringan ikat makhluk hidup,
dan persembuhannya dapat dicapai melalui pertumbuhan sel. Tahap-tahap
persembuhan tulang dapat dilihat pada Gambar 6 dan Tabel 1.
Gambar 6 Proses persembuhan tulang (Anonim 2010).
Minggu Ke-1 Minggu Ke-2 sampai ke-3
Hematoma dan inflamasi Kalus halus
Minggu Ke-4 sampai ke-16 Minggu Ke-17 dan seterusnya
Kalus keras Remodelling
Tabel 1 Persembuhan tulang pada fraktur tulang sederhana
Waktu Perubahan yang terjadi
<1 hari Hemoraghi dan pembentukan hematoma. Penggumpalan darah pada daerah fraktur.
Invasi makrofag untuk menghilangkan debris, sel darah merah, dan fibrin. Nekrosis sel osteosit pada daerah fraktur.
Hari ke 1-5 Edema dan deposisi fibrin pada jaringan sekitar fraktur. Jaringan granulasi menginvasi bekuan darah.
Proliferasi kondroblas dan osteoblas dari bagian pinggir periosteal dan endosteal.
Hari ke 3-7 Pembentukan kalus sementara seiring dengan tulang dihubungkan oleh jaringan granulasi dan pulau-pulau kartilago.
Minggu ke 1-4 Bony callus terbentuk oleh kalsifikasi. Penghubung kalus sementara oleh jaring-jaring trabekula osteoid yang dihasilkan osteoblas.
> 4 minggu Remodeling tulang: proses penyerapan dan pembentukan tulang terus berlangsung.
Penghilangan kalus eksternal.
Pelekukan kalus internal untuk membentuk sumsum tulang.
Secara histologi, persembuhan tulang dapat dibagi menjadi beberapa fase:
1. Fase hemoraghi dan pembentukan jaringan granulasi.
Pada fraktur traumatis sederhana pada tulang panjang, patahan tulang
mengalami pergeseran dari lokasi normalnya dan jaringan lunak di sekitarnya ikut
terlukai (Cheville 2006). Selama 24-48 jam pertama setelah pelukaan, gambaran
histologi persembuhan tulang memperlihatkan adanya eksudat traumatik berisi
serum dan darah akibat pecahnya pembuluh darah (Watson-Jones 1952).
Hemoraghi terjadi di sepanjang daerah fraktur dan otot apabila darah merembes
keluar dari periosteum yang sobek. Koagulasi darah dengan segera membentuk
bekuan darah yang mengisi celah fraktur.
Kerusakan vaskular mengakibatkan terjadinya nekrosis pada jaringan tulang di
sekitar fraktur. Osteosit mati akibat kehilangan nutrisi yang biasanya disuplai
melalui pembuluh darah. Periosteum dan sumsum lebih tervaskularisasi dengan
baik sehingga kejadian nekrosis pada bagian ini lebih sedikit (Cheville 2006).
Bekuan darah selanjutnya berubah menjadi jaringan granulasi untuk
melindungi tulang yang rusak (Samuelson 2007). Jaringan granulasi merupakan
jaringan ikat fibroblastik tervaskularisasi pada persembuhan luka. Monosit
memasuki daerah fraktur dan berubah menjadi makrofag yang berperan utama
2. Fase pembentukan kalus.
Dalam waktu 48 jam setelah fraktur, bekuan darah diserbu oleh sel-sel
osteogenik dari lapisan periosteum, endosteum, dan sumsum tulang. Sel-sel ini
berproliferasi di pinggir fraktur dan secara cepat menyerbu bekuan darah dan
daerah nekrotik sekitarnya untuk membentuk kalus. Kalus merupakan massa
jaringan yang berfungsi melekatkan ujung-ujung tulang yang patah (Cheville
2006). Proses pembentukan kalus yang berasal dari periosteum, endosteum, dan
sumsum tulang tersebut bertemu dalam satu proses yang sama (Rizka 2010).
Proses terus berlangsung ke bagian dalam dan luar tulang sehingga menjembatani
permukaan fraktur satu sama lain. Awalnya, kalus merupakan jaringan granulasi
(kalus lunak) yang kemudian akan berubah menjadi jaringan tulang dan tulang
rawan (kalus keras) (Cheville 2006).
3. Fase pembentukan tulang rawan.
Dalam waktu satu minggu, sel-sel yang berproliferasi mulai berdiferensiasi
menjadi kondroblas dan tulang rawan terbentuk. Material matriks terdeposit
mengelilingi sel. Dalam proses kalsifikasi tulang rawan, vesikula kecil matriks
dilepaskan di bawah pengaruh enzim yang meningkatkan konsentrasi lokal
orthophosphate dan mengarah pada pembentukan hidroksiapatit. Pada 7 sampai 10 hari, pH kalus meningkat sehingga membantu proses deposisi garam kalsium.
Tulang rawan yang terbentuk bersifat hanya sementara karena akan segera
digantikan oleh woven bone. Matriks ekstraseluler tulang rawan mengalami kalsifikasi, sehingga menyebabkan kondrosit mati. Proses perubahan tulang rawan
menjadi tulang terjadi melalui mekanisme osifikasi intrakartilagenous.
4. Fase pembentukan tulang baru.
Selama kalus yang terbentuk sebelumnya menghilang, osteoblas menghasilkan
osteoid dengan susunan yang lebih teratur. Molekul kolagen berorientasi di
sekeliling pembuluh darah untuk membentuk sistem Haversian. Osteoklas
kemudian melekat pada permukaan trabekula tulang untuk meresorpsi tulang.
Woven bone yang lebih dahulu terbentuk secara bertahap berubah menjadi
cortical bone dan kalus berlanjut mengalami remodeling. Secepatnya, dengan ketepatan serta respon kalus yang minimal, susunan tulang terbentuk kembali dan
Ada kalanya fraktur terjadi cukup parah sehingga membutuhkan tindakan lain
untuk membantu persembuhan tulang yang sempurna. Tindakan tersebut dapat
berupa cangkok tulang atau bone graft (Samuelson 2007).
Jika menggunakan suatu bone graft, persembuhan tulang akan dimulai dengan terisinya perbatasan antara tulang-graft dengan jaringan tulang baru. Graft
akan mengalami vaskularisasi dan secara perlahan akan digantikan oleh
pertumbuhan tulang baru. Perbatasan antara tulang-graft akan sembuh dalam 1 sampai 3 bulan, namun proses remodeling terhadap graft dapat berlangsung berbulan-bulan sampai tahunan yang lamanya tergantung pada besarnya graft.
Biomaterial Pengganti Tulang
Biomaterial merupakan suatu material, baik bersifat alamiah maupun
buatan, yang dapat berinteraksi dengan sistem tubuh dengan tujuan untuk
memperbaiki (repair), memulihkan (restore), dan menggantikan jaringan yang rusak (replace) atau sebagai penghubung (interface) dengan lingkungan fisiologis tubuh (Darwis 2008).
Pemilihan biomaterial yang tepat sangatlah diperlukan dalam proses
implantasi. Tentunya biomaterial yang dipilih adalah yang bersifat osteoinduktif,
osteokonduktif, biokompatibel, bioaktif, stabil secara biomekanis, bebas penyakit,
serta mengandung faktor antigen minimal (Kalfas 2001), bioresorbabel (Samsiah
2009) dan biodegradabel (Pane 2008).
Osteoinduktif adalah kemampuan biomaterial untuk menginduksi sel-sel
sumsum tulang atau osteoprogenitor berdiferensiasi menjadi sel-sel tulang dewasa
(Laurencin 2009). Osteokonduktif adalah kemampuan biomaterial untuk
mendukung pelekatan sel-sel osteoblas baru dan osteoprogenitor, menyediakan
struktur saling berhubungan sehingga sel-sel baru dapat berpindah dan pembuluh
darah baru dapat terbentuk (Laurencin 2009). Sifat biokompatibel adalah
kemampuan biomaterial untuk menyesuaikan dengan kecocokan tubuh penerima,
tidak mempunyai efek toksik maupun melukai fungsi biologis (Dorland 2002).
Sedangkan bioaktif adalah kemampuan biomaterial untuk bereaksi dengan
Autograft adalah biomaterial yang berasal dari tubuh pasien itu sendiri.
Autograft memiliki kerugian karena ketersediaannya terbatas serta dapat meningkatkan resiko kehilangan darah, menimbulkan rasa sakit, dan memperbesar
luka akibat operasi tambahan (Schnettler et al. 2004; Nandi et al. 2009). Allograft
adalah biomaterial yang berasal dari spesies yang sama. Allograft berpeluang menularkan berbagai penyakit dan menimbulkan ketidakcocokan respon imun
(Nandi et al. 2009). Xenograft adalah biomaterial yang berasal dari spesies, genus, maupun famili yang berbeda. Misalnya xenograft yang berasal dari tulang sapi. Namun graft tersebut memiliki keterbatasan dalam perbedaan karakter mineral tulang (Stavropoulos 2008).
Biomaterial sintetik pengganti tulang merupakan alternatif yang dapat
mengatasi keterbatasan beberapa metode sebelumnya. Penggunaan biomaterial
sintetik secara tepat untuk substitusi tulang tidak akan menimbulkan inflamasi
serta tidak menyebabkan respon iritasi (Nurlaela 2009). Saat ini penggunaan
biomaterial sintetik yang memiliki kemiripan dengan fase anorganik tulang telah
mengalami peningkatan di bidang operasi rekonstruksi tulang karena sifat
biokompatibilitasnya yang unggul (Schnettler et al. 2004).
Hidroksiapatit (HA)
Secara umum penyusun utama komponen anorganik tulang adalah kalsium
fosfat yang mempunyai dua fase yaitu amorf dan kristal. Senyawa kalsium fosfat
kristal hadir dalam empat fase, yaitu dikalsium fosfat (DKF, CaHPO4.2H2O), okta
kalsium fosfat (OKF, Ca8H2PO4.5H2O), trikalsium fosfat (TKF, Ca3(PO4)2) dan
hidroksiapatit (HA, Ca10(PO4)6(OH)2). Senyawa kalsium fosfat yang paling stabil
adalah hidroksiapatit (Saraswathy et al. 2001). HA terdiri atas kalsium dan fosfat
dengan rasio perbandingan 1,67 (Pane 2008).
Penggunaan HA sebagai material implan untuk aplikasi medis semakin
meningkat saat ini. Beberapa penelitian seperti di India, telah memanfaatkan
bahan alam seperti batu koral, ganggang laut, dan cangkang telur ayam sebagai
sumber CaCO3 untuk pembentukan HA.Bahan alam diyakini lebih dapat diterima
penggunaan HA yang paling umum antara lain sebagai pelapis implan titanium
atau sebagai bahan pembentuk komposit (Pattanayak et al. 2005).
HA banyak digunakan dalam dunia orthopedik karena sifat fisis, kimia,
mekanis, dan biologisnya sangat mirip dengan komponen utama tulang manusia
(Pattanayak et al. 2005; Pane 2008). Sifat HA yang paling menarik adalah kemampuan biokompatibilitasnya yang sangat baik. HA mampu berkontak dan
menyatu secara kimiawi dengan jaringan tulang (Pane 2008). Selain itu, HA
memiliki beberapa sifat yang menonjol lainnya yakni: osteokonduktif, berpori,
bioresorbabel, bioaktif, tidak korosi, inert, tahan aus (Samsiah 2009), serta mudah
didapatkan dalam jumlah banyak (Pane 2008).
Beberapa penelitian telah membuktikan kemampuan HA sebagai bahan
pengganti tulang. Salah satunya terdapat pada penelitian yang dilakukan oleh
Reddy dan Swamy (2010), tentang penggunaan HA sebagai biomaterial pengganti
tulang pada beberapa kasus orthopedik. Berdasarkan penelitian tersebut dapat
disimpulkan bahwa untuk lesio kecil, HA sendiri saja sudah cukup namun untuk
lesio yang lebih besar, lebih ideal untuk mencampurkan HA dengan autogenous bone graft untuk mempercepat persembuhan. Terdapat pertumbuhan tulang baru serta persembuhan lesio yang baik. Selain itu, tidak ditemukan reaksi imunogenik
tubuh terhadap material HA.
Uji mekanik memperkuat pendapat bahwa HA menyatu ke dalam tulang
lebih kuat daripada autogenous bone graft. Hal tersebut karena kemampuan biodegradasi HA lebih lambat daripada autogenous bone graft sehingga mampu memberi kekuatan mekanis yang lebih lama (Reddy & Swamy 2010).
Kitosan (K)
Kitosan adalah biopolimer karbohidrat hasil ekstraksi kitin, yang
merupakan biopolimer alami kedua disamping selulosa yang terdapat dalam
jumlah melimpah. Kitin merupakan komponen struktural primer dari eksoskeleton
hewan arthropoda (contohnya crustacean), dinding sel fungi, dan kutikula
gugus asetilnya menggunakan basa pekat, sehingga bahan ini merupakan polimer
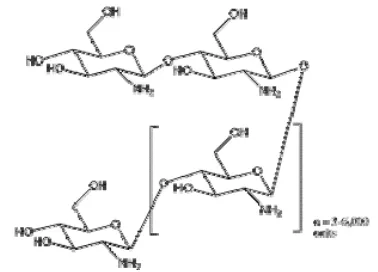
[image:31.595.216.405.133.269.2]dari D-glucosamine (Nurlaela 2009).
Gambar 7 Struktur kimia kitosan (Harisson 2009).
Ketertarikan dalam pemanfaatan kitosan telah meningkat sehubungan
dengan sifat biologisnya yang unggul, seperti biokompatibilitas, mudah
terdegradasi tanpa meninggalkan racun, tidak karsinogenik terhadap hewan
maupun manusia, bioaktif (Nurlaela 2009) serta memiliki efek anti bakterial dan
efek persembuhan yang cepat bagi jaringan (Shin et al. 2009).
Studi lain memperlihatkan bahwa kitosan mampu meningkatkan
pembentukan jaringan tulang dan dapat digunakan sebagai matriks dalam teknik
pembuatan jaringan gingival. Paik et al. (2001) melaporkan bahwa kitosan dapat
meningkatkan sintesis kolagen tipe I pada tahap awal, dan memfasilitasi
diferensiasi sel-sel osteogenik pada percobaan in vitro fibroblas ligamen periodontal manusia. Kitosan diketahui dapat mempercepat migrasi sel serta
membantu pematangan jaringan. Oleh karena itu, semakin banyak dilakukan
penelitian yang berkaitan dengan kemampuan kitosan dalam bidang dentistry dan bedah orthopedik (Shin et al. 2009).
Komposit Hidroksiapatit dan Kitosan (HA-K)
Material komposit adalah kombinasi dua atau lebih fase material, baik
secara makro atau mikro yang berbeda bentuk atau komposisi kimianya untuk
memperoleh keseimbangan sifat (Samsiah 2009). Pengembangan teknologi
komposit bertujuan untuk meningkatkan efisiensi struktur dan karakteristik sifat
material yang signifikan, seperti untuk aplikasi material yang ringan tetapi sangat
Tulang merupakan salah satu komposit alami berskala nano, karena tulang
merupakan kombinasi fase organik dan anorganik (Nurlaela 2009). Material yang
paling baik untuk menggantikan tulang adalah material yang memiliki kesamaan
atau paling tidak identik dengan komposisi tulang yang sebenarnya.
Banyak penelitian yang telah dilakukan untuk menggantikan tulang dari
material komposit yang dibentuk dari HA dan matriks polimer. Beberapa polimer
yang dapat digunakan antara lain: kolagen, kitosan, asam polylactic, dan
polymethylmethacrylate (PMMA) (Nurlaela 2009). HA yang serupa dengan komponen utama mineral tulang memiliki kekerasan yang rendah dan bersifat
rapuh sehingga memberi kendala dalam proses desain (Pattanayak et al. 2005). Sedangkan kitosan yang merupakan biopolimer alami diharapkan dapat bersifat
layaknya komponen organik matriks tulang serta dapat mengatasi sifat rapuh HA.
Komposit HA-K memiliki keuntungan karena ketika matriks polimer terserap,
tulang baru dapat tumbuh di sekitar partikel HA (Samsiah 2009).
Domba Lokal (Ovis ammon aries) Sebagai Hewan Coba
Implan tulang dapat dikatakan telah memenuhi persyaratan biomaterial
yang ideal apabila telah melewati uji in vitro maupun in vivo. Hasil dari uji in vitro saja tidak cukup untuk dapat diterapkan pada manusia karena terkadang memberikan hasil yang berbeda. Oleh karena itu, perlu dilakukan serangkaian uji
in vivo pada berbagai jenis hewan coba sebagai simulasi kondisi klinis manusia. Hewan-hewan coba tersebut antara lain: anjing, domba, kambing, babi, dan
kelinci (Pearce et al. 2007). Hewan coba yang digunakan dalam penelitian ini
adalah domba lokal atau domba ekor tipis (Ovis ammon aries) (Sutama & Budiarsana 2009).
Lebih dari sepuluh tahun terakhir penggunaan domba sebagai hewan coba
dalam penelitian orthopedik terus meningkat. Pada periode 1990-2001, sebanyak
9-12% penelitian orthopedik telah menggunakan domba sebagai hewan coba.
Jumlah ini meningkat dibandingkan dengan periode 1980-1989 ketika
penggunaan domba hanya sekitar 5% (Martini et al. 2001). Peningkatan jumlah ini mungkin berhubungan dengan masalah isu etika dan pandangan negatif
al. 2007). Bermacam-macam penelitian orthopedik yang telah dilakukan dengan
menggunakan domba antara lain tentang fraktur, osteoporosis, bone-lengthening, dan osteoarthritis (Martini et al. 2001).
Secara makrostruktural, domba dewasa memiliki berat tubuh yang hampir
menyerupai manusia dan memiliki dimensi tulang panjang yang cocok untuk
model pemasangan implan tulang manusia dan prosthesis (Newman et al. 1995).
Hal ini tidak dimiliki oleh spesies hewan yang lebih kecil seperti kelinci atau
anjing ras kecil. Sedangkan secara histologi, struktur tulang domba sangat berbeda
dibandingkan dengan tulang manusia. Domba digambarkan memiliki sebagian
besar struktur tulang berupa tulang primer (deKleer 2006), dalam
perbandingannya dengan struktur tulang manusia yang kebanyakan terdiri atas
tulang sekunder (Eitel et al. 1981).
Terdapat perbedaan dalam kepadatan tulang antara manusia dan domba.
Tulang domba secara signifikan menunjukkan kepadatan yang lebih tinggi dan
kekuatan yang lebih besar (Pearce et al. 2007). Sementara itu, perbandingan
komposisi mineral tulang manusia dan domba tidak menunjukkan perbedaan yang
signifikan (Ravaglioli et al. 1996). Walaupun diakui adanya perbedaan dalam
struktur tulangnya, beberapa studi berpendapat bahwa domba masih valuable
sebagai model untuk penelitian remodeling dan pergantian tulang manusia.
Beberapa penelitian tentang implantasi tulang menunjukkan bahwa tulang domba
dan manusia memiliki pola yang serupa dalam hal pertumbuhan tulang (bone
MATERI DAN METODE PENELITIAN
Waktu dan Tempat Penelitian
Proses penelitian berlangsung mulai dari bulan April 2009 sampai Agustus
2010. Operasi implantasi dilakukan di Laboratorium Bagian Bedah dan Radiologi,
Departemen Klinik, Reproduksi, dan Patologi (KRP), Fakultas Kedokteran
Hewan, Institut Pertanian Bogor. Pemeliharaan dan perawatan hewan coba
dilakukan di Kandang Hewan Percobaan yang dikelola Unit Pelayanan Teknis
Hewan Laboratorium (UPT Helab) FKH-IPB. Pembuatan preparat histologi
dilakukan di Laboratorium Patologi, Departemen KRP serta di Laboratorium
Anatomi, Departemen Anatomi, Fisiologi, dan Farmakologi (AFF), FKH-IPB.
Materi Penelitian
Hewan coba yang digunakan pada penelitian ini adalah 3 ekor domba lokal
(2 ekor jantan dan 1 ekor betina) yang sehat, berumur sekitar 1,5-2 tahun dengan
kisaran berat badan 19-20 kg.
Alat-alat yang digunakan pada penelitian ini antara lain: termometer,
stetoskop, pulse oxymetri, alat cukur, peralatan bedah minor, peralatan bedah
orthopedik, perlengkapan operator dan asisten bedah, serta kamera digital.
Sedangkan untuk pembuatan dan pengamatan preparat histologi antara lain:
gergaji triplek, inkubator, tissue cassette, automatic tissue processor, shaker, mikrotom, pencetak parafin, gelas objek, gelas penutup, mikroskop OLYMPUS®
BX51, dan alat mikrofotografi MD® 130 electric eyepiece.
Bahan-bahan yang digunakan pada penelitian ini antara lain: implan
komposit hidroksiapatit-kitosan (HA-K), atropin sulfas 0,25 mg/ml, xylazine HCl
2%, isofluran 1,5-3%, penicillin 50.000 IU, cefotaxime 250 mg, analgesik
Toradol®, yodium tinktur, perubalsam, Levertraan Zalf, dan Gusanex®.
Sedangkan untuk pembuatan preparat histologi antara lain: formalin 10%, asam
nitrat 5%, akuades, akuabides, alkohol, silol, pewarna Hematoksilin-Eosin (HE),
Metode Penelitian
1. Persiapan Implan Komposit Hidroksiapatit-Kitosan (HA-K)
Implan komposit HA-K telah dibuat sebelumnya oleh Ai Nurlaela,
mahasiswa Sekolah Pascasarjana IPB (Nurlaela 2009). Implan tersebut dihasilkan
dari metode presipitasi kalsium dan fosfat dengan rasio perbandingan 0,5M:0,3M.
Sumber kalsium didapatkan dari ekstraksi cangkang telur ayam dan sumber fosfat
dari KH2PO4. Sedangkan kitosannya merupakan produk dari Departemen
Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan IPB.
Sintesis HA-K dilakukan dengan dua tahap. Tahap pertama pembentukan
hidroksiapatit dan tahap kedua penggabungan hidroksiapatit dengan kitosan.
Serbuk komposit yang dihasilkan dari proses tersebut selanjutnya dikemas dalam
bentuk tabung silinder (pellet).
2. Pemeliharaan Hewan Coba
Domba dipelihara dalam lingkungan kandang yang memadai dengan
sirkulasi udara yang cukup, pencahayaan dan temperatur normal, asupan pakan
sebanyak dua kali sehari disertai asupan air ad libitum. Pemeliharaan domba dilakukan selama 10 hari sebelum operasi implantasi untuk evaluasi kondisi
hewan, serta selama 30, 60, dan 90 hari setelah operasi untuk pengamatan dan
pengambilan data penelitian.
3. Operasi Implantasi (Pemasangan Implan)
Operasi implantasi dilakukan sesuai dengan prosedur bedah aseptis.
Sebelum dilakukan pembiusan, semua domba diberikan pre-anestesi atropin sulfas
dengan dosis 0,2 mg/kg (SC) (Plumb 2005). Pembiusan dilakukan dengan
xylazine HCl dengan dosis 0,2 mg/kg (IM) dan 0,10 mg/kg (IV) (Plumb 2005)
serta isofluran secara inhalasi.
Penanaman implan dilakukan pada bagian medial dari ujung proksimal
tulang tibia kaki kiri. Tulang tersebut dilubangi dengan bor tulang sesuai dengan
ukuran implan yang berdiameter ± 6,6 mm dan tinggi ± 5,3 mm. Sedangkan untuk
kontrolnya, bagian yang sama dari tulang tibia kaki kanan dibuat lubang serupa
namun dibiarkan kosong tanpa implan.
Luka sayatan operasi kemudian ditutup dengan penjahitan periosteum,
domba diberi antibiotik topikal dan per-injeksi sebanyak dua kali sehari serta
diberikan analgesik satu kali sehari selama lima hari pascaoperasi. Luka operasi
secara rutin dibersihkan dengan yodium tinktur dan dioleskan campuran
perubalsam dan Levertraan Zalf. Gusanex® juga diberikan sebagai anti miasis.
4. Studi Histologi
Seluruh tulang tibia kemudian diambil pada hari ke-30, 60, dan 90
pascaoperasi. Untuk data makroskopis, bagian tulang yang terdapat implan
dipotong melintang menjadi dua bagian menggunakan gergaji triplek dengan mata
gergaji berukuran kecil. Penentuan lokasi pemotongan ditentukan dengan melihat
gambaran radiografi tulang. Potongan melintang tersebut kemudian diobservasi
dan difoto dengan kamera digital. Kajian makroskopis dilakukan dengan
pengamatan langsung mencakup aspek keadaan, warna, bentuk, dan tingkat
degradasi implan serta pertumbuhan jaringan baru ke dalam implan. Sedangkan
untuk data mikroskopis, tulang yang telah terpotong dua tersebut kemudian
direndam dalam cairan formalin 10% minimal selama sebulan. Bagian tulang
yang terdapat implan selanjutnya dipotong melintang lagi menjadi beberapa
potongan setebal ± 1-2 mm untuk pembuatan preparat gosok dan dekalsifikasi.
5. Pembuatan Preparat Gosok
Sebagian potongan tulang tersebut kemudian ditipiskan dengan cara
menggosoknya dengan amplas berukuran agak kasar (300) sampai terhalus
(1500). Penggosokan dilakukan secara teratur dan perlahan agar tidak merusak
struktur tulang. Setiap kali menggosok, dilakukan pencucian terhadap preparat
dengan akuades steril untuk menghilangkan kotoran dan debu sisa gosokan.
Setelah mendapatkan ketipisan yang sesuai, preparat gosok tersebut kemudian
dicuci dengan akuabides steril selama ± 2 malam, menggunakan alat EYELA Multi Shaker MMS dengan kecepatan pada skala 5-6. Akuabides diganti setiap hari agar kotorannya terbuang. Setelah bersih, preparat kemudian diletakkan dalam
inkubator selama semalam agar kering. Selanjutnya dilakukan proses pewarnaan
dan dehidrasi.
Pewarnaan dilakukan dengan pewarna Hematoksilin selama beberapa
menit dan dibilas dengan akuades. Setelah didapatkan warna dan kontras yang
dari konsentrasi 70%, 80%, 80%, 90%, 96%, absolut 1, hingga absolut 2),
kemudian direndam dalam larutan silol bertingkat (mulai dari silol 1, silol 2,
hingga silol 3). Preparat lalu dilekatkan dengan gelas penutup menggunakan
Permount® dan diberi label. Pengamatan preparat selanjutnya dilakukan dengan
mikroskop cahaya.
6. Pembuatan Preparat Dekalsifikasi
Sebagian potongan tulang lainnya kemudian direndam dalam larutan
dekalsifikasi (asam nitrat 5%) sampai lunak selama ± 2 minggu. Tulang terus
dipantau sampai benar-benar terdekalsifikasi. Ciri-ciri tulang terdekalsifikasi ialah
strukturnya menjadi lebih fleksibel, transparan, dan mudah ditusuk atau digores
(Nandi et al. 2009). Setelah itu, tulang dicuci dengan air mengalir selama 24 jam, kemudian dinetralkan dengan larutan formalin 10% untuk menghilangkan mineral
seperti kalsium dan magnesium yang masih tersisa. Selanjutnya dicuci kembali
dengan air mengalir selama 1-2 hari. Tulang tersebut kemudian dimasukkan ke
dalam tissue cassette untuk proses dehidrasi.
Dehidrasi dilakukan dengan larutan alkohol bertingkat masing-masing
selama 2 jam, kemudian direndam dalam larutan silol bertingkat masing-masing
selama 40 menit. Proses dehidrasi tersebut menggunakan alat Automatic Tissue Processor Sakura®. Selanjutnya tulang diletakkan dalam parafin cair (embedding) bersuhu ± 60oC selama 2 jam dan dimasukkan ke dalam blok pencetak. Kemudian
blok organ disimpan sejenak di dalam lemari pendingin dan dipotong dengan
mikrotom hingga mencapai ketebalan 5-6 µm. Sayatan tersebut lalu diletakkan di
atas permukaan air hangat (38-40oC), kemudian ditempel pada gelas objek dan
dikeringkan di inkubator bersuhu 60oC selama semalam. Terakhir slide preparat
tersebut diwarnai dengan pewarnaan HE (Hematoksilin-Eosin).
Tahapan pewarnaan HE yaitu: deparafinisasi dengan perendaman dalam
silol bertingkat dan alkohol bertingkat masing-masing selama 2 menit. Kemudian
preparat dibilas dengan air dan diwarnai dengan pewarna Hematoksilin selama
2-3 menit. Preparat dibilas kembali dengan air dan direndam dalam litium karbonat
selama 10 detik. Preparat kemudian dibilas kembali dengan air dan diwarnai
dengan pewarna Eosin selama 6-7 menit. Preparat lalu dibilas dengan air kembali
Preparat lalu dilekatkan dengan gelas penutup menggunakan Permount® dan
diberi label. Pengamatan preparat dilakukan dengan mikroskop cahaya.
7. Evaluasi Histologi
Preparat tulang gosok dan dekalsifikasi tersebut kemudian diobservasi
untuk melihat perubahan gambaran histologi yang terjadi setiap waktu
pengambilan sampel. Untuk preparat gosok, pengamatan ditekankan terhadap pola
pertumbuhan tulang baru yang terbentuk selama proses persembuhan. Sedangkan
untuk preparat dekalsifikasi, aspek-aspek berikut dapat diobservasi secara
histologi mengacu pada Sunil et al. (2008) antara lain: (i) pertumbuhan dan regenerasi tulang, (ii) ikatan antara implan dengan tulang, (iii) pertumbuhan
tulang baru ke dalam implan, (iv) tanda-tanda keberadaan implan pada akhir
pengamatan, dan (v) tanda-tanda reaksi inflamasi di sekitar implan. Hasil
pengamatan kemudian dituliskan ke dalam format tabel seperti yang tertulis pada
Tabel 2. Analisis data dilakukan secara deskriptif terhadap gambaran histologi
preparat. Kemudian dilakukan dokumentasi gambaran histologi tersebut dengan
mikroskop cahaya yang dilengkapi kamera mikrofotografi. Rangkaian prosedur
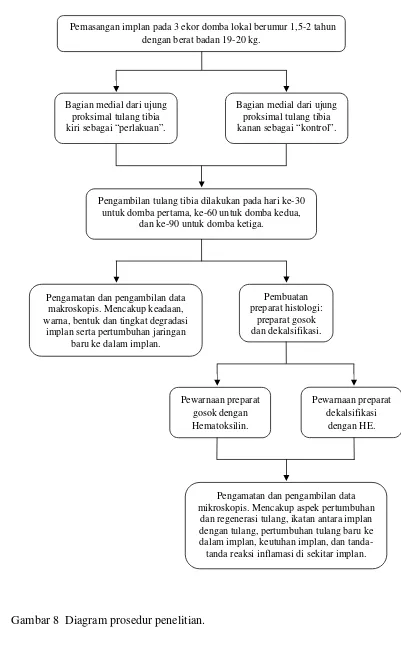
penelitian secara singkat disajikan dalam sebuah diagram alir (Gambar 8).
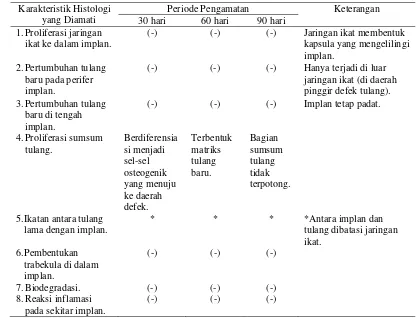
Tabel 2 Format data hasil pengamatan evaluasi histologi terhadap preparat dekalsifikasi
Karakteristik Histologi yang Diamati Periode Pengamatan
30 hari 60 hari 90 hari 1.Proliferasi jaringan ikat ke dalam implan.
2.Pertumbuhan tulang baru pada perifer implan.
3.Pertumbuhan tulang baru di tengah implan.
4.Proliferasi sumsum tulang.
5.Ikatan antara tulang lama dengan implan.
6.Pembentukan trabekula di dalam implan.
7.Biodegradasi.
8.Reaksi inflamasi pada sekitar implan.
Gambar 8 Diagram prosedur penelitian.
Pemasangan implan pada 3 ekor domba lokal berumur 1,5-2 tahun dengan berat badan 19-20 kg.
Bagian medial dari ujung proksimal tulang tibia kiri sebagai “perlakuan”.
Pengambilan tulang tibia dilakukan pada hari ke-30 untuk domba pertama, ke-60 untuk domba kedua,
dan ke-90 untuk domba ketiga.
Pembuatan preparat histologi:
preparat gosok dan dekalsifikasi. Pengamatan dan pengambilan data
makroskopis. Mencakup keadaan, warna, bentuk dan tingkat degradasi
implan serta pertumbuhan jaringan baru ke dalam implan.
Pewarnaan preparat gosok dengan Hematoksilin.
Pewarnaan preparat dekalsifikasi
dengan HE. Bagian medial dari ujung
proksimal tulang tibia kanan sebagai “kontrol”.
Pengamatan dan pengambilan data mikroskopis. Mencakup aspek pertumbuhan
dan regenerasi tulang, ikatan antara implan dengan tulang, pertumbuhan tulang baru ke dalam implan, keutuhan implan, dan
HASIL DAN PEMBAHASAN
Gambaran Makroskopis Tulang
Pengamatan makroskopis terhadap semua tulang yang diberi perlakuan
implan memperlihatkan keberadaan implan yang terlihat jelas sebagai sebuah benda
padat berwarna putih kekuningan. Hasil pengamatan disajikan dalam Tabel 3 yang
memperlihatkan bahwa dari seluruh parameter yang diamati, tidak terlihat
perubahan implan maupun respon jaringan terhadap parameter yang diamati pada
berbagai periode pengamatan.
Tabel 3 Hasil pengamatan makroskopis terhadap tulang perlakuan pada berbagai periode pengamatan
Karakteristik Pengamatan yang Diamati
Periode Pengamatan
30 hari 60 hari 90 hari
1.Keadaan implan. Tidak terdegradasi Tidak terdegradasi Tidak terdegradasi 2.Warna implan. Putih kekuningan Putih kekuningan Putih kekuningan
3.Bentuk implan. Utuh Utuh Utuh
4.Tingkat degradasi. (-) (-) (-)
5.Pertumbuhan jaringan baru ke dalam implan.
(-) (-) (-)
Keterangan: (-) = tidak ada, (+) = sedikit, (++) = banyak, dan (+++) = semakin banyak.
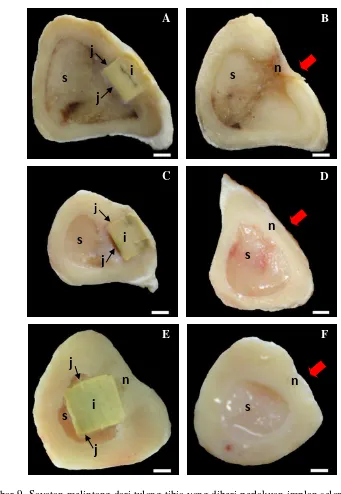
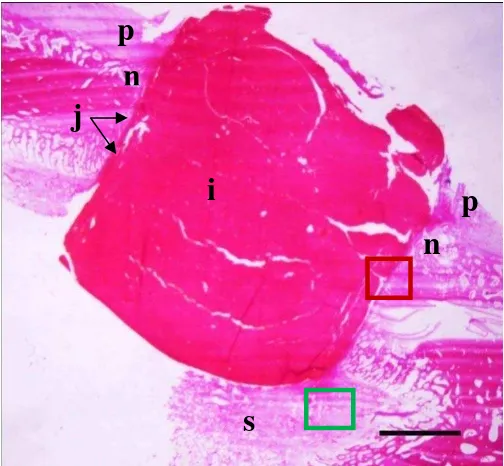
Tulang yang diberi perlakuan implan (tulang perlakuan) selama 30 hari
pascaoperasi memperlihatkan implan masih berada di dalam defek (lubang
pengeboran) tulang dengan kondisi utuh. Implan tidak terlihat mengalami degradasi
maupun resorpsi. Terdapat pertumbuhan jaringan ikat yang terlihat seperti lapisan
putih yang membungkus implan. Jaringan ikat tersebut membatasi permukaan
implan dengan pinggir defek tulang (Gambar 9 A). Tidak terlihat adanya
pertumbuhan jaringan ikat tersebut ke dalam implan.
Sedangkan pengamatan pada tulang yang tidak diberi perlakuan (tulang
kontrol) selama 30 hari pascaoperasi memperlihatkan daerah defek tulang telah
tertutup oleh pertumbuhan jaringan baru yaitu bony callus. Bony callus terbentuk setelah minggu ke-1 sampai ke-4 setelah kerusakan tulang dan akan digantikan oleh
tulang dewasa (Cheville 2006). Kalus yang terbentuk belum memiliki kekerasan
yang sama seperti jaringan tulang sekitarnya. Hal tersebut terlihat dari konsistensi
Tulang yang diberi perlakuan implan selama 60 hari pascaoperasi
memperlihatkan implan tetap berada di dalam defek tulang dengan kondisi utuh.
Terlihat juga adanya jaringan ikat yang membungkus implan seperti pada gambaran
tulang perlakuan selama 30 hari pascaoperasi (Gambar 9 C). Jaringan ikat tersebut
terlihat hanya mengelilingi implan dan tidak tumbuh ke dalamnya. Hal tersebut
mengindikasikan bahwa sampai usia 60 hari pascaoperasi, tidak teramati terjadinya
degradasi ataupun resorpsi terhadap implan.
Hasil pengamatan pada tulang kontrol selama 60 hari pascaoperasi
memperlihatkan daerah defek tulang telah tertutup oleh jaringan tulang baru yang
konsistensi maupun warnanya terlihat telah menyerupai jaringan tulang sekitarnya
(Gambar 9 D). Jaringan tulang baru ini menggantikan keberadaan bony callus yang terbentuk sebelumnya melalui proses remodeling yang kontinu (Cheville 2006).
Tulang yang diberi perlakuan implan selama 90 hari pascaoperasi
memperlihatkan kondisi implan yang tetap utuh dan dibungkus oleh jaringan ikat.
Jika ada bagian dari implan yang terdegradasi, maka akan terlihat pertumbuhan
jaringan ikat yang masuk ke bagian pinggir atau tengah implan. Hal tersebut
mengindikasikan bahwa sampai periode 90 hari pascaoperasi, implan tetap terlihat
tidak mengalami degradasi maupun resorpsi. Perubahan yang terlihat pada periode
ini adalah posisi implan tidak lagi berada di antara defek tulang, melainkan masuk
ke dalam rongga sumsum tulang (Gambar 9 E).
Peneliti lainnya pada aspek radiografi mengemukakan bahwa gambaran
radiografi tulang perlakuan pada hari ke-7 pascaoperasi memperlihatkan implan
masih ada di posisi semula, sedangkan pada hari ke-30 pascaoperasi
memperlihatkan implan telah masuk ke rongga sumsum, sehingga zona radiolucent terlihat di bagian defek yang seharusnya terisi implan (Purwanti 2010). Bagian
tersebut mengalami peningkatan opasitas yang mengindikasikan adanya
pertumbuhan kalus di dalamnya. Berdasarkan data tersebut maka diperkirakan
implan bergeser pada rentang waktu setelah hari ke-7 sampai sebelum hari ke-30
pascaoperasi, sehingga diduga kekosongan defek telah tertutup oleh jaringan tulang
baru yang memperlihatkan persembuhan yang lebih cepat dibandingkan dengan
persembuhan tulang kontrol selama 60 hari pascaoperasi. Tejadinya pergeseran
Sedangkan pengamatan pada tulang kontrol selama 90 hari pascaoperasi
memperlihatkan daerah defek telah tertutup oleh jaringan tulang baru yang telah
mengalami proses remodeling lebih lanjut sehingga terlihat menyerupai jaringan tulang sekitarnya (Gambar 9 F).
[image:42.595.125.466.180.674.2]
Gambar 9 Sayatan melintang dari tulang tibia yang diberi perlakuan implan selama 30 hari (A), 60 hari (C), dan 90 hari (E), serta tulang tibia kontrol selama 30 hari (B), 60 hari (D), dan 90 hari (F) pascaoperasi. Tanda panah merah menunjukkan lokasi defek tulang. Sayatan ini menunjukkan bagian struktur tulang: i = implan, j = jaringan ikat, n = pertumbuhan jaringan baru yang menutupi defek, dan s = sumsum tulang. Bar A, B, C, dan D = 2,5 mm; E dan F = 2 mm.
A B
C
C D
E F
s
i
j
j
s
n
s
jj
i
n
s
s
j
j
i
n
s
Gambaran Mikroskopis Preparat Tulang Gosok
Pada preparat tulang gosok dengan pewarnaan Hematoksilin, keberadaan
implan tidak dapat dipertahankan akibat proses penggosokan. Hal tersebut terjadi
karena belum terbentuknya ikatan yang sangat kuat antara jaringan tulang dengan
implan. Dengan demikian proses penggosokan tersebut menyisakan jaringan tulang
yang dapat diamati pola pertumbuhannya.
Preparat tulang yang diberi perlakuan implan selama 30 hari pascaoperasi
memperlihatkan pola pertumbuhan bony callus. Bony callus adalah massa jalinan tulang tidak terorganisasi yang berkembang menurut pola bekuan fibrin asalnya
(Dorland 2002). Jaringan tulang yang menyusun bony callus adalah woven bone (Gambar 10 A). Woven bone adalah jaringan tulang yang ditemukan pada embrio dan hewan muda, serta pada berbagai kond