OPTIMISASI PEMBENTUKAN MIKROKAPSUL DENGAN
PENYALUT ALGINAT-KITOSAN UNTUK ENKAPSULASI
SEL-SEL LEYDIG
DEVI RAHAYU
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DEVI RAHAYU. Optimisasi Pembentukan Mikrokapsul dengan Penyalut
Alginat-Kitosan untuk Enkapsulasi Sel-Sel Leydig. Dibimbing oleh IRMANIDA
BATUBARA dan KUSDIANTORO MOHAMAD.
Hipogonadisme adalah kondisi klinik yang ditandai dengan rendahnya
konsentrasi hormon testosteron. Hipogonadisme disebabkan oleh fungsi sel
Leydig sebagai penghasil testosteron yang tidak mencukupi. Metode enkapsulasi
akan melindungi sel yang akan ditransplantasikan sehingga dapat mencegah
terjadinya penolakan oleh sistem kekebalan tubuh. Penelitian ini bertujuan
mengoptimisasi pembentukan mikrokapsul untuk mengenkapsulasi sel Leydig.
Mikrokapsul dibuat menggunakan alginat sebagai penyalut pertama dan kitosan
sebagai penyalut kedua. Konsentrasi minimum larutan alginat untuk membuat
kapsul berbentuk bulat, yaitu 1,5% (b/v) dengan viskositas 33,8 cPs yang
menghasilkan mikrokapsul dengan diameter berkisar 230-270
µm.
Kondisi
optimum penyalut kedua, kitosan, adalah 0,5% (b/v) yang menghasilkan
mikrokapsul berbentuk bulat dengan memiliki stabilitas mekanik sampai 4 jam.
Sel-sel Leydig dapat terperangkap di dalam kapsul dengan kerapatan berbanding
lurus dengan konsentrasi sel yang digunakan dalam enkapsulasi.
ABSTRACT
DEVI RAHAYU. Optimization of Alginate-Chitosan Microcapsules Formation
for Leydig Cells Encapsulation. Supervised by IRMANIDA BATUBARA and
KUSDIANTORO MOHAMAD.
Hypogonadism is a clinical condition characterized by low concentrations of
testosterone. It is caused by malfunction of Leydig cells in producing testosterone.
Encapsulation method will protect the transplanted cells from the immune system
rejection. The aims of this study was to optimize the formation of microcapsules
for Leydig cells encapsulation. The microcapsules were made of alginate and
chitosan as the first and the second coating agents, respectively. The result
showed that the minimum concentration of alginate was 1.5% (w/v) with a
viscosity of 33.8 cPs, resulted spherical microcapsules with diameters of 230-270
OPTIMISASI PEMBENTUKAN MIKROKAPSUL DENGAN
PENYALUT ALGINAT-KITOSAN UNTUK ENKAPSULASI
SEL-SEL LEYDIG
DEVI RAHAYU
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Optimisasi Pembentukan Mikrokapsul dengan Penyalut Alginat-
Kitosan untuk Enkapsulasi Sel-Sel Leydig
Nama
: Devi Rahayu
NIM
: G44070011
Disetujui
Pembimbing I
Pembimbing II
Dr. Irmanida Batubara, S.Si, M.Si
drh. Kusdiantoro Mohamad, M.Si, PAVet
NIP 19750807 200501 2001
NIP 19710820 199512 1001
Diketahui
Ketua Departemen Kimia FMIPA IPB
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2002
PRAKATA
Segala puji bagi Allah SWT yang telah melimpahkan segala rahmat-Nya
sehingga penulis dapat menyelesaikan karya ilmiah yang telah dilaksanakan sejak
bulan Januari hingga Juni 2011 di Laboratorium Kimia Analitik, Departemen
Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam dan Laboratorium
Embriologi, Fakultas Kedokteran Hewan. Tema yang dipilih adalah enkapsulasi,
dengan judul “Optimisasi Pembentukan Mikrokapsul dengan Penyalut
Alginat-Kitosan untuk Enkapsulasi Sel-Sel Leydig”.
Penulis mengucapkan terima kasih kepada Ibu Dr. Irmanida Batubara, S.Si,
M.Si dan Bapak drh. Kusdiantoro Mohamad, M.Si selaku pembimbing yang telah
memberikan saran, kritik, dorongan ilmu, dan bimbingannya selama penelitian
dan penulisan karya ilmiah. Penulis juga mengucapkan terima kasih kepada
pemberi dana hibah bersaing No. 04/13.24.4/SPP/PHB/2011 dengan judul
Pemanfaatan Enkapsulasi Sel-Sel Leydig untuk Terapi Hormon Testosteron atas
nama Ibu drh. Wahono Esthi Prasetyaningtyas, M.Si. Penulis juga mengucapkan
terima kasih kepada staf laboran Kimia Analitik, yaitu Pak Eman, Pak Dede, Bu
Nunung, dan para pegawai di Laboratorium Kimia Analitik, serta Pak Wahyu
(laboran Embriologi) yang telah membantu penulis selama penelitian. Ucapan
terima kasih tidak terhingga kepada Bapak, Ibu, adik, dan seluruh keluarga atas
nasihat, semangat, dan doanya. Semoga tulisan ini bermanfaat dan dapat
menambah wawasan ilmu pengetahuan bagi penulis khususnya dan pembaca
umumnya.
Bogor, Agustus 2011
RIWAYAT HIDUP
Penulis dilahirkan di Klaten pada tanggal 11 Desember 1989 dari pasangan
bapak Sugito dan ibu Hesti Setiyo Budi. Penulis adalah anak pertama dari dua
bersaudara. Penulis lulus dari SMAN 1 Klaten pada tahun 2007 dan pada tahun
yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui
jalur Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Kimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama masa perkuliahan, penulis aktif di beberapa organisasi antara lain
FORCES IPB tahun 2007/2008, Ikatan Mahasiswa Kimia (Imasika) pada tahun
2008/2009 sebagai staf ahli Pengembangan Kualitas Keprofesian Mahasiswa
(PK2M), dan OMDA Klaten tahun 2007 hingga sekarang. Penulis juga pernah
menjadi asisten praktikum Kimia TPB pada tahun ajaran 2008-2011, Kimia
Organik Layanan untuk mahasiswa Biokimia pada tahun ajaran 2009/2010, Kimia
Analitik Layanan untuk mahasiswa Biologi pada tahun 2009/2010, Kimia Organik
untuk Program Diploma Tiga (D3) pada tahun ajaran 2010/2011, Kimia Bahan
Alam untuk Program Ekstensi pada tahun ajaran 2010/2011, Elektroanalitik dan
Teknik Pemisahan untuk mahasiswa Kimia pada tahun ajaran 2010/2011, dan
Spektrofotometri dan Aplikasi Kemometrik untuk mahasiswa Kimia pada tahun
ajaran 2010/2011.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
METODE ... 2
Bahan dan Alat ... 2
Lingkup Kerja ... 2
HASIL ... 4
Kadar Air dan Kadar Abu ... 4
Osmolaritas... 4
Viskositas ... 4
Kondisi Optimum Inti Kapsul ... 4
Uji Stabilitas Mekanik Mikrokapsul ... 5
Enkapsulasi Sel-Sel Leydig ... 6
PEMBAHASAN ... 6
Kadar Air dan Kadar Abu ... 6
Osmolaritas... 7
Viskositas ... 7
Kondisi Optimum Inti Kapsul ... 7
Uji Stabilitas Mekanik Mikrokapsul ... 9
Enkapsulasi Sel-Sel Leydig ... 9
SIMPULAN DAN SARAN ... 10
Simpulan ... 10
Saran ... 10
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1 Hasil Kadar Air dan Kadar Abu ... 4
2 Penentuan Viskositas Larutan ... 4
DAFTAR GAMBAR
Halaman
1 Struktur Na-alginat ... 1
2 Struktur Kitosan ... 1
3 Pembentukan Mikrokapsul dengan Ragam Konsentrasi Alginat ... 5
4 Diameter Mikrokapsul dengan Ragam Konsentrasi Alginat dan CaCl2 . 5
5 Waktu Pengerasan Gel Alginat dengan Ragam Konsentrasi Alginat
dan CaCl2 ... 5
6 Stabilitas Mekanik Mikrokapsul dengan Ragam Konsentrasi Kitosan ... 6
7 Mikrokapsul dengan Ragam Konsentrasi Sel-Sel Leydig ... 6
8 Reaksi Tautan Silang antara Alginat dan CaCl2 ... 8
9 Bentuk Mikrokapsul dengan Konsentrasi Alginat ... 8
10 Reaksi Tautan Silang antara Alginat dan Kitosan ... 9
DAFTAR LAMPIRAN
Halaman
1 Diagram Alir Penelitian ... 13
2 Penentuan Kadar Air Bahan Penyalut ... 15
3 Penentuan Kadar Abu Bahan Penyalut ... 16
4 Penentuan Osmolaritas Larutan ... 17
5 Penentuan Viskositas Bahan Penyalut ... 18
6 Pengaruh Konsentrasi Alginat pada Pembentukan Mikrokapsul ... 19
7 Pengaruh Konsentrasi Alginat dengan Ragam Konsentrasi CaCl2
terhadap Ukuran Mikrokapsul ... 20
8 Waktu Pengerasan Gel Alginat pada Ragam Konsentrasi Alginat
dan CaCl2 ... 22
9 Uji Stabilitas Mekanik Mikrokapsul ... 23
10 Diameter Mikrokapsul dengan Ragam Konsentrasi Sel Leydig ... 25
PENDAHULUAN
Hipogonadisme adalah kondisi klinis yang ditandai dengan rendahnya konsentrasi
hormon testosteron. Hipogonadisme
disebabkan oleh fungsi sel Leydig sebagai penghasil testosteron yang tidak mencukupi (Rhoden dan Morgentaler 2004). Gejala klinis yang ditimbulkan akibat hipogonadisme antara lain atropi dan kelemahan otot, osteoporosis, menurunnya densitas tulang, fungsi seksual, dan meningkatnya massa lemak serta gejala lain yang sama pada usia muda (Gruenewald dan Matsumoto 2003). Pengobatan yang selama ini digunakan adalah dengan terapi pemberian hormon sintetis. Namun demikian, terapi dengan hormon sintetis ini dalam jangka panjang dapat menimbulkan risiko, yaitu ischemia arteri koroner (penyakit jantung koroner) (Gruenewald dan Matsumoto 2003), fluid retention, kanker prostat, hepatotoxicity, dan
sleep apnee (Rhoden dan Morgentaler 2004). Oleh karena itu, metode lain sebagai alternatif pengobatan diperlukan untuk mengurangi risiko yang dapat berdampak buruk pada kesehatan.
Salah satu cara untuk mengatasi kelemahan tersebut ialah dengan cara terapi sel menggunakan transplantasi sel-sel Leydig, sel penghasil hormon testosteron. Akan tetapi, transplantasi sel memiliki kendala penolakan oleh sistem kekebalan tubuh. Salah satu cara mengatasi penolakan ini adalah dengan enkapsulasi sel dengan suatu penyalut, yang memungkinkan difusi nutrisi dan metabolit keluar masuk mikrokapsul tetapi menghalangi sistem kekebalan mencapai sel.
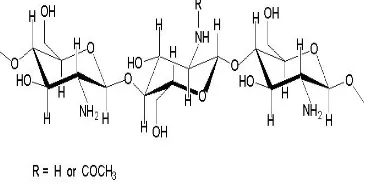
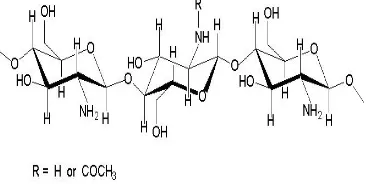
Mikrokapsul merupakan partikel kecil yang berisi senyawa aktif atau bahan inti yang dibungkus oleh suatu lapisan atau cangkang (Beneta 1996). Enkapsulasi dibedakan menjadi dua, yaitu makroenkapsulasi dan mikroenkapsulasi. Kedua proses dibedakan berdasarkan ukuran kapsul yang dihasilkan (Uludag et al. 2000). Proses enkapsulasi yang dilakukan pada penelitian ini menggunakan bahan penyalut alginat dan kitosan. Alginat adalah polisakarida anionik yang diperoleh dari ekstraksi alga cokelat (Macrocytis pyrifera) dan merupakan kopolimer yang
terdiri atas residu asam β(1,4)-D-manuronat
(M) dan asam α(1,4)-L-guluronat (G) (Sæther
et al. 2008) (Gambar 1). Alginat telah banyak digunakan dalam proses enkapsulasi karena sifatnya yang biokompatibel dan murah (Friedli & Schlager 2005).
Gambar 1 Struktur Na-alginat.
Kitosan merupakan biopolimer
polikationik yang tersusun dari unit berulang 2-amino-2-deoksi-D-glukopiranosa yang
terhubung oleh ikatan β-(1,4) (Gambar 2). Kitosan bersifat alami, biodegradabel, biokompatibel, dan tidak beracun bagi tubuh. Polimer terdiri dari polimer yang bersifat kationik dan anionik. Kitosan merupakan polimer bermuatan positif sehingga dapat membentuk ikatan silang dengan polimer anionik, yaitu polimer yang bermuatan negatif diantaranya adalah alginat, karagenan, dan karboksimetil selulosa. Penggunaan sistem penyalut berganda alginat kitosan dapat mengurangi porositas dan meningkatkan kestabilan kapsul yang dihasilkan (Silva et al.
2006).
Gambar 2 Struktur kitosan.
Beberapa penelitian tentang enkapsulasi pernah dilakukan dengan menggunakan bahan penyalut alginat-kitosan terhadap bahan aktif seperti ibuprofen (Wukirsari 2006), ketoprofen (Sugita et al. 2010; Arianto 2010), kurkumin (Herdini et al. 2010) sedangkan untuk materi biologis pernah dilakukan enkapsulasi terhadap hemoglobin (Silva et al.
Metode enkapsulasi yang pernah dilakukan oleh Sugita et al. 2010, Arianto (2010), dan Herdini et al. (2010) tidak dapat digunakan untuk enkapsulasi sel karena pada penelitian tersebut menggunakan alat penyemprot kering (spray drying) sehingga dapat mengakibatkan kerusakan pada sel. Oleh karena itu, penelitian ini menggunakan teknik pembentukan droplet gel alginat-CaCl2
dengan metode ekstruksi, yaitu dengan penetesan langsung larutan alginat ke dalam larutan CaCl2 sehingga terbentuk gel alginat
kemudian disalut menggunakan larutan kitosan. Penelitian ini bertujuan melakukan optimisasi pembentukan mikrokapsul alginat dengan ragam konsentrasi alginat dan CaCl2,
menguji stabilitas mekanik mikrokapsul alginat-kitosan dengan ragam konsentrasi kitosan, dan enkapsulasi sel-sel Leydig dengan ragam konsentrasi sel.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah alginat (Sigma Aldrich), kitosan niaga dari Bratachem dengan derajat asetilasi dan bobot molekul berturut-turut 73,76% dan ± 3,7×105 g/mol, sel-sel Leydig hasil isolasi dari jaringan testis tikus jantan Sprague Dawley. Alat-alat yang digunakan adalah viskometer Brookfield, osmometer krioskopik, sentrifuse swing rotor, biological safety cabinet, dan mikroskop cahaya.
Lingkup Kerja
Penelitian ini terbagi menjadi tiga tahapan (Lampiran 1). Tahap pertama adalah pencirian sifat bahan penyalut (alginat dan kitosan) meliputi penentuan kadar air, kadar abu, osmolaritas, dan viskositas dari berbagai larutan yang digunakan dalam penelitian. Tahap kedua adalah penentuan optimisasi pembentukkan mikrokapsul gel alginat dengan ragam konsentrasi alginat dan CaCl2
serta pengujian stabilitas mekanik mikrokapsul dengan ragam konsentrasi kitosan sebagai penyalut kedua. Tahap ketiga adalah aplikasi enkapsulasi sel-sel Leydig dengan ragam konsentrasi sel dengan penyalut alginat-kitosan.
Penentuan Kadar Air
Penentuan kadar air dilakukan
menggunakan metode standar AOAC (1999). Cawan porselen dikeringkan pada suhu 105 °C selama 30 menit kemudian didinginkan dalam desikator dan ditimbang. Sebanyak 3 g bahan penyalut (alginat dan kitosan) dimasukkan ke dalam cawan lalu dimasukkan ke dalam oven pada suhu 105 °C selama 3 jam kemudian didinginkan dalam desikator dan ditimbang. Prosedur ini dilakukan hingga diperoleh bobot yang tetap.
Kadar air (%) =
100
%
A
B
A
Keterangan:
A = bobot contoh awal (g)
B = bobot contoh kering (g)
Penentuan Kadar Abu
Penentuan kadar abu bahan penyalut dilakukan menggunakan metode standar AOAC (1999). Cawan porselen yang bersih dan kering dipanaskan di dalam tanur untuk menghilangkan sisa-sisa kotoran yang menempel di cawan. Setelah didinginkan dalam desikator, cawan ditimbang. Sebanyak 0,5 g bahan penyalut dimasukkan ke dalam cawan tersebut dan dipanaskan sampai tidak berasap kemudian dibakar dalam tanur pada suhu 600 °C sampai diperoleh abu. Cawan berisi abu didinginkan dalam desikator dan ditimbang.
Kadar abu (%) =
100
%
A
B
Keterangan:
A = bobot contoh awal (g)
B = bobot abu (g)
Pengukuran Osmolaritas dan Viskositas
Larutan alginat dibuat dengan ragam konsentrasi 0,5; 1,0; 1,5; 2,0 % (b/v) dalam akuades dan buffer fosfat salin. Larutan kitosan dibuat dengan ragam konsentrasi 0,5; 1,0; 1,5; 2,0 % (b/v) dalam pelarut CH3COOH
1%. Larutan CaCl2 dibuat dengan ragam
konsentrasi 0,05; 0,1; 0,15; 0,2 M dalam akuades. Semua larutan diukur nilai osmolaritasnya dengan alat osmometer
Pengkondisian Optimum Pembentukan Inti Mikrokapsul
Optimisasi pembentukkan mikrokapsul didahului dengan menggunakan metode (Wukirsari 2006), akan tetapi metode ini tidak dapat digunakan karena sel akan mengalami kerusakan. Selanjutnya metode yang digunakan adalah metode Goosen et al. (1987) yang dimodifikasi. Larutan alginat dengan konsentrasi 0,5; 1,0; 1,5; 2,0 % (b/v) dalam buffer fosfat salin diteteskan ke dalam larutan CaCl2 dengan ragam konsentrasi 0,05; 0,1;
0,15; 0,2 M. Penetesan dilakukan dengan pipet mikro. Lama kontak gel alginat dalam CaCl2 selama 15 menit. Mikrokapsul yang
terbentuk lalu dicuci tiga kali dengan buffer fosfat. Bentuk mikrokapsul diamati, lama pengerasan gel dihitung, serta diameter mikrokapsul diukur dengan menggunakan mikroskop cahaya yang telah dilengkapi dengan garis skala mikrometer.
Uji Stabilitas Mekanik
Setelah diperoleh konsentrasi alginat
minimum maka dilanjutkan dengan
penyalutan ganda. Konsentrasi alginat yang digunakan adalah 1,5% (b/v) dan CaCl2 0,15
M (berdasarkan hasil optimisasi tahap sebelumnya). Mikrokapsul hasil penyalutan pertama dimasukkan ke dalam larutan kitosan dengan ragam konsentrasi 0,5; 1,0; 1,5; 2,0 % (b/v). Lama kontak inti mikrokapsul dengan kitosan selama 6 menit. Mikrokapsul dicuci dengan akuades lalu dicuci dengan buffer fosfat. Pengujian kestabilan mikrokapsul dilakukan dengan menggunakan metode Zhu
et al. (2005) yang dimodifikasi. Sebanyak 25 buah mikrokapsul dimasukkan ke dalam gelas piala yang berisi larutan buffer fosfat salin pH 7,2 dan didiamkan selama 15 menit. Mikrokapsul diaduk dengan pengaduk magnetik dengan kecepatan 500 rpm. Lama waktu kerusakan mikrokapsul mencapai 50% ditentukan.
Isolasi Sel-Sel Leydig dari Jaringan Testis Tikus
Sel-sel Leydig diisolasi dari jaringan testis tikus jantan Sprague Dawley usia 8 minggu (pubertas). Isolasi dan purifikasi sel-sel Leydig menggunakan metode Chemes et al.
(1992) yang telah dimodifikasi. Testis diambil dari tikus yang telah dibius dengan eter dan dietanuasi secara dislocatio cervicalis. Selaput tunika albugunea dan jaringan ikat dibuang
lalu kurang lebih 700 mg jaringan testis ditempatkan di tempat yang bersih kemudian dicuci tiga kali dengan Dulbecco’s Phosphat Buffer Saline (DPBS). Pengambilan jaringan testis dilakukan secara aseptis. Jaringan testis diurai menggunakan pinset steril di dalam cawan petri yang telah mengandung DPBS
dengan kolagenase 0,04% dan 10 µg/mL
tripsin inhibitor. Setelah tubulus seminiferus terurai sempurna, potongan jaringan testis kemudian dipindahkan ke dalam tabung yang berisi larutan yang sama dan diinkubasi pada suhu 34 °C selama 40 menit. Setelah itu larutan kolagenase diencerkan 4 kali volume awal dengan menggunakan DPBS kemudian didiamkan selama 2 menit agar potongan kecil jaringan hasil cerna enzimatis mengendap membentuk sedimen. Cairan supernatan yang mengandung sel-sel hasil cerna enzimatis disentrifugasi dengan kecepatan 200 X g selama 3 menit. Pelet sel dicuci sebanyak 2 kali dengan DPBS dengan cara sentrifugasi. Pelet sel diencerkan dengan 0,5 mL larutan DPBS pada pencucian akhir.
Suspensi sel-sel interstisial selanjutnya dimurnikan dengan menggunakan larutan Percoll dengan gradien 21, 26, 34, dan 60%. Tabung berisi suspensi sel dalam Percoll gradien disentrifugasi dengan kecepatan 400 X g selama 15 menit dan dilanjutkan dengan kecepatan 800 X g selama 15 menit dengan menggunakan sentrifuse swing rotor pada suhu ruang. Fraksi sel-sel yang terletak diantara gradien 34 dan 60% dikoleksi dan dicuci berturut-turut dengan DPBS sebanyak 2 kali, dan DPBS + serum sebanyak 2 kali. Selanjutnya konsentrasi sel dihitung dengan
menggunakan Neubauer chamber dan
diencerkan dengan alginat 1,5% dalam saline (osmolaritas 300 mosmol/kg) sehingga diperoleh konsentrasi akhir 1×107 sel/mL.
Enkapsulasi Sel-Sel Leydig
Enkapsulasi sel-sel Leydig menggunakan metode Goosen et al. (1987) yang dimodifikasi. Sel-sel Leydig diencerkan dengan ragam konsentrasi, yaitu 1×107, 1×106, 1×105, dan 1×104 sel/mL. Larutan alginat yang mengandung sel-sel Leydig kemudian diteteskan dengan pipet mikro ke dalam CaCl2 0,15 M. Mikrokapsul yang
Mikrokapsul diamati dan diukur diameternya dengan mikroskop cahaya yang dilengkapi dengan mikrometer.
HASIL
Kadar Air dan Kadar Abu
Bahan penyalut yang digunakan dalam penelitian ini adalah alginat dan kitosan. Kadar air dapat dilihat pada Lampiran 2 sedangkan kadar abu pada Lampiran 3. Alginat yang digunakan dalam penelitian memiliki kadar air 9,74% dan kitosan sebesar 13,85%. Kadar abu alginat jauh lebih tinggi daripada kitosan, yaitu sebesar 56,71% sedangkan kitosan sebesar 0,03% (Tabel 1).
Tabel 1 Hasil kadar air dan kadar abu
Analisis (%) Bahan penyalut
Alginat Kitosan
Kadar air 9,74 13,85
Kadar abu 56,71 0,03
Sifat-sifat alginat bergantung pada tingkat polimerisasi dan perbandingan komposisi guluronan dan mannuronan dalam molekul. Alginat tidak dapat larut dalam pelarut organik dan dapat mengendap dalam alkohol (Rasyid 2003). Ciri kitosan antara lain berupa padatan amorf putih, serpihan bening, tidak larut dalam air, alkohol, aseton, dan larutan basa, tetapi larut dalam asam organik maupun anorganik. Mutu kitosan ditentukan oleh viskositas, nilai derajat deasetilasi, kadar abu, dan kadar air. Larutan kitosan pada batas konsentrasi tertentu dalam larutan asam asetat 1% dapat membentuk gel (Khan et al. 2002). Gel kitosan tersebut dapat menahan air dalam strukturnya sehingga disebut sebagai hidrogel dan memiliki formasi tiga dimensi (Wang et al. 2004).
Osmolaritas
Hasil pengukuran osmolaritas larutan CaCl2, alginat, dan kitosan dalam ragam
konsentrasi ditunjukkan pada Lampiran 4. Larutan CaCl2 dengan ragam konsentrasi
0,05-0,2 M memiliki osmolaritas dengan kisaran 75-249 mosmol/kg. Osmolaritas alginat dalam akuades berkisar 78-240 mosmol/kg sedangkan dalam pelarut buffer nilai osmolaritasnya naik menjadi 357-618 mosmol/kg. Larutan buffer dapat menaikkan osmolaritas suatu larutan karena adanya keberadaan ion-ion yang terkandung dalam
larutan buffer fosfat salin. Nilai osmolaritas larutan kitosan berkisar 33-123 mosmol/kg. Hal ini menunjukkan bahwa semakin tinggi konsentrasi larutan maka nilai osmolaritasnya semakin tinggi pula.
Viskositas
Pegukuran viskositas dilakukan
mengunakan viskometer Brookfield.
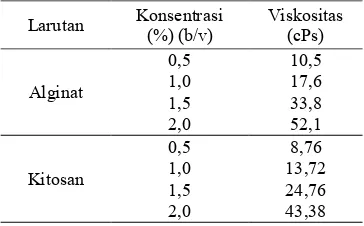
Kecepatan spindel yang digunakan adalah 50 rpm dengan spindel nomor M2. Larutan yang diukur adalah alginat dan kitosan dalam ragam konsentrasi. Larutan alginat yang diukur memiliki nilai viskositas berkisar 10,5-52,1 cPs sedangkan viskositas larutan kitosan berkisar 8,76-43,88 cPs (Tabel 2). Viskositas larutan menunjukkan kekentalan dan tingkat konsentrasi suatu larutan. Semakin tinggi konsentrasi larutan maka semakin tinggi nilai viskositasnya (Lampiran 5).
Tabel 2 Penentuan viskositas larutan
Larutan Konsentrasi (%) (b/v)
Viskositas (cPs)
Alginat
0,5 10,5 1,0 17,6 1,5 33,8 2,0 52,1
Kitosan
0,5 8,76 1,0 13,72 1,5 24,76 2,0 43,38
Kondisi Optimum Inti Mikrokapsul
Enkapsulasi diawali dengan pembuatan inti mikrokapsul menggunakan larutan alginat. Penetesan larutan alginat ke dalam larutan CaCl2 dilakukan dengan ragam konsentrasi
0,5-2,0 % (b/v) dengan menggunakan pipet mikro. Larutan alginat dengan konsentrasi 0,5 dan 1,0% (b/v) ketika diteteskan ke dalam CaCl2 menghasilkan kapsul yang berukuran
pembentukan mikrokapsul. Lampiran 6 menunjukkan hasil pengamatan dalam pembentukan inti mikrokapsul untuk mendapatkan kondisi yang optimum.
Gambar 3 Pembentukan mikrokapsul dengan ragam konsentrasi alginat: a. 0,5%; b. 1,0%; c. 1,5%; dan d. 2,0%, panah = mikrokapsul.
Kapsul yang dibuat menggunakan alginat 0,5% tidak dapat ditentukan diameter kapsulnya karena kapsul berbentuk tidak beraturan sedangkan mikrokapsul dengan konsentrasi alginat 1,0% memiliki rerata diameter 310,35-322,13 µm (Lampiran 7). Kapsul yang dibuat menggunakan alginat 1,5 dan 2,0% dan CaCl2 0,15 dan 0,2 M memiliki
rerata diameter sebesar 205,80-258,00 µm (Gambar 4).
Gambar 4 Diameter mikrokapsul dengan ragam konsentrasi alginat dan CaCl2.
Larutan alginat yang diteteskan ke dalam CaCl2 membentuk gel dan mengeras dengan
waktu pengerasan gel alginat berbanding
terbalik dengan konsentrasi larutan CaCl2.
Semakin tinggi konsentrasi CaCl2 maka waktu
pengerasan gel akan semakin cepat. Pembentukan gel alginat dengan konsentrasi
CaCl2 0,05 M membutuhkan waktu
pengerasan lebih lama daripada dengan CaCl2
0,15 atau 0,2 M (Gambar 5).
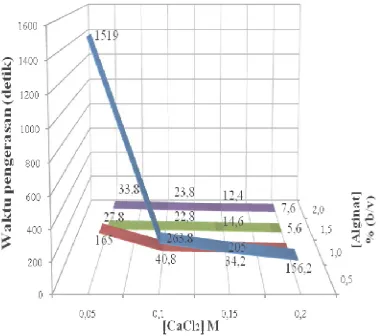
Gambar 5 Waktu pengerasan gel alginat dengan ragam konsentrasi alginat dan CaCl2.
Pengerasan gel alginat 0,5 %
membutuhkan waktu 1519 detik sedangkan gel alginat dengan konsentrasi 1,5 dan 2,0 % membutuhkan waktu kurang dari satu menit, yaitu berkisar 5-34 detik (Lampiran 8). Pembentukan kompleks antara polianionik alginat dan kation divalen, yaitu CaCl2
berlangsung secara spontan. Kation Ca2+ dapat digantikan dengan kation yang lainnya seperti Ba2+, Sr2+, Fe3+, dan Al3+.
Uji Stabilitas Mekanik Mikrokapsul
Pengujian stabilitas mikrokapsul alginat-kitosan dilakukan dengan cara pengadukan mikrokapsul dalam larutan buffer fosfat salin dengan kecepatan 500 rpm dengan ragam konsentrasi. Mikrokapsul gel alginat berubah warna menjadi kuning setelah dimasukkan ke dalam larutan kitosan. Kitosan dapat berikatan dengan alginat secara ionik. Setelah gel alginat disalut dengan kitosan maka mikrokapsul menjadi lebih keras daripada gel alginat-CaCl2.
Gambar 6 menunjukkan hasil pengujian stabilitas mikrokapsul. Mikrokapsul yang disalut dengan kitosan 0,5 dan 1,0 % mengalami kerusakan di atas 50% setelah dilakukan pengadukan selama 4 jam, yaitu
a
b
sebesar 58,67% dan 64% secara berurutan, mikrokapsul dengan kitosan 1,5% mengalami kerusakan di atas 50% setelah diaduk selama 5 jam, yaitu sebesar 56%, sedangkan kerusakan mikrokapsul yang disalut dengan kitosan 2,0% mengalami rusak 50,67% setelah diaduk 11 jam (Lampiran 9).
Gambar 6 Stabilitas mekanik mikrokapsul dengan konsentrasi kitosan (◊: 0,5; □: 1,0; ∆: 1,5; dan ○: 2,0% (b/v)).
Enkapsulasi Sel-Sel Leydig
Sel Leydig sebagai penghasil hormon dapat digunakan untuk pengganti terapi hormon sehingga defisiensi hormonal dapat diatasi dengan terapi sel. Terapi sel Leydig bisa diterapkan dengan metode enkapsulasi (Uludag et al. 2000). Enkapsulasi sel-sel Leydig menggunakan larutan alginat 1,5% dan CaCl2 0,15 M. Hasil enkapsulasi sel-sel
Leydig menunjukkan bahwa sel yang disalut dapat terperangkap ke dalam inti mikrokapsul alginat. Mikrokapsul yang dihasilkan berwarna putih dan berbentuk bulat. Diameter mikrokapsul yang berhasil dibuat berkisar 230-270 µm (Lampiran 10).
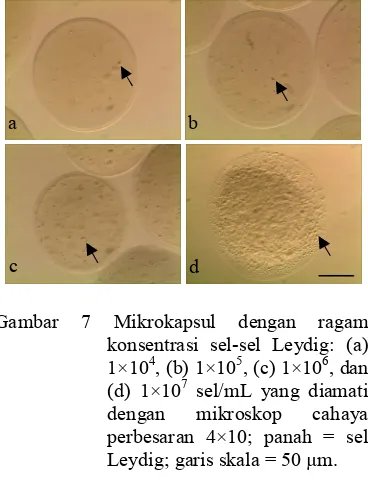
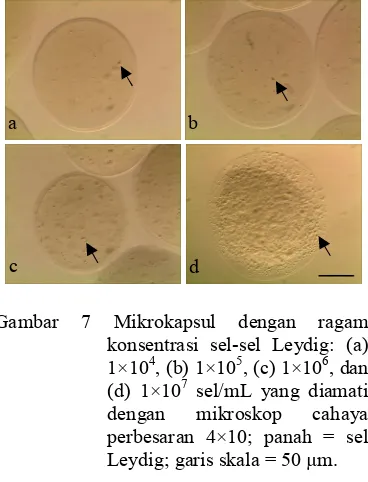
Sel-sel Leydig terperangkap di dalam inti mikrokapsul secara menyebar (Gambar 7). Konsentrasi sel dibuat beragam untuk mengetahui perbedaan kerapatan persebaran sel-sel di dalam mikrokapsul. Mikrokapsul yang dibuat dengan konsentrasi sel 1×104 sel/mL memiliki kerapatan sel yang paling renggang , sel yang disalut dengan konsentrasi 1×105 dan 1×106 sel/mL memiliki kerapatan sedang, sedangkan dengan konsentrasi 1×107 sel/mL kerapatan sel di dalam mikrokapsul
sangat rapat. Kerapatan sel berbanding lurus dengan konsentrasi sel yang digunakan.
Gambar 7 Mikrokapsul dengan ragam konsentrasi sel-sel Leydig: (a) 1×104, (b) 1×105, (c) 1×106, dan (d) 1×107 sel/mL yang diamati dengan mikroskop cahaya perbesaran 4×10; panah = sel Leydig; garis skala = 50 µm.
PEMBAHASAN
Kadar Air dan Kadar Abu
Kadar air berkaitan dengan daya simpan bahan. Menurut Winarno (1997) sampel yang baik disimpan dalam jangka panjang adalah sampel yang memiliki kadar air kurang dari 10%. Berdasarkan hasil penelitian alginat lebih tahan daya simpannya daripada kitosan. karena kadar airnya lebih kecil daripada kitosan.
Penentuan kadar abu dilakukan untuk mengetahui kandungan senyawa anorganik yang terdapat dalam bahan. Menurut Patria (2007) kadar abu berhubungan erat dengan kandungan mineral yang terdapat dalam suatu bahan, kemurnian serta kebersihan suatu bahan yang dihasilkan. Alginat dapat diperoleh dari hasil ekstraksi alga cokelat sedangkan kitosan diperoleh dari kitin cangkang organisme jenis crustaceae. Bentuk garam dari alginat dapat berupa Na-alginat
atau Ca-alginat sedangkan kitosan
mengandung garam karbonat. Kadar abu alginat jauh lebih tinggi daripada kitosan karena serbuk alginat yang digunakan dalam bentuk garamnya, yaitu Na-alginat. Natrium merupakan salah satu jenis logam alkali yang menjadi penyusun abu.
a b
Osmolaritas
Alginat dapat larut dalam pelarut polar seperti akuades dan larutan buffer fosfat salin. Larutan kitosan dilarutkan dalam CH3COOH
1%. Osmolaritas menyatakan jumlah partikel zat terlarut per liter larutan. Osmolaritas yang dimiliki oleh sel berkisar 280-320 mosmol/kg (Nguyen et al. 2003). Kondisi dengan osmolaritas ini menjadikan sel tetap hidup. Larutan alginat dengan konsentrasi 0,5-2% (b/v) dalam akuades memiliki nilai osmolaritas kurang dari 300 mosmol/kg (Lampiran 4) sehingga larutan tersebut harus disesuaikan dengan kondisi sel. Nilai osmolaritas larutan alginat meningkat setelah alginat dilarutkan dalam buffer fosfat salin. Akan tetapi larutan alginat dengan konsentrasi paling rendah yang dilarutkan dalam buffer fosfat memiliki osmolaritas yang lebih tinggi dari kondisi sel sehingga dalam proses
enkapsulasi menggunakan sel tidak
menggunakan larutan alginat dalam buffer fosfat. Larutan buffer mengandung ion-ion elektrolit sehingga dapat meningkatkan nilai osmolaritas larutan.
Larutan alginat untuk enkapsulasi sel Leydig dibuat dengan pelarut akuades dan penyesuaian nilai osmolaritas dilakukan dengan penambahan garam NaCl ke dalam larutan alginat sehingga dapat diatur osmolaritas larutan alginat sebesar 300 mosmol/kg. Pengukuran osmolaritas larutan CaCl2 dan kitosan kurang berpengaruh pada
proses penyalutan karena sel tidak berada langsung dalam kedua larutan tersebut. Sel-sel Leydig yang disalut berada di dalam larutan alginat sehingga osmolaritas larutan alginat harus disesuaikan dengan kondisi lingkungan sel. Osmolaritas perlu ditentukan karena keseimbangan osmolaritas bahan penyalut dapat mempengaruhi kondisi sel yang berada dalam larutan. Proses difusi osmosis dapat terjadi pada sel yang berada di dalam larutan non-isotonis. Sel akan mengalami pengerutan (krenasi) ketika osmolaritas di luar sel lebih tinggi daripada di dalam sel (hipertonis) dan sebaliknya, sel akan membengkak (hemolisis) ketika osmolaritas di luar sel lebih rendah daripada di dalam sel (hipotonis). Pengerutan dan pembengkakan sel akan mengakibatkan sel mati.
Viskositas
Salah satu parameter yang menentukan keberhasilan pembuatan mikrokapsul adalah konsentrasi bahan penyalut. Larutan alginat
dan kitosan adalah larutan yang memiliki tingkat viskositas berbeda-beda di setiap konsentrasinya. Larutan alginat dengan konsentrasi rendah relatif encer sedangkan alginat dengan konsentrasi 2,0% relafif agak kental. Berdasarkan hasil pengukuran, viskositas larutan alginat 2,0% paling tinggi diantara konsentrasi alginat lainnya, yaitu sebesar 52,1 cPs. Alginat dengan konsentrasi 0,5% memiliki viskositas yang rendah, yaitu 10,5 cPs. Hal ini menunjukkan bahwa semakin tinggi konsentrasi larutan alginat dan kitosan maka nilai viskositas larutan semakin tinggi pula.
Enkapsulasi sel dilakukan dengan dua penyalutan, yaitu penyalutan pertama/inti mikrokapsul (core) menggunakan larutan alginat dan penyalut kedua dengan larutan kitosan. Viskositas alginat menentukan pembentukan droplet alginat yang diteteskan ke dalam larutan CaCl2. Alginat dengan
konsentrasi rendah (0,5-1,0%) belum dapat menghasilkan droplet berbentuk bulat. Pada konsentrasi tersebut viskositas larutan kurang dari 20 cPs (Tabel 2). Mikrokapsul mulai berbentuk bulat ketika digunakan alginat dengan konsentrasi 1,5 dan 2%. Larutan alginat 1,5% memiliki viskositas 33,8 cPs, oleh karena itu, batas minimum pembentukan droplet inti mikrokapsul untuk menghasilkan mikrokapsul berbentuk bulat ialah 33,8 cPs. Hal ini sesuai dengan penelitian Goosen et al.
(1987) yang menyatakan bahwa batas minimum viskositas larutan alginat agar dapat membentuk mikrokapsul berbentuk bulat adalah 30 cPs. Pengukuran viskositas larutan kitosan ditentukan untuk mengetahui pengaruh kekentalan larutan kitosan terhadap stabilitas mekanik mikrokapsul. Penyalutan mikrokapsul dengan kitosan 2% memiliki kulit mikrokapsul yang lebih tebal sehingga dapat lebih tahan terhadap uji mekanik. Hal ini berbeda dengan mikrokapsul yang disalut kitosan dengan viskositas rendah cenderung lebih mudah rusak oleh pengadukan.
Kondisi Optimum Inti Mikrokapsul
Nilai viskositas larutan alginat
memengaruhi proses pembentukan
(PVA) (Wang et al. 2004). Akan tetapi glutaraldehida tidak dapat digunakan sebagai penaut silang dalam penelitian ini karena dapat mempengaruhi kondisi sel-sel Leydig yang disalut. Oleh karena itu, pada penelitian ini digunakan CaCl2 sebagai pengganti
glutarldehida karena lebih aman bagi sel. Menurut Friedli dan Schlager (2005) pembentukan ikatan pada membran kitosan-alginat relatif lama dan lemah sehingga dapat ditingkatkan kekuatan membrannya dengan penambahan larutan CaCl2. Ion Ca2+ dapat
berdifusi pada lapisan membran alginat sehingga menyebabkan terjadinya ikatan silang antara alginat-kitosan. Pertukaran ion Na+ dan Ca2+ menyebabkan terjadinya pembentukan gel seperti egg box sehingga terbentuklah jaringan inter rantai yang semakin rapat (Daniel et al. 2008). Alginat
merupakan polimer anionik karena
mengandung gugus COO- sehingga dapat berikatan dengan ion Ca2+. Ikatan silang menyebabkan terbentuknya gel alginat (Gambar 8).
Gambar 8 Reaksi tautan silang antara alginat dan CaCl2, = glukopiranosa
(Friedli & Schlager 2005).
Larutan alginat 0,5% memiliki viskositas yang paling rendah, yaitu sebesar 10,5 cPs dan tidak dapat digunakan dalam enkapsulasi karena droplet yang dihasilkan tidak memenuhi persyaratan untuk enkapsulasi, yaitu tidak dapat berbentuk bulat dan ukuran mikrokapsul yang dihasilkan besar, yaitu
sekitar 450 µm bahkan ada yang tidak dapat ditentukan diameternya karena bentuk
mikrokapsul yang tidak beraturan.
Mikrokapsul yang dibuat dengan konsentrasi alginat 1,5% dan 2,0% dapat berbentuk bulat dan berwarna putih transparan (Gambar 9).
Gambar 9 Bentuk mikrokapsul dengan konsentrasi alginat: a. 1,5%; b. 2,0%.
Konsentrasi CaCl2 memengaruhi lama
pengerasan gel alginat. Waktu yang dibutuhkan untuk gel mulai mengeras pun berbeda-beda. Waktu pengerasan berbanding lurus dengan konsentrasi CaCl2 yang
digunakan. Semakin tinggi konsentrasi CaCl2
maka waktu pengerasan gel akan semakin cepat. Waktu pengerasan gel alginat 0,5%, yaitu 2-25 menit (Lampiran 8). Semakin tinggi konsentrasi CaCl2 maka waktu droplet
alginat mengeras semakin cepat.
Konsentrasi CaCl2 tidak memengaruhi
bentuk dan ukuran mikrokapsul yang dihasilkan. Mikrokapsul yang dihasilkan berbentuk bulat dengan diameter berkisar
232-258 µm. Ukuran mikrokapsul yang dihasilkan telah memenuhi syarat untuk proses enkapsulasi sel Leydig, yaitu berkisar 200-400
µm (Stuiver 2001).
Gel terbentuk dalam waktu kurang dari satu menit. Gel yang dihasilkan mudah pecah karena bersifat lunak. Gel alginat didiamkan selama 15 menit dalam larutan CaCl2 agar
pembentukan ikatan silang berlangsung sempurna. Kation-kation yang dapat digunakan untuk membentuk ikatan silang dengan alginat antara lain Mg2+, Cu2+, Ba2+, Sr2+ dan Al3+. Kation dengan konsentrasi tinggi atau valensi tinggi dapat meningkatkan derajat ikatan silang dengan polimer anionik tetapi menurunkan kelarutan dalam larutan garam (Cohen et al 1992). Konsentrasi CaCl2
0,15 M adalah konsentrasi optimum dalam pembentukan mikrokapsul pada penelitian ini karena diperoleh mikrokapsul berbentuk bulat dan gel alginat mengeras dalam waktu singkat. Setelah gel alginat terbentuk sempurna maka dilakukan pencucian dengan akuades untuk menghilangkan larutan CaCl2
yang tidak terikat pada alginat. Konsentrasi alginat 1,5% merupakan konsentrasi minimum untuk membuat mikrokapsul berbentuk bulat. Oleh karena itu, alginat dengan konsentrasi 1,5% dapat digunakan dalam proses enkapsulasi sel Leydig.
kitosan
Uji Stabilitas Mekanik Mikrokapsul
Sifat stabilitas mekanik mikrokapsul merupakan salah satu aspek keberhasilan teknik enkapsulasi sel disamping sifat permeabilitas kapsul, perlindungan sistem imun, dan biocompatibility (Uludag 2000). Gel alginat yang dihasilkan dengan konsentrasi 1,5% (b/v) dan CaCl2 0,15 M
adalah mikrokapsul dengan bentuk dan ukuran yang optimum. Selanjutnya, mikrokapsul yang diperoleh dengan kondisi optimum tersebut disalut dengan penyalut kedua, yaitu larutan kitosan dalam ragam konsentrasi. Friedli dan Schlanger (2005) menyatakan bahwa alginat dan kitosan dapat berikatan secara spontan dalam waktu kurang dari 5 menit. Gel alginat pada penyalutan pertama akan berikatan dengan gugus amina yang terdapat pada kitosan. Menurut Dawolo (2005) interaksi yang dihasilkan dari alginat-kitosan merupakan ikatan silang dari kationik NH3+ yang berasal dari kitosan dan anionik
COO- yang berasal dari alginat. Penyalutan kedua dilakukan agar mikrokapsul yang dibentuk lebih kuat daripada disalut dengan penyalut tunggal. Berikut adalah ilustrasi ikatan yang terjadi antara alginat dan kitosan.
Gambar 10 Reaksi tautan silang antara alginat dan kitosan, = glukopiranosa (Friedli & Schlager 2005).
Pengujian stabilitas mekanik mikrokapsul penting, tidak hanya untuk menentukan daya tahan kapsul selama produksi atau perlakuan tetapi juga sebagai petunjuk integritas membran dari mikrokapsul yang dihasilkan (Uludag 2000). Ragam konsentrasi kitosan digunakan untuk melihat pengaruh kekuatan mikrokapsul yang dihasilkan. Kerusakan mikrokapsul diamati secara visual, pecahnya kapsul bergantung pada kekuatan membran, ketebalan kapsul, sifat inti kapsul seperti viskositas (Uludag 2000). Mikrokapsul yang disalut dengan kitosan konsentrasi rendah
akan mudah hancur karena akan membentuk lapisan pada gel alginat dengan ketebalan yang tipis. Selain itu, ketebalan penyalut
kedua juga memengaruhi kerusakan
mikrokapsul. Mikrokapsul menjadi keriput ketika dimasukkan ke dalam kitosan dengan konsentrasi tinggi (2%). Hal ini disebabkan oleh peristiwa osmosis dalam larutan tersebut. Konsentrasi larutan di luar mikrokapsul lebih tinggi sehingga air dalam mikrokapsul akan keluar menuju larutan kitosan dan mikrokapsul cenderung mengerut. Oleh karena itu, penyalutan dengan kitosan konsentrasi 0,5% paling baik untuk enkapsulasi sel-sel Leydig karena tidak akan memengaruhi keseimbangan osmolaritas sel.Semakin tinggi konsentrasi larutan kitosan maka ketahanan mikrokapsul akan semakin besar sehingga mikrokapsul lebih sulit hancur. Ketebalan mikrokapsul dengan konsentrasi kitosan rendah tidak menghasilkan kestabilan mekanik yang baik (Zhu et al. 2005).
Enkapsulasi Sel-Sel Leydig
Proses enkapsulasi sel-sel Leydig hasil kultur harus dilakukan secara steril (Gepp et al. 2009). Sel-sel Leydig diperoleh dari hasil isolasi testis tikus jantan Sprague Dawley. Konsentrasi sel dibuat bervariasi untuk melihat pengaruh konsentrasi sel terhadap kerapatan sel di dalam mikrokapsul. Osmolaritas larutan alginat yang digunakan dalam penelitian ini sebesar 300 mosmol/kg. Pengaturan osmolaritas larutan alginat dilakukan dengan cara melarutkan alginat dalam akuades kemudian ditambahkan garam NaCl. Hal ini dilakukan karena larutan alginat dalam pelarut akuades osmolaritasnya di bawah 300 mosmol/kg sedangkan alginat dalam buffer fosfat memiliki nilai osmolaritas di atas 300 mosmol/kg. Osmolaritas larutan alginat yang tidak sesuai dengan kondisi sel akan mengakibatkan sel rusak/mati. Sel dapat mengalami hemolisis maupun krenasi bila osmolaritas lingkungan tidak sama dengan osmolaritas sel sehingga dapat mengakibatkan kerusakan pada sel.
Larutan alginat dan larutan sel-sel Leydig bercampur secara homogen. Penetesan campuran alginat-sel ke dalam larutan CaCl2
mengakibatkan pembentukan droplet
mikrokapsul sel Leydig dalam alginat. Alginat berikatan dengan CaCl2 sehingga terbentuk gel
alginat. Penetesan larutan alginat-sel ke dalam CaCl2 menghasilkan droplet yang berbentuk
bulat dan berwarna putih. Sel Leydig dapat terperangkap ke dalam gel alginat dan tidak
berada di luar inti mikrokapsul. Hal ini ditunjukkan dengan tidak adanya sel-sel Leydig yang berada di larutan CaCl2
Kerapatan sel di dalam inti mikrokapsul berbeda-beda setiap ragam konsentrasi sel-sel Leydig. Mikrokapsul yang dibuat dengan konsentrasi sel 1×107 sel/mL memiliki kerapatan sel dalam mikrokapsul yang paling tinggi, hampir semua bagian mikrokapsul tertutupi oleh sel sedangkan mikrokapsul yang berisi konsentrasi sel sebesar 1×104 sel/mL memiliki kerapatan sel yang paling renggang (Lampiran 11).
Ikatan yang terjadi antara alginat dan CaCl2 mengakibatkan bagian permukaan gel
alginat-CaCl2 mengeras. Oleh karena itu,
pencucian mikrokapsul dengan buffer sitrat atau EDTA dapat melepaskan ikatan antara alginat dan CaCl2 sehingga terjadi pencairan
kembali gel alginat (Cohen et al. 1992). CaCl2
sensitif pada larutan buffer sitrat sehingga dapat mengakibatkan pelepasan ikatan alginat-CaCl2 dan larutan buffer dapat
memasuki rongga mikrokapsul. Sel-sel Leydig berada dalam lingkungan buffer sehingga transfer nutrisi, oksigen, dan hasil metabolisme sel dapat keluar masuk mikrokapsul. Diameter mikrokapsul yang dihasilkan berkisar 230-270 µm.Mikrokapsul berdiameter kecil menghasilkan jumlah sel yang terperangkap di dalam mikrokapsul juga sedikit. Selain dipengaruhi oleh diameter mikrokapsul, kerapatan sel yang terperangkap juga dipengaruhi oleh konsentrasi sel yang disalut. Semakin tinggi konsentrasi sel maka semakin tinggi kerapatan sel-sel Leydig di dalam mikrokapsul.
SIMPULAN DAN SARAN
Simpulan
Konsentrasi minimal alginat untuk pembentukan mikrokapsul sebagai inti mikrokapsul adalah 1,5% (b/v), yaitu dengan viskositas di atas 30 cPs dan konsentrasi CaCl2 0,15 M. Inti mikrokapsul yang
dihasilkan berbentuk bulat, berwarna putih, dan berdiameter 230-370 µm. Kestabilan mikrokapsul dengan dua penyalut semakin tinggi dengan bertambahnya konsentrasi kitosan. Enkapsulasi dapat diaplikasikan pada sel, yaitu sel-sel Leydig. Sel-sel Leydig yang terkapsul berada di dalam mikrokapsul secara menyebar. Kerapatan sel yang terperangkap di dalam sel sebanding dengan konsentrasi sel yang digunakan.
Saran
Perlu dilakukan tahap pemurnian bahan penyalut, terutama alginat sebelum digunakan untuk enkapsulasi. Perlu juga dilakukan pengujian efisiensi sel-sel Leydig, penentuan viabilitas sel-sel Leydig yang telah terenkapsulasi, pengujian hasil enkapsulasi secara in vivo serta melakukan analisis morfologi mikrokapsul alginat-kitosan menggunakan mikroskop elektron payaran (SEM).
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 1999. Official Methods of AOAC International. Revisi ke-5. Volume ke-2. Maryland: AOAC International.
Arianto BD. 2010. Perilaku disolusi mikrokapsul ketoprofen tersalut gel kitosan-alginat berdasarkan ragam konsentrasi tween 80 [skripsi]. Bogor:
Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Pertanian Bogor.
Beneta S. 1996. Microcapsulation Method and Industrial Application. New York: Marcel Dekker.
Chemes H, Cigorraga S, Begadá C, Schteingart H, Rey R, Pellizzari E. 1992. Isolation of human Leydig cell mesenchymal precursors from patient with the androgen insensitivity syndrome: testosterone production and reaponse to human chorionic gonadotropin stimulation in culture. Biology of Reproduction
46:793-801.
Cohen S, Bano C, Visscher KB, Chow M, Allcock HR, Langer RS. 1992, penemu; Massachusetts Institute of Technology. 22 Sep 1992. Ionically cross-linked polymeric microcapsule. US Patent 5.149.543.
Daniel, Kaban J, Linasari V. 2008. Interaksi kalsium alginat dengan etanolamin dalam
pembuatan membran. J Kimia
Mulawarman 5(2):14-19.
Friedli AC, Schlager IR. 2005. Demonstrating encapsulation and release: a new take on alginate complexation and the nylon rope trick. J Chem Educ 82: 1017-1020.
Gepp MM, Ehrhart F, Shirley SG, Howitz S, Zimmermann H. 2009. Dispensing of very low volumes of ultra high viscosity alginate gels: a new tool for encapsulation of adherent cells and rapid prototyping of scaffolds and implants. BioTechniques
46:31-43.
Goosen MFA, O’Shea GM, Sun MF, penemu; Connaught Laboratories. 25 Agu 1987. Microencapsulation of living tissue and cells. US Patent 4.689.293.
Gruenewald DA, Matsumoto AM. 2003. Testosterone supplementation therapy for older men: potential benefit and risks. J of the American Geriatics Society 51: 101-115.
Herdini, Darusman LK, Sugita P. 2010. Disolusi mikroenkapsulasi kurkumin tersalut gel kitosan-alginat-glutaraldehida.
Makara 14: 57-62
Khan TA, Kok KP, Hung SC. 2002. Reporting degree of deacetylation value of chitosan: the influence of analytical methods. J Pharm Pharmeceut Sci 5:205-212.
Mandal S, Puniya AK, Singh K. 2006. Effect of alginate concentrations on survival of microencapsulated Lactobacillus casei NCDC-298. International Dairy J
16:1190–1195.
Nguyen VT, Kurebayashi S, Harayama H, Nagai T, Miyake M. 2003. Stage spesific effects of the osmolarity of a culture
medium on the development of
parthenogenetic diploids in pig.
Theriogenology 59: 719-734.
Patria A. 2007. Pengaruh waktu fermentasi dan lama pengeringan terhadap mutu tepung cokelat (Theobroma cocoa L.) [skripsi]. Banda Aceh: Fakultas Pertanian, Universitas Syah Kuala.
Rasyid A. 2003. Algae cokelat (phaeophyta) sebagai sumber alginat. Oseana 28(1):33-38.
Rhoden EL, Morgentaler A. 2004. Risks of testosterone-replacement therapy and
recommendations for monitoring. The New England J Medicine 350:482- 492.
Sæther HV, Hilde K. Holme HK, Maurstad G,
Smidsrød O, Stokke BT. 2008.
Polyelectrolyte complex formation using alginate and chitosan. Carbohydrate Polymers 74:813–821.
Silva CM, Riberio AJ, Figueiredo M, Ferreira D, Veiga F. 2006. Microencapsulation of hemoglobin in chitosan-coated alginate
microspheres prepared by
emulsification/internal gelation. AAPS J
7:E903-E912.
Stuiver I. 2001. Microencapsulation of islet for the treatment of type 1 diabetes.
Workshop encapsulation and immunoprotective strategies of islet cells proceeding; Washington DC, 6-7 Des 2001.
Sugita P, Napthaleni, Kurniati M, Wukirsari T. 2010. Enkapsulasi ketoprofen dengan kitosan-alginat berdasarkan jenis dan ragam konsentrasi tween 80 dan span 80.
Makara 14(2):107-112.
Teramura Y, Iwata H. 2009. Islet encapsulation with living cells for improvement of biocompatibility.
Biomaterials 30:2270–2275.
Uludag H, DeVos P, Tresco PA. 2000.
Technology of mammalian cell
encapsulation. Advance Drug Delivery
42:29-64.
Wang T, Turhan M, Gunasekaram S. 2004. Selected properties of pH-sensitive, biodegradable chitosan-poly(vinyl alcohol) hydrogel. Society of Chemical Industry.
Polym Int 53:911-918.
Winarno FG. 1997. Kimia Pangan dan Gizi. Jakarta: Gramedia.
Wukirsari T. 2006. Enkapsulasi ibuprofen dengan penyalut alginat-kitosan [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Larutan alginat konsentrasi 0,5; 1,0; 1,5; 2,0% (b/v) Lampiran 1 Diagram alir penelitian
1.Pencirian sifat bahan penyalut
2.Optimisasi pembentukkan mikrokapsul
Bahan penyalut (alginat dankitosan)
kadar air, kadar abu, osmolaritas, dan viskositas
diteteskan
Larutan CaCl2 konsentrasi 0,05; 0,1; 0,15; 0,2 M
Mikrokapsul optimum Bentuk, ukuran, dan
waktu pengerasan
Larutan kitosan konsentrasi 0,5; 1,0; 1,5; 2,0% (b/v)
Uji stabilitas mekanik dengan 500 rpm
3.Enkapsulasi sel-sel Leydig
Alginat 1,5% (b/v) + sel-sel Leydig ( 1×104, 1×105, 1×106, 1×107 sel/mL)
diteteskan
Larutan CaCl2 0,15 M
Gel alginat-CaCl2
Penyalutan kedua dengan kitosan
Pencucian mikrokapsul
Lampiran 2 Penentuan kadar air bahan penyalut
Bahan
penyalut Ulangan
Bobot (g) Kadar air (%)
Cawan
kosong Sampel
Sampel + cawan
Sampel
kering Rerata
Alginat
1 1,9389 3,0011 4,6507 2,7118 9,64
9,74
2 1,9254 3,0005 4,6363 2,7109 9,65
3 1,9316 3,0042 4,6378 2,7062 9,92
Kitosan
1 1,9478 3,0006 4,5306 2,5828 13,92
13,85
2 1,9333 3,0015 4,5191 2,5858 13,85
3 1,9373 3,0009 4,5250 2,5877 13,77
Contoh Perhitungan:
Alginat pada ulangan 1:
Bobot sampel kering = (bobot sampel+cawan)−bobot cawan kosong = 4,6507−1,9389
= 2,7118
Kadar air (%) = 100% A
B A
=
0011 , 3
7118 , 2 0011 ,
3 × 100% = 9,64%
Keterangan:
A = bobot sampel awal (g)
B = bobot sampel kering (g)
Rerata kadar air (%) =
3 n
i
n
Xi
=3
92 , 9 65 , 9 64 ,
Lampiran 3 Penentuan kadar abu bahan penyalut
Bahan
penyalut Ulangan
Bobot (g) Kadar abu (%)
Cawan kosong
Sampel kering
Sampel +
cawan Abu Rerata
Alginat
1 36,4211 0,5003 36,7036 0,2825 56,47
56,71
2 34,1643 0,5001 34,4477 0,2834 56,67
3 31,0505 0,5007 31,3358 0,2853 56,98
Kitosan
1 33,2676 0,5016 33,2678 0,0002 0,04
0,03
2 31,8951 0,5020 31,8952 0,0001 0,02
3 27,8722 0,5015 27,8723 0,0001 0,02
Contoh perhitungan:
Alginat pada ulangan 1:
Kadar abu (%) =
B
A
× 100%
Keterangan :
A = bobot abu (g)
B = bobot sampel awal(g)
Kadar abu (%) =
5003 , 0
0,2825× 100% = 56,47%
Rerata kadar abu (%) =
3 n
i
n
Xi
=3
98 , 56 67 , 56 47 ,
Lampiran 4 Penentuan osmolaritas larutan
Larutan Konsentrasi mosmol/kg
CaCl2 (M)
0,050 75
0,100 135
0,150 204
0,200 249
Alginat (%) b/v dalam akuades
0,5 78
1,0 141
1,5 147
2,0 240
Alginat (%) b/v dalam buffer
0,5 357
1,0 504
1,5 534
2,0 618
Kitosan (%) b/v
0,5 33
1,0 72
1,5 90
Lampiran 5 Penentuan viskositas bahan penyalut
Larutan Konsentrasi (%) b/v
Ulangan Rerata
(cPs)
1 2 3 4 5
Alginat
0,5 10,5 10,5 10,3 10,7 10,5 10,5
1,0 17,6 17,6 17,7 17,6 17,5 17,6
1,5 33,9 33,7 33,7 33,8 33,9 33,8
2,0 52,1 52,1 52,1 52 52,2 52,1
Kitosan
0,5 8,8 8,7 8,7 8,8 8,8 8,76
1,0 13,7 13,7 13,9 13,6 13,7 13,72
1,5 24,7 24,9 24,7 24,8 24,7 24,76
2,0 43,3 43,4 43,4 43,5 43,3 43,38
Contoh Perhitungan:
Alginat 1,0% :
Rerata (cPs) =
5 n
i
n
Xi
=5
5 , 17 6 , 17 7 , 17 6 , 17 6 ,
Lampiran 6 Pengaruh konsentrasi alginat pada pembentukan mikrokapsul
[Alginat]
% (b/v) Ulangan
[CaCl2] M
0,05 0,1 0,15 0,2
0,5
1 TB TB TB TB
2 TB TB TB TB
3 TB TB TB TB
4 TB TB TB TB
5 TB TB TB TB
6 TB TB TB TB
7 TB TB TB TB
8 TB TB TB TB
9 TB TB TB TB
10 TB TB TB TB
1,0
1 TB TB TB TB
2 TB BB L TB
3 TB BB L TB
4 TB L BB TB
5 TB L B TB
6 TB TB TB TB
7 TB TB TB TB
8 TB L TB TB
9 BB L BB TB
10 BB TB TB TB
1,5
1 B B B B
2 B B B B
3 L B B B
4 B B B B
5 B B B B
6 B B B B
7 L L B B
8 B L B B
9 B B B B
10 B B B B
2,0
1 B B B B
2 B B B B
3 B B L B
4 B L B B
5 B B B B
6 B L B B
7 B B L B
8 B B B B
9 B B B B
10 L B B B
Lampiran 7 Pengaruh konsentrasi alginat dengan ragam konsentrasi CaCl2 terhadap
ukuran mikrokapsul*
[Alginat]
% (b/v) Ulangan
[CaCl2] M
0,05 0,1 0,15 0,2
0,5
1 TI TI TI 450
2 TI TI TI 468
3 TI TI TI 412
4 TI TI TI 450
5 TI TI TI 487
6 TI TI TI TI
7 TI TI TI TI
8 TI TI TI TI
9 TI TI TI TI
10 TI TI TI TI
Rerata TI TI TI 453,40
1,0
1 255,00 283,13 210,00 240,00
2 255,00 262,50 262,50 255,00
3 258,75 281,25 270,00 255,00
4 255,00 262,50 258,00 281,25
5 258,75 266,25 206,25 266,25
6 TI 255,00 345,00 255,00
7 TI 262,50 206,25 247,50
8 TI 281,25 220,00 281,25
9 TI 300,00 270,00 266,00
10 TI 273,75 270,00 281,25
Rerata TI 322,13 310,35 310,50
1,5
1 247,50 232,50 255,00 225,00
2 255,00 236,25 236,25 236,25
3 262,50 232,50 247,50 243,75
4 243,75 217,50 243,75 225,00
5 262,50 240,00 232,50 225,00
6 251,25 217,50 240,00 240,00
7 281,25 240,00 232,50 232,50
8 255,00 240,00 247,50 243,75
9 251,25 240,00 240,00 240,00
10 270,00 232,50 240,00 232,50
Rerata 258,00 232,88 241,50 234,38
*Ukuran mikrokapsul dalam µm.
Lampiran 7 Pengaruh konsentrasi alginat dengan ragam konsentrasi CaCl2 terhadap ukuran
mikrokapsul*
[Alginat]
% (b/v) Ulangan
[CaCl2] M
0,05 M 0,1 M 0,15 M 0,2 M
2,0
1 225,00 217,50 236,25 187,50
2 232,50 255,00 225,00 189,00
3 236,25 213,75 213,75 264,00
4 240,00 232,50 236,25 213,75
5 240,00 206,25 202,50 225,00
6 243,75 213,75 213,75 168,75
7 251,25 221,25 202,50 195,00
8 255,00 232,50 198,75 202,50
9 221,25 228,75 225,00 187,50
10 255,00 236,25 225,00 225,00
Rerata 240,00 225,75 217,88 205,80
Lampiran 8 Waktu pengerasan gel alginat pada ragam konsentrasi alginat dan CaCl2
[Alginat]
% (b/v) Ulangan
[CaCl2] M
0,05 0,1 0,15 0,2
0,5
1 1440* 240 180 137
2 1535 252 192 152
3 1500 260 201 160
4 1560 267 222 165
5 1560 300 230 167
Rerata 1519 263,8 205 156,2
1,0
1 150 35 30 20
2 162 37 32 23
3 165 40 35 24
4 168 44 36 27
5 180 48 38 30
Rerata 165 40,8 34,2 24,8
1,5
1 23 20 11 4
2 25 21 13 5
3 27 22 14 5
4 30 25 17 7
5 34 26 18 7
Rerata 27,8 22,8 14,6 5,6
2,0
1 32 21 10 6
2 33 22 12 7
3 33 24 12 8
4 35 25 13 8
5 36 27 15 9
Rerata 33,8 23,8 12,4 7,6
Lampiran 9 Uji stabilitas mekanik mikrokapsul
[Kitosan]
% (b/v) Ulangan
Waktu pengadukan (jam)
1 2 3 4 5 6
x % x % x % x % x % x %
0,5
1 17 32 15 40 13 48 9 64 9 64
2 18 28 15 40 13 48 11 56 11 56
3 17 32 15 40 14 44 11 56 10 60
Rerata 30,67 40 46,67 58,67 60
1,0
1 19 24 17 32 14 44 10 60 9 64
2 16 36 15 40 14 44 8 68 8 68
3 18 28 15 40 15 40 9 64 9 64
Rerata 29,33 37,33 42,67 64 65,33
1,5
1 23 8 20 20 15 40 13 48 10 60 8 68
2 24 4 20 20 16 36 13 48 12 52 8 64
3 24 4 17 32 15 40 13 48 11 56 9 64
Rerata 5,33 24 38,67 48 56 65,33
2,0
1 25 0 25 0 24 4 24 4 24 4 24 4
2 25 0 25 0 23 8 23 8 23 8 23 8
3 25 0 24 4 22 12 22 12 21 16 21 16
Lampiran 9 Uji stabilitas mekanik mikrokapsul
[Kitosan]
% (b/v) Ulangan
Waktu pengadukan (jam)
7 8 9 10 11 12 13
x % x % x % x % x % x % x %
2,0
1 22 12 22 12 18 28 15 40 12 52 10 60 9 64
2 22 12 21 16 18 28 14 44 12 52 12 52 9 64
3 20 20 20 20 17 32 16 36 13 48 10 60 8 68
Rerata 14,67 16 29,33 40 50,67 57,33 65,33
Keterangan:
x = jumlah mikrokapsul yang utuh % = kerusakan mikrokapsul
Contoh perhitungan:
Pada kitosan 0,5%
Kerusakan % =
=
25
17
25
× 100%
= 32%
× 100% Jumlah kapsul rusak
Lampiran 10 Diameter mikrokapsul dengan ragam konsentrasi sel Leydig
[Sel Leydig] sel/mL
Ulangan Rerata
(µm)
1 2 3 4 5
1×104 240,00 254,00 264,75 286,50 276,75 264,40
1×105 232,75 225,00 236,25 243,75 248,50 237,25
1×106 286,25 269,75 232,50 236,25 232,50 251,45
1×107 225,00 254,75 240,00 232,50 242,25 238,90
Contoh perhitungan:
Konsentrasi sel-sel Leydig 1×104 sel/mL
Rerata (µm) =
5 n
i
n
Xi
=5
75 , 276 5 , 286 75 , 264 254
Lampiran 11 Pembentukan mikrokapsul dengan ragam konsentrasi sel-sel Leydig
ABSTRAK
DEVI RAHAYU. Optimisasi Pembentukan Mikrokapsul dengan Penyalut
Alginat-Kitosan untuk Enkapsulasi Sel-Sel Leydig. Dibimbing oleh IRMANIDA
BATUBARA dan KUSDIANTORO MOHAMAD.
Hipogonadisme adalah kondisi klinik yang ditandai dengan rendahnya
konsentrasi hormon testosteron. Hipogonadisme disebabkan oleh fungsi sel
Leydig sebagai penghasil testosteron yang tidak mencukupi. Metode enkapsulasi
akan melindungi sel yang akan ditransplantasikan sehingga dapat mencegah
terjadinya penolakan oleh sistem kekebalan tubuh. Penelitian ini bertujuan
mengoptimisasi pembentukan mikrokapsul untuk mengenkapsulasi sel Leydig.
Mikrokapsul dibuat menggunakan alginat sebagai penyalut pertama dan kitosan
sebagai penyalut kedua. Konsentrasi minimum larutan alginat untuk membuat
kapsul berbentuk bulat, yaitu 1,5% (b/v) dengan viskositas 33,8 cPs yang
menghasilkan mikrokapsul dengan diameter berkisar 230-270
µm.
Kondisi
optimum penyalut kedua, kitosan, adalah 0,5% (b/v) yang menghasilkan
mikrokapsul berbentuk bulat dengan memiliki stabilitas mekanik sampai 4 jam.
Sel-sel Leydig dapat terperangkap di dalam kapsul dengan kerapatan berbanding
lurus dengan konsentrasi sel yang digunakan dalam enkapsulasi.
ABSTRACT
DEVI RAHAYU. Optimization of Alginate-Chitosan Microcapsules Formation
for Leydig Cells Encapsulation. Supervised by IRMANIDA BATUBARA and
KUSDIANTORO MOHAMAD.
Hypogonadism is a clinical condition characterized by low concentrations of
testosterone. It is caused by malfunction of Leydig cells in producing testosterone.
Encapsulation method will protect the transplanted cells from the immune system
rejection. The aims of this study was to optimize the formation of microcapsules
for Leydig cells encapsulation. The microcapsules were made of alginate and
chitosan as the first and the second coating agents, respectively. The result
showed that the minimum concentration of alginate was 1.5% (w/v) with a
viscosity of 33.8 cPs, resulted spherical microcapsules with diameters of 230-270
PENDAHULUAN
Hipogonadisme adalah kondisi klinis yang ditandai dengan rendahnya konsentrasi
hormon testosteron. Hipogonadisme
disebabkan oleh fungsi sel Leydig sebagai penghasil testosteron yang tidak mencukupi (Rhoden dan Morgentaler 2004). Gejala klinis yang ditimbulkan akibat hipogonadisme antara lain atropi dan kelemahan otot, osteoporosis, menurunnya densitas tulang, fungsi seksual, dan meningkatnya massa lemak serta gejala lain yang sama pada usia muda (Gruenewald dan Matsumoto 2003). Pengobatan yang selama ini digunakan adalah dengan terapi pemberian hormon sintetis. Namun demikian, terapi dengan hormon sintetis ini dalam jangka panjang dapat menimbulkan risiko, yaitu ischemia arteri koroner (penyakit jantung koroner) (Gruenewald dan Matsumoto 2003), fluid retention, kanker prostat, hepatotoxicity, dan
sleep apnee (Rhoden dan Morgentaler 2004). Oleh karena itu, metode lain sebagai alternatif pengobatan diperlukan untuk mengurangi risiko yang dapat berdampak buruk pada kesehatan.
Salah satu cara untuk mengatasi kelemahan tersebut ialah dengan cara terapi sel menggunakan transplantasi sel-sel Leydig, sel penghasil hormon testosteron. Akan tetapi, transplantasi sel memiliki kendala penolakan oleh sistem kekebalan tubuh. Salah satu cara mengatasi penolakan ini adalah dengan enkapsulasi sel dengan suatu penyalut, yang memungkinkan difusi nutrisi dan metabolit keluar masuk mikrokapsul tetapi menghalangi sistem kekebalan mencapai sel.
Mikrokapsul merupakan partikel kecil yang berisi senyawa aktif atau bahan inti yang dibungkus oleh suatu lapisan atau cangkang (Beneta 1996). Enkapsulasi dibedakan menjadi dua, yaitu makroenkapsulasi dan mikroenkapsulasi. Kedua proses dibedakan berdasarkan ukuran kapsul yang dihasilkan (Uludag et al. 2000). Proses enkapsulasi yang dilakukan pada penelitian ini menggunakan bahan penyalut alginat dan kitosan. Alginat adalah polisakarida anionik yang diperoleh dari ekstraksi alga cokelat (Macrocytis pyrifera) dan merupakan kopolimer yang
terdiri atas residu asam β(1,4)-D-manuronat
(M) dan asam α(1,4)-L-guluronat (G) (Sæther
[image:36.595.326.507.87.179.2]et al. 2008) (Gambar 1). Alginat telah banyak digunakan dalam proses enkapsulasi karena sifatnya yang biokompatibel dan murah (Friedli & Schlager 2005).
Gambar 1 Struktur Na-alginat.
Kitosan merupakan biopolimer
polikationik yang tersusun dari unit berulang 2-amino-2-deoksi-D-glukopiranosa yang
terhubung oleh ikatan β-(1,4) (Gambar 2). Kitosan bersifat alami, biodegradabel, biokompatibel, dan tidak beracun bagi tubuh. Polimer terdiri dari polimer yang bersifat kationik dan anionik. Kitosan merupakan polimer bermuatan positif sehingga dapat membentuk ikatan silang dengan polimer anionik, yaitu polimer yang bermuatan negatif diantaranya adalah alginat, karagenan, dan karboksimetil selulosa. Penggunaan sistem penyalut berganda alginat kitosan dapat mengurangi porositas dan meningkatkan kestabilan kapsul yang dihasilkan (Silva et al.
2006).
Gambar 2 Struktur kitosan.
Beberapa penelitian tentang enkapsulasi pernah dilakukan dengan menggunakan bahan penyalut alginat-kitosan terhadap bahan aktif seperti ibuprofen (Wukirsari 2006), ketoprofen (Sugita et al. 2010; Arianto 2010), kurkumin (Herdini et al. 2010) sedangkan untuk materi biologis pernah dilakukan enkapsulasi terhadap hemoglobin (Silva et al.
[image:36.595.326.509.423.515.2]Metode enkapsulasi yang pernah dilakukan oleh Sugita et al. 2010, Arianto (2010), dan Herdini et al. (2010) tidak dapat digunakan untuk enkapsulasi sel karena pada penelitian tersebut menggunakan alat penyemprot kering (spray drying) sehingga dapat mengakibatkan kerusakan pada sel. Oleh karena itu, penelitian ini menggunakan teknik pembentukan droplet gel alginat-CaCl2
dengan metode ekstruksi, yaitu dengan penetesan langsung larutan alginat ke dalam larutan CaCl2 sehingga terbentuk gel alginat
kemudian disalut menggunakan larutan kitosan. Penelitian ini bertujuan melakukan optimisasi pembentukan mikrokapsul alginat dengan ragam konsentrasi alginat dan CaCl2,
menguji stabilitas mekanik mikrokapsul alginat-kitosan dengan ragam konsentrasi kitosan, dan enkapsulasi sel-sel Leydig dengan ragam konsentrasi sel.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah alginat (Sigma Aldrich), kitosan niaga dari Bratachem dengan derajat asetilasi dan bobot molekul berturut-turut 73,76% dan ± 3,7×105 g/mol, sel-sel Leydig hasil isolasi dari jaringan testis tikus jantan Sprague Dawley. Alat-alat yang digunakan adalah viskometer Brookfield, osmometer krioskopik, sentrifuse swing rotor, biological safety cabinet, dan mikroskop cahaya.
Lingkup Kerja
Penelitian ini terbagi menjadi tiga tahapan (Lampiran 1). Tahap pertama adalah pencirian sifat bahan penyalut (alginat dan kitosan) meliputi penentuan kadar air, kadar abu, osmolaritas, dan viskositas dari berbagai larutan yang digunakan dalam penelitian. Tahap kedua adalah penentuan optimisasi pembentukkan mikrokapsul gel alginat dengan ragam konsentrasi alginat dan CaCl2
serta pengujian stabilitas mekanik mikrokapsul dengan ragam konsentrasi kitosan sebagai penyalut kedua. Tahap ketiga adalah aplikasi enkapsulasi sel-sel Leydig dengan ragam konsentrasi sel dengan penyalut alginat-kitosan.
Penentuan Kadar Air
Penentuan kadar air dilakukan
menggunakan metode standar AOAC (1999). Cawan porselen dikeringkan pada suhu 105 °C selama 30 menit kemudian didinginkan dalam desikator dan ditimbang. Sebanyak 3 g bahan penyalut (alginat dan kitosan) dimasukkan ke dalam cawan lalu dimasukkan ke dalam oven pada suhu 105 °C selama 3 jam kemudian didinginkan dalam desikator dan ditimbang. Prosedur ini dilakukan hingga diperoleh bobot yang tetap.
Kadar air (%) =
100
%
A
B
A
Keterangan:
A = bobot contoh awal (g)
B = bobot contoh kering (g)
Penentuan Kadar Abu
Penentuan kadar abu bahan penyalut dilakukan menggunakan metode standar AOAC (1999). Cawan porselen yang bersih dan kering dipanaskan di dalam tanur untuk menghilangkan sisa-sisa kotoran yang menempel di cawan. Setelah didinginkan dalam desikator, cawan ditimbang. Sebanyak 0,5 g bahan penyalut dimasukkan ke dalam cawan tersebut dan dipanaskan sampai tidak berasap kemudian dibakar dalam tanur pada suhu 600 °C sampai diperoleh abu. Cawan berisi abu didinginkan dalam desikator dan ditimbang.
Kadar abu (%) =
100
%
A
B
Keterangan:
A = bobot contoh awal (g)
B = bobot abu (g)
Pengukuran Osmolaritas dan Viskositas
Larutan alginat dibuat dengan ragam konsentrasi 0,5; 1,0; 1,5; 2,0 % (b/v) dalam akuades dan buffer fosfat salin. Larutan kitosan dibuat dengan ragam konsentrasi 0,5; 1,0; 1,5; 2,0 % (b/v) dalam pelarut CH3COOH