ABSTRACT
INNES MAULIDYA. B04080117. Characteristics of Raw Semen, Sperm Morphology, and Plasma Membrane Integrity Test of Lop and Rex Rabbits. Directed by Prof. Dr. Dra. R. Iis Arifiantini, MSi.
The study was conducted to investigate the quality of semen between Lop and Rex breed. Semen samples was collected by using artificial vagina and evaluated macro and microscopically. The evaluation included semen volume, pH, consistency, color, mass movement, motility, individual scores, concentration, and viability. The sperm morphology was examination using carbofuchsin eosin staining and the plasma membran integrity was determine using Hypo-Osmotic Swelling test (HOS test). Hypo-Osmotic solution was modified by mixing fructose and sodium citrate into three different osmotic pressure: 50, 100, and 150 mOsm/kg. All data were analyzed statistically using analysis of variance (ANOVA), whereas the data from HOS test were analyzed using completely randomized design (CRD) with three factor patterns. The result showed that mass movement, motility, and individual scores of Rex’s sperm was superior compare than Lop’s, but there were no difference in other parameters. The respons of plasma membrane integrity showed that Rex’s sperm was faster (15 minute) compare than Lop’s (30 minute). This fact may relate to the composition structure of the plasma membrane and seminal plasma.
RINGKASAN
INNES MAULIDYA. B04080117. Karakteristik Semen Segar, Morfologi, dan Pengujian Keutuhan Membran Plasma Spermatozoa Kelinci Lop dan Rex. Dibimbing oleh oleh Prof. Dr. Dra. R. Iis Arifiantini, MSi.
Penelitian dilakukan untuk mempelajari kualitas semen dari kelinci Lop dan Rex. Sampel semen dikoleksi menggunakan vagina buatan, semen lalu dievaluasi secara makroskopis dan mikroskopis. Evaluasi yang dilakukan meliputi pemeriksaan volume semen, pH, konsistensi, warna semen, gerakan massa, motilitas, skor individu, konsentrasi, dan viabilitas. Morfologi spermatozoa diwarnai menggunakan pewarnaan Williams dan keutuhan membran plasma spermatozoa diuji dengan Hypo-Osmotic Swelling test (HOS test). Larutan hipoosmotik yang digunakan merupakan campuran Fruktosa dan Natrium sitrat bertekanan osmotik 50, 100, dan 150 mOsm/kg. Data yang diperoleh dianalisis secara statistik menggunakan ANOVA, sedangkan data HOS test dianalisis menggunakan rancangan acak lengkap (RAL) dengan pola tiga faktor. Hasil penelitian menunjukkan bahwa gerakan massa, motilitas, dan skor individu spermatozoa kelinci Rex berbeda (P<0.05) dengan kelinci Lop, tetapi tidak berbeda (P>0.05) untuk parameter lainnya. Pada pengujian membran plasma utuh (MPU), spermatozoa kelinci Rex berespon (coil) 15 menit lebih cepat dibandingkan kelinci Lop. Hal ini kemungkinan berhubungan dengan komposisi struktur membran plasma dan plasma semen.
KARAKTERISTIK SEMEN SEGAR, MORFOLOGI, DAN
PENGUJIAN KEUTUHAN MEMBRAN PLASMA
SPERMATOZOA KELINCI LOP DAN REX
INNES MAULIDYA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul Karakteristik Semen Segar, Morfologi, dan Keutuhan Membran Plasma Spermatozoa Kelinci Lop dan Rex adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal dan dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, September 2012
Innes Maulidya
ABSTRACT
INNES MAULIDYA. B04080117. Characteristics of Raw Semen, Sperm Morphology, and Plasma Membrane Integrity Test of Lop and Rex Rabbits. Directed by Prof. Dr. Dra. R. Iis Arifiantini, MSi.
The study was conducted to investigate the quality of semen between Lop and Rex breed. Semen samples was collected by using artificial vagina and evaluated macro and microscopically. The evaluation included semen volume, pH, consistency, color, mass movement, motility, individual scores, concentration, and viability. The sperm morphology was examination using carbofuchsin eosin staining and the plasma membran integrity was determine using Hypo-Osmotic Swelling test (HOS test). Hypo-Osmotic solution was modified by mixing fructose and sodium citrate into three different osmotic pressure: 50, 100, and 150 mOsm/kg. All data were analyzed statistically using analysis of variance (ANOVA), whereas the data from HOS test were analyzed using completely randomized design (CRD) with three factor patterns. The result showed that mass movement, motility, and individual scores of Rex’s sperm was superior compare than Lop’s, but there were no difference in other parameters. The respons of plasma membrane integrity showed that Rex’s sperm was faster (15 minute) compare than Lop’s (30 minute). This fact may relate to the composition structure of the plasma membrane and seminal plasma.
RINGKASAN
INNES MAULIDYA. B04080117. Karakteristik Semen Segar, Morfologi, dan Pengujian Keutuhan Membran Plasma Spermatozoa Kelinci Lop dan Rex. Dibimbing oleh oleh Prof. Dr. Dra. R. Iis Arifiantini, MSi.
Penelitian dilakukan untuk mempelajari kualitas semen dari kelinci Lop dan Rex. Sampel semen dikoleksi menggunakan vagina buatan, semen lalu dievaluasi secara makroskopis dan mikroskopis. Evaluasi yang dilakukan meliputi pemeriksaan volume semen, pH, konsistensi, warna semen, gerakan massa, motilitas, skor individu, konsentrasi, dan viabilitas. Morfologi spermatozoa diwarnai menggunakan pewarnaan Williams dan keutuhan membran plasma spermatozoa diuji dengan Hypo-Osmotic Swelling test (HOS test). Larutan hipoosmotik yang digunakan merupakan campuran Fruktosa dan Natrium sitrat bertekanan osmotik 50, 100, dan 150 mOsm/kg. Data yang diperoleh dianalisis secara statistik menggunakan ANOVA, sedangkan data HOS test dianalisis menggunakan rancangan acak lengkap (RAL) dengan pola tiga faktor. Hasil penelitian menunjukkan bahwa gerakan massa, motilitas, dan skor individu spermatozoa kelinci Rex berbeda (P<0.05) dengan kelinci Lop, tetapi tidak berbeda (P>0.05) untuk parameter lainnya. Pada pengujian membran plasma utuh (MPU), spermatozoa kelinci Rex berespon (coil) 15 menit lebih cepat dibandingkan kelinci Lop. Hal ini kemungkinan berhubungan dengan komposisi struktur membran plasma dan plasma semen.
©
Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
KARAKTERISTIK SEMEN SEGAR, MORFOLOGI, DAN
PENGUJIAN KEUTUHAN MEMBRAN PLASMA
SPERMATOZOA KELINCI LOP DAN REX
INNES MAULIDYA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Karakteristik Semen Segar, Morfologi, dan Pengujian Keutuhan Membran Plasma Spermatozoa Kelinci Lop dan Rex
Nama : Innes Maulidya
NRP : B04080117
Disetujui, Pembimbing
Prof. Dr. Dra. R. Iis Arifiantini, MSi NIP. 19600804 198103 2 001
Mengetahui,
Wakil Dekan Fakultas Kedokteran Hewan IPB
Drh. H. Agus Setiono, MS, Ph.D, APVet NIP. 19630810 198803 1 004
Tanggal Lulus :
KATA PENGANTAR
Bismillahirrohmanirrohiim
Alhamdulillah, segala puji hanya bagi Allah SWT yang telah memberikan Rahmat dan Karunia-Nya kepada penulis sehingga penulisan skripsi yang berjudul “Karakteristik Semen Segar, Morfologi, dan Pengujian Keutuhan Membran Plasma Spermatozoa Kelinci Lop dan Rex” dapat diselesaikan. Pada kesempatan ini, penulis ingin mengucapkan terima kasih kepada:
1. Prof. Dr. Dra. R. Iis Arifiantini, M.Si selaku dosen pembimbing yang telah mengarahkan, membimbing, dan membantu penulis selama ini.
2. Drh. Muhidin Nurdin selaku dosen penilai seminar serta kepada Drh. Adi Winarto Ph.D PAVet dan Dr. drh. H. Akhmad Arif Amin selaku dosen penguji atas saran dan masukan yang telah diberikan.
3. Dr. drh. Amrozi selaku dosen pembimbing akademik penulis atas segala bimbingannya selama ini.
4. Bapak Ekon Maludi, Bapak Sinto, dan karyawan Indira Farm dan Istana Kelinci yang telah menyediakan kelinci sebagai sampel dalam penelitian serta menyediakan tempat untuk melakukan penelitian.
5. Dr. drh. Amrozi selaku kepala Unit Rehabilitasi dan Reproduksi (URR) FKH IPB yang telah memberikan izin penelitian di laboratorium Fisiologi Reproduksi, serta kepada Bapak Bondan dan segenap staf URR atas bantuan yang diberikan selama penelitian.
6. Staf laboratorium Embriologi dan Histologi atas bantuannya.
7. Ayah, Ibu, Dila, Vira, dan seluruh keluarga besar penulis yang telah memberikan do’a, semangat, dan kasih sayangnya kepada penulis.
8. Adit Fahrizal atas do’a dan dukungan yang diberikan.
9. Teman-teman satu penelitian, Irena, Rice, dan Rizal yang telah membantu penulis hingga dapat menyelesaikan penelitian ini.
10. Sahabatku Sarah, Ulan, dan Tia atas dukungan dan kebersamaannya.
11. Amink, Desray, Hana, Fara, dan rekan-rekan Avenzoar 45 atas kebersamaannya selama ini.
12. Semua pihak yang telah membantu penulis dalam menyelesaikan skripsi ini. Penulis menyadari skripsi ini masih jauh dari sempurna, untuk itu penulis mengucapkan terima kasih atas kritik dan saran yang sifatnya membangun dari semua pihak demi kesempurnaan skripsi ini. Penulis berharap semoga skripsi ini dapat bermanfaat bagi pembaca.
Bogor, September 2012
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 25 Oktober 1990 dari pasangan Bapak Ekon Maludi dan Ibu Widyawati Noor. Penulis merupakan anak pertama dari tiga bersaudara.
Penulis menyelesaikan sekolah dasar di SDN Sindang Barang 2 pada tahun 2002, sekolah menengah pertama di SMPN 6 Bogor pada tahun 2005, sekolah menengah atas di SMAN 5 Bogor pada tahun 2008 dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk (USMI) IPB memilih Fakultas Kedokteran Hewan.
DAFTAR LAMPIRAN ... xiii
PENDAHULUAN ... 1
Pengujian Keutuhan Membran Plasma Spermatozoa ... 9
MATERI DAN METODE ... 10
Pemeriksaan Morfologi Spermatozoa ... 13
Pengujian Keutuhan Membran Plasma Spermatozoa ... 14
Analisis Data ... 14
HASIL DAN PEMBAHASAN ... 15
Karakteristik Semen Segar Kelinci Lop dan Rex ... 15
Morfologi Spermatozoa Segar Kelinci Lop dan Rex ... 18
Keutuhan Membran Plasma Spermatozoa ... 28
SIMPULAN DAN SARAN ... 35
Simpulan ... 35
Saran ... 35
DAFTAR PUSTAKA ... 36
DAFTAR TABEL
Halaman 1 Karakteristik semen segar kelinci Lop dan Rex yang dikoleksi
menggunakan vagina buatan ... 15 2 Jenis abnormalitas spermatozoa primer kelinci Lop dan Rex yang
dikoleksi menggunakan vagina buatan (%) ... 19 3 Jenis abnormalitas spermatozoa sekunder kelinci Lop dan Rex yang
dikoleksi menggunakan vagina buatan (%) ... 24 4 Morfologi kepala dan ekor spermatozoa kelinci Lop dan Rex yang
dikoleksi menggunakan vagina buatan (%) ... 27 5 MPU semen segar kelinxi Lop dan Rex pada beberapa tekanan
osmotik yang diinkubasi selama satu jam (%) ... 29 6 Waktu optimal pengujian MPU semen segar kelinci Lop dan Rex pada
3 Struktur Spermatozoa (Adellman & Cahill 1989) ... 8
4 Komponen vagina buatan (kiri) dan vagina buatan (kanan) ... 11
5 Proses pewarnaan eosin nigrosin ... 12
6 Kamar hitung Neubauer dan bidang hitungnya ... 13
7 Hasil koleksi semen kelinci ... 16
8 Spermatozoa hidup (kepala berwarna putih) dan spermatozoa mati (kepala berwarna merah, tanda panah), pewarnaan eosin nigrosin ... 18
9 Diagram persentase jenis abnormalitas spermatozoa primer kelinci Lop dan Rex ... 20
10 Morfologi kepala spermatozoa kelinci Lop dan Rex (a) normal, (b) abnormal contour, (c) KA defect, (d) detachedhead, (e) macrocephalus, (f) microcephalus, (g) narrow, (h) taperred, (i) pearshaped, (j) round head (perbesaran 1000X) ... 22
11 Diagram persentase jenis abnormalitas spermatozoa sekunder kelinci Lop dan Rex ... 25
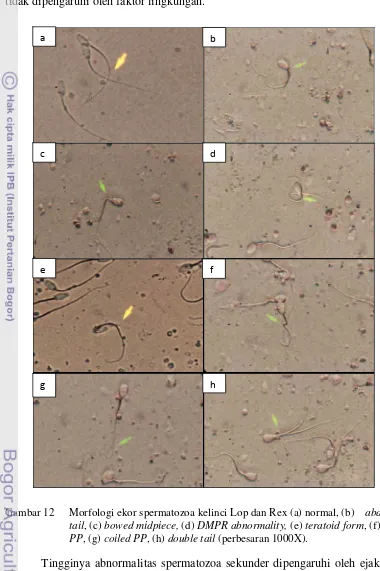
12 Morfologi ekor spermatozoa kelinci Lop dan Rex (a) normal, (b) abaxial tail, (c) bowed midpiece, (d) DMPR abnormality, (e) teratoid form, (f) bent PP, (g) coiled PP, (h) double tail (perbesaran 1000X) ... 26
13 Respon spermatozoa (coil) saat terpapar larutan hipoosmotik (tanda panah) ... 30
14 Diagram persentase spermatozoa coil kelinci Lop dan Rex dalam larutan bertekanan 50 mOsm/kg ... 31
15 Diagram persentase spermatozoa coil kelinci Lop dan Rex dalam larutan bertekanan 100 mOsm/kg ... 31
DAFTAR LAMPIRAN
Halaman
1 Karakteristik semen segar kelinci Lop ... 41
2 Karakteristik semen segar kelinci Rex ... 42
3 Persentase MPU semen segar kelinci Lop ... 43
4 Persentase MPU semen segar kelinci Rex ... 43
5 Tekanan osmotik semen segar kelinci Lop dan Rex ... 44
1
PENDAHULUAN
Latar Belakang
Saat ini, kelinci menjadi salah satu hewan kesayangan yang semakin digemari di Indonesia. Berbagai breed kelinci mulai dibudidayakan untuk memenuhi berbagai keperluan, seperti pemanfaatan daging, kulit dan rambut, serta sebagai hewan laboratorium dan hewan kesayangan (Sarwono 2001). Berdasarkan perbedaan ukuran tubuh, warna dan panjang rambut, pertumbuhan, serta manfaat satu dengan lainnya, terdapat lebih dari 72 breed kelinci yang tersebar luas di dunia termasuk di Indonesia. Beberapa breed kelinci yang banyak diketahui, dipelihara, dan dibudidayakan oleh peternak Indonesia antara lain kelinci Angora, Lop, Flemish Giant, Rex, Dutch, English Spot, Himalayan, Lion Head, Satin, Nederland Dwarf, New Zealand, Hotot, Harlequine, Tan, Polish, Havana, Chinchila, dan Californian.
Diantara berbagai breed kelinci yang ada, kelinci Lop dan Rex memiliki ciri khas tersendiri yang membedakannya dengan kelinci breed lain. Ciri khas kelinci Lop terletak pada telinga yang menggantung dari pangkal kepala hingga samping pipi dengan ujung membulat, tidak seperti kelinci pada umumnya yang memiliki telinga tegak (Sarwono 2001). Ciri khas ini menyebabkan kelinci Lop terlihat lucu dan menarik sehingga digemari banyak orang sebagai kelinci hias. Kelinci Lop juga dapat dimanfaatkan sebagai penghasil daging karena ukurannya yang besar. Kelinci Rex memiliki ciri khas pada rambutnya yang halus dan lembut seperti beludru (Sarwono 2001). Karena keindahan rambutnya, breed kelinci ini banyak dibudidayakan sebagai penghasil rambut untuk bahan pembuatan jaket dan aksesoris pakaian. Kelinci Rex juga dapat dimanfaatkan sebagai hewan kesayangan dan penghasil daging.
jantan. Pemeriksaan dilakukan secara makroskopis dan mikroskopis. Pemeriksaan secara makroskopis terdiri atas pengukuran volume semen, konsistensi, warna, dan pH semen, sedangkan pemeriksaan secara mikroskopis terdiri atas gerakan massa, gerakan individu, motilitas, konsentrasi, viabilitas, dan morfologi spermatozoa.
Spermatozoa terdiri atas dua bagian, yaitu kepala dan ekor (Garner & Hafez 2000). Keseluruhan bagian ini dibungkus oleh membran plasma yang berfungsi sebagai pelindung terhadap perubahan lingkungan, unsur transport dari dalam ke luar sel atau sebaliknya (Pinto & Kozink 2008), serta menjaga intergritas biokimia dan struktur spermatozoa (Amorim et al. 2009). Membran plasma yang mengalami kerusakan akan menyebabkan terganggunya komponen-komponen dalam spermatozoa seperti akrosom di bagian kepala yang mengandung enzim-enzim penting untuk fertilisasi ataupun mengganggu mitokondria jika kerusakan terjadi pada bagian ekor. Kerusakan dapat menyebabkan terjadinya penurunan fungsi membran plasma sehingga penurunan kualitas spermatozoa dapat terjadi. Mengingat pentingnya fungsi membran plasma, maka dilakukan pengujian terhadap keutuhan membran plasma dengan uji khusus yang disebut Hypo-Osmotic Swelling test (HOS test).
Pengujian terhadap keutuhan membran plasma spermatozoa telah banyak dilaporkan pada berbagai hewan, antara lain pada kambing (Fonseca et al. 2005), sapi (Correa & Zavos 1994), babi (Zou & Yang 2000), kuda (Neild et al. 1999), dan manusia (Jayendran et al. 1984), akan tetapi pengujian ini masih jarang dilakukan pada kelinci.
Tujuan
Penelitian ini dilakukan untuk mempelajari karakteristik semen segar baik secara makroskopis dan mikroskopis, terutama morfologi dan keutuhan membran plasma spermatozoa kelinci Lop dan Rex.
Manfaat
TINJAUAN PUSTAKA
Tinjauan Umum Kelinci
Kelinci yang banyak diternakkan saat ini berasal dari kelinci liar (Orytolagus cuniculus) yang telah mengalami domestikasi, tersebar di kawasan Afrika Utara, Eropa, Australia, Selandia Baru, Chili, serta pulau-pulau di Pasifik dan Atlantik. Klasifikasi kelinci adalah sebagai berikut:
Kingdom : Animalia
Genus : Lepus, Pentalagus, Bunolagus, Nesolagus, Romerolagus, Brachylagus, Sylvilagus, Oryctolagus, dan Poelagus.
Spesies : Lepus spp., Pentalagus spp., Bunolagus spp., Nesolagus spp., Romerolagus spp., Brachylagus spp., Sylvilagus spp., Oryctolagus spp., dan Poelagus spp.
Di Indonesia khususnya Pulau Jawa, kelinci pada mulanya merupakan ternak hias yang dipelihara oleh Belanda. Pada perkembangannya, kelinci mulai meluas ke kalangan rakyat biasa dan banyak diternakkan oleh petani-petani di daerah pegunungan. Breed kelinci pertama yang diternakkan di Indonesia adalah Nederland Dwarf yang pada awalnya merupakan usaha sambilan berskala kecil. Pada tahun 1980, pemerintah Indonesia mulai menggalakkan pemeliharaan kelinci sebagai sumber daging, akan tetapi usaha ini tidak berjalan mulus seperti di daerah Eropa dan Asia.
Berdasarkan bobotnya, kelinci dewasa dibedakan menjadi tiga tipe, yaitu tipe kecil, sedang, dan besar. Ketiga tipe tersebut dijelaskan sebagai berikut: 1. Tipe kecil (small and dwarf breeds). Kelinci tipe ini dimanfaatkan sebagai
2. Tipe sedang (medium breeds). Kelinci tipe ini dimanfaatkan sebagai penghasil daging, bulu, dan kulit. Bobotnya adalah antara 2-4 kg. Mencapai dewasa kelamin pada umur 7-8 bulan. Beberapa breed kelinci tipe sedang antara lain Rex, New Zealand White, English spot, dan Californian.
3. Tipe berat (giant breeds). Kelinci tipe ini dimanfaatkan sebagai penghasil daging, bulu, dan kulit seperti tipe sedang. Bobot yang dapat dicapai adalah hingga 8 kg. Kelinci tipe ini mencapai dewasa kelamin pada umur 10-12 bulan. Beberapa breed kelinci tipe berat antara lain Flemish Giant dan Giant Chinchilla (Sarwono 2001).
Terdapat lebih dari 72 breed kelinci yang tersebar luas di dunia. Beberapa
breed kelinci yang sudah dibudidayakan di Indonesia, antara lain: 1. Kelinci Lop
Kelinci Lop memiliki kepala lebar, mata hitam, serta tubuh kompak dan padat. Ciri khas kelinci Lop terletak pada telinga yang menggantung dari pangkal kepala hingga samping pipi dengan ujung membulat, tidak seperti kelinci pada umumnya yang memiliki telinga tegak (Gambar 1). Perubahan posisi telinga terlihat setelah usia kelinci 2-4 bulan. Ciri khas ini yang menyebabkan kelinci Lop terlihat lucu dan menarik sehingga digemari banyak orang sebagai kelinci hias.
5
Lop melahirkan 6-8 ekor anak setiap kali bunting. Kemampuan beranak tiap induk cukup besar, yaitu mencapai 36 ekor per tahun. Anak Lop tumbuh cepat dan berdaging padat. Rata-rata bobot anak setelah berumur 65 hari adalah 1.8 kg dan bobot dewasa mencapai 4.5-5 kg, karenanya Lop juga banyak diternakkan untuk diambil dagingnya (Sarwono 2001). Beberapa jenis kelinci Lop antara lain English Lop, Holland Lop, Dwarf Lop, American Fuzzy Lop, Angora Lop, dan French Lop. Diantara beberapa jenis kelinci Lop tersebut, English Lop merupakan jenis yang paling terkenal, berwarna kuning, coklat, dan hitam kekuning-kuningan.
2. Kelinci Rex
Kelinci Rex memiliki proporsi tubuh yang baik dengan bagian belakang membulat, tulang kuat, kepala lebar, dan telinga tegak. Ciri khas kelinci Rex terletak pada rambutnya yang halus dan lembut seperti beludru dengan panjang hingga 1.27 cm. Karena keindahan rambutnya, kelinci ini banyak dibudidayakan sebagai penghasil rambut selain sebagai kelinci hias. Rambut Rex yang eksotis digunakan sebagai bahan baku pembuatan jaket atau aksesoris pakaian. Bobot dewasa Rex dapat mencapai 2.7-3.6 kg. Ukurannya yang besar juga dimanfaatkan peternak Rex untuk diambil dagingnya (Sarwono 2001).
Kelinci Rex melahirkan 6-7 ekor anak setiap kali bunting dan setiap tahun kelinci ini dapat melahirkan hingga 6 kali. Warna rambut kelinci Rex sangat bervariasi antara lain putih, hitam, biru, ungu merah muda (Lilac), coklat emas (Nutria, Cinnamon), merah kuning keemasan, coklat gelap kehitam-hitaman (Havana), bertotol (Dalmation), kombinasi hitam dan oranye (Harlequin), dan seperti kucing Siam (Siamese Sable). Kelinci Rex yang paling terkenal adalah White Rex, yang berambut putih mulus dan tebal. Kualitas rambutnya sangat baik, lembut seperti beludru. Breed ini disebut juga Ermine Rex.
Fisiologi Semen
Semen merupakan sekresi dari organ kelamin jantan yang terdiri atas spermatozoa dan plasma semen (Garner & Hafez 2000). Spermatozoa pada semen dihasilkan oleh testis dan dipengaruhi oleh hormon gonadotropin dan gonad, sedangkan plasma semen merupakan campuran sekresi dari epididimis dan kelenjar-kelenjar kelamin seperti kelenjar vesikularis dan prostat. Plasma semen berperan dalam keberhasilan reproduksi karena digunakan sebagai media transport dan energi bagi spermatozoa. Semen memiliki larutan buffer nitrat, bikarbonat, kation, pH sedikit basa (7.3-7.8), dan tekanan osmotik yang hampir sama dengan darah.
Evaluasi Semen
Semen yang telah dikoleksi segera mungkin dievaluasi untuk mengetahui kuantitas dan kualitas semen sebelum semen itu digunakan. Hal ini karena hanya semen dengan kualitas baik yang memiliki kemampuan fertilisasi yang tinggi. Keberhasilan fertilisasi dari ejakulasi secara pasti hanya dapat ditentukan setelah inseminasi, akan tetapi cara ini memakan waktu dan biaya. Karenanya, tes laboratorium dikembangkan untuk memperkirakan kualitas in vitro dan mengorelasikan parameter kualitas semen tersebut dengan kesuburan in vivo. Tes laboratorium ini dapat digunakan untuk memprediksi kesuburan pejantan (Rodríguez-Martínez 2003; Carluccio et al. 2004).
7
mencakup evaluasi secara makroskopis dan mikroskopis. Secara makroskopis, volume semen, pH, konsistensi, dan warna semen dapat dinilai, sedangkan secara mikroskopis, gerakan massa, motilitas, skor individu, konsentrasi, viabilitas, dan morfologi dapat dinilai.
Morfologi Spermatozoa
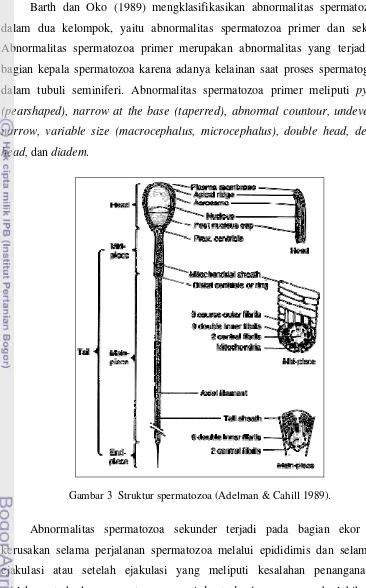
Garner dan Hafez (2000) membagi spermatozoa menjadi dua bagian, yaitu kepala dan ekor. Kepala spermatozoa berbentuk bulat, lonjong, dan pipih. Kepala spermatozoa terdiri atas bagian akrosom anterior dan post akrosomal posterior. Akrosom anterior dibungkus oleh tudung akrosom yang merupakan struktur berupa dua lapis membran diantara plasma membran dan anterior kepala spermatozoa. Kandungan tudung akrosom adalah akrosin, hyaluronidase, dan enzim hidrolitik lainnya yang berfungsi untuk menembus ovarium dan membran oosit. Kepala juga berisi kromosom atau untaian DNA (Barth & Oko 1989). Ekor spermatozoa terdiri atas bagian penghubung(connecting piece), bagian tengah (midpiece), bagian utama (principle piece), dan bagian ujung (endpiece). Ekor terdiri atas aksonema yang tersusun oleh sembilan pasang mikrotubulus yang melingkari 2 inti filament. Aksonema dibungkus oleh banyak mitokondria yang berfungsi sebagai sumber energi bagi motilitas spermatozoa. Fruktosa yang terkandung dalam semen merupakan sumber pembentuk adenosine triphosphate
(ATP) pada mitokondria. Ekor spermatozoa berfungsi sebagai penggerak lokomosi dengan gelombang di daerah implantasi ekor kepala, mendorong spermatozoa bergerak melalui uterus dan tuba Falopii hingga bertemu dan berpenetrasi pada oosit (Schatten & Gheorghe 2007), keberhasilan fertilisasi bergantung pada hal ini.
Kelainan terhadap morfologi spermatozoa atau abnormalitas secara alami dapat ditemukan pada spermatozoa karena kurang sempurnanya proses dalam organ reproduksi hewan. Abnormalitas dipicu oleh penyakit, heat stress,
perlakuan kriopreservasi, dan musim (Barth & Oko 1989). Tingginya persentase spermatozoa abnormal berkorelasi dengan kesuburan pada kelinci (Lavara et al.
Barth dan Oko (1989) mengklasifikasikan abnormalitas spermatozoa ke dalam dua kelompok, yaitu abnormalitas spermatozoa primer dan sekunder. Abnormalitas spermatozoa primer merupakan abnormalitas yang terjadi pada bagian kepala spermatozoa karena adanya kelainan saat proses spermatogenesis dalam tubuli seminiferi. Abnormalitas spermatozoa primer meliputi pyriform (pearshaped), narrow at the base (taperred), abnormal countour, undeveloped, narrow, variable size (macrocephalus, microcephalus), double head, detached head, dan diadem.
Gambar 3 Struktur spermatozoa (Adelman & Cahill 1989).
9
apabila abnormalitas spermatozoa primer yang ditemukan mencapai 18-20% karena dapat menurunkan fertilitas (Barth & Oko 1989).
Pengujian Keutuhan Membran Plasma Spermatozoa
Seluruh bagian spermatozoa diselimuti oleh membran plasma yang berfungsi sebagai pelindung terhadap perubahan lingkungan, sebagai unsur transport dari dalam ke luar sel atau sebaliknya (Pinto & Kozink 2008), serta menjaga integritas biokimia dan struktur spermatozoa (Amorim et al. 2009). Keutuhan membran plasma akan menentukan kualitas spermatozoa. Hypo-Osmotic Swelling test (HOS test) merupakan uji khusus yang digunakan untuk mengetahui keutuhan membran plasma spermatozoa (Lodhi et al. 2008). Mocé et al. (2004), Daader dan Seleem (2005), dan Safaah et al. (2008) menunjukkan bahwa HOS test dapat digunakan untuk menilai hasil fertilisasi in vitro dari semen kelinci.
MATERI DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Juli 2011 sampai April 2012 bertempat di Indira Farm Hamtaro and Rabbit House, Istana Kelinci, dan di Unit Rehabilitasi Reproduksi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Materi Penelitian
Alat yang digunakan dalam penelitian adalah vagina buatan, mikroskop cahaya, gelas objek dan penutup, water bath, heating table, pH paper, pipet, mikropipet, pipet Pasteur, counting chamber, tabung Eppendorf, stopwatch,
counter, termometer, termos, spoit, aluminium foil, dan bak pencuci.
Bahan yang digunakan antara lain semen kelinci yang berasal dari 3 ekor kelinci Lop dan 3 ekor kelinci Rex (berbobot badan 2-2.5 kg dalam usia produktif), 1 ekor kelinci Lop betina, 1 ekor kelinci Rex betina, alkohol, NaCl 0.9%, KY Jelly, larutan Hipoosmotik (Natrium Sitrat dan Fruktosa), bahan pewarnaan Eosin Nigrosin, dan bahan pewarnaan Williams (alkohol absolut,
chloramin 0.5%, air destilasi, alkohol 95%, dan larutan Williams).
Metode Penelitian Persiapan Kelinci
Kelinci jantan dipelihara dalam kandang individual, dipelihara juga kelinci betina sebagai pemancing (teaser) di kandang lain.
Persiapan Vagina Buatan dan Koleksi Semen
Komponen vagina buatan, yaitu outer layer, inner linner, termometer, tabung penampung, KY Jelly, spoit, dankaret disiapkan (Gambar 4). Inner linner
11
Daerah sekitar preputium kelinci dibersihkan dengan menggunakan NaCl 0.9%. Teaser kemudian dimasukkan ke dalam kandang pejantan atau didekatkan dengan pejantan. Pejantan dibiarkan menaiki pemancing (mounting). Pada saat yang bersamaan, vagina buatan diarahkan pada penis kelinci. Koleksi semen dilakukan sebanyak 3 kali dengan interval waktu 3 hari.
Gambar 4 Komponen vagina buatan (kiri) dan vagina buatan (kanan).
Evaluasi Semen
Evaluasi semen yang dilakukan meliputi evaluasi secara makroskopis dan mikroskopis. Secara makroskopis, volume semen, pH, konsistensi, serta warna semen dapat dinilai. Sedangkan secara mikroskopis, gerakan massa, motilitas, skor individu, konsentrasi, viabilitas, dan morfologi spermatozoa dapat dinilai. Evaluasi Makroskopis:
1. Warna dapat dinilai langsung dengan menggunakan indra penglihatan, akan diperoleh warna putih, krem, atau kuning.
2. Volume dapat dilihat langsung dari skala yang ditunjukkan pada tabung penampung.
4. pH dapat diketahui dengan membaca hasil pada pH paper yang dicelupkan pada semen.
Evaluasi Mikroskopis: 1. Gerakan massa
Gerakan massa dapat dinilai dengan mengamati pergerakan spermatozoa menyerupai gelombang pada mikroskop perbesaran 100X, yaitu dengan meneteskan satu tetes semen ke atas permukaan gelas objek dan selanjutnya dilihat di bawah mikroskop. Pemeriksaan dilakukan minimal pada lima lapang pandang berbeda. Hasil yang diperoleh adalah (+++), (++), (+), atau (-).
2. Skor individu dan Motilitas
Skor individu dan motilitas dapat dinilai dengan bentuan cairan isotonis NaCl 0.9%. Satu tetes semen dicampurkan dengan empat tetes NaCl 0.9% dan ditutup gelas penutup, lalu diamati di mikroskop perbesaran 400X. Skor individu spermatozoa dinilai berdasarkan kecepatan pergerakan spermatozoa (1-5), sedangkan motilitas dinilai berdasarkan banyaknya spermatozoa yang bergerak progressive dan dinyatakan dalam persen (%). Pemeriksaan dilakukan minimal pada lima lapang pandang berbeda.
3. Viabilitas
Viabilitas dinilai menggunakan bantuan pewarnaan Eosin Nigrosin. Satu tetes spermatozoa dicampur dengan empat tetes pewarna Eosin Nigrosin lalu diulas, difiksasi di atas meja pemanas, dan diamati di bawah mikroskop perbesaran 400X. Sebanyak sepuluh lapang pandang spermatozoa dihitung. Spermatozoa hidup akan memiliki kepala berwarna putih, sedangkan spermatozoa mati akan memiliki kepala berwarna merah.
13
Perhitungan:
4. Konsentrasi Spermatozoa
Sebanyak 5 µL semen dicampurkan dengan 95 µL formol salin. Kemudian campuran tersebut diteteskan pada counting chamber. Konsentrasi spermatozoa adalah jumlah spermatozoa dalam counting chamber x 106 dengan satuan spermatozoa per mL.
Gambar 6 Kamar hitung Neubauer dan bidang hitungnya.
Pemeriksaan Morfologi Spermatozoa
Morfologi spermatozoa diwarnai dengan pewarnaan Williams. Dari sampel semen segar yang ada, dibuat preparat ulas dan difiksasi di atas meja pemanas. Preparat ulas yang telah siap kemudian dicuci dalam alkohol absolut selama 4 menit dan dikeringudarakan. Selanjutnya preparat dicelupkan berulang kali dalam larutan chloramin 0.5% selama 1-2 menit atau hingga lendir (mucous) hilang dan ulasan terlihat jernih. Preparat kemudian dicuci dalam air destilasi. Setelah itu preparat dicelupkan dalam alkohol 95%. Selama 8-10 menit selanjutmya, preparat diwarnai dengan larutan Williams. Langkah terakhir, preparat dicuci dengan air mengalir hingga ulasan terlihat jernih dan dikeringkan.
Perhitungan:
Pengujian Keutuhan Membran Plasma Spermatozoa
Pengujian dilakukan menggunakan larutan campuran 0.735 g Natrium Sitrat dan 1.351 g Fruktosa dalam 100 mL aquadest dan diatur tekanannya menjadi 50 mOsm/kg (TO50), 100 mOsm/kg (TO100), dan 150 mOsm/kg (TO150). Sebanyak 10 µL semen dari masing-masing kelinci dicampur dengan 2 mL larutan sesuai perlakuan. Campuran kemudian diinkubasi dalam water bath (37oC) dan diamati setiap 15 menit selama 1 jam. Pemeriksaan dilakukan dengan perbesaran 400X pada sepuluh lapang pandang. Spermatozoa dengan membran plasma utuh akan memperlihatkan kebengkokan ekor (coil).
Perhitungan:
Analisis Data
HASIL DAN PEMBAHASAN
Karakteristik Semen Segar Kelinci Lop dan Rex
Evaluasi terhadap semen sangat diperlukan untuk memperoleh informasi mengenai kualitas semen. Informasi tersebut dapat digunakan sebagai pedoman dalam upaya meningkatkan kualitas spermatozoa (Brun et al. 2002). Perbedaan karakteristik semen pada berbagai inidividu dipengaruhi oleh breed, genetik, pakan, status kesehatan, kondisi pemeliharaan, musim, umur, dan frekuensi koleksi semen (Alvarino 2000).
Evaluasi semen dilakukan secara makroskopis dan mikroskopis. Pemeriksaan secara makroskopis meliputi pengukuran volume semen, konsistensi, warna semen, dan pH, sedangkan pemeriksaan secara mikroskopis meliputi pemeriksaan terhadap gerakan massa, motilitas, skor individu, konsentrasi, viabilitas, dan morfologi spermatozoa (Tabel 1).
Tabel 1 Karakteristik semen segar kelinci Lop dan Rex yang dikoleksi menggunakan vagina buatan
Superskrip dengan notasi berbeda menyatakan perbedaan yang nyata (p<0.05)
Makroskopis
Lop lebih banyak dibandingkan kelinci Rex, tetapi secara statistik tidak berbeda (P>0.05). Garcia-Tomas et al. (2006) memperoleh nilai yang lebih tinggi, yaitu 1.19±0.43 mL. Ogbuewu et al. (2009) dan El-Azim dan El-Kamash (2011) juga memperoleh nilai yang lebih tinggi, yaitu sebesar 0.51-0.64 mL, akan tetapi nilai tersebut tidak terlalu berbeda dengan hasil yang diperoleh dari penelitian. Perbedaan volume yang diperoleh setiap peneliti terutama disebabkan karena adanya perbedaan breed kelinci yang digunakan. Variasi umur, bobot badan, status kesehatan dan reproduksi, kualitas pakan, serta frekuensi koleksi semen juga berpengaruh terhadap volume semen yang dihasilkan (Johnson et al. 2000).
Gambar 7 Hasil koleksi semen kelinci.
Konsistensi dan warna semen yang teramati pada kelinci Lop dan Rex adalah sama, yaitu encer hingga kental dengan semen berwarna putih hingga krem (Gambar 7). Garner dan Hafez (2000) menjelaskan bahwa warna dan konsistensi dipengaruhi oleh riboflavin (hasil sekresi kelenjar vesikularis) dan banyaknya jumlah spermatozoa yang terkandung dalam semen. Kedua parameter ini dapat digunakan untuk memprediksi secara cepat konsentrasi spermatozoa dalam semen. Semen dengan konsistensi kental dan berwarna keruh menunjukkan bahwa semen memiliki konsentrasi spermatozoa yang tinggi.
17
dalam semen. Kelinci memiliki pH basa (El-Azim & El-Kamash 2011), pH yang asam dapat menurunkan kelangsungan hidup spermatozoa. Adanya penimbunan asam laktat (produk sampingan metabolisme spermatozoa) atau karena adanya disfungsi dari salah satu atau kedua kelenjar aksesori pada saluran reproduksi jantan dapat menyebabkan pH menjadi asam. Pada penelitian ini semen kelinci Lop dan Rex memiliki pH yang sama (P>0.05), yaitu 7.28±0.44 dan 7.38±0.19. Nilai ini hampir sama dengan pH kelinci Sinai dan Balady yang diteliti oleh El-Azim dan El-Kamash (2011) dan Garcia-Tomas et al. (2006), yaitu 7.33 hingga 7.63. Perbedaan pH disebabkan karena perbedaan breed dan faktor lingkungan termasuk pakan.
Mikroskopis
Gerakan massa merupakan gerakan spermatozoa dalam kelompok sehingga membentuk gelombang menyerupai awan. Gerakan massa yang teramati pada kelinci Rex dan Lop adalah 2.67±0.50 dan 2.33±0.71, kedua nilai ini berbeda (P<0.05) secara statistika. Motilitas dan skor individu merupakan gerakan dan kecepatan spermatozoa secara individual. Spermatozoa motil dan skor individu pada kelinci Rex adalah 61.67±12.58% dan 4.00±0.43. Nilai ini berbeda (P<0.05) dengan kelinci Lop, yaitu sebesar 40.00±9.35% dan 3.67±0.50.
Motilitas digunakan sebagai acuan kualitas semen dan indikasi fertilitas, meskipun motilitas tidak secara langsung mempengaruhi hasil kebuntingan pada teknik fertilisasi in vitro maupun intra cytoplasmic sperm injection (ICSI) (Moghadam et al. 2005). Motilitas sangat erat hubungannya dengan fertilitas, karena hanya spermatozoa yang memiliki motilitas progressive yang dapat mencapai tempat terjadinya fertilisasi. Beberapa peneliti melaporkan hasil pemeriksaan motilitas yang beragam. Kelinci New Zealand White memiliki motilitas 74.50% (Ogbuewu et al. 2009), 60.27% (El-Haekam et al. 1992), dan 68.21% (El-Azim & El-Kamash 2011), Balady 63.21%, sedangkan Sinai 63.11% (El-Azim & El-Kamash 2011). Perbedaan motilitas berhubungan dengan breed, perlakuan, dan metode koleksi semen.
tersebut hampir sama dengan laporan Garcia-Tomas et al. (2006), yaitu 245.35±227.08 x 106/mL. Perbedaan konsentrasi dipengaruhi oleh teknik koleksi semen, breed, umur, dan status kesehatan hewan (Setiadi et al. 2006).
Viabilitas spermatozoa kelinci Lop (47.94±15.02%) lebih rendah daripada kelinci Rex (61.40±18.10%), akan tetapi keduanya lebih rendah dibandingkan dengan temuan Garcia-Tomas et al. (2006) dan El-Azim dan El-Kamash (2011), yaitu sebesar 81.14-86.17% (Gambar 8).
Gambar 8 Spermatozoa hidup (kepala berwarna putih) dan spermatozoa mati (kepala berwarna merah, tanda panah), pewarnaan eosin nigrosin.
Seluruh parameter evaluasi dari kelinci Lop dan Rex yang diteliti menunjukkan nilai yang lebih rendah dibandingkan hasil penelitian lainnya. Meskipun demikian, kedua kelinci tersebut terbukti fertil, karena secara in vivo
telah menghasilkan banyak anak melalui perkawinan alami. Sehingga kemungkinan kualitas tersebut normal dan merupakan karakteristik dari semen pada kedua kelinci tersebut.
Morfologi Spermatozoa Segar Kelinci Lop dan Rex
19
Abnormalitas Spermatozoa Primer
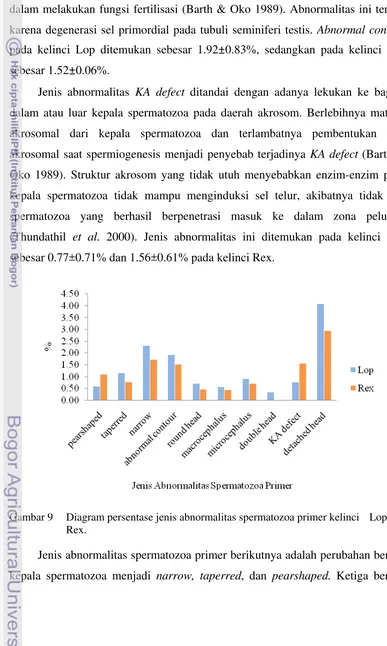
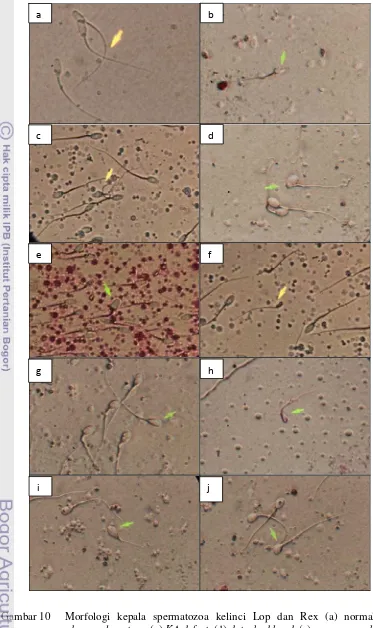
Abnormalitas pada bagian kepala spermatozoa atau abnormalitas spermatozoa primer terjadi karena adanya kelainan saat proses spermatogenesis dalam tubuli seminiferi (Chenoweth 2005). Abnormalitas spermatozoa primer yang ditemukan adalah pearshaped, taperred, narrow, abnormal contour, round head, macrocephalus, microcephalus, double head, knobbed acrosome defect (KA defect), dan detached head (Tabel 2 dan Gambar 10).
Tabel 2 Jenis abnormalitas spermatozoa primer kelinci Lop dan Rex yang dikoleksi menggunakan vagina buatan (%)
No Jenis abnormalitas L1 L2 L3 Rataan R1 R2 R3 Rataan
Ket : L (kelinci Lop), R (kelinci Rex)
Jenis abnormalitas spermatozoa primer yang paling banyak ditemukan pada kedua breed kelinci adalah detached head, yaitu sebesar 4.08±1.95% pada kelinci Lop dan 2.94±0.57% pada kelinci Rex. Detached head ditandai dengan kepala spermatozoa tanpa ekor karena tidak sempurnanya membran plasma yang menghubungkan bagian posterior kepala dengan basal ekor. Spermatozoa tanpa ekor menyebabkan spermatozoa tidak dapat bergerak. Hal ini disebabkan karena fungsi ekor adalah sebagai penggerak spermatozoa (Schatten & Gheorghe 2007).
Detached head diakibatkan oleh hipoplasia testis, degenerasi testis, atau akibat peradangan pada ampula dan epididimis. Predisposisi kejadian detached head
adalah faktor genetik (McGowan et al. 1995). Secara fisiologis, abnormalitas kepala tanpa ekor dapat terjadi terkait dengan pematangan sel sertoli (Shimomura
et al. 2008).
dalam membuahi sel telur. Penyebab utama kedua jenis abnormalitas ini adalah kelainan genetik (Barth & Oko 1989). Pada abnormal contour, terjadi perubahan struktur kepala spermatozoa menjadi tidak rata dan tidak teratur. Adanya perubahan struktur ini menyebabkan spermatozoa kehilangan kemampuannya dalam melakukan fungsi fertilisasi (Barth & Oko 1989). Abnormalitas ini terjadi karena degenerasi sel primordial pada tubuli seminiferi testis. Abnormal contour
pada kelinci Lop ditemukan sebesar 1.92±0.83%, sedangkan pada kelinci Rex sebesar 1.52±0.06%.
Jenis abnormalitas KA defect ditandai dengan adanya lekukan ke bagian dalam atau luar kepala spermatozoa pada daerah akrosom. Berlebihnya matriks akrosomal dari kepala spermatozoa dan terlambatnya pembentukan fase akrosomal saat spermiogenesis menjadi penyebab terjadinya KA defect (Barth & Oko 1989). Struktur akrosom yang tidak utuh menyebabkan enzim-enzim pada kepala spermatozoa tidak mampu menginduksi sel telur, akibatnya tidak ada spermatozoa yang berhasil berpenetrasi masuk ke dalam zona pelusida (Thundathil et al. 2000). Jenis abnormalitas ini ditemukan pada kelinci Lop sebesar 0.77±0.71% dan 1.56±0.61% pada kelinci Rex.
Gambar 9 Diagram persentase jenis abnormalitas spermatozoa primer kelinci Lop dan Rex.
21
abnormalitas spermatozoa ini berpengaruh terhadap kemampuan fertilitas (Barth & Oko 1989; Chenoweth 2005). Bentuknya yang berbeda, lebih kecil, dan ramping menyebabkan pergerakan ketiga bentuk spermatozoa ini lebih
progressive. Hal ini dapat diamati pada saat pemeriksaan motilitas spermatozoa. Pada kelici Lop dan Rex narrow ditemukan sebesar 2.31±0.48 dan 1.72±0.44%.
Narrow ditandai dengan penyempitan pada bagian kepala spermatozoa secara menyeluruh karena tidak sempurnanya fase spermatosit primer dan tidak meratanya penyebaran substansi spermatozoa pada daerah kepala.
Taperred memiliki morfologi yang hampir sama dengan narrow, akan tetapi penyempitan pada taperred hanya terjadi pada bagian post akrosom dengan batas yang tidak jelas. Persentase abnormalitas yang terjadi pada Lop dan Rex adalah 1.15±0.99 dan 0.77±0.66%. Pearshaped ditandai dengan pembesaran pada bagian akrosom yang berisi kromatin dan penyempitan bagian post akrosom dengan batasan yang jelas (Barth & Oko 1989). Abnormalitas ini disebabkan karena tidak sempurnanya pembentukan akhir tudung akrosom akibat gangguan regulasi panas dan hormonal pada testis saat proses spermiogenesis (McGowan et al. 1995).
Pearshaped bersifat genetik (Chenoweth 2005), pada kelinci Lop dan Rex ditemukan sebesar 0.60±0.57 dan 1.01±0.35%.
Round head merupakan jenis abnormalitas kepala yang ditandai dengan bentuk kepala spermatozoa menjadi bulat tanpa adanya batasan akrosom yang jelas. Abnormalitas ini merupakan kelainan yang disebabkan karena faktor genetik. Round head yang ditemukan pada kelinci Lop sebesar 0.71±0.13% dan pada kelinci Rex sebesar 0.46±0.61%.
Variabel size adalah jenis abnormalitas spermatozoa primer yang ditandai dengan ukuran kepala mengecil (microcephalus) atau membesar (macrocephalus).
Gambar 10 Morfologi kepala spermatozoa kelinci Lop dan Rex (a) normal, (b)
abnormal contour, (c) KA defect, (d) detached head, (e) macrocephalus,
(f) microcephalus, (g) narrow, (h) taperred, (i) pearshaped, (j) roundhead
(perbesaran 1000X).
a
g
f e
d c
b
j h
23
Microcehalus dapat menyebabkan terlihatnya progressive movement saat pemeriksaan motilitas spermatozoa akibat ukuran kepala yang kecil dan kemampuan ekor yang meningkat, sedangkan macrocephalus dapat menyebabkan melambatnya pergerakan spermatozoa karena ketidakmampuan ekor melakukan pergerakan dengan ukuran kepala spermatozoa yang besar. Microcephalus dan
macrocephalus yang ditemukan pada kelinci Lop adalah sebesar 0.92±0.31% dan 0.56±0.38%, sedangkan pada kelinci Rex sebesar 0.72±0.03% dan 0.45±0.46%.
Jenis abnormalitas terakhir yang ditemukan adalah double head yang ditandai dengan kepala ganda berukuran sama atau berbeda pada satu ekor.
Double head hanya ditemukan pada kelinci Lop, yaitu sebesar 0.34±0.45%. Abnormalitas ini disebabkan karena kelainan genetik pada sel primordial dan kesalahan pada saat spermiogenesis.
Tingginya abnormalitas spermatozoa primer pada semen berhubungan dengan menurunnya fertilitas pejantan (Saacke 2008; Sarder 2004). Hal ini terjadi karena kepala spermatozoa berisi nukleus sebagai pembawa materi genetik dan
acrosomal enzyme untuk melakukan fertilisasi.
Abnormalitas Spermatozoa Sekunder
Abnormalitas pada bagian leher dan ekor spermatozoa atau abnormalitas spermatozoa sekunder terjadi setelah proses spermiasi, yaitu saat perjalanan spermatozoa dari tubuli seminiferi testis menuju epididimis (Chenoweth 2005). Pemeriksaan terhadap ekor dapat dengan mudah teramati saat melakukan evaluasi motilitas spermatozoa, yaitu ditemukannya pergerakan spermatozoa tidak
progressive. Abnormalitas spermatozoa sekunder yang ditemukan adalah distal midpiece reflex abnormality (DMPR abnormality), segmental aplasia of mitokondrial sheat (SA mitokondrial), bowed midpiece, bent principal piece (bent PP), coiled principal piece (coiled PP), abaxial tail, double tail, dan teratoid forms (Tabel 3 dan Gambar 12).
dicirikan dengan letak pangkal ekor yang bergeser dari tengah kepala spermatozoa ke samping dan membentuk fosa implantasi di tempat tersebut. Jenis abnormalitas ini normal ditemukan pada babi (McIntosh 1990).
Tabel 3 Jenis abnormalitas spermatozoa sekunder kelinci Lop dan Rex yang dikoleksi menggunakan vagina buatan (%)
No Jenis abnormalitas L1 L2 L3 L R1 R2 R3 R
Abnormalitas midpiece yang ditemukan adalah bowed midpiece dan DMPR abnormality. Abnormalitas pada midpiece atau leher spermatozoa merupakan abnormalitas genetik yang bersifat kongenital dan herediter (Chenoweth 2005). Kedua abnormalitas ini terjadi akibat preparasi yang salah, proses abnormal selama ejakulasi (Bloom 1968), dan tidak sempurnanya proses pematangan spermatozoa (Barth & Oko 1989).
Bowed midpiece ditemukan pada kelinci Lop dan Rex sebesar 2.40±1.69 dan 0.44±0.13%. Bowed midpiece ditandai dengan adanya lengkungan membentuk huruf U pada bagian leher spermatozoa, sedangkan DMPR abnormality ditandai dengan melingkarnya leher spermatozoa. Bowed midpiece
tidak menyebabkan penurunan fertilitas, begitu juga DMPR abnormality. Kedua jenis abnormalitas ini hanya menyebabkan penurunan motilitas karena terdapat membran yang membungkus bagian leher yang melingkar. Pada kelinci Rex,
DMPR abnormality merupakan jenis abnormalitas sekunder yang paling banyak ditemukan, yaitu sebesar 1.21±1.00%.
25
akibat cold shock dan perbedaan tekanan osmotik dengan lingkungan. Bent PP
ditemukan pada kelinci Lop dan Rex sebesar 1.25±1.18% dan 1.14±0.41%.
Coiled PP ditandai dengan ekor yang menggulung sederhana pada bagian ujung. Abnormalitas ini disebabkan karena preparasi yang kurang tepat dan pematangan yang tidak sempurna pada spermatozoa (Barth & Oko 1989). Coiled PP dapat menyebabkan terganggunya motilitas spermatozoa akibat adanya membran yang membungkus bagian melingkar tersebut. Pada kelinci Lop coiled PP tidak ditemukan, sedangkan pada kelinci Rex jenis abnormalitas ini ditemukan sebesar 0.63±0.58%.
Gambar 11 Diagram persentase jenis abnormalitas spermatozoa sekunder kelinci Lop dan Rex.
Abnormalitas jenis SA mitokondrial ditemukan sebesar 1.02±1.13% pada kelinci Lop dan 1.19±1.69% pada kelinci Rex. Abnormalitas ini bersifat serius karena mitokondria diperlukan sebagai tempat mengkonversi adenosine triphosphate (ATP) dan adenosine diphosphate (ADP) menjadi energi yang diperlukan untuk pergerakan spermatozoa (Silva & Gadella 2006). Pergerakan spermatozoa sangat berpengaruh terhadap fertilitas.
spermatozoa. Teratoid form pada kelinci Lop dan Rex ditemukan sebesar 0.72±0.45% dan 0.52±0.40%. Teratoid form merupakan abnormalitas genetik dan tidak dipengaruhi oleh faktor lingkungan.
Gambar 12 Morfologi ekor spermatozoa kelinci Lop dan Rex (a) normal, (b) abaxial tail, (c) bowed midpiece, (d) DMPR abnormality, (e) teratoid form, (f) bent PP, (g) coiled PP, (h) double tail (perbesaran 1000X).
Tingginya abnormalitas spermatozoa sekunder dipengaruhi oleh ejakulasi yang tidak sempurna dan akibat perlakuan yang tidak tepat saat koleksi semen, seperti pemanasan, pendinginan, penambahan antibiotik, atau terkontaminasi zat
a b
e f
g h
27
berbahaya (Barth & Oko 1989). Arifiantini dan Ferdian (2004) juga menjelaskan bahwa kesalahan preparasi spermatozoa dapat menyebabkan peningkatan jumlah abnormalitas spermatozoa sekunder yang ditemukan.
Abnormalitas spermatozoa yang ditemukan pada kelinci Lop dan Rex tidak berbeda (P>0.05), baik abnormalitas spermatozoa primer maupun sekunder. Hal ini menunjukkan bahwa kualitas kedua breed kelinci jika dilihat dari tingkatan abnormalitas yang teramati sama, meskipun jumlah abnormalitas pada kelinci Lop lebih tinggi dibandingkan pada kelinci Rex.
Tabel 4 Morfologi kepala dan ekor spermatozoa kelinci Lop dan Rex yang dikoleksi menggunakan vagina buatan (%)
Pejantan Kepala Ekor Total Spermatozoa
Abnormal Normal Abnormal Normal Abnormal
L1 85.94 ± 5.92 14.06 ± 5.92 90.87 ± 6.12 9.13 ± 6.12 11.60 ± 3.49
Ket: L (kelinci Lop), R (Kelinci Rex)
Berdasarkan hasil penelitian, persentase morfologi kepala dan ekor spermatozoa normal pada kelinci Lop sebesar 86.64±0.79 dan 89.21±2.23. Kelinci Rex memperoleh persentase morfologi kepala dan ekor spermatozoa normal lebih tinggi secara deskriptif dibandingkan kelinci Lop, yaitu sebesar 88.77±1.73 dan 93.76±2.26 (Tabel 4), tetapi tidak terdapat perbedaan secara statistik (P>0.05). El-Haekam et al. (1992) memperoleh nilai persentase morfologi kepala dan ekor normal kelinci yang hampir sama, yaitu 91.21% dan 91.87% untuk kelinci New Zealand White serta 90.85% dan 91.61% untuk kelinci Californian. Perbedaan persentase normalitas setiap peneliti dapat disebabkan karena perbedaan dalam teknik koleksi dan penanganan semen, breed, kualitas hewan yang digunakan (Toelihere 1993), perbedaan iklim, heat stress, dan musim (Barth & Oko 1989).
Abnormalitas dianggap serius jika abnormalitas yang ditemukan mencapai 18-20% karena dapat menurunkan fertilitas (Barth & oko 1989).
Persentase abnormalitas spermatozoa yang ditemukan pada kedua breed
kelinci kurang dari 20%. Hasil ini menunjukkan bahwa kelinci yang digunakan secara umum memiliki kualitas spermatozoa yang baik karena kelinci mendapatkan manajemen pakan dan pemeliharaan yang baik. Koleksi semen menggunakan vagina buatan pada hewan yang belum terbiasa juga dapat meningkatkan abnormalitas spermatozoa yang terjadi (Arifiantini & Ferdian 2004). Nilai abnormalitas spermatozoa primer yang tinggi dapat juga dipengaruhi oleh umur. Hewan tua cenderung memiliki abnormalitas yang lebih rendah dibandingkan dengan hewan muda (Padrik & Jaakma 2002).
Keutuhan Membran Plasma Spermatozoa
Pengujian membran plasma utuh (MPU) spermatozoa bertujuan untuk mengetahui kualitas spermatozoa (Lodhi et al. 2008). Pengujian ini perlu dilakukan mengingat fungsi membran plasma yang sangat penting. Membran plasma spermatozoa berfungsi sebagai pelindung organel-organel sel spermatozoa terhadap perubahan lingkungan, mengatur keluar masuknya za-zat makanan dan ion-ion yang diperlukan dalam proses metabolisme, menjaga keseimbangan elektrolit intra dan ekstraseluler, serta menjaga intergritas biokimia dan struktur spermatozoa (Pinto & Kozink 2008; Amorim et al. 2009). Spermatozoa dengan MPU menunjukkan kebengkokan ekor (coil) saat berada dalam larutan hipoosmotik.
Pengujian MPU pada spermatozoa kelinci Lop dan Rex dilakukan dengan menggunakan larutan bertekanan 50 mOsm/kg (TO50), 100 mOsm/kg (TO100), dan 150 mOsm/kg (TO150) pada suhu 37ºC selama satu jam dan diamati setiap 15 menit (Tabel 5). Pemilihan larutan hipoosmotik yang digunakan disesuaikan dengan tekanan osmotik semen kelinci yang diperoleh. Tekanan osmotik semen kelinci Lop adalah 300, 300, dan 320 mOsm/kg, sedangkan tekanan osmotik semen kelinci Rex adalah 270, 290, dan 300 mOsm/kg.
Pada awal pemeriksaan, yaitu pada menit ke-0, persentase spermatozoa coil
29
belum banyak spermatozoa yang bereaksi terhadap larutan hipoosmotik. Hal ini berkaitan dengan plasma semen yang memberikan efek stabil pada spermatozoa (Setiadi et al. 2006) sehingga reaksi berjalan lambat. Pengencer atau krioprotektan pada semen beku dan cair juga memberikan kestabilan pada spermatozoa di awal pemeriksaan (Rusiyantono 2008).
Tabel 5 MPU semen segar kelinci Lop dan Rex pada beberapa tekanan osmotik yang diinkubasi selama 1 jam (%)
Tekanan Ras
Masa inkubasi (menit ke-)
0 15 30 45 60
50 mOsm/kg
Lop 22.42±13.73b 32.09±19.05b 55.03±9.29a 35.02±4.51a,b 32.28±2.43b Rex 25.99±7.45b 69.77±32.89a 59.52±13.44a 48.63±6.40a,b 37.52±7.99a,b 100
mOsm/kg
Lop 23.36±5.58b 26.33±5.68b 32.82±3.18b 46.29±5.51 a 44.35±4.96 a Rex 24.88±9.02b 35.15±18.68a,b 60.16±22.13a 44.18±8.39a,b 39.79±8.47a,b 150
mOsm/kg
Lop 18.58±9.22 25.82±7.83 27.37±12.17 36.70±21.25 29.33±13.19 Rex 14.50±14.40 34.12±31.07 25.86±5.42 19.83±2.29 16.47±2.97 Superskrip dengan notasi berbeda menyatakan perbedaan yang nyata (p<0.05)
Saat terpapar larutan hipoosmotik, spermatozoa yang memiliki tekanan osmotik lebih tinggi (hiperosmotik) akan bereaksi terhadap larutan untuk mempertahankan fungsi normalnya. Spermatozoa akan menunjukkan kemampuannya dalam mengatur volume sel, terutama regulatory volume increase
(RVI) (Petrunkina et al. 2005). Kemampuan spermatozoa untuk mengatur volume sel didapatkan saat spermatozoa berada dalam epididimis (Yeung et al. 2004). Kegagalan untuk mengatur volume sel dalam keadaan fisiologis dapat menjadi salah satu sumber infertilitas (Yeung et al. 2006).
hipoosmotik. Proses tersebut terus berlangsung hingga tercapai keseimbangan antara kompartemen dalam spermatozoa dengan lingkungan ekstraseluler.
Gambar 13 Respon spermatozoa (coil) saat terpapar larutan hipoosmotik (tanda panah).
Dalam TO50, spermatozoa kelinci Lop mengalami coil dari menit ke-0 hingga menit ke-30, lalu mengalami penurunan pada menit berikutnya. Pada menit ke-30, persentase spermatozoa coil mencapai 55.03±9.29%, berbeda (P<0.05) dengan menit sebelumnya (Gambar 14). Hasil ini menunjukkan bahwa pemeriksaan MPU spermatozoa kelinci Lop dalam TO50, sebaiknya dilakukan pada menit ke-0 hingga menit ke-30 dan optimal dilakukan pada menit ke-30. Hal berbeda ditunjukkan oleh spermatozoa kelinci Rex, kenaikan persentase spermatozoa coil hanya terjadi hingga menit ke-15, yaitu mencapai 69.77±32.89%, lalu mengalami penurunan hingga menit ke-60 (Gambar 14). Hasil ini menunjukkan bahwa pemeriksaan MPU spermatozoa kelinci Rex dalam TO50 sebaiknya dilakukan pada menit ke-0 hingga menit ke-15, dengan hasil optimal pada menit ke-15 (Tabel 6).
31
menit ke-45 (Gambar 15 dan 16). Hasil ini menunjukkan bahwa pemeriksaan MPU spermatozoa kelinci Rex sebaiknya dilakukan pada menit ke-0 hingga menit ke-30 dengan waktu optimal pada menit ke-30 (TO100) dan pada menit ke-15 (TO100), sedangkan kelinci Lop sebaiknya diperiksa pada menit ke-0 hingga menit ke-45 dengan waktu optimal pada menit ke-45 dalam TO100 dan TO150 (Tabel 6).
Gambar 14 Diagram persentase spermatozoa coil kelinci Lop dan Rex dalam larutan bertekanan 50 mOsm/kg.
Gambar 16 Diagram persentase spermatozoa coil kelinci Lop dan Rex dalam larutan bertekanan 150 mOsm/kg.
Perbedaan waktu yang diperlukan spermatozoa kelinci Lop dan Rex untuk mencapai puncak persentase coil sangat bergantung pada kondisi membran plasma spermatozoa (Herdis et al. 2004). Struktur membran plasma spermatozoa yang dimiliki kelinci Rex diduga lebih tipis dibandingkan kelinci Lop, sehingga kelinci Rex selalu mencapai puncak coil lebih cepat dibandingkan kelinci Lop. Faktor lain yang mempengaruhi hasil ini adalah cairan dari kelenjar asesoris yang membentuk plasma semen. Cairan ini diduga bertanggung jawab terhadap kestabilan membran plasma spermatozoa ejakulat yang diperlihatkan dengan lebih banyaknya MPU (Setiadi et al. 2006).
Tabel 6 Waktu optimal pengujian MPU semen segar kelinci Lop dan Rex pada beberapa larutan hipoosmotik
Larutan Hipoosmotik
Menit ke-
Lop Rex
50 mOsm/kg 30’ 15’
100 mOsm/kg 45’ 30’
150 mOsm/kg 45’ 15’
33
gerakan massa, motilitas, konsentrasi, total spermatozoa utuh (Prasad et al. 1999), dan tingkat fertilitas individual (Jayendran et al. 1984). Hasil HOS test juga berhubungan dengan viabilitas dan morfologi spermatozoa normal (Jayendran et al. 1984; Mantovani et al. 2002; Fonseca et al. 2005).
Semen segar kelinci Rex memiliki gerakan massa, motilitas, konsentrasi, viabilitas, dan morfologi spermatozoa normal lebih tinggi dibandingkan semen segar kelinci Lop. Hasil ini berkorelasi positif dengan hasil MPU yang menunjukkan bahwa spermatozoa kelinci Rex juga memperoleh persentase MPU yang lebih tinggi dibandingkan kelinci Lop.
Keutuhan membran plasma juga berkorelasi positif dengan motilitas spermatozoa (Hashinuma & Sekine 2003; Yu & Leibo 2002). Korelasi ini menunjukkan kemampuan spermatozoa untuk hidup. Akan tetapi, kualitas membran plasma spermatozoa dapat tetap dipertahankan meskipun motilitas menurun secara drastis, yaitu dengan menambahkan bahan pengencer yang tepat (Setiadi et al. 2006). Setiadi et al. (2006) menduga krioprotektan yang terdapat dalam bahan pengencer ikut berperan dalam mempertahankan keutuhan membran plasma tersebut.
Setelah mencapai puncak persentase coil, terjadi penurunan pada pemeriksaan di menit berikutnya. Secara fisiologis, penurunan persentase ini terjadi karena spermatozoa berusaha menurunkan volumenya kembali akibat kebengkakan yang terjadi. Spermatozoa akan meningkatkan kemampuannya untuk melakukan regulatory volume decrease (RVD), proses ini akan menyebabkan ekor spermatozoa lurus kembali (Petrunkina et al. 2004).
mulai kehilangan motilitas dan keutuhan akrosom yang pada akhirnya dapat menyebabkan kematian spermatozoa (Iguer-ouada & Verstegen 2001; Yu & Leibo 2002; Yulnawati & Setiadi 2005).
SIMPULAN DAN SARAN
Simpulan
1. Kelinci Lop memiliki karakteristik semen dengan volume 0.47 ml, berwarna putih-krem, konsistensi encer-kental, pH 7.28, gerakan massa 2.33, motilitas 40%, skor individu 3.67, konsentrasi 123.89 x 106/mL, dan viabilitas 47.94%, sedangkan karakteristik semen kelinci Rex adalah volume 0.44 ml, berwarna putih-krem, konsistensi encer-kental, pH 7.38, gerakan massa 2.67, motilitas 61.67%, skor individu 4, konsentrasi 280.56 x 106/mL, dan viabilitas 61.40%. 2. Abnormalitas spermatozoa yang ditemukan pada kelinci Lop dan Rex adalah
12.07 dan 8.74%.
3. Pengujian optimal terhadap keutuhan membran plasma spermatozoa kelinci Rex adalah 15-30 dan Lop adalah 30-45 menit inkubasi.
Saran
1. Perlu dilakukan penelitian lebih lanjut mengenai pengenceran dan pembekuan semen kelinci serta inseminasi buatan (IB) pada kedua breed kelinci untuk mengetahui efektifitas IB pada kelinci.
DAFTAR PUSTAKA
Adelman MM, Cahill EM. 1989. Atlas Sperm Morphology. Chicago, Illinois: ASCP Pr.
Alvarino JMR. 2000. Reproductive performance of male rabbits. In Proc. 7th World Rabbit Congress, July 2000, Valencia, Spain, A: 13-35.
Amorim EAM, Torres CAA, Graham JK, Amorim LS, Santos LVL. 2009. The hypoosmotic swelling test in fresh rabbit spermatozoa. Anim. Reprod. Sci.
111: 338-343.
Arifiantini RI, Purwantara B, Putra WW. 1999. Pengujian keutuhan membran plasma spermatozoa semen cair domba menggunakan larutan hipoosmotik. Prosiding Seminar Hasil-Hasil Penelitian Bidang Ilmu Hayat. Pusat Antar Universitas Ilmu Hayat IPB.
Arifiantini RI, Ferdian F. 2004. Tinjauan aspek morfologi dan morfometri spermatozoa kerbau rawa (Bubalus bubalis) yang dikoleksi dengan teknik masase. J. Vet. FKH Udayana 7: 83-91.
Barth AD, Oko RJ. 1989. Abnormal Morphology of Bovine Spermatozoa. Iowa: Iowa State University Pr.
Bloom. 1968. A new sperm defect pseudo droplets in the middle piece of the bull sperm. Nord. Vet. Med. 20: 270-288.
Brun JM, Theau-Clément M, Bolet G. 2002. The relationship between rabbit semen characteristics and reproductive performance after artificial insemination. Anim. Reprod. Sci. 70: 139-149.
Cabrita E, Alvarez R, Anel E, Herr´aez MP. 1999. The hypoosmotic swelling test performed with counter: a method to assay functional integrity of sperm membrane in rainbow trout. Anim. Reprod. Sci. 55: 279-287.
Carluccio A, Robbe D, De Amicis I, Contri A, Tosi U, Russo F, Paoletti M. 2004. Artificial insemination in rabbits: Laboratory and field trail with three different semen extenders. World Rabbit Sci. 12: 65-79.
Chenoweth PJ. 2005. Genetic sperm defect. Theriogenology 64: 457-468.
Correa JR, Zavos PM. 1994. The hypoosmotic swelling test: its employement as an assay to evaluated the functional integrity of the frozen-thawed bovine sperm membrane. Theriogenology 42: 351-360.
Daader AH, Seleem TST. 2005. Response of spermatozoa of different breeds of rabbits to hypo-osmotic swelling test. In Proc.: The 4 th. Inter. Con. on Rabbit Prod. in Hot Clim., Sharm El-Sheikh, Egypt, 177-181.
El-Haekam AA, El-Moty AKI, El-Bogdady AH, Hassanein HH. 1992. Some physical characteristics of rabbit semen as a affected by breed, lighting systems, and ejaculation sequences. Egypt J. Rabbit Sci. 2(1): 33-37.
37
Fonseca JF, Torres CAA, Maffili VV, Borges AM, Santos ADF, Rodrigues MT, Oliviera RMF. 2005. The hypoosmotic swelling test in fresh goat spermatozoa. Anim. Reprod. 2(2): 139-144.
Freshman JL. 2002. Semen collection and evaluation. Clin. Tech. in Small Pract.
17(3): 104-107.
Garcia-Tomas M, Sanchez J, Refael O, Ramon J, Piles M. 2006. Variability, repeatability, and phenotypic relationships of several characteristics of production and semen quality in rabbit. Anim. Reprod. Sci. 93: 88-100. Garner DL, Hafez ESE. 2000. Spermatozoa and Seminal Plasma. In: Hafez B and
ESE Hafez, editor. Reproduction in Farm Animal, 7th ed. USA: Williams and Wikins.
Hashinuma M, Sekine J. 2003. Evaluation of membrane integrity of canine epididymal spermatozoa by short hypoosmotic swelling test with ultrapure water. J. Vet. Med. Sci. 65(7): 817-820.
Herdis, Rizal M, Boediono A. 2004. Daya hidup sperma epididimis domba setelah disimpan pada suhu rendah (5ºC). J. Anim. Prod. 6(1): 30-36.
Iguer-ouada M, Verstegen JP. 2001. Long term preservation of chilled canine semen: effect of commercial and laboratory prepared extenders.
Theriogenology 55(2): 671-684.
Jayendran RS, Vander-Ven HH, Perez-Pelaez M, Crabo BG, Zanevld LJD. 1984. DeveLopment of an assay to assess the functional integrity of the human sperm membrane and its relationship to other semen characters. J. Reprod. Fertil 70: 219-228.
Johnson LA, Weitze KF, Fiser P, Maxwell WMC. 2000. Storage of boar semen. J. Anim. Sci. 62: 143-172.
Kale MM, Manik RS, Tomer OS. 2000. In vitro assessment of crossbreed buck fertility. Indian J. Anim. Sci. 70: 25-29.
Lavara R, Mocé E, Lavara F, Viudes de Castro M, Vicente J. 2005. Do parameters of seminal quality correlate with the results of on- farm inseminations in rabbits? Theriogenology 64: 1130-1141.
Lodhi LA, Zubair M, Qureshi ZI, Ahmad I, Jamil H. 2008. Correlation between hypoosmotic swelling test and various conventional semen evaluation parameters in fresh Nili-Ravi buffalo and Sahiwal cow bull semen. Pakistan Vet. J. 28(4): 186-188.
Mantovani R, Rota A, Falomo ME, Bailoni L, Vincenti L. 2002. Comparison between glycerol and ethylene glycol for the cryopreservation of equine spermatozoa: semen quality assessment with standard analyses and with the hypoosmotic swelling test. Reprod. Nutr. Dev. 42: 217-226.
McGowan M, Galloway D, Taylor E, Entwistle K, Johnston P. 1995.
McIntosh GB. 1990. Pig AI; The Technique. Farm Note, Queensland Department of Primary Industry.
Mocé E, Vicente JS, Lavara F, Lavara R, Marco-Jiménez F. 2004. Different in the response of the spermatozoa from three rabbit linesto the Hypo-Osmotic Swelling Test. Reprod. in Dom. Anim. 39(4): 265.
Moghadam KK, Nett R, Robin JC, Thomas MA, Awadalla SG, Scheiber MD, Williams DB. 2005. The motility of epididymal or testicular spermatozoa does not directly affect IVF/ICSI pregnancy outcomes. J. Androl. 26(5): 619-623.
Neild D, Chaves G, Flores M, Mora N, Beconi M, Aguero A. 1999. Hypoosmotic test in equine spermatozoa. Theriogenology 51: 721-727.
Ogbuewu IP, Okoli IC, Iloeje MU. 2009. Semen Quality characteristics, reaction time, testis weight, and seminiferous tubule diameter of buck rabbit fed neem (Azadirachta Indica A. Juss) leaf meal based diets. Iranian J. of Reprod. Med. 7(1): 23-28.
Padrik P, Jaakma U. 2002. Sperm morphology in Estonian Holstein dairy bulls, factors affecting it and relation to fertility. Agraarteadus 13: 243-56.
Petrunkina AM, Harrison RAP, Ekhlasi-Hundrieser M, To¨pfer-Petersen E. 2004. The role of volume-sensitive osmolyte and anion channels in volume regulation by mammalian spermatozoa. Mol. Hum. Reprod. 10: 815-823. Petrunkina AM, Jebe E, To¨pfer-Petersen E. 2005. Regulatory and necrotic
volume increase in boar spermatozoa. J. of Cell. Phys. 204: 508-521.
Pinto CRF, Kozink DM. 2008. Simplified hypoosmotic swelling testing (HOST) of fresh and frozen-thawed canine spermatozoa. Anim. Reprod. Sci. 104: 450-455.
Prasad JK, Kumar S, Mohan G, Shanker U, Agarwal SK. 1999. Hypo-osmotic swelling test (HOST) and its response in fresh and freeze-thawed semen.
Indian J. Anim. Sci. 69: 766-769.
Rodríguez-Martínez H. 2003. Laboratory semen assessment and prediction of fertility: still utopia. Reprod. Dom. Anim. 38: 312-318.
Rusiyantono Y. 2008. Penambahan bahan krioprotektan dalam bahan pengencer pembuatan semen beku melalui teknologi sederhana dalam menunjang pelaksanaan IB di daerah. Prosiding seminar sapi potong.
Saacke RG. 2008. Sperm morphology: Its relevance to compensable and uncompressible traits in semen. Theriogenology 70: 473-478.
Safaah M, Vicente JS, Lavara R, Viudes de Castro MP. 2008. Semen evaluation of two selected lines of rabbit bucks. World rabbit sci. 16: 141-148.
Sankai T, Tsuchiya H, Ogonuki N. 2002. Shortterm nonfrozen storage of mouse epididymal spermatozoa. Theriogenology 55(8): 1759-1768.
39
Sarwono B. 2001. Kelinci potong dan Hias. Jakarta: Agromedia Pustaka.
Schatten H, Gheorghe M. 2007. Comparative Reproductive Biology. Iowa, USA: Blackwell Pub.
Setiadi MA, Suprayogi A, Yulnawati. 2006. Viabilitas dan integritas membran plasma spermatozoa epididimis anjing selama penyimpanan pada pengencer yang berbeda. Media Kedokteran Hewan 22(2): 118-123.
Shimomura K, Sakurai K, Shimada K, Hagiwara M, Kato M, Furuhara K. 2008. Occurance of headless sperms in adolescent rat urine. Lab. anim. 42: 204-212.
Silva PFN, Gadella BM. 2006. Detection of damage in mammalian sperm cells.
Theriogenology 65: 958-978.
Thundathil J, Meyer R, Palasz AT, Barth AD, Mapletoft RJ. 2000. Effect of the knobbed acrosome defect in bovine sperm on IVF and embryo production.
Theriogenology 54: 921-34.
Toelihere. 1993. Inseminasi Buatan Pada Ternak. Bandung: Angkasa.
Togun VA, Egbunike GN. 2006. Seasonal variations in the sperm production characteristics of Zebu (White fulani) cattle genitalia in the humid tropical environment. Middle-East J. Sci. Res. 1: 87-95.
Yeung CH, Anapolski M, Setiawan I, Lang F, Cooper TG. 2004. Effectsof putative epididymal osmolytes on sperm volume regulation of fertile and infertile c-ros transgenic mice. J. Androl. 25: 216-223.
Yeung CH, Barfield JP, Cooper TG. 2006. Physiological volume regulation by spermatozoa. Mol. and Cell. Endocrin. 250: 98-105.
Yu I, Leibo SP. 2002. Recovery motile, membrane intact spermatozoa from canine epididymides stores for 8 day at 4ºC. Theriogenology 57(3): 1179-1190.
Yulnawati, Setiadi MA. 2005. Motilitas dan Keutuhan Membran Plasma Spermatozoa Epididimis Kucing Selama Penyimpanan Pada Suhu 4° C.
Media Kedokteran Hewan 21(3).
Zou CX, Yang ZM. 2000. Evaluation on sperm quality of freshly ejaculated boar semen during in vitro storage under different temperatures. Theriogenology