PENGUJIAN KOMPATIBILITAS
ANTARA MIKROBA PELARUT FOSFAT ASAL TANAH
PAKU HAJI TANGERANG DENGAN TANAMAN KEDELAI
(Glycine max (L.) Merr) VARIETAS WILIS
NOVI PRASTYOWATI
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
PENGUJIAN KOMPATIBILITAS
ANTARA MIKROBA PELARUT FOSFAT ASAL TANAH
PAKU HAJI TANGERANG DENGAN TANAMAN KEDELAI
(Glycine max (L.) Merr) VARIETAS WILIS
SKRIPSI
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains Pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
NOVI PRASTYOWATI 104095003065
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
PENGUJIAN KOMPATIBILITAS
ANTARA MIKROBA PELARUT FOSFAT ASAL TANAH PAKU HAJI TANGERANG DENGAN TANAMAN KEDELAI
(Glycine max (L.) Merr) VARIETAS WILIS
SKRIPSI
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains Pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
NOVI PRASTYOWATI 104095003065
Menyetujui,
Pembimbing I Pembimbing II
Megga Ratnasari Pikoli, M.Si Dasumiati, M.Si NIP : 150 321 587 NIP : 150 293 237
Mengetahui:
Ketua Program Studi Biologi Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta
PENGESAHAN UJIAN
Skripsi berjudul “Pengujian Kompatibilitas Antara Mikroba Pelarut Fosfat Asal Tanah Paku Haji Tangerang Dengan Tanaman Kedelai (Glycine max (L.) Merr) Varietas Wilis” yang ditulis oleh Novi Prastyowati, NIM 104095003065 telah diuji dan dinyatakan LULUS dalam Munaqosyah Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta pada tanggal 5 Desember 2008. Skripsi ini telah diterima sebagai salah satu syarat untuk memperoleh gelar sarjana strata satu (S1) Program Studi Biologi.
Menyetujui,
Penguji I Penguji II
Dra. Nani Radiastuti, M. Si DR. Lily Surayya E.P, M.Env. Stud NIP. 150 318 610 NIP. 150 375 182
Pembimbing I Pembimbing II
Megga Ratnasari Pikoli, M.Si Dasumiati, M.Si
NIP. 150 321 587 NIP. 150 293 237
Mengetahui,
Dekan Ketua Prodi Biologi
Fakultas Sains dan Teknologi
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI BENAR-BENAR HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN.
Ciputat, Desember 2008
ABSTRAK
Novi Prastyowati. Pengujian Kompatibilitas Antara Mikroba Pelarut Fosfat Asal Tanah Paku Haji Tangerang Dengan Tanaman Kedelai (Glycine max (L.) Merr) Varietas Wilis. Skripsi : Program Studi Biologi. Fakultas Sains dan Teknologi. Universitas Islam Negeri Syarif Hidayatullah, Jakarta. 2008.
Telah dilakukan penelitian untuk mengetahui kompatibilitas isolat mikroba pelarut fosfat dengan tanaman kedelai varietas Wilis. Pada penelitian ini digunakan isolat bakteri pelarut fosfat (PH3-1B, PH4-3B, dan PH5-2B) dan isolat fungi pelarut fosfat (PH1-3F, PH1-4F dan PH5-5F) yang diisolasi dari sampel tanah Paku Haji. Rancangan yang digunakan adalah rancangan acak lengkap (RAL) yang terdiri dari perlakuan inokulasi mikroba pelarut fosfat tersebut pada akar dan biji tanaman kedelai varietas Wilis. Pengamatan pertumbuhan dilakukan sejak perkecambahan sampai terbentuknya bunga. Hasil penelitian menunjukkan bahwa inokulasi PH4-3B pada benih berpeluang meningkatkan tinggi, jumlah daun dan berat kering tanaman kedelai, sedangkan inokulasi PH5-2B berpeluang meningkatkan lebar daun. Inokulasi fungi pelarut fosfat tidak efektif untuk meningkatkan pertumbuhan tanaman kedelai. Isolat mikroba pelarut fosfat asal Paku Haji yang kompatibel terhadap tanaman kedelai varietas Wilis adalah PH4-3B, PH5-2B, PH1-3F dan PH5-5F. Aplikasi terbaik untuk menginokulasi mikroba pelarut fosfat pada tanaman kedelai adalah melalui benih.
ABSTRACT
Novi Prastyowati. Assesment of Compatibility Between Phosphate Solubilizing Microbe From Paku Haji Tangerang With Wilis Variety of Soy (Glycine max (L.) Merr) Plant. Thesis. Biology Departement. Faculty of Science and Technology. State Islamic University Syarif Hidayatullah, Jakarta. 2008.
Compatibility assessment between phosphate solubilizing microbe with Wilis variety of soy plant had been conducted. In this research the isolates assessed were phosphate solubilizing bacteria (PH3-1B, PH4-3B and PH5-2B) and phosphate solubilizing fungi (PH1-3F, PH1-4F and PH5-5F) from Paku Haji Soil Tangerang. The experiment was arranged in randomized completed design (RAL) consisted of phosphate solubilizing microbe inoculation into root and seed Wilis variety of soy plant. Plant growth was observed in the time of germination until flowering. The Results showed that isolate PH4-3B inoculated into seed had chance to increase height, quantity and dry weight of soy, whereas inoculation PH5-2B had chance to increase leaf width. Inoculation of phosphate solubilizing fungi was not as effective as bacteria in increasing the growth of soy plant. Therefore Phosphate solubilizing microbes from Paku Haji soil whose compatibilities with Wilis variety of soy plant were PH4-3B and PH5-2B. The best application of solubilizing microbe to inoculation into soy plant was through the seed.
KATA PENGANTAR
Segala puji bagi Allah SWT yang telah memberikan rahmat dan karunianya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Pengujian Kompatibilitas Tanaman Kedelai (Glycine max
(L.) Merr) Varietas Wilis Dengan Isolat Mikroba Pelarut Fosfat Asal Tanah Paku Haji Tangerang” . Shalawat serta salam semoga tercurahkan kepada Nabi Muhammad SAW.
Skripsi ini disusun untuk memenuhi salah satu syarat untuk memperoleh gelar sarjana sains pada Program Studi Biologi Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta. Dalam penyusunan skripsi ini, penulis mengucapkan terima kasih kepada:
1. Ibu Megga Ratnasari Pikoli, M.Si selaku pembimbing I dan Ibu Dasumiati, M.Si selaku Pembimbing II yang telah begitu banyak memberikan nasihat dan masukan materi selama melaksanakan penelitian hingga selesainya skripsi ini.
2. DR. Syopiansyah Jaya Putra, M.Si, selaku Dekan Fakultas Sains dan Teknologi, Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. DR. Lily Surayya E.P, M. Env. Stud, selaku Ketua Program Studi Biologi Fakultas Sains dan Teknologi.
4. Ibu Dra Nani Radiastuti, M.Si selaku penguji I dan Ibu Priyanti, M.Si selaku penguji II yang telah memberikan saran dan kritik.
5. Laboran Laboratorium Biologi (Mba Dian, Mba Ida, Mba Puji dan Ka Bahri) yang telah banyak memberikan bantuan kepada penulis.
6. Pak Junaidi dan Bang Iping atas bantuan dan sarannya selama penelitian di kebun agri.
7. Kedua orang tua, adik dan seluruh keluarga yang telah memberi kasih sayang, semangat dan dukungannya sehingga penulis dapat menyelesaikan skripsi ini.
semangatmu selalu mengiringi sehingga penulis dapat menepati janji untuk menyelesaikan skripsi ini.
9. Teman-teman seperjuangan di Laboratorium Mikrobiologi (Sarah, Ayu, Neni, Eva, Tya, Vana dan Din) yang telah berbagi suka dan duka selama penelitian.
10.Jun, Sofiah, Alfian, Ofi dan Ridho atas bantuannya sehingga skripsi ini dapat selesai.
11.Seluruh teman-teman biologi angkatan 2004, terima kasih atas pengalaman hidup selama menjadi bagian dari keluarga besar ini.
12.Mutiara dan keluarga atas bantuan dan semangatnya yang selalu menemani penulis selama penyusunan skripsi ini.
13.Teman-teman Pondok Tiara (Barkah, Imas, Yana, Tari, Ida, Ami dan Apsah) atas semangatnya kepada penulis.
14.Seluruh pihak yang telah membantu selesainya skripsi ini.
Penulis berharap semoga skripsi ini dapat bermanfaat bagi penulis sendiri dan juga bagi pembaca. Pada kesempatan ini penulis menyampaikan permohonan maaf yang sebesar-besarnya atas kekurangan yang masih ada. Oleh karena itu, saran dan kritik yang membangun penulis harapkan untuk masa yang akan datang.
Ciputat, 5 Desember 2008
DAFTAR ISI
2.5. Fosfat dan Mekanisme Penyerapan Fosfat ... 11
2.6. Interaksi Mikroba Tanah Dengan Akar Tanaman ... 14
2.7. Tanaman Kedelai ... 16
2.7.1. Sistematika dan Morfologi Kedelai ... 16
2.7.2. Syarat Tumbuh Tanaman Kedelai ... 17
2.7.4. Nilai Gizi dan Peran Kedelai ... 19
BAB III METODOLOGI PENELITIAN 3.1. Waktu dan Tempat ... 21
3.2. Bahan dan Alat ... 21
3.3. Cara Kerja ... 22
3.3.1. Pembuatan Inokulum Bakteri Pelarut Fosfat (BPF) ... 22
3.3.2. Inokulasi Benih dan Akar... 26
3.3.3. Penanaman Kedelai ... 27
3.4. Analisis Data ... 29
BAB IV HASIL DAN PEMBAHASAN 4.1. Morfologi BPF dengan Pewarnaan Gram ... 31
4.2. Kurva Pertumbuhan BPF ... 33
4.4. Inokulum Isolat Fungi ... 36
4.3. Pertumbuhan Kedelai Dengan Inokulasi BPF Pada Benih ... 37
4.4. Pertumbuhan Kedelai Dengan Inokulasi FPF Pada Benih ... 43
4.5. Pertumbuhan Kedelai Dengan Inokulasi BPF Pada Akar ... 49
4.6. Pertumbuhan Kedelai Dengan Inokulasi FPF Pada Akar ... 53
4.7. Perbandingan Pertumbuhan Kedelai Inokulasi MPF Pada Akar dan Benih ... 54
4.8. Penentuan Mikroba Pelarut Fosfat Terbaik ... 55
BAB V KESIMPULAN DAN SARAN 5. 1. Kesimpulan ... 56
5. 2. Saran ... 56
DAFTAR PUSTAKA ... 57
DAFTAR TABEL
Halaman
Tabel 1. Waktu dan Kecepatan Pertumbuhan Isolat PH3-1B ... 33 Tabel 2. Waktu dan Kecepatan Pertumbuhan Isolat PH4-3B ... 34 Tabel 3. Waktu dan Kecepatan Pertumbuhan Isolat PH5-2B ... 35
DAFTAR GAMBAR
Gambar 5. Kurva Pertumbuhan Isolat Bakteri PH5-2B ... 34
Gambar 6. Kurva Pertumbuhan Isolat Bakteri PH4-3B ... 35
Gambar 7. Rata-rata Tinggi Tanaman Kedelai Dengan Inokulasi BPF Pada Benih ... 38
Gambar 8. Rata-rata Jumlah Daun Tanaman Kedelai Dengan Inokulasi BPF Pada Benih ... 39
Gambar 9. Rata-rata Lebar Daun Tanaman Kedelai Dengan Inokulasi BPF Pada Benih ... 40
Gambar 10. Berat Kering Tanaman Kedelai Varietas Wilis dengan Inokulasi Bakteri Pelarut Fosfat ... 41
Gambar 11. Rata-rata Tinggi Tanaman Kedelai Dengan Inokulasi FPF Pada Benih ... 44
Gambar 12. Rata-rata Jumlah Daun Tanaman Kedelai Dengan Inokulasi FPF Pada Benih ... 45
Gambar 13. Rata-rata Lebar Daun Tanaman Kedelai Dengan Inokulasi FPF Pada Benih ... 46
Gambar 14. Berat Kering Tanaman Kedelai Varietas Wilis dengan Inokulasi Fungi Pelarut Fosfat ... 48
Gambar 15. Tinggi Tanaman Kedelai Setelah Inokulasi BPF Pada Akar ... 50
Gambar 16. Jumlah Daun Tanaman Kedelai Setelah Inokulasi BPF Pada Akar ... 51
Gambar 17. Lebar Daun Tanaman Kedelai Setelah Inokulasi BPF Pada Akar ... 52
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Bagan Alir Penelitian ... 61
Lampiran 2. Denah Sampel Penelitian ... 62
Lampiran 3. Isolat Mikroba Pelarut Fosfat ... 63
Lampiran 4. Nilai Jumlah Sel dan Absorbansi Isolat Mikroba Pelarut Fosfat ... 64
Lampiran 5. Kurva Standar BPF ... 65
Lampiran 6. Perkecambahan Tanaman Kedelai Dengan Inokulasi Mikroba Pelarut Fosfat Pada Benih... 66
Lampiran 7. Pengamatan Pertumbuhan Tanaman Kedelai Setelah Inokulasi Pada Akar ... 67
Lampiran 8. Pengamatan Parameter Fisik di Rumah Kaca ... 68
Lampiran 9. Pertumbuhan Tanaman Kedelai ... 69
BAB I PENDAHULUAN
1.1. Latar Belakang
Tanaman kedelai telah lama dibudidayakan di Indonesia. Beberapa
varietas lokal yang banyak ditanam oleh petani adalah varietas Wilis, Anjasmoro,
Burangrang dan Kaba (Ikawati, 2008). Keunggulan varietas Wilis adalah lebih
toleran terhadap lingkungan yang berdrainase kurang dan lebih tahan terhadap
penyakit, seperti karat dan layu. Varietas ini juga dapat hidup pada lahan kering
dan tanah masam (Sofia, 2007).
Kedelai merupakan salah satu sumber gizi protein utama. Hasil olahan
kedelai dapat menghasilkan berbagai macam produk yang disukai oleh
masyarakat, seperti tempe, tahu, tepung dan minyak. Kebutuhan kedelai
meningkat tiap tahun sejalan dengan meningkatnya pertumbuhan penduduk.
Kebutuhan nasional akan kedelai diperkirakan sebanyak 2,25 juta ton per tahun
dan baru tercukupi sebanyak 650 ribu ton per tahun. Kondisi seperti ini,
pemerintah harus mengimpor kedelai dari Amerika Serikat dan negara-negara
Amerika Latin, jumlahnya sekitar 60% untuk mencukupi kebutuhan dalam negeri
(Kasno, 2008). Namun produksi kedelai dunia yang terus menurun menyebabkan
harga kedelai di pasar internasional naik. Keadaan ini mengakibatkan harga
kedelai nasional mahal (Nasution, 2008). Oleh karena itu, peningkatan
produktivitas tanaman kedelai perlu dilakukan agar kebutuhan kedelai nasional
Kendala utama dalam peningkatan produktivitas tanaman kedelai adalah
semakin sempitnya lahan subur akibat pengubahan lahan pertanian menjadi non
pertanian dan sebagian tanah di Jawa adalah tanah marginal. Kendala yang
dihadapi tanah marginal adalah kemasaman tanah yang dapat mengakibatkan
pengikatan fosfat (Sofia, 2007).
Unsur fosfor (P) adalah unsur esensial kedua setelah nitrogen (N) yang
berperan penting dalam fotosintesis dan perkembangan akar. Pada tanah masam
fosfat akan berikatan dengan alumunium membentuk Al-P, sedangkan pada tanah
alkali fosfat akan berikatan dengan kalsium membentuk Ca-P yang sukar larut.
Adanya pengikatan fosfat tersebut menyebabkan pemberian pupuk menjadi tidak
efisien (Hardjowigeno, 1992).
Sebagian besar petani di Indonesia menggunakan pupuk kimia. Keadaan
ini dapat membahayakan lingkungan karena pupuk kimia sulit diuraikan air.
Pupuk kimia juga mengandung radikal bebas yang berbahaya bagi manusia karena
mengendap di dalam buah yang dihasilkan (Saputra, 2003). Penggunaan pupuk
kimia secara berlebihan juga dapat menyebabkan penurunan kadar unsur organik
pada lahan. Akibatnya keberadaan berbagai mikroba tanah semakin terdesak,
sementara keberadaan mikroba sangat diperlukan karena berperan dalam melepas
unsur hara yang dibutuhkan tanaman (Suprapta, 2005).
Salah satu alternatif pengganti pupuk kimia adalah dengan penggunaan
pupuk hayati. Pupuk hayati adalah bahan yang mengandung mikoorganisme hidup
yang mengkolonisasi rhizosfir atau bagian dalam tanaman dan memacu
menstimulus pertumbuhan tanaman target bila dipakai pada benih, permukaan
tanaman atau tanah (FNCA Biofertilizer Project Group, 2006 dalam
Simanungkalit dan Suriadikarta, 2006).
Beberapa mikroba, seperti bakteri dan fungi, memiliki kemampuan untuk
melarutkan fosfat sehingga dapat diserap oleh tanaman, contoh bakteri pelarut
fosfat adalah Bacillus megaterium dan Pseudomonas striata, dan contoh fungi
pelarut fosfat adalah Aspergillus awamori dan Penicillium digitatum (Motsara,
1995). Mikroba ini mengeluarkan asam organik sehingga fosfat yang terikat dapat
larut dan menjadi tersedia bagi tanaman (Ginting dkk., 2006).
Pengggunaan pupuk hayati (termasuk mikroba pelarut fosfat) mampu
meningkatkan ketersediaan hara dan hasil panen berbagai tanaman antara
20-100% serta dapat menekan penggunaan pupuk buatan dan meningkatkan efisiensi
pemupukan (Simarmata, 1995 dalam Latupapua dan Widawati, 2001). Namun,
aspek keamanan agen hayati terhadap tanaman itu sendiri, manusia, hewan dan
lingkungan belum banyak diperhatikan (Supriadi, 2006), sehingga mikroba
pelarut fosfat dapat saja tidak kompatibel terhadap pertumbuhan tanaman.
Kompatibel menurut kamus biologi berarti kecocokan (Yatim, 2003). Oleh karena
itu, perlu dilakukan pengujian untuk mengetahui efek pemberian mikroba pelarut
fosfat terhadap pertumbuhan tanaman kedelai yang diinokulasikan melalui akar
1.2. Perumusan Masalah
Kurang diperhatikannya aspek keamanan terhadap penggunaan agen
hayati menyebabkan penggunaan mikroba pelarut fosfat dapat saja tidak
kompatibel terhadap pertumbuhan tanaman. Permasalahan yang dikaji dalam
penelitian ini adalah:
1. Apakah pemberian isolat mikroba pelarut fosfat asal Paku Haji pada akar dan
benih memiliki kompatibilitas terhadap pertumbuhan tanaman kedelai varietas
Wilis?
2. Apakah isolat mikroba pelarut fosfat dapat diaplikasikan pada akar dan benih
tanaman kedelai varietas Wilis?
1.3. Hipotesis
Hipotesis dari penelitian ini adalah:
1. Isolat mikroba pelarut fosfat asal Paku Haji memiliki kompatibilitas terhadap
pertumbuhan tanaman kedelai varietas Wilis.
2. Isolat mikroba pelarut fosfat dapat diaplikasikan pada akar dan benih tanaman
1.4. Tujuan
Tujuan penelitian ini adalah:
1. Mengetahui isolat mikroba pelarut fosfat asal Paku Haji yang kompatibel
terhadap tanaman kedelai varietas Wilis.
2. Untuk mengetahui cara aplikasi mikroba pelarut fosfat pada tanaman kedelai
varietas Wilis.
1.5. Manfaat
Hasil pengujian ini diharapkan dapat digunakan sebagai informasi untuk
mengembangkan penggunaan isolat mikroba pelarut fosfat dalam meningkatkan
pertumbuhan dan produktivitas tanaman kedelai varietas Willis pada tanah
BAB II
TINJAUAN PUSTAKA
2.1. Pupuk Hayati
Pupuk adalah suatu bahan yang digunakan untuk mengubah sifat fisik,
kimia atau biologi tanah sehingga menjadi lebih baik bagi pertumbuhan tanaman.
Pemupukan adalah penambahan bahan tersebut ke dalam tanah agar tanah
menjadi subur. Usaha pertanian yang dilakukan oleh manusia menyebabkan
proses penghanyutan dan pencucian zat hara dari tanah semakin besar sehingga
tanah menjadi kurang subur (Hardjowigeno, 1992). Hal-hal yang perlu
diperhatikan dalam pemupukan adalah tanaman yang akan dipupuk, jenis tanah
yang akan dipupuk, jenis pupuk yang digunakan, dosis pupuk yang diberikan,
waktu pemupukan dan cara pemupukan (Lakitan, 1999).
Salah satu jenis pupuk yang aman bagi lingkungan adalah pupuk hayati.
Pupuk hayati adalah bahan yang mengandung mikoorganisme hidup yang
mengkolonisasi rhizosfer atau bagian dalam tanaman dan memacu pertumbuhan
dengan jalan meningkatkan pasokan ketersediaan hara primer atau menstimulus
pertumbuhan tanaman target bila dipakai pada benih, permukaan tanaman atau
tanah (FNCA Biofertilizer Project Group, 2006 dalam Simanungkalit dan
Suriadikarta, 2006). Menurut Motsara (1995), pupuk hayati adalah mikroba yang
dapat memfiksasi nitrogen dari atmosfer atau meningkatkan kelarutan nutrien
Mikroba yang digunakan biasanya mampu hidup bersama (simbiosis)
dengan tanaman inangnya. Kedua pihak mendapatkan keuntungan, tanaman inang
mendapatkan tambahan unsur hara yang dibutuhkan, sedangkan mikroba
mendapatkan bahan organik untuk pertumbuhannya. Mikroba yang digunakan
sebagai pupuk hayati dapat diberikan langsung ke dalam tanah, disertakan dalam
pupuk organik atau disalutkan pada benih yang akan ditanam (Isroi, 2007).
Kelebihan penggunaan pupuk hayati adalah untuk meningkatkan produksi
pertanian baik kualitas maupun kuantitas, mengurangi pencemaran lingkungan
dan meningkatkan kualitas lahan secara berkelanjutan. Penggunaan pupuk organik
dalam jangka panjang dapat meningkatkan produktivitas lahan dan dapat
mencegah degradasi lahan. Pupuk hayati juga memiliki fungsi kimia yang
penting, yaitu sebagai penyedia unsur hara makro dan mikro, meningkatkan
kapasitas tukar kation, dan dapat membentuk senyawa kompleks dengan ion
logam yang meracuni tanaman (Simanungkalit dan Suriadikarta, 2006).
2.2. Mikroba Tanah
Tanah sangat kaya akan keanekaragaman miroorganisme, seperti bakteri,
aktinomisetes, fungi, protozoa, alga dan virus. Tanah pertanian yang subur
mengandung lebih dari 100 juta mikroba per gram tanah. Produktivitas dan daya
dukung tanah tergantung pada aktivitas mikroba tersebut. Sebagian besar mikroba
tanah memiliki peranan yang menguntungkan bagi pertanian, yaitu berperan
biologis nitrogen, pelarutan fosfat, merangsang pertumbuhan, biokontrol patogen
dan membantu penyerapan unsur hara (Isroi, 2007).
2.2.1. Bakteri Tanah
Bakteri di dalam tanah bervariasi, tergantung pada kondisi yang
mendukung pertumbuhannya. Umumnya, populasi yang besar terdapat pada
horizon permukaan dengan kondisi suhu, kelembaban, aerasi dan ketersediaan
makanan yang baik. Jumlah bakteri di dalam tanah sangat banyak, mungkin dapat
mencapai 3-4 miliar per gram tanah. Beberapa bakteri tanah seperti dari genus
Alcaligenes, Acinetobacter, Arthrobacter, Azospirillum, Bacillus, Burkholdenia,
Enterobacter, Erwinia, Flavobacterium, Paenibacillus, Pseudomonas,
Rhizobium, dan Serratia dapat digunakan sebagai pupuk hayati atau agen kontrol
untuk meningkatkan pertanian (FNCA Biofertilizer, 2006). Bakteri
membutuhkan mineral dan bahan organik untuk pertumbuhannya. Sebagian besar
bakteri tanah bersifat heterotrof sehingga sumber energi dan karbon berasal dari
bahan organik tanah (Brady and Weil, 2002).
2.2.2. Fungi Tanah
Fungi terbagi menjadi tiga kelompok, yaitu yeast, mold (kapang) dan
mushroom. Namun, hanya mold dan mushroom yang berperan dalam tanah.
Fungi berperan dalam transformasi unsur pokok di dalam tanah dan pembentukan
humus. Fungi tidak mengandung klorofil, sumber energi dan karbon bergantung
individu per gram tanah, tergantung pada kondisi tanah. Faktor penting yang
berhubungan dengan aktivitas fungi adalah ketersediaan makanan. Penambahan
pupuk pada tanah dapat menyebabkan peningkatan pertumbuhan (Brady and
Weil, 2002).
Mold merupakan fungi yang mikroskopik atau semi mikroskopik. Dalam
tanah, peranan mold lebih besar dibandingkan mushroom. Mold berperan dalam
aerasi tanah dan mengurangi pergerakan udara. Mold dapat menurunkan pH
tanah sehingga banyak tedapat pada tanah masam, dimana tidak terlalu banyak
kompetisi dengan bakteri. Mold banyak terdapat pada semua horizon tanah, yang
memiliki bahan organik banyak dan aerasi cukup. Ada empat genera yang umum
ditemukan di dalam tanah, yaitu Penicillium sp., Mucor sp., Trichoderma sp., dan
Aspergillus sp. (Brady and Weil, 2002).
2.3. Kurva Pertumbuhan Bakteri
Fase dalam pertumbuhan bakteri ada empat, yaitu fase adaptasi (log
phase), fase eksponensial (exponential phase), fase statis (stationer phase), dan
kematian (death phase) (Purwoko, 2007). Fase adaptasi terjadi pada awal
pertumbuhan populasi. Pada fase ini tidak terjadi penambahan jumlah sel, tetapi
terjadi penambahan volume sel (Sugiri, 1992).
Pada fase eksponensial, peningkatan jumlah sel dalam biakan sesuai
dengan waktu. Hal ini sesuai dengan anggapan bahwa keadaannya stabil, dengan
sel yang dikeluarkan ke lingkungan sel tidak mengganggu pertumbuhan maupun
pembelahan sel (Sugiri, 1992).
Beberapa alasan bakteri tidak melakukan pembelahan pada fase stationer
adalah nutrien habis, akumulasi metabolit toksik, penurunan kadar oksigen dan
ketersediaan air. Setelah itu, kultur tersebut memasuki fase kematian yang berarti
jumlah sel yang mati lebih besar dibandingkan penambahan sel. Penyebab utama
kematian adalah autolisis sel dan penurunan energi seluler (Purwoko, 2007).
2.4. Mikroba Pelarut Fosfat
Mikroba pelarut fosfat dapat digunakan sebagai alternatif untuk
meningkatkan efisiensi pemupukan fosfat. Mikroba pelarut fosfat, yaitu mikroba
yang dapat melarutkan fosfat yang tidak tersedia menjadi tersedia sehingga dapat
diserap oleh tanaman. Mikroba ini juga diketahui memproduksi asam amino,
vitamin dan substansi pemacu pertumbuhan seperti Indole Acetic Acid (IAA) serta
giberelin yang dapat membantu pertumbuhan tanaman (Ponmurugan and Gopi,
2006).
Mikroba pelarut fosfat dapat diisolasi dari tanah yang kandungan fosfatnya
rendah terutama di sekitar perakaran tanaman, karena mikroba ini menggunakan
fosfat dalam jumlah sedikit untuk keperluan metabolismenya. Kemampuan bakteri
dan fungi pelarut fosfat berbeda-beda tergantung jenis strain (Ginting dkk., 2006).
Bakteri yang dapat melarutkan fosfat adalah Bacillus megaterium, B. subtilis,
Pseudomonas striata dan P. liquifaciens. Fungi yang dapat melarutkan fosfat
Pertumbuhan mikroba pelarut fosfat sangat dipengaruhi oleh kemasaman
tanah. Pada tanah masam, aktivitas mikroba didominasi oleh kelompok fungi
sebab pertumbuhan optimum fungi pada pH 5 - 5,5. Sebaliknya, pertumbuhan
kelompok bakteri optimum pada pH netral dan meningkat seiring dengan
meningkatnya pH tanah, yaitu berkisar antara 4 - 10,6 (Ginting dkk., 2006).
2.5. Fosfat dan Mekanisme Penyerapannya
Fosfat adalah unsur hara kedua yang dibutuhkan setelah nitrogen
(Schachtman et al., 1998 dalam Handbook Of Microbial Fertilizer, 2006). Fosfat
merupakan 0,2% dari berat kering tanaman. Fosfat berperan dalam pembelahan
sel, pembentukan lemak dan albumin, pementukan bunga, buah dan benih,
pematangan hasil panen dan menghilangkan efek kelebihan aplikasi nitrogen,
perkembangan akar terutama akar lateral dan serabut, meningkatkan hasil panen
dan meningkatkan resisten terhadap penyakit dan dalam metabolisme melalui
suplai energi yang diperlukan untuk proses metabolik (Brady and Weil, 2002).
Fosfat diserap tanaman dalam bentuk ion fosfat. Ada dua jenis fosfat di dalam
tanah, yaitu fosfat organik dan fosfat anorganik (Hardjowigeno, 1992).
Umumnya konsentrasi fosfat anorganik di dalam tanah lebih tinggi
dibandingkan fosfat organik. Fosfat anorganik berasal dari fosfat yang berikatan
dengan kalsium, besi dan alumunium serta mineral apatite, dimana mineral
tersebut berada pada batuan, seperti fluorapatite, chloroapatite dan hidroksiapatite
yang biasanya sukar larut. Konsentrasi ion di dalam tanah tergantung pada pH
HPO42-, sedangkan pada pH netral 6-7, kedua ion tersebut tersedia didalam tanah.
Pada pH basa, HPO42- lebih dominan dbandingkan dengan H2PO4 (Tan, 1994).
Keberadaan fosfat anorganik dipengaruhi oleh keberadaan besi, alumunium dan
kalsium, jumlah dan dekomposisi bahan organik serta aktivitas mikroba (Brady
and Weil, 2002).
Fosfat organik terdiri atas phytin dan asam nukleat. Phytin dapat diserap
langsung oleh tanaman, sedangkan asam nukleat harus dipecah dengan
menggunakan enzim dipermukaan akar. Pada tanah masam, phytin menjadi tidak
larut dan tidak tersedia untuk tanaman karena diikat oleh besi dan alumunium.
Keberadaan asam nukleat rendah pada tanah masam yang banyak mengadung
montmorilonit, karena dapat diikat oleh montmorilonit (Brady and Weil, 2002).
Jumlah fosfat dalam tanah sangat tinggi sekitar 0,1-1 ppm, tetapi sebagian
besar berada dalam bentuk yang tidak dapat digunakan oleh tanaman karena
terjadi pengikatan (fiksasi) oleh aluminium pada tanah masam atau oleh kalsium
pada tanah alkalis (Hardjowigeno, 1992). Adanya pengikatan-pengikatan fosfat
tersebut menyebabkan pupuk fosfat yang diberikan tidak efisien, sehingga perlu
diberikan dalam takaran yang tinggi. Pemberian pupuk fosfat ke dalam tanah,
hanya 15-20% yang dapat diserap oleh tanaman. Hal ini menyebabkan defisiensi
fosfat bagi pertumbuhan tanaman (Ginting dkk., 2006).
Pelarutan senyawa fosfat berlangsung secara kimia dan biologi. Pada
mekanisme pelarutan fosfat secara kimia, mikroba mengeksresikan sejumlah asam
organik dengan berat molekul rendah seperti oksalat, suksinat, tartat, laktat, sitrat,
dengan penurunan pH. Perubahan pH berperan penting dalam peningkatan
kelarutan fosfat. Selanjutnya, asam-asam organik ini akan bereaksi dengan
pengikat fosfat seperti alumunium dan kalsium membentuk khelat organik yang
stabil sehingga mampu membebaskan fosfat yang terikat dan dapat diserap oleh
tanaman (Ginting dkk., 2006).
Urutan kemampuan asam organik dalam melarutkan fosfat adalah asam
sitrat > asam oksalat = asam tartrat = asam malat > asam laktat = asam format =
asam asetat (Isroi, 2007). Sedangkan dalam FNCA Biofertilizer Project (2005),
dijelaskan bahwa asam glikonik yang dihasilkan oleh Pseudomonas sp., Erwinia
herbicola, P. cepacia dan Burkholderia cepacia merupakan agen utama pelarutan
fosfat. Asam organik lainnya adalah asam 2 ketoglukonik yang dihasilkan oleh
Rhizobium leguminosarum, R. meliloti dan Bacillus firmus. Bakteri dari strain
Bacillus, Pseudomonas dan Rhizobium merupakan strain yang paling unggul
dalam melarutkan fosfat.
Asam organik yang membentuk kompleks yang lebih mantap dengan
kation logam akan lebih efektif dalam melepas Ca dan Al mineral tanah sehingga
akan melepas fosfat yang lebih besar. Sedangkan kemudahan fosfat terlepas
mengikuti urutan Ca3(PO4)2 > AlPO4. Kecepatan pelarutan fosfat dari mineral
fosfat oleh asam organik ditentukan oleh kecepatan difusi asam organik dari
larutan tanah, waktu kontak antara asam organik dan permukaan mineral, tingkat
dissosiasi asam organik, tipe dan letak gugus fungsi asam organik, afinitas kimia
agen pengkhelat terhadap logam dan kadar asam organik dalam larutan tanah
Pelarutan fosfat secara biologi terjadi karena mikroba tersebut
menghasilkan enzim fosfatase. Fosfatase adalah enzim yang akan dihasilkan
apabila ketersediaan fosfat rendah. Pada proses mineralisasi bahan organik,
senyawa fosfat organik diuraikan menjadi bentuk fosfat anorganik yang tersedia
bagi tanaman dengan bantuan enzim fosfatase. Enzim fosfatase dapat
memutuskan fosfat yang terikat oleh senyawa organik menjadi bentuk yang
tersedia (Ginting dkk., 2006).
Penggunaan mikroba pelarut fosfat dapat berupa kultur murni (terdiri dari
satu jenis mikroba) maupun kultur campuran (terdiri dari beberapa mikroba yang
bekerja sama). Sebagai contoh kultur campuran adalah penggunaan Rhizobium,
Bacillus megatherium dan fungi biokontrol Trichoderma spp. Kombinasi tersebut
dapat meningkatkan perkecambahan, pengambilan nutrisi, berat tanaman, jumlah
cabang, nodul, hasil polong dan biomassa total jika dibandingkan inokulasi
dengan menggunakan salah satu dari mikroba tersebut atau tanpa inokulasi
(FNCA Biofertilizer Project, 2005).
2.6. Interaksi Mikroba Tanah dengan Akar Tanaman
Interaksi mikroba dengan akar tanaman dapat bersifat menguntungkan
atau merugikan. Bersifat menguntungkan apabila antara tanaman dan mikroba
tanah saling bekerjasama seperti mikroba membantu tanaman untuk mendapatkan
unsur hara. Sedangkan merugikan, apabila mikroba hanya mengambil bahan
Proses di dalam tanah dibantu oleh mikroba dan berpengaruh terhadap
pertumbuhan tanaman. Mikroba tanah mendekomposisi tanaman dan sisa hewan
sehingga dapat menambah bahan organik dan humus pada tanah. Mikroba tersebut
dapat membebaskan nitrogen, CO2 dan mineral yang penting untuk pertumbuhan
tanaman (Waksman, 1963).
Mikroba dapat berasosiasi dengan tanaman, seperti pada nodul tanaman
Leguminoceae yang bersimbiosis dengan bakteri. Beberapa percobaan
menunjukkan bahwa mikroba memiliki peranan penting dalam ketersediaan
fosfat untuk tanaman. Faktor yang mempengaruhinya adalah kehadiran mikroba
pelarut fosfat dalam tanah, komposisi kimia fosfat, pH dan temperatur tanah
(Waksman, 1963). Hubungan mikroba tanah dengan tanaman adalah:
Mikroba menyebabkan pertumbuhan tanaman dengan mempengaruhi
ketersediaan berbagai elemen nutrisi yang essensial untuk pertumbuhan
tanaman;
Mikroba menyebabkan pertumbuhan tanaman melalui produksi zat pengatur
pertumbuhan, seperti auksin dan fitohormon;
Mikroba dapat bersimbiosis dengan tanaman;
Beberapa mikroba dapat berkompetisi dengan tanaman untuk mendapatkan
nutrisi;
Beberapa mikroba dapat menimbulkan pengaruh berbahaya untuk tanaman,
2.7. Tanaman Kedelai
2.7.1. Sistematika dan Morfologi Tanaman Kedelai
Kedelai termasuk famili Leguminosae, subfamili Papilionoideae, genus
Glycine dan nama spesiesnya adalah Glycine max (L.) Merr (Liu, 1997). Kedelai
merupakan tanaman semak berumur satu tahun, memiliki tinggi 0,2-0,6 meter
(Steenis et al., 1992).
Benih kedelai berkeping dua yang terbungkus oleh kulit benih. Embrio
terletak diantara keping benih. Warna kulit benih bermacam-macam, yaitu kuning,
hitam, hijau dan coklat. Bentuk benih kedelai umumnya bulat lonjong, bundar
atau agak pipih. Besar benih bervariasi, tergantung varietas. Di Indonesia besar
benih bervariasi dari 6-30 gram (Suprapto, 2001).
Sistem perakaran kedelai terdiri dari dua macam, yaitu akar tunggang dan
akar sekunder (serabut) yang tumbuh dari akar tunggang. Selain itu, kedelai juga
seringkali membentuk akar adventif yang tumbuh dari bagian bawah hipokotil.
Pada umumnya, akar adventif terjadi karena cekaman tertentu, misalnya kadar air
tanah yang terlalu tinggi (Adisarwanto, 2005 dalam Sofia, 2007).
Batang kedelai biasanya berwarna hijau atau ungu. Pada saat tanaman
kedelai masih sangat muda (setelah fase perkecambahan), batang dibedakan
menjadi dua, yaitu bagian batang di bawah keping benih yang belum lepas disebut
hipokotil sedangkan di bagian atas keping benih disebut epikotil. Daun kedelai
merupakan daun majemuk yang terdiri dari tiga helai anak daun dan umumnya
berwarna hijau muda atau hijau kekuningan. Bentuk daun oval atau segitiga
Bunga kedelai disebut bunga kupu-kupu, mempunyai dua mahkota dan
dua kelopak bunga. Bunga kedelai berwarna putih atau ungu. Bunga tumbuh pada
ketiak daun, biasanya terdapat 3-15 kuntum bunga, tetapi hanya beberapa yang
dapat membentuk polong. Penyerbukan kedelai termasuk penyerbukan sendiri
karena pembuahan terjadi sebelum bunga mekar. Semua varietas kedelai
mempunya bulu yang berwarna coklat atau putih kehijauan pada batang, cabang,
daun dan polong (Andrianto dan Indarto, 2004).
2.7.2. Syarat Tumbuh Tanaman Kedelai
Tanaman kedelai umumnya dapat beradaptasi terhadap berbagai jenis
tanah dan menyukai tanah bertekstur ringan hingga sedang, dan berdrainase baik
(Rubatzky dan Yamaguchi, 1998 dalam Sofia, 2007). Kedelai tumbuh baik pada
tanah yang bertekstur gembur, lembab, tidak tergenang air dan memiliki pH 6-6,8.
kedelai dapat tumbuh di tanah yang agak masam akan tetapi dapat menimbulkan
keracunan Aluminium (Sofia, 2007).
Benih kedelai biasanya ditanam pada kedalaman antara 2-5 cm tergantung
pada jenis dan kelembaban tanah. Kelembaban tanah yang baik selama
perkecambahan harus mengandung kelembaban 50% sebelum perkecambahan.
Tetapi, kelembaban yang berlebihan tidak baik untuk perkecambahan karena
membatasi ketersediaan oksigen (Liu, 1997).
Sebagian besar tanaman terdiri dari dua fase pertumbuhan, yaitu fase
vegetatif dan generatif atau reproduktif. Pada tanaman kedelai, waktu sampai
6-8 minggu. Lama fase vegetatif tergantung dari genotip, waktu tanam, lokasi
geografik dan kondisi lingkungan. Setelah fase vegetatif, tanaman kedelai
memasuki fase generatif ketika kuncup berkembang menjadi bunga sampai 2-35
bunga. Kemudian diikuti dengan perkecambahan polong, benih dan pematangan.
Fase generatif mulai terjadi pada minggu ke 7 sampai ke 12. Tanaman kedelai
menghasilkan 2-3 benih per polong. Polong biasanya lurus, panjangnya antara 2-7
cm dan warna polong yang matang adalah kuning, abu-abu atau hitam (Liu,
1997).
Kendala utama dalam usaha meningkatkan produksi kedelai adalah adanya
serangan pengganggu yaitu hama, penyakit dan gulma. Hama utama tanaman
kedelai adalah perusak bibit yang disebabkan oleh Agromyza phaseoli, perusak
daun yang disebabkan oleh Phaedononia inclusa, perusak polong yang
disebabkan oleh Etiella zhinchenella dan hama lain yang dapat menularkan
penyakit pada tanaman kedelai. Penyakit yang sering menyerang tanaman kedelai
adalah yang disebabkan oleh virus, seperti soybean mosaic virus, penyakit yang
disebabkan oleh fungi penyebab karat (Phatospora pachyrhizi) dan penyakit yang
disebabkan oleh bakteri Pseudomonas syringae penyebab hawar daun. Jenis
gulma penting pada tanaman kedelai adalah rumput-rumputan (Digitaria ciliaris),
teki (Cyprus kyllinges) dan bayam berdaun lebar (Amaranthus sp.) (LIPTAN,
2.7.3. Kedelai Varietas Wilis
Kualitas kedelai lokal seperti varietas Bromo, Argomulyo, Burangrang,
Mahameru, Anjasmoro, Merubetiri, Baluran, Panderman, Gumitir, Argomulyo,
Wilis dan Lokon lebih baik dibandingkan dengan kedelai impor. Kedelai lokal
memiliki ukuran yang lebih besar, kadar protein yang lebih tinggi sekitar 37-42%
dan rasa yang enak karena lebih segar jika dibandingkan kedelai impor yang
sudah ditimbun beberapa tahun (Suryo, 1996).
Varietas Wilis memiliki ciri-ciri seperti warna daun hijau, warna bunga
ungu, warna benih kuning, warna kulit polong masak coklat kehitaman, tinggi
tanaman 40-50 cm, bentuk benih oval, berbunga pada umur 39 hari dan polong
masak pada umur 88 hari (Surat Keputusan Menteri Pertanian
no.318/Kpts/Tp.240/41985). Varietas Wilis memiliki keunggulan, yaitu lebih
toleran terhadap lingkungan yang berdrainase kurang baik dan terhadap penyakit
seperti penyakit karat dan layu. Varietas ini juga dapat tumbuh pada lahan kering
dan tanah asam (Sofia, 2007).
2.7.4. Nilai Gizi dan Peran Kedelai
Kedelai merupakan sumber protein nabati yang efisien. Untuk setiap 100
gram kedelai mengandung 330 kalori, 35% protein, 18% lemak, 35% CHO dan
8% air. Bahkan pada varietas unggul, kandungan protein kedelai dapat mencapai
40-43% (Suprapto, 2001). Kedelai juga mengandung kalsium, besi, potassium,
Kedelai dalam kehidupan sehari-hari berperan dalam meningkatkan
metabolisme tubuh; menguatkan sistem imun tubuh; menstabilkan kadar gula
arah; melindungi jantung; menambah daya ingat; membentuk tulang yang kuat;
menurunkan resiko penyakit jantung, kanker payudara dan kanker prostat;
menurunkan tekanan darah dan kolesterol; mencegah menopouse pada wanita;
BAB III
METODOLOGI PENELITIAN
3.1. Waktu dan Tempat
Penelitian ini dilakukan pada bulan Februari sampai Juli 2008 di
Laboratorium Mikrobiologi Pusat Laboratorium Terpadu Universitas Islam Negeri
Syarif Hidayatullah Jakarta untuk pembuatan inokulum bakteri dan fungi dan
penanaman dilakukan di rumah kaca Universitas Islam Negeri Syarif Hidayatullah
Jakarta.
3.2. Bahan dan Alat
Bahan dan Alat Pembuatan Inokulum Bakteri dan Fungi
Bahan-bahan yang digunakan adalah isolat bakteri PH3-1B (Paku Haji
pada titik sampel ke 3, bakteri pertama), PH5-2B, PH4-3B dan isolat fungi
PH1-4F, PH1-3F, PH5-5F yang diisolasi dari sampel tanah Paku Haji, media NB
(Nutrient Broth), media NA (Nutrient Agar), umbi kentang, dextrose, Bacto agar,
kain kassa, akuades steril, spirtus dan alkohol 70%.
Alat-alat yang digunakan adalah gelas kimia, timbangan Schout Pro Ohaus
2000 gram, penangas air, stirrer, spatula, labu Erlenmeyer, stopwatch, gelas ukur,
shaker, hemasitometer, mikroskop cahaya, counter, spektrofotometer, sentrifuge,
Bahan dan Alat Inokulasi dan Penanaman Kedelai
Bahan-bahan yang digunakan adalah inokulum bakteri PH3-1B, PH5-2B,
PH4-3B dan inokulum fungi PH1-4F, PH1-3F, PH5-5F, larutan sagu 2%, spirtus,
alkohol 70%, akuades steril, benih kedelai varietas Wilis, tanaman kedelai
berumur 2 minggu, pasir dan tanah Paku Haji steril, pupuk N, pupuk P dan pupuk
K dengan perbandingan 1:2:1. Alat-alat yang digunakan untuk penanaman kedelai
adalah pot plastik dengan diameter 17 cm, bunsen, spatula, pinset, benang dan
meteran. Alat-alat yang digunakan untuk pengukuran parameter fisik adalah lux
meter, soil tester dan termometer.
3.3. Cara Kerja
3.3.1. Pembuatan Inokulum Isolat Bakteri dan Fungi Pembuatan Media NB dan NA
Sebanyak 4 gram media NB ditimbang dan dimasukkan ke dalam
Erlenmeyer, kemudian dilarutkan dalam 500 ml akuades steril. Media tersebut
dipanaskan dengan menggunakan penangas air sampai homogen. Setelah itu,
media disterilisasi dengan mengunakan autoklaf pada suhu 121oC selama 15
menit. Hal yang sama dilakukan untuk pembuatan NA dengan penambahan agar
sebanyak 7,5 gram.
Pembuatan Media PDB dan PDA
Kentang dikupas bersih, dipotong kecil-kecil dan ditimbang sebanyak 150
300 ml akuades steril kemudian dipanaskan dengan menggunakan penangas air.
Selanjutnya, dilakukan penyaringan dengan menggunakan kain kassa steril 4 lapis
dan ditambahkan akuades steril sampai volumenya mencapai 500 ml, kemudian
ditambahkan dextrose sebanyak 7,5 gram. Media tersebut dipanaskan kembali
sampai homogen kemudian disterilisasi dengan menggunakan autoklaf pada suhu
121oC selama 15 menit. Hal yang sama dilakukan untuk pembuatan PDA dengan
penambahan agar sebanyak 7,5 gram.
Peremajaan Stok Bakteri dan Fungi Pelarut Fosfat
Isolat bakteri dari kultur stok PH3-1B diambil sebanyak 1 ose kemudian
diinokulasikan ke dalam media NA miring. Hal yang sama dilakukan pada isolat
bakteri PH5-2B dan PH4-3B kemudian diinkubasi pada suhu ruang selama 24-48
jam. Isolat fungi dari kultur stok PH1-4F diambil sebanyak 1 ose kemudian
diinokulasikan ke dalam media PDA miring. Hal yang sama dilakukan pada isolat
fungi PH1-3F dan PH5-5F kemudian diinkubasi pada suhu ruang selama 7 hari.
Pengamatan Morfologi dan Pengukuran Panjang Sel Bakteri
Isolat bakteri yang digunakan, yaitu PH3-1B, PH4-3B dan PH5-2B,
dijadikan preparat kering dan dilakukan pewarnaan Gram. Dengan menggunakan
pewarnaan Gram tersebut dapat dilihat kemurnian isolat bakteri.
Pewarnaan Gram dilakukan dengan cara berikut ini, satu tetes NaCl
fisiologis diteteskan di atas kaca objek, ditambahkan satu ose kultur PH3-1B,
kering ditambahkan larutan kristal violet dan didiamkan selama satu menit,
kemudian dibilas dengan menggunakan air mengalir dan dikeringkan. Setelah itu,
preparat ditambahkan larutan iodin, didiamkan selama satu menit, kemudian
dibilas dengan air mengalir dan dikeringkan. Preparat diteteskan alkohol 95%
selama beberapa detik kemudian dibilas dengan air mengalir dan dikeringkan.
Preparat kemudian ditambahkan safranin, didiamkan selama 45 detik, lalu dibilas
dengan air mengalir dan dikeringkan. Preparat tersebut diamati dengan mikroskop
perbesaran 1000x kemudian difoto.
Berrdasarkan hasil foto, diambil 5 sel secara acak dari masing-masing
isolat kemudian diukur dengan menggunakan penggaris. Setelah itu, rata-rata
pengukuran panjang tersebut dikonversi berdasarkan ukuran bakteri yang tertulis
pada gambar.
Pembuatan Kurva Standar Isolat Bakteri
Kultur stok isolat bakteri PH3-1B yang telah diremajakan dibuat menjadi
suspensi bakteri yang diencerkan beberapa kali. Setiap suspensi dengan
pengenceran yang berbeda diukur absorbansinya dengan menggunakan
spektrofotometer (λ 600 nm). Setelah itu, suspensi dengan absorbansi yang
berbeda tersebut diukur jumlah selnya melalui metode Total Plate Count (TPC)
pada media NA. Nilai-nilai absorbansi dan TPC yang diperoleh dibuat menjadi
kurva standar dengan menggunakan Software Excel sehingga dapat diketahui
jumlah sel pada suatu nilai absorbansi. Hal yang sama dilakukan untuk isolat
Pembuatan Kurva Tumbuh Bakteri
Kultur isolat bakteri yang telah diremajakan diinokulasi seujung ose ke
dalam 100 ml NB dalam labu Erlenmeyer 250 ml. Kultur tersebut kemudian
dikocok dengan menggunakan shaker 125 rpm sampai tercapai puncak
pertumbuhan. Pada setiap interval 2 jam, sampel kultur diambil untuk diukur
absorbansi, yang kemudian dikonversi menjadi jumlah sel/ml. Hasil pengukuran
tersebut dibuat menjadi kurva tumbuh sehingga dapat diketahui kapan terjadinya
kecepatan pertumbuhan tertinggi.
Pembuatan Inokulum Bakteri
Kultur isolat bakteri yang telah diremajakan diinokulasi seujung ose ke
dalam 100 ml NB dalam labu Erlenmeyer 250 ml. Kultur tersebut kemudian
dikocok dengan menggunakan shaker 125 rpm sampai tercapai fase aktif
pertumbuhan. Setelah itu, kultur disentrifuge selama 10 menit 3000 rpm.
Supernatan hasil sentrifuge dibuang kemudian pelet diencerkan dengan
penambahan NaCl fisiologis sampai absorbansi tertentu (λ 700 nm) untuk
mencapai jumlah sel 10 9 cfu/ml.
Pembuatan Inokulum Isolat Fungi
Spora yang terbentuk dari hasil peremajaan yang berumur 7 hari
ditambahkan 20 ml akuades steril, kemudian spora diluruhkan dengan
menggunakan ose sehingga diperoleh suspensi spora. Kemudian dihitung jumlah
perbesaran 400 X. Suspensi spora yang diinginkan adalah dengan konsentrasi
5x109 spora/ml PDB.
Rumus jumlah spora/ml :
Rata-rata jumlah spora :
Dimana : 0,1 mm : Kedalaman kamar hitung
0,0025 mm2 : Luas kamar hitung
R1 : Spora ruang 1
R2 : Spora ruang 2
R3 : Spora ruang 3
3.3.2. Inokulasi Benih dan Akar Inokulasi Benih
Benih yang digunakan dalam penelitian ini memiliki karakter yang sama
yaitu berukuran besar, tidak cacat dan berwarna seragam. Benih kedelai yang akan
ditanam dilukai dengan menggunakan jarum steril dan dimasukkan ke dalam
alkohol 70% selama 1 menit kemudian direndam di dalam larutan sagu 2% selama
2 menit. Setelah itu, benih direndam ke dalam suspensi isolat bakteri pelarut
fosfat dengan kepadatan 5x109 cfu/ml selama 5 menit. Perlakuan yang diuji terdiri
atas 6 macam, yaitu perendaman benih dalam suspensi bakteri PH3-1B, PH4-3B
dan PH5-2B) dan fungi PH1-3F, PH1-4F dan PH5-5F. Kontrol yang digunakan Rata-rata jumlah spora X faktor pengenceran
0,1 X 0,0025 mm2
adalah akuades steril (kontrol 1) dan larutan sagu 2% (kontrol 2). Benih kedelai
tersebut siap untuk ditanam. Setiap perlakuan dilakukan pengulangan sebanyak 3
kali (Fitriatin dan Simarmata, 2005).
Inokulasi Akar
Akar tanaman kedelai yang telah memiliki 2-3 daun utama diambil
kemudian dibersihkan dari media tanam (campuran pasir dan tanah Paku Haji)
dengan menggunakan air mengalir dan dilakukan perendaman dengan
menggunakan alkohol 70% selama 1 menit. Setelah itu, akar tersebut dilukai
dengan menggunakan jarum steril kemudian dimasukkan ke dalam larutan sagu
2% selama 30 detik dan direndam dalam suspensi isolat mikroba (bakteri dan
fungi pelarut fosfat) dengan kepadatan 5x109 cfu/ml selama 60 detik. Kontrol
yang digunakan adalah akuades steril (kontrol 1) dan larutan sagu 2% (kontrol 2).
Akar tanaman kedelai tersebut siap untuk ditanam kembali. Setiap perlakuan
dilakukan pengulangan sebanyak 3 kali (Montealegre et al, 2003).
3.3.3. Penanaman Kedelai Persiapan Media Tanam
Pasir diayak dengan menggunakan ayakan berdiameter 3 mm. Hal yang
sama dilakukan untuk tanah. Setelah itu, pasir dan tanah dimasukkan ke dalam
plastik tahan panas dengan perbandingan 3:1 sebanyak 1 kg, kemudian
dimasukkan ke dalam pot plastik yang berdiameter 17 cm kemudian diberikan
campuran pupuk NPK dengan perbandingan 1:2:1 sebanyak 1 gram.
Penanaman, Pemupukan dan Pemeliharaan
Tiga benih kedelai ditanam dalam media tanam dengan kedalaman 2 cm
pada pot plastik dan ditempatkan di dalam rumah kaca. Pemeliharaan tanaman
kedelai dilakukan dengan penyiraman setiap hari. Pembersihan gulma di sekitar
tanaman dilakukan dengan cara pencabutan sedangkan pemeliharaan dari hama
dan penyakit tanaman dilakukan dengan penyemprotan fungisida Dithane M-45
dengan dosis 1,5 gram per liter.
Pengamatan Parameter Tanaman dan Lingkungan
Parameter yang diamati adalah:
A. Perkecambahan, dilakukan dengan mengamati waktu benih berkecambah
dan muncul ke permukaan media tanam. Hanya satu tanaman dari setiap
pot yang terus diamati sampai akhir pengamatan.
B. Tinggi tanaman, dilakukan dengan mengukur tinggi tanaman dari
permukaan tanah sampai ujung tanaman tertinggi dengan menggunakan
benang. Selanjutnya, benang tersebut diukur dengan menggunakan
meteran.
C. Jumlah daun, dilakukan dengan menghitung jumlah daun yang tumbuh.
D. Lebar daun, dilakukan dengan menggunakan benang pada permukaan
E. Berat kering tanaman, dilakukan dengan mencabut akar kemudian
dibersihkan dari media tanam dengan menggunakan air mengalir
kemudian tanaman kedelai ditimbang (berat basah). Setelah itu, tanaman
kedelai tersebut dikeringkan dengan menggunakan oven kemudian
ditimbang kembali (berat kering). Selanjutnya dihitung selisih berat kering
dan berat basah.
Pengamatan parameter tinggi tanaman, jumlah dan lebar daun dilakukan
setiap 2 hari sedangkan untuk berat kering tanaman dilakukan di akhir
pengamatan.
Pengamatan parameter lingkungan yang dilakukan adalah pengukuran
suhu rumah kaca dengan menggunakan termometer, kelembaban dan pH media
tanam dengan menggunakan soil tester, dan intensitas cahaya dengan
menggunakan lux meter.
3.3. Analisis Data
Data yang diperoleh dalam penelitian ini yang merupakan pengamatan
ketiga parameter (tinggi tanaman, jumlah dan lebar daun) diolah secara statistik
dengan metode analisis variansi satu arah (one way Anova) dengan rancang acak
lengkap pada taraf uji 0,05%.
Hipotesis 0 : parameter pada kontrol dan perlakuan tidak berbeda nyata
Hipotesis 1 : parameter pada kontrol dan perlakuan berbeda nyata
Jika signifikansi < 0,05% maka H0 ditolak sedangkan jika signifikansi >
pada inokulasi akar maupun benih, faktor yang diuji adalah pengaruh pemberian
isolat mikroba pelarut fosfat terhadap pertumbuhan tanaman kedelai varietas
Wilis. Perbandingan pertumbuhan tanaman kedelai yang diinokulasi mikroba
BAB IV
HASIL DAN PEMBAHASAN
4.1. Morfologi Isolat Bakteri Pelarut Fosfat dengan Pewarnaan Gram
Pengamatan morfologi isolat bakteri pelarut fosfat yang telah diberi
pewarnaan Gram bertujuan untuk memastikan tidak terjadinya kontaminasi pada
kultur yang digunakan. Hasil pewarnaan Gram menunjukkan bahwa semua isolat
bakteri pelarut fosfat yang diamati (PH3-1B, PH4-3B dan PH5-2B) merupakan
bakteri Gram positif (Gambar 1, 2 dan 3). Secara mikroskopis, semua isolat
bakteri pelarut fosfat yang diuji menunjukkan berbentuk batang dan pada setiap
preparat sel-selnya tampak seragam. Menurut Pelczar dan Chan (1986), salah satu
bakteri yang menunjukkan ciri berbentuk batang dan Gram positif adalah Bacillus
sp. Beberapa jenis Bacillus sp. memiliki kemampuan melarutkan fosfat seperti
Bacillus megaterium dan Bacillus subtilis (Motsara et al, 1995). Meskipun semua
berbentuk batang, ketiga isolat bakteri memiliki panjang yang berbeda. Rata-rata
ukuran panjang PH3-1B (1,68 m) terlihat lebih besar dibandingkan kedua isolat
lainnya, yaitu PH5-2B (1,08 m) dan PH4-3B (0,36 m).
Dengan karakter bakteri yang menunjukkan Gram positif, maka bakteri
tersebut tahan terhadap pengaruh faktor lingkungan yang ada di tanah masam.
Menurut Pelczar dan Chan (1986), bakteri Gram positif lebih resisten terhadap
gangguan fisik dan perlakuan mekanis. Dinding sel bakteri Gram positif memiliki
peptidoglikan yang lebih tebal (Pelczar dan Chan, 1986), sehingga dapat bertahan
Gambar 1. Isolat Bakteri PH3-1B Perbesaran 1000 x
Gambar 2. Isolat Bakteri PH5-2B Perbesaran 1000 x
4.2. Kurva Pertumbuhan Isolat Bakteri Pelarut Fosfat
Pertumbuhan bakteri dapat diamati melalui peningkatan jumlah sel terhadap
waktu. Menurut Pelczar dan Chan (1986), kurva pertumbuhan terdiri dari fase
adaptasi, logaritmik, stationer dan kematian mikroorganisme. Pada kurva
pertumbuhan ketiga isolat bakteri pelarut fosfat yang diamati, semua fase dapat
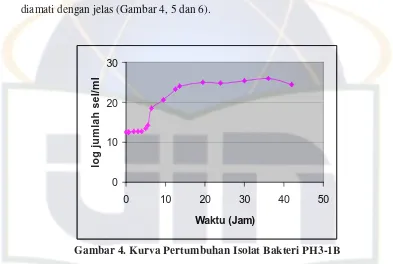
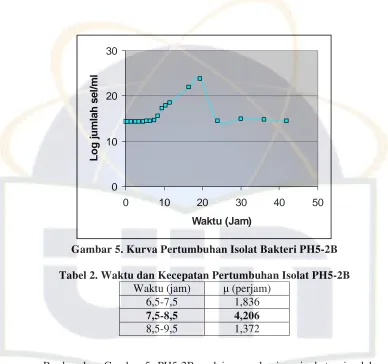
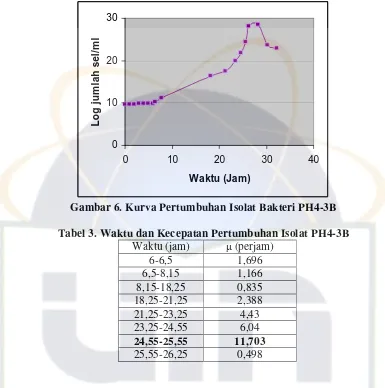
diamati dengan jelas (Gambar 4, 5 dan 6).
Gambar 4. Kurva Pertumbuhan Isolat Bakteri PH3-1B Tabel 1. Waktu dan Kecepatan Pertumbuhan Isolat PH3-1B
Waktu (jam) µ (perjam) 4-5 1,614 5-5,5 3,857
5,5-6,5 9,558
6,5-9,5 1,663
Pada Gambar 4, PH3-1B mulai menunjukkan peningkatan jumlah sel sejak
jam ke-5. Fase logaritmik tercepat terjadi pada jam ke-5,5-6,5 (Tabel 1) dengan
36 jam. Pertumbuhan isolat bakteri ini terlihat lebih cepat dibandingkan isolat
lain yang digunakan, sehingga lebih cepat mencapai fase logaritmik.
0
Gambar 5. Kurva Pertumbuhan Isolat Bakteri PH5-2B Tabel 2. Waktu dan Kecepatan Pertumbuhan Isolat PH5-2B
Berdasarkan Gambar 5, PH5-2B mulai mengalami peningkatan jumlah sel
sejak jam ke-7,5 dan mencapai puncak fase logaritmik pada jam ke-8,5 jam
dengan nilai = 4,206 perjam (Tabel 2). Penurunan jumlah sel yang signifikan
mulai terjadi setelah 19,5 jam. Hal ini dapat saja disebabkan oleh nutrisi yang
semakin berkurang atau terakumulasinya limbah metabolisme (Sugiri, 1992). Waktu (jam) (perjam)
6,5-7,5 1,836
7,5-8,5 4,206
0
Gambar 6. Kurva Pertumbuhan Isolat Bakteri PH4-3B Tabel 3. Waktu dan Kecepatan Pertumbuhan Isolat PH4-3B
Waktu (jam) (perjam)
Berdasarkan Gambar 6, PH4-3B menunjukkan pertumbuhan yang lambat.
Isolat bakteri ini menunjukkan peningkatan pertumbuhan sejak jam ke-10 dan
mencapai fase logaritmik tercepat pada jam ke-24,55-25,55 dengan nilai =
11,703 perjam (Tabel 3). Penurunan jumlah sel terjadi setelah jam ke-28.
Hasil pengamatan menunjukkan bahwa ketiga isolat bakteri pelarut fosfat
yang digunakan membutuhkan waktu yang berbeda-beda untuk mencapai fase
logaritmik. Untuk kepentingan pengujian digunakan isolat bakteri pada fase
paling cepat. Pada fase logaritmik kebutuhan nutrien cukup dan limbah sel yang
dikeluarkan ke lingkungan tidak mengganggu pembelahan sel, sehingga
pertumbuhan jumlah selnya paling cepat (Sugiri, 1992). Karena kondisi setiap
isolat bakteri dibuat sama, maka perbedaan waktu untuk mencapai fase logaritmik
dipengaruhi oleh sifat masing-masing isolat yang digunakan. Perbedaan waktu
untuk mencapai jumlah sel tertentu dipengaruhi oleh beberapa faktor, yaitu
sumber energi, sumber karbon, pH, suhu, lingkungan, O2 dan masa inkubasi atau
sifat mikroorganisme tersebut (Pelczar dan Chan,1986).
4.3. Inokulum Isolat Fungi Pelarut Fosfat
Inokulum fungi dapat diberikan ke tanaman dalam bentuk spora atau miselia
(Isroi, 2007). Dalam penelitian ini, inokulum fungi yang digunakan untuk
diinokulasikan ke tanaman kedelai varietas Wilis adalah dalam bentuk spora
sebanyak 5x109 spora/ml. Berdasarkan pengamatan dibawah mikroskop dengan
perbesaran 400 x, spora fungi yang digunakan berbentuk bulat dan berwarna
hijau.
Keuntungan penggunaan inokulum spora adalah tahan terhadap pengaruh
fisik dan kimia karena ketebalan dindingnya (Widiastuti, 2005). Berdasarkan
penelitian terdahulu oleh Sekardini (2005), pemberian inokulan 5% spora
Aspergillus niger dan pupuk kimia super fosfat 0,5 konsentrasi, optimum untuk
4.4. Pertumbuhan Tanaman Kedelai Dengan Inokulasi Bakteri Pelarut Fosfat pada Benih
Perkecambahan
Pertumbuhan tanaman kedelai varietas Wilis yang telah diinokulasi bakteri
pelarut fosfat pada benih diamati mulai dari munculnya kecambah ke permukaan
media tanam sampai muncul bunga atau tanaman berumur 5 minggu. Beberapa
benih kedelai varietas Wilis dengan inokulasi bakteri pelarut fosfat mulai
berkecambah pada hari ke-3. Namun sebagian besar yang lain mulai berkecambah
pada hari ke-5.
Bakteri yang diinokulasikan berpengaruh terhadap perkecambahan benih, di
mana benih yang diinokulasi dengan bakteri PH3-1B tidak ada yang berkecambah
karena terjadi pembusukan benih, sedangkan benih yang diinokulasi PH4-3B dan
PH5-2B semuanya berkecambah dan tumbuh dengan baik. Demikian juga dengan
kontrol 1 dan 2 yang tidak diinokulasi bakteri dapat berkecambah dan tumbuh.
Tidak berkecambahnya benih yang diinokulasi bakteri PH3-1B disebabkan bakteri
tersebut menghambat perkecambahan atau bahkan dapat dikatakan patogen pada
tanaman kedelai. Seperti yang diungkapkan oleh Supriadi (2006), selain dapat
meningkatkan pertumbuhan tanaman, bakteri pelarut fosfat ada yang berpotensi
menyebabkan patogen pada tanaman seperti Bacillus polymyxa.
Tinggi Tanaman
Berdasarkan hasil uji Anova (Lampiran 7.1b), tinggi tanaman pada minggu
ke-5 memiliki nilai probabilitas (signifikansi) 0,95. Nilai ini menunjukkan
bakteri PH4-3B dan PH5-2B) tidak memperlihatkan perbedaan yang nyata. Hal ini
memperlihatkan bahwa tidak ada potensi penghambatan pertumbuhan tanaman
kedelai varietas Wilis oleh isolat bakteri PH4-3B dan PH5-2B.
0
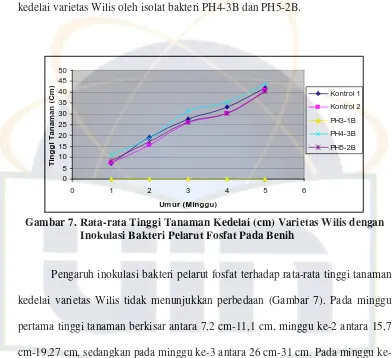
Gambar 7. Rata-rata Tinggi Tanaman Kedelai (cm) Varietas Wilis dengan Inokulasi Bakteri Pelarut Fosfat Pada Benih
Pengaruh inokulasi bakteri pelarut fosfat terhadap rata-rata tinggi tanaman
kedelai varietas Wilis tidak menunjukkan perbedaan (Gambar 7). Pada minggu
pertama tinggi tanaman berkisar antara 7,2 cm-11,1 cm, minggu ke-2 antara 15,7
cm-19,27 cm, sedangkan pada minggu 3 antara 26 cm-31 cm. Pada minggu
ke-4 tinggi tanaman antara 30 cm-35,23 cm dan minggu ke-5 antara ke-40,37 cm-ke-43,67
cm. Pada akhir pengamatan, tinggi tanaman dengan inokulasi PH4-3B terlihat
lebih tinggi dibandingkan dengan kontrol 1 dan 2.
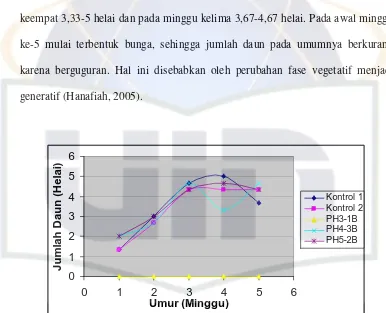
Jumlah dan Lebar Daun
Jumlah daun tanaman kedelai varietas Wilis yang dihitung dalam
perlakuan meningkat pada minggu ke-2 dan ke-3 (Gambar 8). Hal ini disebabkan
tanaman kedelai varietas Wilis pada minggu ke-2 dan ke-3 masih dalam fase
vegetatif, sehingga jumlah daun akan selalu bertambah. Lama fase vegetatif
dipengaruhi oleh genotip, waktu tanam, lokasi geografik dan kondisi lingkungan
(Liu, 1997). Rata-rata jumlah daun pada minggu pertama berkisar antara 1,33-2
helai, minggu kedua antara 2,67-3 helai, minggu ketiga 4,33-4,67 helai, minggu
keempat 3,33-5 helai dan pada minggu kelima 3,67-4,67 helai. Pada awal minggu
ke-5 mulai terbentuk bunga, sehingga jumlah daun pada umumnya berkurang
karena berguguran. Hal ini disebabkan oleh perubahan fase vegetatif menjadi
generatif (Hanafiah, 2005).
Gambar 8. Rata-rata Jumlah Daun Tanaman Kedelai (Helai) Varietas Wilis dengan Inokulasi Bakteri Pelarut Fosfat Pada Benih
Pengamatan rata-rata jumlah daun pada semua perlakuan tidak
menunjukkan perbedaan. Berdasarkan hasil uji Anova (Lampiran 7.2b), parameter
rata-rata jumlah daun pada akhir pengamatan (minggu ke-5) memiliki nilai
varietas Wilis pada kontrol dan perlakuan (inokulasi bakteri PH4-3B dan PH5-2B)
tidak memperlihatkan perbedaan yang nyata. Hal ini berarti isolat bakteri PH4-3B
dan PH5-2B yang diinokulasikan pada benih tidak menghambat pertumbuhan
jumlah daun tanaman kedelai varietas Wilis.
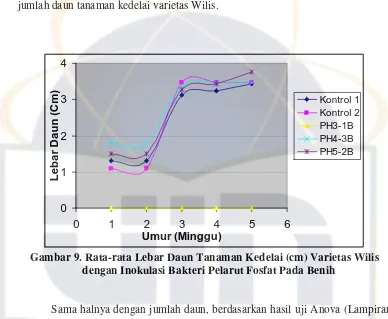
0
Gambar 9. Rata-rata Lebar Daun Tanaman Kedelai (cm) Varietas Wilis dengan Inokulasi Bakteri Pelarut Fosfat Pada Benih
Sama halnya dengan jumlah daun, berdasarkan hasil uji Anova (Lampiran
7.3b), rata-rata lebar daun pada minggu ke-5 memiliki nilai signifikansi 0,674. Hal
ini memperlihatkan bahwa rata-rata lebar daun tanaman kedelai varietas Wilis
pada kontrol dan perlakuan (inokulasi bakteri PH4-3B dan PH5-2B) tidak
menunjukkan perbedaan yang nyata. Hal ini berarti inokulasi bakteri PH4-3B dan
PH5-2B pada benih tidak menghambat lebar daun tanaman kedelai varietas Wilis.
Rata-rata lebar daun pada minggu pertama berkisar antara 1,1-1,8 cm, minggu
kedua 1,1-1,8 cm, minggu ketiga 3,13-3,47 cm, minggu keempat 3,23-3,6 cm, dan
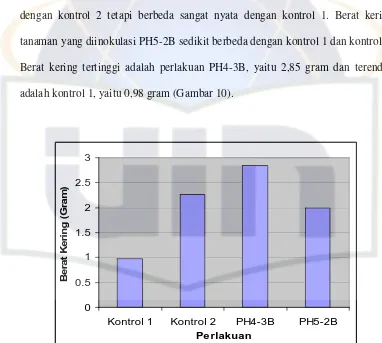
Berat Kering
Berat kering yang dihasilkan oleh tanaman kedelai pada akhir pengamatan
bervariasi pada setiap perlakuan. Berdasarkan hasil uji Anova (Lampiran 7.4b),
berat kering tanaman menunjukkan perbedaan yang nyata dengan nilai
signifikansi 0,034. Hasil uji lanjut Duncan (Lampiran 7.4c) menunjukkan berat
kering tanaman kedelai varietas Wilis dengan inokulasi PH4-3B tidak berbeda
dengan kontrol 2 tetapi berbeda sangat nyata dengan kontrol 1. Berat kering
tanaman yang diinokulasi PH5-2B sedikit berbeda dengan kontrol 1 dan kontrol 2.
Berat kering tertinggi adalah perlakuan PH4-3B, yaitu 2,85 gram dan terendah
adalah kontrol 1, yaitu 0,98 gram (Gambar 10).
0
Kontrol 1 Kontrol 2 PH4-3B PH5-2B Pe rlakuan
Gambar 10. Berat Kering Tanaman Kedelai Varietas Wilis dengan Inokulasi Bakteri Pelarut Fosfat
Tanaman yang diinokulasi bakteri PH4-3B dapat meningkatkan berat
parameter tinggi dan jumlah daun tanaman. Setelah pencabutan, tanaman yang
diinokulasi dengan bakteri PH4-3B memiliki perakaran yang lebih bagus
dibandingkan dengan perlakuan lain. Hal ini disebabkan fungsi fosfat yang
berperan untuk perkembangan akar (Brady and Weil, 2002). Pelarutan fosfat yang
tinggi menyebabkan proses metabolisme dan fotosintesis berjalan dengan baik dan
hasil dari proses tersebut dapat digunakan untuk pertumbuhannya (Mujib dkk.,
2000).
Sesuai dengan hasil uji Anova pada setiap karakter yang diamati (tinggi,
jumlah dan lebar daun), tanaman kedelai varietas Wilis yang diinokulasi PH4-3B
dan PH5-2B tidak berbeda nyata jika dibandingkan tanaman kontrol. Tetapi secara
deskripsi, perlakuan inokulasi PH4-3B hampir pada semua parameter memiliki
nilai tertinggi dibandingkan perlakuan lainnya, sedangkan perlakuan inokulasi
PH5-2B memiliki nilai tertinggi pada parameter lebar daun.
Bakteri PH4-3B dan PH5-2B dapat dikatakan kompatibel atau berhasil
melakukan pelarutan fosfat bagi tanaman kedelai varietas Wilis karena dapat
meningkatkan pertumbuhan tanaman kedelai. Bakteri PH3-1B tidak kompatibel
dengan tanaman kedelai varietas Wilis sehingga menyebabkan tidak terjadinya
perkecambahan pada benih yang diinokulasi bakteri tersebut. Kebutuhan fosfat
yang cukup pada tanaman berperan dalam pembelahan sel, pembentukan bunga,
buah dan benih, perkembangan akar dan peningkatan hasil panen (Brady and
Weil, 2002). Pada penelitian terdahulu oleh Yousry et al (1977), pemberian
Bacillus megatherium dapat meningkatkan berat kering kapri sebesar 10,9%.
kali pada tanah yang tidak dipupuk fosfat dan 8 kali lipat pada tanah yang dipupuk
dengan trikalsium fosfat (Robert dan Barthelin, 1986 dalam Goenadi 2006).
4.5. Pertumbuhan Tanaman Kedelai dengan Inokulasi Fungi Pelarut fosfat Pada Benih
Perkecambahan
Beberapa benih kedelai dengan inokulasi fungi pelarut fosfat mulai
berkecambah pada hari ke-3. Namun sebagian besar yang lain mulai berkecambah
pada hari ke-5. Hal ini menyerupai yang terjadi pada bakteri (Halaman 33), yang
berarti tidak terdapat perbedaan pengaruh inokulasi bakteri pelarut fosfat atau
fungi pelarut fosfat terhadap kecepatan pertumbuhan.
Tinggi Tanaman
Pengaruh inokulasi fungi pelarut fosfat pada benih terhadap rata-rata tinggi
tanaman berbeda dengan inokulasi bakteri pelarut fosfat. Hal ini dapat dilihat pada
Gambar 11. Rata-rata tinggi tanaman kedelai varietas Wilis dengan inokulasi
fungi pelarut fosfat lebih rendah dibandingkan kontrol 1 dan kontrol 2.
Berdasarkan hasil uji Anova (Lampiran 7.5b), rata-rata tinggi tanaman
pada minggu ke-5 memiliki nilai signifikansi 0,004. Nilai ini memperlihatkan
bahwa rata-rata tinggi tanaman kedelai pada kontrol dan perlakuan (inokulasi