commit to user
PENGARUH PEMBERIAN EKSTRAK KULIT BUAH DELIMA MERAH (Punica ganatum) TERHADAP JUMLAH ERITROSIT DAN KADAR
HEMOGLOBIN PADA TIKUS PUTIH (Rattus norvegicus) YANG DIPAPAR GELOMBANG ELEKTROMAGNETIK PONSEL
SKRIPSI
Untuk Memenuhi Persyaratan
Memperoleh Gelar Sarjana Kedokteran
NOVARINA RATNANINGTYAS
G0007114
FAKULTAS KEDOKTERAN
UNIVERSITAS SEBELAS MARET
ii
PENGESAHAN SKRIPSI
Skripsi dengan Judul : Pengaruh Pemberian Ekstrak Kulit Buah Delima Merah (Punica ganatum) terhadap Jumlah Eritrosit dan Kadar Hemoglobin
pada Tikus Putih (Rattus norvegicus) yang Dipapar Gelombang Elektromagnetik Ponsel
NOVARINA RATNANINGTYAS: G0007114: Tahun 2010
Telah diuji dan sudah disahkan di hadapan Dewan Penguji Skripsi Fakultas Kedokteran Universitas Sebelas Maret
Pada Hari Rabu, Tanggal 29 Desember 2010
Pembimbing Utama
Nama :Isna Qodriyati, dr.,M.Kes.
NIP : 19670130 199603 2 001 ...
Nama : Sutarmiadji D.P., Drs. ,M.Kes.
NIP : 19511211 198602 1 001 ...
Surakarta,
Ketua Tim Skripsi Dekan FK UNS
Muthmainah,dr., M.Kes Prof. Dr. H. A.A. Subijanto, dr.,M.S.
commit to user
iiiPERNYATAAN
Dengan ini menyatakan bahwa dalam skripsi ini tidak terdapat karya yang pernah
diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan
sepanjang pengetahuan penulis juga tidak terdapat karya atau pendapat yang
pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu
dalam naskah dan disebutkan dalam daftar pustaka.
Surakarta, 29 Desember 2010
Novarina Ratnaningtyas
iv ABSTRAK
Novarina Ratnaningtyas, G0007114, 2010. Pengaruh Pemberian Ekstrak
Kulit Buah Delima Merah (Punica ganatum) terhadap Jumlah Eritrosit dan
Kadar Hemoglobin Tikus Putih (Rattus norvegicus) yang Dipapar
Gelombang Elektromagnetik Ponsel.
Tujuan Penelitian: Penelitian ini bertujuan untuk mengetahui pengaruh
pemberian ekstrak kulit buah Delima Merah (Punica ganatum) terhadap jumlah eritrosit dan kadar hemoglobin pada tikus putih (Rattus norvegicus) yang dipapar gelombang elektromagnetik ponsel.
Metode Penelitian: Jenis penelitian ini adalah eksperimental laboratorik post uji
only goup design. Hewan uji yang digunakan adalah 32 ekor tikus putih jantan
yang dibagi dalam 4 kelompok perlakuan : (1) Kelompok kontrol; (2) Kelompok yang dipapar gelombang elektromagnetik ponsel; (3) Kelompok yang dipapar gelombang elektromagnetik ponsel dan diberi ekstrak kulit buah Delima Merah sebelum dan selama pemaparan dan (4) Kelompok yang dipapar gelombang elektromagnetik ponsel dan diberi ekstrak kulit buah Delima Merah sebelum, selama dan sesudah pemaparan. Penelitian ini berjalan selama 41 hari dan berakhir dengan pengambilan darah melalui sinus orbitalis tikus putih jantan. Sampel darah kemudian diberi EDTA, lalu dihitung jumlah eritrosit dan kadar hemoglobin di Laboratorium PK FK UNS, Surakarta. Data yang diperoleh diolah secara statistik diuji dengan uji t tidak berpasangan menggunakan SPSS for
Windows release 16.0. Signifikansi yang digunakan adalah p<0,05.
Hasil Penelitian: Jumlah eritrosit pada kelompok perlakuan (1)
695,38±38,311;(2)627,00±42,393; (3)661,00±63,833; (4)673,57±42,035.Kadar hemoglobin pada kelompok perlakuan (1) 12,425 ± 0,446;(2) 11,600 ± 0,489; (3) 11,857 ± 0,378;(4) 11,914 ± 0,598. Analisis menggunakan uji t tidak berpasangan menunjukkan hasil yang signifikan antara kelompok (1) dan (2), tetapi tidak signifikan antara kelompok lain.
Simpulan Penelitian: Dari penelitian ini dapat disimpulkan bahwa pemberian ekstrak kulit buah Delima Merah dapat menaikkan jumlah eritrosit dan kadar hemoglobin namun tidak signifikan (p>0,05).
Kata kunci: Gelombang elektromagnetik ponsel, kulit buah delima merah,
commit to user
vABSTRACT
Novarina Ratnaningtyas, G0007114, 2010. The Effect of Red Pomeganate
(Punica ganatum) Peel Extract with Erythrocyte Count and Hemoglobin
Level Rats Exposed to Mobile Phone Electromagnetic Radiation.
Objective: To examine the effect of red pomeganate (Punica ganatum) peel extract with erythrocyte count and hemoglobin level rats exposed to mobile phone electromagnetic radiation.
Methode: This study was a laboratory experimental post test only control goup design. The subjects used were 32 male rats divided into 4 goups: (1) Control goup; (2) Exposed mobile phone electromagnetic radiation goup; (3) Exposed mobile phone electromagnetic radiation goup with red pomeganate peel extract pre and during exposed; (4) Exposed mobile phone electromagnetic radiation goup with red pomeganate peel extract pre, during, and post exposed. After 41 days, blood was collected in clean tube with EDTA from orbitalis sinus rats. Blood used for erythrocyte count and hemoglobin level in Patology Clinic Laboratory, Faculty of Medicine Sebelas Maret University. The data obtained were statistic analyzed by independent t test using SPSS Progamme for Microsoft Windows release 16.0. Significance was set at p<0,05.
Result: Erythrocyte count of goup (1) 695,38±38,311;(2)627,00±42,393;
(3)661,00±63,833; (4)673,57±42,035. Hemoglobin level of goup (1) 12,425 ± 0,446;(2) 11,600 ± 0,489;(3) 11,857 ± 0,378; (4) 11,914 ± 0,598. Statistical analyses with independent t test showed that the result was significance between goup (1) an (2), but not significance for the other goup.
Conclusion: The experiment result showed that red pomeganat peel extract can increase the erythrocyte count and hemoglobin level rats exposed to mobile phone electromagnetic radiation but statistically insignificance (p>0,05).
Keyword: Mobile phone electromagnetic radiation, red pomeganate peel,
vi PRAKATA
Puji syukur ke hadirat Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan penyusunan skripsi yang
berjudul “Pengaruh Pemberian Ekstrak Kulit Buah Delima Merah (Punica
ganatum) terhadap Jumlah Eritrosit dan Kadar Hemoglobin pada Tikus Putih
(Rattus norvegicus) yang Dipapar Gelombang Elektromagnetik Ponsel”.
Penelitian dan penulisan skripsi ini dapat terlaksana dengan baik atas bantuan, bimbingan, saran dan dukungan dari berbagai pihak. Penulis menyampaikan terima kasih kepada :
1. Prof. Dr.H. A.A Subijanto, dr. M.S., selaku Dekan Fakultas Kedokteran Universitas Sebelas Maret Surakarta.
2. Muthmainah, dr., M.Kes., selaku Ketua Tim Skripsi beserta Staf Bagian Skripsi Fakultas Kedokteran Universitas Sebelas Maret Surakarta.
3. Isna Qodriyati, dr.,M.Kes, selaku Pembimbing Utama yang telah
memberikan bimbingan, saran, dan pengarahan bagi penulis.
4. Arif Suryawan, dr., selaku Pembimbing Pendamping yang telah
memberikan bimbingan, saran, dan motivasi bagi penulis.
5. Enny Ratna S., drg., selaku Penguji Utama yang telah memberikan
masukan dan saran dalam melengkapi kekurangan dalam penulisan skripsi ini.
6. Sutarmiadji D.P., Drs., M.Kes., selaku Penguji Pendamping yang telah memberikan bimbingan, kritik dan saran demi kesempurnaan penulisan naskah skripsi ini.
7. Seluruh Staf Laboratorium Fisika, Biokimia dan PK Fakultas Kedokteran Universitas Sebelas Maret Surakarta yang telah membantu proses penelitian ini.
Penulis menyadari bahwa penyusunan skripsi ini masih jauh dari sempurna. Oleh karena itu penulis mengharapkan saran dan kritik yang membangun. Semoga skripsi ini bermanfaat bagi dunia kedokteran pada khususnya dan masyarakat pada umumnya.
Surakarta, 29 Desember 2010
commit to user
DAFTAR LAMPIRAN... xii
BAB I PENDAHULUAN A. Latar Belakang Masalah... 1
B. Perumusan Masalah... 3
C. Tujuan Penelitian... 4
D. Manfaat Penelitian... 4
BAB II LANDASAN TEORI A. Tinjauan Pustaka 1. Gelombang Elektromagnetik Ponsel ………... 5
2. Sel Darah Merah (Eritrosit)………... 7
3. Hemoglobin ……….. 10
4. Kulit Buah Delima Merah………. 12
5. Tikus Putih ………... 18
6. Pengaruh Gelombang Elektromagnetik Ponsel terhadap Eritrosit dan Hemoglobin……….. 21
7. Hubungan Gelombang Elektromagnetik Ponsel dengan Mekanisme Pertahanan Ekstrak Kulit Buah Delima Merah…. 22 B. Kerangka Pemikiran ………. 23
C. Hipotesis ………... 23
BAB III METODE PENELITIAN A. Jenis Penelitian... 24
viii
C. Subyek Penelitian... 24
D. Teknik Sampling... 24
E. Rancangan Penelitian... 26
F. Identifikasi Variabel Penelitian... 27
G. Definisi Operasional Variabel... 27
H. Alat dan Bahan Penelitian... 30
I. Cara Kerja... 31
J. Teknik Analisis Data... 36
BAB IV HASIL PENELITIAN A. Hasil Penelitian... 38
B. Analisis Data... 40
BAB V PEMBAHASAN... 48
BAB VI SIMPULAN DAN SARAN A. Simpulan ... 54
B. Saran ... 54
DAFTAR PUSTAKA... .. 56
commit to user
ixDAFTAR TABEL
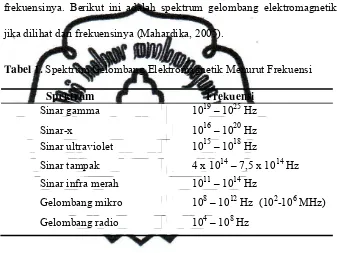
Tabel 1. Spektrum Gelombang Elektromagnetik Menurut Frekuensi……… 6
Tabel 2. Kandungan Kimia dan Efek Farmakologis Kulit Buah Delima Merah………... ……… 14
Tabel 3. Sifat Biologi Tikus Putih (Rattus norvegicus)………... 19
Tabel 4. Rerata Jumlah Eritrosit dari Setiap Kelompok………... 38
Tabel 5. Rerata Kadar Hemoglobin dari Setiap Kelompok……… 39
Tabel 6. Hasil Uji Shapiro-Wilk Jumlah Eritrosit pada Setiap Kelompok………...………….. 41
Tabel 7. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok K dan P1……… 41
Tabel 8. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok K dan P2……… 41
Tabel 9. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok K dan P3………... 42
Tabel 10. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok P1 dan P2………... 42
Tabel 11. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok P1 dan P3………... 43
Tabel 12. Hasil Uji Levene’s dan Uji tTidak Berpasangan Jumlah Eritrosit Kelompok P2 dan P3………. 43
Tabel 13. Hasil Uji Shapiro-Wilk Kadar Hemoglobin pada Setiap Kelompok………... 44
Tabel 14. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Kadar Hemoglobin pada Kelompok K dan P1………. 44
x
Tabel 16. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Kadar
Hemoglobin Kelompok K dan P3.………... 45
Tabel 17. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Kadar
Hemoglobin Kelompok P1 dan P2………... 46
Tabel 18. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Kadar
Hemoglobin Kelompok P1 dan P3………... 46
Tabel 19. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Kadar
Hemoglobin Kelompok P2 dan P3………. 47
commit to user
xiDAFTAR GAMBAR
Gambar 1. Mekanisme Pembentukan Eritrosit……….. 9
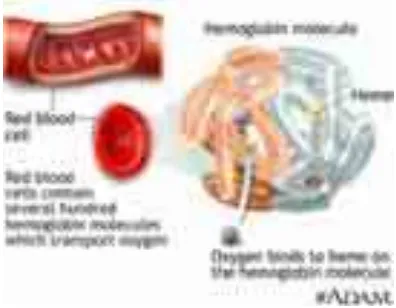
Gambar 2. Struktur Hemoglobin……… 11
Gambar 3. Buah Delima Merah ….………... 13
Gambar 4.Ellagic Acid……….. 15
Gambar 5.Punicalagin……… 16
Gambar 6. Rancangan Penelitian……… 26
Gambar 7. Diagam Batang Rerata Jumlah Eritrosit……….. 39
xii
DAFTAR LAMPIRAN
Lampiran 1. Hasil Pengukuran Jumlah Eritrosit pada Setiap Kelompok…… 61
Lampiran 2. Hasil Uji Shapiro-Wilk Jumlah Eritrosit pada Setiap Kelompok 62 Lampiran 3. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah
Lampiran 9. Hasil Pengukuran Kadar Hemoglobin pada Setiap Kelompok.... 69
Lampiran 10. Hasil Uji Shapiro-Wilk Kadar Hemoglobin pada Setiap
Kelompok……….. 70
Lampiran 11. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Kadar
Hemoglobin Kelompok K dan P1……… 71
Lampiran 12. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Kadar
Hemoglobin Kelompok K dan P2……… 72
Lampiran 13. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Kadar
Hemoglobin Kelompok K dan P3……… 73
Lampiran 14. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Kadar
Hemoglobin Kelompok P1 dan P2………... 74
Lampiran 15. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Kadar
commit to user
xiiiLampiran 16. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Kadar
Hemoglobin Kelompok P2 dan P3……… 76
Lampiran 17. Surat Keterangan Kelaikan Etik... 77
1 BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Kemajuan teknologi komunikasi telah banyak membantu memenuhi
kebutuhan manusia. Ponsel sebagai bagian dari kemajuan teknologi
menggunakan gelombang elektromagnetik sebagai medianya sehingga praktis
dan bisa digunakan di manapun (Mahardika, 2009). Potensi radiasi ponsel
tersebut semakin besar, mengingat penggunaan ponsel telah demikian luas di
masyarakat. Paling tidak ke depan dengan jumlah penduduk Indonesia sekitar
220 juta jiwa, sudah 25 juta pelanggan yang menggunakan ponsel
(Swamardika, 2009).
Efek gelombang elektromagnetik tergantung jenis, frekuensi, energi dan
durasi paparan (Balmori, 2005). Energi yang ditimbulkan oleh radiasi
elektromagnetik ponsel, secara kuantitas relatif kecil namun bila jarak antara
ponsel dengan kepala diperhitungkan maka dampak radiasi elektromagnetik
yang dipancarkan oleh ponsel tidak boleh diabaikan begitu saja. Hal ini
disebabkan intensitas radiasi elektromagnetik yang diterima oleh materi akan
berbanding terbalik dengan kuadrat jarak, artinya makin dekat dengan sumber
commit to user
Pada penelitian yang menggunakan pemaparan gelombang
elektromagnetik ponsel pada tikus putih (Rattus norvegicus), didapatkan
penurunan sistem antioksidan yang ditunjukkan dengan peningkatan stres
oksidatif pada hati dan otak (Achudume dkk, 2009). Penelitian yang
dilakukan Devrim (2002) memperoleh hasil gelombang elektromagnetik
ponsel dapat menyebabkan stres oksidatif pada eritrosit, hati, jantung, dan
ovarium tikus putih (Rattus norvegicus) dan vitamin C sebagai antioksidan,
terbukti dapat melindunginya stres oksidatif. Menurut Yurekli dkk (2006),
radiasi mempuyai efek terhadap struktur dan fungsi sel terutama sel yang
mempunyai membran lipid.
Eritrosit memiliki struktur membran yang salah satu komposisinya
adalah lipid. Komponen di dalamnya, yakni hemoglobin mempuyai fungsi
penting untuk membawa oksigen ke jaringan. Perubahan struktur dan fungsi
membran sel pada eritrosit dapat menyebabkan hal yang mengganggu bahkan
membahayakan (Muray dkk, 2003).
Antioksidan sangat penting untuk menjaga kerusakan sel yang
disebabkan oleh stres oksidatif. Untuk memperlambat proses oksidasi,
diperlukan penambahan antioksidan dari luar tubuh. Berdasarkan jenisnya,
antioksidan ada yang berbentuk sintetik, yaitu diperoleh dari hasil sintesa
reaksi kimia, dan ada yang alami, yaitu hasil ekstraksi bahan alami. Beberapa
contoh antioksidan sintetik antara lain Butil Hidroksi Anisol (BHA), Butil
Hidroksi Toluen (BHT), Propil Galat (PG), Tert-Butil Hidrokuinon (TBHQ),
diketahui dapat meningkatkan terjadinya kanker sehingga penggunaan
antioksidan alami mengalami peningkatan. Antioksidan alami adalah
antioksidan yang terdapat dalam makanan, seperti sayuran, buah, atau susu
sapi (Amarowicz dkk, 2000). Salah satu sumber antioksidan alami adalah
Delima Merah (Amalia dan Balittro, 2009).
Bagian pohon Delima Merah seperti buah, kulit, dan akarnya mempunyai
rasa yang sepat. Rasa yang sepat ini merupakan tanda bahwa di dalam bagian
tanaman tersebut mengandung senyawa polifenol (Wiryowidagdo, 2007).
Kandungan polifenol pada ekstrak kulit buah Delima Merah yang berfungsi
sebagai antioksidan mencapai 26% dari seluruh kandungan kimia yang
terdapat di dalamnya (Ferlina, 2009). Namun manfaat kulit buah Delima
Merah kurang banyak diketahui oleh masyarakat sehingga penggunaan kulit
Delima Merah masih minimal.
Berdasarkan uraian di atas, maka penulis tertarik untuk meneliti
pengaruh pemberian ekstrak kulit buah Delima Merah (Punica ganatum)
terhadap jumlah eritrosit dan kadar hemoglobin pada tikus putih (Rattus
norvegicus) yang dipapar gelombang elektromagnetik ponsel.
B. Perumusan Masalah
Adakah pengaruh pemberian ekstrak kulit buah Delima Merah (Punica
ganatum) terhadap jumlah eritrosit dan kadar hemoglobin pada tikus putih
commit to user
C. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian ekstrak
kulit buah Delima Merah (Punica ganatum) terhadap jumlah eritrosit dan
kadar hemoglobin pada tikus putih (Rattus norvegicus) yang dipapar
gelombang elektromagnetik ponsel.
D. Manfaat Penelitian
1.Manfaat Ilmiah
Penelitian ini diharapkan dapat memberikan informasi ilmiah
mengenai pengaruh pemberian kulit buah Delima Merah (Punica
ganatum) terhadap jumlah eritrosit dan kadar hemoglobin pada tikus
putih (Rattus norvegicus) yang dipapar gelombang elektromagnetik
ponsel sehingga dapat dipakai sebagai bahan pertimbangan untuk
penelitian selanjutnya
2.Manfaat aplikatif
Sebagai bahan pertimbangan dalam mengembangkan buah Delima
5 BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Gelombang Elektromagnetik Ponsel
Gelombang elektromagnetik adalah gelombang yang terbentuk dari
medan magnetik dan medan listrik. Kedua medan ini bergetar dalam arah
yang saling tegak lurus. Medan magnetik dan medan listrik pembentuk
gelombang elektromagnetik adalah gelombang transversal, yang arah
rambatnya tegak lurus dengan arah getarnya (Mahardika, 2005).
Berdasarkan kemampuannya dalam membentuk ion, radiasi
gelombang elektromagnetik dibedakan menjadi radiasi pengion dan
radiasi non-pengion. Radiasi pengion didefinisikan sebagai penyebaran
atau emisi energi yang bila melalui suatu media dan terjadi proses
penyerapan, berkas energi tersebut akan mampu menginduksi terjadinya
proses ionisasi dalam media tersebut. Termasuk dalam kelompok radiasi
pengion adalah sinar-x dan sinar gamma. Sedangkan radiasi non pengion
didefinisikan sebagai penyebaran atau emisi energi yang bila melalui
suatu media dan terjadi proses penyerapan, berkas energi radiasi tersebut
commit to user
tersebut. Contoh gelombang elektromagnetik nonpengion antara lain
sinar ultra violet, cahaya tampak, infra merah, gelombang mikro
(microwave) dan gelombang radio (Alatas dan Lusiyanti, 2003).
Gelombang elektromagnetik juga dapat diklasifikasikan berdasarkan
frekuensinya. Berikut ini adalah spektrum gelombang elektromagnetik
jika dilihat dari frekuensinya (Mahardika, 2005).
Tabel 1. Spektrum Gelombang Elektromagnetik Menurut Frekuensi
Spektrum Frekuensi
Sinar gamma 1019 – 1025 Hz
Secara umum sistem yang digunakan telepon seluler terbagi menjadi
dua yaitu Global Sytem for Mobile Telecommunication (GSM), yang
menggunakan frekuensi 800 MHz = 8 x 108 Hz , 900 MHz = 9 x 108 Hz
dan 1800 MHz = 1,8 x 109 Hz, dan Code Division Multiple Acces
(CDMA), yang menggunakan frekuensi 450 MHz = 4,5 x 108 Hz, 800
MHz = 8 x 108 Hz dan 1900 MHz =1,9 x 109 Hz (Mahardika, 2005).
Berdasarkan kemampuanya dalam membentuk ion, gelombang
elektromagnetik ponsel termasuk dalam kelompok gelombang
gelombang yang digunakan oleh ponsel berada pada spektrum
gelombang mikro (Mahardika, 2005).
2. Sel Darah Merah (Eritrosit)
Eritrosit normal berbentuk cakram bikonkaf yang mempunyai garis
tengah rata-rata sekitar 7,8 mikrometer dan dengan ketebalan 2,5
mikrometer diukur dari bagian yang paling tebal, dan di tengahnya
mempunyai tebal 1 mikrometer atau kurang (Guyton dan Hall, 2007).
Proses pembentukan eritrosit (eritropoesis) bersifat sangat aktif.
Sekitar 2,5 juta eritrosit diproduksi setiap detiknya. Faktor utama yang
dapat merangsang produksi eritrosit adalah hormon eritropoetin yang
disekresi oleh ginjal terutama pada saat kadar O2 dalam darah menurun
(Fox, 2002).
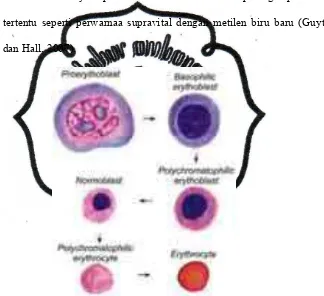
Sel pertama yang dikenal sebagai bagian dari rangkaian pembetukan
sel darah merah adalah proeritroblas. Proeritroblas adalah sel yang
terbesar dari rangkaian pembentukan sel darah merah, dengan diameter
sekitar 15-20 µm, inti mempunyai pola kromatin yang seragam, dan satu
atau dua anak inti yang mencolok. Setelah pewarnaan Leishman atau
Giemsa, sitoplasma proeritroblas bersifat basofilik sedang (berwarna biru
muda). Proeritroblas kemudian menjadi eritroblas basofil. Eritroblas
basofil agak lebih kecil dari pada proeritroblas dan diameternya rata-rata
10µm. Intinya mempunyai heterokromatin padat dalam jala-jala kasar,
commit to user
Giemsa, sitoplasma eritroblas basofil bersifat basofilik (berwarna biru
tua). Hal ini sejalan dengan peningkatan jumlah ribosom bebas dan
polirobosom. Pada stadium eritroblas basofil mulai disentesis
hemoglobin di mitokondria (Guyton dan Hall, 2007).
Eritroblas basofil membelah berkali-kali secara mitosis dan
menghasilkan eritroblas polikromatofil. Setelah pewarnaan Leishman
atau Giemsa, sitoplasma eritroblas polikromatofil warnanya
berbeda-beda, dari biru ungu sampai lila atau abu-abu. Jadi mereka adalah
polikromatofil. Inti eritroblas polikromatofil mempunyai jala kromatin
lebih padat dari pada eritroblas basofil, dan selnya lebih kecil.. Eritroblas
polikromatofil membelah beberapa kali secara mitosis. Sifat basofil
sitoplasma berkurang dan jumlah hemoglobin bertambah sampai
mencapai suatu jumlah sehingga sitoplasmanya terpulas kurang lebih
merah seperti eritrosit dewasa. Sel-sel yang menunjukkan derajat asidofil
yang demikian disebut normoblas (Guyton dan Hall, 2007).
Normoblas lebih kecil dari pada eritroblas polikromatofil dan
mengandung inti yang lebih kecil yang terwarnai basofil padat. Intinya
secara bertahap menjadi piknotik. Tidak ada lagi aktivitas mitosis.
Akhirnya inti dikeluarkan dari sel bersama-sama dengan pinggiran tipis
sitoplasma. Inti yang sudah dikeluarkan dimakan oleh
makrofag-makrofag yang ada di dalam stroma sumsum tulang. Normoblas
kemudian menjadi retikulosit. Retikulosit adalah sel eritrosit yang belum
berkembang dan matang di sumsum tulang merah dan disirkulasikan
dalam pembuluh darah sebelum matang menjadi eritrosit. Seperti
eritrosit, retikulosit tidak memiliki inti sel (nukelus). Sel ini disebut
retikulosit karena memiliki jaringan seperti retikuler pada ribosom RNA.
Retikuler ini hanya dapat diamati di bawah mikroskop dengan pewarnaan
tertentu seperti perwarnaa supravital dengan metilen biru baru (Guyton
dan Hall, 2007).
Gambar 1. Mekanisme Pembentukan Eritrosit
Jumlah eritrosit normal pada laki-laki 4,6-6,2 juta/mm3 dan pada
wanita 4,2-5,4 juta/mm3. Eritrosit memiliki struktur yang lebih sederhana
dibandingkan dengan sel manusia yang lain. Walaupun tidak
mempunyai inti, lisosom (apparatus golgi) dan mitokondria, eritrosit
mempunyai enzim-enzim sitoplasma yang sanggup mensintesis ATP
commit to user
Eritrosit dibungkus oleh membran dengan permeabilitas yang
selektif dan berfungsi sebagai sawar untuk mempertahankan perbedaan
komposisi antara bagian dalam dan bagian luar. Perubahan nyata pada
struktur membran dapat mempengaruhi keseimbangan air serta aliran ion,
dan demikian pula segala proses di dalamnya (Muray dkk, 2003).
Membran eritrosit tersusun atas karbohidrat, protein, oligosakarida
dan lipid (fosfolipid, kolesterol, glikolipid). Fosfolipid merupakan lipid
yang jumlahnya paling banyak. Membran eritrosit dapat ditembus air dan
mudah dilalui ion H+, OH-, NH4, PO42-, HCO3-, glukosa, asam amino,
urea dan asam urat tetapi tidak dapat ditembus oleh Na+, K+, Ca2+, Mg2+,
fosfat organik dan protein plasma (Indera dkk,2006). Enzim-enzim
dalam eritrosit berfungsi mempertahankan kelenturan membran sel,
mempertahankan transport ion melalui membran, menjaga besi
hemoglobin agar tetap dalam bentuk fero, dan mencegah oksidasi protein
di dalam eritrosit (Guyton dan Hall, 2007). NADPH, yang diproduksi
dalam reaksi yang dikatalis oleh enzim glikosa 6-fosfat dehidrogenase,
memainkan peran penting dalam memasok ekuivalen pereduksi di dalam
eritrosit (Muray dkk, 2003).
3.Hemoglobin
Sintesis hemoglobin terjadi di mitokondria dalam stadium eritroblas
basofil (Guyton dan Hall, 2007). Proses pembentukan hemoglobin
berikatan dengan glisin untuk membentuk molekul pirol. Kemudian,
empat pirol bergabung untuk membentuk protoporfirin IX, yang
kemudian bergabung dengan besi untuk membentuk molekul heme.
Akhirnya setiap molekul heme bergabung dengan rantai polipeptida
panjang, yaitu globin yang disintesis oleh ribosom, membentuk suatu
subunit hemoglobin yang disebut rantai hemoglobin (Guyton dan Hall,
2007). Dalam tiap molekul hemoglobin terkandung 4 Fe. Salah satu
fungsi hemoglobin yaitu mengangkut oksigen. Hemoglobin membawa 20
ml oksigen dalam setiap 100 ml darah (Ganong, 2002).
Proses penguraian hemoglobin sangat kompleks. Hemoglobin yang
dilepaskan saat eritrosit lisis, akan difagosit oleh sel-sel makrofag dalam
tubuh, terutama oleh sel-sel Kuplffer hati, makrofag limpa, dan
makrofag sumsum tulang. Makrofag melepaskan besi dari hemoglobin
untuk pembentukan eritrosit yang baru, sedangkan bagian purpirin akan
menjadi pigmen empedu bilirubin(Guyton dan Hall, 2007).
commit to user
4.Kulit Buah Delima Merah
Delima Merah atau Punica ganatum adalah salah satu pohon kecil
atau semak belukar, termasuk dalam keluarga Punicaceae. Pohon
ditemukan tumbuh liar di Arabia, Afghanistan dan Pakistan. Berbagai
bagian pohon Delima Merah bermanfaat untuk kesehatan manusia
(Wiryowidagdo, 2007).
a. Taksonomi buah Delima Merah menurut Yuniarti (2008).
Kingdom : Plantae
Divisio : Spermatophyta
Sub divisio : Angiospermae
Klasis : Dicotyledonae
Ordo : Myrtales
Familia : Punicaceae
Genus : Punica
Spesies : Punica ganatum L
Varietas yang dipakai dalam penelitian adalah Delima Merah
b. Nama lokal
Delima mempunyai nama berbeda di beberapa daerah di
Indonesia, antara lain disebut delima oleh Melayu di Sumatera, glima
(Aceh), glineu mekah (Gayo), dalimo (Batak), gangsalan (Jawa),
dalima (Sunda), dhalima (Madura), jeliman (Sasak), talima (Bima),
dila dae lok (Roti), lele kase dan rumu (Timor), dan sedang di daerah
c. Morfologi
Pohon Delima Merah berupa perdu atau pohon kecil dengan
tinggi 2-5 m. Batang berkayu, percabangan banyak, lemah, berduri
pada ketiak daunnya, berwarna cokelat. Daun tunggal, bertangkai
pendek, letaknya berkelompok. Helaian daun bentuknya lonjong
sampai lanset, pangkal lancip, ujung tumpul, tepi rata, pertulangan
menyirip, permukaan mengilap, panjang 1-9 cm, lebar 0,5-2,5 cm,
warnanya hijau (Dalimartha, 2007).
Bunga tunggal bertangkai pendek, keluar dari ujung ranting atau
ketiak daun yang paling atas. Biasanya terdapat satu sampai lima
bunga, warnanya merah, putih atau ungu. Berbunga sepanjang tahun.
Buahnya buah buni bentuknya bulat dengan diameter 5-12 cm, warna
kulitnya beragam seperti hijau keunguan, putih, cokelat kemerahan
atau ungu kehitaman. Bijinya banyak, kecil-kecil, bentuknya bulat
panjang tersusun tidak beraturan, warnanya merah, merah jambu atau
putih (Dalimartha, 2007).
commit to user
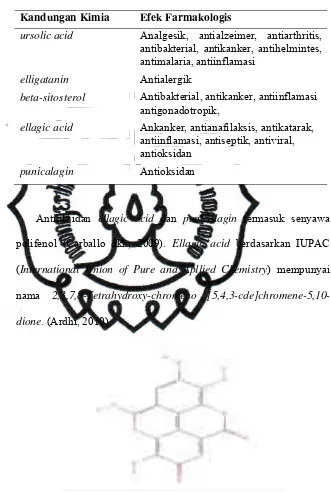
d. Kandungan kimia kulit buah Delima MerahKulit buah Delima Merah mengandung alkaloid pelletierene,
ganatin, betulic acid, ursolic acid, isoquercitrin, resin, triterpenoid,
kalsium oksalat dan pati. (Dalimartha, 2007). Selain itu terdapat
kandungan seperti beta-sitosterol, casuarin, casuarinin, D-mannitol,
ellagic acid, ellagitanin, friedelin, isopelletierine,
methyl-isopelletierine, methyl-pelletierine, psuedopelletierine,
punicacorteins, dan punigluconin (Duke, 2010).
e. Efek farmakologis kulit buah Delima Merah
Masyarakat sudah banyak menggunakan kulit buah Delima
Merah untuk sakit perut karena cacing, buang air besar yang
mengandung darah dan lendir (disentri amoeba), diare kronis,
perdarahan (wasir berdarah, muntah darah, batuk darah, perdarahan
rahim, perdarahan rektum), prolaps rektum, radang tenggorok,
radang telinga, keputihan, dan nyeri lambung (Dalimartha, 2007).
Menurut Duke (2010) kandungan kulit buah Delima Merah yang
mempunyai efek farmakologis dapat dilihat pada tabel berikut.
Tabel 2. Kandungan Kimia dan Efek Farmakologis Kulit Buah Delima Merah
Kandungan Kimia Efek Farmakologis
pelletierene Antihelmintes
ganatin Antihepatotoksik
betulic acid Anthelmintes, antibakterial, antikanker,
Tabel 2. Kandungan Kimia dan Efek Farmakologis Kulit Buah Delima Merah (lanjutan)
Kandungan Kimia Efek Farmakologis
ursolic acid Analgesik, antialzeimer, antiarthritis,
antibakterial, antikanker, antihelmintes, antimalaria, antiinflamasi
elligatanin Antialergik
beta-sitosterol Antibakterial, antikanker, antiinflamasi
antigonadotropik,
ellagic acid Ankanker, antianafilaksis, antikatarak,
antiinflamasi, antiseptik, antiviral, antioksidan
punicalagin Antioksidan
Antioksidan ellagic acid dan punicalagin termasuk senyawa
polifenol (Carballo dkk, 2009). Ellagic acid berdasarkan IUPAC
(International Union of Pure and Apllied Chemistry) mempunyai
nama 2,3,7,8-Tetrahydroxy-chromeno
[5,4,3-cde]chromene-5,10-dione. (Ardhi, 2010).
commit to user
Senyawa polifenol lain yang adalah punicalagin. Punicalagin
mempunyai nama IUPAC
2,3-(S)-hexahydroxydiphenoyl-4,6-(S,S)-gallagyl-D-glucose (Shaanxi, 2000).
Gambar 5. Punicalagin (Thomas, 2009)
Polifenol (polyphenol) merupakan senyawa kimia yang bersifat
antioksidan kuat. Antioksidan dapat didefinisikan sebagai suatu zat
yang dapat menghambat atau memperlambat proses oksidasi.
Oksidasi adalah jenis reaksi kimia yang melibatkan pengikatan
oksigen, pelepasan hidrogen, atau pelepasan elektron. Sifat
antioksidan polifenol 100 kali lebih efektif dibandingkan vitamin C
dan 25 kali lebih tinggi dibandingkan vitamin E. Polifenol ini
berperan melindungi sel tubuh dari kerusakan akibat radikal bebas
Bila terjadi reaksi oksidasi pada membran eritrosit di mana
reaksi tersebut menghasilkan hasil samping berupa radikal bebas
(OH-) maka tanpa adanya kehadiran antioksidan, radikal bebas ini
akan menyerang molekul-molekul lain di sekitarnya. Hasil reaksi ini
akan dapat menghasilkan radikal bebas yang lain yang siap
menyerang molekul yang lainnya lagi. Akhirnya akan terbentuk
reaksi berantai yang sangat membahayakan.
Tanpa adanya antioksidan
Reaktan → Produk + OH-
OH- + (DNA,protein, lipid) →Produk + Radikal bebas yang lain
Radikal bebas yang lain akan memulai reaksi yang sama dengan
molekul yang ada di sekitarnya.
Berbeda halnya bila terdapat antioksidan. Radikal bebas akan
segera bereaksi dengan antioksidan membentuk molekul yang stabil
dan tidak berbahaya. Reaksi radikal bebas dengan molekul sel
tubuhpun berhenti sampai di sini.
Dengan adanya antioksidan
Reaktan → Produk + OH-
OH-+ H+ →Produk yang stabil
Senyawa polifenol sebagai senyawa antioksidan mampu
menyumbangkan atom hidrogen ke radikal bebas untuk menetralkan
commit to user
5.Tikus Putih
Tikus putih (Rattus norvegicus) merupakan salah satu spesies tikus
yang dijumpai di perkotaan dan digunakan sebagai hewan percobaan
(Abel, 2008).
a. Taksonomi tikus putih (Rattus norvegicus) menurut Sugiyanto
(1995)
Filum : Chordata
Subfilum : Vertebrata
Classis : Mammalia
Subclassis : Placentalia
Ordo : Rodentia
Familia : Muridae
Genus : Rattus
Species : Rattus norvegicus
b. Morfologi tikus putih (Rattus norvegicus)
Tikus putih (Rattus norvegicus) galur Wistar mempunyai ciri
kepala lebar, telinga panjang, dan mempunyai ekor yang panjangnya
tidak melebihi panjang tubuhnya, berbulu putih, mata berwarna
merah, moncong tumpul, telinga dan mata kecil. Tikus putih (Rattus
norvegicus) galur Wistar memiliki sifat pemalu, gugup jika ada
menyukai daging dan kacang, ahli berenang, bisa memanjat namun
tidak ahli (Sugiyanto, 1995).
c. Sifat biologi tikus putih (Rattus norvegicus)
Tabel 3. Sifat Biologi Tikus Putih (Rattus norvegicus) menurut Mangkoewidjojo dan John Smith (1988)
Sifat Biologis Tikus Putih Keterangan
Berat badan
Kelahiran 5-6 g
Menyapih 30-55 g
Pubertas 150-200 g
Usia12 minggu (jantan) 200-400 g
Dewasa (jantan) 300-800 g
Perkembangan
Mantel bulu 9 hari
Gigi seri muncul 8-10 hari
Geraham pertama muncul 19 hari
Turunya testis 15-50 hari
Pubertas (jantan) 39-47 hari
Fisiologi
Suhu rektal 38-39 º C
Denyut jantung 320-480 bpm
Tekanan darah sistolik 75-120 mm Hg
Tekanan darah diastolik 60-90 mm Hg
Respiratory rate 85-110 napas / menit
Konsumsi makanan
Makanan 5 g/100 g BB
Minuman 8-11 ml/100 g BB
Urine out put perhari 5,5 ml/100g BB
Darah
Volume darah 5,6-7,1 ml/100 g BB
Volume plasma 3,08-3,67 ml/100 g BB
Jumlah eritrosit 7-10 x 106 eritrosit/mm3
commit to user
Tabel 3. Sifat Biologi Tikus Putih (Rattus norvegicus) menurut Mangkoewidjojo dan John Smith (1988) (lanjutan)
Sifat Biologis Tikus Putih Keterangan
Leukosit total 9 (6-18) x 103/mm3
d. Karakteristik tikus putih (Rattus norvegicus)
Tikus putih (Rattus norvegicus) sebagai hewan percobaan
relatif resisten terhadap infeksi dan sangat cerdas. Tikus putih tidak
begitu bersifat fotofobik seperti halnya mencit (Mus musculus) dan
kecenderungan untuk berkumpul dengan sesamanya tidak begitu
besar. Aktivitasnya tidak terganggu oleh adanya manusia di
sekitarnya (Mangkoewidjojo dan John Smith, 1988).
Tikus putih jantan jarang berkelahi seperti mencit jantan. Tikus
putih dapat tinggal sendirian dalam kandang dan hewan ini lebih
besar dibandingkan dengan mencit, sehingga untuk percobaan
laboratorium, tikus putih lebih menguntungkan (Mangkoewidjojo
dan John Smith, 1988).
Pada penelitian ini digunakan tikus putih jantan sebagai binatang
percobaan karena tikus putih jantan dapat memberikan hasil
siklus menstruasi dan kehamilan seperti pada tikus putih betina.
Tikus putih jantan juga mempunyai kecepatan metabolisme obat
yang lebih cepat dan kondisi biologis tubuh yang lebih stabil
dibanding tikus betina (Sugiyanto, 1995).
6.Pengaruh Gelombang Elektromagnetik Ponsel terhadap Eritrosit dan
Hemoglobin
Menurut penelitian Achudume (2009), gelombang
elektromagnetik ponsel dapat menyebabkan stres oksidatif pada hati dan
otak tikus putih (Rattus norvegicus). Sedangkan menurut penelitian
Devrim (2002), radiasi gelombang elektromagnetik ponsel pada tikus
putih selama 40 menit perhari selama 28 hari didapatkan peningkatan stes
oksidatif yang ditandai dengan adanya peroksidasi lipid eritrosit.
Indera dkk (2006) mengemukakan bahwa peroksidasi lipid pada
membran eritrosit dapat meningkatkan fragilitas atau kerapuhan membran
eritrosit yang selanjutnya mengakibatkan eritrosit akan mudah pecah atau
hemolisis dan menyebabkan hemoglobin terbebas. Destruksi hemoglobin
akan menghasilkan heme dan globin, sehingga hemoglobin yang terbebas
commit to user
7.Hubungan Gelombang Elektomagnetik Ponsel dengan Mekanisme
Pertahanan Ekstrak Kulit Buah Delima Merah
Telah diketahui bahwa gelombang elektromagnetik dapat
menyebabkan peroksidasi lipid. Dalam proses peroksidasi lipid, akan
terbentuk radikal bebas hidroksil (OH-) (Yasoubi dkk, 2007). Radikal
hidroksil adalah oksidan yang sangat reaktif dan tidak stabil. Radikal
hidroksil tersebut dapat bereaksi dengan hampir semua substrat biologik
(Gitawati, 1995).
Antioksidan yang paling banyak terdapat di buah Delima Merah
adalah polifenol (Amalia dan Balittro, 2009). Penelitian yang dilakukan
oleh Toklu dkk (2009) membuktikan bahwa ekstrak kulit buah Delima
Merah yang diekstrak dengan methanol mengandung antioksidan
polifenol yang dapat menurunkan stes oksidatif pada ilueum tikus putih
(Rattus norvegicus).
Senyawa polifenol mampu memutus rantai reaksi pembentukan
radikal bebas hidroksil. Dalam hal ini memberikan atom hidrogen yang
berasal dari gugus hidroksi senyawa fenol sehingga terbentuk senyawa
yang stabil. Dengan demikian reaksi oksidasi dapat dihambat sehingga
kerusakan sel darah merah akibat stres oksidatif dapat dicegah (Winarsi,
B. Kerangka Pemikiran
Terdapat pengaruh pemberian ekstrak kulit buah Delima Merah
(Punica ganatum) terhadap jumlah eritrosit dan kadar hemoglobin pada tikus
(Rattus norvegicus) yang dipapar gelombang elektromagnetik ponsel.
Hemolisis eritrosit
Fragilitas membran eritrosit meningkat Peroksidasi lipid
b i i
Stres oksidatif pada membran eritrosit
Paparan gelombang elektromagnetik ponsel pada tikus putih (Rattus norvegicus)
Jumlah eritrosit dan kadar hemoglobin menurun
commit to user
24 BAB IIIMETODE PENELITIAN
A. Jenis Penelitian
Penelitian yang dilakukan bersifat eksperimental laboratorik (Arief,
2004).
B. Lokasi Penelitian.
Penelitian dilakukan di Laboratorium Biokimia Fakultas Kedokteran
Universitas Sebelas Maret, Surakarta.
C. Subjek Penelitian
Subjek penelitian adalah tikus putih (Rattus norvegicus) galur Wistar
dengan umur kurang lebih 2 bulan jenis kelamin jantan dan berat ± 200 gam.
D. Teknik Sampling
Dalam penelitian ini pengambilan sampel dilakukan dengan metode
purposive sampling, yakni pemilihan sampel berdasarkan kriteria inklusi dan
eksklusi. Sedangkan pengelompokan sampel dilakukan dengan teknik simple
random sampling. Setiap subjek penelitian diberi nomor urut terlebih dahulu
kemudian ditulis pada secarik kertas dan dimasukkan ke dalam kotak untuk
yang dikehendaki tanpa memasukkan kembali kertas yang telah terambil.
Setiap subjek yang nomor urutnya terambil menjadi anggota kelompok
sampel (Arief, 2004).
Sampel akan dibagi menjadi empat kelompok. Besar sampel tiap
kelompok dihitung dengan rumus Federer. Penelitian ini membagi sampel
menjadi 4 kelompok sehingga t=4.
(n-1)(t-1) > 15
(n-1)(4-1) > 15
3n > 18
n > 6 (Federer, 1974)
Keterangan:
n = jumlah sampel tiap kelompok
t = jumlah kelompok
Berdasarkan perhitungan tersebut maka jumlah sampel minimal yang
diperlukan adalah 6 ekor tikus putih untuk setiap kelompok percobaan.
Peneliti memakai 8 tikus dalam tiap kelompok percobaan. Sehingga besar
commit to user
E. Rancangan Penelitian
Penelitian ini menggunakan rancangan ThePost Uji Only Control Goup
Design (Arief, 2004).
Gambar 6. Rancangan Penelitian
Keterangan:
K = Kelompok kontrol, tanpa diberi ekstrak kulit buah Delima Merah maupun gelombang elektromagnetik ponsel.
P1 = Kelompok perlakuan I, dipapar gelombang elektromagnetik ponsel selama 4 jam setiap hari pada pukul 7.00 sampai 11.00 selama 14 hari. Lama pemaparan mengacu pada penelitian oleh Mailankot dkk (2009) yang dimodifikasi.
P2 = Kelompok perlakuan II, diberi ekstrak kulit buah Delima Merah peroral 50 mg/Kg BB tikus/hari selama 10 hari sebelum pemaparan dan selama pemaparan gelombang elektromagnetik. Gelombang elektromagnetik dipaparkan pada hari ke 11 sampai hari ke 24 selama 4 jam setiap hari pada pukul 7.00 sampai 11.00. P3 = Kelompok perlakuan III, diberi ekstrak kulit buah Delima Merah
peroral 50 mg/Kg BB tikus/hari selama 10 hari sebelum pemaparan, selama pemaparan, dan 10 hari sesudah pemaparan gelombang elektromagnetik. Paparan gelombang elektromagnetik ponsel diberikan mulai hari ke 11 sampai hari ke 24 selama 4 jam setiap hari pada pukul 7.00 sampai 11.00.
HK = Perhitungan jumlah eritrosit dan kadar hemoglobin pada tikus kelompok kontrol.
HP1= Perhitungan jumlah eritrosit dan kadar hemoglobin pada tikus kelompok perlakuan I.
HP3 = Perhitungan jumlah eritrosit dan kadar hemoglobin pada tikus kelompok perlakuan III.
F. Idetifikasi Variabel Penelitian
1. Variabel bebas : ekstrak kulit buah Delima Merah (Punica ganatum).
2. Variabel terikat : jumah eritrosit dan kadar hemoglobin tikus putih
(Rattus norvegicus).
3. Variabel luar
a.Variabel luar terkendali : genetik, makanan, minuman, jenis
kelamin, jenis ponsel.
b.Variabel luar tak terkendali : hormonal, stres saat perlakuan.
G. Definisi Operasional Variabel
1. Variabel bebas : ekstrak kulit buah Delima Merah
Ekstrak kulit buah Delima Merah dibuat dengan ekstraksi ethanol
dengan dosis 50 mg/Kg BB tikus/hari mengacu pada penelitian Toklu dkk
(2009). Tikus putih (Rattus norvegicus) pada kelompok perlakuan II
diberikan ekstrak kulit buah Delima Merah sebelum dan selama
pemaparan gelombang elektromagnetik. Pemberian dengan dosis yang
sama pada kelompok perlakuan III diberikan pada tikus putih sebelum,
selama, dan sesudah pemaparan. Tikus putih pada kelompok perlakuan I
dan kontrol tidak diberikan ekstrak kulit buah Delima Merah. Skala yang
commit to user
2. Variabel terikat
a. Perhitungan jumlah eritrosit tikus putih (Rattus norvegicus)
Perhitungan eritrosit dilakukan dengan cara mengambil darah
tikus melalui sinus orbitalis dengan menggunakan tabung mikrokapiler
berukuran 1,5 ml. Jumlah eritrosit dihitung dalam 5 kotak sedang
kamar hitung Improved Neubeur. Jumlah eritrosit yang didapat
kemudian dikalikan 10.000. Satuan yang digunakan adalah jumlah
eritrosit dalam 1 mm3 (Gandasoebrata, 2001). Jumlah eritrosit normal
tikus putih 7-10 x 106 eritrosit/ mm3 (Mangkoewidjojo dan John Smith,
1988). Skala pengukuran yang digunakan adalah skala rasio (Arief,
2004).
b. Perhitungan kadar hemoglobin
Perhitungan kadar hemoglobin dilakukan dengan cara mengambil
darah tikus melalui sinus orbitalis dengan menggunakan tabung
mikrokapiler berukuran 1,5 ml. Kadar hemoglobin diukur
menggunakan metode Sahli. Satuan yang digunakan adalah g/dl
(Gandasoebrata, 2001). Kadar hemoglobin normal tikus putih 11-19
g/dl (Mangkoewidjojo dan John Smith, 1988) .Skala pengukuran yang
3. Variabel luar
a. Variabel luar terkendali
1) Genetik
Faktor genetik seperti adanya sel benih hematopoietik yang
mengalami proliferasi (pada polisitemia), pembentukan eritrosit
dalam kuantitas atau kualitas yang rendah (anemia) menentukan
jumlah eritrosit dan kadar hemoglobin. Faktor ini dapat
dikendalikan dengan cara menggunakan tikus dari strain yang
sama, yakni strain Wistar sehingga sampel bersifat homogen.
2) Makanan dan Minuman
Faktor ini dapat dikendalikan dengan cara pemberian
makanan pada kelompok perlakuan dibuat sama jenisnya, yaitu
makanan buatan pellet BR2. Pemberian makanan buatan pellet
BR2 dan air minum pada perlakuan disebut sebagai diet standar.
3) Jenis kelamin
Jumlah eritrosit pada pria dan wanita berbeda. Oleh karena itu
peneliti menggunakan sampel tikus putih (Rattus norvegicus)
yang berjenis kelamin jantan.
4) Jenis Ponsel
Jenis ponsel mempengaruhi jumlah eritrosit dan kadar
commit to user
b. Variabel luar tak terkendali
1) Hormonal
Hormon tiroksin, hormon pertumbuhan, epinefrin dan kortisol
meningkatkan eritropoesis sehingga dapat meningkatkan jumah
eritrosit. Hormon-hormon ini disekresi dalam tubuh dapat
berfluktuasi dalam keadaan tertentu misalnya dalam keadaan
sakit, stres dan hipoksia. Faktor ini tidak dapat dikendalikan.
2) Stres
Stres tidak mungkin dapat dihindari pada tikus yang
mendapat perlakuan. Faktor ini tidak dapat dikendalikan.
H. Alat dan Bahan Penelitian
1. Alat
a. Kandang tikus berbentuk kontak ( 60 x 30 x 30 cm) dilengkapi tempat
makan dan minum.
b. Timbangan dan wadah untuk menimbang berat badan tikus
c. Ponsel
d. Tabung mikrokapiler berukuran 1,5 ml
e. Tabung reaksi untuk menampung sampel darah
f. Rak tabung reaksi
g. Pipet air
i. Hemositometer : bilik hitung Improved Neuber dan pipet darah eritrosit
j. Satu set haemometer Sahli
k. Sonde lambung
2. Bahan
a. Makanan dan minuman hewan percobaan (pellet BR2 dan air PAM)
b. Ekstrak kulit buah Delima Merah
c. EDTA
d. Larutan Hayem untuk meghitung jumlah eritrosit
e. HCl 0,1 N
f. Aquades
I. Cara kerja
1. Persiapan Percobaan
a. Sampel
Sampel yang sudah diperoleh dengan metode purposivesampling
yakni pemilihan sampel berdasarkan kriteria inklusi dan eksklusi
kemudian dilakukan adaptasi di Laboratorium Biokimia Fakultas
Kedokteran Universitas Sebelas Maret Surakarta selama 7 hari dan
dilakukan pengelompokkan dengan teknik simple random sampling.
Setiap subjek penelitian diberi nomor urut terlebih dahulu kemudian
ditulis pada secarik kertas dan dimasukkan ke dalam kotak untuk
commit to user
sampel yang dikehendaki tanpa memasukkan kembali kertas yang
telah terambil. Setiap subjek yang nomor urutnya terambil menjadi
anggota kelompok sampel (Arief, 2004). Sampel dikelompokkan
menjadi 4 kelompok. Tiap kelompok 8 ekor. Pada hari I dilakukan
penimbangan dan penandaan.
b. Ekstrak Kulit Buah Delima Merah
Ekstraksi kulit buah Delima Merah dilakukan di LPPT UGM
dengan menggunakan metode ekstraksi ethanol dengan cara maserasi.
Kulit buah Delima Merah halus dimasukkan ke dalam sebuah bejana
kemudian menambahkan ethanol 90% ditutup rapat dan dibiarkan
selama 3 hari, terlindung dari cahaya matahari sambil diaduk sesekali
setiap hari. Ekstrak ethanol cair sampel tersebut dipekatkan
menggunakan rotary evaporator sampai diperoleh ekstrak pekat
ethanol (Darmawan, 2004). Bentuk akhir ekstrak kulit buah Delima
Merah adalah pasta atau semisolid. Dosis yang diberikan sebesar
50mg/Kg BB tikus /hari (Toklu dkk, 2009). Bila setiap tikus
mempunyai berat 200 gam, maka :
mg
Volume cairan maksimal yang dapat diberikan per oral pada tikus
adalah 5 ml/100g BB tikus (Ngatijan, 1991), disarankan takaran
karena itu dilakukan pengenceran ekstrak, dengan rincian 1 gam
ekstrak dilarutkan dalam 100 ml .
Bila dosis tiap tikus adalah 10 mg maka volume ekstrak yang
diberikan adalah 1 ml tiap tikus.
c. Ponsel
Ponsel diletakkan di dalam kandang tikus. Setiap kelompok satu
ponsel. Ponsel ditelepon selama 4 jam/hari pada pukul 7.00 sampai
11.00 selama 14 hari pada kelompok P1, P2, dan P3.
d. Kandang Pemaparan
Hewan coba ditempatkan dalam kandang yang terbuat dari kayu
dengan luas 3600 cm2 (60 x 30 x 30 cm). Setiap kandang dapat
menampung setiap kelompok (8 ekor hewan coba).
2. Pelaksanaan Percobaan
Pada minggu I, keempat kelompok perlakuan diberi pellet BR2 dan air
PAM agar semua tikus dapat beradaptasi dengan lingkungan baru. Pada
commit to user
kelompok. Sebelumnya masing-masing tikus ditimbang untuk menentukan
dosis perlakuan.
Pada minggu II, kelompok P1 dipapar gelombang elektromagnetik
yang berasal dari ponsel selama 4 jam setiap hari selama 14 hari. Kelompok
P2 dan P3 diberi ekstrak buah Delima Merah terlebih dahulu selama 10
hari, kemudian pada hari ke sebelas dipapar gelombang elektromagnetik
ponsel dan ekstrak buah Delima Merah tetap diteruskan. Setelah
pemaparan, pemberian ekstrak kulit buah Delima Merah pada kelompok P2
dihentikan sedangkan pada kelompok P3 pemberian ekstrak buah Delima
Merah masih diteruskan sampai 10 hari setelah pemaparan.
3. Metode Pengumpulan Data
Pengumpulan data dilakukan dengan perhitungan jumlah eritrosit
dengan hemositometer dan pembacaan kadar hemoglobin darah dengan
metode Sahli dari sampel darah.
a. Perhitungan jumlah eritrosit menurut Gandasoebrata (2001).
1) Menghisap darah dengan pipet darah eritrosit sampai tanda 0,5.
2) Dengan pipet darah yang sama, cairan Hayem dihisap sampai tanda
101.
3) Menggerak-gerakkan pipet darah eritrost tegak lurus dengan sumbu
pipet untuk mencampur darah dengan larutan Hayem.
4) Membuang beberapa tetes cairan darah yang telah diencerkan
5) Meneteskan larutan darah tersebut ke dalam kamar hitung
neubauer yang sudah ada kaca penutupnya.
6) Melihat di bawah mikroskop pada kotak eritrosit mula-mula
dengan pembesaran lemah, kemudian dengan pembesaran kuat.
7) Memastikan larutan tidak masuk (luber) ke kanal hemositometer
atau terbentuk gelembung udara di bawah kaca penutupnya.
8) Menghitung jumlah eritrosit dalam 5 kotak sedang dalam bilik
hitung Improved Neuber. Darah dihisap sampai tanda 0,5
diteruskan penghisapan larutan Hayem sampai tanda 101 berarti
terjadi pengenceran 200 kali. Berarti eritrosit yang didapat hanya
1/100 dari jumlah yang sebenarnya.
Luas 1 kotak sedang = 1/5 x 1/5 mm2
Luas 5 kotak sedang = 5 x 1/5 x 1/5= 5/25= 1/5 mm2
Tinggi kamar hitung = 0,1 mm2
Volume 5 kotak sedang= 1/5 mm x 0,1 mm =1/50 mm3
Bila dalam 5 kotak sedang didapatkan n eritrosit, berarti dalam
1/50 mm3= 200 n (pengenceran 200 kali). Dapat dikatakan bahwa
dalam 1 mm3= 10.000 n eritrosit.
b. Perhitungan kadar hemoglobin dengan metode Sahli menurut
Gandasoebrata (2001).
1) Mengisi ke dalam tabung pengukur haemometer dengan HCl 0,1 N
commit to user
2) Menghisap darah dengan pipet penghisap haemometer sampai tepat
pada garis 0,02 ml.
3) Darah yang tercecer pada ujung pipet diserap dengan kertas tisue.
4) Meniupkan darah ke dalam tabung pengukur haemometer yang
telah diisi HCl 0,1 N.
5) Mencampurkan larutan tersebut dengan batang pengaduk supaya
darah dan HCl 0,1 N bereaksi.
6) Membiarkan selama 3 menit.
7) Meneteskan aquades dengan pipet air dan mengaduk pelan-pelan
dengan batang pengaduk sampai warna coklat sama dengan warna
standart di sebelah kiri dan kanan tabung pengukur.
8) Membaca tinggi permukaan cairan dalam tabung pengukur dalam
g/dl.
J. Teknik Analisis Statistik
Untuk mengetahui hubungan antara dua variabel pada kelompok yang
tidak berpasangan dengan data berupa data numerik maka dilakukan uji t
tidak berpasangan. Sebelumnya dilakukan uji normalitas Shapiro Wilk untuk
mengetahui distribusi data. Data yang diperoleh harus berdistribusi normal
(nilai p> 0,05) sebagai syarat uji t tidak berpasangan. Varians data diuji
menggunakan uji Levene’s. Varians data boleh sama (p> 0,05), boleh juga
berbeda (p< 0,05). Untuk menentukan nilai significancy (p) pada uji t tidak
Levene’s. Bila varians data sama (p> 0,05), maka untuk melihat uji t tidak
berpasangan memakai hasil pada baris pertama (equal variances assumed).
Sedangkan bila varians data berbeda (p< 0,05), maka untuk melihat uji t tidak
berpasangan memakai hasil pada baris kedua (equal variances not assumed).
Nilai p< 0,05 berarti terdapat pengaruh ekstrak kulit buah Delima Merah
(Punica ganatum) terhadap jumlah eritrosit dan kadar hemoglobin tikus putih
(Rattus norvegicus). Sedangkan nilai p>0,05 menunjukkan tidak ada
pengaruh ekstrak kulit buah Delima Merah (Punica ganatum) terhadap
jumlah eritrosit dan kadar hemoglobin tikus putih (Rattus norvegicus)
(Sopiyudin, 2008).
commit to user
38 BAB IVHASIL PENELITIAN
A. Hasil Penelitian
Data yang diperoleh dari hasil penelitian berupa data rasio yaitu jumlah
eritrosit dan kadar hemoglobin yang dihitung dari tiap sampel darah hewan
uji. Kemudian dicari rerata untuk setiap kelompok perlakuan. Hasil
perhitungan rerata jumlah eritrosit dari setiap kelompok perlakuan
berdasarkan data pada lampiran 1 akan disajikan dalam Tabel 4.
Tabel 4. Rerata Jumlah Eritrosit dari Setiap Kelompok
Kelompok Perlakuan Rerata ± SD (x104)
K = Kelompok kontrol, tanpa diberi ekstrak kulit buah Delima Merah maupun gelombang elektromagnetik ponsel.
P1 = Kelompok perlakuan I, dipapar gelombang elektromagnetik ponsel selama 4 jam setiap hari pada pukul 7.00 sampai 11.00 selama 14 hari. Lama pemaparan mengacu pada penelitian oleh Mailankot dkk (2009) yang dimodifikasi.
P3 = Kelompok perlakuan III, diberi ekstrak kulit buah Delima Merah
peroral 50 mg/Kg BB tikus/hari selama 10 hari sebelum pemaparan, selama pemaparan, dan 10 hari sesudah pemaparan gelombang elektromagnetik. Paparan gelombang elektromagnetik ponsel diberikan mulai hari ke 11 sampai hari ke 24 selama 4 jam setiap hari pada pukul 7.00 sampai 11.00.
Bila digambarkan dalam bentuk diagam akan didapatkan :
580
Gambar 7. Diagam Batang Rerata Jumlah Eritrosit
Sedangkan hasil perhitungan rerata kadar hemoglobin dari setiap
kelompok perlakuan berdasarkan data pada lampiran 9 akan disajikan dalam
tabel 5.
Tabel 5. Rerata Kadar Hemoglobin pada Setiap Kelompok
Kelompok Perlakuan Rerata ± SD (g/dl)
K 12,425 ± 0,446
P1 11,600 ± 0,489
P2 11,857 ± 0,378
commit to user
Bila digambarkan dalam bentuk diagam akan terlihat :
11
Gambar 8. Diagam Batang Rerata Kadar Hemoglobin
B. Analisis Data
Data yang diperoleh dianalisis secara statistik dengan uji t tidak
berpasangan menggunakan progam SPSS for Windows Release 16.0 dan
p<0,05 dipilih sebagai tingkat minimal signifikansinya.
Sebelumnya dilakukan uji normalitas Shapiro-Wilk (karena jumlah
sampel kurang dari 50). Didapatkan nilai signifikansi jumlah eritrosit untuk
semua kelompok p>0,05 sehingga dapat disimpulkan bahwa distribusi
kelompok tersebut adalah normal. Berikut ini hasil uji nomalitas
Tabel 6.Hasil Uji Shapiro-Wilk Jumlah Eritrosit pada Setiap Kelompok
Setelah dilakukan uji normalitas, selanjutnya dilakukan uji varians data
sekaligus uji t tidak berpasangan untuk kelompok K dan P1 berdasarkan
data pada lampiran 3 disajikan dalam tabel 7.
Tabel 7. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok K dan P1.
Levene’s test sig. t test sig.
Equal variances assumed 0,976 0,004
Equal variances not assumed 0,005
Pada kotak Uji Levene’s nilai sig = 0,976. Karena nilai p >0,05 maka
varians data kedua kelompok sama. Karena varians data sama, maka untuk
melihat hasil uji t memakai hasil pada baris pertama (equal variances
assumed). Angka significancy pada baris pertama adalah 0,004.
Setelah itu dilakukan uji varians data sekaligus uji t tidak berpasangan
untuk kelompok K dan P2 berdasarkan data pada lampiran 4, disajikan
dalam tabel 8.
Tabel 8. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok K dan P2
Levene’s test sig. t test sig.
Equal variances assumed 0,167 0,221
commit to user
Pada kotak Uji Levene’s nilai sig = 0,167. Karena nilai p >0,05 maka
varians data kedua kelompok sama. Karena varians data sama, maka untuk
melihat hasil uji t memakai hasil pada baris pertama (equal variances
assumed). Angka significancy pada baris pertama adalah 0,221.
Setelah itu dilakukan uji varians data sekaligus uji t tidak berpasangan
untuk kelompok K dan P3 berdasarkan data pada lampiran 5, disajikan
dalam tabel 9.
Tabel 9. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok K dan P3.
Levene’s test sig. t test sig.
Equal variances assumed 0,550 0,312
Equal variances not assumed 0,316
Pada kotak Uji Levene’s nilai sig = 0,550. Karena nilai p >0,05 maka
varians data kedua kelompok sama. Karena varians data sama, maka untuk
melihat hasil uji t memakai hasil pada baris pertama (equal variances
assumed). Angka significancy pada baris pertama adalah 0,312.
Setelah itu dilakukan uji varians data sekaligus uji t tidak berpasangan
untuk kelompok P1 dan P2 berdasarkan data pada lampiran 6, disajikan
dalam tabel 10.
Tabel 10. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok P1 dan P2.
Levene’s test sig. t test sig.
Equal variances assumed 0,927 0,794
Equal variances not assumed 0,794
Pada kotak Uji Levene’s nilai sig = 0,927. Karena nilai p >0,05 maka
varians data kedua kelompok sama. Karena varians data sama, maka untuk
melihat hasil uji t memakai hasil pada baris pertama (equal variances
assumed). Angka significancy pada baris pertama adalah 0,794.
Setelah itu dilakukan uji varians data sekaligus uji t tidak berpasangan
untuk kelompok P1 dan P3 berdasarkan data pada lampiran 7, disajikan
dalam tabel 11.
Tabel 11. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok P1dan P3.
Levene’s test sig. t test sig.
Equal variances assumed 0,641 0,053
Equal variances not assumed 0,053
Pada kotak Uji Levene’s nilai sig = 0,641. Karena nilai p >0,05 maka
varians data kedua kelompok sama. Karena varians data sama, maka untuk
melihat hasil uji t memakai hasil pada baris pertama (equal variances
assumed). Angka significancy pada baris pertama adalah 0,053.
Setelah itu dilakukan uji varians data sekaligus uji t tidak berpasangan
untuk kelompok P2 dan P3 berdasarkan data pada lampiran 8, disajikan
dalam tabel 12.
Tabel 12. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok P2 dan P3.
Levene’s test sig. t test sig.
Equal variances assumed 0,196 0,866
Equal variances not assumed 0,872
commit to user
Pada kotak Uji Levene’s nilai sig = 0,196. Karena nilai p >0,05 maka
varians data kedua kelompok sama. Karena varians data sama, maka untuk
melihat hasil uji t memakai hasil pada baris pertama (equal variances
assumed). Angka significancy pada baris pertama adalah 0,866.
Untuk melakukan uji t tidak berpasangan data harus terdistribusi normal.
Berdasarkan uji normalitas Shapiro-Wilk (karena jumlah sampel kurang
dari 50) didapatkan nilai signifikansi kadar hemoglobin untuk semua
kelompok p>0,05 sehingga dapat disimpulkan bahwa distribusi kelompok
tersebut adalah normal.Berikut ini hasil uji nomalitas Shapiro-Wilk
berdasarkan data pada lampiran 10.
Tabel 13. Hasil Uji Shapiro-Wilk Kadar Hemoglobin pada Setiap Kelompok
Setelah itu dilakukan uji varians data sekaligus uji t tidak berpasangan
untuk kelompok K dan P1 berdasarkan data pada lampiran 11, disajikan
dalam tabel 14.
Tabel 14. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Kadar
Hemoglobin Kelompok K dan P1
Levene’s test sig. t test sig.
Equal variances assumed 0,716 0,011
Equal variances not assumed 0,011
Pada kotak Uji Levene’s nilai sig = 0,716. Karena nilai p >0,05 maka
varians data kedua kelompok sama. Karena varians data sama, maka untuk
melihat hasil uji t memakai hasil pada baris pertama (equal variances
assumed). Angka significancy pada baris pertama adalah 0,011.
Setelah itu dilakukan uji varians data sekaligus uji t tidak berpasangan
untuk kelompok K dan P2 berdasarkan data pada lampiran 12, disajikan
dalam tabel 15.
Tabel 15. Hasil Uji Levene’s dan Uji Tidak Berpasangan Jumlah Eritrosit Kelompok K dan P2
Levene’s test sig. t test sig.
Equal variances assumed 0,999 0,068
Equal variances not assumed 0,066
Pada kotak Uji Levene’s nilai sig = 0,999. Karena nilai p >0,05 maka
varians data kedua kelompok sama. Karena varians data sama, maka untuk
melihat hasil uji t memakai hasil pada baris pertama (equal variances
assumed). Angka significancy pada baris pertama adalah 0,068.
Setelah itu dilakukan uji varians data sekaligus uji t tidak berpasangan
untuk kelompok K dan P3 berdasarkan data pada lampiran 13, disajikan
dalam tabel 16.
Tabel 16. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok K dan P3
Levene’s test sig. t test sig.
Equal variances assumed 0,267 0,198
Equal variances not assumed 0,212
commit to user
Pada kotak Uji Levene’s nilai sig = 0,267. Karena nilai p >0,05 maka
varians data kedua kelompok sama. Karena varians data sama, maka untuk
melihat hasil uji t memakai hasil pada baris pertama (equal variances
assumed). Angka significancy pada baris pertama adalah 0,198.
Setelah itu uji varians data sekaligus uji t tidak berpasangan untuk
kelompok P1 dan P2 berdasarkan data pada lampiran 14, disajikan dalam
tabel 17.
Tabel 17. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok P1 dan P2
Levene’s test sig. t test sig.
Equal variances assumed 0,695 0,281
Equal variances not assumed 0,273
Pada kotak Uji Levene’s nilai sig = 0,695. Karena nilai p >0,05 maka
varians data kedua kelompok sama. Karena varians data sama, maka untuk
melihat hasil uji t memakai hasil pada baris pertama (equal variances
assumed). Angka significancy pada baris pertama adalah 0,281.
Setelah itu uji varians data sekaligus uji t tidak berpasangan untuk
kelompok P1 dan P3 berdasarkan data pada lampiran 15, disajikan dalam
tabel 18.
Tabel 18. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok P1 dan P3.
Levene’s test sig. t test sig.
Equal variances assumed 0,461 0,283
Equal variances not assumed 0,292
Pada kotak Uji Levene’s nilai sig = 0,461. Karena nilai p >0,05 maka
varians data kedua kelompok sama. Karena varians data sama, maka untuk
melihat hasil uji t memakai hasil pada baris pertama (equal variances
assumed). Angka significancy pada baris pertama adalah 0, 283.
Setelah itu uji varians data sekaligus uji t tidak berpasangan untuk
kelompok P2 dan P3 berdasarkan data pada lampiran 16, disajikan dalam
tabel 19.
Tabel 19. Hasil Uji Levene’s dan Uji t Tidak Berpasangan Jumlah Eritrosit Kelompok P2 dan P3.
Levene’s test sig. t test sig.
Equal variances assumed 0,226 0,824
Equal variances not assumed 0,835
Pada kotak Uji Levene’s nilai sig = 0,226. Karena nilai p >0,05 maka
varians data kedua kelompok sama. Karena varians data sama, maka untuk
melihat hasil uji t memakai hasil pada baris pertama (equal variances
commit to user
48 BAB VPEMBAHASAN
Pada gambar 7, didapatkan bahwa pada pemaparan gelombang
elektromagnetik ponsel 4 jam/hari selama 14 hari, menurunkan rerata jumlah
eritrosit kelompok perlakuan 1 menjadi (627,00 ± 42,393) x 104 dibandingkan
dengan kelompok kontrol yang berkisar (695,38 ± 38,311) x 104. Pemberian
ekstrak kulit buah Delima Merah sebelum dan selama pemaparan pada kelompok
perlakuan 2 menunjukkan peningkatan rerata jumlah eitrosit dari (627,00 ±
42,393) x 104 menjadi (661,0 ± 63,833) x 104. Sedangkan pemberian ekstrak
kulit buah Delima Merah sebelum, selama, dan sesudah pemaparan juga
menunjukkan peningkatan menjadi (673,57 ± 420,035) x 104 bila dibandingkan
dengan kelompok perlakuan 1 dan 2.
Pada gambar 8, didapatkan bahwa pada pemaparan gelombang
elektromagnetik ponsel 4 jam/hari selama 14 hari, menurunkan rerata kadar
hemoglobin kelompok perlakuan 1 menjadi 11,6 ± 0,489 g/dl dibandingkan
dengan kelompok kontrol yang berkisar 12,425 ± 0,446 g/dl. Pemberian ekstrak
kulit buah Delima Merah sebelum dan selama pemaparan pada kelompok
perlakuan 2 menunjukkan peningkatan rerata kadar hemoglobin dari 11,6 ±
0,489 g/dl menjadi 11,857 ± 0,378 g/dl. Sedangkan pemberian ekstrak kulit