KARAKTERISASI SIMPLISIA DAN UJI AKTIVITAS
ANTIBAKTERI EKSTRAK ETANOL DAUN
TANAMAN KECIPIR
(Psophocarpus tetragonolobus (L.) DC.)
SKRIPSI
OLEH:
RAHMATIKA PUTRI
NIM 060804027
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI SIMPLISIA DAN UJI AKTIVITAS
ANTIBAKTERI EKSTRAK ETANOL DAUN
TANAMAN KECIPIR
(Psophocarpus tetragonolobus (L.) DC.)
SKRIPSI
Diajukan untuk Melengkapi Salah Satu Syarat untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
RAHMATIKA PUTRI
NIM 060804027
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI SIMPLISIA DAN UJI AKTIVITAS
ANTIBAKTERI EKSTRAK ETANOL DAUN
TANAMAN KECIPIR
(Psophocarpus tetragonolobus (L.) DC.)
OLEH:
RAHMATIKA PUTRI
060804027
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sumatera Utara Pada Tanggal: Juli 2012
Pembimbing I, Panitia Penguji:
Drs. Suryadi Achmad, M.Sc., Apt. Dra. Aswita Hafni Lubis, M.Si., Apt. NIP 195109081985031002 NIP 195304031983032001
Pembimbing II, Drs. Suryadi Achmad, M.Sc., Apt. NIP 195109081985031002
Drs. Awaluddin Saragih, M.Si., Apt. Drs. Panal Sitorus, M.Si., Apt. NIP 195008221974121002 NIP 195310301980031002
Dra. Herawaty Ginting, M.Si., Apt. NIP 195112231980032002
Medan, Juli 2012
Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Bismillahirrahmanirrahim
Segala puji dan syukur penulis sampaikan kehadirat Allah SWT yang telah
melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat melaksanakan
penelitian dan menyelesaikan penulisan skripsi ini. Tujuan penelitian ini adalah
untuk melakukan “Karakterisasi simplisia dan uji aktivitas antibaktekteri ekstrak
etanol daun tanaman kecipir (Psophocarpus tetragonolobus (L.) DC.)”. Skripsi ini
diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada
Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis menyampaikan terima kasih yang
sebesar-besarnya kepada Prof. Dr. Sumadio Hadisahputera, Apt., selaku Dekan Fakultas
Farmasi Universitas Sumatera Utara, yang telah memberikan bantuan dan fasilitas
selama masa pendidikan. Bapak Drs. Suryadi Achmad, M.Sc., Apt., dan Bapak
Drs. Awaluddin Saragih, M.Si., Apt., yang telah membimbing dengan penuh
kesabaran, tulus dan ikhlas selama penelitian hingga selesainya penulisan skripsi
ini. Bapak Drs. Maralaut Batubara, M.Phill., Apt., selaku penasehat akademis
yang memberikan bimbingan kepada penulis selama ini. Bapak dan Ibu staf
pengajar Fakultas Farmasi Universitas Sumatera Utara yang telah mendidik
selama perkuliahan, Ibu Dra. Aswita Hafni Lubis, M.Si., Apt., Bapak Drs. Panal
Sitorus, M.Si., Apt. dan Ibu Dra. Herawaty Ginting, M.Si., Apt. yang telah
memberikan masukan, arahan dan saran dalam penyusunan skripsi ini.
Penulis mengucapkan terima kasih yang tak terhingga kepada kedua orang
tua, Ayahanda Erman Tanjung dan Ibunda Hj. Dahliar, Abangda Surya Ilham,
S.HI. atas do’a, motivasi dan pengorbanan yang tulus baik moril maupun
materil. Terima kasih juga kepada teman-teman farmasi stambuk 2006,
kakak-kakak dan adik-adik yang juga turut memberi motivasi dan do’a dalam
penyelesaian skripsi ini.
Penulis menyadari bahwa skripsi ini masih banyak kekurangannya, oleh
karena itu sangat diharapkan kritik dan saran yang bersifat membangun dari
semua pihak guna perbaikan skripsi ini. Akhir kata penulis berharap semoga
skripsi ini bermanfaat bagi ilmu pengetahuan khususnya bidang Farmasi.
Medan, Juli 2012
Penulis
Rahmatika Putri
KARAKTERISASI SIMPLISIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAUN DARI TANAMAN KECIPIR
(Psophocarpus tetragonolobus (L.) DC.)
ABSTRAK
Kecipir termasuk kelompok tanaman kacang-kacangan yang dapat digunakan sebagai bahan pangan, bahan pakan, obat tradisional, bahan penyubur tanah dan penahan erosi. Secara tradisional, daun kecipir dapat digunakan untuk obat sakit mata, telinga dan bisul. Daun tanaman ini mengandung senyawa metabolit sekunder. Penelitian bertujuan untuk karakterisasi simplisia dan uji aktivitas antibakteri ekstrak etanol daun tanaman kecipir (Psophocarpus tetragonolobus (L.) DC.)
Karakterisasi simplisia meliputi pemeriksaan organoleptik, makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari larut dalam air, penetapan kadar sari larut dalam etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut dalam asam. Ekstraksi dilakukan dengan cara perkolasi menggunakan pelarut etanol 96%. Uji golongan senyawa kimia dilakukan terhadap daun segar, simplisia dan ekstrak etanol. Uji aktivitas antibakteri dilakukan secara in vitro menggunakan metode difusi agar dengan mengukur diameter zona hambat sekitar punch hole.
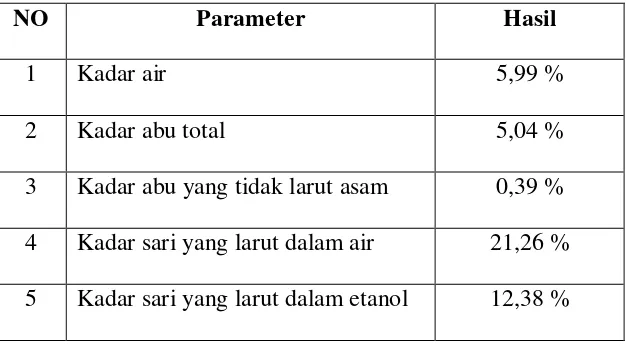
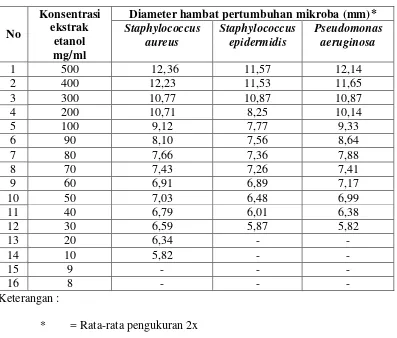
Hasil karakterisasi simplisia diperoleh kadar air 5,99%, kadar sari yang larut dalam air 21,26%, kadar sari yang larut dalam etanol 12,38%, kadar abu total 5,04% dan kadar abu yang tidak larut dalam asam 0,39%. Hasil uji golongan senyawa kimia diperoleh adanya golongan senyawa kimia yaitu steroida/triterpenoida, alkaloida, glikosida, flavonoida, saponin dan tanin. Hasil pengujian aktivitas antibakteri ekstrak etanol daun kecipir memberikan efek antibakteri dengan konsentarasi hambat minimum (KHM) terhadap bakteri Staphylococcus aureus yaitu 10 mg/ml sedangkan pada bakteri Staphylococcus epidermidis dan Pseudomonas aeruginosa yaitu 30 mg/ml.
THE CHARACTERIZATION OF SIMPLEX AND TEST OF ANTIBACTERIAL ACTIVITY ETHANOL EXTRACT OF
WINGBEAN LEAF (Psophocarpus tetragonolobus (L.) DC.)
ABSTRACT
Wingbean is a group of nut plants that can be used as food staple, cattle food, traditional medicine, material of soil fertilizer and erotion prevention. Traditionally, wingbean leaf used for medicine of eye, ear and furunkel The leaf of this plant contain secondary metabolit. This research was done for the characterization of simplex and test of antibacterial activity ethanol extract wingbean leaf (Psophocarpus tetragonolobus (L.) DC.).
The characterization of simplex include organileptic test, macroscopic test, microscopic test, water content value test, water soluble extract test, ethanol soluble extract test, total ash value test and acid insoluble value test. Extraction was done by percolation use ethanol 96% as solvent. Test group of chemical compounds was done for fresh leaf, simplisia and ethanol extract. Test antibacterial activity was done by using in vitro agar diffusion method through measurement the diameter of inhibition zone around the punch hole.
The result of characterization simplex shown a water content value of 5.99% water soluble extract 21.26%, ethanol soluble extract 12.38%, total ash value 5.04% and acid insoluble value 0.39%. The result of test group of chemical compounds was steroida/triterpenoida, alcaloida, glycocida, flavonoida, saponin and tannin. The experiment from antibacterial activities of wingbean leaf gave antibacterial activity with MIC for Staphylococcus aureus at 10 mg/ml and for Staphylococcus epidermidisand Pseudomonas aeruginosa at 30 mg/ml.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Tanaman ... 5
2.1.1 Habitat ... 5
2.1.2 Morfologi Tanaman ... 5
2.1.4 Nama Daerah ... 6
2.1.5 Nama Asing ... 6
2.1.6 Khasiat Tanaman ... 6
2.2 Kandungan Kimia ... 7
2.2.1 Steroida/Triterpenoida ... 7
2.2.2 Glikosida ... 8
2.2.3 Flavonoida ... 8
2.2.4 Tanin ... 9
2.2.5 Saponin ... 10
2.3 Ekstrak ... 10
2.3.1 Pengertian ... 10
2.3.2 Metode Ekstraksi ... 11
2.4 Bakteri ... 12
2.4.1 Sejarah ... 13
2.4.2 Struktur Sel ... 13
2.4.3 Bakteri Staphylococcus aureus ... 13
2.4.4 Bakteri Staphylococcus epidermidis ... 14
2.4.5 Bakteri Pseudomonas aeruginosa ... 15
2.4.6 Faktor-Faktor yang Mempengaruhi Pertumbuhan Bakteri ... 16
2.4.7 Fase Pertumbuhan Bakteri ... 18
2.5 Media Isolasi Biakan Bakteri ... 19
2.6 Media Pertumbuhan Bakteri ... 19
2.8 Bisul ... 22
BAB III METODE PENELITIAN ... 24
3.1 Tempat Pelaksanaan Penelitian ... 24
3.2 Metode Penelitian ... 24
3.3 Alat dan Bahan ... 24
3.3.1 Alat ... 24
3.3.2 Bahan ... 25
3.4 Penyediaan Sampel ... 25
3.4.1 Pengumpulan Sampel ... 25
3.4.2 Determinasi Sampel ... 26
3.4.3 Pengolahan Sampel ... 26
3.5 Rancangan Penelitian ... 26
3.6 Pemeriksaan Karakterisasi Simplisia ... 27
3.6.1 Pemeriksaan Organoleptik ... 27
3.6.2 Pemeriksaan Makroskopik ... 27
3.6.3 Pemeriksaan Mikroskopik ... 27
3.6.4 Penetapan Kadar Air ... 27
3.6.5 Penetapan Kadar Sari Larut dalam Air ... 28
3.6.6 Penetapan Kadar Sari yang Larut dalam Etanol ... 28
3.6.7 Penetapan Kadar Abu Total ... 29
3.6.8 Penetapan Kadar Abu yang Tidak Larut dalam Asam ... 29
3.7 Pembuatan Pereaksi ... 29
3.7.2 Pereaksi Asam Sulfat 2 N ... 29
3.7.3 Pereaksi Lieberman-Burchard ... 29
3.7.4 Pereaksi Kloralhidrat ... 30
3.7.5 Pereaksi Mayer ... 30
3.7.6 Pereaksi Bouchardat ... 30
3.7.7 Pereaksi Dragendorff ... 30
3.7.8 Pereaksi Molish ... 30
3.7.9 Pereaksi Besi (III) Klorida 1% ... 30
3.7.10 Pereaksi Timbal (II) Asetat 0,4 M ... 31
3.7.11 Pereaksi Natrium Hidroksida 2 N ... 31
3.8 Uji Golongan Senyawa Kimia ... 31
3.8.1 Pemeriksaan Steroida/Triterpenoida ... 31
3.8.2 Pemeriksaan Alkaloida ... 31
3.8.3 Pemeriksaan Glikosida ... 32
3.8.4 Pemeriksaan Flavonoida ... 32
3.8.5 Pemeriksaan Saponin ... 32
3.8.6 Pemeriksaan Tanin ... 33
3.9 Pembuatan Ekstrak Etanol dari Daun Kecipir Secara Perkolasi ... 33
3.10 Sterilisasi Alat ... 34
3.11 Pembuatan Media ... 34
3.11.1 Pembuatan Muller Hinton Agar (MHA) ... 34
3.11.2 Pembuatan Larutan NaCl 0,9% ... 35
3.11.4 Pembuatan Media Agar Miring ... 35
3.12 Pembuatan Stok Kultur Bakteri ... 36
3.13 Pembuatan Inokulum Bakteri ... 36
3.14 Pembuatan Larutan Ekstrak Dengan Berbagai Konsentrasi ... 36
3.15 Uji Aktivitas Antibakteri ... 37
BAB IV HASIL DAN PEMBAHASAN ... 38
4.1 Hasil Identifikasi Tanaman ... 38
4.2 Hasil Karakterisasi Simplisia ... 38
4.3 Hasil Uji Golongan Senyawa Kimia ... 40
4.4 Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Daun Kecipir terhadap Bakteri Staphylococcus aureus, Staphylococcus epidermidis dan Pseudomonas aeruginosa ... 41
BAB V KESIMPULAN DAN SARAN ... 45
5.1 Kesimpulan ... 45
5.2 Saran ... 45
DAFTAR PUSTAKA ... 46
DAFTAR TABEL
Tabel Halaman
4.1 Hasil pemeriksaan karakteristik simplisia daun kecipir ... 39
4.2 Hasil uji golongan senyawa kimia daun kecipir ... 40
4.3 Hasil uji aktivitas antibakteri ekstrak etanol daun kecipir
terhadap bakteri Staphylococcus aureus, Staphylococcus
DAFTAR GAMBAR
Gambar Halaman
1 Tanaman Kecipir ... 50
2 Makroskopik Daun Kecipir ... 51
3 Mikroskopik Penampang Melintang Daun Kecipir ... 52
4 Mikroskopik Simplisia Daun Kecipir ... 53
5 Hasil Pengecatan Bakteri Gram Positif dan Gram Negatif ... 54
6 Bagan Penelitian ... 56
7 Bagan Pembuatan Simplisia ... 57
8 Bagan Pembuatan Ekstrak Etanol Daun Kecipir ... 58
9 Bagan Uji Aktivitas Antibakteri Ekstrak Etanol Daun Kecipir... 59
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil Identifikasi Tanaman Kecipir ... 49
2. Morfologi Tanaman Kecipir ... 50
3. Anatomi Daun Kecipir ... 52
4. Hasil Pengecatan Bakteri Gram Positif dan Gram Negatif ... 54
5. Rancangan Percobaan ... 56
6. Hasil Pengukuran Daerah Hambat Pertumbuhan Bakteri dari Ekstrak Etanol Daun Kecipir ... 60
7. Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Daun Kecipir .. 61
KARAKTERISASI SIMPLISIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL DAUN DARI TANAMAN KECIPIR
(Psophocarpus tetragonolobus (L.) DC.)
ABSTRAK
Kecipir termasuk kelompok tanaman kacang-kacangan yang dapat digunakan sebagai bahan pangan, bahan pakan, obat tradisional, bahan penyubur tanah dan penahan erosi. Secara tradisional, daun kecipir dapat digunakan untuk obat sakit mata, telinga dan bisul. Daun tanaman ini mengandung senyawa metabolit sekunder. Penelitian bertujuan untuk karakterisasi simplisia dan uji aktivitas antibakteri ekstrak etanol daun tanaman kecipir (Psophocarpus tetragonolobus (L.) DC.)
Karakterisasi simplisia meliputi pemeriksaan organoleptik, makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari larut dalam air, penetapan kadar sari larut dalam etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut dalam asam. Ekstraksi dilakukan dengan cara perkolasi menggunakan pelarut etanol 96%. Uji golongan senyawa kimia dilakukan terhadap daun segar, simplisia dan ekstrak etanol. Uji aktivitas antibakteri dilakukan secara in vitro menggunakan metode difusi agar dengan mengukur diameter zona hambat sekitar punch hole.
Hasil karakterisasi simplisia diperoleh kadar air 5,99%, kadar sari yang larut dalam air 21,26%, kadar sari yang larut dalam etanol 12,38%, kadar abu total 5,04% dan kadar abu yang tidak larut dalam asam 0,39%. Hasil uji golongan senyawa kimia diperoleh adanya golongan senyawa kimia yaitu steroida/triterpenoida, alkaloida, glikosida, flavonoida, saponin dan tanin. Hasil pengujian aktivitas antibakteri ekstrak etanol daun kecipir memberikan efek antibakteri dengan konsentarasi hambat minimum (KHM) terhadap bakteri Staphylococcus aureus yaitu 10 mg/ml sedangkan pada bakteri Staphylococcus epidermidis dan Pseudomonas aeruginosa yaitu 30 mg/ml.
THE CHARACTERIZATION OF SIMPLEX AND TEST OF ANTIBACTERIAL ACTIVITY ETHANOL EXTRACT OF
WINGBEAN LEAF (Psophocarpus tetragonolobus (L.) DC.)
ABSTRACT
Wingbean is a group of nut plants that can be used as food staple, cattle food, traditional medicine, material of soil fertilizer and erotion prevention. Traditionally, wingbean leaf used for medicine of eye, ear and furunkel The leaf of this plant contain secondary metabolit. This research was done for the characterization of simplex and test of antibacterial activity ethanol extract wingbean leaf (Psophocarpus tetragonolobus (L.) DC.).
The characterization of simplex include organileptic test, macroscopic test, microscopic test, water content value test, water soluble extract test, ethanol soluble extract test, total ash value test and acid insoluble value test. Extraction was done by percolation use ethanol 96% as solvent. Test group of chemical compounds was done for fresh leaf, simplisia and ethanol extract. Test antibacterial activity was done by using in vitro agar diffusion method through measurement the diameter of inhibition zone around the punch hole.
The result of characterization simplex shown a water content value of 5.99% water soluble extract 21.26%, ethanol soluble extract 12.38%, total ash value 5.04% and acid insoluble value 0.39%. The result of test group of chemical compounds was steroida/triterpenoida, alcaloida, glycocida, flavonoida, saponin and tannin. The experiment from antibacterial activities of wingbean leaf gave antibacterial activity with MIC for Staphylococcus aureus at 10 mg/ml and for Staphylococcus epidermidisand Pseudomonas aeruginosa at 30 mg/ml.
BAB I PENDAHULUAN
1.1Latar Belakang
Indonesia merupakan negara terkaya kedua di dunia yang memiliki
keanekaragaman hayati setelah Brazil dimana 30.000 spesies dari sekitar 40.000
spesies tanaman yang ada di dunia ini, hidup di kepulauan Indonesia. Diantara
30.000 spesies yang hidup di Indonesia, sekurang-kurangnya 9.600 spesies
tanaman berkhasiat sebagai obat dan kurang lebih 300 spesies telah digunakan
sebagai bahan obat tradisional oleh industri obat tradisional (Depkes RI, 2007).
Pemanfaatan dan pengembangan obat tradisional merupakan warisan turun
temurun berdasarkan pengalaman dan selanjutnya berkembang melalui
pembuktian ilmiah dengan uji pra klinik dan uji klinik. Obat tradisional yang
didasarkan pada pendekatan “warisan turun temurun” disebut jamu sedangkan
yang berdasarkan pendekatan ilmiah melalui uji pra klinik disebut obat herbal
terstandar dan yang telah melalui uji klinik disebut fitofarmaka (Depkes RI,
2007).
Pengembangan dan peningkatan obat tradisional ditujuka n agar diperoleh
obat tradisional yang bermutu tinggi, aman, memiliki khasiat nyata yang teruji
secara ilmiah dan dapat dimanfaatkan secara luas baik untuk pengobatan sendiri
ataupun digunakan dalam pelayanan kesehatan formal. Penggunaan obat
tradisional terus meningkat baik di negara berkembang maupun di
negara-negara maju. Badan Kesehatan Dunia (WHO) merekomendasikan penggunaan
masyarakat, pencegahan dan pengobatan penyakit terutama untuk
penyakit-penyakit kronis, penyakit-penyakit-penyakit-penyakit degeneratif dan kanker (Depkes RI, 2007).
Salah satu tanaman yang dapat digunakan sebagai obat tradisional adalah
tanaman kecipir (Psophocarpus tetragonolobus (L.) DC.), famili Fabaceae atau
kelompok kacang-kacangan (Djatmiko, 1986). Tanaman kecipir ini mengandung
senyawa metabolit sekunder (Jhonny, 1993). Bagian tanaman kecipir yang dapat
digunakan sebagai obat tradisional antara lain adalah daun. Daunnya dapat
digunakan sebagai obat penyakit pada mata dan telinga serta obat bisul (Djatmiko,
1986).
Penyakit pada mata dan telinga serta bisul dapat disebabkan oleh beberapa
bakteri diantaranya Staphylococcus dan Pseudomonas. Bakteri Staphylococcus
merupakan bakteri Gram Positif sedangkan bakteri Pseudomonas merupakan
bakteri Gram Negatif yang sering ditemukan sebagai bakteri flora normal pada
kulit dan selaput lendir manusia (Syahrurachman, 1994).
Berdasarkan hal tersebut di atas, maka perlu dilakukan karakterisasi
simplisia dan uji aktivitas antibakteri ekstrak etanol daun tanaman kecipir
(Psophocarpus tetragonolobus (L.) DC.) terhadap bakteri Staphylococcus aureus,
Staphylococcus epidermidis dan Pseudomonas aeruginosa.
1.2Perumusan Masalah
Berdasarkan uraian diatas maka perumusan masalah pada penelitian ini
adalah:
b. Apakah golongan senyawa kimia yang terdapat pada daun segar, simplisia
dan ekstrak daun kecipir.
c. Apakah ekstrak etanol daun kecipir mempunyai aktivitas sebagai antibakteri
terhadap Staphylococcus aureus, Staphylococcus epidermidis dan
Pseudomonas aeruginosa.
1.3Hipotesis
Berdasarkan perumusan masalah diatas maka hipotesis penelitian ini
adalah:
a. Karakteristik simplisia daun kecipir menunjukkan simplisia tersebut
memenuhi persyaratan Materia Medika Indonesia.
b. Golongan senyawa kimia yang terdapat dalam daun segar, simplisia dan
ekstrak daun kecipir mengandung senyawa metabolit sekunder.
c. Ekstrak etanol daun kecipir bersifat antibakteri karena daun kecipir
mengandung senyawa metabolit sekunder yang bersifat antibakteri misalnya
flavonoida dan tanin.
1.4Tujuan Penelitian
Adapun tujuan penelitian ini adalah :
a. Untuk memperoleh informasi mengenai karakteristik simplisia daun kecipir
yang merupakan bagian dari standarisasi simplisia.
b. Untuk mengetahui golongan senyawa kimia yang terdapat pada daun segar,
c. Untuk melihat aktivitas antibakteri dari ekstrak etanol daun kecipir terhadap
bakteri Staphylococcus aureus, Staphylococcus epidermidis dan Pseudomonas
aeruginosa.
1.5 Manfaat Penelitian
Hasil penelitian ini dapat diinformasikan kepada masyarakat dalam upaya
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tanaman 2.1.1 Habitat
Tanaman kecipir hanya tumbuh di daerah Asia Tenggara dan merupakan
tanaman yang tumbuh di pekarangan, di pagar-pagar pekarangan atau di tegalan.
Diperkirakan 4 daerah yang mungkin merupakan daerah asal tanaman kecipir
yaitu Papua New Guinea, Mauritius, Madagaskar dan India (Djatmiko, 1986).
2.1.2 Morfologi Tanaman
Tanaman semak dan merambat ini mempunyai bentuk batang yang bulat,
beralur, beruas dan berwarna hijau. Daunnya merupakan daun majemuk berbentuk
segitiga, beranak daun tiga, berujung lancip, berpangkal tumpul, bertepi rata,
panjangnya 7-8,5 cm, bertulang menyirip dan letaknya berselang-seling. Tangkai
daun berbentuk bulat, beralur, bagian atas berlekuk memanjang, pada pangkal dan
ujung menebal, berwarna hijau dengan noda-noda berwarna kuning. Bunganya
merupakan bunga tunggal, berbentuk kupu-kupu, berada di ketiak daun,
bertangkai, kelopak bagian bawah bersatu, bagian atas bertajuk empat, bertangkai
putik melengkung, kepala putik berambut putih, benang sari bagian pangkal
bersatu dan kepala sari berwarna kuning hingga kuning kebiru-biruan. Buahnya
berupa polong, berbentuk segi empat memanjang, tepi beringgit, mempunyai
panjang 30 cm dan berwarna hijau. Bijinya bulat dan berdiameter 8-10 mm
berwarna coklat sedangkan akarnya berupa akar tunggang berwarna putih
2.1.3 Sistematika Tanaman
Sistematika tanaman kecipir (Psophocarpus tetragonolobus (L.) DC.)
adalah sebagai berikut :
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledonae
Bangsa : Rosales
Suku : Fabaceae
Marga : Psophocarpus
Jenis : Psophocarpus tetragonolobus (L.) DC (Jhonny, 1993).
2.1.4 Nama Daerah
Kacang belingbing (Palembang), Kacang botol (Melayu), Jaat (Sunda),
Kecipir (Jawa Tengah), Kelongkang (Bali), Biraro (Ternate) (Jhonny, 1993).
2.1.5 Nama Asing
Wingbean (bahasa Inggris) (Djatmiko, 1986).
2.1.6 Khasiat Tanaman
Secara tradisional, daun kecipir yang direbus dengan sedikit air, air
rebusannya yang telah dingin dapat digunakan untuk obat sakit mata dan telinga.
Jika air rebusan tadi ditambah adas pulosari dan sedikit air lalu dihaluskan
menjadi pasta, dapat digunakan sebagai obat tapal (penutup) bisul sedangkan
bijinya dapat digunakan untuk penambah nafsu makan, pencegah masuk angin,
2.2 Kandungan Kimia
Daun dan biji kecipir mengandung saponin, flavonoida dan tanin (Jhonny,
1993).
2.2.1 Steroida/Triterpenoida
Steroid adalah triterpenoid yang kerangka dasarnya sistem cincin
siklopentana perhidrofenantren. Uji yang biasa digunakan adalah reaksi
Lieberman Burchard (asam asetat anhidrida-H2SO4 pekat) yang dengan
kebanyakan triterpen dan steroid memberikan warna hijau biru (Harborne, 1987).
Gambar 2. Sruktur Steroida
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isoprene dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik
yaitu skualena. Senyawa ini berstruktur siklik yang rumit, kebanyakan berupa
alkohol, aldehid atau asam karboksilat. Berupa senyawa warna berbentuk kristal.
Sering kali bertitik leleh tinggi dan aktif optik (Harborne, 1987).
Triterpenoid mempunyai fungsi bagi tumbuhan antara lain sebagai
pengatur tumbuh misalnya seskuiterpen absisin dan diterpen giberelin. Karotenoid
mempunyai fungsi sebagai senyawa warna tumbuhan dan hampir semua terpenoid
2.2.2 Glikosida
Glikosida adalah suatu senyawa yang jika dihidrolisis akan menghasilkan
bagian gula yang disebut glikon dan bagian bukan gula disebut aglikon. Gula
yang dihasilkan biasanya adalah glukosa, ramnosa dan lain sebagainya. Jika
bagian gulanya adalah glukosa maka disebut glukosida sedangkan jika bagian
gulanya selain glukosa disebut glikosida.
Pembagian glikosida berdasarkan atom yang menghubungkan bagian gula
dan bagian bukan gula adalah sebagai berikut :
1. O-glikosida : Jika bagian gula dan bukan gula dihubungkan oleh atom O
2. S-glikosida : Jika bagian gula dan bukan gula dihubungkan oleh atom S
3. N-glikosida : Jika bagian gula dan bukan gula dihubungkan oleh atom N
4. C-glikosida : Jika bagian gula dan bukan gula dihubungkan oleh atom C
Glikosida mempunyai beberapa fungsi diantaranya sebagai penghasil
hormon steroid, racun ikan, perlindungan terhadap serangga, pencahar dan
lain-lain (Sirait, M., 2007).
2.2.3 Flavonoida
Flavonoida merupakan golongan fenol yang mengandung 15 atom karbon
yang tersusun dalam konfigurasi C6-C3-C6 yaitu dua cincin aromatik yang
dihubungkan oleh tiga satuan karbon (Markham, 1988).
Umumnya senyawa flavonoida dalam tumbuhan terikat dengan gula
disebut sebagai glikosida dan aglikon flavonoida yang berbeda-beda mungkin saja
terdapat pada satu tumbuhan dalam beberapa bentuk kombinasi glikosida. Oleh
karena itu dalam menganalisis flavonoida biasanya lebih baik memeriksa aglikon
yang telah dihidrolisis dibandingkan dalam bentuk glukosida dengan kerumitan
strukturnya. Flavonoida berkhasiat sebagai antioksidan, antibakteri dan inflamasi
(Harborne, 1987).
2.2.4 Tanin
Tanin merupakan senyawa komplek yang tersusun dari polifenol yang
sukar dipisahkan dan tidak membentuk kristal. Tanin tersebar hampir pada semua
tumbuhan dan biasanya terdapat pada bagian daun, buah, akar dan batang. Tanin
dan senyawa turunannya bekerja dengan jalan menciutkan selaput lendir pada
saluran pencernaan dan di bagian kulit yang luka. Pada perawatan untuk luka
bakar, tanin dapat mempercepat pembentukan jaringan yang baru sekaligus dapat
melindunginya dari infeksi atau sebagai antiseptik (Tyler, 1976).
Tanin terdapat luas dalam tumbuhan berpembuluh dalam angiospermae
terdapat khusus dalam jaringan kayu. Menurut batasannya tanin dapat bereaksi
dengan protein membentuk kopolimer mantap yang tidak larut dalam air. Dalam
industri, tanin mampu mengubah kulit hewan yang mentah menjadi kulit siap
pakai karena kemampuannya menyambung silang protein. Secara kimia terdapat
dua jenis utama tanin yaitu tanin terhidrolisis dan tanin terkondensasi. Tanin
terhidrolisis penyebarannya terbatas pada tumbuhan berkeping dua sedangkan
tanin terkondensasi terdapat dalam tumbuhan paku-pakuan dan gimnospermae
penambahan pereaksi ferri klorida menghasilkan warna hijau kehitaman atau biru
kehitaman (Harborne, 1987).
2.2.5 Saponin
Saponin adalah glikosida triterpen dan sterol. Saponin merupakan senyawa
aktif permukaan, bersifat seperti sabun dan dapat dideteksi berdasarkan
kemampuannya membentuk busa dan menghemolisis sel darah. Pembentukan
busa yang mantap sewaktu mengekstraksi tumbuhan atau pada waktu
memekatkan ekstrak tumbuhan merupakan bukti terpercaya akan adanya saponin
(Harborne, 1987).
Senyawa golongan ini banyak terdapat pada tumbuhan tinggi. Keberadaan
saponin sangat mudah ditandai dengan pembentukan larutan koloidal dengan air
yang apabila dikocok menimbulkan buih yang stabil. Saponin merupakan
senyawa berasa pahit menusuk, menyebabkan bersin dan sering mengakibatkan
iritasi terhadap selaput lendir (Gunawan & Mulyani, 1995).
Saponin juga menarik dari segi ekonomi karena mempunyai toksisitas
yang umum terhadap hewan ternak (misalnya alfalfa) atau rasanya yang manis
(misalnya glisirizin dari radiks liquorice) (Sirait, M., 2007).
2.3 Ekstrak 2.3.1 Pengertian
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai
kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang
Sebagian besar ekstrak dibuat dengan mengekstraksi bahan baku obat secara
perkolasi. Seluruh perkolat biasanya dipekatkan dengan cara destilasi dengan
pengurangan tekanan agar bahan utama obat sedikit mungkin terkena panas
(Ditjen POM, 1995).
Ekstraksi merupakan suatu cara penyarian terhadap simplisia dengan
menggunakan suatu penyari tertentu. Biasanya metode ekstraksi dipilih
berdasarkan beberapa faktor seperti sifat dari bahan mentah obat. Untuk
mengekstraksi senyawa organik yang terdapat dalam tumbuhan telebih dahulu
enzimnya diinaktifkan dengan etanol panas atau dengan mengeringkan bagian
tumbuhan yang diambil sebelum diekstraksi (Harborne, 1987).
2.3.2 Metode Ekstraksi
Ekstraksi dapat dilakukan dengan beberapa cara yaitu:
1. Cara dingin
a. Maserasi
Maserasi adalah proses ekstraksi menggunakan pelarut dengan beberapa kali
pengadukan pada temperatur ruangan. Remaserasi berarti dilakukan
pengulangan penambahan pelarut setelah dilakukan penyaringan maserat.
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna,
umumnya dilakukan pada temperatur ruangan. Prosesnya terdiri dari tahapan
pengembahan bahan, maserasi antara dan perkolasi sebenarnya (penetesan
dan penampungan ekstrak) terus menerus sampai diperoleh ekstrak
2. Cara panas
a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan
dengan adanya pendingin balik.
b. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru, umumnya
dilakukan menggunakan alat khusus sehingga terjadi ekstraksi kontinu
dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
c. Digesti
Digesti adalah maserasi dengan pengadukan kontinu pada temperatur yang
lebih tinggi dari temperatur ruangan yaitu secara umum dilakukan pada
temperatur 40-50oC.
d. Infus
Infus adalah ekstraksi simplisia dengan pelarut air pada suhu 90oC selama 15
menit.
e. Dekok
Dekok adalah ekstraksi simplisia dengan pelarut air pada suhu 90oC selama
30 menit. (Depkes RI, 2000).
2.4 Bakteri
Bakteri berasal dari kata bakterion (bahasa Yunani) yang berarti tongkat
atau batang. Sekarang nama itu dipakai untuk menyebut sekelompok
berkembang biak dengan cara pembelahan diri dan berukuran sedemikian kecil
sehingga hanya tampak dengan mikroskop (Dwidjoseputro, 1982).
2.4.1 Sejarah
Bakteri pertama ditemukan oleh Anthony Van Leeuwenhoek pada 1674
dengan menggunakan mikroskop buatannya sendiri. Istilah bacterium
diperkenalkan dikemudian hari oleh Ehrenberg pada tahun 1828 (Anonim b,
2010).
2.4.2 Struktur Sel
Bakteri merupakan organisme prokariot yaitu memiliki kromosom tunggal
dan tidak memiliki nukleus. Struktur sel bakteri yang paling penting yaitu dinding
sel yang bersifat kaku dan berfungsi untuk mempertahankan bentuknya serta
melindungi sel dari perubahan tekanan osmotik antara sel dengan lingkungannya.
Bakteri dapat dikelompokkan menjadi 2 kelompok yaitu bakteri Gram positif dan
Gram negatif. Dinding sel bakteri Gram positif memiliki lapisan peptidoglikan
yang tebal dan membrane sel sedangkan dinding sel Gram negatif memiliki 3
lapisan yaitu: membran dalam, membran luar dan lapisan peptidoglikan yang
lebih tipis.
Bakteri juga dapat dikelompokkan berdasarkan bentuknya yaitu: coccus
(monococcus, diplococcus, sarcina, streptococcus dan staphylococcus), basil
(monobasil, diplobasil dan streptobasil) dan spiral yang berbeda-beda (spiral,
vibrio dan spirochaeta) (Irianto, K., 2007).
2.4.3 Bakteri Staphylococcus aureus
Staphylococcus berasal dari kata Staphyle yang berarti kelompok buah
bakteri flora normal pada kulit dan selaput lendir manusia. Dapat menjadi infeksi
baik pada manusia maupun hewan.
Infeksi oleh jenis bakteri ini yang terutama menimbulkan penyakit pada
manusia. Setiap jaringan maupun alat tubuh dapat diinfeksi olehnya dan
menyebabkan timbulnya penyakit dengan tanda-tanda yang khas yaitu
peradangan, nekrosis dan pembentukan abses. Bakteri ini tidak bergerak, tidak
berspora dan merupakan bakteri Gram positif (Syahrurachman, A., 1994).
Klasifikasi dari bakteri ini adalah:
Domain : Bacteria
Phylum : Protophyta
Class : Schizomycetes
Ordo : Eubacteriales
Famili : Micrococaceae
Genus : Staphylococcus
Species : Staphylococcus aureus (Syahrurachman, A., 1994).
2.4.4 Bakteri Staphylococcus epidermidis
Staphylococcus epidermidis merupakan bakteri Gram positif, aerob atau
anaerob fakultatif berbentuk bola atau kokus berkelompok tidak teratur, diameter
0,8-1,0 µm tidak membentuk spora dan tidak bergerak, koloni berwarna putih dan
bakteri ini tumbuh cepat pada suhu 37oC. Koloni pada pembenihan padat
berbentuk bulat halus, menonjol, berkilau, tidak meghasilkan pigmen, berwarna
putih porselin sehingga Staphylococcus epidemidis disebut Staphylococcus albus,
koagulasi-negatif dan tidak meragi manitol. Staphylococcus epidermidis terdapat
kemampuannya berkembang biak dan menyebarluas dalam jaringan (Jawetz,
2001).
Sistematika bakteri:
Divisio : Prokariota
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Micrococcaceae
Marga : Staphylococcus
Jenis : Staphylococcus epidermidis (Tjitrosoepomo, G., 1994).
2.4.5 Bakteri Pseudomonas aeruginosa
Pseudomonas aeruginosa merupakan bakteri gram negatif aerob obligat,
berbentuk batang, bergerak, berukuran sekitar 0,5-8 x 1,5-3,0 µ m, terlihat sebagai
bakteri tunggal, berpasangan dan kadang-kadang membentuk rantai yang pendek.
Pseudomonas aeruginosa membentuk koloni halus dengan warna fluoresensi
kehijauan. Bakteri ini menghasilkan piosianin, suatu pigmen kebiru-biruan yang
tak berfluoresensi dan berdifusi kedalam agar. Fluoresensi dapat dihasilkan bila
biakan diinkubasi pada suhu 20-30oC dari pada yang dibiakkan pada suhu
35-37oC.
Pseudomonas aeruginosa tersebar luas di alam dan biasanya terdapat di
lingkungan yang lembab. Bakteri ini menyebabkan penyakit bila pertahanan tubuh
inang abnormal. Dalam jumlah kecil, bakteri ini sering terdapat dalam flora usus
normal dan pada kulit manusia serta merupakan patogen utama dari kelompok
Pseudomonas. Bakteri ini menimbulkan infeksi pada luka, meningitis, infeksi
Sistematika bakteri:
Divisio : Protophyta
Kelas : Schizomycetes
Bangsa : Pseudomonadales
Suku : Pseudomonadaceae
Marga : Pseudomonas
Jenis : Pseudomonas aeruginosa (Buchanan dan Gibbons, 1974).
2.4.6 Faktor-Faktor yang Mempengaruhi Pertumbuhan Bakteri
Faktor-faktor yang mempengaruhi pertumbuhan bakteri adalah suhu, pH,
tersedianya nutrien, air, oksigen dan potensial oksidasi reduksi.
a. Suhu
Masing-masing bakteri mempunyai suhu optimum, minimum dan
maksimum untuk pertumbuhannya. Hal ini disebabkan di bawah suhu minimum
dan di atas suhu maksimum, aktivitas enzim akan berhenti, bahkan pada suhu
yang terlalu tinggi akan terjadi denaturasi enzim. Berdasarkan kemampuannya
untuk memulai pertumbuhan, bakteri dibagi atas golongan :
1. Psikrofil : 0-20oC dengan optimum 5-15oC
2. Mesofil : 10-45oC dengan optimum 20-40oC
3. Termofil : 25-80oC dengan optimum 45-60oC (Waluyo, L., 2007).
b. pH
Nilai pH medium sangat berpengaruh pada jenis mikroba yang tumbuh.
Kebanyakan bakteri mempunyai pH optimum yaitu pH dimana pertumbuhannya
c. Nutrien
Bakteri membutuhkan nutrien untuk kehidupan dan pertumbuhannya yaitu
sebagai: sumber karbon, sumber nitrogen, sumber energi dan faktor pertumbuhan
misalnya mineral dan vitamin. Nutrien tersebut dibutuhkan untuk membentuk
energi dan menyusun komponen-komponen sel. Bakteri yang tumbuh, misalnya
pada makanan, umumnya bersifat heterotrof yaitu menggunakan karbohidrat
sebagai sumber energi dan karbon. Kebanyakan organisme heterotrof
menggunakan komponen organik yang mengandung protein sebagai sumber N
tetapi beberapa bakteri dapat pula menggunakan sumber nitrogen anorganik
(Waluyo, L.,2007).
d. Potensial oksidasi-reduksi (Eh)
Eh suatu perbenihan merupakan faktor yang menentukan apakah suatu
bakteri yang dibiakkan dapat tumbuh atau tidak. Eh kebanyakn perbenihan bila
berkontak dengan udara adalah kurang lebih +0,2 – 0,4 volt pada pH 7. Bakteri-
bakteri anaerob tidak mungkin tumbuh kecuali apabila Eh perbenihan mencapai
-0,2 volt (Syahrurrachman, A., 1994).
e. Oksigen
Berdasarkan keperluan oksigen, bakteri dibagi dalam 5 golongan:
1. Bakteri anaerob obligat: hidup tanpa O2, O2 toksis terhadap golongan kuman
ini.
2. Bakteri anaerob aerotoleran: tidak mati denga adanya O2.
3. Bakteri anaerob fakultatif: mampu tumbuh baik dalam suasana dengan atau
tanpa O2.
5. Bakteri mikroaerofilik: hanya tumbuh baik dalam tekanan O2 yang rendah
(Syahrurachman, A., 1994).
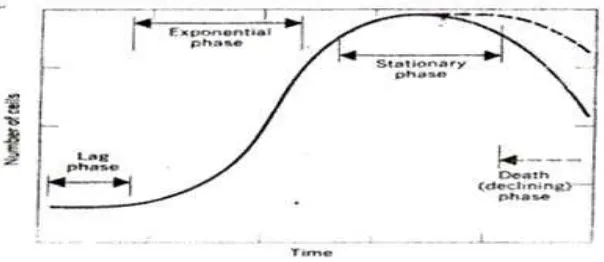
2.4.7 Fase Pertumbuhan Bakteri Ada 4 fase pertumbuhan bakteri :
1. Fase penyesuaian diri (lag phase)
Fase ini untuk menyesuaikan diri dengan substrat dan kondisi lingkungan di
sekitarnya. Fase ini belum terjadi pembelahan sel karena beberapa enzim mungkin
belum disintesis. Jumlah sel pada fase ini mungkin tetap tetapi kadang-kadang
menurun. Lamanya fase ini bervariasi, dapat cepat atau lambat tergantung dari
kecepatan penyesuaian dengan lingkungan di sekitarnya (Waluyo, L., 2007).
2. Fase pembelahan (logarhytmik phase)
Sel mulai membelah dengan kecepatan yang masih rendah. Setelah bakteri
menyesuaikan diri dengan lingkungannya maka sel membelah degan cepat. Pada
fase ini kecepatan pertumbuhan sangat dipengaruhi oleh medium tumbuhnya
seperti pH, kandungan nutrien dan suhu. Pada fase ini sel membutuhkan energi
lebih banyak dibandingkan dengan fase lainnya, selain itu sel paling sensitif
terhadap keadaan lingkungan ( Waluyo, L., 2007).
3. Fase stasioner (stationary phase)
Pada fase ini jumlah populasi sel tetap karena jumlah sel yang tumbuh sama
dengan jumlah sel yang mati. Ukuran sel pada fase ini lebih kecil karena sel tetap
membelah meskipun zat nutrien sudah habis (Waluyo, L., 2007).
4. Fase kemunduran ( period of decline)
Pada fase ini sebagian populasi bakteri mulai mengalami kematian karena
Jumlah sel yang mati semakin lama akan semakkin banyak dan kecepatan
kematian dipengaruhi kondisi nutrien dan lingkungan (Waluyo, L.,2007).
Gambar 3. Grafik pertumbuhan bakteri 2.5 Metode Isolasi Biakan Bakteri
a) Cara gores
Ose yang telah steril dicelupkan ke dalam suspensi mikroorganisme yang
diencerkan, lalu dibuat serangkaian goresan sejajar yang tidak saling menutupi di
atas permukaan agar yang telah padat.
b) Cara sebar
Suspensi mikroorganisme yang telah diencerkan diinokulasikan secara
merata dengan menggunakan hockey stick pada permukaan media padat.
c) Cara tuang
Pengenceran inokulum yang berturut-turut diletakkan pada cawan petri
steril dan dicampurkan dengan medium agar cair, lalu dibiarkan memadat. Koloni
yang berkembang akan tertanam di dalam media tersebut (Stanier, 1982).
2.6 Media Pertumbuhan Bakteri
Berdasarkan sumber karbon yang digunakan, bakteri dibagi menjadi dua
dinamakan autotrof sedangkan bakteri yang memerlukan satu atau lebih senyawa
organik sebagai sumber karbon disebut heterotrof. Namun di samping sumber
karbon organik, heterotrof juga memerlukan karbondioksida. Macam zat organik
yang diperlukan amat beragam bergantung pada bakterinya. Ada yang
memerlukan 10 macam atau lebih senyawa organik dari yang sederhana sampai
kompleks (Waluyo, L., 2010).
Media biakan dikelompokkan dalam beberapa kategori, yaitu:
1. Berdasarkan susunan kimia, media dibagi atas:
a. Media sintetik yaitu media yang yang susunan kimianya dapat diketahui
dengan pasti. Komposisi media sintetik biasanya dibuat dari bahan-bahan kimia
(Waluyo, L., 2010).
b. Media non-sintetik yaitu media yang susunan kimianya tidak dapat ditentukan
dengan pasti. Medium ini banyak digunakan untuk menumbuhkan
mikroorganisme. Contohnya: ekstrak daging dan pepton (Waluyo, L., 2010).
2. Berdasarkan fungsinya, dapat dibedakan menjadi: a. Media selektif
Media selektif adalah media biakan yang selektif untuk mencegah
pertumbuhan mikroba lainnya. Misalnya media yang mengandung kristal violet
pada kadar tertentu dapat mencegah pertumbuhan bakteri Gram positif tanpa
mempengaruhi pertumbuhan bakteri Gram negatif (Waluyo, L., 2010).
b. Media diferensial
Media ini mengandung zat kimia tertentu yang memungkinkan membedakan
berbagai macam tipe mikroba. Misalnya media agar darah dapat membedakan
c. Media diperkaya
Media ini ditambah zat tertentu untuk menumbuhkan mikroorganisme
heterotrof tertentu. Zat tersebut misalnya darah (Waluyo, L., 2010).
3. Berdasarkan konsistensinya, dibagi atas: a. Media cair
Media cair adalah media yang berbentuk cair. Misalnya kaldu nutrien, kaldu
glukosa dan air pepton (Waluyo, L.,2010).
b. Media semi padat
Media semi padat dibuat dengan bahan sama dengan media padat akan tetapi
yang berbeda adalah komposisi agarnya (Waluyo, L., 2010).
c. Media padat
Media padat diperoleh dengan cara menambahkan agar-agar. Agar berasal
dari ganggang/alga yang berfungsi sebagai bahan pemadat. Alga digunakan
karena bahan ini tidak diuraikan oleh mikroorganisme dan dapt membeku pada
suhu di atas 45oC (Waluyo, L., 2010).
2.7 Pengukuran Aktivitas Antimikroba
Penentuan kepekaan bakteri patogen terhadap antimikroba dapat dilakukan
dengan salah satu dari dua metode pokok yaitu dilusi atau difusi.
a. Metode Dilusi
Metode ini menggunakan antimikroba dengan kadar yang menurun secara
bertahap, baik dengan media cair atau padat kemudian media diinokulasi bakteri
uji dan diinkubasi. Tahap akhir dilarutkan antimikroba dengan kadar yang
Uji kepekaan cara dilusi agar memakan waktu dan penggunaannya dibatasi
pada keadaan tertentu saja (Jawetz, 2001).
b. Metode Difusi
Metode yang paling sering digunakan adalah metode difusi agar. Cakram
kertas saring berisi sejumlah tertentu obat ditempatkan pada permukaan medium
padat yang sebelumnya telah diinokulasi bakteri uji pada permukaannya. Setelah
inkubasi, diameter zona hambatan sekitar cakram dipergunakan mengukur
kekuatan hambatan obat terhadap organisme uji (Jawetz, 2001).
c. Metode Turbidimetri
Pada cara ini digunakan media cair. Pertama dilakukan penuangan media
kedalam tabung reaksi lalu ditambahkan suspensi bakteri kemudian dilakukan
pemipetan larutan uji dan dilakukan inkubasi. Selanjutnya dilakukan pengukuran
kekeruhan. Kekeruhan yang disebabkan oleh pertumbuhan bakteri diukur dengan
menggunakan instrumen yang cocok, misalnya spektrofotometer setelah itu
dilakukan penghitungan potensi antimikroba (Ditjen POM, 1995).
2.8 Bisul
Bisul / abscessus / furunkel adalah sekumpulan
telah terakumulasi di rongga di jaringan setelah te
karena Staphylococcus, bakteri lain, jamur atau barang asing
(seperti luka tembakan/tikaman). Bisul juga merupakan
jaringan untuk menghindari menyebarnya barang asing di tubuh (Anonim a,
Organisme atau barang asing membunuh
keluarnya toksin. Toksin tersebut menyebabkan
menuju tempat tersebut dan kemudian meningkatkan aliran
tersebut. Struktur terakhir bisul adalah dinding bisul yang terbentuk oleh sel sehat
untuk mencegah barang asing tersebut masuk ke dalam tubuh dan mencegah
terkenanya sel lain. Namun, enkapsulasi ini berfungsi untuk mencegah sel imun
untuk menyerang bakteri atau barang asing di bisul (Anonim a, 2010).
Bisul paling sering ditemukan di daerah leher dan wajah. Akan terasa
sangat nyeri jika timbul di sekitar hidung atau telinga atau pada jari-jari tangan.
Bisul berawal sebagai benjolan keras berwarna merah yang mengandung nanah.
Lalu benjolan ini akan berfluktuasi dan tengahnya menjadi putih atau kuning
(membentuk pustula). Bisul bisa pecah spontan atau dipecahkan dan
BAB III
METODE PENELITIAN
3.1 Tempat Pelaksanaan Penelitian
Penelitian ini dilaksanakan di Laboratorium Obat Tradisional Fakultas
Farmasi USU dan Balai Laboratorium Kesehatan Medan.
3.2 Metode Penelitian
Penelitian dilakukan dengan metode eksperimental dengan tahapan
meliputi pengumpulan sampel, pembuatan simplisia, pemeriksaan karakteristik
simplisia, uji golongan senyawa kimia, pembuatan ekstrak dan uji aktivitas
antibakteri dari ekstrak daun kecipir terhadap bakteri Staphylococcus aureus,
Staphylococcus epidermidis dan Pseudomonas aeruginosa. Penentuan aktivitas
antibakteri ekstrak daun kecipir dilakukan dengan metode difusi agar. Prinsip
metode ini adalah menggunakan media padat dan pencetak lubang kemudian
diameter hambat (zona jernih) bakteri diukur dengan jangka sorong.
3.3 Alat dan Bahan 3.3.1 Alat
Alat- alat yang digunakan adalah alat perkolator, alat-alat gelas, alat
penentuan kadar air, aluminium foil, autoklaf (Webeco), blender (National), botol
bertutup, cawan penguap rata, cawan penguap, cawan petri, desikator, freeze dryer
(Modulio), inkubator (Memmert), jarum ose, jangka sorong, kaca preparat, kaca
(Toshiba), lemari pengering, mikroskop (Olympus), neraca kasar (Ohaus), neraca
listrik (Mettler Toledo), oven listrik (Fisher scientific), pinset, penangas air,
pencetak lubang, rotary evaporator (Haake D), spatula dan tanur (Ney M 525
Series II).
3.3.2 Bahan
Bahan yang digunakan dalam penelitian ini adalah daun kecipir, etanol
96% (teknis), air suling, suspensi Mc. Farland, Mueller Hinton Agar (Difco),
biakan bakteri Staphylococcus aureus ATCC 25923 ,Staphylococcus epidermidis
ATCC 12228dan Pseudomonas aeruginosa ATCC 9027, larutan fisiologis NaCl
0,9%, dan bahan yang berkualitas pro analisa (E-Merck) kecuali dinyatakan lain:
alfa naftol, asam asetat anhidrida, asam klorida pekat, asam klorida 2 N, asam
nitrat, asam sulfat pekat, asam sulfat 2 N, besi (III) klorida, bismut (III) nitrat,
benzen, etanol, isopropanol, iodium, kalium iodida, kloralhidrat, kloroform,
metanol, natrium hidroksida, natrium sulfat anhidrat, raksa (II) klorida, serbuk
magnesium, serbuk zink, timbal (II) asetat, toluen dan timbal (II) asetat.
3.4 Penyediaan sampel 3.4.1 Pengumpulan sampel
Sampel yang dipergunakan adalah daun kecipir (Psophocarpus
tetragonolobus (L.) DC.) yang diperoleh di Jalan Selambo, Kecamatan Amplas,
Medan. Pengambilan sampel dilakukan secara purposif yaitu tanpa
membandingkan dengan tanaman yang sama dari daerah lain. Gambar dapat
3.4.2 Determinasi sampel
Determinasi tanaman dilakukan oleh Lembaga Ilmu Pengetahuan Indonesia (LIPI)
Pusat Penelitian Biologi-LIPI Bogor Jl. Raya Jakarta – Bogor Km. 46 Cibinong,
Indonesia. Hasil identifikasi tanaman dapat dilihat pada Lampiran 1, halaman 49.
3.4.3 Pengolahan sampel
Daun kecipir dibersihkan dari kotoran dengan cara mencuci di bawah air
mengalir hingga bersih, ditiriskan dan ditimbang berat basahnya 6,5 kg.
Kemudian dikeringkan dalam lemari pengering pada suhu 40-60oC. Daun kecipir
dianggap kering apabila rapuh. Kemudian ditimbang berat kering simplisia yaitu
5,5 g. Selanjutnya simplisia diserbuk menggunakan blender dan disimpan dalam
wadah plastik di tempat yang terlindung dari cahaya sebelum digunakan. Gambar
simplisia daun kecipir dapat dilihat pada Lampiran 2, halaman 51.
3.5 Rancangan Penelitian Rancangan penelitian terdiri dari:
a. Pemeriksaan karakteristik simplisia
b. Uji golongan senyawa kimia
c. Pembuatan ekstrak etanol daun kecipir secara perkolasi.
d. Pengenceran larutan ekstrak etanol daun kecipir
3.6 Pemeriksaan Karakteristik Simplisia 3.6.1 Pemeriksaan organoleptik
Pemeriksaan secara organoleptik meliputi pemeriksaan warna, bau dan
rasa dari daun segar dan simplisia kecipir.
3.6.2 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar dari
daun segar dan simplisia daun kecipir.
3.6.3 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap daun segar dan serbuk
simplisia. Daun segar dipotong tipis secara melintang di atas kaca preparat lalu
diteteskan larutan kloralhidrat dan dipanaskan diatas api bunsen kemudian ditutup
dengan kaca penutup dan diamati di bawah mikroskop. Serbuk simplisia
ditaburkan di atas kaca preparat, lalu diteteskan larutan kloralhidrat dan ditutup
dengan kaca penutup kemudian diamati di bawah mikroskop.
3.6.4 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (Destilasi
Toluen). Alat-alat terdiri dari labu alas bulat 500 ml, alat penampung, pendingin,
tabung penyambung dan tabung penerima 5 ml.
Cara kerja: kedalam labu alas bulat dimasukkan 200 ml toluen dan 2 ml air suling,
didestilasi selama 2 jam, toluen didinginkan selama 30 menit dan volume air
didalam tabung penerima dibaca kemudian kedalam labu dimasukkan 5 g serbuk
simplisia yang telah ditimbang seksama lalu dipanaskan hati-hati selama 15
menit. Setelah toluen mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik
tetes tiap detik. Setelah air terdestilasi, bagian dalam pendingin dibilas dengan
toluen. Destilasi dilanjutkan selama 5 menit kemudian tabung penerima dibiarkan
mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, dibaca
volume air dengan ketelitian 0,05 ml. Kadar air dihitung dalam persen (WHO,
1992).
3.6.5 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk yang telah dikeringkan di udara, dimaserasi selama
24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air suling sampai 1
liter) dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama
kemudian dibiarkan selama 18 jam lalu disaring. Sejumlah 20 ml filtrat pertama
diuapkan sampai kering dalam cawan penguap rata yang telah dipanaskan dan
ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen
sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan di udara
(Ditjen POM, 1995).
3.6.6 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara, dimaserasi selama
24 jam dalam 100 ml etanol 95% dalam labu bersumbat sambil sesekali dikocok
selama 6 jam pertama kemudian didiamkan selama 18 jam lalu disaring. Sejumlah
20 ml filtrat pertama diuapkan sampai kering dalam cawan penguap rata yang
telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap.
Kadar dalam persen sari yang larut dalam etanol 95% dihitung terhadap bahan
3.6.7 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama
dimasukkan dalam krus porselin yang telah dipijar dan ditara kemudian ditarakan.
Krus dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu
600oC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot
tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen
POM, 1995).
3.6.8 Penetapan kadar abu yang tidak larut dalam asam
Abu yang telah diperoleh dalam penetapan kadar abu didihkan dalam 25
ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring dan dipijarkan sampai bobot tetap,
kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam
dihitung terhadap bahan yang dikeringkan di udara (Ditjen POM, 1995).
3.7 Pembuatan Pereaksi
3.7.1 Pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling hingga
100 ml (Ditjen POM, 1995).
3.7.2Pereaksi asam sulfat 2 N
Sebanyak 5,5 ml asam sulfat pekat diencerkan dengan air suling hingga
100 ml (Ditjen POM, 1995).
3.7.3 Pereaksi Lieberman-Burchard
Tambahkan hati-hati 5 bagian volume asam asetat anhidrida ke dalam
campuran tersebut, dinginkan (Ditjen POM, 1995).
3.7.4 Pereaksi kloralhidrat
Larutkan 50 g kloralhidrat dalam 20 ml air (Ditjen POM, 1995).
3.7.5Pereaksi Mayer
Campurkan 60 ml larutan raksa (II) klorida dan 10 ml larutan kalium
iodida, tambahkan air secukupnya hingga 100 ml (Ditjen POM, 1995).
3.7.6 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam 20 ml air suling kemudian
ditambah 2 g iodium sambil diaduk sampai larut lalu cukupka n dengan air suling
hingga 100 ml (Depkes RI, 1980).
3.7.7Pereaksi Dragendorff
Campur 20 ml larutan bismut (III) nitrat dalam asam nitrat lalu tambahkan
dengan 50 ml larutan kalium iodida diamkan sampai memisah sempurna. Ambil
larutan jernih dan encerkan dengan air secukupnya hingga 100 ml (Ditjen POM,
1995).
3.7.8Peraksi Molish
Sebanyak 3 g alfa naftol dilarutkan dengan sedikit etanol kemudian
ditambahkan asam nitrat 0,5 N secukupnya hingga diperoleh 100 ml (Ditjen
POM, 1979).
3.7.9Pereaksi besi (III) klorida 1%
Ditimbang sebanyak 1 g besi (III) klorida dilarutkan dalam air suling
3.7.10 Pereaksi timbal (II) asetat 0,4 M
Ditimbang sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air hingga
100 ml (Ditjen POM, 1995).
3.7.11 Pereaksi natrium hidroksida 2 N
Sebanyak 8,002 g natrium hidroksida dilarutkan dalam air suling bebas
CO2 hingga diperoleh 100 ml larutan (Ditjen POM,1979).
3.8 Uji Golongan Senyawa Kimia 3.8.1 Pemeriksaan steroida/triterpenoida
Sebanyak 1 g sampel dimaserasi dengan 20 ml n-heksan selama 2 jam,
lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 2
tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat. Timbul warna ungu
merah menunjukkan adanya triterpenoida atau warna hijau biru menunjukkan
adanya steroida (Farnsworth, 1966).
3.8.2 Pemeriksaan alkaloida
Sebanyak 0,5 g serbuk simplisia ditambahkan 1 ml asam klorida 2 N dan 9
ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan
disaring. Filtrat dipakai untuk uji alkaloida sebagai berikut:
a. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Mayer
akan terbentuk endapan berwarna putih atau kuning.
b. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi
Bouchardat akan terbentuk endapan berwarna coklat sampai kehitaman.
c. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi
Alkaloida positif jika terjadi endapan atau kekeruhan dua dari tiga
percobaan diatas (Depkes RI, 1989).
3.8.3 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g kemudian disari dengan 30 ml
campuran 7 ml bagian etanol 96 % dan 3 bagian air suling ditambah dengan 10
ml HCL 2 N. Direfluks selama 30 menit, didinginkan dan disaring. Diambil 20 ml
filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok
lalu didiamkan selama 5 menit dan disaring. Filtrat disari dengan 20 ml campuran
3 bagian kloroform dan 2 isopropanol dilakukan berulang sebanyak tiga kali.
Kumpulan sari air diuapkan pada temperatur tidak lebih dari 50oC. Sisanya
dilarutkan dalam 2 ml metanol kemudian diambil 0,1 ml larutan percobaan
dimasukkan kedalam tabung reaksi, diuapkan di penangas air. Pada sisa
ditambahkan 2 ml air dan 5 tetes pereaksi Molish kemudian secara perlahan
ditambahkan 2 ml asam sulfat pekat melalui dinding tabung jika terbentuk cincin
ungu pada batas kedua cairan menunjukkan adanya glikosida (Depkes RI, 1989).
3.8.4 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambahkan 100 ml air, didihkan selama
5 menit dan disaring dalam keadaan panas. Kedalam 5 ml filtrat ditambahkan 0,1
g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok
dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah, kuning,
jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.8.5 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan ke dalam tabung reaksi,
Jika terbentuk busa setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10
menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan
adanya saponin (Depkes RI, 1989).
3.8.6 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu
disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil
sebanyak 2 ml dan ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida 1%.
Jika terjadi warna biru atau kehitaman menunjukkan adanya tanin (Depkes RI,
1989).
3.9 Pembuatan Ekstrak Etanol dari Daun Kecipir Secara Perkolasi.
Sebanyak 200 g serbuk simplisia dimasukkan kedalam bejana tertutup dan
dibasahi dengan 500 ml cairan penyari etanol, didiamkan selama 3 jam kemudian
massa dipindahkan sedikit demi sedikit kedalam perkolator sambil tiap kali
ditekan hati-hati, hingga memadat. Selanjutnya dituangi dengan cairan penyari
secukupnya sampai cairan penyari mulai menetes dan diatas simplisia masih
terdapat selapis cairan penyari diatas lalu perkolator ditutup dengan aluminium
foil dan dibiarkan selama 24 jam. Kran perkolator dibuka dan diatur cairan
menetes dengan kecepatan 1 ml/menit dan dipasang reservoir penyari sehingga
tetap dapat dipertahankan selapis cairan penyari diatas serbuk simplisia. Perkolat
dihentikan bila tetesan terakhir larutan penyari menjadi jernih. Perkolat yang
dihasilkan diuapkan dengan rotary evaporator pada suhu 50oC setelah itu
kedalam desikator sampai diperoleh ekstrak kental (Ditjen POM, 1979). Bagan
pembuatan ekstrak dapat dilihat pada Lampiran 5, halaman 58.
3.10 Sterilisasi alat
Sterilisasi untuk alat-alat yang digunakan antara lain:
1. Alat–alat yang terbuat dari gelas dibungkus dengan kertas perkamen,
disterilkan menggunakan oven pada suhu 170oC selama 1 jam.
2. Alat-alat jenis lainnya seperti media disterilkan di autoklaf pada suhu
121oC selama 15 menit.
3. Jarum ose dan pinset disterilkan dengan cara dibakar pada lampu bunsen.
4. Sebelum mulai daerah sekitar pengerjaan disemprot dengan etanol 70%
dan dibiarkan selama 15 menit sebelum digunakan.
5. Meja dibersihkan dari debu dan dilap menggunakan desinfektan (Lay,
1994).
3.11 Pembuatan Media
3.11.1 Muller Hinton Agar (MHA)
Komposisi : Beef infusion from 300 g
Casein hydrolysate 17,5 g
Starch 1,50 g
Bacto – Agar 17,0 g
pH = 7,4
Cara pembuatan: Ditimbang sebanyak 38 g serbuk MHA kemudian disuspensikan
1000 ml, dipanaskan hingga mendidih sambil sesekali diaduk sampai bahan larut
sempurna dan jernih. Tutup erlenmeyer dengan kapas yang dilapisi dengan
aluminium foil. Disterilkan di dalam autoklaf pada suhu 121oC tekanan 2 atm
selama 15 menit.
3.11.2 Pembuatan larutan NaCl 0,9%
Komposisi: Natrium Klorida 0,9 g
Air suling steril ad 100 ml
Cara pembuatan: Ditimbang sebanyak 0,9 g natrium klorida lalu dilarutkan dalam
air suling steril sedikit demi sedikit dalam labu ukur 100 ml sampai larut
sempurna. Ditambahkan air suling steril sampai garis tanda, dimasukkan dalam
erlenmeyer steril yang bertutup lalu disterilkan pada autoklaf suhu 121oC tekanan
2 atm selama 15 menit.
3.11.3 Pembuatan suspensi standar Mc.Farland
Suspensi standar yang menunjukkan konsentrasi kekeruhan suspensi
bakteri sama dengan 108 CFU/ml.
Komposisi: Larutan asam sulfat 1% 9,5 ml
Larutan barium klorida 1,175% b/v 0,5 ml
Cara pembuatan: Kedua larutan dicampurkan dalam tabung reaksi steril, dikocok
sampai homogen dan ditutup. Apabila kekeruhan hasil suspensi bakteri sama
dengan kekeruhan suspensi standar berarti konsentrasi bakteri 108 CFU/ml.
3.11.4 Pembuatan media agar miring
10 ml media agar yang telah dimasak dimasukkan kedalam tabung reaksi,
ditutup dan di bungkus lalu disterilkan di dalam autoklaf selama 15 menit pada
30-45oC. Diperhatikan bahwa agar tidak menyentuh tutup tabung. Agar dibiarkan
menjadi dingin dan keras (Lay, 1994).
3.12 Pembuatan Stok Kultur Bakteri
Masing-masing sebanyak satu ose dari biakan murni bakteri
Staphylococcus aureus ATCC 25923 , Staphylococcus epidermidis ATCC 12228
dan Pseudomonas aeruginosa ATCC 9027 digoreskan dengan metode sinambung
pada permukaan nutrien agar miring, ditutup mulut tabung reaksi dengan kapas.
Diinkubasi selama 18-24 jam pada suhu 37oC.
3.13 Pembuatan Inokulum Bakteri
Bakteri hasil inkubasi menggunakan jarum ose steril lalu disuspensikan
kedalam tabung yang berisi 10 ml larutan NaCl 0,9% steril kemudian
dihomogenkan dengan vorteks hingga diperoleh kekeruhan suspensi bakteri yang
sama dengan kekeruhan suspensi standar Mc. Farland, ini berarti konsentrasi
suspensi bakteri adalah 108 CFU(Colony Forming Unit)/ml. Setelah itu dilakukan
pengenceran dengan memipet 0,1 ml biakan bakteri (108 CFU/ml), dimasukkan
kedalam tabung steril yang berisi larutan NaCl 0,9% sebanyak 9,9 ml dan dikocok
homogen maka diperoleh suspensi bakteri dengan konsentrasi 106 CFU/ml.
3.14 Pembuatan Larutan Ekstrak Dengan Berbagai Konsentrasi
Ditimbang 5 g ekstrak etanol daun kecipir lalu dilarutkan dengan etanol
96% di dalam labu tentukur 10 ml hingga garis tanda. Konsentrasi ekstrak adalah
dengan konsentrasi 400 mg/ml, 300 mg/ml, 200 mg/ml, 100 mg/ml, 90 mg/ml, 80
mg/ml, 70 mg/ml, 60 mg/ml, 50 mg/ml, 40 mg/ml, 30 mg/ml, 20 mg/ml, 10
mg/ml, 9 mg/ml dan 8 mg/ml.
3.15 Uji Aktivitas Antibakteri
Sebanyak 0,1 ml suspensi bakteri konsentrasi 106 CFU/ml dimasukkan ke
dalam cawan petri kemudian ditambahkan 18 ml media MHA cair (45-50oC) lalu
dihomogenkan dan didiamkan hingga media memadat. Selanjutnya dibuat lubang
dengan pencetak lubang dan diteteskan larutan ekstrak mulai dari konsentrasi 500
mg/ml hingga pengenceran 8 mg/ml masing-masing 0,1 ml pada lubang dan
sebagai kontrol diteteskan 0,1 ml larutan etanol 96%. Ditutup cawan petri dan
dibungkus. Didiamkan selama 10-15 menit kemudian diinkubasi pada suhu 37oC
selama 18-24 jam. Setelah itu diukur diameter hambat pertumbuhan bakteri pada
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tanaman
Berdasarkan identifikasi tanaman yang dilakukan di Herbarium
Bogoriense Bidang Botani Pusat Penelitian Biologi-LIPI Bogor, identitas
tanaman adalah Psophocarpus tetragonolobus (L.) DC., suku Fabaceae. Hasil
identifikasi tanaman dapat dilihat pada Lampiran 1, halaman 49.
4.2 Hasil Karakterisasi Simplisia
Hasil pemeriksaan organoleptik terhadap daun segar yaitu berwarna hijau,
tidak berbau dan tidak berasa. Hasil pemeriksaan makroskopik terhadap daun
segar yaitu berwarna hijau, berbentuk seperti ujung tombak, tersusun majemuk
ganda tiga pada tangkai, panjang 7-8,5 cm dan lebar 4-6 cm, berdaun tipis, tidak
berasa dan cepat layu, tangkai berbentuk bulat dan berwarna hijau muda. Hasil
pemeriksaan mikroskopik terhadap daun segar menunjukkan adanya epidermis
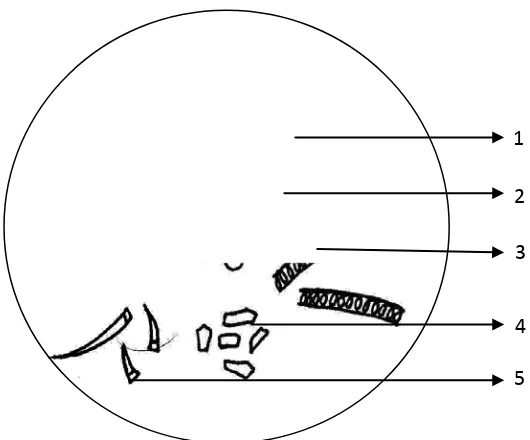
atas, jaringan palisade, kristal oksalat bentuk prisma, berkas pembuluh xilem
bentuk spiral, jaringan bunga karang, xilem, floem, stomata, kolenkim, epidermis
bawah dan rambut penutup.
Hasil pemeriksaan organoleptik terhadap simplisia yaitu berwarna hijau
kecoklatan, berbau langu dan tidak berasa. Hasil pemeriksaan makroskopik
simplisia yaitu berwarna hijau kecoklatan, keriput dan rapuh. Hasil pemeriksaan
mikroskopik serbuk simplisia menunjukkan adanya sel epidermis, stomata tipe