PERTUMBUHAN EKSPLAN BUNGA BETINA KELAPA
SAWIT (
Elaeis guineensis
Jacq.) PADA MEDIA MS DENGAN
KOMBINASI 2,4-D DAN BAP
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
SITI SHOFIYA NASUTION 090805022
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PERTUMBUHAN EKSPLAN BUNGA BETINA
KELAPA SAWIT (Elaeis guineensis Jacq.) PADA MEDIA MS DENGAN KOMBINASI 2,4-D DAN BAP
Kategori : SKRIPSI
Nama : SITI SHOFIYA NASUTION
Nomor Induk Mahasiswa : 090805022
Program Studi : SARJANA (S1) BIOLOGI
Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di
Medan, April 2014
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dra. Isnaini Nurwahyuni, M. Sc Dr. Suci Rahayu, M.Si NIP. 196005231985022001 NIP. 196506291992032002
Diketahui/Disetujui Oleh
Departemen Biologi FMIPA USU Ketua,
PERTUMBUHAN EKSPLAN BUNGA BETINA KELAPA SAWIT (Elaeis
guineensis Jacq.) PADA MEDIA MS DENGAN KOMBINASI 2,4-D DAN
BAP
ABSTRAK
Penelitian tentang “Pertumbuhan Eksplan Bunga Betina Kelapa Sawit (Elaeis guineensis Jacq.) pada Media MS dengan Kombinasi 2,4-D dan BAP” telah dilakukan di Laboratorium Kultur Jaringan Tumbuhan Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara dari bulan Januari 2013 sampai dengan bulan Desember 2013. Penelitian yang bertujuan untuk mengetahui kombinasi 2,4-D dan BAP terbaik pada induksi kalus dan pertumbuhan kultur eksplan bunga betina kelapa sawit (Elaeis guineensis
Jacq.) ini menggunakan Rancangan Acak Lengkap Faktorial 2 faktor dengan taraf 2,4-D yaitu 0; 325; 400; 475 µ M dan 4 taraf BAP yaitu 0; 25; 50; 75 µM. Hasil analisis statistik menunjukkan bahwa interaksi kedua zat pengatur tumbuh tersebut memberikan pengaruh yang tidak berbeda nyata terhadap waktu tumbuh dan berat kalus. Perlakuan yang terbaik berdasarkan waktu tumbuh yaitu 2,4-D 475 µM tanpa BAP, sedangkan berat basah kalus terbaik pada kombinasi 2,4-D 400 µM dan BAP 25 µM. Persentase kultur yang membentuk kalus embriogenik sebesar 44,44% dan menghasilkan kalus berwarna kuning sebesar 55,56%, kuning kecoklatan 30,56%, dan coklat 13,88%.
THE EFFECT OF 2,4-D AND BAP COMBINATION IN MS MEDIA ON THE GROWTH OF THE IMMATURE INFLORESCENCES OF OIL
PALM (Elaeis guineensis Jacq.) ABSTRACT
The research of “The Effect of 2,4-D and BAP Combination in MS Media on The Growth of The Immature Inflorescences of Oil Palm (Elaeis guineensis Jaqc.)”
has been done in Plant Tissue Culture Laboratory, University of Sumatera Utara from January 2013 to December 2013. The aim of this research was to know the effects combination 2,4-D and BAP for callus induction and the growth of the immature inflorescences of oil palm (Elaeis guineensis Jacq.) using Complete Randomized Design, two factors which are 4 levels of 2,4-D concentrations: 0; 325; 400; 475 µM and 4 concentrations of BAP: 0; 25; 50; 75 µM. The result of statistic analysis indicated that the interaction of 2,4-D and BAP give have no significant effect of callus growth in culture and the percentage of callus fresh weight. The result showed that the treatment 2,4-D 475 µM without BAP can result the fastest time of callus induction. Meanwhile, the best treatment of callus fresh weight found in 2,4-D 400 µM and BAP 25 µM. Percentage of the culture that formed embriogenic callus is 44,44% and produced yellow callus 55,56%, yellow brown callus 30,56% and brown callus 13,88%.
DAFTAR ISI
2.1. Botani Tanaman Kelapa Sawit 4
2.2. Kultur Jaringan Kelapa Sawit 5
2.3. Eksplan 6
2.4. Media Kultur Jaringan 7
2.5. Zat Pengatur Tumbuh 8
BAB 4. HASIL DAN PEMBAHASAN
4.3. Persentase Kultur yang Membentuk Kalus Embriogenik 19
4.4. Warna Kalus 21
4.5. Berat Basah Kalus 22
BAB 5. KESIMPULAN DAN SARAN
5.1. Kesimpulan 24
5.2. Saran 24
DAFTAR PUSTAKA 25
DAFTAR TABEL
Nomor
Tabel Judul Halaman
4.1. Persentase Kultur yang Membentuk Kalus 17 4.2. Rata-rata Waktu Tumbuh Kalus (Hari) pada Perlakuan
Kombinasi 2,4-D dan BAP
19 4.3. Rata-rata Berat Basah Kalus (g) pada Perlakuan
Kombinasi 2,4-D dan BAP
DAFTAR GAMBAR
Nomor
Gambar Judul Halaman
3.1. Bunga betina kelapa sawit 12
4.1. Kalus bunga betina kelapa sawit dalam kultur in vitro 16
4.2. Eksplan mati dalam kultur in vitro 19
4.3. Kalus embriogenik 20
4.4. Hubungan persentase kultur membentuk kalus embriogenik dengan kombinasi ZPT
21 4.5. Warna kalus kelapa sawit (Elaeis guineensis Jacq.) pada
perlakuan kombinasi 2,4-D dan BAP
DAFTAR LAMPIRAN
Nomor
Lamp. Judul Halaman
1. Persentase Data Pengamatan Kultur yang Membentuk Kalus
29 2. Data Pengamatan Waktu Tumbuh Kalus (Hari Setelah
Tanam)
30 3. Persentase Kultur yang Membentuk Kalus Embriogenik 32
4. Data Pengamatan Warna Kalus 33
5. Persentase Warna Kalus 34
6. Data Pengamatan Berat Basah Kalus (g) 35
7. Komposisi Media Murashige-Skoog (MS) 37
PERTUMBUHAN EKSPLAN BUNGA BETINA KELAPA SAWIT (Elaeis
guineensis Jacq.) PADA MEDIA MS DENGAN KOMBINASI 2,4-D DAN
BAP
ABSTRAK
Penelitian tentang “Pertumbuhan Eksplan Bunga Betina Kelapa Sawit (Elaeis guineensis Jacq.) pada Media MS dengan Kombinasi 2,4-D dan BAP” telah dilakukan di Laboratorium Kultur Jaringan Tumbuhan Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara dari bulan Januari 2013 sampai dengan bulan Desember 2013. Penelitian yang bertujuan untuk mengetahui kombinasi 2,4-D dan BAP terbaik pada induksi kalus dan pertumbuhan kultur eksplan bunga betina kelapa sawit (Elaeis guineensis
Jacq.) ini menggunakan Rancangan Acak Lengkap Faktorial 2 faktor dengan taraf 2,4-D yaitu 0; 325; 400; 475 µ M dan 4 taraf BAP yaitu 0; 25; 50; 75 µM. Hasil analisis statistik menunjukkan bahwa interaksi kedua zat pengatur tumbuh tersebut memberikan pengaruh yang tidak berbeda nyata terhadap waktu tumbuh dan berat kalus. Perlakuan yang terbaik berdasarkan waktu tumbuh yaitu 2,4-D 475 µM tanpa BAP, sedangkan berat basah kalus terbaik pada kombinasi 2,4-D 400 µM dan BAP 25 µM. Persentase kultur yang membentuk kalus embriogenik sebesar 44,44% dan menghasilkan kalus berwarna kuning sebesar 55,56%, kuning kecoklatan 30,56%, dan coklat 13,88%.
THE EFFECT OF 2,4-D AND BAP COMBINATION IN MS MEDIA ON THE GROWTH OF THE IMMATURE INFLORESCENCES OF OIL
PALM (Elaeis guineensis Jacq.) ABSTRACT
The research of “The Effect of 2,4-D and BAP Combination in MS Media on The Growth of The Immature Inflorescences of Oil Palm (Elaeis guineensis Jaqc.)”
has been done in Plant Tissue Culture Laboratory, University of Sumatera Utara from January 2013 to December 2013. The aim of this research was to know the effects combination 2,4-D and BAP for callus induction and the growth of the immature inflorescences of oil palm (Elaeis guineensis Jacq.) using Complete Randomized Design, two factors which are 4 levels of 2,4-D concentrations: 0; 325; 400; 475 µM and 4 concentrations of BAP: 0; 25; 50; 75 µM. The result of statistic analysis indicated that the interaction of 2,4-D and BAP give have no significant effect of callus growth in culture and the percentage of callus fresh weight. The result showed that the treatment 2,4-D 475 µM without BAP can result the fastest time of callus induction. Meanwhile, the best treatment of callus fresh weight found in 2,4-D 400 µM and BAP 25 µM. Percentage of the culture that formed embriogenic callus is 44,44% and produced yellow callus 55,56%, yellow brown callus 30,56% and brown callus 13,88%.
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Tanaman kelapa sawit (Elaeis guineensis Jacq.) merupakan tanaman penghasil minyak nabati yang mempunyai kekhasan tersendiri dari tanaman kelapa umumnya dan memiliki nilai ekonomi yang cukup tinggi. Menurut Sunarko (2012), produksi minyak sawit di Indonesia terus mengalami peningkatan. Tahun 1997, produksi minyak kelapa sawit hanya 5,5 juta ton. Tahun 2007, produksi meningkat menjadi 17,3 juta ton. Tahun 2011, produksi minyak sawit lebih dari 20 juta ton. Kenaikan produksi ini terutama disebabkan oleh pertambahan luas areal perkebunan kelapa sawit, perbaikan bibit, dan pengelolaan kebun kelapa sawit yang semakin intensif.
Penyediaan bibit kelapa sawit selama ini dilakukan dengan dua cara, yaitu secara generatif dan vegetatif. Perbanyakan generatif menggunakan benih dari biji hasil persilangan Dura dengan Pisifera (Lubis, 1992). Perbanyakan secara vegetatif, salah satunya dilakukan dengan teknik kultur jaringan. Keunggulan dari teknik kultur jaringan adalah mampu menghasilkan banyak bibit dalam waktu yang relatif singkat (Ginting & Fatmawati, 2003).
Dalam kultur jaringan, ada dua golongan zat pengatur tumbuh (ZPT) yang penting yaitu sitokinin dan auksin. Penambahan auksin atau sitokinin eksogen mengubah level ZPT endogen sel (Gunawan, 1992). Dalam penelitian ini digunakan auksin asam 2,4-diklorofenoksiasetat (2,4-D) yang bersifat stabil karena tidak mudah mengalami kerusakan oleh cahaya maupun pemanasan pada saat sterilisasi (Hendaryono & Wijayani, 1994). Sitokinin yang digunakan adalah benzil amino purin (BAP). Menurut Noggle & Fritz (1983), BAP memiliki sifat aktif dan struktur yang mirip dengan kinetin dan juga aktif dalam proliferasi dan pertumbuhan kalus.
2
bunga yaitu tidak terlalu merusak pohon induk (ortet), dan memiliki jumlah individu bunga yang banyak. Kelemahan eksplan dari bunga adalah induksi kalus membutuhkan waktu lama (Ginting & Fatmawati, 2003). Pengurangan waktu untuk induksi kalus dapat dilakukan dengan pemberian kombinasi hormon dan konsentrasi hormon yang sesuai. Oleh karena itu, dilakukan penelitian ini.
Penelitian kultur kelapa sawit dari eksplan bunga betina sudah pernah dilakukan Guedes et al., (2011). Penelitian tersebut dilakukan dengan penambahan 2,4-D dengan konsentrasi (0; 225; 450; dan 675 µ M). Dari hasil penelitian diperoleh dengan penambahan 2,4-D 225 µM dapat menginduksi kalus embriogenik terbaik pada eksplan. Perlakuan BAP dengan konsentrasi (0; 25; dan 50 µM) tidak memberikan efek signifikan. Dari hasil penelitian diperoleh dengan penambahan BAP 25 µM memberikan hasil terbaik dalam menginduksi kalus embriogenik eksplan bunga kelapa sawit.
Berdasarkan penelitian tersebut, maka dalam penelitian ini eksplan bunga kelapa sawit dikulturkan dalam media Murashige dan Skoog (MS) dengan kombinasi 2,4-D dan BAP. Media kultur diberi perlakuan 2,4-D dengan konsentrasi (0; 325; 400; dan 475 µ M) dan BAP dengan konsentrasi (0; 25; 50; dan 75 µM).
1.2. Permasalahan
Perbanyakan benih kelapa sawit dengan teknik kultur jaringan saat ini telah banyak dilakukan. Namun, untuk induksi dan pertumbuhan kalus membutuhkan waktu yang lama. Oleh karena itu, dalam penelitian ini digunakan berbagai konsentrasi 2,4-D dan BAP terhadap inisiasi dan pertumbuhan eksplan bunga betina kelapa sawit. Adapun permasalahan yang dikaji dari penelitian ini adalah berapa konsentrasi 2,4-D dan BAP yang tepat untuk mempersingkat waktu dalam menginduksi dan pertumbuhan bunga betina kelapa sawit dalam kultur in vitro.
1.3. Tujuan Penelitian
Tujuan penelitian ini adalah untuk mendapatkan kombinasi 2,4-D dan BAP optimum terhadap pertumbuhan eksplan bunga betina kelapa sawit dengan kultur
3
1.4. Hipotesis
Kombinasi hormon 2,4-D dan BAP yang tepat dapat menginduksi pertumbuhan kalus dan memacu pertumbuhan eksplan bunga betina kelapa sawit dengan kultur
in vitro pada media MS.
1.5. Manfaat Penelitian
Penelitian ini bermanfaat untuk mengetahui kombinasi 2,4-D dan BAP optimum terhadap pertumbuhan eksplan bunga betina kelapa sawit dengan kultur in vitro
BAB 2
TINJAUAN PUSTAKA
2.1. Botani Tanaman Kelapa Sawit
Tanaman kelapa sawit disebut dengan nama latin Elaeis guineensis Jacq. Elaeis
berasal dari Elaion yang dalam bahasa Yunani berarti minyak. Guineensis berasal dari kata Guinea yaitu Pantai Barat Afrika dan Jacq singkatan dari Jacquin seorang botanis dari Amerika (Soehardjo et al., 1998). Menurut Pandey (1981), tanaman kelapa sawit diklasifikasikan sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Monocotyledonae
Ordo : Arecales
Famili : Arecaceae
Genus : Elaeis
Spesies : Elaeis guineensis Jacq.
Tanaman kelapa sawit tumbuh tegak lurus dan dapat mencapai ketinggian pohon sampai 20 m. Tanaman ini berumah satu atau monoecious yaitu bunga jantan dan bunga betina terdapat pada satu pohon. Bunga jantan terdapat pada tandan bunga jantan dan bunga betina terdapat pada tandan bunga betina. Masing-masing tandan terletak terpisah dan keluar dari ketiak pelepah (Soehardjo et al., 1998). Walaupun demikian, kadang-kadang dijumpai juga bunga jantan dan betina pada satu tandan (hermaprodit) (Pahan, 2006).
5
sawit terbentuk rangkaian bunga yang hermaprodit, terutama pada tanaman yang masih muda (Fauzi et al., 2002).
2.2. Kultur Jaringan Kelapa Sawit
Kultur jaringan tanaman adalah suatu teknik isolasi bagian-bagian tanaman, seperti jaringan, organ, ataupun embrio, lalu dikultur pada medium buatan yang steril sehingga bagian-bagian tanaman tersebut mampu beregenerasi dan berdiferensiasi menjadi tanaman lengkap (Winata, 1987). Yusnita (2003), menambahkan bahwa berdasarkan bagian tanaman yang dikulturkan secara lebih spesifik terdapat beberapa tipe kultur, yaitu kultur kalus, kultur suspensi sel, kultur akar, kultur pucuk tunas, kultur embrio, kultur ovul, kultur anter, dan kultur kuncup bunga. Teknik kultur jaringan pada saat ini telah berkembang menjadi teknik perkembangbiakan tumbuhan yang sangat penting pada berbagai spesies tumbuhan (Pandiangan & Subarnas, 2011).
Setiap sel mampu tumbuh dan berkembang menjadi tumbuhan normal jika dikulturkan pada nutrisi dan lingkungan yang tepat. Totipotensi yang awal masih sekitar totipotensi morfologi. Berdasarkan teori totipotensi inilah berkembang sampai pada totipotensi kimia. Pada saat ini sudah dikembangkan produksi senyawa kimia atas dasar totipotensi kimia tersebut. Senyawa kimia pada tanaman utuh alami dapat dihasilkan juga secara in vitro atau kultur jaringan tumbuhan (Zulkarnain, 2009).
Pemanfaatan utama dari kultur jaringan pada awalnya adalah untuk mendapatkan tanaman baru dalam jumlah banyak dengan waktu relatif singkat, yang mempunyai sifat fisiologi dan morfologi sama persis dengan induknya. Teknik kultur jaringan tumbuhan diharapkan dapat memperoleh tumbuhan baru yang bersifat unggul. Perbanyakan tumbuhan secara besar-besaran telah dibuktikan keberhasilannya pada perkebunan kelapa sawit dan tebu di Sumatera (Pandiangan & Subarnas, 2011).
6
untuk mendapatkan klon kelapa sawit dengan perlakuan khusus dari bahan biakan yang berupa jaringan muda (Fauzi et al., 2002).
Penggunaan teknik kultur jaringan pada tanaman kelapa sawit terbukti memberikan beberapa keuntungan, di antaranya dalam waktu singkat dapat dihasilkan bibit dalam jumlah banyak. Selain itu, bibit dari kultur jaringan memiliki sifat yang sama dengan induknya. Keuntungan lain adalah dapat meningkatkan produksi (Fauzi et al., 2002). Jambak (2011), perbanyakan kelapa sawit melalui kultur jaringan mampu meningkatkan produksi mencapai 25-30%, mengingat variasi produksi antar tanaman cukup tinggi yang dapat mencapai antara 60-100% dari produksi rata-rata. Produk komersil 5-6 ton minyak seperti sekarang akan dapat ditingkatkan menjadi 7-9 ton per/ha/tahun.
2.3. Eksplan
Pada prinsipnya, tahapan perbanyakan bibit kelapa sawit dengan kultur jaringan dimulai dari sepotong jaringan daun muda atau akar sebagai bahan tanaman (eksplan). Potongan-potongan jaringan daun muda diambil dari pohon induk. Pohon induk harus berasal dari hasil pengamatan mulai umur 3-9 tahun, telah dilakukan analisis tandan dan pengamatan karakter yang lain (Fauzi et al., 2002).
Seleksi bahan eksplan yang cocok merupakan faktor penting yang menentukan keberhasilan program kultur jaringan. Untuk memulai sistem kultur jaringan yang baru dengan spesies atau kultivar tanaman yang baru pula, seringkali menghendaki analisis yang sistematis terhadap potensi eksplan dari setiap tipe jaringan (Hartman et al., 1990). Oleh karena itu, Pierik (1997) mengemukakan tiga aspek utama yang harus diperhatikan dalam seleksi bahan eksplan, yaitu genotip, umur, dan kondisi fiosiologis bahan tersebut.
7
daun mulai muncul dan tunas-tunas berakar sehingga akan terbentuk tanaman baru (planlet). Bibit yang berasal dari teknik kultur jaringan disebut klon (Fauzi et al., 2002).
Eksplan diambil dari bunga betina kelapa sawit. Menurut Guedes et al.
(2011),bunga dewasa menjadi salah satu yang paling menjanjikan, karena jumlah bunga yang banyak dan bunga dapat diperoleh dari tanaman dewasa tanpa menyebabkan utama kerusakan pada pohon induk. Bunga dewasa biasanya dilindungi oleh spatha sehingga mengurangi penggunaan desinfektan.
2.4. Media Kultur Jaringan
Media merupakan salah satu faktor penentu keberhasilan perbanyakan tanaman secara kultur jaringan. Berbagai komposisi media kultur telah diformulasikan untuk mengoptimalkan pertumbuhan dan perkembangan tanaman yang dikulturkan. Media kultur secara fisik dapat berbentuk cair atau padat (Yusnita, 2003).
Apabila suatu eksplan dikulturkan, jaringan eksplan tersebut mengalami perubahan-perubahan yang dinyatakan oleh Hartmann et al., (1990), sebagai situasi kritis. Di samping kekurangan suplai air dan mineral sebagai akibat menurun tekanan akar, tanaman pun kehilangan karbohidrat karena tidak ada daun-daun yang menyediakan gula ke dalam sistem floem, juga terjadi gangguan yang menyeluruh pada sistem regulasi hormon tanaman.
8
2.5. Zat Pengatur Tumbuh
Fitohormon adalah senyawa-senyawa yang dihasilkan oleh tanaman tingkat tinggi secara endogen. Senyawa tersebut berperan merangsang dan meningkatkan pertumbuhan serta perkembangan sel, jaringan, dan organ tanaman menuju arah diferensiasi tertentu. Senyawa-senyawa lain yang memiliki karakteristik yang sama dengan hormon, tetapi diproduksi secara eksogen, dikenal sebagai zat pengatur tumbuh (ZPT). Didalam teknik kultur jaringan, kehadiran ZPT sangat nyata pengaruhnya (Pierik, 1997).
Auksin dan sitokinin berperan penting dalam manipulasi pertumbuhan tumbuhan dalam kondisi yang terkontrol dengan baik. Kebanyakan eksplan menghasilkan sejumlah auksin dan sitokinin endogen (endogenus). Dalam kultur jaringan, ZPT tambahan (eksogenus) diberikan untuk memperoleh efek pertumbuhan. Sebagai panduan umum, auksin atau sitokinin atau keduanya ditambahkan ke dalam kultur untuk memperoleh respons pertumbuhan (Pandiangan & Subarnas, 2011).
Zat pengatur tumbuh yang biasa digunakan antara lain auksin, sitokinin, dan giberelin. Hormon-hormon ini sering digunakan karena mempunyai kemampuan untuk merangsang pertumbuhan eksplan dan mempengaruhi pertumbuhan akar. Dari ketiga jenis hormon ini yang paling sering digunakan adalah auksin dan sitokinin (Wetherell, 1982).
2.5.1. Auksin
9
Pemberian 2,4-D pada konsentrasi 10-7 – 10-5 M tanpa sitokinin sangat efektif untuk induksi proliferasi kalus pada kebanyakan kultur (Dodds & Roberts, 1985). Menurut Gamborg et al., (1976), senyawa tersebut dapat menekan organogenesis dan sebaiknya tidak digunakan pada kultur yang melibatkan inisiasi pucuk dan akar. Sementara itu, Pierik (1997) menganjurkan untuk membatasi penggunaan 2,4-D pada kultur in vitro karena 2,4-D dapat meningkatkan peluang terjadinya mutasi genetik dan menghambat fotosintesis pada tanaman yang diregenerasikan.
2.5.2. Sitokinin
Sitokonin adalah senyawa yang dapat meningkatkan pembelahan sel pada jaringan tanaman serta mengatur pertumbuhan dan perkembangan tanaman, sama halnya dengan kinetin (6-furfurylaminopurine). Peranan auksin dan sitokinin sangat nyata dalam pengaturan pembelahan sel, pemanjangan sel, diferensiasi sel, dan pembentukan organ (Zulkarnain, 2009).
Pemberian sitokinin ke dalam medium kultur jaringan penting untuk menginduksi perkembangan dan pertumbuhan eksplan. Senyawa tersebut dapat meningkatkan pembelahan sel, proliferasi pucuk, dan morfogenesis pucuk (Smith, 1992). Bahkan menurut George & Sherrington (1984), apabila ketersediaan sitokinin di dalam medium kultur sangat terbatas maka pembelahan sel pada jaringan yang dikulturkan akan terhambat. Akan tetapi, apabila jaringan tersebut disubkulturkan pada medium dengan kandungan sitokinin yang memadai maka pembelahan sel akan berlangsung secara sinkron.
10
BAB 3
METODE PENELITIAN
3.1. Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret 2013 – Desember 2013. Penelitian dilakukan di Laboratorium Kultur Jaringan Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2. Bahan dan Alat
Bahan tanaman yang digunakan dalam penelitian ini adalah bunga betina tanaman kelapa sawit yang diperoleh dari kebun percobaan pusat penelitian kelapa sawit (PPKS) Bukit Sentang Desa Securai Utara Kecamatan Babalan Kabupaten Langkat sebagai sumber eksplan. Bahan kimia yang digunakan adalah bahan-bahan penyusun media MS (Murashige dan Skoog, 1962), 2,4-D, BAP, HCl 0,1N, NaOH 0,1N, sukrosa, agar, arang aktif, larutan pemutih (NaOCl 5,25%), detergen, fungisida, alkohol 70%, antibiotik, akuades, spiritus, dan HgCl2.
Alat yang digunakan pada penelitian ini adalah erlenmeyer, gelas ukur, pipet serologi, propipet, pH-meter, autoklaf, entkas, laminar air flow, rak kultur, kertas saring, aluminium foil, plastik, karet, botol selai, shaker, botol kultur, alat diseksi, beaker glass, neraca digital, mikroskop, bunsen, cawan petri, kain hitam, mancis, dan handsprayer.
3.3. Rancangan Percobaan
Penelitian ini menggunakan metode percobaan dengan rancangan acak lengkap (RAL), faktorial dengan 2 faktor, yaitu:
Faktor 1 (A) : Perlakuan media MS dengan penambahan ZPT 2,4-D A0 : Konsentrasi 0 µM (sebagai kontrol)
12
Faktor 2 (B) : Perlakuan media MS dengan penambahan ZPT BAP B0 : Konsentrasi 0 µM (sebagai kontrol)
B1 : Konsentrasi 25 µM B2 : Konsentrasi 50 µM B3 : Konsentrasi 75 µM
Sehingga diperoleh kombinasi perlakuan 4 X 4 = 16 perlakuan untuk masing-masing kelompok percobaan dengan masing-masing-masing-masing ulangan sebanyak 3 kali. Rincian kombinasi perlakuan sebagai berikut:
A0B0 A1B0 A2B0 A3B0 A0B1 A1B1 A2B1 A3B1 A0B2 A1B2 A2B2 A3B2 A0B3 A1B3 A2B3 A3B3 Sehingga diperoleh jumlah total sebanyak 48 botol.
Gambar 3.1. Bunga betina kelapa sawit: (a) Rangkaian bunga betina; (b) Spikelet; (c) Individu bunga betina
3.4. Cara Kerja
3.4.1. Sterilisasi Alat dan Bahan
Seluruh alat gelas dan alat diseksi yang digunakan dicuci dengan air bersih dan dikeringkan. Alat-alat tersebut dibungkus kertas dan disterilisasi bersamaan dengan akuades dalam botol selai yang telah ditutup aluminium foil dalam autoklaf pada suhu 1210C dengan tekanan 15 psi selama 60 menit. Alat dan
a
b
13
bahan disimpan di ruang pemeliharaan kultur yang telah aseptik dengan cara disemprot setiap hari dengan menggunakan alkohol 70%. Suhu ruangan tetap dijaga berkisar 250C±20C dengan pengaturan AC.
3.4.2. Pembuatan Media
Media yang digunakan adalah media MS (Lampiran 7 halaman 38) yang diberi perlakuan tanpa penambahan 2,4-D untuk perlakuan A0, dengan penambahan 2,4-D sebanyak 325 µM untuk perlakuan A1, 400 µM untuk perlakuan A2, 475 µM untuk perlakuan A3. Tanpa penambahan BAP untuk perlakuan B0, dengan penambahan BAP sebanyak 25 µM untuk perlakuan B1, 50 µM untuk perlakuan B2, 75 µM untuk perlakuan B3. Tahap awal pembuatan media adalah pembuatan larutan stok terlebih dahulu yaitu hara makro, mikro, iron, dan vitamin. Unsur-unsur lain ditimbang sesuai kebutuhan seperti sukrosa dan agar. Pembuatan media sebanyak 1000 ml.
Unsur-unsur hara makro, mikro, iron, vitamin, sukrosa, ZPT dimasukkan ke dalam gelas piala dan ditambah dengan akuades sehingga volume menjadi 1000 ml. Pada media tersebut ditambahkan arang aktif 3 mg/l kemudian ZPT 2,4-D dan BAP sesuai dengan perlakuan. Keasaman media diukur dengan menggunakan pH meter sekitar 5,8. Untuk mendapatkan keasaman yang diharapkan, ditambah dengan HCl 0,1 N atau NaOH 0,1 N. Ke dalam media dimasukkan agar, lalu dipanaskan hingga larutan menjadi bening. Larutan tersebut dituang ke dalam botol kultur lalu ditutup dengan aluminium foil dan plastik kemudian diikat dengan karet. Media diautoklaf pada suhu 1210C dengan tekanan 15 psi selama 10 menit, media disimpan di ruang kultur lebih kurang selama 1 minggu sebelum digunakan.
3.4.3. Sterilisasi Eksplan
Eksplan berupa bunga betina kelapa sawit dibersihkan dengan air mengalir hingga bersih. Selanjutnya eksplan direndam dalam larutan fungisida 2 g/l dan dishaker
14
dengan akuades steril. Kemudian eksplan direndam kembali dengan larutan HgCl2 1 g/l selama 15 menit lalu dibilas 3 kali dengan akuades steril. Eksplan dikeringkan di atas kertas saring steril dalam cawan petri.
3.4.4. Penanaman Eksplan
Sebelum melakukan penanaman diusahakan agar ruangan dalam keadaan bersih. Penanaman dilakukan di dalam Laminar Air Flow (LAF) yang telah disterilisasi dengan UV. Alat-alat diseksi, lampu bunsen dan alkohol 70% dipersiapkan terlebih dahulu. Salah satu sisi bunga betina dilukai lalu satu per satu ditanam dalam media. Botol media hanya diisi oleh satu eksplan saja. Setiap kali melakukan penyayatan pisau terlebih dahulu dicelupkan ke dalam alkohol 70% lalu pisau dibakar. Botol berisi eksplan kemudian ditutup dengan aluminium foil
dan diikat dengan karet.
3.4.5. Pemeliharaan Kultur Bunga Kelapa Sawit
Eksplan yang telah ditanam di dalam botol kultur diletakkan pada rak pemeliharaan dengan kondisi ruangan yang steril. Botol kultur diletakkan di ruang tanpa cahaya. Botol-botol yang berisi eksplan tersebut disusun dengan rapi sehingga memudahkan dalam pengamatan. Ruangan diupayakan dalam keadaan steril atau dengan menyemprotkan alkohol 70% setiap harinya sampai eksplan membentuk kalus.
3.4.6. Parameter Pengamatan
Parameter yang diamati dalam penelitian ini adalah:
a. Waktu pertumbuhan eksplan bunga betina kelapa sawit
Pertumbuhan kultur bunga betina kelapa sawit diamati pada hari awal tumbuhnya kalus.
b. Persentase kultur yang membentuk kalus (%)
Persentase eksplan berkalus =
c. Persentase kultur yang membentuk kalus embriogenik (%)
Persentase kalus embriogenik =
15
d. Warna kalus
e. Berat basah kultur (g)
Berat basah kultur dihitung pada akhir penelitian.
3.5. Analisis Data
BAB 4
HASIL DAN PEMBAHASAN
4.1. Persentase Kultur yang Membentuk Kalus
Kalus merupakan sekumpulan sel yang belum berdiferensiasi dan tumbuh dari proliferasi sel-sel yang tidak terorganisasi. Kalus terbentuk akibat pelukaan pada permukaan eksplan dan pengaruh perlakuan ZPT yang diberikan pada medium kultur (Zulkarnain, 2009). Kalus diinisiasi secara in vitro dengan meletakkan bagian kecil tanaman (eksplan) pada medium pertumbuhan pada kondisi aseptik (George & Sherington, 1984).
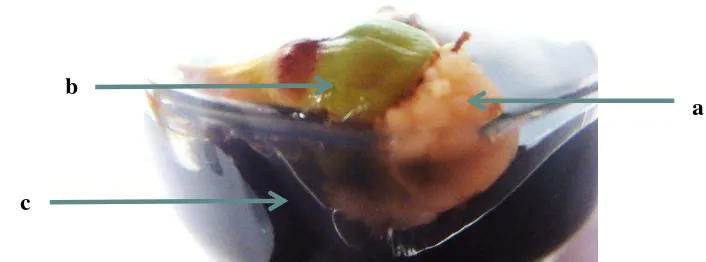
Gambar 4.1. Kalus bunga betina kelapa sawit dalam kultur in vitro: a. kalus; b. eksplan bunga betina kelapa sawit; c. media
Gambar 4.1. dapat dilihat eksplan mengalami pembengkakan. Pembengkakan tersebut merupakan interaksi eksplan dengan media tumbuh, ZPT, dan lingkungan tumbuh. Kalus mulai terbentuk pada bagian bawah eksplan yang bersentuhan dengan media. Hal ini dipengaruhi oleh proses pengambilan nutrisi medium eksplan. Penyerapan unsur hara lebih baik karena terjadi kontak langsung antara eksplan dan nutrisi media. Kalus muncul pada bagian yang terluka karena adanya rangsangan dari jaringan pada eksplan untuk menutupi luka. Hal ini sesuai dengan pendapat Santoso (2001), kalus terbentuk pada tanaman yang mengalami pelukaan dan dapat pula terbentuk akibat tanaman mengalami stres.
Pengamatan kultur yang membentuk kalus dapat dilihat pada Lampiran 1 a b
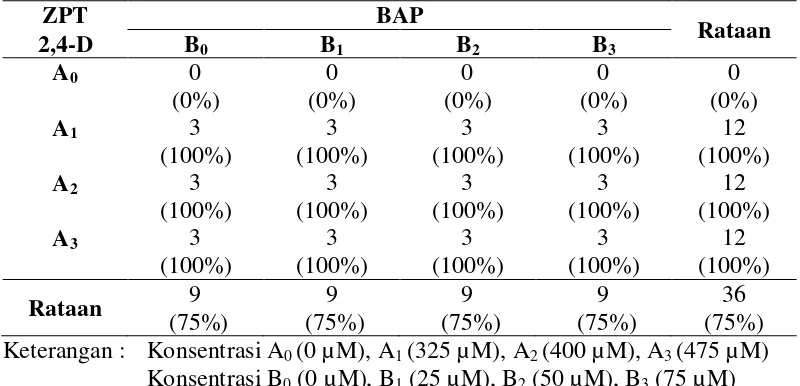
17
adalah 75% yaitu sebanyak 36 dari 48 botol perlakuan. Pengaruh perlakuan 2,4-D dan BAP terhadap persentase kultur yang hidup ditampilkan pada Tabel 4.1. Tabel 4.1. Persentase Kultur yang Membentuk Kalus
ZPT BAP perlakuan dengan penambahan 2,4-D menunjukkan adanya pertumbuhan kultur menjadi kalus sebesar 100% pada masing-masing perlakuan. Hal ini mungkin disebabkan kurangnya hormon auksin endogen yang terkandung dalam eksplan tersebut sehingga membutuhkan ZPT auksin yang tinggi untuk merangsang pembelahan sel menjadi kalus.
Komponen media yang mempengaruhi proses regenerasi tanaman secara
in vitro salah satunya adalah komposisi ZPT (Taji et al. 2002). Morfogenesis kalus tergantung pada keseimbangan auksin dan sitokinin di dalam media. Interaksi antara ZPT endogen tanaman dan ZPT eksogen yang diserap dalam media dapat menentukan arah perkembangan kalus (Asnawati et al. 2002).
18
4.2 Waktu Pertumbuhan Kalus Bunga Betina Kelapa Sawit
Data pengamatan waktu pertumbuhan kalus bunga betina kelapa sawit dan tabel daftar sidik ragam dapat dilihat pada Lampiran 2 halaman 30. Berdasarkan tabel sidik ragam, dapat dilihat bahwa perlakuan ZPT 2,4-D (A) memberikan pengaruh berbeda sangat nyata terhadap waktu pertumbuhan kalus bunga betina kelapa sawit sedangkan perlakuan BAP (B) maupun interaksi (AxB) dari kedua zat pengatur tumbuh memberikan pengaruh yang tidak berbeda nyata. Rata-rata waktu tumbuh kalus pada perlakuan kombinasi 2,4-D dan BAP dapat dilihat
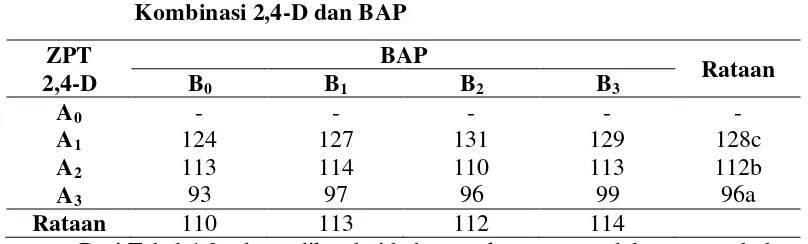
Dari Tabel 4.2., dapat diketahui bahwa waktu tercepat dalam pertumbuhan kalus pada perlakuan A3B0 dengan perlakuan 2,4-D 475 µM tanpa BAP. Hal ini sesuai dengan penelitian yang dilakukan oleh Teixeira et al. (1994), pertumbuhan kalus membutuhkan waktu dua sampai tiga bulan pada media MS dengan penambahan 2,4-D 475 µM. Verdeil et al. (1994) menambahkan, pada tanaman kelapa sawit membutuhkan waktu tiga sampai empat bulan. Dan penelitian Fki et al. (2011), pada tanaman kurma membutuhkan waktu empat sampai delapan bulan untuk induksi kalus. Hal ini menjadi karakteristik umum Arecaceae yang dibudidayakan secara in vitro, termasuk tanaman kelapa sawit. Menurut Sujatha & Prabakaran (2001), ZPT dari kelompok auksin seperti 2,4-D sangat dibutuhkan untuk induksi kalus. Selain itu, auksin juga dapat menyebabkan sel yang telah terdiferensiasi mampu mengalami dediferensiasi.
19
Menurut Masmoudi et al. (2011), penambahan sitokinin eksogen seperti BAP tidak diperlukan untuk induksi kalus pada tanaman monokotil.
Menurut Poonsapaya et al. (1989), penambahan auksin ke dalam media kultur dapat meningkatkan konsentrasi ZPT endogen di dalam sel menjadi faktor pemicu dalam proses pertumbuhan dan perkembangan jaringan. Teixeira et al. (1994) menambahkan, media MS dengan penambahan arang aktif dan ZPT 2,4-D memberikan hasil terbaik untuk induksi kalus kelapa sawit.
Pada kultur tanpa penambahan 2,4-D tidak adanya pertumbuhan kalus dan warna eksplan menjadi coklat (browning). Hal ini mungkin terjadi karena eksplan hanya dipacu oleh hormon endogen sehingga tidak mampu untuk menginduksi pembentukan kalus dan menyebabkan eksplan mati. Hal ini sesuai dengan penelitian yang dilakukan oleh Teixeira et al. (1994), subkultur eksplan ke dalam media tanpa 2,4-D menyebabkan pertumbuhan menjadi lambat dan adanya peningkatan akumulasi fenolik menyebabkan eksplan browning dan mati. Eksplan
browning sering membuat tidak terjadinya pertumbuhan dan perkembangan eksplan (Santoso & Nursandi, 2001).
Gambar 4.2. Eksplan mati dalam kultur in vitro: a. eksplan browning; b. media
4.3. Persentase Kultur yang Membentuk Kalus Embriogenik
Kalus embriogenik adalah kalus yang memiliki potensi untuk menghasilkan embrio somatik baik secara langsung (embrio somatik primer) maupun secara tidak langsung (embrio somatik sekunder). Kalus embriogenik memiliki ciri selnya berukuran kecil, berwarna kuning mengkilat, dan sitoplasma padat (Lestari, 2007).
a
20
Gambar 4.3. Kalus embriogenik dengan perbesaran 40 kali
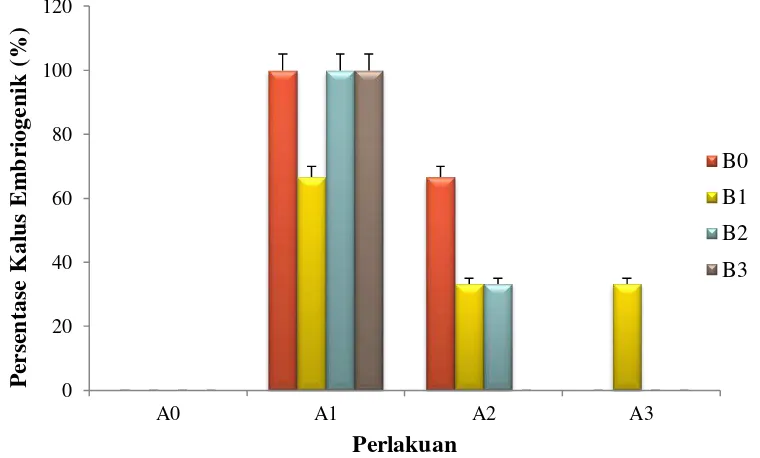
Pengamatan kultur yang membentuk kalus embriogenik dapat dilihat pada Lampiran 3 halaman 32. Hubungan persentase kultur membentuk kalus embriogenik dengan kombinasi ZPT dapat dilihat pada Gambar 4.4.
Gambar 4.4. Hubungan persentase kultur membentuk kalus embriogenik dengan kombinasi ZPT
Dari Gambar 4.4. dapat dilihat persentase kultur yang membentuk kalus embriogenik terdapat pada perlakuan A1B0, A1B2, dan A1B3 sebesar 100 %, sedangkan pada perlakuan A0B0, A0B1, A0B2, A0B3, A2B3, A3B0, A3B2, dan A3B3 tidak terlihat adanya kalus embriogenik. Menurut Wattimena et al. (1988), pada umumnya untuk menginduksi kalus embriogenik diperlukan auksin dan sitokinin. Perbandingan kedua ZPT auksin dan sitokinin yaitu konsentrasi auksin dalam media harus lebih tinggi dibandingkan konsentrasi sitokinin (Suryowinoto, 1991).
21
Menurut Indrianto (2002), insiasi kalus embriogenik terjadi sebagai respon dari stres akibat pangaruh konsentrasi auksin. Auksin 2,4-D memiliki kontribusi untuk meningkatkan kalus embriogenik kelapa sawit (Abdullah et al., 2005). Berbagai hasil penelitian menunjukkan bahwa konsentrasi 2,4-D yang tepat, efektif untuk induksi kalus embriogenik. Zat pengatur tumbuh tersebut merupakan auksin sintetis yang cukup kuat dan tahan terhadap degradasi karena reaksi enzimatik dan fotooksidasi (Purnamaningsih, 2002).
Oleh karena itu, untuk menstimulasi pertumbuhan lebih lanjut dari embrio somatik perlu mentransfer kultur embriogenik pada medium yang rendah atau tanpa auksin. Salah satu mekanisme dimana auksin dapat mengatur embriogenesis adalah melalui pengasaman sitoplasma dan dinding sel (Zimmerman, 1993).
4.4. Warna Kalus
Pengamatan warna kalus dilakukan di akhir penelitian. Warna kalus yang tumbuh bervariasi, yaitu kuning, kuning coklat, coklat. Warna kalus yang paling banyak tumbuh adalah kuning dengan persentase sebesar 55,56%, sedangkan warna kuning coklat 30,56% dan warna coklat 13,88% (Lampiran 5 halaman 34).
(a) (b) (c)
Gambar 4.5. Warna kalus kelapa sawit (Elaeis guineensis Jacq.) pada perlakuan kombinasi 2,4-D dan BAP: (a) kuning; (b) kuning coklat; (c) coklat
22
pertumbuhan dan perkembangan embrio somatik, tetapi jika konsentrasi etilen terlalu tinggi dapat menghambat pertumbuhan dan perkembangan embrio yang akhirnya dapat menyebabkan browning pada kultur kalus embriogenik.
Kalus berwarna coklat mengalami peningkatan pada konsentrasi 2,4-D 475 µM. Konsentrasi 2,4-D yang ditambahkan ke dalam media tergolong tinggi untuk masa kultur yang panjang. Auksin 2,4-D memicu eksplan menghasilkan senyawa fenol sebagai mekanisme pertahanan diri. Menurut Kardhinata (1999), kalus yang berwarna cokelat menyebabkan pertumbuhan dan perkembangan kalus terhambat. Apabila kalus telah berubah menjadi coklat maka kalus tidak dapat melakukan aktivitas sehingga menyebabkan kematian. Hal ini kemungkinan disebabkan oleh terhambatnya difusi nutrien, penguapan air yang mengakibatkan penimbunan metabolit yang bersifat racun bagi kalus dan nutrisi telah habis. Wattimena (1988) menambahkan, sitokinin berperan dalam memperlambat proses senesen sel dengan menghambat perombakan butir-butir klorofil dalam protein dalam sel.
4.5. Berat Basah Kalus
Pengamatan berat basah kalus dilakukan di akhir penelitian. Data pengamatan berat basah kalus bunga betina kelapa sawit dan tabel daftar sidik ragam dapat dilihat pada Lampiran 6 halaman 35. Berdasarkan tabel sidik ragam tersebut, dapat dilihat bahwa perlakuan ZPT 2,4-D (A) memberikan pengaruh berbeda sangat nyata sedangkan perlakuan BAP (B) maupun interaksi (AxB) memberikan pengaruh yang tidak berbeda nyata. Pengaruh rata-rata berat basah kalus pada perlakuan kombinasi 2,4-D dan BAP dapat dilihat pada Tabel 4.3.
Tabel 4.3. Rata-rata Berat Basah Kalus (g) pada Perlakuan Kombinasi 2,4-D dan BAP
23
Interaksi substansi pertumbuhan dan ZPT tersebut akan meningkatkan jumlah dan ukuran sel dalam jaringan tumbuhan tersebut. Auksin dan sitokinin yang diberikan pada perbandingan yang tepat dapat menginisiasi pembelahan sel dan meningkatkan pertumbuhan sel. Hal ini terjadi pada perlakuan A2B1 memiliki berat basah tertinggi dengan nilai 0,455 g, sedangkan berat basah terendah pada perlakuan A3B0 dengan nilai 0,260 g. Hal ini menunjukkan bahwa pada kombinasi A2B1 merupakan kombinasi yang tepat dalam menginisiasi pembelahan sel dan meningkatkan pertumbuhan eksplan bunga betina kelapa sawit.
Pada perlakuan A1B0, A1B1, A1B2, A2B0, A2B1, dan A2B2 terdapat peningkatan berat basah kalus. Berat basah kalus yang besar ini disebabkan karena kandungan air yang tinggi. Berat basah yang dihasilkan sangat tergantung pada kecepatan sel-sel tersebut membelah diri, memperbanyak diri dan dilanjutkan dengan pembesaran kalus.
Menurut Gati & Mariska (1992), bahwa aktivitas auksin dan sitonikin dalam pembelahan sel dirangsang oleh adanya auksin. Perbedaan berat basah antar kalus disebabkan oleh perbedaan kemampuan tiap jaringan dalam menyimpan air dan unsur hara meliputi difusi, osmosis, dan pengaturan tekanan turgor sel (Sriyanti, 2000).
Perlakuan A3B0 memiliki berat basah yang rendah. Hal ini dikarenakan terlalu tingginya konsentrasi 2,4-D menyebabkan kalus berubah warna menjadi coklat dan mengalami kematian. Kematian kalus dengan kondisi mencoklat atau
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Adapun kesimpulan yang diperoleh dari penelitian ini adalah:
1. Pemberian zat pengatur tumbuh 2,4-D 475 µM tanpa BAP dapat memacu induksi kalus bunga betina kelapa sawit (Elaeis guineensis Jacq.).
2. Pemberian zat pengatur tumbuh 2,4-D 400 µM dan BAP 25 µM efektif untuk memacu pertumbuhan kalus bunga betina kelapa sawit (Elaies guineensis
Jacq.) ditandai dengan kenaikan berat basahnya yaitu 0,455 g.
5.2. Saran
DAFTAR PUSTAKA.
Abdullah R., A. Zainal, W. Y. Heng, L. C. Li, Y. C. Beng, L. M. Phing, S. A. Sirajuddin, W. Y. S. Ping, J. L. Joseph, S. A. Jusoh, M. R. Muad, Y. L. Huey. 2005. Immature embryo: a usefull tool for oil palm (Elaeis guineensis Jacq.) genetic transformation studies. Electron J. Biotechnol. 8:24-34.
Aslam, J. and S. A. Khan. 2009. In vitro micropropagation of khalas date palm (Phoenix dactylifera L.), an important fruit plant. Journal of Fruit and Ornamental Plant Research. 17(1): 15-27.
Asnawati, G. A. Wattimena, M. Machmud, dan A. Purwito. 2002. Studi regenerasi dan produksi protoplas mesofil daun beberapa klon tanaman kentang (Solanum tuberosum L.). Buletin Agronomi. 20(3): 87-91.
Basiron, Y. 2004. Sawit Penyumbang Utama Bekalan Minyak Dunia. Berita Harian (Berita Sawit) September.
Daisy, Wijayani. 1994. Kultur Jaringan Tanaman. Kanisius. Yogyakarta.
Dodds, J. H. and L. W. Roberts. 1985. Experiments in Plant Tissue Culture. Cambrige. Cambridge University Press.
Fauzi, Y., Y. E. Widyastuti, I. Satyawibawa dan R. Hartono. 2002. Kelapa Sawit Budi Daya, Pemanfaatan Hasil dan Limbah, Analisis Usaha dan culture media. In Vitro. 12: 473-478.
Gati, E. dan Mariska, I. 1992. Pengaruh Auksin dan Sitokinin Terhadap Kalus
Mentha piperita Linn. Buletin Litri. 3: 1-4.
George, E. F. and P. D. Sherrington. 1984. Plant Propagation by Tissue Culture. England. Eastern Press.
26
Gray, D.J. 2005. Propagation from nonmeristematic tissue: nonzygotic embryogenesis. 187-200. In : R.N. Trigiano and D.J. Gray (Eds). Plant Development and Biotechnology. CRC Press. United States of America. Guedes, R. S., T. L. Silva, Z. G. Luis and J. E. S. Pereira. 2011. Initial
requirements for embriogenic calluses initiation in thin cell layers explants for immature female oil palm inflorescences. African Journal of Biotechnology. 10(52): 10774-10780.
Gunawan, L. W. 1992. Teknik Kultur Jaringan. Bogor. Laboratorium Kultur Jaringan Tanaman PAU Bioteknologi IPB.
Hartmann, H. T., D. E. Kester and F. T. Davis-Jr. 1990. Plant Propagation: Principle and Practices. New Jersey. Prentice Hall International, Inc. Hendaryono, D.P dan A. Wijayani. 1994. Teknik Kultur Jaringan. Yogyakarta.
Kanisius.
Indrianto, A. 2002. Kultur jaringan tumbuhan. Yogyakarta. UGM Press.
Kardhinata, E. H. 1999. Induksi Kalus Embrio Kedelai pada Media MS dengan Penambahan NAA dan Air Kelapa. [Skripsi]. Medan: Universitas Sumatera Utara.
Keese, J. R., Rupert, E. A. and Carter, G. E. 1991. Physiologia Plantarum. An International Journal For Plant Biology. 81(4): 513-520.
Kumar, H. N., S. D. Preethi and J. B. Chauhan. 2012. Studies on the in vitro propagation of Calamus travancoricus. Asian Journal of Plant Science and Research. 2(2): 173-179.
Lestari EG. 2007. Kultur Jaringan: Menjawab Persoalan Pemenuhan Kebutuhan akan Peningkatan Kualitas Bibit Unggul dan Perbanyakannya secara Besar-Besaran. Bogor. Ganang Dwi Kartika.
Lubis, A.U. 1992. Kelapa Sawit (Elaeis guineensis Jacq) di Indonesia. Pematang Siantar. Pusat Penelitian Perkebunan Marihat Bandar Kuala Pematang Siantar-Sumatera Utara.
Noggle, G. R. and G. J. Fritz. 1983. Introductory Plant Physiology. New Jersey. Prentice Hall, Inc.
27
Pandey, B. P. 1981. A Textbook of Botany Angiosperms Taxonomy, Anatomy, Embryology (Including Tissue Culture) and Economic Botany. New Delhi. S. Chand and Company LTD.
Pandiangan, D. dan A. Subarnas. 2011. Produksi Katarantin melalui Kultur Jaringan. Bandung. Lubuk Agung.
Pierik, R. L. M. 1997. Plant Tissue Culture as Motivation for The Symposium.
Papers Landbouwhogeschool Wageningen. 9: 3-13.
Poonsapaya, P. M. W., Nabors, W. Kersi and M. Vajrabhaya. l989. A comparison of methods for callus culture and plant regeneration of RD-25 rice (Oryza sativa L.) in vitro laboratoris. Plant Cell Tiss. Org. Cult. 16(3): 175-186. Purnamaningsih, R. 2002. Regenerasi Tanaman melalui Embriogenesis Somatik
dan Beberapa Gen yang Mengendalikannya. Buletin AgroBio. 5(2): 51-58. Salisbury, F. B. dan C. W. Ross. 1995. Fisiologi Tumbuhan. Jilid ke-3. Edisi ke-4.
Bandung. Institut Teknologi Bandung.
Santoso, U. dan F. Nursandi. 2001. Kultur Jaringan Tanaman. Malang. UMM Press.
Sastrosupadi, A. 2004. Rancangan Percobaan Praktis Bidang Pertanian. Edisi Revisi. Yogyakarta. Kanisius.
Soehardjo, H., H. Halil, R. Ishak, A. Purba, E. Lubis, S. Budiana dan Kusmahadi. 1998. Vademecum Kelapa Sawit. Pematang Siantar. PT. Perkebunan Nusantara IV (Persero).
Smith, R. H. 1992. Plant Tissue Culture: Techniques and Experiments. New York. Academic Press Inc.
Sriyanti D P. 2000. Pelestarian tanaman nilam (Pogostemon heyneanus Benth.) melalui kultur mikrostek. Biosmart. Vol. 2(2): 21-25
Sujatha, M. and A.J. Prabakaran. 2001. High frequency embryogenesis in immature zygotic embryos of sunflower. Plant Cell Tissue and Organ Cult. 65: 23-29.
Sunarko. 2012. Membangun Kebun Mini Kelapa Sawit di Lahan 2 Hektare. Jakarta. AgroMedia Pustaka.
Suryowinoto, M. 1991. Budidaya Jaringan Terobosan Bermanfaat dalam Bioteknologi. Yogyakarta. UGM Press.
28
Taji, A., P. Kumar and P. Lakshmanan. 2002. In Vitro Plant Breeding. New York. Haworth Press Inc.
Teixeira, J. B., M. R. Sondahl and E. G. Kirby. 1994. Somatic embryogenesis from immature inflorescences of oil palm. Plant Cell Reports. 13: 247-250.
Torres, K. C. 1989. Tissue Culture Techniques for Horticultural Crops. New York. Van Nostrand Reinhold.
Verdeil, J. C., C. Huet, F. Grosdemange, and J. Buffard-Morel. 1994. Plant regeneration from cultured immature inflorescences of coconut (Cocos nucifera L.): evidence for somatic embryogenesis. Plant Cell Reports. 13:218-221.
Wattimena, G.A. 1988. Zat Pengatur Tumbuh Tanaman. Bogor. IPB.
Wetherell, D.F. 1982. Pengantar Propagasi Tanaman secara In Vitro. diterjemahkan oleh Koensoemardiyah. Wayne New Jersey. Avery Publishing Group Inc.
Winata, L. 1987. Teknik Kultur Jaringan. Bogor. Pusat Antar Universitas Institut Pertanian Bogor.
Yusnita. 2003. Kultur Jaringan Cara Memperbanyak Tanaman Secara Efisien. Jakarta. PT. Agromedia Pustaka.
Zulkarnain. 2009. Kultur Jaringan Tanaman. Jakarta. Bumi Aksara.
LAMPIRAN
Lampiran 1. Persentase Data Pengamatan Kultur yang Membentuk Kalus
30
Lampiran 2. Data Pengamatan Waktu Tumbuh Kalus (Hari Setelah Tanam)
Perlakuan Ulangan Rataan
I II III
A0B0 - - - -
A0B1 - - - -
A0B2 - - - -
A0B3 - - - -
A1B0 124 131 116 123,7
A1B1 128 129 124 127,0
A1B2 134 128 132 131,3
A1B3 123 137 128 129,3
A2B0 109 117 112 112,7
A2B1 117 109 115 113,7
A2B2 113 114 103 110,0
A2B3 107 112 121 113,3
A3B0 94 97 88 93,0
A3B1 101 95 94 96,7
A3B2 98 93 97 96,0
A3B3 98 96 102 98,7
Daftar Sidik Ragam Waktu Tumbuh Kalus
SK DB JK KT Fhit F Tabel
f5% f1% Perlakuan 11 6222,222 565,657 22,958** 2,216 3,094 Auksin (A) 2 6050,056 3025,028 122,775** 3,402 5,613 Sitokinin (B) 3 76,000 25,333 1,028tn 3,008 4,718
AxB 6 96,167 16,028 0,651tn 2,508 3,666
Galat 24 591,333 24,639 - - -
Total 46 13035,778 - - - -
31
Tes Post Hoc Auksin 2,4-D Duncana,b
2,4-D N Subset
1 2 3
A3 12 96,0833
A2 12 112,4167
A1 12 127,8333
Sig. 1,000 1,000 1,000
Sitokinin BAP Duncana,b
BAP N Subset
1
B0 9 109,7778
B2 9 112,4444
B1 9 112,4444
B3 9 113,7778
32
Lampiran 3. Persentase Kultur yang Membentuk Kalus Embriogenik
33
Lampiran 4. Data Pengamatan Warna Kalus
Perlakuan Ulangan
I II III
A0B0 - - -
A0B1 - - -
A0B2 - - -
A0B3 - - -
A1B0 Kuning Kuning Kuning
A1B1 Kuning Kuning Kuning
A1B2 Kuning Kuning Kuning
A1B3 Kuning Kuning Kuning
A2B0 Kuning Kuning Kuning
A2B1 Kuning Coklat Kuning Kuning
A2B2 Kuning Coklat Kuning Coklat Kuning A2B3 Kuning Coklat Kuning Coklat Kuning Coklat
A3B0 Coklat Kuning Kuning Coklat
A3B1 Kuning Coklat Kuning Coklat
A3B2 Coklat Kuning Coklat Coklat
34
Lampiran 5. Persentase Warna Kalus
Perlakuan Warna Kalus Total
Kuning Kuning Coklat Coklat
35
Lampiran 6. Data Pengamatan Berat Basah Kalus (g)
Perlakuan Ulangan Rataan
I II III
A0B0 - - - -
A0B1 - - - -
A0B2 - - - -
A0B3 - - - -
A1B0 0,302 0,220 0,376 0,299
A1B1 0,322 0,371 0,423 0,372
A1B2 0,307 0,545 0,327 0,393
A1B3 0,407 0,352 0,393 0,384
A2B0 0,484 0,376 0,395 0,418
A2B1 0,499 0,403 0,462 0,455
A2B2 0,441 0,350 0,509 0,433
A2B3 0,464 0,354 0,384 0,401
A3B0 0,196 0,304 0,279 0,260
A3B1 0,335 0,246 0,225 0,269
A3B2 0,224 0,377 0,249 0,283
A3B3 0,251 0,232 0,309 0,264
Daftar Sidik Ragam Berat Basah Kalus
SK DB JK KT Fhit F Tabel
f5% f1%
Perlakuan 11 0,173 0,016 3,308** 2,216 3,094
Auksin (A) 2 0,151 0,076 15,876** 3,402 5,613 Sitokinin (B) 3 0,011 0,004 0,747tn 3,008 4,718
AxB 6 0,011 0,002 0,400tn 2,508 3,666
Galat 24 0,114 0,005 - - -
Total 46 0,46 - - - -
36
Tes Post Hoc Auksin 2,4-D Duncana,b
2,4-D N Subset
1 2 3
A3 12 0,268917
A1 12 0,362083
A2 12 0,426750
Sig. 1,000 1,000 1,000
Sitokinin BAP Duncana,b
BAP N Subset
1
B0 9 0,325778
B3 9 0,349556
B1 9 0,365111
B2 9 0,369889
37
Lampiran 7. Komposisi Media Murashige-Skoog (MS)
38
Lampiran 8. Alur Kerja
Pembuatan Media MS
dimasukkan hara makro, mikro, iron, vitamin, ke dalam erlenmeyer dan ditambah akuades hingga 2000 ml.
dibagi ke 16 perlakuan.
ditambahkan ZPT sesuai perlakuan. ditambahkan arang aktif 0,375 g.
diukur derajat keasaman (pH) larutan setiap perlakuan dengan menggunakan pH meter sebesar 5,8.
ditambahkan masing-masing media dengan 0,875 g agar sambil dimasak.
dimasukkan media ke dalam botol-botol kultur dengan volume lebih kurang 10 ml.
ditutup aluminium foil kemudian diikat dengan karet.
disterilkan botol berisi tersebut dengan autoklaf pada tekanan 15 psi, suhu 1210C selama 10 menit.
disimpan dalam rak kultur dalam ruangan AC. Unsur Hara
39
Pengkulturan Bunga Betina pada Media MS
dibersihkan dengan air mengalir hingga bersih. direndam dalam larutan fungisida 2 g/L. dibilas dengan akuades steril.
direndam dengan larutan antibiotik. dibilas dengan akuades steril.
direndam dengan larutan pemutih 10 % selama 10 menit. dibilas 3 kali dengan akuades steril
direndam dengan HgCl2 1 g/L selama 15 menit. dibilas 3 kali dengan akuades steril
dikeringkan di atas kertas saring steril dalam cawan petri.
dilukai salah satu sisi bunga betina satu per satu. ditanam dalam media MS sesuai perlakuan
ditutup dengan aluminium foil botol yang berisi eksplan. disusun pada rak kultur
diamati dan dipelihara hingga terbentuk kalus
Bunga Betina
Bunga Betina Steril