OPTIMISASI PRODUKSI XILANASE DARI BAKTERI LAUT
NADIA ULFA JABBAR ROBBANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi Optimisasi Produksi Xilanase dari Bakteri Laut adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Nadia Ulfa Jabbar Robbani
ABSTRAK
NADIA ULFA JABBAR ROBBANI. Optimisasi Produksi Xilanase dari Bakteri Laut. Dibimbing oleh IRMA HERAWATI SUPARTO dan NANIK RAHMANI.
Xilanase dapat digunakan dalam aplikasi teknologi enzim pada industri seperti makanan, pakan, farmasi, pulp dan kertas, maupun dalam pembuatan bioetanol. Enzim ini dapat dihasilkan dari tanaman, hewan, maupun mikrob. Xilanase dari bakteri laut masih sedikit diteliti, oleh karena itu perlu dilakukan penelitian terkait dengan xilanase yang berasal dari bakteri laut. Ampas tebu merupakan salah satu limbah pertanian yang dapat dimanfaatkan untuk produksi xilanase. Tujuan penelitian ini untuk menentukan kondisi optimum produksi xilanase dari isolat bakteri laut P20 dari pesisir Pulau Pari. Berdasarkan hasil penelitian, isolat bakteri laut P20 dapat menghasilkan xilanase ekstraseluler pada kondisi optimum dengan konsentrasi substrat ampas tebu 1.5%, pH media 7, suhu fermentasi 20 °C, tambahan sumber karbon laktosa, dan sumber nitrogen urea. Setelah dioptimisasi, diperoleh nilai aktivitas enzim tertinggi sebesar 4.06 U/mL pada jam ke-96.
Kata kunci: aktivitas enzim, ampas tebu, bakteri laut, optimisasi, xilanase
ABSTRACT
NADIA ULFA JABBAR ROBBANI. Optimization of Xylanase Production from Marine Bacteria. Supervised by IRMA HERAWATI SUPARTO and NANIK RAHMANI.
Xylanase are applied in manufacturing food, feed, pharmaceutical, pulp and paper, and bioethanol. Xylanase can be produced by some plants, animals, or microbes. Exploration to produce xylanase from marine bacteria is still limited. Therefore, the objective of this study was to determine the optimum growth condition that produces optimum extracellular xylanase activities of marine bacterial isolate P20 from the coast of Pari Island. As substrate, sugarcane bagasse, an inexpensive agro-industrial waste rich in lignocellulosic materials showed the maximum production of xylanase. The result showed that marine bacteria isolate P20 gave extracellular xylanase in optimum conditions with substrate bagasse concentration of 1.5%, medium pH 7, fermentation temperature 20 °C, and addition of carbon sources of lactose, and nitrogen sources of urea. Folowing the optimization, the maximum enzyme activities was 4.06 U/mL at 96 hours.
OPTIMISASI PRODUKSI XILANASE DARI BAKTERI LAUT
NADIA ULFA JABBAR ROBBANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Penelitian : Optimisasi Produksi Xilanase dari Bakteri Laut Nama : Nadia Ulfa Jabbar Robbani
NIM : G44100009
Disetujui oleh
Dr dr Irma Herawati Suparto, MS Nanik Rahmani, MSi
Pembimbing I Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Bismillahirrahmaannirrahim
Puji syukur kehadirat Allah SWT penguasa segenap alam dan isinya. Sujud syukur kepada-Nya yang telah memberikan rahmat dan ridho-Nya sehingga
penulis dapat menyelesaikan laporan hasil penelitian dengan judul “Optimisasi
Produksi Xilanase dari Bakteri Laut”. Penelitian dilaksanakan pada bulan Februari hingga Mei di Laboratorium Biokatalis dan Fermentasi, Bidang Bioproses, Pusat Penelitian Bioteknologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong.
Perkenankanlah penulis untuk mengucapkan terima kasih yang sebesar-besarnya kepada Ibu Dr dr Irma Herawati Suparto, MS dan Ibu Nanik Rahmani, MSi yang telah meluangkan waktu, tenaga, dan pikiran untuk memberikan pengarahan dan bimbingan selama penelitian dan penyusunan laporan ini. Ucapan terima kasih yang tak terhingga penulis sampaikan kepada Bapak Iskandar AB dan Ibu Emilda selaku kedua orang tua atas segala kasih sayang dan doa yang tak henti untuk selalu memberikan motivasi baik moral maupun materiil sehingga penulis dapat menyelesaikan laporan penelitian ini. Dalam kesempatan ini juga penulis ingin mengucapkan terima kasih kepada Bapak Yopi dan Awan Purnawan, Apridah Camelia, Alifah, dan Dicky Gustiawanto atas bantuan dan bimbingannya di laboratorium. Ucapan terima kasih penulis sampaikan juga kepada Fariz Adrian Riwanto dan teman-teman selaboratorium khususnya Fatia Izzaty, Mona Yuniarsa, Diajeng Pangestu, Nikmatia Herfena, Yuli Caprianti, Irfan Pebi, dan Rony Masari yang telah mendukung selama penelitian berlangsung. Akhir kata, penulis mengucapkan banyak syukur dan terima kasih. Penulis menyadari masih banyak kekurangan dalam laporan ini, oleh karena itu segala bentuk kritik dan saran yang membangun sangat diharapkan sehingga laporan ini dapat bermanfaat bagi siapapun yang membacanya terutama penulis sendiri.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN xiv
PENDAHULUAN 1
Latar Belakang 1
METODOLOGI 2
Alat dan Bahan 2
Metode Penelitian 3
HASIL DAN PEMBAHASAN 5
Pemilihan Isolat Bakteri Laut 5
Produksi Xilanase Ekstrak Kasar dari Isolat Bakteri P20 7
SIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 17
DAFTAR GAMBAR
1 Kurva pertumbuhan sel bakteri P20 optimisasi konsentrasi substrat 8 2 Reaksi asam dinitrosalisilat (DNS) dengan gula D-xilosa 9 3 Kurva aktivitas xilanase hasil optimisasi konsentrasi substrat 9 4 Kurva pertumbuhan sel bakteri P20 optimisasi pH media 10 5 Kurva aktivitas xilanase hasil optimisasi pH media 11 6 Kurva pertumbuhan sel bakteri P20 optimisasi suhu fermentasi 12 7 Kurva aktivitas xilanase hasil optimisasi suhu fermentasi 13 8 Kurva pertumbuhan sel bakteri P20 pengaruh tambahan sumber karbon 14 9 Kurva aktivitas xilanase pengaruh penambahan sumber karbon 15 10 Kurva pertumbuhan sel bakteri P20 pengaruh tambahan sumber nitrogen 16 11 Kurva aktivitas xilanase pengaruh penambahan sumber nitrogen 16
DAFTAR LAMPIRAN
1 Bagan alir penelitian 20
2 Data optimisasi konsentrasi substrat 21
3 Data optimisasi pH media 22
4 Data optimisasi suhu fermentasi 23
PENDAHULUAN
Latar Belakang
Pengembangan bioenergi seperti bioetanol dari biomassa sebagai sumber bahan baku yang dapat diperbarui merupakan satu alternatif yang memiliki nilai positif dari aspek sosial dan lingkungan (Lynd et al. 1991). Etanol yang mempunyai rumus kimia C2H5OH adalah zat organik dalam kelompok alkohol dan banyak digunakan untuk berbagai keperluan. Pada umumnya etanol diproduksi dengan cara fermentasi dengan bantuan mikroorganisme oleh karenanya sering disebut sebagai bioetanol. Teknologi proses produksi etanol dalam proses hidrolisis biasanya dilakukan dengan metode konvensional, yaitu dengan menggunakan asam sulfat (H2SO4) atau asam klorida (HCl). Namun metode ini kurang ramah lingkungan karena penggunaan asam dalam proses tersebut, biaya bahan kimia yang relatif mahal, dan asam juga dapat menimbulkan korosi. Oleh karena itu, pengembangan teknologi bioproses dengan menggunakan enzim pada proses hidrolisisnya diyakini sebagai suatu proses yang lebih ramah lingkungan (Pandey et al. 2000).
Enzim telah banyak dikembangkan menjadi komoditas yang diproduksi dan diperdagangkan. Enzim dapat dimanfaatkan dalam pengolahan pada berbagai bidang industri, diagnosis, analisis, biologi molekuler, transformasi senyawa kimia, sebagai bahan aditif dalam detergen, dan digunakan sebagai obat (Kumala dan Fitri 2008). Perkembangan industri enzim pada saat ini semakin pesat dan menempati posisi penting di bidang industri. Hal ini disebabkan enzim memiliki sifat yang efisien, selektif, mengkatalis reaksi tanpa produk samping, dan ramah lingkungan (Fuad et al. 2004). Kebutuhan domestik atas enzim cukup besar namun ketersediannya masih tergantung impor, karena itu perlu dicari terobosan dengan memanfaatkan bahan alam dan organisme hidup seperti tanaman, hewan, dan mikroba untuk memproduksi enzim. Salah satu enzim yang dapat diproduksi adalah xilanase.
Xilanase adalah enzim ekstraseluler yang dapat menghidrolisis xilan menjadi xilosa dan xilooligosakarida (Ruiz-Arribas et al. 1995). Xilanase merupakan salah satu enzim yang berperan penting dalam proses pembuatan bioetanol dan juga dalam biokonversi hemiselulosa menjadi gula konstituennya. Dalam dekade terakhir, produksi xilanase telah menarik perhatian banyak peneliti karena enzim ini sangat penting untuk proses degradasi bahan berlignoselulosa dalam tanaman biomassa (Aksoz dan Seyis 2005). Xilanase merupakan produk bioteknologi yang memiliki kegunaan cukup beragam, tetapi produksinya masih menghadapi kendala, yaitu masih kurangnya ketersediaan mikroba unggul dan rendahnya pengetahuan tentang teknologi produksi enzim (Richana et al. 2000).
2
Bacillus, dan Clostridium (Tork et al. 2013). Bakteri yang dapat digunakan sebagai penghasil xilanase salah satunya adalah bakteri yang berasal dari laut. Lingkungan laut sendiri memiliki beberapa karakter diantaranya tekanan dan salinitasnya tinggi, suhu rendah, serta kedap cahaya. Oleh karena itu, diharapkan bakteri laut lebih dapat beradaptasi dan bertahan meski dilingkungan yang ekstrim (Prasad dan Sethi 2013). Berbeda dengan bakteri yang berasal dari darat lebih mudah mengalami gangguan seperti perubahan iklim dan suhu, oleh karena itu pada penelitian ini digunakan bakteri laut sebagai mikroba penghasil xilanase.
Xilanase mampu menghidrolisis xilan menjadi gula xilosa. Untuk menghasilkan xilanase, maka substrat yang digunakan harus mengandung xilan. Penggunaan xilan murni dalam produksi enzim tidak ekonomis karena harganya yang mahal. Upaya untuk menekan biaya produksi enzim diperlukan dengan pemilihan substrat pengganti yang lebih murah dengan memanfaatkan limbah biomassa. Xilan banyak terdapat pada biomassa limbah pertanian dan industri makanan (Beg et al. 2001). Beberapa limbah pertanian dan perkebunan yang dapat dimanfaatkan sebagai substrat penghasil xilanase di antaranya, yaitu sekam padi, jerami padi, ampas tebu, batang dan tongkol jagung, bungkil kelapa sawit, tandan kosong kelapa sawit dan lain sebagainya. Untuk mengoptimalkan produksi enzim perlu adanya pengoptimalan faktor-faktor yang berperan dalam produksi enzim tersebut antara lain jumlah substrat, suhu fermentasi, pH media fermentasi, serta melihat pengaruh tambahan sumber karbon dan sumber nitrogen (Trismilah
et al. 2003)
Penelitian ini bertujuan mengetahui isolat bakteri terbaik penghasil xilanase dan kondisi optimum dalam memproduksi xilanase sehingga didapatkan enzim dengan kualitas dan kuantitas yang baik. Informasi yang diperoleh dari hasil penelitian ini bermanfaat untuk mengetahui biomassa pengganti substrat xilan yang memanfaatkan limbah-limbah pertanian dan perkebunan. Selain itu, dapat menghasilkan enzim yang berguna dalam pembuatan bioetanol.
METODOLOGI
Alat dan Bahan
Alat-alat yang digunakan adalah peralatan gelas, cawan petri steril, ose steril, sumbat kapas, pipet mikro, tips steril, tabung mikro eppendorf, ultrasentrifugasi (Hitachi CS 150NX), autoklaf, inkubator kocok, laminar, spektrofotometer UV-vis (Hitachi U-3900H), oven, stopwatch, penangas air, dan kuvet.
Metode Penelitian
Peremajaan Isolat Bakteri Laut
Dua isolat bakteri laut Xilan-4 dan P20 ditumbuhkan pada media padat dengan komposisi media mineral yang digunakan ASW 3.8%, ekstrak kamir 0.1%, pepton 0.5%, agar 1.5%, dan substrat 0.5% dalam 200 mL akuades. Komposisi media diaduk menggunakan pengaduk magnet sampai homogen, selanjutnya disterilisasi pada suhu 121 °C. Media yang telah siap dituangkan ke dalam cawan petri di dalam laminar. Peremajaan isolat bakteri dilakukan dengan menggoreskan isolat bakteri menggunakan jarum ose steril pada media padat yang telah disiapkan. Sebelum melakukan penanaman, laminar tempat kerja dan media padat disinari ultraviolet terlebih dahulu selama 15 menit untuk membunuh mikroorganisme yang tidak diinginkan sehingga dapat menurunkan risiko kontaminasi sebelum penanaman. Media yang telah ditanami isolat diinkubasi pada suhu 27 °C selama kurang lebih dua hari. Selanjutnya akan dilakukan pemilihan isolat terbaik penghasil xilanase dari kedua isolat yang telah diremajakan.
Pemilihan Isolat Terbaik Penghasil Xilanase
4
Produksi Enzim
Optimisasi produksi xilanase dari isolat bakteri laut dan substrat biomassa terpilih
Proses produksi dilakukan melalui dua tahap, yaitu prekultur dan kultur dengan isolat bakteri terpilih. Prekultur dilakukan dengan memindahkan 1 ose koloni tunggal bakteri dari media padat ke dalam erlenmeyer 100 mL yang telah diisi 10 mL media cair. Prekultur diinkubasi dalam inkubator kocok berkecepatan 150 rpm, suhu 30 °C selama satu malam. Selanjutnya dilakukan proses kultur dengan cara memindahkan sejumlah prekultur ke dalam media kultur (30 mL media dalam erlenmeyer 300 mL) dengan pipet mikro. Media kultur kemudian diinkubasi dalam inkubator kocok berkecepatan 150 rpm, 30 °C selama 6 hari untuk dilakukan proses sampling atau pemanenan pada jam ke-0, 24, 48, 72, 96, 120 dan 144. Optimisasi produksi enzim xilanase dilakukan dengan mengukur aktvitas enzim berdasarkan lima parameter penting, yaitu konsentrasi substrat terpilih (0.5%, 1.0%, 1.5%, 2.0%), pH media produksi (5, 6, 7, 8), suhu fermentasi (20 °C, 30 °C, 40 °C, dan 50 °C) (Ninawe et al. 2008), pengaruh penambahan sumber karbon (maltosa, laktosa, glukosa, sukrosa, dan xilosa) (Haq-ul et al. 2002), dan pengaruh penambahan sumber nitrogen (amonium klorida, amonium nitrat, amonium sulfat, kasein, dan urea) (Kumar et al. 2010). Tahap optimisasi dilakukan berurutan sesuai urutan parameter, artinya optimisasi pH dilakukan setelah konsentrasi optimumnya diketahui, begitupun dengan parameter lainnya.
Pembuatan kurva pertumbuhan sel isolat bakteri
Kurva pertumbuhan sel dibuat dengan cara melakukan pengukuran optical density (OD) sel sampel dengan spektrofotometer pada panjang gelombang 660 nm. Sampel yang diukur OD-nya yaitu sampel pada jam ke-0, 24, 48, 72, 96, 120, dan 144.
Preparasi xilanase ekstrak kasar
Xilanase ekstrak kasar didapatkan dari ekstraksi kultur sel dengan cara sentrifugasi pada kecepatan 116 g, selama 10 menit pada suhu 4 °C, kemudian supernatan dipindahkan pada tabung mikro eppendorf baru dan disentrifugasi lagi pada kecepatan, suhu, dan waktu yang sama. Ekstrak xilanase dipertahankan pada suhu dingin, yaitu 4 °C untuk menjaga aktivitas enzim. Hasil ekstraksi enzim (supernatan) yang diperoleh merupakan xilanase ekstrak kasar yang siap digunakan untuk proses pengujian.
Analisis aktivitas xilanase ekstrak kasar (Miller 1959)
inkubasi selesai, tabung reaksi berisi sampel direndam dalam es batu selama 10 menit. Warna yang terbentuk diukur dengan spektrofotometer dengan panjang gelombang 540 nm. Nilai absorbansi yang diperoleh dikonversi menjadi konsentrasi gula pereduksi (ppm) menggunakan persamaan yang didapat dari kurva standar xilosa. Kurva standar xilosa dibuat dengan cara melarutkan 0.01 g D-xilosa ke dalam 10 mL buffer fosfat 0.05 M (1000 ppm), kemudian diencerkan pada konsentrasi 10 ppm sampai 100 ppm. Sebanyak 0.5 mL dari hasil pengenceran kemudian direaksikan dengan 0.75 mL reagen DNS, dipanaskan 10 menit dalam penangas air 100 °C, kemudian diukur nilai absorbansinya dengan spektrofotometer pada panjang gelombang 540 nm. Nilai aktivitas enzim ditentukan menggunakan rumus yang tertera pada Lampiran 6.
HASIL DAN PEMBAHASAN
Pemilihan Isolat Bakteri Laut
Dua isolat bakteri laut yang digunakan dalam penelitian ini, yaitu isolat bakteri Xilan-4 yang berasal dari Pulau Bali dan P20 yang berasal dari Pulau Pari. Dalam penelitian ini, peremajaan isolat dilakukan untuk mempersiapkan isolat segar dengan tujuan mendapatkan isolat yang aktif, memiliki sistem metabolisme yang segar dan lebih baik karena sebelumnya isolat tersebut berada dalam kondisi inaktif di dalam lemari pendingin. Peremajaan biakan adalah upaya yang dilakukan untuk mempertahankan sifat alami isolat bakteri laut. Selain itu, peremajaan biakan dapat mencegah terjadinya kerusakan isolat seperti penurunan viabilitas dan stabilitas sel suatu isolat yang dapat menurunkan potensi sel isolat tersebut (Hernandez et al. 2009).
Isolat bakteri laut yang telah diremajakan selanjutnya dilakukan pemilihan isolat bakteri terbaik penghasil xilanase menggunakan pewarnaan congo red.
Pewarnaan congo red pada kultur merupakan analisis awal untuk mengetahui aktivitas enzim yang dihasilkan suatu bakteri secara kualitatif dari kedua isolat. Masing-masing isolat bakteri tersebut ditumbuhkan pada substrat yang mengandung xilan diantaranya TBKKS, BKS, ampas tebu, dan xilan komersial. Bakteri yang mampu membentuk daerah zona bening disekitar koloninya setelah pewarnaan mengindikasikan adanya aktivitas xilanase. Diameter zona bening yang dihasilkan menunjukkan besarnya aktivitas enzim. Untuk membandingkan besarnya aktivitas enzim maka dihitung indeks xilanolitiknya dengan membandingkan diameter isolat dan diameter zona bening yang terbentuk (Yopi
6
Tabel 1 Pemilihan isolat bakteri P20 dan Xilan-4 sebagai penghasil xilanase pada berbagai substrat dengan metode congo red
TBKKS:tandan buah kosong kelapa sawit; bBKS: bungkil kelapa sawit
Pemilihan bakteri menggunakan metode ini bersifat semi kuantitatif karena pengukurannya berdasarkan penglihatan secara langsung atau kualitatif. Metode ini menggunakan 2 jenis pewarna, yaitu pewarna basa congo red dan pewarna asam NaCl 2%. Congo red akan berikatan dengan substrat, semakin banyak jumlah substrat dalam bentuk polisakarida maka akan semakin kuat ikatan yang terjadi. Hal ini disebabkan karena substrat dalam bentuk polisakarida strukturnya panjang dan tersusun dengan rapat sehingga pewarna congo red yang masuk ke dalamnya akan terikat semakin kuat dibandingkan dengan substrat yang memiliki ukuran lebih pendek. Larutan NaCl 2% berfungsi untuk mencuci congo red yang menempel pada media, karena NaCl bersifat higroskopis sehingga dapat menyerap pewarna congo red. Semakin kuat ikatan antara congo red dengan substrat maka larutan NaCl semakin sulit untuk mencuci pewarna tersebut. Perbedaan kekuatan ikatan antara congo red dengan substrat dapat dibedakan berdasarkan struktur substratnya, yaitu monosakarida, polisakarida, dan oligosakarida. Berdasarkan perbedaan struktur ini maka setelah pencucian dengan NaCl substrat yang berbentuk monosakarida dan oligosakarida akan berwarna lebih pudar dibandingkan dengan substrat yang masih berbentuk polisakarida. Oleh karena itu dapat terlihat zona bening yang menunjukkan bahwa substrat tersebut mengalami degradasi oleh enzim yang dihasilkan bakteri (Yopi et al. 2006).
Produksi Xilanase Ekstrak Kasar dari Isolat Bakteri P20
Produksi xilanase dilakukan dengan menggunakan isolat bakteri terpilih, yaitu isolat P20. Beberapa optimisasi kondisi produksi enzim dilakukan dengan variasi perlakuan, yaitu konsentrasi substrat 0.5%, 1.0%, 1.5%, dan 2.0%; pH media 5, 6, 7, dan 8; suhu fermentasi 20 °C, 30 °C, 40 °C, dan 50 °C; tambahan sumber karbon berupa maltosa, laktosa, glukosa, sukrosa, dan xilosa; dan sumber nitrogen berupa amonium klorida, amonium nitrat, amonium sulfat, kasein, dan urea. Produksi xilanase dilakukan sampai hari ke-6 menggunakan inkubator kocok pada kecepatan 150 rpm melalui dua tahapan, yaitu prekultur dan kultur untuk mengetahui kurva pertumbuhan sel bakteri dan aktivitas enzim.
Optimisasi konsentrasi substrat untuk produksi xilanase
Optimisasi konsentrasi substrat ini dilakukan menggunakan substrat terpilih. Substrat terbaik yang digunakan untuk produksi xilanase adalah substrat xilan, namun penggunaan substrat xilan sangat mahal sehingga pada penelitian ini digunakan substrat pengganti xilan, yaitu ampas tebu. Ampas tebu memiliki komposisi hemiselulosa dengan komponen utama berupa xilan yang berikatan dengan selulosa, lignin dan polisakarida yang lain untuk menyusun dinding sel tanaman. Dibandingkan dengan bahan lignoselulosa yang lain, ampas tebu memiliki kandungan hemiselulosa yang tertinggi, yaitu 25-40%. Komponen hemiselulosa dapat didegradasi oleh enzim xilanase menjadi produk xilobiosa, xilotriosa, dan xilosa (Moreira et al. 2012).
Tahapan untuk semua optimisasi kondisi dimulai dari tahap prekultur selama 1 hari, kemudian hasil prekultur dipindahkan ke dalam kultur yang berisi media dengan komposisi yang sama seperti pada prekultur tetapi volumenya ditingkatkan. Tujuan prekultur adalah agar bakteri bisa beradaptasi pada media cair sebelum ditumbuhkan pada lingkungan yang baru, sebagai stimulasi atau rangsangan isolat untuk mengeluarkan enzim (Wahyuningsih 2011). Media kultur bakteri berubah dari kuning bening menjadi kuning keruh. Hal tersebut merupakan salah satu ciri adanya pertumbuhan dan sistem metabolisme bakteri. Bakteri memiliki 4 fase kurva pertumbuhan, yaitu fase lag, log, stasioner, dan kematian. Fase lag merupakan fase saat bakteri dipindahkan dalam suatu medium, bakteri tersebut harus beradaptasi dengan lingkungan disekitarnya. Fase log merupakan fase bakteri membelah dengan cepat dan konstan mengikuti kurva logaritmik. Fase ini kecepatan pertumbuhan dipengaruhi oleh medium tempat tumbuhnya. Fase stasioner merupakan fase dimana jumlah sel tetap karena jumlah sel yang tumbuh sama dengan jumlah sel yang mati. Fase kematian, pada fase ini sebagian populasi bakteri mulai mengalami kematian yang disebabkan nutrisi dalam medium dan energi cadangan dalam sel sudah habis (Yuwono 2005).
8
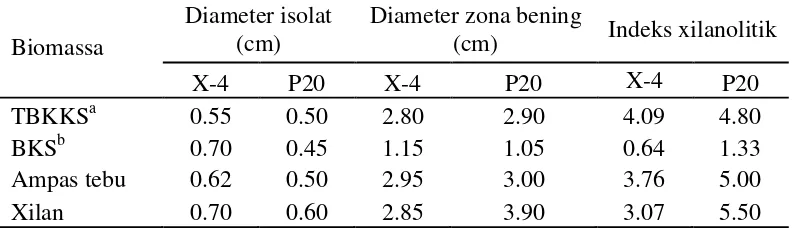
peningkatan terus menerus sampai jam ke-144. Berdasarkan hasil yang didapatkan semakin tinggi konsentrasi maka pertumbuhan sel semakin banyak. Hal ini disebabkan semakin banyak substrat, bakteri dapat tumbuh dengan baik karena kebutuhan akan nutrisinya terpenuhi.
Gambar 1 Kurva pertumbuhan sel bakteri P20 optimisasi konsentrasi substrat
Selanjutnya dilakukan pengukuran aktivitas enzim untuk optimisasi konsentrasi pada isolat bakteri P20. Xilanase termasuk ke dalam enzim ekstraseluler (eksoenzim), yang berarti enzim tersebut disekresikan ke luar sel dan berdifusi ke dalam media. Sebagian besar eksoenzim ini bersifat hidrolitik, yaitu dapat menguraikan molekul kompleks menjadi molekul-molekul yang lebih sederhana (Waluyo 2007). Untuk mendapatkan xilanase ekstrak kasar, sama seperti enzim ekstraseluler lainnya, yaitu dengan cara sentrifugasi. Cara ini bertujuan memisahkan enzim yang terdapat pada supernatan dari biomassanya. Supernatan yang didapatkan merupakaan sampel enzim kasar untuk analisis aktivitas enzim selanjutnya.
Pengujian aktivitas xilanase ekstrak kasar menggunakan metode DNS yang direaksikan selama 15 menit. Reaksi dengan DNS merupakan jenis reaksi redoks pada gugus aldehid gula yang teroksidasi menjadi gugus karboksil. Sementara itu DNS sebagai oksidator akan tereduksi membentuk asam 3-amino-5-nitrosalisilat (Gambar 2). Reaksi ini berjalan dalam suasana basa. Bila terdapat gula reduksi pada sampel, maka larutan DNS yang awalnya berwarna kuning akan bereaksi dengan gula reduksi sehingga menimbulkan warna jingga kemerahan. Dalam pembuatan reagen DNS, kita perlu menambahkan NaOH ke dalam larutan yang bertujuan untuk memberikan suasana basa. Karena nantinya reaksi dari reagen DNS ini bekerja pada suasana basa. Selain menambahkan NaOH, juga ditambahkan KNa tartat, fungsi dari penambahan ini adalah untuk menstabilkan warna yang terbentuk pada saat reaksi terjadi yaitu merah bata. Di samping itu, juga diperlukan pemanasan untuk membantu mempercepat jalannya reaksi. Semakin pekat warna kuning yang dihasilkan, gula pereduksi yang dihasilkan semakin banyak akibat aktivitas enzim (Sastrohamidjojo 2005). Bila terdapat gula reduksi pada sampel, maka larutan DNS yang awalnya berwarna kuning bereaksi dengan gula reduksi sehingga menimbulkan warna jingga kemerahan. Warna yang dihasilkan senyawa kompleks memberikan warna yang dapat dibaca secara
optimal dengan spektrofotometer pada panjang gelombang 540 nm (Reissig et al.
1955).
Gambar 2 Reaksi asam dinitrosalisilat (DNS) dengan gula D-xilosa
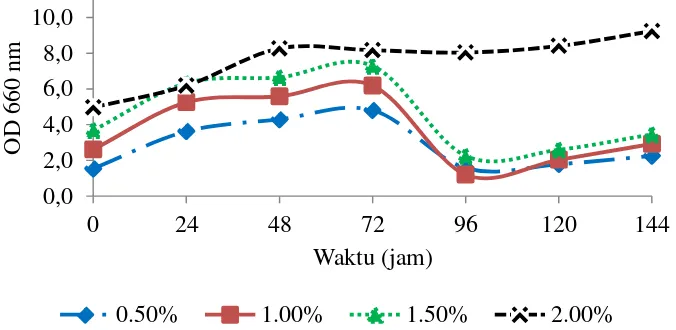
Kurva aktivitas xilanase disajikan pada Gambar 3. Perhitungan aktivitas enzim didapatkan dari konversi absorbansi gula pereduksi dengan kurva standar xilosa. Berdasarkan kurva aktivitas enzim konsentrasi substrat 0.5% dan 1.5% mengalami peningkatan dari jam 0 sampai 96 kemudian turun pada jam ke-120 sampai ke-144, sedangkan konsentrasi substrat 1.5% dan 2.0% aktivitasnya terus meningkat sampai jam ke-120 dan turun pada jam ke-144. Hal ini menjelaskan pada konsentrasi 0.5% dan 1.0% aktivitas optimum terjadi pada jam ke-96 sedangkan konsentrasi 1.5% dan 2.0% pada jam ke-120. Nilai aktivitas xilanase tertinggi dapat dilihat pada konsentrasi substrat 1.5% dibandingkan konsentrasi lainnya, yaitu sebesar 3.93 U/mL, sedangkan untuk konsentrasi 2.0% aktivitas xilanase justru menurun. Pangesti et al. (2012) menyatakan bahwa substrat yang berada pada medium dapat menyebabkan terjadinya peningkatan pertumbuhan mikroorganisme tetapi jika berada dalam jumlah yang banyak mempunyai efek negatif terhadap produksi enzim. Konsentrasi substrat yang tinggi pada medium berperan sebagai represor katabolit sehingga terjadi penurunan aktivitas enzim. Oleh karena itu selanjutnya dipilih konsentrasi substrat 1.5% sebagai kondisi optimum untuk produksi xilanase.
Gambar 3 Kurva aktivitas xilanase hasil optimisasi konsentrasi substrat 1,0
1,5 2,0 2,5 3,0 3,5 4,0 4,5
0 24 48 72 96 120 144
Aktivi
tas e
nz
im
(U
/m
L
)
Waktu inkubasi (jam)
10
Optimisasi pH media untuk produksi xilanase
Reaksi enzimatis dipengaruhi beberapa hal salah satunya, yaitu pH media. Keadaan pH media memberikan pengaruh terhadap perubahan morfologi suatu mikroba dan sekresi enzim yang dihasilkan oleh mikroba. Pengaruh pH terhadap pertumbuhan bakteri ini berkaitan dengan aktivitas enzim (Gupta et al. 2003). Menurut Richana dan Lestiana (2006) menyatakan bahwa aktivitas optimum enzim berkisar pada pH pertumbuhan mikroorganisme penghasil enzim tersebut, sehingga pH optimum aktivitas enzim ini berbeda-beda tergantung mikroorganisme penghasil enzimnya. Apabila pH dalam suatu medium atau lingkungan tidak optimal maka akan mengganggu kerja enzim-enzim tersebut dan akhirnya mengganggu pertumbuhan bakteri itu sendiri.
Gambar 4 menunjukkan kurva pertumbuhan sel dari isolat bakteri P20. Dari hasil penelitian pertumbuhan sel P20 pada variasi pH 5, 6, 7, dan 8 besarnya pertumbuhan sel tidak terlalu terlihat artinya pertumbuhan sel pada selang pH 5-8 memiliki besar yang sama. Fase log terjadi pada jam ke-48 hingga mencapai puncaknya pada jam ke-72. Memasuki jam ke-96 pertumbuhan sel mulai menurun dan mengalami fase stasioner sampai jam ke-144. Hal ini juga mengindikasikan bahwa bakteri yang digunakan dapat hidup dalam rentang pH yang sedikit asam mendekati netral.
Gambar 4 Kurva pertumbuhan sel bakteri P20 optimisasi pH media
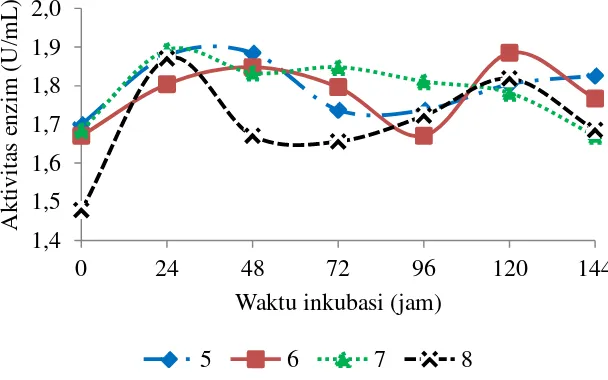
Gambar 5 menunjukkan kurva aktivitas xilanase dengan variasi pH 5, 6, 7, dan 8 dari hasil tersebut dapat dilihat nilai aktivitas enzim pada pH media 8 lebih rendah dibandingkan pH lainnya walaupun perbedaan nilai aktivitas yang dihasilkan tidak terlalu signifikan. pH 5 dan 6 memberikan puncak aktivitas xilanase pada jam ke-48 dan menurun pada jam ke-72 sampai ke-144, sedangkan pada pH 7 dan 8 puncak aktivitas xilanase sudah terlihat pada jam ke-24 dan selanjutnya menurun. Besarnya aktivitas xilanase yang didapatkan pada puncak tertinggi variasi pH 5, 6, 7, dan 8 berturut-turut adalah 1.89 U/mL, 1.85 U/mL, 1.90 U/mL, dan 1.87 U/mL. Berdasarkan hasil yang didapatkan pH media optimum yang digunakan untuk produksi xilanase yaitu pada pH media 7. Kuhad
et al. (2006) dalam penelitiannya memproduksi enzim xilanase maksimum pada pH 7 dari Bacillus sp.
Nilai aktivitas xilanase pada optimisasi pH ini menurun jika dibandingkan dengan optimisasi pada konsentrasi substrat. Menurunnya aktivitas xilanase karena perubahan pH media yang tidak terlalu besar (sedikit dibawah atau diatas pH optimalnya) disebabkan oleh berubahnya keadaan ion enzim dan seringkali juga keadaan ion substrat. Perubahan kondisi ion enzim dapat terjadi pada residu asam amino yang berfungsi katalitik mengikat substrat maupun pada residu asam amino yang berfungsi untuk mempertahankan struktur tersier dan kuartener enzim yang aktif. Disamping itu, perubahan struktur tersier menyebabkan kelompok hidrofobik kontak dengan air sehingga solubilitas enzim menjadi berkurang. Berkurangnya solubilitas enzim dapat mengakibatkan turunnya aktivitas enzim secara bertahap. Aktivitas enzim yang mengalami penurunan tersebut dapat dipulihkan kembali dengan merubah kondisi reaksi enzimatis pada pH optimalnya (Meriyandini et al. 2008)
Gambar 5 Kurva aktivitas xilanase hasil optimisasi pH media
Optimisasi suhu fermentasi untuk produksi xilanase
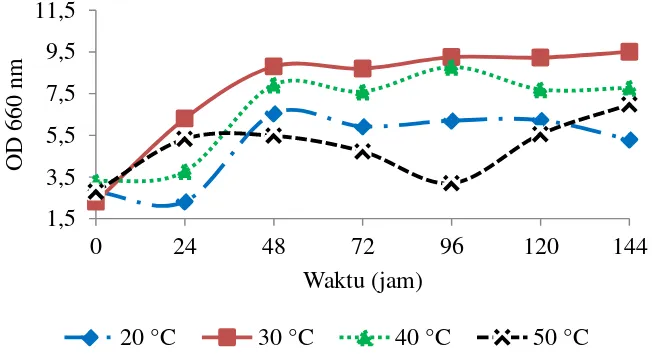
Suhu berpengaruh langsung terhadap kecepatan pertumbuhan mikroba, kecepatan sintesis enzim, dan kecepatan inaktivasi enzim. Suhu yang terlalu tinggi dapat mengakibatkan proses pengeringan protein sehingga dapat mengakibatkan kematian sel. Sedangkan pada suhu yang terlalu rendah dapat mengakibatkan aktivitas enzim berkurang dan pertumbuhan mikroba terganggu (Richana 2002). Hasil pertumbuhan sel dengan variasi suhu fermentasi 20 °C, 30 °C. 40 °C, dan 50 °C dapat dilihat pada Gambar 6. Pada suhu 50 °C dapat dilihat kurva pertumbuhannya lebih rendah dibandingkan suhu lainnya, sedangkan untuk suhu 20 °C, 30 °C, dan 40 °C memiliki puncak pertumbuhan sel pada jam ke-48 dan mengalami fase stasioner dari jam ke-72 sampai jam ke-144. Berdasarkan hasil yang didapatkan semakin meningkatnya suhu pertumbuhan sel akan semakin
12
banyak, namun saat suhu terlalu tinggi terjadi kematian sel yang mengakibatkan konsentrasi pertumbuhan sel pada suhu 50 °C menurun.
Gambar 6 Kurva pertumbuhan sel bakteri P20 optimisasi suhu fermentasi
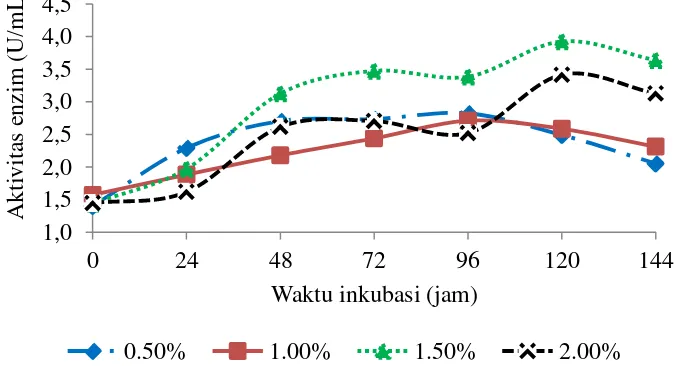
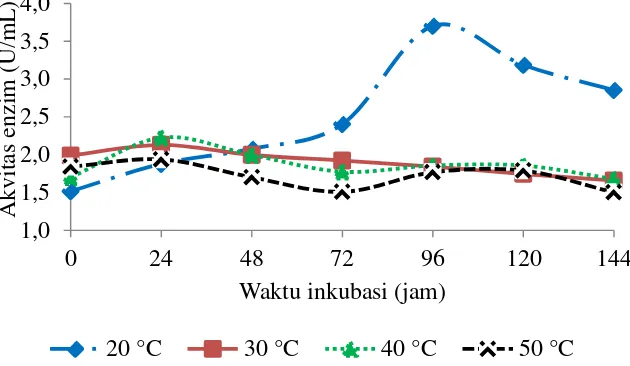
Kenaikan suhu akan diikuti dengan kenaikan aktivitas enzim sebelum mencapai suhu optimum, sedangkan pada suhu yang lebih tinggi dari suhu optimum aktivitas enzim akan turun dengan cepat. Enzim juga akan terdenaturasi pada suhu yang lebih tinggi sehingga mengakibatkan hilangnya aktivitas dari enzim (Septiningrum dan Moeis 2009). Aktivitas xilanase yang dihasilkan pada optimisasi suhu dapat dilihat pada Gambar 7 menunjukkan bahwa pada suhu produksi 20 °C aktivitas xilanase mencapai maksimum pada jam ke-96 sebesar 3.70 U/mL. Pada suhu 30 °C, 40 °C, dan 50 °C aktivitas enzim xilanase telah mencapai puncaknya pada jam ke-24 yaitu berturut-turut sebesar 2.13 U/mL, 2.23 U/mL, dan 1.94 U/mL. Kemampuan aktivitas enzim pada suhu rendah disebabkan karena terjadi pelipatan asam amino sistein pada sisi aktif enzim akibat denaturasi protein pada suhu tinggi (Kulkarni et al. 1999).
Proses kimia yang menjelaskan peranan suhu pada sebuah reaksi enzimatis adalah bertambahnya suhu sampai dengan suhu optimum disebabkan meningkatnya energi kinetika yang mempercepat gerak vibrasi, translasi dan rotasi dari molekul-molekul yang bereaksi (enzim dan substrat) sehingga memperbesar frekuensi tumbukan yang merupakan peluang keduanya untuk bereaksi. Sedangkan diatas suhu optimal aktivitas enzim menurun disebabkan terjadinya perubuhan konformasi pada struktur protein enzim atau substrat sehingga gugus reaktifnya mengalami hambatan dalam memasuki sisi aktif enzim (Meriyandini et al. 2008). Beberapa penelitian mengindikasikan bahwa aktivitas xilanase berada pada suhu optimal mendekati suhu ruang. Hal ini dilaporkan juga oleh Azin et al. (2007) dengan suhu optimum untuk produksi xilanase pada suhu 25 °C dari Trichoderma longibrachitum, sedangkan Sathiyavati dan Parvatham (2013) melaporkan hasil produksi xilanase optimum pada suhu 27 °C. Ahmad et al. (2009) melaporkan bahwa suhu 30 °C merupakan suhu optimum untuk produksi xilanase dari Aspergillus niger. Penelitian ini menghasilkan suhu optimum untuk produksi xilanase pada suhu rendah, yaitu 20 °C. Hal ini diperkuat
oleh penelitian Heck et al. (2005) yang menghasilkan aktivitas enzim tertinggi pada suhu rendah dari B. subtilis. Hal tersebut menunjukkan bahwa suhu optimum dalam memproduksi enzim berpengaruh terhadap habitat tinggal suatu mikroorganisme yang digunakan.
Gambar 7 Kurva aktivitas xilanase hasil optimisasi suhu fermentasi
Pengaruh penambahan sumber karbon untuk produksi xilanase
Untuk mengoptimalkan produksi xilanase diperlukan penambahan sumber karbon pada media fermentasi untuk membantu insiasi pertumbuhan bakteri. Setelah pertumbuhan bakteri meningkat, diharapkan produksi xilanase juga meningkat. Beberapa sumber karbon yang dilaporkan untuk produksi xilanase dari golongan gula sederhana yaitu xilosa, sukrosa, glukosa, pati, laktosa, maltosa, dan dekstrosa (Haq-ul et al. 2002). Beberapa penelitan menggunakan sumber karbon sebagai pengganti substrat, namun pada penelitian ini sumber karbon digunakan sebagai tambahan sumber dalam media fermentasi yang juga mengandung substrat untuk meningkatkan energi biosintesis mikroorganisme
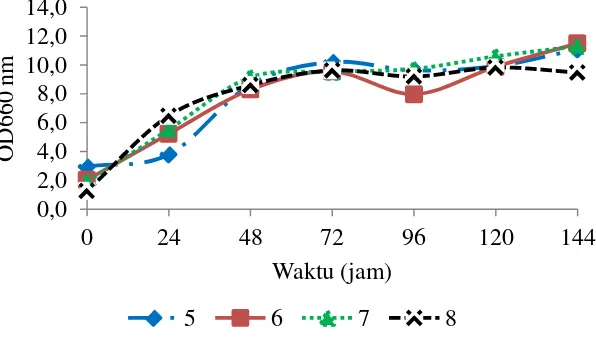
Penelitian ini menggunakan lima sumber karbon untuk produksi xilanase, yaitu maltosa, laktosa, glukosa, sukrosa, dan xilosa dengan konsentrasi 0.5%. Berdasarkan kurva pertumbuhan yang didapatkan puncak pertumbuhan sel dengan tambahan sumber karbon maltosa terjadi pada jam ke-120, sedangkan laktosa, glukosa, dan sukrosa terjadi pada jam ke-96, serta xilosa memiliki pertumbuhan sel lebih rendah dibandingkan sumber karbon lain (Gambar 8). Berdasarkan kurva pertumbuhan sel dengan adanya penambahan sumber karbon dapat dilihat bakteri P20 pertumbuhan selnya tumbuh baik pada sumber maltosa, sukrosa, dan laktosa, sedangkan pada sumber glukosa dan xilosa pertumbuhan sel lebih rendah. Menurut Singh et al. (2013) monosakarida dan disakarida merupakan sumber karbon terbaik untuk produksi enzim bergantung pada spesifikasi enzim itu bekerja. Hasil ini menunjukkan bakteri P20 tumbuh baik pada sumber karbon yang termasuk dalam golongan gula disakarida dibandingkan gula monosakarida. Diduga hal ini berpengaruh karena substrat yang digunakan, yaitu ampas tebu yang memiliki struktur lebih kompleks dibandingkan disakarida. Bakteri akan
14
mengkonsumsi nutrisi yang lebih sederhana seperti gula disakarida dibandingkan substrat biomassanya.
Gambar 8 Kurva pertumbuhan sel bakteri P20 pengaruh tambahan sumber karbon
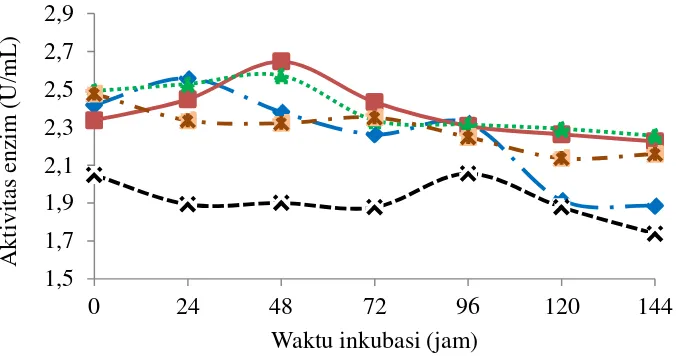
Aktivitas xilanase yang dihasilkan dengan penambahan sumber karbon laktosa memiliki nilai aktivitas yang lebih besar dibandingkan sumber karbon lainnya, yaitu 2.65 U/mL pada jam ke-48 selanjutnya aktivitas enzim menurun, begitu juga dengan sumber karbon glukosa tetapi nilai aktivitasnya lebih rendah, yaitu sebesar 2.57 U/mL. Sedangkan sumber karbon maltosa memiliki aktivitas puncak pada jam ke-24 sebesar 2.56 U/mL dan untuk sumber sukrosa serta xilosa aktivitasnya jauh lebih rendah, yaitu berturut-turut 2.06 U/mL pada jam ke-96 dan 2.48 U/mL pada jam ke-0 (Gambar 9). Menurut hasil yang telah didapatkan penambahan sumber karbon laktosa merupakan sumber karbon yang baik digunakan untuk produksi xilanase dibandingkan sumber karbon lainnya. Hal ini disebabkan karena pemecahan molekul laktosa menjadi gula sederhananya, yaitu glukosa dan galaktosa dalam sel bakteri menghasilkan energi yang besar untuk menghasilkan xilanase sehingga menghasilkan aktivitas yang lebih besar. Selain itu diduga pada sel bakteri P20 terjadi represi katabolit, yaitu sel bakteri mampu menghasilkan enzim untuk metabolisme gula selain xilosa sehingga sel sedikit menghasilkan xilanase jika terdapat xilosa. Oleh sebab itu pada penelitian ini xilosa memiliki aktivitas lebih rendah. Begitu juga dengan penambahan sumber karbon sukrosa, karena sukrosa bukan termasuk golongan gula pereduksi maka saat pengujian aktivitas xilanase dengan DNS nilai serapan yang dihasilkan jauh lebih rendah sehingga aktivitas xilanasenya juga menurun.
4,0 4,8 5,6 6,4 7,2 8,0 8,8 9,6
0 24 48 72 96 120 144
OD
660 nm
Waktu (jam)
Gambar 9 Kurva aktivitas xilanase pengaruh penambahan sumber karbon
Pengaruh penambahan sumber nitrogen untuk produksi xilanase
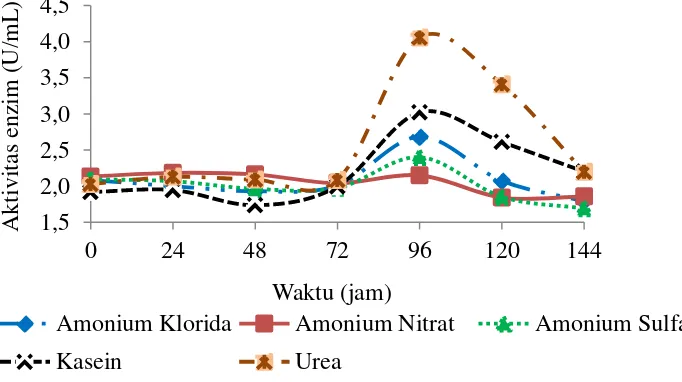
Senyawa yang mengandung nitrogen merupakan senyawaan penting lain untuk produksi enzim. Senyawa ini terkandung dalam banyak senyawa organik, yaitu kelompok amina, asam amino, dan bagian dari nukleotida dasar. Berat kering sel mikroba mengandung senyawaan nitrogen sebanyak 14%. Adanya nitrogen dapat meningkatkan pertumbuhan gizi untuk banyak organisme karena dengan nitrogen yang cukup organisme dapat membangun protein dan nukleotida (Chin 2006). Beberapa sumber nitrogen yang digunakan untuk produksi xilanase seperti KNO3 (kalium nitrat), NaNO3 (natrium nitrat), NH4NO3 (amonium nitrat), (NH4)2SO4 (amonium sulfat), NH4H2PO4 (amonium fosfat), pepton, urea, kasein, dan ekstrak khamir (Kumar et al. 2010). Sumber nitrogen yang digunakan pada penelitian ini adalah NH4Cl, NH4NO3, (NH4)2SO4, kasein, dan urea dengan konsentrasi masing-masing 0.5%.
Hasil penelitian menunjukkan kurva pertumbuhan sel isolat bakteri P20 penghasil xilanase (Gambar 10), dari kurva pertumbuhan terlihat koloni bakteri yang mendapatkan tambahan sumber nitrogen kasein memiliki pertumbuhan sel yang lebih besar dibandingkan sumber nitrogen lainnya. Pertumbuhan sel isolat bakteri P20 dengan penambahan sumber nitrogen memiliki pertumbuhan sel yang optimum pada jam ke-96 selanjutnya pertumbuhan sel mengalami penurunan sampai jam ke-144. Pola pertumbuhan koloni bakteri tersebut mengindikasikan pada jam ke-120 dan ke-144 mulai mengalami fase kematiannya.
16
Gambar 10 Kurva pertumbuhan sel bakteri P20 pengaruh tambahan sumber nitrogen
Berbeda dengan pertumbuhan sel, aktivitas xilanase yang dihasilkan memiliki puncak tertinggi pada koloni yang diberi tambahan sumber nitrogen urea, yaitu sebesar 4.06 U/mL dibandingkan sumber nitrogen lainnya (Gambar 11). Pertumbuhan sel dan aktivitas enzim memiliki waktu optimum pada jam ke-96 dan setelah itu aktivitas enzim menurun. Hasil yang didapatkan dari penambahan sumber nitrogen mengindikasikan dengan adanya tambahan sumber nitrogen dalam media dapat meningkatkan aktivitas enzim walaupun peningkatannya tidak terlalu signifikan. Menurut Kuhad et al. (2006) sumber nitrogen organik dilaporkan sebagai sumber yang jauh lebih baik untuk pertumbuhan sel dan aktivitas enzim dibandingkan dengan sumber nitrogen anorganik. Oleh karena itu, urea memiliki aktivitas enzim tertinggi dibandingkan dengan sumber nitrogen anorganik. Selain itu urea sangat mudah terurai dan melepaskan amonia dan CO2, dimana amonia yang dilepaskan akan diserap menjadi sumber nitrogen yang digunakan bakteri untuk mempercepat pertumbuhan sel dalam proses fermentasi.
Berdasarkan hasil yang diperoleh untuk setiap proses optimisasi kondisi dalam produksi xilanase cenderung meningkatkan aktivitas enzimnya walaupun pada optimisasi pH media dan sumber karbon aktivitas enzim justru menurun. Hal ini mengindikasikan dugaan dengan menggunakan ampas tebu sebagai substrat pengganti dapat menghasilkan aktivitas xilanase dari bakteri P20 dan tidak membutuhkan nutrisi tambahan berupa sumber karbon.
SIMPULAN DAN SARAN
Simpulan
Kondisi optimum dari produksi enzim dapat diketahui dengan mengukur aktivitas suatu enzim yang dihasilkan dari mikroorganisme. Berdasarkan hasil penelitian yang dilakukan substrat pengganti xilan untuk produksi xilanase terbaik adalah substrat ampas tebu. Kondisi optimum untuk produksi xilanase, yaitu dengan konsenstrasi substrat ampas tebu 1.5%, pH media 7, suhu fermentasi 20 °C, laktosa 0.5% sebagai tambahan sumber karbon, dan urea 0.5% sebagai tambahan sumber nitrogen. Aktivitas enzim tertinggi didapatkan dengan nilai aktivitas sebesar 4.06 U/mL pada jam 96. Aktivitas meningkat dua kali lipat dibandingkan kondisi yang belum optimum.
Saran
Pengoptimalan kondisi dalam produksi enzim yang dilakukan pada penelitian ini masih menggunakan rancangan sederhana, sehingga disarankan untuk mendapatkan kondisi optimum yang lebih baik digunakan rancangan percobaan seperti rancangan acak lengkap ataupun kelompok.
DAFTAR PUSTAKA
Ahmad Z, Butt MS, Anjum FM, Asgher M. 2009. Effect of wheat bran concentration on xylanase biosynthesis by Aspergillus niger. Int J Agri Biol. 11:571-576.
18
Azin M, Moraavej R, Zareh D. 2007. Production of xylanase by Trichoderma longibrachiatum on a mixture of wheat bran and wheat straw: optimization of culture condition by Taguchi method. Enzyme Microb Tech. 40:801-805.
Beg KQ, Kapoor M, Mahajan L, Hoondal GS. 2001. Microbial xylanase and their industrial application: a review. J Appl Microbiol Biotechnol. 56: 326-338.
Fuad AM, Rahmawati R, Mubarik NR. 2004. Produksi dan karakterisasi parsial protease alkali termostabil Bacillus thermoglusidasius AF-01. J Mikrob Indones. 9(1): 29-35.
Gupta R, Gigras P, Mohapatra H, Goswami VK, Chauhan B. 2003. Microbial-amylases: a biotechnological perspective. J Proces Biochem. 38: 1599-1616.
Haq-ul I, Khan A, Butt WA, Ali S, Qadeer MA. 2002. Effect of carbon and nitrogen sources on xylanase production by mutant strain of Aspergillus niger GCBMX-45. J Bio Sci. 2(2): 143-144.
Heck JX, Soares LH, Ayub MAZ. 2005. Optimization of xylanase and mannanase production by Bacillus circulans strain BL53 on solid-state cultivation.
Enzyme Microb Technol. 37(4): 417-423.
Hernandez CC, Carrillo EP, Saldivar SO. 2009. Production of bioethanol from steam-flaked sorghum and maize. J Cereal Sci. 50: 131–137.
Chin LT. 2006. Screening of xylanase producer from soil [tesis]. Malaysia: University College of Engineering & Technology.
Kuhad RC, Chopra P, Battan B, Kapoor M, Kuhad S. 2006. Production, partial purification and characterization of athermo-alkali stable xylanase from
Bacillus sp.RPP-1. Ind J Microb. 46: 13-23.
Kulkarni N, Abhay S, Mala R. 1999. Molecular and biotechnological aspects of xylanase. FEMS Microbiological Reviews. 23: 411-456.
Kumala S, Fitri NA. 2008. Penapisan kapang endofit ranting kayu meranti merah (Shorea balangeran Korth.) sebagai penghasil enzim xilanase. J Ilmu Kefarmasian Indones. (6)1:1-6.
Kumar D, Verma R, Sharma P, Rana A, Sharma R, Prakash C, Bhalla TC. 2010. Production and partial purification of xylanase from a new thermophilic isolate. An Int J. 2(2): 83-87.
Lynd LR, Bothast RJ, Wyman DE. 1991. Fuel etanol from cellulosic biomass.
Science. 251: 1318-1323.
Meriyandini A, Widyastuti N, Lestari Y. 2008. Pemurnian dan karakterisasi xilanase Streptomyces sp. SKK1-8. Makara Sains. 2(12):55-60.
Miller GL. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. J Anal Chem. 31:426-428.
Moreira LR, Ferreira GV, Santos SS, Ribeiro A, Siquira F, Filho EX. 2012.The hydrolysis of agroindustrial residues by holocellulose degrading enzyme.
Braz J Microbiol. 43(2): 498-505. doi 10.1590/S1517-83822012000200010.
Pandey A, Soccol CR, Nigam P, Soccol VT. 2000. Biotechnological potential of agroindustrial residues: sugarcane bagasse. Bioresour Technol. 74: 69-80.
Pangesti NWI, Pangastuti A, Retnaningtyas E. 2012. Pengaruh penambahan molase pada produksi enzim xilanase oleh fungi Aspergillus niger dengan substrat jerami padi. Bioteknologi. 9(2): 41-48.
Prasad MP, Sethi R. 2013. Screening for xylanase producing microorganisms from marine sources. Int J Curr Microbiol App Sci. 2(12): 489-492. Reissig JL, Strominger JL, dan Leloir LF.1995. A modified colorimetric method
for estimation of n-acetylamino sugars. J Biochem. 966.
Richana N, Lestari P, Thontowi A, Rosmimik. 2000. Seleksi isolat bakteri lokal penghasil xilanase. J Mikrob Indones. 5(2):54-56.
Richana N. 2002. Produksi dan prospek enzim xilanase dalam pengembangan bioindustri di Indonesia. B AgroBio. 5(1): 29-36.
Richana N, Lestiana P. 2006. Produksi xilanase untuk biokonversi limbah biji kedelai. Prosiding Seminar Hasil Penelitian Rintisan dan Bioteknologi Tanaman. 388-396.
Ruiz-Arribas A, Fernandez-Abalos JM, Sanches P, Gardu AL, Santamaria RI. 1995. Over production, purification, and biochemical characterization of xylanase I (xys 1) from Streptomyces halstedii JM8. Appl Environ Microbiol. 61(6): 2414-2419.
Sastrohamidjojo H. 2005. Kimia Organik, Sterokimia, Lemak, dan Protein. Yogyakarta (ID): Gadjah Mada University Press.
Sathiyavati M, Parvatham R. 2013. Industrial application of xylanase in the crude enzyme extract from Trichoderma sp. MS 2010. Asian J Pharm Clin Res. 6:90-96.
Septiningrum K, Moeis MR. 2009. Isolasi dan karakterisasi xilanase dari Bacillus circulans. BS 44(1):31-40.
Singh K, Richa K, Bose H, Karthik L, Kumar G, Bhaskara Rao KV. 2013. Statistical media optimization and cellulose production from marine
Bacillus VITRKHB. Biotech. doi 10.1007/s13205-013-0173-x.
Tork S, Aly MM, Alakilli SY, Al-Seeni MN. 2013. Production and characterization of thermostable xylanase from Bacillus subtilis XP10 isolated from marine water. Africian J Biotechnol. 12(8):780-790.
Trismilah, Deden, Sumaryanto. 2003. Produksi xilanase. J Sains Teknol. 2: 66-69. Wahyuningsih. 2011. Peranan enzim mananase dari Saccharopolyspora flava
pada hidrolisis substrat tepung mannan umbi porang untuk menghasilkan oligosakarida [skripsi]. Jakarta(ID) : Universitas Negeri Jakarta.
Waluyo L. 2007. Mikrobiologi Umum. Malang(ID) : Universitas Muhammadiyah Malang.
Yopi, Purnawan A, Thontowi A, Hermansyah H, Wijanarko A. 2006. Preparasi mannan dan mannanase kasar dari bungkil kelapa sawit. J Teknol. No. 4 Tahun XX: 312-319.
20
LAMPIRAN
Lampiran 1 Bagan alir penelitian
Pemilihan isolat bakteri pada berbagai biomassa (uji congo red)
Peremajaan isolat
Isolat terpilih
Prekultur
Kultur
Optimisasi produksi xilanase: 1. Konsentrasi substrat 2. pH media
3. Suhu fermentasi 4. Sumber karbon 5. Sumber nitrogen
Sampling H0-H6
Media padat
Media cair
Supernatan
Sentrifugasi
Pertumbuhan sel
22
Lampiran 3 Data optimisasi pH media
24
Lampiran 5 Data optimisasi penambahan sumber karbon
26
contoh perhitungan aktivitas enzim
Absorbansi terukur = absorbansi S1- kontrol 1 = 0.087- 0.072
= 0.015