PRODUKSI BIODIESEL MENGGUNAKAN LIPASE AMOBIL
PADA KITIN DALAM REAKTOR UNGGUN DIAM
(FIXED BED REACTOR)
SULFITRI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis Produksi Biodiesel Menggunakan Lipase Amobil pada Kitin dalam Reaktor Unggun Diam (Fixed Bed Reactor) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
SULFITRI. Produksi Biodiesel Menggunakan Lipase Amobil pada Kitin dalam Reaktor Unggun Diam (Fixed Bed Reactor). Dibimbing oleh ANI SURYANI dan DADANG SUHENDAR.
Produksi biodiesel menggunakan katalis biologis tidak memerlukan proses pemurnian produk dan kebutuhan energi yang lebih rendah dibandingkan penggunaan katalis kimiawi. Meski demikian, biokatalis tidak banyak digunakan dalam industri karena harganya yang mahal. Oleh karena itu, metode imobilisasi enzim menjadi alternatif solusinya. Kitin dapat digunakan sebagai support dalam proses imobilisasi enzim karena mengandung gugus amino yang menyediakan tempat ikatan untuk protein. Produksi biodiesel pada skala laboratorium banyak dilakukan secara batch. Untuk implementasi enzim amobil dalam dunia industri, reaktor batch kurang efisien. Oleh karena itu dibutuhkan alternatif proses yaitu menggunakan reaktor kontinyu, salah satunya dengan menggunakan fixed bed reactor. Berdasar pada hal tersebut, penelitian ini bertujuan untuk memperoleh lipase yang terimobilisasi pada kitin dengan nilai derajat imobilisasi terbaik dari variasi waktu aktivasi kitin, konsentrasi lipase dan waktu inkubasi selama imobilisasi; memperoleh hasil terbaik dari konversi minyak menjadi metil ester dari variasi konsentrasi substrat dan suhu reaksi; dan memperoleh konversi metil ester yang berlangsung secara kontinyu pada fixed bed reactor.
Pada penelitian ini kitin diaktivasi dengan glutaraldehid sebelum digunakan sebagai support. Waktu aktivasi kitin bervariasi antara 1 jam hingga 3 jam. Setelah itu kitin diinkubasi dalam larutan lipase berbagai konsentrasi mulai dari 0.044 mg mL-1 hingga 0.264 mg mL-1 dan didiamkan dalam cold room dengan variasi waktu yang berbeda-beda pula yaitu 14 jam hingga 24 jam. Perlakuan yang menghasilkan persentase tertinggi dari lipase yang terikat pada kitin adalah aktivasi kitin dengan glurataraldehid selama 1 jam 30 menit. Konsentrasi lipase yang menghasilkan derajat imobilisasi tertinggi adalah 0.22 mg mL-1. Sedangkan waktu inkubasi kitin dalam larutan lipase yang menghasilkan derajat imobilisasi tertinggi adalah inkubasi selama 18 jam pada cold room. Lipase amobil kemudian digunakan dalam proses transesterifikasi minyak sawit untuk memperoleh konversi metil ester. Suhu transesterifikasi yang digunakan bervariasi antara 40 oC hingga 55 oC dan rasio mol minyak dan metanol sebesar 1:3 hingga 1:6. Konversi metil ester tertinggi setelah 8 jam reaksi diperoleh pada kondisi suhu reaksi 45 oC dan rasio mol minyak dan metanol sebesar 1:4. Kestabilan lipase amobil dipelajari melalui reaksi transesterifikasi yang berlangsung dalam reaktor kontinyu fixed bed reactor selama 50 jam tanpa henti. Lipase amobil menghasilkan konversi metil ester sebesar 67.95% dan aktivitasnya terus mengalami penurunan seiring bertambahnya waktu produksi.
SUMMARY
SULFITRI. Biodiesel Production Using Lipase Immobilized Onto Chitin In Fixed Bed Reactor. Supervised by ANI SURYANI and DADANG SUHENDAR.
Biodiesel production using biological catalyst does not require products purification process and lower energy requirements compared to the chemical catalysts. However, one of the main obstacles for industrial application of lipase is the high cost of biocatalysts. Therefore immobilization of lipase is an alternative solution. Chitin can be used as a support in the enzyme immobilization process because it contains amino groups that provide binding sites for proteins. Biodiesel production on a laboratory scale most commonly used batch reactors system but it is not efficient for implementation of immobilized lipase in biodiesel industrial. Therefore, it needs an alternative process using fixed bed reactor as a reactor with continuous system. Based on this problem, this study aims to obtain lipase immobilized on chitin with a high value of immobilization degree with the variation of chitin activation period, the concentration of lipase and incubation period of immobilization; obtain the best results from the conversion of oil into methyl ester with the variation of substrate concentration and reaction temperature; and obtain methyl ester conversion takes place continuously on a fixed bed reactor.
In this study, chitin was activated using glutaraldehyde before used as a support. Chitin activation time ranging from 1 hour to 3 hours. After that, chitin was incubated in a various concentrations of lipase solution ranging from 0.044 mg mL-1 to 0264 mg mL-1 and stored in a cold room with a variety storage time between 14 hours to 24 hours. The highest percentage of lipase bound to chitin was obtained by the treatment of chitin activation with glurataraldehid for 1 hour 30 minutes, incubation chitin in a lipase solution with concentrations 0,22 mg mL-1 and stored for 18 hours in a cold room. The immobilized lipase was used in the transesterification process to obtained the conversion of palm oil to methyl ester. Transesterification temperatur that was used varying between 40 oC to 55 oC and oil to methanol molar ratio was 1: 3 to 1: 6. High methyl ester conversion after 8 hours of reaction was obtained on condition at 45 oC of reaction temperature and at 1: 4 of oil to methanol molar ratio. The stability of the immobilized lipase was learned through a transesterification reaction which takes place in a fixed bed reactor for 50 hours without stopping. Immobilized lipase was produced conversion of methyl ester with yield of 67.95% and its activities decreased with increasing time of production.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
PRODUKSI BIODIESEL MENGGUNAKAN LIPASE
AMOBIL PADA KITIN DALAM REAKTOR UNGGUN DIAM
(FIXED BED REACTOR)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Produksi Biodiesel Menggunakan Lipase Amobil Pada Kitin Dalam Reaktor Unggun Diam (Fixed Bed Reactor)
Nama : Sulfitri NIM : P051130101
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Ani Suryani, DEA Ketua
Dr Dadang Suhendar, M Eng Anggota
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof Dr Ir Suharsono, DEA
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc Agr
Tanggal Ujian: 7 Januari 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala yang telah memberikan limpahan nikmat dan kemudahan sehingga tesis ini dapat diselesaikan. Tak lupa shalawat penulis panjatkan kepada junjungan Rasulullah Muhammad SAW penuntun langkah menuju cahaya di surga. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2014 ini ialah Poduksi Biodiesel Menggunakan Lipase Amobil Pada Kitin Dalam Reaktor Unggun Diam (Fixed Bed Reactor).
Penulis menyampaikan rasa terima kasih yang tulus kepada Prof Dr Ir Ani Suryani, DEA sebagai ketua komisi pembimbing dan Dr Dadang Suhendar, M Eng sebagai anggota komisi pembimbing yang telah meluangkan waktu, tenaga, dan pikiran dalam memberikan bimbingan bagi penulis. Ucapan terima kasih juga penulis sampaikan kepada Dr Ir Hj Mulyorini Rahayuningsih, MS yang telah memberikan saran dan masukan kepada penulis dalam menyelesaikan tesis ini, kepada pihak BPPT dan Program Beasiswa Pascasarjana BPPDN 2013 yang telah membiayai penelitian yang dlakukan oleh penulis serta kepada Nuur Faridatun Hasanah ST dan seluruh staf Laboratorium Teknologi Bioindustri, Badan Pengkajian dan Penerapan Teknologi yang telah membantu baik secara langsung maupun tidak langsung dalam penyelesaian tesis ini. Ucapan terima kasih juga penulis sampaikan kepada papa Safaruddin, mama Nurhaniah, Sri Rahyuni, Junaedi S Si, seluruh keluarga dan teman-teman atas doa restu, motivasi, cinta dan kasih sayangnya. Semoga Allah SWT memberikan perlindungan, kesehatan dan pahala yang berlipat ganda atas segala kebaikan yang telah dicurahkan kepada penulis.
Akhirnya, dengan segala kerendahan hati penulis menyampaikan bahwa tak ada manusia yang tak luput dari kesalahan dan kekhilafan. Oleh karena itu penulis senantiasa mengharapkan saran dan kritikan yang membangun. Semoga karya ini dapat memberikan manfaat bagi semua yang membutuhkannya. Amin Ya Rabbal ‘Alamin.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 4
Biodiesel 4
Minyak Sawit Sebagai Bahan Baku Biodiesel 5
Transesterifikasi Secara Enzimatik 6
Imobilisasi Lipase 8
Kitin Sebagai Support 9
Reaktor Unggun Diam (Fixed Bed Reactor) 10
3 METODE 11
Waktu dan Tempat Penelitian 11
Alat dan Bahan 11
Prosedur Penelitian 11
4 HASIL DAN PEMBAHASAN 13
Aktivasi Kitin Menggunakan Glutaraldehid 13
Pengaruh Konsentrasi Lipase 16
Pengaruh Waktu Inkubasi 17
Aktivitas Lipase Amobil 18
Pengaruh Suhu Reaksi Terhadap Konversi Metil Ester 19 Pengaruh Rasio Mol Minyak dan Metanol Terhadap Konversi Metil Ester 20 Uji Stabilitas Enzim Amobil pada Proses Transesterfikasi dalam reaktor
Unggun Diam (Fixed Bed Reactor) 21
5 SIMPULAN DAN SARAN 24
Simpulan 24
Saran 24
DAFTAR PUSTAKA 25
LAMPIRAN 29
DAFTAR TABEL
1 Komposisi asam lemak pada minyak sawit 5
2 Pengaruh waktu aktivasi terhadap derajat imobilisasi 15 3 Pengaruh konsentrasi lipase terhadap derajat imobilisasi 16 4 Pengaruh waktu inkubasi terhadap derajat imobilisasi 17
DAFTAR GAMBAR
1 Reaksi transesterifikasi trigliserida dengan metanol 6 2 Diagram alir proses produksi biodiesel dengan menggunakan lipase
sebagai katalis 7
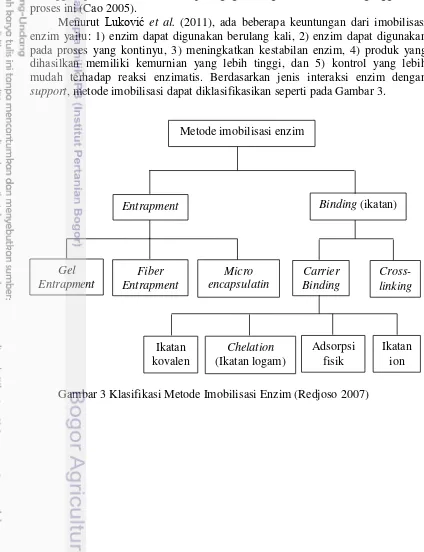
3 Klasifikasi metode imobilisasi enzim 8
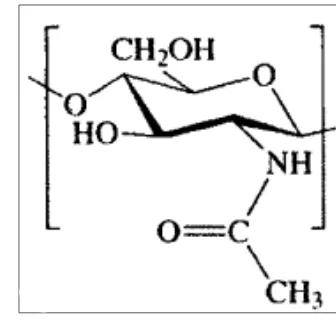
4 Struktur kimiawi kitin 9
5 Reaksi glutaraldehid dengan protein 14
6 Imobilisasi protein pada support teraminasi menggunakan glutaraldehid 15 7 Pengaruh suhu reaksi terhadap konversi metil ester 19 8 Pengaruh rasio mol minyak dan metanol terhadap konversi metil ester 20
9 Skema representasi dari reaktor unggun diam 22
10 Konversi metil ester secara kontinyu selama 50 jam 23
DAFTAR LAMPIRAN
11 Kurva standar protein dengan metode Bradford 29
12 Rumus perhitungan derajat imobilisasi 29
1 PENDAHULUAN
Latar Belakang
Ketergantungan secara terus menerus terhadap energi bahan bakar fosil, tidak berkelanjutan dalam jangka panjang karena menghabiskan sumber daya. Menurut World Energy Forum cadangan minyak berbasis fosil, batubara dan gas akan habis dalam 10 dekade (Narwal dan Gupta 2012). Selain itu bahan bakar fosil telah berkonstribusi sangat besar terhadap masalah lingkungan. Oleh karena itu, upaya untuk mengembangkan bahan bakar yang sifatnya renewable dan biodegradable menjadi solusi yang menjanjikan untuk mengurangi ketergantungan terhadap bahan bakar fosil.
Biodiesel merupakan salah satu alternatif yang tepat untuk menggantikan bahan bakar fosil. Biodiesel merupakan monoalkil ester dari asam lemak rantai panjang yang terkandung dalam minyak nabati maupun lemak hewan yang dihasilkan melalui proses esterifikasi dan transesterifikasi. Biodiesel memiliki kelebihan dibandingkan dengan bahan bakar petroleum diesel. Biodiesel bersifat renewable dan biodegradable. Biodiesel tidak beracun, hasil pembakarannya hampir tidak mengandung partikel, sulfur dioksida, karbon dioksida, nitrogen dioksida sehingga ramah lingkungan. Energi yang dihasilkan oleh biodiesel relatif tidak berbeda dengan petroleum diesel sehingga dapat digunakan sebagai pengganti 100% petroleum diesel maupun sebagai campuran dengan berbagai perbandingan tanpa modifikasi mesin. Biodiesel juga tidak menghasilkan uap yang membahayakan pada suhu kamar, maka biodiesel lebih aman daripada petroleum diesel dalam penyimpanan dan penggunaannya (Lukovi et al. 2011).
Sumber minyak nabati sebagai bahan dasar produksi biodiesel diantaranya minyak kedelai, minyak bunga matahari, minyak kelapa sawit, minyak dedak padi, minyak jarak, minyak zaitun, dll. Minyak nabati ini tersusun dari berbagai macam trigliserida yang bervariasi tergantung pada panjang dan tingkat kejenuhan ikatannya (Dizge dan Keskinler 2008). Produksi biodiesel dapat menggunakatan katalis kimiawi ataupun katalis biologis. Produksi biodiesel menggunakan katalis kimiawi memiliki beberapa kelemahan diantaranya memerlukan pemurnian produk, konsumsi energi yang tinggi, tidak dapat digunakan kembali, dan berpotensi menyebabkan pencemaran lingkungan. Oleh karena itu, produksi biodiesel menggunakan biokatalis menjadi alternatif pilihan untuk mengatasi masalah penggunaan katalis kimiawi (You et al. 2013).
2
satu bahan penyangga yang dapat digunakan untuk imobilisasi enzim adalah kitin. Kitin merupakan homopolimer dari N-acetilglukosamin yang jumlahnya melimpah di alam. Kitin mengandung gugus amino yang menyediakan tempat ikatan untuk protein sehingga dapat berguna sebagai penyangga untuk imobilisasi beberapa jenis enzim (Gomes et al. 2004). Pada penelitian ini, akan dilakukan proses imobilisasi enzim lipase pada kitin sebagai penyangga. Kitin diaktivasi dengan menggunakan glutaraldehid. Glutaraldehid berfungsi sebagai agen cross-link dan menstabilkan enzim pada suhu tinggi dari pengaruh denaturasi (Charuchinda et al. 2013). Oleh karena itu, dilakukan beberapa variasi masa aktivasi kitin menggunakan glutaraldehid. Selain itu, konsentrasi enzim dan masa inkubasi dalam proses imobilisasi turut diperhitungkan untuk mendapatkan banyak enzim yang terikat pada kitin.
Melihat potensi biodiesel sebagai salah satu energi alternatif, penelitian tentang sintesis biodiesel telah banyak dilakukan. Gomes et al. (2004) dan Setyahadi et al. (2011), melakukan imobilisasi lipase pada kitin menggunakan metode ikatan kovalen teraminasi dalam sintesis biodiesel. Proses sintesis dilakukan secara batch. Namun, reaktor batch mempunyai beberapa kelemahan. Diantaranya adalah produktivitas yang rendah dan biaya operasi yang lebih tinggi. Selain itu, untuk kepentingan peningkatan skala produksi, informasi dengan reaktor bacth tidak cukup mendukung (Lukovi et al. 2011). Oleh karena itu dibutuhkan alternatif proses yaitu menggunakan reaktor kontinyu. Keuntungan proses kontinyu adalah kemudahan dalam mengontrol terjadinya reaksi serta produktivitas dan kualitas produk yang tinggi (Hama & Kondo 2013). Reaktor unggun diam (fixed bed reactor) merupakan jenis reaktor kontinyu yang paling banyak digunakan dalam sintesis biodiesel. Fixed bed reactor sering dimanfaatkan dalam produksi skala besar karena tingginya efisiensi, ekonomis dalam pengoperasiannya dan mudah dalam konstruksinya (Watanabe et al. 2001). Reaktor unggun isian memungkinkan terjadinya kontak substrat dan biokatalis tanpa perlu tekanan yang tinggi dan tidak membutuhkan proses separasi antara produk dan katalis. Selain itu, reaktor unggun isian sangat cocok untuk produksi jangka panjang dan lebih hemat bila dibandingkan dengan bioreaktor tipe batch (Ongjanovic et al. 2009). Secara stoikiometri, reaksi transesterifikasi membutuhkan 1 mol trigliserida dan 3 mol metanol untuk menghasilkan 3 mol metil ester dan 1 mol gliserol. Menurut Fukuda et al. (2001), untuk menghasilkan metil ester yang lebih banyak dalam waktu singkat, perlu penggunaan jumlah mol alkohol yang lebih tinggi. Di sisi lain, suhu reaksi juga mempengaruhi banyak sedikitnya konversi metil ester yang dihasilkan. Hal ini berkaitan dengan aktivitas enzim yang dipengaruhi oleh suhu lingkungan.
Perumusan Masalah
3 katalis. Tetapi penggunaan lipase untuk produksi biodiesel sulit diterapkan karena biayanya yang relatif mahal. Oleh karena itu diperlukan proses imobilisasi enzim dimana pergerakan molekul enzim dalam ruang tempat reaksi akan ditahan sehingga terbentuk sistem enzim yang aktif, tidak larut dalam air dan dapat digunakan berulang-ulang. Dalam imobilisasi enzim diperlukan support untuk terjadinya pengikatan enzim. Kitin merupakan support yang potensial digunakan untuk imobilisasi lipase. Faktor yang mempengaruhi banyak sedikitnya enzim yang terikat pada support akan dipelajari dalam penelitian ini meliputi masa aktivasi support, konsentrasi enzim dan waktu inkubasi dalam proses imobilisasi. Pada penelitian ini, biodiesel disintesis dari minyak sawit yang diperoleh melalui proses transesterifikasi dengan menggunakan lipase amobil. Proses sintesis biodiesel umumnya dilakukan secara batch. Namun, pada reaktor batch produktivitas rendah dan biaya operasi lebih tinggi pada produksi skala besar. Oleh karena itu, proses sintesis biodiesel akan dilakukan secara kontinyu menggunakan reaktor unggun diam (fixed bed reactor). Suhu reaksi dan rasio substrat (minyak dan metanol) akan dipelajari untuk mendapatkan konversi metil ester yang tinggi.
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Memperoleh lipase yang terimobilisasi pada kitin dengan nilai derajat imobilisasi terbaik dari variasi waktu aktivasi kitin, konsentrasi lipase dan waktu inkubasi selama imobilisasi
2. Memperoleh hasil terbaik dari konversi minyak menjadi metil ester dari variasi konsentrasi substrat dan suhu reaksi
3. Memperoleh konversi metil ester yang berlangsung secara kontinyu pada reaktor unggun diam (Fixed Bed Reactor)
Manfaat Penelitian
4
2 TINJAUAN PUSTAKA
Biodiesel
Biodiesel secara sederhana dapat diartikan sebagai bahan bakar terbarukan yang diproduksi dari metanol dan minyak nabati, lemak hewan, maupun minyak goreng bekas. Secara teknis biodiesel diartikan sebagai monoalkil ester asam lemak rantai panjang yang berasal dari bahan baku berupa lipid yang dapat diperbaharui seperti minyak sayur atau lemak hewan untuk digunakan sebagai bahan bakar mesin diesel (Conley 2009). Reaksi sintesis biodiesel dapat menggunakan katalis kimiawi ataupun katalis biologis. Produksi biodiesel secara industri menggunakan katalis basa homogen. Katalis basa seperti NaOH bereaksi dengan metanol menghasilkan natrium metoksida yang kemudian bereaksi dengan trigliserida menghasilkan ester (Salis et al. 2007). Penggunaan katalis basa menghasilkan rendemen yang tinggi dalam waktu singkat, namun memerlukan energi yang intensif dan separasi antara produk dan katalis. Sebaliknya, penggunaan katalis biologis tidak memerlukan separasi. Produk samping berupa gliserol dapat dengan mudah diperoleh kembali tanpa proses yang kompleks. Selain itu asam lemak yang terkandung dalam minyak dapat diubah seluruhnya menjadi metil ester dengan sempurna (Fukuda et al. 2001).
Biodiesel memiliki potensi besar sebagai bahan bakar diesel alternatif. Menurut Lukovi et al. (2011), beberapa keunggulan biodiesel dibandingkan dengan bahan bakar diesel konvesional diantaranya:
1. Bahan baku biodiesel berasal dari sumber-sumber yang dapat diperbaharui sehingga hasil pembakarannya tidak menyebabkan emisi karbondioksida 2. Tingkat biodegradabilitinya sama dengan glukosa sehingga sangat cocok
digunakan pada kegiatan di perairan sebagai bahan bakar
3. Produk pembakaran biodiesel memiliki emisi partikulat, sulfur, karbon monoksida, dan nitrogen oksida yang rendah
4. Biodiesel tidak menghasilkan uap yang membahayakan pada suhu kamar sehingga lebih aman dalam penyimpanan dan penggunaannya
5. Viskositas biodiesel lebih tinggi, mempunyai daya pelumasan yang lebih baik, dan menurunkan keausan piston sehingga mesin menjadi lebih awet.
5
Minyak Sawit sebagai Bahan Baku Biodiesel
Buah kelapa sawit merupakan buah yang kaya dengan minyak. Kelapa sawit memiliki karakteristik unik dan unggul dibandingkan jenis tanaman penghasil minyak lainnya karena kelapa sawit menghasilkan dua jenis minyak dari buah yang sama. Dalam proses pengepresan, daging buah sawit akan menghasilkan minyak sawit kasar (crude palm oil,CPO) dan inti sawit akan menghasilkan minyak inti sawit kasar (crude palm kernel oil,CPKO). CPO dan CPOK mempunyai karakteristik kimia, fisik dan gizi unik yang berbeda. CPO kaya dengan asam palmitat sedangkan CPOK kaya dengan asam laurat dan asam miristat. Pada prakteknya, dibandingkan CPKO, CPO lebih banyak diproses lanjut menjadi minyak goreng yang sering disebut sebagai minyak sawit. Minyak sawit banyak digunakan dalam berbagai aplikasi, baik pangan misalnya sebagai minyak goreng, margarin, cocoa butter subtitutes dan produk pangan lainnya, maupun non-pangan misalnya biodiesel, oleokimia maupun farmasi (O’Brien 1998). Minyak kelapa sawit merupakan senyawa tidak larut dalam air dimana komponen penyusunnya yang utama adalah trigliserida dalam jumlah yang besar dan nontrigliserida (motibgliserida, digliserida, fosfatida, karbohidrat, protein, zat warna, bahan-bahan berlendir atau getah) dalam jumlah yang sedikit (Pasaribu 2004).
Trigliserida sebagai senyawa utama penyusun minyak sawit merupakan bahan baku pada pembuatan biodiesel. Trigliserida merupakan ester dari satu senyawa gliserol dengan tiga molekul asam lemak. Sekitar 98% minyak kelapa sawit terdiri dari asam lemak seperti yang ditunjukkan pada Tabel 1.
Tabel 1 Komposisi asam lemak pada minyak sawit
Asam lemak Komposisi (%)
Biodiesel yang dihasilkan dari minyak yang memiliki kandungan asam lemak tak jenuh yang lebih tinggi menunjukkan pour point dan cloud point yang rendah sehingga sesuai untuk cuaca dingin maupun cuaca panas. Namun kualitas biodiesel lebih rendah karena memiliki angka setana dan suhu pembakaran yang rendah (Ghaly et al 2010). Selain itu, biodiesel yang dihasilkan dari minyak dengan asam lemak rantai panjang (lebih dari 18 karbon) memiliki angka setana dan suhu pembakaran yang tinggi, namun pour point dan cloud point tinggi dan viskositasnya lebih besar (Robles-Medina et al, 2009). Minyak sawit memiliki komposisi asam lemak jenuh dan tidak jenuh dengan proporsi yang seimbang sehingga minyak sawit tidak menempati posisi khusus dalam pengkategorian sebagai minyak jenuh ataupun minyak tak jenuh.
6
dan Giraldo (2011), meneliti reaksi transesterifikasi minyak sawit dengan metanol dan etanol menggunakan lipase imobil sebagai katalisator. Reaksi transesterifikasi antara minyak sawit dengan metanol menghasilkan metil ester sebesar 70% sedangkan dengan etanol menghasilkan metil ester sebesar 80%. Charuchinda et al. (2013), melakukan penelitian tentang hidrolisis-esterifikasi minyak sawit dalam proses sintesis biodiesel memanfaatkan enzim amobil menghasilkan fatty acid ethyl ester (FAEE) sebesar 49.6%.
Transesterifikasi secara Enzimatik
Transesterifikasi mereaksikan trigliserida dari minyak nabati atau lemak hewani dengan alkohol rantai pendek seperti metanol menghasilkan metil ester asam lemak (Fatty Acids Methyl Esters/FAME) dan gliserol (gliserin) sebagai produk samping (Gambar 1). Reaksi transesterifikasi merupakan reaksi pertukaran bagian alkohol dari suatu ester yang berlangsung dalam sistem kesetimbangan (reversible). Reaksi reversibel harus dijaga agar kesetimbangan reaksi bergeser ke arah produk sehingga perolehan biodiesel tinggi. Untuk mencapai hal tersebut, digunakan metanol sebagai pereaksi dalam jumlah yang melebihi kebutuhan stoikiometri. Reaksi yang tidak sempurna dapat menyebabkan rendahnya kualitas biodiesel (Fessenden R dan Fessenden J 1986).
Gambar 1 Reaksi Transesterifikasi Trigliserida dengan Metanol (Nagi et al. 2008) Reaksi transesterifikasi pada dasarnya merupakan reaksi bolak-balik (reversible). Reaksi transesterifikasi dikatalisis secara kimiawi ataupun enzimatik. Katalis kimia yang digunakan adalah senyawa asam atau basa kuat. Katalis basa memiliki kelemahan yaitu memerlukan proses pemurnian produk samping berupa gliserol, asam lemak bebas, sisa katalis dan air agar menghasilkan biodiesel murni. Sedangkan katalis asam membutuhkan suhu dan tekanan yang tinggi (energi lebih besar) serta waktu reaksi yang lebih lama. Selain itu katalis kimiawi memerlukan reaktor yang resisten terhadap agen agresif dan standar keselamatan yang tinggi (Vasudevan dan Briggs 2008). Disisi lain, penggunaan katalis kimiawi juga tidak ramah lingkungan. Oleh karena itu, penggunaan enzim sebagai katalis menjadi pilihan utama dalam produksi biodiesel.
H
H
7 Transesterifikasi enzimatik dapat mengatasi masalah-masalah yang terjadi jika menggunakan katalis basa. Terutama produk samping gliserol dapat dengan mudah diperoleh kembali tanpa proses yang komlpeks. Selain itu asam lemak bebas yang terkandung dalam minyak dapat diubah seluruhnya menjadi metil ester dengan sempurna. Proses lanjut dengan katalis lipase jauh lebih sederhana karena tidak dibutuhkan recovery metanol dan perlakuan terhadap limbah basa. Gliserol yang terbentuk dengan mudah dapat dipisahkan dari produk utama karena perbedaan kepolaran dan keduanya tidak saling bercampur (Fukuda et al. 2001). Diagram alir proses produksi biodiesel dengan menggunakan katalis lipase dapat dilihat pada Gambar 2.
Gambar 2 Diagram Alir Proses Produksi Biodiesel dengan Menggunakan Katalis Lipase (Lukovi et al. 2011)
Beberapa tahun belakangan ini, telah banyak diteliti sintesis ester yang dikatalisasi oleh lipase. Lipase (triasilgliserol hidrolase) merupakan enzim yang menghidrolisis trigliserida menjadi asam-asam lemak dan gliserol. Lipase ekstraselular dan intraselular dapat mengkatalisis reaksi transesterifikasi secara efektif pada sistem aqueus atau nonaqueus (Setyahadi 2011). Wrinkler et al. (1990) mengemukakan bahwa sisi aktif lipase diselubungi oleh suatu struktur aktif yang dinamakan Lid. Lid distabilkan oleh interaksi dengan permukaan air atau substrat. Pada konformasi tertutup, lid menyelubungi sisi aktif lipase yang menyebabkan tidak terbentuknya ikatan enzim-substrat karena sisi hidrofilik menghadap pelarut dan sisi hidrofobik menghadap ke inti protein. Sedangkan pada struktur terbuka, sisi hidrofobik menjadi terbuka dan memperbesar pembentukan permukaan hidrofobik dan tempat terikatnya substrat.
Asam amino penyusun utama yang membangun sifat lipase disebut triad katalis yaitu serin, histidin, dan asam aspartat atau asam glutamat. Sifat dari asam amino tersebut akan mempengaruhi reaktivitas dan selektivitas lipase. Dalam reaksi hidrolisis, terdapat penggolongan selektivitas lipase berdasarkan kemampuannya dalam memutuskan rantai trigliserida, yaitu: lipase yang menghidrolisis trigliserida secara acak terhadap posisi asam lemak pada trigliserol menjadi asam lemak, dimana enzim ini dapat menghidrolisis ikatan ester secara sempurna menghasilkan asam lemak bebas dan gliserol; lipase yang menghidrolisis secara spesifik pada posisi 1 dan 3 dari trigliserol, dimana produk yang dihasilkan adalah asam lemak bebas, 1,2-digliserol, dan 2-monogliserol; dan lipase yang menghidrolisis secara spesifik asam lemak tertentu dari trigliserol (Redjoso 2007). Supaya lipase dapat digunakan secara berulang, maka lipase bebas disimpan aktivitas katalitiknya dengan proses imobilisasi.
8
Imobilisasi Lipase
Teknologi imobilisasi enzim berkembang sejak disadarinya beberapa kelemahan enzim antara lain ketidaksatabilan enzim, biaya isolasi dan pemurnian yang tinggi, serta tingginya biaya penggunaan enzim karena enzim yang telah digunakan tidak dapat dipisahkan atau dipergunakan lagi. Padahal selama struktur enzim belum rusak, maka enzim masih bisa digunakan secara
berulang-ulang (Suhartono 1989). Imobilisasi enzim merupakan suatu proses dimana pergerakan molekul enzim dalam ruang tempat reaksi ditahan sedemikian rupa sehingga terbentuk sistem enzim yang aktif dan tidak larut dalam air. Dalam Imobilisasi enzim, pengikatan enzim pada suatu karier harus terjadi tanpa adanya perusakan pada struktur ruang tiga dimensi dari sisi aktif enzim tersebut,
sehingga spesifitas substrat maupun gugus fungsi aktif tidak terganggu oleh mudah terhadap reaksi enzimatis. Berdasarkan jenis interaksi enzim dengan support, metode imobilisasi dapat diklasifikasikan seperti pada Gambar 3.
9 Imobilisasi lipase secara luas digunakan untuk aplikasi industri terutama untuk sintesis biodiesel. Banyak studi tentang metode imobilisasi lipase yang telah dilakukan, diantaranya yaitu adsorpsi dalam support padat dan entrapment dalam matriks polimer support (Noureddini 2005). Tetapi metode adsorpsi dan entrapment memiliki beberapa kekurangan, diantaranya yaitu enzim amobil mudah dipengaruhi oleh kondisi lingkungan karena interaksi antara enzim dengan support sangat lemah sehingga enzim mudah lepas (Cao 2005). Metode ikatan kovalen memiliki beberapa keuntungan yaitu ikatan antara enzim dan support stabil sehingga enzim tidak mudah lepas ke dalam larutan dan substrat dapat dengan mudah berinteraksi karena enzim berada pada permukaan support (Brena dan Batista-Viera 2006). Akan tetapi menurut Aehle (2004), metode ikatan kovalen juga memiliki beberapa kerugian yaitu situs aktif enzim bisa saja rusak karena modifikasi kimiawi, aktivitas enzim bisa berkurang dan support tidak dapat diperbaharui. Meski demikian, metode ikatan kovalen lebih menguntungkan, hal ini dibuktikan oleh penelitian yang dilakukan Mokodongan (2009) yang membandingkan imobilisasi enzim lipase pada kitin sebagai matriks dengan menggunakan metode ikatan kovalen dan metode adsorpsi. Enzyme loading yang diperoleh dengan metode ikatan kovalen jauh lebih tinggi yaitu 60 mg g-1 support sedangkan metode adsorpsi hanya 29.17 mg g-1 support.
Kitin Sebagai Support
Kitin yang merupakan polimer dari β-(1-4)-N-asetil-D-glukosamin, adalah polisakarida yang jumlahnya paling melimpah. Struktur kimiawi kitin dapat dilihat pada Gambar 4. Sumber kitin sebagaian besar terdapat pada cangkang hewan kelas Crustacea, Mollusca, serta kutikula pada serangga. Kitin pada cangkang dan kutikula berperan sebagai pelindung dan penguat. Pada Crustacea dan Mollusca, kitin ditemukan sebagai konstituen jaringan kompleks dengan protein. Dalam dunia industri, kitin diekstrak dari cangkang Crustacea dengan dilarutkan di dalam kalsium karbonat kemudian diekstraksi dengan basa untuk melarutkan proteinnya. Setelah itu dilakukan decolorization untuk menghilangkan pigmennya (Rinaudo 2006).
10
Hidrolisis kitin akan menghasilkan 2-amino-2-deoksi-D-glukosa (gugus asetat lepas). Adanya gugus amino menyediakan tempat ikatan untuk protein yang berguna sebagai support dalam proses imobilisasi dari beberapa macam enzim. Kitin telah secara luas digunakan sebagai support dalam proses imobilisasi beberapa jenis enzim. Gomes et al. (2004), mengaktivasi kitin dengan heksametilendiamin dan glutaraldehid untuk digunakan sebagai support dalam imobilisasi lipase. Lipase imobil kemudian digunakan sebagai katalisator dalam proses transesterifikasi trigliserida. Aktivitas esterifikasi enzim lipase imobil sebesar 187 µmol mg-1 Min-1. Dalam industri makanan, kitin digunakan sebagai support imo ilisasi enzim α- dan β-amilase. Hal ini tidak terlepas dari sifat kitin yang tidak beracun, biodegradable, bersifat antibakterial, memiliki afinitas yang tinggi terhadap protein, dan dapat digunakan dalam berbagai bentuk misalnya bubuk, gel, serat maupun membran (Rinaudo 2006).
Reaktor Unggun Diam (Fixed Bed Reactor)
Reaktor merupakan sebuah peralatan atau sistem yang mampu menyediakan sebuah lingkungan biologis yang dapat menunjang terjadinya reaksi biokimia. Dalam reaksi kimiawi yang memanfaatkan katalis terimobilisasi, terdapat beberapa jenis reaktor yang bisa digunakan yaitu reaktor unggun, reaktor tangki berpengaduk ataupun reaktor membran (Mangunwidjaja dan Suryani 1994).
Reaktor unggun diam biasanya merupakan reaktor pipa berisi katalis yang ditempatkan pada posisi tertentu. Tujuan penempatan katalis adalah untuk mendapatkan luas permukaan kontak umpan untuk melangsungkan reaksi dan menghindari katalis yang terbawa oleh aliran. Selain itu, pada reaktor unggun diam, katalis tidak dikonsumsi pada reaksi sehingga dapat digunakan berulang-ulang sebagai aliran kontinyu dari reaktan yang dilewatkan pada unggun tanpa mengharuskan proses pemisahan dan recycling katalis. Reaktor unggun diam banyak digunakan untuk reaksi-reaksi gas maupun cair dengan katalis berupa padatan. Kontak katalis-umpan dalam reaktor unggun diam lebih efisien dibandingkan dengan penggunaan unggun terfluidisasi (fluidized bed reactor) untuk sejumlah katalis yang sama (Finlayson 1971). Reaktor unggun diam digunakan secara luas untuk proses skala besar pada industri petroleum dan industri bahan-bahan kimia.
11 Terdapat dua hal yang harus dipertimbangkan ketika mengoperasikan reaktor unggun diam yaitu batasan difusi partikel dalam laju reaksi dan tingginya pressure drop sepanjang reaktor. Perpindahan eksternal dapat dikurangi pada penggunaan reaktor unggun diam dengan meningkatkan laju alir dari substrat dan menggunakan rasio tinggi kolom dan diameter reaktor. Partikel-partikel kecil dari katalis yang digunakan juga dapat mengurangi masalah tingginya pressure drop dalam reaktor (Napitupulu 2012).
3 METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan November 2014 sampai Juni 2015 di Laboratorium Teknologi Bioindustri, Badan Pengkajian dan Penerapan Teknologi (BPPT), Kawasan PUSPIPTEK Serpong, Tangerang Selatan.
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini antara lain: spektrofotometer Ultra Violet-Visible (U-2001, Hitachi, Jepang), shaker incubator (Kuhner, Swiss), magnetic stirrer (MR-3002, Heidolph, Jerman), vortex (Sargent-Welch, USA), neraca analitis, GC-MS, erlenmeyer, becker glass, pipet mikro, microtube (Eppendorf, Jerman), corong Buchner, vacum, spatula, labu ukur, reaktor fixed bed, waterbath.
Bahan-bahan yang digunakan dalam penelitian ini antara lain: lipase komersil cair (Habio Lipase, by Mianyang Habio Engineering Co., Ltd), minyak sawit, kitin, glutaraldehid 3%, heksametilendiamin 2%, buffer fosfat 0.05 M pH 7, Bovine Serum Albumin, reagen Bradford, olive oil, PVA (polivinylalkohol), metanol, n-heksana, air Reverse Osmosis, Comassie Brilliant Blue G-250, asam fosfat 85%, etanol 95%, kertas saring, standar GC-MS.
Prosedur Penelitian Imobilisasi Lipase Pada Kitin
12
lipase dengan variasi konsentrasi 0.044 mg mL-1, 0.088 mg mL-1,0.132 mg mL-1, 0.176 mg mL-1, 0.22 mg mL-1 dan 0.264 mg mL-1 kemudian diaduk pada kecepatan 150 rpm selama 3 jam. Setelah itu, campuran disimpan pada cold room dengan variasi waktu penyimpanan 14 jam, 16 jam, 18 jam, 20 jam, 22 jam dan 24 jam. Campuran kemudian disaring dan menghasilkan residu lipase amobil dan filtrat A. Residu lipase amobil dibilas dengan 25 mL n-heksana sebanyak 2 kali sehingga menghasilkan filtrat B dan C. Lipase amobil kemudian dikeringkan dengan vacum dan disimpan di dalam cold room. Filtrat A, B, dan C kemudian diuji kadar proteinnya menggunakan metode Bradford.
Membuat Reagen Bradford dan Kurva Standar BSA
Pembuatan larutan pereaksi bradford dilakukan dengan cara menambahkan 0.1 g Commassie Brilliant Blue G-250 ke dalam 50 mL Etanol 95% (v/v) kemudian diaduk dan ditambahkan 100 mL asam fosfor 85% lalu dihomogenkan. Kemudian ditambahkan H2O steril sampai volume 1000 mL. Campuran
dihomogenkan lalu disaring dengan kertas saring dan disimpan dalam botol yang berwarna gelap dengan suhu 4oC. Sebelum digunakan, reagen Bradford diencerkan 5 kali.
Larutan standar BSA dibuat dengan melarutkan 0.1 gram BSA di dalam 10 mL air mili-Q. Kemudian dilakukan pengenceran untuk mendapatkan konsentrasi BSA bertingkat. Setelah itu, sebanyak 1 mL reagen Bradford dimasukkan ke dalam microtube lalu ditambahkan 20 µL sampel. Sebagai blanko adalah air mili-Q. Kemudian sampel divortex dan diinkubasi selama 20 menit. Selanjutnya dilakukan pengukuran pada spektrofotometer UV-VIS U-2001 pada panjang gelombang 595 nm (Lampiran 1).
Analisa Derajat Imobilisasi
Masing-masing larutan lipase, filtrat A, filtrat B, dan filtrat C dianalisa kadar proteinnya menggunakan metode Bradford. Sebanyak 1 mL Bradford dimasukkan ke dalam microtube kemudian ditambahkan 20 µL sampel. Sebagai blanko adalah buffer fosfat 0.05 M pH 7. Kemudian sampel divortex dan diinkubasi selama 20 menit. Selanjutnya dilakukan pengukuran pada spektrofotometer UV-VIS U-2001 pada panjang gelombang 595 nm. Derajat imobilisasi merupakan perbandingan konsentrasi lipase sebelum dan setelah imobilisasi sehingga diperoleh persentase lipase yang terikat pada kitin. Perhitungan derajat imobilisasi mengikuti persamaan Mokodongan (2009), dapat dilihat pada Lampiran 2.
Uji Aktivitas Lipase
13
Transesterifikasi Enzimatik Minyak Sawit Secara Batch
Substrat berupa minyak sawit dan metanol dengan variasi perbandingan mol minyak dan metanol 1:3, 1:4, 1:5, dan 1:6 dimasukkan ke dalam erlenmeyer kemudian ditambahkan 1 gram kitin yang mengandung lipase amobil. Setelah itu diinkubasi pada suhu reaksi yang bervariasi yaitu 40 oC, 45 oC, 50 oC dan 55 oC. Reaksi berlangsung selama 8 jam. Campuran didekantasi sehingga menghasilkan residu lipase amobil dan filtrat produk. Filtrat produk dipanaskan pada suhu 80 oC untuk menginaktivasi enzim yang mungkin terlepas dari kitin.
Uji Stabilitas Enzim Amobil pada Proses Transesterifikasi dalam Reaktor Unggun Diam (Fixed Bed Reactor)
Diameter dari reaktor yang digunakan adalah 1.1 cm dengan panjang 15 cm. Jumlah katalis yang dibutuhkan sebanyak 3 gram diisikan ke dalam tabung reaktor sepanjang 10 cm. Reaksi transesterfikasi dilakukan secara kontinyu didalam reaktor tersebut. Substrat berupa minyak sawit dan metanol dengan rasio mol minyak dan metanol 1:4 dipompa menuju kolom reaktor dengan laju alir 0.2 mL menit-1. Suhu reaksi 45 oC dijaga konstan dengan cara mengalirkan air dalam jaket reaktor. Produksi dilakukan selama 50 jam tanpa henti, dengan pengambilan sampel dilakukan pada jam ke-0, jam ke-1 jam ke-5, jam ke-12, jam ke-24, jam ke-36, dan jam ke-50.
Analisis Konversi Trigliserida
Analisis konversi metil ester dilakukan di Pusat Laboratorium Forensik Mabes Polri, Jakarta Selatan. Konversi metil ester dianalisis menggunakan Gas Chromatography-Mass Spectrometry (GC-MS) (Hewlett-Packard 5890) dengan detektor MS dan kolom kapiler 15-m (DB-1 Angilent Technologies Inc, Palo Alto, CA) menggunakan metil palmitat sebagai standar analisis. Perhitungan % konversi metil ester (metil palmitat) yang diperoleh adalah:
Konsentrasi sampel x Luas area sampel
% konversi = x 100% Konsentrasi standar x Luas area standar
4 HASIL DAN PEMBAHASAN
Aktivasi Kitin Menggunakan Glutaraldehid
16
agen reaktif. Semakin lama waktu reaksi yang digunakan, semakin banyak lipase yang terikat pada support (Lee et al. 2006).
Waktu aktivasi 2 jam 30 menit dan 3 jam menunjukkan penurunan angka derajat imobilisasi. Aktivasi lebih dari dua jam menyebabkan ikatan yang terbentuk antara enzim dan kitin mudah terlepas. Hal ini terlihat dari tingginya kadar protein yang terkandung dalam hasil pembilasan kitin setelah proses imobilisasi. Migneault et al. (2004), menyatakan bahwa kekuatan ikatan cross-linking dipengaruhi oleh struktur konjugat yang terbentuk. Kitin yang diaktivasi lebih dari dua jam menunjukkan struktur yang keras dan kaku dibandingkan dengan kitin sebelum aktivasi maupun kitin yang diaktivasi kurang dari dua jam.
Hasil penelitian yang diperoleh menunjukkan bahwa waktu aktivasi yang menghasilkan derajat imobilisasi tertinggi adalah 1 jam 30 menit hingga 2 jam. Hasil ini tidak jauh berbeda dengan yang diperoleh Migneault et al. (2004) yang dalam penelitiannya melakukan ikatan silang antara glutaraldehid dengan tripsin. Ikatan silang bisa tercapai maksimal dengan waktu aktivasi sekitar 0.5 menit sampai 120 menit dalam larutan buffer fosfat 0.5 M pH 6.8. selain itu, Carneiro et al. (2014) mengaktivasi kitosan dengan glutaraldehid 2.5% selama 1 jam menghasilkan efesiensi imobilisasi sebesar 68.2%. Waktu aktivasi 1 jam 30 menit digunakan untuk proses imobilisasi selanjutnya dalam penelitian ini.
Pengaruh Konsentrasi Lipase
Konsentrasi lipase merupakan variabel yang digunakan dalam penelitian ini untuk mendapatkan banyak lipase yang terikat pada kitin. Konsentrasi enzim harus dipertimbangkan untuk mendapatkan banyak ikatan cross-linking terhadap enzim dan support. Dalam penelitian ini digunakan lipase Habio komersial cair. Pemilihan konsentrasi lipase yang digunakan didasarkan pada penelitian sebelumnya yang dilakukan oleh Mokodongan (2009) yang menggunakan lipase Habio komersial bubuk. Konsentrasi lipase Habio bubuk yang digunakan adalah 0.05 g mL-1 hingga 0.125 g mL-1. Konsentrasi murni dalam 0.05 g mL-1 lipase Habio padat adalah sebesar 0.044 mg mL-1. Oleh karena itu, variasi konsentrasi lipase yang digunakan pada penelitian ini adalah 0.044 mg mL-1, 0.088 mg mL-1, 0.132 mg mL-1, 0.176 mg mL-1, 0.22 mg mL-1 dan 0.264 mg mL-1 yang diencerkan dari stok lipase Habio cair dengan konsentrasi 88 mg mL-1.
Tabel 3 Pengaruh konsentrasi lipase terhadap derajat imobilisasi
Konsentrasi lipase (mg mL-1) Derajat imobilisasi (%)
17 Untuk konsentrasi enzim yang lebih besar yakni 0.264 mg mL-1, juga menghasilkan derajat imobilisasi yang lebih rendah dibandingkan konsentrasi 0.22 mg mL-1, yaitu sebesar 63.17%. Menurut Migneault et al. (2004), konsentrasi enzim yang rendah cenderung mengakibatkan gugus fungsional glutaraldehid berikatan dengan enzim yang sama sedangkan konsentrasi enzim yang terlalu tinggi menyebabkan ikatan cross-linking yang terbentuk sedikit akibat adanya pengendapan enzim. Artinya, dalam konsentrasi yang rendah, kitin akan berikatan dengan enzim yang sama karena jumlah enzim yang kurang sehingga menghasilkan derajat imobilisasi yang rendah. Dalam konsentrasi enzim yang terlalu tinggi, maka kitin juga akan mengikat enzim dalam jumlah yang sedikit akibat terjadinya pengendapan enzim. Oleh karena itu, konsentrasi enzim yang digunakan dalam proses imobilisasi dalam kondisi penelitian ini adalah 0.22 mg mL-1. Dari penelitian sebelumnya yang dilakukan oleh Mokodongan (2009), menggunakan lipase Habio bubuk yang diimobilisasi pada kitin. Untuk 1 g kitin yang digunakan sebagai support dibutuhkan 0.075 g mL-1 lipase bubuk dan menghasilkan derajat imobilisasi sebesar 49.82%.
Pengaruh Waktu Inkubasi
Proses imobilisasi lipase pada kitin melewati tahapan inkubasi kitin aktif (telah diberi perlakuan sebelumnya dengan heksametilendiamin dan glutaraldehid) dalam larutan lipase. Proses inkubasi ini terdiri dari fase dinamis dan fase statis. Fase dinamis yaitu fase dimana kitin direndam dalam larutan lipase dengan konsentrasi tertentu dan dilakukan pengadukan selama 3 jam. Sementara itu, fase statis merupakan kelanjutan dari fase dinamis, dimana kitin dan enzim diinkubasi dalam cold room (4 oC). Menurut Setyahadi et al. (2011), waktu inkubasi lipase dengan kitin (inkubasi secara statis) menentukan banyaknya lipase yang terikat pada kitin. Oleh karena itu, dalam penelitian ini dilakukan variasi waktu inkubasi fase statis yaitu 14 jam, 16 jam, 18 jam, 20 jam, 22 jam dan 24 jam.
Tabel 4 Pengaruh waktu inkubasi terhadap derajat imobilisasi
Waktu inkubasi (jam) Derajat imobilisasi (%)
18
inkubasi 18 jam sudah optimal dalam proses imobilisasi lipase pada kitin. Setyahadi et al. (2011) melakukan imobilisasi lipase pada kitin dengan waktu inkubasi selama 18 jam menghasilkan derajat imobilisasi dan enzyme loading masing-masing sebesar 60% dan 14.23 mg gkitin-1. Sama halnya dengan penelitian Gomes et al. (2004), yang melakukan inkubasi selama 18 jam dalam proses imobilisasi lipase Candida rugosa pada matriks kitin.
Aktivitas Lipase Amobil
Lipase amobil yang digunakan dalam proses transesterifikasi diimobilisasi dengan perlakuan yang terbaik yang telah diperoleh sebelumnya, yaitu waktu aktivasi kitin selama 1 jam 30 menit, konsentrasli lipase yang digunakan adalah 0.22 mg mL-1, dan waktu inkubasi kitin dalam larutan lipase selama 18 jam. Aktivitas lipase amobil dan lipase bebas juga telah dipelajari menggunakan metode titrasi, dimana diperoleh aktivitas lipase amobil sebesar 10000 U gram-1 dan aktivitas lipase bebas sebesar 18500 U mL-1 (Lampiran 3). Dari uji aktivitas tersebut, diketahui bahwa terjadi penurunan aktivitas enzim setelah dilakukan proses imobilisasi. Hal ini mungkin disebabkan oleh reaksi antara glutaraldehid dan enzim yang menyebabkan terjadinya perubahan konformasi molekul enzim yang berupa modifikasi asam amino baik pada sisi aktif maupun sisi non aktif (Chui dan Wan 1997). Glutaraldehid dapat bereaksi dengan gugus sulfuhidril pada sisi aktif enzim sehingga dapat menghambat aktivitas enzim tersebut (Goldstein dan Manecke 1976). Daya katalitik dan stabilitas lipase amobil juga dapat dipengaruhi oleh faktor lingkungan terutama gugus fungsi reaktif enzim pada pusat aktif. Menurut Suhartono (1989) aktivitas enzim imobil dapat menurun karena kondisi operasional yang menimbulkan denaturasi enzim atau molekul penyangga selama proses operasi. Penurunan aktivitas selama operasi dipengaruhi oleh kecepatan aliran substrat atau pelarut lain selama proses operasi selain perubahan pH, suhu, kekuatan ion dan kondisi fisik lainnya. Perubahan pH optimum dari lipase amobil disebabkan oleh terbentuknya ion asam (H+) yang dihasilkan ketika aldehida dan amina bergabung dengan cepat membentuk suatu kompleks yang memiliki nilai pKa yang jauh lebih rendah dari amina induk. Semakin banyak amina yang bereaksi, semakin banyak pula asam yang dihasilkan, akibatnya semakin rendah nilai pKa sehingga pH optimum menjadi lebih asam (Migneault et al. 2004).
19
keuntungan dari imobilisasi enzim yakni dapat digunakan terus-menerus dan berkali-kali dengan stabilitas yang lebih tinggi dibanding lipase bebas dan mudah dilakukan pemisahan antara enzim dan media reaksi.
Pengaruh Suhu Reaksi Terhadap Konversi Metil Ester
Setiap enzim memiliki suhu reaksi optimum masing-masing. Secara umum, reaksi transesterifikasi dengan katalis basa terjadi pada titik didih alkohol, namun transesterifikasi menggunakan lipase amobil sebagai katalis dapat menggunakan suhu yang lebih rendah. Hal ini bertujuan untuk mencegah hilangnya aktivitas lipase (Shimada et al. 2001). Pada penelitian ini, suhu reaksi transesterifikasi menggunakan lipase amobil dipelajari untuk mendapatkan konversi metil ester yang tinggi. Suhu divariasikan antara 40 oC, 45 oC, 50 oC, dan 55 oC. Pemilihan variasi suhu didasarkan pada profil lipase komersial yang digunakan. Lipase komersial tersebut memiliki aktivitas yang tinggi pada rentang suhu 40 oC sampai 65 oC. Rasio mol minyak dan metanol yang digunakan adalah 1:3 mol. Reaksi belangsung selama 8 jam. Konversi metil ester yang dihasilkan sebagai berikut:
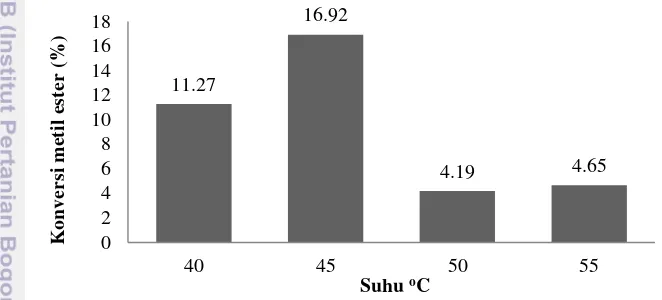
Gambar 7 Pengaruh suhu reaksi terhadap konversi metil ester
Gambar 7 menunjukkan bahwa konversi metil ester yang dihasilkan meningkat dari suhu 40 oC hingga suhu 45 oC yakni 11.27% pada suhu 40 oC dan 16.92% pada suhu 45 oC. Sementara itu, pada suhu 50 oC dan 55 oC konversi metil ester mengalami penurunan. Berdasarkan hal tersebut, maka suhu 45 oC merupakan suhu yang optimum untuk digunakan dalam proses transesterifikasi selanjutnya meskipun dengan nilai konversi yang masih kecil. Egwim et al. (2012), mempelajari efek suhu reaksi terhadap biodiesel yield.. Suhu yang digunakan berkisar antara 30 oC hingga 60 oC. Biodiesel yield terus meningkat hingga suhu 40 oC yakni sebesar 61% kemudian mengalami penurunan pada suhu 50 oC.
20
penelitian ini menghasilkan konversi metil ester tertinggi pada suhu 45 oC. Ikatan kovalen yang digunakan dalam proses imobilisasi memberikan stabilitas termal yang lebih tinggi bagi lipase amobil karena interaksi yang kuat antara molekul enzim dan support (Brena dan Batista-Viera 2006). Nie et al. (2006) melakukan imobilisasi lipase dengan metode adsorpsi yang digunakan untuk memproduksi biodiesel. Konversi biodiesel tertinggi diperoleh mulai pada suhu 27 oC hingga 40 o
C stabil pada konversi sebesar 87%. Sedangkan pada suhu diatas 40 oC, lipase amobil mengalami penurunan aktivitas. Hal ini disebabkan oleh ikatan antara support dan lipase tidak kuat sehingga pada suhu yang lebih tinggi, lipase terlepas dan mengalami kerusakan. Xie dan Ma (2009), melakukan imobilisasi lipase pada senyawa nanopartikel dengan metode ikatan kovalen. Aktivitas lipase amobil stabil mulai dari suhu 35 oC hingga suhu 45 oC sebesar 85%.
Pengaruh Rasio Mol Minyak dan Metanol Terhadap Konversi Metil Ester
Rasio mol minyak dan mentanol mempengaruhi besar-kecilnya konversi metil ester yang dihasilkan. Kelebihan rasio mol metanol terhadap minyak diperlukan untuk memperoleh laju reaksi yang lebih cepat, selama alkohol dapat larut dengan baik dalam substrat tersebut (Antczak et al. 2009). Kelarutan alkohol menjadi faktor pembatas karena dapat mempengaruhi aktivitas enzim amobil yang digunakan (Ghaly et al. 2010). Biasanya dalam sistem terlarut, rasio mol minyak dan metanol yang banyak digunakan adalah 1:3 hingga 1:6. Pada penelitian ini, rasio mol minyak dan metanol yang digunakan dalam reaksi transesterifikasi adalah 1:3 mol, 1:4 mol, 1:5 mol dan 1:6 mol. Suhu reaksi yang digunakan adalah 40 oC, selama 8 jam reaksi.
Gambar 8 Pengaruh rasio mol minyak dan metanol terhadap konversi metil ester
21 melebihi kebutuhan stoikiometri (Fessenden R & Fessenden J 1986). Reaksi transesterifikasi 1 mol trigliserida membutuhkan 3 mol metanol. Jumlah mol metanol yang melebihi kebutuhan, menghasilkan konversi metil ester yang lebih besar seperti yang dihasilkan pada penelitian ini. Jeong dan Park (2007), melakukan melakukan transesterifikasi menggunakan lipase sebagai katalis. Konversi tertinggi diperoleh pada rasio minyak dan metanol 1:4 yaitu sebesar 72%. Nasratun et al. (2009) melakukan transesterifikasi menggunakan lipase amobil sebagai katalis pada kondisi rasio mol minyak dan metanol 1:4 menghasilkan konversi ester sebesar 72.25%.
Jumlah mol metanol yang terlalu tinggi juga dapat menurunkan aktivitas enzim amobil, dimana rasio mol minyak dan metanol 1:5 dan 1:6 pada penelitian ini menghasilkan konversi yang lebih rendah daripada 1:4 yaitu masing-masing 19.52% dan 16.62%. Hal ini menunjukkan bahwa metanol dalam jumlah yang banyak dapat menghambat aktivitas enzim. Alkohol mendenaturasi protein dengan memutuskan ikatan hidrogen intramolekul pada rantai samping protein. Ikatan hidrogen yang baru dapat terbentuk antara alkohol dan rantai samping protein tersebut. Hal ini menyebabkan aktivitas enzim amobil menurun bahkan hilang. Hasil ini sesuai dengan penelitian yang dilakukan oleh Kose et al. (2002) yang menghasilkan konversi metil ester tertinggi pada rasio mol minyak dan metanol 1:4 yaitu sebesar 87.4%. Aktivitas enzim amobil dan konversi metil ester menurun pada rasio mol minyak dan metanol 1:5 dan 1:6. Selain itu, Nasratun et al. (2009), telah melakukan reaksi transesterifikasi menggunakan rasio minyak dan metanol 1:4 dan 1:6. Konversi ester tertinggi diperoleh pada rasio mol minyak dan metanol 1:4 yaitu sebesar 71.25%, sedangkan pada rasio 1:6 menghasilkan konversi ester sebesar 62.50%.
Uji Stabilitas Enzim Amobil pada Proses Transesterifikasi dalam Reaktor Unggun Diam (Fixed Bed Reactor)
22
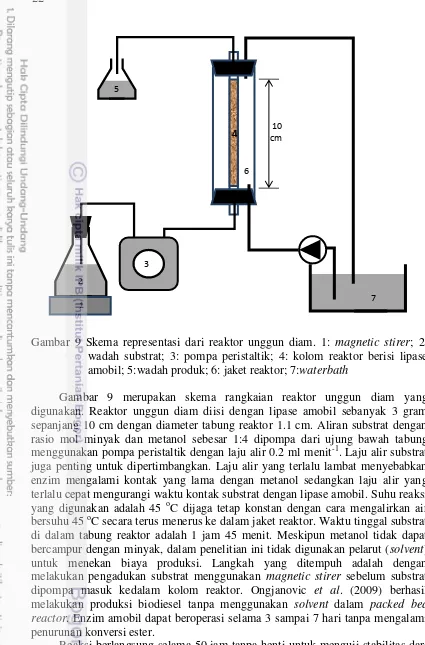
Gambar 9 Skema representasi dari reaktor unggun diam. 1: magnetic stirer; 2: wadah substrat; 3: pompa peristaltik; 4: kolom reaktor berisi lipase amobil; 5:wadah produk; 6: jaket reaktor; 7:waterbath
Gambar 9 merupakan skema rangkaian reaktor unggun diam yang digunakan. Reaktor unggun diam diisi dengan lipase amobil sebanyak 3 gram sepanjang 10 cm dengan diameter tabung reaktor 1.1 cm. Aliran substrat dengan rasio mol minyak dan metanol sebesar 1:4 dipompa dari ujung bawah tabung menggunakan pompa peristaltik dengan laju alir 0.2 ml menit-1. Laju alir substrat juga penting untuk dipertimbangkan. Laju alir yang terlalu lambat menyebabkan enzim mengalami kontak yang lama dengan metanol sedangkan laju alir yang terlalu cepat mengurangi waktu kontak substrat dengan lipase amobil. Suhu reaksi yang digunakan adalah 45 oC dijaga tetap konstan dengan cara mengalirkan air bersuhu 45 oC secara terus menerus ke dalam jaket reaktor. Waktu tinggal substrat di dalam tabung reaktor adalah 1 jam 45 menit. Meskipun metanol tidak dapat bercampur dengan minyak, dalam penelitian ini tidak digunakan pelarut (solvent) untuk menekan biaya produksi. Langkah yang ditempuh adalah dengan melakukan pengadukan substrat menggunakan magnetic stirer sebelum substrat dipompa masuk kedalam kolom reaktor. Ongjanovic et al. (2009) berhasil melakukan produksi biodiesel tanpa menggunakan solvent dalam packed bed reactor. Enzim amobil dapat beroperasi selama 3 sampai 7 hari tanpa mengalami penurunan konversi ester.
Reaksi berlangsung selama 50 jam tanpa henti untuk menguji stabilitas dari lipase amobil yang digunakan. Salah satu tujuan dilakukannya imobilisasi enzim adalah untuk melihat apakah enzim tersebut dapat digunakan terus menerus dalam
1 2
3
6 4 5
7 10
23 selama 50 jam reaksi tanpa henti.
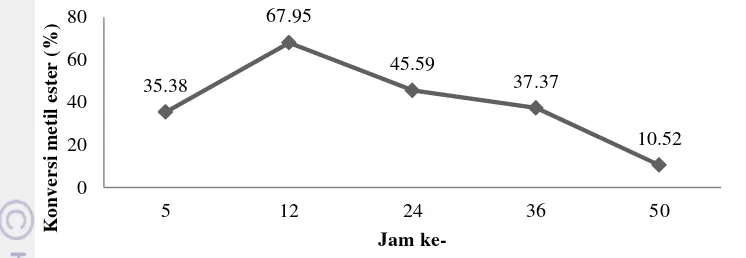
Gambar 10 Konversi metil ester secara kontinyu selama 50 jam
Konversi metil ester yang berlangsung secara kontinyu diperoleh sebesar 67.95% dan terus menurun seiring pertambahan waktu produksi yakni sebesar 10.52%. Hasil ini menunjukkan bahwa enzim amobil yang digunakan memiliki stabilitas yang rendah dalam penggunaan jangka panjang jika dibandingkan dengan penelitian lain yang serupa. Hama et al. (2011), melakukan uji kestabilan lipase amobil pada sintesis metil ester dalam packed bed reactor. Reaktor ini terdiri dari lima kolom reaktor yang dirangkaikan berseri dimana proses sintesis berlangsung secara kontinyu. Metil ester yang dihasilkan sebesar 96% dan tidak terjadi perubahan aktivitas enzim amobil secara signifikan selama 550 jam waktu produksi. Sementara itu Chen et al. (2009) melakukan produksi biodiesel secara kontinyu dari minyak goreng bekas menggunakan lipase Candida yang telah diimobilisasi. Reaksinya menggunakan n-heksan sebagai solvent. Suhu reaksi yang digunakan 45 oC, dengan laju alir 1.2 mL menit-1 dan rasio mol minyak dan metanol 1:4. Konversi biodiesel yang dihasilkan sebesar 91.08% dan mengalami penurunan setelah 100 jam yaitu sebesar 76.74%.
24
akibatnya semakin rendah nilai pKa sehingga pH optimum menjadi lebih asam (Migneault et al. 2004).
Untuk aplikasi selanjutnya dengan penggunaan jenis reaktor yang sama, perlu dilakukan beberapa modifikasi untuk menghasilkan konversi metil ester yang tinggi dan tetap mempertahankan kestabilan enzim amobil dalam jangka waktu pemakaian yang panjang. Beberapa modifikasi yang bisa dilakukan diantaranya adalah: 1) meningkatkan waktu tinggal substrat di dalam reaktor sehingga kontak antara substrat dan enzim lebih lama. Kontak enzim-substrat yang lebih lama akan menghasilkan konversi produk yang lebih banyak; 2) modifikasi aliran substrat masuk ke dalam tabung reaktor agar terjadi percampuran yang merata antara minyak dan metanol; 3) Hama & Kondo (2013), mengemukakan bahwa perlu dilakukan modifikasi reaktor dengan penambahan beberapa seri kolom reaktor yang disertai dengan tangki pemisah gliserol. Produk yang dihasilkan akan masuk ke dalam tangki pemisah gliserol untuk memisahkan gliserol dengan produk. Produk transesterifikasi dipompa kembali masuk ke seri kolom reaktor selanjutnya untuk proses transesterifikasi dan proses ini berlangsung terus-menerus hingga seri kolom reaktor terakhir; 3) untuk mendapatkan percampuran yang baik antara minyak dan metanol dapat digunakan solvent baik berupa senyawa n-heksan maupun tert-butanol. Selain itu, solvent juga berfungsi untuk mengurangi efek toksik dari metanol dengan menurunkan konsentrasi metanol dalam substrat (Lukovi et al. 2011; Chen et al. 2009).
5 SIMPULAN DAN SARAN
Simpulan
Kesimpulan dari penelitian ini adalah sebagai berikut:
1. Waktu aktivasi kitin, konsentrasi lipase dan waktu inkubasi yang menghasilkan nilai derajat imobilisasi tertinggi adalah masing-masing 1 jam 30 menit, 0.22 mg mL-1 dan 18 jam.
2. Suhu reaksi dan rasio perbandingan mol minyak dan metanol yang menghasilkan konversi metil ester tertinggi adalah 45 oC dan 1:4.
3. Proses transesterifikasi dalam reaktor unggun diam (fixed bed reactor) menghasilkan konversi metil ester tertinggi pada jam ke-12 yaitu 67.95% dan stabilitasnya terus mengalami penurunan hingga 50 jam waktu produksi.
Saran
25
DAFTAR PUSTAKA
Aehle W. 2004. Enzymes in Industry, Production and Aplication. Netherland (NL): Wiley-VcH Verlag GmbH & Co. KgaA Weinheim.
Antczak MS, Kubiak A, Antczak T, Bielecki S. 2009. Enzymatic biodiesel synthesis-key factors affecting efficiency of the process. Renew. Energy. 34:1185-1194.
Anwar A, Qader SAU, Raiz A, Iqbal S, Azhar A. 2009. Calcium alginate: a support material for immobilization of proteases from newly isolated of Bacillus subtilis KIBGE-HAS. World. Appl. Sci. J. 7(10):1281-1286. Arita S. 2009. Proses pembuatan biodiesel di dalam reaktor unggun diam (Fixed
bed reactor) dengan katalis padat aluminia berbasis logam. Prosiding seminar nasional daur bahan bakar; 2009 Oktober 13; Serpong; Indonesia. Serpong (ID). ISSN 1693-4687.
Betancor L, López-Gallego F, Alonso-Morales N, Dellamora G, Mateo C, Fernandez-Lafuente R, Guisan JM. 2006. Glutaraldehyde in protein
immobilization: a versatile reagent. Methods in Biotechnology:
Immobilization of Enzymes and Cells, Second Edition. Totowa (US):
Humana Press Inc.
Brena BM, Batista-Viera F. 2006. Immobilization of Enzymes, Immobilization of Enzymes and Cells. Spanyol: Humana Press.
Buasri A, Chaiyut N, Luryuenyong V, Rodklum C, Chaikwan T, Kumphan N. 2012. Continous process for biodiesel production in packed bed reactor from waste frying oil using potassium hydroxide supported on Jatropha curcas fruit shell as solid catalyst. Appl. Sci. 2:641-653.
Cao L. 2005. Carrier-Bound Immobilization Enzymes. Germany (DE): WILLEY-VCH Verlag GmbH & Co. KgaA Weinheim.
Carneiro LABC, Costa-Silva TA, Souza CRF, Bachmann L, Oliveira WP, Said S. 2014. Immobilization of lipases produced by the endophytic fungus Cercospora kikuchii on chitosan microparticles. Braz. Arch. Biol. Technol. vol.57(4):578-586.
Charuchinda S, Kensingh P, Chulalaksananukul W. 2013. Immobilization of the Candida rugosa lipase onto a Scirpus grossus L.f. fiber as biocatalyst for biodiesel synthesis via hydrolysis-esterification. Afr. J. Biotechnol. 12(44):6326-6334.
Chen HC, Ju HY, Wu TT, Liu YC, Lee CC, Chang C, Chung YL, Shieh CJ. 2010. Continous production of lipase-catalyzed biodiesel in a packed bed reactor:optimization and enzyme reuse study. J. Biomed. Biotechnol. 2011:7.
Chen Y, Xiao B, Chang J, Fu Y, Lv P, Wang X. 2009. Synthesis of biodiesel from waste cooking oil using immobilized lipase in fixed bed reactor. Energy. Convers. Manag. 50(3):668-673.
Chui WK, Wan LS. 1997. Prolonged retention of cross-linked trypsin in calcium alginate microspheres. J. Microencapsulation. 14:51-61.
26
Dizge N, Keskinler B. 2008. Enzymatic production of biodiesel from canola oil using immobilized lipase. Biomass And Bioenergy 32:1274-1278.
Egwim EC, Adesina AA, Oyewole OA, Okoliegbe IN. 2012. Optimization of lipase immobilized on chitosan beads for biodiesel production. Glo. Adv. Res. J. Microbiol. 2(2):103 –112.
Fessenden RJ, Fessenden JS. 1986. Kimia Organik, edisi ketiga, jilid 2. Jakarta (ID): Erlangga.
Finlayson BA. 1971. Packed bed reactor analysis by orthogonal collocation. Chem. Eng. Sci. 26:1081-1091.
Fukuda H, Kondo A, Noda H. 2001. Review biodiesel fuel production by transesterification of oil. J. Biosci. Bioeng. 92(5):405-416.
Ghaly AE, Dave D, Brooks MS, Budge S. 2010. Review: Production of biodiesel by enzymatic transesterification. Am. J. Biochem. Biotechnol. 6(2):54-76. Goldstein L, Mannecke G. 1976. The chemistry of enzyme immobilization. Di
dalam: L.B. Wingard, E. Katchalski, L. Goldstein, editor. Appl. Biochem. Bioeng. New York (US): Academic Pr.
Gomes FM, Pereira EB, de Castro HF. 2004. Immobilization of lipase on chitin and its use in nonconventional biocatalysis. Biomacromolecules. 5:17-23. Hama S, Kondo A. 2013. Enzymatic biodiesel production: an overview of
potential feedstocks and process development. Bioresource. Techn 135:386-395.
Hama S, Tamalampudi S, Yoshida A, Tamadani N, Kuratani N, Noda H, Fukuda H, Kondo A. 2011. Process engineering and optimization of glycerol separation in a packed-bed-reactor for enzymatic biodiesel production. Bioresource. Techn.102:10419-10424.
Jeong GT, Park DH. 2007. Lipase-catalyzed transesterification of rapeseed oil for biodiesel production with tert-butanol. Appl. Biochem. Biotechnol. 148:131-139.
Kose O, Tuter M, Aksoy HA. 2002. Immobilized Candida antarctica lipase-catalyzed alcoholysis of cotton seed oil in a solvent-free medium. Bioresource. Techn. 83(2):125-129.
Lee DH, Park CH, Yeo JM, Kim SW. 2006. Lipase immobilization on silica gel using a cross-linking method. J. Ind. Eng. Chem. 12(5):777-782.
Lukovi N, Kneževi -Jugovi Z, Bezbradica D. 2011. Biodiesel Fuel Production by Enzymatic Transesterification of Oils: Recent Trends, Challenges and Future Perspectives. Serbia (RS): Faculty of Technology and Metallurgy University of Belgrade.
Mangunwidjaja D, Suryani A. 1994. Teknologi Bioproses. Jakarta (ID): Penebar Swadaya.
Miao Y, Tan SN. 2000. Amperometric hydrogen peroxide biosensor based on immobilization of peroxidase in chitosan matrix crosslinked with glutaraldehyde. Analyst. 125:1591–1594.
Migneault I, Dartiguenave C, Bertrand MJ, Waldron KC. 2004. Glutaraldehyde: behavior in aqueous solution, reaction with proteins, and application to enzyme crosslinking. BioTechniques. 37:790-802.
27 Moreira ABR, Perez VH, Zanin GM, Castro HF. 2007. Biodiesel synthesis by enzymatic transesterification of palm oil with ethanol using lipases from several sources immobilized on silica–PVA composite. Energy & Fuels. 21(36):3689–3694.
Moreno-Piraja’n JC, Giraldo L. 2011. tudy of immo ilized candida rugosa lipase for biodiesel fuel production from palm oil by flow microcalorimetry. Arabian. J. Chemistry. 4:55–62.
Nagi J, Ahmed SK, Nagi F. 2008. Palm biodiesel an alternative green renewable energy for the energy demands of the future. ICCBT. 7:79-94.
Napitupulu EC. 2012. Scale up produksi biodiesel rute non alkohol dalam reaktor unggun isian [Skripsi]. Depok (ID): Program Studi Ekstensi Teknik Kimia Fakultas Teknik Universitas Indonesia.
Narwal KN, Gupta R. 2012. Biodiesel production by transesterification using immobilized lipase. Biotechnol. Lett. 35:479–490.
Nasratun M, Said HA, Noraziah A, Alla ANA. 2009. Immobilization of lipase from Candida rugosa on chitosan beads for transesterification reaction. Am. J. Applied. Sci. 6(9):1653-1657.
Nie K, Xie F, Wang F, Tan T. 2006. Lipase catalyzed methanolisis to produce biodiesel:optimization of the biodiesel production. J. Mol. Catal. B: Enz. 43:142-147.
Noureddini H, Gao H, Philkana RS. 2005. Immobilized Pseudeumonas cepacia lipase for biodiesel fuel production from soybean oil. Bioresource. Techn. 96:769-777.
O’Brien RD. 1998. Fats and Oils, Formulating and Processing for Applications. USA: Technomic Publishing Campany.
Ongjanovic N, Bezbradica D, Knezevic-Jugovic Z. 2009. Enzymatic conversion of sunflower oil to biodiesel in a solvent-free system: process optimization and the immobilized system stability. Bioresource. Techn. 100: 5146-5154. Pasaribu N. 2004. Minyak Buah Kelapa Sawit. e-USU Repository. Medan (ID):
Jurusan Kimia, FMIPA Universitas Sumatera Utara.
Redjoso MT. 2007. Reaksi Hidrolisis Minyak Zaitun Menggunakan Lipase Spesifik yang Diimobilisasi dengan Metode Adsorpsi [Skripsi]. Depok (UI): Departemen Teknik Kimia Fakultas Teknik Universitas Indonesia. Rinaudo M. 2006. Chitin and chitosan: properties and applications. Prog. Polym.
Sci. 31:603-632.
Robles-Medina A, Gonzales-Moreno PA, Esteban-Cerdan L, Molina-Grima E. 2009. Biocatalysis: Towards ever greener biodiesel production. Biotechnology Advances. 27(4):398-408.
Salis A, Monduzzi M, Solinas V. 2007. Use of lipases for the production of biodiesel. J Polaina and A P MacCabe (eds.), Industrial Enzymes. 317-339. Setyahadi S, Machsum AL, Mokodongan RS. 2011. Kitin sebagai Penopang untuk Amobilisasi Lipase pada Proses Trans-esterifikasi Trigliserida. Pengembangan Teknologi Kimia untuk Pengolahan Sumber Daya Alam Indonesia. Prosiding Seminar Nasional Teknik Kimia Kejuangan. 2011 Februari 22; Yogyakarta Indonesia .ISSN 1693 – 4393.
28
Suhartono MT. 1989. Enzim dan Bioteknologi. Bogor (ID): Departemen Pendidikan dan Kebudayaan, Institut Pertanian Bogor.
Sujoy B, Aparna A. 2013. Enzymology, immobilization and applications of ureases enzyme. Int. Res. J. Biological. Sci. 2(6):51-56.
Vasudevan PT, Briggs M. 2008. Biodiesel production-current state of the art and challenges. Ind. Microbiol. Biotechnol. A. 35:421–430.
Watanabe Y, Shimada Y, Sugihara A, Noda H, Fukuda H, Tominga Y. 2001. Continous production of biodiesel fuel from vegetable oil using immobilized Candida antartica lipase. J. Am. Chem. Soc. 77(4):335-360. Wrinkler FK, D’Arcy A, Hunzker W. 1990. tructure of human pancreatic lipase.
Nature. 343:771-774.
Xie W, Ma N. 2009. Immobilized lipase on Fe3O4 nanoparticles as biocatalyst for biodiesel production. Energy & Fuel. 23:1347–1353.
You Q, Yin X, Zhao Y, Zhang Y. 2013. Biodiesel production from jatropha oil catalyzed by immobilized Burkholderia cepacia lipase on modified attapulgite. Bioresource. Techn. 148:202–207.