PENAPISAN BAKTERI ASOSIATIF
KARANG LUNAK (Octocorallia; Alcyonacea)
Sinularia dura DAN Lobophytum strictum YANG POTENSIAL
SEBAGAI ALTERNATIF PENANGANAN MICROFOULING
DI LAUT
RAIJ BASTILA SUTIA
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul
PENAPISAN BAKTERI ASOSIATIF KARANG LUNAK (Octocorallia; Alcyonacea) Sinularia dura DAN Lobophytum strictum YANG POTENSIAL SEBAGAI ALTERNATIF PENANGANAN MICROFOULING DI LAUT
adalah benar merupakan hasil karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir Skripsi ini.
RINGKASAN
RAIJ BASTILA SUTIA. Penapisan Bakteri Asosiatif Karang Lunak (Octocorallia; Alcyonacea) Sinularia dura dan Lobophytum strictum yang Potensial sebagai Alternatif Penanganan Microfouling di Laut. Dibimbing oleh DEDI SOEDHARMA dan MEUTIA SAMIRA ISMET.
Microfouling (pembentukan biofilm) merupakan syarat utama terjadinya
biofouling, sehingga untuk melakukan penghambatan terjadinya biofouling pada struktur bangunan laut dapat dilakukan dengan menghambat terjadinya biofilm. Beberapa mikroorganisme laut seperti bakteri yang berasosiasi dengan karang lunak mampu menghasilkan sejumlah metabolit sekunder yang dapat menghambat pertumbuhan biofilm. Tujuan dari penelitian ini adalah mencari bakteri asosiasi potensial dari karang lunak Sinularia dura dan Lobophytum strictum yang dapat menghasilkan senyawa bioaktif sebagai sumber anti-microfouling alami.
Penelitian ini dilakukan pada bulan Mei hingga Agustus 2011. Penelitian dibagi menjadi beberapa tahap, yaitu pengambilan sampel karang lunak jenis
Sinularia dura dan Lobophytum strictum, penjebakan biofilm bakteri, isolasi bakteri, dan uji antagonisme. Pengambilan sampel karang lunak dan penjebakan
biofilm bakteri dilakukan pada waktu dan tempat yang sama yaitu di perairan Barat pulau Pramuka, Kepulauan Seribu. Uji antagonisme dilakukan antara bakteri asosiasi karang lunak terhadap bakteri pembentuk biofilm dengan metode difusi agar. Parameter kualitas perairan (fisika-kimia) yang diukur sebagai data penunjang meliputi suhu, kadar garam, kecerahan, pH, nitrat, fosfat, TSS, dan COD.
© Hak cipta milik Raij Bastila Sutia, tahun 2011
Hak cipta dilindungi
PENAPISAN BAKTERI ASOSIATIF
KARANG LUNAK (Octocorallia; Alcyonacea)
Sinularia dura DAN Lobophytum strictum YANG POTENSIAL
SEBAGAI ALTERNATIF PENANGANAN MICROFOULING
DI LAUT
RAIJ BASTILA SUTIA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada
Departemen Ilmu dan Teknologi Kelautan
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul : PENAPISAN BAKTERI ASOSIATIF KARANG LUNAK (Octocorallia; Alcyonacea) Sinularia dura
DAN Lobophytum strictum YANG POTENSIAL
SEBAGAI ALTERNATIFPENANGANAN MICROFOULING DI LAUT
Nama : Raij Bastila Sutia
NRP : C54070024
Departemen : Ilmu dan Teknologi Kelautan
Menyetujui,
Komisi Pembimbing
Dosen Pembimbing I Dosen Pembimbing II
Prof. Dr. Ir. Dedi Soedharma, DEA Meutia Samira Ismet, S.Si., M.Si NIP. 19460218 197301 1 001 NIP. 19800325 200701 2 002
Mengetahui, Ketua Departemen
Prof. Dr. Ir. Setyo Budi Susilo, M.Sc NIP. 19580909 198303 1 003
KATA PENGANTAR
Puji syukur Penulis panjatkan kepada Allah SWT atas segala karunia-Nya, sehingga penulis dapat menyelesaikan skripsi dengan judul Penapisan Bakteri Asosiatif Karang Lunak (Octocorallia; Alcyonacea) Sinularia dura dan
Lobophytum strictum sebagai Alternatif Penanganan Microfouling di Laut.
Penulis mengucapkan banyak terimakasih kepada seluruh pihak yang telah membantu proses penyelesaian skripsi ini, diantaranya kepada:
1) Mamah, Bapak, Kakak, Adek serta Putu Mandala atas kasih sayang, doa, dukungan, nasehat, semangat, kesabaran dan bantuannya baik moril maupun materil.
2) Prof. Dr. Ir. Dedi Soedharma, DEA dan Meutia Samira Ismet, S.Si., M.Si selaku dosen pembimbing atas segala bimbingan, pengarahan, serta segala penjelasan sehingga penulis dapat menyelesaikan skripsi ini.
3) Dr. Iriani Setyaningsih, MS selaku penguji sidang atas masukan, nasehat dan pengarahan yang diberikan.
4) Dr. Bintang Marhaeni, S.Si., M.Si yang telah memberikan motivasi, bimbingan, dan pengarahan dalam penelitian saya.
5) Ibu Heni, Pak Jaka, Kak Putri selaku laboran di Laboratorium Mikrobiologi yang telah banyak membantu dalam penelitian ini.
Kesempurnaan skripsi ini tidak terlepas dari segala kritik dan saran yang membangun dari semua pihak. Semoga skripsi ini dapat bermanfaat bagi pihak-pihak yang membutuhkannya.
DAFTAR ISI
2.3. Senyawa Bioaktif sebagai Sumber Antifoulant Alami ... 8
2.4. Aktifitas Biofouling di laut ... 10
2.5. Permasalahan dan Upaya Penanggulangan Biofouling di laut ... 12
3. METODOLOGI PENELITIAN ... 15
4.1. Pengamatan Parameter Fisika-Kimia Perairan ... 24
4.2. Identifikasi Karang Lunak ... 26
4.3. Isolasi Bakteri Asosiatif Karang Lunak (Sddan Ls) ... 28
4.4. Isolasi Bakteri Pembentuk Biofilm ... 31
4.5. Uji Hambat (Uji Antagonisme) Bakteri Asosiasi Karang Lunak terhadap Petumbuhan Bakteri Pembentuk Biofilm ... 34
5. KESIMPULAN DAN SARAN ... 43
5.1. Kesimpulan ... 43
5.2. Saran ... 43
DAFTAR PUSTAKA ... 44
DAFTAR TABEL
Halaman
1. Senyawa terpenoid dari beberapa jenis karang lunak ... 9
2. Natural Product Antifouling (NPA) yang diisolasi dari beberapa jenis karang lunak ... 14
3. Hasil analisis parameter kualitas lingkungan perairan (fisika-kimia) pada lokasi pengambilan sampel karang lunak ... 24
4. Jumlah koloni bakeri asosiasi (CFU/mL) pada kedua jenis karang lunak ... 29
5. Karakteristik morfologi koloni bakteri asosiasi Sd ... 30
6. Karakteristik morfologi koloni bakteri asosiasi Ls ... 30
7. Karakteristik morfologi koloni bakteri pembentuk biofilm ... 33
8. Hasil uji antagonis antar populasi bakteri yang berasosiasi dengan karang lunak Sddan Ls terhadap bakteri pembentuk biofilm ... 34
9. Persentase bakteri asosiasi karang lunak Sd dan Ls yang aktif pada uji antagonisme terhadap pertumbuhan bakteri pembentuk biofilm ... 35
DAFTAR GAMBAR
Halaman
1. Penampang vertikal polip karang lunak ... 4
2. Mekanisme pembentukan biofilm ... 11
3. Peta lokasi pengambilan sampel karang lunak dan penjebakan biofilm bakteri ... 15
4. Proses penjebakan biofilm bakteri pada substrat kayu ... 18
5. Proses isolasi bakteri asosiasi karang lunak ... 19
6. Proses isolasi bakteri pembentuk biofilm ... 21
7. Diagram alir penelitian... 23
8. Morfologi Sinularia dura dan Lobophytum strictum ... 27
9. Penyebaran koloni bakteri asosiasi karang lunak ... 29
10.Penyebaran koloni bakteri pembentuk biofilm pada media SWC... 31
11.Foto bawah air biofilm panel kayu (a) hari pertama perendaman dan (b) Seminggu setelah perendaman ... 32
12.Jumlah isolat bakteri asosiasi yang positif pada uji antagonisme terhadap pertumbuhan bakteri pembentuk biofilm... 35
13.Diameter zona hambat (mm) hasil uji antagonisme bakteri asosiasi karang lunak (Sd dan Ls) terhadap pertumbuhan bakteri A, B dan C ... 36
14.Kurva pertumbuhan bakteri asosiasi karang lunak ... 38
15.Persentase bakteri pembentuk biofilm yang dihambat oleh bakteri asosiasi karang lunak (Sd dan Ls) ... 39
16.Diameter zona hambat (mm) uji penghambatan bakteri asosiasi karang lunak Sd dan Ls terhadap biofilm ... 40
DAFTAR LAMPIRAN
Halaman
1. Identifikasi sampel karang lunak ... 48
2. Metode pewarnaan Gram ... 50
3. Sterilisasi alat dan bahan ... 51
4. Pembuatan media isolasi bakteri ... 52
5. Hasil uji hambat (uji antagonisme) ...... 54
6. Penghitungan total koloni bakteri pada media SWC ...... 55
7. Hasil pewarnaan Gram beberapa isolat bakteri asosiasi... 56
8. Diameter zona hambat (mm) bakteri asosiasi karang lunak terhadap bakteri pembentuk biofilm ... 57
9. Kurva pertumbuhan bakteri asosiasi karang lunak... 56
10. Diameter zona hambat (mm) bakteri asosiasi karang lunak terhadapbakteri biofilm ...... 59
11. Alat dan bahan yang digunakan dalam penelitian... 60
1. PENDAHULUAN
1.1.Latar Belakang
Struktur bangunan laut yang berada di sekitar pantai tidak terlepas dari berbagai masalah-masalah teknis. Salah satu masalah yang timbul pada pemasangan struktur bangunan laut adalah tumbuhnya organisme penempel (fouling). Penempelan organisme fouling merupakan fenomena yang dapat menimbulkan kerugian dan kerusakan pada beberapa struktur bangunan laut seperti penghambatan laju kapal, kerusakan peralatan bawah air, dan
mempercepat pelapukan konstruksi bangunan bawah air. Usaha-usaha pencegahan terhadap tumbuhnya organisme fouling telah banyak dilakukan diantaranya dengan menggunakan cat antifoulant sintetis yang umumnya dibuat dari bahan kimia beracun seperti tributyltin (TBT). Namun banyak penelitian membuktikan bahwa ternyata TBT tidak hanya toksik terhadap biota penempel, tetapi juga dapat mencemari lingkungan dan membahayakan berbagai organisme non-target lainnya. Sehingga diperlukan alternatif sumber alami untuk mencegah keberadaan organisme fouling, salah satunya adalah dengan memanfaatkan kandungan senyawa bioaktif yang berasal dari organisme laut. Berbagai
organisme laut diketahui memiliki potensi yang sangat besar dalam menghasilkan senyawa-senyawa bioaktif. Salah satu organisme laut tersebut adalah karang lunak.
dan antifouling (Sammarco dan Coll, 1990). Namun masalah utama dalam pengembangan dari produk hayati laut tersebut adalah masalah suplai. Proksch et al. (2002) menyatakan bahwa senyawa bioaktif yang dihasilkan avertebrata laut sangat sedikit. Bahan baku yang dibutuhkan untuk mendapatkan 1 gram senyawa bioaktif adalah sekitar 1 ton berat basah. Dengan demikian produksi senyawa bioaktif dari karang lunak dalam jumlah yang banyak secara kontinyu, akan menyebabkan over-eksploitasi terhadap karang lunak.
Di sisi lain, karang lunak sebagai organisme bentik sesil diketahui hidup berasosiasi dengan beberapa mikroorganisme seperti bakteri. Bakteri yang berasosiasi dengan karang lunak juga dapat menghasilkan sejumlah metabolit sekunder yang sama seperti organisme inang (Faulkner et al., 2000). Beberapa penelitian telah dilakukan untuk membuktikan hipotesa tersebut. Senyawa bioaktif telah berhasil ditemukan diantaranya adalah dari bakteri asosiasi karang lunak jenis Juncella juncea (Arlyza, 2007). Hal ini membuktikan bahwa bakteri asosiasi karang lunak merupakan salah satu sumber yang menjanjikan sebagai sumber alternatif senyawa bioaktif. Dengan demikian maka over-eksploitasi terhadap karang lunak dapat dihindari.
Salah satu fungsi ekologis dari senyawa hasil metabolit sekunder karang lunak adalah sebagai antifouling. Oleh karena itu kemungkinan bakteri asosiasi karang lunak menghasilkan metabolit sekunder yang dapat digunakan sebagai
antifouling juga perlu dipelajari. Dengan demikian pencarian senyawa bioaktif
1.2.Tujuan
Adapun tujuan dari penelitian ini adalah:
1. Mencari bakteri asosiasi karang lunak yang potensial sebagai sumber
anti-microfouling alami sehingga dapat diproduksi secara efektif.
2. TINJAUAN PUSTAKA
2.1. Biologi dan Ekologi Karang Lunak
Karang lunak merupakan kelompok hewan tingkat rendah (avertebrata) yang termasuk ke dalam filum Coelenterata, kelas Anthozoa. Kelas Anthozoa dibagi dalam dua sub-kelas yaitu sub-kelas Scleractinia dan sub-kelas
Octocorallia. Karang lunak termasuk dalam sub-kelas Octocorallia yang memiliki delapan tentakel. Octocorallia memiliki tubuh yang lunak tetapi lentur dan
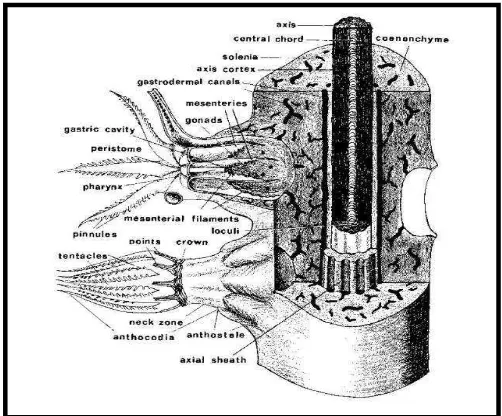
mempunyai tangkai yang melekat pada substrat yang keras terutama karang mati (Manuputty, 2002). Bagian atas tangkai disebut kapitulum, bentuknya bervariasi antara lain seperti jamur, bentuk lobus atau bercabang-cabang. Kapitulum mengandung polip yaitu individu atau binatang karang sehingga disebut bagian fertil, sedangkan tangkainya banyak mengandung spikulayaitu duri-duri kecil dari kalsium karbonat yang berfungsi sebagai penyokong jaringan tubuh, sehingga disebut bagian steril. Polip karang lunak dibagi menjadi tiga bagian besar yaitu antokodia, kaliksdan antostela (Gambar 1).
Antokodia merupakan bagian yang terdapat dipermukaan koloni dan bersifat retraktil,yaitu dapat ditarik masuk ke dalamjaringan tubuh. Apabila antokodia ditarik ke dalam, maka yang nampak dariatas adalah pori-pori kecil seperti bintang. Bangunan luar dari pori-poriinilah yang disebut kaliks. Pada antokodia ditemukan tentakel yangberjumlah delapan dengan deretan duri-duri (pinnula) yang berfungsi untuk membantu mengalirkan air dan zat-zatmakanan ke dalam mulut. Antokodia juga mengandungspikula yang letaknya berderet sampai ke ujung masing-masing tentakel.Pada daerah kaliks ditemukan rongga gastrovaskuler atau rongga perut, terusan dari farinks (yang terbagi menjadi delapan dan disebut septa), benang-benang septa dan organ reproduksi atau gonad. Bagian antostela merupakan bagian basal polip yang mengandung jaring-jaring solenia. Jaring-jaring solenia ini menghubungkan antara polip satu dengan polip lainnya (Manuputty, 2002).
Karang lunak juga mempunyai sel-sel amuboid yang akan berkembang menjadi sel-sel knidoblas dan menghasilkan sel-sel penyengat (nematosit). Sebagian dari sel-sel amuboid tersebut akan menjadi sel-sel skleroblas yang menghasilkan sklerit berkapur (spikula). Sebaran spikula pada bagian basal tentakel dan dinding tubuh di antara septa umumnya kurang merata. Namun di bagian bawah antokodia, sebaran spikula merata dan tersusun dalam jumlah besar sehingga memberi kesan lebih kokoh dan tidak lentur (Manuputty, 2002). Spikula pada bagian kapitulum (atas) terutama pada bagian dalam dan permukaan lobus serta di bagian permukaan tangkai (base) umumnya berbentuk “club” yaitu
kumparan kecil dengan salah satu ujung yang melebar. Sedangkan di bagian
Anggota Octocorallia hidupnya menetap, tidak dapat berpindah tempat dan melekat erat di dasar perairan yang keras. Octocorallia memiliki kebiasaan makan yang holosoik, yaitu menangkap organisme planktonik (crustacea kecil dan larva moluska) dalam jumlah yang besar. Namun ada juga beberapa jenis dari suku Xenidae dan jenis-jenis dari genus Clavulariadapat hidup bertahan lama walaupun sama sekali tidak mengambil makanan dari air laut. Hal tersebut dikarenakan jenis-jenis ini mengandung zooxanthellae dalam jumlah besar di dalam dinding gastrodermisnya (Manuputty, 1986).
Karang lunak hidup di daerah pasang surut sampai kedalaman 200 m. Hewan ini menyukai perairan yang hangat atau sedang terutama di Indo-Pasifik. Faktor-faktor eksternal yang mempengaruhi distribusi dan pertumbuhan karang lunak adalah gelombang, arus, cahaya, nutrien, sedimentasi, kadar garam, dan temperatur. Hasil ekspedisi Sibolga di perairan Timur Jauh (zona Indo-Malaya), termasuk Indonesia, mencatat ditemukannya 4 suku, 28 marga dan 219 jenis karang lunak (Manuputty, 1986).
longicirra (Manuputty, 1986). Karang lunak juga bersimbiosis mutualisme dengan beberapa mikroorganisme seperti bakteri. Simbiosis karang lunak dengan oganisme lain dapat terjadi baik pada permukaan tubuh (epifit) dan di dalam jaringan tubuh (endofit) (Mearns-Spargg et al., 1998).
2.2. Bakteri Asosiatif Karang Lunak
Bakteri laut umumnya dapat berasosiasi dengan organisme laut lainnya seperti karang lunak, spons, dan moluska. Bakteri asosiasi merupakan komunitas bakteri yang hidup bersama dengan biota lain dan melakukan berbagai macam pola hubungan (interaksi) yang paling penting dan mendasar dalam ekologi di lingkungan laut (Munn, 2004). Asosiasi bakteri dengan organisme laut dapat mempengaruhi proses metabolisme bakteri. Oleh karena itu bakteri asosiatif memiliki kecenderungan menghasilkan senyawa bioaktif yang lebih tinggi daripada bakteri yang hidup planktonik (Nofiana et al., 2009; Armstrong et al.,
2001). Beberapa senyawa bioaktif yang dihasilkan oleh bakteri asosiatif adalah senyawa yang dapat digunakan sebagai pertahanan terhadap patogen dan organisme fouling (Murniasih, 2005). Hal tersebut disebabkan oleh adanya
kompetisi hidup yang tinggi antar bakteri dan keterbatasan nutrisi (Mearns-Spargg
et al.,1998). Kompetisi ruang dan nutrisi dapat menginduksi bakteri untuk
menghasilkan senyawa dengan berbagai aktivitas biologis, misalnya antimikroba. Sehingga dapat dikatakan bahwa produksi senyawa antimikroba merupakan salah satu cara bakteri beradaptasi terhadap lingkungan dengan tujuan bakteri
mempertahankan diri.
mengandung bakteri dan bersifat tidak merusak inangnya (Kim, 1994). Bakteri yang disolasi dari avertebrata laut merupakan sumber yang menjanjikan dalam pencarian produk hayati laut dengan berbagai aktivitas biologis. Raveendran dan Limna (2009) menyatakan bahwa Pseudoalteromonas tunicata yang diisolasi dari tunicate Ciona intensitanalis, memperlihatkan adanya aktifitas antifouling
melawan larva Balanus amphitrite dan Ciona intestinalis. Selain itu juga
Alteromonas sp. yang diisolasi dari sponge Halichondria okadai yang menghasilkan ubiquinone-8 (metabolit penghambat) mampu menghambat terbentuknya biofilm. Bukti-bukti keterlibatan bakteri asosiasi dalam
menghasilkan senyawa bioaktif menjadikan bakteri asosiasi tersebut sebagai hal yang sangat penting dalam bidang biologi laut dan produk alami laut. Hal tersebut dikarenakan potensi yang dimilikinya dapat menjadi sumber baru sehingga dapat menyelesaikan masalah suplai produk alami laut tanpa harus melakukan
pemanenan biomassa inang secara berlebihan (Li, 2009).
2.3. Senyawa Bioaktif sebagai Sumber Antifoulant Alami
Karang lunak merupakan salah satu organisme bentik sesil yang memiliki kemampuan menghasilkan metabolit sekunder sebagai salah satu upaya
pertahanan diri terhadap lingkungan. Metabolit sekunder yang dihasilkan oleh karang lunak diantaranya terpenoid, steroid, dan steroid glikosida. Salah satu senyawa kimia yang paling banyak ditemukan pada karang lunak adalah
terpenoid. Terpenoid merupakan suatu kelompok senyawa kimia dari golongan hidrokarbon isometrik dengan rumus molekul C10H16 yang memiliki aroma atau
Tabel 1. Senyawa terpenoid dari beberapa jenis karang lunak Nama senyawa Jenis karang lunak Literatur Lobolide Lobophytum crassum Tursch et al., 1978 Crassolide Lobophytum crassum Tursch et al., 1978 Nephtenol Lobophytum pauciflorum Tursch et al., 1978 Sinularide Sinularia flexibilis Tursch et al., 1978 Dihydrosinularian Sinularia flexibilis Tursch et al., 1978 11-Episinularide acetate Sinularia queciformis Tursch et al., 1978 Sarcopane Sarcophyton glancum Tursch et al., 1978
Flexibilide Sinularia flexibilis Sammarco dan Coll, 1988 Isosarcophytoxides Sarcophyton sp Sammarco dan Coll, 1988 13-Hydroxylobolide Lobophytum crassum Sammarco dan Coll, 1988 Epoxypulide Sinularia sp Sammarco dan Coll, 1988 Lobohediliolide Lobophytum hedleyi Sammarco dan Coll, 1988
Pukalide Lobophytum
microbulatum
Sammarco dan Coll, 1988 Sumber: Tursch et al. (1978) dan Sammarco dan Coll (1988)
Senyawa biaoktif (bioactive compound) merupakan senyawa kimia aktif yang dihasilkan secara alamiah oleh organisme melalui jalur biosintetik metabolit sekunder. Metabolit sekunder adalah komponen senyawa yang diproduksi pada saat kebutuhan metabolisme primer sudah terpenuhi dan digunakan dalam mekanisme evolusi spesies atau strategi adaptasi terhadap lingkungan (Torsell, 1983). Pembentukan senyawa metabolit sekunder sangat dipengaruhi oleh kondisi lingkungan organisme. Produksi metabolit sekunder karang lunakmerupakan kompetisi akibat interaksi dengan lingkungan biotik, abiotik dan sebagai senjata kimia terhadap predator (Harper et al., 2001). Metabolit sekunder tersebut berperan penting dalam fungsi ekologis terutama untuk perlindungan terhadap predator, kompetisi ruang hidup serta memberikan pertahanan kimia sebagai antimikroba untuk mencegah terjadinya infeksi dan fouling (Sammarco dan Coll, 1992).
inangnya(Armstrong et al., 2000). Hasil penelitian Sabdono et al. (2005) menunjukan bahwa 10 isolat dari 371 isolat bakteri yang berhasil diisolasi dari karang lunak Sarcophyton sp. dan Sinularia sp. di perairan Ujung Kulon dan Karimunjawa menunjukkan adanya aktifitas antifoulant. Selain itu juga ekstrak kasar dari Pelagiobacter variabilis UPS3.37 diketahui mempunyai aktifitas
antifouling terhadap bakteri fouling. Uji macrofouling menunjukkan bahwa pemberian ekstrak kasar tanpa campuran cat mampu menurunkan jumlah penempelan bernakel (Sabdono, 2007). Metabolit sekunder yang dihasilkan organisme laut merupakan penemuan baru yang dapat dijadikan sebagai alternatif teknologi non-toksik untuk mengontrol biofouling di laut.
2.4. Aktivitas Biofouling di Laut
Rittchof (2001) menyatakan bahwasemua permukaan bawah air di dalam lingkungan laut dipengaruhi oleh penempelan organisme fouling seperti bakteri, alga dan invertebrata khususnya teritip dan remis. Faktor-faktor biologi, fisika, dan kimia juga mempengaruhi semua permukaan di lingkungan laut. Hal tersebut akan menghasilkan suatu lapisan kompleks dari perlekatan mikroorganisme (microfouling) dan makroorganisme (macrofouling) yang lebih dikenal sebagai
biofouling. Biofouling adalah penempelan dan akumulasi organisme hidup yang melekat pada permukaan substrat(material yang ditempeli biofouling). Istilah ini biasanya mengacu pada organisme stasioner makroskopik seperti makroalga, teritip, kerang, dan sejenisnya. Namun biofouling juga terjadi sangat cepat pada skala mikroskopis. Sehingga biofouling dapat dibagi menjadi 2, yaitu
macrofouling yaitu penempelan makroorganisme (kolonisasi avertebrata dan makroalga) yang bersifat merusak (Railkin, 2004).
Biofilm merupakan kumpulan mikroorganisme khususnya bakteri yang melekat erat pada permukaan substrat dan diselubungi oleh matriks extracellular polymeric. Biofilm tersebut diketahui merupakan prasyarat bagi penempelan dan metamorphosis dari organisme penempel (Sabdono, 2007; Marhaeni, 2011).
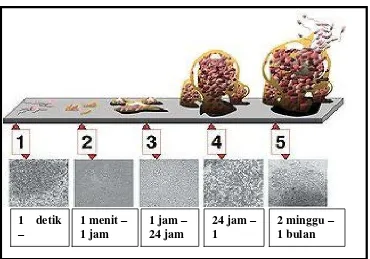
Biofouling diawali dengan adanya akumulasi nutrien sebagai sumber makanan pada permukaan substrat sehingga menarik bakteri di sekitarnya untuk menempel. Akumulasi dan reproduksi bakteri pada permukaan substrat menjadi sumber nutrisi bagi perkembangan organisme jenjang trofik yang lebih tinggi. Keadaan tersebut selanjutnya dapat menarik makroorganisme untuk menempel (Railkin, 2004). Sehingga dalam hal ini mikroorganisme merupakan agen utama yang mengambil tempat di permukaan dan berkembang untuk menghasilkan biofilm. Mekanisme pembentukan biofilm dapat dilihat pada Gambar 2.
Gambar 2. Mekanisme pembentukan biofilm (Donlan, 2002) 1 detik
– 1 menit 1 jam –
1 jam – 24 jam
24 jam – 1
Pembentukan biofilm pada suatu substrat di perairan membutuhkan waktu-waktu tertentu dalam setiap tahapannya. Bakteri planktonik yang berada di perairan mengalami pengendapan yang berubah-ubah dalam hitungan detik. Selanjutnya bakteri melekat pada substrat dalam hitungan menit (pelekatan awal). Bakteri yang melekat membentuk koloni dan melekat secara permanen pada substrat karena terjadi produksi eksopolimer dalam hitungan menit hingga jam. Selanjutnya terjadi proses pematangan biofilm tahap awal (maturasi 1) dalam hitungan 1 jam sampai 24 jam. Pematangan biofilm tahap akhir(maturasi 2) terjadi pada hitungan 24 jam hingga 1 minggu. Pada hitungan 2 minggu hingga 1 bulan terjadi proses disphersi, yaitu sebagian bakteri siap untuk menyebar dan berkolonisasi di tempat lain.
2.5.Permasalahan dan Upaya Penanggulangan Biofouling di Laut
Organisme fouling (biofouling) yang menempel pada kapal dan berbagai struktur buatan manusia di laut memberikan kerugian (ekonomis maupun operasional). Berdasarkan Chambers et al. (2006) keberadaan organisme fouling
pada lambung kapal yang telah berlayar selama 6-8 bulan dapat mengakibatkan berkurangnya kecepatan kapal hingga 50%. Hal tersebut mengakibatkan
tertundanya waktu berlayar selama 10-15% dari total waktu berlayar serta meningkatkan konsumsi bahan bakar hingga 40%.
Biofouling secara komersial dapat menyebabkan dampak besar bagi konsumer, tetapi ahli lingkungan mengatakan bahwa biofouling memiliki beberapa kerugian yang lain juga. Penelitian yang dilakukan Sudaryanto et al.
gastropoda laut betina karena dapat menyebabkan penyumbatan pada saluran pengeluaran telur. Kelainan seksual pada spesies gastropoda yang terekspos TBT tergambar secara luas pada awal tahun 1990 (Soedharma dan Fauzan, 1996).
Usaha-usaha untuk mencegah dan menghilangkan biofouling terus dikembangkan diantaranya dengan metode pengerokan. Namun metode serupa dirasa sangat tidak efektif karena untuk melakukan pengerokan diperlukan teknik khusus dengan terlebih dahulu melakukan pendaratan kapal. Hal ini menyebabkan kerugian besar bagi industri perkapalan karena pada masa itu kapal tidak bisa melakukan aktivitasnya di laut. Oleh karena itu pada pertengahan tahun 1800 dikembangkan cat antifouling yang mengandung tembaga. Namun penggunaan cat ini memiliki masa pakai yang pendek (kurang dari 1,5 tahun). Tahun 1960 digunakan bahan-bahan kimia seperti arsen, organo-mercury, DDT, dan timah sebagai campuran cat antifouling. Berdasarkan hasil penelitian, bahan-bahan kimia tersebut memiliki daya toksikyang berbahaya dan memiliki persisten tinggi di lingkungan.
Metode pencegahan selanjutnya adalah penggunaan cat antifouling
berbahan dasar tributyltin (TBT). Ine dan Ant (2001) menyatakan hampir seluruh dunia termasuk Indonesia menggunakan cat berbahan baku TBT untuk pengecatan badan kapal.TBT yang merupakan campuran dalam cat antifouling memiliki sifat peluruhan yang tinggi serta membahayakan berbagai organisme laut lainnya. Oleh karena itu, produk alami antifoulant (Natural Product Antifoulant atau NPA) sebagai alternatif antifouling alami pengganti TBT telah dikembangkan. Karang lunak merupakan salah satu avertebrata laut yang telah dikenal memiliki
Penyelidikan properti antifouling dari karang lunak bergerak pesat pada tahun 1980-an dengan banyaknya laboratorium yang memfokuskan penelitian ke arah ini. Berikut merupakan Natural Product Antifouling (NPA) yang diisolasi dari karang lunak antara lain (Tabel 2).
Tabel 2. Natural Product Antifouling (NPA) yang diisolasi dari beberapa jenis karang lunak
Nama Senyawa Jenis Karang Lunak
Himarine Leptogorgia virtulata
Muricin Muricea fruticosa
Renillafoulins Renilla reniformis Pukalide dan epoxypukalide L. Virgulata 11-episinulariolide dan sinulariolide Sinlaria flexibillis
12α-acetoxy-13 17-seco-cholesta-1, 4-dien-3-ones Dendronepthya sp
Juncins Juncella juncea
(Reveendran dan Limna, 2009)
Selain dari organisme karang lunak, mikroba simbion yang diisolasi dari permukaan avertebrata laut juga dapat dijadikan sebagai sumber NPA.
Keuntungan menggunakan mikroorganisme sebagai sumber NPA adalah
3. METODOLOGI PENELITIAN
3.1. Waktu dan Lokasi Penelitian
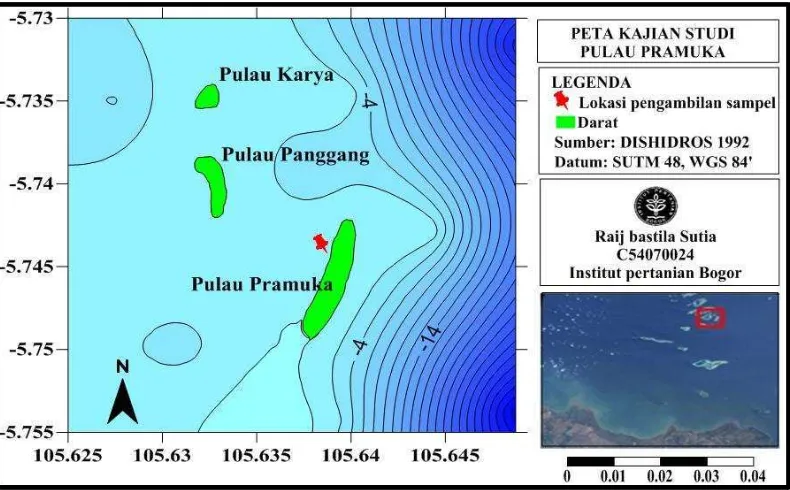
Penelitian dilakukan mulai bulan Mei sampai Agustus 2011. Lokasi pengambilan sampel karang lunak serta penjebakan biofilm bakteri dilakukan di perairan pulau Pramuka, Kepulauan Seribu, DKI Jakarta (Gambar 3). Isolasi bakteri, serta uji hambat dilakukan di Laboratorium Mikrobiologi, FMIPA, IPB. Identifikasi karang lunak dilakukan di Laboratorium Kering Biologi Laut, ITK, FPIK, IPB. Analisis kualitas perairan dilakukan di Laboratorium Produktivitas Lingkungan (Proling), FPIK, IPB.
Gambar 3. Peta lokasi pengambilan sampel karang lunak dan penjebakan biofilm bakteri
3.2. Alat dan Bahan
panas, botol sampel, kontainer pendingin, thermometer dan substrat jebakan. Sedangkan peralatan yang digunakan di Laboratorium meliputi mikroskop, cawan petri, spatula, mortar, erlenmeyer, vortex stirrer, timbangan analitik, tabung reaksi, batang penyebar, jarum ose, laminar air flow, paper disk (diameter 6 mm),
spektrofotometer, dan jangka sorong.
Bahan yang digunakan di lapangan meliputi es batu dan air laut. Sementara bahan yang digunakan di laboratorium meliputi sampel karang lunak segar, akuades, air laut, media Sea Water Complex (SWC) padat dan cair, alkohol 70%, dan antibiotik ampicilin sigma konsentrasi 100 ppm.
3.3. Metode Penelitian
Penelitian ini dilakukan untuk mencari bakteri asosiasi karang lunak yang potensial sebagai alternatif teknologi ramah lingkungan untuk mengontrol
biofouling di laut. Penelitian ini dilakukan melalui beberapa tahap, yaitu:
3.3.1. Koleksi dan Pengambilan Sampel Karang Lunak
Metoda sampling yang digunakan adalah metoda purposive sampling
dimana pengambilan sampel terfokus pada target dengan mempertimbangkan kriteria-kriteria tertentu terhadap obyek yang sesuai dengan tujuan penelitian (Fachrul, 2007). Dalam hal ini penelitian dilakukan terhadap karang lunak jenis
Sinularia dura dan Lobophytum strictum yang mana berdasarkan Radjasa et al.
dura dan Lobophytum strictum yang belum mendapat sentuhan difoto untuk kepentingan identifikasi. Sampel karang lunak selanjutnya dibawa ke permukaan air secara perlahan dan dimasukkan dalam kantong plastik tahan panas berisi air laut. Selanjutnya disimpan dalam kontainer pendingin berisi es untuk
ditransportasikan ke laboratorium.
3.3.2. Identifikasi Sampel Karang Lunak
Identifikasi sampel karang lunak dilakukan di Laboratorium Kering Biologi Laut, FPIK, IPB. Sedangkan buku panduan dan teknik identifikasi mengacu pada Fabricius dan Alderslade (2001) dan Manuputty (2002). Identifikasi sampel karang lunak dilakukan melalui beberapa tahap (Lampiran 1), yaitu:
1) Foto bawah air dari sampel karang lunak uji dicocokkan dengan foto bawah air jenis-jenis karang lunak yang ada pada buku identifikasi. Hal tersebut dilakukan untuk mengetahui genus dari karang lunak uji.
2) Sampel karang lunak segar dipotong menjadi dua bagian yaitu bagian atas (top) dan bagian bawah (basal). Hal tersebut bertujuan untuk mengetahui bentuk spikula pada masing-masing bagian karang lunak. Cuplikan jaringan dari setiap bagian karang lunak diletakkan di atas gelas objek, kemudian diberi larutan pemutih dengan tujuan untuk melarutkan jaringan karang. Selanjutnya dilakukan pencucian dengan air untuk menghilangkan larutan pemutih dan sisa jaringan. Spikula dari masing-masing bagian karang lunak diamati di bawah mikroskop dengan perbesaran 10 x 40.
3.3.3. Penjebakan biofilm bakteri
Penjebakan biofilm bakteri adalah suatu proses untuk mendapatkan bakteri pembentuk biofilm dengan cara menunggu hingga bakteri tersebut terjebak pada substrat yang telah disipkan dalam rentang waktu tertentu. Penjebakan dilakukan dengan menggunakan substrat berupa empat buah balok kayu steril berukuran 3 x 6 cm2. Balok kayu tersebut kemudian diikatkan pada penyangga besi dengan menggunakan tali pengikat dan dipasang secara sirkular (Gambar 4). Hal tersebut bertujuan supaya bakteri dapat terjebak dalam kondisi apapun.
6 cm
Gambar 4. Proses penjebakan biofilm bakteri pada substrat kayu
Substrat jebakan dipasang pada lokasi di sekitar ekosistem karang lunak dengan cara dibenamkan pada kedalaman 1 meter di bawah permukaan laut selama 1 minggu. Setelah 1 minggu pembenaman, substrat diambil dan dimasukkan dalam kantong plastik berisi air laut. Selanjutnya disimpan dalam kontainer pendingin berisi es untuk ditransportasikan ke laboratorium.
3.3.4. Isolasi Bakteri Asosiatif Karang Lunak
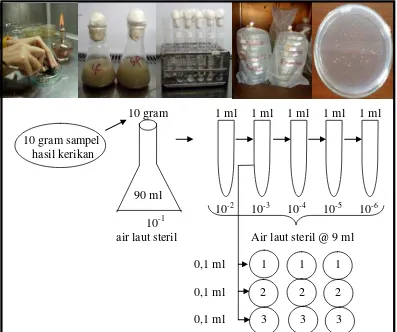
berikut: karang lunak segar dicuci dengan menggunakan air laut steril sebanyak tiga kali (triturasi). Hal tersebut bertujuan untuk menghilangkan bakteri non target (bakteri non simbion). Kemudian dilakukan pengerokan terhadap permukaan jaringan dengan alat pengerok steril. Selanjutnya dilakukan seri pengenceran terhadap sampel tersebut. Sebanyak 10 gram sampel hasil kerokan dimasukkan ke dalam air laut steril 90 ml dan diperoleh pengenceran sampel sebesar 10-1. Dari pengenceran 10-1 tersebut diambil 1 ml sampel dengan pipet steril dan
dimasukkan ke dalam tabung reaksi yang berisi 9 ml air laut steril dan diperoleh pengenceran 10-2. Demikian selanjutnya sehingga diperoleh pengenceran sampel sampai 10-6. Masing-masing hasil pengenceran 10-3, 10-4 dan 10-5 diambil 100 μl diteteskan dalam cawan petri steril berisi 20 ml media SWC. (Gambar 5).
10 gram 1 ml 1 ml 1 ml 1 ml 1 ml 10 gram sampel
hasil kerikan
90 ml
10-2 10-3 10-4 10-5 10-6 10-1
air laut steril Air laut steril @ 9 ml 0,1 ml 1 1 1 0,1 ml 2 2 2 0,1 ml 3 3 3
Selanjutnya disebar dengan menggunakan batang penyebar steril dan diinkubasi selama 2 x 24 jam pada suhu 37 0C (suhu optimum untuk pertumbuhan bakteri) (Pelczar dan Chan, 2005). Setelah inkubasi, jumlah koloni yang tumbuh pada masing-masing cawan dihitung dan diamati. Koloni-koloni dengan bentuk, warna, elevasi, dan tepian koloni berbeda diisolasi dan dilakukan pengamatan bentuk sel dan pewarnaan Gram (Lampiran 2). Semua alat dan bahan yang digunakan dilakukan sterilisasi terlebih dahulu dengan autoklaf (Lampiran 3).
3.3.5. Isolasi Bakteri Pembentuk Biofilm
Biofilm bakteri disiapkan dengan tujuan memperoleh isolat bakteri pembentuk biofilm. Metode yang digunakan untuk isolasi bakteri pembentuk
Gambar 6. Proses isolasi bakteri pembentuk biofilm
3.3.6. Uji Hambat (Uji Antagonisme) Bakteri Asosiatif Karang Lunak terhadap Pertumbuhan Bakteri Pembentuk Biofilm
Kegiatan uji hambat pertumbuhan dilakukan antara isolat bakteri asosiatif karang lunak terhadap bakteri pembentuk biofilm dengan metode difusi agar (Radjasa,2004). Bakteri uji yang digunakan adalah bakteri pembentuk biofilm.
Tahapan dari uji ini meliputi persiapan media cair dan persiapan media padat (Lampiran 4). Sebanyak 20 ml media agarSWC dalam keadaan cair
ditambahkan 20 μl bakteri pembentuk biofilm dan dihomogenkan dengan vortex, kemudian segera dituangkan ke dalam cawan petri steril. Cawan petri yang telah berisi campuran media SWC dan bakteri pembentuk biofilm tersebut didiamkan sekitar 15 menit atau sampai media membeku. Selanjutnya beberapa paper disk
steril (diameter 6 mm) diletakkan secara aseptik pada permukaan agar dan sebanyak 20 µl kultur cair bakteri asosiasi karang lunak diteteskan di atas paper disk. Sebagai kontrol positif digunakan antibiotik ampicillin sigma konsentrasi 100 ppm sebanyak 20 µl. Inkubasi dilakukan pada suhu 37 0C selama 2 x 24 jam. Aktivitas antibakteri ditunjukkan dengan adanya zona bening (zona hambatan) disekitar paper disk dan dibandingkan dengan aktivitas antibiotik ampicillin (Murniasih dan Rasyid, 2010). Diameter zona bening diukur dengan
3.3.7. Uji Hambat (Uji Antagonisme) Bakteri Asosiatif Karang Lunak terhadap Pembentukkan Biofilm
Bakteri uji yang digunakan dalam uji hambat ini adalah biofilm bakteri (kumpulan dari beberapa jenis bakteri pembentuk biofilm). Kegiatan uji hambat dilakukan dengan metode difusi agar (Radjasa, 2004). Sebanyak 20 ml media agar SWC dalam keadaan cair ditambahkan 20 μl biofilm bakteri dan dihomogenkan dengan vortex, kemudian segera dituangkan ke dalam cawan petri steril. Cawan petri yang telah berisi campuran media SWC dan biofilm bakteritersebut
didiamkan sekitar 15 menit sampai media membeku. Selanjutnya beberapa paper disk steril (diameter 6 mm) diletakkan secara aseptik pada permukaan agar dan sebanyak 20 µl kultur cair bakteri asosiasi karang lunak diteteskan di atas paper disk. Sebagai kontrol positif digunakan antibiotik ampicillin sigma konsentrasi 100 ppm sebanyak 20 µl. Inkubasi dilakukan pada suhu 37 0C selama 2 x 24 jam. Aktivitas antibakteri ditunjukkan dengan adanya zona bening (zona hambatan) disekitar paper disk dan dibandingkan dengan aktivitas antibiotik ampicillin (Murniasih dan Rasyid, 2010). Diameter zona bening diukur dengan
menggunakan jangka sorong dengan ketelitian 0,1 mm.
3.3.8. Analisis Data
Analisis data yang digunakan pada penelitian ini menggunakan analisis deskriptif kualitatif. Analisis tersebut diperoleh berdasarkan tabel dan gambar, serta melihat ukuran diameter zona hambat bakteri asosiatif terhadap biofilm
bakteri. Isolat bakteri asosiasi yang memiliki zona hambat paling tinggi terhadap ketiga bakteri uji dijadikan sebagai isolat terpilih sebagai sumber
3.4. Diagram Alir Penelitian
Berikut merupakan diagram alir penelitian disajikan pada Gambar 7.
4. HASIL DAN PEMBAHASAN
4.1. Pengamatan Parameter Fisika-Kimia Perairan
Kondisi lingkungan (fisika-kimia) habitat merupakan salah satu faktor yang mempengaruhi produksi senyawa metabolit sekunder karang lunak. Karang lunak merupakan organisme yang memiliki sifat toleransi yang tinggi terhadap ekologi perairan (Dinensen et al., 1983). Walaupun demikian, terdapat beberapa faktor yang tidak dapat ditolerir seperti kekeringan yang terlalu lama, endapan yang tebal, dan penurunan kadar garam yang drastis. Data pendukung berupa hasil analisis parameter fisika-kimia pada lokasi pengambilan sampel disajikan pada Tabel 3.
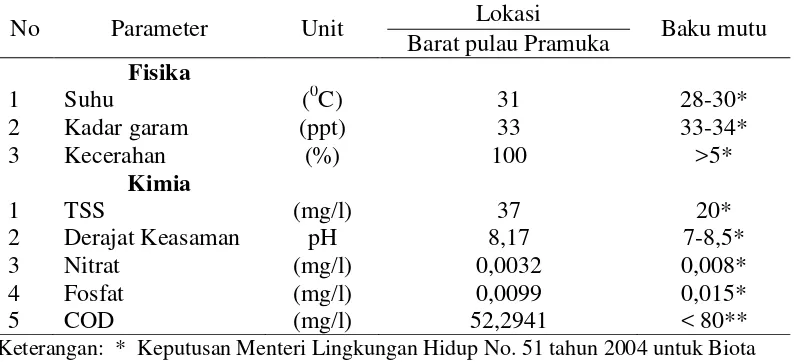
Tabel 3. Hasil analisis parameter kualitas lingkungan perairan (fisika-kimia) pada lokasi pengambilan sampel karang lunak
No Parameter Unit Lokasi
Barat pulau Pramuka Baku mutu Fisika
Keterangan: * Keputusan Menteri Lingkungan Hidup No. 51 tahun 2004 untuk Biota Perairan Laut
** Bapedalda DKI Jakarta – LP ITB, 1998
air laut untuk mendukung kehidupan biota yang telah ditetapkan oleh Keputusan Menteri Lingkungan Hidup No. 51 Tahun 2004.
Kondisi perairan pada lokasi pengambilan sampel terlihat jernih. Hal tersebut ditunjukkan oleh persentase kecerahan pada lokasi pengambilan sampel mencapai 100% (sampai dasar perairan). Kondisi perairan tersebut sangat mendukung kehidupan karang lunak mengingat intensitas cahaya matahari yang tinggi sangat mendukung proses fotosintesis alga simbiotik dari karang lunak (zooxanthellae). Zooxanthellae sendiri merupakan sumber nutrisi dan warna bagi karang lunak (Birkeland, 1997). Suhu pada lokasi pengambilan sampel karang lunak mencapai 310C. Nilai suhu yang diperoleh melebihi batas kisaran suhu yang baik untuk pertumbuhan karang (25-29 0C). Namun menurut Nybakken (1992) terdapat beberapa jenis karang lunak yang mampu mentolerir perubahan suhu sampai kira-kira sekitar 36-40 0C. Pengaruh perubahan suhu terhadap binatang karang adalah respon makan menurun, banyak mengeluarkan lendir, dan proses fotosintesis atau respirasi menjadi berkurang.
Kadar garam merupakan salah satu faktor pembatas pertumbuhan karang. Kadar garam pada lokasi pengambilan sampel mencapai 33 ppt, sehingga dapat dikatakan kadar garam pada lokasi pengambilan sampel masih berada dalam kisaran yang masih mendukung hidup karang lunak. Derajat keasaman pada lokasi pengambilan sampel sebesar 8,17. Angka tersebut menunjukkan bahwa derajat keasaman perairan masih dalam batas standar baku mutu menurut Keputusan Menteri Lingkungan Hidup No. 51 Tahun 2004. Hal ini diperkuat dengan
tersebut. Nutrien yang diukur pada lokasi pengambilan sampel adalah nitrat dan fosfat. Kandungan nitrat pada lokasi pengambilan sampel adalah 0,00321 mg/l dan fosfat sebesar 0,0099 mg/l. Kandungan nutrien tersebut berfungsi untuk mendukung pertumbuhan karang lunak. COD (Chemical Oxygen Demand) merupakan suatu karakteristik yang menunjukkan jumlah oksigen terlarut yang diperlukan oleh mikroorganisme untuk mengurai atau mendekomposisi bahan organik dalam kondisi aerobik. Hasil pengukuran COD pada penelitian ini mengindikasikan bahwa perairan tersebut kemungkinan mengalami kontaminasi bahan organik, atau menunjukkan bahwa perairan tersebut merupakan perairan yang cukup subur namun masih tergolong normal (Hariyadi, 2004).
4.2. Identifikasi Karang Lunak
Hasil identifikasi menunjukkan bahwa karang lunak yang digunakan
sebagai biota inang dari bakteri yang diisolasi berasal dari spesies Sinularia dura
(Sd) dan Lobophytum strictum (Ls). Kedua karang lunak tersebut dapat diklasifikasikan (Fabricius dan Alderslade, 2001; Manuputty, 2002) sebagai berikut:
Morfologi karang lunak Sinularia dura dan Lobophytum strictum dapat dilihat pada Gambar 8.
(a) Sinularia dura (b) Sinularia dura
di bawah air di atas air
(c) Lobophytum strictum (d) Lobophytum strictum
di bawah air di atas air
Gambar 8. Morfologi Sinularia dura dan Lobophytum strictum Sinularia dura dan Lobophytum strictum termasuk kedalam famili Alcyoniidae. Berdasarkan Gambar 8 kedua spesies karang lunak uji tampak memiliki bentuk morfologi yang hampir sama, yaitu mempunyai bentuk koloni merambat, kapitulum lebar, dan permukaan digitata. Namun terdapat perbedaan yang kontras antara kedua spesies ini, yaitu warna koloni. Warna koloni
Berdasarkan hasil analisis spikula,Sdmemiliki spikula berbentuk club yaitu kumparan kecil dengan salah satu ujung yang melebar. Sementara spikulapadaLs memiliki bentuk seperti kapstan yaitu kumparan kecil berujung tumpul dengan tonjolan duri yang menggerombol teratur.
Kedua jenis karang lunak tersebut dipilih sebagai organisme uji dikarenakan keberadaan spesies tersebut yang sangat melimpah di alam. Di Indonesia,
terutama di kepulauan Seribu jenis-jenis karang lunak didominasi berturut-turut oleh genus Sinularia, Sarcophyton, Lobophytum, Lobularia, dan Nephtea
(Manuputty, 1986). Selain kelimpahannya yang sangat tinggi, karang lunak tersebutjuga telah terbukti pada beberapa penelitian oleh adanya indikasi kandungan senyawa bioaktif yang mampu menghambat pertumbuhan bakteri pembentuk biofilm dan penempelan teritip (Radjasa et al., 1999). Sehingga kemungkinan besar mengindikasikan bakteri yang hidup berasosiasi dengan karang lunak tersebut juga dapat menghasilkan senyawa bioaktif seperti inangnya.
4.3. Isolasi Bakteri Asosiatif Karang Lunak (Sddan Ls)
Bakteri laut umumnya memiliki kecenderungan untuk berasosiasi dengan organisme laut lainnya seperti bakteri kemosintetik yang biasa hidup pada
jaringan tubuh cacing laut . Penelitian ini juga telah membuktikan bahwa bakteri laut memiliki kecenderungan untuk hidup berasosiasi dengan karang lunak.
Tabel 4. Jumlah koloni bakteri asosiasi (CFU/mL) pada kedua jenis karang lunak
No Spesies Jumlah Bakteri Asosiasi
(CFU/mL) 1 Sinularia dura (Sd) 1,7 x 106 2 Lobophytum strictum (Ls) 3 x 104 Sumber data: Diolah dari Lampiran 6
Berdasarkan hasil perhitungan total bakteri pada kedua jenis karang lunak dapat diketahui bahwa jumlah bakteri asosiasi Sdlebih banyak dibandingkan dengan jumlah bakteri asosiasi Ls. Hal tersebut dapat disebabkan oleh adanya perbedaan struktur morfologi dari masing-masing inangnya. Sdmemiliki morfologi yang tidak keras dengan spikula berukuran kecil. Sementara Ls
memiliki morfologi yang kaku dan agak keras dengan spikula yang tersebar secara merata sehingga bakteri yang menempel pada permukaan karang lunak Ls
menjadi lebih mudah lepas ketika terbilas arus. Hal tersebut diperkuat oleh
pernyataan Ismet (2007) bahwa organisme dengan morfologi yang tidak keras dan susunan spikula yang tidak terlalu padat memiliki bakteri simbion yang lebih banyak dibandingkan organisme yang memiliki morfologi yang lebih kaku dan mengandung spikula yang tersebar merata. Sebaran koloni bakteri asosiasi kedua karang lunak setelah diisolasi pada media agar SWC dapat dilihat pada Gambar 9.
(a)
(b)
Bentuk koloni Elevasi koloni Tepi koloni Warna koloni Bentuk sel Gram
SD1 Bulat Datar Licin Putih Coccus
-SD2 Bulat Datar Licin Putih basil +
SD3 Bulat Cembung Licin Putih basil pendek
-SD4 Bulat Datar Licin Putih krem basil pendek
-SD5 Bulat Cembung Licin Putih basil pendek +
SD6 Bulat Cembung Licin Putih krem Coccus
-SD7 Bulat Datar Licin Putih Coccus
-SD8 Bulat Datar Berombak Putih Coccus +
SD9 Bulat Datar Licin Putih bening basil pendek
-SD10 Bulat Datar Licin Putih krem Coccus
-SD11 Bulat Cembung Licin Putih Coccus +
SD12 Bulat Cembung Berombak Putih basil pendek
-SD13 Bulat Datar Licin Putih bening basil pendek -SD14 Bulat Cembung Licin Putih krem basil pendek
-SD15 Bulat Datar Licin Putih krem Coccus
-SD16 Bulat Datar Licin Putih krem basil pendek +
Morfologi bakteri Isolat bakteri
Bentuk koloni Elevasi koloni Tepi koloni Warna koloni Bentuk sel Gram LS1 Tak beraturan Datar Berombak Putih basil pendek -LS2 Bulat Cembung Licin Putih krem Coccus -LS3 Bulat Cembung Licin Putih bening Coccus -LS4 Tak beraturan Datar Licin Putih krem basil pendek -LS5 Bulat Cembung Berombak Putih krem Coccus -LS6 Bulat Cembung Licin Putih krem Coccus -LS7 Bulat Cembung Licin Putih Coccus -LS8 Bulat Cembung Licin Putih krem basil pendek + Isolat bakteri Morfologi bakteri
Berdasarkan hasil pengamatan koloni bakteri terisolasi dari segi bentuk, warna, elevasi, dan tepian koloni diperoleh 16 isolat bakteri asosiasi Sddengan kode isolat SD1-SD16 (Tabel 5) dan 8 isolat bakteri asosiasi Lsdengan kode isolat LS1-LS8 (Tabel 6). Hasil pewarnaan Gram menunjukkan bahwa bakteri yang berhasil diisolasi dari karang lunak Sd, sebelas isolat diantaranya merupakan bakteri Gram (-) dan lima isolat berasal dari bakteri Gram (+). Sementara hampir semua isolat bakteri yang berasosiasi dengan Ls berasal dari bakteri Gram (-), namun terdapat satu isolat yang berasal dari bakteri Gram (+). Hasil pewarnaan Gram disajikan pada Lampiran 7.
Tabel 5. Karakterisik morfologi koloni bakteri asosiasi Sd
Tabel 6. Karakteristik morfologi koloni bakteri asosiasi Ls
4.4. Isolasi bakteri pembentuk biofilm
Biofilm yang digunakan sebagai objek dalam penelitian ini berasal dari kelompok bakteri. Biofilm bakteri diperoleh dengan cara menjebak secara
langsung pada ekosistem karang lunak tempat karang lunak uji dikoleksi. Substrat jebakan yang digunakan dalam penelitian ini adalah berupa empat buah panel kayu berukuran 3 x 6 cm2. Berdasarkan metode penelitian yang dilakukan, ditemukan adanya beberapa bakteri yang mampu membentuk biofilm pada permukaan panel kayu di perairan pulau Pramuka kepulauan Seribu yang dipilih sebagai tempat penelitian. Sebaran koloni bakteripembentuk biofilm yang berhasil diisolasi dari balok kayu pada media agar SWC disajikan pada Gambar 10.
Gambar 10. Penyebaran koloni bakteri pembentuk biofilm pada media SWC
dikarenakan substrat tersebut dibenamkan dalam perairan sehingga permukaan substrat menjadi lembab. Kombinasi permukaan yang lembab, air serta nutrien yang cukup memicu bakteri pembentuk biofilm untuk tumbuh. Foto bawah air
biofilm pada panel kayu disajikan pada Gambar 11.
Gambar 11. Foto bawah air biofilm panel kayu (a) hari pertama perendaman dan (b) seminggu setelah perendaman
Berdasarkan Gambar 11 terlihat bahwa telah terjadi perubahan tekstur pada permukaan panel kayu seiring dengan bertambahnya waktu pembenaman substrat. Hal tersebut dikarenakan ketika substrat dibenamkan dalam air laut, molekul-molekul organik dan nutrien yang berada di dalam air laut tersebut langsung teradsorpsi oleh permukaan substrat sehingga memodifikasi permukaan substrat (Loeb dan Neihof, 1975). Adanya akumulasi molekul-molekul organik dan nutrien pada permukaan substrat memicu tersedianya sumber makanan dan menarik mikroorganisme seperti bakteri untuk menempel. Hal tersebut terbukti setelah satu minggu pembenaman, permukaan substrat kayu menjadi lebih licin seperti dilapisi oleh gel (lendir) yang diduga banyak mengandung bakteri pembentuk biofilm (Gambar 11b). Alasan dilakukan penjebakan selama satu minggu dikarenakan pembentukan biofilm pada suatu substrat di perairan membutuhkan waktu-waktu tertentu dalam setiap tahapannya. bakteri yang
Bentuk koloni Elevasi koloni Tepi koloni Warna koloni Bentuk sel Gram
A Bulat Cembung Licin Merah Basil pendek +
B Bulat Cembung Licin Kuning Basil pendek +
C Bulat Cembung Licin Putih Basil pendek
-Isolat bakteri Morfologi bakteri
merupakan pembentuk dari biofilm tersebut memiliki waktu reproduksi yang sangat cepat. Sel induk bakteri melakukan reproduksi melalui pembelahan biner dalam waktu 20-30 menit menjadi 2 sel anakan, lalu 20-30 menit berikutnya setiap sel anak tersebut berbagi diri lagi menjadi 4 sel anakan. Sel-sel tersebut terus berbagi diri dalam jumlah eksponensial menjadi bermilyar-milyar sel anakan yang bertumpukan di atas dan di sampingnya membentuk satu koloni. Koloni bakteri tersebut kemudian memproduksi sebuah lapisan eksopolisakarida (EPS) untuk memperkuat pelekatannya. Selanjutnya terbentuklah biofilm yang
pelekatannya sangat kuat. Berdasarkan Donlan (2002), usia 1 minggu merupakan waktu dimana biofilm mengalami proses maturasi 2 yaitu pematangan biofilm
tahap akhir.
Faktor lingkungan merupakan salah satu faktor penting yang dapat menentukan banyaknya jumlah bakteri pembentuk biofilm menempel dan membentuk lapisan biofilm pada substrat. Kondisi nutrien yang cukup rendah pada lokasi penjebakan menyebabkan bakteri cenderung untuk melekat ke permukaan padat dalam hal ini adalah kayu. Dengan kondisi demikian,
kesempatan bakteri untuk mendapatkan nutrisi menjadi lebih tinggi (Dewanti dan Haryadi, 1997). Berdasarkan hasil purifikasi, diperoleh tiga isolat bakteri
pembentuk biofilm dengan morfologi koloni berbeda (Tabel 7).
Tabel 7. Karakteristik morfologi koloni bakteri pembentuk biofilm
Hasil pewarnaan Gram menunjukkan bahwa dua isolat bakteri pembentuk
satu isolat (bakteri C) berasal dari bakteri Gram (-). Ketiga bakteri pembentuk
biofilm tersebut akan dijadikan sebagai bakteri uji untuk mengetahui kemampuan bakteri asosiatif karang lunak dalam menghambat pertumbuhan biofilm yang merupakan rantai utama terbentuknya biofouling di laut.
4.5. Uji Hambat (Uji Antagonisme) Bakteri Asosiasi Karang Lunak terhadap Pertumbuhan Bakteri Pembentuk Biofilm
Penapisan bakteri asosiasi karang lunak dilakukan dengan uji antagonisme antara bakteri asosiasi karang lunak terhadap bakteri pembentuk biofilm. Bakteri pembentuk biofilm tersebut terdiri dari bakteri A dan bakteri B sebagai perwakilan bakteri Gram (+) dan bakteri C sebagai perwakilan bakteri Gram (-). Hasil uji antagonis antar isolat bakteri yang berasosiasi dengan karang lunak Sddan Ls terhadap pertumbuhan bakteri pembentuk biofilm disajikan pada Tabel 8.
Tabel 8. Hasil uji antagonis antar populasi bakteri yang berasosiasi dengan karang lunak Sddan Lsterhadap bakteri pembentuk biofilm
No Kode
Sinularia dura
Kode
Lobophytum strictum
Bakteri pembentuk biofilm Bakteri pembentuk biofilm
Masing-masing isolat bakteri asosiasi memiliki kemampuan antagonisme yang beragam pada setiap bakteri uji. Hasil analisis uji sifat antagonisme antar isolat bakteri asosiasi menunjukkan bahwa dari 24 total bakteri yang berasosiasi dengan karang lunak Sd dan Ls, hanya satu isolat bakteri yang tidak memiliki sifat antagonisme terhadap semua bakteri pembentuk biofilm yaitu bakteri dengan kode isolat SD2. Tabel 9 menunjukkan bahwa bakteri asosiasi karang lunak Ls
memiliki persentase antagonisme lebih tinggi dibandingkan bakteri asosiasi Sd walaupun jumlah bakteri asosiasi yang terisolasinya lebih banyak.
Tabel 9. Persentase bakteri asosiasi karang lunak Sd dan Ls yang aktif pada uji antagonisme terhadap pertumbuhan bakteri pembentuk biofilm
Jenis Karang Lunak Persentasi bakteri penghambat (%)
Sinularia dura 93,75 %
Lobophytum strictum 100%
Hasil penapisan awal diperoleh 15 isolat dan 8 isolat bakteri yang memiliki sifat antagonisme terhadap bakteri pembentuk biofilm berturut-turut dari bakteri Sd dan Ls (Gambar 12). Ke 23 bakteri tersebut merupakan isolat terpilih untuk dilakukan uji antagonisme selanjutnya.
Uji antagonisme dilakukan untuk melihat tingkat penghambatan dari bakteri asosiasi karang lunak terhadap bakteri pembentuk biofilm berdasarkan diameter zona bening (zona hambatan) yang terbentuk di sekitar paper disk. Tingkat penghambatan isolat bakteri asosiasi karang lunak terhadap bakteri pembentuk
biofilm disajikan pada Gambar 13.
Sinularia dura Lobophytum strictum
.
Sumber : Diolah dari Lampran 8
Keterangan: SD : kode bakteri asosiasi Sinularia dura LS : kode bakteri asosiasi Lobophytum strictum
Gambar 13. Diameter zona hambat (mm) hasil uji antagonisme bakteri asosiasi karang lunak (Sd dan Ls) terhadap pertumbuhan bakteri A ( ),
Berdasarkan hasil uji antagonisme, diameter zona hambatan yang dihasilkan oleh isolat bakteri asosiasi karang lunak berbeda-beda pada setiap bakteri uji. Zona hambatan yang terbentuk merupakan hasil dari perlawanan isolat bakteri asosiasi terhadap pertumbuhan bakteri pembentuk biofilm. Zona hambatan
tersebut mengindikasikan adanya aktivitas antagonisme dari isolat bakteri asosiasi tersebut. Semakin tinggi diameter zona hambatan yang dihasilkan,
mengindikasikan bahwa semakin tinggi pula tingkat perlawanan yang dimiliki oleh isolat bakteri asosiasi. Gambar 13menunjukkan bahwa secara keseluruhan dapat dikatakan bakteri asosiasi Sdmemiliki zona hambat lebih besar
dibandingkan bakteri asosiasi Ls. Hal tersebut menunjukkan bahwa tingkat perlawanan bakteri asosiasi Sd terhadap bakteri pembentuk biofilm lebih tinggi dibandingkan dengan tingkat perlawanan dari bakteri asosiasi Ls.
Gambar 14 fase stasioner berlangsung dari jam ke-10 dengan log kepadatan
9,692832 sel/ml sampai jam ke-42 dengan log kepadatan 9,696906 sel/ml.
Sementara uji hambat dalam penelitian ini menggunakan isolat bakteri yang sudah memasuki fase kematian (jam ke-48) sehingga diduga produktivitas metabolit sekunder yang dihasilkan bakteri mulai menurun.
Sumber: Diolah dari Lampiran 9
Gambar 14. Kurva pertumbuhan bakteri asosiasi karang lunak
Gambar 15. Persentase bakteri pembentuk biofilm yang dihambat oleh bakteri asosiasi karang lunak (Sd dan Ls)
Persentase bakteri asosiasi karang lunak Sd dan Ls yang aktif dalam uji antagonisme terhadap bakteri pembentuk biofilm memperlihatkan bahwa bakteri asosiasi Ls memiliki persentase penghambatan lebih besar terhadap ke tiga bakteri pembentuk biofilm dibandingkan dengan bakteri asosiasi Sd. Secara keseluruhan, berdasarkan grafik dapat dikatakan bakteri asosiasi karang lunak (Sd dan Ls) memiliki aktivitas penghambatan lebih besar terhadap bakteri C. Hal tersebut dikarenakan bakteri C merupakan bakteri Gram (-) yang mana bakteri Gram (-) memiliki struktur dinding sel yang lebih tipis (10-15 nm) dibandingan dengan bakteri Gram (+), sehingga bakteri ini umumnya kurang rentan terhadap senyawa dan gangguan fisik.
4.6. Uji Hambat (Uji Antagonisme) Bakteri Asosiatif Karang Lunak terhadap Pembentukkan Biofilm
16 merupakan tingkat aktivitas penghambatan bakteri asosiasi karang lunak terhadap pembentukkan biofilm dilihat dari diameter zona hambat yang dihasilkan
Sumber: Diolah dari Lampiran 10
Gambar 16. Diameter zona hambatan (mm) uji penghambatan bakteri asosiasi karang lunak Sd dan Ls terhadap biofilm
Uji kuantitatif menunjukkan bahwa setiap isolat bakteri asosiasi karang lunak (Sd dan Ls) semuanya memperlihatkan adanya aktivitas penghambatan terhadap biofilm. Hal tersebut dapat dilihat dari terbentuknya diameter zona hambatan pada setiap isolat bakteri asosiasi karang lunak(Gambar 16). Zona hambat uji antagonisme memperlihatkan hasil bahwa bakteri asosiasi Sd memiliki aktivitas penghambatan yang lebih beragam terhadap pembentukkan
biofilm. Hal tersebut dapat dilihat dari diameter zona hambatan yang dihasilkan pada setiap isolat bakteri asosiasinya. Sementara bakteri asosiasi Lsmemiliki aktivitas penghambatan yang hampir sama pada setiap isolatnya.
Adonizio (2008) menyatakan jika suatu bakteri telah membentuk biofilm
terhadap beberapa jenis antibakteri. Hal tersebut sejalan dengan hasil penelitian ini yang dapat dilihat pada Gambar 17.
Gambar 17. Tingkat resistansi bakteri pembentuk biofilm dan biofilm terhadap bakteri asosiasi Sddan Ls
Berdasarkan Gambar 17 secara keseluruhan dapat dikatakan tingkat resistansi biofilm cenderung lebih tinggi terhadap isolat bakteri asosiasi karang lunak (Sd dan Ls). Meningkatnya tingkat resistansi biofilm dilihat dari
menurunnya diameter zona hambatan yang dihasilkan oleh setiap bakteri asosiasi. Semakin kecil diameter zona hambatan yang dihasilkan artinya semakin tinggi resistansi yang dimiliki oleh bakteri uji. Tingginya tingkat resistansi pada biofilm
sehingga resistansi yang diperoleh tidak hanya berasal dari satu bakteri saja. Hal tersebut diperkuat oleh pernyataan Bauman (2009) bahwa ketika bakteri tersebut menjadi bagian dari biofilm maka bakteri akan saling bekerja sama dan
5. KESIMPULAN DAN SARAN
5.1. Kesimpulan
Bakteri asosiasi yang terisolasi pada karang lunak Sinularia dura (Sd) dan
Lobophytum strictum (Ls) memperlihatkan bahwa jumlah isolat bakteri asosiasi Sd lebih banyak dibandingkan bakteri asosiasi Ls. Hasil isolasi menunjukkan 16 isolat bakteri asosiasi telah berhasil diisolasi dari Sd dan 8 isolat bakteri asosiasi dari Ls. Uji antagonis menunjukkan bahwa 95,83% dari total bakteri asosiasi karang lunak memiliki sifat antagonis terhadap bakteri pembentuk biofilm dan mampu menghambat pembentukkan biofilm. Berdasarkan diameter zona hambatan yang dihasilkan, bakteri asosiasi Sdmemiliki tingkat aktivitas
penghambatan yang lebih tinggi daripada bakteri asosiasi Ls. Uji penghambatan terhadap biofilm menunjukkan bahwa biofilm menjadi lebih resisten terhadap isolat bakteri asosiasi karang lunak dibandingkan dengan bakteri pembentuk
biofilm. SD6 dan LS1 merupakan bakteri asosiasi karang lunak yang memiliki tingkat aktivitas penghambatan paling tinggi terhadap bakteri pembentuk biofilm
dan biofilm. Sehingga bakteri SD6 dan LS1 berpotensi sebagaisumber anti-microfouling alami yang ramah lingkungan.
5.2. Saran
Perludilakukan uji ulangan dengan menggunakan biofilm target untuk mencari penyebab tinggi atau rendahnya efektivitas uji hambat, serta dilakukan uji ulangan dengan menggunakan substansi dari intra dan ekstraseluler bakteri
DAFTAR PUSTAKA
Adonizio, A.L. 2008. Anti-quorum sensing Agents From South Florida Medicinal Plants and Their Attenuation of Pseudomonas aeruginosa
Pathogenicity. FIU Electronic Theses and Dissertations, Florida
International University. http://biobakteri.wordpress.com/2009/06/07/8-biofilm/. (25 Agustus 2011).
Armstrong, E., L. Yan, K.G. Boyd, P.C. Wright, dan J.G. Burgess. 2001. The symbiotic role of marine microbes on living surfaces. Hydrobiologia, 461: 37-40.
Arlyza, S.I. 2007. Bahan aktif dari organisme laut sebagai pengendali biota penempel. Oseana. 32(1): 39-48.
Bauman. 2009. biofilm, Pseudomonas putida, Streptococcus mutans.
http://biobakteri.wordpress.com/2009/06/07/8-biofilm/. (9 Agustus 2011). Bayer, F.M. 1956. Octocorallia. In : Treatise on Invertebrata Palaeotology,
Coelenterata. R.C. Moore. Dan F. Part (ed). Univ. Kansas Press. Lawrence. Birkeland, C. 1997. Life and Death of Coral Reefs. International Thomson
Publishing. New York.
Chambers, L.D., K.R. Stokes, F.C. Walsh, dan R.J.K. Wood. 2006. Modern approaches tomarine antifouling coating. Surface & Coatings Technology, 201: 3642–3652.
Coll, J.C. dan P.W. Sammarco. 1983. Terpenoid toxins of soft corals (Cnidaria, Octocorallia) their nature, toxicity and ecological significance. Toxicol Suppl, 41(3): 69-72.
Davidstout. 1971. Disc plate method of microbiological antibiotic assay. Journal of Microbiology, 22(4): 659-665.
Dewanti, R., dan Haryadi. 1997. Pembentukan biofilm bakteri pada permukaan padat. Buletin Teknolgi dan Industri Pangan, 8(1): 70-76.
Dinensen, Z.D. 1983. Pattern in the distribution of soft coral across the central Great Barrier Reef. Coral Reefs, 1: 229-236.
Donlan, R.M. 2002. Biofilm: Microbial Life on Surface. Emerging Infectious Diseases. 8(9).
Fabricius, K. dan P. Alderslade. 2001. Soft coral and sea fans: a comprehensive guide to tropica; shallow-water genera of the central-west pasific, the indian ocean and the red sea. Institute of Marine Science. Town.
Fachrul, M.F. 2007. Metode sampling bioekologi. Bumi Aksara. Jakarta. Faulkner, D.J., M.. Harper, M.G. Haygood, C.E. Salomon, dan E.W. Schmidt.
2000. Symbiotic bacteria in sponges: source of bioactive substances. In: N. Fusetani (ed). Drugs from the sea. Basel. Karger.
Harder, T. 2004. Analytical chemistry of natural product with Marine Biology, Larval Biology, Environmental Microbology and Molecular Biology. Hariyadi, D. 2004. BOD dan COD sebagai parameter pencemaran air dan baku
mutu air limbah. [Tesis]. Institut pertanian Bogor. Bogor.
Harper, M.K., T.S. Bugni, B.R. Copp, J.D. James, B.S. Lindsay, A.D. Richardson, P.C. Schnabel, D. Tasemir, F.M.V. Wagoner, S.M. Veritski, dan C.M. Ireland. 2001. Introduction to the Chemical Ecology of Marine Natural Products.Hlm.3-29. In J.B. McClintock, B.J. Baker (ed). Marine Chemical Ecology. CRC Press USA. New York.
Ine dan Ant. 2001. RI Tandatangani Konvensi Larangan Penggunaan Cat Kapal. Warta. Ed. Kamis, 11 Oktober 2001.
Ismet, S.A. 2007. Penapisan senyawa bioaktif spons Aaptos aaptos dan Petrosia
sp. dari lokasi yang berbeda. [Tesis]. Institut Pertanian Bogor. Bogor.
Kim, K.Y. 1994. Antimicrobial activity in Gorgonian corals (Coelenterata, Octocorallia). Coral Reefs, 13: 75-80.
Li, Z. 2009. Advance in marine microbial symbionts in the china sea and related pharmaceutical metabolites. Mar. Drugs, 7: 113-129.
Loeb, G.I. dan R.A. Neihof. 1975. Marine conditioning films. In R.E Baier (ed) Applied chemistry at protein interfaces. American Chemical Society, Washington, DC. Advances in Chemistry Series, 1045: 319-335 . Manuputty, W.E.A. 1986. Karang lunak, salah satu penyusun terumbu karang.
Oseana, 11(4): 131-141.
Manuputty, W.E.A. 2002. Karang lunak (soft coral) perairan Indonesia. Puslitbang Oseanologi-LIPI. Jakarta.
Marhaeni, B. 2011. Potensi bakteri simbion tumbuhan lamun sebagai penghambat terjadinya biofouling di laut. [Tesis]. Institut Pertanian Bogor. Bogor. Mearns-Spargg, A., M. Bregu, K.G. Boyd, dan J.G. Burgess. 1998. Cross-species
Munn, C.B. 2004. Marine Microbiology, Ecology and Aplication. Garland Science BIOS Science Publishers.
Murniasih, T. 2005. Substansi kimia untuk mempertahankan diri dari hewan laut tak bertulang belakang. Oseana, 30(2): 19-27.
Murniasih, T. dan A. Rasyid. 2010. Potensi bakteri yang berasosiasi dengan spons asal Barang Lompo (Makassar) sebagai sumber bahan antibakteri. Oseana,
36(3): 281-292.
Nofiana, R., Kadarisno, Daryat, dan A. Sapan. 2009. Characteristics of Antimicrobial Activity of Eucheuma cottonii Doty-Associated Bacteria Extracts. Jurnal Pengolahan Hasil Perikanan Indonesia, 12(2): 14-153. Nybakken, J.W. 1992. Biologi laut: suatu pendekatan ekologis. Diterjemahkan
oleh H.M. Eidman, Koesobiono, D.G. Bengen, M. Hutomo, dan S. Sukardjo. PT. Gramedia. Jakarta.
Pelczar, M. J. dan E.C.S. Chan. 2005. Dasar-Dasar Mikrobiologi 2.
Diterjemahkan oleh R.S. Hadioetomo, T. Imas, S.S. Tjitrosomo, dan S.L. Angka. Penerjemah. UI Press, Jakarta.
Proksch, P., R.A. Edraa, dan R. Ebel. 2002. Drugs from the seas-current status and microbiological implications. Appl. Microbiol. Biotechnol, 59:125-134. Radjasa, O.K., A. Sabdono. dan Suharsono. 1999. The growth inhibition of
marine biofilm-forming bacteria by the crude extract of soft coral Sinularia
sp. J. Coastal Development, 2: 329-334.
Radjasa, O.K. 2004. Marine invertebrate-associated bacteria in coral reef
ecosystem as a new source of ioactive compounds. J. Coast. Dev, 7: 65-70. Railkin, A.I. 2004. Marine Biofouling; Colonization Processes and Defence. CRC
Press. Florida.
Raveendran, T.V. dan M.P.V. Limna. 2009. Natural Product Antifoulants. Review Article. National Institute of Oceanography (Regional Centre). India.
Rittchof, D. 2001. Natural poduct antifoulant and coatings development. In: J.B. Mcclintock, dan B.J. Baker (ed). Marine Chemical Ecology (eds). CRC Press
Sabdono, A., O.K. Radjasa, dan T. Bachtiar. 2005. Eksplorasi senyawa bioaktif antifoulant bakteri yang berasosiasi dengan avertebrata laut sebagai alternatif penanganan biofouling di laut. Pusat studi pesisir dan laut tropis. Universitas Diponegoro. Semarang.
Sammarco, P.W. dan J.C. Coll. 1988. The chemical ecology of alcyonarian corals (Coelenterata: Octocorallia). In: Scheuer, P. J. (ed.). Bioorganic marine chemistry, (2): 87-116.
Sammarco, P. W. dan J.C. Coll. 1990. Lack of predictability in terpenoid function: multiple roles and integration with related adaptations in soft corals. J. Chem. Ecol, 16: 273-289.
Sammarco, P.W. dan J.C. Coll. 1992. Chemical adaptation in the Octocorallia: Evolutionary considerations. Marine Ecology Progress Series, 88: 93-104. Soedharma, D. dan A. Fauzan. 1996. Imposex pada Neogastropoda (Thais sp)
sebagai akibat kontaminasi Tributyltin (Senyawa Sn) dari cat pelapis Kapal di sekitar Pelabuhan Ratu, Jawa Barat. Jurnal Ilmu-ilmu Perairan dan Perikanan Indonesia, 4(1): 45-53.
Sudaryanto, A., M. Muhtar, H. Razak, dan S. Tanabe. 2001. Pencemaran Senyawa Butyltin di sedimen dari perairan Indonesia. Jurnal Sains dan Teknologi, 3(5): 64-69.
Torsell, K.B.G. 1983. Natural product chemistry: a mechanistic and biosynthetic approach to secondary metabolisme. British: John Wiley & Sons,Ltd. Tursch, B., C.J. Braekman, D. Dalose, dan M. Kasin. 1978. Terpenoid from
Lampiran 1. Identifikasi Sampel Karang Lunak
1. Sinularia dura
a). Pengamatan dengan Mikroskop
a.Fragmen karang lunak b. Potongan fragmen c. Perendaman
d. Koloni karang lunak e. Spikula bagian lobus f. Spikula bagian basal
b. Perbandingan dengan Literatur (Manuputty, 2002)
Hasil Pengamatan Literatur
a. Spikula pada bagian lobus
2. Lobophytum strictum
a). Pengamatan dengan Mikroskop
a. Fragmen karang lunak b. Potongan fragmen c. Perendaman
d. Koloni karang lunak e. Spikula bagian lobus f. Spikula bagian basal
b. Perbandingan dengan Literatur (Manuputty, 2002)
Hasil Pengamatan Literatur