DINAMIKA POPULASI PLANKTON
DALAM AREA PUSAT PENANGKAPAN BENUR DAN NENER
DI PERAIRAN PANTAI KECAMATAN SUPPA
KABUPATEN PINRANG, SULAWESI SELATAN
NUR ASIA UMAR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
x
Halaman
DAFTAR TABEL ………... xii
DAFTAR GAMBAR ……….……... xiv
DAFTAR LAMPIRAN ………... xviii
I PENDAHULUAN ………... 1
Latar Belakang ……….. 1
Rumusan Masalah ………... 3
Tujuan dan Kegunaan ………... 7
II TINJAUAN PUSTAKA ……….. 8
Distribusi dan Kelimpahan Fitoplankton ……….. 8
Pertumbuhan Fitoplankton dan Produktivitas Primer ………... 10
Distribusi dan Kelimpahan Zooplankton ……….. 11
Pemangsaan Zooplankton Terhadap Fitoplankton ... 14
Benur, Nener dan Larva Lainnya ... 20
Parameter Lingkungan dan Nutrien ... 25
III METODE PENELITIAN ………... 31
Waktu dan Lokasi ... 31
Pengambilan Data ... 32
Pengukuran Parameter Lingkungan ... 32
Pengambilan Sampel Plankton dan Larva ... 33
Pengukuran Produktivitas Primer ... 35
Pengamatan Pemangsaan ... 36
Analisis Data ... 38
Parameter Lingkungan ... 39
Produktivitas Primer ... 40
Distribusi dan Kelimpahan Plankton, Benur, Nener dan Larva Lainnya ... 41
Pemangsaan Plankton ... 41
Dinamika Populasi Plankton ... 43
IV HASIL DAN PEMBAHASAN ……… 44
Parameter Lingkungan ……….. 44
Suhu ……….. 44
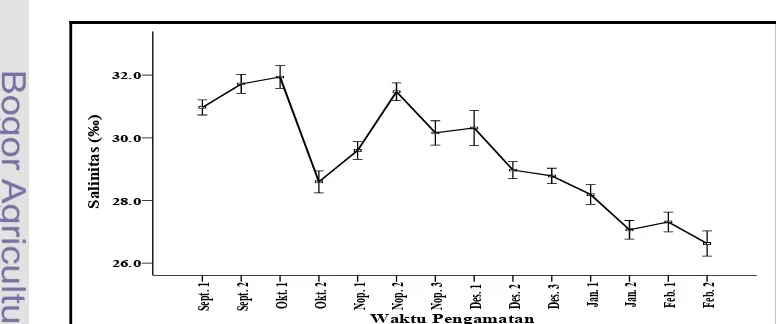
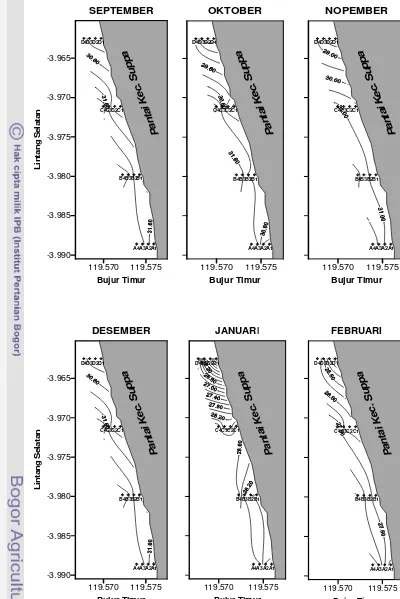
Salinitas ……… 46
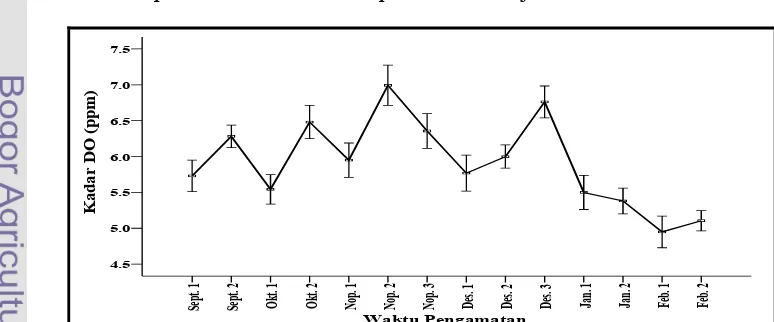
Kadar Oksigen Terlarut (DO) ... 48
Kecepatan Arus ……… 50
Kadar Nutrien ………... 51
Parameter Lingkungan Berdasarkan Musim Benur dan Nener ... 52
Latar Belakang
Fitoplankton memiliki peranan penting dalam ekosistem perairan, sebagai
organisme autotrof yang mampu mensintesis sejumlah bahan organik dari bahan
anorganik melalui proses fotosintesis (Nybakken 1992; Nontji 1987). Produksi
primer yang dihasilkan oleh fitoplankton ini sangat penting bagi kehidupan
organisme lainnya di dalam suatu perairan. Dalam struktur rantai makanan
fitoplankton dikonsumsi oleh zooplankton dan selanjutnya kedua golongan
plankton ini menjadi sumber makanan utama berbagai jenis organisme pada stadia
awal perkembangannya. Larva berbagai jenis ikan, udang dan hewan yang
memiliki nilai ekonomis penting memiliki ketergantungan yang sangat tinggi
terhadap kelimpahan fitoplankton dan zooplankton di perairan pantai (Hinrichsen
et al. 2002).
Produksi primer yang dihasilkan oleh fitoplankton sangat ditentukan oleh
kelimpahan dan komposisi jenis fitoplankton yang ada dalam suatu perairan.
Komposisi jenis dan kelimpahan fitoplankton sangat dipengaruhi oleh kondisi
lingkungan dan aktivitas pemangsaan oleh zooplankton dan organisme planktivor
lainnya. Nutrien dan cahaya merupakan parameter lingkungan laut yang memiliki
pengaruh yang sangat besar terhadap kelimpahan fitoplankton di laut maupun
perairan pantai. Intensitas pemangsaan melalui grazing zooplankton dan
pemangsaan oleh larva berbagai jenis hewan tingkat tinggi juga merupakan faktor
utama yang cukup berpengaruh terhadap kelimpahan fitoplankton.
Ekosistem perairan pantai yang relatif dinamis mengalami perubahan baik
dalam skala waktu harian melalui pasang surut maupun skala musiman yang
terkait dengan proses fisik yang mengalami siklus musiman seperti curah hujan,
masukan nutrien melalui run off, intensitas penyinaran dan suhu yang akan
mempengaruhi dinamika populasi fitoplankton secara musiman di pantai. Oleh
karena itu produktivitas primer akan mengalami dinamika sesuai dengan dinamika
populasi fitoplankton yang dipengaruhi oleh kondisi lingkungan dan aktivitas
mempengaruhi kelimpahan dan kelangsungan hidup populasi benur, nener dan
larva beberapa hewan tingkat tinggi lainnya.
Berkaitan dengan pemangsaan terhadap populasi fitoplankton maupun
zooplankton, larva udang windu (Penaeus monodon Fab.) dan larva ikan bandeng
(Chanos chanos Forsk.) merupakan larva yang secara musiman mempengaruhi
kelimpahan fitoplankton dan zooplankton di beberapa perairan pantai di pesisir
pantai barat Sulawesi Selatan. Pada stadia larva kedua jenis ini mengkonsumsi
plankton sebagai makanan utamanya. Oleh karena itu kelangsungan hidupnya
sangat ditentukan oleh ketersediaan plankton di pantai. Kelimpahan benur dan
nener secara musiman sangat ditentukan oleh jumlah larva yang dihasilkan dari
pemijahan dan selanjutnya kelangsungan hidup pada perkembangan stadia larva
sangat dipengaruhui oleh ketersediaan makanannya.
Penangkapan benur dan nener dari alam telah lama dilakukan oleh
masyarakat pesisir pantai di Sulawesi Selatan. Sampai saat ini penangkapan
benur dan nener itu masih cukup intensif dilakukan terutama pada daerah-daerah
tertentu seperti di Kabupaten Pinrang, Barru, dan Bantaeng. Bahkan akhir-akhir
ini teknik penangkapan tradisionil dengan menarik jaring (seser) oleh tenaga
manusia semakin dikembangkan dengan cara menggunakan perahu motor tempel.
Indikasi ini menunjukkan bahwa minat para petani tambak untuk menggunakan
benur dan nener alami masih terus meningkat, meskipun penyediaan benih dari
hatchery dengan harga lebih murah dan jumlah yang banyak juga semakin
meningkat. Hal ini disebabkan adanya beberapa keunggulan benur dan nener
alami dibandingkan dengan produksi hatchery, seperti daya tahan dan tingkat
kelangsungan hidup yang relatif lebih tinggi, namun jumlah dan kontinyuitasnya
sangat terbatas dan tergantung pada musim.
Kegiatan penangkapan benur dan nener pada beberapa sentra penangkapan
dilakukan secara musiman, mengikuti kelimpahan populasinya di alam. Puncak
musim biasanya terjadi pada musim barat. Populasi benur dan nener pada musim
tersebut mencapai kepadatan yang sangat tinggi dan biasanya berlangsung hanya
beberapa bulan saja. Secara alamiah dengan meningkatnya populasi benur dan
nener di alam pada musim tertentu akan berpengaruh terhadap populasi plankton
pemangsaan pada musim tersebut maka populasi fitoplankton akan mengalami
perubahan sesuai keseimbangan antara daya dukung lingkungan dan laju
pemangsaan.
Melihat gejala ini maka dapat diduga bahwa ada faktor-faktor yang
menyebabkan populasi benur dan nener itu sangat melimpah pada musim tersebut.
Faktor-faktor apa saja yang sangat erat kaitannya dengan kelimpahan tersebut
sejauh ini masih dikaitkan dengan waktu pemijahan ikan dan udang dewasa.
Sementara informasi mengenai beberapa parameter bioekologi masih terbatas.
Bagaimana hubungan antar populasi plankton dengan kelimpahan benur dan nener
berikut mekanisme mangsa memangsa yang membentuk dinamika populasinya
merupakan salah satu kajian yang dianggap perlu untuk diteliti. Hal ini
merupakan salah satu yang melatarbelakangi sehingga penelitian ini dilaksanakan.
Rumusan Masalah
Pola musim melimpahnya larva benur dan nener adalah pada musim barat
sekitar bulan Desember sampai Februari (musim barat yaitu Desember sampai
Februari, musim pancaroba I Maret sampai Mei, musim timur yaitu Juni sampai
Agustus, musim pancaroba II yaitu September sampai Nopember). Musim ini
pada beberapa pantai di sepanjang pantai barat Sulawesi Selatan sangat terkait
dengan musim pemijahan udang dan ikan bandeng. Pola angin dan arus pada
musim tersebut menyebabkan terbawanya benur dan nener yang baru menetas dari
laut menuju pantai. Konsentrasi larva yang tinggi di perairan pantai menyebabkan
tekanan pemangsaan terhadap plankton terutama fitoplankton relatif cukup besar.
Akibatnya terjadi perubahan kelimpahan populasi plankton yang cukup cepat dan
akhirnya menyebabkan perubahan pula pada produktivitas primer. Jika
produktivitas primer tidak meningkat dari waktu sebelum puncak hingga
kelimpahan benur dan nener mencapai puncaknya, maka akibatnya dapat
dipastikan bahwa sebagian besar benur dan nener akan mati karena kekurangan
makanan, hal ini sesuai dengan pernyataan Smith dan Eppley (1982) yang
menyatakan bahwa produksi ikan anchovy berhubungan erat dengan produktivitas
primer. Produksi rata-rata musiman ikan anchovy paling tinggi ketika
oleh variasi produktivitas primer. Sebaliknya jika laju produktivitas primer
meningkat pada puncak musim hingga mencapai titik yang dapat mendukung
populasi benur dan nener sehingga terjadi keseimbangan dengan tekanan
pemangsaan maka jelas bahwa kematian populasi benur dan nener bukan akibat
kekurangan makanan. Untuk menjelaskan kejadian tersebut maka perlu dilakukan
penelitian cermat yang mempelajari hubungan antara kelimpahan plankton dan
produktivitas primer dengan kelimpahan populasi benur dan nener di lokasi
penelitian.
Populasi plankton yang tersusun dari berbagai taksa atau genera sangat
memungkinkan adanya perbedaan respon baik terhadap faktor lingkungan
maupun terhadap tekanan pemangsaan. Karena diduga bahwa tidak semua jenis
fitoplankton dan zooplankton dikonsumsi dalam jumlah yang sama oleh populasi
benur dan nener, maka hal ini berpotensi menyebabkan perbedaan dalam
kelimpahan dan dinamika populasi antar jenis plankton. Apabila masalah ini
hanya dilihat dari perubahan produktivitas primer pada tingkat populasi maka
sangat sulit untuk menjelaskan terjadinya perbedaan antar jenis tersebut. Dengan
demikian masalah ini memerlukan pengamatan melalui pemangsaan yang mampu
mengidentifikasi paling tidak pada tingkat genera. Untuk menjelaskan lebih detail
mengenai dinamika populasi plankton diperlukan fakta-fakta yang lebih detail
mengenai pola perubahan distribusi dan kelimpahan diantara genera-genera
penyusun populasi tersebut berdasarkan responnya terhadap perubahan
lingkungan dan pemangsaan benur dan nener.
Benur dan nener yang bersifat planktonik dan juga makan plankton sangat
dipengaruhi oleh populasi fitoplankton dan zooplankton serta larva hewan tingkat
tinggi lainnya. Ketika mencapai puncak musim, peningkatan populasi benur dan
nener yang tinggi mutlak memerlukan banyak makanan. Masalahnya adalah
apakah daya dukung lingkungan (berdasarkan kelimpahan dan produktivitas
primer) mampu memenuhi kebutuhan benur dan nener serta jenis apa saja yang
menjadi makanannya, pemangsa dan pesaing dalam perebutan sumberdaya bagi
benur dan nener dari sekian banyak jenis plankton yang ada. Jika telah diketahui
berpengaruh, seberapa besar pengaruh perubahan populasi plankton terhadap
plankton maupun benur dan nener terhadap perubahan parameter lingkungan?
Oleh karena itu agar masalah tersebut dapat dijelaskan perlu dilakukan penelitian
yang mempelajari dinamika populasi plankton, benur dan nener serta larva lainnya
yang juga bersifat planktonik, termasuk pengaruh parameter lingkungan terhadap
populasi plankton yang ada di dalamnya.
Permasalahan yang dijelaskan di atas dapat dijawab melalui penelitian
dengan melakukan serangkaian kegiatan seperti pengambilan data kelimpahan
plankton dan pengukuran beberapa parameter lingkungan dalam waktu yang
bersamaan secara periodik dan meliputi waktu sebelum, pada saat dan setelah
puncak musim benur dan nener, pengukuran produktivitas dan pengamatan laju
pemangsaan benur, nener dan larva lain terhadap plankton. Melalui kerangka
berfikir dan sesuai dengan tujuan penelitian ini maka rumusan masalah dalam
penelitian ini secara skematis ditunjukkan dalam diagram seperti dalamGambar 1.
Berdasarkan permasalahan tersebut maka dibuat hipotesis dalam penelitian ini
yaitu:
(1) Kelimpahan plankton dan produktivitas primer pada puncak musim lebih
tinggi jika dibandingkan dengan sebelum dan sesudah puncak musim benur
dan nener.
(2) Laju pemangsaan benur, nener dan larva lain terhadap populasi plankton
tergantung pada kelimpahan plankton dan terjadi kompetisi antara benur,
nener dan larva lain dalam memangsa plankton.
(3) Dinamika populasi plankton dipengaruhi oleh parameter lingkungan dan
pemangsaan oleh benur, nener dan larva lainnya, perubahan populasi
plankton mempengaruhi perubahan populasi benur dan nener dan ada spesies
Tujuan dan Kegunaan
Tujuan utama penelitian ini adalah:
(1) Untuk mempelajari bagaimana hubungan antara parameter lingkungan,
kelimpahan plankton dan produktivitas primer dengan kelimpahan benur dan
nener di lokasi penelitian.
(2) Mengkaji dinamika populasi plankton, benur dan nener sebelum, pada saat,
dan setelah puncak musim benur dan nener.
Hasil penelitian ini diharapkan dapat memberikan informasi dasar
mengenai karakteristik perairan pantai, kapasitas daya dukung dan dinamika
sistem planktonik serta pengaruhnya terhadap populasi benur dan nener. Selain
itu diharapkan dari pengetahuan tentang dinamika populasi plankton di lokasi
penelitian dapat menjadi acuan dasar dalam merumuskan kebijakan untuk upaya
peningkatan populasi benur dan nener.
Distribusi dan Kelimpahan Fitoplankton
Distribusi biogeografis plankton sangat ditentukan oleh faktor lingkungan,
seperti cahaya, temperatur, salinitas, nutrien, pH, arah dan kecepatan arus. Faktor
tersebut sangat menentukan keberadaan dan kesuksesan spesies plankton di suatu
lingkungan (Parsons et al. 1984; Valiela 1984). Lebih lanjut Parsons et al. (1984)
mengemukakan bahwa tidak mudah untuk menjelaskan kondisi yang berlaku
umum tentang penyebaran fitoplankton secara horisontal di laut. Hal ini
disebabkan oleh perbedaan kondisi ekologi pada bagian-bagian laut yang berbeda,
seperti di daerah pantai dan estuari, pesisir pantai dan laut lepas.
Ada kecenderungan persebaran fitoplankton bersifat lebih mengelompok
di daerah neritik dibanding dengan di oseanik (lepas pantai).
Kecenderungan pengelompokan fitoplankton secara horisontal
kemungkinan berhubungan dengan variasi parameter fisika, kimia dan biologi
(salinitas, turbulensi, dan pemangsaan). Keragaman distribusi horisontal ini lebih
nampak di daerah dekat pantai, estuari, dan teluk dibanding di laut terbuka.
Umumnya fitoplankton di laut terbuka kurang melimpah dan distribusinya lebih
merata dibandingkan dengan fitoplankton di dekat pantai (Lorenzen 1971;
Venrick 1972, diacu dalam Levinton 1982).
Secara spasial dan musiman, penyusun biomassa dan ukuran sel
fitoplankton di daerah paparan benua sebelah timur laut Selandia Baru berkaitan
dengan keterbatasan nutrien, cahaya dan pemangsaan. Pada awal musim semi dan
selama turbulensi dan upwelling musim dingin fitoplankton didominasi oleh
diatom berbentuk rantai dan berukuran besar. Blooming menurun pada akhir
musim semi karena keterbatasan nutrien, diatom berukuran lebih kecil bertepatan
dengan munculnya dinoflagellata, nannoflagellata kecil dan picofitoplankton pada
awal dan akhir musim panas (Chang et al. 2003).
Cahaya sangat menentukan persebaran fitoplankton di laut. Fitoplankton
dapat beradaptasi dengan kondisi cahaya yang masuk dalam perairan, sehingga
Fitoplankton tipe terang hidup di permukaan dan mempunyai kemampuan untuk
beradaptasi menggunakan intensitas cahaya tinggi dengan efisien (Nontji 1984).
Nontji (1975) yang telah meneliti 38 stasiun di daerah upwelling
Laut Banda mendapatkan rata-rata kandungan klorofil-a untuk kedalaman 0, 25,
50, 75 dan 100 meter masing-masing sebesar 0.26, 0.38, 0.33, 0.18 dan
0.08 mg/m3. Klorofil-a maksimum umumnya ditemukan pada kedalaman 25 dan
50 meter. Sedangkan Dickson dan Wheeler (1993) mendapatkan adanya
perbedaan kedalaman konsentrasi klorofil-a maksimum menurut letak lintang
di garis bujur 152oB. Pada lintang 28oU, 37oU, 42oU dan 48oU secara berurut
memiliki kedalaman konsentarsi klorofil-a maksimum yaitu 130, 100, 40 dan 0
meter. Sejalan dengan hal itu, Matsumura-Tundisi et al. (1997) berdasarkan hasil penelitiannya di bagian timur Lautan Hindia menyatakan bahwa sebaran
konsentrasi klorofil-a pada bagian atas lapisan permukaan tercampur sangat
sedikit, dan mulai meningkat menuju bagian bawah dari lapisan permukaan
tercampur dan menurun secara drastis pada lapisan termoklin hingga tidak ada
lagi klorofil-a di bawah lapisan termoklin.
Perbedaan kelimpahan dan spesies yang mendominasi komunitas
fitoplankton pada tiga perairan teluk (Jakarta, Lampung dan Semangka) yang
berbeda didapatkan dari hasil penelitian Damar (2003). Meskipun pada ketiga
teluk komunitas fitoplankton didominasi oleh diatom, namun terdapat perbedaan
dalam tingkat genus dan spesies yang mendominasi. Spesies dari diatom kecil
yang berbentuk rantai Skeletonema costatum dan Chaetoceros spp. terutama
mendominasi daerah lepas pantai di Teluk Jakarta, sementara di perairan pantai
yang kurang teraduk Chyanophycea (Trichodesmium spp.) dan Dinophyceae
(Ceratium spp. dan Dynophysis caudata) juga ditemukan tetapi dengan jumlah
yang relatif terbatas dibandingkan dengan diatom. Teluk Lampung dan Teluk
Semangka lebih didominasi oleh Chaetoceros spp., di daerah yang kurang
teraduk dan lebih terstratifikasi di mulut sungai didapatkan dinoflagellata dan
cyanophyceae yang lebih melimpah dibandingkan dengan di lepas pantai.
Distribusi vertikal klorofil di laut pada umumnya berbeda menurut waktu,
pada suatu saat ditemukan maksimum di dekat permukaan, namun di lain waktu
1960, diacu dalam Parsons et al.1984). Hal ini didukung oleh kenyataan yang
didapatkan oleh Setiapermana et al. (1992) di Lautan Hindia bagian timur dan
Arinardi (1994) di Teluk Jakarta yang menunjukkan adanya perbedaan distribusi
klorofil-a pada musim yang berbeda. Mann dan Lazier (1991) menyatakan bahwa
secara umum produktivitas primer fitoplankton dipengaruhi oleh berbagai aspek
fisika di laut.
Pertumbuhan Fitoplankton dan Produktivitas Primer
Respon fitoplankton terhadap intensitas cahaya sangat dipengaruhi oleh
pigmen yang dikandungnya. Perbedaan pigmen yang dikandung antara jenis
fitoplankton menyebabkan perbedaan intensitas cahaya yang diabsorbsi. Hal ini
berpengaruh terhadap tingkat efisiensi fotosintesis. Lebih spesifik Levinton
(1982) menyatakan bahwa fitoplankton berfotosintesis menggunakan klorofil a, c
dan pigmen tambahan seperti protein fucoxanthin dan peridinin yang secara
lengkap menggunakan semua cahaya dalam spektrum tampak. Cahaya dengan
panjang gelombang lebih dari 600 nm diabsorbsi oleh klorofil dan yang kurang
dari 600 nm diabsorbsi oleh pigmen tambahan.
Gabric dan Parslow (1989) menyatakan bahwa faktor fisik utama yang
mengontrol produksi fitoplankton di daerah eutrofik adalah percampuran vetikal,
penetrasi cahaya dalam kolom air dan laju pengendapan sel-sel fitoplankton itu
sendiri. Sharples et al. (2001) mendapatkan konsentrasi klorofil-a maksimum di
lapisan termoklin pada perairan terstratifikasi sempurna di bagian barat Selat
Inggris. Konsentrasi klorofil-a maksimum (sekitar 45 mg/m3) pada kedalaman
sekitar 30 meter dengan ketebalan sekitar 5 meter. Kedalaman tersebut
merupakan lapisan di sekitar batas bawah lapisan termoklin dan sangat dekat
dengan lapisan dimana kandungan kadar nitrat sangat tinggi. Maksimumnya
konsentrasi klorofil-a pada kedalaman tersebut berkaitan dengan intensitas
cahaya, konsentrasi nitrat dan energi disipasi turbulensi akibat pengaruh pasang
surut.
Observasi selama satu dekade di utara Teluk San Fransisco menunjukkan
bahwa biomassa fitoplankton estuari berfluktuasi dalam skala waktu beberapa hari
fluktuasi energi pasang surut. Blooming biomassa fitoplankton meningkat dari
2 - 4 mg klorofil-a per m3 sampai puncaknya 20 - 40 mg klorofil-a per m3
kemudian menurun kembali dalam beberapa minggu. Peningkatan biomassa
terjadi selama pasang perbani dan setiap penurunan bersesuaian dengan pasang
purnama. Hal ini menunjukkan bahwa variasi harian laju percampuran vertikal
akibat pasang surut kemungkinan mengontrol dinamika blooming fitoplankton
di estuari (Cloern 1991).
Hasil penelitian Peperzak et al. (2003) mengenai laju pengendapan
fitoplankton di wilayah Rhine yang mendapat pengaruh air tawar tidak
memperlihatkan adanya hubungan linier antara ukuran fitoplankton (< 10 sampai
> 1000 µm) dengan laju pengendapan (–0.4 sampai > 2.2m hari-1) 24 spesies dan
genus fitoplankton autotrof. Faktanya, di bawah kondisi nutrien cukup laju
pengendapan diatom (Chaetoceros radicans), Rhizosolenia shrubsolei dan
Rhizosolenia stolterfothii menurun dengan meningkatnya ukuran. Laju
pengendapan koloni yang besar dari prymnesiophyte Phaeocystis globosa
berkorelasi negatif dengan ukuran dan berkorelasi positif dengan bouyancy. Laju
pengendapan klorofil-a secara periodik melebihi satu meter per hari, cukup
signifikan untuk menyebabkan laju kehilangan pada lapisan permukaan sebanyak
0.2 µg klorofil-a per hari. Pada kondisi terstratifikasi, laju pengendapan dan
konsentrasi klorofil-a pada lapisan dasar signifikan lebih tinggi dibandingkan
dengan lapisan permukaan (secara berurut +49% dan +16%).
Distribusi dan Kelimpahan Zooplankton
Dubi et al. (2003) menyatakan bahwa variabel lingkungan seperti suhu,
salinitas, pH dan oksigen terlarut berpengaruh terhadap komunitas plankton dan
fitobentos. Perbedaan salinitas antara musim hujan dan kemarau menyebabkan
perbedaan kelimpahan zooplankton, dimana selama musim hujan dengan salinitas
rendah rotifer melimpah, sedangkan selama musim kering protozoa dan kopepoda
yang melimpah.
Suhu memiliki salah satu peranan penting dalam karakter life history
Pseudocalanus newmani, tidak hanya pertumbuhan dan reproduksi yang
yang dikontrol suhu di bawah suplai makanan yang cukup (Lee et al. 2003). Pada
kisaran suhu 3 - 15oC, perkembangan dari penetasan sampai mencapai betina
dewasa meningkat secara eksponensial dengan menurunnya suhu. Di atas suhu
15oC, laju pertumbuhan berat spesifik (SGR) meningkat secara linier dengan suhu
dengan persamaan: SGR = 0.0095T + 0.0462(r = 0.996). Sementara laju produksi
berat telur spesifik (SER) meningkat dengan meningkatnya suhu mengikuti
persamaan: SER = 0.02T + 0.014 (r = 0.99) di bawah suhu 15 oC. Pada suhu
tinggi (20 oC) perkembangan embrio dan postembrio dan produksi telur tertekan.
Pengaruh penghambatan suhu tinggi ini terkait dengan kisaran distribusi vertikal
dan siklus kelimpahan musiman di alam.
Uye dan Shimazu (1997) mendapatkan adanya perbedaan musim
kelimpahan, biomassa dan laju produksi meso dan makro plankton di Laut Inland,
Jepang. Rata-rata biomassa net-zooplankton di lokasi tersebut lebih tinggi pada
bulan Oktober (35.5 mg C m–3) dibandingkan dengan bulan lainnya (13.2, 14.9
dan 16.4 mg C m–3, pada Januari, April dan Juni 1994). Dari biomassa tersebut
kopepoda merupakan bagian yang penting (rata-rata tahunan 65%), diikuti oleh
chaetognata (12%) dan malacostraca yang terdiri dari euphausiid, mysid, dan
larva decapoda (10%). Net-zooplankton dibagi ke dalam produser sekunder dan
produser tertier, menurut kebiasaan makannya. Rata-rata tahunan produksi
sekunder dan produksi tertier adalah 4.35 mg C m–3 hari–1 (=51.8 g C m–2 th–1)
dan 1.68 mg C m–3 hari–1 (=20.0 g C m–2 th–1). Kedua laju produksi paling tinggi
pada bulan Oktober dibanding dengan bulan lainnya, dalam respon yang tidak
selalu diikuti dengan laju produksi fitoplankton tinggi pada bulan tersebut.
Zooplankton yang mudah dimakan oleh ikan yang khas pemakan plankton
bertahan pada perairan yang lebih dalam dan gelap pada siang hari. Posisi
vertikal mungkin dipengaruhi oleh profil suhu dan oksigen, tetapi intensitas
cahaya menjadi faktor kritis yang penting. Kecerahan air tergantung pada
konsentrasi karbon organik terlarut (DOC), dengan demikian perbedaan pola
distribusi vertikal zooplankton bervariasi berdasarkan kandungan DOC.
Cladosera kecil didapatkan lebih di atas dibanding cladosera besar, sementara
kopepoda berada pada kolom air lebih dalam. Perairan yang jernih ditentukan
waktu tertentu. Suhu dan oksigen juga merupakan variabel utama yang
menentukan distribusi vertikal zooplankton (Wissel & Ramacharan 2003).
Nejstgaard et al. (2001) telah meneliti pertumbuhan, aktivitas makan dan
keberhasilan reproduksi zooplankton Calanus helgolandicus secara simultan
dalam kondisi blooming plankton yang didominasi diatom dan mikrozooplankton
flagellata. C. helgolandicus umumnya menyukai makanan bukan diatom seperti
ciliata dan metazoa. Produksi spesifik karbon dalam tubuh naupli betina tertinggi
10.6% per hari terjadi selama blooming mikrozooflankton flagellata, kemudian
menurun sekitar 1.7% per hari selama blooming Dictyocha speculum. Dalam
perairan yang didominasi diatom produksi spesifik karbon menurun sampai 0.1%
dan selalu <5.2% per hari. Selanjutnya didapatkan total standing stock kopepoda
calanoid meningkat sampai 2.6 kali lebih banyak pada mesocosm yang
didominasi mikrozooplankton flagellata. Penurunan keberhasilan reproduksi
dalam perairan yang didominasi diatom terlihat ketika laju pemangsaan tinggi,
ciliata dan mangsa lainnya menyusun bagian subtansial makanan. Hal ini
menunjukkan bahwa semua mangsa lainnya termasuk ciliata kualitasnya rendah,
dan atau komponen penghambat tersebut mungkin memiliki peran penting selama
blooming diatom, terjadi ketika jumlah yang signifikan dari mangsa alternatif
tersedia. Hasil ini juga mendukung bahwa blooming silicoflagellata Dictyocha
speculum mungkin berpengaruh negatif terhadap reproduksi kopepoda. Tingginya
konsentrasi populasi zooplankton di Western Bank, Scotian Shelf disebabkan
karena lebih tingginya laju produksi yang melampaui laju hilangnya akibat
adveksi sebagai pengaruh arus. Calanus typicus dan Pseudocalanus spp dapat
meningkatkan populasinya melampaui laju kematian sekitar 10% per hari.
Hasil pengamatan Tarling et al. (1998) terhadap migrasi vertikal
komunitas zooplankton yang didominasi oleh eupausid Meganyctiphanes
norvegica menunjukkan bahwa bulan berpengaruh terhadap migrasi vertikal
zooplankton. Permulaan turunnya zooplankton berkorelasi sangat kuat dengan
waktu terbitnya bulan. Hasil ini menunjukkan bahwa M. norvegica berespon
terhadap cahaya bulan.
Laju produksi dan kesuksesan penetasan telur Centropages hamatus dan
Hasilnya menunjukkan bahwa dalam kondisi terdapat makanan alami, peranan
penetasan yang terhambat dan laju pengendapan yang tinggi menyebabkan
hilangnya telur dari kolom air. Kumulatif kesuksesan penetasan selama 15 hari
konsisten tinggi selama bulan Maret-Juni, yaitu 80% dan 70% masing-masing
pada Centropages hamatus dan Temora longicornis. Laju pengendapan telur
untuk Centropages hamatus berkisar antara 4.6 - 22.4 m per hari dan 13.4 - 25.4
m per hari untuk Temora longicornis. Dalam perairan dangkal seperti di Long
Island Sound (<20 m) sering terjadi telur mengendap ke dasar perairan sebelum
menetas.
Somoue et al. (2005) mendapatkan 78 spesies dari 24 famili kopepoda di
perairan pantai bagian Selatan Maroko. Pada umumnya kopepoda menghuni
perairan pantai, empat jenis diantaranya yang dominan adalah Calanus
helgolandicus, Paracalanus parvus, Acartia clausi dan Corycaeus typicus.
Keempat spesies tersebut jumlahnya mencapai 57% dari total kpepoda pada
musim panas.
Pemangsaan Zooplankton Terhadap Fitoplankton
Greze (1987) menggunakan metode secara fisiologis dalam pendugaan
laju pertumbuhan populasi zooplankton di Laut Mediterania. Hasilnya
menunjukkan bahwa laju pertumbuhan spesifik kopepoda pada lapisan permukaan
100 meter mencapai rata-rata 0.10 mg/m3, krustasea pelagis 0.05-0.06 mg/m3,
chaetognatha 0.08-0.10 mg/m3, coelenterata 0.13-0.14 mg/m3. Berdasarkan atas
biomassa, taksonomi dan komposisi zooplankton pada bagian-bagian yang
berbeda di Laut Mediterania, nilai produksi diduga terdiri dari herbivor, carnivor
dan euryphage.
Aktivitas pemangsaan zooplankton dapat ditentukan dengan berbagai cara
berdasarkan pada pengukuran terhadap variasi penjejak dalam makanan terhadap
waktu. Metode inkubasi berdasarkan pada pengukuran jumlah fitoplankton atau
klorofil-a dalam medium menurut waktu tertentu. Metode ini termasuk
pengukuran secara tidak langsung. Pengukuran tidak langsung lainnya adalah
berdasarkan pada produksi faecal pellets. Kwint dan Kramer (1996)
zooplankton. Isi lambung zooplankton diukur dari b-dimethylsulphoniopropionate
(DMSP), yang dapat mengukur kejadian dalam individu kopepoda. Tracer
gabungan tersebut menggabungkan sensitivitas tinggi, deteksi dalam lambung
zooplankton dan kemungkinan diaplikasikan di lapangan. Laju pengisian dan laju
pengosongan lambung dapat diduga dalam metode tersebut berdasarkan pada
analisis terhadap senyawa sulfur b-dimethylsulphoniopropionate (DMSP). DMSP
terdapat pada kebanyakan spesies fitoplankton laut (salah satu sumber makanan
utama zooplankton yang mungkin memiliki fungsi osmolyte. DMSP terutama
terdapat dalam sel-sel hidup, dengan cepat terdegradasi dalam air dengan aksi
fisik dan mikrobiologis. DMSP dapat dianalisis sebagai dimethylsulphide (DMS)
dengan gas chromatography, setelah hidrolisasi dengan NaOH. DMS yang
terbentuk dengan hidrolisis ini hanya terkait dengan DMSP. Selain itu dijelaskan
pula bahwa aktivitas pemangsaan zooplankton dapat diketahui dengan berbagai
cara berdasarkan pada pengukuran variasi tracer dalam makanan sebagai fungsi
dari waktu. Penggunaan material radio-labelled memiliki kelemahan. Karena
pengukuran fluoroscen lambung dan metode 14C terbentuk dalam zooplankton itu
sendiri sehingga dengan demikian adalah metode langsung, dapat juga digunakan
ketika makanan yang tersedia berlebih. Salah satu kelemahan kedua metode yaitu
metode inkubasi dan metode fluorescen lambung adalah bahwa dibutuhkan
jumlah kopepod yang sangat besar dalam suatu waktu (lebih 200 untuk kopepod
<500 µm), sensitivitas metode tersebut relatif rendah (Rodriguez & Durbin 1992,
diacu dalam Kwint & Kramer 1996). Selanjutnya dijelaskan bahwa pigmen adalah
sangat rentan perubahan karena pengaruh cahaya dan suhu. Hanya metode
fluorescen lambung dapat diaplikasikan dalam eksprimen terbuka dalam kondisi
lapangan.
Pengukuran laju pemangsaan secara insitu dinoflagellata miksotrofik
Gyrodinium galatheanum terhadap populasi cryptophyta yang mengandung
phycoerithrin telah dilakukan oleh Li et al. (2001) di Teluk Chesapeake. Laju
pemangsaan diduga dari kandungan vakuola makanan, suhu in situ, kelimpahan
cryptophyta dan penentuan laju pemangsaan secara eksperimental. Eksperimen
pemangsaan di laboratorium menunjukkan bahwa laju pemangsaan spesifik
kandungan awal vakuola ketika kandungannya < 0.46 cryptophyta per
dinoflagellata. Hasil ini memungkinkan untuk mengembangkan model empiris
untuk mengestimasi laju pemangsaan in situ cryptophyta oleh Gyrodinium
galatheanum. Hasil estimasi berkisar antara 0 - 0.26 cryptophyta per
dinoflagellata per hari, sesuai dengan pemangsaan harian 0 - 12.29 pg karbon,
0-2.48 pg nitrogen dan 0 - 0.34 pg fosfat per dinoflagellata. Estimasi konsumsi
harian biomassa cryptophyta oleh Gyrodinium galatheanum setara dengan
0-12% carbon tubuh, 0 - 13% nitrogen tubuh dan 0 - 21% fosfor tubuh. Estimasi
laju penyaringan in situ terhadap cryptophyta berkisar dari 0-27 μl per
dinoflagellata per hari, menunjukkan kehilangan harian 0 - 4% dari produksi tetap
cryptophyta.
Metode 14C digunakan untuk menandai makanan fitoplankton dalam
eksperimen pemangsaan zooplankton terhadap fitoplankton. Kandungan karbon
per unit volume dan laju penyerapan karbon menurun dengan meningkatnya
ukuran sel. Ketika bekerja dengan multi spesies fitoplankton, dihasilkan suatu
distribusi tracer yang tidak proporsional terhadap biomassa karbon fitoplankton.
Hal ini disebabkan karena banyak zooplankton yang memilih ukuran sel
fitoplankton tertentu. Distribusi tracer yang tidak proporsional ini menyebabkan
suatu bias dalam menentukan laju pemangsaan terhadap total populasi
fitoplankton dengan metode 14C. Hasil penelitian Tackx dan Daro (1993) yang
mengkombinasikan pengamatan secara eksperimen laju pemangsaan kopepoda
Acartia tonsa dan Tartonus longicornis yang diukur pada distribusi bahan partikel
alami yang digabungkan dengan perhitungan secara teoritis laju pengambilan 14C
menunjukkan bahwa laju pemangsaan yang diukur dengan metode 14C akan
dugaan lebih rendah tekanan pemangsaan terhadap stock karbon fitoplankton
sekitar 7 - 24%.
Hasil uji pendahuluan penelitian Gifford dan Percy (1998) di Eastsound,
Washintong didapatkan komposisi taksonomi organisme dalam lapisan piknoklin
sama dengan lapisan di sekitarnya. Taxa fitoplankton terdiri dari berbagai spesies
diatom berantai yang koloninya terdegradasi Chaetoceros socialis, dan sel-sel
nannoplankton < 20 µm. Mikrozooplankton didominasi oleh dinoflagellata
pemangsaan mikrozooplankton di dalam dan sekitar lapisan piknoklin yang
berasosiasi dengan fitoplankton di Eastsound, Washintong menggunakan metode
pengenceran air laut. Klorofil di atas dan di dalam piknoklin tumbuh dengan
kecepatan sama mendekati sekitar 1 penggandaan/hari, sedangkan klorofil di
bawah piknoklin tumbuh sekitar 0.83 penggandaan/hari. Pengaruh pemangsaan
microzooplankton di atas dan di dalam lapisan piknoklin signifikan (p < 0.0001),
sekitar 100% dari produksi klorofil harian dikonsumsi pada kedua lapisan
tersebut. Sebaliknya di bawah lapisan piknoklin, 39% dari produksi klorofil
harian dikonsumsi tetapi tidak signifikan. Hasil ini mendukung bahwa laju
pemangsaan yang sama di dalam dan di atas lapisan piknoklin mempertahankan
batas lapisan permukaan, sedangkan batas di bawahnya nampaknya dibatasi oleh
dasar piknoklin (Gifford & Percy 1998).
Naupli kopepoda dan kopepoda dewasa Eurytemora affinis Poppe
signifikan menurunkan kelimpahan ciliata dan flagellata dalam eksperimen
pemangsaan yang dilakukan Merrell dan Stoecker (1998). Mikroplankton
protozoa umumnya dikonsumsi dalam proporsi yang sesuai dengan
ketersediaannya di alam, meskipun laju pemangsaan nauplii kopepoda dan
kopepoda dewasa lebih tinggi pada mangsa yang lebih besar (40 μm). Eurytemora
affinis nauplii dan dewasa memangsa protozoa dapat dikatakan lebih cepat
dibandingkan terhadap klorofil-a. Laju pemangsaan naupli setingkat lebih rendah
dibandingkan yang dewasa. Dijelaskan pula bahwa pemangsaan total komponen
penyusun kopepoda dapat diduga lebih rendah baik dalam pengamatan mesocosm
maupun pengamatan lapangan jika stadia juvenil diabaikan.
Laju pemangsaan fitoplankton oleh komunitas zooplankton metazoa telah
diteliti oleh White dan Roman (1992) di Teluk Chesapeake, Amerika Serikat.
Hasilnya menunjukkan bahwa pemangsaan fitoplankton didominasi oleh
kopepoda. Acartia dominan pada bulan Maret dan Agustus sedangkan Oithona
dominan pada bulan Juni dan Oktober. Naupli copepoda hampir selalu menjadi
pemangsa utama sebab biomassanya yang tinggi. Jumlah produksi harian
fitoplankton yang dapat dihilangkan bervariasi antara 12 sampai 13%.
Laju pemangsaan kopepoda calanoid terhadap fitoplankton dan
bahwa laju pemangsaan Leptodiaptomus sicilis terhadap klorofil-a fitoplankton
berkisar antara 2-14 ng C per kopepoda per hari. Lebih lanjut dijelaskan bahwa
proporsi makanan L. sicilis dari mikrozooplankton lebih besar dibandingkan
dengan fitoplankton pada akhir musim dingin sampai awal musim semi.
Blooming alga Phaeocystis dimakan oleh berbagai macam zooplankton
grazer. Pengamatan Turner et al. (2002) mengenai pemangsaan kopepoda
Temora stylifera dan Calanus helgolandicus terhadap sel-sel soliter Phaeocystis
(masing-masing dengan kepadatan 2.5–7.9x 104 sell per ml dan 1.2–3.6x 104 sel
per ml) menunjukkan bahwa kedua jenis kopepoda hidup dengan baik dan
kontinyu menghasilkan kotoran (fecal pellet) yang mengindikasikan bahwa
terjadi pemangsaan terhadap Phaeocystis. Meskipun produksi telur kedua jenis
kopepoda rendah, namun keberhasilan penetasannya tinggi. Laju pemangsaan
Temora stylifera lebih tinggi daripada hasil yang didapatkan pada bebeberapa
pengamatan pemangsaan sebelumnya pada konsentrasi Phaeocystis yang lebih
rendah. Dengan demikian disimpulkan bahwa meskipun kopepoda makan
Phaeocystis dengan baik, namun miskinnya fekunditas kopepoda dengan makan
tersebut menghambat peningkatan populasi kopepoda selama terjadi blooming.
Diduga Phaeocystis mengandung semacam senyawa kimia yang berfungsi sebagai
senyawa penghambat telur kopepoda seperti yang banyak terjadi pada jenis
fitoplankton lainnya.
Sakka et al. (2002) dalam hasil penelitiannya di laguna Atol Takapoto,
Polynesia Prancis mendapatkan produksi bersih partikel plankton yang relatif
tinggi terutama disebabkan oleh cyanobakteri yang ukurannya < 1 μm. Pelepasan
karbon organik terlarut dari fitoplankton rata-rata 48% dari total karbon
fotoassimilasi. Jaringan makanan planktonik dicirikan dengan biomassa yang
tinggi dari protozoa kecil (82% < 14 μm). Kontribusi metazoa dalam stok karbon
dari zooplankton lebih kecil daripada protozoa, tetapi laju produksi dan
pemangsaannya lebih tinggi. Penggunaan karbon dalam sistem planktonik
menunjukkan bahwa 70% dari total peroduksi bersih fitoplankton hilang dalam
respirasi heterotrofik. Sisanya 30% diekspor ke transfer jaringan makanan dan
mengendap jadi detritus masing-masing sebesar 20% dan 10%. Hal ini
primernya berukuran kecil namun sangat efisien dalam mengekspor karbon
biogenik. Protozoa grazer memiliki peran kunci dalam ekspor karbon,
memberikan tekanan pemangsaan yang kuat terhadap fitoplankton, dan protozoa
itu sendiri dimangsa cukup besar oleh zooplankton metazoa. Efisiensi degradasi
pigmen makanan hidup pada konsentrasi berbeda Thalassiosira weissflogii
bervariasi antara 30.56 dan 94.05% dan kuantitas pigmen yang hilang selama
melewati usus berhubungan langsung dengan total pemangsaan. Fraksi klorofil-a
yang dimakan yang terdegradasi oleh kopepoda beradaptasi dengan konsentrasi
makanan yang tinggi (15 µg Chl-a ml-1). Persentase klorofil-a terkonsumsi yang
Acartia clausi transformasi menjadi bahan yang tidak terdeteksi secara
fluorometrik tidak konstan. Pengetahuan mengenai proses rusaknya pigmen
mengindikasikan bahwa klorofil-a dan pigmen yang dihasilkannya tidak
menjelaskan dengan baik secara kuantitatif aktivitas makan kopepoda. Hal ini
mendukung untuk menguji kembali penerapan metode fluoroscen usus dalam
mengevaluasi aktivitas pemangsaan kopepoda Acartiaclausi.
Kleppel (1998) meneliti jumlah fucoxanthin, suatu diagnosa secara
taxonomi carotenoid, diambil setelah melewati usus Acartia californiensis dan
Calanus pacificus, setelah kopepoda makan pada konsentrasi diatom
Thalassiosira weissflogii berbeda (rendah = 50 μg Cl-1 dan tinggi = 350μg Cl-1)
untuk Acartia californiensis dan 350 μg Cl-1 untuk Calanus pacificus, selama
musim semi (Mei) dan musim dingin (Desember). Perubahan konsentrasi pigmen
dan kelimpahan sel diamati melalui eksperimen inkubasi (dengan kopepoda) dan
tanpa kopepoda (kontrol). Pigmen recovery dilihat dengan cara: (1)
membandingkan jumlah pigmen yang diperoleh dari makanan dari kelompok
percobaan dengan dugaan yang telah dimakan melalui data perhitungan sel, dan
(2) membandingkan rasio fucoxanthin/sel dalam kontrol dengan contoh
eksperimen. Kedua metode menunjukkan bahwa pigmen yang hilang secara
subtansial umumnya 60 - 100% tanpa memperhitungkan spesies, ketersediaan
makanan dan musim. Pola konservasi pigmen berbeda antar spesies, meskipun
pemulihan pigmen selalu lebih tinggi pada konsentrasi makanan lebih tinggi
dibandingkan dengan konsentrasi makanan lebih rendah. Pigmen recovery pada
musim dingin tidak ada pemulihan) tanpa melihat konsentrasi makanannya. Pada
Calanus pacificus, pigmen recovery selalu lebih tinggi pada konsentrasi makanan
lebih tinggi.
Hasil penelitian Wang et al. (1998) di Laut Bohai, China menunjukkan
bahwa copepoda (Calanus sinicus, Paracalanus parvus, Acartia bifilosa dan
Centropages mcmurrichi) memperlihatkan pola migrasi diurnal. Variasi
kandungan pigmen usus dalam siklus 24 jam memperlihatkan adanya ritme harian
makanan yang kuat, utamanya pada copepoda yang besar. Kandungan maksimum
harian usus terjadi pada saat menjelang malam sampai tengah malam (jam 18:00 -
24:00). Laju pemangsaan harian zooplankton terhadap fitoplankton bervariasi
menurut ukuran zooplankton. Copepoda mengkonsumsi hanya sebagian kecil dari
biomassa fitoplankton (2.90 - 13.52%) tetapi mencapai 77% dari produksi harian
fitoplankton. Perhitungan terhadap laju konsumsi harian copepoda terhadap
biomassa fitoplankton dapat mencapai 85 - 319%.
Benur, Nener dan Larva Lainnya
Penelitian mengenai stok populasi udang windu di bagian barat Samudra
Hindia dan bagian barat Samudra Pasifik yang telah dilakukan Duda dan Palumbi
(1999) menunjukkan adanya perbedaan yang sangat kuat diantara populasi dari
kedua wilayah tersebut. Keragaman nukletid yang berbeda diantara kedua
wilayah tersebut menunjukkan adanya perbedaan regional demografis secara
histori, dimana Indo-Australian Archipelago merupakan pemisah antar keduanya.
Siklus hidup P. monodon dicirikan dengan perubahan habitat mengikuti
perkembangan stadianya. Stadia planktonik udang windu terdiri dari nauplii,
protozoa, mysis dan post larva. Fase dewasa dihabiskan di laut lepas dan memijah
pada kedalamn 30 - 60 meter. Setiap ekor induk betina dapat memijahkan antara
200.000 sampai satu juta telur (Dall et al. 1990).
Gómezdan Gracia (2007) yang meneliti pola penyebaran larva dan post
larva udang di Campeche Bay, Mexico, mendapatkan kelimpahan tertinggi pada
musim panas dengan rata-rata kelimpahan larva masing-masing pada stadia
Penelitian Kumlu et al. (1999) untuk melihat pengaruh salinitas terhadap
pertumbuhan, kelangsungan hidup dan perkembangan larva Penaeus semisulcatus
pada stadia protozoea 1 (PZ) digunakan pakan Tetraselmis chuii (20 cells /µl),
Chaetoceros calcitrans (50 cells /µl) dan Isohrysis galbana (30 cells /µl),
ditambah lima naupli/ml Artemia pada suhu 28°C dengan perlakuan salinitas
25 - 55 ppt dan interval 5 ppt. Hasilnya menunjukkan bahwa salinitas optimal
untuk pertumbuhan dan kelangsungan hidup larva berkisar antara 30 - 35 ppt, dan
larva menunjukkan lebih toleran pada salinitas tinggi dibandingkan dengan
salinitas rendah. Meskipun kelangsungan hidup relatif lebih tinggi pada salinitas
tinggi (45 - 55 ppt) namun pertumbuhan dan perkembangan larva lebih bagus
pada salinitas rendah (25 - 40 ppt). Menurut Merchie et al. (1998) daya tahan
larva udang windu terhadap kejutan salinitas meningkat dengan meningkatnya
jumlah asam askorbat dan astaxanthin dalam makanannya, meskipun dalam
penelitian ini tidak didapatkan perbedaannya dalam daya tahan terhadap penyakit.
Percobaan pemeliharaan larva udang windu selama 24 hari dari stadia
naupli sampai postlarva (PL16) dengan kepadatan berbeda yaitu 70, 140 dan 210
naupli/liter telah dilakukan Luangthuvapranit et al. (2004). Hasilnya menunjukkan
bahwa pertumbuhan panjang rata-rata larva tidak berbeda berdasarkan kepadatan.
Rata-rata persentase tingkat kelangsungan hidup tertinggi pada kepadatan 70
naupli/liter, berbeda nyata lebih tinggi dibandingkan dengan perlakuan lainnya
dengan kepadatan lebih tinggi.
Carballo et al. (1994) menyatakan bahwa rotifera dapat mencegah
perubahan pH yang drastis dan mempertahankan keseimbangan nitrat-amonia
dalam tambak maupun tanki-tanki percobaan. Larva udang Penaeus japonicus
tumbuh lebih cepat dan juga memperlihatkan kelangsungan hidup dan konversi
pakan yang lebih baik dibandingkan dengan larva yang dikultur tanpa rotifer.
Hasil penelitian Le Pay et al. (2000) menyimpulkan bahwa biomassa alga
cocok digunakan sebagai makanan udang, ketika dimasukkan dalam suatu
makanan yang seimbang secara komposisi sebagai sumber karbohidrat/DHD
yang dapat dicerna dalam makanan larva/postlarva. Setelah pemeliharaan selama
yang mengandung alga, nyata lebih berat 50 - 60% dibandingkan dengan kontrol
yang tidak diberikan alga.
Distribusi ikan bandeng berkisar dari 40o BT - 100o BB dan 30 - 40o LU –
30 - 40 o LS menyebar di perairan tropis dan sub tropis di Samudra Hindia dan
Pasifik. Ikan bandeng mengkonsumsi diatom, alga biru hijau, alga filament, dan
kadang-kadang berbagai hewan seperti nematoda dan kopepoda. Ikan bandeng
memijah di laut dekat pantai dengan fekunditas mencapai sekitar tujuh juta telur
per ekor induk betina, memijah dua kali atau sekali dalam setahun tergantung
wilayahnya (Perschbacher 2004).
Hasil penelitian Gapasin et al. (1998) menunjukkan bahwa pengkayaan
asam lemak esensial dan vitamin C dalam makan hidup (rotifer yang diberi
Chlorella sp.dan naupli Artemia) larva ikan bandeng berpengaruh nyata lebih
tinggi dibandingkan dengan kontrol terhadap pertumbuhan dan daya tahan
terhadap tekanan salinitas, tetapi tidak mengurangi terjadinya kelainan bentuk
(deformity) pada operkulum larva. Amores (2004) menyatakan bahwa larva ikan
bandeng memakan zooplankton, juvenil dan dewasanya makan cyanobacteria,
alga halus dan avertebrata bentik kecil.
Artemia spp. banyak digunakan dalam pemberian makanan berbagai
macam larva krustacea dan telah menjadi makanan standar dalam kultur larva
karena komposisi kimianya yang mendukung. Meskipun demikian nilai nutrisi
Artemia spp. tidaklah konstan tetapi bervariasi secara geografis dan temporal.
Selain itu metode pengkayaan dalam berbagai teknik kultur juga berpengaruh
terhadap kandungan nutrisinya (Sorgeloos et al. 1998).
Rotifera Brachionus plicatilis dapat dikultur massal dan merupakan salah
satu makan hidup yang penting dalam akuakultur. Umumnya diberikan pada larva
berumur 7-30 hari. Kepadatan mangsa berpengaruh terhadap laju, rasio, aktivitas,
waktu evakuasi pemangsaan serta efisiensi dan laju pertumbuhan larva ikan.
Brachionus plicatilis dibutuhkan untuk memenuhi kebutuhan metabolisme dan
meningkatkan tingkat kelangsungan hidup larva (Lubzens 1987). Alemany dan
Ignacio (2003) menyatakan bahwa tingkat kelangsungan hidup larva ikan
dipengaruhi oleh kondisi pemijahan dan makanan dalam suatu waktu dan periode
Larva ikan kakap Lutjanus argentimaculatus yang dipelihara dalam tanki
percobaan dan diberi makanan Chlorella, rotifera Brachionus plicatilis kecil,
Artemia dan ikan ruca, setelah dipelihara selama 24 hari tingkat kelangsungan
hidupnya relatif rendah yaitu 27% dalam tanki kapasitas 3 ton dan hanya 3%
dalam tanki 5 ton. Selama pemeliharaan panjang awal larva 2.15 mm menjadi
8.2 mm setelah 24 hari dan menjadi 306 mm setelah 55 hari. Pertumbuhan dan
kelangsungan hidup larva lebih bagus ketika larva mengkonsumsi Brachionus
plicatilis kecil (< 90 μm) selama 14 hari pertama (Duray et al. 1996).
Pada pemberian Artemia 2 per ml per hari, kelangsungan hidup lebih tinggi pada
frekuensi pemberian 4 kali sehari dibandingkan dengan frekuensi 1 - 2 kali sehari.
Disamping itu Carrillo et al. (1993) melaporkan bahwa dalam pemeliharaan larva
ikan kakap Lates calcarifer di Asia Tenggara dan Australia banyak digunakan
Chlorella, rotifera Brachionus plicatilis dan naupli Artemia. Ketersediaan
Chlorella dalam jumlah besar sangat dibutuhkan untuk mencukupi kebutuhan
dalam kultur rotifera.
Pertumbuhan dan tingkat kelangsungan hidup larva ikan herring di daerah
front dipengaruhi oleh fitoplankton dan zooplankton (Kiørboe et al. 1988).
Pengetahuan laju mortalitas larva dan telur ikan merupakan salah satu kunci untuk
mengetahui proses rekruitmen karena banyak spesies jumlah rekruitmen
kemungkinan ditentukan pada stadia awal daur hidupnya. Akurasi pengukuran
jumlah dan variabilitas laju mortalitas di lapangan dibutuhkan untuk mengetahui
penyebab dan proses mortalitas, seperti pemangsaan dan makanan. Data variasi
antar tahunan laju mortalitas dapat dijadikan sebagai alat dalam menduga
kesuksesan kelompok umur tertentu (Hinckley et al. 1998).
Hinrichsen et al. (2002) menyatakan bahwa menghubungkan zooplankton
dengan ikan merupakan konsep penting dalam biologi laut. Dinamika populasi
ikan dikontrol oleh perubahan populasi fitoplankton di laut. Kelimpahan ikan
terkait dengan kelimpahan fitoplankton dan zooplankton (Trumble et al. 1981,
diacu dalam Mann dan Lazier 1991). Penyebaran jenis ikan tersebut dipengaruhi
oleh suhu perairan dan musim. Menurut Peterman dan Bradford (1986), kecepatan
angin sangat mempengaruhi tingkat kelangsungan hidup larva ikan “northern
mortalitas larva dengan kekuatan angin. Kecepatan dan arah angin sangat
mempengaruhi proses transportasi larva ikan jenis tersebut.
Smith dan Eppley (1982) menyatakan bahwa produksi ikan anchovy
berhubungan erat dengan produktivitas primer. Produksi rata-rata musiman ikan
anchovy paling tinggi ketika produktivitas primer meningkat dan sekitar 50%
variasi jumlah larva anchovy ditentukan oleh variasi produktivitas primer.
Uye dan Shimazu (1997) menduga laju produkasi oleh fitoplankton,
microzooplankton dan ikan planktivorous memungkinkan untuk menentukan
aliran karbon dalam trofik level lebih rendah dalam ekosistem pelagis di Laut
Inland, Jepang. Rata-rata efisiensi transfer dari produksi primer ke produksi
sekunder dan dari produksi sekunder ke produksi tertier adalah 28 dan 26%,
mengindikasikan bahwa aliran energi dalam perairan dangkal dan area laut yang
produktif ini sangat efisien. Pada produksi tertier, bagaimanapun kontribusi ikan
planktivor sangat kecil dibandingkan dengan zooplankton karnivor.
Parsons dan Kessler (1987) menggunakan sebuah model ekosistem untuk
perkiraan produktivitas plankton dalam kaitannya dengan kelangsungan hidup
benih ikan di Amerika. Scott et al. (2002), menyatakan bahwa faktor oseanografi
fisik seperti stratifikasi dan produktivitas primer, kedalaman lapisan tercampur
dan gradient piknoklin merupakan variabel yang mengontrol ketersedian ikan
untuk predator.
Fiiliukienà dan Fiiliukas (2000) mendapatkan komposisi jenis dan
kelimpahan larva ikan yang berbeda antara daerah pantai dan bagian terbuka di
laguna Curonian, di Lituania. Pada bagian terbuka laguna, rata-rata kelimpahan
ichthoplankton bervariasi antara 4.1 - 29.3 individu per m3. Di daerah pantai
kelimpahan larva ikan meningkat mencapai 374.3 individu /m3. Meskipun
hubungannya tidak terlalu kuat (r = 0.339), namun kelimpahan larva ikan
menunjukkan korelasi positif dengan kelimpahan zooplankton.
Komposisi makanan 14 spesies ikan yang banyak tertangkap dengan beach
seine dalam padang lamun di Teluk Gazi, Kenya yang dianalisis secara
gravimetrik oleh De Troch et al. (1998) menunjukkan adanya kelompok ikan
sebagai pemakan plankton, pemakan benthos dan pemakan ikan lainnya.
duodecimalis merupakan kelompok pemakan plankton, dengan makanan utama
terdiri dari kopepoda harpatikoid dan calanoid, dan zoea serta megalova dari
brachiura. Ikan-ikan Apogon thermalis, Fowleria aurita, Paramonacanthus
barnardi, Mulloides flavolineatus, Lutjanus fulviflamma, L. argentimaculatus dan
Gerres acinaces merupakan pemakan benthos, terutama memangsa epibenthic dan
hiperbenthic kecil yang didominasi oleh amphipoda (Gammaridae), Tanaidacea
dan Mysidacea. Ikan yang memangsa ikan lainnya terdiri dari Bothus myriaster,
Fistularia commersonii, Sphyraena barracuda dan Plotosus lineatus, terutama
memakan larva ikan lainnya dan invertebrata nekton besar (Gammaridea,
amphipoda, mysid, udang dan kepiting).
Parameter Lingkungan dan Nutrien
Suhu permukaan laut di perairan Indonesia berkisar antara 26 oC - 30 oC.
Suhu maksimun terjadi pada musim pancaroba I (sekitar Maret – Mei) dan musim
pancaroba II (September-November). Sebaliknya suhu mencapai minimum
terjadi pada musim barat (Desember-Februari). Hal ini disebabkan karena pada
musim barat kecepatan angin sangat kuat dan curah hujan yang tinggi
(Nontji, 1987).
Menurut Clark (1974) suhu perairan mempunyai pengaruh yang besar
di ekosistem perairan pesisir. Berbagai aktivitas hewan akuatik dipengaruhi oleh
suhu, misalnya migrasi, pemijahan, kebiasan makan, kecepatan berenang,
perkembangan larva dan laju metabolisme. Jones (1964) menyatakan bahwa suhu
perairan dapat berpengaruh pada sifat fisika, kimia dan biologi perairan. Hewan
air mempunyai toleransi terhadap suhu, tergantung pada jenis, stadium dan
aklimatisasinya.
Suhu merupakan faktor pembatas yang sangat vital bagi biota air dan dapat
mempengaruhi proses biokimia, fisiologi dan tingkah laku ikan-ikan
(Wooton 1992). Suhu juga dapat membatasi daerah penyebaran juvenil dan ikan
dewasa karena masing-masing mempunyai perbedaan dalam toleransi suhu
(Laevastu dan Hayes 1981). Meningkatnya suhu menyebabkan konsentrasi
oksigen perairan menurun, yang akhirnya mempengaruhi kehidupan organisme
Vernberg (1972), diacu dalam Saengar dan Holmes (1991) mengemukakan
bahwa rata-rata perkembangan telur dan larva avertebrata air akan meningkat
dengan meningkatnya suhu sampai pada titik tertentu. Kisaran suhu optimal yang
dapat ditoleransi untuk proses perkembangan beberapa spesies sering berkolerasi
dengan karakteristik suhu habitatnya.
Sebaran salinitas di laut dipengaruhi oleh berbagai faktor seperti pola
sirkulasi air, penguapan, curah hujan dan aliran sungai (Sverdrup et al. 1961;
Tchernia 1980). Keragaman salinitas air laut dapat mempengaruhi biota bahari
lewat perubahan massa jenis air laut dan lewat perubahan tekanan osmotik.
Salinitas air mempengaruhi osmoregulasi ikan dan berpengaruh besar terhadap
fertilisasi dan perkembangan telur. Setiap jenis ikan mempunyai kemampuan
berbeda dalam beradaptasi terhadap salinitas.
Tinggi rendahnya kekeruhan perairan sangat tergantung pada jumlah
padatan tersuspensi. Semakin tinggi konsentrasi padatan tersuspensi,
maka kekeruhan juga akan meningkat. Menurut laporan EIFAC (1961), diacu
dalamTrain (1979), kekeruhan akibat konsentrasi padatan tersuspensi yang tinggi
dapat merugikan populasi ikan dan populasi makanan ikan. Hal ini disebabkan
karena dapat mematikan atau menghambat pertumbuhan, menghalangi
perkembangan telur dan larva ikan, dapat merubah pergerakan dan migrasi ikan
dan dapat mengurangi ketersediaan kelimpahan makanan ikan. Laevastu dan
Hayes (1981) menyatakan bahwa bagi ikan, kecepatan arus berpengaruh besar
dalam transportasi telur, larva dan ikan-ikan kecil, juga berperan dalam
menentukan orientasi selama melakukan perjalanan migrasi yang panjang,
terutama di daerah Ugahari.
Kandungan oksigen terlarut di laut dipengaruhi oleh tiga faktor, yaitu
interaksi antara permukaan air laut dengan atmosfir, kegiatan biologi, dan arus
beserta proses percampuran yang mempunyai kecenderungan untuk mengubah
pengaruh kegiatan biologi lewat gerakan massa air. Konsentrasi oksigen terlarut di
lapisan permukaan laut pada siang hari cenderung meningkat sebagai akibat dari
proses fotosintesa oleh fitoplankton (Sverdrup et al. 1961). Konsentrasi oksigen
Oksigen terlarut merupakan gas yang mutlak dibutuhkan dalam proses
respirasi ikan dan biota lain serta diperlukan dalam perombakan bahan organik.
Untuk proses metabolisme, hewan air membutuhkan oksigen terlarut di atas 5 ml/l
dan cukup layak bagi kehidupan larva plankton (Shahab 1986). Para ahli
perikanan sering menyebutkan bahwa ikan dan biota air lain memerlukan
sekurang-kurangnya 3 mg/l oksigen terlarut untuk kehidupannya secara normal.
Prescod (1973) menyatakan bahwa kandungan oksigen terlarut minimal sebesar
2 ppm, cukup untuk mendukung kehidupan perairan secara normal di daerah
tropik dengan asumsi perairan tidak mengandung bahan beracun.
Bagian utama pelepasan bahan organik terlarut oleh fitoplankton di laut
terdiri dari molekul-molekul kecil (bahan organik terlarut berat molekul rendah)
(Jensen 1983; Rancelot 1984, diacu dalamBiddanda & Benner 1997). Selanjutnya
dijelaskan bahwa pelepasan organik terlarut oleh fitoplankton berkolerasi positif
dengan laju fotosintesa.
Parsons et al. (1984) menyatakan bahwa fraksi terbesar karbon organik
di laut berasal dari pecahan-pecahan organisme dan bahan organik terlarut
biasanya digunakan oleh organisme hetetrofik. Sumber-sumber utama karbon
organik berasal dari organisme autotrof baik fototrop maupun kemotrof.
Valiela (1984) menyatakan bahwa jumlah bahan organik terlarut dalam
nitrogen selalu lebih rendah daripada nitrogen anorganik. Konsentrasi nitrogen
terlarut berkisar dari 5 sampai lebih besar dari 30 μg atom N/l. Asam amino dan
urea hanya merupakan komponen kecil dari nitrogen terlarut, asam amino berkisar
dari 0.25 – 1.4 μmol sedangkan konsentrasi urea mencapai 8,9 μg atom N/l.
N organik terlarut kurang begitu penting secara nutrisi bagi fitoplankton oseanik
dan mikroba estuari. Selanjutnya dijelaskan bahwa kebanyakan nitrogen terlarut
mungkin resisten terhadap dekomposisi.
Hasil penelitian Berland et al. (1987) di Laut Mediterania menunjukkan
bahwa konsentrasi nitrat menjadi rendah (2 - 4 nmol l-1) pada kedalaman
100 meter dan fosfat (kurang dari 0.1 pmol l-1). Pada kedalaman 300 meter rasio
N:P berada dalam kisaran 37 - 40 yang menunjukkan terjadinya penipisan fosfor.
Konsentrasi klorofil-a sebesar 0.09 ng l-1 pada lapisan homogen 60 meter, dan
tersebut sangat oligotrop. Biomassa fototrofik dasar terutama terdiri dari nannno
dan picoplankton. Picoplankton berkontribusi lebih dari 60% dari konsentrasi
total klorofil-a. Hasil eksperimen biologis tersebut menunjukkan bahwa fosfor
dan nitrogen membatasi biomassa. Penambahan secara simultan fosfor dan
nitrogen belum mendukung untuk merangsang pertumbuhan yang
mengindikasikan bahwa Mn merupakan elemen paling penting untuk
pertumbuhan fitoplankton dalam perairan yang oligotrop.
Rasio C:P dapat mempengaruhi kualitas makanan fitoplankton pada
zooplankton sehingga sangat menarik untuk mengukur rasio C:P dalam sistem
perairan. Kebanyakan analisis C diukur dengan berat kering menggunakan C-N
analizer (Lampman et al. 1997). Carbon dapat diukur dengan suatu variasi dari
metode yang sama dengan pencernaan basah (persulfate) yang sering digunakan
untuk menganalisis P sehingga dapat diukur dalam filter yang sama. Untuk
kisaran nilai C yang tinggi (1 - 40 uM/filter), metode persulfate untuk
pengukuran C memberikan nilai yang sama pada seston dan fitoplankton yang
diukur dengan berat kering menggunakan Carlo-Erba CN analyzer. Metode ini
lebih murah dibandingkan metode berat kering dalam pengertian alat dan biaya
per unit sampelnya. Selanjutnya bahwa metode persulfate method cukup teliti (cv
= 3%) dibandingkan dengan metode berat kering (cv = 2%) untuk pengukuran C.
Trace elemen memiliki peranan ekologis yang penting terutama bagi
pertumbuhan fitoplankton. Sampai tahun 1999 belum ditemukan metode yang
dapat mengukur secara langsung pengembalian baik secara intra maupun ekstra
selluler atau menyerapan logam baru dan teregenerasi. Hutchins et al. (1999)
kemudian mengembangkan metode baru dengan menggunakan isotop rangkap
dari trace elemen yang sama untuk mengukur secara langsung proses biogeokimia
penting tersebut pada komunitas plankton laut dan tawar. Hasil penelitian dalam
laboratorium dan lapangan pada fitoplankton laut menggunakan radiolabels 59Fe
dan 55Fe untuk membandingkan penyerapan Fe baru dan Fe teregenerasi.
Hasilnya menunjukkan bahwa new Fe (Fe terlarut) lebih banyak digunakan oleh
fitoplankton dibandingkan dengan Fe regenerated, tetapi transfer intraselluler Fe
sangat penting. Hasil pengujian setelah proses pemangsaan zooplankton terhadap
oleh zooplankton, sementara Fe ekstraselluler diregenerasi terlebih dahulu ke
dalam bentuk terlarut selama pemangsaan.
Hasil penelitian Varela et al. (2003) menunjukkan bahwa konsentrasi
nitrogen anorganik berhubungan dengan pengkayaan nitrat melalui upwelling,
sedangkan konsentrasi amonia umumnya rendah pada semua lokasi. Amonia
yang tidak terakumulasi di daerah penelitian mendukung adanya skala waktu
harian gabungan antara regenarasi dan penyerapan. Sebaliknya nitrogen organik
terlarut (DON) melebihi nitrogen inorganik pada semua kondisi. Regenerasi
amonia berkorelasi positif dengan pelepasan DON. Rasio C:N dari pelepasan
DON dan karbon organik terlarut (DOC) bervariasi cukup tinggi, memperlihatkan
kelebihan yang lebih besar dari DOC dibandingkan dengan DON.
Mempelajari perpindahan nutrien dalam suatu sistem sangat penting untuk
menunjukkan pemasukan dan pengeluaran nutrien (Wong 1994). Tingkah laku
setiap nutrien dalam sistem tersebut perlu diuraikan Salah satu caranya adalah
menganalisis profil nutrien berdasarkan konsep diagram percampuran. Fakta dari
estuari mangrove di Malaysia menunjukkan bahwa amonia masuk dalam sistem
melalui masuknya sumber air tawar. Keluar masuknya nitrat, nitrit dan fosfor
tergantung dari fase pasang surut. Selama air surut nitrat, nitrit dan fosfor masuk
ke dalam sistem melalui masuknya sumber air tawar. Konsentrasi amonia
bervariasi antara lebih dari 50 μM di ujung air tawar sampai tidak terdeteksi pada
ujung air laut dalam sistem estuari. Konsentrasi nitrat, nitrit dan total fosfor
bervariasi dari 0.1 - 0.3 μM sampai 6.0 μM. Perbedaan senyawa nitrogen dalam
sistem dapat diinterpretasikan sebagai hasil dari interkonversi oleh nitrifikasi dan
denitrifikasi
Kontribusi zooplankton cukup besar dalam aliran turunnya karbon dalam
suatu perairan. Bradford-Grieve et al. (2001) mengestimasi sekitar 1.7 - 9.3 g C m–2 tahun–1 di perairan subantarctic mengalir ke dasar perairan. Nilai ini setingkat
lebih tinggi dari dugaan sebesar 0.27 g C m–2 tahun–1 pada migrasi kopepoda besar
di Atlantik Utara. Dari total 55.6 x 106 km2, dimana Neocalanus tonsus, 0.17 Gt
C tahun–1 diperkirakan hilang setiap tahun ke laut lepas. Nilai ini sesuai dengan
1.4% produksi primer, dan 14% lebih tinggi daripada karbon organik partikel
Neocalanus tonsus tidak pernah didapatkan dalam sedimen trap dengan
bertambahnya waktu.
Hasil penelitian Townsend dan Pettigrew (1997) di George Bank yang
memiliki aliran nutrien yang cukup besar dari perairan yang lebih dalam di
perairan sekitarnya menunjukkan bahwa produktivitas dan siklus nutrien cukup
tinggi. Perpindahan biomassa dari zooplankton ke ikan dibatasi oleh frekuensi
dan intensitas proses yang menyebabkan aliran nitrogen dari perairan dalam
Waktu dan Lokasi
Penelitian ini dilaksanakan selama 6 (enam) bulan dimulai dari bulan
September 2005 sampai Februari 2006. Rentang waktu tersebut mencakup waktu
sebelum, pada saat dan setelah puncak musim benur dan nener. Lokasi
pengambilan sampel adalah di sepanjang pantai Kecamatan Suppa, Kabupaten
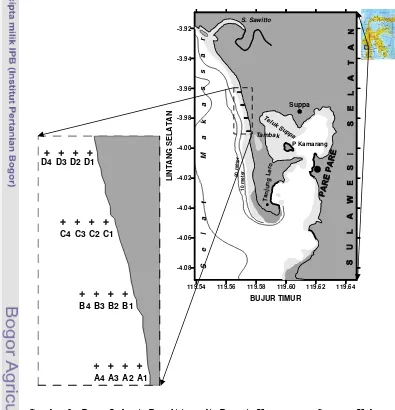
Pinrang, Propinsi Sulawesi Selatan (Gambar 2).
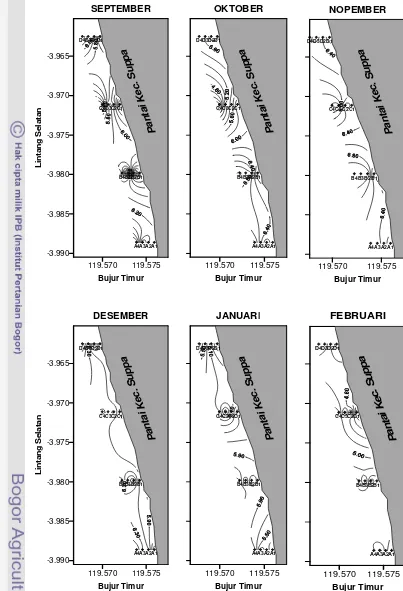
Gambar 2 Peta Lokasi Penelitian di Pantai Kecamatan Suppa, Kabupaten
Pinrang. Jarak antar Transek (A1, B1, C1, D1), Sejajar Garis Pantai Masing-masing 1 Km. Jarak antar Stasiun (A1, A2, A3, A4), Tegak Lurus Pantai Masing-masing 75 m.
(Sumber Peta: Didigitasi Ulang dari Peta Bakosurtanal, 2005). 119.54 119.56 119.58 119.60 119.62 119.64
Pengambilan Data
Pengambilan data yang dilakukan dengan pengukuran in situ di lapangan
berupa pengukuran parameter lingkungan (suhu, salinitas, kadar DO, kedalaman
kecerahan, kecepatan arus), pengukuran produktivitas primer, pengambilan
contoh untuk identifikasi jenis dan kelimpahan plankton, benur, dan nener serta
larva lainnya; serta pengamatan pemangsaan fitoplankton oleh zooplankton dan
pengamatan pemangsaan plankton (fitoplankton dan zooplankton) oleh benur,
nener, dan larva lain. Kegiatan yang dilakukan di laboratorium terdiri dari
identifikasi jenis plankton dan larva, pengambilan gambar plankton, percobaan
isolasi plankton, dan pengukuran kadar nutrien (Lampiran 1).
Stasiun-stasiun pengamatan dan pengambilan data dibuat sebanyak 16
stasiun dalam 4 transek (4x4) dengan arah sebaran stasiun per transek tegak lurus
garis pantai. Setelah dilakukan survei di lokasi penelitian yang menunjukkan
topografi dan batimetri perairan pantai yang hampir sama pada semua transek,
maka sebaran stasiun dalam satu transek ditentukan berdasarkan jarak yaitu
75 meter antar stasiun dengan posisi stasiun terdekat dengan garis pantai
ditetapkan pada kedalaman 0.5 meter pada waktu surut. Penentuan stasiun sebagai
titik sampling dilakukan dengan memasang tanda sebagai acuan di pantai.
Frekuensi pengambilan contoh di lapangan dilakukan dengan interval yang
bervariasi antar parameter yang diukur.
Pengukuran Parameter Lingkungan
Pengukuran parameter lingkungan dilakukan 2 (dua) kali dalam sebulan
bersamaan dengan pengambilan contoh plankton, benur, nener, dan larva pada
semua stasiun pengamatan. Parameter lingkungan hanya diukur pada bagian
permukaan saja sebab berdasarkan penelitian yang dilakukan oleh Naulita (1998)
di perairan Selat Makassar terjadi percampuran sampai kedalaman 20 m.
Parameter lingkungan yang diukur secara in situ adalah suhu, salinitas, kadar DO,
kedalaman, kecerahan dan kecepatan arus pada semua stasiun (14 kali selama
penelitian). Pengambilan air contoh untuk pengukuran kandungan nutrien (nitrat,
fosfat dan silikat) dilakukan pada setiap transek di stasiun terdekat dari pantai
didapatkan bahwa tidak ada perbedaan antar stasiun yang dekat pantai dengan
ketiga stasiun yang berjarak 75 m, 150 m dan 225 m dari pantai (Lampiran 2).
Selain itu, pengambilan data nutrien ini hanya difokuskan pada wilayah
penangkapan benur dan nener. Kemudian frekuensi pengukuran data nutrien yaitu
7 (tujuh) kali selama penelitian sebab dianggap bahwa perubahan nutrien tidak
secepat perubahan biologis yang terjadi di laut, dengan cara mengambil air
permukaan sebanyak 250 ml lalu dimasukkan ke dalam botol sampel yang terbuat
dari bahan kaca. Setiap botol sampel diberi label kemudian dimasukkan ke dalam
cool box bersuhu 4oC dan untuk selanjutnya dibawa ke laboratorium untuk
dianalisis. Jenis parameter, alat, dan metode pengukuran yang digunakan dalam
pengukuran parameter lingkungan disajikan dalam Tabel 1.
Tabel 1 Parameter Lingkungan, Alat/Metode yang Digunakan, Frekuensi, dan Jumlah Stasiun Pengamatan
No Parameter
Lingkungan Alat/metode
Frekuensi/ 6 bulan
Jumlah Stasiun
1 Suhu Termometer/Pemuaian 14 16
2 Salinitas Hand Refraktometer/Refraksi 14 16
3 Oksigen terlarut (DO) DO meter/potensiometrik 14 16
4 Kecerahan Secchi disck/visual 14 16
5 Kecepatan arus Floating drauge/Langrangian 14 16
6 Fosfat Spektrofotometer/Colorimetri 7 4
7 Nitrat Spektrofotometer/Colorimetri 7 4
8 Silikat Spektrofotometer/Colorimetri 7 4
9 Pasang Surut Menggunakan Data Dishidros 1 16
Pengambilan Sampel Plankton dan Larva
Pengambilan sampel untuk perhitungan kelimpahan dan komposisi jenis
fitoplankton, zooplankton, benur, nener, dan larva lainnya dilakukan dengan cara
menyaring air laut menggunakan plankton net dan seser. Plankton net yang
digunakan untuk fitoplankton dengan mesh size 35 µm dan untuk zooplankton
dengan mesh size 50 µm dengan luas bukaan 962 cm2 (Gambar 3A). Untuk
menyaring benur, nener, larva digunakan seser (alat tangkap) dengan mesh size
0.1mm yang digunakan nelayan setempat selama ini sebagai pengganti larva net