LAJU POTENSIAL NITRIFIKASI, DENITRIFIKASI, DNRA
(DISSIMILATIVE NITRATE REDUCTION TO AMMONIUM),
DAN
KELIMPAHAN BAKTERI DI LAHAN PERKEBUNAN SAWIT JAMBI
RANDI HADIANTA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Laju Potensial Nitrifikasi, Denitrifikasi, DNRA (Dissimilative Nitrate Reduction to Ammonium) dan Kelimpahan Bakteri di Lahan Perkebunan Sawit Jambi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
RANDI HADIANTA. Laju Potensial Nitrifikasi, Denitrifikasi, DNRA (Dissimilative Nitrate Reduction to Ammonium), dan Kelimpahan Bakteri di Lahan Perkebunan Sawit Jambi. Dibimbing oleh IMAN RUSMANA dan NISA RACHMANIA MUBARIK.
Konversi dari hutan hujan menjadi hutan industri, perkebunan, dan pertanian menimbulkan perubahan komunitas mikrob dan siklus yang terdapat di dalamnya. Siklus nitrogen merupakan salah satu yang berperan penting di alam. Adapun yang termasuk dalam siklus nitrogen antara lain nitrifikasi, denitrifikasi, dan DNRA (Dissimilative Nitrate Reduction to Ammonium). Penelitian ini bertujuan menghitung laju potensial nitrifikasi, denitrifikasi, DNRA dan kelimpahan mikrobnya di lahan perkebunan sawit, Jambi. Sebanyak 10 pipa sepanjang 15 cm yang berasal dari 5 lokasi dengan 2 ulangan sampel diuji dan dianalisis. Analisis yang dilakukan antara lain uji amonium, nitrit, dan nitrat untuk laju potensial, Vmaks dan Km. Uji MPN (Most Probable Number) dilakukan untuk menentukan kelimpahan bakteri. Laju DNRA tercatat paling tinggi, kemudian denitrifikasi lalu nitrifikasi. Kelimpahan bakteri DNRA tercatat pada stratifikasi bawah, sedangkan nitrifikasi tercatat pada pada stratifikasi atas. Denitrifikasi tidak menunjukkan perbedaan yang berarti pada dua stratifikasi yang diuji.
Kata kunci: denitrifikasi, DNRA, kelimpahan bakteri, nitrifikasi
ABSTRACT
RANDI HADIANTA. Potential rate of Nitrification, Denitrification, DNRA (Dissimilative Nitrate Reduction to Ammonium), and Abundance of Bacteria in the Palm Oil Plantation Jambi. Supervised by IMAN RUSMANA dan NISA RACHMANIA MUBARIK.
Conversion of rainforest into plantations and agriculture lead to change microbial communities and nutrient cycle balance. One of nutrient cycle is Nitrogen Cycle. Several nitrogen metabolism that plays in nitrogen cycle are nitrification, denitrification, and DNRA (Dissimilative Reduction to Ammonium Nitrate). This research was conducted to calculate the potential rate of nitrification, denitrification, DNRA, and abundance of microbes possessing metabolism in oil palm plantation at Jambi. A total of 10 soil sample cores which 15 cm in depth was collected at 5 location in Palm Oil Plantation in Jambi. Ammonium, nitrite, and nitrate test have been undertaken used to determine the potential rate, Vmax, and Km. MPN (Most Probable Number) used to determine the abundance of bacteria. The results showed that DNRA rate was the highest rate and followed by denitrification and nitrification rate. DNRA bacteria abundance was noted at the bottom of stratification, while nitrification was noted at the upper of stratification. Denitrification rate showed no significant difference in the two stratifications were tested.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
LAJU POTENSIAL NITRIFIKASI, DENITRIFIKASI, DNRA
(DISSIMILATIVE NITRATE REDUCTION TO AMMONIUM),
DAN
KELIMPAHAN BAKTERI DI LAHAN PERKEBUNAN SAWIT JAMBI
RANDI HADIANTA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Laju Potensial Nitrifikasi, Denitrifikasi, DNRA (Dissimilative Nitrat Reduction to Ammonium), dan Kelimpahan Bakteri di Lahan Perkebunan Sawit Jambi
Nama : Randi Hadianta NIM : G34090020
Disetujui oleh
Dr Ir Iman Rusmana, MSi Pembimbing I
Dr Nisa Rachmania Mubarik, MSi Pembimbing II
Diketahui oleh
Dr Ir Iman Rusmana, MSi Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2013 ini ialah Nitrogen, dengan judul Laju Potensial Nitrifikasi, Denitrifikasi,DNRA dan Kelimpahan Bakterinya di Lahan Perkebunan Sawit Jambi.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Iman Rusmana, M.Si dan Ibu Dr. Nisa Rachmania Mubarik, M.Si selaku pembimbing. Terima kasih disampaikan kepada Bapak Dr. Aris Tjahjoleksono, DEA selaku wakil komisi pendidikan dan penguji ujian skripsi atas saran dan diskusi yang diberikan. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya. Di samping itu, ungkapan terima kasih penulis sampaikan kepada Marsela, lalu rekan satu bimbingan (Rukhin, Zahra, Munji, Kak Andri, Kak Aay dan Kak Antri), rekan fasttrack (Hendri, Ayun, Feni, Annisa dan Nurul), rekan-rekan Biologi 46 dan semua pihak yang turut berpartisipasi dalam penelitian ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 1
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 2
Bahan 2
Alat 2
Prosedur Analisis Data 3
HASIL DAN PEMBAHASAN 4
Hasil 4
Pembahasan 12
SIMPULAN DAN SARAN 14
Simpulan 14
Saran 15
DAFTAR PUSTAKA 15
LAMPIRAN 17
DAFTAR TABEL
1 Lokasi pengambilan sampel 2
2 Kelimpahan bakteri nitrifikasi, denitrifikasi, dan DNRA pada desa Lubuk Kepayang (kode BO2) dengan dua kedalaman yang berbeda 5 3 Kelimpahan bakteri nitrifikasi, denitrifikasi, dan DNRA pada desa
Lubuk Kepayang (kode PT ELM) dengan dua kedalaman yang
berbeda 7
4 Kelimpahan bakteri nitrifikasi, denitrifikasi, dan DNRA pada desa Lubuk Kepayang (kode BO3) dengan dua kedalaman yang berbeda 8 5 Kelimpahan bakteri nitrifikasi, denitrifikasi, dan DNRA pada desa
Pompa Air (kode POMPA) dengan dua kedalaman yang berbeda 10 6 Kelimpahan bakteri nitrifikasi, denitrifikasi, dan DNRA pada desa
Bungku (kode BUNGKU) dengan dua kedalaman yang berbeda 11 7 Nilai Vmaks dan Km dari setiap spot pada kedalaman berbeda 11
DAFTAR GAMBAR
1 Laju potensial nitrifikasi, denitrifikasi, dan DNRA pada desa Lubuk Kepayang (kode BO2) dengan kedalaman (a) 0-5 cm dan (b) 5-10 cm 5 2 Laju potensial nitrifikasi, denitrifikasi, dan DNRA pada desa Lubuk
Kepayang (kode PT ELM) dengan kedalaman (a) 0-5 cm dan (b) 5-10
cm 6
3 Laju potensial nitrifikasi, denitrifikasi, dan DNRA pada desa Lubuk Kepayang (kode BO3) dengan kedalaman (a) 0-5 cm dan (b) 5-10 cm 8 4 Laju potensial nitrifikasi, denitrifikasi, dan DNRA pada desa Pompa
air (kode POMPA) dengan kedalaman (a) 0-5 cm dan (b) 5-10 cm 9 5 Laju potensial nitrifikasi, denitrifikasi, dan DNRA pada desa Bungku
(kode BUNGKU) dengan kedalaman (a) 0-5 cm dan (b) 5-10 cm 10
DAFTAR LAMPIRAN
1 Peta lokasi Lubuk Kepayang 17
2 Peta lokasi Bungku 17
3 Kurva standar amonium 18
4 Kurva standar nitrit 18
5 Kurva standar nitrat 19
6 Komposisi media nitrifikasi 19
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara dengan wilayah hutan hujan tropis yang luas. Selain itu, Indonesia juga termasuk ke dalam negara agraris karena aktivitas utama penduduknya ialah bercocok tanam (bertani atau berkebun). Wilayah pertanian dan perkebunan di Indonesia setiap hari semakin berkurang karena lahan untuk bercocok tanam tidak mencukupi. Oleh karena itu pembukaan hutan hujan untuk mengatasi kekurangan lahan mutlak dilakukan. Konversi dari hutan hujan menjadi wilayah hutan industri, perkebunan dan pertanian menimbulkan perubahan komunitas mikrob dan siklus yang terdapat di dalamnya. Salah satu siklus yang berperan penting di alam ialah siklus nitrogen. Siklus nitrogen yang berperan penting di alam antara lain nitrifikasi, denitrifikasi, dan DNRA (Dissimilative Nitrate Reduction to Ammonium).
Nitrifikasi merupakan proses oksidasi senyawa amonium menjadi nitrit dan nitrat. Proses nitrifikasi terjadi pada kondisi pertumbuhan autotrof maupun heterotrof (Bock et al. 1992, Atlas dan Bartha 1998). Proses nitrifikasi diawali dengan oksidasi ammonium menjadi nitrit, kemudian dilanjutkan dengan oksidasi nitrit menjadi nitrat. Denitrifikasi ialah proses reduksi nitrat menjadi nitrit, nitrit menjadi nitrit oksida, nitrit oksida menjadi gas nitrous oksida hingga pada akhirnya dihasilkan gas nitrogen (Atlas dan Bartha 1998). Richardson (2000) mengemukakan bahwa denitrifikasi merupakan proses reduksi nitrat yang berhubungan langsung dengan proses transfer elektron dan senyawa organik berperan sebagai donor elektron.
DNRA atau Dissimilative Nitrate Reduction to Ammonium merupakan proses reduksi nitrat menjadi amonium secara disimilasif pada saat konsentrasi karbon tinggi. Bakteri DNRA mereduksi senyawa nitrat sejalan dengan penambahan senyawa nitrit. Ketika konsentrasi nitrat rendah, terjadi penambahan ammonium (Kelso et al. 1997). Proses pembentukan N2O secara DNRA bukan
sebagai senyawa antara seperti pada proses denitrifikasi, tetapi merupakan produk samping melalui reaksi kimia dalam menghasilkan ammonium (Rusmana 2003). Tiga komponen yang diamati ini merupakan bagian dari siklus nitrogen yang berpengaruh terhadap kelangsungan ekosistem.
Perumusan Masalah
Proses nitrifikasi, denitrifikasi, dan DNRA merupakan proses yang umum terjadi di ekosistem, terlebih di hutan. Aktivitas bakteri nitrifikasi, denitrifikasi, dan DNRA berperan pada siklus nitrogen dan emisi N2O. Perubahan tata guna
2
Tujuan Penelitian
Penelitian ini bertujuan untuk menghitung laju potensial nitrifikasi, denitrifikasi, DNRA, dan kelimpahan bakterinya di lahan perkebunan sawit, Jambi.
Manfaat Penelitian
Penelitian ini diharapkan bisa dijadikan sebagai acuan untuk pengukuran laju nitrifikasi, denitrifikasi, dan DNRA pada lahan kelapa sawit yang berbeda serta dapat mengetahui karakter siklus nitrogen yang terdapat pada tanah tersebut.
METODE
Penelitian ini dilaksanakan pada bulan Januari 2013 – Maret 2013 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
Bahan
Bahan yang digunakan dalam penelitian ini meliputi sampel tanah hutan primer Jambi dari lima plot dengan dua ulangan (Tabel 1) , media cair nitrifikasi, media cair denitrifikasi, media cair DNRA (Rodina 1972 dalam Novita 2006), reagen nitrit, reagen ammonium, reagen nitrat (Greenberg et al. 1992), dan gas nitrogen.
Tabel 1 Lokasi pengambilan sampel
Kode pipa Lokasi pengambilan
BO 2 Desa Lubuk Kepayang, Kec. Air Hitam, Kab. Sarolangun, Jambi
BO 3 Desa Lubuk Kepayang, Kec. Air Hitam, Kab. Sarolangun, Jambi
PT ELM Desa Lubuk Kepayang, Kec. Air Hitam, Kab. Sarolangun, Jambi
BUNGKU Desa Bungku, Kec. Bajubang, Kab. Batanghari, Jambi
POMPA Desa Pompa Air, Kec. Bajubang, Kab. Batanghari, Jambi
Alat
3
Prosedur Analisis Data
Sampling Tanah
Pengambilan tanah dilakukan secara acak pada beberapa titik yang mewakili lahan dengan cara menancapkan soil sample core yang terbuat dari pipa PVC berdiameter 1.5 inchi ke tanah. Tanah diambil sekitar 15 cm secara vertikal. Kemudian soil sample core diangkat dan ditutup dengan plastik pada kedua ujungnya dengan rapat.
Pembuatan Slurry
Sampel yang terdapat pada pipa dikeluarkan dengan cara dipotong agar tidak mengubah struktur dan letak tanah yang diambil tiap 5 cm kemudian sampel dibuat slurry (Rusmana dan Nedwell 2004). Tanah diambil lalu dimasukkan ke dalam tabung, selanjutnya dicampurkan dengan air destilata (1:3). Selanjutnya campuran dihomogenisasi, kemudian dibagi-bagi ke dalam beberapa tabung sesuai perlakuan yang diinginkan. Perlakuan dan penambahan substrat yang berbeda-beda tergantung laju proses yang diukur.
Pengukuran Laju Potensial Nitrifikasi
Slurry ditambahkan dengan substrat berupa NH4+ dengan konsentrasi 0,
100, 200, 500, 1000, dan 2000 µM. Campuran dihomogenisasi dan didiamkan selama 3 jam dalam suasana aerob. Konsentrasi NO3-, NO2-, dan NH4+ kemudian
dianalisis.
Pengukuran Laju Potensial Denitrifikasi dan DNRA
Slurry ditambahkan dengan substrat berupa NO3- dengan konsentrasi 0,
100, 200, 500, 1000, dan 2000 µM. Campuran dihomogenisasi dan didiamkan selama 3 jam dalam suasana anaerob. Konsentrasi NO3-, NO2-, dan NH4+
kemudian dianalisis. Perlakuan untuk denitrifikasi dan DNRA dilakukan pada tabung yang berbeda.
Analisis Kadar Ammonium
Sebanyak 5 ml sampel yang telah disaring ditambah dengan 0.2 ml fenol alkohol 10 %, 0.2 ml nitroprusid 0.5 %, dan 0.5 ml campuran hipoklorit teknis dan asam sitrat 20 % (1:4), kemudian didiamkan selama 1 jam. Setiap setelah pemberian pereaksi dilakukan pengadukan. Pemberian pereaksi akan menghasilkan warna biru. Warna yang terbentuk dibaca serapannya pada panjang gelombang 640 nm (Greenberg et al. 1992). Nilai absorban yang diperoleh dikonversi menggunakan standar hingga diperoleh satuan dalam konsentrasi
(μM).
Analisis Kadar Nitrit
4
nm (Greenberg et al. 1992). Nilai absorban yang diperoleh dikonversi
menggunakan standar hingga diperoleh satuan dalam konsentrasi (μM).
Analisis Kadar Nitrat
Sebanyak 5 ml sampel yang telah disaring ditambah dengan 1 ml NaCl 30%, 5 ml asam sulfat pekat dan 0.5 ml brusin sulfat, kemudian dipanaskan dipenangas selama 20 menit pada suhu 95 oC. Perlakuan akan menghasilkan warna kuning. Warna yang terbentuk dibaca serapannya pada panjang gelombang 410 nm (Greenberg et al. 1992). Nilai absorban yang diperoleh dikonversi
menggunakan standar hingga diperoleh satuan dalam konsentrasi (μM).
Perhitungan Kelimpahan Bakteri
Kelimpahan bakteri dihitung dengan mengunakan metode MPN (Most Probable Number) 3 seri dengan pengenceran 6 kali yang dilakukan pada media cair. Media yang digunakan berupa media nitrifikasi, dan denitrifikasi. Media nitrifikasi ditambah dengan NH4Cl dan NaHCO3. Media denitrifikasi ditambah
dengan KNO3 dan Na-asetat sedangkan media DNRA dengan KNO3 dan glukosa.
Tanah diencerkan di dalam larutan NaCl fisiologis dengan perbandingan 1:9, kemudian campuran dihomogenisasi. Sebanyak 1 ml campuran dimasukkan ke dalam 9 ml media cair (Pengenceran 1) kemudian diambil 1 ml dari pengenceran 1, dimasukkan ke dalam 9 ml media cair pada tabung 2 (Pengeceran 2), kemudian diambil 1 ml dari pengenceran 2, dimasukkan ke dalam 9 ml media cair pada tabung 3 (Pengenceran 3) hingga pengenceran ke- 6. Tabung di inkubasi 72 jam untuk melihat adanya aktivitas bakteri.
HASIL DAN PEMBAHASAN
Hasil
Laju Potensial dan Kelimpahan Bakteri Nitrifikasi, Denitrifikasi dan DNRA pada Perkebunan Sawit di Desa Lubuk Kepayang
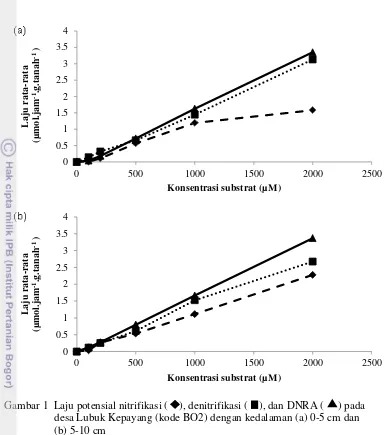
Pada desa Lubuk Kepayang, sampel yang diambil terdiri atas tiga plot, yaitu plot BO2, PT ELM, dan BO3. Pada plot BO2, laju DNRA tercatat paling tinggi, disusul dengan laju denitrifikasi kemudian laju nitrifikasi untuk kedua kedalaman (Gambar 1). Laju potensial pada kedalaman 0-5 cm tercatat 3.35 µmol.jam-1.g.tanah-1 untuk DNRA, 3.12 µmol.jam-1.g.tanah-1 untuk denitrifikasi dan 1.58 µmol.jam-1.g.tanah-1 untuk nitrifikasi. Laju potensial pada kedalaman 5-10 cm tercatat 3.36 µmol.jam-1.g.tanah-1 untuk DNRA, 2.67 µmol.jam-1.g.tanah-1 untuk denitrifikasi dan 2.27 µmol.jam-1.g.tanah-1 untuk nitrifikasi. Laju nitrifikasi pada kedalaman 0-5 cm menjadi landai pada konsentrasi substrat 2000 µM.
5
Gambar 1 Laju potensial nitrifikasi ( ), denitrifikasi ( ), dan DNRA ( ) pada
desa Lubuk Kepayang (kode BO2) dengan kedalaman (a) 0-5 cm dan
(b) 5-10 cm
Tabel 2 Kelimpahan bakteri nitrifikasi, denitrifikasi, dan DNRA pada desa Lubuk Kepayang (kode BO2) dengan dua kedalaman yang berbeda
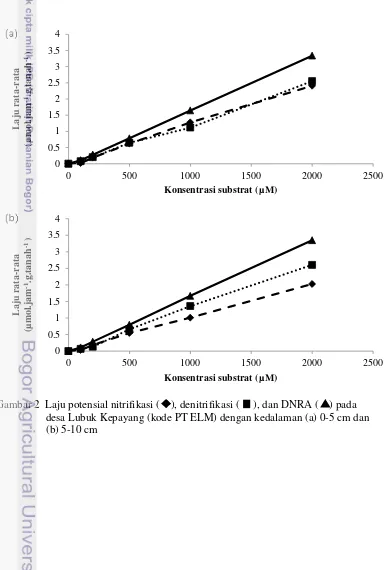
Uji Kelimpahan bakteri (MPN.g.tanah dengan laju denitrifikasi dan nitrifikasi untuk kedua kedalaman (Gambar 2). Laju potensial pada kedalaman 0-5 cm tercatat 3.34 µmol.jam-1.g.tanah-1 untuk DNRA, 2.55 µmol.jam-1.g.tanah-1 untuk denitrifikasi dan 2.40 µmol.jam-1.g.tanah-1 untuk
0 500 1000 1500 2000 2500
L
0 500 1000 1500 2000 2500
6
g.tanah-1 untuk DNRA, 2.60 µmol.jam-1.g.tanah-1 untuk denitrifikasi dan 2.02 µmol.jam-1.g.tanah-1 untuk nitrifikasi. Setiap laju rata- rata mengalami kenaikan seiring dengan pertambahan substrat yang diberikan.
Kelimpahan bakteri nitrifikasi dominan pada kedalaman 5-10 cm. Kelimpahan bakteri denitrifikasi dominan pada kedalaman 5-10 cm. Kelimpahan bakteri DNRA dominan pada kedalaman 0-5 cm (Tabel 3). Kelimpahan bakteri denitrifikasi relatif tidak berbeda pada kedalaman 0-5 cm dan 5-10 cm. Hal ini kemungkinan disebabkan oleh bakteri yang berperan dalam proses denitrifikasi. Kelimpahan bakteri nitrifikasi yang tinggi tidak disertai dengan laju potensial yang dihasilkan. Laju potensial nitrifikasi menempati urutan terendah dibandingkan dua laju potensial yang lain.
Gambar 2 Laju potensial nitrifikasi ( ), denitrifikasi ( ), dan DNRA ( ) pada
0 500 1000 1500 2000 2500
L
0 500 1000 1500 2000 2500
7 Tabel 3 Kelimpahan bakteri nitrifikasi, denitrifikasi, dan DNRA pada desa Lubuk
Kepayang (kode PT ELM) dengan dua kedalaman yang berbeda
Uji Kelimpahan bakteri (MPN.g.tanah
-1
)
0-5 cm 5-10 cm
Nitrifikasi 8.3 x 103 8.5 x 103
Denitrifikasi 1.6 x 104 1.8 x 104
DNRA 2.5 x 104 2.3 x 104
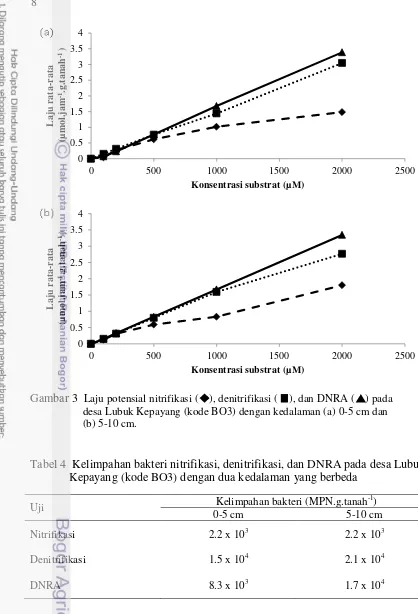
Pada plot ketiga dari desa Lubuk Kepayang, yaitu plot BO3 diperoleh laju DNRA tercatat paling tinggi, disusul oleh laju denitrifikasi kemudian laju nitrifikasi (Gambar 3). Laju potensial pada kedalaman 0-5 cm tercatat 3.38 µmol.jam-1.g.tanah-1 untuk DNRA, 3.04 µmol.jam-1.g.tanah-1 untuk denitrifikasi dan 1.48 µmol.jam-1.g.tanah-1 untuk nitrifikasi. Laju potensial pada kedalaman 5-10 cm tercatat 3.34 µmol.jam-1.g.tanah-1 untuk DNRA, 2.76 µmol.jam-1.g.tanah-1 untuk denitrifikasi dan 1.79 µmol.jam-1.g.tanah-1 untuk nitrifikasi. Laju DNRA dan denitrifikasi mengalami kenaikan seiring dengan penambahan substrat. Namun, laju nitrifikasi tidak mengalami kenaikan yang signifikan pada konsentrasi substrat yang tinggi.
Kelimpahan bakteri nitrifikasi sama pada kedalaman 0-5 cm dan 5-10 cm. Kelimpahan bakteri denitrifikasi dominan pada kedalaman 5-10 cm. Kelimpahan bakteri DNRA dominan pada kedalaman 5-10 cm (Tabel 4). Kelimpahan bakteri nitrifikasi pada plot ini berada pada urutan terbawah dibandingkan dengan kelimpahan bakteri DNRA dan denitrifikasi sehingga berkorelasi dengan laju potensial yang dihasilkan lebih rendah dari dua laju lain. Kelimpahan bakteri DNRA yang tinggi sesuai dengan tingginya laju potesial yang diperoleh.
8
Gambar 3 Laju potensial nitrifikasi ( ), denitrifikasi ( ), dan DNRA ( ) pada desa Lubuk Kepayang (kode BO3) dengan kedalaman (a) 0-5 cm dan (b) 5-10 cm.
Tabel 4 Kelimpahan bakteri nitrifikasi, denitrifikasi, dan DNRA pada desa Lubuk Kepayang (kode BO3) dengan dua kedalaman yang berbeda
Uji Kelimpahan bakteri (MPN.g.tanah
Laju Potensial dan Kelimpahan Bakteri Nitrifikasi, Denitrifikasi dan DNRA pada Perkebunan Sawit di Desa Pompa Air
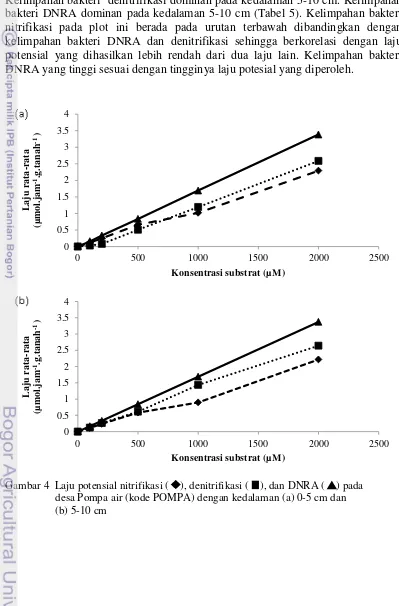
Laju DNRA tercatat sebagai laju paling tinggi pada plot ini, disusul laju denitrifikasi kemudian laju nitrifikasi (Gambar 4). Laju potensial pada kedalaman 0-5cm tercatat 3.38 µmol.jam-1.g.tanah-1 untuk DNRA, 2.58 µmol.jam-1.g.tanah-1
0 500 1000 1500 2000 2500
L
0 500 1000 1500 2000 2500
9 untuk denitrifikasi dan 2.28 µmol.jam-1.g.tanah-1 untuk nitrifikasi. Laju potensial pada kedalaman 5-10 cm tercatat 3.37 µmol.jam-1.g.tanah-1 untuk DNRA, 2.63 µmol.jam-1.g.tanah-1 untuk denitrifikasi dan 2.21 µmol.jam-1.g.tanah-1 untuk nitrifikasi. Setiap laju rata- rata mengalami kenaikan seiring dengan pertambahan substrat yang diberikan.
Kelimpahan bakteri nitrifikasi dominan pada kedalaman 0-5 cm. Kelimpahan bakteri denitrifikasi dominan pada kedalaman 5-10 cm. Kelimpahan bakteri DNRA dominan pada kedalaman 5-10 cm (Tabel 5). Kelimpahan bakteri nitrifikasi pada plot ini berada pada urutan terbawah dibandingkan dengan kelimpahan bakteri DNRA dan denitrifikasi sehingga berkorelasi dengan laju potensial yang dihasilkan lebih rendah dari dua laju lain. Kelimpahan bakteri DNRA yang tinggi sesuai dengan tingginya laju potesial yang diperoleh.
Gambar 4 Laju potensial nitrifikasi ( ), denitrifikasi ( ), dan DNRA ( ) pada
0 500 1000 1500 2000 2500
L
0 500 1000 1500 2000 2500
10
Tabel 5 Kelimpahan bakteri nitrifikasi, denitrifikasi, dan DNRA pada desa Pompa Air (kode POMPA) dengan dua kedalaman yang berbeda
Uji Kelimpahan bakteri (MPN.g.tanah
Laju Potensial dan Kelimpahan Bakteri Nitrifikasi, Denitrifikasi dan DNRA pada Perkebunan Sawit di Desa Bungku
Laju DNRA dan denitrifikasi hampir sama, tetapi tetap DNRA laju tertinggi. Laju nitrifikasi tetap berada diurutan terbawah. (Gambar 5). Laju potensial pada kedalaman 0-5cm tercatat 3.36 µmol.jam-1.g.tanah-1 untuk DNRA, 3.33 µmol.jam-1.g.tanah-1 untuk denitrifikasi dan 2.19 µmol.jam-1.g.tanah-1 untuk
0 500 1000 1500 2000 2500
L
0 500 1000 1500 2000 2500
11
Laju potensial pada kedalaman 5-10 cm tercatat 3.29 µmol.jam-1.g.tanah-1 untuk DNRA, 3.28 µmol.jam-1.g.tanah-1 untuk denitrifikasi dan 2.02 µmol.jam-1.g.tanah
-1
untuk nitrifikasi. Setiap laju rata-rata mengalami kenaikan seiring dengan pertambahan substrat yang diberikan.
Kelimpahan bakteri nitrifikasi dominan pada kedalaman 0-5 cm. Kelimpahan bakteri denitrifikasi dominan pada kedalaman 0-5 cm. Kelimpahan bakteri DNRA dominan pada kedalaman 5-10 cm (Tabel 6). Kelimpahan bakteri nitrifikasi pada plot ini berada pada urutan terbawah dibandingkan dengan kelimpahan bakteri DNRA dan denitrifikasi sehingga berkorelasi dengan laju potensial yang dihasilkan lebih rendah dari dua laju lain.
Tabel 6 Kelimpahan bakteri nitrifikasi, denitrifikasi, dan DNRA pada desa Bungku (kode BUNGKU) dengan dua kedalaman yang berbeda
Uji Kelimpahan bakteri (MPN.g.tanah
Kinetika Aktivitas Nitrifikasi, Denitrifikasi, dan DNRA
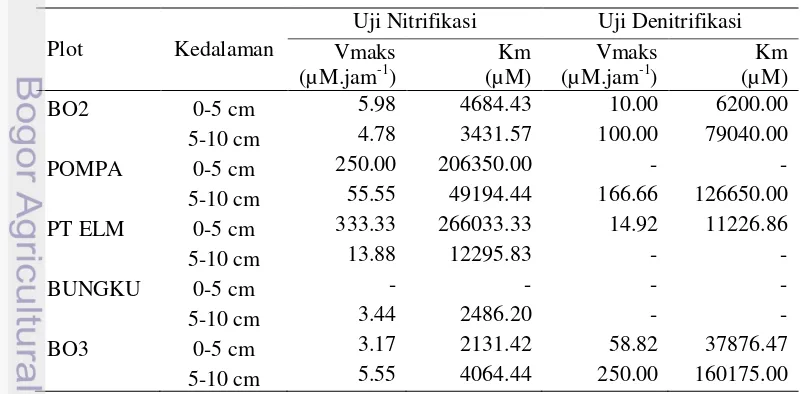
Kinetika aktivitas diketahui dengan cara mencari nilai Vmaks dan Km. Nilai Vmaks dan Km dari tiap plot dihitung. Perhitungan dilakukan dengan menggunakan metode Lineweaver-Burk (Double Reciprocal). Nilai Vmaks dan Km uji nitrifikasi rata-rata positif, sedangkan nilai Vmaks dan Km untuk DNRA tidak dapat diukur dengan metode ini. Nilai Vmaks dan Km uji denitrifikasi ada yang dapat diukur dan ada yang tidak (Tabel 7).
Tabel 7 Nilai Vmaks dan Km dari setiap spot pada kedalaman berbeda *)
Plot Kedalaman
BO2 0-5 cm 5.98 4684.43 10.00 6200.00
5-10 cm 4.78 3431.57 100.00 79040.00
POMPA 0-5 cm 250.00 206350.00 -
-5-10 cm 55.55 49194.44 166.66 126650.00
PT ELM 0-5 cm 333.33 266033.33 14.92 11226.86
5-10 cm 13.88 12295.83 -
-BUNGKU 0-5 cm - - -
-5-10 cm 3.44 2486.20 -
-BO3 0-5 cm 3.17 2131.42 58.82 37876.47
5-10 cm 5.55 4064.44 250.00 160175.00
12
Pembahasan
Laju Potensial Nitrifikasi, Denitrifikasi dan DNRA
Pada setiap uji (uji amonium, uji nitrit, dan uji nitrat) akan menunjukkan warna yang berbeda-beda. Uji ammonium akan menghasilkan warna biru, uji nitrit menghasilkan warna merah muda sedangkan uji nitrat menghasilkan warna kuning, kemudian diukur absorbannya dengan spektrofotometer. Data yang diperoleh dari pengukuran dengan spektrofotometer yang kemudian dikonversi dengan menggunakan kurva standar (Lampiran 3,4,5). Hasil data yang diperoleh kemudian dikonversi menjadi laju rata-rata dalam satuan µmol.jam-1.g.tanah-1.
Dari kelima plot yang diuji, terlihat dengan jelas bahwa laju DNRA menempati urutan pertama, kemudian diikuti oleh laju denitrifikasi dan yang terakhir laju nitrifikasi. Hal ini sesuai dengan yang dilaporkan oleh Dong et al. (2011) bahwa pada daerah tropis, perbandingan reduksi nitrat akan mengikuti pola DNRA > denitrifikasi > anammox. Silver et al. (2001) juga melaporkan bahwa 75% NO3 pada tanah tropis direduksi secara DNRA. Hal ini berkorelasi dengan
yang didapat bahwa laju DNRA pada tanah yang diuji tinggi.
Menurut Wei et al. (2012), proses DNRA lebih efektif dibandingkan denitrifikasi karena pada DNRA, terjadi transfer 8 elektron per mol NO3-,
sedangkan proses denitrifikasi hanya terjadi transfer 5 elektron per mol NO3-.
Selain itu juga melaporkan bahwa bakteri yang mampu melakukan proses DNRA lebih banyak dibandingkan denitrifikasi sehingga proses DNRA cenderung lebih sensitif terhadap adanya NO3- yang terdapat di area tersebut.
Laju DNRA biasanya akan optimum pada lingkungan dengan kadar karbon yang tinggi (Buresh & Patrick 1978, Christensen et al. 2000). Lahan tropis biasa terdekomposisi dengan bahan organik sehingga kadar karbon yang terkandung di dalam tanah cenderung tinggi. Namun, pada beberapa plot terlihat bahwa laju DNRA dan laju denitrifikasi tidak terpaut jauh. Hal ini dapat dipengaruhi oleh beberapa faktor dan terkait tanah yang dianalisis. Proses DNRA umumnya terjadi anaerob, sedangkan denitrifikasi juga berlangsung dalam kondisi anaerob namun ada beberapa spesies yang mampu melakukan proses denitrifikasi dalam kondisi aerob sperti Pseudomonas stutzeri (Korner & Zumft 1989). Baik DNRA dan denitrifikasi membutuhkan pH berkisar 6 hingga 7 agar optimum.
Proses DNRA dan denitrifikasi sama-sama menghasilkan gas N2O, namun
dengan jalan yang berbeda. N2O merupakan produk yang dihasilkan langsung
pada denitrifikasi sedangkan pada DNRA merupakan produk sampingan. N2O
tergolong ke dalam gas rumah kaca (Rusmana 2003). Dengan demikian, secara tidak langsung proses DNRA dan denitrifikasi menyumbang kontribusi terhadap global warming.
Kelimpahan Bakteri Nitrifikasi, Denitrifikasi dan DNRA
13 Kelimpahan bakteri yang didapat bervariasi tergantung dari proses yang diuji. Pada uji nitrifikasi, umumnya kelimpahan bakteri dominan pada kedalaman 0-5 cm. Proses nitrifikasi terjadi secara aerob, sehingga bakteri nitrifikasi berada pada bagian atas tanah karena pada daerah tersebut kondisi oksigen masih baik. Pada kedalaman 5-10 cm, kondisi oksigen sudah mulai menurun. Namun, pada beberapa spot tidak terlihat perbedaan nyata. Hal ini disebabkan tanah yang diuji agak liat, sehingga kemungkinan pada tanah bagian atas dapat terbentuk kondisi anaerob.
Pada uji denitrifikasi, hasil yang didapat bervariasi. Hasil pada semua plot acak untuk kedalaman 0-5 cm dan 5-10 cm. Ada beberapa plot yang dominan bakteri denitrifikasinya pada kedalaman 0-5 cm, tetapi ada juga plot yang dominan bakteri denitrifikasinya pada kedalaman 5-10 cm. Secara teori, aktivitas denitrifikasi umum pada kondisi anerob, sehingga kedalaman 5-10 cm diharapkan menunjukkan kelimpahan bakteri yang tinggi. Namun, aktivitas denitrifikasi juga dapat terjadi pada kondisi aerob (Zumft 1992), sehingga pada kedalaman 0-5 cm dapat terjadi aktivitas denitrifikasi.
Pada uji DNRA, kelimpahan bakteri yang diperoleh dominan pada kedalaman 5-10 cm. Hal ini sesuai dengan kondisi yang dibutuhkan oleh bakteri DNRA karena pada kedalaman tersebut, kadar oksigen sudah tidak terlalu tinggi dibandingkan kedalaman 0-5 cm sehingga terbentuk suasana anaerob. Bakteri DNRA mereduksi nitrat menjadi amonium pada kondisi anaerob.
Kelimpahan bakteri juga berpengaruh terhadap laju potensial yang dihasilkan pada tiap-tiap plot. Kelimpahan bakteri DNRA yang cenderung tinggi jika dibandingkan dengan laju lain menunjukkan korelasi yang positif terhadap laju potensial DNRA pada plot yang diamati. Hal yang serupa juga ditemui pada proses nitrifikasi. Kelimpahan bakteri nitrifikasi tercatat paling rendah dari dua laju lain. Hal ini juga berkorelasi dengan laju potensial nitrifikasi yang rendah dibandingkan dengan laju potensial denitrifikasi dan DNRA. Jadi, kelimpahan bakteri (nilai MPN) berkorelasi positif terhadap laju potensial yang dihasilkan pada masing-masing proses.
Namun, jika dilihat dari kelimpahan bakteri yang dihasilkan dari uji nitrifikasi, kelimpahan bakteri yang diperoleh sebenarnya tidak terlalu rendah. Penurunan laju potensial nitrifikasi yang terjadi kemungkinan disebabkan oleh adanya faktor penghambat laju nitrifikasi. Proses nitrifikasi dapat berlangsung lambat pada beberapa tipe tanah dan pada beberapa kasus juga terhambat oleh beberapa eksudat akar atau senyawa yang terlarut pada tanah (Robertson dan Groffman 2007). Nitrapirin, dycandimide dan piridin dapat menghambat proses nitrifikasi di tanah. Selain itu, Freenay et al. (2000) melaporkan kalsium karbit (CaC2) dapat menghambat proses nitrifikasi dengan cara bereaksi dengan air
membentuk asetilen (C2H2) yang menghambat proses nitrifikasi. Minyak neem
yang diekstrak dari Azadirachta indica, digunakan secara komersial sebagai pelapis pelet pupuk urea juga dapat menghambat proses nitrifikasi (Robertson dan Groffman 2007).
Kinetika Aktivitas Nitrifikasi, Denitrifikasi, dan DNRA.
14
(1/laju) dengan 1/s (1/konsentrasi substrat). Nilai V dari suatu reaksi enzim akan meningkat dengan bertambahnya konsentrasi substrat [S], akan tetapi setelah [S] meningkat lebih lanjut akan sampai pada kecepatan yang tetap. Pada konsentrasi enzim tertentu, nilai V hampir linier dengan [S]. Pada kondisi ketika V tidak dapat bertambah lagi dengan bertambahnya [S] disebut kecepatan maksimum (Vmaks). Vmaks merupakan salah satu parameter kinetika enzim (Wiseman 1989).
Parameter kinetika enzim yang lain adalah konstanta Michaelis-Menten, yang lebih dikenal dengan Km. Km merupakan konsentrasi substrat yang separuh dari lokasi aktifnya telah terisi, yaitu bila kecepatan reaksi enzim telah mencapai ½ Vmaks. Nilai Km dapat digunakan dalam menentukan ukuran afinitas enzim-substrat (E-S), merupakan suatu indikator kekuatan ikatan kompleks E-S atau suatu tetapan keseimbangan untuk disosiasi kompleks E-S menjadi E dan S. Nilai Km kecil berarti kompleks E-S mantap, afinitas enzim tinggi terhadap substrat, sedangkan bila Km besar berlaku kebalikannya. Nilai Km enzim sangat bervariasi tergantung dari jenis substrat, keadaan lingkungan dan kekuatan ion (Wiseman 1989).
Hasil yang diperoleh terdapat beberapa spot dengan nilai Vmaks dan Km yang positif (dapat diukur), namun ada pula beberapa yang tidak dapat diukur. Pada uji nitrifikasi hampir semua terukur dengan baik (hanya satu yang tidak dapat diukur). Hal ini berbanding terbalik dengan DNRA, karena pada semua spot nilai Vmaks dan Km tidak dapat diukur. Pada denitrifikasi ada beberapa yang tidak dapat diukur dan ada yang dapat diukur.
Nilai Vmaks dari uji yang dapat diukur (nitrifikasi dan sebagian denitrifikasi) tergolong rendah dan nilai Km yang didapat tergolong tinggi. Diduga, kompleks ikatan E-S pada reaksi nitrifikasi dan denitrifikasi kurang mantap dan afinitas enzim yang kurang. Nilai Vmaks dan Km pada uji DNRA yang tidak dapat diukur diduga pengukuran yang dilakukan dengan metode Burk tidak efektif untuk DNRA. Pemakaian metode Lineweaver-Burk sebenarnya cukup beresiko. Hasil transformasi data dengan metode ini dapat dengan mudah diinterpretasikan, namun terkadang tidak semua uji dapat menggunakan metode ini. Selain itu, metode Lineweaver-Burk memiliki nilai error yang cukup tinggi (Dowd dan Riggs 1965).
SIMPULAN DAN SARAN
Simpulan
15
Saran
Uji lanjut diperlukan untuk pengukuran laju potensial nitrifikasi, denitrifikasi, dan DNRA dengan rentang waktu lebih dari 3 jam. Selain itu diperlukan uji dan metode yang cocok untuk analisis selain metode Lineweaver-Burk untuk menghitung Vmaks dan Km.
DAFTAR PUSTAKA
Atlas RM, Bartha R. 1998. Microbial Ecology: Fundamentals and Applications. 4th Edition. California (US): Benjamin Cumming Sciences Publishing. Bock E, Koops HP, Ahlers B, Harms H. 1992. Oxidation of inorganic compounds
as Energy Sources. Di dalam Balows A, Truper GH, Dworkin M, Harder W, Schleifer KZ, editor. The Prokaryotes. A Hand Book on the Biology of Bacteria. New York (US): Springer-Verlag.
Buresh RJ, Patrick WH. 1978. Nitrate reduction to ammonium in anaerobic soil. Soil Sci Soc of Am J. 42(6): 913-918.
Christensen PB, Rysgaard S, Sloth NP, Dalsgaard T, Schwaerter S.2000. Sedimen mineralization, nutrient fluxes, denitrification and dissimilatory nitrate reduction to ammonium in an estuarine fjord with sea cage trout farms. Aquat Microb Ecol. 21(1): 73-84.
Dong LF, Sobey MN, Smith CJ, Rusmana I, Philips W, Stott A, Osborn AM, Nedwell DB. 2012. Dissimilatory reduction of nitrate to ammonium, not denitrification or anammox, dominates benthic nitrate reduction in tropical estuaries. Limnol Oceanogr. 56(1): 279–291.
Dowd JE, Riggs DS. 1965. A comparison of estimates of Michaelis-Menten kinetic constants from various linear transformations. Biochem J. 240(2): 863-869.
Freney JR, Randall PJ, Smith JWB, Hodgkin J, Harrington KJ, Morton TC. 2000. Slow release of acetylene to inhibit nitrification in soil. Nutrient Cycling Agroecosyst. 56(3): 241-251.
Greenberg AE, Clesceri LS, Eaton AD. 1992. Standard Methods for Examination of Water and Wastewater. 18th Edition. Washington DC (US): Publication Office American Public Health Association.
Kelso BHL, Smith RV, Laughlin RJ, Lennox D. 1997. Dissimilatory nitrate reduction in aerobic sediments leading river nitrite accumulation. Appl Environ Microbiol. 63(12): 4679-4685.
Korner H, Zumft WG. 1989. Expression of denitrification enzymes in response to the dissolved oxygen level and respiratory substrate in continuos culture of Pseudomonas stutzeri. Appl Environ Microbiol. 55(7): 1670-1676.
Novita L. 2006. Aktivitas oksidasi amonium dan reduksi nitrat ASLT2 pada sumber karbon yang berbeda [skripsi]. Bogor (ID): Institut Pertanian Bogor. Richardson DJ. 2000. Bacterial respiration: a flexible process for a changing
16
Robertson GP, Groffman PM. 2007. Nitrogen Transformation. Di dalam: Paul EA, editor. Soil Microbiology, Biochemistry, and Ecology. New York (US): Springer.
Rusmana I. 2003. Physiology of nitrous oxide production in estuarian dissimilative nitrate reducing bacteria [disertasi]. Colchester (UK): Department of Biology University of Essex.
Rusmana I, Nedwell DB. 2004. Use of chlorate as a selective inhibitor to distinguish membrane-bound nitrate reductase (Nar) and periplasmic nitrate reductase (Nap) of dissimilative nitrate reducing bacteria in sediment. FEMS Microbiol. 48(3): 379–386.
Silver WL, Herman DJ, Firestone MK. 2001. Dissimilatory nitrate reduction to ammonium in upland tropical forest soils. Ecology 82(9): 2410–2416. Wiseman A. 1989. Handbook of Enzymes Biotechnology. 2nd Edition. New York
(US): Ellis Howard Inc.
Wei LW, Riya S, Sheng Z, Hosomi M, Lin ZH, Ming SW. 2012. In situ dissimilatory nitrate reduction to ammonium in a paddy soil fertilized with liquid cattle waste. Pedosphere 22(3): 314–321.
17
LAMPIRAN
Lampiran 1 Peta lokasi Lubuk Kepayang
Desa Lubuk Kepayang, Kecamatan Air Hitam, Kabupaten Sarolangun, Jambi.
Lampiran 2 Peta lokasi Bungku
18
Lampiran 3 Kurva standar amonium
19 Lampiran 5 Kurva standar nitrat
Lampiran 6 Komposisi media nitrifikasi
Komposisi media nitrifikasi (g/L) (Rodina 1972 dalam Novita 2006) 13.5 KH2PO4
Lampiran 7 Komposisi media denitrifikasi dan DNRA
Komposisi media denitrifikasi dan DNRA (g/L) (Rodina 1972 dalam Novita 2006).
10 Na-asetat (untuk denitrifikasi), Glukosa (untuk DNRA) 5 KNO3
Kondisi anaerob dibuat dengan metode Oxygen-Free Nitrogen (OFN) yang dialirkan melalui syringe selama 2 menit.
20
RIWAYAT HIDUP
Penulis dilahirkan di Solok pada tanggal 15 Februari 1991 sebagai anak pertama dari dua bersaudara, dengan ayah bernama Drs. Abdul Hadi Sp.PSA dan ibu bernama Rosyanti Eka Putri S.Pd.
Pada tahun 2009, penulis lulus dari SMU Negeri 1 Solok dan pada tahun yang sama diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama mengikuti perkuliahan di IPB, penulis pernah menjadi asisten praktikum Biologi Dasar pada tahun ajaran 2011/2012. Penulis juga pernah menjadi pengurus HIMABIO divisi INFOKOM pada tahun 2011 dan ketua divisi INFOKOM pada tahun 2012. Penulis juga aktif dalam perkusi PISCES dan pengurus IPMM divisi INFOKOM. Penulis juga aktif dalam beberapa kepanitian di kampus dan di organisasi. Penulis mendapatkan beasiswa PPA (Peningkatan Prestasi Akademik) dari semester satu hingga semester delapan.