PENGARUH PEMBERIAN BAKTERI NITRIFIKASI DAN
DENITRIFIKASI SERTA MOLASE DENGAN C/N RASIO
BERBEDA TERHADAP PROFIL KUALITAS AIR,
KELANGSUNGAN HIDUP, DAN PERTUMBUHAN
UDANG VANAME
Litopenaeus vannamei
DEBY YUNIASARI
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI :
Dengan ini saya menyatakan bahwa Skripsi yang berjudul :
PENGARUH PEMBERIAN BAKTERI NITRIFIKASI DAN DENITRIFIKASI SERTA MOLASE DENGAN C/N RASIO YANG BERBEDA TERHADAP PROFIL KUALITAS AIR, KELANGSUNGAN
HIDUP, DAN PERTUMBUHAN UDANG VANAME Litopenaeus vannamei
Adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, Januari 2009
RINGKASAN
DEBY YUNIASARI. Pengaruh Pemberian Bakteri Nitrifikasi dan Denitrifikasi
serta Molase dengan C/N Rasio Berbeda terhadap Profil Kualitas Air, Kelangsungan Hidup, dan Pertumbuhan Udang Vaname Litopenaeus vannamei. Dibimbing oleh WIDANARNI dan SUKENDA.
Salah satu permasalahan dalam budidaya udang adalah adanya penurunan kualitas air sebagai akibat akumulasi bahan organik. Akumulasi bahan organik ini dapat menyebabkan timbulnya akumulasi senyawa-senyawa, seperti nitrogen anorganik (amonia, nitrit, nitrat) serta H2S yang pada kisaran tertentu dapat bersifat toksik bagi udang. Permasalahan tersebut dapat diatasi dengan pengontrolan nitrogen anorganik melalui penambahan bahan berkarbon (molase). Penambahan molase dapat meningkatkan pertumbuhan bakteri, baik itu yang merugikan maupun yang menguntungkan. Oleh karena itu perlu dilakukan inokulasi bakteri menguntungkan ke dalam media budidaya untuk menjaga agar bakteri yang tumbuh dominan adalah bakteri yang menguntungkan tersebut. Inokulan bakteri yang dapat digunakan adalah bakteri nitrifikasi dan denitrifikasi. Bakteri nitrifikasi akan mereduksi amonia dan merubahnya menjadi nitrit dan nitrat yang tidak begitu toksik bagi udang. Sedangkan bakteri denitrifikasi dapat mengubah nitrat menjadi gas nitrogen (N2) yang dapat lepas ke udara. Diharapkan dengan penambahan molase serta bakteri nitrifikasi dan denitrifikasi mampu mengurangi amonia dari lingkungan budidaya. Penelitian ini bertujuan untuk mengetahui pengaruh pemberian bakteri nitrifikasi dan denitrifikasi serta molase pada C/N rasio 0, 10, 15, 20, dan 25 terhadap profil kualitas air, kelangsungan hidup, dan pertumbuhan udang vaname Litopenaeus vannamei.
Dalam penelitian ini terdapat 6 perlakuan, yaitu kontrol (tanpa penambahan bakteri dan molase), penambahan bakteri tanpa molase (C/N rasio 0), penambahan bakteri+molase C/N rasio 10, penambahan bakteri+molase C/N rasio 15, penambahan bakteri+molase C/N rasio 20, penambahan bakteri+molase C/N rasio 25. Pemberian pakan dilakukan 5 kali sehari, sedangkan jumlah molase yang ditambahkan didasarkan rumus Avnimelech (1999). Bakteri yang digunakan merupakan hasil isolasi dari tambak udang windu tradisional di Desa Belanakan, Kecamatan Ciasem, Kabupaten Subang, Jawa Barat (Pranoto, 2007). Analisa data dilakukan dengan menggunakan program Excel Ms. Office 2003 dan SPSS 11.0.
Penambahan bakteri nitrifikasi dan denitrifikasi serta molase mempengaruhi profil pH, dissolved oxygen (DO), amonia, nitrit dan nitrat pada media pemeliharaan. Namun demikian kualitas air pada semua perlakuan selama masa pemeliharaan masih berada dalam kisaran toleransi udang vaname. Persentase perubahan amonia yang paling tinggi dimiliki oleh perlakuan penambahan bakteri+molase C/N rasio 10, diikuti dengan perlakuan penambahan bakteri+molase C/N rasio 20 dan bakteri+molase C/N rasio 15 dengan nilai penurunan sebesar 28.5%, 13.9%dan 7.2%.
PENGARUH PEMBERIAN BAKTERI NITRIFIKASI DAN
DENITRIFIKASI SERTA MOLASE DENGAN C/N RASIO
BERBEDA TERHADAP PROFIL KUALITAS AIR,
KELANGSUNGAN HIDUP, DAN PERTUMBUHAN
UDANG VANAME
Litopenaeus vannamei
DEBY YUNIASARI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Departemen Budidaya Perairan
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : Pengaruh Pemberian Bakteri Nitrifikasi dan Denitrifikasi serta Molase dengan C/N Rasio Berbeda terhadap Profil Kualitas Air, Kelangsungan Hidup, dan Pertumbuhan Udang Vaname Litopenaeus vannamei
Nama Mahasiswa : Deby Yuniasari Nomor Pokok : C 14104015
Disetujui,
Pembimbing I Pembimbing II
Dr. Widanarni Dr. Sukenda NIP. 131 101 009 NIP. 132 045 962
Diketahui
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP. 131 578 799
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas rahmat dan hidayah-Nya sehingga skripsi ini dapat diselesaikan dengan baik. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar sarjana pada Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini penulis megucapkan terima kasih yang sebesar-besarnya kepada :
1. Ibu Dr. Widanarni selaku Pembimbing I Skripsi dan Dr. Sukenda selaku Pembimbing II Skripsi atas arahan, bimbingan, dan motivasi selama penelitian dan penyusunan skripsi
2. Bapak Dr. Tatag Budiardi selaku Pembimbing Akademik atas bimbingan, didikan dan bantuan yang telah diberikan selama proses penyelesaian studi 3. Bapak Prof. Dr. Enang Harris selaku dosen penguji atas masukannya yang
berharga
4. Ayahanda, ibunda dan kakanda atas semangat, doa, serta dukungannya
5. Bapak Ranta atas bimbingannya, bantuan serta “gosip-gosip” selama di Laboratotium Kesehatan Ikan
6. Bang Abe, Pak Wasjan, Mba Retno, Pak Aam, Kang Adna, dan Bang Hadi atas bantuannya selama penelitian
7. Rekan-rekan BDP 41: Tata, Uu, Fiska, Sarah, Icha, Agnis, Dewi, Ema, Mbayu, Sahel, Handy, Fheby, Agus, dll atas bantuan, motivasi dan persahabatan yang diberikan,
Bogor, Januari 2009
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 23 Juni 1986 dari pasangan Bapak Dasto dan Ibu Misni. Penulis merupakan anak kedua dari dua bersaudara.
Penulis memulai pendidikannya di Taman Kanak-Kanak Al-Muttaqien Jakarta, SD Pabuaran I Bogor, SLTP Angkasa Bogor, dan SMU Negeri 5 Bogor. Pada tahun 2004 penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor (USMI) dan masuk pada Program Studi Teknologi dan Manajemen Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis aktif menjadi Pengurus Himpunan Mahasiswa Akuakultur (2006/2007) dan Pengurus Badan Eksekutif Mahasiswa (2006/2007). Penulis juga pernah menjadi asisten pada mata kuliah Dasar-Dasar Akuakultur (2006/2007, 2007/2008, dan 2008/2009), Dasar-Dasar Mikrobiologi Akuatik (2007/2008), Manajemen Kesehatan ikan (2007/2008), Fisiologi dan Reproduksi Ikan (2008/2009). Untuk menambah pengetahuan dalam budidaya ikan, penulis mengikuti kegiatan magang ikan hias di Yohannes Fish Farm Ciseeng-Parung (2005), praktek lapang pembenihan dan pembesaran Udang Vaname Litopenaeus vannamei di PT. Centralpertiwi Bahari, Rembang dan PT. Surya Windu Kartika, Banyuwangi (2007). Selain itu penulis juga mengikuti kegiatan Kompetisi Pemikiran Kritis Mahasiswa (KPKM) tingkat nasional di Surabaya (2008), Pekan Mahasiswa Ilmiah Nasional (PIMNAS) di UNILA, Lampung pada tahun 2007 dan di UNISSULA, Semarang pada tahun 2008.
Untuk menyelesaikan studi penulis melakukan penelitian dengan judul
“Pengaruh Pemberian Bakteri Nitrifikasi dan Denitrifikasi serta Molase
dengan C/N Rasio Berbeda terhadap Profil Kualitas Air, Kelangsungan
DAFTAR ISI
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
I. PENDAHULUAN... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
II. TINJAUAN PUSTAKA ... 3
2.1 Udang Vaname Litopenaeus vannamei ... 3
2.2 Sistem Bakteri Heterotrof ... 4
2.2.1 Teknik Intensifikasi Mikrobial ... 7
2.2.2 Sumber Karbon (Molase) ... 8
2.3 Nitrogen ... 9
2.3.1 Amonia (NH3) ... 11
2.3.2 Nitrit (NO2-) ... 12
2.3.3 Nitrat (NO3-) ... 13
2.4 Bioremediasi ... 14
2.5 Proses Penyisihan Nitrogen Secara Biologis ... 15
2.5.1 Nitrifikasi ... 15
2.5.2 Denitrifikasi ... 18
2.6 Kualitas Air ... 19
2.6.1 pH... 19
2.6.2 Suhu ... 19
2.6.3 Oksigen Terlarut (Dissolved oxygen)... 20
III. BAHAN DAN METODE... 22
3.1 Waktu dan Tempat ... 22
3.2 Alat dan Bahan ... 22
3.2.1 Hewan Uji ... 22
3.2.2 Bakteri Nitrifikasi dan Denitrifikasi ... 22
3.2.3 Medium Bakteri ... 22
3.2.4 Sumber Karbon ... 23
3.2.5 Wadah dan Media Pemeliharaan... 23
3.2.5 Peralatan ... 23
3.3 Metode Penelitian ... 23
3.3.1 Persiapan Wadah... 23
3.3.2 Pemeliharaan Udang ... 23
3.3.4 Perlakuan... 25
3.4 Parameter Pengamatan ... 26
3.4.1 Tingkat Kelangsungan Hidup atau Survival Rate (SR)... 26
3.4.2 Pertumbuhan Spesifik atau Spesific Growth Rate (SGR) ... 27
3.4.3 Efisiensi pakan (EP) ... 27
3.4.4 Total Bakteri pada Media Pemeliharaan ... 27
3.4.5 Kualitas Air ... 28
3.4.5.1 Total Amonia Nitrogen (TAN) dan Amonia ... 28
3.4.5.2 pH dan Suhu ... 29
3.4.5.3 Nitrit (NO2-) ... 29
3.4.5.3 Nitrat (NO3-) ... 29
3.5 Prosedur Pengolahan Data ... 30
IV. HASIL DAN PEMBAHASAN ... 31
4.1 Dinamika Populasi Total Bakteri ... 31
4.2 Profil Kualitas Air ... 33
4.3 Pertumbuhan, Kelangsungan Hidup, dan Efisiensi Pakan ... 43
V. KESIMPULAN DAN SARAN ... 49
4.1 Kesimpulan ... 49
4.2 Saran ... 49
DAFTAR PUSTAKA ... 50
DAFTAR TABEL
Halaman
1. C/N rasio berbagai sistem akuatik ... 7
2. Komposisi kimia molase ... 9
3. Bentuk-bentuk nitrogen ... 14
4. Teknologi bioremediasi ... 15
5. Faktor-faktor yang mempengaruhi proses nitrifikasi... 16
6. Laju nitrifikasi beberapa bakteri nitrifikasi autotrof dan heterotrof... 18
7. Kualitas air untuk budidaya udang ... 21
PENGARUH PEMBERIAN BAKTERI NITRIFIKASI DAN
DENITRIFIKASI SERTA MOLASE DENGAN C/N RASIO
BERBEDA TERHADAP PROFIL KUALITAS AIR,
KELANGSUNGAN HIDUP, DAN PERTUMBUHAN
UDANG VANAME
Litopenaeus vannamei
DEBY YUNIASARI
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI :
Dengan ini saya menyatakan bahwa Skripsi yang berjudul :
PENGARUH PEMBERIAN BAKTERI NITRIFIKASI DAN DENITRIFIKASI SERTA MOLASE DENGAN C/N RASIO YANG BERBEDA TERHADAP PROFIL KUALITAS AIR, KELANGSUNGAN
HIDUP, DAN PERTUMBUHAN UDANG VANAME Litopenaeus vannamei
Adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, Januari 2009
RINGKASAN
DEBY YUNIASARI. Pengaruh Pemberian Bakteri Nitrifikasi dan Denitrifikasi
serta Molase dengan C/N Rasio Berbeda terhadap Profil Kualitas Air, Kelangsungan Hidup, dan Pertumbuhan Udang Vaname Litopenaeus vannamei. Dibimbing oleh WIDANARNI dan SUKENDA.
Salah satu permasalahan dalam budidaya udang adalah adanya penurunan kualitas air sebagai akibat akumulasi bahan organik. Akumulasi bahan organik ini dapat menyebabkan timbulnya akumulasi senyawa-senyawa, seperti nitrogen anorganik (amonia, nitrit, nitrat) serta H2S yang pada kisaran tertentu dapat bersifat toksik bagi udang. Permasalahan tersebut dapat diatasi dengan pengontrolan nitrogen anorganik melalui penambahan bahan berkarbon (molase). Penambahan molase dapat meningkatkan pertumbuhan bakteri, baik itu yang merugikan maupun yang menguntungkan. Oleh karena itu perlu dilakukan inokulasi bakteri menguntungkan ke dalam media budidaya untuk menjaga agar bakteri yang tumbuh dominan adalah bakteri yang menguntungkan tersebut. Inokulan bakteri yang dapat digunakan adalah bakteri nitrifikasi dan denitrifikasi. Bakteri nitrifikasi akan mereduksi amonia dan merubahnya menjadi nitrit dan nitrat yang tidak begitu toksik bagi udang. Sedangkan bakteri denitrifikasi dapat mengubah nitrat menjadi gas nitrogen (N2) yang dapat lepas ke udara. Diharapkan dengan penambahan molase serta bakteri nitrifikasi dan denitrifikasi mampu mengurangi amonia dari lingkungan budidaya. Penelitian ini bertujuan untuk mengetahui pengaruh pemberian bakteri nitrifikasi dan denitrifikasi serta molase pada C/N rasio 0, 10, 15, 20, dan 25 terhadap profil kualitas air, kelangsungan hidup, dan pertumbuhan udang vaname Litopenaeus vannamei.
Dalam penelitian ini terdapat 6 perlakuan, yaitu kontrol (tanpa penambahan bakteri dan molase), penambahan bakteri tanpa molase (C/N rasio 0), penambahan bakteri+molase C/N rasio 10, penambahan bakteri+molase C/N rasio 15, penambahan bakteri+molase C/N rasio 20, penambahan bakteri+molase C/N rasio 25. Pemberian pakan dilakukan 5 kali sehari, sedangkan jumlah molase yang ditambahkan didasarkan rumus Avnimelech (1999). Bakteri yang digunakan merupakan hasil isolasi dari tambak udang windu tradisional di Desa Belanakan, Kecamatan Ciasem, Kabupaten Subang, Jawa Barat (Pranoto, 2007). Analisa data dilakukan dengan menggunakan program Excel Ms. Office 2003 dan SPSS 11.0.
Penambahan bakteri nitrifikasi dan denitrifikasi serta molase mempengaruhi profil pH, dissolved oxygen (DO), amonia, nitrit dan nitrat pada media pemeliharaan. Namun demikian kualitas air pada semua perlakuan selama masa pemeliharaan masih berada dalam kisaran toleransi udang vaname. Persentase perubahan amonia yang paling tinggi dimiliki oleh perlakuan penambahan bakteri+molase C/N rasio 10, diikuti dengan perlakuan penambahan bakteri+molase C/N rasio 20 dan bakteri+molase C/N rasio 15 dengan nilai penurunan sebesar 28.5%, 13.9%dan 7.2%.
PENGARUH PEMBERIAN BAKTERI NITRIFIKASI DAN
DENITRIFIKASI SERTA MOLASE DENGAN C/N RASIO
BERBEDA TERHADAP PROFIL KUALITAS AIR,
KELANGSUNGAN HIDUP, DAN PERTUMBUHAN
UDANG VANAME
Litopenaeus vannamei
DEBY YUNIASARI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Departemen Budidaya Perairan
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : Pengaruh Pemberian Bakteri Nitrifikasi dan Denitrifikasi serta Molase dengan C/N Rasio Berbeda terhadap Profil Kualitas Air, Kelangsungan Hidup, dan Pertumbuhan Udang Vaname Litopenaeus vannamei
Nama Mahasiswa : Deby Yuniasari Nomor Pokok : C 14104015
Disetujui,
Pembimbing I Pembimbing II
Dr. Widanarni Dr. Sukenda NIP. 131 101 009 NIP. 132 045 962
Diketahui
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP. 131 578 799
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas rahmat dan hidayah-Nya sehingga skripsi ini dapat diselesaikan dengan baik. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar sarjana pada Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini penulis megucapkan terima kasih yang sebesar-besarnya kepada :
1. Ibu Dr. Widanarni selaku Pembimbing I Skripsi dan Dr. Sukenda selaku Pembimbing II Skripsi atas arahan, bimbingan, dan motivasi selama penelitian dan penyusunan skripsi
2. Bapak Dr. Tatag Budiardi selaku Pembimbing Akademik atas bimbingan, didikan dan bantuan yang telah diberikan selama proses penyelesaian studi 3. Bapak Prof. Dr. Enang Harris selaku dosen penguji atas masukannya yang
berharga
4. Ayahanda, ibunda dan kakanda atas semangat, doa, serta dukungannya
5. Bapak Ranta atas bimbingannya, bantuan serta “gosip-gosip” selama di Laboratotium Kesehatan Ikan
6. Bang Abe, Pak Wasjan, Mba Retno, Pak Aam, Kang Adna, dan Bang Hadi atas bantuannya selama penelitian
7. Rekan-rekan BDP 41: Tata, Uu, Fiska, Sarah, Icha, Agnis, Dewi, Ema, Mbayu, Sahel, Handy, Fheby, Agus, dll atas bantuan, motivasi dan persahabatan yang diberikan,
Bogor, Januari 2009
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 23 Juni 1986 dari pasangan Bapak Dasto dan Ibu Misni. Penulis merupakan anak kedua dari dua bersaudara.
Penulis memulai pendidikannya di Taman Kanak-Kanak Al-Muttaqien Jakarta, SD Pabuaran I Bogor, SLTP Angkasa Bogor, dan SMU Negeri 5 Bogor. Pada tahun 2004 penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor (USMI) dan masuk pada Program Studi Teknologi dan Manajemen Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis aktif menjadi Pengurus Himpunan Mahasiswa Akuakultur (2006/2007) dan Pengurus Badan Eksekutif Mahasiswa (2006/2007). Penulis juga pernah menjadi asisten pada mata kuliah Dasar-Dasar Akuakultur (2006/2007, 2007/2008, dan 2008/2009), Dasar-Dasar Mikrobiologi Akuatik (2007/2008), Manajemen Kesehatan ikan (2007/2008), Fisiologi dan Reproduksi Ikan (2008/2009). Untuk menambah pengetahuan dalam budidaya ikan, penulis mengikuti kegiatan magang ikan hias di Yohannes Fish Farm Ciseeng-Parung (2005), praktek lapang pembenihan dan pembesaran Udang Vaname Litopenaeus vannamei di PT. Centralpertiwi Bahari, Rembang dan PT. Surya Windu Kartika, Banyuwangi (2007). Selain itu penulis juga mengikuti kegiatan Kompetisi Pemikiran Kritis Mahasiswa (KPKM) tingkat nasional di Surabaya (2008), Pekan Mahasiswa Ilmiah Nasional (PIMNAS) di UNILA, Lampung pada tahun 2007 dan di UNISSULA, Semarang pada tahun 2008.
Untuk menyelesaikan studi penulis melakukan penelitian dengan judul
“Pengaruh Pemberian Bakteri Nitrifikasi dan Denitrifikasi serta Molase
dengan C/N Rasio Berbeda terhadap Profil Kualitas Air, Kelangsungan
DAFTAR ISI
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
I. PENDAHULUAN... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
II. TINJAUAN PUSTAKA ... 3
2.1 Udang Vaname Litopenaeus vannamei ... 3
2.2 Sistem Bakteri Heterotrof ... 4
2.2.1 Teknik Intensifikasi Mikrobial ... 7
2.2.2 Sumber Karbon (Molase) ... 8
2.3 Nitrogen ... 9
2.3.1 Amonia (NH3) ... 11
2.3.2 Nitrit (NO2-) ... 12
2.3.3 Nitrat (NO3-) ... 13
2.4 Bioremediasi ... 14
2.5 Proses Penyisihan Nitrogen Secara Biologis ... 15
2.5.1 Nitrifikasi ... 15
2.5.2 Denitrifikasi ... 18
2.6 Kualitas Air ... 19
2.6.1 pH... 19
2.6.2 Suhu ... 19
2.6.3 Oksigen Terlarut (Dissolved oxygen)... 20
III. BAHAN DAN METODE... 22
3.1 Waktu dan Tempat ... 22
3.2 Alat dan Bahan ... 22
3.2.1 Hewan Uji ... 22
3.2.2 Bakteri Nitrifikasi dan Denitrifikasi ... 22
3.2.3 Medium Bakteri ... 22
3.2.4 Sumber Karbon ... 23
3.2.5 Wadah dan Media Pemeliharaan... 23
3.2.5 Peralatan ... 23
3.3 Metode Penelitian ... 23
3.3.1 Persiapan Wadah... 23
3.3.2 Pemeliharaan Udang ... 23
3.3.4 Perlakuan... 25
3.4 Parameter Pengamatan ... 26
3.4.1 Tingkat Kelangsungan Hidup atau Survival Rate (SR)... 26
3.4.2 Pertumbuhan Spesifik atau Spesific Growth Rate (SGR) ... 27
3.4.3 Efisiensi pakan (EP) ... 27
3.4.4 Total Bakteri pada Media Pemeliharaan ... 27
3.4.5 Kualitas Air ... 28
3.4.5.1 Total Amonia Nitrogen (TAN) dan Amonia ... 28
3.4.5.2 pH dan Suhu ... 29
3.4.5.3 Nitrit (NO2-) ... 29
3.4.5.3 Nitrat (NO3-) ... 29
3.5 Prosedur Pengolahan Data ... 30
IV. HASIL DAN PEMBAHASAN ... 31
4.1 Dinamika Populasi Total Bakteri ... 31
4.2 Profil Kualitas Air ... 33
4.3 Pertumbuhan, Kelangsungan Hidup, dan Efisiensi Pakan ... 43
V. KESIMPULAN DAN SARAN ... 49
4.1 Kesimpulan ... 49
4.2 Saran ... 49
DAFTAR PUSTAKA ... 50
DAFTAR TABEL
Halaman
1. C/N rasio berbagai sistem akuatik ... 7
2. Komposisi kimia molase ... 9
3. Bentuk-bentuk nitrogen ... 14
4. Teknologi bioremediasi ... 15
5. Faktor-faktor yang mempengaruhi proses nitrifikasi... 16
6. Laju nitrifikasi beberapa bakteri nitrifikasi autotrof dan heterotrof... 18
7. Kualitas air untuk budidaya udang ... 21
DAFTAR GAMBAR
Halaman
1. Trofik level dalam kolam budidaya ... 5
2. Proses-proses mikrobial penting dalam kolam ... 6
3. Siklus nitrogen pada perairan ... 10
4. Proses mikrobial di tambak udang ... 12
5. Pengaruh pH terhadap organisme akuatik ... 19
6. Dinamika populasi total bakteri selama penelitian ... 31
7. Profil pH pada beberapa perlakuan selama penelitian ... 34
8. Profil DO pada beberapa perlakuan selama penelitian ... 36
9. Profil amonia pada beberapa perlakuan selama penelitian ... 38
10. Profil perubahan amonia pada beberapa perlakuan selama penelitian ... 38
11. Profil nitrit pada beberapa perlakuan selama penelitian ... 40
12. Profil nitrat pada beberapa perlakuan selama penelitian... 41
13. Laju pertumbuhan panjang udang vaname ... 43
14. Laju pertumbuhan bobot udang vaname ... 44
15. Tingkat kelangsungan hidup udang vaname ... 45
DAFTAR LAMPIRAN
Halaman 1. Bahan-bahan untuk pembuatan media nitrifikasi dan denitrifikasi... 55
2. Total bakteri selama pemeliharaan udang ... 56
3. Nilai pH selama masa pemeliharaan udang ... 57
4. Nilai DO selama masa pemeliharaan udang ... 57
5. Nilai amonia selama masa pemeliharaan udang ... 57
6. Persentase perubahan amonia selama masa pemeliharaan udang... 57
7. Nilai Nitrit selama masa pemeliharaan udang ... 58
8. Nilai Nitrat selama masa pemeliharaan udang... 58
9. Tabel anova serta uji BNJ dan BNT laju pertumbuhan bobot ... 58
10. Tabel anova serta uji BNJ dan BNT laju pertumbuhan panjang... 60
11. Tabel anova serta uji BNJ dan BNT kelangsungan hidup ... 62
12. Tabel anova serta uji BNJ dan BNT efisiensi pakan... 64
13. Peralatan yang digunakan dalam penelitian... 66
14. Molase yang digunakan dalam penelitian ... 66
I. PENDAHULUAN
1.1 Latar Belakang
Kontribusi krustasea pada akuakultur dunia mencapai 22.6% pada tahun
2004. Udang menyumbang sebesar 83% untuk jumlah dan 85% untuk nilai pada
produksi krustasea. Dari nilai tersebut udang vaname memberikan kontribusi
sebesar 47% produksi udang dan 43% nilai produksinya (FAO, 2006 dalam
Focken et al., 2006). Oleh karenanya produksi udang harus senantiasa ditingkatkan. Salah satu faktor yang menyebabkan terjadinya penurunan produksi
udang adalah adanya penurunan kualitas air sebagai akibat dari akumulasi bahan
organik baik yang berasal dari limbah metabolisme, sisa-sisa pakan, dan bahan
organik lainnya. Akumulasi bahan organik ini dapat berakibat pada timbulnya
akumulasi senyawa-senyawa, seperti amonia, nitrit, nitrat, dan H2S yang pada
kisaran tertentu dapat bersifat toksik bagi udang. Penurunan kualitas air juga dapat
menjadi stressor bagi munculnya berbagai jenis penyakit pada udang, yang pada
akhirnya dapat mengakibatkan kematian massal dan penurunan produksi udang.
Langkah-langkah yang dapat dilakukan untuk mengurangi dampak limbah
budidaya antara lain (McIntosh et al., 2001) : (1) mengurangi kandungan nutrien di limbah budidaya dengan memanipulasi pakan dan pemberian pakan; (2)
meningkatkan treatment air untuk mengurangi buangan air; (3) mengurangi
volume air yang digunakan untuk budidaya. Metode-metode tersebut dapat
digunakan untuk mengurangi limbah budidaya, tetapi tidak mampu untuk
menghilangkan semua limbah budidaya. Metode yang umum digunakan untuk
mengurangi limbah budidaya adalah zero water exchange yang dapat mengurangi pengeluaran air dan meningkatkan biosecurity. Tetapi penggunaan zero water exchange akan menyebabkan terjadinya hypereutrophic (tambak menjadi terlalu subur) yang dapat mempengaruhi kesehatan udang dan menyebabkan terjadinya
penurunan produksi udang (Erler et al., 2005).
Metode yang potensial untuk dikembangkan dalam rangka mengurangi
limbah budidaya adalah pengontrolan nitrogen anorganik melalui penambahan
bahan berkarbon. Penambahan bahan berkarbon akan meningkatkan C/N rasio
heterotrof yang pada akhirnya akan mengurangi nitrogen anorganik dan
meningkatkan protein mikrobial. Bahan berkarbon yang potensial untuk
digunakan adalah molase karena memiliki harga yang relatif murah serta
kandungan karbon yang cukup tinggi (Willet dan Morrison, 2006).
Penambahan molase dapat meningkatkan pertumbuhan bakteri, baik itu
yang menguntungkan maupun yang merugikan. Oleh karenanya perlu dilakukan
inokulasi bakteri menguntungkan ke dalam media budidaya untuk menjaga agar
bakteri yang tumbuh dominan adalah bakteri yang menguntungkan tersebut.
Bakteri yang dapat digunakan adalah bakteri nitrifikasi dan denitrifikasi. Bakteri
nitrifikasi akan mereduksi amonia dan merubahnya menjadi nitrit dan nitrat yang
tidak begitu toksik bagi udang. Sedangkan bakteri denitrifikasi dapat mengubah
nitrat menjadi gas nitrogen (N2) yang dapat lepas ke udara. Diharapkan dengan
penambahan molase serta bakteri nitrifikasi dan denitrifikasi mampu mengurangi
amonia dalam lingkungan budidaya.
1.2 Tujuan
Tujuan dari penelitian ini adalah untuk mengetahui pengaruh pemberian
bakteri nitrifikasi dan denitrifikasi serta molase dengan C/N rasio 0, 10, 15, 20,
dan 25 terhadap profil kualitas air, kelangsungan hidup, dan pertumbuhan udang
II. TINJAUAN PUSTAKA
2.1 Udang Vaname Litopenaeus vannamei
Penggolongan udang vaname menurut Tseng (1987) adalah sebagai
berikut :
Filum : Arthropoda
Kelas : Crustacea
Subkelas : Eumalacostraca
Ordo : Decapoda
Famili : Penaeidae
Genus : Litopenaeus
Spesies : Litopenaeus vannamei
Bagian tubuh udang vaname terdiri dari kepala (thorax) dan perut
(abdomen). Kepala udang vaname terdiri dari antenula, antena, mandibula, dan
sepasang maxillae. Kepala udang vaname juga dilengkapi dengan 5 pasang kaki
jalan (periopod), dimana kaki jalan ini terdiri dari 2 pasang maxillae dan 3 pasang
maxilliped. Perut udang vaname terdiri dari 6 ruas dan juga terdapat 5 pasang kaki
renang (pleopod) serta sepasang uropods yang membentuk kipas bersama-sama
telson. Sifat udang vaname aktif pada kondisi gelap (nokturnal), dapat hidup pada kisaran salinitas lebar (euryhaline), suka memangsa sesama jenis (kanibal), tipe pemakan lambat tapi terus-menerus (continuous feeder), serta mencari makan lewat organ sensor (chemoreceptor) (Haliman dan Adijaya, 2006).
Ada 3 tipe budidaya udang di Indonesia, yaitu tradisional (ekstensif), semi
intensif, dan intensif. Ketiga tipe budidaya tersebut dikategorikan berdasarkan
kepadatan, input sumber daya, dan sistem manajeman yang diterapkan. Budidaya
ekstensif dilakukan oleh petani tradisional yang menggunakan sistem polikultur
dalam pelaksanaannya. Budidaya semi intensif biasanya dilakukan oleh
perusahaan yang mampu melakukan 3 kali panen tiap tahunnya, serta memiliki
fasilitas hatceri dan cold storage. Sedangkan budidaya intensif dilakukan oleh perusahaan terintegrasi yang memiliki fasilitas-fasilitas pendukung, seperti
hatceri, perusahaan pakan, pengelolaan udang, serta fasilitas ekspor (Rangkuti,
Udang merupakan komoditas ekspor yang sangat penting. Terlihat dari
volume ekspor perikanan Indonesia tahun 2003 sebesar 32223 ton dengan nilai
mencapai US $ 96,627 juta. Dari nilai tersebut, volume ekpor udang hanya
mencapai 8027 ton tetapi nilai ekspornya paling tinggi sebesar US $ 68.3 juta
(Haliman dan Adijaya, 2006). Ekspor udang Indonesia ke Jepang dan USA pada
tahun 2007 menempati urutan ke-2 terbesar setelah Vietnam dan ke-3 terbesar
setelah Thailand dan Vietnam (FAO Globefish, 2008a,b).
Tetapi pada tahun 2007 terdapat kecenderungan penurunan ekspor udang
dunia, tidak terkecuali Indonesia. Dapat dilihat dari nilai ekspor udang Indonesia
ke Jepang pada tahun 2007 yang mengalami penurunan dibandingkan tahun 2006,
dari 43665 MT menjadi 37080 MT (FAO Globefish, 2008a). Beberapa faktor
yang mempengaruhi pasar udang dunia sepanjang tahun 2007 antara lain,
peningkatan harga bahan bakar minyak (BBM), penurunan pertumbuhan
ekonomi, penurunan kepercayaan konsumen, serta adanya isu kesehatan (FAO
Globefish, 2008b). Di Indonesia dapat dilihat pengaruhnya dari adanya pelarangan
ekspor udang Indonesia ke Jepang dan Uni Eropa akibat adanya residu antibiotik
(Rangkuti, 2007).
Akuakultur mendapat banyak tantangan mulai dari penurunan produksi,
serangan penyakit, biaya produksi yang semakin tinggi, serta adanya isu
kesehatan hingga isu lingkungan. Oleh karenanya dibutuhkan usaha yang lebih
untuk dapat meningkatkan efisiensi produksi serta mengurangi dampak limbah
budidaya terhadap lingkungan.
2.2 Sistem Bakteri Heterotrof
Peningkatan produksi budidaya berimplikasi pada peningkatan kepadatan
dan jumlah pakan yang digunakan. Hal ini akan menyebabkan terjadinya
akumulasi bahan organik pada lingkungan budidaya. Akumulasi bahan organik
berakibat pada penurunan kualitas air karena tingginya kandungan senyawa
nitrogen anorganik, baik yang berasal dari limbah metabolisme (ekskresi), sisa
setengah dari nitrogen yang masuk ke dalam kolam (yang berasal dari pakan)
akan dikonversi menjadi amonia (Willet dan Morrison, 2006).
Akumulasi amonia diatasi dan dikelola dengan memanipulasi alga. Tetapi
alga ini hanya bisa mereduksi amonia dalam jumlah sedikit sehingga akumulasi
amonia dalam kolam tetap tinggi. Amonia yang tinggi dapat mengakibatkan
tingginya kandungan nitrit perairan yang bersifat toksik. Nitrit tersebut merupakan
produk antara bakteri nitrifikasi yang memanfaatkan amonia dalam prosesnya.
Selain itu amonia yang tinggi juga dapat mengakibatkan blooming alga. Solusi
yang dapat dilakukan untuk mengatasi masalah tersebut adalah dengan melakukan
pergantian air secara rutin. Tetapi hal tersebut tidak dapat selalu dilakukan, terkait
dengan masalah lingkungan, kualitas air, limbah buangan budidaya, dan lain-lain.
Oleh karenanya pengembangan sistem heterotrof dapat menjadi salah satu solusi
yang dapat dilakukan untuk mengontrol nitrogen anorganik (Willet dan Morrison,
2006).
Sistem heterotrof ini berdasar pada bakteri. Bakteri memegang peranan
penting dalam dekomposisi nutrien organik di dalam kegiatan produksi akuakultur
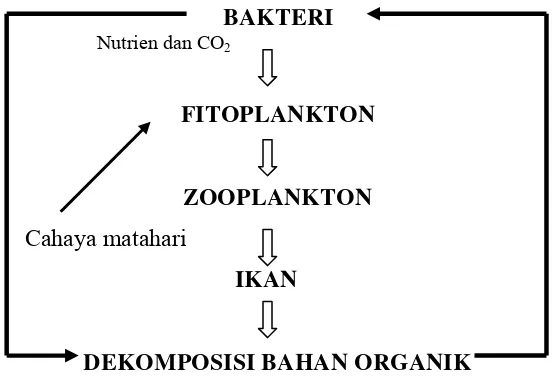
dan sedimen tambak (Hargreaves, 1998 dalam Hadi, 2006). Peranan bakteri dalam sistem akuakultur dapat dilihat pada trofik level berikut :
BAKTERI
Nutrien dan CO2
FITOPLANKTON
ZOOPLANKTON
Cahaya matahari
IKAN
DEKOMPOSISI BAHAN ORGANIK
Gambar 1. Trofik level dalam kolam budidaya
Menurut Woon (2007) pertumbuhan bakteri heterotrof mempengaruhi
menjadi sel; (2) diasimiliasi nitrogen melalui proses respirasi; dan (3) denitrifikasi
nitrat dan nitrit.
Beberapa proses mikrobial akan bereaksi untuk menghilangkan atau
menambah amonia pada kolam budidaya konvensional. Proses-proses mikrobial
tersebut, diantaranya nitrifikasi, denitrifikasi, fotosisntesis, dan heterotrof. Tiga
proses mikrobial yang mendominasi kualitas air pada kolam budidaya menurut
Brune et al., (2003), yaitu :
Biosintesis Alga (Photoautotrophic)
106 CO2 + 16 NH4+ + 52 H2O + PO-3
C106H152O53N16P + 106 O2 + 16 H+
C/N = 5.7/1 mg/mg VS = 50% Karbon 8.7% Nitrogen µ = 1 – 2/hari (24 – 48 hr generation time)
Biosintesis Bakteri (Heterotrophic)
BOD5 + NH4 C5H7NO2
C/N = 4.3/1 mg/mg VS = 53% Karbon 12.3% Nitrogen µ = 2.5/hari (10 hr generation time)
Nitrifikasi (Chemoautotrophic)
22 NH4+ + 37 O2 + 4 CO2 + HCO3
-C5H7NO2 + 21 NO2- + 2 H2O + 42 H+
µ = 1/hari (24 hr generation time)
Gambar 2. Proses-proses mikrobial penting dalam kolam
Beberapa faktor kunci pengembangan sistem heterotrof ini menurut
McIntosh (2000) yaitu : (1) kepadatan yang tinggi; (2) aerasi yang cukup bagi
pergerakan air untuk menjaga padatan tetap terlarut dan tingkat oksigen
mencukupi bagi kesehatan udang; (3) input bahan organik yang tinggi, sebagai
sumber makanan baik bagi udang maupun bakteri. Selain itu perlu diperhatikan
juga mengenai keseimbangan nutrien yang dibutuhkan oleh bakteri, seperti karbon
2.2.1 Teknik Intensifikasi Mikrobial
Beberapa cara yang dapat digunakan untuk proses intensifikasi bakteri
antara lain (Brune et al., 2003): (1) peningkatan aerasi untuk meningkatkan proses pencampuran sedimen yang bertujuan untuk meningkatkan proses nitrifikasi pada
kolom air; (2) penambahan bahan berkarbon untuk menstimulasi pertumbuhan
bakteri. Penambahan bahan berkarbon merupakan teknik yang potensial untuk
meningkatkan pertumbuhan bakteri dalam lingkungan budidaya. Bakteri
heterotrof akan menggunakan karbon organik sebagai sumber energi, berkorelasi
dengan nitrogen yang akan digunakan untuk sintesis protein demi menghasilkan
material sel baru (Willet dan Morrison, 2006). Dengan adanya penambahan bahan
berkarbon, bakteri akan menggunakan nitrogen yang terdapat dalam kolam
budidaya sehingga mampu mengurangi konsentrasi nitrogen anorganik (amonia)
yang bersifat toksik bagi organisme budidaya. Penambahan bahan berkarbon ini
terbukti mampu mengurangi nitrogen anorganik dan menggantikan protein pakan
(Avnimelech, 1999; Erler et al., 2005).
Berapa banyak karbon yang dibutuhkan oleh bakteri dapat diketahui
dengan berdasar pada nilai C/N rasio bakteri (Willet dan Morrison, 2006). Jika
C/N rasio bernilai tinggi seperti pada perairan alami, maka nitrogen akan semakin
cepat hilang (Berard et al., 1995 dalam Beristain et al., 2005a). Pada lingkungan budidaya pemberian pakan dengan kandungan protein tinggi akan menyebabkan
terjadinya penyuburan nitrogen. C/N rasio yang ditemukan pada kondisi tersebut
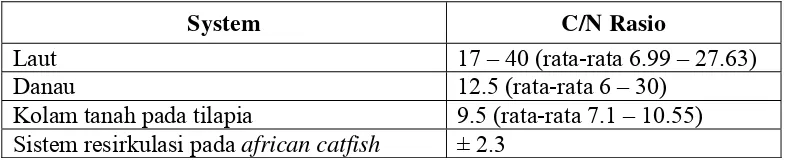
sangat rendah. Berikut merupakan nilai C/N rasio dari beberapa sistem menurut
Beristain et al., (2005a) :
Tabel 1. C/N rasio berbagai sistem akuatik
System C/N Rasio
Laut 17 – 40 (rata-rata 6.99 – 27.63)
Danau 12.5 (rata-rata 6 – 30)
Kolam tanah pada tilapia 9.5 (rata-rata 7.1 – 10.55) Sistem resirkulasi pada african catfish ± 2.3
Kemampuan bakteri untuk dapat mengurangi nitrogen anorganik dalam
[image:30.595.116.509.593.675.2]koefisien konversi mikroba, C/N rasio biomassa bakteri, serta kandungan karbon
dari bahan yang ditambahkan (Avnimelech, 1999).
2.2.2 Sumber Karbon (Molase)
Sumber karbon organik yang dapat digunakan meliputi alkohol, gula,
sagu, dan bahan berserat (fiber). Alkohol dan gula mudah untuk dicerna, dapat
menstimulus pertumbuhan bakteri lebih cepat, sehingga mampu untuk
berkompetisi dengan fitoplankton dalam mengabsorbsi nitrogen dan fosfor dalam
kolam budidaya. Karbohidrat kompleks seperti jagung, sagu dan tepung terigu
lebih lambat dimetabolisme (dicerna) dibandingkan alkohol dan gula, tetapi
keunggulan dari penggunaan karbohidrat kompleks adalah dapat menyediakan
partikel-partikel yang dapat dijadikan tempat menempel bakteri. Partikel tersebut
juga akan memudahkan proses pelepasan karbon organik. Karbohidrat kompleks
membutuhkan enzim bakteri yang cocok dalam proses dekomposisinya.
Enzim-enzim tersebut akan meningkatkan proses pencernaan spesies akuakultur. Bahan
fiber (berserat) sangat dihindari penggunaannya, karena bahan berserat relatif
tidak terdekomposisi dengan baik. Tetapi bahan berserat menyediakan partikel
yang tahan lama sebagai substrat bakteri (Chamberlain et al., 2001).
Molase (gula tetes) merupakan buangan akhir proses pengolahan gula
setelah mengalami kristalisasi berulang, berwarna coklat kehitaman dan berbentuk
cairan kental. Molase mengandung 48 – 56% gula dan sedikit bahan atau
unsur-unsur mikro (trace element) yang penting bagi kehidupan organisme, seperti cobalt, boron, iodium, tembaga, mangan, dan seng. Selain itu, molase juga
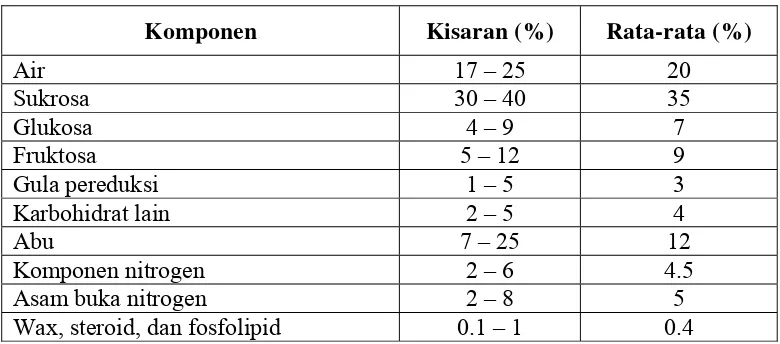
mengandung vitamin dan pigmen (Paturau, 1982 dalam Saputra, 2008). Komposisi kimia dari molase dapat dilihat pada Tabel 2.
Penggunaan molase sebagai sumber karbon didasarkan pada harga molase
yang relatif murah, memiliki kandungan karbon yang tinggi, serta
penggunaannnya yang cukup mudah (Willet dan Morrison, 2006). Penggunaan
molase mampu mengurangi nilai total amonia nitrogen (TAN) dari kolam
Tabel 2. Komposisi kimia molase
Komponen Kisaran (%) Rata-rata (%)
Air 17 – 25 20
Sukrosa 30 – 40 35
Glukosa 4 – 9 7
Fruktosa 5 – 12 9
Gula pereduksi 1 – 5 3
Karbohidrat lain 2 – 5 4
Abu 7 – 25 12
Komponen nitrogen 2 – 6 4.5
Asam buka nitrogen 2 – 8 5
Wax, steroid, dan fosfolipid 0.1 – 1 0.4
2.3 Nitrogen
Nitrogen merupakan elemen yang esensial bagi pertumbuhan
mikroorganisme, tumbuhan, dan hewan yang sering juga disebut sebagai
biostimulan. Senyawa kimia nitrogen sangat kompleks, karena nitrogen memiliki
beberapa tahapan oksidasi yang dapat merubah senyawa kimia nitrogen. Proses
oksidasi tersebut dipengaruhi oleh organisme hidup (Metcalf dan Eddy, 1991).
Nitrogen dalam perairan terdapat dalam bentuk gas nitrogen (N2), amonia terlarut
(NH3), ion amonium (NH4+), nitrit (NO2-), nitrat (NO3-), dan senyawa bentuk lain
yang berasal dari masuknya nutrien akibat aktivitas pertanian, buangan domestik,
limbah industri, limbah perikanan, peternakan, feses, serta urin dari ikan dan
hewan lainnya (Goldman dan Horne, 1983). Sedangkan Metcalf dan Eddy (1991)
menyebutkan nitrogen dalam perairan terdapat dalam bentuk gas nitrogen (N2),
amonia (NH3), amonium (NH4+), ion nitrit (NO2-), ion nitrat (NO3-), dan nitrogen
organik. Nitrogen organik merupakan campuran kompleks berbagai bahan seperti
asam amino, gula amino, dan protein (polimer). Nitrogen dalam bentuk ini siap
untuk diubah menjadi amonium oleh mikroorganisme yang berada di air atau
tanah.
Pemberian pakan buatan pada lingkungan budidaya akan meningkatkan
jumlah nitrogen yang masuk ke dalam perairan. Hal ini mengakibatkan kandungan
nutrien dalam perairan meningkat, termasuk amonia yang berbahaya bagi
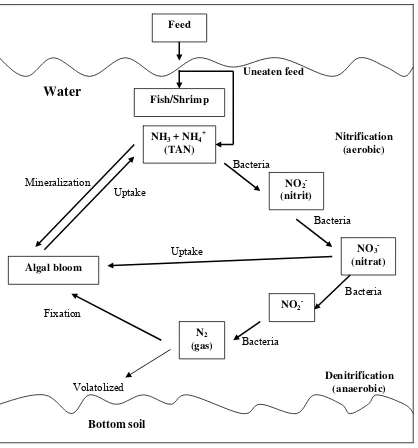
organisme akuatik. Amonia tersebut akan digunakan sebagai sumber nitrogen oleh
akan mendorong pertumbuhan alga yang pesat (blooming) yang pada akhirnya berakibat pada kematian massal alga. Proses dekomposisi alga mati, sisa pakan,
tanaman air dan organisme akuatik yang mati akan membebaskan amonia. Selain
alga, bakteri juga memanfaatkan amonia melalui proses nitrifikasi yang akan
mengubah amonia menjadi nitrit kemudian nitrat yang tidak berbahaya. Nitrat ini
akan digunakan kembali oleh alga dan tumbuhan air. Nitrat juga dapat diubah
menjadi gas N2 oleh mikroorganisme melalui proses denitrifikasi (Duborrow et
al., 1997). Semua proses tersebut membentuk sikus nitrogen seperti Gambar 3.
Water
Feed
Fish/Shrimp
NH3 + NH4 +
(TAN)
NO2
-(nitrit)
NO3
-(nitrat)
NO2
-N2
(gas) Algal bloom
Volatolized Fixation
Bacteria
Denitrification (anaerobic)
Bacteria Bacteria Bacteria
Nitrification (aerobic)
Mineralization
Uneaten feed
Uptake
Uptake
[image:33.595.105.523.263.711.2]Bottom soil
2.3.1 Amonia (NH3)
Amonia merupakan produk akhir utama penguraian protein pada ikan.
Ikan akan mencerna protein dalam pakan dan mengekskresikan amonia melalui
insang dan feses. Amonia pada lingkungan budidaya juga berasal dari proses
dekomposisi bahan organik seperti sisa pakan, alga mati dan tumbuhan akuatik
(Duborow et al., 1997). Terdapat 2 bentuk amonia di air, yaitu yang terionisasi (amonium, NH4+) dan yang tidak terionisasi (amonia, NH3). Amonia yang tidak
terionisasi berbahaya bagi organisme akuatik, karena bersifat toksik (Masser et al., 1999). Nilai NH3 tergantung pada nilai pH dan suhu perairan (Van Wyk dan
Scarpa, 1999; Masser et al., 1999; Boyd, 1982). Semakin tinggi suhu dan pH air, persentase NH3 semakin tinggi (Boyd, 1990). Perbandingan antara NH3 dan NH4+
dapat dilihat pada persamaan berikut :
NH3 + H2O ↔ NH4+ + OH-
Konsentrasi amonia yang tinggi di dalam air akan mempengaruhi
permeabilitas ikan oleh air dan mengurangi konsentrasi ion di dalam tubuh.
Amonia juga meningkatkan konsumsi oksigen di jaringan, merusak insang, dan
mengurangi kemampuan darah untuk mengangkut oksigen (Boyd, 1982).
Amonium digunakan sebagai sumber nitrogen oleh fitoplankton, alga,
tumbuhan air, dan golongan bakteri yang dikenal sebagai bakteri heterotrof.
Diduga bakteri menggunakan amonium dalam jumlah yang signifikan dalam
kolam budidaya. Beberapa studi mengindikasikan bakteri heterotrof menggunakan
hampir 50% total amonium dalam air. Bakteri heterotrof tidak hanya
menggunakan amonium sebagai sumber nitrogen, tetapi juga sisa pakan dan hasil
ekskresi organisme akuatik (Montoya dan Velasco, 2000). Peran bakteri dalam
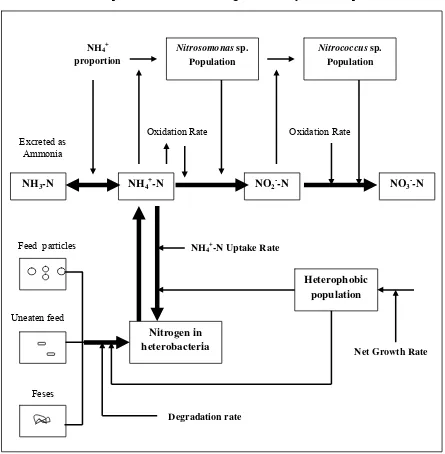
lingkungan tambak dapat dilihat pada Gambar 4.
Toksisitas amonia pada udang tergantung pada umur udang. Post larva dan
juvenil udang lebih rentan terhadap toksisitas amonia dibandingkan dengan udang
yang berukuran besar atau dewasa. Lethal concentration (LC50) dari NH3 adalah
0.2 mg/l untuk post larva dan 0.95 mg/l untuk udang yang berukuran 4.87 gram. Kesehatan dan pertumbuhan udang tidak terpengaruh pada konsentrasi amonia
konsentrasi sublethal akan berdampak buruk pada udang, laju pertumbuhan akan
turun dan konversi pakan (FCR) akan meningkat (Van Wyk dan Scarpa, 1999).
NH4+-N Uptake Rate
Oxidation Rate Oxidation Rate
Excreted as
NH4+ proportion
Nitrosomonas sp. Population
Nitrococcus sp. Population
[image:35.595.94.539.119.573.2]Ammonia
Gambar 4. Proses mikrobial di tambak udang
2.3.2 Nitrit (NO2-)
Nitrit merupakan bentuk nitrogen yang relatif tidak stabil dan mudah
teroksidasi, dan biasanya merupakan indikator tingkat polusi. Walaupun dalam
konsentrasi rendah, nitrit bersifat toksik bagi ikan dan organisme akuatik lainnya
(Metcalf dan Eddy, 1991). Nitrit merupakan produk awal dari proses nitrififikasi
dimana ion amonium dioksidasi oleh bakteri Nitrosomonas menjadi nitrit. Dalam
NH3-N NH4
+
-N NO2
--N NO3
--N
Feed particles
Uneaten feed
Feses
Heterophobic population
Nitrogen in
heterobacteria Net Growth Rate
lingkungan budidaya akan terjadi akumulasi nitrit apabila proses lanjutan dari
nitrifikasi yang akan mengubah nitrit menjadi nitrat tidak dapat berjalan (Van
Wyk dan Scarpa, 1999).
Pada ikan senyawa nitrit akan terikat pada darah yang akan membentuk
methaemoglobin (Hb + NO2- = Met-Hb). Met-Hb akan mengganggu proses
transportasi oksigen ke jaringan-jaringan ikan sehingga dapat menyebabkan ikan
mengalami hypoxsia. Met-Hb dalam darah menyebabkan darah berwarna coklat. Oleh karenanya keracunan nitrit disebut juga penyakit brown blood (Boyd, 1982; Van Wyk dan Scarpa, 1999; Masser et al., 1999). Pada udang mekanisme toksisitas nitrit tidak sepenuhnya dipahami, karena udang mempunyai pigmen
darah (hemocyanin) yang berbeda dibandingkan ikan. Walaupun demikian diduga mekanisme toksisitas nitrit pada udang tidak berbeda jauh, karena nitrit yang
tinggi menurunkan toleransi udang terhadap oksigen (Van Wyk dan Scarpa,
1999). Daya racun nitrit yang tinggi dipengaruhi oleh bentuk persenyawaan
nitritnya, yaitu bila terdapat dalam bentuk asam (HNO2) maka akan lebih toksik
daripada bentuk ion nitrit.
Toksisitas nitrit dapat dikurangi dan dihambat dengan adanya ion klorida
(Masser et al., 1999). Jika konsentrasi ion klorida dalam air besarnya 6 kali dari konsentrasi nitrit, maka nitrit tidak akan ditransportasikan ke dalam insang
sehingga toksisitas nitrit dapat dicegah. Oleh karena itu nitrit akan lebih toksik
pada salinitasnya rendah. Toksisitas nitrit dipengaruhi oleh spesies, ukuran, serta
salinitas. LC50 udang vaname lebih rendah dibandingkan udang windu (Van Wyk
dan Scarpa, 1999).
2.3.3 Nitrat (NO3-)
Nitrat merupakan produk akhir dari proses nitrifikasi, dimana dengan
bantuan bakteri Nitrobacter nitrit akan diubah menjadi nitrat yang relatif tidak toksik (Van Wyk dan Scarpa, 1999; Masser et al., 1999). Nitrat akan bersifat toksik pada konsentrasi di atas 300 ppm (Masser et al., 1999), tetapi pada udang konsentrasi nitrat lebih dari 200 ppm akan memperngaruhi pertumbuhan serta
daya tahan udang terhadap penyakit (Van Wyk dan Scarpa, 1999). Nitrat dalam
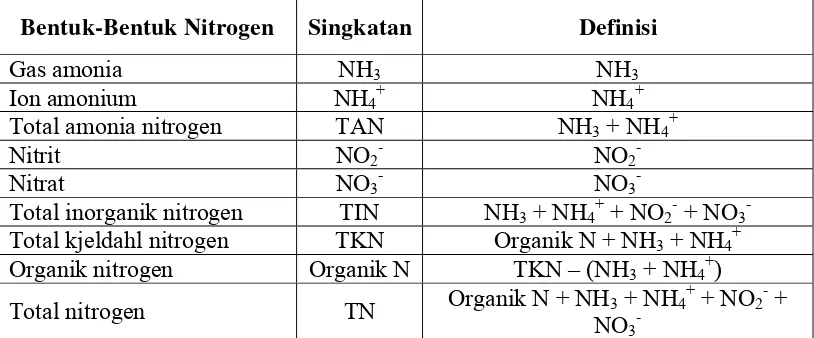
akan mengubah nitrat menjadi gas nitrogen. Gambaran bentuk-bentuk nitrogen
[image:37.595.109.516.154.323.2]menurut Metcalf dan Eddy, (1991) dapat dilihat pada Tabel 3 :
Tabel 3. Bentuk-bentuk nitrogen
Bentuk-Bentuk Nitrogen Singkatan Definisi
Gas amonia NH3 NH3
Ion amonium NH4+ NH4+
Total amonia nitrogen TAN NH3 + NH4+
Nitrit NO2- NO2
-Nitrat NO3- NO3
-Total inorganik nitrogen TIN NH3 + NH4+ + NO2- + NO3
-Total kjeldahl nitrogen TKN Organik N + NH3 + NH4+
Organik nitrogen Organik N TKN – (NH3 + NH4+)
Total nitrogen TN Organik N + NH3 + NH4
+
+ NO2- +
NO3
-2.4 Bioremediasi
Bioremediasi merupakan proses dimana bahan organik berbahaya
didegradasi secara biologis menjadi senyawa lain yang lebih sederhana.
Bioremediasi dapat dilakukan langsung pada lingkungan tercemar (in situ) atau dengan membuat lingkungan baru berupa bioreaktor yang dikondisikan (ex situ) dengan menggunakan inokulan yang dapat mendegradasi bahan pencemar
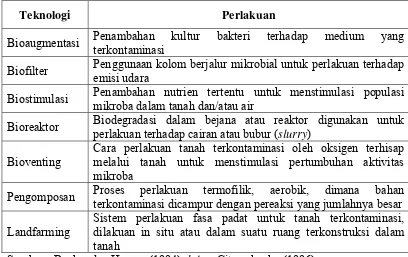
(Citroreksoko, 1996). Teknologi-teknologi yang diterapkan dalam proses
bioremediasi dapat dilihat pada Tabel 4.
Sumber utama polutan pada lingkungan budidaya berasal dari hasil
dekomposisi protein dari sisa pakan yang tidak terkonversi dan kotoran udang itu
sendiri. Hasil dari proses tersebut adalah amonia dan nitrit yang pada kisaran
tertentu bersifat toksik bagi organisme budidaya. Menurut Davis dan Cornwell
(1991) terdapat 3 alasan mengapa nitrogen berbahaya, yaitu : (1) dalam
konsentrasi yang tinggi NH3–N toksik bagi ikan; (2) NH3 dalam konsentrasi yang
rendah, dan NO3- dapat mendorong terjadinya blooming alga; (3) konversi NH4+
menjadi NO3- membutuhkan oksigen dalam jumlah besar.
Pendekatan bioremediasi yang potensial untuk diterapkan pada sistem
budidaya udang vaname adalah dengan berlandaskan pada aktivitas mikroba yang
bakteri serta nutrien yang akan menstimulus pertumbuhan bakteri. Kelompok
bakteri yang dapat mengurangi amoniak, nitrit, dan nitrat dari lingkungan
budidaya yaitu bakteri nitrifikasi dan denitrifikasi. Sedangkan nutrien yang dapat
[image:38.595.106.514.200.457.2]digunakan untuk menstimulus pertumbuhan bakteri adalah bahan berkarbon.
Tabel 4. Teknologi Bioremediasi
Teknologi Perlakuan
Bioaugmentasi Penambahan kultur bakteri terhadap medium yang terkontaminasi
Biofilter Penggunaan kolom berjalur mikrobial untuk perlakuan terhadap emisi udara
Biostimulasi Penambahan nutrien tertentu untuk menstimulasi populasi mikroba dalam tanah dan/atau air
Bioreaktor Biodegradasi dalam bejana atau reaktor digunakan untuk perlakuan terhadap cairan atau bubur (slurry)
Bioventing
Cara perlakuan tanah terkontaminasi oleh oksigen terhisap melalui tanah untuk menstimulasi pertumbuhan aktivitas mikroba
Pengomposan Proses perlakuan termofilik, aerobik, dimana bahan terkontaminasi dicampur dengan pereaksi yang jumlahnya besar
Landfarming
Sistem perlakuan fasa padat untuk tanah terkontaminasi, dilakuan in situ atau dalam suatu ruang terkonstruksi dalam tanah
Sumber : Bacher dan Herson (1994) dalam Citroreksoko (1996)
2.5 Proses Penyisihan Nitrogen Secara Biologis
Proses penyisihan nitrogen dapat dilakukan baik secara kimiawi maupun
biologis. Secara kimiawi dapat dilakukan dengan proses yang disebut ammonia stripping, yaitu dengan cara peningkatan pH atau penambahan kalsium karbonat. Penyisihan karbon secara kimiawi ini harus dibarengi dengan proses pergantian
air secara rutin. Sedangkan secara biologis, proses penyisihan nitrogen dilakuan
melalui proses nitrifikasi dan denitrifikasi (Davis dan Cornwell, 1991).
2.5.1 Nitrifikasi
Nitrifikasi merupakan proses mikrobial yang mereduksi komponen
nitrogen (amonia) menjadi nitrit dan nitrat (EPA, 2002). Nitrifikasi berlangsung
melalui 2 tahapan reaksi, dimana pada tahap pertama oksidasi amonium menjadi
pada tahap kedua oksidasi nitrit oleh mikroba pengoksidasi nitrit (Nitrobacter sp). Tahapan reaksi nitrifikasi menurut Spotte (1979) dalam Pranoto (2007) yaitu :
Nitrosomonas sp
NH4+ + 3/2 O2 NO2- + 2H+ + H2O
Enzim amonia monooksigenase ΔG = -66 Kkal mol N-1
tahap kedua :
Nitrobacter sp
NO2- + 1/2 O2 NO3
Enzim nitrit oksidase ΔG = -18 Kkal mol N-1
Proses kimiawi nitrifikasi berlangsung menurut reaksi sebagai berikut
(Van Wyk dan Scarpa, 1999) :
55NH4+ + 76O2 + 109HCO3- 54NO2- + 57H2O + 104H2CO3 + C5H7NO2
400NO2- + NH4+ + O2 + 4H2CO3 + HCO3- + 195O 400NO3= + 3H2O +
C5H7NO2
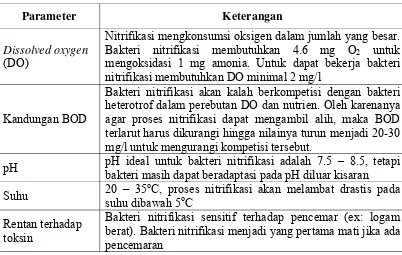
Menurut EPA (2002) pertumbuhan bakteri nitrifikasi dipengaruhi oleh
konsentrasi amonia, suhu, pH, cahaya, konsentrasi oksigen, dan komposisi
bakteri. Sedangkan faktor-faktor yang dapat mempengaruhi proses nitrifikasi
[image:39.595.110.512.487.742.2]menurut Ripple (2003) dapat dilihat pada Tabel 5.
Tabel 5. Faktor-faktor yang mempengaruhi proses nitrifikasi
Parameter Keterangan
Dissolved oxygen
(DO)
Nitrifikasi mengkonsumsi oksigen dalam jumlah yang besar. Bakteri nitrifikasi membutuhkan 4.6 mg O2 untuk
mengoksidasi 1 mg amonia. Untuk dapat bekerja bakteri nitrifikasi membutuhkan DO minimal 2 mg/l
Kandungan BOD
Bakteri nitrifikasi akan kalah berkompetisi dengan bakteri heterotrof dalam perebutan DO dan nutrien. Oleh karenanya agar proses nitrifikasi dapat mengambil alih, maka BOD terlarut harus dikurangi hingga nilainya turun menjadi 20-30 mg/l untuk mengurangi kompetisi tersebut.
pH pH ideal untuk bakteri nitrifikasi adalah 7.5 – 8.5, tetapi bakteri masih dapat beradaptasi pada pH diluar kisaran
Suhu 20 – 35
o
C, proses nitrifikasi akan melambat drastis pada suhu dibawah 5oC
Rentan terhadap toksin
Umum diketahui bahwa bakteri nitrifikasi merupakan
chemolithoautotrophic bacteria (ex: Nitrosomonas, Nitrobacter), yang mampu memenuhi kebutuhan karbonnya melalui fiksasi CO2 (siklus Calvin), serta sumber
energinya berasal dari proses oksidasi reduksi amonia menjadi nitrat. Namun
beberapa strain dari bakteri pengoksidasi nitrit (nitrit oxidizing bacteria) memiliki kemampuan untuk melakukan metabolisme heterotrof dengan menggunakan
substrat karbon sederhana (Ward, 2000).
Beberapa bakteri denitrifikasi, heterotrof, dan fungi memperlihatkan
kemampuan nitrifikasi heterotrof (Ward, 2000). Oleh karenanya Alexander (1999)
mendefinisikan proses nitrifikasi sebagai proses konversi nitrogen baik itu dalam
bentuk organik maupun anorganik, yang melibatkan proses oksidasi dan reduksi.
Nitrifikasi heterotrof memiliki reaksi oksidasi yang berbeda dengan bakteri
nitrifikasi autotrof, termasuk reaksi yang melepaskan nitrit dan nitrat yang berasal
dari dekomposisi nitrogen organik. Diduga bakteri nitrifikasi heterotrof memiliki
mekanisme enzim yang berbeda dengan bakteri nitrifikasi autotrof (Wehrfritz et al., 1993 dalam Ward, 2000). Selain itu nitrifikasi heterotrof juga memiliki mekanisme pembentukan energi yang berbeda dengan bakteri nitrifikasi autotrof
(Castignetti, 1990 dalam Ward, 2000).
Nitrifikasi heterotrof tidak memberikan kontribusi yang besar dalam
mengkonversi amonia menjadi nitrit dan nitrat (Atlas dan Bartha, 1981).
Walaupun bakteri nitrifikasi heterotrof tidak efisien dalam mengkonversi amonia,
namun jumlahnya yang banyak akan mempengaruhi laju sintesis nitrat
(Alexander, 1999). Perbandingan laju nitrifikasi oleh bakteri nitrifikasi autotrof
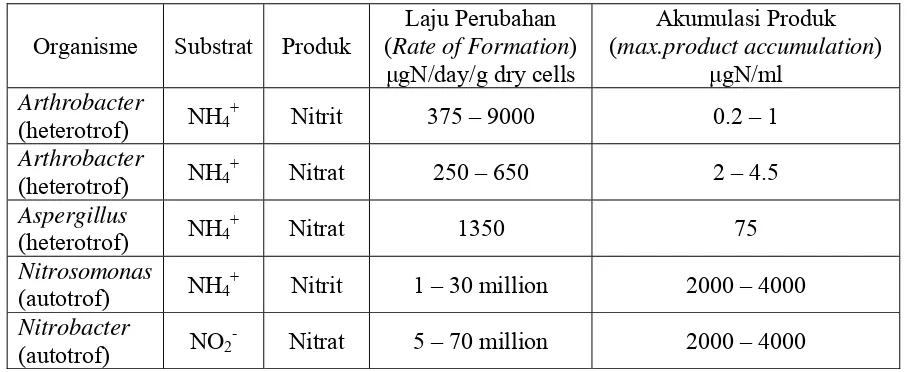
Tabel 6. Laju nitrifikasi beberapa bakteri nitrifikasi autotrof dan heterotrof
Organisme Substrat Produk
Laju Perubahan (Rate of Formation) μgN/day/g dry cells
Akumulasi Produk (max.product accumulation)
μgN/ml
Arthrobacter
(heterotrof) NH4
+
Nitrit 375 – 9000 0.2 – 1
Arthrobacter
(heterotrof) NH4
+
Nitrat 250 – 650 2 – 4.5
Aspergillus
(heterotrof) NH4
+
Nitrat 1350 75
Nitrosomonas
(autotrof) NH4
+
Nitrit 1 – 30 million 2000 – 4000
Nitrobacter
(autotrof) NO2
-Nitrat 5 – 70 million 2000 – 4000
Sumber : Focht dan Verstraete (1977) dalam (Atlas dan Bartha, 1981)
2.5.2 Denitrifikasi
Denitrifikasi merupakan proses dimana nitrat dan nitrit direduksi menjadi
gas N2, yang pada akhirnya dilepas dari kolom air. Denitrifikasi ini merupakan
proses penting untuk mengatur N (Keeney et al., 1971). Menurut Woon (2007) proses denitrifikasi berlangsung dalam beberapa tahap, yaitu :
Nitrat → Nitrit →Nitric oxide→Nitrous oxide→Dinitrogen gas
Salah satu produk gas pada proses denitrifikasi adalah gas N2O (nitrous
oksida). Gas tersebut berpengaruh negatif terhadap lingkungan, yaitu sebagai
salah satu penyebab terjadinya efek rumah kaca (pemanasan global). Secara
alamiah gas tersebut diemisikan dari ekosistem perairan sungai, estuarin, dan
daratan. Perairan sungai memberikan sumbangan sebesar 55%, estuarin 11%, dan
daratan sebesar 33%. Laju denitrifikasi akan meningkat dengan meningkatnya
kandungan nitrat pada sedimen (Widiyanto, 2005).
Salah satu faktor yang mempengaruhi proses denitrifikasi adalah
lingkungan. Lingkungan yang tepat bagi bakteri denitrifikasi adalah lingkungan
dengan kandungan oksigen yang rendah atau tidak ada oksigen. Proses
denitrifikasi optimum ketika DO nol. pH optimum bagi denitrifikasi adalah 6.5 -
2.6 Kualitas Air
2.6.1 pH
Konsentrasi ion hidrogen merupakan parameter kualitas air yang penting.
Konsentrasi ion hidrogen tersebut dinyatakan sebagai pH yang didefinisikan
sebagai logaritma negatif dari konsentrasi ion hidrogen (Metcalf dan Eddy, 1991;
Van Wyk dan Scarpa, 1999). pH rendah mengindikasikan konsentrasi ion
hidrogen yang tinggi, sedangkan pH tinggi mengindikasikan konsentrasi ion
hidrogen yang rendah. Nilai pH berkisar antara 0 – 14. Air disebut asam jika pH<
7, netral jika pH= 7, dan basa/alkali jika pH> 7 (Van Wyk dan Scarpa, 1999).
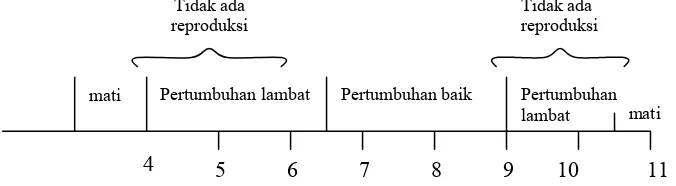
Pengaruh pH terhadap organisme akuatik menurut Swingle (1969) dalam Boyd (1982) dapat dilihat pada Gambar 5.
mati Pertumbuhan lambat Pertumbuhan baik Pertumbuhan
lambat mati
Tidak ada reproduksi
Tidak ada reproduksi
5 6 7 8 9 10 11
[image:42.595.130.468.328.421.2]4
Gambar 5. Pengaruh pH terhadap organisme akuatik
Udang mampu mentolerir pH pada kisaran 7 – 9. Air yang terlalu asam
(pH<6.5) dan air yang terlalu basa (pH>10) dapat merusak insang udang dan
mengganggu pertumbuhan. Walaupun udang dapat hidup pada kisaran pH 7 – 9,
tetapi pH sebaiknya dijaga pada kisaran 7.2 – 7.8. Hal ini berkaitan dengan
toksisitas amonia, dimana toksisitas amonia semakin meningkat seiring dengan
meningkatnya pH. Pada pH kurang dari 7.8 fraksi amonia dalam total amonia
nitrogen berkurang sekitar 5% dan pada pH lebih dari 9 sekitar 50% total amonia
nitrogen berada dalam bentuk amonia (Van Wyk dan Scarpa, 1999).
2.6.2 Suhu
Suhu suatu badan air dipengaruhi oleh musim, lintang (latitude), ketinggian dari permukaan air laut (altitude), waktu dalam satu hari, sirkulasi udara, penutupan awan, dan aliran serta kedalaman air. Proses suhu berpengaruh
ikan memiliki kisaran suhu optimum untuk pertumbuhan. Pada suhu yang
optimum ikan tumbuh lebih cepat, memiliki efisiensi pakan yag lebih baik, dan
relatif lebih tahan dari serangan penyakit (Masser et al., 1999).
Suhu akan mempengaruhi proses fisiologi dalam tubuh udang, dimana
setiap peningkatan suhu sebesar 10oC akan menyebabkan peningkatan reaksi
biokimia dalam tubuh sebesar 2 kali. Udang memiliki kisaran suhu yang sangat
luas dengan batas bawah sebesar 15oC dan batas atas sebesar 35oC atau sampai
40oC dalam rentang waktu yang singkat. Suhu optimum bagi udang berkisar 24 –
32oC. Bila udang hidup di bawah maupun di atas kisaran suhu optimumnya, maka
udang akan stres dan tidak tumbuh dengan baik (Van Wyk dan Scarpa, 1999).
2.6.3 Oksigen Terlarut (Dissolved oxygen)
Oksigen terlarut merupakan faktor yang menentukan dalam budidaya
perikanan intensif dan keberhasilan serta kegagalan pemeliharaan ikan sering
tergantung pada kemampuan untuk mengatasi masalah oksigen terlarut yang
rendah (Boyd, 1982). Kadar oksigen berkurang dengan semakin meningkatnya
suhu, ketinggian, dan berkurangnya tekanan atmosfir (Jeffries dan Mills, 1996).
Oksigen dibutuhkan oleh udang untuk respirasi serta proses-proses
fisiologi sel yang berperan dalam pembentukkan energi yang dibutuhkan dalam
proses metabolisme nutrien dalam pakan. Oksigen yang terbatas akan
menyebabkan kemampuan udang untuk memetabolis pakan menjadi terbatas,
penurunan laju pertumbuhan, serta penurunan kemampuan mengkonversi pakan.
Pertumbuhan dan nilai FCR yang baik diperoleh ketika konsentrasi oksigen
berada pada 80% saturasi. Konsentrasi oksigen sebesar 5 ppm tidak akan
mengakibatkan stres pada udang, tetapi pemaparan konsentrasi oksigen rendah (<
Tabel 7. Kualitas air untuk budidaya udang
Variabel Bentuk dalam Air Nilai Optimum
Oksigen Gas oksigen 5 – 15 ppm
pH H+ [-Log (H+)] pH 7 – 9
Salinitas - 5 – 35 ppt
Suhu - 26 – 29oC
Amonium (NH4+) 0.2 – 2 ppm
Amonia (NH3) < 0.1 ppm
Nitrit (NO2-) < 0.23 ppm
Nitrogen
III. BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilakukan mulai bulan Agustus sampai September 2008 di
Laboratorium Lapang Teaching Farm, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3.2 Alat dan Bahan
3.2.1 Hewan Uji
Hewan uji yang digunakan adalah benur udang vaname Litopenaeus vannamei berukuran PL 16 yang berasal dari PT. Tri Windu Manunggal, Anyer, Banten. Sebelum diberikan perlakuan benur diaklimatisasi terlebih dahulu selama
5 hari. Benur yang akan digunakan dalam penelitian dipilih yang berukuran
seragam melalui proses sortasi.
3.2.2 Bakteri Nitrifikasi dan Denitrifikasi
Bakteri yang digunakan merupakan bakteri nitrifikasi dan denitrifikasi
hasil isolasi dari tambak udang windu tradisional di Desa Belanakan, Kecamatan
Ciasem, Kabupaten Subang, Jawa Barat. Bakteri nitrifikasi yang digunakan
merupakan isolat S12 yang memiliki kemampuan mereduksi amonia sebesar
80.54%, serta menghasilkan nitrit dan nitrat sebesar 0.51% dan 20.59% pada
media cair nitrifikasi. Sedangkan bakteri denitrifikasi yang digunakan merupakan
isolat DS7 dengan kemampuan mereduksi nitrat sebesar 56.49%, serta
membentuk nitrit (29.1%), amonia (1.63 mg/l), serta gas N2 (70.36%) pada media
denitrifikasi cair (Pranoto, 2007).
3.2.3 Medium Bakteri
3.2.4 Sumber Karbon
Sumber karbon yang digunakan adalah molase dengan kandungan karbon
sebesar 61,45%.
3.2.5 Wadah dan Media Pemeliharaan
Wadah yang digunakan adalah akuarium berukuran 50 x 30 x 25 cm
sebanyak 18 buah sebagai wadah pemeliharaan udang. Pada masing-masing
akuarium diisi air laut sebanyak 24 liter dan benur udang sebanyak 24
ekor/akuarium lengkap dengan sistem aerasinya.
3.2.6 Peralatan
Alat-alat yang digunakan meliputi peralatan aerasi, serokan ikan,
penggaris, timbangan digital, tabung reaksi, cawan petri, pembakar bunsen, jarum
ose, inkubator goyang (shaker), penangas air, inkubator (suhu ruang), autoklaf, oven, penangas air, mikropipet, heater, termometer, pH meter, DO meter, pipet, bulp, gelas piala, erlanmeyer, spektrofotometer, erlenmeyer, lemari es, vortex,
alumunium foil, dan tissue.
3.3 Metode Penelitian
3.3.1 Persiapan Wadah
Sebelum digunakan akuarium dicuci dengan deterjen dan diisi air.
Selanjutnya wadah berisi air tersebut disterilisasi menggunakan kaporit dengan
dosis 100 ppm dan dibiarkan selama 2 hari, tanpa aerasi. Setelah itu air dibuang
dan wadah diisi air laut yang telah disaring sebanyak 24 liter dan diberi aerasi.
Peralatan aerasi sebelum digunakan direndam terlebih dahulu dengan kaporit 100
ppm.
3.3.2 Pemeliharaan Udang
Pemeliharaan udang dilakukan selama 25 hari pada akuarium dengan
volume 24 liter. Jumlah udang yang ditebar sebanyak 24 ekor/akuarium dengan
bobot rata-rata 0.015 gram dan panjang rata-rata 1.32 cm. Pemberian pakan
22.00. Jumlah pakan yang diberikan didasarkan pada sistem blind feeding
program pakan komersil Gold Coin. Kandungan protein pakan ditentukan berdasarkan hasil analisa kadar protein di Laboratorium Nutrisi Ikan, Departemen
Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian
Bogor. Pemberian molase dilakukan satu kali sehari pada pukul 22.30. Inokulasi
bakteri dilakukan setiap 5 hari sekali dengan konsentrasi masing-masing ~108
CFU/ml. Pemeliharaan udang ini menggunakan sistem zero water exchange
dengan tidak melakukan pergantian air selama 25 hari.
3.3.3 Prosedur Penambahan Karbon
Proses intensifikasi mikrobial dilakukan dengan penambahan molase pada
media budidaya dengan mengadaptasi perhitungan yang dilakukan oleh
Avnimelech (1999).
Kontrol akumulasi nitrogen anorganik di tambak dapat dilakukan dengan
berdasar pada metabolisme karbon dan immobilisasi nitrogen oleh bakteri. Bakteri
dan mikroorganisme yang lain menggunakan karbohidrat (gula, pati, dan selulosa)
sebagai makanan guna mendapatkan energi dan tumbuh melalui pembentukkan
sel-sel baru (Avnimelech, 1999). Proses tersebut dapat dilihat pada persamaan
berikut :
Corganik CO2 + Energi + Cterasimilasi dalam sel mikroba (1)
Penambahan karbohidrat potensial untuk mengurangi konsentrasi nitrogen
anorganik pada budidaya dengan sistem intensif. Berdasarkan persamaan (1) dan
definisi efisiensi konversi mikroba (persentase karbon yang terasimilasi
berdasarkan karbon pakan yang tercerna), maka jumlah potensial asimilasi karbon
mikroba adalah sebagai berikut :
(2)
E C CH
Cmik =Δ × ×
Δ %
Jumlah nitrogen yang dibutuhkan untuk memproduksi sel baru (∆N)
bergantung pada C/N rasio dari biomassa mikroba. Nilainya adalah sebagai
berikut :
[
C N]
mik Cmik Nmik / Δ = Δ (3)[
C N]
mikIkan atau udang di tambak hanya memanfaatkan 25% nitrogen dalam
pakan, sisanya diekskresikan sebagai NH4 atau sebagai N organik yang terdapat
dalam feses dan residu pakan. Jumlah nitrogen yang terdapat dalam pakan dapat
dihitung melalui persamaan berikut :
ΔN = pakan ×%Npakan ×%Nekskresi (4) Berdasarkan persamaan-persamaan di atas, maka jumlah karbon yang
harus ditambahkan untuk mendukung proses pertumbuhan bakteri, yaitu :
(
)
[
]
E C
mik N C Nekskresi Npakan
pakan CH
×
× ×
× =
Δ
%
/ %
%
Keterangan :
[C/N]mik : rasio [C/N] bakteri
∆CH : jumlah karbon yang harus ditambahkan
%C : kandungan karbon dari sumber karbon yang ditambahkan
E : efisiensi konversi mikroba
Pakan : jumlah pakan yang diberikan
%N pakan : kandungan N dalam pakan
%N ekskresi : kandungan N yang dikeluarkan oleh tubuh ikan
3.3.4 Perlakuan
Penelitian ini dilakukan dengan melakukan pemeliharaan udang pada
beberapa perlakuan, yaitu kontrol, penambahan bakteri tanpa molase, serta
penambahan bakteri dengan molase (C/N rasio 10, 15, 20, dan 25). Jumlah molase
yang ditambahkan didasarkan pada rumus Avnimelech (1999) dengan berdasar
pada nilai C/N rasio. Asumsi-asumsi yang digunakan dalam perhitungan antara
lain :
1. Kadar protein pakan 39.79%
2. Efisiensi konversi mikroba (E) 40%
3. Kadar karbon dalam molase (%C) 61.45%
4. Kadar nitrogen dalam pakan (%N pakan) 16%
5. Nitrogen yang diekskresikan (%N ekskresi) 33%
Perlakuan yang diberikan pada penelitian ini antara lain :
1. Kontrol, tanpa ada pemberian bakteri nitrifikasi, denitrifikasi dan molase
2. Penambahan bakteri nitrifikasi dan denitrifikasi, tanpa molase
3. Penambahan bakteri nitrifikasi, denitrifikasi serta molase dengan C/N rasio 10
Jumlah karbon yang ditambahkan adalah : ΔCH = pakan ×0.85
4. Penambahan bakteri nitrifikasi, denitrifikasi serta molase dengan C/N rasio 15
Jumlah karbon yang ditambahkan adalah : ΔCH = pakan ×1.275
5. Penambahan bakteri nitrifikasi, denitrifikasi serta molase dengan C/N rasio 20
Jumlah karbon yang ditambahkan adalah : ΔCH = pakan×1.7
6. Penambahan bakteri nitrifikasi, denitrifikasi serta molase dengan C/N rasio 25
Jumlah karbon yang ditambahkan adalah : ΔCH = pakan ×2.125
3.4 Parameter Pengamatan
Selama masa pemeliharaan dilakukan sampling kualitas air tiap 5 hari
sekali, yang meliputi pH, suhu, dissolved oxygen (DO), nitrit, nitrat, total amoniak nitrogen (TAN), serta total bakteri. Pengujian kualitas air dilakukan di
Laboratorium Lingkungan, sedangkan penghitungan total bakteri dilakukan di
Laboratorium Kesehatan ikan, Departemen Budidaya Perairan, Fakultas Perikanan
dan Ilmu Kelautan, Institut Pertanian Bogor. Untuk parameter tingkat
kelangsungan hidup (SR), pertumbuhan, dan efisiensi pakan hanya dilakukan pada
akhir pengamatan.
3.4.1 Tingkat Kelangsungan Hidup atau Survival Rate (SR)
Tingkat kelangsungan hidup (SR) udang dapat dihitung dengan
menggunakan rumus :
% 100
x No Nt SR =
Keterangan :
SR = tingkat kelangsungan hidup (%)
Nt = jumlah udang pada waktu t
3.4.2 Pertumbuhan Spesifik atau Spesific Growth Rate (SGR)
Untuk mengetahui laju pertumbuhan harian (SGR), persentase
pertambahan bobot dan panjang tiap hari dilakukan dengan perhitungan rumus :
⎪⎭ ⎪ ⎬ ⎫ ⎪⎩ ⎪ ⎨ ⎧ ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ −
= 1 x100%
Wo Wt t α dan ⎪⎭ ⎪ ⎬ ⎫ ⎪⎩ ⎪ ⎨ ⎧ ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ −
= 1 x100%
Lo Lt
t α
Keterangan :
α = laju pertumbuhan harian udang (%) t = lama waktu pemeliha