PRODUKSI PRODIGIOSIN TERHADAP PENAMBAHAN
Ca
2+DAN Fe
2+PADA MEDIA TUMBUH BAKTERI
Serratia
marcescens
DAN UJI RESISTENSI KLORAMFENIKOL
RAHMINOVITA HERLIS
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
RAHMINOVITA HERLIS. Produksi Prodigiosin terhadap Penambahan Ca2+ dan Fe2+ pada Media Tumbuh Bakteri Serratia marcescens dan Uji Resistensi Kloramfenikol. Dibimbing oleh IMAN RUSMANA dan TRI PUJI PRIYATNO.
Pigmen merah prodigiosin yang dihasilkan oleh bakteri S. marcescens adalah metabolit sekunder dari famili tripyrrole yang sudah digunakan secara meluas dalam pengobatan sebagai antibiotik multi fungsi. Produksi prodigiosin telah dicoba pada media cair Lurial Bertani (LB) dan
Nutrient Broth (NB) yang mengandung CaCO3 dan FeSO4 dengan konsentrasi yang berbeda. Hasil
penelitian menunjukkan bahwa ada interaksi yang nyata antara jenis media dengan konsentrasi CaCO3 dan FeSO4 terhadap produksi prodigiosin. Produksi prodigiosin yang tinggi terjadi pada
media NB jika ditambah dengan FeSO4. Pengaruh penambahan CaCO3 tidak sebesar hasil yang
diperoleh dengan penambahan FeSO4. Dalam 250 ml media LB dan NB yang mengandung FeSO4
1 mM diperoleh prodigiosin masing-masing sebanyak 486.0 dan 489.0 mg. Tetapi berdasarkan pemurnian menggunakan kromatografi kolom dengan silika gel, tingkat kemurnian prodigiosin dari media LB hanya 77.8% sedangkan dari media NB mencapai 92%. Hasil deteksi prodigiosin dengan kromatografi lapis tipis silika gel menunjukkan pigmen merah prodigiosin mempunyai nilai Rf 0.83. Spot merah pada nilai Rf tersebut bersifat antibakteri berdasarkan uji bioautografi. Menariknya, meski S. marcescens tahan terhadap antibiotik kloramfenikol tetapi biosintesis prodigiosin terhambat. Bagaimana mekanisme kloramfenikol menghambat biosintesis prodigiosin masih belum diketahui.
Kata kunci: Prodigiosin, Serratia marcescens, Lurial Bertani Broth, Nutrient Broth, CaCO3 and
FeSO4.
ABSTRACT
RAHMINOVITA HERLIS. Prodigiosin Production on Bacterial Growth Media of Serratia marcescens Enrich by Ca2+ and Fe2+ and Chloramphenicol Resistance Test.Under supervision of IMAN RUSMANA and TRI PUJI PRIYATNO.
Red pigment prodigiosin produced by S. marcescens is a secondary metabolite family of
tripyrrole. It has been widely used in pharmacology as multifunctional antibiotics. Prodigiosin was produced in Lurial Bertani (LB) and Nutrient Broth (NB) media containing different concentrations of CaCO3 dan FeSO4. The results showed that there was a significant interaction
between media and concentrations of CaCO3 and FeSO4 on prodigiosin production. High
production of prodigiosin in NB media with FeSO4. Effect of CaCO3 addition on prodigiosin
production was lower than that of FeSO4 addition. Production of prodigiosin in 250 ml LB and NB
with 1 mM addition of FeSO4 1mM was 486.0 and 489.0 mg respectively. However, based on
column chromatography purification using silica gel, the purity of prodigiosin produced in LB and NB was 77.8% and 92% respectively. Thin layer silica gel chromatography showed that the red pigment prodigiosin had Rf value of 0.83. The red spot had antibacterial activity based on bioautography analysis. Interestingly, although S. marcescens resistant to cloramphenicol, the antibiotic inhibited biosynthesis of prodigiosin. However, the mechanism of cloramphenicol inhibition to the biosynthesis of prodigiosin is still unclear.
Keyword: Prodigiosin, Serratia marcescens, Lurial Bertani Broth, Nutrient Broth, CaCO3 and
FeSO4.
PRODUKSI PRODIGIOSIN TERHADAP PENAMBAHAN
Ca
2+DAN Fe
2+PADA MEDIA TUMBUH BAKTERI
Serratia
marcescens
DAN UJI RESISTENSI KLORAMFENIKOL
RAHMINOVITA HERLIS
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Produksi Prodigiosin terhadap Penambahan Ca2+ dan Fe2+ pada Media Tumbuh Bakteri Serratia marcescens dan Uji Resistensi Kloramfenikol.
Nama : Rahminovita Herlis
NIM : G34070009
Menyetujui:
Mengetahui:
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
(Dr. Ir. Ence Darmo Jaya Supena, M.S) NIP 196410021989031002
Tanggal Lulus:
Pembimbing I,
(Dr. Ir. Iman Rusmana, M.Si.) NIP 1965072019911031002
Pembimbing II,
PRAKATA
Puji syukur penulis ucapkan kehadirat Allah SWT yang telah memberikan rahmat dan karuniaNya sehingga penulis dapat menyelesaikan karya ilmiah ini. Tema yang dipilih dalam penelitian ini adalah Produksi Prodigiosin terhadap Penambahan Ca2+ dan Fe2+ pada Media Tumbuh Bakteri Serratia marcescens dan Uji Resistensi Kloramfenikol. Penelitian ini dilaksanakan mulai bulan Desember 2010 hingga April 2011 di Laboratorium Biokimia, Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor.
Penulis mengucapkan terima kasih kepada Bapak Dr. Ir. Iman Rusmana, M.Si. dan Bapak Dr. Tri Puji Priyatno selaku pembimbing dan Bapak Dr. Ir. Muhadiono M.Sc. selaku dosen penguji wakil Komisi Departemen Biologi atas arahan dan bimbingan yang diberikan dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini. Terima kasih yang sebesar-besarnya kepada Keluarga tercinta Papa, Mama, Uda, Uni, Adik-adik dan Keluarga Besar atas do’a, dukungan, dan kasih sayang yang diberikan. Terima kasih juga kepada Pak made, Pak Yadi, Bu Alina, Bu Ntin, Bu Uum, Pak Wawan, Ka Pipit, Ka Delly, Novia, Resti, Keluarga Besar Laboratorium Biokimia, Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, Keluarga Besar Primasista serta sahabat-sahabat seperjuangan di Biologi 44 atas semua kebersamaan dan motivasi yang telah diberikan.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor,
Rahminovita Herlis
RIWAYAT HIDUP
Penulis dilahirkan di Kamang pada tanggal 1 November 1988 dari ayahanda Herman dan ibunda Darnelis. Penulis merupakan anak kedua dari empat bersaudara. Tahun 2007 penulis lulus dari SMA N 1 Kamang Magek dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih mayor di Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam dengan Suporting Course dari Departemen Manajemen Fungsional dan Konservasi Sumberdaya Hutan.
Selama mengikuti perkuliahan, penulis aktif sebagai bendahara dari divisi Biosains Himabio pada tahun 2009/2010 dan berbagai kegiatan kepanitiaan lainnya. Penulis juga aktif sebagai asisten praktikum Ekologi Dasar pada tahun ajaran 2010/2011. Pada tahun 2009, penulis melakukan Studi Lapang di Wana Wisata Cangkuang, Sukabumi, Jawa Barat dengan judul laporan
“Ragam Cendawan Entomopatogen di Wana Wisata Cangkuang”. Pada tahun 2010, penulis
melakukan Praktik Kerja Lapang di Laboratorium Kultur Jaringan Tanaman dan Koleksi Anggrek Kebun Raya Bogor dari bulan Juni sampai bulan Juli 2010 dengan judul laporan “Aklimatisasi Anggrek Kantung (Paphiopedilum glaucophyllum)”. Pada tahun 2010/2011, penulis
berkesempatan melakukan penelitian di Laboratorium Biokimia, Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor.
DAFTAR ISI
Halaman
DAFTAR TABEL ...viii
DAFTAR GAMBAR ...viii
DAFTAR LAMPIRAN ...viii
PENDAHULUAN... 1
Latar Belakang ... 1
Tujuan ... 1
Waktu dan Tempat ... 1
METODE ... 1
Pemeliharaan isolat ... 1
Uji Media Produksi Prodigiosin ... 1
Pemurnian prodigiosin... 2
Respon S. marcescens terhadap antibiotik. ... 2
Pengaruh antibiotik kloramfenikol terhadap produksi prodigiosin ... 2
Pembuatan kurva standar prodigiosin ... 2
HASIL ... 2
Produksi prodigiosin pada media LB dan NB ... 2
Pemurnian prodigiosin ... 4
Respon S. marcescens terhadap antibiotik ... 5
PEMBAHASAN ... 6
SIMPULAN ... 7
SARAN ... 7
DAFTAR PUSTAKA ... 7
DAFTAR TABEL
Halaman 1 Data hasil analisis statistik produksi prodigiosin S. marcescens dengan kandungan Fe2+ dan
Ca2+ pada media LB dan NB ... 3
2 Persentase kemurnian prodigiosin ... 4
3 Hasil pengujian beberapa antibiotik terhadap S. marcescens ... 5
DAFTAR GAMBAR
Halaman 1 Biakan Serratia marcescens pada media LB ... 22 Perbedaan kepekatan warna merah pada media LB ... 3
3 Perbedaan kepekatan warna merah pada media NB ... 3
4 Grafik perbandingan konsentrasi prodigiosin pada media LB yang dikombinasikan dengan FeSO4 dan CaCO3 pada konsentrasi berbeda ... 3
5 Grafik perbandingan konsentrasi prodigiosin pada media NB yang dikombinasikan dengan FeSO4 dan CaCO3 pada konsentrasi berbeda ... 4
6 Grafik deteksi prodigiosin pada media NB dengan spektrofotometer ... 4
7 Grafik deteksi prodigiosin pada media LB dengan spektrofotometer ... 4
8 Visualisasi ekstrak prodigiosin dengan kromatografi lapis tipis ... 5
9 Hasil uji bioautografi dengan bakteri Xanthomonas oryzae pv. Oryzae ... 5
10 Hasil uji pengaruh antibiotik kloramfenikol terhadap produksi prodigiosin ... 5
11 Hasil uji pengaruh kloramfenikol terhadap produksi prodigiosin ... 5
DAFTAR LAMPIRAN
Halaman 1 Kombinasi konsentrasi CaCO3 dan FeSO4 pada media LB dan NB ... ... .102 Kurva standar prodigiosin ... ....10
3 Hasil analisis statistik yang menunjukkan interaksi nyata antara jenis media dengan variasi konsentrasi Fe2+ dan Ca2+ terhadap produksi prodigiosin ... ...11
PENDAHULUAN
Latar Belakang
Bakteri entomopatogen Serratia marcescens dari famili Enterobacteriaceae telah berhasil diisolasi dari wereng batang coklat (wbc) yang mati dengan gejala warna merah pada tubuhnya. Hasil uji pastulat Koch
membuktikan bahwa bakteri tersebut bersifat patogenik. Menurut (Wang et al. 2009),
Serratia sp. adalah bakteri endosimbion wbc yang dapat bersifat sebagai patogen lemah, tetapi mekanisme patogenisitasnya masih belum diketahui secara pasti. Kemampuan S. marcescens menginfeksi wbc mempunyai arti penting dan perspektif baru untuk mengendalikan serangga hama dengan tipe mulut pencucuk pengisap menggunakan bakteri patogen. Oleh karena itu, untuk mempelajari mekanisme patogenisitas S. marcescens terhadap wbc perlu diidentifikasi faktor-faktor virulensinya.
Ciri khas S. marcescens yang diisolasi dari wbc adalah koloninya berbentuk cembung dan menghasilkan pigmen merah. Bakteri ini bersifat fakultatif dan mampu tumbuh baik pada kondisi aerob dan anaerob di dalam media buatan. Pertumbuhan optimumnya terjadi pada pH media 9 dan suhu lingkungan 20-37 0C (Giri et al. 2004). Pigmen merah yang dihasilkan oleh S. marcescens
merupakan metabolit sekunder yang dikenal sebagai prodigiosin dari famili tripyrrole yang umumnya mengandung 4-methoxy, ring 2-2
bipyrolle (Giri et al. 2004). Prodigiosin dapat bersifat multi fungsi, yaitu sebagai antibakteri, antifungi, antiprotozoal (Croft et al. 2002), bersifat cytotoxic (Nakashima et al. 2005), antitumor (Castro 1967; Perez-Tomás et al. 2003), antimalaria, antidiabetes, antioksidan, obat-obatan, anti-inflammatory nonsteroidal, serta menjadi pewarna untuk sutera dan wool (Khanafari et al. 2006). Oleh karena itu, prodigiosin merupakan salah satu produk metabolit sekunder dari bakteri gram negatif yang telah digunakan secara luas dalam pengobatan.
Produksi prodigiosin sangat bervariasi antara spesies dan strain Serratia serta dipengaruhi oleh komposisi media dan waktu inkubasi. Media cair yang sudah banyak digunakan untuk produksi prodigiosin adalah
Nutrient Broth, Peptone Gliserol Broth, dan
Lurial Bertani Broth. Penambahan 2% sodium oleat, asam oleat, dan triolein ke dalam media dapat menghasilkan prodigiosin 0.69 mg/ml (Nakamura & Kitamura 1981). Media yang mengandung etanol sebagai sumber karbon
juga sangat baik untuk produksi prodigiosin (Chang et al. 2000). Sedangkan maltosa dan glukosa merupakan represor biosintesis prodigiosin (Khanafari et al. 2006). Menurut Witney et al. (1977), biosintesis prodigiosin dipengaruhi oleh konsentrasi fosfat anorganik di dalam media. Produksi prodigiosin yang tinggi terjadi pada konsentrasi fosfat kurang dari 0.3 mM sedangkan pada konsentrasi antara 10 dan 250 mM pigmentasi Serratia
terhambat.
Fe2+ dan Ca2+ juga merupakan mineral anorganik yang sangat penting dalam produksi prodigiosin (Venil et al. 2009; Casullo de Araújo et al. 2010). Penambahan Fe2+ dalam media biakan S. marcescens dapat menghasilkan pigmen merah yang larut air dan berdifusi ke dalam agar di sekitar koloni (Khanafari et al. 2006). Begitu pula dengan Ca2+ yang juga dapat meningkatkan produksi prodigiosin (Casullo de Araújo et al. 2010)
.
Tujuan
Penelitian ini bertujuan mengetahui komposisi media dengan kandungan Fe2+ dan Ca2+ yang sesuai untuk produksi prodigiosin dan cara pemurniannya.
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Desember 2010 sampai April 2011 di Laboratorium Biokimia, Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor.
METODE
Pemeliharaan isolat. Isolat S. marcescens
dipelihara pada media Lurial Bertani Broth
(LB) agar. Biakan diinkubasikan dalam suhu ruangan dan diremajakan setiap 2 minggu sekali.
Uji Media Produksi Prodigiosin.
Sebanyak 4 ml media LB dan Nutrient Broth
(NB) yang mengandung kombinasi konsentrasi CaCO3 dan FeSO4 dimasukkan ke
2
mengandung 4% HCl 1M dan divorteks selama 1 menit. Prodigiosin yang terlarut dalam etanol dipisahkan dari sel bakteri dengan sentrifugasi 10.000 rpm selama 5 menit. Kandungan prodigiosin dalam etanol diukur dengan spektrofotometer pada panjang gelombang 450 nm. Nilai absorbansi yang diperoleh, dikonversi dengan kurva standar untuk menentukan kandungan prodigiosin yang sebenarnya. Selanjutnya data dianalisis secara statistik untuk mengetahui komposisi media yang terbaik. Percobaan ini dilakukan sebanyak empat kali ulangan.
Pemurnian prodigiosin. Bakteri S. marcescens dibiakkan dalam 250 ml media LB dan NB yang masing-masing mengandung FeSO4 1 mM. Media diautoklaf dan
diinokulasi dengan 1 ml biakan bakteri yang berumur 16 jam (OD600: 0.5). Kemudian biakan diinkubasikan dalam mesin bergoyang (75 rpm) selama 7 hari. Prodigiosin diekstraksi dari supernatan biakan bakteri dengan menggunakan etil asetat. Biakan disentrifugasi pada 5000 rpm selama 20 menit untuk memisahkan sel dari supernatan. Supernatan ditambahkan 200 ml etil asetat di dalam erlenmeyer dan diaduk dengan
magnetik stirrer selama 1 jam pada suhu ruangan. Prodigiosin yang terlarut dalam etil asetat dipisahkan dari fraksi air dengan menggunakan tabung fraksinator. Kemudian etil asetat diuapkan dengan evaporator pada suhu 50oC dan prodigiosin yang diperoleh dilarutkan dengan 1.5 ml DMSO.
Pemurnian prodigiosin dilakukan dengan kromatografi kolom menggunakan silika gel yang dibuat dengan pelarut metanol. Kemudian sampel prodigiosin dalam pelarut metanol dialirkan melalui kolom tersebut. Prodigiosin yang terperangkap dalam kolom silika gel dilepaskan dan dilarutkan dengan kloroform. Setelah kloroform diuapkan di dalam ruang asam, prodigiosin dilarutkan dengan 0.5 ml DMSO. Konsentrasi prodigiosin diukur dengan spektrofotometer dan profilnya dideteksi menggunakan kromatografi lapis tipis dengan silika gel dan amil asetat sebagai pelarut. Setelah didiamkan lebih kurang selama 2 jam akan terbentuk spot berwarna pink (merah muda). Spot ini merupakan visualisasi dari prodigiosin murni yang dikoleksi dan dilarutkan dalam DMSO. Spot ini juga diukur Rf-nya. Rf dapat dihitung dengan cara:
Rf =
Respon S. marcescens terhadap antibiotik. Antibiotik kloramfenikol, kasuga-misin, rimfamisin, streptomisin, dan ampisilin masing-masing ditambahkan ke dalam media LB sebanyak 50 g/ml. Kemudian bakteri Serratia marcescens ditumbuhkan dengan metode gores pada media tersebut dan diinkubasi pada suhu ruang selama 3 hari.
Pengaruh antibiotik kloramfenikol terhadap produksi prodigiosin. Pengaruh kloramfenikol terhadap produksi prodigiosin diuji dalam tabung reaksi yang mengandung 3 ml media LB dengan konsentrasi 0, 2.5, 5, dan 10 g/ml. Media diinokulasi dengan 10 µL biakan bakteri Serratia marcescens dan diinkubasi pada suhu ruang dalam mesin bergoyang. Produksi prodigiosin diamati 2 hari setelah inkubasi.
Pembuatan kurva standar prodigiosin.
Kurva standar dibuat dari prodigiosin murni dengan Sigma. Larutan prodigiosin dengan konsentrasi 0–100 g/ml dibuat dalam pelarut metanol (Lampiran 2).
HASIL
Produksi prodigiosin pada media LB dan NB
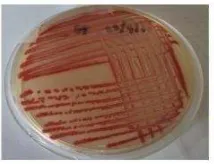
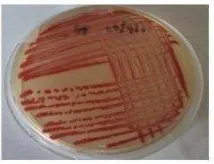
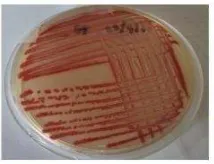
Bakteri patogen wbc yang diidentifikasi sebagai S. marcescens menunjukkan pertumbuhan koloni berwarna merah pada media LB agar setelah diinkubasi selama 3 hari pada suhu ruang (Gambar 1). Pigmen merah juga dihasilkan oleh S. marcescens
ketika dibiakan dalam media LB dan NB cair, tetapi pigmentasi merah terlihat cukup bervariasi bila ada penambahan Fe2+ dan Ca2+ dengan konsentrasi yang berbeda (Gambar 2 dan 3).
3
a b c d
Gambar 2 Perbedaan kepekatan warna merah pada media LB. Hasil uji menunjukkan bahwa (a) CaCO3 0
mM: FeSO4 0 mM (b) CaCO3 0
mM: FeSO4 0.25 mM (c) CaCO3 0
mM: FeSO4 0.5 mM (d) CaCO3 0
mM: FeSO4 1 mM menghasilkan
kepekatan yang berbeda.
a b c d
Gambar 3 Perbedaan kepekatan warna merah pada media NB. Hasil uji menunjukkan bahwa (a) CaCO3 0
mM: FeSO4 0 mM (b) CaCO3 0
mM: FeSO4 0.25 mM (c) CaCO3 0
mM: FeSO4 0.5 mM (d) CaCO3 0
mM: FeSO4 1 mM menghasilkan
kepekatan yang berbeda.
Hasil analisis statistik produksi prodigiosin
S. marcescens pada media LB dan NB dengan kandungan Fe2+ dan Ca2+ disajikan dalam Tabel 1. Ada interaksi yang nyata antara jenis media dengan variasi konsentrasi Fe2+ dan Ca2+ terhadap produksi prodigiosin (Lampiran 3).
S. marcescens menghasilkan prodigiosin lebih tinggi dalam media NB dibandingkan dengan media LB. Penambahan CaCO3 dan
FeSO4 ke dalam media mampu meningkatkan
produksi prodigiosin, tetapi peningkatan produksi prodigiosin yang paling signifikan
disebabkan oleh penambahan FeSO4.
Sedangkan peningkatan konsentrasi CaCO3
cenderung menurunkan produksi prodigiosin. Pada konsentrasi FeSO4 antara 0.25 dan 1
mM, hubungan antara kosentrasi FeSO4
dengan produksi prodigiosin cenderung bersifat linier. Artinya, semakin tinggi konsentrasi FeSO4 dalam media, semakin
tinggi produksi prodigiosin. Produksi prodigiosin pada media LB dan NB dengan konsentrasi FeSO4 1 mM masing-masing
mencapai 165 dan 293.5 g/ml (Gambar 4 dan 5).
Media FeSO4
(mM)
CaCO3 (mM)
0 2.5 5 10
LB 0 59 dey 128 dx 60 cy 66,5 dy
0.25 73 dx 85,5 ex 31 dy 30 ey
0,5 107 cx 110,5 dx 72,5 cy 108,5 cx
1 165 bx 143,5 cy 131 by 142,5 by
NB 0 95 cy 90 ey 140,5 bx 93,5 cy
0.25 94,5 cy 121,5 dx 129,5 bx 97,5 cy
0.5 42,5 ez 202,5 bx 151,5 by 137 by
1 293,5 ax 262 ay 259 ay 256 ay
Gambar 4 Grafik perbandingan konsentrasi prodigiosin pada media LB yang dikombinasikan dengan FeSO4
dan CaCO3 pada konsentrasi
berbeda.
Catatan: Angka-angka pada setiap kolom dan baris (a,b,c) yang sama yang diikuti oleh huruf-huruf yang sama (p,q,r) tidak berbeda nyata.
BNT 0,05= 14.5
4
Gambar 5 Grafik perbandingan konsentrasi prodigiosin pada media NB yang dikombinasikan dengan FeSO4
dan CaCO3 pada konsentrasi
berbeda.
Pemurnian prodigiosin
Sebanyak 250 ml media LB dan NB yang mengandung FeSO4 1 mM digunakan untuk
produksi prodigiosin. Biakan diinokulasi dengan 1 ml biakan bakteri (OD600: 0.5) dan diinkubasikan dalam mesin bergoyang (75 rpm) selama 7 hari. Prodigiosin yang dihasilkan diekstraksi dari supernatan biakan bakteri dengan menggunakan etil asetat. Hasil ekstraksi dari media LB dan NB masing-masing diperoleh prodigiosin sebanyak 486.0 dan 489.0 mg. Setelah dimurnikan melalui kromatografi kolom dengan silika gel, tingkat kemurniannya masing-masing mencapai 77,8% dan 92% pada media LB dan NB (Tabel 2).
Tabel 2 Persentase kemurnian prodigiosin
Media
Ekstrak prodigio
sin
Prodigiosin hasil kromatogr
afi
% Kemurni
an
LB 486 378 77,8
NB 489 450 92
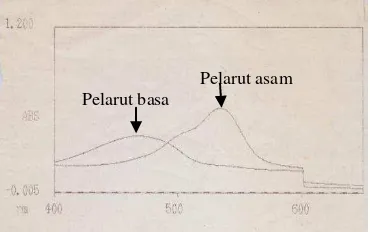
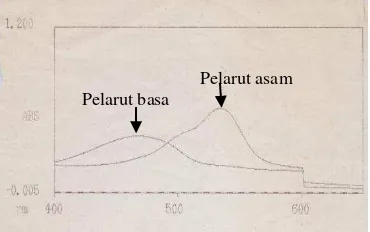
Hasil pemurnian prodigiosin dianalisis dengan menggunakan spektrofotometer dan kromatografi lapis tipis dengan silika gel. Hasil analisis dengan spektrofotometer menunjukkan bahwa prodigiosin memiliki nilai absorbansi yang tinggi pada panjang gelombang 460 nm jika dilarutkan dalam pelarut yang bersifat basa dan 540 nm jika berada dalam pelarut yang bersifat asam.
Perbedaan serapan panjang gelombang prodigiosin pada kedua sifat pelarut tersebut berkaitan dengan perubahan warna prodigiosin pada kondisi asam dan basa. Warna merah akan terjadi pada pelarut yang bersifat asam sedangkan pada pelarut yang bersifat basa, warna prodigiosin menjadi kekuningan.
Titik puncak yang lain juga dapat terdeteksi pada serapan panjang gelombang 494-496 nm baik pada pelarut bersifat basa dan asam dari prodigiosin pada media LB (Gambar 6). Begitu juga dari prodigiosin media NB, titik puncak lainnya terdeteksi pada panjang gelombang 502 dan 506 nm (Gambar 7). Hal ini menunjukkan bahwa pemurnian dengan kromatografi kolom masih belum mampu membersihkan prodigiosin dari senyawa metabolit lainnya.
Pelarut asam Pelarut basa
Pelarut basa Pelarut asam
Gambar 8 menunjukkan hasil analisis prodigiosin menggunakan kromatografi lapis tipis dengan silika gel yang dijalankan dengan pelarut amil asetat. Ada dua spot yang terdeteksi dengan nilai Rf 0.24 dan 0.82 cm pada media LB dan Rf 0.25 dan 0.83 cm pada Gambar 6 Grafik deteksi prodigiosin pada
media NB dengan spektrofotometer.
5
media NB. Spot merah dengan nilai Rf 0.82 dan 0.83 adalah prodigiosin.
14.1 cm 11.5 cm
13.8 cm 11.5 cm
Gambar 8 Visualisasi ekstrak prodigiosin dengan kromatografi lapis tipis.
Uji bioautografi dengan bakteri
Xanthomonas oryzae pv. oryzae telah dilakukan untuk memastikan bahwa spot merah pada nilai Rf 0.82 dan 0.83 adalah prodigiosin (Gambar 9). Hasil pengujian menunjukkan bahwa pertumbuhan bakteri hanya terhambat pada spot merah, tetapi tidak pada spot yang lain. Hal ini membuktikan bahwa spot merah yang mampu menghambat pertumbuhan X. oryzae pv. oryzae dengan nilai Rf 0.82 dan 0.83 adalah prodigiosin.
Gambar 9 Hasil uji bioautografi dengan bakteri Xanthomonas oryzae pv.
oryzae.
Respon S. marcescens terhadap antibiotik Tabel 3 menyajikan hasil pengujian beberapa antibiotik terhadap S. marcescens. Bakteri ini bersifat resisten terhadap hampir semua antibiotik yang diuji, kecuali streptomisin. Hal yang menarik adalah
meskipun S. marcescen mampu tumbuh pada media yang mengandung kloramfenikol, tetapi pigmentasinya terhambat (Gambar 10). Bahkan pigmentasi merah sudah tidak terjadi pada konsentrasi kloramfenikol 5 µg/ml (Gambar 11). Hal ini menjukkan bahwa antibiotik kloramfenikol dapat menghambat biosintesis prodigiosin.
Tabel 3 Hasil pengujian beberapa antibiotik terhadap S. marcescens
Antibiotik (50 g/ml)
Fenotipe Warna koloni
Kloramfenikol + Putih
Kasugamisin + Merah
Rimfamisin + Merah
Streptomisin - -
Ampisilin + Merah
Gambar 10 Hasil uji pengaruh antibiotik kloramfenikol terhadap produksi prodigiosin.
a b c d
Gambar 11 Hasil uji pengaruh kloramfenikol terhadap produksi prodigiosin pada konsentrasi (A) 0 µg/ml, (B) 2.5 µg/ml, (C) 5 µg/ml, (D) 10 µg/ml.
LB NB
6
PEMBAHASAN
Produksi prodigiosin tidak saja berbeda-beda antar strain S. marcescens, tetapi juga ditentukan oleh komposisi media dalam biakan (Pandey et al. 2009; Kim et al. 2009). Casullo de Araújo et al. (2010) telah berhasil menggunakan limbah buangan tepung kasava yang ditambahkan dengan manitol (2%) untuk menghasilkan prodigiosin hingga 49.5 mg/ml. Hasil prodigiosin ini lebih tinggi dibandingkan dengan menggunakan tepung kacang seperti dilaporkan oleh Giri et al.
(2004) yang hanya mencapai 39 mg/ml. Sedangkan hasil penelitian Jungdon et al. (2001) di dalam media cair yang mengandung
dextrose dan casein hanya menghasilkan 13 mg/ml prodigiosin.
Penelitian ini membandingkan produksi prodigiosin pada media LB dengan NB yang mengandung konsentrasi CaCO3 dan FeSO4
yang berbeda-beda. Kedua jenis media memiliki sumber nitrogen (N) dan karbon (C) yang berbeda. Sumber N dan C pada media LB berasal dari triptose dan ekstrak khamir serta ditambahkan dengan mineral NaCl sedangkan pada media NB menggunakan ektrak daging dan pepton.
Perbedaan produksi prodigiosin yang signifikan dalam media LB dan NB diduga berkaitan dengan perbedaan kandungan nutrisi pada kedua media tersebut. Media NB mengandung pepton dan ekstrak daging. Pepton berfungsi sebagai sumber nitrogen, sulfur, karbon, dan energi sedangkan ekstrak daging penting untuk memenuhi kebutuhan asam amino esensial, vitamin, koenzim, dan mineral dalam pertumbuhan bakteri. Pada media LB, sumber nitrogen, karbon, asam amino esensial, vitamin, koenzim, dan mineral dipenuhi dari ekstrak khamir dan triptose.
Nutrisi dalam media LB kaya dengan karbon yang bersumber dari tryptose,
sedangkan media NB kaya dengan nitrogen yang berasal dari ektrak daging dan pepton. Pada umumnya, pertumbuhan bakteri lebih cepat pada media dengan kandungan nitrogen yang tinggi. Hal ini yang menyebabkan produksi prodigiosin lebih tinggi pada media NB dibandingkan dengan media LB. Disamping itu, struktur prodigiosin yang mengandung nitrogen banyak juga membutuhkan sumber nitrogen yang lebih tinggi untuk proses biosintesisnya (Lampiran 4). Kebutuhan ini hanya dapat disuplai dari media yang banyak kandungan nitrogennya seperti yang terdapat pada media NB.
Hasil ini juga sesuai dengan yang diungkapkan oleh Venil dan Perumalsamy (2009) bahwa media NB merupakan salah satu media yang baik untuk produksi prodigiosin. Hal ini menunjukkan bahwa biosintesis progidiosin lebih tinggi pada media rendah nutrisi. Oleh karena itu, Casullo de Araújo et al. (2010) dan Giri et al. (2004) berhasil memproduksi prodigosin pada media yang cukup sederhana dengan masing-masing memanfaatkan limbah buangan tepung kasava dan tepung kacang. Harapan ke depannya adalah limbah tepung kasava yang banyak mengandung karbon dapat diteliti untuk dijadikan media standar dalam produksi prodigiosin.
Kemampuan bakteri menghasilkan prodigiosin semakin meningkat jika ada penambahan CaCO3 dan FeSO4. Hal ini
menunjukkan bahwa kedua mineral tersebut mempunyai peranan penting dalam biosintesis prodigiosin. Peran spesifik Fe2+ dalam biosintesis prodigiosin belum diketahui, tetapi penambahan Fe2+ hingga konsentrasi tertentu sangat diperlukan untuk memaksimalkan pertumbuhan sel mikroba. Keberadaan Fe2+ dalam media dapat menghasilkan prodigiosin yang larut dalam air. Sedangkan Ca2+ merupakan salah satu ion yang juga dapat digunakan untuk mempengaruhi pertumbuhan bakteri (Kim et al. 2004). Disamping itu, Ca2+ dan Fe2+ juga merupakan salah satu ion yang berperan sebagai kofaktor untuk membantu kerja enzim dalam biosintesis prodigiosin.
Media NB dengan FeSO4 merupakan
kombinasi terbaik untuk produksi prodigiosin dalam skala besar. Rata-rata konsentrasi tertinggi terdapat pada media NB dengan FeSO4 1 mM, yaitu 293,5 g/ml. Sedangkan
rata-rata konsentrasi terendah adalah 30
g/ml, terdapat pada media LB dengan CaCO3 10 mM dan FeSO4 0,25 mM.
7
Kromatogram hasil dari kromatografi lapis tipis digunakan dalam metode bioautografi. Metode ini bertujuan untuk menunjukkan adanya aktivitas antibakteri yang ditandai dengan terbentuknya daerah jernih yang tidak ditumbuhi oleh mikroba pada media (Kusumaningtyas et al. 2008). Hasil percobaan ini menunjukkan bahwa prodigiosin memang memiliki fungsi sebagai antibakteri yang terbukti dengan terbentuknya zona bening pada media yang sebelumnya sudah diinokulasikan dengan bakteri
Xanthomonas oryzae pv. oryzae.
Biosintesis prodigiosin ternyata terhambat oleh antibiotik kloramfenikol, tetapi bagaimana mekanisme penghambatannya belum diketahui. Kloramfenikol adalah antibiotik yang mempunyai aktivitas bakteriostatik dan pada dosis tinggi bersifat bakterisidal. Aktivitas antibakterisidalnya terjadi melalui penghambatan proses sintesis protein dengan menginaktifkan enzim peptidil transferase yang seharusnya berperan sebagai katalisator untuk membentuk ikatan peptida (Ganiswarna et al. 1995). Kemungkinan dengan terhambatnya sintesis protein tersebut, biosintesis propdigiosin akan terhambat.
SIMPULAN
Media terbaik yang bisa digunakan untuk produksi prodigiosin adalah media NB yang dikombinasikan dengan larutan FeSO4 1 mM.
Pada media ini diperoleh konsentrasi prodigiosin tertinggi, yaitu 293,5 g/ml. Sedangkan pada larutan CaCO3 konsentrasi
prodigiosin yang dihasilkan lebih sedikit, yaitu 165 g/ml. Prodigiosin yang murni dapat diperoleh melalui purifikasi dari prodigiosin menggunakan kromatografi lapis tipis dengan silika gel. Setelah dilakukan proses purifikasi diperoleh kemurnian tertinggi pada media NB, yaitu 92%.
Biosintesis prodigiosin terhambat oleh kloramfenikol. Hal ini diduga disebabkan oleh terhambatnya proses sintesis protein atau enzim yang berperan dalam biosintesis prodigiosin.
SARAN
Perlu penelitian lebih lanjut untuk produksi prodigiosin dalam skala besar dengan memanfaatkan bahan dasar media yang lebih murah dan ekonomis, seperti
penggunaan limbah tepung kasava sebagai sumber karbon dan limbah tahu/ tempe untuk sumber nitrogennya.
DAFTAR PUSTAKA
Castro AJ. 1967. Antimalarial activity of prodigiosin. Nature 13: 903–4.
Casullo de Araújo, Fukushima K, Takaki GMC. 2010. Prodigiosin production by
Serratia marcescens UCP 1549 using Renewable-Resources as a low cost substrate. Molecules 15:6931-6940. Chang S, M. Sanada, O. Johdo, S. Ohta, Y.
Nagamatsu and A. Yoshimoto. 2000. High production of prodigiosin by Serratia marcescens grown ethanol. Biotechnol Lett 22: 1761-1765.
Croft SL, K. Seifert, M. Duchene. 2002. Antiprotozoal activities of phospholipid analogues. Mol Biochem Parasitol 126: 165–172.
Dhanasekaran D. Raj DM, Thajuddin N, Panneerselvam A. 2009. Production of prodigiosin from Serratia marcescens and its cytotoxicity activity. Pharm Res 2: 590-593.
Ganiswarna SG et al. 1995. Pharmacological Basis of Therapeutic. Di dalam: Gilman AG, editor. Farmakologi dan Terapi. Jakarta: Fakultas Kedokteran Universitas Indonesia.
Giri AV, Anandkumar N, Muthukumaran G, Pennathur G. 2004. A novel medium for the enhanced cell growth and production of prodigiosin from Serratia marcescens
isolated from soil. BMC Microbiol 4: 1-10. Jungdon B, Hyunsoo M, Kyeong-Keun O, Chang-Ho K, Dae SL, Seung WK, Suk-In H. 2001. A novel bioreactor with an internal adsorbent for intergrated fermentation and recovery of prodigiosin like pigment produced from Serratia sp. Biotechnol Letts 23: 1315-1319.
Khanafari A, Assadi MM, Fakhr FA. 2006. Review of prodigiosin, pigmentation in
Serratia marcescens.Biol Sci 6: 1-13. Kim HB, Smith CP, Micklefield J, Mavituna
F. 2004. Metabolic flux analysis for calcium dependent antibiotic (CDA) production in Streptomyces coelicolor.
Metabol Eng 6: 313–325.
8
Kusumaningtyas E, Astuti E, darmono. 2008. Sensitivitas metode bioautografi kontak dan agar overlay dalam penentuan senyawa antikapang. Ilmu Kefarmasian Indonesia 6: 75-79.
Nakamura K., Kitamura K. 1981. Process for preparation of prodigiosin. U.S Patent 4: 266.
Nakashima T, Tamura T, Kurachi M, Yamaguchi K, Oda T. 2005. Apoptosis-mediated cytotoxicity of prodigiosin-like red pigment produced by ã-Proteobacterium and its multiple bioactivities. Biol Pharm Bul 28: 2289– 2295.
Pandey R et al. 2009. Prodigiosin as anti cancer agents: Living upto their name.
Curr Pharm 15: 732-741.
Perez-Tomas, R., B. Montaner, E. Llagostera, and V. Soto-Cerrato. 2003. The prodigiosins, proapoptotic drugs with anticancer properties. Biochem Pharmacol
66: 1447– 1452.
Venil KC, Perumalsamy L. 2009. An insightful overview on microbial pigment, prodigiosin. Elect Biol 5: 49-61.
Wang W et al. 2009. Diversity of endosymbiotic bacteria of Nilaparvata lugens (Stal) (rice brown planthopper). China National Rice Research Institute Newsletter, Hangzhou Tiyuchang.
10
Lampiran 1 Kombinasi konsentrasi CaCO3 dan FeSO4 pada media LB dan NB
Media FeSO4
CaCO3
0 2,5 5 10
LB 0 0;0 2.5;0 5;0 10;0
0.25 0;0.25 2.5;0.25 5;0.25 10;0.25
0.5 0;0.5 2.5;0.5 5;0.5 10;0.5
1 0;1 2.5;1 5;1 10;1
NB 0 0;0 2.5;0 5;0 10;0
0.25 0;0.25 2.5;0.25 5;0.25 10;0.25
0.5 0;0.5 2.5;0.5 5;0.5 10;0.5
1 0;1 2.5;1 5;1 10;1
11
Lampiran 3 Hasil analisis statistik yang menunjukkan interaksi nyata antara jenis media dengan variasi konsentrasi Fe2+ dan Ca2+ terhadap produksi prodigiosin
S of V Df SS MS Fhitung Ftabel
Media 1 0.029 0.029 15.127** 3.94
Fe 3 0.004 0.001 0.730 2.70
Ca 3 0.004 0.001 0.730 2.70
M x Fe 3 10.07 3.356 1750.65** 2.70
M x Ca 3 0.037 0.012 6.451** 2.70
Fe x Ca 9 0.088 0.009 5.101** 1.97
MxFexCa 9 1.148 0.127 66.510** 1.97
Error 96 0.184 0.0019
Total 127
ABSTRAK
RAHMINOVITA HERLIS. Produksi Prodigiosin terhadap Penambahan Ca2+ dan Fe2+ pada Media Tumbuh Bakteri Serratia marcescens dan Uji Resistensi Kloramfenikol. Dibimbing oleh IMAN RUSMANA dan TRI PUJI PRIYATNO.
Pigmen merah prodigiosin yang dihasilkan oleh bakteri S. marcescens adalah metabolit sekunder dari famili tripyrrole yang sudah digunakan secara meluas dalam pengobatan sebagai antibiotik multi fungsi. Produksi prodigiosin telah dicoba pada media cair Lurial Bertani (LB) dan
Nutrient Broth (NB) yang mengandung CaCO3 dan FeSO4 dengan konsentrasi yang berbeda. Hasil
penelitian menunjukkan bahwa ada interaksi yang nyata antara jenis media dengan konsentrasi CaCO3 dan FeSO4 terhadap produksi prodigiosin. Produksi prodigiosin yang tinggi terjadi pada
media NB jika ditambah dengan FeSO4. Pengaruh penambahan CaCO3 tidak sebesar hasil yang
diperoleh dengan penambahan FeSO4. Dalam 250 ml media LB dan NB yang mengandung FeSO4
1 mM diperoleh prodigiosin masing-masing sebanyak 486.0 dan 489.0 mg. Tetapi berdasarkan pemurnian menggunakan kromatografi kolom dengan silika gel, tingkat kemurnian prodigiosin dari media LB hanya 77.8% sedangkan dari media NB mencapai 92%. Hasil deteksi prodigiosin dengan kromatografi lapis tipis silika gel menunjukkan pigmen merah prodigiosin mempunyai nilai Rf 0.83. Spot merah pada nilai Rf tersebut bersifat antibakteri berdasarkan uji bioautografi. Menariknya, meski S. marcescens tahan terhadap antibiotik kloramfenikol tetapi biosintesis prodigiosin terhambat. Bagaimana mekanisme kloramfenikol menghambat biosintesis prodigiosin masih belum diketahui.
Kata kunci: Prodigiosin, Serratia marcescens, Lurial Bertani Broth, Nutrient Broth, CaCO3 and
FeSO4.
ABSTRACT
RAHMINOVITA HERLIS. Prodigiosin Production on Bacterial Growth Media of Serratia marcescens Enrich by Ca2+ and Fe2+ and Chloramphenicol Resistance Test.Under supervision of IMAN RUSMANA and TRI PUJI PRIYATNO.
Red pigment prodigiosin produced by S. marcescens is a secondary metabolite family of
tripyrrole. It has been widely used in pharmacology as multifunctional antibiotics. Prodigiosin was produced in Lurial Bertani (LB) and Nutrient Broth (NB) media containing different concentrations of CaCO3 dan FeSO4. The results showed that there was a significant interaction
between media and concentrations of CaCO3 and FeSO4 on prodigiosin production. High
production of prodigiosin in NB media with FeSO4. Effect of CaCO3 addition on prodigiosin
production was lower than that of FeSO4 addition. Production of prodigiosin in 250 ml LB and NB
with 1 mM addition of FeSO4 1mM was 486.0 and 489.0 mg respectively. However, based on
column chromatography purification using silica gel, the purity of prodigiosin produced in LB and NB was 77.8% and 92% respectively. Thin layer silica gel chromatography showed that the red pigment prodigiosin had Rf value of 0.83. The red spot had antibacterial activity based on bioautography analysis. Interestingly, although S. marcescens resistant to cloramphenicol, the antibiotic inhibited biosynthesis of prodigiosin. However, the mechanism of cloramphenicol inhibition to the biosynthesis of prodigiosin is still unclear.
Keyword: Prodigiosin, Serratia marcescens, Lurial Bertani Broth, Nutrient Broth, CaCO3 and
FeSO4.
PENDAHULUAN
Latar Belakang
Bakteri entomopatogen Serratia marcescens dari famili Enterobacteriaceae telah berhasil diisolasi dari wereng batang coklat (wbc) yang mati dengan gejala warna merah pada tubuhnya. Hasil uji pastulat Koch
membuktikan bahwa bakteri tersebut bersifat patogenik. Menurut (Wang et al. 2009),
Serratia sp. adalah bakteri endosimbion wbc yang dapat bersifat sebagai patogen lemah, tetapi mekanisme patogenisitasnya masih belum diketahui secara pasti. Kemampuan S. marcescens menginfeksi wbc mempunyai arti penting dan perspektif baru untuk mengendalikan serangga hama dengan tipe mulut pencucuk pengisap menggunakan bakteri patogen. Oleh karena itu, untuk mempelajari mekanisme patogenisitas S. marcescens terhadap wbc perlu diidentifikasi faktor-faktor virulensinya.
Ciri khas S. marcescens yang diisolasi dari wbc adalah koloninya berbentuk cembung dan menghasilkan pigmen merah. Bakteri ini bersifat fakultatif dan mampu tumbuh baik pada kondisi aerob dan anaerob di dalam media buatan. Pertumbuhan optimumnya terjadi pada pH media 9 dan suhu lingkungan 20-37 0C (Giri et al. 2004). Pigmen merah yang dihasilkan oleh S. marcescens
merupakan metabolit sekunder yang dikenal sebagai prodigiosin dari famili tripyrrole yang umumnya mengandung 4-methoxy, ring 2-2
bipyrolle (Giri et al. 2004). Prodigiosin dapat bersifat multi fungsi, yaitu sebagai antibakteri, antifungi, antiprotozoal (Croft et al. 2002), bersifat cytotoxic (Nakashima et al. 2005), antitumor (Castro 1967; Perez-Tomás et al. 2003), antimalaria, antidiabetes, antioksidan, obat-obatan, anti-inflammatory nonsteroidal, serta menjadi pewarna untuk sutera dan wool (Khanafari et al. 2006). Oleh karena itu, prodigiosin merupakan salah satu produk metabolit sekunder dari bakteri gram negatif yang telah digunakan secara luas dalam pengobatan.
Produksi prodigiosin sangat bervariasi antara spesies dan strain Serratia serta dipengaruhi oleh komposisi media dan waktu inkubasi. Media cair yang sudah banyak digunakan untuk produksi prodigiosin adalah
Nutrient Broth, Peptone Gliserol Broth, dan
Lurial Bertani Broth. Penambahan 2% sodium oleat, asam oleat, dan triolein ke dalam media dapat menghasilkan prodigiosin 0.69 mg/ml (Nakamura & Kitamura 1981). Media yang mengandung etanol sebagai sumber karbon
juga sangat baik untuk produksi prodigiosin (Chang et al. 2000). Sedangkan maltosa dan glukosa merupakan represor biosintesis prodigiosin (Khanafari et al. 2006). Menurut Witney et al. (1977), biosintesis prodigiosin dipengaruhi oleh konsentrasi fosfat anorganik di dalam media. Produksi prodigiosin yang tinggi terjadi pada konsentrasi fosfat kurang dari 0.3 mM sedangkan pada konsentrasi antara 10 dan 250 mM pigmentasi Serratia
terhambat.
Fe2+ dan Ca2+ juga merupakan mineral anorganik yang sangat penting dalam produksi prodigiosin (Venil et al. 2009; Casullo de Araújo et al. 2010). Penambahan Fe2+ dalam media biakan S. marcescens dapat menghasilkan pigmen merah yang larut air dan berdifusi ke dalam agar di sekitar koloni (Khanafari et al. 2006). Begitu pula dengan Ca2+ yang juga dapat meningkatkan produksi prodigiosin (Casullo de Araújo et al. 2010)
.
Tujuan
Penelitian ini bertujuan mengetahui komposisi media dengan kandungan Fe2+ dan Ca2+ yang sesuai untuk produksi prodigiosin dan cara pemurniannya.
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Desember 2010 sampai April 2011 di Laboratorium Biokimia, Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor.
METODE
Pemeliharaan isolat. Isolat S. marcescens
dipelihara pada media Lurial Bertani Broth
(LB) agar. Biakan diinkubasikan dalam suhu ruangan dan diremajakan setiap 2 minggu sekali.
Uji Media Produksi Prodigiosin.
Sebanyak 4 ml media LB dan Nutrient Broth
(NB) yang mengandung kombinasi konsentrasi CaCO3 dan FeSO4 dimasukkan ke
PENDAHULUAN
Latar Belakang
Bakteri entomopatogen Serratia marcescens dari famili Enterobacteriaceae telah berhasil diisolasi dari wereng batang coklat (wbc) yang mati dengan gejala warna merah pada tubuhnya. Hasil uji pastulat Koch
membuktikan bahwa bakteri tersebut bersifat patogenik. Menurut (Wang et al. 2009),
Serratia sp. adalah bakteri endosimbion wbc yang dapat bersifat sebagai patogen lemah, tetapi mekanisme patogenisitasnya masih belum diketahui secara pasti. Kemampuan S. marcescens menginfeksi wbc mempunyai arti penting dan perspektif baru untuk mengendalikan serangga hama dengan tipe mulut pencucuk pengisap menggunakan bakteri patogen. Oleh karena itu, untuk mempelajari mekanisme patogenisitas S. marcescens terhadap wbc perlu diidentifikasi faktor-faktor virulensinya.
Ciri khas S. marcescens yang diisolasi dari wbc adalah koloninya berbentuk cembung dan menghasilkan pigmen merah. Bakteri ini bersifat fakultatif dan mampu tumbuh baik pada kondisi aerob dan anaerob di dalam media buatan. Pertumbuhan optimumnya terjadi pada pH media 9 dan suhu lingkungan 20-37 0C (Giri et al. 2004). Pigmen merah yang dihasilkan oleh S. marcescens
merupakan metabolit sekunder yang dikenal sebagai prodigiosin dari famili tripyrrole yang umumnya mengandung 4-methoxy, ring 2-2
bipyrolle (Giri et al. 2004). Prodigiosin dapat bersifat multi fungsi, yaitu sebagai antibakteri, antifungi, antiprotozoal (Croft et al. 2002), bersifat cytotoxic (Nakashima et al. 2005), antitumor (Castro 1967; Perez-Tomás et al. 2003), antimalaria, antidiabetes, antioksidan, obat-obatan, anti-inflammatory nonsteroidal, serta menjadi pewarna untuk sutera dan wool (Khanafari et al. 2006). Oleh karena itu, prodigiosin merupakan salah satu produk metabolit sekunder dari bakteri gram negatif yang telah digunakan secara luas dalam pengobatan.
Produksi prodigiosin sangat bervariasi antara spesies dan strain Serratia serta dipengaruhi oleh komposisi media dan waktu inkubasi. Media cair yang sudah banyak digunakan untuk produksi prodigiosin adalah
Nutrient Broth, Peptone Gliserol Broth, dan
Lurial Bertani Broth. Penambahan 2% sodium oleat, asam oleat, dan triolein ke dalam media dapat menghasilkan prodigiosin 0.69 mg/ml (Nakamura & Kitamura 1981). Media yang mengandung etanol sebagai sumber karbon
juga sangat baik untuk produksi prodigiosin (Chang et al. 2000). Sedangkan maltosa dan glukosa merupakan represor biosintesis prodigiosin (Khanafari et al. 2006). Menurut Witney et al. (1977), biosintesis prodigiosin dipengaruhi oleh konsentrasi fosfat anorganik di dalam media. Produksi prodigiosin yang tinggi terjadi pada konsentrasi fosfat kurang dari 0.3 mM sedangkan pada konsentrasi antara 10 dan 250 mM pigmentasi Serratia
terhambat.
Fe2+ dan Ca2+ juga merupakan mineral anorganik yang sangat penting dalam produksi prodigiosin (Venil et al. 2009; Casullo de Araújo et al. 2010). Penambahan Fe2+ dalam media biakan S. marcescens dapat menghasilkan pigmen merah yang larut air dan berdifusi ke dalam agar di sekitar koloni (Khanafari et al. 2006). Begitu pula dengan Ca2+ yang juga dapat meningkatkan produksi prodigiosin (Casullo de Araújo et al. 2010)
.
Tujuan
Penelitian ini bertujuan mengetahui komposisi media dengan kandungan Fe2+ dan Ca2+ yang sesuai untuk produksi prodigiosin dan cara pemurniannya.
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Desember 2010 sampai April 2011 di Laboratorium Biokimia, Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor.
METODE
Pemeliharaan isolat. Isolat S. marcescens
dipelihara pada media Lurial Bertani Broth
(LB) agar. Biakan diinkubasikan dalam suhu ruangan dan diremajakan setiap 2 minggu sekali.
Uji Media Produksi Prodigiosin.
Sebanyak 4 ml media LB dan Nutrient Broth
(NB) yang mengandung kombinasi konsentrasi CaCO3 dan FeSO4 dimasukkan ke
2
mengandung 4% HCl 1M dan divorteks selama 1 menit. Prodigiosin yang terlarut dalam etanol dipisahkan dari sel bakteri dengan sentrifugasi 10.000 rpm selama 5 menit. Kandungan prodigiosin dalam etanol diukur dengan spektrofotometer pada panjang gelombang 450 nm. Nilai absorbansi yang diperoleh, dikonversi dengan kurva standar untuk menentukan kandungan prodigiosin yang sebenarnya. Selanjutnya data dianalisis secara statistik untuk mengetahui komposisi media yang terbaik. Percobaan ini dilakukan sebanyak empat kali ulangan.
Pemurnian prodigiosin. Bakteri S. marcescens dibiakkan dalam 250 ml media LB dan NB yang masing-masing mengandung FeSO4 1 mM. Media diautoklaf dan
diinokulasi dengan 1 ml biakan bakteri yang berumur 16 jam (OD600: 0.5). Kemudian biakan diinkubasikan dalam mesin bergoyang (75 rpm) selama 7 hari. Prodigiosin diekstraksi dari supernatan biakan bakteri dengan menggunakan etil asetat. Biakan disentrifugasi pada 5000 rpm selama 20 menit untuk memisahkan sel dari supernatan. Supernatan ditambahkan 200 ml etil asetat di dalam erlenmeyer dan diaduk dengan
magnetik stirrer selama 1 jam pada suhu ruangan. Prodigiosin yang terlarut dalam etil asetat dipisahkan dari fraksi air dengan menggunakan tabung fraksinator. Kemudian etil asetat diuapkan dengan evaporator pada suhu 50oC dan prodigiosin yang diperoleh dilarutkan dengan 1.5 ml DMSO.
Pemurnian prodigiosin dilakukan dengan kromatografi kolom menggunakan silika gel yang dibuat dengan pelarut metanol. Kemudian sampel prodigiosin dalam pelarut metanol dialirkan melalui kolom tersebut. Prodigiosin yang terperangkap dalam kolom silika gel dilepaskan dan dilarutkan dengan kloroform. Setelah kloroform diuapkan di dalam ruang asam, prodigiosin dilarutkan dengan 0.5 ml DMSO. Konsentrasi prodigiosin diukur dengan spektrofotometer dan profilnya dideteksi menggunakan kromatografi lapis tipis dengan silika gel dan amil asetat sebagai pelarut. Setelah didiamkan lebih kurang selama 2 jam akan terbentuk spot berwarna pink (merah muda). Spot ini merupakan visualisasi dari prodigiosin murni yang dikoleksi dan dilarutkan dalam DMSO. Spot ini juga diukur Rf-nya. Rf dapat dihitung dengan cara:
Rf =
Respon S. marcescens terhadap antibiotik. Antibiotik kloramfenikol, kasuga-misin, rimfamisin, streptomisin, dan ampisilin masing-masing ditambahkan ke dalam media LB sebanyak 50 g/ml. Kemudian bakteri Serratia marcescens ditumbuhkan dengan metode gores pada media tersebut dan diinkubasi pada suhu ruang selama 3 hari.
Pengaruh antibiotik kloramfenikol terhadap produksi prodigiosin. Pengaruh kloramfenikol terhadap produksi prodigiosin diuji dalam tabung reaksi yang mengandung 3 ml media LB dengan konsentrasi 0, 2.5, 5, dan 10 g/ml. Media diinokulasi dengan 10 µL biakan bakteri Serratia marcescens dan diinkubasi pada suhu ruang dalam mesin bergoyang. Produksi prodigiosin diamati 2 hari setelah inkubasi.
Pembuatan kurva standar prodigiosin.
Kurva standar dibuat dari prodigiosin murni dengan Sigma. Larutan prodigiosin dengan konsentrasi 0–100 g/ml dibuat dalam pelarut metanol (Lampiran 2).
HASIL
Produksi prodigiosin pada media LB dan NB
Bakteri patogen wbc yang diidentifikasi sebagai S. marcescens menunjukkan pertumbuhan koloni berwarna merah pada media LB agar setelah diinkubasi selama 3 hari pada suhu ruang (Gambar 1). Pigmen merah juga dihasilkan oleh S. marcescens
ketika dibiakan dalam media LB dan NB cair, tetapi pigmentasi merah terlihat cukup bervariasi bila ada penambahan Fe2+ dan Ca2+ dengan konsentrasi yang berbeda (Gambar 2 dan 3).
2
mengandung 4% HCl 1M dan divorteks selama 1 menit. Prodigiosin yang terlarut dalam etanol dipisahkan dari sel bakteri dengan sentrifugasi 10.000 rpm selama 5 menit. Kandungan prodigiosin dalam etanol diukur dengan spektrofotometer pada panjang gelombang 450 nm. Nilai absorbansi yang diperoleh, dikonversi dengan kurva standar untuk menentukan kandungan prodigiosin yang sebenarnya. Selanjutnya data dianalisis secara statistik untuk mengetahui komposisi media yang terbaik. Percobaan ini dilakukan sebanyak empat kali ulangan.
Pemurnian prodigiosin. Bakteri S. marcescens dibiakkan dalam 250 ml media LB dan NB yang masing-masing mengandung FeSO4 1 mM. Media diautoklaf dan
diinokulasi dengan 1 ml biakan bakteri yang berumur 16 jam (OD600: 0.5). Kemudian biakan diinkubasikan dalam mesin bergoyang (75 rpm) selama 7 hari. Prodigiosin diekstraksi dari supernatan biakan bakteri dengan menggunakan etil asetat. Biakan disentrifugasi pada 5000 rpm selama 20 menit untuk memisahkan sel dari supernatan. Supernatan ditambahkan 200 ml etil asetat di dalam erlenmeyer dan diaduk dengan
magnetik stirrer selama 1 jam pada suhu ruangan. Prodigiosin yang terlarut dalam etil asetat dipisahkan dari fraksi air dengan menggunakan tabung fraksinator. Kemudian etil asetat diuapkan dengan evaporator pada suhu 50oC dan prodigiosin yang diperoleh dilarutkan dengan 1.5 ml DMSO.
Pemurnian prodigiosin dilakukan dengan kromatografi kolom menggunakan silika gel yang dibuat dengan pelarut metanol. Kemudian sampel prodigiosin dalam pelarut metanol dialirkan melalui kolom tersebut. Prodigiosin yang terperangkap dalam kolom silika gel dilepaskan dan dilarutkan dengan kloroform. Setelah kloroform diuapkan di dalam ruang asam, prodigiosin dilarutkan dengan 0.5 ml DMSO. Konsentrasi prodigiosin diukur dengan spektrofotometer dan profilnya dideteksi menggunakan kromatografi lapis tipis dengan silika gel dan amil asetat sebagai pelarut. Setelah didiamkan lebih kurang selama 2 jam akan terbentuk spot berwarna pink (merah muda). Spot ini merupakan visualisasi dari prodigiosin murni yang dikoleksi dan dilarutkan dalam DMSO. Spot ini juga diukur Rf-nya. Rf dapat dihitung dengan cara:
Rf =
Respon S. marcescens terhadap antibiotik. Antibiotik kloramfenikol, kasuga-misin, rimfamisin, streptomisin, dan ampisilin masing-masing ditambahkan ke dalam media LB sebanyak 50 g/ml. Kemudian bakteri Serratia marcescens ditumbuhkan dengan metode gores pada media tersebut dan diinkubasi pada suhu ruang selama 3 hari.
Pengaruh antibiotik kloramfenikol terhadap produksi prodigiosin. Pengaruh kloramfenikol terhadap produksi prodigiosin diuji dalam tabung reaksi yang mengandung 3 ml media LB dengan konsentrasi 0, 2.5, 5, dan 10 g/ml. Media diinokulasi dengan 10 µL biakan bakteri Serratia marcescens dan diinkubasi pada suhu ruang dalam mesin bergoyang. Produksi prodigiosin diamati 2 hari setelah inkubasi.
Pembuatan kurva standar prodigiosin.
Kurva standar dibuat dari prodigiosin murni dengan Sigma. Larutan prodigiosin dengan konsentrasi 0–100 g/ml dibuat dalam pelarut metanol (Lampiran 2).
HASIL
Produksi prodigiosin pada media LB dan NB
Bakteri patogen wbc yang diidentifikasi sebagai S. marcescens menunjukkan pertumbuhan koloni berwarna merah pada media LB agar setelah diinkubasi selama 3 hari pada suhu ruang (Gambar 1). Pigmen merah juga dihasilkan oleh S. marcescens
ketika dibiakan dalam media LB dan NB cair, tetapi pigmentasi merah terlihat cukup bervariasi bila ada penambahan Fe2+ dan Ca2+ dengan konsentrasi yang berbeda (Gambar 2 dan 3).
3
a b c d
Gambar 2 Perbedaan kepekatan warna merah pada media LB. Hasil uji menunjukkan bahwa (a) CaCO3 0
mM: FeSO4 0 mM (b) CaCO3 0
mM: FeSO4 0.25 mM (c) CaCO3 0
mM: FeSO4 0.5 mM (d) CaCO3 0
mM: FeSO4 1 mM menghasilkan
kepekatan yang berbeda.
a b c d
Gambar 3 Perbedaan kepekatan warna merah pada media NB. Hasil uji menunjukkan bahwa (a) CaCO3 0
mM: FeSO4 0 mM (b) CaCO3 0
mM: FeSO4 0.25 mM (c) CaCO3 0
mM: FeSO4 0.5 mM (d) CaCO3 0
mM: FeSO4 1 mM menghasilkan
kepekatan yang berbeda.
Hasil analisis statistik produksi prodigiosin
S. marcescens pada media LB dan NB dengan kandungan Fe2+ dan Ca2+ disajikan dalam Tabel 1. Ada interaksi yang nyata antara jenis media dengan variasi konsentrasi Fe2+ dan Ca2+ terhadap produksi prodigiosin (Lampiran 3).
S. marcescens menghasilkan prodigiosin lebih tinggi dalam media NB dibandingkan dengan media LB. Penambahan CaCO3 dan
FeSO4 ke dalam media mampu meningkatkan
produksi prodigiosin, tetapi peningkatan produksi prodigiosin yang paling signifikan
disebabkan oleh penambahan FeSO4.
Sedangkan peningkatan konsentrasi CaCO3
cenderung menurunkan produksi prodigiosin. Pada konsentrasi FeSO4 antara 0.25 dan 1
mM, hubungan antara kosentrasi FeSO4
dengan produksi prodigiosin cenderung bersifat linier. Artinya, semakin tinggi konsentrasi FeSO4 dalam media, semakin
tinggi produksi prodigiosin. Produksi prodigiosin pada media LB dan NB dengan konsentrasi FeSO4 1 mM masing-masing
mencapai 165 dan 293.5 g/ml (Gambar 4 dan 5).
Media FeSO4
(mM)
CaCO3 (mM)
0 2.5 5 10
LB 0 59 dey 128 dx 60 cy 66,5 dy
0.25 73 dx 85,5 ex 31 dy 30 ey
0,5 107 cx 110,5 dx 72,5 cy 108,5 cx
1 165 bx 143,5 cy 131 by 142,5 by
NB 0 95 cy 90 ey 140,5 bx 93,5 cy
0.25 94,5 cy 121,5 dx 129,5 bx 97,5 cy
0.5 42,5 ez 202,5 bx 151,5 by 137 by
1 293,5 ax 262 ay 259 ay 256 ay
Gambar 4 Grafik perbandingan konsentrasi prodigiosin pada media LB yang dikombinasikan dengan FeSO4
dan CaCO3 pada konsentrasi
berbeda.
Catatan: Angka-angka pada setiap kolom dan baris (a,b,c) yang sama yang diikuti oleh huruf-huruf yang sama (p,q,r) tidak berbeda nyata.
BNT 0,05= 14.5
4
Gambar 5 Grafik perbandingan konsentrasi prodigiosin pada media NB yang dikombinasikan dengan FeSO4
dan CaCO3 pada konsentrasi
berbeda.
Pemurnian prodigiosin
Sebanyak 250 ml media LB dan NB yang mengandung FeSO4 1 mM digunakan untuk
produksi prodigiosin. Biakan diinokulasi dengan 1 ml biakan bakteri (OD600: 0.5) dan diinkubasikan dalam mesin bergoyang (75 rpm) selama 7 hari. Prodigiosin yang dihasilkan diekstraksi dari supernatan biakan bakteri dengan menggunakan etil asetat. Hasil ekstraksi dari media LB dan NB masing-masing diperoleh prodigiosin sebanyak 486.0 dan 489.0 mg. Setelah dimurnikan melalui kromatografi kolom dengan silika gel, tingkat kemurniannya masing-masing mencapai 77,8% dan 92% pada media LB dan NB (Tabel 2).
Tabel 2 Persentase kemurnian prodigiosin
Media
Ekstrak prodigio
sin
Prodigiosin hasil kromatogr
afi
% Kemurni
an
LB 486 378 77,8
NB 489 450 92
Hasil pemurnian prodigiosin dianalisis dengan menggunakan spektrofotometer dan kromatografi lapis tipis dengan silika gel. Hasil analisis dengan spektrofotometer menunjukkan bahwa prodigiosin memiliki nilai absorbansi yang tinggi pada panjang gelombang 460 nm jika dilarutkan dalam pelarut yang bersifat basa dan 540 nm jika berada dalam pelarut yang bersifat asam.
Perbedaan serapan panjang gelombang prodigiosin pada kedua sifat pelarut tersebut berkaitan dengan perubahan warna prodigiosin pada kondisi asam dan basa. Warna merah akan terjadi pada pelarut yang bersifat asam sedangkan pada pelarut yang bersifat basa, warna prodigiosin menjadi kekuningan.
Titik puncak yang lain juga dapat terdeteksi pada serapan panjang gelombang 494-496 nm baik pada pelarut bersifat basa dan asam dari prodigiosin pada media LB (Gambar 6). Begitu juga dari prodigiosin media NB, titik puncak lainnya terdeteksi pada panjang gelombang 502 dan 506 nm (Gambar 7). Hal ini menunjukkan bahwa pemurnian dengan kromatografi kolom masih belum mampu membersihkan prodigiosin dari senyawa metabolit lainnya.
Pelarut asam Pelarut basa
Pelarut basa Pelarut asam
Gambar 8 menunjukkan hasil analisis prodigiosin menggunakan kromatografi lapis tipis dengan silika gel yang dijalankan dengan pelarut amil asetat. Ada dua spot yang terdeteksi dengan nilai Rf 0.24 dan 0.82 cm pada media LB dan Rf 0.25 dan 0.83 cm pada Gambar 6 Grafik deteksi prodigiosin pada
media NB dengan spektrofotometer.
5
media NB. Spot merah dengan nilai Rf 0.82 dan 0.83 adalah prodigiosin.
14.1 cm 11.5 cm
13.8 cm 11.5 cm
Gambar 8 Visualisasi ekstrak prodigiosin dengan kromatografi lapis tipis.
Uji bioautografi dengan bakteri
Xanthomonas oryzae pv. oryzae telah dilakukan untuk memastikan bahwa spot merah pada nilai Rf 0.82 dan 0.83 adalah prodigiosin (Gambar 9). Hasil pengujian menunjukkan bahwa pertumbuhan bakteri hanya terhambat pada spot merah, tetapi tidak pada spot yang lain. Hal ini membuktikan bahwa spot merah yang mampu menghambat pertumbuhan X. oryzae pv. oryzae dengan nilai Rf 0.82 dan 0.83 adalah prodigiosin.
Gambar 9 Hasil uji bioautografi dengan bakteri Xanthomonas oryzae pv.
oryzae.
Respon S. marcescens terhadap antibiotik Tabel 3 menyajikan hasil pengujian beberapa antibiotik terhadap S. marcescens. Bakteri ini bersifat resisten terhadap hampir semua antibiotik yang diuji, kecuali streptomisin. Hal yang menarik adalah
meskipun S. marcescen mampu tumbuh pada media yang mengandung kloramfenikol, tetapi pigmentasinya terhambat (Gambar 10). Bahkan pigmentasi merah sudah tidak terjadi pada konsentrasi kloramfenikol 5 µg/ml (Gambar 11). Hal ini menjukkan bahwa antibiotik kloramfenikol dapat menghambat biosintesis prodigiosin.
Tabel 3 Hasil pengujian beberapa antibiotik terhadap S. marcescens
Antibiotik (50 g/ml)
Fenotipe Warna koloni
Kloramfenikol + Putih
Kasugamisin + Merah
Rimfamisin + Merah
Streptomisin - -
Ampisilin + Merah
Gambar 10 Hasil uji pengaruh antibiotik kloramfenikol terhadap produksi prodigiosin.
a b c d
Gambar 11 Hasil uji pengaruh kloramfenikol terhadap produksi prodigiosin pada konsentrasi (A) 0 µg/ml, (B) 2.5 µg/ml, (C) 5 µg/ml, (D) 10 µg/ml.
LB NB
6
PEMBAHASAN
Produksi prodigiosin tidak saja berbeda-beda antar strain S. marcescens, tetapi juga ditentukan oleh komposisi media dalam biakan (Pandey et al. 2009; Kim et al. 2009). Casullo de Araújo et al. (2010) telah berhasil menggunakan limbah buangan tepung kasava yang ditambahkan dengan manitol (2%) untuk menghasilkan prodigiosin hingga 49.5 mg/ml. Hasil prodigiosin ini lebih tinggi dibandingkan dengan menggunakan tepung kacang seperti dilaporkan oleh Giri et al.
(2004) yang hanya mencapai 39 mg/ml. Sedangkan hasil penelitian Jungdon et al. (2001) di dalam media cair yang mengandung
dextrose dan casein hanya menghasilkan 13 mg/ml prodigiosin.
Penelitian ini membandingkan produksi prodigiosin pada media LB dengan NB yang mengandung konsentrasi CaCO3 dan FeSO4
yang berbeda-beda. Kedua jenis media memiliki sumber nitrogen (N) dan karbon (C) yang berbeda. Sumber N dan C pada media LB berasal dari triptose dan ekstrak khamir serta ditambahkan dengan mineral NaCl sedangkan pada media NB menggunakan ektrak daging dan pepton.
Perbedaan produksi prodigiosin yang signifikan dalam media LB dan NB diduga berkaitan dengan perbedaan kandungan nutrisi pada kedua media tersebut. Media NB mengandung pepton dan ekstrak daging. Pepton berfungsi sebagai sumber nitrogen, sulfur, karbon, dan energi sedangkan ekstrak daging penting untuk memenuhi kebutuhan asam amino esensial, vitamin, koenzim, dan mineral dalam pertumbuhan bakteri. Pada media LB, sumber nitrogen, karbon, asam amino esensial, vitamin, koenzim, dan mineral dipenuhi dari ekstrak khamir dan triptose.
Nutrisi dalam media LB kaya dengan karbon yang bersumber dari tryptose,
sedangkan media NB kaya dengan nitrogen yang berasal dari ektrak daging dan pepton. Pada umumnya, pertumbuhan bakteri lebih cepat pada media dengan kandungan nitrogen yang tinggi. Hal ini yang menyebabkan produksi prodigiosin lebih tinggi pada media NB dibandingkan dengan media LB. Disamping itu, struktur prodigiosin yang mengandung nitrogen banyak juga membutuhkan sumber nitrogen yang lebih tinggi untuk proses biosintesisnya (Lampiran 4). Kebutuhan ini hanya dapat disuplai dari media yang banyak kandungan nitrogennya seperti yang terdapat pada media NB.
Hasil ini juga sesuai dengan yang diungkapkan oleh Venil dan Perumalsamy (2009) bahwa media NB merupakan salah satu media yang baik untuk produksi prodigiosin. Hal ini menunjukkan bahwa biosintesis progidiosin lebih tinggi pada media rendah nutrisi. Oleh karena itu, Casullo de Araújo et al. (2010) dan Giri et al. (2004) berhasil memproduksi prodigosin pada media yang cukup sederhana dengan masing-masing memanfaatkan limbah buangan tepung kasava dan tepung kacang. Harapan ke depannya adalah limbah tepung kasava yang banyak mengandung karbon dapat diteliti untuk dijadikan media standar dalam produksi prodigiosin.
Kemampuan bakteri menghasilkan prodigiosin semakin meningkat jika ada penambahan CaCO3 dan FeSO4. Hal ini
menunjukkan bahwa kedua mineral tersebut mempunyai peranan penting dalam biosintesis prodigiosin. Peran spesifik Fe2+ dalam biosintesis prodigiosin belum diketahui, tetapi penambahan Fe2+ hingga konsentrasi tertentu sangat diperlukan untuk memaksimalkan pertumbuhan sel mikroba. Keberadaan Fe2+ dalam media dapat menghasilkan prodigiosin yang larut dalam air. Sedangkan Ca2+ merupakan salah satu ion yang juga dapat digunakan untuk mempengaruhi pertumbuhan bakteri (Kim et al. 2004). Disamping itu, Ca2+ dan Fe2+ juga merupakan salah satu ion yang berperan sebagai kofaktor untuk membantu kerja enzim dalam biosintesis prodigiosin.
Media NB dengan FeSO4 merupakan
kombinasi terbaik untuk produksi prodigiosin dalam skala besar. Rata-rata konsentrasi tertinggi terdapat pada media NB dengan FeSO4 1 mM, yaitu 293,5 g/ml. Sedangkan
rata-rata konsentrasi terendah adalah 30
g/ml, terdapat pada media LB dengan CaCO3 10 mM dan FeSO4 0,25 mM.
7
Kromatogram hasil dari kromatografi lapis tipis digunakan dalam metode bioautografi. Metode ini bertujuan untuk menunjukkan adanya aktivitas antibakteri yang ditandai dengan terbentuknya daerah jernih yang tidak ditumbuhi oleh mikroba pada media (Kusumaningtyas et al. 2008). Hasil percobaan ini menunjukkan bahwa prodigiosin memang memiliki fungsi sebagai antibakteri yang terbukti dengan terbentuknya zona bening pada media yang sebelumnya sudah diinokulasikan dengan bakteri
Xanthomonas oryzae pv. oryzae.
Biosintesis prodigiosin ternyata terhambat oleh antibiotik kloramfenikol, tetapi bagaimana mekanisme penghambatannya belum diketahui. Kloramfenikol adalah antibiotik yang mempunyai aktivitas bakteriostatik dan pada dosis tinggi bersifat bakterisidal. Aktivitas antibakterisidalnya terjadi melalui penghambatan proses sintesis protein dengan menginaktifkan enzim peptidil transferase yang seharusnya berperan sebagai katalisator untuk membentuk ikatan peptida (Ganiswarna et al. 1995). Kemungkinan dengan terhambatnya sintesis protein tersebut, biosintesis propdigiosin akan terhambat.
SIMPULAN
Media terbaik yang bisa digunakan untuk produksi prodigiosin adalah media NB yang dikombinasikan dengan larutan FeSO4 1 mM.
Pada media ini diperoleh konsentrasi prodigiosin tertinggi, yaitu 293,5 g/ml. Sedangkan pada larutan CaCO3 konsentrasi
prodigiosin yang dihasilkan lebih sedikit, yaitu 165 g/ml. Prodigiosin yang murni dapat diperoleh melalui purifikasi dari prodigiosin menggunakan kromatografi lapis tipis dengan silika gel. Setelah dilakukan proses purifikasi diperoleh kemurnian tertinggi pada media NB, yaitu 92%.
Biosintesis prodigiosin terhambat oleh kloramfenikol. Hal ini diduga disebabkan oleh terhambatnya proses sintesis protein atau enzim yang berperan dalam biosintesis prodigiosin.
SARAN
Perlu penelitian lebih lanjut untuk produksi prodigiosin dalam skala besar dengan memanfaatkan bahan dasar media yang lebih