KERAGAMAN GENETIK TANAMAN KACANG BOGOR
(
Vigna subterranea
L. Verdc.)
IN VITRO
DAN
IN VIVO
BERDASARKAN MARKA SSR DAN SNAP
ZIKRIL ILLAHI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Keragaman Genetik Tanaman Kacang Bogor (Vigna subterranea L. Verdc.) in Vitro dan in Vivo
Berdasarkan Marka SSR dan SNAP adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Zikril Illahi
RINGKASAN
ZIKRIL ILLAHI. Keragaman Genetik Tanaman Kacang Bogor (Vigna subterranea L. Verdc.) in Vitro dan in Vivo Berdasarkan Marka SSR dan SNAP. Dibimbing oleh SUDARSONO dan NI MADE ARMINI WIENDI.
Kacang bogor atau bambara groundnut (Vigna subterranea (L.) Verdcourt) adalah salah satu tanaman legume yang belum terlalu banyak dibudidayakan dan dapat menjadi sumber pangan alternatif di Indonesia. Tujuan penelitian ini adalah mengembangkan metode kultur in vitro (organogenesis dan embriogenesis)
kacang bogor dan mempelajari keragaman planlet hasil kultur in vitro serta keragaman tanaman di lapang yang berasal dari daerah Sukabumi dan Sumedang. Penelitian ini dilakukan di Plant Molecular Biology Laboratorium (PMB-Lab), Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor, Bogor, Indonesia.
Penelitian terdiri atas tiga percobaan yang berkesinambungan yaitu 1) organogenesis dan embriogenesis somatik kacang bogor asal Sukabumi, 2) Analisis keragaman genetik tanaman in vitro dan in vivo menggunakan marka SSR, dan 3) Pengembangan marka SNAP berdasarkan sekuen gen Pto asal kacang bogor. Percobaan organogenesis terdiri atas induksi tunas dan proliferasi tunas dan akar secara in vitro. Percobaan embriogenesis terdiri atas induksi kalus, proliferasi kalus dan regenerasi kalus menjadi embrio somatik. Analisis keragaman genetik tanaman in vitro dan in vivo dilakukan dengan menggunakan marka SSR. Pengembangan marka SNAP terdiri atas identifikasi situs SNP, desain primer SNAP dan evaluasi untuk menghasilkan marka SNAP.
Hasil penelitian ini menunjukkan bahwa induksi tunas dipengaruhi oleh interaksi antara media perlakuan dengan jenis eksplan axis yang digunakan. Media yang optimal untuk induksi perakaran secara in vitro adalah kombinasi antara 2.0 mg L-1 BAP dengan 0.1 mg L-1 NAA pada media dasar MSVitB5 dengan persentase akar yang dihasilkan sebesar 83.33%. Media yang optimal untuk induksi kalus adalah media yang mengandung 5 mg L-1 2,4-D (96.67%) dan picloram 3 mg L-1 (88.33%) dan eksplan terbaik adalah daun muda. Tingkat proliferasi kalus lebih tinggi pada media yang mengandung picloram daripada media yang mengandung 2,4-D. Media yang optimal untuk induksi embrio somatik fase globular adalah 0.1 mg L-1 picloram. Bagaimanapun, pada percobaan ini embrio somatik fase hati, fase torpedo, dan fase kotiledon belum berhasil diregenerasikan.
Hasil pengembangan marka SNAP berdasarkan sekuen gen Pto kacang bogor berhasil mengidentifikasi 22 lokus SNP dan menghasilkan enam pasang primer SNAP. Primer SNAP dievaluasi dengan menggunakan PCR pada 80 individu tetua dan 47 individu progeni. Produk amplifikasi dihailkan dari lima pasang primer SNAP sedangkan satu primer SNAP tidak menghasilkan produk amplifikasi. Hasil analisis primer SNAP menunjukkan bahwa evaluasi sampel kacang bogor memiliki kombinasi alel heterozigot untuk empat lokus SNP (SNP_78; SNP_378; SNP_481 dan SNP_510) dan satu lokus memiliki kombinasi alel homozigot (SNP_502).
SUMMARY
ZIKRIL ILLAHI. Genetic Diversity of the Bambara Groundnut (Vigna subterranea L. Verdc.) in Vitro and in Vivo Based on SSR and SNAP Markers. Supervised by SUDARSONO and NI MADE ARMINI WIENDI.
Bambara groundnut (Vigna subterranea (L.) Verdcourt) can be used an alternative food and an important under-utilized legume crop in Indonesia. The objectives of this study were to develop a method of in vitro culture of Bambara groundnut (organogenesis and somatic embryogenesis) and evaluate the genetic diversity of in vitro derived plantlets and field grown plants from Sukabumi and Sumedang, West Java, Indoesia. This research was conducted at the Plant Molecular Biology Laboratory (PMB-Lab), Department of Agronomy and Horticulture, Faculty of Agriculture, Bogor Agricultural University, Bogor, Indonesia.
The research covers three main activities, such as: 1) regeneration of plants through organogenesis and somatic embryogenesis, 2) genetic diversity analysis of in vitro and in vivo plants using SSR markers, and 3) the development and analysis of SNAP marker based on Pto gene sequences. Organogenesis experiment consists of shoot induction and in vitro shoots and roots proliferation. Embryogenesis experiment consists of callus induction, callus proliferation and regeneration into somatic embryos. Genetic diversity analysis of in vitro and in vivo plants were done using SSR markers. SNAP markers development consists of the SNP site identification, SNAP primer design and evaluation to produce SNAP markers.
The result of this study showed that shoots induction was affected by interaction between medium and the axis explant type used. The optimal medium for rooting induction is combination between 2.0 mg L-1 BAP with 0.1 mg L-1 NAA in MSVitB5 medium with roots percentage produced 83.33% . The best medium for callus induction is a medium containing 5 mg L-1 2,4-D (96.67%) and 3 mg L-1 picloram (88.33%) andthe best explant is young leaf. The level callus proliferation was higher at picloram containing medium than that of 2,4-D. The best medium for induction somatic embryos of globular shape is 0.1 mg L-1 picloram. However, in this experiment, heart shape, torpedo shape and cotyledonary stage somatic embyo have not been succesfully regenerated.
Genetic diversity analysis of in vitro and in vivo Bambara groundnut by using five SSR primer showed the gene diversity (HE) is very low (0.119).
BamCo80 locus is the informative primer, capable of detecting three alleles and the having the highest PIC value (0.453). Genetic diversity of sample from Sumedang region was higher (0.113-0.119) than that of Sukabumi regions (0.000-0.050). Grouping of samples based on genetic distance using Darwin software divides into two main groups which fit to the origin of the sample. This result is also in line with the reverts of the analysis using Structure software.
showed that the evaluated Bambara groundnut samples have heterozygous allele combinations for the four SNP loci (SNP_78, SNP_378, SNP_481 and SNP_510) and one locus homozygous (SNP_502).
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
KERAGAMAN GENETIK TANAMAN KACANG BOGOR
(
Vigna subterranea
L. Verdc.)
IN VITRO
DAN
IN VIVO
BERDASARKAN MARKA SSR DAN SNAP
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2013 ini ialah kultur in vitro dan molekuler, dengan judul Keragaman Genetik Tanaman Kacang Bogor (Vigna subterranea L. Verdc.) in Vitro dan in Vivo Menggunakan Marka SSR dan SNAP. Penulisan tesis ini dilakukan sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Pemuliaan dan Bioteknologi Tanaman, Sekolah Pascasarjana Institut Pertanian Bogor.
Ucapan terima kasih dan penghargaan yang setinggi-tingginya penulis sampaikan kepada:
1. Prof Dr Ir Sudarsono, MSc dan Dr Ir Ni Made Armini Wiendi, MS selaku komisi pembimbing yang telah memberikan arahan dan bimbingan sejak perencanaan, pelaksanaan sampai penyelesaian penyusunan tesis ini.
2. Dr Desta Wirnas, SP MSi selaku dosen penguji luar komisi ujian tesis dan Dr Dewi Sukma, SP MSi selaku wakil Program Studi Pemuliaan dan Bioteknologi Tanaman atas saran dan masukannya.
3. Dr Ir Yudiwanti Wahyu EK, MS selaku ketua Program Studi Pemuliaan dan Bioteknologi Tanaman atas saran dan masukannya.
4. Ayahanda (Yurdanis) dan ibunda (Yulinar) serta kakak-kakak (Fevi Yetmi, SPt, Ratna Yulita, SS dan Sri Maria, SP) dan adik (Hayatul Rahmi, SSi MSi) atas doa dan motivasinya.
5. Fitria Lukita, SP atas motivasi dan bantuannya selama pelaksanaan penelitian di lapang dan laboratorium.
6. Seluruh civitas akademika Fakultas Pertanian Institut Pertanian Bogor, khususnya para dosen Program Studi Pemuliaan dan Bioteknologi Tanaman IPB yang telah mencurahkan ilmunya kepada kami.
7. Keluarga besar PMB-Lab; Dr Ir Ismail Maskromo, MSi; Mba Susilawati; Mas Agus; Fetrina Oktavia, SSi MSi; Anneke Pesik, SP MSi beserta Pieter Agusthinus Riupassa, SSi MSi; dan Ir Megayani Sri Rahayu, MS beserta Dr Ir Asep Setiawan, MS yang telah banyak membantu, memberikan saran dan motivasi dalam pelaksanaan penelitian dan penyusunan tesis ini.
8. Keluarga besar PBT angkatan 2012 atas bantuan dan motivasinya.
9. Seluruh teman-teman yang tidak bisa penulis sebutkan namanya satu persatu. Terima kasih atas dukungan dan doanya.
Semoga karya ilmiah ini dapat bermanfaat bagi pengembangan ilmu pengetahuan dan ilmu pertanian masa depan.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN x
1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Tujuan Penelitian 3
1.3 Manfaat Penelitian 4
1.4 Ruang Lingkup Penelitian 4
2 TINJAUAN PUSTAKA
2.1 Sejarah Kacang Bogor 10
2.2 Morfologi, Budidaya dan Manfaat Kacang Bogor 10
2.3 Kultur In vitro Kacang Bogor 12
2.4 Zat Pengatur Tumbuh 12
2.5 Keragaman Genetik Kacang Bogor 13
2.6 Marka Molekuler 15
2.7 Gen Pto 16
3 ORGANOGENESIS DAN EMBRIOGENESIS KACANG BOGOR (Vigna subterranea L. Verdc.) ASAL SUKABUMI
Abstrak 20
3.1 Pendahuluan 22
3.2 Bahan dan Metode 24
3.3 Hasil dan Pembahasan 26
3.4 Kesimpulan 33
Daftar Pustaka 33
4 KERAGAMAN GENETIK KACANG BOGOR (Vigna subterranea
L. Verdc.) BERDASARKAN MARKA SSR
Abstrak 37
4.1 Pendahuluan 39
4.2 Bahan dan Metode 40
4.3 Hasil dan Pembahasan 41
4.4 Kesimpulan 46
Daftar Pustaka 46
5 PENGEMBANGAN MARKA SNAP BERDASARKAN SEKUEN GEN PTO ASAL KACANG BOGOR
Abstrak 49
5.1 Pendahuluan 51
5.3 Hasil dan Pembahasan 54
5.4 Kesimpulan 61
Daftar Pustaka 61
6 PEMBAHASAN UMUM 64
DAFTAR PUSTAKA 66
LAMPIRAN 76
DAFTAR TABEL
3.1 Respon pertumbuhan kacang bogor secara inVitro 27 3.2 Pengaruh BAP dan NAA terhadap persentase tunas berakar pada
kultur in Vitro kacang bogor (8 MST) 30
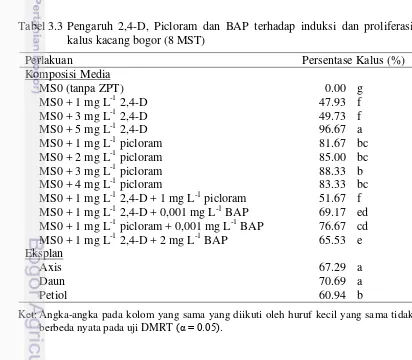
3.3 Pengaruh 2,4-D, Picloram dan BAP terhadap induksi dan proliferasi
kalus kacang bogor (8 MST) 31
4.1 Sekuen primer SSR yang digunakan untuk mengamplifikasi DNA
genom kacang bogor 41
4.2 Hasil analisis Cervus 2.0 terhadap 130 sampel kacang bogor
berdasarkan 5 lokus SSR 42
5.1 Persentase basa nitrogen pada gen Pto asal kacang bogor 55 5.2 Hasil penelusuran tingkat kemiripan antara Pto-like kinase pada
kacang bogor dengan sejumlah aksesi tanaman dari GenBank
menggunakan algoritma Blast Protein 55
5.3 Karakter dari 22 SNP yang diidentifikasi pada sekuen gen Pto
kacang bogor 58
5.4 Primer SNAP terpilih dari 6 posisi SNP berdasarkan fragmen gen
Pto asal kacang bogor 59
5.5 Data genotipe hasil konversi dari elektroferogram produk PCR
menggunakan primer SNAP berbasis gen Pto kacang bogor 60
DAFTAR GAMBAR
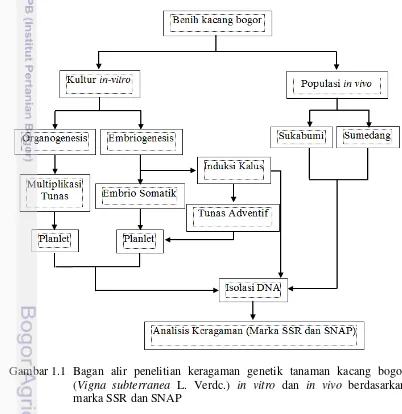
1.1 Bagan alir penelitian keragaman genetik tanaman kacang bogor (Vigna subterranea L. Verdc.) in vitro dan in vivo berdasarkan
marka SSR dan SNAP 5
2.1 Morfologi tanaman kacang bogor (Vigna subterranea L. Verdc.) 11 2.2 Keragaman morfologi biji kacang bogor (Vigna subterranea L.
Verdc.) asal Sukabumi dan Sumedang 13
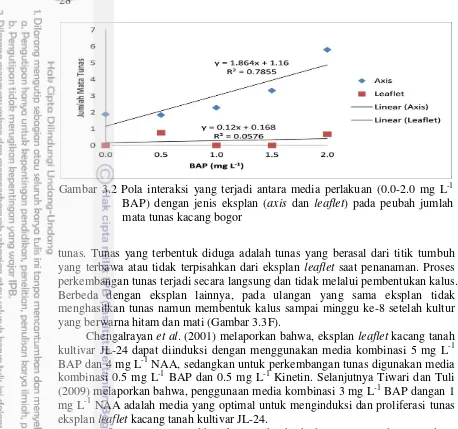
3.1 Bagian biji kacang bogor yang dijadikan eksplan 24 3.2 Pola interaski yang terjadi antara media perlakuan (0.0-2.0 mg L-1
BAP) dengan jenis eksplan (axis dan leaflet) pada peubah jumlah
mata tunas kacang bogor 28
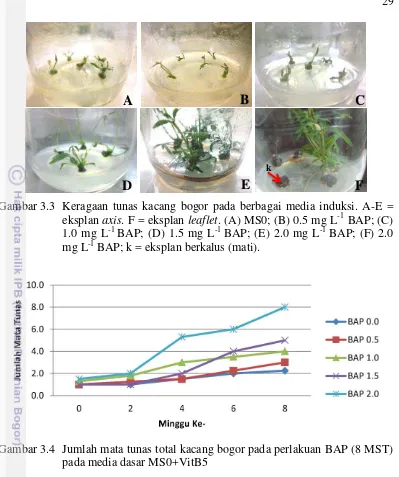
3.3 Keragaan tunas kacang bogor pada berbagai media induksi 29 3.4 Jumlah mata tunas total kacang bogor pada perlakuan BAP 29 3.5 Keragaan akar kacang bogor pada media induksi perakaran secara in
Vitro 30
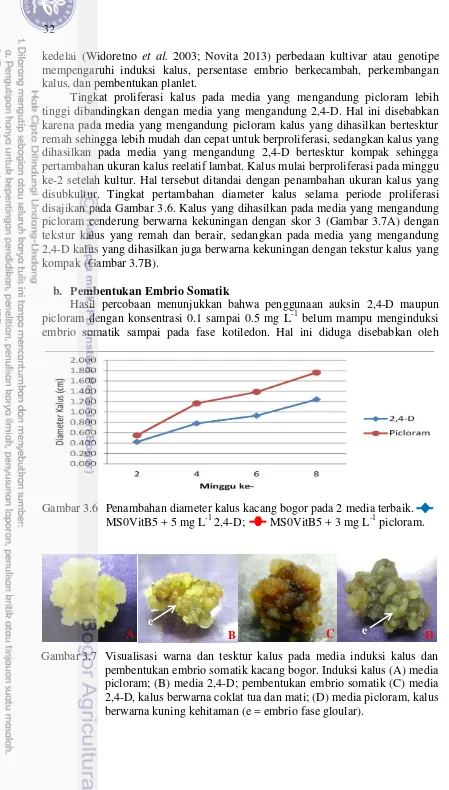
3.6 Penambahan diameter kalus kacang bogor pada 2 media induksi
terbaik 32
3.7 Visualisasi warna dan tesktur kalus pada media induksi kalus dan
media pembentukan embrio somatik kacang bogor 32
4.1 Tingkat heterozigositas populasi kacang bogor 43 4.2 Visualisasi poliakrilamid gel elektroforesis vertikal sampel kacang
4.3 Jarak genetik kacang bogor berdasarkan Principal Coordinate
Analysis (PCoA) 44
4.4 Pohon filogenetik perwakilan sampel kacang bogor berdasarkan jarak genetik menggunakan metode Tree Construction-Neighbor
Joining pada software DARwin versi 6.0.8 44 4.5 Pohon filogenetik perwakilan sampel kacang bogor menggunakan
metode SimQual pada software NTSys versi 2.02 45 4.6 Struktur populasi kacang bogor asal Sukabumi dan Sumedang. 46 5.1 Visualisasi produk PCR hasil amplifikasi primer Pto pada genom
kacang bogor 54
5.2 Visualisasi pembacaan runutan DNA hasil sekuensing dengan software DNASTAR untuk sampel kacang bogor aksesi
KR261569.1 (SKC14) 54
5.3 Runutan basa dan prediksi runutan asam amino dari DNA genom
kacang bogor aksesi KR261570.1 (SKH3) sepanjang 555 pb 56 5.4 Posisi conserve region runutan asam amino fragmen gen Pto asal
kacang bogor pada gen Pto-like kinase pembanding asal GenBank 57 5.5 Dendogram hasil pensejajaran conserve region runutan asam amino
fragmen gen Pto kacang bogor dengan aksesi pembanding dari
GenBank 57
5.6 Representasi situs SNP pada fragmen gen Pto kacang bogor 58 5.7 Visualisasi produk PCR hasil amplifikasi genom kacang bogor
menggunakan empat pasang primer SNAP 60
5.8 Visualisasi produk PCR hasil amplifikasi genom kacang bogor
menggunakan 2 pasang primer SNAP 60
DAFTAR LAMPIRAN
1 Komposisi media Murashige and Skoog dan media Gamborg 76 2 Prosedur isolasi DNA berdasarkan metode CTAB (Doyle & Doyle
1987) yang dimodifikasi oleh Das et al. (2009) 77
3 Prosedur pembuatan larutan stok 78
4 Prosedur running plate SSR 80
1
PENDAHULUAN
1.1 Latar Belakang
Kacang bogor atau bambara groundnut (Vigna subterranea L. Verdcourt) adalah salah satu tanaman kacang-kacangan yang belum terlalu banyak dibudidayakan di Indonesia. Tanaman ini berasal dari daerah Bambara di kawasan Afrika Barat yang telah menyebar di kawasan Asia seperti Indonesia, Malaysia, Philiphina dan Thailand. Berbeda dengan tanaman legume pada umumnya, kacang bogor lebih adaptif dan toleran pada daerah yang kurang subur (Linnemann 1990; Stephens 2003). Produksi tanaman cukup baik pada tanah yang miskin hara dengan curah hujan yang rendah, yaitu 0.5 sampai 0.8 ton ha-1. Tanaman ini dapat tumbuh tanpa pupuk kimia serta dapat tumbuh baik pada tanah masam di Afrika, namun kurang baik pada tanah berkapur (Mkandawire 2007). Tanaman ini mampu menghasilkan 4 ton ha-1 biji kering pada kondisi lingkungan tumbuh yang optimal (Madamba 1997; Kouassi dan Zoro 2010).
Kacang bogor berpotensi menjadi bahan pangan alternatif di Indonesia sebagai sumber protein dan karbohidrat. Biji kering kacang bogor mengandung 19% protein, 63% karbohidrat dan 6.5% lemak (Amarteifio dan Moholo 1998; Brough dan Azam-Ali 1992; Ijarotimi dan Esho 2009), serta mengandung zat besi 59 mg, kalium 1240 mg, posfor 296 mg, sodium 3.7 mg dan kalsium 78 mg (Amarteifio dan Moholo 1998). Kandungan proteinnya tinggi, mengandung asam amino esensial lysine (6.8%) dan methionine (1.3%) (Brough et al. 1993; Ellah dan Singh 2008; Okpuzor et al. 2010).
Polong muda biasanya dikonsumsi dengan cara direbus, sedangkan biji kering biasanya diproses dahulu menjadi tepung dan sebagai bahan utama pembuatan susu di Harare (Hampson et al. 2000). Kacang bogor telah lama beradaptasi dengan baik di Indonesia seperti di daerah Sukabumi, Majalengka, Tasikmalaya, Bandung, Jawa Tengah (Pati dan Kudus), Jawa Timur (Gresik), Lampung, NTB dan NTT (Kuswanto et al. 2012).
Budidaya kacang bogor yang dilakukan di sentra produksi di Indonesia masih menggunakan populasi campuran dengan kulit biji berwarna hitam, merah, dan krem. Redjeki (2003) melaporkan bahwa seleksi galur murni berdasarkan warna biji (krem, merah dan hitam) tidak berpengaruh nyata terhadap hasil tanaman kacang bogor. Populasi campuran menghasilkan biji kering 2 ton ha-1, populasi hitam 0.9 ton ha-1, sedangkan populasi merah dan krem menghasilkan 1 ton ha-1. Selanjutnya Redjeki (2007) melaporkan bahwa galur kacang bogor asal Bogor menghasilkan jumlah polong per tanaman, bobot basah dan bobot kering polong, serta bobot kering 100 biji secara nyata lebih tinggi dari pada galur asal Gresik.
2
keragaman genetik kacang bogor asal Indonesia (Bandung dan Gresik) sangat rendah berdasarkan marka SSR.
Peningkatan keragaman genetik tanaman dapat dicapai dengan berbagai teknik seperti rekombinasi genetik melalui persilangan, seleksi, induksi mutasi dan pendekatan bioteknologi yang tepat (Adu-Dapaah dan Sangwan 2004). Salah satu penerapan teknik tersebut adalah melalui teknik kultur jaringan tanaman. Teknik ini dapat menjadi alternatif untuk menjawab berbagai permasalahan diatas. Penggunaan teknik ini sangat tergantung pada keberhasilan sistem regenerasi tanaman melalui teknik kultur in vitro. Dalam jangka panjang, perbanyakan tanaman secara in vitro diharapkan dapat membantu mengatasi masalah sistem regenerasi tanaman.
Kultur in vitro dapat dilakukan melalui dua cara yaitu secara organogenesis dan embriogenesis. Informasi tentang kultur in vitro kacang bogor sampai sekarang ini masih sedikit. Perbanyakan tanaman kacang bogor secara organogenesis baru dilaporkan oleh Lacroix et al. (2003); Kone et al. (2007); Mongomake et al. (2009); dan Konate et al. (2013). Namun masih banyak terdapat permasalahan, antara lain tingkat multiplikasi tunas yang relatif rendah dan sulitnya meregenerasikan kalus menjadi planlet.
Selain perbanyakan melalui organogenesis, perbanyakan secara embriogenesis juga dapat dilakukan. Berbagai publikasi telah melaporkan bahwa embriogenesis dapat dihasilkan dari jaringan somatik seperti daun dan batang. Embriogenesis somatik pada beberapa eksplan tanaman dapat terjadi secara langsung maupun tidak langsung seperti pada tanaman vinca (Hashemloian et al.
2008), kopi arabika (Gatica et al. 2008), dan gandum (Eudes et al. 2003). Penelitian embriogenesis somatik pada tanaman legume telah dilaporkan oleh Baker et al. (1995), Sinaga (1998), Chengalrayan et al. (2001), Widoretno et al.
(2003), Zuyasna (2004),Edy dan Pujisiswanto (2008), Joshi et al. (2008), Naz et al. (2008), dan Novita (2013). Laporan penelitian maupun publikasi ilmiah tentang embriogenesis somatik pada tanaman kacang bogor belum ada, oleh karena itu perlu dilakukan penelitian untuk mendapatkan metode mikropropagasi kacang bogor secara organogenesis maupun embriogenesis somatik.
Kelebihan kultur in vitro adalah 1) mendapatkan tanaman yang seragam secara genetik melalui sistem organogenesis dan 2) memunculkan variasi atau keragaman melalui induksi mutasi. Variasi atau keragaman yang muncul diharapkan dapat memberikan keuntungan (sifat unggul baru) yang dapat diwariskan pada keturunannya. Keseragaman maupun keragaman genetik yang dihasilkan pada kultur in vitro melalui organogenesis dan embriogenesis dapat diuji secara morfologi serta menggunakan marka molekuler. Penggunaan marka molekuler tidak hanya dapat mendeteksi keseragaman pada tanaman hasil kultur
in vitro, tetapi juga dapat mendeteksi keragaman genetik tanaman di lapang. Dewasa ini, banyak marka molekuler yang dapat digunakan sebagai pendeteksi tingkat keragaman genetik dan jarak genetik suatu tanaman, salah satunya adalah marka molekuler Simple Sequence Repeat (SSR).
Pemanfaatan marka SSR untuk mengidentifikasi keragaman genetik telah banyak dilakukan pada berbagai jenis tanaman baik tanaman monokotil maupun dikotil seperti pada tanaman kedelai (Priolli et al. 2002); teh (Freeman et al.
3 SSR pada tanaman kacang bogor telah dilakukan oleh Basu et al. (2007); Somta et al. (2011); Molosiwa (2012); dan Siise dan Massawe (2012). Marka SSR memiliki keuntungan antara lain tingkat polimorfisme yang tinggi, lokus yang spesifik, hanya membutuhkan sedikit DNA, tersebar pada genom, tingkat keterulangan yang tinggi dan mudah diperbanyak, dan yang terpenting bersifat co-dominan (Kalia et al. 2011). Dengan berbagai kelebihan yang dimiliki, maka marka SSR sangat potensial untuk dikembangkan sebagai marka molekuler terutama untuk keperluan identifikasi dan studi keragaman genetik.
Perkembangan marka molekuler dewasa ini sangat pesat terutama untuk kepentingan studi keragaman, identifikasi dan seleksi suatu karakter. Marka molekuler yang berkembang saat ini adalah Single nucleotide polymorphism
(SNP). SNP adalah polimorfisme yang disebabkan oleh proses substitusi satu basa pada nukleotida dalam genom tanaman. Pengembangan marka SNP ini sangat tergantung dari keberadaan situs SNP dari genom tanaman. Penyebaran SNP pada genom tanaman berpotensi untuk digunakan sebagai marka molekuler (Gupta et al. 2001).
SNP yang terdapat pada gen fungsional (coding region) mendapat perhatian khusus karena secara langsung berhubungan dengan sifat yang diekspresikan oleh gen yang bersangkutan, oleh karena itu marka SNP dibuat berdasarkan sekuen dari expresses sequence tags (ESTs) (Shu et al. 2010). SNP yang ditemukan pada
coding region dibagi menjadi 2, yaitu yang bersifat non-synonymous yang bisa merubah asam amino, dan synonymous yang tidak merubah asam amino (Sunyaev
et al. 2001).
Salah satu gen fungsional yang dapat digunakan dalam pengembangan marka SNAP adalah gen ketahanan. Prinsip dari mekanisme yang berhubungan dengan pertahanan tanaman terhadap patogen disebut dengan konsep gene-for-gene. Mekanisme ketahanan tersebut melibatkan interaksi molekuler secara langsung maupun tidak langsung antara produk gen avirulence (avr) sebagai elisitor dengan produk gen ketahanan (R gene) (Dangl dan Jones 2001). Salah satu gen yang terdapat dalam lintasan ekspresi R gene adalah gen Pto. Gen Pto telah banyak dipelajari pada berbagai tanaman sebagai gen ketahanan. Gen Pto
berinteraksi secara langsung dengan masing-masing patogen penyebab serangan penyakit (Wu et al. 2004). Kelebihan dari gen Pto adalah dapat ditemukan pada berbagai jenis tanaman dengan tingkat kesamaan yang tinggi.
1.2 Tujuan Penelitian
Penelitian ini secara umum bertujuan mengembangkan metode kultur in vitro (organogenesis dan embriogenesis) kacang bogor dan mempelajari keragaman planlet hasil kultur in vitro sehingga diharapkan dapat membantu program pemuliaan tanaman terutama dari segi perbaikan genetik tanaman kacang bogor.
Adapun tujuan khusus dari penelitian ini adalah:
4
b. Memperoleh informasi keragaman genetik tanaman kultur in vitro dan in vivo
dengan menggunakan marka SSR dan SNAP.
1.3 Manfaat Penelitian
1. Memperoleh protokol dan metode untuk menginduksi organogenesis dan embriogenesis pada kacang bogor,
2. Memperoleh informasi keragaman genetik kacang bogor berdasarkan marka SSR dan SNAP.
1.4 Ruang Lingkup Penelitian
Informasi tentang kacang bogor yang didapatkan baik dari hasil-hasil penelitian dalam bentuk publikasi maupun buku primer menjadi acuan dalam pelaksanaan penelitian ini. Tanaman kacang bogor merupakan tanaman hasil introduksi dari Afrika yang memiliki berbagai potensi dan keunggulan untuk dikembangkan namun tanaman ini belum banyak dikenal oleh masyarakat Indonesia. Tanaman ini berpeluang dapat meningkatkan pendapatan petani, namun produktivitas tanaman ini masih tergolong rendah, tingkat ketahanan terhadap serangan hama dan penyakit yang masih rendah serta belum adanya benih unggul. Hal inilah yang menjadi kendala dalam pengembangan tanaman kacang bogor secara luas di Indonesia.
Tersedianya informasi keragaman genetik tanaman kacang bogor menjadi penting untuk diketahui dalam upaya perakitan kultivar maupun varietas unggul nantinya. Sistem perbanyakan tanaman dalam menghasilkan benih-benih unggul dapat dilakukan melalui metode konvensional maupun melalui rekayasa genetika. Ketersediaan informasi tentang keanekaragaman kacang bogor di Indonesia masih terbatas sekali disebabkan karena masih banyak para peneliti yang belum mengenal kacang bogor dan kurangnya minat untuk menjadikan tanaman ini sebagai objek penelitian. Perkembangan penelitian tentang kacang bogor yang ada di Indonesia saat ini masih dalam proses menghasilkan galur-galur murni yang berdaya hasil tinggi namun belum ada laporan maupun penelitian lebih jauh tentang respon tanaman kacang bogor terhadap ketahanan penyakit.
Penelitian ini terdiri atas dua aspek yaitu teknik kultur in vitro dan teknik marka molekuler. Percobaan pertama dilakukan untuk mendapatkan media yang optimal untuk induksi dan proliferasi tunas, serta induksi perakaran kacang bogor secara in vitro. Hal ini akan sangat membantu proses perbanyakan bibit secara masal dalam waktu yang relatif cepat dibandingkan dengan waktu yang yang dibutuhkan untuk mendapatkan benih secara konvensional. Perbanyakan secara in vitro hanya memerlukan waktu sekitar 8-10 minggu setelah tanam sedangkan perbanyakan secara konvensional memerlukan waktu sekitar 16-18 minggu setelah tanam. Tingkat keberhasilan kultur in vitro sangat dipengaruhi oleh jenis eksplan yang digunakan.
5 yaitu melalui transformasi genetik. Tersedianya protokol yang stabil dan dapat diandalkan dalam regenerasi kalus-kalus embriogenik merupakan syarat mutlak dalam melakukan metode rekayasa genetik. Percobaan kedua dilakukan untuk mendapatkan media yang optimal untuk induksi dan proliferasi kalus embriogenik serta regenerasi embrio somatik menjadi planlet.
Perbanyakan klonal secara in vitro, diuji dengan menggunakan marka molekuler dengan tujuan untuk memperoleh informasi tingkat keseragaman genetik planlet kacang bogor yang dihasilkan secara in vitro melalui sistem organogenesis dan memperoleh informasi keragaman genetik tanaman kacang bogor in vivo berdasarkan marka SSR. Hasil percobaan ini menjadi informasi dasar yang dapat dipertimbangkan oleh pemulia kacang bogor dalam mengembangkan galur-galur kacang bogor yang ada saat ini. Pemilihan bahan perbanyakan dalam perakitan varietas unggul sangat bergantung kepada jarak genetik yang dimiliki masing-masing galur.
Salah satu kelebihan kultivar unggul kacang bogor yang diharapkan nantinya adalah tahan terhadap serangan hama dan penyakit. Berbagai literatur menyatakan bahwa tanaman ini adaptif dan toleran tehadap kekeringan, namun belum ada laporan mengenai tingkat ketahanan kacang bogor terhadap penyakit.
6
Berdasarkan hasil penanaman kacang bogor (1 biji per pot) yang dilakukan di kampus IPB-Dramaga, ditemukan beberapa tanaman yang rentan terhadap serangan penyakit disaat musim hujan. Hal ini menunjukkan bahwa kacang bogor memiliki tingkat ketahanan terhadap penyakit yang berbeda-beda walaupun warna biji dan asalnya sama. Ketahanan terhadap penyakit merupakan suatu karakter penting yang perlu dipelajari lebih lanjut karena ini merupaka karakter yang mempengaruhi produktivitas tanaman. Salah satu gen yang terlibat dalam lintasan ekspresi gen ketahanan terhadap penyakit adalah gen Pto. Percobaan keempat dilakukan dengan tujuan untuk mengembangankan marka SNAP berdasarkan sekuen gen Pto asal kacang bogor. Diagram alir kegiatan penelitian disajikan pada Gambar 1.1.
Daftar Pustaka
Adu-Dapaah HK, Sangwan RS. 2004. Improving bambara groundnut productivity using gamma irradiation and in vitro techniques. African Journal of Biotechnology. 3(5):260-265.
Amarteifio JO, Moholo D. 1998. The chemical composition of four legumes consumed in Botswana. Journal of Food Composition and Analysis.
11(4):329-332.
Baker CM, Durham RE, Burns JA, Parrott WA, Wetzstein HY. 1995. High frequency somatic embryogenesis in peanut (Arachis hypogaea L.) using mature, dry seed. Plant Cell Reports. 15(1):38-42.
Basu S, Roberts JA, Azam-Ali SN, Mayes S. 2007. Bambara groundnut. Di dalam: Kole C, editor. Genome Mapping and Molecular Breeding in Plants.
Volume 3: Pulses, Sugar and Tuber Crops. Pennsylvania State University (US): Springer Verlag Berlin Heidelberg. hlm 159-173.
Brough SH, Azam-Ali SN. 1992. The effect of soil moisture on the proximate composition of bambara groundnut (Vigna subterranea (L.) Verdc.).
Journal of the Science of Food and Agriculture. 60(2):197-203.
Brough SH, Taylo, AJ, Azam-Ali SN. 1993. The potential of bambara groundnut (Vigna subterranea) in vegetable milk production and basic protein functionality systems. Food Chem. 47(3):277-283.
Chengalrayan K, Hazra S, Gallo-Meagher M. 2001. Histological analysis of somatic embryogenesis and organogenesis induced from mature zygotic embryo-derived leaflets of peanut (Arachis hypogaea L.). Plant Science.
161(3):415-421.
Dangl JL, Jones JDG. 2001. Plant pathogens and integrated defence responses to infection. Nature. 411(6839):826-833.
Edy A, Pujisiswanto H. 2008. Pengaruh 2,4-D terhadap induksi embrio somatik eksplan leaflet pada beberapa varietas kacang tanah (Arachis hipogeae L.) secara in vitro. Seminar Nasional Sains dan Teknologi-II. 2008, November 17-18: Univ Lampung (ID). hal 41-50.
7 Eudes F, Acharya S, Laroche A, Selinger LB, Cheng KJ. 2003. A novel method to induce direct somatic embryogenesis, secondary embryogenesis and regeneration of fertile green cereal plants. Plant Cell Tissue dan Organ Cult. 73(2):147-157.
Freeman S, West J, James C, Lea V, Mayes S. 2004. Isolation and characterization of highly polymorfic microsatellites in tea (Camellia sinensis). Mol Ecol. 4(3):324-326.
Gatica AM, Arrieta G, Espinoza AM. 2008. Direct somatic embryogenesis in
Coffea arabica L cvs Caturra dan Catuai : Effect of triacontanol, light condition and medium consistency. Agronomia Costaricense. 32(1):139-147.
Gupta PK, Roy JK, Prasad M. 2001. Single nucleotide polymorphisms: A new paradigm for molecular marker technology and DNA polymorphism detection with emphasis on their use in plants. Current Sci. 80(4):524-535. Hampson K, Azam-Ali SH, Sesay A, Mukwaya SM, Azam-Ali SN. 2000.
Assessing opportunities for increased utilisation of bambara groundnut in southern africa. Loughborough (UK): University of Nottingham. 67 hlm. Hashemloian BD, Azimi AA, Majid A, Ebrahimzadeh H. 2008. Abnormal
plantlets regeneration through direct somatic embryogenesis on immature seeds of Vinca herbacea Waldst dan Kit. African J. Biotech. 7(11):179-183. Ijarotimi OS, Esho TR. 2009. Comparison of nutritional composition and anti-nutrient status of fermented, germinated and roasted bambara groundnut seeds (Vigna subterranea L. Verdc.). British Food Journal. 111(4):376-386. Joshi M, Sujatha K, Harza S. 2008. Effect of TDZ and 2,4-D on peaut somatic embryogenesis and in vitro bud development. Plant Cell Tiss Organ Cult. 94(1):85-90.
Kacar YA, Lezzoni A, Cetiner S. 2005. Sweetcherry cultivar identification by using SSR markers. J. of Biosci. 5(5):616-619.
Kalia RK, Rai MK, Kalia S, Singh R, Dhawan AK. 2011. Microsatellite markers: an overview of the recent progress in plants. Euphytica. 177(3):309-334. Konate S, Kone M, Kouakou HT, Kouadio JY, Zouzou M. 2013. Callus induction
and proliferation from cotyledon explants in bambara groundnut. African Crop Science Journal. 21(3):255-263.
Kone M, Patat-Ochatt EM, Conreux C, Sangwan RS, Ochatt SJ. 2007. In vitro
morphogenesis from cotyledon and epicotyl explants and flow cytometry distinction between landraces of Bambara groundnut (Vigna subterranea
(L.) Verdc.), an under-utilised grain legume. Plant Cell Tissue Organ Culture. 88(1):61-75.
Kouassi NJ, Zoro BIA. 2010. Effect of sowing density and seedbed typed on yield and yield components in bambara groundnut (Vigna subterranea) in woodland savannas of Côte d’Ivore. Experimental Agriculture. 46(1):99-110.
8
Lacroix B, Assoumou Y, Sangwan RS. 2003. Efficient in vitro direct shoot organogenesis of fertile plants from embryo explants of Bambara groundnut (Vigna subterranea (L.) Verdc.). Plant Cell Report. 21(12):1153-1158. Linnemann AR. 1990. Cultivation of bambara groundnut (Vigna subterranea L.
Verdc.) in western province, zambia: report of a field study. Tropical Crops Communication. 16 hlm.
Madamba R. 1997. Breeding bambara groundnut varieties suitable for zimbabwean conditions. Didalam: Heller J, Begemann F, Mushonga J, editor. Promoting the conservation and use of underutilized and neglected crops. 9.Proceedings of the workshop on Conservation and Improvement of Bambara Groundnut (Vigna subterranea (L.) Verdc.); 1995 November 14-16; Harare, Zimbabwe. Roma, Italia (IT): International Plant Genetic
Mkandawire CH. 2007. Review of bambara groundnut production in sub-Saharan Africa. Agricultural Journal. 2(4):464-470.
Molosiwa OO. 2012. Genetic Diversity and Population Structure Analysis of Bambara Groundnut (Vigna subterranea (L.) Verdc.) Landraces Using Morpho-Agronomic Characters and SSR Markers. [disertasi]. Loughborough, Leicestershire (UK): The University of Nottingham Sutton Bonington Campus.
Mongomake K, Hilaire KT, Daouda K, Michel Z, Justin KY, Ochatt SJ. 2009. In vitro plantlets regeneration in Bambara groundnut (Vigna subterranea (L.) Verdc.) through direct shoot bud differentiation on hypocotyl and epicotyl cuttings. African Journal of Biotechnology. 8(8):1466-1473.
Naz S, Ali A, Siddique FA, Iqbal J. 2008. Somatic embryogenesis from immature cotyledone and leaf calli of chicpea (Cicer arietinum L). Pak J Bot. 40(2):523-531.
Novita V. 2013. Induksi Embriogenesis Somatik dan Seleksi In vitro Empat Genotipe Kedelai untuk Toleransi terhadap Cekaman Aluminium. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Okpuzor J, Ogbunugafor HA, Okafor U, Sofidiya MO. 2010. Identification of protein types in Bambara nut seeds: Perspectives for dietary protein supply in developing countries. EXCLI Journal. 9:17-28. Resources Institute. hlm 128-134.
Priolli RHG, Mendez CT, Arantes NE, Contel EPB. 2002. Characterization of brazilian soybean cultivars using microsatellite markers. Mol Biol. 25(2):185-193.
Rao NK. 2004. Plant genetic resources: Advancing conservation and use through biotechnology. African J Biotech. 3(2):13-145.
Redjeki ES. 2003. Pengaruh seleksi galur murni pada populasi campuran terhadap hasil tanaman kacang bogor (Vigna subterranea (L.) Verdcourt). Agrofish. 3(2):97-105.
9 Shu YJ, Li Y, Wu NLH, Bai X, Cai H, Ji W, Zhu YM. 2010. Mining and identification of SNPs from EST sequences in soybean and converting SNP markers into CAPS. Acta Agron Sin. 36(4):574-579.
Siise A, Massawe FJ. 2013. Microsatellites based marker molecular analysis of Ghanian Bambara groundnut (Vigna subterranea L.Verdc) landraces alongside morphological characterization. Genet Resour Crop Evol. 60(2):777-787.
Sinaga S. 1998. Variasi Somaklonal pada Kacang Tanah (Arachis hypogaea L.) Kultivar Gajah Hasil Kultur Jaringan: Evaluasi pada Generasi R0. [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Solodenko A, Yu S. 2005. Genotyping of helianthus based on microsatelite sequences. Helia. 28(42):19-26.
Somta P, Chankaew S, Rungnoi O, Srinives P. 2011. Genetic diversity of the Bambara groundnut (Vigna subterranea (L.) Verdc.) as assessed by SSR markers. Genome. 54(11):898-910.
Stephens JM. 2003. Bambara Groundnut (Voandzeia subterranea L.) thouars. Florida (US): IFAS Extension.
Sunyaev S, Ramensky V, Koch I, Lathe W, Kondrashov AS, Bork P. 2001. Prediction of deleterious human alleles. Hum Mol Genet. 10(6):591-597. Widoretno W, Arumningtyas EL, Sudarsono. 2003. Metode induksi pembentukan
embrio somatik dari kotiledon dan regenerasi planlet kedelai secara in vitro.
Hayati. 10(1):19-24.
Wu A-J, Andriotis VME, Durrant MC, Rathjen JP. 2004. A patch of surface-exposed residues mediates negative regulation of immune signaling by tomato Pto kinase. Plant Cell. 16(10):2809-2821.
Yi JY, Lee GA, Lee JR, Lee MC, Kang MJ, Baek HJ, Kim CK. 2011. Genetic diversity assessment and phylogenetic analysis of peanut (Arachis hypogaea
L.) in RDA genebank collection using SSRs. Korean Journal of Plant Resources. 24(3): 272-279.
10
2
TINJAUAN PUSTAKA
2.1 Sejarah Kacang Bogor
Kacang bogor atau Bambara groundnut termasuk kedalam famili
Leguminosae, subfamili Papilionoideae. Tanaman ini pertama kali disebutkan dalam literatur abad ke-17 (Marcgrav de Liebstad 1648), yang disebut sebagai 'mandubi d'Angola'. Pada tahun 1763, Linnaeus mengelompokkan kedalam
Spesies Plantarum, dan menamakan tanaman ini dengan Glycine subterranea, sesuai dengan sistem tata nama. Du Petit-Thouars (1806) menemukan tanaman ini di Madagaskar, dengan nama daerah 'voanjo', kemudian ditulis sebagai 'voandzou', dalam bahasa Perancis, Voandzeia subterranea (L.) Thouars. Penelitian botani yang lebih rinci dilakukan oleh Marechal et al. (1978) menemukan kesamaan besar antara Bambara groundnut dan spesies tanaman dari genus vigna. Studi tersebut telah dikonfirmasi oleh Verdcourt, dan pada tahun 1980 nama botani tanaman ini berubah menjadi Vigna subterranea (L.) Verdc (Goli 1997).
Kacang bogor (Vigna subterranea L. Verdc.) memiliki jumlah kromosom 2n=2x=22 (Uguru et al. 2006). Selama beberapa abad, tanaman ini telah dibudidayakan sebagai tanaman asli di daerah tropis Afrika bagian selatan dari gurun Sahara. Kacang bogor ini termasuk kedalam kelompok kacang-kacangan yang sering ditanam sendiri atau sebagai tanaman sela dengan tanaman yang tahan kekeringan seperti milet. Kacang bogor dapat mentolerir cekaman biotik dan abiotik pada sistem pertanian dengan input yang rendah (Zeven 1998).
2.2 Morfologi, Budidaya dan Manfaat Kacang Bogor
Tanaman kacang bogor adalah tanaman in-determinate, herba tahunan dengan tinggi mencapai 30 cm, bercabang banyak, batang yang berdaun lateral yang berada di atas permukaan tanah. Tipe perkecambahan kacang bogor adalah hipogeal (Linneman dan Azam-Ali 1993). Morfologi umum dari tanaman kacang bogor yaitu: tersusun atas batang, akar, daun dan polong (Gambar 2.1). Batangnya pendek sehingga secara visual tanaman seperti tidak mempunyai batang, memiliki banyak cabang. Tanaman tampak merumpun yang terdiri atas kumpulan daun dengan tangkai yang panjang. Helaian daun berbentuk lancip dan trifoleat. Rangkaian bunga berwarna kuning, setelah bunga mengalami penyerbukan, tangkai dari bunga yang telah terserbuki akan memanjang dan masuk ke dalam permukaan tanah (Basu et al. 2007).
Bunga kacang bogor bertipe kupu-kupu dan muncul dari ketiak daun, tumbuh menyebar di atas permukaan tanah dengan tangkai bunga yang tidak terlalu panjang (< 1.5 cm) dan berbulu, mahkota bunga berukuran kecil, berwarna kuning muda, kuning tua, kemerah-merahan atau beberapa jenis lainnya berwarna merah muda. Sistem penyerbukan tanaman kacang bogor adalah menyerbuk sendiri. Masa reseptif anter dan stigma terjadi pada hari yang sama (Basu et al.
11
Polong masak dalam keadaan segar berwarna putih dan halus, sedangkan jika polong kering berwarna coklat dan berkerut.
Kacang bogor termasuk kepada tanaman hari pendek dan dapat dibudidayakan di daerah tropis sampai ketinggian 1600 meter di atas permukaan laut (dpl). Tanaman ini menyukai keadaan iklim yang sama seperti kacang tanah, yaitu curah hujan yang tinggi sekitar 900-1200 mm tahun-1, serta sinar matahari yang cerah dengan suhu harian berkisar antara 20 °C sampai 28 °C. Tanaman ini dapat tumbuh pada tanah dengan kondisi hara yang rendah pada iklim yang panas, juga mampu tumbuh pada daerah kering dimana lahan tersebut tidak optimum untuk tanaman kacang-kacangan lainnya (Basu et al. 2007).
Tanaman kacang-kacangan termasuk tanaman kacang bogor sering dimanfaatkan untuk meningkatkan produktivitas tanah karena kemampuan tanaman legume untuk bersimbiosis dengan bakteri Rhizobium spp. dalam mengikat nitrogen bebas dari udara dengan membentuk bintil-bintil akar (Gueye
et al. 1998). Tanaman kacang-kacangan sering dijadikan sebagai tanaman sela dan sebagai legume cover crop (LCC), yang berfungsi untuk memecah tetesan air hujan supaya percikan air hujan yang jatuh ke tanah tidak akan menyebarkan penyakit yang mungkin terkandung di dalam tanah. Umumnya tanaman kacang bogor di Indonesia berbentuk menyebar sehingga sangat sesuai dijadikan sebagai tanaman penutup tanah untuk mencegah erosi, dan brangkasan tanaman ini dapat digunakan sebagai pupuk hijau (Redjeki 2007). Linneman dan Azam-Ali (1993) melaporkan bahwa kacang bogor di Afrika ditanam untuk konsumsi manusia dan diolah menjadi berbagai macam makanan.
[image:31.595.112.514.58.504.2]Bagian dari tanaman yang dikonsumsi dari tanaman kacang bogor adalah biji dalam keadaan segar atau direbus. Biji kering biasanya diproses terlebih dahulu seperti tepung dan bahan utama pembuatan susu di daerah Harare, Afrika Barat (Hampson et al. 2000). Biji kacang bogor dapat digunakan untuk memproduksi susu nabati yang sebanding dengan susu kedelai. Pengujian fungsi protein pada bubuk biji kacang bogor menunjukkan bahwa hal itu dapat bersaing atau menggantikan tepung konvensional lainnya dalam berbagai produk olahan (Brough et al. 1993).
Gambar 2.1 Morfologi tanaman kacang bogor (Vigna subterranea (L.) Verdc.). a = daun; b = batang; c = polong; d = akar.
12
2.3 Kultur In vitro Kacang Bogor
Teknik kultur in vitro dan sistem regenerasi yang efisien untuk kacang bogor pertama kali telah dilaporkan oleh Lacroix et al. (2003). Eksplan yang digunakan adalah embrio axis dari biji matang yang dikulturkan pada media dasar makro dan mikro MS+vitamin Nitsch dan Nitsch. Sistem organogenesis secara langsung dan pembentukan tunas adventif secara tidak langsung hanya terjadi pada jaringan meristem yang dikulturkan pada media yang mengandung sitokinin eksogen (BAP) yang tinggi (Lacroix et al. 2003).
Sistem perbanyakan secara in vitro melalui organogenesis langsung juga telah dilakukan oleh Mongomake at al. (2009) dengan menggunakan eksplan dari potongan hipokotil dan epikotil tanaman in vitro kacang bogor. Penggunaan media dasar MS dengan modifikasi penambahan vitamin B5 memberikan respon terbaik (73.33% sampai 97.77%) dalam induksi tunas secara langsung dengan penambahan zat pengatur tumbuh jenis sitokinin (BAP 2 mg L-1). Penggunaan sitokinin lainnya (Kinetin dan TDZ) 2 mg L-1 selama induksi tunas, tidak menunjukkan respon peningkatan jumlah tunas yang dihasilkan dibandingkan dengan penggunaan BAP 2 mg L-1. Penggunaan kombinasi BAP dengan NAA (0.01 sampai 0.5 mg L-1) tidak memberikan pengaruh yang nyata selama induksi akar dibandingkan dengan penggunaan BAP tunggal (Mongomake et al. 2009).
Sistem perbanyakan secara in vitro melalui induksi kalus baru dilaporkan oleh Konate et al. (2013), penggunaan 2,4-D atau Picloram (0.5 mg L-1) adalah media terbaik dalam induksi kalus (98%) untuk eksplan kotiledon yang berasal dari biji masak, sedangkan penggunaan kombinasi 2,4-D dengan 4 sitokinin lainnya (BAP, Kinetin, TDZ dan Zeatin) menunjukkan penurunan kecepatan pembentukan kalus dan proliferasi sel.
2.4 Zat Pengatur Tumbuh
Zat pengatur tumbuh (ZPT) adalah senyawa organik yang berfungsi merangsang pertumbuhan pada tanaman. Pertumbuhan dan morfogenesis tanaman secara in vitro dikendalikan oleh keseimbangan dan interaksi antara ZPT endogen dan ZPT eksogen (Pierik 1987). Terdapat beberapa faktor penting yang mempengaruhi induksi kalus dan regenerasi tanaman antara lain: pemilihan jenis eksplan, genotipe, jenis dan konsentrasi ZPT yang diberikan pada media. Dalam perbanyakan in vitro, auksin berperan dalam merangsang pembentukan kalus, pemanjangan sel, pembesaran jaringan dan pembentukan akar. Pengaruh sitokinin dalam perbanyakan in vitro adalah merangsang pembelahan sel dan multiplikasi tunas (George dan Sherrington, 1984). Selanjutnya, Gaspar et al. (1996) menyatakan bahwa auksin sangat diperlukan dalam pertumbuhan organogenesis termasuk dalam pembentukan akar. Menurut Riyadi dan Tahardi (2005), perlakuan kombinasi NAA dan IBA menghasilkan pengakaran yang lebih tinggi dibanding NAA secara tunggal meskipun NAA secara tunggal dapat menginduksi pengakaran.
13 Droste et al. 2010; Loganathan et al. 2010). Tahap proliferasi pada embrio somatik yang berasal dari eksplan kotiledon muda membutuhkan ZPT jenis auksin. Perbandingan konsentrasi auksin dan sitokinin perlu diperhatikan karena adanya sifat antagonis dari sitokinin terhadap auksin dalam inisiasi dan perbanyakan akar. Tunas akan terbentuk apabila media mengandung sitokinin yang tinggi dan auksin yang rendah, sedangkan akar terbentuk apabila perbandingan zat-zat tersebut di dalam media adalah sebaliknya. Morfogenesis eksplan tergantung kepada keseimbangan auksin dan sitokinin di dalam media dan interaksi antara zat pengatur tumbuh endogen pada tanaman serta zat pengatur tumbuh eksogen yang diserap dari media tumbuh (Wattimena 1992).
Komposisi auksin dan sitokinin dalam media kultur in vitro sangat berperan dalam induksi kalus serta regenerasi kalus menjadi tunas. Interaksi antara sitokinin dan auksin merupakan hal yang sangat penting dalam mengontrol proses pertumbuhan dan perkembangan dalam kultur in vitro. Walaupun auksin berperan utama dalam pembelahan sel, namun dalam beberapa tanaman sitokinin juga sangat dibutuhkan untuk poliferasi kalus (Wattimena 1992).
2.5 Keragaman Genetik Kacang Bogor
Evaluasi keragaman genetik yang tersedia adalah prasyarat untuk perbaikan genetik dalam tanaman, terutama pada tanaman yang masih belum intensif dikembangkan seperti kacang bogor (Olukolu et al. 2012). Evaluasi keragaman genetik yang dilakukan Kuswanto et al. (2012) berdasarkan pengamatan karakter kualitatif dan kuantitatif terdapat keragaman karakter kualitatif antar galur lokal. Perbedaan karakter kualitatif ini menunjukkan adanya perbedaan sifat genetik.
Keragaman genetik yang ada pada spesies (liar dan budidaya) penting untuk diketahui. Populasi tanaman liar diketahui dapat menjadi sumber yang berpotensi dalam penggunaan gen secara menyeluruh dan sifat-sifat yang dapat dimasukkan ke dalam gen pool, khususnya gen yang bertanggung jawab untuk adaptasi terhadap lingkungan stres dan memberikan resistensi tertentu terhadap patogen atau kondisi kering (Cattan-Toupance et al. 1998).
Perbedaan morfologi pada kacang bogor yang paling jelas terletak pada warna biji yaitu krem, coklat, ungu, merah keunguan atau hitam, sampai burik/berbercak (Gambar 2.2), sedangkan bentuk kulitnya ada yang mulus dan
14
keriput. Jumlah biji per polong tanaman kacang bogor hanya berjumlah 1 sampai 2 butir, dengan bentuk biji bulat dan licin, dengan ukuran yang beragam (diameter biji mencapai 1.5 cm), Menurut Linneman dan Azam-Ali (1993), warna biji kacang bogor sangat beragam: putih, krem, kuning, merah, ungu, coklat, dan hitam. Warna kulit biji ada yang seragam dan ada pula dengan warna yang tak beraturan atau strip. Beberapa ada yang memiliki mata dengan warna yang gelap di antara hilum yang berwarna putih. Biji kacang bogor yang berwarna gelap (merah dan hitam) lebih tinggi kandungan nutrisi dan mineralnya dari pada biji yang berwarna terang (krem dan putih). Namun di indonesia, umumnya galur yang ditanam petani (Bogor maupun Gresik) adalah kultivar berwarna gelap yaitu: hitam, merah dan coklat (Redjeki 2007).
Keragaman genetik spesies tanaman dapat diketahui dengan menggunakan metode penanda yang berbeda, termasuk; morfologi, sifat/agronomi, biokimia dan molekuler. Penanda molekuler memiliki beberapa keunggulan dibandingkan penanda morfologi, karena dapat digunakan secara efisien, terlepas dari tahap perkembangan tanaman yang uji (Mondini et al. 2009). Berbagai penanda molekuler telah diaplikasikan pada tanaman kacang bogor untuk mempelajari keragaman genetik tanaman tersebut.
Penggunaan marka molekuler RAPD pertama kalinya diaplikasikan oleh Amadou et al. (2001) dan Massawe et al. (2003). Penggunaan penanda RAPD pada 25 aksesi kacang bogor asal Afrika dari koleksi di IITA (Ibadan dan Nigeria) menunjukkan bahwa aksesi kacang bogor asal Afrika mengelompok menjadi dua kelompok utama dan sesuai dengan distribusi geografis tanaman kacang bogor tersebut (Amadou et al. 2001).
Keragaman genetik 100 aksesi tanaman tunggal kacang bogor dari berbagai lokasi di Tanzania telah dianalisis menggunakan marka AFLP, menghasilkan 49 pita yang polimorfik dari 11 primer AFLP yang informatif. Analisis Cluster menunjukkan bahwa kacang bogor memiliki dua kelompok besar yang diduga sejalan dengan asal-usul geografis tanaman tersebut (Ntundu et al. 2004).
Keragaman genetik kacang bogor aksesi liar dan budidaya sangat tinggi dengan menggunakan marka isozim yang menghasilkan 14 lokus yang polimorfik untuk aksesi liar dan 7 lokus untuk aksesi budidaya. Tingkat keragaman aksesi liar lebih tinggi (Ht=0.087) dari pada aksesi budidaya (Ht=0.052). Studi genetik menggunakan isozim ini menunjukkan bahwa kacang bogor aksesi liar mungkin menjadi nenek moyang sejati dari kacang bogor budidaya. Selain tingginya nilai keragaman intra-populasi di kedua populasi (liar dan budidaya), studi ini juga menunjukkan bahwa penyerbukan sendiri adalah cara utama reproduksi seksual untuk kedua jenis aksesi tanaman ini (Pasquet et al. 1999).
15
2.6 Marka Molekuler
Analisis keragaman genetik tanaman dapat dilakukan secara morfologi (pengamatan langsung terhadap fenotipe) maupun dengan menggunakan marka molekuler. Analisis dengan karakter morfologi telah lama digunakan untuk mengidentifikasi varietas, spesies, genus, maupun famili dari suatu jenis tanaman. Pengamatan langsung terhadap karakter morfologi memiliki kelemahan karena seringkali dipengaruhi oleh faktor lingkungan. Marka molekuler memiliki kelebihan dibandingkan dengan marka morfologi, yaitu diantaranya dapat meningkatkan efisiensi seleksi dalam pemuliaan tanaman dengan cara seleksi tidak langsung pada karakter yang diharapkan. Selain itu marka molekuler tidak dipengaruhi oleh lingkungan dan marka molekuler dapat mendeteksi pada semua tempat perkembangan atau bagian tanaman (Mohan et al. 1997).
Marka molekuler bekerja pada tingkat DNA, memiliki beberapa kelebihan dibandingkan dengan marka morfologi antara lain: 1) karena genotipe suatu organisme diuji secara langsung, sehingga pengaruh lingkungan dan perkembangan terhadap fenotipe tidak menjadi masalah, 2) DNA berevolusi dengan kecepatan rendah, sehingga bagian yang cocok dapat digunakan untuk studi tertentu, 3) jumlah polimorfisme tidak terbatas, 4) berbagai macam teknik telah dikembangkan yang masing-masing dapat menyediakan marka yang sesuai dengan tujuan tertentu (Weising et al. 1995).
Setelah dipublikasikannya penemuan teknologi PCR oleh Mullis & Faloona (1987), marka molekular berbasis PCR makin berkembang karena kemudahan dan peluang keberhasilannya yang tinggi. Beragam teknik berbasis PCR telah digunakan untuk menganalisis keragaman genetik, hubungan kekerabatan antara spesies antara lain Random Amplified Polymorphic DNA (RAPD), Amplified Fragment Length Polymorphism (AFLP), Diversity Arrays Technology (DArT),
Simple Sequence Repeat (SSR), dan Single Nucleotide Amplified Polymorphisms
(SNAP) (Gupta et al. 2001).
Berdasarkan hasil pengujian empat marka molekuler (RFLP, RAPD, AFLP dan SSR) yang dilakukan oleh Powell et al. (1996) mendapatkan bahwa marka SSR memiliki kandungan informasi (kemampuan untuk membedakan genotipe) yang paling tinggi untuk mengevaluasi plasma nutfah kedelai dibandingkan dengan marka molekuler yang lainnya. SSR sering juga disebut dengan marka mikrosatelit. SSR tersusun atas dua sampai enam DNA berulang seperti (AT)n, (AGC)n, (GACT)n yang tersebar pada genom organisme eukariotik. Variasi alel pada lokus mikrosatelit dengan mudah dapat diperoleh dengan teknik PCR menggunakan primer spesifik dan telah banyak digunakan pada berbagai tanaman. Marka SSR memiliki keuntungan seperti tingkat polimorfisme yang tinggi, lokus yang spesifik, mudah diperbanyak, hanya membutuhkan sedikit DNA, tersebar pada genom, tingkat keterulangan yang tinggi, dan yang terpenting bersifat co-dominan (Kalia et al. 2011).
Perkembangan marka molekuler sangat pesat terutama untuk kepentingan studi keragaman, identifikasi dan seleksi suatu karakter. Marka yang berkembang dewasa ini adalah Single Nucleotide Amplified Polymorphism (SNAP). SNP yang ditemukan di coding region dibagi menjadi 2, yaitu yang bersifat non-synonymous
16
2.7 Gen Pto
Gen yang mengendalikan sifat ketahanan terdiri atas dua kelompok yaitu: kelompok gen yang terlibat dalam pengenalan patogen atau sinyal transduksi disebut gen ketahanan (R gene); kelompok lainnya yang terlibat dalam mekanisme ketahanan dan sintesis produk yang dibutuhkan untuk pengenalan patogen (Chinchilla et al. 2006).
Berdasarkan domain structural yang dimiliki, gen ketahanan (R gene) dapat dikelompokkan menjadi tiga kelompok: 1) gen yang menyandi protein yang mengandung Nucleotide Binding Site dan Leucine-Rich Repeat (NBS-LRR); 2) gen yang menyandi protein yang mengandung Serin/Threonin Kinase (STK); 3) gen yang menyandi protein yang mengandung extracitoplasmic Leucine-Rich Repeat (eLRR) (Gao et al. 2005). Berbagai gen ketahanan telah berhasil diisolasi dari beberapa tanaman seperti kacang tanah (Yuksel et al. 2005), kapas (Gao et al.
2005), sorghum (Totad et al. 2005), pisang (Miller et al. 2008), tomat (Pedley dan Martin 2003), gandum (Zhang et al. 2011) dan apel (Baek dan Choi 2013).
Gen pto adalah sebuah protein kinase yang hanya mengandung Ser-Thr Kinase tanpa LRR (Kim et al. 2002) dan Rpg1 yang mengkode receptor kinase-like protein dengan 2 protein kinase (Brueggeman et al. 2002). Kedua gen ini merupakan kelompok R gene yang berinteraksi secara langsung dengan masing-masing penyebab serangan penyakit (Wu et al. 2004). Gen Pto membutuhkan protein NBARC-LRR Prf untuk berfungsi (Salmeron et al. 1996).
Daftar Pustaka
Amadou HI, Bebeli PJ, Kaltsikes PJ. 2001. Genetic diversity in Bambara groundnut (Vigna subterranea L.) germplasm revealed by RAPD markers.
Genome. 44(6):995-999.
Baek DE, Choi C. 2013. Identification of resistance gene analogs in Korean wild apple germplasm collections. Genet Mol Res. 12(1):483-493.
Baker CM, Durham RE, Burns JA, Parrott WA, Wetzstein HY. 1995. High frequency somatic embryogenesis in peanut (Arachis hypogaea L.) using mature, dry seed. Plant Cell Reports. 15(1):38-42.
Basu S, Roberts JA, Azam-Ali SN, Mayes S. 2007. Bambara groundnut. Di dalam: Kole C, editor. Genome Mapping and Molecular Breeding in Plants.
Volume 3: Pulses, Sugar and Tuber Crops. Pennsylvania State University (US): Springer Verlag Berlin Heidelberg. hlm 159-173.
Brough SH, Taylo, AJ, Azam-Ali SN. 1993. The potential of bambara groundnut (Vigna subterranea) in vegetable milk production and basic protein functionality systems. Food Chem. 47(3):277-283.
Brueggeman R, Rostoks N, Kudrna D, Kilian A, Han F, Chen J, Druka A, Steffenson B, Kleinhofs A. 2002. The barley stem rust-resistance gene Rpg1
is a novel disease-resistance gene with homology to receptor kinases. Proc Natl Acad Sci. 99(14):9328-9333.
17 Chengalrayan K, Hazra S, Gallo-Meagher M. 2001. Histological analysis of somatic embryogenesis and organogenesis induced from mature zygotic embryo-derived leaflets of peanut (Arachis hypogaea L.). Plant Science.
161(3):415-421.
Chinchilla D, Bauer Z, Regenass M, Boller T, Felix G. 2006. The Arabidopsis receptor kinase FLS2 binds flg22 and determines the specificity of flagellin perception. Plant Cell. 18(2):465-476.
Droste A, Silva AM, Souza IF, Wiebke-Strohm B, Bucker-Neto L, Bencke M, Sauner MV, Bodanes-Zanettini MH. 2010. Screening of Brazilian soybean genotypes with high potential for somatic embryogenesis and plant regeneration. Pesquisa Agropecuária Brasileira. 45(7):715-720.
Edy A, Pujisiswanto H. 2008. Pengaruh 2,4-D terhadap induksi embrio somatik eksplan leaflet pada beberapa varietas kacang tanah (Arachis hipogeae L.) secara in vitro. Seminar Nasional Sains dan Teknologi-II. 2008, November 17-18: Univ Lampung (ID). hal 41-50.
Gao Y, Guo W, Wang L, Zhang T. 2006. Isolation and characterization of resistance and defense gene analogs in cotton (Gossypium barbadense L.).
Science in China Series C: Life Sciences. 49(6):530-542.
Gaspar T, C Kevers, C Penel, H Greppin, DM Reid, TA Thorpe. 1996. Plant hormones and plant growth regulators in plant tissue culture. In vitro Cell Dev Biol Plant. 32(4):272-289.
George EF, Sherrington PD. 1984. Plant Propagation by Tissue Culture. London (GB): Exegenetics. 709 hlm.
Goli AE. 1997. Bibliographical Review. Didalam: Heller J, Begemann F, Mushonga J, editor. Promoting the conservation and use of underutilized and neglected crops. 9. Proceedings of the workshop on Conservation and Improvement of Bambara Groundnut (Vigna subterranea (L.) Verdc.); 1995 November 14-16; Harare, Zimbabwe. Roma, Italia (IT): International Plant Genetic Resources Institute. pp. 4-10.
Gueye M, James EK, Kierans M, Sprent JL. 1998. The development and structure of root nodules on bambara groundnut [Vondzeia (Vigna) subterranea].
W.J.Microbiol Biotechnol. 14(2):177-184.
Gupta PK, Roy JK, Prasad M. 2001. Single nucleotide polymorphisms: A new paradigm for molecular marker technology and DNA polymorphism detection with emphasis on their use in plants. Current Sci. 80(4):524-535. Hampson K, Azam-Ali SH, Sesay A, Mukwaya SM, Azam-Ali SN. 2000.
Assessing opportunities for increased utilisation of bambara groundnut in southern africa. Loughborough (UK): University of Nottingham. 67 hlm. Joshi M, Sujatha K, Harza S. 2008. Effect of TDZ and 2,4-D on peaut somatic
embryogenesis and in vitro bud development. Plant Cell Tiss Organ Cult. 94(1):85-90.
Kalia RK, Rai MK, Kalia S, Singh R, Dhawan AK. 2011. Microsatellite markers: an overview of the recent progress in plants. Euphytica. 177(3):309-334. Kim Y, Lin N, Martin G. 2002. Two distinct Pseudomonas effector proteins
18
Konate S, Kone M, Kouakou HT, Kouadio JY, Zouzou M. 2013. Callus induction and proliferation from cotyledon explants in bambara groundnut. African Crop Science Journal. 21(3):255-263.
Kuswanto, Waluyo B, Pramantasari RA, Candra S. 2012. Koleksi dan Evaluasi Galur-Galur Lokal Kacang Bogor (Vigna subterranea). Seminar Nasional Perhimpunan Ilmu Pemuliaan Indonesia (PERIPI) [internet] (2012 November 6); Bogor (ID). academia.edu. hlm 1-12; [diunduh 2014 Februari 03]. Tersedia pada: http://www.academia.edu/2147504/Koleksi_dan_ Evaluasi_Galur-galur_Lokal_Kacang_Bogor_Vigna_ subterranea.pdf. Lacroix B, Assoumou Y, Sangwan RS. 2003. Efficient in vitro direct shoot
organogenesis of fertile plants from embryo explants of Bambara groundnut (Vigna subterranea (L.) Verdc.). Plant Cell Report. 21(12):1153-1158. Linnemann AR, Azam-Ali SN. 1993. Bambara groundnut. Di dalam: Williams
JT, editor. Pulses and Vegetables. London (GB): Chapman and Hall. hlm 13-58.
Loganathan M, Maruthasalam S, Ling YS, Wei CL, Wen HH, Pei FL, Chih WY, Chin HL. 2010. Regeneration of soybean (Glycine max L. Merrill) through direct somatic embryogenesis from the immature embryonic shoot tip. in Vitro Cell Dev Biol Plant. 46(3):265–273.
Miller RNG, Bertioli DJ, Baurens FC, Santos CMR, Alves PC, Martins NF, Togawa RC, Souza-Júnior MT, Pappas-Júnior GJ. 2008. Analysis of non-TIR-NBS-LRR resistance gene analogs in Musa acuminate Colla: isolation, RFLP marker development, and physical mapping. BMC Plant Biology. 8(1):15.
Mohan M, Nair S, Bhagwat A, Krishna TG, Yano M. 1997. Genome mapping, molecular markers and marker-assisted selection in crop plants. Molecular Breeding. 3(2):87-103.
Mondini L, Noorani A, Pagnotta MA. 2009. Assessing plant genetic diversity by molecular tools. Diversity. 1(1):19-35.
Mongomake K, Hilaire KT, Daouda K, Michel Z, Justin KY, Ochatt SJ. 2009. In vitro plantlets regeneration in Bambara groundnut (Vigna subterranea (L.) Verdc.) through direct shoot bud differentiation on hypocotyl and epicotyl cuttings. African Journal of Biotechnology. 8(8):1466-1473.
Ntundu WH, Bach IC, Christiansen JL, Andersen SB. 2004. Analysis of genetic diversity in bambara groundnut (Vigna subterrnea (L.) Verdc.) landraces using amplified fragment length polymorphism (AFLP) markers. African Journal of Biotechnology. 3(4):220-225.
Olukolu BA, Mayes S, Stadler F, Ng NQ, Fawole I, Dominique D, Azam-Ali SN, Abbott AG, Kole C. 2012. Genetic diversity in Bambara groundnut (Vigna subterranea (L.) Verdc.) as revealed by phenotypic descriPTOrs and DArT marker analysis. Genetic Resources and Crop Evolution. 59(3):347-358. Pasquet RS, Schwedes S, Gepts P. 1999. Isozyme diversity in Bambara
groundnut. Crop Science. 39(4):1228-1236.
Pedley KF, Martin GB. 2003. Molecular basis of Pto-mediated resistance to bacterial speck disease in tomato. Annu Rev Phytopathol. 41(1):215-243. Pierik LLM. 1987. In vitro Culture of Hinger Plant. Netherlands (NL):
19 Powell W, M Morgante, C Andre, M Hanafey, J Vogel, S Tingey, A Rafalski. 1996. The comparison of RFLP, RAPD, AFLP and SSR (microsatellite) markers for germplasm analysis. Molecular Breeding. 2(3):225-238.
Redjeki ES. 2007. Pertumbuhan dan hasil tanaman kacang bogor (Vigna subterranea (L.) Verdcourt) galur gresik dan bogor pada berbagai warna biji. Prosiding Seminar Nasional Hasil Penelitian yang Dibiayai oleh Hibah Kompetitif Depertemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB, 2007 Agustus 1-2; Bogor (ID): hlm 114-118.
Riyadi I, JS Tahardi. 2005. Pengaruh NAA dan IBA terhadap pertumbuhan dan perkembangan tunas kina (Cinchona succirubra). Jurnal Bioteknologi Pertanian. 10(2):45-50.
Salmeron JM, Oldroyd GED, Rommens CMT, Scofield SR, Kim H-S, Lavelle DT, Dahlbeck D, Staskawicz BJ. 1996. Tomato Prf is a member of the leucine-rich repeat class of plant disease resistance genes and lies embedded within the Pto kinase gene cluster. Cell. 86(1):123-133.
Somta P, Chankaew S, Rungnoi O, Srinives P. 2011. Genetic diversity of the Bambara groundnut (Vigna subterranea (L.) Verdc.) as assessed by SSR markers. Genome. 54(11):898-910.
Sunyaev S, Ramensky V, Koch I, Lathe W, Kondrashov AS, Bork P. 2001. Prediction of deleterious human alleles. Hum Mol Genet. 10(6):591-597. Texeira LR, Braccini AL, Churata BGM, Vieira ESN, Martins PK, Schuster I.
2011. Evaluation of soybean cultivars on the embryogenic and organogenic potential. Maringà. 33(1):67-74.
Totad AS, Fakrudin B, Kuruvinashetti MS. 2005. Isolation and characterization of resistnce gene analogue (RGAs) from sorghum (Sorghum bicolor L. Moenih). Euphytica. 143(1):179-188.
Uguru MI, Agwatu UK, Faluyi JO. 2006. Cytogenetic studies on bambara groundnut (Vigna subterranea L. Verdc.). Journal of Agriculture, Food, Environment and Extension. 3(2):13-20.
Wattimena GA. 1992. Bioteknologi Tanaman I. Bogor (ID): Pusat Antar Universitas Bioteknologi.
Weising K, Nybom H, Wolff K, Meyer W. 1995. DNA Fingerprinting in Plants and Fungi. Boca Raton, Florida (US): CRC Pr. 323 hlm.
Wu A-J, Andriotis VME, Durrant MC, Rathjen JP. 2004. A patch of surface-exposed residues mediates negative regulation of immune signaling by tomato Pto kinase. Plant Cell. 16(10):2809-2821.
Yuksel B, Estill JC, Schulze SR, Paterson AH. 2005. Organization and evolution of resistance gene analogs in peanut. Mol.Gen. Genomics. 274(3):248-263. Zeven AC. 1998. Landraces: a review of definitions and classifications.
Euphytica. 104(2):127-139.
Zhang N, Wang S, Wang HY, Liu DQ. 2011. Isolation and characterization of NBS-LRR class resistance homologous gene from wheat. J Integra Agric.
20
3
ORGANOGENESIS DAN EMBRIOGENESIS KACANG
BOGOR (
Vigna subterranea
L. Verdc.) ASAL SUKABUMI
Abstrak
Peningkatan keragaman genetik tanaman kacang bogor melalui induksi mutasi dan transformasi genetik dapat dicapai dengan tersedianya protokol yang dapat diandalkan untuk sistem regenerasi tanaman secara in vitro. Tujuan penelitian ini adalah 1) memperoleh informasi pengaruh zat pengatur tumbuh (BAP dan NAA) dalam induksi dan proliferasi tunas dan pengakaran kacang bogor, 2) memperoleh informasi media dan eksplan terbaik dalam induksi dan proliferasi kalus embriogenik dan media regenerasi kalus menjadi embrio somatik