POTENSI BAKTERI ENDOFIT ASAL TANAMAN KOPI UNTUK
PENGENDALIAN NEMATODA LUKA AKAR
Pratylenchus coffeae
(Zimmermann) Filipjev & Schuurmans Stekhoven
DAN PEMACU
PERTUMBUHAN TANAMAN
DWI HALIMAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Potensi Bakteri Endofit Asal Tanaman Kopi untuk Pengendalian Nematoda Luka Akar Pratylenchus coffeae (Zimmermann) Filipjev & Schuurmans Stekhoven dan Pemacu Pertumbuhan Tanaman adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
DWI HALIMAH. Potensi Bakteri Endofit Asal Tanaman Kopi untuk Pengendalian Nematoda Luka Akar Pratylenchus coffeae (Zimmermann) Filipjev & Schuurmans Stekhoven dan Pemacu Pertumbuhan Tanaman. Dibimbing oleh ABDUL MUNIF dan GIYANTO.
Kopi merupakan tanaman perkebunan yang memiliki potensi ekspor yang cukup tinggi. Sebelum abad 19, Indonesia merupakan negara penghasil kopi terbesar di dunia setelah Brazil, namun saat ini produksi terus menurun dan telah tergeser oleh negara lain. Salah satu faktor penyebabnya adalah serangan nematoda luka akar Pratylenchus coffeae. Penurunan produksi akibat nematoda tersebut mencapai 28.7-78.4% pada kopi Robusta dan pada kopi Arabika, tanaman hanya dapat bertahan selama dua tahun. Upaya pengendalian terhadap P. coffeae telah dilakukan di antaranya secara kultur teknis, penggunaan bahan tanam tahan, kimiawi dan pengendalian biologis. Salah satu teknik pengendalian biologi adalah dengan pemanfaatan bakteri endofit. Penelitian mengenai eksplorasi dan penggunaan bakteri endofit pada tanaman kopi sebagai agens pengendali nematoda P. coffeae belum banyak dilakukan. Penelitian bertujuan memperoleh isolat tunggal maupun konsorsium bakteri endofit asal tanaman kopi yang efektif untuk mengendalikan nematoda luka akar P. coffeae dan memacu pertumbuhan tanaman.
Ruang lingkup penelitian meliputi: 1) isolasi bakteri endofit dari bagian akar, batang dan daun sehat tanaman kopi untuk memperoleh isolat tunggal dan konsorsium; 2) penapisan bakteri endofit melalui uji hipersensitif dan hemolisis; 3) pengelompokan isolat tunggal bakteri endofit menurut golongan pseudomonad fluoresen, Bacillus, Aktinomiset dan bukan ketiganya; 4) penyiapan inokulum P. coffeae; 5) uji in vitro bakteri endofit terhadap mortalitas P. coffeae dan pemacuan pertumbuhan tanaman; 6) karakterisasi bakteri endofit mencakup pengujian aktivitas hidrolisis (kitinolitik, proteolitik, dan lipolitik), produksi HCN, kemampuan pelarutan fosfat (P), penambatan nitrogen (N2); 7) uji potensi bakteri endofit dalam menekan populasi P. coffeae dan memacu pertumbuhan tanaman di rumah kaca; dan 8) identifikasi secara molekuler dengan sekuensing gen 16S rRNA terhadap 2 isolat tunggal terbaik di rumah kaca.
memacu pertumbuhan batang dan/atau akar, dan 4 isolat dapat menekan P. coffeae serta memacu pertumbuhan tanaman. Bakteri endofit konsorsium terseleksi sebanyak 4 konsorsium, terdiri atas satu konsorsium yang mampu menekan populasi P. coffeae saja, satu konsorsium dapat memacu pertumbuhan saja, serta 2 konsorsium yang mampu menekan P. coffeae dan memacu pertumbuhan tanaman. Berdasarkan karakterisasi fisiologis, diperoleh: 1) isolat tunggal bakteri endofit C939A31 memiliki kemampuan aktivitas proteolitik, kitinolitik, lipolitik, dan fiksasi N2, serta kemampuan menekan P. coffeae 66.7%; C939A32 memiliki kemampuan aktivitas lipolitik, pelarutan P dan fiksasi N2, serta kemampuan menekan P. coffeae 100%; I308A32 memiliki kemampuan aktivitas proteolitik, lipolitik, pelarutan P dan fiksasi N2, serta kemampuan menekan P. coffeae 77.9%; 2) konsorsium bakteri endofit K6 memiliki kemampuan aktivitas proteolitik, kitinolitik, lipolitik, produksi HCN dan fiksasi N2, serta kemampuan menekan P. coffeae 65.8%; K8 memiliki kemampuan aktivitas proteolitik, kitinolitik, lipolitik, produksi HCN dan fiksasi N2, serta kemampuan menekan P. coffeae 43.1%; K15 memiliki kemampuan aktivitas proteolitik, kitinolitik, lipolitik, produksi HCN, pelarutan P dan fiksasi N2, serta kemampuan menekan P. coffeae 43.3%.
Hasil pengujian di rumah kaca menunjukkan bahwa isolat tunggal terbaik yang dapat memacu pertumbuhan dan menekan populasi P. coffeae sebesar 62 dan 69.1% adalah isolat C939A31 dan C939A32, sedangkan konsorsium bakteri endofit terbaik yang mampu memacu pertumbuhan kopi dan menekan populasi P. coffeae sebesar 83 dan 92.4% adalah konsorsium K8 dan K15. Identifikasi gen 16S rRNA menunjukkan bahwa isolat C939A31 memiliki kemiripan dengan Ochrobactrum intermedium DSQ5 dan C939A32 dengan Klebsiella oxytoca NGB-FR 50.
SUMMARY
DWI HALIMAH. Potency of Endophytic Bacteria from Coffee Plant for Controlling Root Lesion Nematode Pratylenchus coffeae (Zimmermann) Filipjev & Schuurmans Stekhoven and Plant Growth Promoting. Supervised by ABDUL MUNIF and GIYANTO. attacking of root lesion nematode Pratylenchus coffeae. Decreasing of production caused by this nematode was 28.7-78.4 % on Robusta coffee and on Arabica coffee, the plants can survived only 2 years. The efforts to control this nematode have been made by various techniques, such as technical culture, the use of resistant planting material, chemical and biological control. One technique of biological control is application of endophytic bacteria. Research on the exploration and use of endophytic bacteria on coffee plants as an controlling agenst of P. coffeae nematode has not been widely implemented. This study aims to obtain either single isolates or consortia of endophytic bacteria origin from coffee plant which effectively controlling P. coffeae nematode and promote the growth of plants.
The scopes of research includes: 1) the isolation of endophytic bacteria from roots, stems, and leaves of healthy coffee plants to obtain single isolates and consortia of endophytic bacteria; 2) selection of endophytic bacteria through hypersensitivity and hemolysis test; 3) grouping single isolates of endophytic bacteria by fluorescent pseudomonads, Bacillus, actinomycetes and out of those three groups; 4) preparation of P. coffeae inoculum; 5) in vitro assays of endophytic bacteria to P. coffeae mortality and promoting plant growth; 6) characterization of endophytic bacteria include hydrolytic activity test (chitinolytic, proteolytic and lipolytic), HCN production, dissolving of phosphate, and nitrogen fixation; 7) in vivo assays of endophytic bacteria potential to suppress P. coffeae population and promote plant growth in greenhouse; and 8) molecular identification by 16S rRNA gene sequencing of the 2 best single isolates in greenhouse.
could kill P. coffeae and stimulate plant growth. The four selected consortia of endophytic bacteria were one consortia which could only kill P. coffeae, one consortia which could only stimulate plant growth, and two consortia which could kill P. coffeae and stimulate plant growth.
Based on physiologyst characteristics on in vitro assays, we obtained: 1) C939A31 single isolate which indicated on proteolytic, chitinolytic, lipolytic, and N2-fixing activities, and suppressed P. coffeae at 66.7%; C939A32 isolate which have ability on lipolytic, solubilization of phosphate and N2-fixing activities, and ability to suppressed P. coffeae at 100%; I308A32 isolate which showed on proteolytic, lipolytic, solubilization of phosphate and N2-fixing activities, and ability to suppressed P. coffeae at 77.9%; 2) K6 consortia which indicated on proteolytic, chitinolytic, lipolytic, HCN production and N2-fixing activities, and suppressed P. coffeae at 65.8%; K8 consortia which have ability on proteolytic, chitinolytic, lipolytic, HCN production and N2-fixing activities, and ability to suppressed P. coffeae at 43.1%; K15 consortia which showed on proteolytic, chitinolytic, lipolytic, HCN production, solubilization of phosphate and N2-fixing activities, and ability to suppressed P. coffeae at 43.3%.
The in vivo assays in greenhouse showed that single isolates which gave highest coffee growth promotion and highly suppressed P. coffeae population on 62 and 69.1% were C939A31 and C939A32 isolates; while consortia endophytic bacteria which gave highest coffee growth promotion and highly suppressed P. coffeae population on 83 and 92.4% were K8 and K15 consortia. Identification of 16S rRNA gene showed that C939A31 isolate was identical to Ochrobactrum intermedium DSQ5, and C939A32 isolate was identical to Klebsiella oxytoca NGB-FR 50.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
POTENSI BAKTERI ENDOFIT ASAL TANAMAN KOPI UNTUK
PENGENDALIAN NEMATODA LUKA AKAR
Pratylenchus coffeae
(
Zimmerman) Filipjev & Schuurmans Stekhoven DAN PEMACU
PERTUMBUHAN TANAMAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Penguji Luar Komisi pada Ujian tesis: Dr Ir Rita Harni, M. Si
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan Januari 2014 – Juni 2015 ini ialah pengendalian biologi, dengan judul Potensi Bakteri Endofit Asal Tanaman Kopi untuk Pengendalian Nematoda Luka Akar Pratylenchus coffeae (Zimmermann) Schuurmans & Stekhoven dan Pemacu Pertumbuhan Tanaman.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Abdul Munif, M Sc Agr dan Bapak Dr Ir Giyanto, M Si selaku pembimbing, serta Ibu Dr Rita Harni, M Si selaku penguji luar komisi. Di samping itu, penghargaan penulis sampaikan kepada Bapak Dr Yudi Sastro, SP, MP dan Ibu Ana Feronika Cindra Irawati, SP, MP dari Badan Pengkajian Teknologi Pertanian Jakarta; serta Bapak Dr Misnawi, Bapak Ir Nurkholis, Bapak Imam Ghozali dan Ibu Khodidjah dari Pusat Penelitian Kopi dan Kakao Jember, yang telah membantu selama penelitian. Ungkapan terima kasih penulis sampaikan kepada suami tercinta Tri Budi Bowo Laksono, anak-anakku tersayang Jyotis Andra Arya Pratama dan Lituhayu Puspa Arya Nirwasita yang telah merelakan waktu kebersamaan kita untuk penyelesaian penelitian. Penghormatan dan terimakasih tak terhingga penulis sampaikan kepada suami tercinta; Ibu Sugi Harini dan Bapak Admo Sugito tercinta; juga mertua tersayang Ibu Soemiyem dan Bapak Soerachman; serta seluruh keluarga, atas segala doa, kasih sayang dan motivasi yang tak henti-hentinya di setiap detik dan menit masa penelitian. Ucapan terimakasih juga penulis sampaikan kepada rekan-rekan Laboratorium Bakteriologi dan Nematologi Departemen Proteksi Tanaman IPB, serta rekan S2 Fitopatologi IPB angkatan 2012 yang telah menemani dalam suka duka selama perkuliahan dan penelitian.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 3
2 TINJAUAN PUSTAKA 4
Pertanaman Kopi Di Indonesia 4
Nematoda Luka Akar Pratylenchus coffeae 4
Kerugian Akibat Serangan P. coffeae 7
Pengendalian Nematoda P. coffeae 7
Pengendalian Nematoda Parasit dengan Bakteri Endofit 7
3 METODE 10
Waktu dan Tempat 10
Ekstraksi dan Perbanyakan Nematoda P. coffeae 10
Isolasi dan Pengelompokan Bakteri Endofit 10
Seleksi Bakteri Endofit sebagai Agens Hayati Secara In Vitro 12
Karakterisasi Fisiologis Bakteri Endofit 13
Seleksi Bakteri Endofit sebagai Agens Hayati di Rumah Kaca 14 Identifikasi Bakteri Endofit Berdasarkan Sekuen Gen 16S rRNA 15
Analisis Data 15
4 HASIL DAN PEMBAHASAN 16
Ekstraksi dan Perbanyakan Nematoda P. coffeae 16 Isolasi, Seleksi, dan Karakterisasi Bakteri Endofit Asal Tanaman Kopi 17 Pengaruh Bakteri Endofit terhadap Pertumbuhan Tanaman Kopi di
Rumah Kaca 30
Pengaruh Perlakuan Bakteri Endofit terhadap Populasi Nematoda P.
coffeae di Rumah Kaca 33
Identifikasi Isolat Tunggal Bakteri Endofit Potensial Berdasarkan
Sekuen Gen 16S rRNA 34
Pembahasan Umum 35
5 SIMPULAN DAN SARAN 39
Simpulan 39
Saran 39
LAMPIRAN 49
RIWAYAT HIDUP 51
DAFTAR TABEL
1 Kelimpahan populasi bakteri endofit hasil isolasi dari tanaman kopi
Klon BP939 dan BP308 18
2 Penggolongan bakteri endofit isolat tunggal asal tanaman kopi klon BP939 dan BP308 dari Jawa Timur dan Jawa Barat 18 3 Indeks keragaman (H') bakteri endofit isolat tunggal asal tanaman kopi
klon BP939 dan BP308 dari Jawa Timur dan Jawa Barat 19 4 Pengaruh kultur filtrat bakteri endofit isolat tunggal terhadap tingkat
mortalitas nematoda P. coffeae 21
5 Pengaruh kultur filtrat konsorsium bakteri endofit terhadap tingkat
mortalitas nematoda P. coffeae 22
6 Pengaruh bakteri endofit isolat tunggal asal tanaman kopi terhadap
pertumbuhan benih tomat 23
7 Pengaruh konsorsium bakteri endofit asal tanaman kopi terhadap
pertumbuhan benih tomat 24
8 Karakter fisiologis bakteri endofit isolat tunggal dan konsorsium asal
tanaman kopi yang terseleksi 26
9 Pengaruh bakteri endofit isolat tunggal terhadap tinggi tanaman kopi di
rumah kaca 31
10 Pengaruh bakteri endofit isolat tunggal terhadap biomassa tanaman
kopi 31
11 Pengaruh konsorsium bakteri endofit terhadap tinggi tanaman kopi di
rumah kaca 32
12 Pengaruh konsorsium bakteri endofit terhadap biomassa tanaman kopi 32 13 Pengaruh isolat tunggal dan konsorsium bakteri endofit terhadap P.
coffeae dan tanaman kopi pada percobaan di rumah kaca 33 14 Hasil analisis runutan gen 16S rRNA isolat bakteri endofit dengan
runutan gen 16S rRNA di pusat data GeneBank 35
DAFTAR GAMBAR
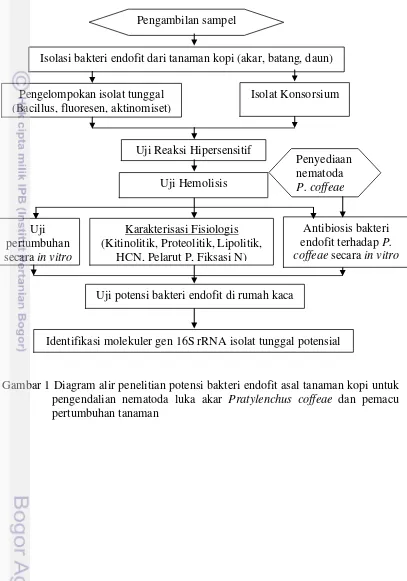
1 Diagram alir penelitian potensi bakteri endofit asal tanaman kopi untuk pengendalian nematoda luka akar Pratylenchus coffeae dan pemacu
pertumbuhan tanaman 3
2 Gejala serangan nematoda P. coffeae pada akar kopi 16 3 Inokulum nematoda P. coffeae yang digunakan untuk pengujian 17 4 Hasil uji reaksi hipersensitif bakteri endofit asal tanaman kopi 20 5 Uji hemolisis pada isolat bakteri endofit asal tanama kopi 20 7 Karakter fisiologis pada bakteri endofit asal tanaman kopi 28
DAFTAR LAMPIRAN
1 Homologi runutan pita DNA isolat terseleksi dengan spesies lain di
GeneBank 49
2 Urutan basa nukleotida isolat C939A31 50
3 Urutan basa nukleotida isolat C939A32 50
1 PENDAHULUAN
Latar Belakang
Kopi merupakan salah satu komoditas perkebunan unggulan di Indonesia, namun produksinya terus menurun. Salah satu penyebabnya adalah adanya serangan nematoda, di antaranya Meloidogyne incognita, Pratylenchus coffeae dan Radhopolus similis. Penurunan produksi akibat serangan nematoda tersebut berkisar 28.7%-78.4% pada kopi Robusta (Wiryadiputra dan Atmawinata 1998). Nursol et al. (2006) menyebutkan serangan nematoda parasit pada kopi robusta menyebabkan tanaman hanya dapat bertahan hidup hingga 5 tahun, tetapi pada kopi Arabika hanya dapat bertahan selama 2 tahun (Wiryadiputra dan Atmawinata 1998).
Serangan P. coffeae dapat menyebabkan akar tanaman kopi berwarna kuning, kemudian berubah menjadi coklat, sedangkan akar lateralnya busuk. Luka pada akar tersebut merusak seluruh sistem perakaran kopi sehingga menghambat penyerapan hara dari tanah. Daun menunjukkan gejala klorosis (menguning) dimulai dari daun terdekat dari batang, kemudian cabang-cabang utama tumbuh sedikit, dan batang pohon menjadi mudah digoyang karena akarnya habis, akhirnya tanaman mati (Campos et al. 1990). Pada bibit dan tanaman muda pertumbuhan lambat, tanaman kurus dan kerdil, daun mengecil serta klorosis. Pada daun timbul bercak nekrosis berwarna coklat tua seperti terbakar, dimulai dari ujung daun. Tanaman muda kopi Arabika varietas Kartika 1 dan Kartika 2 yang terserang berat mati sebelum dewasa, atau paling lama setelah berbuah pertama, diawali dengan gejala menguningnya daun. Hal ini berkaitan dengan sebaran populasi nematoda tersebut mulai permukaan tanah hingga kedalaman 30 cm, dimana akar kopi muda sebagian besar berada pada zona kedalaman yang sama. Dalam hamparan pertanaman kopi dewasa, gejala menguning tampak dalam blok-blok tertentu mengikuti jalannya aliran air. Gejala kerusakan diperparah jika tidak ada tanaman penaung dan kurang pemupukan (Hulupi 2008).
Upaya pengendalian nematoda pada tanaman kopi dapat dilakukan dengan kultur teknis, kimiawi, varietas tahan, dan pengendalian secara biologis. Pengendalian kultur teknis dapat dilaksanakan dengan sanitasi kebun, penanaman tanaman perangkap, pergiliran/rotasi tanaman (Wiryadiputra, 1997). Pengendalian secara kimiawi dapat dilakukan dengan sterilisasi media bibit dengan fungisida dan sterilisasi pertanaman dengan nematisida sistemik dan kontak (Mustika 2005). Pengendalian dengan varietas tahan dapat dilakukan dengan penanaman klon BP308 yang telah direkomendasikan sebagai klon yang tahan terhadap nematoda parasit (Surat Keputusan Menteri Pertanian No. 65/Kpts/SR.120/1/2004). Pengendalian secara biologis dapat dilakukan dengan aplikasi agens hayati, salah satunya menggunakan bakteri endofit.
2
ketahanan tanaman oleh bakteri endofit dapat terjadi melalui induksi ketahanan sistemik (induced systemic resistance/ISR) dan ketahanan perolehan (systemis acquire resistance/SAR) (Van Loon dan Bakker 2006). ISR oleh bakteri endofit dapat terjadi dengan pembentukan senyawa lipopolysacharida (LPS) yang menurunkan penetrasi nematoda pada akar, mencegah terbentuknya feeding site dan reproduksi nematoda (Sikora et al. 2007). Mekete et al. (2009) telah menggunakan bakteri endofit Bacillus pumilus dan B. mycoides untuk menekan populasi dan jumlah puru nematoda Meloidogyne incognita pada tanaman kopi. Eksplorasi bakteri endofit dari komoditas kopi di Indonesia telah dilaksanakan oleh (Harni dan Khaerati 2013) dari beberapa lokasi pertanaman kopi di Jawa Barat dan Lampung. Dari 422 isolat hasil eksplorasi, 50 isolat (12.3%) bersifat antagonis terhadap P. coffeae dan 60 isolat (14.21%) dapat meningkatkan pertumbuhan.
Perumusan Masalah
Serangan nematoda luka akar P. coffeae pada tanaman kopi telah menimbulkan kerugian yang tinggi. Berbagai teknologi pengendalian telah dikembangkan, di antaranya pengendalian secara biologi. Hal tersebut menjadi landasan dilaksanakannya penelitian ini. Penelitian ini mencakup kegiatan eksplorasi, seleksi dan pengujian keefektifan bakteri endofit asal tanaman kopi untuk pengendalian nematoda luka akar P. coffeae dan memacu pertumbuhan tanaman.
Tujuan Penelitian
Penelitian ini bertujuan mendapatkan isolat bakteri endofit asal tanaman kopi, baik isolat tunggal maupun konsorsium yang efektif untuk mengendalikan nematoda luka akar P. coffeae dan memacu pertumbuhan tanaman.
Manfaat Penelitian
3
Ruang Lingkup Penelitian
Ruang lingkup penelitian meliputi kegiatan isolasi, seleksi secara in vitro di laboratorium dan pengujian di rumah kaca (Gambar 1).
Gambar 1 Diagram alir penelitian potensi bakteri endofit asal tanaman kopi untuk pengendalian nematoda luka akar Pratylenchus coffeae dan pemacu pertumbuhan tanaman
Isolasi bakteri endofit dari tanaman kopi (akar, batang, daun)
Pengelompokan isolat tunggal (Bacillus, fluoresen, aktinomiset)
Isolat Konsorsium Pengambilan sampel
Uji Reaksi Hipersensitif Uji Hemolisis
Penyediaan nematoda P. coffeae
Karakterisasi Fisiologis (Kitinolitik, Proteolitik, Lipolitik,
HCN, Pelarut P, Fiksasi N) Uji
pertumbuhan secara in vitro
Antibiosis bakteri endofit terhadap P. coffeae secara in vitro
Uji potensi bakteri endofit di rumah kaca
4
2 TINJAUAN PUSTAKA
Pertanaman Kopi Di Indonesia
Kopi merupakan salah satu komoditas perkebunan di Indonesia. Kopi Arabika varietas Typica merupakan jenis kopi yang pertama kali dibudidayakan di Indonesia. Pada tahun 1959, penyakit karat daun mulai menyerang pertanaman kopi di Indonesia, sehingga varietas tersebut hanya mampu bertahan jika ditanam pada ketinggian > 1250 m dpl. Kopi Liberika (Coffea liberica) dan Ekselsa (Coffea dewevrei var. excelsa) diintroduksi untuk penanaman di lahan rendah. Kedua jenis kopi tersebut memiliki produktivitas yang rendah dan citarasa kopi yang asam, sehingga kurang disukai (Yahmadi, 1972). Pada saat ini jenis kopi tersebut hanya dijumpai di lahan gambut (Sumatera dan Kalimantan) sebagai konsumsi lokal. Selanjutnya jenis kopi Robusta (Coffea canephora var. robusta) (kopi Robusta) diintroduksi untuk mengatasi kelemahan kedua jenis kopi sebelumnya.
Hasil pengamatan lapangan menunjukkan bahwa sebagian besar klon anjuran maupun varietas lokal kopi Robusta di Indonesia rentan serangan nematoda parasit. Klon-klon kopi Robusta anjuran, BP 42, BP 358, BP 409, BP 436, BP 534, BP 936 dan BP 939 rentan nematoda P. coffeae (Wiryadiputra dan Hulupi 1997), dan sampai saat ini baru ditemukan satu genotipe yang menunjukkan reaksi tahan, yaitu klon BP 308 (Mawardi et al. 2003). Hal serupa juga terjadi pada kopi Arabika, semua varietas anjuran kopi Arabika tidak tahan serangan nematoda parasit, dengan tingkat kerentanan berbeda-beda. Varietas S 795 merupakan varietas yang mampu beradaptasi pada kondisi lahan marginal namun ternyata rentan terhadap nematoda parasit (Hulupi 2006).
Nematoda Luka Akar Pratylenchus coffeae
5 nematoda luka akar (root-lesion nematodes) diturunkan dari luka nekrotik yang mudah terlihat pada akar inangnya. Genus Praylenchus terdiri atas 68 spesies yang tersebar di seluruh dunia dengan berbagai jenis tanaman inang, di antaranya Pratylenchus brachyurus yang menyerang tanaman herba dan buah-buahan, Pratylenchus coffeae (Zimmermann 1898) Filipjev & Schuurmans Stekhoven yang menyerang kopi, jeruk, tebu dan teh, Pratylenchus loosi Loof 1960 yang menyerang teh, Pratylenchus penetrans Cobb 1917 yang memarasit tanaman buah, rumput dan strawberi, serta 64 spesies lainnya (Castillo dan Vovlas 2007).
Nematoda P. coffeae dilaporkan sebagai tipe lokal yang pertama kali tersebar luas di Asia (India, Thailand, Vietnam, Taiwan, Jepang), Eropa dan USA (Zhang et al. 2002; Giribabu dan Saha 2003; Lee et al. 2006; Van den Berg et al. 2006; Inserra et al. 2001; Adiko dan N’Guessan 2001; Urek et al. 2003); dan di Spanyol memarasit pisang (Castillo dan Vovlas 2007).
Pratylenchus coffeae (Zimmermann) Filipjev & Schuurmans Stekhoven termasuk ke dalam kingdom Animalia, filum Nematoda, kelas Secernentea, subkelas Tylenchia, ordo Tylenchida, subordo Tylenchina, superfamili Tylenchoidea, famili Pratylenchidae, subfamili Pratylenchinae, genus Pratylenchus (Goodey 1973). P. coffeae dicirikan oleh tubuh nematoda betina agak silinder saat masih muda dan menjadi agak datar saat sudah tua/dewasa, kutikula memiliki anulasi yang jelas. Bagian lateral memiliki 4 atau kadang-kadang 5/6 garis. Daerah bibir datar/agak offset dari tubuhnya, dengan dua/tiga anul yang jelas pada satu sisi bibir. Bagian bawah dicirikan oleh fusi antara subdorsal, subventral dan bibir lateral dengan mulut yang datar (Corbett dan Clark 1983; Hernández et al. 2000). Pangkal knob dari stiletnya melingkar hingga lonjong. Kantong post-vulva uterine berukuran 1-1.5 kali diameter tubuh, panjang mencapai 90 μm, ovarium tidak berkembang dan terkadang memiliki oocyte. Spermateka besar, berbentuk oval atau hampir bulat, biasanya dengan sperma. Telur pada intra-uterin terdiri atas embrio-embrio. Ekor berukuran 2-2.5 kali diameter bagian tubuh anal pada betina muda, dan 1.5-2 kali diameter bagian tubuh anal pada betina dewasa; bagian terminal kadang-kadang tampak melingkar lembut, truncate atau crenate tidak beraturan (Castillo dan Vovlas 2007). Nematoda betina memiliki ukuran panjang tubuh 0.45-0.70 mm, anulus 25-35 μm, vulva 76-83, dan stilet 15-18 μm. Jumlah nematoda jantan biasanya berlimpah. spikula ramping, dengan manubria yang terbentuk baik dan poros bagian ventral melengkung, panjang tubuh 16-20 μm, panjang gubernaculum 4-7 μm, hypoptygma menonjol (Castillo dan Vovlas 2007). Nematoda jantan tersebut memiliki ukuran 0.45-0.70 mm, anulus 26-40 μm, stilet 15-17 μm (Sher dan Allen, 1953).
6
betina, dan ujung ekor P. coffeae yang agak datar atau truncate atau hemispherical dibandingkan meruncing secara jelas/lembut pada P. loosi. Siddiqi (2000) meneliti paratipe dari R. allius dan R. brassicae, dan menemukan bahwa keduanya termasuk dalam genus Pratylenchus. Setelah studi paratipe tersebut, Siddiqi (2000) memutuskan bahwa P. brassicae (Shahina dan Maqbool, 1996) merupakan sinonim dari P.coffeae.
Luc et al. (1995) menyebutkan bahwa nematoda P. coffeae dicirikan oleh dua anul pada daerah bibir, bagian kepala tampak rendah dan datar. Panjang tubuh berkisar antara 0.37 – 0.83 mm. Bagian anterior agak cembung dan tidak ada tanda-tanda seksual dimorfisme. Bentuk tubuhnya sedikit bengkok pada bagian ventralnya saat fase istirahat/mati. Nematoda jantan mempunyai ciri-ciri yaitu ekornya pendek, bagian dorsalnya seperti kerucut dan melengkung, spikulanya silindris memanjang dan melengkung. Bentuk spermateka nematoda jantan melingkar dan dipenuhi oleh sperma. Nematoda betina mempunyai vulva di bagian posterior. Pos-vulva bervariasi namun tidak berfungsi (mono-prodelfik). P. coffeae mempunyai stilet yang panjang (14-18 µm) dan mengalami sklerotinisasi sedang, basal knob berbentuk bulat serta bagian anteriornya berbentuk cekung.
P. coffeae bersifat semimigratori endoparasitik dan bereproduksi secara seksual/amfimiktik. Semua stadium hidupnya terdapat di dalam jaringan korteks inangnya. Nematoda ini mempunyai 4 stadium juvenil dan dewasa. Perkembangbiakan P. coffeae mencapai optimum pada suhu tanah relatif tinggi yaitu 26-30 0C. Pada suhu tersebut populasi nematoda dapat menyelesaikan daur hidupnya kurang dari satu bulan dan dapat mencapai tingkat populasi sebanyak 10 000 ekor/g akar. Nematoda dapat bertahan hidup tanpa tumbuhan inang selama beberapa bulan atau paling sedikit 4 bulan. Perpindahan nematoda ini melalui tanah berjalan sangat lambat yaitu sekitar satu meter tiap tahun. Nematoda bersifat patogenik pada tanah pasiran sampai tanah debuan pasiran (Luc et al. 1995). Pada umumnya, populasi P. coffeae meningkat pada musim hujan dan mencapai puncaknya ketika 7-8 bulan setelah masa tanam. Populasi P. coffeae menurun pada kondisi tanah yang mempunyai pH 3.85 - 6 (Castillo dan Vovlas 2007).
7 sebelum dewasa, atau paling lama setelah berbuah pertama, diawali dengan gejala klorosis. Hal ini berkaitan dengan sebaran populasi nematoda tersebut mulai permukaan tanah hingga kedalaman 30 cm, dimana akar kopi muda sebagian besar berada pada zona kedalaman yang sama. Dalam hamparan pertanaman kopi dewasa, gejala menguning tampak dalam blok-blok tertentu mengikuti jalannya aliran air. Gejala kerusakan diperparah jika tidak ada tanaman penaung dan kurang pemupukan (Hulupi 2008).
Kerugian Akibat Serangan P. coffeae
Serangan P. coffeae pada kopi robusta dapat menyebabkan penurunan produksi sampai 57% atau berkisar 28.7-78.4 % (Wiryadiputra dan Atmawinata 1998), dan tanaman hanya dapat bertahan sampai umur 5 tahun, dengan tingkat kematian mencapai 30% (Nursol et al. 2006). Serangan pada kopi Arabika menyebabkan tanaman hanya dapat bertahan selama 2 tahun. Serangan Radhopolus similis bersama-sama dengan P. coffeae pada kopi Arabika dapat mengakibatkan kerusakan lebih parah yaitu 80% dan tanaman akan mati pada umur kurang dari 3 tahun (Wiryadiputra dan Atmawinata 1998). Di daerah grassland ekosistem subtropis utara, kejadian penyakit akibat Pratylenchus adalah 84% lebih sering terjadi dibanding nematoda sista (21% kejadian penyakit) atau puru akar (19% kejadian penyakit) (De Goede dan Bongers 1998).
Pengendalian Nematoda P. coffeae
Pengendalian nematoda pada tanaman kopi selama ini dilakukan dengan kultur teknis, mekanis, kimiawi, bahan tanam tahan, dan secara biologi (CABI 2014; Wiryadiputra 1997; Wiryadiputra dan Hulupi 1997). Pengendalian kultur teknis dapat dilaksanakan dengan sanitasi kebun, penanaman tanaman perangkap, pergiliran/rotasi tanaman (rumput guatemala/Trypsacum laxum, Tagetes patula, Crotalaria anagyroides, C. striata dan C. usaramuensis, tebu, kakao terutama kakao Lindak (Bulk cocoa), dan karo benguk (Mucuna sp.) (Wiryadiputra 1997). Pengendalian secara mekanis dapat dilakukan dengan solarisasi/pemberaan tanah dan hot water treatment pada benih. Pengendalian secara kimiawi dapat dilakukan dengan sterilisasi media bibit dan pertanaman digunakan nematisida sistemik dan kontak (oksamil, karbofuran, etoprofos dan kadusafos) (Mustika 2005). Penggunaan bahan tanam tahan dapat dilaksanakan dengan menanam jenis kopi Ekselsa (Coffea exelsa), yaitu Bgn. 121.09, dan Robusta (C. canephora var. robusta), yaitu BP 961 dan BP 308 (Wiryadiputra 1997; Wiryadiputra dan Hulupi 1997).
Pengendalian Nematoda Parasit dengan Bakteri Endofit
8
salah satu komponen dari konsep pengendalian penyakit secara terpadu untuk mengurangi kepadatan inokulum dan aktivitas patogen, dengan memanipulasi lingkungan dan inang menggunakan satu atau lebih agens antagonis. Agens pengendali hayati mempunyai kemampuan mempengaruhi pertumbuhan dan aktivitas patogen karena diduga adanya senyawa metabolit yang dikeluarkan serta adanya kompetisi ruang dan nutrisi (Baker dan Cook 1974). Agens antagonis terbukti tidak menimbulkan efek negatif bagi lingkungan maupun organisme lain (Graham dan Mitchell 1999). Agens antagonis baik dari golongan bakteri maupun cendawan, hidup pada habitat yang sama dengan patogen (Thomas et al. 1999). Pengendalian secara biologi menggunakan bakteri endofit menjadi pilihan yang cukup menjanjikan karena P. coffeae termasuk patogen yang sulit dikendalikan. Castillo dan Vovlas (2007) menyebutkan bahwa kemampuan beberapa spesies Pratylenchus untuk bertahan dalam kondisi anhydrobiosis merupakan salah satu penyebab mengapa nematoda tersebut sulit dieradikasi dari lahan yang telah terinfeksi. Beberapa studi menyebutkan bahwa P. coffeae dapat bertahan lama dalam kondisi kering di tanah. Tsai (2008) melaporkan bahwa P. coffeae merespon pengeringan yang lambat dengan membungkukkan tubuhnya dalam bentuk coil yang ketat. Dalam kondisi tersebut individu P. coffeae dapat direaring hingga 9 bulan dengan tingkat survival mencapai 36.1%.
Bakteri endofit didefinisikan sebagai bakteri yang hidup dalam jaringan tanaman, tanpa menyebabkan kerugian bagi tanaman inang (Hallmann et al. 1999). Hubungan antara tanaman dan bakteri endofit merupakan interaksi secara tertutup, dengan tanaman menyediakan nutrisi bagi bakteri endofit dan bakteri endofit meningkatkan pertumbuhan dan kesehatan tanaman. Penambatan nitrogen (N2) secara biologis oleh sejumlah spesies bakteri endofit memiliki keunggulan dibandingkan bakteri rizosfer, karena keberadaannya di dalam jaringan interseluler tanaman yang tidak mudah hilang, sedangkan nitrogen yang berada bebas di alam sangat bersifat labil, mudah tercuci air hujan dan erosi, dan mudah menguap ke udara (Susilowati et al. 2007).
Chandrashekhara et al. (2007), menyatakan bahwa bakteri endofit dari beberapa genera seperti Pseudomonas, Bacillus dan Azospirillum, dilaporkan mampu meningkatkan pertumbuhan tanaman, menguraikan dinding sel patogen, dan menghambat pertumbuhan patogen dengan menghasilkan senyawa antimikroba. Aktinomiset/actinobacteria merupakan satu grup bakteri gram positif yang banyak dilaporkan memproduksi antibiotik (Chantongcome et al. 2009).
9 mekanisme kerja bakteri endofit dalam mengendalikan P. brachyurus pada tanaman nilam adalah dengan menginduksi ketahanan tanaman melalui peningkatan produksi asam salisilat, peroksidase dan fenol oleh bakteri endofit A. xylosoxidans TT2, A. faecalis NJ16 dan P. putida EH11. Di samping itu, bakteri endofit juga dapat memicu pertumbuhan tanaman melalui peningkatan indole acetic acid terutama pada perlakuan dengan Bacillus cereus MSK.
10
3 METODE
Waktu dan Tempat
Penelitian dilaksanakan dari bulan Januari 2014 hingga Agustus 2015, di Laboratorium Nematologi dan Laboratorium Bakteriologi Departemen Proteksi Tanaman IPB, Laboratorium Mikrobiologi BPTP Jakarta, dan rumah kaca University Farm Cikabayan IPB.
Ekstraksi dan Perbanyakan Nematoda P. coffeae
Nematoda P. coffeae diperoleh dari koleksi Laboratorium Pusat Penelitian Kopi dan Kakao Jember. P. coffeae diperbanyak pada bibit kopi umur +2 bulan. Nematoda diinokulasikan sebanyak 50 ekor/tanaman dan digunakan sebagai sumber inokulum. Setelah inkubasi selama 2-6 bulan, nematoda P. coffeae diekstraksi dari contoh akar tanaman kopi yang terinfeksi nematoda dengan metode mist chamber (Viglierchio dan Schmitt 1983).Akar dipotong-potong +1-2 cm dan diletakkan di atas corong yang telah dialasi dengan kain saring. Corong yang telah terisi akar diletakkan di dalam ruang mist chamber. Pemanenan nematoda dilakukan setelah 2-3 hari dengan mengambil air dalam wadah penampung dan disaring dengan saringan berukuran 500 mesh.
Nematoda yang diperoleh diidentifikasi secara morfologi dengan pengamatan preparat semipermanen. Pembuatan preparat semipermanen mengikuti metode Goodey (1973) yang telah dimodifikasi. Lingkaran parafin dibuat di atas gelas objek dengan menggunakan bor gabus (cork borer) dengan ketebalan yang sama, kemudian diteteskan laktofenol pada tengah lingkaran parafin. Sebanyak 3-5 ekor nematoda diletakkan pada larutan laktofenol dengan posisi sejajar dan ditutup cover glass. Preparat kemudian dipanaskan di atas lampu bunsen. Pinggir cover glass direkatkan dengan kuteks transparan. Pengamatan morfologi dilakukan menggunakan mikroskop dan didokumentasikan menggunakan kamera. Identifikasi dilakukan mengacu pada buku identifikasi nematoda yaitu: buku Plant Parasitic Nematodes : a Pictorial Key to Genera (May et al. 1996). Nematoda telah diidentifikasi sebagai nematoda P. coffeae, digunakan untuk pengujian in vitro dan di rumah kaca.
Isolasi dan Pengelompokan Bakteri Endofit
Isolasi Isolat Tunggal Bakteri Endofit dari Tanaman Kopi
11 2 menit, dilanjutkan perendaman dalam NaOCl 3% + 0.05% Tween 20 selama 4 menit. Pembilasan terakhir dilakukan dengan aquadest steril sebanyak tiga kali. Sampel selanjutnya digerus menggunakan mortar steril sampai halus dan dilakukan pengenceran berseri hingga 10-3. Suspensi pada tingkat pengenceran 10 -2 dan 10-3 ditumbuhkan pada media
Trypsic Soybean Agar (TSA) 20% lalu diinkubasi selama 24 jam pada suhu ruang. Sebagai pembanding atau kontrol, akar, batang dan daun yang sudah disterilisasi permukaan (sebelum dihancurkan) digoreskan pada media TSA 20%. Jika pada kontrol tidak tumbuh bakteri maka koloni bakteri hasil isolasi dapat diasumsikan sebagai endofit.
Koloni bakteri endofit yang tumbuh dimurnikan pada media TSA 100%. Jumlah total bakteri merupakan perkalian jumlah koloni dengan faktor pengencerannya. Penyimpanan isolat bakteri endofit menggunakan media TSB 100% + 20% gliserol pada suhu -20 ˚C.
Isolasi Konsorsium Bakteri Endofit dari Tanaman Kopi
Isolasi konsorsium bakteri endofit yang dilakukan sama dengan metode isolasi endofit koloni tunggal. Seluruh koloni bakteri endofit dari isolasi yang tumbuh dipanen dengan diluruhkan. Pemanenan dilakukan dengan menuangkan 2 mL media Trypsic Soybean Broth (TSB )100% + gliserol 20% pada biakan koloni di cawan petri. Suspensi konsorsium bakteri endofit tersebut kemudian disimpan dalam tabung eppendorf 1.5 mL pada suhu -20 oC.
Uji Hipersensitivitas
Uji hipersensitif mengikuti metode Klement dan Goodman (1967). Isolat tunggal dan konsorsium bakteri endofit dikulturkan pada media TSB 100% dan dishaker dengan kecepatan 100 rpm selama 24 jam. Suspensi bakteri endofit disuntikkan pada lamina daun tembakau sehat bagian bawah, menggunakan jarum suntik, masing-masing sebanyak 2 mL dengan tiga kali ulangan untuk setiap isolat. Tanaman tembakau diinkubasi selama 48 jam. Pengamatan dilakukan terhadap terjadinya klorosis/nekrosis pada daun tembakau. Isolat yang tidak menunjukkan terjadinya nekrosis pada daun digunakan untuk pengujian selanjutnya.
Uji Hemolisis
12
warna media ( -hemolisis) akan digunakan untuk pengujian lebih lanjut (Khusnan et al. 2008).
Pengelompokan Isolat Tunggal Bakteri Endofit
Bakteri endofit hasil isolasi dikelompokkan ke dalam kelompok Fluoresen, Aktinomiset dan Bacillus, dengan menggunakan media selektif. Pengelompokan ini bertujuan untuk mempermudah identifikasi lebih lanjut.
Bakteri endofit kelompok Fluoresen. Satu ose isolat bakteri endofit dibiakkan pada media King’s B 100% (20 g protease pepton, 1.5 g K2HPO4, 1.5 g MgSO4, 15 mL gliserol, 15 g agar, dan 1 000 mL akuades, (Schaad et al. 2001)) dan diinkubasikan 24-48 jam. Biakan diamati di bawah sinar UV dengan panjang 360 nm. Biakan bakteri yang berpendar di bawah sinar UV merupakan kelompok Fluoresen.
Bakteri endofit kelompok Aktinomiset. Satu ose isolat bakteri endofit dibiakkan pada media Water Yeast Extract Agar (WYE) (Schaad et al. 2001). Inkubasi dilakukan selama 1-2 minggu. Biakan yang dapat membentuk spora merupakan kelompok Aktinomiset.
Bakteri endofit kelompok Bacillus. Satu ose isolat bakteri disuspensikan dalam 20 mL aquadest steril, divortex hingga homogen, dan diinkubasi pada suhu +80-90 oC selama 20 menit. Sebanyak 100 µL suspensi disebar dan diratakan pada media TSA 100% dan diinkubasi selama 24-48 jam. Isolat bakteri yang dapat tumbuh setelah perlakuan suhu 80-90 oC merupakan bakteri dari kelompok Bacillus.
Seleksi Bakteri Endofit sebagai Agens Hayati Secara In Vitro
Pengaruh bakteri endofit terhadap mortalitas nematoda P. coffeae secara in vitro
13
Kemampuan bakteri endofit sebagai pemacu pertumbuhan tanaman secara
in vitro
Seleksi isolat tunggal dan konsorsium bakteri endofit sebagai pemacu pertumbuhan tanaman dilakukan mengikuti metode Harni dan Khaerati (2013) yang dimodifikasi. Benih tomat varietas Ratna digunakan sebagai benih uji. Pemilihan benih tomat sebagai benih uji disebabkan pertumbuhannya yang lebih cepat dibanding benih kopi, yang memerlukan waktu hingga dua bulan sampai menghasilkan akar. Sterilisasi permukaan benih tomat dilakukan dengan hot water treatment. Benih tomat direndam dalam aquadest steril pada suhu +55 oC selama 20 menit, dilanjutkan dalam suspensi isolat tunggal atau konsorsium bakteri endofit selama +1 jam. Benih yang telah direndam ditiriskan pada kertas tisu steril dan ditanam pada kertas saring steril yang dilembabkan. Benih tomat yang direndam dengan air steril dan ditanam pada media yang sama digunakan sebagai kontrol. Pengamatan terhadap panjang batang dan akar dilakukan 4 hari setelah tanam. Pengujian dilaksanakan dengan rancangan acak lengkap, setiap perlakuan diulang sebanyak 5 kali.
Karakterisasi Fisiologis Bakteri Endofit
Aktivitas kitinolitik
Uji kitinolitik dilakukan mengikuti metode Marin et al. (2013) yang dimodifikasi. Isolat tunggal dan konsorsium bakteri dibiakkan pada media trypsic soybean broth (TSB) dan digojog selama 24 jam dengan kecepatan 100 rpm. Kertas saring steril Ø 0.5cm diletakkan pada media nutrient agar (NA) yang diperkaya koloidal kitin 0.4%. Sebanyak 4 µL biakan diinokulasikan pada kertas saring. Biakan diinkubasi pada suhu ruang selama 72-96 jam. Aktivitas kitinolitik diukur dari diameter zona bening yang terbentuk.
Aktivitas proteolitik
Aktivitas proteolitik diuji mengikuti prosedur Denizci et al. (2004) yang dimodifikasi. Kultur cair isolat diinokulasikan pada kertas saringsteril pada media skim milk agar (SMA: 900 mL media trypsic soya agar (TSA) 100% steril, 100 mL susu skim steril konsentrasi 10%). Inkubasi dilakukan pada suhu ruang selama 24-72 jam. Aktivitas proteolitik ditunjukkan dengan terbentuknya zona bening di sekitar koloni bakteri (Baehaki dan Budiman 2011).
Aktivitas lipolitik
14
Kemampuan pelarutan fosfat
Kemampuan pelarutan fosfat (P) dilakukan mengikuti metode Gupta et al. (2012) yang dimodifikasi. Kertas saring steril diletakkan sedemikian rupa pada media Pikovskaya. Isolat diinokulasi pada kertas saring tersebut dan diinkubasi selama 48 jam pada suhu 30 °C. Kemampuan hidup bakteri pelarut fosfat pada media ditandai dengan terbentuknya zona bening (halo) di sekitar koloni bakteri.
Fiksasi nitrogen (N2)
Kemampuan fiksasi N diuji dengan menumbuhkan isolat pada media semi solid NFB (Nitrogen Fixing Bacteria), yaitu 1 mL biakan cair dalam 10 mL media NFB (Yim et al. 2009). Inkubasi dilakukan 4-7 hari hingga terjadi perubahan warna media dari kehijauan menjadi kebiruan, serta muncul pelikel/cincin bakteri pada media.
Produksi HCN
Produksi HCN/asam sianida diuji mengikuti prosedur Castric (1975) yang dimodifikasi. Media yang digunakan adalah nutrient agar (NA) 100% yang mengandung 4.4 g glisin. Produksi asam sianida dideteksi dengan larutan cyanide detection solution (CDS), berupa: 200 mL aquadest steril yang mengandung 2 g asam pikrat dan 8 g Sodium Karbonat (Na2CO3). Kertas saring dipotong dengan ukuran 1 x 1 cm dan disterilkan. Isolat konsorsium bakteri uji digoreskan secara kuadran pada media NA yang diperkaya glisin. Pada bagian tutup cawan petri diletakkan kertas saring steril yang telah direndam dalam larutan CDS dan dikeringanginkan. Pengamatan dilakukan pada hari ke-4 setelah inokulasi. Produksi HCN ditandai dengan berubahnya warna kertas saring dari kuning cerah menjadi oranye kemerahan.
Seleksi Bakteri Endofit sebagai Agens Hayati di Rumah Kaca
15 Pengamatan dilakukan terhadap kemampuan bakteri endofit dalam menekan nematoda P. cofeeae dan pertumbuhan tanaman. Daya antagonis diamati dengan menghitung faktor reproduksi (pf/pi) nematoda. Faktor reproduksi adalah perbandingan antara populasi akhir dengan populasi awal nematoda. Nematoda pada akar diekstraksi dengan metode pengabutan, sedangkan nematoda dari tanah diekstraksi dengan metode sentrifugasi. Sentrifugasi dilakukan dengan mengambil tanah dalam polibag tanaman sebanyak 100 mL dan disaring dengan saringan bertingkat 100 mesh dan 400 mesh. Tanah hasil saringan disentrifugasi dengan kecepatan 3 500 rpm selama 5 menit. Supernatannya dibuang dan sisa tanah dicampur dengan air gula konsentrasi 40% dan disentrifus lagi dengan kecepatan 3 500 rpm selama 2.5 menit. Hasilnya disaring dengan saringan 500 mesh dan diamati jumlah nematoda yang ada.
Pertumbuhan tanaman diamati dengan mengukur tinggi tanaman seminggu sekali, dan mengukur berat basah serta berat kering batang dan akar pada akhir pengamatan. Percobaan dilaksanakan dengan rancangan acak lengkap, tiap perlakuan diulang 4 kali dan setiap ulangan terdiri dari 4 unit pengamatan.
Identifikasi Bakteri Endofit Berdasarkan Sekuen Gen 16S rRNA
Isolasi DNA total bakteri endofit mengikuti prosedur GeneJET Genomic DNA Purification Kit #K0722® (Thermo Scientific, Lithuania). Gen 16S rRNA diamplifikasi menggunakan sepasang primer universal untuk kelompok prokariotik, yaitu 27F (5’-AGA GTT TGA TCC TGG CTC AG-3’) dan 1492R (5’-GGT TAC CTT ACG ACT T-3’) (Lane 1991). Volume total reaksi untuk PCR adalah 25 L, terdiri atas 24 L bahan PCR (MgCl2 1.5 mM, dNTPs 0.2 mM, Taq polymerase 5 unit/reaksi, ddH2O 9.5 L, primer 27F 20 pmol 1 L, dan primer1492R 20 pmol 1 L) dan 1 Ltemplate DNA isolat yang diuji. Program PCR dilaksanakan dengan kondisi sebagai berikut: satu siklus predenaturasi pada 94 oC selama 3 menit; 30 siklus yang terdiri dari denaturasi 94 oC selama 30 detik, annealing pada 57 oC selama 30 detik, ekstensi pada 72 oC selama 1.5 menit; dan satu siklus ekstensi akhir pada 72 oC selama 5 menit, serta 4 oC penyimpanan. Produk PCR dikirim ke 1st BASE Sequencing Singapura untuk dilakukan proses perunutan. Hasil runutan basa nukleotida gen 16S rRNA dianalisis menggunakan program Basic Local Allignment Search Tool (BLAST) untuk mendapatkan kesamaan data runutan pada GeneBank. Selanjutnya tingkat homologi runutan basa nukleotida isolat terpilih dengan spesies lain pada Genebank dianalisis menggunakan program Bioedit®.
Analisis Data
16
4 HASIL DAN PEMBAHASAN
Ekstraksi dan Perbanyakan Nematoda P. coffeae
Akar yang digunakan sebagai sumber inokulum nematoda P. coffeae menunjukkan gejala kerusakan berupa luka hitam dalam akar yang berkembang menjadi nekrosis ke seluruh permukaan akar. Serangan awal ditandai luka (nekrosis) yang hanya terjadi pada akar sekunder atau serabut. Luka tersebut dikelilingi oleh sel-sel epidermis yang mati dan berwarna pucat. Luka dapat meluas ke seluruh jaringan parenkim. Infeksi stadium akhir, ditandai dengan jaringan parenkim hancur dan jaringan korteks terpisah dari silinder pusat. Serangan stadium akhir tersebut menyebabkan akar serabut hancur, bahkan nekrosis berlanjut pada jaringan akar tunggang (Gambar 2). Visualisasi gejala tersebut sesuai dengan penjelasan Luc et al. (1995) yang menyebutkan bahwa gejala kerusakan nematoda ini adalah luka hitam yang berkembang di dalam akar pada tempat nematoda parasitik menginfeksi kemudian berkembang menjadi nekrosis yang meluas sampai ke seluruh permukaan akar. Luka tersebut dikelilingi oleh sel-sel epidermis yang mati dan berwarna pucat serta dapat meluas ke seluruh jaringan parenkim. Stadium akhir dari infeksi, jaringan parenkim tersebut hancur dan jaringan korteks terpisah dari silinder pusat.
A. B.
Gambar 2 Gejala serangan nematoda P. coffeae pada akar kopi, A. Serangan awal P.coffeae pada akar serabut, tampak akar mengalami nekrosis; B. Serangan stadium akhir, akar serabut telah hancur, B1: akar tunggang mengalami nekrosis, B2: jaringan parenkim dan korteks telah hancur
Hasil ekstraksi nematoda P. coffeae dari akar bergejala tersebut diperoleh nematoda yang pada saat posisi istirahat memiliki bentuk tubuh sedikit bengkok pada bagian ventralnya. Bagian kepala datar dan rendah. Stilet kuat dengan sklerotinisasi yang sedang dengan knop yang berbentuk bulat (stomato-stylet). Nematoda jantan memiliki spikula yang panjang dan melengkung, ekor pendek.
B1
17 Secara keseluruhan tubuh memiliki anulasi yang cukup jelas dan esofagus yang overlapping dengan bagian anterior (Gambar 3). Hal tersebut sesuai dengan morfologi nematoda P. coffeae sebagaimana dijelaskan oleh Luc et al. (1995).
A.
C. B.
Gambar 3 Inokulum nematoda P. coffeae yang digunakan untuk pengujian, pengamatan di mikroskop dengan perbesaran 400x, A. nematoda betina, B. nematoda jantan, C. bentuk stilet dan kepala nematoda P. coffeae
Isolasi, Seleksi, dan Karakterisasi Bakteri Endofit Asal Tanaman Kopi
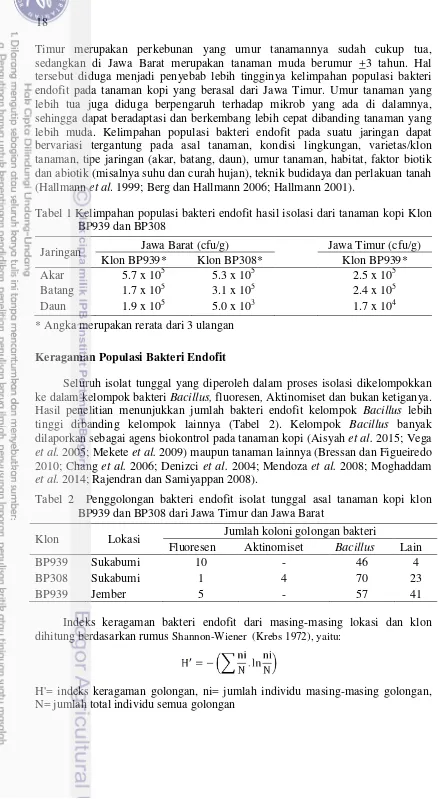
Kelimpahan Populasi Bakteri Endofit
Hasil penghitungan bakteri endofit dari masing-masing jaringan, klon dan asal lokasi disajikan pada Tabel 1. Populasi bakteri endofit pada jaringan akar kopi klon BP939 dan BP308 asal Jawa Barat, serta klon BP939 asal Jawa Timur lebih tinggi dibanding populasi endofit dari jaringan batang dan daun. Lugtenberg dan Kravchenko (1999) melaporkan bahwa kelimpahan populasi bakteri endofit yang tertinggi adalah pada akar atau daerah rizosfer. Perakaran/rizosfer menyediakan nutrisi yang melimpah bagi bakteri endofit, baik berupa eksudat akar maupun sisa-sisa jaringan akar yang telah mati.
18
Timur merupakan perkebunan yang umur tanamannya sudah cukup tua, sedangkan di Jawa Barat merupakan tanaman muda berumur +3 tahun. Hal tersebut diduga menjadi penyebab lebih tingginya kelimpahan populasi bakteri endofit pada tanaman kopi yang berasal dari Jawa Timur. Umur tanaman yang lebih tua juga diduga berpengaruh terhadap mikrob yang ada di dalamnya, sehingga dapat beradaptasi dan berkembang lebih cepat dibanding tanaman yang lebih muda. Kelimpahan populasi bakteri endofit pada suatu jaringan dapat bervariasi tergantung pada asal tanaman, kondisi lingkungan, varietas/klon tanaman, tipe jaringan (akar, batang, daun), umur tanaman, habitat, faktor biotik dan abiotik (misalnya suhu dan curah hujan), teknik budidaya dan perlakuan tanah (Hallmann et al. 1999; Berg dan Hallmann 2006; Hallmann 2001).
Tabel 1 Kelimpahan populasi bakteri endofit hasil isolasi dari tanaman kopi Klon BP939 dan BP308
Jaringan Jawa Barat (cfu/g) Jawa Timur (cfu/g)
Klon BP939* Klon BP308* Klon BP939*
Akar 5.7 x 105 5.3 x 105 2.5 x 105
Batang 1.7 x 105 3.1 x 105 2.4 x 105
Daun 1.9 x 105 5.0 x 103 1.7 x 104
* Angka merupakan rerata dari 3 ulangan
Keragaman Populasi Bakteri Endofit
Seluruh isolat tunggal yang diperoleh dalam proses isolasi dikelompokkan ke dalam kelompok bakteri Bacillus, fluoresen, Aktinomiset dan bukan ketiganya. Hasil penelitian menunjukkan jumlah bakteri endofit kelompok Bacillus lebih tinggi dibanding kelompok lainnya (Tabel 2). Kelompok Bacillus banyak dilaporkan sebagai agens biokontrol pada tanaman kopi (Aisyah et al. 2015; Vega et al. 2005; Mekete et al. 2009) maupun tanaman lainnya (Bressan dan Figueiredo 2010; Chang et al. 2006; Denizci et al. 2004; Mendoza et al. 2008; Moghaddam et al. 2014; Rajendran dan Samiyappan 2008).
Tabel 2 Penggolongan bakteri endofit isolat tunggal asal tanaman kopi klon BP939 dan BP308 dari Jawa Timur dan Jawa Barat
Klon Lokasi Jumlah koloni golongan bakteri
Fluoresen Aktinomiset Bacillus Lain
BP939 Sukabumi 10 - 46 4
BP308 Sukabumi 1 4 70 23
BP939 Jember 5 - 57 41
Indeks keragaman bakteri endofit dari masing-masing lokasi dan klon dihitung berdasarkan rumus Shannon-Wiener (Krebs 1972), yaitu:
19 Keragaman golongan bakteri asal klon BP939 lokasi Jawa Timur lebih tinggi dibanding Jawa Barat. Secara umum keragaman golongan bakteri pada akar lebih tinggi dibandingkan bagian lainnya, sedangkan keragaman bakteri pada akar klon BP939 lokasi Jawa Barat lebih rendah dibanding bagian lainnya (Tabel 3). Keragaman bakteri endofit hasil isolasi sangat dipengaruhi oleh berbagai faktor, di antaranya varietas atau klon atau jenis hibrida (Liu et al. 2012) dan lokasi pengambilan sampel. Liu et al. (2012) menyebutkan bahwa perbedaan genotipe tanaman inang diduga berpengaruh terhadap keragaman spesies bakteri endofit pada 4 hibrida jagung dan tetuanya. Pengaruh geografis telah dilaporkan oleh Munif (2001) bahwa tanaman tomat di daerah subtropis seperti di Born (Jerman) hanya ditemukan 38 spesies bakteri endofit dari 21 genus, sedangkan di daerah tropis seperti Bogor (Indonesia) ditemukan 50 spesies dari 32 genus. Spesies yang paling banyak ditemukan di kedua wilayah geografis tersebut adalah Pseudomonas putida dan Bacillus megaterium sebagaimana sering dilaporkan di daerah lain di dunia (Hallmann dan Berg 2007).
Tabel 3 Indeks keragaman (H') bakteri endofit isolat tunggal asal tanaman kopi klon BP939 dan BP308 dari Jawa Timur dan Jawa Barat
Klon Lokasi Keragaman Bakteri Tiap Bagian Tanaman (H') H'
Akar Batang Daun
BP939 Sukabumi 0.56 0.69 0.76 0.79
BP308 Sukabumi 0.80 0.67 0.53 0.76
BP939 Jember 0.89 0.80 0.66 0.84
H' dihitung dengan rumus Shannon-Wiener (Krebs 1972), nilai H' ≤ 1: keragaman rendah, 1≤ H' ≤ 3: keragaman sedang, H' > 5: keragaman tinggi
Perbedaan karakteristik genetik, morfologi dan fisiologi dari kultivar tanaman diketahui berpengaruh terhadap keragaman bakteri endofit pada bibit kapas. Kultivar kapas yang memiliki ketahanan tinggi ternyata tidak hanya dipengaruhi oleh karakter genetik yang tahan terhadap patogen saja, namun juga oleh komunitas bakteri endofit yang berasosiasi dengan tanaman tersebut (Bird et al. 1980; Quadt-Hallmann et al. 1997). Tanaman inang bakteri yang hidup pada habitat yang berbeda juga akan menunjukkan kelimpahan dan keragaman bakteri endofit yang berbeda. Diduga tanaman kopi yang ditanam di daerah kering Jember (Jawa Timur) memiliki keragaman bakteri endofitnya lebih tinggi dibanding daerah basah Sukabumi (Jawa Barat). Kondisi lingkungan abiotik sangat berpengaruh terhadap keragaman tersebut. Tanah pasiran memiliki keragaman bakteri endofit yang lebih tinggi dibanding tanah lempung, terkait dengan kemudahan penetrasi bakteri endofit yang diinisiasi luka pada akar oleh partikel pasir. Bahan organik dalam tanah juga berpengaruh terhadap keragaman bakteri endofit. Tanah dengan bahan organik tinggi memberikan nutrisi yang lebih baik bagi mikrob endofit (Hallmann et al. 1997; Mahaffee dan Kloepper 1997).
Reaksi Hipersensitif (HR) dan Hemolisis
20
tanaman. Baker dan Cook (1974) menyebutkan antibiotik (metabolit sekunder) yang diproduksi suatu agens antagonis tidak boleh menyebabkan kerusakan pada inangnya.
A. B.
Gambar 4 Hasil uji reaksi hipersensitif bakteri endofit asal tanaman kopi, tanda panah menunjukkan A: reaksi negatif, B: reaksi positif
Syarat lain suatu mikrob dapat menjadi agens antagonis adalah, mikrob tersebut bukan merupakan patogen pada manusia, sehingga harus dilakukan uji hemolisis. Hemolisis merupakan destruksi eritrosit pada sel darah (Segel 2011). Enzim hemolisin yang dapat menyebabkan lisis eritrosit, diproduksi oleh beberapa bakteri patogen yaitu bakteri gram negatif di antaranya Escherichia Coli, Pseudomonas aeroginosa, Serratia sp., dan gram positif di antaranya Streptococcus spp., Staphylococcus aureus, Listeria sp. (Bauman 2007).
Gambar 5 Uji hemolisis pada isolat bakteri endofit asal tanaman kopi, tanda panah menunjukkan Aμ α-hemolisis, Bμ -hemolisis
Hasil isolasi diperoleh 264 isolat tunggal bakteri endofit, terdiri atas 159 isolat dari Jawa Barat dan 105 isolat dari Jawa Timur. Sebanyak 98 isolat (37.1%) menunjukkan reaksi negatif pada uji HR, dan dari 98 isolat yang bereaksi negatif pada uji HR, 78 diantaranya bereaksi negatif pada uji hemolisis yang digunakan pada pengujian selanjutnya (Gambar 4 dan 5).
Isolasi konsorsium bakteri endofit asal tanaman kopi diperoleh 27 konsorsium, yaitu 9 konsorsium dari bagian daun, 9 konsorsium dari bagian akar, dan 9 konsorsium dari bagian batang. Hasil uji HR menunjukkan bahwa 9 dari 27 konsorsium bakteri endofit tidak menunjukkan gejala nekrosis setelah 24-48 jam inokulasi. Hasil pengujian menunjukkan bahwa terdapat 9 konsorsium yang bersifat -hemolisis, yaitu konsorsium K6, K7, K8, K10, K12, K15, K19, K20 dan 21 yang digunakan untuk pengujian selanjutnya.
A
21
Pengaruh Bakteri Endofit terhadap Mortalitas Nematoda P. coffeae Secara
In Vitro
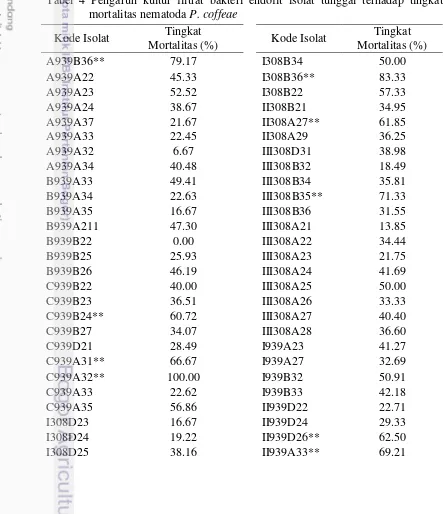
Strategi untuk mempercepat proses seleksi mikrob sebagai kandidat agens biokontrol pada umumnya diawali dengan seleksi secara in vitro. Hasil uji in vitro menunjukkan sebanyak 77 isolat (98.7%) dari 78 isolat tunggal bakteri endofit yang diuji dapat mematikan nematoda P. coffeae dengan kisaran persentase mortalitas P. coffeae antara 6.7-100%. Hasil tersebut lebih tinggi dibandingkan penelitian Harni dan Khaerati (2013), yang menyebutkan bahwa 12.3% isolat tunggal bakteri endofit yang diuji menunjukkan mortalitas 5-80% terhadap P. coffeae. Tingkat mortalitas tertinggi ditunjukkan oleh bakteri endofit isolat tunggal C939A32, II939A25, I308D31, I308B36, dan A939B36 dengan nilai mortalitas P. coffeae berturut-turut adalah 100, 95.7, 83.3, 83.3, dan 79.2% (Tabel 4).
Tabel 4 Pengaruh kultur filtrat bakteri endofit isolat tunggal terhadap tingkat mortalitas nematoda P. coffeae
Kode Isolat Tingkat
A939A34 40.48 III308B32 18.49
B939A33 49.41 III308B34 35.81
B939A34 22.63 III308B35** 71.33
B939A35 16.67 III308B36 31.55
B939A211 47.30 III308A21 13.85
B939B22 0.00 III308A22 34.44
B939B25 25.93 III308A23 21.75
B939B26 46.19 III308A24 41.69
C939B22 40.00 III308A25 50.00
C939B23 36.51 III308A26 33.33
C939B24** 60.72 III308A27 40.40
C939B27 34.07 III308A28 36.60
22
I308A212 47.30 III939A35 29.46
I308A215 41.44 III939A36 46.55
I308A32** 77.89 III939A37 40.27
I308A33 43.97 III939B21 30.73
I308A39 0.00 Kontrol – 0.0
I308B33 20.10 Media TSB 5.2
*Angka merupakan rerata dari 3 ulangan perlakuan, **Isolat yang dipilih untuk pengujian selanjtnya
Seluruh konsorsium bakteri endofit (100%) mampu menekan P. coffeae secara in vitro dengan persentase mortalitas antara 21.2-65.8%. Persentase mortalitas tertinggi ditunjukkan konsorsium K6, diikuti K15 dan K8 masing-masing sebesar 65.8, 43.3 dan 43.1 % (Tabel 5). Kemampuan bakteri endofit dalam mematikan nematoda P. coffeae tersebut dikarenakan adanya pengaruh senyawa antibiotik bakteri endofit terhadap nematoda (Silva et al. 2013). Antibiosis merupakan mekanisme penting yang digunakan oleh agens biokontrol dalam menekan patogen tular tanah, diantaranya nematoda parasit. Proses antibiosis suatu agens biokontrol terhadap patogen sasaran dapat terjadi dengan adanya senyawa antimikrob yang diproduksi oleh bakteri endofit (Harni dan Khaerati 2013).
Tabel 5 Pengaruh kultur filtrat konsorsium bakteri endofit terhadap tingkat mortalitas nematoda P. coffeae **konsorsium yang dipilih untuk pengujian selanjutnya
23 lebih dari 60% yaitu isolat A939B36, C939B24, C939A31, C939A32, I308D31, I308A21, I308A32, I308B36, II308A27, III308B35, II939D26, II939A33 dan II939A25 (Tabel 4); dan 4 dari 9 konsorsium bakteri endofit dengan persentase mortalitas nematoda lebih dari 40% yaitu konsorsium K6, K8, K15 dan K20 untuk uji in vivo di rumah kaca (Tabel 5).
Pengaruh Bakteri Endofit terhadap Pertumbuhan Tanaman Secara In Vitro
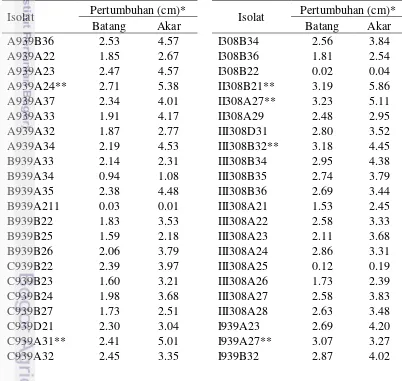
Pengaruh bakteri endofit terhadap pertumbuhan tanaman secara in vitro telah diuji menggunakan benih tomat varietas Ratna sebagai benih uji. Hasil pengujian bakteri endofit terhadap pertumbuhan benih tomat menunjukkan bahwa 20 isolat tunggal (25.6%) bakteri endofit dari 78 isolat yang diuji mampu memacu pertumbuhan batang yang lebih tinggi dibanding kontrol. Isolat III939A33 menghasilkan panjang batang tertinggi dibanding kontrol, diikuti II939A29, II939A33, II308B21, dan II308A27. Sebanyak 18 isolat tunggal (23.1%) dari 78 isolat yang diuji mampu memacu pertumbuhan akar dibandingkan kontrol. Panjang akar tertinggi ditunjukkan perlakuan isolat II308B21, diikuti II939A33, III939A37, A939A24, dan III939A33 (Tabel 6).
Tabel 6 Pengaruh bakteri endofit isolat tunggal asal tanaman kopi terhadap pertumbuhan benih tomat
Isolat Pertumbuhan (cm)* Isolat Pertumbuhan (cm)*
Batang Akar Batang Akar
A939B36 2.53 4.57 I308B34 2.56 3.84
A939A22 1.85 2.67 I308B36 1.81 2.54
A939A23 2.47 4.57 I308B22 0.02 0.04
A939A24** 2.71 5.38 II308B21** 3.19 5.86
A939A37 2.34 4.01 II308A27** 3.23 5.11
A939A33 1.91 4.17 II308A29 2.48 2.95
A939A32 1.87 2.77 III308D31 2.80 3.52
A939A34 2.19 4.53 III308B32** 3.18 4.45
B939A33 2.14 2.31 III308B34 2.95 4.38
B939A34 0.94 1.08 III308B35 2.74 3.79
B939A35 2.38 4.48 III308B36 2.69 3.44
B939A211 0.03 0.01 III308A21 1.53 2.45
B939B22 1.83 3.53 III308A22 2.58 3.33
B939B25 1.59 2.18 III308A23 2.11 3.68
B939B26 2.06 3.79 III308A24 2.86 3.31
C939B22 2.39 3.97 III308A25 0.12 0.19
C939B23 1.60 3.21 III308A26 1.73 2.39
C939B24 1.98 3.68 III308A27 2.58 3.83
C939B27 1.73 2.51 III308A28 2.63 3.48
C939D21 2.30 3.04 I939A23 2.69 4.20
C939A31** 2.41 5.01 I939A27** 3.07 3.27
24
Tabel 6 Lanjutan...
Isolat Pertumbuhan (cm)* Isolat Pertumbuhan (cm)*
Batang Akar Batang Akar
C939A33 1.95 3.36 I939B33 2.43 3.42
C939A35 2.75 4.61 II939D22 2.62 3.66
I308D23 2.01 3.72 II939D24 2.33 3.38
I308D24** 2.63 5.00 II939D26** 3.02 4.27
I308D25** 2.27 5.24 II939A33** 3.23 5.83
I308D31 1.77 3.80 II939A34 2.10 3.22
I308D32 2.42 4.41 II939A24 2.85 5.02
I308A21 2.33 4.93 II939A25 2.47 4.28
I308A23 2.69 4.20 II939A26 2.64 4.19
I308A24 2.05 4.28 II939A27** 3.32 4.29
I308A25 2.49 4.78 II939A29 2.29 3.86
I308A26 2.34 3.38 III939A33** 3.51 5.25
I308A212** 2.61 5.17 III939A35 2.25 3.41
I308A215 2.81 3.99 III939A36 2.50 3.59
I308A32 2.11 2.83 III939A37** 2.83 5.81
I308A33 2.32 1.88 III939B21 2.64 3.36
I308A39 1.87 3.57 Kontrol 2.68 4.60
I308B33 2.43 3.55
* Angka merupakan rerata dari 5 ulangan dalam satu perlakuan, **isolat yang dipilih untuk pengujian selanjutnya
Total dari 9 konsorsium bakteri endofit yang diuji, 6 konsorsium mampu memacu pertumbuhan batang, dan hanya satu konsorsium yang mampu memacu pertumbuhan akar. Pertumbuhan batang tertinggi ditunjukkan oleh konsorsium K21, diikuti K15 dan K8. Panjang akar tertinggi ditunjukkan oleh konsorsium K21 (Tabel 7).
Tabel 7 Pengaruh konsorsium bakteri endofit asal tanaman kopi terhadap pertumbuhan benih tomat
Konsorsium Pertumbuhan (cm)* Konsorsium Pertumbuhan (cm)*
Batang Akar Batang Akar
K6** 2.2 1.6 K15** 3.6 3.7
K7 3.1 2.4 K19 2.3 3.0
K8** 3.4 4.6 K20 2.9 3.6
K10 3.2 4.4 K21** 3.6 5.1
K12 2.7 3.9 Kontrol 2.7 4.6
* Angka merupakan rerata dari 5 ulangan dalam satu perlakuan, **konsorsium yang dipilih untuk pengujian selanjutnya
25 benih dan pertumbuhan bibit cabai. Agustiansyah et al. (2013) melaporkan bahwa perlakuan benih dengan agens hayati Pseudomonas diminuta dan Bacillus subtilis, baik secara tunggal maupun dicampur, dapat meningkatkan daya kecambah, pertumbuhan dan hasil panen padi yang diinokulasi dengan Xanthomonas oryzae pv. oryzae. Hasil uji pertumbuhan secara in vitro dipilih 15 isolat tunggal dan 3 konsorsium bakteri endofit yang menunjukkan pertumbuhan batang dan/atau akar lebih tinggi dibanding kontrol (Tabel 6 dan 7).
Hasil penggabungan seleksi antara parameter mortalitas P. coffeae dan pemacuan pertumbuhan batang maupun akar, diperoleh 27 isolat yang terdiri atas 23 isolat tungggal dan 4 konsorsium bakteri endofit. Dua puluh tiga isolat tunggal bakteri endofit tersebut terdiri atas 9 isolat yang hanya mampu membunuh P. coffeae saja, 10 isolat yang hanya mampu memacu pertumbuhan batang dan/atau akar, dan 4 isolat yang mampu membunuh P. coffeae maupun memacu pertumbuhan batang dan/atau akar. Empat konsorsium bakteri endofit semuanya mampu menekan P. coffeae, terdiri atas 3 konsorsium yang memacu pertumbuhan batang saja dan satu konsorsium yang hanya memacu pertumbuhan akar (Tabel 7).
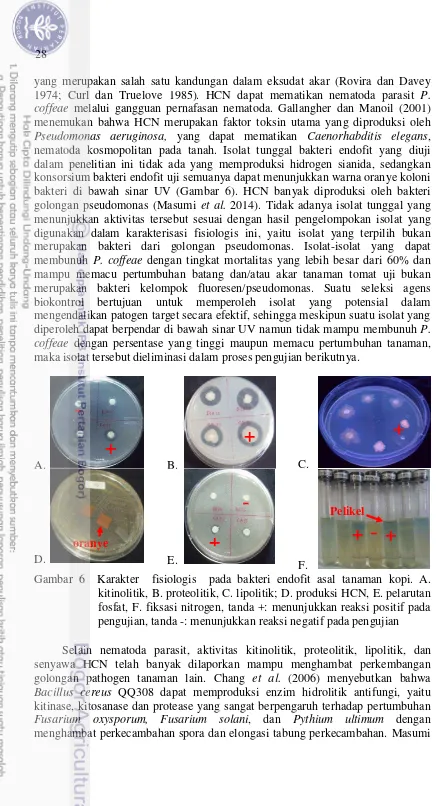
Karakterisasi Fisiologis Bakteri Endofit
Suatu agens biokontrol dapat mengendalikan patogen melalui beberapa mekanisme, misalnya kemampuan antibiosis; hidrolisis kitin, protein, dan lipid; produksi asam sianida (Hydrogen Cyanide/HCN) (Ramyasmruthi et al. 2012; Gohel et al. 2004; Chaiharn et al. 2008; Lunge dan Patil 2012; Herrera-Estrella dan Chet 1999; Miller dan Sands 1977; Wei et al. 1991); pelarutan fosfat (P); dan fiksasi nitrogen (N2) (Gupta et al. 2012).
Selanjutnya 23 isolat tunggal dan 4 konsorsium bakteri endofit dilakukan uji karakterisasi fisiologis. Hasil pengujian menunjukkan bahwa dari 23 isolat tunggal yang diuji, sebanyak 11 isolat (47.8%) mampu menghidrolisis protein, 5 isolat (21.7%) mampu menghidrolisis kitin, 9 isolat (39.1%) mampu menghidrolisis lipid/lemak, tidak ada yang mampu memproduksi HCN, 6 isolat (26.1%) mampu melarutkan fosfat (P), dan 8 isolat (34.8%) mampu menambat/memfiksasi nitrogen (N) (Tabel 8).
Seluruh konsorsium bakteri endofit yang diuji mampu menunjukkan aktivitas proteolitik, kitinolitik, lipolitik, memproduksi HCN, dan memfiksasi nitrogen (N2), serta satu konsorsium (25%) mampu melarutkan fosfat (P) (Tabel 8). Karakter fisiologis tersebut diduga berperan dalam mengendalikan nematoda P. coffeae, yaitu produksi enzim protease, kitinase, lipase dan produksi HCN; serta induksi ketahanan/pemacuan pertumbuhan tanaman (melalui pelarutan P dan fiksasi N2) (Miller dan Sands 1977).
Protease
26
terluar dari kutikula nematoda, menghilangkan materi pengisi striasi nematoda, menurunkan motilitas T. dubius hingga 75% (Miller dan Sands 1977).
Tabel 8 Karakter fisiologis bakteri endofit isolat tunggal dan konsorsium asal tanaman kopi yang terseleksi
Lapisan kulit terluar dari nematoda terdiri atas eksoskeleton yang tertutupi oleh selubung permukaan/surface coat atau glycocalyx (Bird dan Zuckerman 1989). Glycocalyx ini merupakan komponen karbohidrat pada bagian luar * +: bereaksi positif pada pengujian yang dilakukan, -: bereaksi negatif pada