KONSORSIUM BAKTERI ENDOFIT SEBAGAI AGENS
BIOKONTROL NEMATODA PURU AKAR
Meloidogyne incognita PADA TOMAT
ANKARDIANSYAH PANDU PRADANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Konsorsium Bakteri Endofit Sebagai Agens Biokontrol Nematoda Puru Akar Meloidogyne incogita pada Tomat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2016
Ankardiansyah Pandu Pradana
RINGKASAN
Tomat merupakan komoditas hortikultura penting di Indonesia. Buah tomat banyak digunakan sebagai bahan baku industri makanan dan dapat dikonsumsi dalam kondisi segar. Salah satu kendala budidaya tomat adalah infeksi patogen. Nematoda puru akar (NPA) Meloidogyne incognita merupakan patogen penting pada tanaman tomat, yang menyebabkan tanaman kerdil, mudah layu, daun menguning, dan akar berpuru. Infeksi NPA juga menyebabkan tomat menjadi rentan terhadap infeksi Ralstonia solanacearum, dan Fusarium oxysporum. Keberadaan puru menyebabkan rusaknya sistim dan fungsi perakaran, sehingga hasil panen tomat menurun.
Aplikasi bakteri endofit merupakan salah satu cara pengendalian NPA. Akan tetapi keefektifan konsorsium bakteri endofit sebagai agens pengendali M. incognita belum banyak dilaporkan. Konsorsium bakteri endofit adalah seluruh bakteri yang hidup di dalam jaringan tanaman dan dapat ditumbuhkan pada media buatan. Penelitian ini bertujuan untuk memperoleh; (1) konsorsium bakteri endofit yang berpotensi menekan keparahan penyakit puru akar pada tomat, (2) formulasi kompos konsorsium bakteri endofit yang berpotensi mengendalikan M. incognita
dengan daya simpan yang tinggi.
Konsorsium bakteri endofit diisolasi dari 16 jenis tanaman yaitu bambu (Bambusa bambos), mint (Coleus amboinicus), bit merah (Beta vulgaris), gingseng (Talinum triangulare), pecah beling ungu (Strobilanthes crispus), pacar air (Impatiens balsamina), tomat (Lycopersicum esculentum), serai (Cymbopogon nardus), padi (Oryza sativa), tithonia (Tithonia diversifolia), kumis kucing (Orthosiphon aristatus), binahong (Anredera cordifolia), jinten (Nigella sativa), temulawak (Curcuma xanthorrhiza), garut (Maranta arundinacea), dan cabai rawit (Capsicum frutescens). Isolasi dilakukan menggunakan media Tryptone Soya Agar
(TSA) 20% dan 50%, Nutrient Agar (NA) 20% dan 50%, dan King’s B agar. Konsorsium bakteri endofit diuji keamanannya dengan uji hipersensitifitas, uji hemolisis, dan uji patogenesitas. Sebanyak 80 konsorsium yang diperoleh, 16 konsorsium dinyatakan aman untuk diuji lanjut.
Uji lanjut dilakukan untuk mengetahui potensi setiap konsorsium bakteri endofit sebagai agens biokontrol. Parameter yang diuji adalah kemampuan konsorsium bakteri endofit dalam memacu pertumbuhan bibit tanaman tomat, produksi enzim, produksi senyawa sianida, dan pengaruhnya terhadap infeksi NPA pada tomat. Konsorsium bakteri dengan performa terbaik diformulasi dalam bentuk kompos. Formulasi tersebut juga diuji kemampuannya sebagai biopestisida terhadap NPA pada tomat.
Keefektifan konsorsium bakteri endofit sebagai agens hayati terlihat dari menurunnya populasi nematoda dan tingkat kerusakan akar. Lebih lanjut konsorsium bakteri endofit diketahui mampu menekan skala kerusakan akar tomat 37%, jumlah puru 31.25%, jumlah M. incognita di akar 39% dan di tanah 42.98%. Aplikasi konsorsium bakteri endofit mampu meningkatkan pertumbuhan tomat yang terinfeksi M. incognita. Tanaman tomat terinfeksi M. incognita dengan perlakuan konsorsium bakteri endofit mengalami peningkatan hingga 11.91% (panjang akar), 12.96% (berat segar), 15.94% (berat kering), 27.34% (tinggi tanaman), dan 40.98% (jumlah daun). Secara umum seluruh konsorsium bakteri endofit memiliki potensi yang baik sebagai agens hayati. Namun demikian konsorsium TmtN2 dan TmtN5 memberikan pengaruh paling baik pada tanaman tomat dibandingkan konsorsium lainnya.
Seluruh konsorsium diuji kemampuannya menghasilkan enzim protease, enzim kitinase, hidrogen sianida, menambat nitrogen, dan melarutkan fosfor. Enzim protease, enzim kitinase, dan hidrogen sianida berperan penting untuk mengendalikan patogen tanaman. Kemampuan bakteri menambat nitrogen dan melarutkan fosfor menunjukkan potensi bakteri tersebut sebagai agens pemacu pertumbuhan tanaman. Hasil uji menunjukkan 15 konsorsium memproduksi enzim protease, 11 konsorsium memproduksi enzim kitinase, 5 konsorsium memproduksi hidrogen sianida, 4 konsorsium mampu menambat nitrogen, dan 4 konsorsium mampu melarutkan fosfor.
Pada tanaman tomat konsorsium TmtN2 dan TmtN5 merupakan konsorsium dengan potensi biokontrol terbaik. Dua formulasi bakteri tersebut diformulasi agar mudah disimpan, diangkut dan diaplikasikan di lapangan. Formulasi dilakukan dengan bahan pembawa kompos yang diperkaya dengan molase dan pepton. Hasil formulasi menunjukkan setiap minggu terjadi penurunan populasi konsorsium TmtN2 dan TmtN5. Meskipun terjadi penurunan populasi, kedua konsorsium mampu bertahan sampai minggu ke-8. Formulasi dari kedua konsorsium tersebut juga efektif mengendalikan M. incognita dan meningkatkan pertumbuhan tanaman tomat. Tanaman tomat yang diberi perlakuan dengan formulasi TmtN2 memiliki berat segar tanaman 43.17% lebih baik dibandingkan tanaman kontrol. Aplikasi formulasi kedua konsorsium efektif menekan populasi NPA di tanah sebesar 40.38% (TmtN2) dan 53.64% (TmtN5). Penekanan populasi tersebut berpengaruh pada tingkat kerusakan akar. Aplikasi formulasi TmtN2 dan TmtN5 secara berurutan mampu menekan 42.16% dan 50.88% tingkat kerusakan akar tomat.
SUMMARY
Tomato is an important horticultural comodity in Indonesia. Tomato is widely used as raw material for food industry or can be consumed freshly. One of problem in tomato cultivation is pathogen infection. Root knot nematode (RKN) is an important pathogen in tomato that cause stunt, wilt, yellowing leaves and root galls. Infection of NPA lead tomatoes to become more susceptible to Ralstonia solanacearum and Fusarium oxysporum.
Application of endophytic bacteria is the promising method to control RKN’s infection. However, effectiveness of endophytic bacteria consortium as biocontrol agent for M. incognita has not widely reported. Consortium of endophytic bacteria is some of bacteria that lived in plant tissue and can be cultivated in artificial medium. The objectives of this research are to obtain (1) consortium of endophytic bacteria that have good potential to suppress disease severity of root gall in tomato, and (2) compos formulation as biocontrol agents that are able to preserve for M. incognita.
Endophytic bacteria consortia were isolated from 16 plants, that were bamboo (Bambusa bambos), mint (Coleus amboinicus), beet (Beta vulgaris), water leaf (Talinum triangulare), black face general (Strobilanthes crispus), balsam (Impatiens balsamina), tomato (Lycopersicum esculentum), citronella grass (Cymbopogon nardus), rice (Oryza sativa), tithonia (Tithonia diversifolia), Java tea (Orthosiphon aristatus), mignontette vine (Anredera cordifolia), black cumin (Nigella sativa), Javanese ginger (Curcuma xanthorrhiza), arrow root (Maranta arundinacea), and pepper (Capsicum frutescens). Isolation was conducted using
Tryptone Soya Agar (TSA) 20% and 50%, Nutrient Agar (NA) 20% and 50%, and
King’s B. Bacteria consortia were undergone test including hypersensitive test, hemolytic test, and pathogenicity test resulted 16 potentil consortia from 80 consortia.
Bacteria consortia were also tested for their potency as biocontrol agents, that were their ability as plant growth-promoting bacteria, production of lytic enzymes, production of HCN, and their ability to control RKN on tomatoes. The selected bacteria consortia were formulated using compost. The formulated consortia were tested their ability as biopesticide againts RKN on tomatoes.
All of the bacterial consortia promoted tomato seedlings growth significantly. Weight and height of seedling increased up to 39% and 17.65%. Seedling stage of tomatoes were infected by some important pathogens.
Some characterization such as production of protease enzyme, chitinase enzyme, cyanide hydrogen (HCN), ability of nitrogen fixation, and phosphate dissolving were observed in the selected consortia. Ability of bacteria in producing protease, chitinase, and HCN indicated that the bacteria had a good potential as biocontrol-agents. In addition, ability of bacteria on the nitrogen fixation and dissolving phosphate indicated that the bacteria had a good potential to promote plant growth. Acording to in-vitro test, the bacteria performed the ability as follow; 15 consortia produce protease enzymes, 11 consortia produce chitinase enzymes, 5 consortia produce HCN, 4 consortia fixe nitrogen, and 4 consortia dissolve phosphate.
TmtN2 and TmtN5 were the best consortia among others. These consortia were formulated in order to make them more easy to handle, transport, and apply in the field. Both of consortia were formulated in compost enriched with molasses and peptone. Population of TmtN2 and TmtN5 in the formulation were declined weekly and able to survive within 8 weeks. Both of these consortia formulations performed good ability to control M.incognita and increase tomato growth. Treated tomato plants have higher fresh weight 43.17% compared to control. Application of the formulated bacteria lowered the number of nematodes in soil by 40.38% and 53.64% as well as dissease severity of infected roots by 42.16% and 50.88% for TmtN2 and TmtN5, respectively.
This research provide a new scientific information that endophytic bacterial consortia from roots of several plants have a good potency as biocontrol agents againts RKN. All of consortia gave a good performance on supressing M. incognita
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan mengutip tersebut tidak merugikan kepentingan IPB.
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
KONSORSIUM BAKTERI ENDOFIT SEBAGAI AGENS
BIOKONTROL NEMATODA PURU AKAR
Meloidogyne incognita PADA TOMAT
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2016
Judul Tesis : Konsorsium Bakteri Endofit Sebagai Agens Biokontrol Nematoda Puru Akar Meloidogyne incognita pada Tomat
Nama : Ankardiansyah Pandu Pradana NIM : A352130061
Disetujui oleh Komisi Pembimbing
Dr Ir Abdul Munif, MScAgr Ketua
Dr Ir Supramana, MSi Anggota
Diketahui oleh
Ketua Program Studi Fitopatologi
Prof Dr Ir Sri Hendrastuti Hidayat, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Tema yang dipilih pada tesis ini adalah pengendalian hayati nematoda puru akar (Meloidogyne incognita) pada tanaman tomat menggunakan konsorsium bakteri endofit, sekaligus formulasi bakteri tersebut dengan kompos sebagai bahan pembawanya.
Penulis menyampaikan rasa hormat dan ucapan terima kasih kepada Bapak Dr Ir Abdul Munif, MScAgr. dan Dr Ir Supramana, MSi selaku dosen pembimbing dengan kesabaran dan keikhlasan dalam membimbing sehingga membuka wawasan penulis dalam menyelesaikan tesis ini.
Penulis menyampaikan rasa hormat dan ucapan terima kasih serta penghargaan sebesar-besarnya kepada kedua orang tua Ayahanda Sukardi dan Ibunda Lilis Sulistyawati yang telah memberi dukungan moril dan materil serta sebagai motivator terbesar dalam kehidupan penulis, semoga ketulusan hati beliau dalam mendidik penulis mendapat balasan pahala dan limpahan rahmat dari Allah SWT. Kepada kakak penulis Ankardiana Pandu Pratamasari, dan Ankarlina Pandu Primadata, serta ponakan tersayang Felicia Joselin, penulis ucapkan terimakasih yang sebesar-besarnya, karena mereka adalah salah satu motivator terbesar penulis untuk menyelesaikan tesis ini. Rekan-rekan Fitopatologi IPB 2013 yang sangat kompak dalam kebersamaan, terimakasih atas arahan serta nasehat yang bersifat membangun bagi penulis baik dalam hal perkuliahan maupun dalam kehidupan sehari-hari. Rekan-rekan Laboratorium Nematologi Tumbuhan, khususnya Bapak Gatut Heru Bromo, Diana Putri, Firdaus Oktavianto, Tri Dasa Angga Pratama, Fita Vindia Wati, Mas Yadi Nurjayadi, Roy Ibrahim, dan Mba Ropalia yang banyak membantu penulis selama penelitian berlangsung penulis ucapkan terimakasih atas segala pengorbanan dalam membantu penulis. Teman-teman dari Laboratory of Applied Microbiology Hokkaido University yang telah bersedia membantu dalam diskusi dan mencari pustaka terkini, serta semua pihak yang namanya tidak tercantum yang telah memberikan andil secara ikhlas membantu penulis dalam berbagai hal.
Akhirnya dengan segala kerendahan hati, penulis menyadari bahwa hasil dari karya ini masih sangat jauh dari kesempurnaan. Oleh karena itu, penulis sangat mengharapkan kritikan dan saran positif yang bersifat membangun dalam mengembangkan karya ini, sehingga dapat berguna bagi kita semua, insya Allah, Amin.
Bogor, Agustus 2016
DAFTAR ISI
DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Hipotesis Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 3
2 TINJAUAN PUSTAKA 3
Biologi Tanaman Tomat 4
Biologi Nematoda Puru Akar Meloidogyne incognita 5
Bakteri Endofit 8
Formulasi Agens Hayati 10
3 METODE 13
Lokasi dan Waktu Penelitian 13
Perbanyakan Inokulum Meloidogyne incognita 13
Isolasi Konsorsium Bakteri Endofit 14
Penapisan Konsorsium Bakteri Endofit 14
Uji Potensi Konsorsium Bakteri Endofit sebagai Pemacu Pertumbuhan Bibit Tomat
15 Seleksi Konsorsium Bakteri Endofit Sebagai Agens Pengendali NPA dan Plant Growth Promoter
15
Karakterisasi Sifat Fisiologis Bakteri 16
Formulasi Bakteri Endofit sebagai Biopestisida 18 Pengujian Daya Simpan Konsorsium Bakteri Endofit dalam
Formulasi
18 Pengujian Keefektifan Bakteri Endofit sebagai Biopestisida
Pengendali M. incognita
18
4 HASIL DAN PEMBAHASAN 20
Pemurnian dan Perbanyakan Meloidogyne incognita 20
Kelimpahan Konsorsium Bakteri Endofit 21
Keamanan Hayati dan Karakter Koloni Konsorsium Bakteri Endofit
22 Konsorsium Bakteri Endofit sebagai Pemacu Pertumbuhan
Bibit Tomat
24 Konsorsium Bakteri Endofit sebagai Agens Pengendali
M. incognita pada Tomat
25 Konsorsium Bakteri Endofit sebagai Pemacu Pertumbuhan
Tanaman Tomat Terinfeksi M. incognita
Karakter Fisiologis Konsorsium Bakteri Endofit 29 Viabilitas Konsorsium Bakteri Endofit pada Formulasi Kompos 35 Keefektifan Formulasi Konsorium Bakteri Endofit sebagai
Pengendali M. incognita pada Tomat
37
Pembahasan Umum 39
5 SIMPULAN DAN SARAN 42
DAFTAR PUSTAKA 43
LAMPIRAN 59
DAFTAR TABEL
1 Kelimpahan populasi bakteri endofit asal akar 16 jenis tanaman pada media TSA 20% dan 50%, NA 20% dan 50%,
dan King’s B
21
2 Tujuh belas konsorsium bakteri endofit asal berbagai tanaman yang aman sebagai kandidat agens hayati
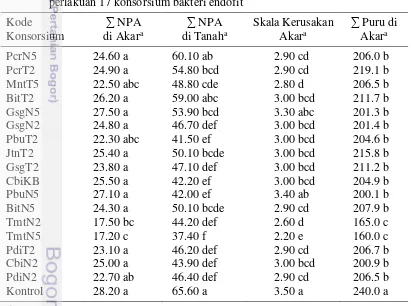
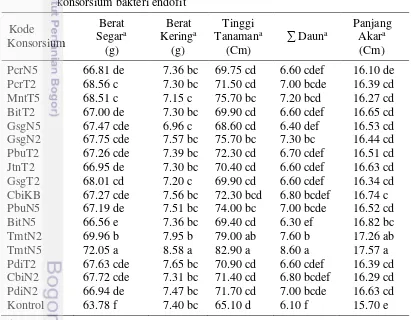
23 3 Pertumbuhan bibit tomat pada perlakuan 17 konsorsium
bakteri endofit
25 4 Populasi M. incognita, jumlah puru, dan skala kerusakan akar
tomat pada perlakuan 17 konsorsium bakteri endofit
26 5 Pertumbuhan tanaman tomat terinfeksi M. incognita pada
aplikasi 17 konsorsium bakteri endofit
28 6 Kemampuan 17 konsorsium bakteri endofit dalam
memproduksi enzim protease, kitinase, dan HCN
30 7 Aktivitas konsorsium bakteri endofit dalam melarutkan fosfat
dan menambat nitrogen
33
DAFTAR GAMBAR
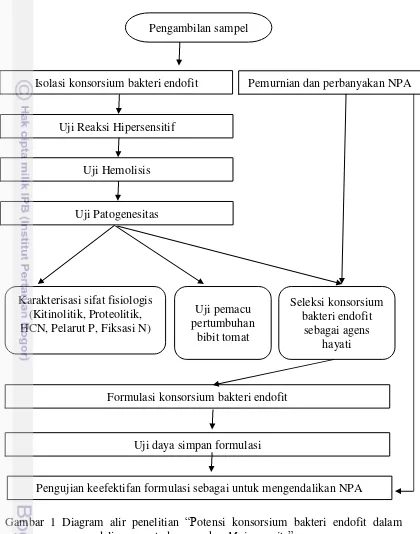
1 Diagram alir penelitian “Potensi konsorsium bakteri endofit dalam pengendalian nematoda puru akar M. incognita”
3 4 Paket telur nematoda puru akar: (a) paket telur menempel pada
posterior NPA betina dewasa, (b) paket telur diambil menggunakan pisau untuk dikembangkan pada tanaman tomat, (c) telur NPA yang diekstraksi dari paket telur
20
5 Morfologi pola perineal: (a) M. incognita yang digunakan untuk pengujian, (b) M. incognita menurut Eisenback et al. (1981)
20
6 Hasil uji reaksi hipersensitif pada daun tanaman tembakau: (a, b) muncul gejala nekrotik pada reaksi positif, (c) tidak muncul gejala pada reaksi negatif
22
7 Hasil uji hemolisis: (a) zona bening yang terbentuk karena
bakteri memproduksi toksin β-hemolisis, (b) zona gelap karena
bakteri memproduksi toksin α-hemolisis, (c) tidak terjadi perubahan pada media karena bakteri tidak memproduksi toksin.
23
8 Kerusakan akar pada tanaman tomat yang diberi perlakuan konsorsium bakteri endofit TmtN2, TmtN5, dan PbuT2 dibandingkan dengan akar tanpa perlakuan (kontrol)
9 Hasil uji aktivitas proteotilitik: (a) bakteri mampu menghasilkan enzim protease yang ditandai oleh terbentuknya zona bening di sekitar koloni bakteri, (b) bakteri tidak menghasilkan enzim protease
30
10 Hasil uji aktivitas kitinolitik: (a) bakteri mampu menghasilkan enzim kitinase yang ditandai oleh terbentuknya zona bening di sekitar koloni bakteri, (b) bakteri tidak menghasilkan enzim kitinase
31
11 Hasil uji produksi sianida (HCN): (a) bakteri mampu menghasilkan memproduksi sianida (HCN) ditandai dengan warna kertas CDS berubah menjadi jingga kecoklatan, (b) bakteri tidak mampu memproduksi sianida (HCN)
32
12 Hasil uji bakteri pelarut fosfat: (a) bakteri tidak mampu
melarutkan fosfat pada media pikovskaya’s agar, (b,c) bakteri
mampu melarutkan fosfat pada media pikovskaya’s agar ditandai dengan terbentuknya zona bening di sekitar koloni
34
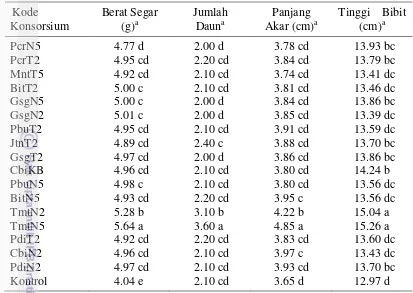
13 Hasil uji bakteri penambat nitrogen: (a) bakteri mampu menambat nitrogen ditunjukkan dengan media NFB yang warnanya berubah menjadi kebiruan dan terbentuk pellicle, (b) bakteri tidak mampu menambat nitrogen
35
14 Viabiltas konsorsium bakteri endofit TmtN2 dan Tmtn5 serta Isolat Tunggal MSJ pada formulasi kompos
36 15 Pengaruh perlakuan formulasi konsorsium bakteri endofit
terhadap tanaman tomat terinfeksi M. incognita (Angka-angka pada grafik yang diikuti oleh huruf yang sama tidak berbeda nyata pada p-value 0.05 (uji selang berganda Duncan)
38
DAFTAR LAMPIRAN
1 Skala kerusakan akar akibat infeksi nematoda puru akar berdasarkan skala Bridge dan Page (1980)
59 2 Lokasi pengambilan sampel tanaman sumber konsorsium
bakteri endofit
60 3 Keragaman warna, bentuk, dan elevasi koloni 17
konsorsium bakteri endofit kandidat agens hayati
61 4 Benih tomat varietas Permata F1 yang digunakan untuk
penelitian, (a) tampak depan kemasan benih, (b) tampak belakang kemasan benih, (c) bentuk benih
63
5 Fase hidup Meloidogyne incognita di dalam jaringan akar tanaman tomat: (a) telur nematoda/ J1, (b) juvenil 2, (c) juvenil 3, (d) juvenil 4, (e) nematoda betina dewasa
64
6 Akar tanaman tomat terinfeksi nematoda puru akar
Meloidogyne spp. yang diambil paket telurnya untuk pemurnian spesies M. incognita
1
PENDAHULUAN
Latar Belakang
Tomat (Lycopersicum escelentum Mill.) merupakan salah satu tanaman hortikultura yang banyak diminati oleh masyarakat Indonesia. Komoditas ini memiliki nilai ekonomi tinggi dalam dunia perdagangan produk tersebut. Selain dapat digunakan sebagai sayur dan dimakan sebagai buah segar, tomat banyak dijual sebagai bahan baku industri. Sebagai bahan makanan, tomat mengandung gizi yang tinggi. Gould (2013) melaporkan bahwa dalam 100 g tomat masak terkandung 20 kal kalori, 1 g protein, 0.3 g lemak, 4.2 g karbohidrat, 5 g kalsium, 27 mg fosfor, 0.5 mg zat besi, 1 500 SI vitamin A, 0.06 mg vitamin B, 40 mg vitamin C, dan 94 g air.
Meloidogyne incognita (nematoda puru akar), Fusarium oxysporum
(penyebab layu fusarium), dan Ralstonia solanacearum (penyebab penyakit layu bakteri) adalah patogen utama yang menginfeksi tanaman tomat. Infeksi ketiga patogen tersebut dapat menimbulkan kehilangan hasil panen dan kerugian ekonomi (Nakaho et al. 2000; El-Rafai et al. 2003; Bar-Or et al. 2005). Keparahan penyakit layu karena F. oxysporum dan R. solanacearum di lapangan semakin meningkat dengan keberadaan M. incogita (Abawi & Widmer 2000; Siddiqui et al. 2012). Infeksi nematoda puru akar (NPA) pada tanaman tomat dapat menurunkan kualitas dan kuantitas buah tomat. Gejala yang disebabkan oleh infeksi M. incognita berupa puru pada akar. Keberadaan puru dapat mengganggu sistem distribusi air dan mineral dari tanah melalui akar ke seluruh bagian tanaman, sehingga menyebabkan akar baru tidak muncul, tanaman mudah layu, pertumbuhan terhambat, kerdil, dan dapat menyebabkan klorosis (Moens et al. 2009).
M. incognita merupakan salah satu nematoda yang sulit dikendalikan dengan teknik rotasi tanam karena memiliki kisaran tanaman inang yang luas (Anwar et al. 2007). Pengendalian NPA perlu dilakukan secara bijak agar tidak merusak kualitas produk maupun lingkungan. Aplikasi agens hayati dapat menjadi solusi pengendalian NPA yang ramah lingkungan. Mikroba yang umum digunakan sebagai agens pengendali NPA berasal dari golongan bakteri dan cendawan. Bakteri antagonis yang berpotensi untuk mengendalikan NPA diantaranya adalah Bacillus sp. dan Pseudomonas fluorescens. Menurut Ghasemi
et al. (2010) dan Yang et al. (2009) Bacillus sp. mampu menghasilkan enzim protease dan kitinase. Arora et al. (2007) melaporkan bakteri P. fluorescens
menghasilkan enzim yang sama. Enzim-enzim tersebut mampu mendegradasi telur dan larva nematoda.
Agens hayati dari kelompok endofit diketahui mampu mengendalikan nematoda M. incognita, Rotylenchulus reniformis, Globodera pallida, Radopholus similis, Pratylenchus brachyurus pada skala laboratorium, rumah kaca, dan lapangan (Sikora & Pocasangre 2006; Harni et al. 2007; Sikora et al. 2007; Mekete et al. 2009; Harni & Munif 2011). Harni dan Munif (2012) berhasil menemukan 3 isolat bakteri endofit yang berpotensi menekan intensitas penyakit kuning pada tanaman lada yang disebabkan oleh infeksi Meloidogyne spp.,
2
Saat ini eksplorasi agens tidak hanya dilakukan pada agens tunggal, tetapi juga dilakukan eksplorasi pada konsorsium agens hayati. Aplikasi konsorsium bakteri dilaporkan mampu meningkatkan pertumbuhan tanaman. Fitri dan Gofar (2010) menyatakan isolat konsorsium bakteri efektif meningkatkan pertumbuhan tanaman dan meningkatkan produksi padi. Trianggana (2013) juga melaporkan konsorsium bakteri berpotensi menekan pertumbuhan bakteri Xanthomonas oryzae pv. oryzae secara in vitro. Namun sampai saat ini belum terdapat laporan keefektifan konsorsium bakteri endofit sebagai agens pengendali nematoda puru akar.
Produk agens hayati belum banyak digunakan oleh masyarakat, khususnya petani. Rendahnya jumlah produk agens hayati yang telah terformulasi menjadi faktor utama rendahnya aplikasi agens hayati di masyarakat. Formulasi agens hayati sebaiknya mengandung komponen penting yang mendukung kehidupan mikroba yang terkandung di dalamnya. Bahan pembawa yang umum digunakan sebagai bahan dasar formulasi biasanya berbentuk butiran, tepung, dan cair. Pemilihan bahan pembawa formulasi akan menentukan keefektifan formulasi tersebut sebagai pemacu pertumbuhan tanaman (biofertilizer) dan sebagai pengendali patogen (biopesticide) (Ardakani et al. 2010; Riana 2011; Syachroni 2011).
Tujuan Penelitian
1. Mendapat konsorsium bakteri endofit yang berpotensi memacu pertumbuhan tanaman dan menekan keparahan penyakit puru akar akibat M. incognita pada tomat.
2. Memperoleh formulasi kompos konsorsium bakteri endofit yang berpotensi sebagai agens biokontrol terhadap M. incognita yang dapat disimpan dalam waktu lama.
Hipotesis Penelitian
1. Konsorsium bakteri endofit mampu memproduksi metabolit sekunder yang berperan dalam pengendalian nematoda puru akar, meningkatkan pertumbuhan tanaman, dan mampu menekan keparahan penyakit akibat infeksi M. incognita pada tomat.
2. Formulasi menggunakan bahan pembawa kascing, molase, dan pepton efektif untuk menunjang kehidupan bakteri sebagai biopestisida untuk mengendalikan M. incognita.
Manfaat Penelitian
3
Ruang Lingkup Penelitian
Ruang lingkup penelitian meliputi kegiatan isolasi, karakterisasi sifat fisiologis di laboratorium, dan pengujian di rumah kaca (Gambar 1).
Gambar 1 Diagram alir penelitian “Potensi konsorsium bakteri endofit dalam pengendalian nematoda puru akar M. incognita”
Pengujian keefektifan formulasi sebagai untuk mengendalikan NPA Uji daya simpan formulasi
Formulasi konsorsium bakteri endofit Karakterisasi sifat fisiologis
(Kitinolitik, Proteolitik, HCN, Pelarut P, Fiksasi N)
Uji pemacu pertumbuhan
bibit tomat
Seleksi konsorsium bakteri endofit
sebagai agens hayati Uji Patogenesitas
Uji Hemolisis Uji Reaksi Hipersensitif
4
2 TINJAUAN PUSTAKA
Biologi Tanaman Tomat
Taksonomi dan Klasifikasi Kingdom : Plantae
Subkingdom : Tracheobionta Divisi : Magnoliophyta Kelas : Magnoliopsida Subkelas : Asteridae Ordo : Solanales Famili : Solanaceae Genus : Solanum L.
Spesies : Solanum lycopersicum L. (Costa & Heuvelink 2005)
Morfologi
Tomat merupakan tanaman yang berumur pendek. Tanaman ini dapat tumbuh dengan tinggi 1 sampai 3 meter atau lebih, tergantung varietasnya. Akar tanaman tomat berbentuk serabut yang menyebar ke segala arah. Kemampuan menembus tanahnya terbatas pada kedalaman 30 sampai 70 cm. Tomat memiliki batang berbentuk silinder dengan diameter batang mencapai 4 cm. Batang tanaman tomat dapat bercabang banyak dan menyebar apabila tidak dilakukan pemangkasan. Daun tanaman tomat berwarna hijau dan memiliki rambut-rambut halus. Tangkai daun tomat berbentuk bulat memanjang sekitar 7 sampai 10 cm dengan ketebalan 0.3 sampai 0.5 cm. Daun tomat berbentuk oval, memiliki gerigi dan memiliki banyak celah-celah yang menyirip agak melengkung kedalam pada bagian tepinya. Daun tomat merupakan majemuk ganjil, yang berjumlah sekitar 5 sampai 7 helai dan antara pasangan-pasangan daun terdapat daun kecil yang disebut foliol (Costa & Heuvelink 2005).
Syarat Tumbuh
Tanaman tomat merupakan tanaman yang dapat dibudidayakan di dataran tinggi maupun dataran rendah. Tomat dapat tumbuh pada ketinggian antara 100 -600 m di atas permukaan laut (dpl) dan pada ketinggian ekstrem 1000 – 2500 m dpl. Tanaman ini baik ditanam pada suhu 17 – 23 oC. Kelembapan relatif yang diperlukan untuk tanaman tomat adalah 80%. Curah hujan yang dibutuhkan tanaman tomat sekitar 750 – 1250 mm/tahun. Tanah yang sesuai untuk budidaya tanaman tomat adalah tanah dengan pH 5.5 – 6.5 dan tidak tergenang atau becek (Costa & Heuvelink 2005).
5
Biologi Nematoda Puru Akar Meloidogyne incognita
Taksonomi dan Klasifikasi
Fillum : Nemata atau Nematoda Klas : Secernantea
Sub klas : Diplogaster Ordo : Tylenchida Sub Ordo : Tylenchina Super Famili : Tylenchoidea Famili : Meloidogynidae Genus : Meloidogyne
Spesies : Meloidogyne incognita
(Carneiro & Cofcewicz 2008). Morfologi
Meloidogyne incognita memiliki tubuh transparan seperti nematoda lain pada umumnya. Juvenil 2 (J2) berbentuk silindris dan memiliki panjang tubuh ± 450 µm. Stilet dan kerangka kepala J2 mengalami sklerotinasi yang tipis. Ekor nematoda ini memiliki bentuk kerucut hialin dimulai dekat ujung ekor (Luc et al.
2005).
Nematoda jantan dewasa memiliki panjang tubuh 887-1268 µm. Bentuk kepala M. incognita jantan tidak berlekuk dan memiliki stilet yang lebih panjang bila dibandingkan dengan nematoda betina. Nematoda jantan memiliki panjang stilet 16-19 µm. Ekor M. incognita terbilang pendek dan membulat, pada bagian posterior terpilin (Eisenback & Hirschmann 1979).
Nematoda betina dewasa berbentuk seperti buah pir dengan leher pendek dan posterior membulat. Rata-rata ukuran panjang tubuh M. incognita betina dewasa adalah 921 µm. Kerangka kepala nematoda betina terbilang lembek dengan lubang ekskresi terletak agak anterior sampai pada lempeng klep bulbus median dan sering terlihat pada basal stilet. Vulva dari M. incognita betina terletak subterminal dekat anus, kutikula berwarna agak keputihan, tipis, dan beranulasi jelas (Eisenback & Hirschmann 1979; Eisenback et al. 1980).
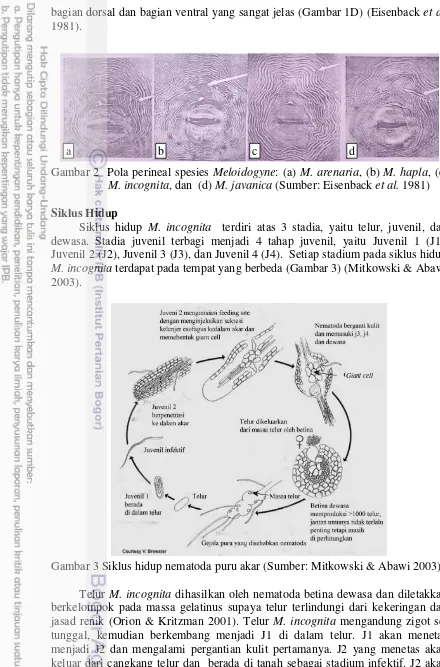
Pola Perineal
6
bagian dorsal dan bagian ventral yang sangat jelas (Gambar 1D) (Eisenback et al.
1981).
Gambar 2 Pola perineal spesies Meloidogyne: (a) M. arenaria, (b) M. hapla, (c)
M. incognita, dan (d) M. javanica (Sumber: Eisenback et al. 1981) Siklus Hidup
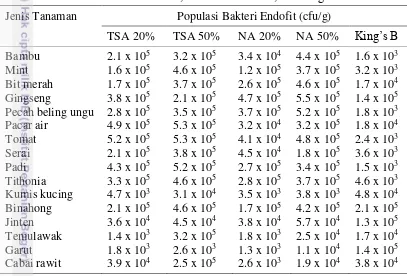
Siklus hidup M. incognita terdiri atas 3 stadia, yaitu telur, juvenil, dan dewasa. Stadia juvenil terbagi menjadi 4 tahap juvenil, yaitu Juvenil 1 (J1), Juvenil 2 (J2), Juvenil 3 (J3), dan Juvenil 4 (J4). Setiap stadium pada siklus hidup
M. incognita terdapat pada tempat yang berbeda (Gambar 3) (Mitkowski & Abawi 2003).
Gambar 3 Siklus hidup nematoda puru akar (Sumber: Mitkowski & Abawi 2003) Telur M. incognita dihasilkan oleh nematoda betina dewasa dan diletakkan berkelompok pada massa gelatinus supaya telur terlindungi dari kekeringan dan jasad renik (Orion & Kritzman 2001). Telur M. incognita mengandung zigot sel tunggal, kemudian berkembang menjadi J1 di dalam telur. J1 akan menetas menjadi J2 dan mengalami pergantian kulit pertamanya. J2 yang menetas akan keluar dari cangkang telur dan berada di tanah sebagai stadium infektif. J2 akan
d c
b a
7
mencari tanaman inang, dan masuk ke dalam jaringan tanaman inang, lalu menginfeksi tanaman inang. Setelah menemukan tempat infeksi yang cocok, J2 akan mengalami pertumbuhan dan pergantian kulit tiga kali berturut-turut menjadi J3, J4, dan dewasa (Curto et al. 2005; Khan et al. 2006).
Setelah dewasa nematoda jantan akan meninggalkan akar dan nematoda betina hidup menetap pada jaringan akar inang (Khan et al. 2006). Organ reproduksi M. incognita akan terlihat setelah menjadi betina dewasa. Pada saat M. incognita betina menjadi dewasa pola sidik pantat akan terbentuk (Khan 2003). Siklus hidup nematoda dipengaruhi oleh tipe tanah. Beberapa hal yang dapat mempengaruhi perkembangan nematoda adalah tekstur tanah, aerasi, kelembapan, pH, kandungan bahan organik dan anorganik tanah. Nematoda menyukai lingkungan yang lembap dan aerasi yang baik. Pertukaran udara di dalam tanah juga mempengaruhi perkembangan nematoda. Perkembangan nematoda akan baik jika keadaan udara di dalam tanah cukup. Kondisi oksigen yang rendah di dalam tanah dapat menghambat penetasan telur nematoda. Selain berpengaruh terhadap penetasan telur, oksigen juga mempengaruhi pergantian kulit nematoda (Garbeva
et al. 2004; Talavera & Mizukubo 2005; Ros et al. 2008). Mekanisme Patogenesis
J2 yang baru menetas dari telur bergerak aktif di dalam tanah menuju akar tanaman inang. Proses infeksi diawali ketika J2 melakukan penetrasi ke dalam jaringan akar tumbuhan melalui epidermis akar yang terletak di sekitar tudung akar. J2 masuk ke dalam jaringan akar dengan membuat lubang atau luka pada akar menggunakan stilet. Selain penetrasi secara mekanis, M. incognita juga mengeluarkan enzim yang berperan untuk menguraikan dinding sel tanaman yang terdiri dari protein, polisakarida seperti pektin, selulase, dan hemiselulase. Terurainya bahan-bahan penyusun dinding sel menyebabkan dinding sel rusak dan mudah untuk dipenetrasi. J2 bergerak diantara sel-sel menuju sel dekat silinder pusat atau berada di daerah pertumbuhan akar samping (Gheysen & Fenoll 2002; Caillaud et al. 2008; Gheysen & Mitchum 2011).
Infeksi terjadi ketika J2 menginjeksikan senyawa sinyal (elisitor) melalui stilet ke dalam jaringan inang. Senyawa sinyal tersebut menyebabkan perubahan fisiologis pada tanaman inang dan berujung pada membesarnya sel inang (giant cells) (Mitkowski & Abawi 2003). Giant cells yang terbentuk merupakan respon inang atas diinjeksikannya elisitor oleh nematoda. Tanaman inang mendistribusikan banyak nutrisi ke giant cells yang selanjutnya akan dimanfaatkan oleh nematoda sebagai sumber nutrisi (Abad et al. 2003;
Karczmarek et al. 2004; Vovlas et al. 2005). Gejala Penyakit
8
bengkak tersebut banyak dikenal sebagai puru. Puru terbentuk karena terjadi pembelahan sel dan pembesaran sel secara berlebihan pada jaringan perisikel tanaman (Williamson & Gleason 2003; Karczmarek et al. 2004; Caillaud et al.
2008).
Infeksi M. incognita menyebabkan sistem perakaran tanaman tidak normal, bahkan pada intensitas yang tinggi dapat menyebabkan disfungsi sistem perakaran secara total. Infeksi NPA pada akar juga menyebabkan terhambatnya penyerapan air dan unsur hara ke seluruh bagian tanaman. Akar tanaman yang terinfeksi oleh NPA biasanya memiliki ukuran kecil, hanya memiliki sedikit akar lateral, dan berpuru. Bentuk puru akibat serangan NPA berbeda, tergantung pada spesies NPA yang menginfeksi. Paulson dan Webster (1970) melaporkan bahwa bentuk puru akibat infeksi M. hapla seperti manik-manik dan cenderung lebih kecil dibandingkan dengan puru yang diakibatkan oleh spesies NPA yang lain.
Bakteri Endofit
Sejarah Perkembangan Bakteri Endofit
Definisi endofit pertama kali dipopulerkan oleh seorang botanis Jerman bernama Heinrich Friedrich pada tahun 1809. Saat itu endofit lebih dikenal dengan sebutan "entophytae" yang berarti sekelompok atau beberapa kelompok cendawan patogen yang hidup di dalam jaringan tanaman. Pada awal abad ke-19 terdapat kepercayaan bahwa tanaman yang sehat atau tumbuh normal merupakan tanaman yang tidak mengandung mikroorganisme sama sekali di dalam jaringannya. Namun pernyataan tersebut dibantah oleh Galippe yang menyatakan bahwa dalam tanaman yang sehat juga terdapat mikroorganisme. Galippe menjelaskan bahwa mikroorganisme yang berada di dalam jaringan tanaman bisa jadi merupakan mikroorganisme tanah yang bermigrasi ke dalam jaringan tanaman. Mikroorganisme tersebut diketahui memberikan keuntungan bagi tanaman. Sejak saat itu sampai dengan sekarang dunia ilmu pengetahuan mengakui bahwa mikroba endofit seperti bakteri, cendawan, archaea, algae, amoeba, dan jenis lainnya memiliki peran dalam kesehatan tanaman. Pada tahun 1991 Orlandi Petrini mendefinisikan endofit sebagai "semua organisme yang hidup di dalam jaringan tanaman pada sebagian atau seluruh siklus hidupnya tanpa menyebabkan gejala pada tanaman inangnya" (Hardoim et al. 2015).
Interaksi Bakteri Endofit dengan Tanaman
9
2008). Keberadaan bakteri endofit di dalam jaringan tanaman dapat berasal dari lingkungan eksternal dan masuk kedalam jaringan tanaman melalui stomata, lentisel, luka, akar lateral, dan akar yang berkecambah. Selain melalui lubang alami yang terdapat pada tanaman, bakteri endofit juga dapat masuk dari lingkungan ke dalam jaringan tanaman melalui luka lain seperti luka pada tumbuhan yang diakibatkan oleh nematoda (Hallmann et al. 1997; Bressan & Borges 2004; Kaga et al. 2008; Reinhold-Hurek & Hurek 2011).
Bakteri Endofit sebagai Agens Hayati
Bakteri endofit digunakan sebagai agens hayati karena memiliki banyak kelebihan. Bakteri endofit diketahui mampu merangsang pertumbuhan tanaman lebih baik dibandingkan dengan mikroorganisme yang hidup bebas (Ryan et al.
2008). Keterikatan endofit dengan inangnya merupakan keuntungan bagi endofit karena mereka tidak harus bersaing dalam ekosistem yang baru dan kompleks. Pengendalian biologi menggunakan bakteri endofit merupakan alternatif pengendalian yang ramah lingkungan. Keunggulan lain dari bakteri endofit sebagai agens hayati adalah mampu meningkatkan pertumbuhan tanaman yang dikenal dengan plant growth promotor (PGP). Mekanisme bakteri endofit sebagai PGP adalah meningkatkan ketersediaan nutrisi, menghasilkan hormon pertumbuhan serta dapat menginduksi ketahanan tanaman yang dikenal dengan
induced systemic resistance (ISR) (Benhamou et al. 1996; Kloepper et al. 2004; Compant et al. 2005; Kloepper & Ryu 2006).
Keefektifan bakteri endofit sebagai agens pengendali nematoda telah diketahui. Hasil penelitian menunjukkan penggunaan bakteri endofit yang diisolasi dari mentimun dan kapas dapat mengurangi populasi M. incognita pada mentimun sampai 50% (Hallmann et al. 1998). Bakteri endofit Bacillus pumilus
dan B. mycoides efektif mengurangi jumlah puru dan telur M. incognita sampai 39% pada kopi (Mekete et al. 2009).
Bakteri Endofit sebagai Agens Pemacu Pertumbuhan Tanaman
Penelitian yang dilakukan Harni dan Munif (2012) menunjukkan bakteri endofit yang diisolasi dari tanaman kehutanan mampu memacu pertumbuhan tanaman lada di rumah kaca dan di lapangan. Karakter yang tumbuh lebih baik dibandingkan dengan tanaman yang tidak diberi perlakuan bakteri endofit adalah tinggi tanaman, panjang akar, bobot akar dan bobot tanaman, serta jumlah buah lada. Wibowo (2013) berhasil mengisolasi bakteri endofit dari tanaman Mahoni, Trembesi, Gaharu, dan Meranti yang kemudian diuji pada tomat. Bibit tomat yang diberi perlakuan perendaman akar dengan bakteri endofit menunjukkan pertumbuhan yang lebih baik dibandingkan dengan yang tidak direndam.
Kemampuan bakteri endofit sebagai PGP dan menginduksi ketahanan melalui mekanisme ISR berimplikasi pada meningkatnya hasil tanaman (Rosenblueth & Martínez-Romero 2006; Ryan et al. 2008). Peningkatan pertumbuhan bibit tomat yang diberi perlakuan dengan konsorsium bakteri endofit diduga karena bakteri endofit mampu menambat nitrogen, meningkatkan aktivitas fotosintesis, dan memproduksi hormon pertumbuhan seperti indole acetic acid
10
tanaman kaktus. Mekanisme yang terjadi adalah bakteri endofit berperan dalam memobilisasi elemen-elemen hara yang berasal dari batuan sehingga mampu meningkatkan aktivitas fotosintesis dan akumulasi biomassa (Lopez et al. 2012). Konsorsium Bakteri Endofit
Konsorsium bakteri endofit merupakan kumpulan beberapa bakteri yang hidup di dalam jaringan tanaman. Konsorsim terdiri atas dua atau lebih jenis bakteri yang berbeda. Keefektifan konsorsium dibandingkan dengan isolat tunggal bakteri telah dilaporkan pada berbagai bidang. Molina et al. (2009) melaporkan konsorsium bakteri memiliki keefektifan yang tinggi untuk meremidiasi tanah yang terkontaminasi oleh minyak. Pada bidang perkebunan Halimah et al. (2015) melaporkan konsorsium bakteri endofit dapat menekan tingkat infeksi nematoda
Pratylenchus coffeae. Selain menekan tingkat infeksi P. coffeae konsorsium bakteri endofit juga dilaporkan meningkatkan pertumbuhan tanaman kopi. Pertumbuhan tajuk dan panjang akar tanaman kopi yang diberi perlakuan konsorsium bakteri endofit mengalami peningkatan. Munif et al. (2015) juga melaporkan bahwa konsorsium bakteri endofit yang diisolasi dari tanaman kehutanan efektif meningkatkan pertumbuhan tanaman tomat. Tinggi tanaman, berat segar, dan panjang akar tanaman tomat yang diberi perlakuan bakteri endofit mengalami peningkatan sampai dengan 37%.
Formulasi Agens Hayati
Jenis dan Fungsi Formulasi
Formulasi adalah tahap akhir dari penjaringan agens hayati. Terdapat tiga jenis formulasi yang umum digunakan di masyarakat, yaitu formulasi tepung, kompos, dan cair. Beberapa perusahaan benih juga melakukan formulasi pada permukaan benih dengan harapan mampu melindungi benih selama penyimpanan, perkecambahan, sampai pertumbuhan (Soesanto 2008).
Formulasi merupakan langkah awal dalam usaha pengendalian hayati yang dapat diusahakan secara komersial. Prinsip dari formulasi adalah mencampurkan organisme dalam bahan pembawa yang dilengkapi dengan bahan tambahan untuk memaksimalkan kemampuan bertahan hidup di penyimpanan, mengoptimalkan aplikasi organisme target dan melindungi organisme pengendali hayati setelah aplikasi. Fungsi dari formulasi adalah stabilisasi organisme selama produksi, distribusi penyimpanan, mengubah aplikasi produk, melindungi agens dari faktor lingkungan yang dapat menurunkan kemampuan bertahan hidupnya serta meningkatkan aktivitas dari agens hayati untuk mengendalikan organisme target. Formulasi ada dua tipe yaitu produk berbentuk padatan (tepung dan butiran) serta berbentuk suspensi (berbahan dasar minyak atau air, dan emulsi) (Copping & Menn 2000; Hynes & Boyetchko 2006; Glare et al. 2012).
11
Pemilihan bahan pembawa dapat dilakukan dengan melihat tujuan formulasi dan jenis agens bakteri yang akan diformulasi. Bahan pembawa yang sesuai dapat menjaga viabilitas sel bakteri. Tantangan yang dihadapi dalam penyimpanan bakteri berformula adalah perubahan bentuk dan kualitas selama disimpan (Habazar et al. 2015).
Formulasi Tepung
Talk adalah mineral dengan komposisi kimia (Mg3SiO10(OH)2). Mineral ini
terbentuk dari hasil hidrasi batuan pembawa magnesium seperti dolomit, periodit, dan gabro. Talk bersifat sangat lunak, halus, licin, penghisap minyak dan lemak, konduktivitas listrik rendah, penghantar panas tinggi, berkekuatan tinggi, memiliki ukuran <20 µm. Bahan ini diketahui memiliki asosiasi dengan kaolinit dan gibsit yang sangat kuat (Dixon 1989).
Beberapa penelitian telah dilakukan untuk mengetahui viabilitas sel bakteri pada berbagai macam formulasi talk. Kuenpech dan Akarapisan (2014) melaporkan bahwa talk yang dicampurkan dengan tepung gandum, sodium alginate, gliserin, sukrosa, yeast extract mampu mempertahankan viabilitas sel bakteri Bacilus subtilis isolat B6. Selain mampu mempertahankan viabilitas sel bakteri formulasi tersebut juga diketahui mampu menekan pertumbuhan cendawan Colletrotichum sp. yang berasal dari tanaman anggrek.
Formulasi Kompos
Kompos merupakan hasil perombakan bahan organik oleh mikroba dengan hasil akhir kompos yang memiliki nisbah C/N rendah. Kompos dapat dibuat dengan penambahan mikroba perombak bahan organik kedalam bahan organik. Ciri-ciri kompos yang sudah matang adalah warnanya coklat tua, tidak berbau busuk tetapi berbau tanah atau fermentasi, suhu stabil, pH alkalis, dan C/N rasio <20 (Wei et al. 2000; Peigné & Girardin 2004; Moldes et al. 2007).
Aplikasi kompos pada media tanaman merupakan salah satu cara yang kerap digunakan untuk menambah nutrisi pada tanaman. Penambahan kompos dapat meningkatkan ketersediaan nutrisi di tanah. Pemberian pupuk organik (kompos) dengan takaran 20 ton/Ha mampu meningkatkan pertumbuhan tanaman sampai minggu ke-16 (Syukur 2006). Saat ini kompos telah banyak mengalami modifikasi, salah satunya adalah dengan penambahan mikroorganisme pada kompos. Aplikasi kompos yang diperkaya dengan bakteri endofit mampu memacu pertumbuhan tanaman dan meningkatkan kesehatan tanaman (Lestari 2006).
Penggunaan kompos sebagai media pembawa bakteri endofit memerlukan beberapa bahan tambahan. Bahan yang ditambahkan tersebut sebaiknya memiliki kandungan karbon dan nitrogen, karena kedua unsur tersebut memiliki pengaruh besar terhadap aktivitas bakteri di dalam formula kompos. Sumber karbon dapat diperoleh dari karbohidrat, lemak, dan asam-asam organik. Sedangkan kebutuhan nitrogen dapat dipenuhi dari protein, amoniak, dan nitrat. Sumber karbon yang digunakan sebaiknya memperhatikan faktor ketersediaan bahan, nilai ekonomis, dan cara mikroorganisme memanfaatkannya (Jinhua et al. 1998; Albareda et al.
2008; Nur 2013; Bashan et al. 2014).
12
gula sampai dengan 55%. Alasan lain penggunaan molase adalah selain sebagai pemanfaatan hasil samping pertanian, juga untuk meningkatkan nilai tambah hasil pertanian secara keseluruhan (Pratiwi 2010).
Formulasi Cair
Formulasi cair paling banyak ditemui di masyarakat, karena formulasi ini mudah diaplikasikan. Beberapa peneliti melakukan formulasi bakteri dengan menggunakan limbah air kelapa. Air kelapa memiliki nutrisi yang cukup lengkap, yaitu 4% karbohidrat, 0.1% lemak, 0.02% kalsium, 0.01% fosfor, 0.05% besi, protein 9 g/L, vitamin C, vitamin B kompleks, dan garam-garam mineral (Yong et al. 2009).
Limbah tetes tebu atau molase juga dapat digunakan untuk formulasi cair. Molase adalah sisa dari proses pembuatan gula yang telah dipisahkan gulanya melalui proses kristalisasi berulang kali sehingga tidak mungkin lagi menghasilkan gula dengan kristalisasi konvensional. Pada proses pembuatan gula akan dihasilkan 4.5% molase dari total produk gula yang terbuat. Molase dapat digunakan sebagai bahan baku fermentasi yang dapat menghasilkan etanol, asam asetat, asam sitrat, monosodium glutamat (MSG), dan asam laktat (Quan et al.
2005; Dumbrepatil et al. 2008).
Molase berupa cairan kental, berbau, berasa pahit, dan memiliki warna hitam kecokelatan. Komposisi molase terdiri atas gula, sukrosa, protein, air, dan abu. Meskipun molase sebagai produk samping dari pembuatan gula, namun molase masih memiliki 55.37% total gula, 30.62% sukrosa, 3.89% protein, 20.33% air, dan 13.09% abu (Rahmasari 2001).
13
3 METODE
Lokasi dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Nematologi Tumbuhan dan Rumah Kaca Cikabayan Institut Pertanian Bogor, dari bulan Desember 2014 sampai dengan bulan Agustus 2015.
Perbanyakan Inokulum Meloidogyne incognita
Pemurnian Inokulum
Inokulum M. incognita didapatkan dari paket telur Meloidogyne spp. yang ditetaskan dan diperbanyak pada tanaman tomat. Paket telur diperoleh dari akar tanaman tomat di lahan percobaan IPB yang berlokasi di Desa Pasir Sarongge, Kecamatan Pacet, Kabupaten Cianjur. Satu paket telur diambil kemudian diinokulasikan pada tanaman tomat yang ditanam pada tanah steril. Enam puluh hari setelah inokulasi, dilakukan pemanenan telur pada tanaman tomat. Telur yang diperoleh diinokulasi kembali ke tanaman tomat untuk memperoleh telur yang lebih banyak. Perbanyakan ini dilakukan secara terus menerus agar inokulum murni terjaga dengan baik.
Identifikasi Spesies Nematoda Berdasarkan Pola Perineal
Identifikasi pola perineal dilakukan pada nematoda betina dewasa. Akar-akar yang berpuru diambil lalu dicuci dengan air mengalir untuk menghilangkan partikel tanah dan kotoran-kotoran yang menempel pada akar. Setelah dicuci, puru direndam dalam air selama 24 jam agar puru melunak. Setelah puru melunak, puru dibelah agar nematoda betina keluar dari dalam puru. Nematoda betina yang telah keluar dari dalam puru kemudian dipindahkan ke dalam cawan sirakus yang berisi asam cuka. Asam cuka berguna untuk menghilangkan lemak yang berada dalam tubuh nematoda betina. Setelah itu, nematoda betina dipindahkan ke gelas objek. Bagian anterior dipotong dengan pisau khusus kemudian bagian posterior ditekan agar sisa kotoran dan lemak dalam tubuh nematoda keluar. Bagian posterior disayat dan jaringan di dalam dibuang secara hati-hati. Sidik pantat kemudian dipindahkan ke gelas objek lain dengan ditetesi setetes air. Gelas penutup direkat dengan kutek kuku kemudian diamati lebih lanjut di bawah mikroskop cahaya dengan perbesaran 400x. Selanjutnya preparat dicocokkan dengan panduan dari artikel “A guide to the four most common species of root knot nematodes (Meloidogyne species) with a pictorial key” (Eisenback et al.
1981).
Ekstraksi J2 dari Paket Telur
14
Isolasi Konsorsium Bakteri Endofit
Tanaman Sumber Konsorsium Bakteri
Konsorsium bakteri endofit diisolasi dari bagian akar tanaman bambu (Bambusa bambos), mint (Coleus amboinicus), bit merah (Beta vulgaris), gingseng (Talinum triangulare), pecah beling ungu (Strobilanthes crispus), pacar air (Impatiens balsamina), tomat (Lycopersicum esculentum), serai (Cymbopogon nardus), padi (Oryza sativa), tithonia (Tithonia diversifolia), kumis kucing (Orthosiphon aristatus), binahong (Anredera cordifolia), jinten (Nigella sativa), temulawak (Curcuma xanthorrhiza), garut (Maranta arundinacea), dan cabai rawit (Capsicum frutescens). Tanaman yang digunakan sebagai sumber konsorsium bakteri endofit adalah tanaman yang diambil dari lapangan, sehat, subur, berasal dari daerah yang tidak banyak terpengaruh oleh pestisida kimia sintetis, dan berasal dari daerah yang tidak memiliki sejarah epidemik penyakit tular tanah. Lebih lanjut lokasi pengambilan sampel disajikan pada Lampiran 2. Sterilisasi Permukaan
Akar tanaman dicuci dengan air mengalir sampai bersih, kemudian dipotong menjadi beberapa bagian dan diambil sebanyak 1 g. Potongan bagian akar disterilisasi permukaan dengan cara direndam dalam alkohol 70% selama 2 menit, larutan sodium hipoklorit (NaOCl) 1% selama 2 menit dan dibilas menggunakan akuades steril sebanyak 3 kali. Potongan sampel dikeringkan dengan kertas tisu steril kemudian potongan sampel ditempelkan pada media tryptic soya agar
(TSA) dan diinkubasi selama 2 hari untuk mengetahui keberhasilan sterilisasi permukaan. (Schulz et al. 1993; Hallmann et al. 2006).
Isolasi dan Inkubasi
Bagian tanaman yang telah steril dimaserasi menggunakan mortar steril sampai halus dengan penambahan akuades steril 1:10 (v/v). Suspensi yang ada diambil sebanyak 0.1 mL kemudian diratakan pada medium tumbuh dan diinkubasi pada suhu ruang selama 2 hari. Medium tumbuh yang digunakan adalah TSA 20%, TSA 50%, nutrient agar (NA) 20%, NA 50%, dan Kings B.
Penapisan Konsorsium Bakteri Endofit
Pengujian Hipersensitivitas
15
Pengujian Aktivitas Hemolisis
Pengujian dilakukan mengikuti metode Beutin (1991). Konsorsium bakteri endofit yang tidak menimbulkan gejala nekrosis pada pengujian hipersensitivitas diuji kemampuannya dalam menghidrolisis butir darah merah. Biakan konsorsium bakteri berumur 48 jam ditumbuhkan pada media Blood Agar, kemudian diinkubasi selama 24 jam dan diamati zona hemolisis yang terbentuk. Konsorsium bakteri endofit yang menghasilkan toksin α-hemolisis akan membentuk zona gelap, toksin β-hemolisis akan membentuk zona terang, dan toksin αβ-hemolisis akan membentuk zona terang diikuti agak gelap di sekitar koloni. Bila konsorsium bakteri menunjukkan salah satu dari ketiga aktivitas hemolisis tersebut maka konsorsium tersebut tidak digunakan pada pengujian selanjutnya karena berbahaya bagi manusia. Konsorsium bakteri endofit yang tidak menunjukkan zona hemolisis/ perubahan warna media (λ-hemolisis) digunakan pada pengujian selanjutnya.
Uji Patogenisitas
Biakan konsorsium bakteri endofit pada media agar berumur 48 jam dipanen menggunakan 5 mL akuades steril. Benih tomat varietas Permata F1 (East-West Seed) yang telah disterilisasi permukaan menggunakan NaOCl 1% selama 1 menit dan akuades steril direndam dalam suspensi konsorsium bakteri endofit selama 12 jam, kemudian ditumbuhkan pada media tanah steril. Enam minggu setelah penanaman benih dilakukan pengamatan terhadap bibit tomat yang tumbuh. Konsorsium bakteri endofit yang menyebabkan gejala nekrosis, daun keriting, busuk, layu, kering, atau rebah tidak digunakan dalam pengujian selanjutnya (Vrbničanin et al. 2011).
Uji Potensi Konsorsium Bakteri Endofit sebagai Pemacu Pertumbuhan Bibit Tomat
Konsorsium bakteri endofit berumur 48 jam dipanen menggunakan 5 mL akuades steril. Benih tomat varietas Permata F1 yang telah disterilisasi permukaan menggunakan NaOCl 1% selama 1 menit dan akuades steril direndam dalam suspensi konsorsium bakteri endofit selama 12 jam, kemudian ditumbuhkan pada media tanah steril. Setelah muncul 4 daun utama, bibit tomat dipindah tanam ke pot plastik berdiameter 15 cm. Rancangan yang digunakan adalah rancangan acak kelompok dengan 5 kali ulangan, setiap ulangan terdiri atas 2 tanaman uji. Tanaman dipelihara sampai 8 minggu setelah pindah tanam. Peubah yang diamati adalah berat segar, jumlah daun, panjang akar, dan tinggi tanaman. Pada akhir pengamatan dilakukan analisis data menggunakan analisis ragam pada taraf α 0.05, apabila berbeda nyata maka dilakukan uji lanjut menggunakan DMRT pada taraf 5%, aplikasi yang digunakan untuk analisis adalah SAS versi 9.1 (Nejad & Johnson 2000).
Seleksi Konsorsium Bakteri Endofit Sebagai Agens Pengendali NPA dan Plant Growth Promoter
16
Benih tomat varietas Permata F1 yang telah disterilisasi permukaan menggunakan NaOCl 1% selama 1 menit dan akuades steril direndam dalam suspensi konsorsium bakteri endofit selama 12 jam. Benih tomat kemudian disemai pada tanah steril dan setelah muncul 4 daun utama dipindah tanam pada pot dengan diameter 15 cm. Penanaman dilakukan mengikuti pola rancangan acak kelompok (RAK) dengan 5 ulangan, setiap ulangan terdiri atas 2 tanaman uji. Setelah dipindah tanam, pada minggu pertama, ke-2, dan ke-5 tanaman tomat disiram dengan suspensi bakteri sebanyak 100 mL dengan kepadatan 108 cfu/ mL .
Penyiraman dilakukan di sekitar pangkal batang. Aplikasi penyiraman dilakukan pada sore hari pukul 16.30.
Infestasi nematoda M. incognita dilakukan 1 bulan setelah tanaman tomat dipindah tanam. Jumlah nematoda yang diinfestasikan ke tanaman adalah 300 nematoda pada fase infektif (J2). Pengukuran peubah pengamatan dilakukan 40 hari setelah inokulasi. Peubah agronomi meliputi jumlah daun, tinggi tanaman, panjang akar, bobot segar dan bobot kering tanaman. Peubah patologi berupa jumlah nematoda di akar dan tanah, tingkat kerusakan akar berdasarkan skala Bridge dan Page (1980) (Lampiran 1), dan jumlah puru pada akar. Analisis data dilakukan pada akhir pengamatan menggunakan analisis ragam pada taraf α 0.05. Apabila berbeda nyata maka dilakukan uji lanjut menggunakan DMRT pada taraf 5%. Aplikasi yang digunakan untuk analisis adalah SAS versi 9.1 (Munif et al.
2013).
Karakterisasi Sifat Fisiologis Bakteri
Aktivitas Proteolitik
Medium uji yang digunakan adalah skim milk agar (SMA). Sebanyak 30 g TSB + 15 g agar-agar bakto + 900 mL air destilasi disterilasi menggunakan autoklaf dengan suhu 121 oC dan tekanan 15 psi (2 atm) selama 20 menit. Media
tersebut kemudian didinginkan hingga suhu 40-50 oC, dan ditambahkan dengan susu (10 g susu skim dalam 100 mL air destilasi) yang disterilisasi pada suhu 110
oC selama 10 menit. Media TSA dan susu dicampur hingga rata kemudian dituang
ke dalam cawan petri. Konsorsium bakteri digores pada media SMA, lalu diinkubasi pada suhu ruang 24-72 jam. Aktivitas proteolitik ditunjukkan dengan terbentuknya zona bening di sekitar koloni bakteri (Baehaki & Budiman 2011). Aktivitas Kitinolitik
Medium uji yang digunakan adalah media kitin 1%, dengan komposisi 15 g agar-agar bakto, 5 g glukosa, 2 g pepton, 10 g koloidal kitin, 0.5 g K2HPO4, 0.5 g
MgSO4, 0.5 g NaCl dalam 1 L akuades. Media disterilasi menggunakan autoklaf
dengan suhu 121 oC dan tekanan 15 psi (2 atm) selama 20 menit. Konsorsium bakteri endofit digores pada media kitin dan diinkubasi pada suhu 27 oC. Adanya
aktivitas kitinolitik ditandai dengan terbentuknya zona bening di sekitar isolat setelah diinkubasi selama 3 hari (Hariprasad et al. 2011).
Produksi Hidrogen Sianida (HCN)
17
1 000 mL akuades. Media disterilasi menggunakan autoklaf dengan suhu 121 oC
dan tekanan 15 psi (2 atm) selama 20 menit. Medium dituang ke dalam cawan petri berdiameter 9 cm.
Preparasi kertas cyanide detection solution (CDS) dilakukan menggunakan 2 g asam pikrat dan 8 g sodium karbonat, kemudian dilarutkan dalam 200 mL air destilasi steril. Larutan tersebut digunakan untuk merendam kertas saring berukuran 1x1 cm yang telah disterilisasi. Kertas saring direndam hingga berwarna kuning cerah, kemudian kertas saring dikeringanginkan di dalam
laminar air flow.
Konsorsium bakteri digores pada medium uji. Kertas saring yang telah dicelupkan ke dalam larutan CDS ditempelkan pada bagian dalam tutup cawan petri. Bakteri diinkubasi 7 hari pada suhu ruang, kemudian di hari ke-7 dilakukan pengamatan terhadap warna kertas saring. Bakteri yang dapat memproduksi sianida dideteksi dengan adanya perubahan warna pada kertas saring dari kuning menjadi jingga kecokelatan.
Kemampuan Melarutkan Fosfat
Pengujian dilakukan menggunakan mediaum Pikovskaya’s agar, dengan tri-calcium phosphate (TCP) sebagai sumber fosfat. Komposisi medium Pikovskaya’s agar adalah 10 g C6H12O6, 5 g CaHPO4, 0.5 g (NH4)2SO4, 0.2 g
NaCl, 0.1 g MgSO4.7H2O, 0.2 g KCl, 0.5 g yeast extract, 0.002 g MnSO4.H2O,
0.002 g FeSO4.7H2O, 15 g agar-agar bakto dengan pH 7.2±0.2 pada suhu 25 oC.
Media disterilasi menggunakan autoklaf dengan suhu 121 oC dan tekanan 15 psi (2 atm) selama 20 menit. Konsorsium bakteri endofit digores pada medium tersebut lalu diinkubasi pada suhu ruang selama 4 hari. Adanya zona bening di sekitar bakteri menunjukkan adanya kemampuan untuk melarutkan fosfat (Nautiyal 1999; Mehta & Nautiyal 2001).
Fiksasi Nitrogen (N2)
Pengujian dilakukan pada medium semi padat NFB. Komposisi dari medium ini adalah 0.5 g malic acid, 0.5 g K2HPO4, 0.2 g MgSO4.7H2O, 0.1 g
NaCl, 0.02 g CaCl2.2H2O, 2 mL larutan mikro nutrien, 2 mL larutan Bromthymol blue, 4 mL Fe(III) EDTA (1.64%), 1 mL larutan vitamin, 0.5 g agar-agar bakto, dengan pH 6.8. Larutan mikro nutrien yang digunakan dalam media ini dibuat dengan komposisi 0.4 g CuSO4.5H2O, 0.12 g ZnSO4.7H2O, 1.4 g H3BO3, 1 g
Na2MoO4.2H2O, 1.5 g MnSO4.H2O, di dalam 1 000 mL akuades. Larutan vitamin
dibuat dengan komposisi 10 mg biotin, 20 mg Pyridoxol HCL di dalam 1 000 mL akuades. Media disterilisasi menggunakan autoklaf pada suhu 121 oC dan tekanan
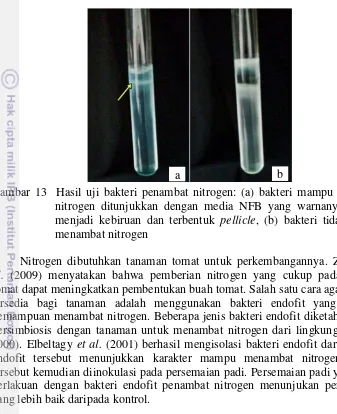
15 psi (2 atm) selama 15 menit. Pengujian dilakukan dengan menumbuhkan 1 mL suspensi bakteri dengan kerapatan 108 cfu/ mL pada 9 mL media semi padat NFB dan diinkubasi selama 48 jam. Indikator bahwa bakteri mampu memfiksasi nitrogen adalah media berubah warna menjadi biru atau biru tua serta pada bakteri akan terdapat lapisan lendir atau pellicle pada permukaan media (Kim et al.
18
Formulasi Bakteri Endofit Sebagai Biopestisida
Bakteri endofit diformulasi menggunakan bahan pembawa campuran kompos dari rumput dan kascing. Kompos sisa rumput (KSR) diperoleh dari Balai Penelitian Tanaman Rempah dan Obat (Balittro), dan kascing diperoleh dari Kebun Biofarmaka Institut Pertanian Bogor. Konsorsium bakteri endofit yang diformulasi adalah 2 konsorsium bakteri endofit dengan performa terbaik pada pengujian sebelumnya. Sebagai pembanding digunakan 1 isolat tunggal bakteri endofit yang telah dieksplorasi dan diuji oleh Harni dan Munif (2012). Isolat tunggal tersebut diketahui mampu menekan kejadian penyakit puru akar pada tanaman tomat, dan menekan penyakit kuning yang disebabkan oleh Meloidogyne
spp., Radopholus similis, dan Fusarium oxysporum pada tanaman lada. Kode isolat pembanding tersebut adalah MSJ (Corynebacterium sp.) yang berasal dari tanaman kehutanan. Kombinasi formulasi yang akan digunakan adalah sebagai berikut:
1. Konsorsium terbaik 1 + 100 g kompos daun + 100 g kascing + 10 mL molase + 1 g pepton + 50 mL akuades
2. Konsorsium terbaik 2 + 100 g kompos daun + 100 g kascing + 10 mL molase + 1 g pepton + 50 mL akuades
3. MSJ + 100 g KSR + 100 g kascing + 10 mL molase + 1 g pepton + 50 mL akuades
Proses formulasi diawali dengan mencampur seluruh bahan pembawa menjadi satu. Bahan pembawa yang telah dicampur kemudian disterilisasi menggunakan autoklaf pada suhu 121 oC dan tekanan 17 psi. Bahan pembawa yang telah steril kemudian dicampur dengan 10 mL bakteri endofit dengan kepadatan 108. (Hasibuan et al. 2013; Sallam et al. 2013; Kuenpech &
Akarapisan 2014).
Pengujian Daya Simpan Konsorsium Bakteri Endofit dalam Formulasi
Sebanyak 1 g formulasi diambil kemudian dilakukan pengenceran berseri sampai dengan konsentrasi 10-4. Hasil pengenceran diambil 0.1 mL, kemudian
diratakan pada media tumbuh konsorsium dan diinkubasi pada suhu ruang. Jumlah koloni yang tumbuh kemudian dihitung untuk mengetahui jumlah bakteri yang bertahan dalam formulasi tersebut (Sallam et al. 2013).
Pengujian Keefektifan Bakteri Endofit sebagai Biopestisida Pengendali M. incognita
19
endofit dengan perbandingan 10:1. Aplikasi dilakukan satu minggu sebelum bibit tomat pindah tanam.
20
4 HASIL DAN PEMBAHASAN
Pemurnian dan Perbanyakan Meloidogyne incognita
Akar tomat yang digunakan sebagai sumber inokulum nematoda menunjukkan gejala puru. Pada umumnya puru akar mengandung setidaknya 1 NPA betina dewasa. Menurut Mitkowski dan Abawi (2003) NPA betina dewasa hidup di dalam puru akar dengan memanfaatkan nutrisi tanaman sebagai makanannya. Telur M. incognita dihasilkan oleh nematoda betina dewasa dan diletakkan berkelompok pada masa gelatinus. Orion dan Kritzman (2001) menyatakan bahwa telur NPA biasanya terletak di luar akar tanaman dan menempel dengan tubuh betina dewasa. Hasil pengamatan menunjukkan ciri-ciri gejala dan paket telur yang digunakan pada penelitian ini sesuai dengan deskripsi di atas (Gambar 4).
Gambar 4 Paket telur nematoda puru akar: (a) paket telur menempel pada posterior NPA betina dewasa, (b) paket telur diambil menggunakan pisau untuk dikembangkan pada tanaman tomat, (c) telur NPA yang diekstraksi dari paket telur
Paket telur nematoda diinfestasikan dan dipelihara pada tanaman tomat selama 60 hari. Jangka waktu tersebut merupakan waktu yang optimal bagi NPA untuk memproduksi telur generasi selanjutnya (Curto et al. 2005). Berdasarkan hasil pengamatan morfologi sidik pantat NPA, diketahui NPA yang didapat merupakan M. incognita (Gambar 5). Spesies M. incognita memiliki ciri pola perineal terdapat lengkung dorsal yang tinggi dan menyempit, sedangkan pada bagian paling luarnya sedikit melebar dan agak mendatar, tidak memiliki garis lateral dan bagian stria terlihat jelas (Eisenback et al. 1981).
Gambar 5 Morfologi pola perineal: (a) M. incognita yang digunakan untuk pengujian, (b) M. incognita menurut Eisenback et al. (1981)
c b
a
21
Kelimpahan Konsorsium Bakteri Endofit
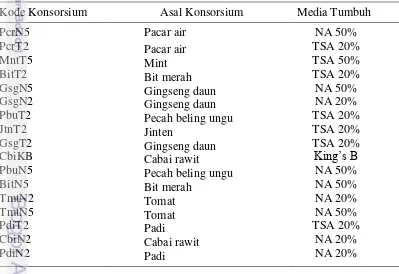
Bakteri endofit dari seluruh jenis tanaman yang diisolasi memiliki populasi yang berbeda. Perbedaan medium isolasi juga mempengaruhi populasi bakteri endofit yang tumbuh. Konsorsium bakteri endofit yang diisolasi menggunakan media tumbuh TSA dan NA memiliki populasi yang lebih tinggi dibandingkan dengan konsorsium yang diisolasi menggunakan media King’s B. Perbedaan populasi bakteri endofit juga berbeda antara media dengan konsentrasi 20% dan 50%. Populasi konsorsium bakteri endofit disajikan pada Tabel 2.
Tabel 1 Kelimpahan populasi bakteri endofit asal akar 16 jenis tanaman pada media TSA 20% dan 50%, NA 20% dan 50%, dan King’s B
Jenis Tanaman Populasi Bakteri Endofit (cfu/g)
TSA 20% TSA 50% NA 20% NA 50% King’s B * Angka merupakan rerata dari 4 ulangan
Asam amino yang dihasilkan tanaman dimanfaatkan oleh bakteri endofit sebagai salah satu sumber nutrisi untuk bertahan hidup di dalam jaringan tanaman. Perbedaan asam amino yang terkandung dalam setiap spesies tanaman menjadi salah satu sebab populasi bakteri endofit antar spesies tanaman juga berbeda (Hardoim et al. 2015). Keragaman dan kelimpahan bakteri endofit yang dapat ditumbuhkan pada media buatan sangat dipengaruhi oleh jenis media yang digunakan. Setiap jenis media memiliki kandungan nutrisi yang berbeda. Eevers
22
nutrisi rendah biasanya memiliki jumlah populasi di bawah media dengan nutrisi tinggi, namun keragamannya lebih tinggi.
Keamanan Hayati dan Karakter Koloni Konsorsium Bakteri Endofit
Reaksi Hipersensitif dan Hemolisis
Hasil uji hipersensitif selama 48 jam menunjukkan terdapat 64 konsorsium bakteri yang tidak bersifat patogenik bagi tanaman. Sebanyak 16 konsorsium bakteri endofit menunjukkan reaksi positif (menyebabkan nekrosis pada daun tanaman tembakau) (Gambar 6). Reaksi ini adalah respon tanaman terhadap munculnya patogen di dalam jaringan tanaman yang merupakan usaha untuk menghambat pertumbuhan patogen. Reaksi hipersensitif dipengaruhi oleh gen hrp
yang umum terdapat pada bakteri Gram negatif patogen tanaman, seperti kelompok Xanthomonas sp. (Zhu et al. 2000). Reaksi hipersensitif merupakan bagian dari program kematian sel yang sangat cepat dan terlokalisasi. Membran seluler pada daun tanaman tembakau yang mengalami kontak dengan bakteri patogen akan hancur, mengalami pengeringan dan nekrosis. Respon tersebut menunjukkan bahwa bakteri yang kontak dengan daun tanaman tembakau memilki potensi sebagai patogen tanaman. Isolat yang menunjukkan reaksi positif berpotensi sebagai patogen pada tanaman (Heath 2000; Lam et al. 2001), sehingga isolat tersebut tidak digunakan pada pengujian selanjutnya.
Gambar 6 Hasil uji reaksi hipersensitif pada daun tanaman tembakau: (a, b) muncul gejala nekrotik pada reaksi positif, (c) tidak muncul gejala pada reaksi negatif
Bakteri yang tidak menunjukkan gejala nekrotik pada uji hipersensitif diuji keamanannya terhadap kesehatan mamalia menggunakan blood agar. Berdasarkan hasil uji diketahui 17 konsorsium bakteri endofit aman bagi mamalia. Sebanyak 43 konsorsium menghasilkan toksin β-hemolisis, dan 4 konsorsium menghasilkan toksin α-hemolisis (Gambar 5). Serratia marcescens diketahui mampu meyebabkan hemolisis pada eritosit manusia (Hertle et al. 1999). Bakteri yang menghasilkan toksin hemolisis tidak digunakan pada pengujian selanjutnya karena telah diketahui supernatan dari α-hemolisis bersifat sangat cytotoxic