SINTESIS GLUKOSA OLEAT
DENGAN BERBANTUAN GELOMBANG MIKRO
HESTI YULIA RACHMAWATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
HESTI YULIA RACHMAWATI. Sintesis Glukosa Oleat dengan Berbantuan Gelombang
Mikro. Dibimbing oleh ZAINAL ALIM MAS’UD dan MUHAMMAD FARID.
Ester karbohidrat asam lemak adalah surfaktan nonionik yang bersifat tidak
beracun, tidak berbau, tidak berasa, dan dapat terurai. Salah satunya adalah glukosa oleat.
Glukosa oleat dapat disintesis dengan mereaksikan glukosa pentaasetat (GPA) dan metil
oleat melalui metode pemanasan konvensional (refluks) selama 6 jam, yang memakan
waktu lama. Untuk itu, telah dikembangkan metode sintesis senyawa organik berbantuan
radiasi gelombang mikro (
Microwave-Assisted Organic Synthesis,
MAOS). Tujuan
penelitian ini mensintesis glukosa oleat, melalui sintesis GPA dan metil oleat, dengan
metode MAOS yang diharapkan reaksi dapat berlangsung lebih cepat dan rendemen lebih
banyak. Parameter yang diamati ialah titik leleh (untuk GPA), kadar asam lemak bebas
(untuk metil oleat), analisis gugus fungsi dengan spektrofotometri
Fourier Transform
Infrared
(FTIR) dan persen hasil. Reaksi yang terjadi pada sintesis GPA dan glukosa
oleat adalah reaksi transesterifikasi, sedangkan reaksi sintesis metil oleat merupakan
reaksi esterifikasi. Dengan metode MAOS, waktu reaksi yang lebih cepat, yakni 5
−
10
menit. GPA, metil oleat, dan glukosa oleat berhasil disintesis sebagaimana ditunjukkan
dari pencirian dengan spektrum FTIR. Persentase hasil sintesis GPA mencapai 68,52%
dengan titik leleh 94–111 °C. Persentase hasil sintesis metil oleat mencapai 95,69%.
Kadar asam lemak bebas metil oleat adalah 2,23%. Persentase hasil sintesis glukosa oleat
mencaai 47,18%.
ABSTRACT
HESTI YULIA RACHMAWATI. Glucose Oleic Acid Synthesis using
Microwave-Assisted Organic Synthesis (MAOS) Method. Supervised by ZAINAL ALIM MAS’UD
and MUHAMMAD FARID.
SINTESIS GLUKOSA OLEAT
DENGAN BERBANTUAN GELOMBANG MIKRO
HESTI YULIA RACHMAWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi
: Sintesis Glukosa Oleat dengan Berbantuan Gelombang Mikro
Nama
: Hesti Yulia Rachmawati
NIM
: G44203031
Menyetujui
Pembimbing I,
Pembimbing II,
Dr. Zainal Alim Mas’ud, DEA
Drs. Muhammad Farid
NIP 19560622 198601 1 001
NIP 19640525 199203 1 003
Mengetahui
Ketua Departemen Kimia
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Bismillahirrohamanirrohim.
Alhamdulillah, puji dan syukur penulis panjatkan ke hadirat Allah SWT atas
limpahan rahmat dan karunia-Nya, sehingga karya ilmiah ini dapat diselesaikan. Skripsi
ini disusun berdasarkan hasil penelitian yang dilaksanakan sejak bulan Juni 2008 sampai
Agustus 2009. Tema yang diambil adalah sintesis, dengan judul Sintesis Glukosa Oleat
dengan Berbantuan Gelombang Mikro.
Terima kasih penulis ucapkan kepada berbagai pihak yang telah membantu selama
kegiatan penelitian dan penyelesaian karya ilmiah ini, antara lain Dr. Zainal Alim
Mas’ud, DEA selaku pembimbing I, Drs. Muhammad Farid selaku pembimbing II, dan
M. Khotib, S.Si atas saran yang telah diberikan. Terima kasih juga disampaikan kepada
segenap staf pengajar di Departemen Kimia FMIPA IPB atas pengajaran yang diberikan,
seluruh staf Laboratorium Terpadu IPB yang telah membantu selama penelitian, dan
rekan-rekan Kimia 40 atas diskusi dan semangatnya. Ucapan terima kasih juga penulis
sampaikan kepada Bapak, Ibu, dan kakak-kakak (Mas Hani, Mbak Ria, dan Mbak Lusi)
atas segala doa, kasih sayang, dan dorongan semangat yang telah diberikan, serta kepada
keluarga besar B-14, MSC, Al-Ghifari, Yapis, dan FORMIS 89 atas doa, semangat, dan
ukhuwah
yang begitu indah.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Januari 2010
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 05 Juli 1985 dari ayah Abdul Rachman
dan ibu Dewi Kutiah. Penulis merupakan putri ketiga dari tiga bersaudara.
Tahun 2003 penulis lulus dari SMUN 89 Jakarta dan pada tahun yang sama lulus
seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih Program
Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Glukosa ... 1
Glukosa Pentaasetat ... 2
Asam Oleat ... 2
Ester Karbohidrat Asam Lemak ... 2
Microwave Assisted Organic Synthesis
(MAOS) ... 3
Transesterifikasi ... 3
BAHAN DAN METODE
Alat dan Bahan ... 4
Metode Penelitian ... 4
HASIL DAN PEMBAHASAN
Sintesis Glukosa Pentaasetat ... 4
Sintesis FAME (Metil Oleat) ... 6
Sintesis Glukosa Oleat ... 8
SIMPULAN DAN SARAN
Simpulan ... 9
Saran ... 10
DAFTAR PUSTAKA ... 10
DAFTAR GAMBAR
Halaman
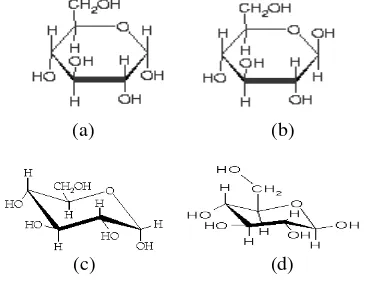
1 Struktur Haworth (a)
α
-D-glukosa dan (b)
β
-D-glukosa;
konformasi kursi (c)
α
-D-glukosa dan (d)
β
-D-glukosa ... 1
2 Struktur
α
-D-Glukosa Pentaaasetat ... 2
3 Struktur asam oleat (C
18) ... 2
4 Skema
microwave oven
... 3
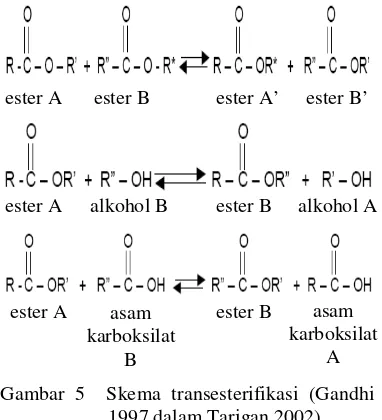
5 Skema transesterifikasi ... 3
6 Reaksi esterifikasi pada sintesis GPA ... 4
7 Produk GPA ... 5
8 Spektrum FTIR glukosa ... 5
9 Spektrum FTIR GPA hasil sintesis ... 6
10 Spektrum FTIR GPA (
Spectra Database for Organic Compound
SDBS) ... 6
11 Reaksi esterifikasi pada sintesis metil oleat ... 6
12 Produk metil oleat ... 7
13 Spektrum FTIR metil oleat hasil sintesis ... 7
14 Spektrum FTIR metil oleat (
Spectra Database for Organic Compound
SDBS) ... 8
15 Reaksi transesterifikasi pada sintesis glukosa oleat ... 8
16 Produk glukosa oleat ... 9
17 Spektrum FTIR glukosa oleat hasil sintesis ... 9
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 13
2 Diagram alir sintesis glukosa pentaasetat metode MAOS ... 14
3 Diagram alir sintesis metil oleat ... 15
4 Diagram alir sintesis glukosa oleat metode MAOS ... 16
5 Perhitungan persentase hasil GPA ... 17
6 Perhitungan persentase hasil metil oleat ... 18
7 Penentuan kadar asam lemak bebas (%FFA) ... 19
PENDAHULUAN
Ester karbohidrat asam lemak adalah surfaktan nonionik yang menarik perhatian para ahli kosmetika, farmasi, surfaktan, dan gizi, karena sifatnya yang multifungsi, tidak berbau, tidak berasa, dan dapat terurai secara biologis, serta memiliki kemampuan yang baik dalam mengaktifkan permukaan. Sejauh ini, sintesis ester karbohidrat asam lemak menggunakan pelarut yang bersifat racun,
seperti dimetilformamida dan
dimetilsulfoksida. Hal ini dapat menjadikan ester karbohidrat asam lemak berbahaya dalam pengaplikasiannya. Beberapa metode yang dikembangkan untuk proses asilasi
polihidroksilat dalam pembuatan ester
karbohidrat asam lemak masih menghadapi
tiga masalah yang mendasar, yakni
menemukan pelarut yang tidak bersifat racun untuk asam lemak dan gula, menghindari karamelisasi gula pada suhu reaksi, dan biaya
pembuatan (Kuang et al. 2000).
Nugraha (2006) dan Rahmawaty (2008) telah melakukan sintesis glukosa oleat dengan mereaksikan glukosa pentaasetat (GPA) dan metil oleat melalui metode pemanasan konvensional (refluks) selama 6 jam. Rerata persentase glukosa oleat yang didapat,
beturut-turut
, sebe
sar 64,65 dan 20,04%.Teknik pemanasan dalam proses sintesis mengalami perkembangan. Pada awalnya,
reaksi dilakukan dengan menggunakan
sumber panas eksternal (seperti oil bath, water
bath, dan sand bath). Prinsip dasar metode
pemanasan konvensional ini adalah transfer panas. Metode tersebut relatif lambat dalam mentransfer energi ke dalam sistem karena sangat bergantung kepada konduktivitas termal dari suatu material yang digunakan, dan biasanya hal yang terjadi adalah suhu dari campuran reaksi masih lebih rendah daripada suhu penangasnya. Selain itu teknik ini terkadang mengalami kelebihan panas dan mendekomposisi bahan serta produk yang dihasilkan (Liu 2002). Untuk itu, para peneliti
mulai mengembangkan metode sintesis
senyawa organik, yakni menggunakan radiasi
gelombang mikro atau Microwave-Assisted
Organic Synthesis (MAOS).
El-Ashry et al. (2007) mensintesis
turunan tioimidazol dengan pemanasan
menggunakan radiasi gelombang mikro. Reaksi yang ramah lingkungan ini lebih
menghemat waktu, yakni 2−3 menit.
Sementara itu, pemanasan konvensional
membutuhkan waktu 3−4 jam. Barbosa et al.
(2006) juga telah melakukan reaksi
esterifikasi bebas pelarut dengan
menggunakan radiasi gelombang mikro. Rerata produk yang didapat meningkat dari 83% menjadi 88,5%, sementara waktu reaksi berkurang dari 1 jam menjadi 1−2 menit.
Energi gelombang mikro diketahui
berpengaruh pada penurunan waktu berbagai jenis reaksi, peningkatan rendemen, dan reaksi kimia yang lebih bersih. Saat ini, energi tersebut telah banyak digunakan sebagai
alternatif dari proses pemanasan
konvensional.
Penelitian ini mensintesis salah satu ester karbohidrat asam lemak, yakni glukosa oleat, dari glukosa pentaasetat (GPA) dan asam
oleat dengan metode Microwave-Assisted
Organic Synthesis (MAOS) bebas pelarut.
Dengan metode ini diharapkan reaksi dapat berlangsung lebih cepat dan rendemen yang diperoleh lebih banyak.
TINJAUAN PUSTAKA
Glukosa
Glukosa, suatu gula monosakarida, adalah salah satu karbohidrat terpenting yang digunakan sebagai sumber tenaga bagi hewan dan tumbuhan. Senyawa ini disebut juga gula
darah, gula anggur, atau dekstrosa. Glukosa
merupakan salah satu hasil utama fotosintesis (Fessenden 1982).
(a) (b)
(c) (d)
Gambar 1 Struktur Haworth (a) α-D-glukosa
dan (b) β-D-glukosa; konformasi
kursi (c) α-D-glukosa dan (d) β -D-glukosa.
Glukosa (C6H12O6, bobot molekul 180,18
g/mol) adalah monosakarida yang
2
cincin tersebut mengikat gugus hidroksil dan hidrogen kecuali atom kelimanya yang mengikat atom karbon keenam di luar cincin
membentuk suatu gugus −CH2OH (Gambar
1).
Glukosa Pentaasetat
Gambar 2 α-D-Glukosa Pentaasetat.
Nama IUPAC dari glukosa pentaasetat
adalah 1,2,3,4,6-penta-O-asetil-α
,ß-D-glukopiranosa, sedangkan nama trivialnya
adalah α-D-glukosa pentaasetat (Gambar 2),
β-D-glukosa pentaasetat, dan α,ß-D-glukosa
pentaasetat. Glukosa pentaasetat berbentuk serbuk kristalin putih serta tidak larut dalam air, namun larut dalam etanol dan kloroform. Senyawa ini biasanya digunakan pada reaksi biokimia dan sebagai obat antara.
Asam Oleat
Asam oleat adalah asam lemak tak jenuh omega 9 (memiliki ikatan rangkap pada C-9), yang tersusun dari 18 atom C. Asam oleat memiliki rumus kimia sebagai berikut, yaitu CH3(CH2)7CH=CH(CH2)7COOH (Gambar 3), dengan berat molekul 282,46 g/mol. Asam oleat dapat ditemukan pada berbagai jenis hewan dan tumbuhan. Ester trigliserida dari asam oleat paling banyak terdapat pada minyak zaitun, walaupun hanya kurang dari 2% sebagai asam bebas pada minyak zaitun murni. Asam oleat terdapat pada minyak biji
anggur sebanyak 15−20% dan buah kelapa
sawit Brazil sebanyak 56% pada daging buahnya.
Gambar 3 Struktur asam oleat (C18).
Asam oleat memiliki titik lebur 16,3 °C dan titik didih 360 °C sehingga pada suhu ruang berwujud cairan kental berwarna kuning
pucat atau kuning kecoklatan (MSDS 2004). Asam oleat larut dalam larutan basa,
menghasilkan garam yang disebut oleates.
Hidrogenasi ikatan rangkap menghasilkan turunan yang jenuh, yakni asam stearat. Oksidasi pada ikatan rangkap terjadi lambat pada udara terbuka yang dikenal sebagai
ketengikan pada bahan makanan dan
pengeringan pada lapisan. Reduksi pada gugus asam karboksilat menghasilkan oleil alkohol. Dalam bidang farmasi, asam oleat digunakan sebagai pengemulsi.
Ester Karbohidrat Asam Lemak
Senyawa ester karbohidrat asam lemak merupakan suatu surfaktan nonionik yang memiliki kemampuan yang baik dalam mengaktifkan permukaan dan memiliki sifat
yang mudah terurai secara biologis (Kasori et
al. 1999). Ester karbohidrat asam lemak
bersifat tidak beracun, tidak berbau, tidak berasa, dan dapat terurai. Senyawa tersebut dapat disintesis melalui reaksi esterifikasi, tetapi seringkali dibutuhkan suhu yang tinggi dan pelarut yang bersifat racun, seperti
dimetilformamida dan dimetilsulfoksida.
Pelarut bersifat racun ini digunakan untuk membentuk larutan yang homogen agar menghasilkan produk dalam jumlah banyak. Akan tetapi, produk yang dihasilkan melalui proses tersebut memiliki keterbatasan sebagai bahan tambahan pada pembuatan makanan.
Sejauh ini, beberapa metode yang
dikembangkan untuk proses asilasi
polihidroksilat masih menghadapi tiga
masalah yang mendasar, yakni menemukan pelarut yang tidak bersifat racun untuk asam lemak dan gula, menghindari karamelisasi gula pada suhu reaksi, serta biaya pemrosesan
(Kuang et al. 2000). Untuk mengatasi hal
tersebut, dapat digunakan metode sintesis bebas-pelarut. Feuge et al. (1970) melakukan reaksi esterifikasi antara sukrosa dan asam lemak tanpa menggunakan pelarut dengan katalis litium, natrium, dan kalium pada suhu
170−187 °C. Reaksi ini terbatas dengan
adanya kecenderungan terjadinya karamelisasi glukosa pada suhu yang lebih besar dari 185 °C.
Gugus asetat pada sukrosa oktaasetat adalah gugus pergi yang baik sekaligus gugus
pelindung untuk menghindari proses
3
asam karboksilat B asam karboksilat A sukrosa oktaasetat, metil ester asam lemak,dan 1−2% katalis logam Na pada suhu 105 oC
selama dua jam dalam kondisi vakum dengan
tekanan 0−5 mmHg. Persentase hasil yang
diperoleh dari metode tersebut adalah
99,6−99,8%.
Kuang et al. (2000) memodifikasi metode
sintesis yang dilakukan Akoh dan Swanson (1990) melalui reaksi interesterifikasi antara
glukosa pentaasetat (GPA) dan Fatty Acid
Methyl Esters (FAME) dari Palm Kernel Oil
(PKO) menggunakan katalis logam Na pada suhu 80−100 °C selama 4−6 jam. Produk utama yang dihasilkan adalah ester mono- dan
di-glukosa asam lemak, masing-masing
sebesar 60,5% dan 20,2%.
Microwave Assisted Organic Synthesis
(MAOS)
Sejak beberapa dekade lalu, terjadi perkembangan yang signifikan dalam kimia
organik, salah satunya dalam teknik
pemanasan. Dari sejumlah program penelitian dan pengembangan sintesis kimia organik,
telah diperoleh alternatif pemanasan
konvensional, yakni pemanasan dengan
menggunakan radiasi gelombang mikro.
Energi gelombang mikro diketahui
berpengaruh pada penurunan waktu reaksi, peningkatan rendemen, dan reaksi kimia yang
lebih bersih. Hal ini menjadikan
Microwave-Assisted Organic Synthesis (MAOS) sebagai
alternatif utama dalam sintesis kimia organik (El-Ashry et al. 2007).
Prinsip dasar dari MAOS adalah efisiensi
dalam memanaskan material (campuran
reaksi) dengan menggunakan efek panas
dielektrik gelombang mikro. Radiasi
gelombang mikro dapat memicu timbulnya panas melalui dua mekanisme, yaitu polarisasi dipolar dan konduksi ionik. Dipol dari suatu pelarut polar akan terlibat dalam memberikan efek polarisasi. Sementara itu muatan ion timbul melalui efek konduksi ionik (Ambara 2007).
Alat yang digunakan pada metode MAOS
ini ialah microwave oven (Gambar 4).
Microwave oven beroperasi dengan pelepasan
gelombang mikro oleh tabung elektron sehingga molekul-molekul air dalam makanan akan teragitasi, yang kemudian menimbulkan getaran, dan akhirnya akan memproduksi panas. Dalam oven ini, gelombang mikro akan masuk melalui bagian atas ruang oven yang dilengkapi dengan kipas pemutar yang berfungsi untuk menyebarkan panas yang dihasilkan tadi ke seluruh bagian oven.
Kombinasi panas berintensitas tinggi dengan
putaran tersebut menyebabkan cepatnya
proses pemasakan.
Gambar 4 Skema microwave oven (sumber:
Microsoft Encarta ’96).
Transesterifikasi
Transesterifikasi adalah proses perubahan gugus alkoksi dari suatu senyawa ester dengan
senyawa lainnya, yaitu alkohol, asam
karboksilat, atau senyawa ester lainnya (Gambar 5). Reaksi ini sering terkatalisis dengan penambahan asam atau basa. Reaksi
transesterifikasi ini beranalogi langsung
dengan hidrolisis dalam asam atau basa. Asam
dapat mengkatalisis reaksi dengan
memberikan proton ke gugus karbonil, sehingga membuatnya lebih reaktif, sementara basa dapat mengkatalisis reaksi dengan memindahkan proton dari alkohol, sehingga membuatnya lebih reaktif. Karena reaksi itu reversibel, biasanya digunakan alkohol awal secara berlebihan (Fessenden 1982).
ester A ester B ester A’ ester B’
ester A alkohol B ester B alkohol A
ester A ester B
BAHAN DAN METODE
Alat dan Bahan
Peralatan yang digunakan yaitu alat-alat
gelas, neraca analitik, oven microwave
(Panasonic NN-S215WF), dan
spektrofotometer FTIR (Perkin-Elmer). Bahan-bahan yang akan digunakan yaitu glukosa, anhidrida asetat, ZnCl2 anhidrat, asam oleat, metanol, NaCl jenuh, heksana, NaOH, asam asetat glasial, asetonitril, akuades.
Metode
Penelitian ini dilakukan melalui tiga tahapan. Tahap pertama adalah sintesis GPA melalui reaksi transesterifikasi antara glukosa dan anhidrida asetat menggunakan katalis
ZnCl2. Tahap kedua adalah sintesis metil oleat
melalui reaksi antara asam oleat dengan metanol menggunakan katalis NaOH. Tahap ketiga sintesis glukosa oleat melalui reaksi transesterifikasi antara GPA dan metil oleat dengan katalis NaOH. Diagram alir penelitian dapat dilihat pada Lampiran 1.
Sintesis Glukosa Pentaasetat Metode
MAOS (Modifikasi Furniss 1989)
Sebanyak 0,5 g ZnCl2 dan 13,5 g
anhidrida asetat dimasukkan ke dalam vial kaca. Kemudian ditambahkan 2,5 g bubuk glukosa sedikit demi sedikit. Campuran diiradiasi gelombang mikro dengan skala
rendah selama 10 menit, kemudian
didinginkan pada suhu ruang dan ditambahkan air dingin 125 ml. Campuran kembali disimpan dalam suhu ruang. Padatan disaring dan dicuci dengan sedikit air dingin. Padatan
dikeringudarakan, kemudian ditimbang,
diukur titik lelehnya serta dilakukan analisis FTIR (Lampiran 2).
Sintesis Metil Oleat (FAME) (Modifikasi AOAC 1999)
Metil oleat disintesis melalui reaksi esterifikasi antara 10 g asam oleat dan 35,4 ml NaOH dalam metanol 1 N selama 20 menit
dengan suhu 80 oC pada penangas air.
Kemudian ditambahkan 70 ml BF3 di ruang
asam dan direfluks kembali selama 20 menit
dengan suhu 80 oC. Setelah didinginkan dalam
suhu ruang, larutan ditambahkan NaCl jenuh dan heksana. Larutan diekstraksi dengan corong pisah. Lapisan heksana dipisahkan kemudian diuapkan. Metil oleat yang didapat diukur kadar asam lemak bebasnya dan dilakukan analisis FTIR (Lampiran 3).
Sintesis Glukosa Oleat Metode MAOS (Modifikasi Kuang et al. 2000)
Campuran metil oleat (15,0 mmol), GPA (5,0 mmol) dan katalis NaOH (0,12 gram) dimasukkan ke dalam vial dan diiradiasi gelombang mikro dengan skala rendah selama 10 menit, kemudian didinginkan dalam suhu
ruang. Produknya dinetralisasi dengan 1−3 ml
asam asetat glasial, didinginkan dalam suhu ruang, dan dilarutkan dengan asetonitril. Kemudian dilakukan analisis FTIR (Lampiran 4).
HASIL DAN PEMBAHASAN
Sintesis Glukosa Pentaasetat (GPA)
Glukosa pentaasetat (GPA) disintesis dari glukosa dan anhidrida asetat (Gambar 6). Asetilasi antara glukosa dan anhidrida asetat
dilakukan dengan katalis ZnCl2 dengan radiasi
gelombang mikro. Dengan menggunakan gelombang mikro, sintesis GPA dapat
berjalan lebih cepat, yakni 5−10 menit.
Sementara dengan cara konvensional,
Nugraha (2006) dan Rahmawaty (2008)
membutuhkan waktu 1−2 jam untuk
mensintesis GPA.
5
Anhidrida asetat berperan sebagai donor asetil. Gugus asetil pada anhidrida asetat diharapkan dapat menggantikan hidrogen pada gugus hidroksil glukosa. Hal ini bertujuan menghindari terjadinya proses karamelisasi pada glukosa saat dilakukan sintesis glukosa oleat.
Produk hasil sintesis GPA berupa padatan berwarna putih (Gambar 7). Persentase hasil sintesis GPA dari tiga kali ulangan adalah 56,05; 68,52; dan 60,14% (Lampiran 5).
Gambar 7 Produk GPA.
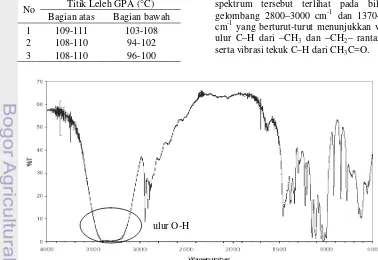
Produk GPA yang dihasilkan diuji titik lelehnya. Nilai titik leleh yang didapat berkisar antara 108−111 °C (bagian atas) dan
94−108 °C (bagian bawah). Nilai tersebut
tidak jauh berbeda dengan nilai titik leleh
GPA dari literatur, yakni 109−111 °C (MSDS
1999). Nilai titik leleh yang tidak jauh berbeda dengan nilai titik leleh pada literatur membuktikan bahwa sintesis GPA telah terbentuk.
Tabel 1 Data titik leleh produk GPA
No Titik Leleh GPA (°C)
Bagian atas Bagian bawah
1 109-111 103-108
2 108-110 94-102
3 108-110 96-100
Pada saat penambahan air es, produk GPA terpisah menjadi 2 bagian, yaitu bagian atas dan bagian bawah. Adanya bagian atas dan bagian bawah maksudnya, pada saat sintesis GPA, produk yang dihasilkan ada yang mengendap di bagian bawah vial dan ada yang ikut melayang pada air. Keduanya diyakini sebagai GPA karena memiliki bentuk yang sama, yakni padatan berwarna putih. Namun untuk GPA bagian bawah, harus dilakukan pemurnian, karena titik lelehnya berkisar antara 94–108 °C. GPA yang diambil untuk analisis FTIR dan sintesis glukosa oleat adalah GPA bagian atas, karena titik lelehnya lebih dekat dengan titik leleh GPA literatur.
Selain dilakukan pengujian titik leleh,
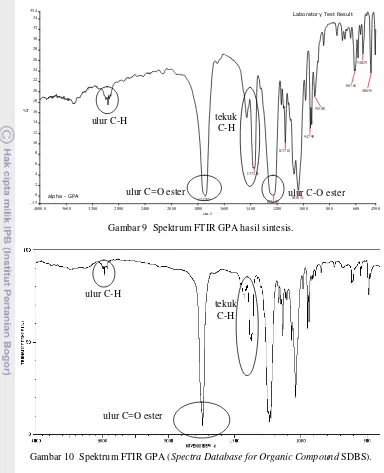
produk sintesis GPA juga dilakukan
pengambilan spektrum analisis FTIR-nya, kemudian hasilnya dibandingkan dengan spektrum FTIR glukosa dan GPA literatur (Gambar 8, 9, dan 10). Spektrum tersebut menunjukkan spektrum yang berbeda antara glukosa dan GPA. Spektrum FTIR glukosa (Gambar 8) memiliki serapan gugus hidroksil
pada 3200–3600 cm-1, sementara pada
spektrum FTIR GPA (Gambar 9) serapannya melemah. Melemahnya serapan vibrasi ulur –
OH (3200–3600 cm-1) menunjukkan bahwa
gugus hidroksil glukosa telah digantikan oleh gugus asetil dari anhidrida asetat. Hal tersebut juga didukung dengan adanya serapan yang sangat tajam dari vibrasi ulur C=O (1735– 1750 cm-1) dan vibrasi ulur C−O ester (1200
cm-1) pada GPA. Perbedaan lain kedua
spektrum tersebut terlihat pada bilangan
gelombang 2800–3000 cm-1 dan 1370–1450
cm-1 yang berturut-turut menunjukkan vibrasi ulur C–H dari –CH3 dan –CH2– rantai alkil
serta vibrasi tekuk C–H dari CH3C=O.
Gambar 8 Spektrum FTIR glukosa (www.asdlib.org).
6
ulur C-O ester tekuk
C-H
4000.0 3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 600 450.0 -1.5
0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 35.4
cm-1 %T
1742.85
1372.31
1224.05 1137.12
1038.31 947.98
913.88 607.64
548.29
486.36
Gambar 9 Spektrum FTIR GPA hasil sintesis.
Gambar 10 Spektrum FTIR GPA (Spectra Database for Organic Compound SDBS).
Sementara antara spektrum FTIR GPA hasil sintesis (Gambar 9) dan literatur (Gambar 10) terdapat persamaan, yakni pada bilangan gelombang 1735–1750, 1200, 2800–
3000 dan 1370–1450 cm-1 yang berturut-turut
menunjukkan vibrasi ulur C=O, vibrasi ulur
C−O ester, vibrasi ulur C–H dari –CH3 dan –
CH2– rantai alkil, serta vibrasi tekuk C–H dari CH3C=O (Silverstein et al. 1981).
Sintesis Metil Oleat
Metil oleat disintesis dari asam oleat dan metanol (Gambar 11). Prinsip reaksinya adalah esterifikasi antara asam karboksilat dan alkohol. Asam oleat berperan sebagai asam karboksilat. Esterifikasi asam oleat menjadi metil oleat bertujuan memaksimalkan reaksi
glukosa oleat, karena gugus metoksi
merupakan gugus pergi yang lebih baik dibandingkan dengan gugus hidroksil.
Gambar 11 Reaksi esterifikasi pada sintesis metil oleat. ulur C=O ester
ulur C-H
tekuk C-H
ulur C=O ester ulur C-H
CH
3OH
BF
37
Larutan NaCl jenuh dan heksana dapat memisahkan FAME dari campuran reaksi
sehingga dihasilkan FAME dengan
kandungan asam lemak bebas (FFA) yang rendah. Larutan NaCl jenuh berfungsi sebagai elektrolit yang memberikan efek garam dan menarik molekul air yang merupakan hasil samping reaksi sehingga proses solvasi FAME oleh heksana berlangsung lebih baik.
Gambar 12 Produk metil oleat.
Produk sintesis metil oleat berupa cairan
berwarna kuning terang (Gambar 12).
Persentase hasil sintesis metil oleat dari tiga kali ulangan adalah 48,89; 38,02; dan 95,69% (Lampiran 6). Penentuan kadar asam lemak bebas (%FFA) dilakukan untuk mengetahui
terbentuknya metil oleat. Dari hasil
perhitungan, kadar asam lemak bebas metil oleat hasil sintesis adalah 4,85; 2,23; dan 4,40% (Lampiran 7).
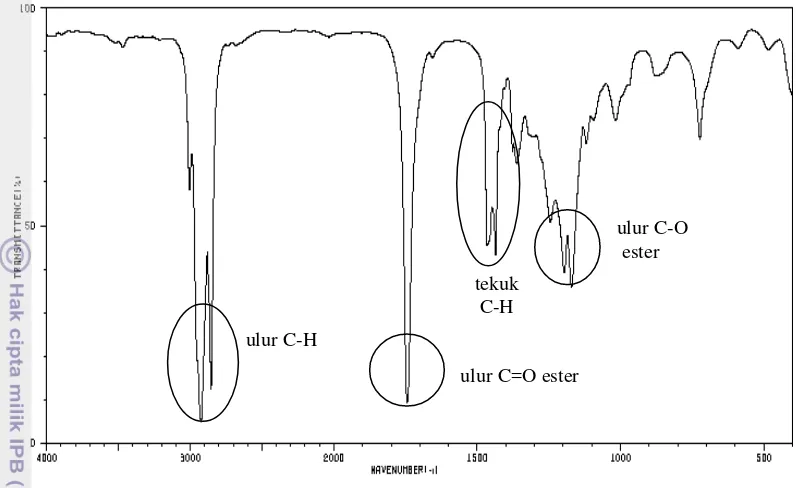
Spektrum FTIR metil oleat hasil sintesis dan literatur (Gambar 13 dan 14) sama-sama memperlihatkan serapan vibrasi ulur dan tekuk C–H dari CH3, –CH2– rantai alkil, berturut-turut pada 2800–3000 dan 1370–
1450 cm-1. Serapan pada 1745 cm-1
menunjukkan vibrasi ulur C=O dan 1170 cm-1
vibrasi ulur C–O ester. Hal ini sesuai dengan
Silverstein et al. (1981) yang menyatakan
bahwa ester metil asam lemak rantai panjang memiliki tiga pita serapan dengan serapan yang kuat pada bilangan gelombang sekitar
1175 cm-1. Hasil analisis FTIR juga
memperlihatkan bahwa gugus −OH asam oleat telah tersubstitusi oleh gugus metil dari metanol. Hal ini didasarkan pada hilangnya
pita serapan −OH (3000–3400 cm-1) pada
spektrum metil oleat.
4000.0 3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 600 450.0
4.0 10 15 20 25 30 35 40 45 50 55 56.5
cm-1 %T
2925.32 2854.81
1743.50
1436.30 1362.23
1171.39
723.31
Gambar 13 Spektrum FTIR metil oleat hasil sintesis.
ulur C-O ester
ulur C-H ulur C=O ester
8
Gambar 14 Spektrum FTIR metil oleat (Spectra Database for Organic Compound SDBS).
Sintesis Glukosa Oleat
Glukosa oleat disintesis dari GPA dan metil oleat, dengan katalis NaOH (Gambar 15). Reaksi ini dilakukan dengan radiasi gelombang mikro. Dengan menggunakan
gelombang mikro, sintesis dapat berjalan lebih cepat yakni 10 menit. Sementara dengan cara
konvensional, Nugraha (2006) dan
Rahmawaty (2008) membutuhkan waktu 6 jam untuk mensintesis glukosa oleat.
Gambar 15 Reaksi transesterifikasi pada sintesis glukosa oleat.
Sintesis glukosa oleat merupakan reaksi transesterifikasi antara GPA dan metil oleat. Pertukaran gugus pada reaksi transesterifikasi ini terjadi antara gugus asetat dari GPA dengan gugus asil dari metil oleat. Reaksi ini termasuk jenis substitusi nukleofilik (gugus
asil) dengan mekanisme adisi-eliminasi.
Nukleofil (atom O dari gugus −OCH3 FAME)
menyerang atom C gugus karbonil GPA lalu melepas gugus pergi untuk membentuk gugus karbonil dari ester yang baru.
ulur C-H
ulur C=O ester tekuk C-H
Produk sintesis glukosa oleat berupa padatan putih kekuningan yang sangat lunak (Gambar 16). Persentase hasil sintesis glukosa oleat adalah 47,18 dan 14,85% (Lampiran 8).
Gambar 16 Produk glukosa oleat.
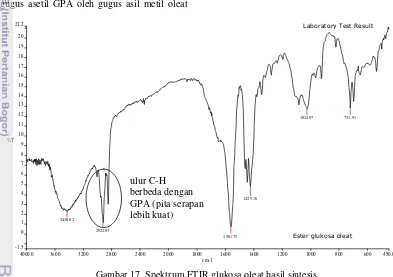
Glukosa oleat dihasilkan karena substitusi gugus asetil GPA oleh gugus asil metil oleat
[CH3-(CH2)7-CH=CH-(CH2)7-C=O]. Hal
tersebut menyebabkan spektrum FTIR
glukosa oleat (Gambar 17) dan GPA hasil
sintesis berbeda pada serapan 2800–3000 cm-1
yang menunjukkan vibrasi ulur C–H dari gugus CH3 dan –CH2– pada rantai alifatik asam lemak (Silverstein et al. 1981). Apabila dibandingkan dengan pita spektrum GPA hasil sintesis, pita serapan ini lebih kuat karena gugus asetil GPA tergantikan oleh gugus asil FAME. Pada bilangan gelombang 3200–3600
cm-1 terdapat serapan vibrasi ulur –OH
(walaupun lebih lemah dibandingkan pada spektrum FTIR glukosa, gambar 8), padahal jika dilihat dari spektrum FTIR GPA (Gambar 9) serapannya sangat lemah. Hal ini terjadi karena tidak semua gugus asetil GPA tersubstitusi oleh gugus asil metil oleat, melainkan tersubstitusi oleh –OH dari katalis NaOH.
4000.0 3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 600 450.0 -1.5 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21.2 cm-1 %T 3430.02 2922.03 1561.75 1425.16 1024.97 721.91
Gambar 17 Spektrum FTIR glukosa oleat hasil sintesis.
SIMPULAN DAN SARAN
Simpulan
Reaksi yang terjadi pada sintesis GPA
dan glukosa oleat adalah reaksi
transesterifikasi, sedangkan reaksi sintesis metil oleat merupakan reaksi esterifikasi. Sintesis GPA dan glukosa oleat dilakukan
dengan metode Microwave-Assisted Organic
Synthesis (MAOS), dengan waktu reaksi yang
lebih cepat yakni 5−10 menit. Sintesis GPA
dan glukosa oleat dengan metode MAOS dapat dikatakan berhasil. Hal ini dapat diketahui dari hasil analisis spektrum FTIR-nya. Selain itu, nilai titik leleh GPA hasil sintesis hampir mendekati titik leleh GPA dalam literatur, yakni 108–111 °C.
Persentase hasil sintesis GPA dari tiga kali ulangan adalah 56,05; 68,52; dan 60,14%. Persentase hasil sintesis metil oleat dari tiga kali ulangan adalah 48,89; 38,02; dan 95,69%. Persentase hasil sintesis glukosa oleat adalah 47,18 dan 14,85%.
Saran
Perlu dilakukan penelitian lanjutan untuk optimasi faktor waktu dan jumlah pada sintesis ester glukosa oleat melalui metode
Microwave-Assisted Organic Synthesis
(MAOS).
DAFTAR PUSTAKA
[MSDS] Material Safety Data Sheet. 2004. MSDS O3596: Oleic Acid. [terhubung
berkala]. http://www.jtbaker.com/msds/
englishhtml/o3596.htm [15 Mei 2009].
Akoh CC dan Swanson BG. 1990.
Carbohydrate Fatty Acid Esters. New
York: Marcell Dekker Inc.
Ambara P. 2007. Microwave Synthesis
[terhubung berkala].
http://ambarapradipta.wordpress.com/7-microwave-synthesis.html [3 Apr 2009].
Barbosa SL et al. 2006. Solvent Free
Esterification Reactions using Lewis Acids in Solid Phase Catalysis. Science
Direct (313):146-150 [terhubung
berkala].linkinghub.elsevier.com/retrieve/ pii/S0926860X06005564 [3 Apr 2009]
El-Ashry ESH et al. 2007. MAOS versus
Conventional Synthesis of 4,5-di- and
3,4,5-triphenylimidazole-2-thione and
Their Derivatives. Arkivoc (vii):30-40
[terhubung berkala].
www.arkat-usa.org/get-file/18706 [13 Des 2007]
Fessenden RJ dan Fessenden JS. 1982. Kimia
Organik. Jilid 2. Ed ke-3. Terjemahan
Alloyssus Hadyana Pudjaatmaka. Jakarta: Erlangga.
Feuge RO, Zeringue Jr HJ, Weiss TJ, Brown M. 1970. Preparation of Sucrose Ester by
Interesterification. Am J Oil Chem Soc
(33):424 [terhubung berkala].
http://ci.nii.ac.jp/naid/10009959390 [15
Mei 2009]
Furniss BS, et al. 1989. Vogel’s Textbook of
Practical Organic Chemistry. Ed ke-5.
New York: John Willey & Sons, Inc.
Harvey D. 2000. Modern Analytical
Chemistry. New York: Mc Graw Hill.
Kasori Y dan Kashiwa K. 1999. Method for Producing A Sucrose Fatty Acid Ester
[terhubung berkala].
www.patentstorm.us/patents/5908922.ht ml [13 Des 2007]
Kuang D, Obaje OJ, dan Ali AM. 2000.
Synthesis and Characterization of
Acetylated Glucose Fatty Esters from Palm and Palm Kernel Oil Fatty Methyl
Esters. Journal of Oil Palm Research.
12(2):14-19 [terhubung berkala].
palmoilis.mpob.gov.my/publications/jopr v12n2-p2.pdf [13 Des 2007].
Liu C. 2002. Microwave Assisted Organic
Synthesis [terhubung berkala].
http://bama.ua.edu/~chem/seminars/stude
ntseminars/fall02/liu-semf02.pdf [13
Desember 2007].
Nugraha A. 2006. Sintesis Ester Glukosa
Oleat dari Glukosa Pentaasetat dan Metil
Oleat [skripsi]. Bogor: Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Petkewich R. 2008. Chemical & Engineering
News [terhubung berkala].
http://pubs.acs.org/cen/news/86/i37/8637 notw9.html [15 Mei 2009].
Rahmawaty M. 2008. Sintesis Glukosa Oleat
dari Metil Oleat dan Glukosa Pentaasetat
Menggunakan Katalis Zeolit Alam
Cikembar [skripsi]. Bogor: Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Silverstein RM, Bassler GC, Morrill TC.
1981. Penyidikan Spektrometrik Senyawa
Organik. Ed ke-4. Terjemahan AJ
Hartomo dan Anny Victor Purba. Jakarta: Erlangga.
Tarigan J. 2002. Ester Asam Lemak
[terhubung berkala].
http://library.usu.ac.id/download/fmipa/K imia-Juliati.pdf [13 Desember 2007].
Varma RS. 2001. Solvent-free Accelerated Organic Syntheses using Microwaves.
Pure Appl. Chem 73(1):193-198
[terhubung berkala].
www.iupac.org/publications/pac/2001/pdf
11
Vogel AI. 1974. A Text-Book of Practical
Organic Chemistry; including Qualitative
Organic Analysis. Ed ke-3. London:
13
Lampiran 1 Diagram alir penelitian
Sintesis GPA
Analisis FTIR
Sintesis Metil Oleat
Sintesis
Glukosa Oleat
•
Titik Leleh
•
Analisis FTIR
14
Lampiran 2 Diagram alir sintesis glukosa pentaasetat metode MAOS
disaring dan dicuci dengan
sedikit air dingin
didinginkan
ditambahkan air es 125 ml
2.5 g glukosa
0.5 g ZnCl
213.5 g
anhidrida asetat
Radiasi dengan gelombang mikro
selama 10 menit
Padatan (minyak mengeras)
Rekristalisasi
GPA
15
Lampiran 3 Diagram alir sintesis metil oleat (modifikasi AOAC 1999)
Refluks
20 menit, 80
oC
10 g asam oleat
35.4 ml NaOH
dalam metanol 1 N
didinginkan dalam suhu ruang
ditambahkan NaCl jenuh dan heksana
ditambahkan 70 mL BF
3di ruang asam
Ekstraksi
Evaporasi
Refluks
20 menit, 80
oC
lapisan heksana dipisahkan
Metil Oleat
16
Lampiran 4 Diagram alir sintesis glukosa oleat metode MAOS
didinginkan
Metil Oleat
(15,0 mmol)
GPA
(5,0 mmol)
katalis NaOH
(0,12 gram)
Radiasi dengan gelombang mikro
selama 10 menit
•
didinginkan
•
dilarutkan dengan asetonitril
Netralisasi dengan 1−3 ml asam asetat glasial
Glukosa Oleat
17
Lampiran 5 Perhitungan persentase hasil GPA
Data persentase hasil sintesis GPA
No
Bobot (g)
Bobot GPA (g)
Persen
Hasil (%)
ZnCl
2anhidrida
asetat
glukosa
bagian
atas
bagian
bawah
total
1
0,5060
13,5421
2,5137
0,1079
2,9552
3,0631
56,05
2
0,5068
13,5309
2,5111
0,2232
3,5211
3,7443
68,52
3
0,5183
13,5314
2,5170
0,3517
2,9347
3,2684
60,14
Keterangan:
Adanya bagian atas dan bagian bawah maksudnya, pada saat sintesis GPA, produk yang
dihasilkan terdiri atas 2 fase. Keduanya diyakini sebagai GPA karena memiliki bentuk
yang sama, yakni padatan berwarna putih. Namun untuk GPA yang bagian bawah, harus
dilakukan pemurnian, karena titik lelehnya berkisar antara 94
–108
°C.Contoh perhitungan persentase hasil sintesis GPA:
Bobot glukosa
= 2,5137 g
Bobot anhidrida asetat
= 13,5421 g
Bobot GPA
= 3,0631 g
BM glukosa
= 180,0954 g/mol
BM anhidrida asetat
= 102,0249 g/mol
BM GPA
= 390,3393 g/mol
Mol glukosa
=
)
/
(
)
(
mol
g
BM
g
bobot
=
mol
g
g
/
0954
,
180
5137
,
2
= 0,0140 mol
Mol anhidrida asetat
=
)
/
(
)
(
mol
g
BM
g
bobot
=
mol
g
g
/
0249
,
102
5421
,
13
= 0,1327 mol
Reaksi:
glukosa +
5 anhidrida asetat
GPA +
5 asam asetat
Mol glukosa
Mol anhidrida
asetat
Mol GPA
Mol asam
asetat
Mula-mula
0,0140
0,1327
-
-
Bereaksi
0,0140
0,0698
0,0140
0,0698
Sisa
-
0,0629
0,0140
0,0698
Bobot teoritis = mol GPA (mol) x BM GPA (g/mol)
= 0,0140 mol x 390,3393 g/mol
= 5,4648 g
Persentase hasil =
×
100
%
teoritis
bobot
contoh
bobot
=
100
%
4648
,
5
0631
,
3
×
g
g
18
Lampiran 6 Perhitungan persentase hasil metil oleat
Data persentase hasil sintesis metil oleat
No
Bobot (gram)
Volume Metanol
(ml)
Persen Hasil (%)
Asam Oleat
Metil Oleat
1
10,0375
5,1600
35
48,89
2
10,0049
3,9900
35
38,02
3
10,0261
10,0717
35
95,69
Contoh perhitungan persentase hasil sintesis metil oleat:
Bobot asam oleat
= 10,0375 g
Bobot metil oleat
= 5,1600 g
Volume metanol
= 35,0000 ml
ρ
metanol
= 0,79 g/ml
BM asam oleat
= 282,2864 g/mol
BM metil oleat
= 296,4879 g/mol
BM metanol
= 32,0317 g/mol
Mol asam oleat
=
)
/
(
)
(
mol
g
BM
g
bobot
=
mol
g
g
/
2864
,
282
0375
,
10
= 0,0356 mol
Mol metanol
=
)
/
(
(g/ml)
)
(
mol
g
BM
ml
volume
×
ρ
=
mol
g
ml
g
ml
/
0317
,
32
/
79
,
0
0000
,
35
×
= 0,8632 mol
Reaksi:
asam oleat
+ metanol
metil oleat +
H
2O
Mol asam oleat
Mol metanol
Mol metil oleat
Mula-mula
0,0356
0,8632
-
Bereaksi
0,0356
0,0356
0,0356
Sisa
-
0,8276
0,0356
Bobot teoritis = mol metil oleat (mol) x BM metil oleat (g/mol)
= 0,0356 mol x 296,4900 g/mol
= 10,5550 g
Persentase hasil =
×
100
%
teoritis
bobot
contoh
bobot
=
100
%
5550
,
10
1600
,
5
×
g
g
19
Lampiran 7 Penentuan kadar asam lemak bebas (%FFA) (SNI 01-3555-1994)
Sebanyak 2,5 ml (
ρ
= 0,86 g/ml) metil oleat dimasukkan ke dalam erlenmeyer 250
ml, kemudian ditambahkan 25 ml etanol dan direfluks selama 15 menit. Larutan
ditambahkan beberapa tetes indikator fenolftalein lalu dititrasi dengan NaOH sampai titik
akhir tercapai yang ditandai dengan timbulnya warna merah jambu tetap selama 15 detik.
%
100
)
(
)
(
%
=
×
×
×
mg
contoh
bobot
oleat
asam
BM
NaOH
N
ml
NaOH
V
FFA
Keterangan:
BM asam oleat = 282,2864 g/mol
Data persentase asam lemak bebas metil oleat hasil sintesis
1)
Metil oleat 1
Pembuatan larutan asam oksalat 0,1 N
Bobot asam oksalat
= 0,6360 gram
Volume larutan
= 100 ml
Normalitas asam oksalat percobaan
=
Volume
oksalat
as
BE
oksalat
as
bobot
.
.
=
L
ekiv
g
g
1
,
0
0350
,
63
6360
,
0
= 0,1009 N
Standardisasi larutan NaOH 1 N oleh asam oksalat 0,1009 N
No
Volume
awal (ml)
Volume
akhir (ml)
Volume
NaOH
(ml)
Normalitas
NaOH (N)
1
21,8
22,3
0,5
1,0090
2
22,3
22,8
0,5
1,0090
3
22,8
23,3
0,5
1,0090
Rerata
1,0090
Contoh perhitungan:
Normalitas NaOH (N) =
NaOH
V
oksalat
asam
N
V
)
(
×
=
ml
N
ml
5
,
0
1009
,
0
5
×
= 1,0090 N
Titrasi Metil oleat 1 oleh NaOH 1,0090 N
No
Volume
awal (ml)
Volume
akhir (ml)
Volume
NaOH
(ml)
%FFA
1
20,5
21,0
0,5
6,62
2
21,0
21,3
0,3
3,97
3
21,3
21,6
0,3
3,97
Rerata
4,85
Contoh perhitungan:
%
100
2150
/
2864
,
282
0090
,
1
3
,
0
%
=
×
×
×
mg
mol
g
N
ml
20
Lanjutan Lampiran 7
2)
Metil oleat 2
Pembuatan larutan asam oksalat 0,1 N
Bobot asam oksalat
= 0,6360 gram
Volume larutan
= 100 ml
Normalitas asam oksalat percobaan
= 0,1009 N
Standardisasi larutan NaOH 1 N oleh asam oksalat 0,1009 N
No
Volume
awal (ml)
Volume
akhir (ml)
Volume
NaOH
(ml)
Normalitas
NaOH (N)
1
19,0
19,5
0,5
1,0090
2
19,5
20,1
0,6
0,8408
3
20,1
20,6
0,5
1,0090
Rerata
0,9529
Titrasi Metil oleat 2 oleh NaOH 0,9529 N
No
Volume
awal (ml)
Volume
akhir (ml)
Volume
NaOH
(ml)
%FFA
1
20,6
20,8
0,2
2,43
2
20,8
20,95
0,15
1,82
3
20,95
21,15
0,2
2,43
Rerata
2,23
3)
Metil oleat 3
Pembuatan larutan asam oksalat 0,1 N
Bobot asam oksalat
= 0,6336 gram
Volume larutan
= 100 ml
Normalitas asam oksalat percobaan
= 0,1005 N
Standardisasi larutan NaOH 1 N oleh asam oksalat 0,1005 N
No
Volume
awal (ml)
Volume
akhir (ml)
Volume
NaOH
(ml)
Normalitas
NaOH (N)
1
13,0
14,1
1,1
0,9145
2
14,1
15,2
1,1
0,9145
3
15,2
16,3
1,1
0,9145
Rerata
0,9145
Titrasi Metil oleat 3 oleh NaOH 0,9145 N
No
Volume
awal (ml)
Volume
akhir (ml)
Volume
NaOH
(ml)
%FFA
21
Lampiran 8 Perhitungan persentase hasil glukosa oleat
Data persentase hasil sintesis glukosa oleat
No
Bobot (g)
Persen hasil
(%)
GPA
Metil oleat (FAME)
Glukosa oleat
1
0,4506
2,2322
0,8178
47,18
2
0,2311
1,1230
0,1320
14,85
Contoh perhitungan persentase hasil sintesis GPA:
Bobot GPA
= 0,4506 g
Bobot metil oleat
= 2,2322 g
Bobot glukosa oleat
= 0,8178 g
BM GPA
= 390,3393 g/mol
BM metil oleat
= 296,4879 g/mol
BM glukosa oleat
= 1501,4718 g/mol
Mol GPA
=
)
/
(
)
(
mol
g
BM
g
bobot
=
mol
g
g
/
3393
,
390
4506
,
0
= 1,1544 x 10
-3mol
Mol metil oleat
=
)
/
(
)
(
mol
g
BM
g
bobot
=
mol
g
g
/
4879
,
296
2322
,
2
= 7,5288 x 10
-3mol
Reaksi:
GPA +
metil oleat
glukosa oleat
Mol GPA
Mol metil oleat
Mol glukosa oleat
Mula-mula
1,1544 x 10
-37,5288 x 10
-3-
Bereaksi
1,1544 x 10
-31,1544 x 10
-31,1544 x 10
-3Sisa
-
6,3744 x 10
-31,1544 x 10
-3Bobot teoritis = mol glukosa oleat (mol) x BM glukosa oleat (g/mol)
= (1,1544 x 10
-3)
mol x 1501,4718 g/mol
= 1,7333 g
Persentase hasil =
×
100
%
teoritis
bobot
contoh
bobot
=
100
%
7333
,
1
.
8178
,
0
×
g
g