OPTIMASI PRODUKSI BIBIT KENTANG (
Solanum tuberosum)
‘
GRANOLA
’
DENGAN TEKNIK FOTOAUTOTROFIK
IN VITRO
SONYA PUTRI RAI
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
3
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Optimasi Produksi Bibit Tanaman Kentang (Solanum tuberosum) ‘Granola’ dengan Teknik Fotoautotrofik In Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor
Bogor, Juli 2015
Sonya Putri Rai
4
RINGKASAN
SONYA PUTRI RAI. Optimasi Produksi Bibit Tanaman Kentang (Solanum tuberosum) ‘Granola’ dengan Teknik Fotoautotrofik. Dibimbing oleh NI MADE ARMINI WIENDI dan KRISANTINI.
Kentang merupakan bahan pangan keempat di dunia setelah padi, jagung, dan gandum. Indonesia masih mengimpor kentang untuk memenuhi kebutuhan bibit, benih dan bahan pangan terutama untuk industri pengolahan. Rendahnya produksi Indonesia disebabkan belum banyaknya petani penghasil bibit kentang bermutu, sehingga permintaan bibit kentang tidak dapat dipenuhi. Upaya yang dapat dilakukan untuk mengatasi kendala tersebut adalah dengan memanfaatkan bioteknologi dengan cara pembiakan mikro bibit kentang. Tanaman yang ditumbuhkan dalam kondisi in vitro pada umumnya tidak melakukan fotosintesis, lapisan kutikula dan jaringan pembuluh antara akar dan pucuk tidak berkembang serta stomata belum berfungsi dengan baik sehingga sulit bertahan pada saat aklimatisasi. Metode mikropropagasi fotoautotrofik telah dikembangkan untuk mengatasi kendala daya adaptasi planlet yang rendah saat aklimatisasi. Metode ini menggunakan gula dengan konsentrasi lebih rendah sebagai sumber energi bagi eksplan dan eksplan diinduksi agar mampu berfotosintesis di dalam kondisi semi terbuka. Kondisi ini lebih mirip dengan kondisi di lapangan, sehingga eksplan akan memiliki daya adaptasi yang lebih tinggi ketika aklimatisasi
Penelitian ini bertujuan mempelajari respon pertumbuhan kentang kultivar Granola yang dikulturkan dengan sistem fotoautotrofik untuk menyediakan bibit kentang yang unggul dan bermutu. Penelitian dilaksanakan di Laboratorium Kultur Jaringan 2, analisis morfologi stomata dilakukan di Laboratorium Mikro Teknik, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilakukan dari bulan November 2014 hingga April 2015. Penelitian ini terdiri dari dua percobaan terpisah. Percobaan pertama menggunakan eksplan buku tunggal, percobaan kedua menggunakan eksplan pucuk. Rancangan percobaan yang digunakan adalah Rancangan Kelompok Lengkap Teracak (RKLT) dua faktor, yaitu konsentrasi gula yang terdiri dari 5 taraf, yaitu 5, 10, 15, 20 dan 25 gL-1 serta ventilasi yang terdiri dari 2 taraf, yaitu 1 dan 2 lubang.
Pada percobaan pertama diperoleh bahwa pengurangan konsentrasi gula nyata menghambat jumlah daun dan buku tunas kentang. Interaksi gula yang rendah dan penambahan ventilasi menyebabkan peningkatan jumlah stomata dan kloroplas serta menghasilkan diameter stomata yang lebih kecil. Sebanyak 45 % planlet yang ditumbuhkan pada media dengan konsentrasi gula 25 gL-1 dengan ventilasi 1 serta 67 % planlet dari media gula 25 gL-1 dengan ventilasi 2 mampu bertahan selama aklimatisasi dan diduga dapat digunakan untuk produksi bibit. Interaksi pengurangan konsentrasi gula dengan penambahan ventilasi pada semua perlakuan nyata meningkatkan kerapatan stomata dan jumlah kloroplas serta menyebabkan diameter stomata yang lebih kecil. Pada percobaan ini tidak terdapat planlet yang mampu bertahan pada tahap aklimatisasi.
5
SUMMARY
SONYA PUTRI RAI. Optimation of Potato (Solanum tuberosum) ‘Granola’ Seedlings Production using Photoautotrophic System. Supervised by NI MADE ARMINI WIENDI and KRISANTINI.
Potato is the fourth food in the world after rice, corn, and wheat. Indonesia still imports potatoes for seedlings, seeds and foods, especially for the industry. Indonesian production was law caused farmers have not been producing good quality of potatoes seed, so the demand for seed of potatoes can not filled. The efforts should be made to overcome these obstacles is use biotechnology by micropropagation for potatoes seedling. In vitro plants rarely photosynthesise; their cuticle, vascular tissue between roots and shoots and stomata do not grow and functioning so that the in vitro derived plantlets had low survival in ex vitro conditions. Photoautotrofik system have been developed to overcome the low adaptability of plantlets when acclimatization. This method uses a lower concentration of sugar as an energy source for explants and explants induced to be able to photosynthesise in the semi-open conditions. This condition is more similar to conditions on the ground, so that the explants will have a higher adaptability when the acclimatization.
This research aims to study the growth of potato ‘Granola’ cultured in vitro
with photoautotrophic system to provide good quality potato explants. This research was conducted at the Laboratory of Tissue Culture 2, morphological analysis of stomata was conducted at the Laboratory of Micro Technique, Department of Agronomy and Horticulture, Faculty of Agriculture, Bogor Agricultural University. The research was conducted from November 2014 until April 2015. This research is consisted of two separate experiments. The first experiment used a single node explant, a second trial using shoot explants. The experiment was arranged in a Randomized Blok Design with two factors concentration of sugar and ventilation. The concentration of sugar are 5, 10, 15, 20 and 25 gL-1, the ventilaion are one and two ventilation.
Increases in sucrose concentration correlated positively to the growth of
Solanum tuberosum plantlets. Interaction of low sugar and additional ventilation increased the number of stomata and chloroplasts as well as narrowing the diameter of stomata. 45% plantlets grown on media with the treatment of 25 gL-1 sugar with 1 ventilation and 67% on 25 gL-1 sugar with 2 ventilation survived and could be used for seedling production. Interaction of low concentration of sugar with the addition of ventilation in second trial on all treatments significantly increased the density of stomata, number of chloroplast and causes smaller diameter of stomata. In this experiment there is no plantlets were able to survive in the acclimatization stage.
2
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
OPTIMASI PRODUKSI BIBIT KENTANG (
Solanum tuberosum)
‘
GRANOLA
’
DENGAN TEKNIK FOTOAUTOTROFIK
IN VITRO
SONYA PUTRI RAI
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
7
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah dengan judul ‘Optimasi Produksi Bibit Tanaman Kentang (Solanum tuberosum) Granola dengan Teknik Fotoautotrofik In Vitro’ ini dapat diselesaikan dengan baik.
Terima kasih penulis ucapkan kepada :
1. Dr. Ir. Ni Made Armini Wiendi, M.S. dan Dr. Ir. Krisantini, M.Sc. selaku pembimbing skripsi yang telah memberikan bimbingan, nasihat, dorongan dan dana selama penyelesaian tugas akhir.
2. Dr. Ir. Diny Dinarty, M.S. selaku pembimbing akademik yang telah memberikan bimbingan dan nasihat selama penulis menempuh pendidikan di Departemen Agronomi dan Hortikultura.
3. Seluruh staf pengajar Departemen Agronomi dan Hortikultura yang telah banyak memberikan ilmunya.
4. Abah dan mama serta kedua saudara, Sunny dan Reskha yang senantiasa memberikan doa, dukungan dan kasih sayangnya.
5. Fajri Khairiz Zaman, Elvira, Fahmi Al-hafiz, Christine Della, Regi Meiliani, Dian Prawita dan Febry Muliani atas doa, bantuan, kasih sayang dan dukungan sampai saat ini.
6. Amel, Nawang, Fittia, Galuh, Novi, Dyra, Abi dan Usamah atas dukungan dan semangatnya selama menempuh pendidikan dan kegiatan penelitian. 7. Teman-teman Kultur Jaringan 2 atas bantuannya selama kegiatan
penelitian.
8. Teman-teman Dandelion AGH 48 yang telah memberikan dukungannya. Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2015
8
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Hipotesis Penelitian 3
TINJAUAN PUSTAKA 3
METODE 5
Tempat dan Waktu 5
Bahan dan Alat 6
Metode Percobaan 6
Prosedur Percobaan 7
Pengamatan 9
HASIL DAN PEMBAHASAN 10
KESIMPULAN 25
DAFTAR PUSTAKA 26
9
DAFTAR TABEL
1 Pengaruh konsentrasi gula terhadap pertumbuhan eksplan buku tunggal
kentang ‘Granola’ secara fotoautotrofik pada 6 MST 11 2 Pengaruh ventilasi terhadap pertumbuhan eksplan buku tunggal kentang
‘Granola’ secara fotoautotrofik pada 6 MST 12 3 Perbandingan nilai tengah perlakuan konsentrasi gula dengan kontrol
pada peubah jumlah daun dan buku 12
4 Perbandingan nilai tengah perlakuan ventilasi dengan kontrol pada
peubah jumlah daun dan buku 13
5 Waktu munculnya akar (MST) pada tanaman kentang ‘Granola’ 14 6 Rekapitulasi hasil uji F pengaruh kombinasi konsentrasi gula dengan
jumlah ventilasi terhadap morfologi stomata tanaman kentang ‘Granola 14 7 Perbandingan nilai tengah perlakuan konsentrasi gula dengan kontrol
pada morfologi stomata 14
8 Perbandingan nilai tengah perlakuan ventilasi dengan kontrol pada
morfologi stomata 15
9 Pengaruh interaksi gula dan ventilasi terhadap kerapatan stomata
kentang ‘Granola’ 15
10 Pengaruh interaksi gula dan ventilasi terhadap diameter stomata
kentang ‘Granola’ 16
11 Pengaruh interaksi gula dan ventilasi terhadap kloroplas kentang
‘Granola’’ 17
12 Pengaruh konsentrasi gula terhadap pertumbuhan eksplan pucuk
kentang ‘Granola’ secara fotoautotrofik pada 6 MST 18 13 Pengaruh ventilasi terhadap pertumbuhan eksplan pucuk kentang
‘Granola’ secara fotoautotrofik pada 6 MST 19 14 Perbandingan nilai tengah perlakuan konsentrasi gula dengan kontrol
pada peubah jumlah daun dan buku 19
15 Perbandingan nilai tengah perlakuan ventilasi dengan kontrol pada
peubah jumlah daun dan buku 20
16 Waktu munculnya akar (MST) pada tanaman kentang ‘Granola’ 20 17 Rekapitulasi hasil uji F pengaruh kombinasi konsentrasi gula dengan
jumlah ventilasi terhadap morfologi stomata tanaman kentang ‘Granola 21 18 Perbandingan nilai tengah perlakuan konsentrasi gula dengan kontrol
pada morfologi stomata 21
19 Perbandingan nilai tengah perlakuan ventilasi dengan kontrol pada
morfologi stomata 22
20 Pengaruh interaksi gula dan ventilasi terhadap kerapatan stomata (mm -2
) kentang ‘Granola’ 23
21 Pengaruh interaksi gula dan ventilasi terhadap diameter stomata (nm)
kentang ‘Granola’ 23
22 Pengaruh interaksi gula dan ventilasi terhadap jumlah kloroplas kentang
‘Granola’ 24
23 Pengaruh konsentrasi gula dan ventilasi terhadap pertumbuhan kentang
‘Granola’ percobaan 1 pada tahap aklimatisasi 24
24 Pengaruh konsentrasi gula dan ventilasi terhadap pertumbuhan kentang
10
DAFTAR GAMBAR
1 Metode penanaman eksplan 8
2 Keragaan tunas kentang yang mengalami kekeringan akibat penyusutan
media 10
3 Keragaan eksplan kentang pada 0 minggu setelah tanam 11
4 Keragaan pertumbuhan tanaman kentang ‘Granola’ dengan teknik
fotoautotrofik 13
5 Kerapatan stomata tanaman kentang ‘Granola’ dengan teknik
fotoautotrofik 16
6 Diameter stomata tanaman kentang ‘Granola’ dengan teknik
fotoautotrofik 17
7 Keragaan eksplan kentang pada 0 minggu setelah tanam 18
8 Keragaan pertumbuhan tanaman kentang ‘Granola’ dengan teknik
fotoautotrofik 20
9 Kerapatan stomata tanaman kentang ‘Granola’ dengan teknik
fotoautotrofik 22
10 Diameter stomata tanaman kentang ‘Granola’ dengan teknik
fotoautotrofik 23
DAFTAR LAMPIRAN
1 Suhu ruang kultur pada tahap in vitro 28
PENDAHULUAN
Latar Belakang
Kentang merupakan salah satu jenis sayuran yang mendapat prioritas untuk dikembangkan di Indonesia. Kentang merupakan bahan pangan keempat di dunia setelah padi, jagung, dan gandum. Sentra produksi kentang di Indonesia tersebar di daerah Sumatera Utara, Sumatera Barat, Jambi, Jawa Barat, Jawa Tengah, Jawa Timur, dan Sulawesi Selatan. Menurut Samadi (2007) Kandungan vitamin C pada kentang dapat mencukupi setengah kebutuhan per hari bagi orang dewasa dan lebih tinggi dibandingkan dengan padi dan gandum. Perbandingan protein dan karbohidrat yang terdapat di dalam ubi kentang lebih tinggi daripada biji serealia dan ubi lainnya. Hal ini menunjukkan bahwa kentang memiliki potensi yang baik untuk mendukung program diversifikasi pangan dalam rangka mewujudkan ketahanan pangan berkelanjutan.
Produktivitas tanaman kentang di Indonesia relatif masih rendah dan tidak stabil, yaitu berkisar antara 15 sampai 16 ton ha-1 (BPS 2013). Hasil rata-rata tersebut masih jauh lebih rendah daripada hasil rata-rata negara maju seperti Amerika Serikat, negara-negara Eropa Barat dan negara-negara Oseania yang mencapai 25 ton ha-1. Hasil kentang maksimum di Australia dan California, Amerika serikat, lebih dari 50 ton ha-1 dengan umur panen 120 hari dan kultivar yang ditanam adalah Delaware, Kennebec dan Atlantic (Rukmana 2007). Indonesia masih mengimpor kentang untuk memenuhi kebutuhan bibit, benih dan bahan pangan terutama untuk industri pengolahan. Kebutuhan industri makanan ringan diperkirakan tidak kurang dari 2 000 ton setiap bulannya, namun yang tersedia hanya 150 sampai 200 ton. Kebutuhan benih kentang nasional pada tahun 2005 tidak kurang dari 14 894 ton dan yang terpenuhi hanya 5 508 ton (Setiadi 2009).
Rendahnya produksi Indonesia disebabkan belum banyaknya petani penghasil bibit kentang bermutu, sehingga permintaan bibit kentang tidak dapat dipenuhi. Upaya yang dapat dilakukan untuk mengatasi kendala tersebut adalah dengan memanfaatkan bioteknologi dengan cara pembiakan mikro bibit kentang. Melalui perbanyakan mikro dapat dihasilkan tanaman dalam jumlah besar dan waktu yang singkat serta bebas dari penyakit sistemik (Gunawan 1992).
Masa aklimatisasi merupakan masa kritis bagi kelangsungan hidup tanaman hasil kultur jaringan. Aklimatisasi adalah satu tahapan dalam kultur jaringan yang merupakan proses adaptasi planlet pada kondisi aseptik dan heterotrof lalu dipindah ke kondisi yang tidak aseptik dan harus hidup dalam kondisi autotrof. Tanaman kultur jaringan hampir tidak pernah berfotosistesis, lapisan kutikula tidak berkembang, jaringan pembuluh antara akar dan pucuk tidak berkembang serta stomata yang belum berfungsi dengan baik. Kondisi tersebut menyebabkan tanaman belum dapat bertahan terhadap proses transpirasi, belum dapat berfotosintesis serta tidak tahan terhadap serangan mikroorganisme.
2
hal ini sesuai dengan rekomendasi dari Murashige dan Skoog (1962) . Penambahan gula ke dalam media kultur juga membantu pemeliharaan osmotik sel dan konservasi air (Hazarika 2003). Gula pada media tanam in vitro
meningkatkan pati dan cadangan makanan pada perbanyakan tanaman dan dapat mendukung aklimatisasi serta mempercepat adaptasi fisiologis (Pospı´sˇilova´ et al. 1999). Meskipun demikian , penambahan gula ke dalam media kultur terbukti berkorelasi negatif terhadap pertumbuhan akar tanaman karena tidak dapat berkembang dengan baik (Kwa et al. 1995) dan hampir tidak melakukan fotosintesis (Hdider dan Desjardins 1994).
Hasil penelitian pada plantlet Limonium latifolium menunjukkan bahwa perbanyakan in vitro tanpa menggunakan gula menghasilkan berat kering yang sama, konsentrasi klorofil yang lebih tinggi, laju fotosintesis yang lebih tinggi, sistem perakaran berkembang lebih baik, tunas yang lebih baik dan kontaminasi yang lebih sedikit bila dibandingkan dengan perbanyakan menggunakan gula (Xiao dan Kozai 2006). Penelitian ini dilakukan pula pada tanaman kentang
‘Granola’. Menurut Purwito dan Wattimena (2008) kultivar Granola banyak ditanam di Indonesia karena memiliki keunggulan seperti berumur pendek, daya adaptasi luas, hasil tinggi, bentuk umbi yang bagus dan relatif tahan penyakit layu bakteri. Kelemahan kultivar ini adalah mempunyai kadar air tinggi dan tidak cocok untuk kentang olahan.
Penelitian ini bertujuan mempelajari pertumbuhan dan perbanyakan tanaman kentang in vitro dengan sistem fotoautotrofik, yaitu dengan mengurangi konsentrasi gula pada media dan memberikan ventilasi pada botol kultur. Penambahan gula pada media dilakukan hingga konsentrasi tinggi pada penelitian ini karena pergerakan udara dari luar ke dalam botol kultur masih dalam jumlah yang terbatas sehingga mempengaruhi karbon dioksida (CO2) yang tersedia untuk proses fotosintesis, hal ini disebabkan oleh ventilasi yang memungkinkan adanya pergerakan udara pada botol kultur ditutup menggunakan paper filter dan
micropore. Penambahan paper filter dan micropore dimaksudkan untuk mengurangi persentase kontaminasi.
Menurut Gunawan (1992) kultur meristem adalah kultur dengan menggunakan eksplan berupa jaringan-jaringan meristematik. Eksplan yang dapat digunakan pada kultur meristem adalah meristem pucuk apikal atau meristem tunas aksilar. Perkembangan pada kultur meristem diarahkan untuk mendapatkan tanaman sempurna dari organ tersebut serta memperbanyaknya. Selain untuk perbanyakan, kultur meristem juga digunakan untuk mengeliminasi virus dari bahan tanaman. Tunas yang berasal dari pucuk apikal digunakan untuk produksi bibit dalam skala besar, sedangkan tunas yang berasal dari tunas aksilar digunakan untuk bahan perbanyakan pada kultur selanjutnya. Penelitian ini menggunakan dua jenis sumber eksplan, yaitu buku tunggal dan pucuk dengan tujuan mengetahui sumber eksplan yang tepat untuk produksi bibit kentang dengan teknik fotoautotrofik.
3
Tujuan Penelitian
Mempelajari respons pertumbuhan buku tunggal dan pucuk kentang
‘Granola’ yang dikulturkan secara in vitro dengan sistem fotoautotrofik untuk menyediakan bibit kentang yang unggul dan bermutu.
Hipotesis Penelitian
1. Eksplan kentang ‘Granola’ dapat tumbuh dan berkembang pada media tanam dengan pengurangan konsentrasi gula dan planlet yang dihasilkan memiliki kemampuan hidup sama atau lebih tinggi dibandingkan dengan eksplan pada media dengan konsentrasi gula 30 gL-1.
2. Pemberian ventilasi pada botol kultur meningkatkan kemampuan tumbuh eksplan dibandingkan eksplan media tanpa ventilasi.
3. Terdapat interaksi antara konsentrasi gula dengan ventilasi pada ruang tumbuh terhadap kemampuan tumbuh eksplan kentang.
TINJAUAN PUSTAKA
Tanaman Kentang
Tanaman kentang (Solanum tuberosum L.) merupakan tanaman semusim yang berbentuk semak, termasuk Divisi Spermatophyta, Subdivisi Angiospermae, Kelas Dicotyledonae, Ordo Tubiflorae, Famili Solanaceae, Genus Solanum dan Spesies Solanum tuberosum L. (Beukema 1977). Tanaman kentang berasal dari Amerika Selatan (Peru, Chili, Bolivia, dan Argentina) serta beberapa daerah Amerika Tengah. Penyebaran kentang ke Asia (India, Cina, dan Jepang), sebagian ke Afrika, dan kepulauan Hindia Barat dilakukan oleh orang-orang Inggris pada akhir abad ke-17 dan di daerah-daerah tersebut kentang ditanam secara luas pada pertengahan abad ke-18 (Hawkes 1992).
Metode perbanyakan tanaman secara in vitro sudah sangat berkembang dan digunakan dalam berbagai penelitian mutakhir maupun secara komersial, di bidang hortikultura, agrikultura maupun kehutanan. Bila dibandingkan dengan pengadaan bibit kentang secara teknik konvensional yang hasilnya kadang tidak stabil dan tidak seragam, metode perbanyakan tanaman secara in vitro akan menghasilkan bibit dalam jumlah yang banyak dengan kualitas seragam, dalam waktu yang singkat serta bebas penyakit (Gunawan 1992).
4
bentuk umbi yang bagus dan agak tahan penyakit layu bakteri, meskipun kelemahannya mempunyai kadar air tinggi dan tidak cocok untuk kentang olahan.
Perbanyakan Tanaman dengan Sistem Fotoautotrofik
Menurut Kubota (2002) terdapat dua metode perbanyakan in vitro, yaitu metode fotomiksotrofik dan fotoautotrofik. Metode kultur jaringan konvensional yang umum digunakan saat ini menggunakan gula sebagai sumber energi bagi tanaman, sehingga disebut juga sebagai mikropropagasi fotomiksotrofik. Adanya gula dalam wadah kultur, didukung dengan kondisi dalam wadah yang sangat lembab dan tertutup, menyebabkan organisme kontaminan mudah tumbuh di dalam wadah. Planlet yang dihasilkan juga memiliki daya adaptasi yang rendah karena tanaman tidak berfotosintesis sebagaimana yang terjadi di lapangan. Metode mikropropagasi fotoautotrofik telah dikembangkan untuk mengatasi kendala daya adaptasi planlet yang rendah saat aklimatisasi. Metode ini menggunakan gula dengan konsentrasi lebih rendah sebagai sumber energi bagi eksplan dan eksplan diinduksi agar mampu berfotosintesis di dalam kondisi semi terbuka. Kondisi ini lebih mirip dengan kondisi di lapangan, sehingga eksplan akan memiliki daya adaptasi yang lebih tinggi ketika aklimatisasi. Rendahnya konsentrasi gula juga dapat menurunkan pertumbuhan organisme kontaminan dalam wadah, sehingga kematian eksplan akibat serangan organisme kontaminan juga dapat ditekan.
Udara di dalam sistem mikropropagasi fotomiksotrofik bersirkulasi dalam keadaan tertutup dan memiliki kandungan CO2 (karbon dioksida) yang rendah, sehingga proses fotosintesis eksplan terhambat (Kozai et al. 2005). Berbeda dengan sistem mikropropagasi fotomiksotrofik, di dalam mikropropagasi fotoautotrofik aerasi diatur secara kontinyu melalui sistem ventilasi berfilter dan diperkaya dengan CO2. Peningkatan konsentrasi CO2 dimaksudkan untuk mengatasi pembatasan proses fotosintesis di dalam sistem mikropropagasi fotomiksotrofik.
5
Kondisi dalam wadah kultur dikendalikan untuk mendukung fotosintesis tanaman. Kondisi dalam wadah kultur dalam mikropropagasi fotoautotrofik diatur menggunakan pompa udara agar memiliki konsentrasi CO2 yang tinggi, kelembaban udara yang lebih rendah, dan tingkat pertukaran udara yang lebih tinggi (Kozai et al. 2005). Komposisi udara juga disesuaikan berdasarkan umur eksplan. Kondisi seperti ini lebih mirip dengan kondisi sebenarnya di lapangan, sehingga kemampuan adaptasi eksplan menjadi tinggi sehingga sebagian besar eksplan dapat bertahan hidup ketika aklimatisasi.
Mikropropagasi fotoautotrofik memiliki kelebihan dibanding kultur jaringan konvensional, baik dari aspek biologis maupun teknis. Mikropropagasi fotoautotrofik dari aspek biologis, memiliki keunggulan seperti: 1) peningkatan pertumbuhan dan fotosintesis 2) tingkat keberhasilan yang tinggi 3) mengurangi terjadinya keragaman morfologi planlet dan 4) penurunan tingkat kematian akibat kontaminasi (Kubota 2002).
Perbanyakan fotoautotrofik juga memiliki keunggulan dari segi biaya. Biaya perbanyakan per eksplan dalam mikropropagasi fotoautotrofik pada tanaman China fir dan calla lily lebih tinggi dibandingkan dengan metode kultur jaringan konvensional, namun tingkat keberhasilannya yang tinggi membuat metode ini lebih unggul secara ekonomis (Kozai et al. 2005).
METODE PENELITIAN
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Kultur Jaringan 2, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Analisis morfologi stomata di Laboratorium Mikro Teknik Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilakukan dari bulan November 2014 hingga April 2015.
Bahan dan Alat
Bahan tanaman (eksplan) yang digunakan adalah buku tunggal dan pucuk dari planlet kentang ‘Granola’ berumur 4 minggu yang dikulturkan dalam medium Murashige & Skoog (MS) dengan konsentrasi hara makro (Larutan stok A, B, C dan D) dua kali dari konsentrasi yang seharusnya. Bahan yang digunakan adalah
paper filter dan micropore 3M sebagai ventilator, kalsium pantotenat (CaP) serta HCl dan KOH sebagai pengatur pH. Media yang digunakan adalah media dasar MS. Media yang digunakan adalah media dasar MS (Murashige & Skoog). Bahan yang digunakan pada tahap ex vitro adalah media tanam yang mengandung campuran sekam dan kompos dengan perbandingan 1:1 (v/v) serta Agrept (bahan aktif 20% streptomisin sulfat) dan Dithane M-45 (bahan aktif mancozep 80%)
6
petri, bunsen, pinset, gunting, pipet, hand sprayer dan rak kultur yang dilengkapi dengan lampu 120.7 Wm-2. Alat yang digunakan pada tahap ex vitro terdiri atas
tray sebagai wadah tanam dan autoklaf untuk sterilisasi media tanam.
Metode Percobaan
Percobaan dalam penelitian ini terdiri atas 2 percobaan terpisah, yaitu percobaan dengan menggunakan bahan tanam buku tunggal dan percobaan menggunakan bahan tanam pucuk. Masing-masing percobaan ini disusun dengan menggunakan rancangan kelompok lengkap teracak (RKLT) dengan dua faktor. Faktor pertama adalah konsentrasi gula terdiri atas 5 taraf perlakuan yaitu 5, 10, 15, 20 dan 25gL-1. Faktor ke dua adalah ventilasi dengan 2 taraf yaitu 1 lubang ventilasi dan 2 lubang ventilasi. Perlakuan 30 gL-1 gula tanpa ventilasi merupakan kontrol. Penanaman eksplan terdiri atas 10 kombinasi perlakuan. Percobaan menggunakan bahan tanam buku tunggal dengan sepuluh ulangan, sedangkan percobaan menggunakan bahan tanam pucuk dengan tiga ulangan. Jumlah satuan percobaan dengan bahan tanam buku tunggal adalah 100 satuan percobaan dan jumlah satuan percobaan dengan bahan tanam pucuk adalah 30 satuan percobaan. Setiap satuan percobaan terdiri atas 5 eksplan sebagai satuan amatan.
Perangkat lunak yang digunakan untuk analisis data adalah Microsoft Excel 2010 untuk rekapitulasi data dan seleksi indeks; SAS 9.1.3 untuk uji F dan uji lanjut. Model linier yang digunakan seperti yang dicontohkan oleh Mattjik dan Sumertajaya (2006) sebagai berikut:
Yijk = μ + αi+ βj+ (αβ)ij+ ρk+ εijk Keterangan :
Yijk = Nilai pengamatan pada perlakuan konsentrasi gula ke-i, ventilasi ke-j dan kelompok ke-k
µ = Rataan umum
αi = Pengaruh perlakuan konsentrasi gula ke-i (i= 1, 2, 3, 4, 5)
βj = Pengaruh perlakuan ventilasi ke-j (j= 1,2)
ρk = Pengaruh ulangan ke-k (k=1, 2, 3,..,10)
(αβ)ij = Pengaruh interaksi perlakuan konsentrasi gula ke-i dan perlakuan ventilasi ke-j
εijk = Pengaruh galat percobaan yang menyebar normal
Prosedur Percobaan
Persiapan Bahan Tanam
Bahan tanaman (eksplan) yang digunakan adalah planlet kentang ‘Granola’ yang diambil bagian buku tunggal dan pucuk berumur 4 minggu yang diperbanyak menggunakan media MS dengan penambahan kalsium pantotenat (CaP) sebanyak 4 mgL-1 sebelum penelitian dilaksanakan.
Pembuatan Larutan Stok dan Media
7
10, 15, 20 dan 25 gL-1 serta kalsium pantotenat (CaP) sebanyak 4 mgL-1. Larutan ditambahkan akuades dan ditera pH nya menggunakan pH meter mencapai 6.0 dengan menambahkan HCl 1 M atau KOH 1 M. Media yang telah ditera ditambahkan agar dan dipanaskan hingga mendidih. Media dimasukkan ke dalam botol kultur.
Sterilisasi Alat dan Bahan
Sterilisasi media dilakukan dengan menggunakan autoklaf dengan suhu tinggi yaitu 121 oC, tekanan 17.5 psi selama 20 menit (Gunawan 1992).
Micropore 3M, paper filter dan plastik yang telah diberi lubang ventilasi sesuai perlakuan diletakkan dalam botol kemudian ditutup menggunakan plastik dan disterilisasi menggunakan autoklaf selama 20 menit. Sterilisasi LAFC dilakukan dengan cara menyemprotkan alkohol 70%.
Persiapan Ruang Tanam
Persiapan ruang tanam dilakukan dengan menyalakan blower pada LAFC
terlebih dahulu. LAFC disemprot menggunakan alkohol 70 %. Alat-alat tanam disemprot alkohol 70 % kemudian dimasukkan ke dalam LAFC. Alat tanam seperti gunting dan pinset dipanaskan terlebih dahulu menggunakan bunsen setiap kali digunakan untuk menghindari kontaminasi.
Penanaman Eksplan
Penanaman eksplan dalam botol sebanyak 5 eksplan buku tunggal (percobaan 1) dan 5 eksplan pucuk (percobaan 2) untuk setiap ulangan dalam perlakuan. Botol kultur ditutup menggunakan paper filter kemudian dilapisi dengan plastik yang telah diberi ventilasi sesuai perlakuan. Lubang ventilasi berdiameter 7 mm dan ditutup dengan menggunakan micropore berukuran 0.2 µm (Gambar 1). Botol disimpan di ruang kultur.
Gambar 1 Metode penanaman eksplan
Inkubasi Kultur
8
serta kelembaban ruang kultur. Rak kultur yang telah dilengkapi dengan lampu dan termometer kemudian dialasi dengan kertas putih.
Uji Morfologi Stomata
Bagian tunas yang diuji morfologi adalah daun pada buku pertama untuk setiap pengujian dengan pengambilan sampel pada tahap in vitro dalam kondisi penyinaran. Percobaan ini terdiri atas analisis stomata dan kloroplas daun tanaman kentang, masing-masing perlakuan diambil 3 sampel.
Analisis stomata dan kloroplas dimulai dengan mengambil daun bagian epidermis bawah tanaman dan meletakkannya pada selotip. Tahap selanjutnya dilakukan pengerokan pada bagian atas daun menggunakan silet sampai hanya tersisa lapisan tipis di bawah daun. Tahap terakhir adalah meletakkan kaca preparat di atas meja mikroskop dan melakukan pengaturan fokus lensa sehingga stomata dan kloroplas dapat terlihat jelas untuk dilakukan perhitungan. Dokumentasi dibuat di bawah mikroskop dengan perbesaran 10 x 40.
Aklimatisasi
Tahap ex vitro atau aklimatisasi dilakukan pada 6 minggu setelah kultur in vitro. Media aklimatisasi menggunakan campuran sekam dan kompos dengan perbandingan 1:1 (v/v) serta menggunakan wadah tray (2x2 cm). Campuran media disterilisasi terlebih dahulu untuk mematikan cendawan yang dapat menyebabkan kematian saat adaptasi plantlet. Pengelompokan plantlet pada tahap aklimatisasi didasarkan pada kombinasi perlakuan saat planlet masih berada dalam kultur in vitro. Terdapat tiga ulangan yang diaklimatisasi untuk setiap perlakuan pada percobaan 1 dan dua ulangan pada percobaan 2. Media yang sudah diautoklaf dimasukkan ke dalam tray. Bibit dikeluarkan dari botol menggunakan pinset satu persatu lalu dicuci hingga bersih dari media agar dengan air steril. Akar-akar yang terlalu panjang dipotong dengan gunting kemudian direndam dengan larutan streptomosin sulfat 20% dan mancozep 80%. Bibit ditanam pada
tray yang sudah diberikan media dan diletakkan pada rak kultur yang dilengkapi dengan lampu 120.7 Wm-2. Penyiraman dilakukan 2-3 kali sehari dengan menggunakan air steril.
Pengamatan
Pengamatan dilakukan selama 6 minggu pada tahap in vitro dan 1 minggu pada tahap ex vitro. Peubah yang diamati pada tahap in vitro antara lain:
Jumlah Buku
Jumlah tunas buku yang terbentuk dihitung saat eksplan berumur 1-6 minggu setelah tanam (MST). Jumlah buku diamati untuk masing-masing eksplan pada setiap ulangan dalam perlakuan.
Waktu Munculnya Akar
9
Jumlah Daun
Jumlah daun dihitung setiap minggu mulai 1-6 MST. Jumlah daun yang diamati merupakan daun yang telah membuka penuh untuk masing-masing eksplan pada setiap ulangan dalam perlakuan.
Persentase Eksplan Hidup
Persentase eksplan hidup diamati setiap hari selama 6 minggu untuk masing-masing ulangan pada setiap perlakuan.
Persentase Kontaminasi
Persentase kontaminasi diamati setiap hari selama 6 minggu untuk masing-masing ulangan pada setiap perlakuan.
Jumlah dan Diameter Stomata
Jumlah stomata diamati sebelum tanaman diaklimatisasi dengan menggunakan mikroskop. Pengamatan stomata menggunakan daun pada buku pertama untuk setiap perlakuan sebanyak tiga ulangan. Jumlah stomata diamati melalui tiga bidang pandang dengan perbesaran 10 × 40. Diameter stomata diukur dari sisi terlebar dengan jumlah sebanyak tiga stomata untuk tiga ulangan pada setiap perlakuan.
Kerapatan Stomata
Kerapatan stomata diukur dengan rumus : Kerapatan = Jumlah Stomata
Luas Bidang pandang Kerapatan = Jumlah Stomata
0.19625 mm2
Jumlah Kloroplas
Jumlah kloroplas diamati sebelum tanaman diaklimatisasi dengan menggunakan mikroskop. Jumlah kloroplas dihitung dari tiga stomata untuk tiga ulangan pada setiap perlakuan. Pengamatan jumlah kloroplas menggunakan daun yang digunakan untuk pengamatan stomata, yaitu daun pada buku pertama untuk setiap perlakuan sebanyak tiga ulangan.
Peubah yang diamati pada tahap ex vitro antara lain:
Jumlah Daun dan Buku
Jumlah daun dan buku yang terbentuk dihitung saat 0, 5 dan 7 hari setelah aklimatisasi (HSA). Jumlah buku diamati untuk masing-masing planlet pada setiap ulangan dalam perlakuan.
Persentase Planlet Hidup
10
HASIL DAN PEMBAHASAN
Kondisi Umum
Pertumbuhan tanaman selama proses pengkulturan berlangsung baik. Ruang kultur dilengkapi dengan termometer pembaca suhu kemudian suhu dicatat pada pukul 08.00, 12.00 dan 16.00 WIB (Lampiran 1). Pembentukan daun dan buku pada percobaan ini berkolerasi positif dengan konsentrasi gula yang diberikan. Perlakuan konsentrasi gula menyebabkan rendahnya laju pertumbuhan akar pada tunas, bahkan tidak terbentuk akar pada beberapa perlakuan di percobaan 2.
Secara umum pertumbuhan tanaman berlangsung baik walaupun terjadi kontaminasi pada media dengan perlakuan konsentrasi gula 20 gL-1 dengan ventilasi 1 serta 10 gL-1 dengan ventilasi 2 masing-masing pada 2 MST dan 3 MST (Percobaan 1). Pada 4 MST terjadi penyusutan media yang menyebabkan kekeringan pada beberapa tanaman di dalam botol kultur (Gambar 2). Hal ini menyebabkan dilakukan pemindahan media pada perlakuan-perlakuan yang mengalami susut media. Kondisi ini diperkirakan karena air pada media menguap akibat adanya ventilasi yang disinari langsung oleh cahaya lampu yang terjadi setelah 4 MST.
Percobaan 1. Optimasi Produksi Bibit Kentang (Solanum Tuberosum)
‘Granola’ dengan Teknik Fotoautotrofik In Vitro dengan
Eksplan Buku Tunggal
Pertumbuhan Eksplan In Vitro
Percobaan ini menggunakan bahan tanam buku tunggal tanaman kentang
‘Granola’ berumur 4 minggu. Eksplan yang digunakan adalah buku tunggal yang terletak 1-3 buku dibawah pucuk (Gambar 3).
11
Gambar 3 Keragaan eksplan kentang pada 0 MST
Konsentrasi gula menunjukkan pengaruh yang sangat nyata terhadap variabel jumlah daun dan jumlah buku, namun tidak menunjukkan pengaruh terhadap persentase kontaminasi dan eksplan hidup (Tabel 1). Konsentrasi gula rendah pada media menurunkan jumlah daun dan buku yang terbentuk pada tunas dan tidak mempengaruhi persentase kontaminasi dan eksplan hidup. Eksplan yang ditumbuhkan pada media dengan konsentrasi gula 25 gL-1 memberikan respons pertumbuhan yang tinggi dilihat dari jumlah daun dan buku.
Tabel 1 Pengaruh konsentrasi gula terhadap pertumbuhan eksplan buku tunggal kentang ‘Granola’ secara fotoautotrofik pada 6 MST
Konsentrasi
12
Tabel 2 Pengaruh ventilasi terhadap pertumbuhan eksplan buku tunggal kentang
‘Granola’ secara fotoautotrofik pada 6 MST Jumlah
Tabel 3 Perbandingan nilai tengah perlakuan konsentrasi gula dengan kontrol pada peubah jumlah daun dan buku
Konsentrasi gula (gL-1) Jumlah daun Jumlah buku
5 -5.36 ** -3.32 **
Pembentukan daun dan buku pada media dengan konsentrasi gula 5 dan 10 gL-1 lebih sedikit bila dibandingkan dengan kontrol (Tabel 3). Respons jumlah daun dan buku yang dibentuk oleh tunas lebih baik pada mikropropagasi fotoautotrofik dibandingkan dengan mikropropagasi konvensional hanya pada perlakuan gula tinggi, yaitu 25 gL-1. Pembentukan daun dan buku pada tunas yang ditumbuhkan pada media dengan konsentrasi gula 15 dan 20 gL-1 tidak berbeda nyata dengan kontrol. Penambahan ventilasi pada botol kultur nyata menyebabkan jumlah daun dan buku yang dibentuk oleh tunas lebih sedikit dibandingkan dengan kontrol (Tabel 4).
Tabel 4 Perbandingan nilai tengah perlakuan ventilasi dengan kontrol pada peubah jumlah daun dan buku
Ventilasi Jumlah daun Jumlah buku
13
Tunas mulai membentuk akar pada 2-3 MST (Tabel 5). Hasil rataan waktu munculnya akar tersebut mengindikasikan bahwa pemberian konsentrasi gula dan jumlah ventilasi yang berbeda tidak mempengaruhi waktu munculnya akar dalam percobaan ini.
Tabel 5 Waktu munculnya akar pada tanaman kentang ‘Granola’ Jumlah
ventilasi
Konsentrasi gula (gL-1)
5 10 15 20 25 Kontrol
1 3 MST 2 MST 3 MST 3 MST 2 MST
2 MST
2 3 MST 3 MST 3 MST 3 MST 3 MST
Keterangan: MST: Minggu Setelah Tanam
Morfologi Stomata
Konsentrasi gula dan jumlah ventilasi berpengaruh sangat nyata terhadap peningkatan jumlah stomata, kerapatan stomata dan jumlah kloroplas pada daun tunas serta menyebabkan penyempitan diameter stomata (Tabel 6).
V
14
Tabel 6 Rekapitulasi hasil uji F pengaruh kombinasi konsentrasi gula dengan jumlah ventilasi terhadap morfologi stomata tanaman kentang ‘Granola’
Peubah Gula Ventilasi Ulangan Interaksi KK(%)
Tabel 7 Perbandingan nilai tengah perlakuan konsentrasi gula dengan kontrol pada morfologi stomata dan penambahan ventilasi nyata menyebabkan kerapatan stomata dan jumlah kloroplas yang lebih tinggi serta diameter stomata yang lebih kecil dibandingkandengan kontrol. Semakin banyak pengurangan konsentrasi gula dan penambahan ventilasi, semakin besar perbedaan nilai tengah perlakuan dengan kontrol.
15
ventilasi memiliki stomata yang lebih besar. Ukuran stomata yang besar menyebabkan jumlah stomata lebih sedikit tiap luas bidang pandang. Adanya stomata pada daun memungkinkan terjadinnya pertukaran gas. Jumlah stomata yang sedikit pada tanaman dapat menjadi indikator bahwa tanaman mengalami laju fotosintesis yang rendah. Pada mikropropagasi in vitro tanaman hampir tidak melakukan proses fotosintesis karena gula sebagai sumber energi utama bagi eksplan telah disediakan (Kubota 2002). Pengurangan konsentrasi gula dan penambahan ventilasi menyebabkan daun pada tunas membentuk kerapatan stomata yang lebih tinggi (Tabel 9).
Tabel 9 Pengaruh interaksi gula dan ventilasi terhadap kerapatan stomata (mm-2) kentang ‘Granola’
Jumlah ventilasi
Konsentrasi gula (gL-1)
5 10 15 20 25
1 188.5 a 181.7 a 173.3 b 169.9 b 144.4 b
2 193.6 a 188.5 a 190.2 a 190.2 a 183.4 a
Keterangan: Angka-angka yang diikuti huruf sama pada kolom dan baris yang sama tidak berbeda nyata pada uji DMRT taraf α 5%
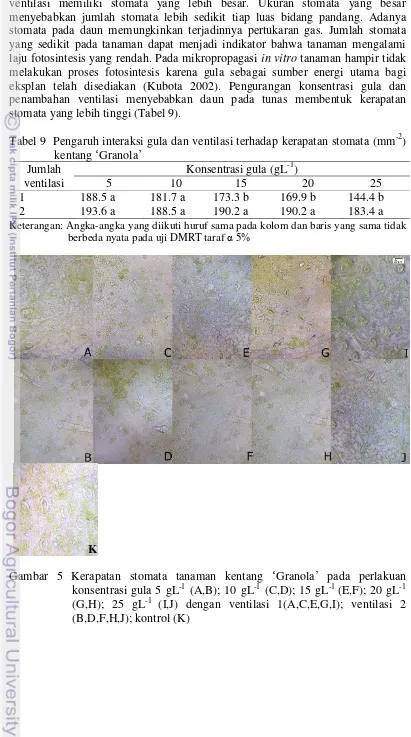
Gambar 5 Kerapatan stomata tanaman kentang ‘Granola’ pada perlakuan konsentrasi gula 5 gL-1 (A,B); 10 gL-1 (C,D); 15 gL-1 (E,F); 20 gL-1 (G,H); 25 gL-1 (I,J) dengan ventilasi 1(A,C,E,G,I); ventilasi 2 (B,D,F,H,J); kontrol (K)
16
Daun dari tunas yang ditumbuhkan pada media dengan perlakuan 5 gL-1 dengan ventilasi 1 (Gambar 5A) memiliki kerapatan stomata tertinggi dan tidak berbeda dengan perlakuan konsentrasi gula 5 gL-1 dengan ventilasi 2 (B), 10 gL-1 dengan ventilasi 1 (C), 10 gL-1 dengan ventilasi 2 (D), 15 gL-1 dengan ventilasi 2 (F) serta 20 gL-1 dengan ventilasi 2 (H). Media dengan perlakuan ventilasi 1 menyebabkan daun menghasilkan jumlah stomata yang tinggi jika dikombinasikan dengan gula yang rendah (5 gL-1 dengan ventilasi 1 serta gula 10 gL-1 dengan ventilasi 1). Perlakuan ventilasi 2 memungkinkan terjadinya pertukaran udara yang lebih baik. Kombinasi ventilasi 2 dengan konsentrasi gula rendah meningkatkan pembentukan stomata daun.
Keterangan: Angka-angka yang diikuti huruf sama pada kolom dan baris yang sama tidak berbeda nyata pada uji DMRT taraf α 5%
17
Organ utama tumbuhan tempat berlangsungnya fotosintesis adalah daun. Tumbuhan menangkap cahaya menggunakan pigmen yang disebut klorofil yang memberi warna hijau pada tumbuhan. Klorofil terdapat dalam organel yang disebut kloroplas, dimana fotosintesis berlangsung tepatnya pada bagian stroma. Permukaan daun dilapisi oleh kutikula lilin yang tahan air yang melindungi daun dari penguapan yang berlebihan dan mengurangi penyerapan sinar biru untuk mengurangi pemanasan. Lapisan epidermis yang tembus pandang memungkinkan cahaya untuk masuk melalui sel mesofil palisade tempat sebagian besar fotosintesis berlangsung (Campbell 2004). Kloroplas pada stomata mengindikasikan bahwa terjadi penangkapan cahaya yang akan digunakan untuk proses fotosintesis yang akan menyebabkan lapisan kutikula lilin pada daun dapat berfungsi dengan baik dan akan melindungi daun dari penguapan yang berlebihan sehingga mampu bertahan pada saat aklimatisasi. Tabel 11 menunjukkan bahwa semua pengurangan konsentrasi gula dengan penambahan ventilasi 2 menyebabkan jumlah kloroplas pada stomata lebih tinggi dibandingkan pengurangan konsentrasi gula dengan ventilasi 1.
Tabel 11 Pengaruh interaksi gula dan ventilasi terhadap kloroplas kentang
‘Granola’ Jumlah
ventilasi
Konsentrasi gula (gL-1)
5 10 15 20 25
1 23.3 22.0 21.3 20.7 19.3
2 25.0 24.0 23.3 22.0 21.3
Percobaan II. Optimasi Produksi Bibit Kentang (Solanum Tuberosum)
‘Granola’ dengan Teknik Fotoautotrofik In Vitro dengan
Eksplan Pucuk
Pertumbuhan Eksplan In Vitro
Percobaan ini menggunakan eksplan pucuk (Gambar 7) planlet kentang
‘Granola’ berumur 4 minggu.
18
Gambar 7 Keragaan eksplan kentang pada 0 MST
Eksplan yang ditumbuhkan pada media dengan konsentrasi gula 25 gL-1 memberikan respons pertumbuhsn yang lebih tinggi dibandingkan pada perlakuan gula 5 gL-1, 10 gL-1, 15 gL-1 dan 20 gL-1 dilihat dari jumlah daun dan jumlah. Hal ini mengindikasikan bahwa pertumbuhan eksplan pada media dengan konsentrasi gula tinggi lebih baik dibandingkan pada konsentrasi gula rendah (Tabel 12).
Tabel 12 Pengaruh konsentrasi gula terhadap pertumbuhan eksplan pucuk kentang ‘Granola’ secara fotoautotrofik pada 6 MST
Konsentrasi gula (gL-1)
Jumlah daun (helai)
Jumlah buku (buku)
Persentase eksplan hidup
(%)
Persentase kontaminasi
(%)
5 3.38 d 1.43 c 95.50 0
10 3.80 cd 1.71 bc 97.22 0
15 4.73 b 2.26 b 82.77 0
20 4.31 bc 2.11 b 78.35 0
25 6.72 a 3.28 a 94.45 0
KK (%) 7.43 5.25 10.47 0
Keterangan: Angka-angka yang diikuti huruf sama pada kolom yang sama tidak berbeda nyata
pada uji DMRT taraf α 5%
19
Tabel 13 Pengaruh ventilasi terhadap pertumbuhan eksplan pucuk kentang
‘Granola’ secara fotoautotrofik pada 6 MST
Keterangan: Angka-angka yang diikuti huruf sama pada kolom dan baris yang sama tidak berbeda nyata pada uji DMRT taraf α 5%
Tabel 14 Perbandingan nilai tengah perlakuan konsentrasi gula dengan kontrol pada peubah jumlah daun dan buku
Perbandingan
Pembentukan daun dan buku pada media dengan pengurangan konsentrasi gulalebih sedikit bila dibandingkan dengan kontrol pada semua perlakuan (Tabel 14). Pada percobaan ini mikropropagasi konvensional membentuk jumlah daun dan buku yang lebih baik dibandingkan dengan mikropropagasi fotoautotrofik. Hal ini menunjukkan bahwa pertumbuhan eksplan lebih baik pada konsentrasi gula tinggi. Penambahan ventilasi pada botol kultur nyata menyebabkan penghambatan pembentukan jumlah daun dan buku yang dibentuk oleh tunas kentang (Tabel 15). Keragaan pertumbuhan tanaman kentang ‘Granola’ dapat disajikan pada Gambar 8.
Tabel 15 Perbandingan nilai tengah perlakuan ventilasi dengan kontrol pada peubah jumlah daun dan buku
Perbandingan ventilasi Jumlah daun Jumlah buku
20
Tabel 16 Waktu munculnya akar pada tunas kentang ‘Granola’ Jumlah
ventilasi
Konsentrasi gula (gL-1)
5 10 15 20 25 Kontrol
1 - - - 4 MST 4 MST
3 MST
2 - - 4 MST 4 MST 4 MST
Keterangan: - : tidak membentuk aka MST : Minggu Setelah Tanam
Tidak semua tunas mampu membentuk akar (Tabel 16). Tunas yang terbentuk pada media dengan konsentrasi gula rendah (5 dan 10 gL-1) tidak mampu membentuk akar selama 6 minggu berada di kondisi fotoautotrofik. Akar tunas muncul saat 2-3 MST pada kontrol sedangkan pada perlakuan konsentrasi gula 15 gL-1 dengan ventilasi 2, gula 20 gL-1 dan 25 gL-1 dengan kedua tipe ventilasi akar pada tunas muncul saat 4 MST. Hal ini mengindikasikan bahwa kondisi fotoautrofik yang diberikan pada percobaan ini justru menunda pembentukan akar dibandingkan dengan kontrol yang menggunakan gula 30 gL-1 tanpa ventilasi.
21
Morfologi Stomata
Tunas yang ditumbuhkan pada media dengan konsentrasi gula rendah meningkatkan kerapatan stomata dan jumlah kloroplas, serta menghasilkan stomata dengan diameter yang lebih kecil. Ventilasi pada botol kultur menyebabkan diameter stomata lebih kecil dan jumlah kloroplas pada daun meningkat namun tidak mempengaruhi kerapatan stomata (Tabel 17). Interaksi perlakuan konsentrasi gula dan jumlah ventilasi nyata meningkatkan kerapatan stomata dan jumlah kloroplas pada daun serta berpengaruh nyata terhadap menyempitnya diameter stomata.
Tabel 17 Rekapitulasi hasil uji F pengaruh kombinasi konsentrasi gula dengan jumlah ventilasi terhadap morfologi stomata tanaman kentang ‘Granola’
Peubah Gula Ventilasi Ulangan Interaksi KK(%)
Kerapatan
Tabel 18 Perbandingan nilai tengah perlakuan konsentrasi gula dengan kontrol pada morfologi stomata
22
Tabel 19 Perbandingan nilai tengah perlakuan ventilasi dengan kontrol pada morfologi stomata
Ventilasi Rata-rata kerapatan stomata
(mm-2)
Perbandingan kerapatan
stomata (mm-2)
Diameter stomata
(nm)
Rata-rata jumlah kloroplas
Perbandingan jumlah kloroplas
1 170.2 29.2** -19986.2** 22.4 5.4** 2 172.6 31.5** -21230.7** 25.7 8.6** KK (%) 2.5 3.5 2.5
Keterangan: tn : tidak berbeda nyata pada uji t-dunnet taraf α 5% * : berbeda nyata pada uji t-dunnet taraf α 5% ** : berbeda sangat nyata pada uji t-dunnet taraf α 1%
Perlakuan konsentrasi gula 5 gL-1 dengan ventilasi 1 (Gambar 9A) serta gula 5 gL-1 dengan ventilasi 2 (B) menyebabkan kerapatan stomata tertinggi pada daun dalam percobaan ini. Perlakuan konsentrasi gula 10 gL-1 dengan ventilasi 1 (C), gula 10 gL-1 dengan ventilasi 2 (D), gula 15 gL-1 dengan ventilasi 1 (E) serta gula 15 gL-1 dengan ventilasi 2 (F) tidak menyebabkan perbedaan kerapatan stomata pada daun. Perlakuan konsentrasi gula 25 gL-1 dengan ventilasi 2 (J) menyebabkan kerapatan terkecil pada daun dalam percobaan ini. Hal ini mengindikasikan bahwa rendahnya konsentrasi gula dan banyaknya jumlah ventilasi menyebabkan tingginya kerapatan stomata yang terbentuk pada daun (Tabel 20).
Gambar 9 Kerapatan stomata tanaman kentang ‘Granola’ pada perlakuan konsentrasi gula 5 gL-1 (A,B);10 gL-1 (C,D); 15 gL-1 (E,F); 20 gL-1 (G,H); 25 gL-1 (I,J) dengan ventilasi 1(A,C,E,G,I); ventilasi 2 (B,D,F,H,J); kontrol (K)
23
Tabel 20 Pengaruh interaksi gula dan ventilasi terhadap kerapatan stomata (mm-2) kentang ‘Granola’
Jumlah ventilasi
Konsentrasi gula (gL-1)
5 10 15 20 25
1 224.2 a 163.1 b 163.1 b 152.8 c 147.8 c
2 193.6 a 176.6 b 174.9 b 163.1 c 154.6 d
Keterangan: Angka-angka yang diikuti huruf sama pada kolom dan baris yang sama tidak berbeda nyata pada uji DMRT taraf α 5%
Gambar 10 Diameter stomata tanaman kentang ‘Granola’ dengan teknik fotoautotrofik pada perlakuan konsentrasi gula 5 gL-1 (A,B); 10 gL-1 (C,D); 15 gL-1 (E,F); 20 gL-1 (G,H); 25 gL-1 (I,J) dengan ventilasi 1(A,C,E,G,I); ventilasi 2 (B,D,F,H,J); kontrol (K)
Tabel 21 Pengaruh interaksi gula dan ventilasi terhadap diameter stomata (nm) kentang ‘Granola’
Jumlah ventilasi
Konsentrasi gula (gL-1)
5 10 15 20 25
1 20036.7 c 22568.7 c 23486.8 b 23572.8 b 22605.5 b 2 19821.8 d 20159.2 c 21982.3 b 22367.0 b 21717.8 b
Keterangan: Angka-angka yang diikuti huruf sama pada kolom dan baris yang sama tidak berbeda nyata pada uji DMRT taraf α 5%
Daun dari tunas pada perlakuan konsentrasi gula 5 gL-1 dengan ventilasi 2 (Gambar 10B) mempunyai diameter terkecil pada percobaan ini. Perlakuan konsentrasi gula 5 gL-1 dengan ventilasi 1(A), gula 10 gL-1 dengan ventilasi 1 (C) serta gula 10 gL-1 dengan ventilasi 2 (D) tidak menyebabkan perbedaan pada diameter stomata. Hal ini mengindikasikan bahwa sel penjaga pada stomata dengan pengurangan konsentrasi gula dan pemberian ventilasi nyata menghasilkan sel penjaga yang lebih baik (Tabel 21).
24
Tabel 22 Pengaruh interaksi gula dan ventilasi terhadap jumlah kloroplas kentang
‘Granola’
Keterangan: Angka-angka yang diikuti huruf sama pada kolom dan baris yang sama tidak berbeda nyata pada uji DMRT taraf α 5%
Aklimatisasi
Aklimatisasi mikropropagasi konvensional penelitian sebelumnya pada kentang dengan bahan tanam asal ditumbuhkan pada media MS dan penambahan CaP 2 mgL-1. Aklimatisasi dilakukan di baki plastik (35x25x15 cm) dengan media campuran tanah dan pupuk kandang steril dengan perbandingan 2:1 (v/v) menghasilkan panen stek pucuk 2-3 kali dengan interval 10-12 hari sekali dan didapatkan rata-rata jumlah stek tanaman induk-1 sebanyak 3-4 stek dengan persentase keberhasilan aklimatisasi 85-90 % (Karjadi dan Abuhaer 2011).
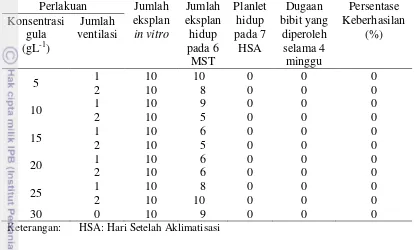
Tabel 23 Pengaruh konsentrasi gula dan ventilasi terhadap pertumbuhan kentang
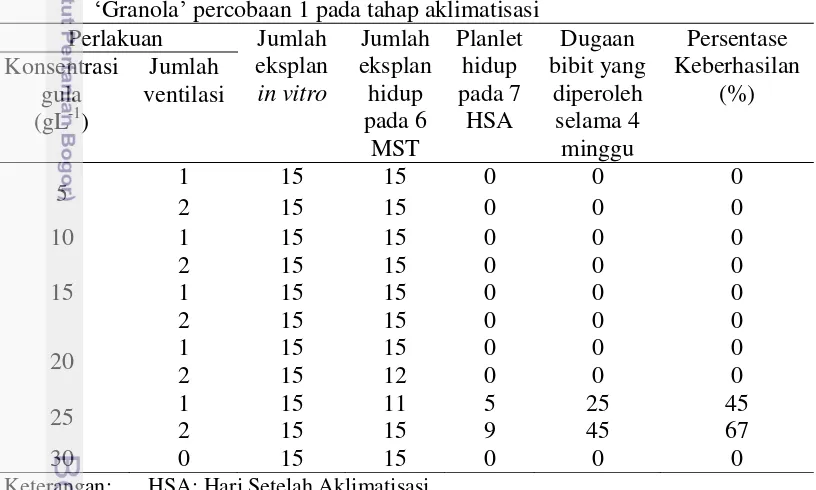
‘Granola’ percobaan 1 pada tahap aklimatisasi
Perlakuan Jumlah
Keterangan: HSA: Hari Setelah Aklimatisasi
25
tumbuh yang sangat rendah sehingga menyebabkan transpirasi berlebih yang dilakukan oleh tanaman dan berakhir pada kematian planlet kentang.
Tabel 24 Pengaruh konsentrasi gula dan ventilasi terhadap pertumbuhan kentang
‘Granola’ percobaan 2 pada tahap aklimatisasi
Perlakuan Jumlah
Keterangan: HSA: Hari Setelah Aklimatisasi
KESIMPULAN
Konsentrasi gula yang rendah pada media in vitro untuk perbanyakan bibit kentang menghambat pembentukan jumlah daun dan buku, meningkatkan kerapatan stomata dan jumlah kloroplas serta menyebabkan diameter stomata yang lebih kecil pada daun yang berasal dari eksplan buku tunggal maupun pucuk. Pada eksplan yang berasal dari buku tunggal, tunas yang terbentuk pada media dengan perlakuan konsentrasi gula 25 gL-1 menghasilkan jumlah daun dan buku yang lebih banyak dibandingkan dengan kontrol. Interaksi konsentrasi gula dengan ventilasi hanya nyata meningkatkan kerapatan stomata, jumlah kloroplas dan menyebabkan diameter stomata yang lebih kecil pada daun. Konsentrasi gula rendah dan pemberian ventilasi tidak mempengaruhi persentase eksplan hidup dan kontaminasi pada semua perlakuan. Akar muncul pada tunas saat 2-3 MST. Sebanyak 45% planlet yang ditumbuhkan pada media dengan perlakuan konsentrasi gula 25 gL-1 dengan ventilasi 1 serta 65% planlet pada gula 25 gL-1 dengan ventilasi 2 mampu bertahan pada tahap aklimatisasi.
26
produksi bibit kentang dengan teknik fotoautotrofik dibandingkan dengan eksplan dari pucuk.
DAFTAR PUSTAKA
[BPS] Badan Pusat Statistik. 2013. Luas Panen, Produksi dan Produktivitas Kentang. Jakarta (ID): BPS.
Beukema HP. 1977. Potato production. Wageningen (NED): International Agriculture Centre. Application in Agriculture. NewYork (USA): Academic Pr.
Gunawan LW. 1992. Teknik Kultur Jaringan Tumbuhan. Bogor (ID): IPB PAU Bioteknologi.
Handoko P dan Fajariyanti Y. 2008. Pengaruh 26groindu cahaya tampak terhadap laju fotosintesis tanaman air Hydrilla verticillata. Seminar Nasional X Pendidikan Biologi, FKIP, Universitas Nusantara PGRI Kediri ; 2006 Jul 21-22; Kediri, Indonesia. Kediri (ID): UNS Press. hlm 123.
Hazarika BN. 2003 Acclimatization of tissue-cultured plants. Curr Sci. 8(5): 1704–1712.
Hawkes JG. 1992. History of the potato. In: Harris PM (eds). The potato crop. The scientific basis for improvement. London (GB): Chapman and Hall,London.
Hardwood RR. 1991. A History Of Sustainable Agriculture. In Edwards CA, Edwards R, Lal P, Madden RH, Miller, House G(eds). Sustainable system. Ankeny (USA): Soil and Water Conservation Society.
Hdider C, Desjardins Y. 1994. Effects of sucrose on photosynthesis and phosphoenolpyruvate carboxylase activity of in vitro cultured strawberry plantlets. Plant Cell Tissue Organ Cult. 36(1): 27–33.
Karjadi AK, Abuhaer B. Produksi Benih Sumber Kentang Varietas Granola, Margahayu dan Kikondo. Bandung (ID): Balai Penelitian Tanaman Sayuran, Kementrian Pertanian.
Kozai T. 1992. Effect of the difference between photoperiod and darkperiod temperatures, and photosynthetic photon flux density on the shot length and growth of potato planlets in vitro. J Japan Soc Hort Sci. 61 (1): 93-98. Kilb B, Wietoska H, Godde D. 1996. Changes in the expression of photosynthetic
genes precede loss of photosynthetic activities and chlorophyll when gLucose is supplied to mature spinach leaves. Plant Sci. 115 (1): 225–235. Kubota C. 2002.Photoautotrophic Micropropagation: Importance of Controlled
Environment in Plat Tissue Culture.Combined Proceedings International Plant Propagators’ Society. 52. 609-613.
27
coronarium (Koenig) Desv under CO2 enrichment. J Exp Bot. 46 (1):1535– 1542.
Mattjik AA, Sumertajaya IM. 2006. Perancangan Percobaan dengan Aplikasi SAS dan Minitab. Bogor (ID): IPB Pr.
Murashige T dan Skoog F. 1962. A revised medium forrapid growth and bioassays with tobacco tissue. Physiol Plant. 15 (1): 473-497.
Pertawati. 2010. Pengaruh fotosintesis terhadap pertumbuhan tanaman kentang (Solanum tuberosum L.) dalam lingkungan fotoautotrof secara in vitro.
Jurnal Sains dan Teknologi Indonesia. 12(1): 31-37.
Pospı´sˇilova´ J, Ticha´ I, Kadlecˇek P, Haisel D, Plza´kova´ S ˇ. 1999.
Acclimatization of micropropagated plants to ex vitro conditions. Biol Plant. 42:481–497.
Purwito A, Wattimena GA. 2008. Kombinasi persilangan dan seleksi in vitro
untuk mendapatkan kultivar unggul kentang. Jurnal Ilmu Pertanian Indonesia. 13 (3):140-149.
Rukmana R. 2007. Budi daya dan Pasca Panen Tanaman Kentang.
Yogyakarta (ID): Kanisius.
Samadi B. 2007. Kentang dan Analisis Usaha Tani. Yogyakarta(ID): Kanisius Salisbury FB, Ross CW. 1995. Fisiologi Tumbuhan. Jilid 3. Lukman DR,
penerjemah. Bandung (ID): ITB.
Setiadi. 2009. Kentang: Budi daya dan Pasca Panen. Yogyakarta (ID): Kanisius. Sugiarto A. 2001. Uji kultivar hasil radiasi dan introduksi beberapa kultivar
kentang (Solanum tuberosum L.) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Wattimena GA. 2000. Pengembangan propagul kentang bermutu dan kultivar kentang unggul dalam mendukung peningkatan produksi kentang di Indonesia. Orasi Ilmiah Guru Besar Tetap Ilmu Hortikultura. Fakultas Pertanian Institut Pertanian Bogor. [Waktu dan tempat pertemuan tidak diketahui]. Bogor (ID): Institut Pertanian Bogor. hlm: 86.
28
L
AMPIRAN
Lampiran 1 Suhu ruang kultur selama inkubasi
Tanggal Suhu (
o C)
08.00 12.00 16.00
24/02/15 23 23 27
25/02/15 26 27 29
26/02/15 26 26 29
27/02/15 27 27 27
02/03/15 26 27 28
03/03/15 27 27 28
04/03/15 26 27 27
05/03/15 26 26 28
06/03/15 27 27 28
09/03/15 26 26 27
10/03/15 26 26 28
11/03/15 21 25 26
12/03/15 26 26 27
13/03/15 25 25 25
16/03/15 23 25 25
17/03/15 23 24 24
18/03/15 22 25 25
19/03/15 21 25 25
20/03/15 22 25 26
23/03/15 20 20 25
24/03/15 25 25 25
25/03/15 23 24 25
27/03/15 26 26 26
30/03/15 21 24 20
02/04/15 21 21 21
03/04/15 24 24 24
06/04/15 25 25 26
09/04/15 23 25 25
10/04/15 26 26 26
29