PENGEMBANGAN MUTAGENESIS SPESIES MIKROALGA
PENGHASIL BIOFUEL DENGAN METODE EMS
(ETIL METAN SULFONAT)
DINA AUGUSTINE
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pengembangan Mutagenesis Spesies Mikroalga Penghasil Biofuel Dengan Metode EMS (Etil Metan Sulfonat) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2015
Dina Augustine
RINGKASAN
DINA AUGUSTINE.Pengembangan Mutagenesis Spesies Mikroalga Penghasil Biofuel Dengan Metode EMS (Etil Metan Sulfonat). Dibimbing oleh MUJIZAT KAWAROE dan AGUS OMAN SUDRAJAT.
Kemampuan mikroalga untuk tumbuh dalam waktu yang cukup singkat dengan jumlah biomassa yang besar menjadi titik acuan untuk menghasilkan bahan bakar nabati dalam waktu yang cukup singkat juga. Sampai saat ini masih dibutuhkan jenis mikroalga yang mampu menghasilkan biomassa yang banyak dan kadar asam lemak yang tinggi sehingga mampu memasok kebutuhan dasar untuk dijadikan bahan bakar nabati di tahap selanjutnya. Salah satu metode yang digunakan untuk meningkatkan biomassa mikroalga adalah dengan metode mutagenesis. Metode mutagenesis di sini dilakukan dengan cara kimiawi yakni dengan menambahkan senyawa tertentu yang disebut Etil Metan Sulfonat (EMS) ke dalam sel individu mikroalga. Dari penelitian ini didapatkan bahwa nilai densitas paling tinggi diantara ketiga perlakuan (Kontrol, 0.1 M dan 0.5 M) terjadi pada perlakuan EMS 0.5 M yakni 60.7 ± 11.93 sel individu/mL pada pada hari ke-6 (fase stasioner). Diantara ketiga perlakuan tersebut, laju pertumbuhan spesifik yang paling tinggi terdapat pada perlakuan EMS 0.1 M (0.52/hari) pada hari ke-5 (fase logaritmik). Perlakuan 0.5 M EMS memiliki nilai rasio RNA/DNA paling tinggi (0.55±0.46) sedangkan kontrol menjadi yang paling rendah (0.12±0.04). Untuk biomassa kering, nilai paling tinggi pada fase stasioner dan kematian terdapat pada kultivasi Nannochloropsis sp. dengan konsentrasi EMS 0.1 M (1.08±0.33 dan 1.11±0.07 gr/L). Pemberian EMS 0.5 M saat kultivasi mampu meningkatkan kadar lipid (3 kali lipat) sebesar 12.17%±0.30 (fase eksponensial) dan 18.14%±0.35 (fase stasioner) serta protein pada Nannochloropsis sp., namun tidak terjadi perubahan pada kadar karbohidrat. Hasil kromatografi mendeteksi sebanyak 22 senyawa asam lemak jenuh dan 3 jenis senyawa asam lemak tidak jenuh. Asam palmitat (asam lemak jenuh/SFA) dan asam oleat memiliki konsentrasi yang tinggi pada kultivasi perlakuan konsentrasi EMS 0.1 M. Sedangkan kultivasi dengan perlakuan konsentrasi EMS 0.5 M lebih berpengaruh dalam meningkatkan proses pembentukan asam lemak tidak jenuh ikatan tunggal (MUFA).
Kata Kunci : Nannochloropsis sp., mutagenesis, etil metansulfonat, asam lemak,
DINA AUGUSTINE. Mutagenetic Development in Microalgae Producing Biofuel Species using EMS Method (Ethyl Methanesulfonate). Supervised by MUJIZAT KAWAROE and AGUS OMAN SUDRAJAT.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Kelautan
PENGEMBANGAN MUTAGENESIS SPESIES MIKROALGA
PENGHASIL BIOFUEL DENGAN METODE EMS
(ETIL METAN SULFONAT)
DINA AUGUSTINE
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
dengan Metode EMS (Etil Metan Sulfonat) Nama : Dina Augustine
NIM : C551110111
Disetujui oleh
Komisi Pembimbing
Dr Ir Mujizat Kawaroe, MSi Ketua
Dr Ir Agus Oman Sudrajat, MSc Anggota
Diketahui oleh
Ketua Program Studi Ilmu Kelautan
Dr Ir Neviaty P Zamani, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Bapa dan AnakNya Yesus Kristus atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei 2013 ini ialah mutasi gen, dengan judul Pengembangan Mutagenesis Spesies Mikroalga Penghasil Biofuel dengan Metode EMS (Etil MetanSulfonat).
Terima kasih penulis ucapkan kepada Ibu Dr Ir Mujizat Kawaroe MSi dan Bapak Dr Ir Agus Oman Sudrajat, MSc selaku pembimbing, serta Bapak Dr Ir Hawis Madduppa, MSc yang telah memberikan banyak bantuan dalam mengerjakan metode molekuler dalam penelitian ini. Di samping itu, penghargaan penulis sampaikan kepada Syarif sebagai Teknisi Laboratorium Mikroalga SBRC LPPM IPB, Teknisi Laboratorium Pangan Pusat Laboratorium Terpadu Universitas Islam Negeri Syarif Hidayatullah, Aradea Bujana sebagai kolega analisis di Laboratorium Biosistematika Kelautan dan Teknisi Laboratorium Kimia Terpadu Kampus IPB Baranangsiang yang telah membantu dalam proses pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2015
1 PENDAHULUAN ... 1
2 PENGARUH INDUKSI ETIL METAN SULFONAT PADA LAJU PERTUMBUHAN Nannochloropsis sp. ... 6
3 EFEK INDUKSI ETIL METAN SULFONAT TERHADAP RASIO DNA DAN RNA pada Nannochloropsis sp. ... 13
4 PENGARUH INDUKSI ETIL METAN SULFONAT TERHADAP BIOMASSA DAN KANDUNGAN PROKSIMAT (KARBOHIDRAT, PROTEIN DAN LIPID) Nannochloropsis sp. ... 20
DAFTAR TABEL
1. Densitas dan laju pertumbuhan spesifik kultivasi Nannochloropsis sp. dengan tiga
perlakuan ... 11
2. Karakteristik Etil Metan Sulfonat ... 13
3. Konsentrasi dan rasio asam nukleat (DNA dan RNA) dalam ng/µl pada 3 perlakuan kultivasi Nannochloropsis sp. ... 17
4. Biomassa basah dan kering Nannochloropsis sp. pada tiga perlakuan kultivasi ... 24
5. Kadar proksimat Nannochloropsis sp. pada tiga perlakuan kultivasi ... 25
6. Senyawa asam lemak hasil identifikasi gas kromatografi ... 31
DAFTAR GAMBAR
1. Alur pikir penelitian ... 52. Pola pertumbuhan Nannochloropsis sp. pada tiga perlakuan kultivasi selama 12 hari 10 3. Struktur kimia Etil Metan Sulfonat ... 13
4. Reaksi nukleofil secara umum ... 14
1 PENDAHULUAN
Latar Belakang
Industrialisasi yang terus meningkat telah menyebabkan kenaikan permintaan bahan bakar fosil di dunia yang sangat signifikan. Sebagian besar atau sekitar 80% kebutuhan energi dunia tersebut dipasok dari bahan bakar fosil. Peningkatan permintaannya pun bisa mencapai hingga 2.5% setiap tahunnya. Konsumsi minyak global tumbuh di bawah rata-rata 0.6 juta barel per hari/0.7% untuk bisa mencapai 88 juta barel per hari. Hal ini selanjutnya memicu krisis ketersediaan minyak dunia (Agarwal et al., 2006). Pada perkembangan terakhir di tahun 2015, harganya mencapai 49 USD per barel. Dengan kenaikan harga minyak mentah dunia, hal ini juga menimbulkan harga BBM di berbagai negara juga melonjak naik. Penyebaran harga BBM di seluruh dunia pun berbeda-beda. Di benua Eropa, rata-rata harga BBM sudah melebihi angka 2 dolar per liternya terus mengalami kenaikan. Untuk negara-negara non Eropa, harga BBM masih berada di kisaran 1 sampai 1.5 dolar per liter namun tak diragukan akan mengalami kenaikan juga akibat harga minyak mentah yang semakin mahal.
Salah satu sumber energi yang saat ini gencar diteliti adalah bio-bahan bakar (biofuel) atau bahan bakar hayati, yang utamanya berasal dari berbagai jenis tumbuhan tingkat tinggi diantaranya kelapa sawit, jarak dan jagung. Sejumlah jenis tumbuhan yang ada di perairan laut juga berpotensi sebagai sumber energi alternatif, namun kajiannya masih tertinggal dibandingkan tumbuhan darat, seperti tanaman sawit dan jarak, yang secara klinis telah diujicobakan pada sejumlah kendaraan uji. Seiring dengan perkembangan penelitian bio bahan bakar, timbul pertanyaan besar mengenai masalah penanggulangan masalah perubahan iklim global akibat akumulasi emisi karbondioksida (CO2).
Biofuel adalah bahan bakar yang berasal dari bahan organik, yang juga disebut non-fossil energy. Beberapa negara di dunia sudah mulai beralih ke bahan bakar non fosil karena kemampuan daya dukung bahan bakar fosil yang mulai menurun. Perkembangan terakhir mengenai pemakaian biofuel di tahun 2008, biodiesel sebanyak 11 triliun liter telah dikonsumsi oleh 27 negara di dunia. Negara yang paling tinggi konsumsinya adalah Eropa bagian barat yakni sebanyak 1.245 juta liter. Jenis biofuel yang banyak dikenal adalah dalam bentuk biodiesel untuk pengganti solar dan bioetanol sebagai pengganti premium atau pertamax. Biodiesel diproduksi dari minyak atau lemak menggunakan transesterifikasi dan merupakan cairan dengan komposisi serupa dengan diesel mineral yaitu metil ester asam lemak (FAME). FAME diperoleh dari reaksi minyak dengan NaOH dan metanol. Reaksi tersebut juga menghasilkan gliserol dimana 1 bagian gliserol dihasilkan untuk setiap 10 bagian biodiesel. FAME banyak ditemukan dalam hasil metabolisme dari proses fotosintesis tumbuhan darat maupun laut, dan salah satunya adalah mikroalga.
lingkungan. Kemampuan mikroalga dalam mengurangi gas rumah kaca adalah dalam menggunakan bentuk terkonsentrasi dari gas CO2, yang diserap dari cerobong gas power plant, sehingga potensi mikroalga dalam menghasilkan produktivitas yang tinggi bisa lebih banyak dibandingkan dengan tumbuhan darat.
Mikroalga termasuk jenis tumbuhan laut yang mampu tumbuh dalam waktu yang cukup singkat. Kelebihan ini menjadi titik acuan untuk menjadi penghasil bahan bakar nabati dalam waktu yang cukup cepat. Di samping daya tumbuhnya yang cepat, diperlukan juga kapasitas biomassa sel tubuhnya yang besar untuk memenuhi kebutuhan dalam produksi akhir biofuel dari mikroalga tersebut. Dengan jumlah biomassa yang besar, dapat diperkirakan juga jumlah persentase lemak yang besar pula sehingga produksi biofuel dari mikroalga bisa mencapai angka yang cukup tinggi. Oleh karena itu, perlu dilakukan pemicuan terhadap proses pertumbuhan mikroalga untuk bisa meningkatkan jumlah biomassanya.
Metode yang dilakukan untuk meningkatkan biomassa mikroalga sudah banyak diketahui diantaranya dengan melakukan kultivasi pada sistem tertutup dan terkontrol ataupun dengan menginjeksikan gas karbondioksida sepanjang proses kultivasi berlangsung. Namun penggunaan kedua metode tersebut masih membutuhkan energi serta biaya yang tidak sedikit. Oleh karena itu masih perlu adanya pencarian metode untuk meningkatkan biomassa mikroalga yang bisa dilakukan secara efisien dan murah. Untuk metode yang digunakan pada penelitian ini masih sangat jarang dilakukan ataupun ditemui pada skala dunia. Metode yang digunakan adalah metode mutagenesis secara kimiawi. Metode ini menggunakan bahan kimia yang disebut etil metan sulfonat (EMS) dimana senyawa ini diestimasi mampu meningkatkan produksi biomassa pada beberapa tumbuhan darat. Namun penggunaan senyawa mutasi ini masih sangat sedikit dalam kajian tumbuhan laut seperti mikroalga. EMS adalah senyawa agen alkilasi berfungsi tunggal dan senyawa yang sangat reaktif dalam mengalkilasi gugus fosfat seperti purin dan pirimidin yang terdapat pada DNA (Taji et al., 2002). Mekanisme singkat dari reaksi EMS adalah reaksi substitusi nukleofilik dimana senyawa ester di EMS bereaksi dengan guanin (basa purin) yang menghasilkan O6 guanin (etil guanin). Sebagai efek jangka panjang, EMS bisa menghasilkan baik basa GC menjadi AT maupun AT menjadi GC yang bertransisi mutasi.
Kerangka Pemikiran
Penelitian kandungan senyawa asam lemak pada mikroalga sudah banyak ditemukan dan dilakukan oleh para peneliti di seluruh dunia. Penelitian mengenai mikroalga yang berpotensi untuk menjadi penghasil biofuel juga sudah dilakukan semenjak tahun 1970-an. diantaranya Pulich et al (1974), Lambert et al (1977), Sanderson et al (1979) dan masih banyak lagi. Namun penelitian yang mengkhususkan peningkatan produktivitas biomassa dan kandungan asam lemaknya sering menjadi hambatan, untuk skala regional ataupun dalam negeri. Selain itu, penelitian baik peningkatan potensi mikroalga untuk menjadi bahan dasar penghasil biofuel ini yang selama ini sudah dilakukan hanya berkisar pada penggunaan gas CO2 ataupun pembuatan alat kultivasi fotobioreaktor.
pertama di dalam rantai makanan perairan juga melakukan proses fotosintesis untuk bisa menghasilkan zat makanan sebagai bahan utama pertumbuhan selnya. Proses pembentukan senyawa lemak dalam sel mikroalga sangat membutuhkan adanya senyawa glukosa yang merupakan hasil dari proses fotosintesis. Glukosa yang dihasilkan kemudian mengalami beberapa proses spesifik menjadi asam piruvat, asetil KoA dan malonil KoA serta dibantu oleh enzim-enzim tertentu seperti asetil KoA karboksilase (ACCase), malonil KoA-ACP transasilase (MAT) dan fatty asil-ACP thioesterase (FAT) yang mengubah asil-ACP menjadi asam lemak bebas (FFA) dalam sel mikroalga (Cagliari et al., 2011). Enzim-enzim ini sangat menentukan keberhasilan dalam mengubah senyawa glukosa menjadi lemak yang tersimpan di dalam sel. Namun sepanjang dilakukan penelitian dan eksplorasi, persentase kadar senyawa asam lemak masih sangat sedikit atau kurang mencukupi kebutuhan pada proses produksi selanjutnya.
Asam lemak pada mikroalga menjadi pokok bahasan yang penting dalam melakukan penelitian tentang bahan bakar nabati terbarukan. Sampai saat ini masih dibutuhkan jenis mikroalga yang mampu menghasilkan biomassa yang banyak dan kadar asam lemak yang tinggi sehingga mampu memasok kebutuhan dasar untuk dijadikan bahan bakar nabati di tahap selanjutnya. Salah satu metode untuk meningkatkan biomassa mikroalga adalah dengan metode mutagenesis. Metode ini masih cukup baru dan sangat rumit untuk dilakukan. Metode mutagenesis di sini dilakukan dengan cara kimiawi yakni dengan menambahkan senyawa tertentu yang disebut Etil Metan Sulfonat (EMS) ke dalam sel individu mikroalga.
Dengan induksi senyawa EMS, proses mutagenesis pada sel mikroalga akan dimulai dengan adanya perubahan pada ikatan basa nitrogen RNA/DNA nya. (Anonim, 2004). Proses ini akan memicu perubahan struktur gen yang akan diterjemahkan ke bentuk yang berbeda jika dibandingkan dengan spesies mikroalga yang asli. Perubahan gen tersebut akan berakibat pada perubahan struktur morfologi sel, dimana sel akan menjadi lebih besar dari sebelum diinduksi dan akan memicu perkembangan biomassa serta kadar senyawa lemak yang lebih tinggi dalam sel tubuh mikroalga. Penerjemahan ekspresi gen yang berbeda juga bisa memicu perubahan kinerja enzim yang bekerja dalam proses pembentukan senyawa asam lemak dalam sel mikroalga.
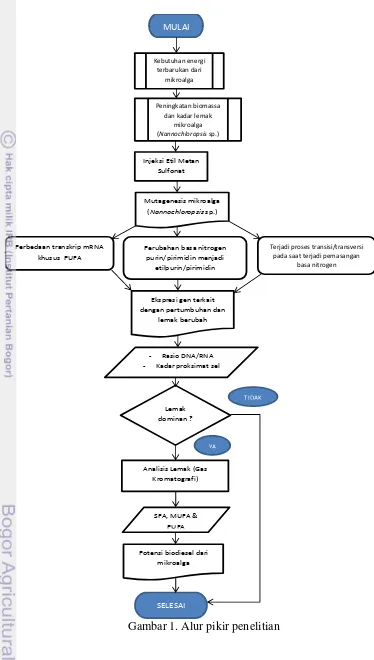
Oleh karena kebaruan metode ini, referensi terkait tentang penggunaan bahan kimia mutasi khususnya Etil Metan Sulfonat untuk mikroalga masih sangat jarang ditemukan bahkan bisa dikatakan hampir sulit didapatkan untuk skala global. Studi mengenai penggunaan metode ini terkait peningkatan biomassa mikroalga masih perlu dipelajari lebih lanjut untuk memahami potensi mikroalga sebagai bahan dasar penghasil biofuel. Alur pemikiran dari penelitian ini digambarkan melalui skema pada Gambar 1.
Perumusan Masalah
penghasil biofuel (asam lemak) yang masih sangat rendah. Persentase kadar lemak atau lipid yang tinggi juga menjadi salah satu acuan untuk tingkat produksi biofuel dari spesies mikroalga tertentu dimana dalam penelitian ini menggunakan
Nannochloropsis sp. Dari hal tersebut, masih diperlukan suatu pengetahuan tentang metode mutagenesis secara kimia dengan senyawa tertentu seperti EMS untuk meningkatkan laju pertumbuhan dan biomassa dari mikroalga yang diestimasi akan berpengaruh terhadap persentase lipid dalam sel tubuhnya.
Tujuan Penelitian
Penelitian ini dilakukan untuk:
1. Mengkaji peran senyawa Etil Metan Sulfonat dalam induksi mutasi pada
Nannochloropsis sp.
2. Mengidentifikasi, mengklasifikasi dan mendeterminasi komposisi proksimat sel (karbohidrat, protein, lemak) dan jenis asam lemak yang terkandung dalam mikroalga Nannochloropsis sp. yang telah mendapat perlakuan injeksi Etil Metan Sulfonat (EMS)
3. Menentukan tingkat potensi produksi biofuel dari Nannochloropsis sp.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan manfaat yaitu:
1. Tersedianya metode induksi produksi biofuel dari Nannochloropsis sp. dengan Etil Metan Sulfonat
Gambar 1. Alur pikir penelitian
MULAI
Kebutuhan energi terbarukan dari
mikroalga
Peningkatan biomassa dan kadar lemak
mikroalga
(Nannochloropsis sp.)
Injeksi Etil Metan Sulfonat
Mutagenesis mikroalga (Nannochloropsis sp.)
Perbedaan transkrip mRNA khusus PUFA
Perubahan basa nitrogen purin/pirimidin menjadi
etilpurin/pirimidin
Terjadi proses transisi/transversi pada saat terjadi pemasangan
basa nitrogen
Ekspresi gen terkait dengan pertumbuhan dan
lemak berubah
- Rasio DNA/RNA - Kadar proksimat sel
Lemak dominan ?
TIDAK
YA
Analisis Lemak (Gas Kromatografi)
SFA, MUFA & PUFA
Potensi biodiesel dari mikroalga
2 PENGARUH INDUKSI ETIL METAN SULFONAT PADA
LAJU PERTUMBUHAN
Nannochloropsis
sp.
Pendahuluan
Mikroalga dikenal sebagai salah satu bentuk kehidupan yang paling tua. Mereka disebut dengan tumbuhan primitif (thallophyta) yang tidak memiliki akar, batang dan daun, tidak memiliki sel penutup steril di sekeliling sel reproduktif serta memiliki zat klorofil sebagai pigmen fotosintesis primernya (Brennan dan Owende, 2009). Dengan adanya zat klorofil, mikroalga mampu melakukan proses fotosintesis layaknya tumbuhan tinggi lainnya serta bisa menghasilkan zat makanan seperti glukosa yang diperlukan untuk proses pertumbuhannya.
Menurut Kawaroe et al. (2010) berdasarkan pigmen mikroalga dikelompokkan menjadi lima filum, yaitu Chlorophyta (alga hijau), Chrysophyta (alga keemasan), Pyrhophyta (alga api), Euglenophyta dan Cyanophyta (alga biru-hijau). Untuk bisa mempertahankan hidupnya, mikroalga memiliki faktor-faktor pembatas yang ada di lingkungan hidupnya. Beberapa kondisi lingkungan yang bisa mempengaruhi pertumbuhan mikroalga antara lain temperatur (suhu), kualitas dan kuantitas nutrien (unsur hara), intensitas cahaya, derajat keasaman (pH), aerasi (sumber CO2), dan salinitas (Kawaroe et al., 2010). Selama hidupnya,
mikroalga melalui 5 fase yakni fase lag, fase logaritmik, fase penurunan pertumbuhan, fase stasioner dan fase kematian. Kelima fase ini memiliki ciri masing-masing seperti berikut (Kawaroe et al., 2010):
- Fase lag atau yang disebut dengan fase awal, mikroalga masih berjumlah sangat sedikit karena masih dalam tahap penyesuaian diri.
- Fase logaritmik, mikroalga akan mengalami peningkatan angka pertumbuhan yang cepat karena sudah mampu beradaptasi dengan media tempat tinggalnya.
- Fase penurunan pertumbuhan, mikroalga pada fase ini akan mengalami penurunan angka kelimpahan hingga bisa kembali ke angka di awal pertumbuhannya dikarenakan adanya penurunan kadar nutrisi dari media. - Fase stasioner, mikroalga mengalami status pertumbuhan yang konstan
dan fase ini dikenal sangat pendek jangka waktunya.
- Fase kematian, mikroalga dalam media tumbuh akan mengalami perubahan warna dari warna pigmen aslinya dan biasanya akan menggumpal di dasar media kultivasi.
Klasifikasi Nannochloropsis spp. yang termasuk dalam kelas alga hijau
Class : Eustigmatophyceae (Hibberd dan Leedale, 1970) Genus : Nannochloropsis (D.J. Hibberd, 1981)
Mikroalga Nannochloropsis spp. memiliki sel berwarna kehijauan, pergerakannya tidak motil, dan tidak pula berflagel. Selnya berbentuk bola, berukuran kecil dengan diamater 4-6 μm dan merupakan pakan yang populer untuk rotifer, artemia, dan pada umumnya merupakan berperan sebagai penyaring (filter feeder. Kondisi pertumbuhan optimum dari mikroorganisme ini juga diperkirakan pada 21 °C, 52 μmol photons m-2 s-1, pH 8,4 dan 14,7 VVH dari kecepatan aerasi (Kawaroe et al., 2010).
Jie et al. (2002) melakukan beberapa analisa faktor pertumbuhan pada
Nannochloropsis oculata. Faktor yang dianalisa diantaranya adalah suhu, cahaya, salinitas dan konsentrasi senyawa karbondioksida. Penelitian tersebut menunjukkan bahwa kondisi lingkungan yang cocok adalah pada suhu 0 sampai 30°C, N.oculata bisa tumbuh dan pertumbuhan tertinggi terjadi pada suhu 20°C. Faktor intensitas cahaya terbaik untuk N. oculata adalah antara 5000 sampai 7000 lux dimana semakin tinggi nilainya, akan semakin baik densitas yang dicapai. Kisaran salinitas untuk pertumbuhan yang baik berkisar antara 13.7-33.4‰, dimana salinitas terbaik adalah 26.9‰. Spesies tersebut lebih menyukai kondisi perairan dimana senyawa NaHCO3 (natrium bikarbonat) lebih tinggi.
Diantara faktor-faktor lingkungan yang mempengaruhi tingkat pertumbuhan mikroalga, cahaya adalah sumber energi dasar dan faktor penting dalam fotosintesis dan sangat penting untuk pertumbuhan mikroalga fotoautotropik (Wahidin et al., 2013). Mikroalga menggunakan cahaya sebagai sumber energi untuk sintesis protoplasma sel dan memiliki batas saturasi cahaya sekitar 600 fc (foot candles). Jadi ketika mikroalga terkena di atas batas saturasi cahaya, maka nilai di atasnya tidak akan digunakan. Di sisi lain, intensitas cahaya memainkan peran penting dan kebutuhannya bervariasi sesuai dengan kedalaman media kultivasi dan densitas mikroalga. Jika mikroalga dikultivasi pada media dengan kedalaman cukup dan densitas sel yang tinggi, intensitas cahaya harus ditingkatkan untuk bisa menembus media kultur. Wahidin et al. (2013) mendapatkan hasil densitas dan laju pertumbuhan spesifik maksimum berturut-turut sebesar 6.5 x 107 sel/ml dan 0.339/hari dengan kondisi kultivasi pada intensitas cahaya 100 umol/m2/s dan periode cahaya 18 jam terang dan 6 jam gelap.
kultivasi pada suhu yang lebih tinggi dibandingkan dengan spesies asli. Pada penelitian yang dilakukan Chaturvedi dan Fujita (2006) diketahui bahwa asam lemak jenis EPA terbukti dapat ditingkatkan dengan cara melakukan mutagenesis pada mikroalga spesies Nannochloropsis oculata. Pada penelitian Doan dan Obbard (2012) yang melakukan uji coba peningkatan kandungan lipid pada mikroalga Nannochloropsis sp. didapatkan bahwa spesies mutan mikroalga menghasilkan asam lemak lebih produktif dibandingkan spesies aslinya baik pada fase eksponensial maupun fase stasioner.
Tujuan
Menunjukkan pengaruh induksi senyawa etil metansulfonat terhadap densitas dan laju pertumbuhan spesifik pada mikroalga Nannochloropsis sp.
Bahan dan Metode
Spesies mikroalga Nannochloropsis sp. didapatkan dari hasil identifikasi dan koleksi Laboratorium Mikroalga Pusat Penelitian Surfaktan dan Bioenergi LPPM IPB yang berlokasi di Baranangsiang, Bogor. Dari proses pemberian bahan kimia EMS untuk mutasi sel mikroalga sampai dengan proses pemanenan biomassa mikroalga akan dilakukan di laboratorium tersebut. Bahan yang digunakan untuk penelitian ini diantaranya adalah :
1. Nannochloropsis sp. dalam media cair
2. Bahan kimia Etil Metan Sulfonat dengan konsentrasi 0.1 M dan 0.5 M. Penggunaan kedua konsentrasi didasari oleh penelitian yang telah dilakukan sebelumnya (Doan dan Obbard, 2012) yaitu dengan konsentrasi 1 sampai 10 M.
3. Media kultur mikroalga (Walne) 4. Air laut
Untuk alat yang digunakan dalam penelitian ini diantaranya adalah cawan petri, pipet tetes, erlenmeyer ukuran 100 ml dan 1 liter, spektrofotometer UV visual, mikroskop cahaya, haemacytometer, selang aerasi, stirrer, pemanas listrik, handcounter, toples ukuran 2 liter dan 5 liter.
Kultivasi mikroalga
diresuspensikan kembali dengan media walne yang baru sebanyak 10 ml dalam erlenmeyer 500 ml dan dibiarkan tumbuh selama 7 hari sebelum dilakukan seleksi. Jumlah sel mikroalga (2 × 107sel individu/ ml) yang termutasi kemudian disebarkan secara merata di atas plate (1,2% agar). Setelah diinkubasi selama 3 minggu pada suhu 25°C, jumlah koloni sel yang bertahan hidup pada plate agar dihitung dan setiap koloninya diinokulasi secara terpisah pada 10 mL air laut dalam tabung reaksi (Chaturvedi dan Fujita, 2006). Selama 12 hari, densitas mikroalga dihitung menggunakan Haemacytometer dan hand counter di bawah mikroskop. Kultivasi Nannochloropsis sp. metode ini dilakukan pada skala laboratorium dan diulang sebanyak 3 kali.
Pengumpulan Data
Kepadatan sel dan laju pertumbuhan spesifik
Kepadatan mikroalga yang teramati pada haemacytometer dapat dihitung dengan menggunakan persamaan 1 (Kawaroe et al., 2010):
106 ... (1) Keterangan:
N = kepadatan mikroalga (sel/ml)
n = jumlah mikroalga yang diamati
Laju pertumbuhan spesifik harian mikroalga dapat dihitung dengan rumus pada persamaan 2 (Guillard dan Ryhter, 1962).
... (2)
Keterangan:
= laju pertumbuhan spesifik
Nt = kepadatan mikroalga pada waktu t
N0 = kepadatan mikroalga awal
To = waktu awal kultivasi
Tt = waktu pengamatan/akhir kultivasi
Prosedur Analisis Data
Uji Statistik
yij = μ + ai + εij ………..(3)
Keterangan:
yi = Nilai laju pertumbuhan karena pengaruh konsentrasi EMS pada taraf ke-i, i = 0.1 M dan 0.5 M; sebanyak j ulangan (j=1, 2 dan 3)
μ = Rataan umum
ai = Konsentrasi EMS pada taraf ke-i, i = 0,1 M dan 0,5 M εij = Galat percobaan
Hasil
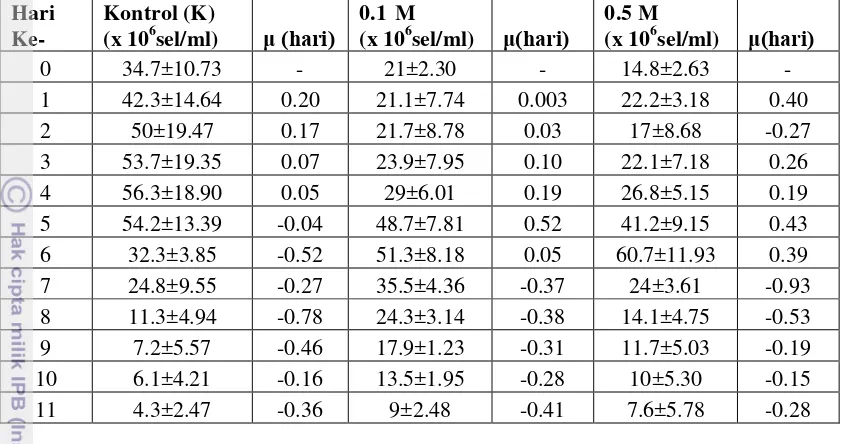
Gambar 2 menunjukkan bahwa kultivasi perlakuan EMS menghasilkan perbedaan munculnya fase pertumbuhan dengan kultivasi kontrol. Fase lag atau awal pada kontrol terjadi pada hari ke-0 lalu langsung ke fase logaritmik dari hari ke-2. Fase stasioner pada kontrol terjadi pada hari ke-4 lalu terjadi fase kematian dari hari ke-6 sampai hari ke-11. Untuk perlakuan EMS 0.1 M, fase lag dimulai dari hari ke-0 sampai ke-3, dilanjutkan ke fase logaritmik di hari ke-4. Fase stasioner terjadi pada hari 6 lalu terjadi fase kematian di hari 7 sampai ke-11. Pada perlakuan EMS 0.5 M, fase yang terjadi hampir sama dengan perlakuan EMS 0.1 M hingga fase kematian di hari ke-11.
Gambar 2. Pola pertumbuhan Nannochloropsis sp. pada tiga perlakuan kultivasi selama 12 hari
Selama 12 hari kultivasi, Nannochloropsis sp. mengalami laju pertumbuhan yang fluktuatif. Densitas paling tinggi terjadi pada hari ke-4 untuk kontrol, sedangkan untuk dua perlakuan EMS lainnya terjadi pada hari ke-6. Nilai densitas paling tinggi diantara ketiga perlakuan terjadi pada perlakuan EMS 0,5 M yakni 60.7 ± 11.93 (x 106) sel individu/mL. Nilai laju pertumbuhan spesifik paling tinggi dialami pada hari ke-1 untuk kontrol, sedangkan untuk dua perlakuan EMS terjadi pada hari ke-5. Diantara ketiga perlakuan tersebut, laju pertumbuhan spesifik yang paling tinggi terdapat pada perlakuan EMS 0.1 M (Tabel 1).
Tabel 1. Densitas dan laju pertumbuhan spesifik kultivasi Nannochloropsis sp.
Diantara ketiga perlakuan tersebut, kultivasi dengan konsentrasi EMS 0.5 M memiliki densitas paling tinggi pada hari ke-6 (fase stasioner). Untuk laju pertumbuhan spesifik, kultivasi dengan konsentrasi 0.1 M EMS memiliki nilai paling tinggi (0.52/hari) pada hari ke-5 (fase logaritmik). Angka ini masih lebih tinggi dibandingkan dengan laju pertumbuhan spesifik pada densitas tertinggi dengan konsentrasi EMS 0.5 M (0.39/hari). Jika dibandingkan dengan kultivasi kontrol, laju pertumbuhan spesifik pada dua perlakuan konsentrasi EMS memiliki angka yang lebih tinggi yakni 0.52/hari dan 0.43/hari pada hari ke-5. Pada kontrol, laju pertumbuhan spesifik paling tinggi adalah pada hari ke-2 sebesar 0.20/hari.
Laju pertumbuhan spesifik pada penelitian ini menunjukkan nilai yang tidak jauh berbeda dibandingkan dengan penelitian yang dilakukan oleh Doan dan Obbard (2012) yakni sebesar 0.56/hari untuk kultivasi spesies asli dan 0.58/hari untuk kultivasi spesies mutan dengan konsentrasi EMS tertentu. Pada penelitian tersebut, disebutkan bahwa percobaan kultivasi menggunakan konsentrasi EMS yang semakin tinggi menghasilkan densitas yang semakin rendah dibandingkan dengan kultivasi spesies asli. Pada penelitian ini, nilai laju pertumbuhan spesifik
Nannochloropsis sp. semakin rendah dari konsentrasi 0.1 M ke 0.5 M.
Ong et al. (2010) menyatakan bahwa Chlorella sp. yang dimutasi dengan konsentrasi EMS 0.1 M memiliki laju pertumbuhan spesifik yang lebih tinggi. Hal ini sesuai dengan hasil penelitian saat ini dimana laju pertumbuhan spesifik
Nannochloropsis sp. pada konsentrasi EMS yang sama menghasilkan angka yang lebih tinggi dibandingkan spesies asli.
Pembahasan
Hasil penelitian ini densitas dan laju pertumbuhan spesifik dengan perlakuan induksi 2 konsentrasi EMS memiliki nilai yang lebih tinggi dibandingkan dengan kontrol. Hal ini dapat diindikasikan karena adanya perubahan genetik tanpa kehilangan bentuk morfologi ataupun genomik (Chaturvedi dan Fujita, 2006). Setelah melakukan uji nilai F, hasil yang didapatkan adalah ketiga perlakuan tersebut tidak memiliki perbedaan yang signifikan dimana nilai P>0.05 dan nilai F hitung < F tabel. Hal ini bisa mengindikasikan bahwa EMS tidak berkorelasi dengan laju pertumbuhan (Nestmann, 1975). Dari hal tersebut, indikasi yang mungkin terjadi adalah induksi bahan mutagen seperti EMS terhadap Nannochloropsis sp. tidak melibatkan kinerja gen replikasi sel.
Indikasi berikutnya adalah hilangnya pengaruh EMS pada saat kultivasi dilakukan. Penelitian Aranez (1981) menyebutkan bahwa induksi EMS pada
Scenedesmus quadricauda setelah satu minggu mulai menghilang dan pada minggu kedua, laju pertumbuhannya pun ikut menurun. Pada minggu yang sama, spesies mikroalga ini pun mampu memulihkan kondisi selnya setelah diberi perlakuan.
Pada penelitian ini, pengaruh EMS terlihat secara khusus saat fase stasioner pertumbuhan. Howell-Saxton et al (1973) menyebutkan Escherichia coli
yang diinduksi oleh EMS pada konsentrasi tertentu menghasilkan frekuensi yang lebih tinggi pada fase stasioner pertumbuhan. Penelitian tersebut menyatakan bahwa kerentanan sel terhadap agen alkilasi seperti EMS dipengaruhi oleh kemampuan genetik untuk melakukan pemulihan dan kondisi fisiologis sel tersebut. Hal tersebut dibuktikan dengan baik pada Howell-Saxton et al (1974) dimana pada fase stasioner, sel E.coli yang diinduksi oleh EMS mengalami proses perbaikan DNA dengan frekuensi paling tinggi.
Simpulan
3 PENGARUH INDUKSI ETIL METAN SULFONAT
TERHADAP RASIO DNA DAN RNA pada
Nannochloropsis
sp.
Pendahuluan
Etil metan sulfonat merupakan salah satu bahan kimia yang banyak digunakan untuk melakukan mutasi gen pada tumbuhan yang ada di darat. Etil metan sulfonat adalah senyawa agen alkilasi berfungsi tunggal dan merupakan senyawa yang sangat reaktif dalam mengalkilasi gugus fosfat seperti purin dan pirimidin yang terdapat pada DNA (Taji et al., 2002). Senyawa ini adalah hasil etil ester dengan asam metanosulfonik (Gambar 3) dan berbentuk cairan transparan pada suhu ruang. Senyawa ini larut dalam air dan selalu stabil di bawah suhu serta tekanan yang normal (National Toxicology Program, 2011).
Gambar 3. Struktur kimia Etil Metan Sulfonat
Tabel 2. Karakteristik Etil Metan Sulfonat
Karakter Informasi
Berat molekul 124.2
Gravitasi spesifik 1.15 pada 22°C
Titik leleh <- 25°C
Titik didih 213°C – 214°C pada 761 mmHg Kelarutan dalam air 135 g/L pada 25°C
Tekanan uap 0.328 mmHg pada 25°C
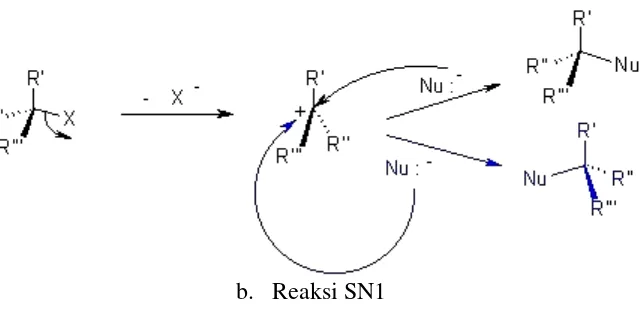
Senyawa EMS melakukan reaksi alkilasi pada lokasi sel yang bersifat nukleofil melalui mekanisme gabungan antara reaksi nukleofil (SN1/SN2) yang dikenal dengan reaksi substitusi nukleofilik (Gambar 4). Pada reaksi substitusi ini, etil metan sulfonat yang merupakan senyawa ester bereaksi dengan guanin sehingga menghasilkan senyawa etil guanin dan senyawa leaving group yaitu mesilat atau metansulfonat (Anonim, 2004).
b. Reaksi SN1
Gambar 4. Reaksi nukleofil secara umum
Data genetik yang menggunakan mikroorganisme menyatakan bahwa EMS bisa menghasilkan baik basa guanine sitosin menjadi adenine timin maupun adenine timin menjadi guanine sitosin yang bertransisi mutasi. Terdapat dua proses yang terjadi akibat induksi bahan kimia agen alkilasi ini yakni proses transisi dan transversi (Rhaese and Boetker, 1973). Proses transisi mutasi terinduksi merupakan proses yang terjadi antara pasangan basa nitrogen yang sama seperti antara purin dengan purin atau pirimidin dengan pirimidin. Proses lainnya dikenal dengan proses transversi yakni pertukaran pasangan basa nitrogen yang berbeda seperti purin berpasangan dengan pirimidin atau sebaliknya (Warwick, 1963). Untuk kasus EMS, dugaan yang terjadi adalah proses transversi dimana senyawa yang terbentuk adalah etil purin/pirimidin yang nantinya akan berpasangan dengan basa nitrogen yang berbeda. EMS juga bisa menyebabkan penyisipan atau penghapusan pasangan basa (Sega, 1984).
Etil metan sulfonat sudah banyak digunakan untuk melakukan proses mutasi pada tumbuhan darat diantaranya pisang kepok (Yanti, 2011), tanaman kenaf/Hibiscus cannabinus (Arumingtyas dan Indriyani, 2004) dan cabai (Manzila
et al., 2010). Pada ketiga tumbuhan darat tersebut dilakukan mutasi secara kimia umumnya untuk mendapatkan tanaman yang tahan terhadap hama penyakit dan virus serta bisa lebih cepat tumbuh dari tanaman yang tidak diberi perlakuan mutasi. Menurut Van Harten (1998), Etil metan sulfonat dikenal sebagai senyawa mutagen yang paling sering digunakan dalam penelitian mutagenesis kimia karena selain efektivitasnya dalam melakukan mutasi, sifat mutageniknya pun bisa hilang setelah mengalami reaksi hidrolisis dengan air (H2O) (Gambar 5).
Gambar 5. Reaksi Etil Metan Sulfonat dengan air
tentang peningkatan senyawa asam lemak EPA dari spesies mutan
Nannochloropsis sp. serta Doan dan Obbard (2012) yang menelusuri peningkatan senyawa lipid dari spesies mutan Nannochloropsis sp.
Tujuan
Menunjukkan ada tidaknya efek induksi senyawa etil metansulfonat terhadap RNA dan DNA Nannochloropsis sp.
Bahan dan Metode
Untuk mengetahui adanya peristiwa mutasi dalam sel mikroalga dilakukan ekstraksi RNA dan DNA menggunakan metode Kit terhadap sel tersebut lalu dilakukan perhitungan rasio antara RNA dan DNA. Analisis tersebut akan dilakukan di Laboratorium Biosistematika Kelautan FPIK Institut Pertanian Bogor. Bahan yang digunakan untuk penelitian ini diantaranya adalah :
1. Nannochloropsis sp. dalam bentuk bubuk yang sudah dikeringkan
2. Qiagen Dneasy Plant Mini Kit untuk ekstraksi DNA (Isi : kolom mini spin DNeasy, kolom mini spin QIAShredder, RNase A, buffer-buffer, Tube koleksi (2ml))
3. Qiagen Rneasy Plant Mini Kit untuk ekstraksi RNA (Isi : kolom mini spin, tube koleksi (1.5 ml dan 2 ml), Reagen Lysis QIAzol, Reagen RNAse-Free) 4. Ethanol 96%
5. Beta merkaptoetanol
Untuk alat yang digunakan dalam penelitian ini diantaranya adalah cawan petri, mikropipet 10 µl, 100 µl dan 1000 µl, Sentrifus, vortex, spinner, pemanas listrik, neraca Ohauss, pinset, tisu, Nanophotometer dan microtube ukuran 2 µl.
Analisis konsentrasi DNA
tube koleksi dibuang. Selanjutnya sampel dipindahkan ke tube koleksi yang baru dan ditambah 500 µl buffer AW2. Sampel kemudian disentrifuse selama 1 menit dengan kecepatan 8 ribu rpm. Cairan bagian tube koleksi kembali dibuang. sampel kemudian dianalisa dengan alat Nanophotometer untuk diukur konsentrasi DNA nya sebanyak 0,1 µl. Analisis konsentrasi DNA ini dilakukan sebanyak 3 kali ulangan pada masing-masing perlakuan (K, 0.1 M dan 0.5 M).
Analisis konsentrasi RNA
Analisis data
Analisis rasio RNA/DNA mikroalga
Analisis rasio RNA/DNA mikroalga dapat dihitung dengan rumus sebagai berikut :
Rasio = RNA / DNA ... (3) Dimana :
RNA : jumlah RNA yang telah terekstraksi (ng/µl) DNA : jumlah DNA yang telah terekstraksi (ng/µl)
Hasil
Konsentrasi DNA paling tinggi dihasilkan dari kultivasi mikroalga pada kontrol, sedangkan yang paling rendah dari perlakuan 0.5 M EMS. Untuk konsentrasi RNA, angka paling tinggi didapat dari kultivasi pada perlakuan 0.5 M EMS, sedangkan yang paling rendah adalah pada kultivasi dengan perlakuan 0.1 M EMS (Tabel 3).
Tabel 3. Konsentrasi dan rasio asam nukleat (DNA dan RNA) dalam ng/µl pada 3 perlakuan kultivasi Nannochloropsis sp.
Perlakuan DNA (ng/µl) RNA (ng/µl) Rasio RNA/DNA
Kontrol 28.17±8.73 3±0.75 0.12±0.04
0.1 M 13.73±3.91 2.67±0.09 0.21±0.07
0.5 M 10.63±6.21 3.6±1.42 0.55±0.46
Untuk rasio RNA/DNA dari ketiga perlakuan kultivasi Nannochloropsis
sp. diketahui bahwa perlakuan 0.5 M EMS memiliki nilai rasio paling tinggi, sedangkan kontrol menjadi yang paling rendah. Dari perhitungan tersebut bisa diketahui bahwa kultivasi Nannochloropsis sp. menggunakan konsentrasi EMS sebanyak 0.5 M memungkinkan adanya peningkatan jumlah konsentrasi RNA menjadi lebih banyak dibandingkan dengan kultivasi secara normal (kontrol).
Dibandingkan dengan penelitian yang dilakukan oleh Kim et al. (2012) pada spesies Botryococcus braunii dengan menggunakan metode Dneasy dari Qiagen, konsentrasi DNA pada penelitian kali ini lebih rendah. Penelitian sebelumnya mendapatkan konsentrasi DNA rata-rata sebanyak 43.725 ng/µl. Hal ini bisa disebabkan spesies yang digunakan sangat berbeda dimana penelitian sebelumnya menggunakan spesies air tawar. Selain itu, bisa juga disebabkan karena adanya pemberian EMS ke sel Nannochloropsis sp. pada penelitian kali ini.
bahan tanaman. Pada penelitian tersebut, konsentrasi RNA total yang dihasilkan sebesar 2.92 – 7.52 μg/ml.
Menurut Nicklisch dan Seinberg (2009), rasio RNA/DNA yang diprediksi bisa dihubungkan dengan laju pertumbuhan spesifik mikroalga dan tergantung pada pigmen mikroalganya. Namun dari penelitian tersebut, hubungan antara rasio RNA/DNA dan laju pertumbuhan spesifik untuk kelas Chlorophyceae ternyata tidak berkorelasi secara signifikan.
Pembahasan
Pada penelitian ini, rasio RNA/DNA pada kultivasi dengan EMS 0.5 M lebih tinggi dibandingkan dengan EMS 0.1 M. Hal ini tidak sejalan dengan penurunan laju pertumbuhan spesifik dari konsentrasi EMS 0.1 M ke EMS 0.5 M. Oleh karena itu, pernyataan Nicklisch dan Seinberg (2009) pada penelitiannya bisa dikatakan terbukti pada penelitian ini dimana rasio RNA/DNA tidak ada korelasinya dengan laju pertumbuhan spesifik khususnya pada spesies di kelas Chlorophyceae. Alasan pernyataan tersebut adalah disebabkan oleh keberadaan fase pembelahan sel pada mikroalga yang menjadikan replikasi DNA terbatas sampai fase-S (fase sintesis) pada sel eukariot seperti mikroalga. Adanya beberapa fase pembelahan sel ini mengakibatkan rasio RNA/DNA pada mikroalga menjadi bervariasi (Nicklisch dan Seinberg, 2009).
Konsentrasi DNA yang lebih rendah pada perlakuan induksi EMS dibandingkan dengan konsentrasi pada kontrol dapat diindikasikan oleh adanya perubahan proses genetik pada sel Nannochloropsis sp. Beberapa fungsi biologis dari EMS diantaranya adalah sebagai genotoksin yakni senyawa kimia yang menyebabkan kerusakan DNA secara tidak langsung atau sebagai mutagen yakni suatu agen yang menambah frekuensi mutasi di atas normal, biasanya dengan berinteraksi langsung dengan DNA dan menyebabkan kerusakan, termasuk substitusi basa baik purin atau pirimidin (Anonim, 2004). DNA yang masih bisa terbentuk kemudian akan ditranskripsi menjadi RNA.
Selanjutnya DNA akan direplikasi secara semikonservatif untuk memperoleh dua rantai barunya. Cara semikonservatif adalah dua rantai DNA lama terpisah dan rantai baru disintesis dengan prinsip komplementasi pada masing-masing rantai DNA lama tersebut (Adhie, 2008). Pada kondisi ini, mekanisme dari hasil reaksi EMS dengan basa purin pada DNA terjadi. Pemberian EMS dengan konsentrasi tertentu pada sel mikroalga bisa menyebabkan terjadinya reaksi alkilasi yang disebut dengan substitusi nukleofil orde kedua (Sn2) (Warwick,1963). Reaksi antara ikatan alkil pada EMS dengan basa purin seperti guanin yang menghasilkan ikatan N7-alkylguanin yang nantinya akan berpasangan dengan basa pirimidin timin (Ekanayake, 2007). Hal ini disebut dengan base mispairing.
dengan timin. Pada RNA, timin berganti menjadi urasil, sehingga guanin akan berpasangan dengan urasil (Warwick,1963).
Adanya peningkatan konsentrasi RNA pada perlakuan EMS 0.5 M menjadikan rasio RNA/DNA pada perlakuan EMS 0.5 M lebih tinggi. Hal ini mengindikasikan adanya pengaruh EMS terhadap proses transkripsi pada DNA menjadi RNA. Menurut Warwick (1963), agen alkilasi seperti EMS cukup berpotensi dalam menghambat proses sintesis DNA namun tidak untuk proses sintesis RNA.
Selanjutnya untuk indikasi mutasi, Jain dan Gupta (2013) menyatakan bahwa perubahan yang dilakukan dari induksi EMS secara umum mengarah ke
missense mutations sebanyak ±50%, sedangkan sebanyak ±5% mengarah ke
nonsense mutations atau pemotongan. Lalu sisanya mengarah ke mutasi tak terlihat (silent mutations). Dalam penelitian ini, hal tersebut belum bisa diketahui karena analisis selanjutnya masih perlu dilakukan untuk melihat jenis asam amino yang dihasilkan dari proses penerjemahan kode genetik.
Simpulan
4 PENGARUH INDUKSI ETIL METAN SULFONAT
TERHADAP BIOMASSA DAN KANDUNGAN PROKSIMAT
(KARBOHIDRAT, PROTEIN DAN LIPID)
Nannochloropsis
sp.
Pendahuluan
Sebagian biomassa mikroalga mengandung tiga komponen utama seperti lipid, protein, dan karbohidrat. Mikroalga menghasilkan dan menyimpan lemak dalam bentuk asam lemak, fosfolipid, glikolipid dan dapat digunakan sebagai bahan baku untuk biodiesel produksi dengan reaksi transesterifikasi di hadapan asam atau basa dengan metanol (Muthukumar et al., 2012). Menurut Moazami et al. (2011) komposisi lipid dan produktivitas pada mikroalga dipengaruhi oleh kondisi saat tumbuh diantaranya adalah komposisi media, cahaya dan suhu. Produktivitas lipid bisa meningkat saat pertumbuhan sel sangat menurun dalam kondisi nutrien yang terbatas. Hasil penelitian tersebut didapatkan biomassa dan kadar lipid Nannochloropsis sp sebanyak 50 g/l/m2 dan 52% selama kultur 14 hari. Disebutkan bahwa produksi biomassa dan kadar lipid dapat dihasilkan dengan memperpanjang hari kultur dan periode ketersediaan cahaya. Sama halnya dengan pernyataan Wahidin et al (2013) faktor pencahayaan seperti panjang penyinaran dan intensitas dapat mempengaruhi kadar lemak. Dari penelitian tersebut, total kadar lemak maksimum (31.3%) diperoleh ketika kultivasi dilakukan dengan paparan cahaya 18 jam terang dan 6 jam gelap pada hari ke-8.
Hu dan Gao (2006) menyebutkan bahwa dalam kondisi kekurangan nitrogen, mikroalga berpigmen hijau menunjukkan peningkatan dalam penyimpanan lipid. Kadar lipidnya berlipat ganda sebanyak 4 kali dengan kondisi senyawa nitrogen yang rendah dan tidak berlaku pada kondisi nitrogen yang tinggi. Selain itu, kadar lipid juga dipengaruhi oleh faktor salinitas air laut dan konsentrasi gas CO2 yang cukup tinggi. Dari penelitian tersebut, Nannochloropsis sp. mengandung kadar lipid, karbohidrat dan protein dengan kisaran 9-62%, 5-17% dan 23-59% dari berat biomassa keringnya.
Biomassa mikroalga cukup menentukan jumlah kadar lipid yang diperoleh nantinya saat proses ekstraksi (Bondioli et al., 2012). Penelitian tersebut menunjukkan bahwa biomassa mikroalga dengan kelembaban 70% atau lebih dapat menghasilkan kadar lipid sebanyak 50% dari berat keringnya. Kandungan minyak dari biomassa mikroalga basah sebanding dengan bibit minyak yang mengandung sekitar 15 % minyak seperti buah zaitun. Setelah ekstraksi minyak, diperlukan pengurangan kadar air dari biomassa sisa untuk menghindari degradasi mikrobiologis. Mikroalga yang tumbuh di bawah kondisi normal dapat menghasilkan jumlah lipid yang tinggi namun lipid yang dihasilkan biasanya terdiri dari sebagian kecil senyawa gliserida dan asam lemak bebas dan sisanya adalah sebagian besar lipid polar seperti glikolipid atau fosfolipid.
media pupuk pertanian dimana kadar karbohidrat, lipid dan proteinnya secara berturut-turut sebesar 24.51%, 24.84% dan 20.61%.
Menurut penelitian yang telah dilakukan oleh Xiao et al. (2013), pada kultivasi batch menggunakan Nannochloropsis oceanica, lipid secara signifikan terakumulasi seiring dengan hari kultivasi yang bertambah, namun untuk kadar protein dan karbohidrat, hanya sedikit berfluktuasi dan memiliki kecenderungan penurunan dan peningkatan. Kisaran lipidnya adalah 44.8% sampai 69.1%, sedangkan karbohidrat dan protein secara berurutan berkisar antara 4.7–6.6% dan 4.3–7.4% selama 23 hari kultivasi. Penelitian tersebut menunjukkan pengaruh keterbatasan gizi dan keterbatasan senyawa nitrat hanya mempengaruhi pertambahan kadar lipid namun tidak memberi pengaruh signifikan terhadap peningkatan ataupun penurunan kadar protein dan karbohidrat.
Tujuan
Menunjukkan adanya pengaruh induksi senyawa etil metansulfonat terhadap biomassa dan kadar lipid-karbohidrat-protein pada Nannochloropsis sp.
Bahan dan Metode
Pemanenan, pengeringan bubuk mikroalga dan proses ekstraksi lipid mikroalga dilakukan di Laboratorium Proses, Pusat Penelitian Surfaktan dan Bioenergi LPPM IPB. Analisis kadar protein dan karbohidrat dilakukan di Laboratorium Terpadu Institut Pertanian Bogor Baranangsiang dengan bahan analisa bubuk kering mikroalga. Bahan yang digunakan untuk penelitian ini diantaranya adalah :
1. Nannochloropsis sp. dalam bentuk pasta dan kering
2. Bahan kimia NaOH untuk proses pemanenan biomassa mikroalga 3. Bahan kimia heksan untuk proses ekstraksi/ uji kadar lemak
4. Bahan kimia Campuran Selen, Indikator campuran, larutan asam borat H3BO3 2%, larutan HCl 0,01 N dan larutan NaOH untuk uji kadar protein kasar 5. Bahan kimia asam klorida 3%, NaOH 30%, kertas lakmus, indikator PP,
larutan luff schoorl, larutan KI 20%, larutan H2SO4 25%, larutan Na2S2O7, 0.1 N dan penunjuk larutan kanji untuk uji kadar karbohidrat
Alat yang digunakan dalam penelitian ini diantaranya adalah cawan petri, erlenmeyer ukuran 100 ml dan 500ml, perangkat soklet, kertas saring, kapas, selang aerasi, neraca Ohauss, vaccum pump, blender, labu Kjeldhal 100 ml, alat penyulingan, pemanas listrik, pembakar, neraca analitik, pendingin tegak, labu ukur 100 ml dan 500 ml, corong, batu didih, pipet gondok 10 ml & 25 ml, stopwatch, gelas ukur, buret dan Gas Kromatografi Spektrofotometer Massa.
Biomassa mikroalga
diukur pada fase eksponensial dan fase kematian untuk membandingkan kadar lemak pada kedua fase tersebut. Setelah semuanya tertampung dalam kertas saring, hasil panen dapat dikeringkan menggunakan sinar matahari atau oven jika cuaca tidak cukup panas. Hasilnya yang berupa bubuk, selanjutnya dianalisis lebih lanjut meliputi penimbangan biomassa mikroalga. Hasil penimbangan dicatat dan dibandingkan per setiap perlakuan. Analisis biomassa baik basah atau kering diulang sebanyak 3 kali pada masing-masing perlakuan (K, 0.1 M dan 0.5 M).
Analisis kadar protein kasar
Prinsip analisis kadar protein kasar adalah senyawa nitrogen diubah menjadi ammonium sulfat oleh H2SO4 pekat. Amonium sulfat yang terbentuk diuraikan dengan NaOH. Amoniak yang dibebaskan diikat dengan asam borat dan dititar dengan larutan baku asam (SNI 01-2891-1992). Prosedur kerjanya dimulai dengan :menimbang seksama 0.51 gr sampel. Lalu dimasukkan ke dalam labu kjeldhal. Setelah itu ditambahkan 2 gr campuran selen dan 25 ml H2SO4 pekat. Kemudian sampel dipanaskan di atas pemanas listrik atau api pembakar sampai mendidih dan larutan menjadi jernih kehijau-hijauan (sekitar 2 jam). Lalu dibiarkan dingin, kemudian diencerkan dan dimasukkan ke dalam labu ukur 100 ml, tepatkan sampai tanda garis. 5 ml larutan sampel dipipet dan dimasukkan ke dalam alat penyuling, dan ditambahkan 5 ml NaOH 30% dan beberapa tetes indikator phenolphthalein. Sampel disulingkan selama lebih kurang 10 menit, sebagai penampung gunakan 10 ml larutan asam borat 2% yang telah dicampur indikator. Kemudian dibilas ujung pendingin dengan air suling. Lalu dititar dengan larutan HCl 0,01 N. Selanjutnya dianalisis penetapan blanko. Analisis ini diulang sebanyak 3 kali. pada masing-masing perlakuan (K, 0.1 M dan 0.5 M).
Analisis kadar karbohidrat
Analisis kadar lipid
Ekstraksi yang akan menghasilkan minyak dari mikroalga dilakukan dengan menggunakan larutan kimia heksan (Bligh dan Dyer, 1959). Sampel mikroalga yang telah dipanen ditimbang dan dibungkus dengan kertas saring dan ditutup dengan kapas bebas lemak. Sampel diekstraksi dengan 200 ml n-heksana teknis (telah dimurnikan) selama 6-7 jam dalam tabung soxhlet. Ekstrak lemak diuapkan dengan alat destilasi dan dikeringkan dalam oven bersuhu 50-60 0C selama kurang lebih 1 jam dan selanjutnya ditimbang untuk mendapatkan kadar lipid. Analisis lipid diulang sebanyak 3 kali pada masing-masing perlakuan (K, 0.1 M dan 0.5 M).
Analisis data
Analisis kadar protein kasar
Kadar protein dihitung dengan menggunakan rumus sebagai berikut :
Kadar protein = –
... (4)
Dimana :
W = bobot cuplikan (gram)
V1 = volume HCl 0.01 N yang dipergunakan penitaran contoh (ml)
V2 = volume HCl yang dipergunakan penitaran blanko (ml)
N = normalitas FICI (N)
f.k = faktor konversi untuk protein dan makanan secara umum : 6,25 susu & hasil olahannya : 638 mentega kacang : 5,46
fp = factor pengenceran
Analisis kadar karbohidrat
Perhitungan menggunakan metode fenol adalah konsentrasi gula dalam contoh ditentukan dengan menggunakan kurva standar (hubungan antara konsentrasi gula standar dengan absorbans) dan memperhitungkan pengenceran yang dilakukan. Rumus perhitungannya dapat ditulis sebagai berikut.
Total gula (%) = ((GxFP)/W)x100 ... (5) Dimana:
G = konsentrasi gula dari kurva standar (gram)
FP = faktor pengenceran
W = berat contoh (gram)
Analisis kadar lipid
Perhitungan rendemen kadar lipid dengan rumus (AOAC 2005) sebagai berikut :
... (6)
W2 = massa labuh lemak setelah ekstraksi (gram) ; W1 = massa labuh lemak
sebelum ekstraksi (gram);W2 – W1 = massa ekstrak (gram); W = massa serbuk
hasil freeze dry (gram)
Hasil
Hasil gravimetri biomassa dari kultivasi mikroalga Nannochloropsis sp. diukur pada 2 hari yang menunjukkan fase pertumbuhan berbeda yakni fase eksponensial akhir(hari ke 6) dan fase stasioner akhir (hari ke 7) (Tabel 4).
Tabel 4. Biomassa basah dan kering Nannochloropsis sp. pada tiga perlakuan kultivasi
Perlakuan
Biomassa basah (g/l) Biomassa kering (g/l)
H-6 (fase eksponensial akhir)
Pada fase eksponensial, biomassa basah Nannochloropsis sp. paling tinggi dimiliki oleh kultivasi kontrol (6.60±0.28 g/l). Berbeda dengan fase stasioner akhir, biomassa basah paling banyak dimiliki oleh kultivasi dengan konsentrasi EMS 0.1 M (10.63±0.15 g/l). Untuk biomassa kering, nilai paling tinggi pada kedua fase dimiliki oleh kultivasi Nannochloropsis sp. dengan konsentrasi EMS 0.1 M (1.08±0.33 dan 1.11±0.07 g/l). Hal ini mungkin terjadi karena kadar air saat panen lebih banyak dibandingkan jumlah individu yang terambil sehingga menambah berat biomassa basah.
Nilai biomassa pada penelitian ini sedikit lebih tinggi dibandingkan dengan hasil penelitian yang dilakukan oleh Doan dan Obbard (2012). Hasil penelitian tersebut menyebutkan bahwa biomassa Nannochloropsis sp. kultivasi spesies asli dan spesies mutan sebesar 0.20±0.02 dan 0.22±0.08 g/l pada hari terakhir. Dari hasil tersebut, Doan dan Obbard (2012) sendiri mengatakan bahwa percobaan dengan EMS berkonsentrasi tinggi (1 M) tidak berpengaruh secara signifikan pada biomassa Nannochloropsis sp. pada saat penelitian dilakukan.
Dibandingkan dengan penelitian Ong et al. (2010), nilai biomassa penelitian ini hampir sama. Penelitian sebelumnya menghasilkan biomassa dengan kisaran 0.6 – 1.2 g/l untuk spesies mutan Chlorella sp. (EMS 0.1 M) dan 0.4 – 0.9 g/l untuk spesies aslinya pada suhu kultivasi 40°C. Dengan demikian, penelitian kali ini menghasilkan spesies mutan Nannochloropsis sp. yang memiliki potensi biomassa yang tinggi.
analisis proksimat adalah sebesar 100% diantaranya adalah kadar air, kadar abu, kadar bahan kering, kadar bahan organik, kadar serat kasar, kadar lemak, kadar protein dan kadar karbohidrat. Namun yang perlu ditunjukkan untuk penelitian ini adalah kadar lemak, protein dan karbohidrat saja.
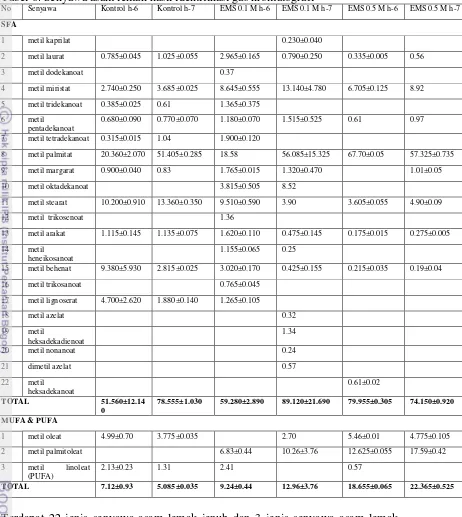
Tabel 5. Kadar proksimat Nannochloropsis sp. pada tiga perlakuan kultivasi
Perlakuan Lipid (%) Karbohidrat (%) Protein (%) nilai tertinggi berada pada perlakuan kultivasi kontrol. Untuk kadar protein, nilai tertinggi pada kultivasi Nannochloropsis sp. dengan perlakuan EMS 0.1 M. Pada kadar lipid, terlihat bahwa angka yang diperoleh dimiliki oleh perlakuan kultivasi
Nannochloropsis sp. dengan konsentrasi EMS 0.5 M. Hal ini berbanding terbalik dengan nilai biomassa (Tabel 3). Biomassa tertinggi didapat dari perlakuan kultivasi Nannochloropsis sp. dengan konsentrasi EMS 0.1 M. Hasil kadar lipid pada konsentrasi EMS 0.1 M juga termasuk tinggi namun pada penelitian ini bisa diketahui bahwa biomassa yang banyak tidak selalu menghasilkan kadar lipid yang tinggi. Jumlah biomassa Nannochloropsis sp. yang tinggi pada EMS 0.1 M justru menghasilkan kadar protein yang lebih banyak dibandingkan kadar lipid dalam sel. Sedangkan biomassa Nannochloropsis sp. pada konsentrasi EMS 0.5 M menghasilkan kadar lipid lebih banyak dibandingkan dengan kadar protein dalam sel. Namun jika dibandingkan, nilai kadar lipid pada kedua perlakuan EMS tidak jauh berbeda. Pada kadar karbohidrat, nilai antara perlakuan EMS 0.1 dan 0.5 M tidak jauh berbeda.
Nilai kadar lipid pada penelitian kali ini sedikit lebih tinggi dari Doan dan Obbard (2012). Penelitian tersebut menyatakan kadar lipid hasil kultivasi spesies mutan sebesar 1.5 sampai 2 kali lipat kultivasi spesies asli pada dua fase pertumbuhan (eksponensial dan stasioner). Pada penelitian ini, kadar lipid kultivasi 0.5 M bertambah 1.5 sampai 3.3 kali lipat hasil kultivasi kontrol pada fase eksponensial dan stasioner. Hal ini menunjukkan adanya kesamaan fase untuk masa panen Nannochloropsis sp. yang sebaiknya dilakukan pada fase stasioner akhir sehingga kadar lipid yang didapat lebih besar.
berturut-turut memiliki kisaran berturut-turut antara 4.26-7.35% dan 4.72-6.62%. Hal ini bisa dikatakan bahwa penggunaan senyawa mutagen EMS tidak memberikan pengaruh secara signifikan terhadap konten karbohidrat dan protein pada Nannochloropsis sp. dibandingkan dengan perlakuan kultivasi standar lainnya seperti dengan menggunakan injeksi gas karbondioksida serta pengurangan senyawa nitrogen pada media kultur.
Pembahasan
Proses pembentukan ketiga senyawa proksimat tersebut berasal dari senyawa asam amino yang mengalami beberapa proses tertentu. Konten protein berasal dari 100 atau lebih ikatan asam amino yang biasa disebut polipeptida. Konten karbohidrat berasal dari proses glikogenesis yang sebelumnya mengalami proses glukoneogenesis yang menghasilkan glukosa. Konten lipid berasal dari asam amino glukogenik yang nantinya mengalami proses katabolisme dan dikonversi menjadi asam lemak (Diwan, 2007).
Spesies mikroalga lain yang juga pernah digunakan untuk uji coba Etil metan sulfonat adalah Chlamydmonas reinhardtii. Lee et al. (2014) menyatakan bahwa setelah dimutasi secara acak dengan EMS, spesies tersebut menghasilkan kadar lipid dalam sel lebih banyak dibandingkan spesies asli. Pada fase ekponensial, kadar lipid spesies mutan meningkat sebanyak 2 kali lipat dari spesies asli. Lalu pada fase stasioner, kadar lipid dari spesies mutan tidak menunjukkan peningkatan yang cukup banyak. Hal ini sejalan dengan hasil penelitian kali ini dimana Nannochloropsis sp. yang diberikan EMS dengan konsentrasi tertentu menghasilkan konten lipid yang lebih tinggi 1.5 sampai 3.3 kali lipat dibandingkan spesies aslinya baik pada fase eksponensial dan stasioner. Dengan demikian, antara penelitian sebelumnya dan yang sekarang menunjukkan kemungkinan media EMS untuk menghasilkan kadar lemak yang tinggi pada generasi mikroalga mutan dengan metode mutagenesis acak.
Kadar lipid dengan dua perlakuan EMS menunjukkan nilai yang lebih tinggi dibandingkan dengan kontrol. Hal ini mengindikasikan adanya peningkatan aktivitas katalis dan atau sintesis enzim tertentu pada Nannochloropsis sp. yang diberi perlakuan EMS dibandingkan dengan spesies aslinya (Chaturvedi et al., 2004). Enzim pertama yang muncul saat sintesis lemak disebut ACCase (ACetyl Co-a karboksilASE) dimana enzim ini bertugas untuk mengubah Asetil ko-a menjadi malonil ko-a yang nantinya akan terus berlanjut sampai pembentukan asam lemak bebas (Ruffing, 2013). Enzim inilah yang diestimasi mengalami peningkatan aktivitas akibat pemberian perlakuan EMS dengan konsentrasi tertentu dimana pada penelitian ini, konsentrasi EMS yang semakin tinggi akan memicu peningkatan kadar lipid.
Hasil uji statistik dengan ANOVA menunjukkan adanya perbedaan yang signifikan antara kontrol dan 2 perlakuan EMS. Hasil tersebut ditunjukkan dari nilai F hitung yang lebih besar dari F tabel dan nilai P < 0.05. Dengan begitu, senyawa EMS bisa memberikan pengaruh yang nyata terhadap peningkatan kadar lipid pada Nannochloropsis sp.
seperti EMS memiliki empat efek merusak pada fungsi protein diantaranya kodon stop prematur, mutasi sambungan ujung (splice site mutations), penghapusan kodon, dan missense mutations. Hasil penelitian kali ini diestimasi terjadi peristiwa yang justru meningkatkan kadar protein pada sel Nannochloropsis sp. disebabkan oleh induksi EMS. Diantara empat efek tersebut, yang memiliki kemungkinan untuk meningkatkan kadar protein adalah splice site mutations dan
missense mutations dimana keduanya tidak menghapus kodon yang terbentuk ataupun menghentikan penerjemahan kode genetik (kodon stop prematur).
Kadar karbohidrat pada ketiga perlakuan memiliki nilai yang berdekatan. Hal ini bisa disimpulkan bahwa perlakuan EMS tidak memberikan pengaruh yang signifikan pada proses pembentukan karbohidrat. Menurut Wingender et al. (1999), eksperimen dengan EMS dilakukan pada makroalga P. aeruginosa tidak menunjukkan perubahan terhadap gen yang bertugas pada metabolisme karbohidrat.
Simpulan
5 PENGARUH PERBEDAAN KONSENTRASI INDUKSI ETIL
METAN SULFONAT TERHADAP KARAKTERISASI ASAM
LEMAK
Nannochloropsis
sp.
Pendahuluan
Mikroalga mensintesis asam lemak sebagai blok bangunan untuk pembentukan berbagai jenis senyawa lipid diantaranya lipid struktural terutama yang bersifat polar seperti fosfolipid dan glikolipid bersama-sama dengan lipid netral seperti monogliserida, digliserida (DAGs) dan trigliserida (TAG), asam lemak bebas, hidrokarbon dan pigmen. Lipid polar terbatas berada pada membran organel dalam sel seperti tilakoid pada kloroplas. TAG adalah lipid netral yang disimpan di vakuola dalam sel (Olofsson et al., 2012).
Komposisi asam lemak berbeda diantara semua kelas lipid yang ada. Asam lemak jenuh (SAFA) dan asam lemak tak jenuh tunggal (MUFA) yang terdiri dari fraksi lipid penyimpan, sedangkan asam lemak tak jenuh ganda (PUFA) sebagian besar terdiri dari fraksi lipid pembangun struktur. Lipid penyimpan di
Nannochloropsis sp. sebagian besarterdiri dari asam palmitat SAFA (C16:0) dan asam palmitoleat MUFA (C16:1) (Olofsson et al., 2012). Bondioli et al. (2012) menyebutkan asam lemak C:16 menjadi yang paling dominan yakni sebanyak75%dari total asam lemak dalam lipid netral, 51% lipid polar dan 31% pada fosfolipid. Asam lemak tak jenuh sebagian besar dominan dalam lipid polar (63%) dan fosfolipid (73.5%). Lipid netral mengandung jumlah yang hampir setara dengan asam lemak tak jenuh dan jenuh. Moazami et al. (2011) mendapatkan hasil yang mirip dengan penelitian-penelitian yang sudah ada dimana di dalam Nannochloropsis sp. terdeteksi senyawa asam palmitat dan asam oleat (untuk jenis MUFA) sebagai senyawa paling dominan. Untuk jenis PUFA, asam linoleat menjadi yang paling dominan (23.6%).
Kandungan tinggi C18:0 dan C18:1 dalam mikroorganisme menjadi prasyarat dalam produksi biodiesel karena stabilitas oksidatif dan potensi kemampuan beradaptasi yang cukup besar dalam produksi skala industri (Olofsson et al., 2012). C16:0 juga telah diusulkan sebagai asam lemak yang sesuai dalam produksi diesel terbarukan. Keduanya sangat jarang didapatkan pada sel Nannochloropsis sp. Namun diharapkan dengan adanya jenis asam lemak MUFA yang lainnya selain asam stearat, asam palmitat dan asam oleat, maka spesies mikroalga ini bisa menjadi salah satu spesies yang berpotensi sebagai salah satu penghasil bahan bakar nabati.
Menurut Olofsson et al. (2012), keberadaan asam lemak PUFA yang terlalu tinggi konsentrasinya bisa mengurangi kemampuan sel mikroalga untuk memproduksi biodisel secara maksimal. Karena ketidakstabilan oksidatif dari asam lemak tak jenuh ganda (PUFA) dan fakta bahwa lipid mikroalga, pada umumnya, mengandung banyak PUFA, asam lemak ini harus dipertimbangkan dalam efisiensi mikroalga untuk produksi biodiesel. Untuk mikroalga
Nannochloropsis sp., hampir jarang ditemukan senyawa asam lemak PUFA. Namun dari penelitian Olofsson et al. (2012), kadar asam lemak PUFA dalam
lainnya juga memungkinkan adanya perubahan kadar asam lemak PUFA dalam sel mikroalga (Hu and Gao, 2006). Kadar PUFA yang tinggi bisa diatasi dengan dicampur dengan minyak nabati dari bahan lain, atau jenis mikroalga lain untuk mencapai komposisi yang sesuai.
Tujuan
Menunjukkan adanya pengaruh perbedaan konsentrasi pada induksi senyawa Etil Metansulfonat terhadap komposisi senyawa asam lemak pada mikroalga Nannochloropsis sp.
Bahan dan Metode
Preparasi sampel minyak mentah dari berat kering mikroalga dilakukan di Laboratorium Proses, Pusat Penelitian Surfaktan dan Bioenergi LPPM IPB. Setelah itu, sampel hasil ekstrak dibawa ke Laboratorium Kimia Terpadu di Universitas Islam Negeri Syarif Hidayatullah untuk diproses dengan menggunakan alat Gas Kromatografi Spektrofotometer Massa (GC-MS). Proses ini dilakukan untuk mengidentifikasi jenis senyawa asam lemak yang terkandung dari hasil percobaan mutasi sel mikroalga dengan menggunakan bahan kimia EMS. Bahan yang digunakan untuk penelitian ini diantaranya adalah :
1. Minyak mentah mikroalga hasil ekstraksi
2. Bahan kimia NaOH 0.5 N, BF3, metanol, Na2SO4 cair
Untuk alat yang digunakan dalam metode penelitian ini diantaranya adalah cawan petri, pipet tetes, mikropipet, neraca Ohauss, tabung reaksi, alat sentrifugasi, botol vial,alat pemanas, gelas ukur, dan seperangkat Gas Kromatografi Spektrofotometer Massa.
Esterifikasi
Esterifikasi bertujuan menurunkan titik uap asam lemak dengan cara merubah gugus fungsional lemak menjadi ester yang relatif mudah dalam analisis GC-MS. 0.5 – 1 gram sampel lemak yang telah diekstrak disaponifikasi dengan 4.5 ml NaOH 0.5 N, kemudian dimasukkan ke dalam tabung reaksi dan direaksikan dengan BF3 dalam metanol. Campuran dikocok dan dipanaskan selama 15 menit, didiamkan sampai terbentuk dua lapisan. Lapisan atas dipisahkan dengan sentrifugasi dan dipurifikasi lebih lanjut dengan menambahkan Na2SO4 untuk menghilangkan kadar airnya. Hasil esterifikasi selanjutnya dimasukkan ke dalam vial untuk dianalisa dengan alat GC-MS (Hermanto et al. 2008).
Analisis gas kromatografi (Tujuan penelitian III)
dalam; dan 0.25 µm ketebalan lapis film) serta helium sebagai gas pendorong. Kromatografi gas memiliki batas deteksi 0.001 ppb. Kromatografi gas menggunakan mode injeksi split dengan rasio 1 : 200. Suhu oven kromatografi gas di program dari 800C dibiarkan konstan selama 2 menit, kemudian dinaikkan 2100C dengan kecepatan 100/menit dibiarkan konstan selama 1 menit, kemudian dinaikkan lagi 2800C dengan kecepatan 60/menit dibiarkan konstan selama 5 menit. Kondisi GC-MS adalah ionisasi potensial/ electron energy 70eV, ion source temperature 2500C dan interface temperature 2800C. Full mass datadicatat antara 50-400 Dalton setiap detik. Waktu retensi dari 0-32.67 menit. Data dicatat dan dianalisis dengan perangkat lunak GC-MS Real Time Analysis dan GCMS Postrun Analysis (Hermanto dan Muawanah, 2008).
Prosedur analisis data
Identifikasi asam lemak
Identifikasi asam lemak menggunakan kromatografi gas dan kromatografi gas-spektrometri massa. Identifikasi metil esters asam lemak dilakukan dengan membandingkan mass spectra dengan data literatur. Penentuan nomor karbon pada senyawa metil ester asam lemak adalah dengan menghitung bobot molekul yang muncul pada spectra massa. Karakteristik metil ester asam lemak memberikan puncak yang kuat pada m/z = 74 yang merupakan puncak dasar rantai lurus metil ester. Peak terluas pada tiap kelompok merepresentasikan fragmen CnH2n-1O2 dan m/z = 14 (n -2) + 74. Secara sederhana dituliskan dengan persamaan:
Cx = ………(7) dimana:
x = nomor karbon (FAME)
m = bobot molekul yang muncul pada peak spektra massa 14 = berat molekul CH2
Hasil