MADE SUHANDANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2014
KARAKTERISASI DAN PEMURNIAN ENZIM
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis yang berjudul “Karakterisasi dan Pemurnian Enzim Polyphenoloxidase dari Udang Windu (Penaeus monodon)” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2014
ii
RINGKASAN
MADE SUHANDANA. Karakterisasi dan Pemurnian Enzim Polyphenoloxidase dari Udang Windu (Penaeus monodon). Dibimbing oleh TATI NURHAYATI dan LAKSMI AMBARSARI.
Udang merupakan komoditas perikanan yang sangat penting. Nilai ekspor dan tingkat konsumsi udang mendorong pemerintah untuk meningkatkan produksi udang. Industri udang tidak luput dari permasalahan-permasalahan. Salah satu permasalahan yang dihadapi adalah pembentukan blackspot. Blackspot dapat menurunkan penerimaan konsumen terhadap udang. Blackspot terjadi karena reaksi enzimatis yang dibantu oleh enzim polyphenoloxidase (PPO). Penelitian ini bertujuan untuk mengkarakterisasi dan memurnikan enzim PPO dari udang windu.
Penelitian dilakukan dalam dua tahap yang meliputi tahap penelitian pertama yaitu tahap ekstraksi dan karakterisasi enzim PPO. Tahap karakterisasi enzim mencakup penentuan pH dan suhu optimum, kinetika enzim, dan pengaruh ion logam terhadap enzim PPO. Tahap penelitian kedua mencakup pemurnian enzim PPO.
Enzim polyphenoloxidase (PPO) diekstraksi dari karapas udang Penaeus
monodon. Metode terbaik untuk mengekstraksi enzim adalah menggunakan
perbandingan sampel dengan bufer sodium fosfat 0,05 M pH 7,2 (yang mengandung NaCl 1 M dan Brij 35 0,2%) sebesar 1:1 secara berulang. Pengendapan untuk mendapatkan aktivitas spesifik tertinggi adalah menggunakan amonium sulfat dengan kejenuhan 70% dan waktu dialisis selama 4 jam. Pemurnian dilakukan menggunakan kromatografi filtrasi gel Sephadex G-150. Dua bobot molekul yaitu 258,29 kDa dan 222,05 kDa diperoleh dari hasil penentuan bobot molekul enzim PPO. Kemurnian meningkat 1,64 kali setelah dimurnikan menggunakan filtrasi gel. Penentuan optimasi kerja enzim PPO diperoleh pH optimum sebesar 7 dan suhu optimum sebesar 35°C. Penghitungan kinetika enzim menunjukkan Km App enzim PPO dari Penaeus monodon sebesar 1,24 mM dengan Vmaks App 23,26 U. Aktivitas PPO dihambat oleh ion logam Na+, Ca2+, Zn2+, dan EDTA dengan konsentrasi 5 dan 10 mM; Cu2+ dengan konsentrasi 10 mM; dan Mn2+ dengan konsentrasi 5 mM. Aktivitas PPO mengalami peningkatan setelah ditambahkan dengan Cu2+ 5 mM, Mn2+ 10 mM, serta Co2+ dengan konsentrasi 5 dan 10 mM.
SUMMARY
MADE SUHANDANA. Characterization and purification of polyphenoloxidase from black tiger shrimp (Penaeus monodon). Supervised by TATI NURHAYATI and LAKSMI AMBARSARI.
Shrimps are a very important commodity. The exports value and the consumption level encourage governments to increase shrimp production. Shrimp industry still facing problems related to deterioration. One of the problems is blackspot formation. Blackspot can lower consumer acceptance of shrimp. Blackspot occurs because the enzymatic reaction by polyphenoloxidase (PPO). This study aimed to characterize and purify the enzyme PPO from black tiger shrimp (Penaeus monodon).
The study was conducted in two step. The first step includes the extraction process and characterization of polyphenoloxidase. The second step includes purification of polyphenoloxidase.
Polyphenoloxidase (PPO) was extracted from carapace of black tiger shrimp
Penaeus monodon. The best method to extract the enzyme was 1:1 ratio sampel
with bufer using multilevel extraction method. The best precipitation to obtain the highest specific activity was using ammonium sulfate at 70 % saturation. Four hours was the best dialysis periode. Purification was carried out using gel filtration chromatography with Sephadex G-150 column chromatography. Polyphenoloxidase has molecular weight about 258.29 kDa and 222.05 kDa . The specific activity after purification 1.64 times higher than crude extract. The optimum pH of PPO was 7 with the optimum temperature was 35°C. The concentration of substrate to obtain optimum activity was 7.5 mM . Kinetics study showed Km App value of PPO was 1.24 mM and Vmax App 23.26 U. Metal ion such as Na+, Ca2+, Zn2+, and EDTA at concentration 5 and 10 mM; 10 mM Cu2+ and 5 mM Mn2+ inhibited PPO activity. Polyphenoloxidase activity increased when 5 mM Cu2+, 10 mM Mn2+, Co2+ at concentration 5 and 10 mM added to the enzyme.
iv
Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
KARAKTERISASI DAN PEMURNIAN
ENZIM
POLYPHENOLOXIDASE
DARI UDANG WINDU
(
Penaeus monodon
)
MADE SUHANDANA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
vi
Judul Tesis : Karakterisasi dan Pemurnian Enzim Polyphenoloxidase dari Udang Windu (Penaeus monodon)
Nama : Made Suhandana
NIM : C351110151
Disetujui oleh
Komisi Pembimbing
Dr Tati Nurhayati, SPi MSi Dr Laksmi Ambarsari, MS
Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Hasil Perairan
Dr Tati Nurhayati, SPi MSi Dr Ir Dahrul Syah, MScAgr
viii
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala Rahmat dan Karunia-Nya sehingga penulisan tesis ini dapat diselesaikan. Judul tesis ini adalah ”Karakterisasi dan Pemurnian Enzim Polyphenoloxidase dari Udang Windu (Penaeus monodon)”. Penelitian ini didanai melalui penelitian Desentralisasi 2013 atas nama Dr Tati Nurhayati, SPi MSi dengan judul “Isolasi, Pemurnian, dan Karakterisasi Inhibitor Polyphenoloxidase Alami sebagai Penghambat Pembentukan Blackspot pada Udang”
Penulis mengucapkan terimakasih yang sebesar-besarnya kepada :
1. Dr Tati Nurhayati, SPi MSi dan Dr Laksmi Ambarsari, MS selaku dosen pembimbing yang telah memberikan bimbingan, arahan, dukungan, semangat serta pelajaran tentang berbagai macam hal sehingga penulis dapat menyelesaikan tesis ini.
2. Dr Kustiariyah Tarman, SPi MSi selaku dosen penguji luar komisi yang telah memberikan bimbingan, arahan, serta pelajaran sehingga penulis mampu menyelesaikan tesis ini.
3. Bapak yang saya banggakan Drs. Gde Sardana, ibu yang saya cintai Dra. Ni Luh Nyoman Sunarti, kakak dan adik yang saya banggakan Luh Santi Udayani dan Nyoman Alit Putra Wirawan.
4. Teman-teman satu penelitian polyphenoloxidase (PPO) yang saya banggakan (Medal, Laela, Sonya). Terimakasih atas bantuan yang tulus. Laboran yang telah membantu penelitian saya (Bang Epul, Mbal Lastri, Ibu Ema, Mba Dini, Ibu Ika, Mba Rima)
5. Keluarga besar mahasiswa sekolah pascasarjana Teknologi Hasil Perairan, yang telah memberikan dorongan semangat baik selama penelitian maupun saat penyusunan tesis ini.
6. Sahabat-sahabatku yang berjiwa besar (Wahyu, Yulia, Patma, Aulia, Mbak Eka, Frets, Bang Aris, Aidil). Abang-abangku dan Mbak-mbak yang telah memberikan dorongan semangat (Bang Fikri, Bang Titot, Bang Ozan, Bang Boy, Mbak Asi, Mbak Tyas, Mbak Ria), rekan-rekan yang penuh semangat (Jeny, Mita, Cia, Yoo, Tirta, Taufik, Bang Yapi, Azwin, Sabri).
7. Terima kasih penulis sampaikan kepada semua pihak yang telah membantu penyelesaian tesis ini.
8. DIKTI yang telah membiayai penelitian melalui hibah Penelitian Unggulan Perguruan Tinggi Tahun 2013
Penulis menyadari bahwa masih terdapat kekurangan dalam penyusunan tesis ini. Oleh karena itu, jika terdapat kesalahan penulis memohon maaf yang sebesar-besarnya. Penulis sangat mengharapkan kritik dan saran yang membangun sehingga bermanfaat untuk penyelesaian tesis ini.
Akhirnya, semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2014
DAFTAR ISI
Halaman
DAFTAR ISI ix
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan 2
Hipotesis Penelitian 2
2 METODE 4
Waktu dan Tempat 4
Bahan dan Alat 4
Prosedur Kerja 4
Penelitian Tahap Pertama : Ekstraksi dan Karakterisasi Enzim 4
Penelitian Tahap Kedua : Pemurnian Enzim 7
Analisis 7
Pengujian Aktivitas Polyphenoloxidase 7
Pengujian Konsentrasi Protein 7
Pengukuran Bobot Molekul dan Zimogram 8
Analisis Data 8
3 HASIL DAN PEMBAHASAN 8
Tahap Ekstraksi dan Karakterisasi Enzim Polyphenoloxidase 8
Ekstrak Enzim Polyphenoloxidase 8
Optimasi Kerja Enzim 11
Suhu Optimum Ekstrak Enzim PPO 12
Nilai pH Optimum Ekstrak Enzim PPO 13
Kinetika Enzim PPO 14
Pengaruh Ion Logam terhadap Aktivitas Enzim 15
Tahap Pemurnian Enzim Polyphenoloxidase 17
Fraksi Amonium Sulfat Enzim PPO 17
Hasil Pemurnian Enzim PPO 20
Hasil Elektroforesis Enzim PPO 22
4 SIMPULAN DAN SARAN 24
Simpulan 24
Saran 24
DAFTAR PUSTAKA 25
x
DAFTAR TABEL
Halaman
1 Yield enzim PPO yang diekstrak menggunakan perbandingan
bufer yang berbeda 11
2 Hasil analisis kelipatan pemurnian enzim polyphenoloxidase 21
DAFTAR GAMBAR
Halaman
1 Roadmap penelitian polyphenoloxidase 3
2 Diagram alir penelitian 5
3 Aktivitas ekstrak PPO dari beberapa bagian udang 9
4 Aktivitas spesifik dari beberapa ekstrak enzim polyphenoloxidase
menggunakan perbandingan bufer yang berbeda 10
5 Peningkatan absorbansi sampel yang diinkubasi pada suhu 30°C dan
suhu 35°C 11
6 Suhu optimum aktivitas enzim polyphenoloxidase 12
7 pH optimum aktivitas enzim polyphenoloxidase 13
8 Konsentrasi substrat optimum untuk aktivitas enzim polyphenoloxidase dan plot Lineweaver-Burk untuk enzim polyphenoloxidase 14 9 Pengaruh ion logam terhadap aktivitas enzim polyphenoloxidase (PPO) 16 10 Aktivitas spesifik enzim hasil pengendapan menggunakan amonium
sulfat pada beberapa tingkat kejenuhan 18
11 Aktivitas spesifik hasil dialisis enzim polyphenoloxidase dari udang
windu (Penaeus monodon) 19
12Elektroforegram dan zimogram enzim PPO 19
13Fraksi-fraksi hasil pemurnian enzim menggunakan filtrasi gel 20 14Elektroforegram enzim PPO fraksi kromatografi filtrasi gel 23 15Zimogram enzim PPO fraksi kromatografi filtrasi gel 23
DAFTAR LAMPIRAN
Halaman 1 Pembuatan larutan standar BSA konsentrasi 0,01-0,1 mg/mL 28
2 Komposisi gel penahan dan pemisah SDS PAGE 28
3 Cara membuat larutan 28
1 PENDAHULUAN
Latar Belakang
Udang merupakan komoditas ekspor yang menjanjikan bagi Indonesia. Tingkat ekspor udang ke luar negeri yang tinggi menjadi sumber pendapatan yang tinggi bagi Indonesia. Ekspor udang Indonesia pada tahun 2010 mencapai volume 145.092 ton. Nilai ekspor udang pada tahun 2010 lebih rendah jika dibandingkan ekspor udang pada tahun 2008 yang mencapai 170.583 ton (KKP 2011).
Ekspor udang ke negara-negara Eropa beberapa tahun terakhir mengalami penurunan. Penurunan ekspor udang disebabkan oleh beberapa faktor misalnya penurunan produksi udang, tekanan perekonomian global, dan penolakan pasar internasional. Penolakan di pasar internasional secara global disebabkan oleh beberapa faktor antara lain terdapat residu bahan kimia dan penurunan mutu udang.
Udang mengalami kemunduran mutu selama penyimpanan. Pornrat et al. (2007) menyatakan bahwa setelah 6 hari penyimpanan pada suhu 5oC, tekstur udang menjadi sangat lunak. Neil (2012) menyebutkan awal post mortem terjadi karena glikolisis secara anaerob akibat penghentian suplai oksigen melalui
haemolymph. Kemunduran mutu udang disebabkan oleh adanya aktivitas enzim
yang terdapat dalam tubuh udang, aktivitas bakteri, dan reaksi yang terjadi dengan lingkungan penyimpanan. Kemunduran mutu udang menyebabkan penurunan nilai-nilai sensori pada udang dan berakibat pada penurunan penerimaan konsumen.
Penampakan dipengaruhi oleh warna dan merupakan parameter pertama yang dinilai untuk mengevaluasi makanan. Warna dapat dipengaruhi oleh pembentukan warna melalui reaksi enzimatis dan non enzimatis. Salah satu reaksi warna yang penting adalah terbentuknya warna kehitaman pada seafood khususnya krustasea yang disebut blackspot (Kim et al. 2000). Pembentukan
black spot pada udang merupakan salah satu contoh pembentukan warna yang
disebabkan oleh aktivitas enzim yaitu polyphenoloxidase (PPO) (Martinez dan Whitaker 1995).
Montero et al. (2001) menyatakan melanosis adalah proses yang dipicu oleh mekanisme biokimia akibat oksidasi fenol menjadi quinon melalui kompleks enzim yang disebut polyphenoloxidase (PPO). Proses ini diikuti oleh polimerasi nonenzimatik quinon sehingga menimbulkan senyawa pigmen dengan berat molekul tinggi dan sangat gelap. Hallio et al. (2007) menyatakan bahwa
phenoloxidase (PO) berperan dalam proses melanosis dan memiliki bentuk inaktif
yang disebut proPO. ProPO diaktifkan oleh tripsin dan zymozan A serta berhubungan dengan protease serin endogeneus (Cardenas dan Dankert 1997). Proses degeneratif pada udang terjadi saat post mortem (Wang et al. 2011). Proses degradasi jaringan udang setelah mati disebabkan oleh enzim-enzim protease pada udang serta berhubungan dengan pengaktifan enzim PPO.
Polyphenoloxidase merupakan enzim yang penting bagi udang terutama
2
disebabkan oleh enzim menjadi tidak terkendali. Penanganan udang setelah mati sangat penting untuk mengurangi aktivitas enzim PPO.
Beberapa penelitian telah dilakukan untuk melihat manfaat enzim PPO. Zhao et al. (2007) menyatakan enzim PPO dari Manduca sexta dapat dimanfaatkan sebagai penghasil komponen dihydroxindole (DHI) yang berperan sebagai antibakteri. Komponen DHI juga berperan sebagai antiviral, anti parasit dan bersifat sitotoksik (Zhao et al. 2011). Svitel dan Miertus (1998) menyebutkan tirosinase dapat digunakan sebagai biosensor untuk bioremediasi komponen fenol di lingkungan.
Pemurnian enzim merupakan salah satu cara untuk dapat memperoleh enzim yang lebih murni. Pemurnian dapat dilakukan berdasarkan bobot molekul enzim menggunakan kromatografi filtrasi gel. Kromatografi filtrasi gel menggunakan bahan pengisi yang merupakan gel yang berpori-pori. Pori-pori pada permukaan gel cukup kecil sehingga mencegah molekul-molekul besar masuk ke dalamnya, tetapi dapat menampung molekul-molekul yang lebih kecil (Stellwagen 2009).
Beberapa penelitian telah dilakukan untuk memurnikan dan karakterisasi enzim PPO dari beberapa spesies seperti Penaeus japonicus (Benjakul et al. 2005), Ruditapes philippinarum (Cong et al. 2005) Artemia sinica (Fan et al. 2011), Nephrops norvegicus (Gimenez et al. 2010), namun penelitian untuk memurnikan dan mengkarakterisasi enzim PPO udang windu (Penaeus monodon) dari Indonesia belum dilakukan. Penelitian ini bertujuan untuk mengkarakterisasi dan memurnikan enzim polyphenoloxidase dari udang windu (Penaeus monodon).
Perumusan Masalah
Blackspot/melanosis merupakan fenomena yang terjadi pada udang selama
penyimpanan. Pembentukan blackspot pada udang mengurangi penerimaan konsumen terhadap udang. Melanosis diakibatkan oleh aktivitas enzim
polyphenoloxidase (PPO). Polyphenoloxidase aktif karena ada substrat yang
cocok dan kondisi lingkungan yang sesuai untuk aktif. Polyphenoloxidase saat udang masih hidup berada dalam kondisi tidak aktif, ketika udang mati kondisi fisiologis untuk menghambat PPO perlahan menghilang. Udang memiliki aktivitas biologis yang kompleks untuk memacu dan menghambat aktivitas enzim. Enzim PPO dalam tubuh udang memiliki fungsi tertentu dalam kondisi terkendali. Pengendalian kerja enzim dalam tubuh udang salah satunya dibantu dengan keberadaan inhibitor. Oleh karena itu perlu dilakukan penelitian untuk mengekstraksi, mengkarakterisasi dan memurnikan enzim PPO.
Tujuan
Tujuan penelitian ini adalah mengekstraksi dan mengkarakterisasi enzim PPO, serta memurnikan enzim PPO dari udang windu (Penaeus monodon).
Hipotesis Penelitian
Gambar 1 Roadmap penelitian polyphenoloxidase
Sepharose 6B (Garcia-carreno et
al. 2008), Sephadex G-25 (Montero et al. 2001)
Artemia sinica dari Cina (Fan et al.
2011)
Charybdis japonica dari Cina (Fan et
al. 2009)
Penaeus vannamei dari Meksiko
(Garcia-carreno et al. 2008)
Ruditapes philippinarum dari Cina
(Cong et al. 2005)
Penaeus japonicus dari Jepang dan
Spanyol (Benjakul et al. 2005, Montero
et al. 2001)
Norway lobster (
Nephrops
norvegicus
) dari Portugal dan Spanyol (Gimenez et al. 2010)Enzim PPO Murni dari Udang Windu (Penaeus
monodon)
Ekstraksi Enzim PPO dari Udang Windu (Penaeus
4
2 METODE
Waktu dan Tempat
Penelitian dilakukan mulai bulan Februari 2013 sampai Januari 2014 di Laboratorium Karakterisasi Bahan Baku Hasil Perairan, Laboratorium Bioteknologi Hasil Perairan II, Laboratorium Mikrobiologi Hasil Perairan, dan Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan. Fakultas Perikanan dan Ilmu Kelautan; Laboratorium Pendidikan dan Layanan, Fakultas Kedokteran Hewan; Serta Laboratorium Biokimia dan Mikrobiologi Pusat Penelitian Sumberdaya Hayati dan Bioteknologi Institut Pertanian Bogor.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini adalah karapas udang windu
(Penaeus monodon) yang diperoleh dari pasar di daerah Bogor, akuades, bufer
sodium fosfat (pH 7,2) (Merck), NaCl (Merck), Brij 35 (Merck), bufer Tris-HCl (pH 7,4) (AppliChem), dihydroxylphenylalanine (L-DOPA) (Sigma), amonium sulfat (teknis), Sephadex G-150, bahan-bahan pengujian elektroforesis, bovine
serum albumin (AppliChem), comassie briliant blue (AppliChem), etanol
(Merck), asam fosfat (Merck)
Alat-alat yang digunakan pada penelitian ini adalah sentrifuse (Sorvall), spektrofotometer (Yamato), pipet mikro (Axygen), kantong dialisis (Sigma), inkubator (Thermoline), alat elektroforesis, kolom kromatografi dan freezer (LG).
Prosedur Kerja
Penelitian dilakukan dalam dua tahap. Penelitian tahap pertama meliputi tahap ekstraksi dan karakterisasi enzim PPO dari udang windu. Karakterisasi enzim PPO mencakup penentuan pH dan suhu optimum, penentuan konsentrasi substrat optimum, penentuan kinetika enzim, serta pengujian pengaruh ion logam terhadap aktivitas enzim
Penelitian tahap kedua mencakup pemurnian enzim PPO dari udang windu. Pemurnian dilakukan melalui tahap pengendapan dengan amonium sulfat, dilanjutkan dengan dialisis, dan kromatografi filtrasi gel. Hasil pemurnian filtrasi gel diuji aktivitas enzim, kadar protein enzim, bobot molekul enzim, dan zimogram (untuk mengetahui pita protein yang memiliki aktivitas PPO).
Penelitian Tahap Pertama : Ekstraksi dan Karakterisasi Enzim Ekstraksi enzim PPO
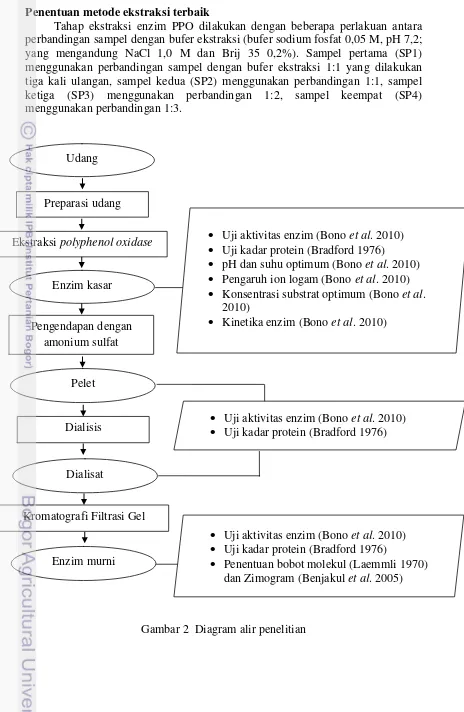
Penentuan metode ekstraksi terbaik
Tahap ekstraksi enzim PPO dilakukan dengan beberapa perlakuan antara perbandingan sampel dengan bufer ekstraksi (bufer sodium fosfat 0,05 M, pH 7,2; yang mengandung NaCl 1,0 M dan Brij 35 0,2%). Sampel pertama (SP1) menggunakan perbandingan sampel dengan bufer ekstraksi 1:1 yang dilakukan tiga kali ulangan, sampel kedua (SP2) menggunakan perbandingan 1:1, sampel ketiga (SP3) menggunakan perbandingan 1:2, sampel keempat (SP4) menggunakan perbandingan 1:3.
Gambar 2 Diagram alir penelitian Udang
Pengendapan dengan amonium sulfat
Uji aktivitas enzim (Bono et al. 2010) Uji kadar protein (Bradford 1976)
pH dan suhu optimum (Bono et al. 2010) Pengaruh ion logam (Bono et al. 2010) Konsentrasi substrat optimum (Bono et al.
2010)
Kinetika enzim (Bono et al. 2010) Preparasi udang
Ekstraksi polyphenol oxidase
Enzim kasar
Dialisis
Kromatografi Filtrasi Gel Dialisat
Uji aktivitas enzim (Bono et al. 2010) Uji kadar protein (Bradford 1976) Pelet
Enzim murni
Uji aktivitas enzim (Bono et al. 2010) Uji kadar protein (Bradford 1976)
6
Penentuan kerja optimum enzim
Optimasi kerja enzim dilakukan untuk melihat waktu konversi substrat pada suhu 30 dan 35°C. Optimasi kerja enzim dilakukan berdasarkan metode Bono
et al. (2010). Sampel diamati setiap 2 menit untuk melihat waktu konversi substrat
pada suhu 30 dan 35°C. Sampel yang telah diinkubasi diukur pada panjang diinkubasi pada suhu 30, 35, 40, 45, 50, 55°C selama 5 menit. Sampel yang telah diinkubasi diukur pada panjang gelombang 475 nm. Aktivitas enzim ditunjukkan dalam satuan U, dengan 1U berarti peningkatan absorban 0,001/ menit.
Penentuan pH optimum
Nilai pH optimum ditentukan menggunakan metode Bono et al. (2010). Sebanyak 0,2 mL enzim ditambahkan dengan 2,8 mL L-DOPA 0,01 M yang dilarutkan dalam bufer fosfat 0,05 M pH 5, 6, 7, 8, 9. Campuran reaksi kemudian diinkubasi pada suhu optimum yang telah diperoleh sebelumnya selama 5 menit. Sampel yang telah diinkubasi diukur pada panjang gelombang 475 nm. Aktivitas enzim ditunjukkan dalam satuan U, dengan 1U berarti peningkatan absorban 0,001/ menit
Pengaruh ion logam dan inhibitor terhadap enzim
Penelitian Tahap Kedua : Pemurnian Enzim Pengendapan dengan amonium sulfat
Amonium sulfat padat ditambahkan dalam supernatan untuk mendapatkan kejenuhan 30-80% dan didiamkan pada suhu 4°C selama 30 menit. Lapisan endapan dikumpulkan dengan sentrifugasi berkecepatan 12.500xg pada suhu 4°C selama 30 menit. Pelet yang diperoleh dilarutkan dalam bufer sodium fosfat 0,05 M pH 7,2 dan didialisis dengan 50 kali volume bufer konsentrasi 0,01 M.
Pengendapan amonium sulfat terbaik ditentukan dengan melihat tingkat kejenuhan yang memberikan aktivitas spesifik tertinggi. Waktu dialisis terbaik ditentukan dengan membandingkan aktivitas spesifik antara waktu dialisis 4 jam dengan 8 jam. Waktu dialisis yang menghasilkan aktivitas spesifik tertinggi ditentukan sebagai waktu dialisis terbaik.
Pemurnian enzim PPO
Pemurnian enzim dilakukan menggunakan Sephadex G-150. Fraksi dikumpulkan sebanyak 3 mL per tabung. Serapan ultraviolet diamati pada panjang gelombang 280 nm. Fraksi yang dihasilkan kemudian diukur aktivitas enzim dan aktivitas proteinnya. Fraksi yang memiliki aktivitas tinggi dikumpulkan dan disebut sebagai fraksi filtrasi gel.
Penentuan bobot molekul
Ekstrak kasar, hasil dialisis, dan fraksi filtrasi gel diuji menggunakan elektroforesis untuk mendapatkan elektroforegram dan zimogram guna menentukan bobot molekul enzim polyphenoloxidase (PPO). Penentuan bobot molekul dilakukan berdasarkan metode Laemmli (1970) sedangkan zimogram dilakukan berdasarkan metode Benjakul et al. (2005).
Analisis
Pengujian Aktivitas Polyphenoloxidase (Bono et al. 2010)
Aktivitas polyphenoloxidase ditentukan dengan mereaksikan 0,2 mL enzim ditambahkan dengan 2,8 mL L-DOPA 0,01 M yang dilarutkan dalam bufer fosfat 0,05 M pH 6,5. Campuran reaksi kemudian diinkubasi pada suhu 35oC selama 5 menit. Sampel yang telah diinkubasi diukur pada panjang gelombang 475 nm. Aktivitas enzim ditunjukkan dalam satuan U, dengan 1U berarti peningkatan absorban 0,001/ menit.
Pengujian Konsentrasi Protein (Bradford 1976)
Persiapan pereaksi Bradford dilakukan dengan cara melarutkan 10 mg
coomasive briliant blue G-250 dalam 5 mL etanol 95%, lalu ditambahkan dengan
10 ml asam fosfat 85% (b/v). Akuades ditambahkan hingga 250 mL jika telah larut sempurna dan disaring dengan kertas saring Whatman 1 sesaat sebelum digunakan.
8
sampel yang didapat kemudian dimasukkan ke dalam kurva standar bradford untuk menentukan konsentrasi protein yang terkandung dalam sampel.
Larutan standar juga diberikan perlakuan seperti larutan sampel. Larutan standar bovine serum albumin (BSA) dibuat dengan konsentrasi 0,01-0,1 mg/mL dari larutan stok BSA konsentrasi 2 mg/ml yang disajikan pada Lampiran 1. Larutan standar digunakan untuk membuat kurva standar BSA.
Pengukuran Bobot Molekul (Laemmli 1970) dan Zimogram (Benjakul et al. 2005)
Metode SDS-PAGE yang dikerjakan dalam penelitian ini menggunakan 4%
stacking gel dan 8% gel akrilamid. Konsentrasi akrilamid yang digunakan dalam
analisis ini adalah 8%. Pewarnaan yang dilakukan adalah Coomassie blue
staining. Deteksi SDS-PAGE dilakukan dengan melepaskan gel hasil
elektroforesis dari cetakan dan diukur jarak migrasi bromphenol blue. Komposisi pembuatan gel penahan dan pemisah SDS-PAGE dapat dilihat pada Lampiran 2.
Fraksi enzim dicampur dengan bufer yang mengandung 1,5M βME dengan perbandingan 1:1 (v/v). Campuran (20 µg protein) dimasukkan ke dalam cetakan gel 7,5%. Elektroforesis dijalankan dengan voltase 120 V menggunakan Conpact PAGE. Setelah pemisahan, satu dari dua gel yang sama direndam dalam bufer McIlvaine pH 6,5 bersisi L-DOPA 15 mM selama 15 jam pada suhu 25°C. Zona
yang menunjukkan aktivitas enzim berwarna hitam. Marker dengan molekul tinggi digunakan untuk memperkirakan berat molekul.
Analisis Data
Analisis data dilakukan menggunakan analisis deskriptif. Rata-rata dan standar deviasi ditentukan menggunakan software microsoft excel. Penelitian dilakukan menggunakan ulangan sebanyak 3 kali.
3 HASIL
DAN
PEMBAHASAN
Tahap Ekstraksi dan Karakterisasi Enzim Polyphenoloxidase
Ekstrak Enzim Polyphenoloxidase
Enzim polyphenoloxidase (PPO) diekstraksi menggunakan bufer sodium fosfat yang mengandung NaCl dan Brij 35. Sampel dihomogenisasi terlebih dahulu sebelum ditambahkan bufer ekstraksi. Sampel udang didinginkan menggunakan nitrogen cair untuk melindungi protein dan mempermudah penghancuran sampel selama proses homogenisasi. Ekstraksi enzim dilakukan menggunakan metode pemisahan dengan sentrifugasi.
Satu Unit memiliki arti terjadi peningkatan absorban sebesar 0,001/menit pada panjang gelombang 475 nm.
Gambar 3 Aktivitas ekstrak PPO dari beberapa bagian udang
Enzim PPO diekstraksi dari karapas udang windu (Penaeus monodon). Ekstraksi enzim PPO menggunakan karapas udang karena aktivitas tertinggi diperoleh dari bagian karapas udang. Hal ini sesuai dengan penelitian yang dilakukan oleh Montero et al. (2001) yang menyatakan PPO banyak ditemukan pada bagian karapas udang. Aktivitas enzim pada karapas menunjukkan hasil yang tinggi. Namun ketika karapas dan kutikel digabung, aktivitas yang dihasilkan menjadi lebih kecil. PPO pada kutikel berada di daerah ventral di pleuron dekat pleopod. Hasil penelitian Zamorano et al. (2009) juga menyebutkan PPO tertinggi ditemukan pada karapas, kemudian diikuti oleh abdominal eksoskeleton, cephalothorax, pleopod, dan telson. Oleh karena itu ekstraksi enzim PPO menggunakan bagian karapas udang.
Daging memiliki aktivitas PPO yang lebih rendah dibandingkan dengan karapas dan abdominal eksoskeleton. Aktivitas PPO yang terdapat pada daging diduga disebabkan oleh kekeruhan pada sampel. Hasil yang sama ditunjukkan oleh Zamorano et al. (2009) yang menyebutkan aktivitas PPO pada daging disebabkan oleh kekeruhan sampel. Zamorano et al. (2009) menyebutkan setelah dilakukan pemurnian sebagian, aktivitas PPO pada daging mengalami penurunan. Ekstraksi enzim kasar dilakukan melalui beberapa tahap optimasi. Tahapan ini merupakan modifikasi dari metode yang dilakukan oleh Simpson et al. (1987). Metode tersebut menggunakan perbandingan sampel dengan bufer sebesar 1:3. Modifikasi perbandingan sampel dengan bufer pada penelitian ini adalah menggunakan perbandingan 1:1 yang dilakukan secara berulang (SP1), perbandingan 1:1 (SP2), perbandingan 1:2 (SP3), perbandingan 1:3 (SP4).
10
Ekstrak enzim SP1 selanjutnya diuji untuk mengetahui aktivitas spesifik dari masing-masing tingkatan ekstraksi. Hasil uji memperlihatkan bahwa dari masing-masing tahap ekstraksi aktivitas spesifik yang diperlihatkan masih tinggi. Hal ini menunjukkan bahwa pada ekstraksi tahap pertama belum terekstrak seluruh protein pada sampel, sehingga pada ekstraksi tahap kedua dan ketiga masih ditemukan aktivitas spesifik yang tidak berbeda jauh dengan ekstrak tahap pertama.
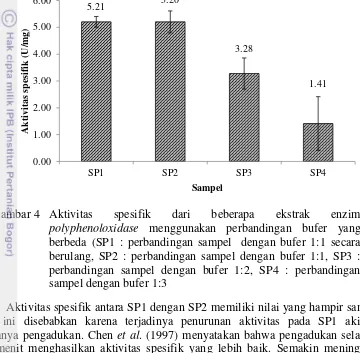
Gambar 4 Aktivitas spesifik dari beberapa ekstrak enzim
polyphenoloxidase menggunakan perbandingan bufer yang
berbeda (SP1 : perbandingan sampel dengan bufer 1:1 secara berulang, SP2 : perbandingan sampel dengan bufer 1:1, SP3 : perbandingan sampel dengan bufer 1:2, SP4 : perbandingan sampel dengan bufer 1:3
Aktivitas spesifik antara SP1 dengan SP2 memiliki nilai yang hampir sama. Hal ini disebabkan karena terjadinya penurunan aktivitas pada SP1 akibat lamanya pengadukan. Chen et al. (1997) menyatakan bahwa pengadukan selama 30 menit menghasilkan aktivitas spesifik yang lebih baik. Semakin meningkat waktu pengadukan aktivitas spesifik mengalami penurunan. Jaringan udang mengalami pemisahan selama ekstraksi dan selama proses tersebut reaksi
browning terjadi. Pembentukan pigmen juga terjadi selama ekstraksi.
Pembentukan pigmen tersebut dapat menyebabkan pengendapan dan enzim menjadi inaktif.
Hasil pengujian total protein yang terdapat pada ekstrak enzim PPO menunjukkan bahwa ekstrak SP1 memiliki yield yang paling tinggi dibandingkan dengan SP2, SP3, dan SP4. Yield SP1 sebesar 100%, sedangkan yield SP2, SP3, dan SP4 berturut-turut adalah sebesar 32,43%, 28,83%, dan 21,62%. Hal ini menunjukkan bahwa dengan melakukan ekstraksi secara berulang protein yang diperoleh lebih tinggi dibandingkan dengan ekstraksi tunggal. Zamorano et al. (2009) menyebutkan semakin lama proeses ekstraksi jumlah protein yang terekstrak akan semakin meningkat, namun rentan terjadi penurunan aktivitas, sehingga harus ditambahkan bahan-bahan pelindung selama ekstraksi seperti
inhibitor. Yield enzim PPO dari beberapa ekstrak enzim menggunakan perbandingan bufer yang berbeda ditunjukkan pada Tabel 1.
Tabel 1 Yield enzim PPO yang diekstrak menggunakan perbandingan bufer yang berbeda
Metode ekstraksi terbaik untuk memproduksi enzim PPO udang windu
(Penaeus monodon) adalah menggunakan perbandingan bufer 1:1 yang dilakukan
secara berulang. Kesimpulan ini ditarik dengan mempertimbangkan aktivitas spesifik yang dihasilkan dan yield protein enzim.
Optimasi Kerja Enzim
Optimasi kerja enzim dilakukan untuk mengetahui waktu konversi substrat L-DOPA menjadi produk. Absorban sampel diukur pada panjang gelombang 475 nm selama beberapa menit. Absorban dipantau sampai laju konversi substrat menjadi produk mengalami penurunan. Hasil penelitian menunjukkan bahwa semakin lama waktu inkubasi nilai absorban sampel akan semakin besar. Namun rasio perubahan absorbansi dengan waktu semakin lama semakin menurun, yang berarti bahwa jumlah substrat yang bisa dikonversi menjadi produk semakin kecil. Peningkatan absorban sampel pada suhu 30 dan 35°C ditunjukkan pada Gambar 5.
(A) (B)
Gambar 5 Peningkatan absorbansi sampel yang diinkubasi pada suhu 30°C (A) dan suhu 35°C (B)
Kecepatan awal reaksi antara substrat dengan enzim pada awalnya tinggi namun menurun seiring dengan penambahan waktu inkubasi. Hasil pengujian
12
menunjukkan konversi substrat menjadi produk tidak mengalami fase lag. Hal ini memberikan informasi bahwa produk langsung diubah menjadi quinon. Garcia-carreno et al. (2008) menyebutkan fase lag muncul pada reaksi enzim oleh tirosinase dan tidak muncul pada oksidasi L-DOPA menjadi quinon.
Suhu inkubasi berpengaruh terhadap peningkatan absorbansi sampel. Suhu 35°C memberikan laju peningkatan yang lebih besar dibandingkan suhu 30°C. Laju peningkatan absorbansi di dua menit pertama untuk suhu 35°C adalah 0,004 sedangkan pada suhu 30°C sebesar 0,003. Laju peningkatan absorbansi sampel berhubungan dengan suhu optimum aktivitas enzim. Semakin tinggi suhu inkubasi maka pergerakan partikel enzim dengan substrat akan makin besar sehingga peluang untuk bereaksi makin tinggi. Penelitian yang dilakukan oleh Benjakul
et al. (2005) menyebutkan phenoloxidase (PO) dari cephalothoraxkuruma prawn
(Penaeus japonicus) memiliki aktivitas maksimum pada suhu 35°C.
Suhu Optimum Ekstrak Enzim PPO
Suhu merupakan salah satu faktor yang berperan penting dalam reaksi enzimatis. Suhu dapat meningkatkan pergerakan partikel dan memperbesar peluang antara substrat dan enzim untuk bereaksi. Peningkatan suhu inkubasi mampu meningkatkan aktivitas namun pada suhu tertentu aktivitas akan menurun akibat perubahan konformasi enzim dan substrat. Hampir semua enzim mengalami denaturasi apabila dipanaskan diatas suhu fisiologisnya. Aktivitas mengalami penurunan akibat adanya denaturasi (Leskovac 2004).
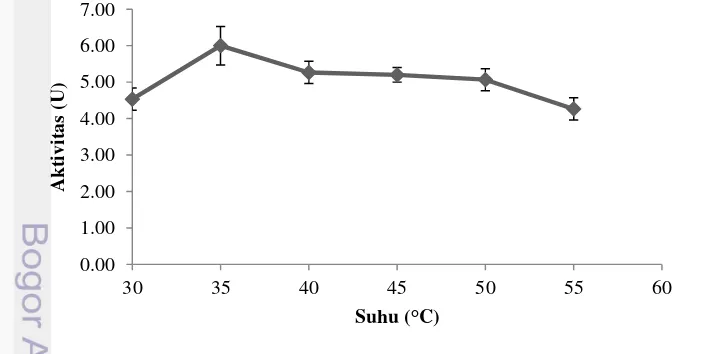
Suhu inkubasi mempengaruhi aktivitas enzim PPO. Peningkatan aktivitas enzim terlihat ketika suhu dinaikkan menjadi 35°C, namun mengalami penurunan aktivitas ketika enzim diinkubasi diatas suhu 35°C (Gambar 6). Enzim PPO diduga masih stabil pada kisaran suhu tersebut sehingga penurunan aktivitas yang ditunjukkan tidak terlalu jauh.
Gambar 6 Suhu optimum aktivitas enzim polyphenoloxidase
Montero et al. (2001) menyebutkan PPO menunjukkan aktivitas tertinggi antara suhu 40 dan 60°C, tetapi stabil pada suhu 35°C. Gimenez et al. (2010) menyatakan aktivitas PPO yang ditemukan pada karapas dan ekstrak jeroan
Norway lobster (Nephrops norvegicus) meningkat sebanding dengan peningkatan
suhu hingga 60°C. Ekstrak karapas menunjukkan kestabilan pada suhu 45°C. Zamorano et al. (2009) melaporkan tidak ada kisaran maksimum yang jelas pada
suhu 15-60°C tetapi stabilitas yang tinggi dicapai pada suhu 30-35°C. Cong et al. (2005) menyatakan PO dari hemolymph Ruditapes philippinarum
memiliki aktivitas tertinggi pada suhu 40°C.
Pengujian aktivitas enzim di atas suhu 55°C tidak dilakukan karena enzim mengalami otooksidasi. Zamorano et al. (2009) menyebutkan bahwa suhu inkubasi diatas 60°C sebaiknya dihindari karena meningkatkan oksidasi L-DOPA tanpa keberadaan enzim PPO. Stabilitas PPO tertinggi diperoleh pada kisaran suhu 30-35°C, dan tidak ada aktivitas ketika diinkubasi pada suhu 70°C. Penelitian yang dilakukan oleh Manheem et al. (2012) menunjukkan bahwa kehilangan aktivitas PPO tertinggi ditemukan ketika enzim dipanaskan pada suhu 80°C dan 90°C. Ketika suhu yang digunakan berkisar antara 50-70°C penurunan aktivitas yang terjadi tidak berbeda nyata. Namun peningkatan aktivitas terjadi ketika enzim dipanaskan pada suhu 40°C. Manheem et al. (2012) menyebutkan bahwa terdapat hubungan antara protease dengan enzim PPO dimana protease meningkatkan aktivitas PPO pada suhu 40°C. PPO merupakan enzim yang stabil terhadap panas dan berperan terhadap terjadinya melanosis selama penyimpanan. Nilai pH Optimum Ekstrak Enzim PPO
Semua reaksi enzim dipengaruhi oleh pH medium tempat reaksi terjadi. Oleh karena itu pada setiap percobaan dengan enzim diperlukan bufer untuk mengontrol pH reaksi. Penentuan pH optimum merupakan tahap awal untuk menentukan bufer yang tepat untuk reaksi enzim. Kekuatan penyangga dari bufer baik ketika mendekati pK maka bufer harus digunakan mendekati nilai tersebut (Stoll dan Blanchard 2009).
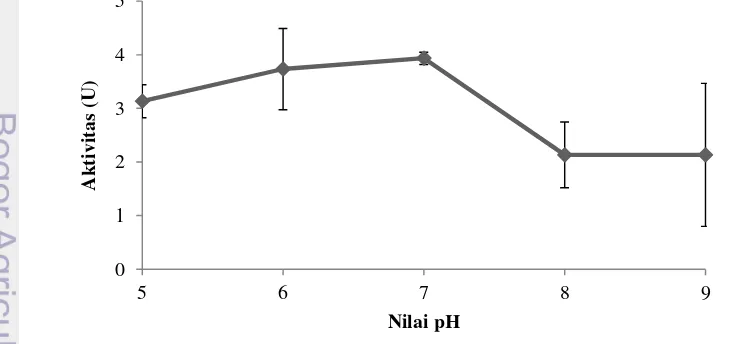
Enzim PPO diinkubasi pada bufer dengan nilai pH yang berbeda-beda. Bufer sodium fosfat pH 5-9 digunakan untuk melarutkan substrat dan diinkubasi bersama enzim PPO. Hasil penelitian menunjukkan enzim PPO mencapai aktivitas optimum pada pH 7. Aktivitas enzim diatas atau dibawah nilai pH tersebut menunjukkan nilai yang lebih kecil (Gambar 7). Montero et al. (2001) menyebutkan enzim PPO tidak stabil pada pH dibawah 5. Hal ini menggambarkan bahwa PPO mampu dihambat pada pH asam.
Gambar 7 pH optimum aktivitas enzim polyphenoloxidase
PPO merupakan enzim yang tidak stabil pada pH rendah dan inaktif pada pH dibawah 3. Perbedaan pH optimum disebabkan oleh perbedaan sumber enzim,
14
perbedaan kematangan sumber enzim, dan perbedaan substrat. pH berhubungan dengan konsentrasi substrat karena pH memberikan efek pada stabilitas substrat. Konsentrasi substrat dapat mengalami pernurunan akibat pemecahan oleh pH.
Benjakul et al. (2005) menyebutkan enzim PO dari cephalothorax kuruma
prawn (Penaeus japonicus) memiliki aktivitas maksimum pada pH 6,5 dan stabil
pada kisaran pH 3-10. Montero et al. (2001) menyatakan polyphenoloxidase menunjukkan aktivitas spesifik yang berbeda pada beberapa lokasi di tubuh tiger
prawn dan aktif pada pH 5 serta 8. Zamorano et al. (2009) melaporkan
karakterisasi dan distribusi jaringan PPO pada deepwater pink shrimp
(Parapenaeus longirostris) setelah mati. Enzim memiliki aktivitas tertinggi pada
pH 4,5 serta stabil pada pH 4,5 dan 9,0. Cong et al. (2005) menyatakan PO dari
hemolymph Ruditapes philippinarum optimum pada pH 7. Simpson et al. (1987)
menyatakan bahwa enzim PO yang diekstraksi dari Penaeus setiferus aktif pada pH 6,5-7,5 stabil pada pH 8, dan tidak stabil pada pH asam. Perbedaan kondisi optimum enzim phenoloxidase bergantung pada sumber enzim dan substrat yang digunakan.
Kinetika Enzim PPO
Enzim merupakan protein yang memiliki sifat unik. Enzim bersifat spesifik terhadap substrat tertentu. Sifat spesifik tersebut menyebabkan enzim hanya dapat bereaksi untuk menghasilkan produk dengan substrat yang cocok. Kinetika enzim dipelajari untuk melihat mekanisme reaksi antara enzim dan substrat yang cocok (Whitaker 2003).
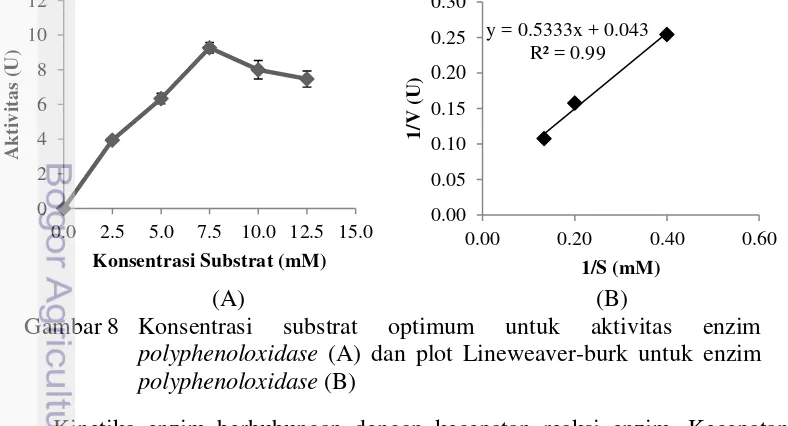
Konsentrasi substrat yang menghasilkan aktivitas kerja enzim optimum adalah sebesar 7,5 mM. Konsentrasi substrat dibawah 7,5 mM menunjukkan aktivitas enzim yang terus meningkat, namun ketika konsentrasi substrat dinaikkan diatas konsentrasi 7,5 mM aktivitas enzim mengalami penurunan (Gambar 8A). Penurunan aktivitas tersebut diduga disebabkan oleh penghambatan produk sebagai hasil reaksi enzimatis.
(A) (B)
Gambar 8 Konsentrasi substrat optimum untuk aktivitas enzim
polyphenoloxidase (A) dan plot Lineweaver-burk untuk enzim
polyphenoloxidase (B)
Kinetika enzim berhubungan dengan kecepatan reaksi enzim. Kecepatan reaksi enzim berhubungan dengan konsentrasi substrat yang ditambahkan. Konsentrasi substrat yang rendah menyebabkan kecepatan reaksi meningkat
seiring dengan penambahan substrat. Kecepatan reaksi konstan (bahkan menurun) ketika konsentrasi substrat sudah jenuh (Whitaker 2003).
Kinetika enzim berdasarkan persamaan Lineweaver-Burk menunjukkan bahwa Km App enzim PPO dari Penaeus monodon sebesar 1.24 mM dengan Vmaks App 23,26 U (Gambar 8B). Beberapa penelitian menunjukkan informasi mengenai Km dari enzim PPO misalnya pada Ruditapes philippinarum sebesar 2,2 mmol/L (Cong et al. 2005), Charybdis japonica sebesar 2,90 mM (Fan et al. 2009), Penaeus vannamei sebesar 1,47 mM (Garcia-Carreno et al. 2008),
Parapenaeus longirostris sebesar 1,85 mM (Zamorano et al. 2009). Nilai Km
dipengaruhi oleh ekstrak enzim PPO masih kasar sehingga diduga pengotor didalamnya masih banyak. Metode pemurnian dapat digunakan untuk meningkatkan aktivitas spesifik enzim PPO.
Substrat yang digunakan untuk pengujian kinetika enzim adalah L-DOPA dengan berbagai konsentrasi. L-DOPA memiliki kemampuan berikatan yang lebih baik dibandingkan dengan substrat lain. Cong et al. (2005) menyebutkan bahwa afinitas L-DOPA dengan enzim lebih tinggi dibandingkan dengan substrat lain, yaitu tirosin. Hal ini dibuktikan dari nilai Km untuk substrat L-DOPA lebih kecil dibandingkan dengan tirosin.
Polyphenoloxidase (1,2-benzenediol : Oxygen Oxidoreductase; EC.
1.10.3.1) merupakan enzim yang mengandung Cu, yang juga dikenal dengan
catechol oxidase, catecholase, diphenol oxidase, o-diphenolase, phenolase, dan
tyrosinase (Martinez dan Whitaker 1995). Polyphenoloxidase bertanggung jawab
untuk mengkatalis terjadinya dua reaksi dasar. Enzim mengkatalis hidroksilasi ke posisi O yang berdekatan dengan hidroksil yang lain menggunakan substrat berupa fenol dan O2. Reaksi kedua adalah oksidasi dari diphenol menjadi
o-benzoquinon, yang selanjutnya teroksidasi menjadi melanin (produk berwarna
coklat) biasanya melalui mekanisme non enzimatis (Kim et al. 2000). Pengaruh Ion Logam terhadap Aktivitas Enzim
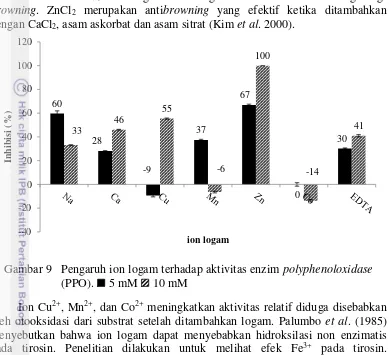
Ion logam dapat mempengaruhi aktivitas enzim PPO. Ion logam dapat meningkatkan atau menurukan aktivitas enzim setelah berinteraksi dengan enzim. Ion logam yang meningkatkan aktivitas enzim disebut dengan aktivator sedangkan yang menurunkan aktivitas enzim disebut dengan inhibitor. Ion logam yang mempengaruhi kerja aktivitas enzim PPO dapat dilihat pada Gambar 9.
Gambar 9 menunjukkan pengaruh beberapa logam terhadap enzim PPO. Aktivitas PPO dihambat oleh ion logam Na+, Ca2+, Zn2+, dan EDTA dengan konsentrasi 5 dan 10 mM; Cu2+ dengan konsentrasi 10 mM; dan Mn2+ dengan konsentrasi 5 mM. Aktivitas PPO mengalami peningkatan setelah ditambahkan dengan Cu2+ 5 mM, Mn2+ 10 mM, serta Co2+ dengan konsentrasi 5 dan 10 mM.
Pengkelat logam EDTA mampu menurunkan aktivitas enzim dengan penghambatan sebesar 30% (konsentrasi 5 mM) dan 41% (konsentrasi 10 mM). EDTA merupakan pengkelat logam yang kuat. Kompleks yang stabil dapat terbentuk akibat reaksi antara EDTA dengan ion logam seperti besi, tembaga, dan kalsium. Kemampuan mengkelat logam semakin tinggi pada pH tinggi. Penghambatan oleh EDTA disebabkan oleh terikatnya ion Cu2+ yang diperlukan oleh enzim PPO.
16
garam-garam halida menurun seiring dengan peningkatan pH. Aktivitas PPO menurun seiring dengan peningkatan konsentrasi NaCl. Garam NaCl dan CaCl2 pada konsentrasi 2-4% biasa digunakan sebagai inhibitor PPO untuk mengurangi
browning. ZnCl2 merupakan antibrowning yang efektif ketika ditambahkan
dengan CaCl2, asam askorbat dan asam sitrat (Kim et al. 2000).
Gambar 9 Pengaruh ion logam terhadap aktivitas enzim polyphenoloxidase (PPO). 5 mM 10 mM
Ion Cu2+, Mn2+, dan Co2+ meningkatkan aktivitas relatif diduga disebabkan oleh otooksidasi dari substrat setelah ditambahkan logam. Palumbo et al. (1985) menyebutkan bahwa ion logam dapat menyebabkan hidroksilasi non enzimatis pada tirosin. Penelitian dilakukan untuk melihat efek Fe3+ pada tirosin. Hidroksilasi menyebabkan perubahan struktur dari DOPA.
Ion Cu2+ dan Mn2+ memberikan efek pernurunan aktivitas relatif pada konsentrasi tertentu. Peningkatan aktivitas relatif juga dihasilkan oleh ion logam tersebut. Hal ini diduga disebabkan oleh konsentrasi dari ion logam yang diberikan. PPO merupakan enzim yang bergantung pada ion Cu2+, namun kelebihan ion Cu2+ diduga menimbulkan efek inhibitor. Palumbo et al. (1985) menjelaskan ion Cu2+ dan Mn2+ memiliki efek inhibitor tetapi tergantung pada konsentrasi, namun belum diketahui bagaimana mode aksi yang terjadi antara ion tersebut dengan enzim.
Penelitian yang dilakukan oleh Cong et al. (2005) menyebutkan bahwa logam Cu2+, Zn2+, Ca2+ menghambat aktivitas kerja enzim PO. Zn2+ menghambat aktivitas PO Ruditapes tertinggi pada konsentrasi 1 mM. Demikian halnya dengan EDTA menghambat aktivitas PPO sebesar 100% pada konsentrasi 10 mM. Penelitian yang dilakukan oleh Fan et al. (2009) menyatakan bahwa Cu, Zn, Ca, Mg, dan EDTA juga menghambat enzim PPO. EDTA dengan konsentrasi 10 mM menghambat enzim sampai 100%. Hasil tersebut menyatakan bahwa PPO merupakan jenis metaloenzim.
Selain beberapa ion logam, enzim PPO juga bisa dihambat oleh beberapa inhibitor protease. Protease bisa dihambat oleh beberapa ion logam. Ferrer et al. (1989) menyatakan ekstrak PO kasar umumnya memiliki aktivitas yang rendah.
Semua protease inhibitor mencegah aktivasi PO. Benjakul et al. (2006) menyatakan sistein dan glutation menunjukkan aktivitas penghambatan pada PO
kuruma prawn.
Tahap Pemurnian Enzim Polyphenoloxidase
Fraksi Amonium Sulfat Enzim PPO
Pengendapan dilakukan menggunakan garam amonium sulfat. Keunggulan menggunakan amonium sulfat adalah memiliki kelarutan tinggi dan umumnya tidak mempengaruhi struktur protein. Garam dapat menurunkan atau meningkatkan kelarutan protein. Penambahan garam akan memengaruhi kekuatan ion dalam larutan, yang berpengaruh terhadap kelarutan protein. Protein dapat diendapkan menggunakan garam dengan konsentrasi tinggi (salting out) (Kusnandar 2010).
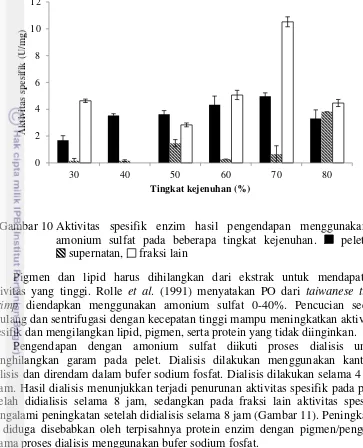
Pengendapan dengan amonium sulfat dilakukan pada ekstrak kasar enzim PPO. Supernatan hasil ekstraksi enzim ditambahkan amonium sulfat dengan kejenuhan tertentu. Tingkat kejenuhan yang digunakan pada saat pengendapan adalah 30-80%. Hasil pengendapan diukur aktivitas enzim dan kadar protein untuk menentukan aktivitas spesifik enzim (Gambar 10).
Hasil pengendapan dengan amonium sulfat menunjukkan tiga bagian yang terpisah satu sama lain. Bagian-bagian tersebut antara lain pelet, supernatan dan bagian yang menggumpal, namun tidak mengendap (fraksi lain). Aktivitas spesifik pelet tertinggi ditemukan pada sampel yang diendapkan menggunakan amonium sulfat dengan kejenuhan 70%. Supernatan menunjukkan aktivitas yang rendah. Berbeda dengan pelet dan supernatan, fraksi lain yang menggumpal ditemukan memiliki aktivitas yang tinggi, terutama ketika diendapkan menggunakan amonium sulfat dengan kejenuhan 70%. Fraksi lain ini diduga merupakan enzim yang masih berikatan dengan senyawa lain.
Zamorano et al. (2009) menyatakan kisaran terbaik untuk pengendapan dengan amonium sulfat tergantung pada spesies yang berdampak pada perbedaan karakteristik biokimia enzim PPO dari sumber yang berbeda. Aktivitas PPO dari
deepwater pink shrimp terbaik ketika diendapkan menggunakan amonium sulfat
dengan kejenuhan 40-70%. Penelitian yang dilakukan oleh Montero et al. (2001) menyebutkan bahwa aktivitas tertinggi ditemukan pada pengendapan menggunakan amonium sulfat 0-40%. Aktivitas relatif enzim hasil pengendapan menunjukkan peningkatan tujuh kali lebih besar dibandingkan ekstrak kasar. Fraksi pengendapan 40-70% menunjukkan aktivitas relatif sebesar 5-10% dibandingkan dengan fraksi 0-40%.
18
Gambar 10 Aktivitas spesifik enzim hasil pengendapan menggunakan amonium sulfat pada beberapa tingkat kejenuhan. pelet,
supernatan, fraksi lain
Pigmen dan lipid harus dihilangkan dari ekstrak untuk mendapatkan aktivitas yang tinggi. Rolle et al. (1991) menyatakan PO dari taiwanese tiger
shrimp diendapkan menggunakan amonium sulfat 0-40%. Pencucian secara
berulang dan sentrifugasi dengan kecepatan tinggi mampu meningkatkan aktivitas spesifik dan mengilangkan lipid, pigmen, serta protein yang tidak diinginkan.
Pengendapan dengan amonium sulfat diikuti proses dialisis untuk menghilangkan garam pada pelet. Dialisis dilakukan menggunakan kantong dialisis dan direndam dalam bufer sodium fosfat. Dialisis dilakukan selama 4 dan 8 jam. Hasil dialisis menunjukkan terjadi penurunan aktivitas spesifik pada pelet setelah didialisis selama 8 jam, sedangkan pada fraksi lain aktivitas spesifik mengalami peningkatan setelah didialisis selama 8 jam (Gambar 11). Peningkatan ini diduga disebabkan oleh terpisahnya protein enzim dengan pigmen/pengotor selama proses dialisis menggunakan bufer sodium fosfat.
Penurunan aktivitas enzim setelah dialisis terjadi karena enzim PPO merupakan enzim yang tidak stabil. Adachi et al. (2004) menyebutkan PO dan prekursornya (proPO) tidak stabil dan mengalami kehilangan aktivitas ketika disimpan selama seminggu. Namun berbeda halnya dengan hemocyanin yang memiliki persamaan dengan PO, pigmen ini lebih stabil dibandingkan dengan PO.
Enzim selama proses dialisis sangat rentan kehilangan aktivitas. Hal ini terjadi karena proses dialisis memerlukan waktu yang cukup lama untuk menghilangkan garam-garam amonium sulfat. Proses dialisis biasanya dilakukan selama beberapa jam hingga satu malam. Montero et al. (2001) juga menyatakan bahwa dialisis menyebabkan kehilangan aktivitas enzim karena dilakukan setidaknya selama 8 jam. Oleh karena itu kolom desalting merupakan solusi yang tepat karena prosesnya lebih cepat (5-10 menit).
Gambar 11 Aktivitas spesifik hasil dialisis enzim polyphenoloxidase dari udang windu (Penaeus monodon). 4 jam, 8 jam
Hasil pengendapan dengan amonium sulfat menghasilkan tiga bagian yang terpisah satu sama lain. Bagian-bagian tersebut antara lain pelet, supernatan dan bagian yang menggumpal, namun tidak mengendap (fraksi lain). Fraksi lain diduga merupakan protein yang belum mengendap secara sempurna. Pengujian menggunakan SDS PAGE dan zimogram dilakukan untuk melihat pola pita-pita protein pada sampel. Elektroforegram ekstrak kasar, pelet dan fraksi lain dapat dilihat pada Gambar 12.
(A) (B)
Gambar 12 Elektroforegram (A) dan zimogram (B) enzim PPO (M : marker, K : ekstrak kasar, DP : dialisis pelet, DL : dialisis fraksi lain) Pengujian SDS PAGE pada tahap ini bertujuan untuk melihat pola pita-pita protein pelet dan fraksi lain hasil pengendapan menggunakan amonium sulfat. Hasil elektroforesis dengan pewarnaan Coomassie briliant blue menunjukkan
0.00 0.50 1.00 1.50 2.00 2.50 3.00 3.50 4.00 4.50
Pelet Fraksi Lain
Ak
tiv
it
a
s
spes
if
ik
(
U/m
g
)
20
beberapa pita yang masih belum terpisah. Pola yang ditunjukkan oleh hasil elektroforesis menunjukkan bahwa ekstrak kasar, hasil dialisis pelet dan hasil dialisis fraksi lain memiliki pola pita yang sama. Kesimpulan yang diperoleh dari pengujian menunjukkan pelet dan fraksi lain memiliki pita-pita yang sama. Fraksi lain yang belum terpisah sempurna dengan supernatan diduga merupakan protein yang masih berikatan dengan pigmen.
Pewarnaan menggunakan Comassie briliant blue menunjukkan pita-pita hasil denaturasi protein menggunakan SDS. Pengujian selanjutnya menggunakan substrat L-DOPA untuk melihat pita yang memiliki aktivitas enzim PPO. Pengujian menggunakan substrat L-DOPA yang dilarutkan menggunakan bufer McIlvaine menunjukkan enzim PPO memiliki 2 sub unit (Gambar 12B).
Hasil Pemurnian Enzim PPO
Ekstrak kasar dan hasil pengendapan dengan amonium sulfat masih mengandung komponen-komponen protein yang bukan enzim. Pemurnian enzim merupakan salah satu cara untuk dapat memperoleh enzim yang lebih murni. Salah satu cara yang efektif untuk pemurnian enzim adalah dengan kromatografi kolom. Kromatografi kolom dapat didefinisikan sebagai sistem pengaliran suatu fluida melalui kolom yang mengandung matrik bahan pengisi dan substansi yang ingin dipisahkan menjadi beberapa komponen dengan adanya perbedaan daya ikat terhadap bahan pengisi.
Penelitian ini menggunakan kromatografi filtrasi gel. Kromatografi filtrasi gel menggunakan bahan pengisi yang merupakan gel yang berpori-pori. Pori-pori pada permukaan gel cukup kecil sehingga mencegah molekul-molekul besar masuk ke dalamnya, tetapi dapat menampung molekul-molekul yang lebih kecil. Penelitian ini menggunakan bahan pengisi Sephadex G-150. Sephadex G-150 mampu memisahkan protein dari selang 5-300 kDa (Stellwagen 2009)
Pemurnian menggunakan kromatografi filtrasi gel menghasilkan fraksi-fraksi enzim yang telah terpisah. Fraksi-fraksi-fraksi tersebut selanjutnya diukur aktivitasnya. Kadar protein enzim juga ditentukan untuk melihat kandungan protein dalam enzim. Hasil pengujian aktivitas enzim menunjukkan bahwa fraksi 6 menunjukkan aktivitas tertinggi. Fraksi 5-9 selanjutnya digunakan untuk menguji bobot molekul enzim PPO (Gambar 13).
Gambar 13 Fraksi-fraksi hasil pemurnian enzim menggunakan filtrasi gel. aktivitas enzim, kadar protein enzim
Penapisan awal perlu dilakukan untuk melihat bobot molekul protein yang akan dimurnikan. Pengujian menggunakan zimogram (Gambar 12B) menunjukkan enzim PPO memiliki dua sub unit. Pemurnian menggunakan filtrasi gel diharapkan mendapatkan dua puncak pada grafik fraksi-fraksi hasil pemurnian (Gambar 13). Hasil penelitian menunjukkan enzim PPO memiliki bobot molekul besar karena aktivitas tertinggi terdapat pada fraksi awal. Protein dengan bobot molekul yang besar akan terelusi terlebih dahulu, kemudian diikuti oleh protein dengan bobot molekul kecil. Fraksi awal pemurnian membentuk satu puncak diduga disebabkan oleh penggunaan matrik yang memiliki fractination range panjang dan flow rate saat pemurnian.
Resolusi pemisahan pada pemurnian filtrasi gel dipengaruhi oleh flow rate,
bead size, dan fractination range. Menurunkan flow rate dapat meningkatkan
resolusi pemisahan, bead size yang memiliki diameter lebih rendah dapat meningkatkan resolusi, matrik yang memiliki fractination range lebih pendek dapat meningkatkan ketepatan pemurnian (Stellwagen 2009). Protein dengan bobot molekul yang besar menyebar lebih dekat dibandingkan dengan molekul kecil yang menyebar lebih jauh. Molekul kecil memiliki koefisien difusi lebih tinggi sehingga menyebar lebih jauh (Cutler 2003).
Fraksi enzim PPO diuji untuk melihat kemurnian enzim. Efektivitas pemurnian enzim dapat dilihat dari kelipatan pemurnian yang dicapai pada setiap tahap produksi enzim. Semakin tinggi tahap pemurnian yang dilakukan akan menghasilkan aktivitas spesifik yang meningkat.
Hasil pemurnian menunjukkan peningkatan aktivitas spesifik jika dibandingkan dengan ekstrak kasar, namun peningkatan aktivitas yang dihasilkan masih belum optimal. Hasil pengendapan menggunakan amonium sulfat dengan kejenuhan 70% memberikan kelipatan pemurnian sebesar 1,27 kali. Penurunan terjadi setelah enzim mengalami proses dialisis. Kelipatan pemurnian enzim hasil dialisis adalah sebesar 1,23 kali. Pemurnian menggunakan kromatografi filtrasi gel diharapkan memberikan kelipatan pemurnian yang lebih baik. Kelipatan pemurnian fraksi 6 hasil kromatografi filtrasi gel memberikan kelipatan pemurnian sebesar 1,64 kali (Tabel 2).
Tabel 2 Hasil analisis kelipatan pemurnian enzim polyphenoloxidase
Tahapan Volume
Beberapa penelitian telah dilakukan untuk memurnikan enzim
polyphenoloxidase (PPO). Cong et al. (2005) menggunakan Q Sepharose FF
22
dimurnikan menggunakan Q Sepharose FF adalah sebesar 3 kali, setelah dimurnikan menggunakan Sephacryl S-100 kelipatan pemurnian mencapai 62,5 kali.
Fan et al. (2011) menggunakan Superdex 200 untuk memurnikan enzim
PPO dari Artemia sinica. Proses dilanjutkan menggunakan Q Sepharose FF dan
Superdex 200. Kelipatan pemurnian enzim menggunakan Superdex 200 mencapai
3,94 kali. Kemurnian meningkat menjadi 18,73 kali setelah dimurnikan menggunakan Q Sepharose FF. Permurnian dilanjutkan dengan Superdex 200 dan kelipatan pemurnian meningkat menjadi 53,87 kali. Pang et al. (2005) menggunakan Sephadex G-200 dan DEAE-FF untuk memurnikan enzim PPO dari
Branchiostoma belcheri tsingtauense. Kelipatan pemurnian yang diperoleh setelah
dimurnikan menggunakan Sephadex G-200 sebesar 12,8 kali. Tingkat kemurnian meningkat menjadi 60 kali setelah dimurnikan menggunakan DEAE-FF. Zibaee
et al. (2011) menggunakan Sephadex G-100 dan CM-Sepharose untuk
memurnikan enzim. Kelipatan pemurnian yang diperoleh setelah dimurnikan menggunakan Sephadex G 100 sebesar 2,85 kali. Tahap akhir pemurnian menunjukkan kelipatan pemurnian meningkat menjadi 7,31 kali dengan aktivitas spesifik sebesar 4,952 U/mg.
Kelipatan pemurnian yang dihasilkan setelah proses pemurnian menggunakan kromatografi filtrasi gel cukup rendah jika dibandingkan dengan beberapa penelitian yang telah dilakukan. hal ini diduga disebabkan oleh tahap pemurnian yang dilakukan hanya menggunakan filtrasi gel, sehingga pemurniannya belum optimal. Proses dialisis yang dilakukan sebelum proses pemurnian menunjukkan penurunan aktivitas spesifik jika dibandingkan dengan proses pengendapan menggunakan amonium sulfat 70%. Penurunan aktivitas spesifik ini diduga ikut berperan dalam menentukan kelipatan pemurnian pada filtrasi gel. Enzim hasil permurnian dan dialisis memiliki sifat yang tidak stabil. Hal ini sesuai dengan yang disebutkan oleh Adachi et al. (2004), enzim PO dan ProPO merupakan enzim yang sangat tidak stabil dan kehilangan aktivitas ketika disimpan selama seminggu.
Hasil Elektroforesis Enzim PPO
Elektroforesis merupakan suatu cara untuk memisahkan fraksi-fraksi berdasarkan pergerakan partikel koloid bermuatan karena pengaruh medan listrik. Teknik elektroforesis yang bermanfaat dalam pemisahan protein adalah elektroforesis gel. SDS PAGE merupakan salah satu teknik elektroforesis yang menggunakan polimer poliakrilamid dan dengan penambahan SDS (Sodium Dodesil Sulfat).
SDS PAGE dilakukan untuk melihat pita-pita yang terdapat pada enzim PPO. Pita-pita akan terpisah dan membentuk pola berdasarkan bobot molekulnya. Elektroforesis juga dilakukan untuk melihat aktivitas PPO terhadap substrat, sehingga terlihat fraksi yang memiliki aktivitas enzim dan dapat diduga bahwa fraksi dengan bobot molekul tersebut merupakan enzim PPO.
Fraksi 5-9 hasil pemurnian masih memiliki banyak pita yang terlihat dari hasil elektroforesis. Hasil elektroforesis menunjukkan pemurnian masih belum optimal karena jumlah pita masih terlalu banyak. Pita-pita yang ditemukan pada fraksi 5-9 adalah 222,03 kDa, 183,12 kDa, 88,91 kDa, 80,75 kDa, 69,88 kDa, 63,46 kDa, 60,48 kDa, serta pita-pita dengan bobot molekul dibawah 60 kDa.
Gambar 14 Elektroforegram enzim PPO fraksi kromatografi filtrasi gel (M : marker, K : ekstrak kasar, D : dialisis, F5-F9 : fraksi 5-9 filtrasi gel)
Pengujian aktivitas menggunakan L-DOPA (zimogram) menunjukkan enzim PPO dalam bentuk kasar dan hasil dialisis memiliki bobot molekul sebesar 258,29 kDa dan 222,05 kDa. Hal yang berbeda diperlihatkan oleh hasil pemurnian (zimogram) tidak ada aktivitas yang ditunjukkan oleh fraksi 5-9. Zimogram fraksi tidak diperlihatkan karena tidak terbentuk pita protein. Hilangnya pita terebut diduga karena enzim PPO telah mengalami kerusakan akibat ketidakstabilan enzim.
Gambar 15 Zimogram enzim PPO fraksi kromatografi filtrasi gel (M : marker, K : ekstrak kasar, D : dialisis, F5-F9 : fraksi 5-9
24
Hasil zimogram menunjukkan bahwa enzim PPO memiliki bobot molekul diatas 100 kDa. Protein dengan bobot molekul di bawah 100 kDa diduga merupakan pengotor yang masih ikut terelusi pada fraksi 5-10. Pengotor diduga merupakan pigmen yang mudah terikat dengan protein. Armenta-Lopez et al. (2002) menyatakan pigmen astaxanthin merupakan pigmen yang terikat pada lipoprotein, menjadikan protein tersebut rentan terhadap aktivitas enzimatis. Pemisahan protein pada pigmen akan menghasilkan peptida-peptida dengan bobot molekul yang beragam. Ekstraksi pigmen menghasilkan beberapa protein/peptida dengan bobot molekul 265 kDa (Carotenoprotein), 65-55 kDa, dan 20 kDa.
Beberapa penelitian telah dilakukan untuk menentukan bobot molekul enzim PPO. Satu aktivitas enzim ditemukan memiliki bobot molekul 160 kDa (Benjakul et al. 2005). Bobot molekul PO clam (Ruditapes philippinarum) sebesar 76,9 kDa (Cong et al. 2005). Enzim PO dari Artemia sinica memiliki bobot
Enzim Polyphenoloxidase (PPO) memiliki aktivitas spesifik tertinggi ketika diekstraksi menggunakan perbandingan sampel dengan bufer 1:1 secara berulang. Enzim PPO memiliki pH optimum 7 dan suhu optimum 35°C. Konsentrasi substrat untuk memperoleh aktivitas optimum enzim adalah 7,5 mM. Penghitungan kinetika enzim menunjukkan Km App enzim PPO sebesar 1,24 mM dan Vmaks App 23,26 U. Aktivitas PPO dihambat oleh ion logam Na+, Ca2+, Zn2+, dan EDTA dengan konsentrasi 5 dan 10 mM; Cu2+ dengan konsentrasi 10 mM; dan Mn2+ dengan konsentrasi 5 mM. Aktivitas PPO mengalami peningkatan setelah ditambahkan dengan Cu2+ 5 mM, Mn2+ 10 mM, serta Co2+ dengan konsentrasi 5 dan 10 mM. Aktivitas spesifik tertinggi diperoleh dengan pengendapan menggunakan amonium sulfat 70% dan waktu dialisis 4 jam. Pemurnian dilakukan menggunakan kromatografi filtrasi gel dengan Sephadex
G-150. Penentuan bobot molekul mendapatkan dua pita dengan bobot molekul
258,29 kDa dan 222,05 kDa. Kelipatan pemurnian enzim setelah dimurnikan mencapai 1,64 kali.
Saran
Perlu dilakukan penelitian untuk mengkaji optimasi metode pemurnian enzim PPO (jenis pemurnian, matrik pengisi dan laju alir) untuk mendapatkan tingkat kemurnian yang lebih baik.
DAFTAR PUSTAKA
Adachi K, Hirata T, Nagai K, Fujio A, Sakaguchi M. 2004. Hemocyanin-related reactions induce blackening Of freeze-thawed prawns during storage.
Developments in Food Science. 42 (1) : 317-330.
Armenta-Lopez R, Guerrero I, Huerta S. 2002. Astaxanthin Extraction From Shrimp Waste by Lactic Fermentation and Enzymatic Hydrolysis of the Carotenoprotein Complex. JFS. 67 (3) : 1002-1006
Benjakul S, Visessanguan W, Tanaka M. 2005.. Properties of phenoloxidase isolated from the Cephalothorax of kuruma prawn (Penaeus Japonicus).
J.Food Biochem. 29 (5): 470–485
Benjakul S. Visessanguan W, Tanaka M. 2006. Inhibitory effect of cysteine and glutathione on phenoloxidase from kuruma prawn (Penaeus japonicus).
Food Chem. 98 (1) : 158–163.
Bono G, Badalucco C, Corrao A, Cusumano S, Mammina L, Palmegiano GB. 2010. Effect of temporal variation, gender and size on cuticle polyphenol
oxidase activity in deep-water rose shrimp (Parapenaeus longirostris).
Food Chem. 123 (2) : 489–493.
Bradford MM. 1976. A rapid and sensitive method for quantification of microgram quantities of protein utilizing the principle of protein dye binding. Anal Biochem 72 (1-2): 234-254.
Cardenas W dan Dankert JR. 1997. Phenoloxidase specific activity in the red swamp crayfish Procambarus clarkii. FSI. 7 (5) : 283–295.
Chen JS, Charest DJ, Marshall MR, Wei CI. 1997. Comparison of two treatment methods on the purification of shrimp polyphenol oxidase. J Sci Food
Agric. 75 (1) : 12-18
Cong R, Sun W, Liu G, Fan T, Meng X, Yang L, Zhu. 2005. Purification and characterization of phenoloxidase from clam Ruditapes philippinarum. FSI. 18 (1) : 61-70.
Cutler P. 2003. Protein Purification Protocols (Methods in Molecular Biology). New York : Humana Press
Fan T, Zhang Y, Yang L, Yang X, Jiang G, Yu M, Cong R. 2009. Identification and characterization of a hemocyanin-derived phenoloxidase from the crab
Charybdis japonica. CBPB. 152 (2) : 144–149
Fan T, Jing Z, Fan X, Yu M, Jiang G. 2011. Purification and characterization of phenoloxidase from brine shrimp Artemia sinica. Acta Biochim Biophys Sin. 43 (9) : 722-728
Ferrer OJ, Koburger JA, Otwell WS, Gleeson RA, Simpson BK, Marshall MR. 1989. Phenoloxidase from the cuticle of florida spiny lobster (Panulirus
argus) : mode of activation and characterization. Journal of Food Science.
26
Garcia-Carreno FL,Cota K, Toro MAND. 2008. Phenoloxidase Activity of Hemocyanin in Whiteleg Shrimp Penaeus vannamei: Conversion, Characterization of Catalytic Properties, and Role in Postmortem Melanosis. J. Agric. Food Chem. 56 (15) : 6454–6459.
Gimenez B, Alvarez OM, Montero P, Guillen MCG. 2010. Characterization of phenoloxidase activity of carapace and viscera from cephalothorax of Norway lobster (Nephrops norvegicus). Food Sci and Tech. 43 (8) : 1240-1245.
Hellio C, Bado-Nilles A, Gagnaire B, Tristan R, Thomas-Guyon H. 2007. Demonstration of a true phenoloxidase activity and activation of a ProPO cascade in Pacific oyster, Crassostrea gigas (Thunberg) in vitro. FSI. 22
[KKP] Kementerian Kelautan dan Perikanan. 2011. Statistik Ekspor Hasil Perikanan. Jakarta : Pusat Data, Statistik, dan Informasi, Sekretariat Jenderal, Kementerian Kelautan dan Perikanan.
Kusnandar F. 2010. Kimia Pangan : Komponen Makro. Jakarta : Dian Rakyat Laemmli UK. 1970. Cleavage of structural protein during the assembly of the heat
of bacteriophag T4. Nature. 227 (10) : 680-685.
Leskovac V. 2004. Comprehensive Enzyme Kinetics. New York : Kluwer Academic Publishers
Manheem K, Benjakul S, Kijroongrojana K, Visessanguan W. 2012. The effect of heating conditions on polyphenol oxidase, proteases and melanosis in pre-cooked Pacific white shrimp during refrigerated storage. Food Chem. 131 (4) : 1370–1375
Martinez MV dan Whitaker JR. 1995. The biochemistry and control of enzymatic
Browning. Trends in Food Science & Technology. 6 (6) : 195-200.
Montero P, Avalos A, Perez-Mateos M. 2001. Characterization of polyphenoloxidase of prawns (Penaeus japonicus). Alternatives to inhibition: additives and high-pressure treatment. Food Chem. 75 (3) : 317–324.
Neil DM. 2012. Ensuring crustacean product quality in the post-harvest phase.
Journal of Invertebrate Pathology. 110 (2) : 267-275.
Pang Q, Zhang S, Shi X, Su F, Wu D. 2005. Purification and characterisation of phenoloxidase from amphioxus Branchiostoma belcheri tsingtauense. FSI. 19 (2) : 139-148
Perdomo-Morales P, Montero-Alejo V, Perera E, Pardo-Ruiz Z, Alonso-Jimenez E. 2007. Phenoloxidase activity in the hemolymph of the spiny lobster
Panulirus argus. FSI. 23 (6) : 1187-1195
Pornrat S, Sumate T, Rommanee S, Sumolaya K, Kerr WL. 2007. Changes in the ultrastructure and texture of prawn muscle (Macrobrachuim rosenbergii) during cold storage. LWT 40 (10) : 1747–1754.