KULTIVASI DAN KARAKTERISASI KOMPONEN AKTIF DAN
NUTRISI DARI MIKROALGA LAUT Chaetoceros gracilis
IRIANI SETYANINGSIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi dengan judul Kultivasi dan Karakterisasi Komponen Aktif dan Nutrisi dari Mikroalga Laut Chaetoceros gracilis adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Agustus 2010
ABSTRACT
IRIANI SETYANINGSIH. Cultivation and Characterization of Active Compound and Nutrients of Marine Microalgae Chaetoceros gracilis Supervised by LINAWATI HARDJITO, DANIEL R. MONINTJA, M. FEDI A. SONDITA, and MARIA BINTANG
Chaetoceros gracilis is a genera of marine microalgae that can be found in Indonesian waters. The aims of this research were: 1) to grow Chaetoceros gracilis in NPSi medium and to get the extract of Chaetoceros gracilis which contained antibacterial compound, 2) to investigate activity and stability of Chaetoceros gracilis extract, 3) to investigate the effect of Chaetoceros gracilis extract against bacteria, and 4) to determine the chemical composition of Chaetoceros gracilis biomass. The Chaetoceros gracilis was grown in nitrogen phosphate silica (NPSi) medium, continously aerated and illuminated by a 20 watt tube lamp (2500 lux). The cultivation was maintained at 25-26 oC, and harvested on the 7th day of cultivation. The biomass was separated using
ceramic filter pore 0,3 μm and then freezed dried. They were extracted by
methanol. Antibacterial activity of extract was tested against Gram positive and negative bacteria by agar diffusion method, compared to commercial antibiotic (chloramphenicol, tetracycline, oxytetracycline and ampicillin). The stability was tested during storage. Mechanism of inhibition was determined by analyzing cell damage. The content of Chaetoceros gracilis biomass such as amino acid, fatty acid, and minerals was determined using HPLC, GC and AAS respectively. The result showed that Chaetoceros gracilis grew well in NPSi medium. Extract of Chaetoceros gracilis showed antibacterial activity against Vibrio harveyi, Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 25923, dan Bacillus cereus ATCC 13091 at the concentration of 300 µg/disc. Antibacterial activity of Chaetoceros gracilis extract at concentration of 300 µg/disc was lower than antibacterial at the same concentration of chloramphenicol, tetracycline, oxytetracycline and ampicillin. After being storaged for 6 months, the extract still showed the same antibacterial activity. The extract of C. gracilis cause damage by leakage of the cell. Chaetoceros gracilis contained essential amino acids (threonine, valine, methionine, leucine, isoleucine, lysine, phenylalanine, histidine), and non essential amino acids (aspartic acid, glutamic acid, serine, glycine, arginine, alanine, tyrosine); saturated fatty acid such as caprilic acid, (C8:0), myristic acid, (C14:0), palmitic acid (C16:0), lauric acid, (C12:0), pentadecanoic acid, (C15:0), stearic acid (C18:0), arachidic acid, (C20:0), heneicosanoic acid (C21:0), behenic (C22:0), and unsaturated fatty acid such as palmitoleic acid (C16:1), heptadecanoic acid (C17:1), myristoleic acid (C14:1), pentadecanoic acid (C15:1), oleic acid (C18:1n9), linoleic acid (C18:3n3), arachidonic acid (C20:4n6), g-linolenic acid (C18:3n6), docosadienoic acid (C22:2), eicosapentaenoic acid (C20:5n3) and docosahexaenoic acid (C22:6n3). Biomass of Chaetoceros gracilis contained minerals such as phosphor (P), magnesium (Mg), ferrum (Fe), zink (Zn), calcium (Ca), and silicate. The biomass also containted alcalloid, steroid, carbohydrate, amino acid, and 0,1 % nucleic acid. It need further study on toxicity.
RINGKASAN
KULTIVASI DAN KARAKTERISASI KOMPONEN AKTIF DAN NUTRISI DARI MIKROALGA LAUT Chaetoceros gracilis. Dibimbing oleh LINAWATI HARDJITO, DANIEL R. MONINTJA, M. FEDI A. SONDITA, dan MARIA BINTANG.
Chaetoceros gracilis merupakan mikroalga laut yang ada di perairan Indonesia. Beberapa peneliti menyatakan bahwa mikroalga ini memiliki komponen aktif dan nutrisi yang baik. Namun saat ini pemanfaatan Chaetoceros masih terbatas untuk pakan alami, sehingga pemanfaatannya perlu dioptimalkan. Medium untuk pertumbuhan Chaetoceros umumnya medium Guillard, akan tetapi medium ini cukup mahal. Dengan alasan tersebut perlu dilakukan penelitian tentang Chaetoceros yang ditumbuhkan dalam medium NPSi dalam menghasilkan komponen aktif dan nutrisi.
Tujuan dari penelitian ini adalah: (1) memperoleh ekstrak Chaetoceros gracilis yang ditumbuhkan dalam medium NPSI yang mempunyai aktivitas antibakteri, (2) menguji aktivitas dan stabilitas senyawa aktif dari ekstrak Chaetoceros gracilis, (3) menganalisis pengaruh ekstrak Chaetoceros gracilis terhadap kerusakan sel bakteri, (4) menentukan kandungan kimia dari biomasa mikroalga Chaetoceros gracilis
Kultivasi Chaetoceros gracilis dilakukan dalam medium NPSi dengan aerasi terus menerus, sumber cahaya lampu 20 W (2500 lux), pada ruangan bersuhu 25-26oC. Kultur umur 7 hari dipanen untuk dipisahkan biomasanya, menggunakan filter keramik pori 0,3 mikron, dikeringkan menggunakan freeze dryer. Biomasa diekstraksi menggunakan metanol, selanjutnya dilakukan analisis aktivitas antibakteri terhadap bakteri Gram positif dan negatif, analisis potensi terhadap antibiotik komersial dan analisis stabilitas senyawa antibakteri. Untuk mengetahui mekanisme hambatannya, dilakukan analisis kebocoran sel, kerusakan dinding sel, dan pengamatan morfologi sel menggunakan Scanning Electron Microscope (SEM). Pada biomasa juga dianalisis kadar protein, lemak, karbohidrat, komposisi asam amino asam lemak dan mineral, serta fitokimia dan asam nukleat .
Chaetoceros gracilis yang ditumbuhkan dalam medium NPSi memiliki fase pertumbuhan eksponensial, stasioner dan fase kematian. Kultur Chaetoceros gracilis berwarna coklat. Ekstrak kasar C. gracilis memiliki aktivitas antibakteri yang dapat menghambat pertumbuhan bakteri Vibrio harveyi, Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, Bacillus cereus ATCC 13091, namun aktivitasnya lebih kecil dibandingkan dengan antibiotik komersial pada konsentrasi 300 ug/disc. Ekstrak Chaetoceros gracilis yang disimpan pada suhu rendah sampai 6 bulan masih memiliki aktivitas antibakteri yang sama dengan awal. Ekstrak dari Chaetoceros gracilis menyebabkan kerusakan sel bakteri yang ditunjukkan dengan terjadinya kebocoran pada sel bakteri.
(C20:4n6), linolenat (C18:3), dokosadienoat (C22:2), eikosapentaenoat (C20:5n3) dan dokosaheksaenoat (C22:6n3). Biomasa Chaetoceros gracilis mengandung mineral seperti fosfor (P), magnesium (Mg), besi (Fe), zink (Zn), kalsium (Ca), dan silika. Biomasa Chaetoceros gracilis mengandung senyawa golongan alkaloid, steroid, asam amino, karbohidrat. Kadar asam nukleat (DNA) Chaetoceros gracilis sebesar 0,1 %. Namun perlu kajian lanjut toksisitas
© Hak cipta milik IPB, tahun 2010
Hak cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
KULTIVASI DAN KARAKTERISASI KOMPONEN AKTIF DAN
NUTRISI DARI MIKROALGA LAUT Chaetoceros gracilis
IRIANI SETYANINGSIH
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Teknologi Kelautan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi pada Ujian Tertutup : 1. Prof. Dr. Ir. Deddy Muchtadi, MS 2. Prof. Dr. Ir. Bambang Murdiyanto, MSc Penguji Luar Komisi pada Ujian Terbuka : 1. Prof. Dr. Jana T. Anggadiredja, MS
Judul Disertasi : Kultivasi dan Karakterisasi Komponen Aktif dan Nutrisi dari Mikroalga Laut Chaetoceros gracilis
Nama : Iriani Setyaningsih
NIM : C 56 1040061
Program Studi : Teknologi Kelautan (TKL)
Disetujui Komisi Pembimbing
Dr. Ir. Linawati Hardjito, MSc Prof. Dr. Ir. Daniel R. Monintja
Ketua Anggota
Dr. Ir. M. Fedi A. Sondita, MSc Prof. Dr. drh. Maria Bintang, MS
Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Teknologi Kelautan
Prof. Dr. Ir.John Haluan, MSc Prof. Dr. Ir. Khairil A. Notodiputro, MS
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah swt, karena atas rahmatNya penulis dapat menyelesaikan penyusunan disertasi dengan judul Kultivasi dan Karakterisasi Komponen Aktif dan Nutrisi dari Mikroalga Laut Chaetoceros gracilis, sebagai salah satu syarat untuk memperoleh gelar doktor di program Studi Teknologi Kelautan, Sekolah Pascasarjana IPB.
Pada kesempatan ini penulis ingin menghaturkan terima kasih yang mendalam disertai penghargaan setinggi-tingginya kepada tim pembimbing kami yaitu ibu Dr. Ir. Linawati Hardjito, MSc selaku Ketua Komisi Pembimbing, bapak Prof. Dr. Ir. Daniel Monintja, bapak Dr. Ir. M. Fedi A. Sondita, MSc, dan ibu Prof. Dr. drh. Maria Bintang, MS selaku anggota komisi pembimbing.
Terima kasih dihaturkan kepada kedua orang tua penulis ayahanda Soekemi (alm) dan ibunda Khayatun yang selalu mendoakan kami. Kepada suami Dr. Ir. Anang Hari Kristanto, MSc beserta anak-anak tercinta Anindita Lintangdesi Afriani dan Nawangwulan Risqi Andriani kami mengucapkan terima kasih yang tak terhingga atas dukungan, kasih sayang dan doanya.
Terima kasih kepada pimpinan IPB, terutama pimpinan Program Pascasarjana , khususnya ketua Program Studi Teknologi Kelautan yang telah memberikan kesempatan kepada penulis untuk menempuh pendidikan pada program doktor (S3). Terima kasih kepada BPPS Dikti atas dukungan pembiayaan selama studi dan Hibah mahasiswa program doktor Dikti atas bantuannya dalam penyelesaian disertasi.
Terima kasih juga kami ucapkan kepada Drs. Lily Panggabean, MSc yang telah membantu dalam pengadaan C. gracilis dan Dr. Ir. Widanarni, MS yang telah memberikan bakteri V. harveyi. Terima kasih kepada sesama staf pengajar di Departemen Teknologi Hasil Perairan, teknisi Ema Masruroh yang banyak membantu selama pelaksanaan penelitian serta semua pihak yang belum sempat kami sebutkan satu persatu.
Semoga, bantuan, dukungan, dan perhatian bapak ibu senantiasa mendapatkan balasan yang berlipat ganda dari Allah SWT. Penulis menyadari akan kekurangannya, untuk itu kami mohon saran. Akhir kata penulis ucapkan semoga disertasi ini memberikan manfaat bagi yang membaca.
RIWAYAT HIDUP
Penulis dilahirkan di Kota Semarang pada tanggal 25 September 1960. Penulis adalah putra kelima dari lima bersaudara dari pasangan Bapak Soekemi (alm) dan Ibu Khayatun. Penulis telah menikah dengan Dr. Ir. Anang Hari Kristanto, MSc dan dikarunai dua orang putri bernama Anindita Lintangdesi Afriani dan Nawangwulan Rizqi Andriani.
Jenjang pendidikan penulis dimulai dari TK Budirini Semarang pada tahun 1965, dilanjutkan dengan jenjang pendidikan di SD Negeri Randusari I Semarang, lulus tahun 1973, SMP Masehi Gergaji Semarang, lulus tahun 1976 dan SMA Negeri Perintis Sekolah Pembangunan Semarang lulus tahun 1980. Penulis diterima di Institut Pertanian Bogor pada tahun 1980. Pada tahun 1981, penulis masuk Jurusan Pengolahan Hasil Perikanan, Fakultas Perikanan, dan lulus tahun 1985. Penulis melanjutkan program Magister Sains di Program Studi Ilmu Pangan, Sekolah Pascasarjana, IPB (1987-1991) dengan dana TMPD. Pada tahun 2004, penulis melanjutkan studi program doktor di Program Studi Teknologi Kelautan, Sekolah Pascasarjana, IPB dengan dana BPPS.
Penulis mulai mengembangkan karier sebagai staf pengajar di Institut Pertanian Bogor pada tahun 1987 pada Jurusan Pengolahan Hasil Perikanan, Fakultas Perikanan, IPB yang kini berubah menjadi Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
DAFTAR ISTILAH ……….. xv
1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Permasalahan ……….. 2
1.3 Tujuan Penelitian ... 3
1.4 Hipotesis Penelitian ……….. 3
1.5 Manfaat Penelitian ... 4
1.6 Ruang Lingkup Penelitian ... 4
1.7 Kerangka Pemikiran ……….. 4
2 TINJAUAN PUSTAKA ... 7
2.1 Deskripsi Mikroalga ... 7
2.2 Chaetoceros sp ... 9
2.3 Antibakteri dari Mikroalga ... 10
2.4 Mekanisme Kerja Senyawa Antibakteri ... 14
2.5 Bakteri Patogen ... 16
2.5.1 Bakteri Gram positif ... 17
2.5.2 Bakteri Gram negatif ... 19
3 METODE PENELITIAN ………. 22
3.1 Waktu dan Tempat Penelitian ……… 22
3.2 Bahan dan Alat ……… 22
3.3 Tahapan Penelitian dan Analisis ………. 23
3.3.1 Kultivasi Chaetoceros gracilisdalam medium NPSi ……… 23
3.3.2 Ekstraksi, uji aktivitas dan stabilitas senyawa antibakteri dari ekstrak Chaetoceros gracilis……… 24
3.3.3 Analisis pengaruh ekstrak Chaetoceros gracilis terhadap kerusakan bakteri ……….. 25
4 KULTIVASI Chaetoceros gracilis DALAM MEDIUM NPSi ……….. 28
4.1 Pendahuluan ... 28
4.2 Bahan dan Metode ... 29
` 4.3 Hasil dan Pembahasan ... 31
4.4 Kesimpulan ……… ... 38
5 AKTIVITAS DAN STABILITAS SENYAWA ANTIBAKTERI DARI EKSTRAK Chaetoceros gracilis………... 39
5.1 Pendahuluan ... 39
5.2 Bahan dan Metode ... 40
` 5.3 Hasil dan Pembahasan ... 44
5.4 Kesimpulan ... 52
6 KERUSAKAN BAKTERI OLEH SENYAWA ANTIBAKTERI DARI EKSTRAK Chaetoceros gracilis ……….. 53
6.1 Pendahuluan ... 53
6.2 Bahan dan Metode ... 55
6.3 Hasil dan Pembahasan ... 57
6.4 Kesimpulan ... 64
7 KANDUNGAN SENYAWA KIMIA MIKROALGA Chaetoceros gracilis YANG DITUMBUHKAN DALAM MEDIUM………… 65
7.1 Pendahuluan ... 65
7.2 Bahan dan Metode ... 66
7.3 Hasil dan Pembahasan ... 73
7.4 Kesimpulan ... 88
8 PEMBAHASAN UMUM ... 90
9. KESIMPULAN DAN SARAN ... 97
DAFTAR PUSTAKA ... 99
LAMPIRAN ... 106
DAFTAR TABEL
Halaman
1 Hasil pemisahan awal komponen antimikroba dari beberapa
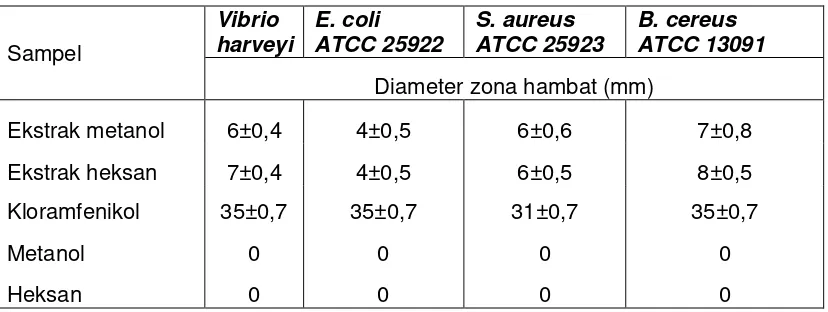
mikroalga ... 13 2 Diameter zona hambat bakteri dari ekstrak C.gracilis ... 46 3 Komposisi asam lemak biomasa kering Chaetoceros gracilis ... 76 4 Kandungan asam lemak dalam Chaetoceros graciis dan komoditi
lain ……… 78 5 Komposisi asam amino pada biomasa kering Chaetoceros
gracilis ... 80
6 Pola kecukupan asam amino dalam tubuh ………. 81 7 Komposisi asam amino dalam biomasa kering C. gracilis
DAFTAR GAMBAR
Halaman
1 Kerangka penelitian ……….. 6
2 Kurva pertumbuhan mikroalga (Fogg dan Thake 1987)……… 8
3 Morfologi sel Chaetoceros gracilis ... 9
4 Kultur Chaetoceros gracilis umur 2 hari ... 32
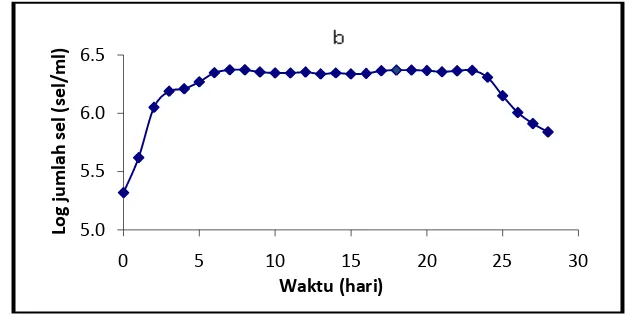
5 Kurva pertumbuhan Chaetoceros gracilis dalam medium NPSi (a = fase pertumbuhan; b = fase stasioner; c = fase kematian)….. 33
6 Kurva pertumbuhan Chaetoceros gracilis dalam medium Guillard (a = fase pertumbuhan b = fase stasioner; c = fase kematian) (Lailati 2007) ………. 33
7 Biomasa Chaetoceros graciliskering ………. . 37
8 Ekstrak Chaetoceros gracilis ………. 45
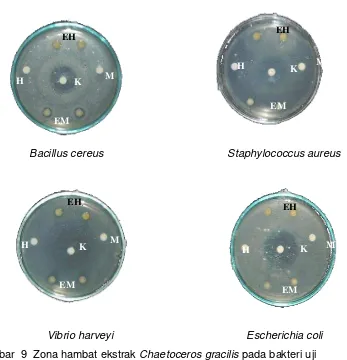
9 Zona hambat ekstrak Chaetoceros gracilis pada bakteri uji (EH = ekstrak heksan; EM = ekstrak metanol; K = kloramfenikol; M =metanol; H = heksan) ……….. 47
10 Diameter zona hambatan dari ekstrak dan antibiotik komersial terhadap pertumbuhan bakteri ( = B. cereus; = V. harveyi) ……… 49
11 Potensi relatif daya hambat ekstrak C. gracilis terhadap 4 jenis antibiotik komersial pada konsentrasi sama ( = B. cereus; = V. harveyi ) ……….. 50
12 Aktivitas antibakteri ekstrak C. gracilis selama penyimpanan dalam refrigerator ( = V. harveyi; = E. coli; = S. aureus; = B. cereus)
………..
5213 Pengaruh ekstrak C. gracilis terhadap kebocoran asam nukleat dan ( = OD 260 nm) kebocoran protein sel ( = OD 280 nm) ……… 58
14 Pengaruh ekstrak C. gracilis terhadap kandungan N-asetil glukosamin ( = tanpa ekstrak, = penambahan ekstrak)……….. 60
15 Sel Bacillus cereus tanpa perlakuan (perbesaran 20.000 x)……….. 62
16 Sel Bacillus cereus yang dikontakkan dengan ekstrak Chaetoceros gracilis(perbesaran 20.000 x)……….. 63
17 Sel Vibrio harveyi tanpa perlakuan (perbesaran 20.000 x)…………. 63
DAFTAR LAMPIRAN
Halaman
1 Komposisi medium pupuk NPSi yang digunakan untuk kultivasi
Chaetoceros gracilis ... 107
2 Kepadatan sel Chaetoceros gracilis selama kultivasi ... 108
3 Diameter zona hambat ekstrak metanol dari Chaetoceros gracilis dan kloramfenikol pada beberapa bakteri (mm) ………. 109
4 Diameter zona hambat ekstrak heksan dari Chaetoceros gracilis dan kloramfenikol pada beberapa bakteri (mm) ………. 109
5 Diameter zona hambat (mm) pada Bacillus cereus dan Vibrio harveyi dari ekstrak C. gracilisdan 4 jenis antibiotik ...… 110
6 Potensi relatif ekstrak Chaetoceros gracilis terhadap antibiotik komersial (%) ……… 110
7 Diameter zona hambat (mm) ekstrak Chaetoceros gracilis selama penyimpanan ...…. 111
8 Perhitungan kadar protein C. gracilis………. 112
9 Perhitungan kadar karbohidrat C. gracilis………. 113
10 Perhitungan hasil analisis mineral dari biomasa C. gracilis……… 114
DAFTAR ISTILAH
Antimikroba = zat yang mampu menghancurkan atau menghambat pertumbuhan mikroorganisme, membunuh atau menekan pertumbuhan mikroorganisme
ATCC = American Typing Culture Collection
Bakteri patogen = merupakan kelompok bakteri parasit yang menimbulkan penyakit pada manusia, hewan dan tumbuhan
Ekstrak = hasil pemisahan suatu bahan yang menggunakan pelarut Faktor intrinsik = faktor-faktor yang berasal dari dalam organisme
dengan proses ekstraksi
Farmasetika = gabungan kimia dan farmasi yang terlibat dalam desain, sintesis, dan pengembangan obat
Glass bead = butiran-butiran dari kaca yang digunakan untuk memecah sel mikroorganisme
Golden brown algae = alga yang di dalam perairan berwarna kecoklatan Komponen aktif = senyawa yang mempunyai aktivitas biologis yang
bermanfaat
Mikroalga = mikroorganisme fotosintetik dengan morfologi sel yang bervariasi
NPSi = Nitrogen-Fosfat-Silika
Nutrasetika = produk-produk pangan dan obat yang terkait dengan kesehatan
Suplemen = pelengkap ketika tubuh kekurangan suatu unsur zat gizi. suplemen dapat berupa vitamin, mineral, atau zat gizi
lainnya seperti asam lemak, asam amino, dan zat esensial (misalnya serat).
1 PENDAHULUAN
1.1 Latar Belakang
Tingginya keanekaragaman organisme laut di Indonesia merupakan aset penting dalam pengembangan bioteknologi laut. Sejauh ini pengembangan bioteknologi di Indonesia dilakukan antara lain pada bidang pertanian, pangan dan kesehatan maupun lingkungan. Produk alam dari laut dapat digunakan untuk berbagai tujuan antara lain untuk bahan farmasi (antibakteri atau antimikroba, antioksidan), bahan nutrisi (asam amino, asam lemak, mineral) dan berbagai bahan lainnya (Nontji 1999).
Antimikroba atau antibakteri merupakan bahan yang dapat membunuh atau menghambat pertumbuhan mikroba, sehingga sering digunakan untuk bahan baku obat. Beberapa jenis organisme laut yang potensial sebagai sumber obat antara lain makroalga, mikroalga, sponge, soft coral (Kobayashi dan Satari 1999). Mikroalga merupakan organisme berukuran mikroskopis yang mempunyai peranan penting dalam kehidupan di perairan, dan mudah dibudidayakan karena hidupnya tidak tergantung musim, tidak memerlukan tempat yang luas, dan tidak memerlukan waktu yang lama untuk memanennya. Mikroalga memiliki banyak keunggulan antara lain sebagai sumber pakan dan pangan yang mengandung protein, lipid, serta sebagai bahan dasar obat-obatan atau farmasi (Borowitzka 1988). Mikroalga telah lama dikenal karena memiliki aktivitas biologikal seperti pigmen, lemak dan protein, selain itu juga menjadi sumber yang potensial untuk produk komersial di bidang akuakultur (Rosa et al. 2005).
bakteri E. coli dan S. aureus, serta kapang Candida albicans. Namun belum diketahui mekanisme hambatan antibakteri dari Chaetoceros terhadap bakteri.
Chaetoceros, selain memiliki komponen antibakteri juga mengandung nilai gizi seperti protein, lemak, karbohidrat. Renaud et al. (2002) melaporkan bahwa Chaetoceros sp yang ditumbuhkan dalam medium Guillard pada suhu 25 o
C mempunyai kandungan karbohidrat sebesar 13,1%, protein 57,3%, lemak 16,8%, serta PUFA. 19,5 %. Hasil penelitian Araujo dan Garcia (2005) menunjukkan bahwa kandungan lemak dan karbohidrat dalam Chaetoceros wighamii yang dikultivasi pada suhu 20 dan 25 oC lebih tinggi dibandingkan 30 oC. Salinitas medium pertumbuhan Chaetoceros 25 dan 30 tidak mempengaruhi pertumbuhan, densitas sel, biomasa dan klorofil (Raghavan et al. 2008).
Salah satu faktor yang mempengaruhi pertumbuhan dan komposisi biokimia mikroalga adalah nutrien dalam medium. Medium yang digunakan untuk pertumbuhan Chaetoceros umumnya medium Guillard, namun harga medium ini mahal, untuk itu perlu dicari medium pertumbuhan yang lebih murah. Larastri (2006) melaporkan bahwa Chaetoceros dapat ditumbuhkan dalam medium NPSi. Namun belum diketahui kandungan senyawa aktif dan senyawa kimia dari Chaetoceros gracilis yang dikultivasi dalam medium NPSi tersebut. Berdasarkan alasan tersebut, maka perlu dilakukan penelitian komponen aktif dan nutrisi dari Chaetoceros gracilis yang diperoleh dari perairan Indonesia dan dikultivasi dalam medium NPSi, sehingga pemanfataannya lebih optimal.
1.2 Rumusan Permasalahan
Senyawa antibakteri alami mudah mengalami kerusakan, oleh karena itu perlu metode penyimpanan yang tepat. Salah satu metode penyimpanan yang dapat digunakan adalah penyimpanan pada suhu rendah. Pada penelitian ini ekstrak Chaetoceros gracilis disimpan pada suhu rendah sampai 6 bulan, untuk dilihat stabilitas senyawa antibakterinya. Sel bakteri dapat mengalami kerusakan setelah kontak dengan antibakteri, oleh karena itu dianalisis pengaruh ekstrak Chaetoceros gracilis terhadap kerusakan sel bakteri.
Chaetoceros mempunyai kandungan biokimia yang lengkap dan digunakan untuk pakan alami larva. Mikroalga ini dapat dioptimalkan pemanfaatannya, misalnya untuk suplemen atau nutrasetika. Komposisi nutrien medium perttumbuhan berpengaruh terhadap komposisi biokimia mikroalga, sehingga perlu dianalisis komposisi kimia Chaetoceros gracilis yang ditumbuhkann dalam medium NPSi.
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah:
(1) Memperoleh ekstrak Chaetoceros gracilis yang ditumbuhkan dalam medium NPSI yang mempunyai aktivitas antibakteri
(2) Menguji aktivitas dan stabilitas senyawa aktif dari ekstrak Chaetoceros gracilis
(3) Menganalisis pengaruh ekstrak Chaetoceros gracilis terhadap kerusakan sel bakteri
(4) Menentukan kandungan kimia dari biomasa mikroalga Chaetoceros gracilis 1.4 Hipotesis Penelitian
Hipotesis pada penlitian ini adalah:
(1) Chaetoceros gracilis yang ditumbuhkan dalam medium NPSi masih mengandung senyawa aktif antibakteri
(2) Ekstrak Chaetoceros gracilis yang disimpan lama dalam suhu rendah masih memiliki aktivitas antibakteri
(3) Sel bakteri uji mengalami kerusakan atau gangguan setelah kontak dengan ekstrak Chaetoceros gracilis
1.5 Manfaat Penelitian
Hasil penelitian ini bermanfaat dalam ilmu pengetahuan dan teknologi (Iptek), khsusunya eksplorasi mikroalga untuk bidang kesehatan. Untuk menghasilkan Chaetoceros gracilis yang mempunyai komponen aktif dan komponen nutrisi yang lengkap dengan harga lebih murah, Chaetoceros gracilis dapat dikultivasi dalam medium NPSi.
1.6 Ruang Lingkup Penelitian
Kajian yang dilakukan pada penelitian ini adalah : (1) Kultivasi Chaetoceros gracilis dalam medium NPSi (2) Aktivitas dan stabilitas ekstrak Chaetoceros gracilis
(3) Kerusakan bakteri oleh senyawa antibakteri dari ekstrak Chaetoceros gracilis (4) Kandungan senyawa kimia dari mikroalga Chaetoceros gracilis
1.7 Kerangka Pemikiran
Chaetoceros merupakan salah satu mikroalga laut berukuran mikroskopis yang mempunyai peranan penting dalam kehidupan di perairan, mudah dibudidayakan, tidak tergantung musim, tidak memerlukan tempat yang luas, dan tidak memerlukan waktu yang lama untuk memanennya. Mikroalga ini mempunyai kandungan kimia yang meliputi protein, lemak, karbohidrat, asam amino, asam lemak yang diperlukan untuk pertumbuhan. Selain itu, Chaetoceros juga mempunyai komponen aktif antibakteri.
Komponen aktif antibakteri (Metting dan Pyne 1986; Wang 1999, Pribadi 1999; Mendiola et al. 2007)
Penelitian yang telah dilakukan sebelumnya
-
????
Penelitian yang dilakukan untuk disertasi
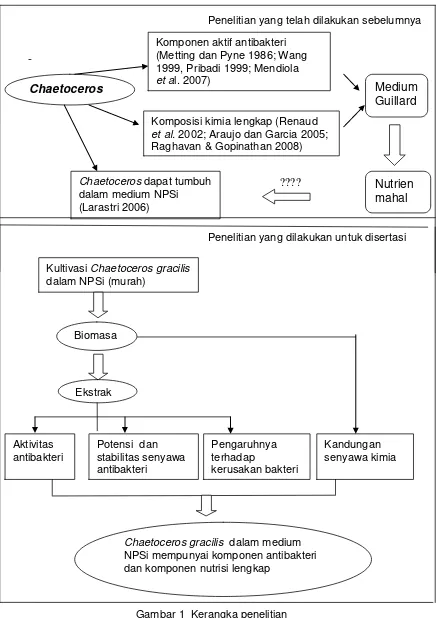
Gambar 1 Kerangka penelitian
Chaetoceros
Chaetoceros dapat tumbuh dalam medium NPSi (Larastri 2006)
Kultivasi Chaetoceros gracilis dalam NPSi (murah)
Ekstrak
Aktivitas antibakteri
Potensi dan stabilitas senyawa antibakteri
Kandungan senyawa kimia Pengaruhnya
terhadap
kerusakan bakteri Komposisi kimia lengkap (Renaud et al. 2002; Araujo dan Garcia 2005; Raghavan & Gopinathan 2008)
Biomasa sel
Chaetoceros gracilis dalam medium NPSi mempunyai komponen antibakteri dan komponen nutrisi lengkap
Medium
Guillard
2 TINJAUAN PUSTAKA
2.1 Deskripsi Mikroalga
Mikroalga merupakan biota perairan yang potensial untuk dikembangkan karena dapat menghasilkan produk komersial di bidang pangan, farmasi, kosmetika, pertanian dan sebagainya. Organisme ini termasuk eukariot yang mempunyai klorofil dan melakukan fotosintesis (microscopic photosynthetic organisms), berukuran mikro, uniselular, dan berperan sebagai produsen primer di dalam perairan, dan dikenal dengan primitive form of plant. Mikroalga dapat hidup di perairan tawar, laut, maupun tempat lembab. Hingga saat ini mikroalga masih banyak digunakan sebagai pakan.
Nutrisi mineral alga tidak jauh berbeda dengan tumbuhan tingkat tinggi. Kebutuhan absolut umum untuk alga meliputi karbon, fosfor, nitrogen, sulfur, potasium dan magnesium. Elemen-elemen seperti besi dan mangan diperlukan dalam jumlah sedikit. Beberapa elemen seperti kobal, seng, boron, copper dan molybdenum merupakan essential trace element. Selain mineral ini beberapa alga juga memerlukan substrat organik seperti vitamin, faktor tumbuh untuk pertumbuhan (Becker 1994).
Mikroalga laut dapat dikultivasi dengan menggunakan medium Guillard. Agar pertumbuhan mikroalga dalam medium kultur bagus, maka lingkungan harus dikondisikan sama dengan kebutuhan intrinsik organisme tersebut. Faktor-faktor lingkungan yang berpengaruh terhadap pertumbuhan alga antara lain faktor fisik berupa cahaya dan suhu, serta faktor kimiawi yang digunakan untuk sintesis struktur dari sel alga (Becker 1994). Kondisi yang mempengaruhi pertumbuhan alga meliputi 1) iluminasi cahaya, yang mana untuk kultur alga dapat digunakan lampu 40 Watt yang memberikan intensitas cahaya 3200 lux, 2) suhu (suhu ruang atau suhu dingin), yang mana suhu dapat mempengaruhi metabolisme organisme, dan 3) medium kultur. Fitoplankton laut dapat ditumbuhkan dalam media air laut yang diperkaya atau media air laut sintetis (Kungvankij 1988).
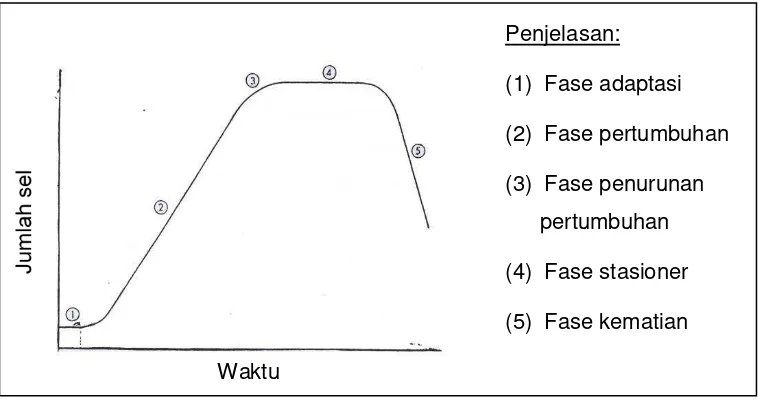
pengurangan dari luar, alga tumbuh melalui fase yang berbeda (Becker 1994). Kurva pertumbuhan mikroalga disajikan pada Gambar 2.
Penjelasan: (1) Fase adaptasi
(2) Fase pertumbuhan (3) Fase penurunan
pertumbuhan (4) Fase stasioner (5) Fase kematian
Waktu
Gambar 2 Kurva pertumbuhan mikroalga (Fogg dan Thake 1987)
Berikut adalah uraian singkat tentang kelima fase pertumbuhan mikroalga tersebut:
Fase 1. Pada fase ini medium diinokulasikan dengan organisme. Kondisi pada awal biasanya berbeda dengan lingkungan sebelumnya. Organisme sering tidak mudah beradaptasi dengan lingkungan baru dan mungkin menjadi tidak nyaman. Selama pada fase adaptasi atau fase lag ini, kultur alga menyesuaikan diri terhadap kondisi, laju pertumbuhan lebih rendah dan akan meningkat dengan waktu kultivasi. Sel menjadi sensitif terhadap suhu atau perubahan lingkungan lainnya.
Fase 2. Setelah kultur alga beradaptasi terhadap kondisi kultivasi yang diberikan, sel masuk ke fase pertumbuhan. Selama periode ini intensitas cahaya tidak terbatas dan perubahan konsentrasi nutrien masih kecil pengaruhnya. Dalam sebuah kultur, dimana persediaan nutrien dan cahaya tidak terbatas, biomas alga bertambah per waktu secara proposional. Jumlah masa sel meningkat seiring terhadap waktu. Sel-sel membelah pada laju yang konstan. Keadaan ini sangat penting dalam menentukan keadaan kultur.
Fase 4. Pada fase ini suplai cahaya per sel alga menjadi terbatas dan peranan respirasi mulai meningkat. Kurva pertumbuhan mendekati nilai limit, yaitu fase stasioner.
Fase 5. Fase ini merupakan berakhirnya fase stasioner, yang mana populasi sel berkurang, sel-sel alga mulai mengeluarkan bahan organik, pertumbuhan terhambat. Terjadinya fase ini disebabkan oleh umur kultur yang sudah tua, suplai cahaya dan nutrien terbatas. Pada fase ini laju kematian menjadi tinggi, populasi alga menjadi rusak secara sempurna.
2.2 Chaetoceros sp
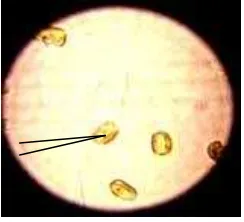
Salah satu diatom laut yang bisa dikembangkan adalah Chaetoceros. Chaetoceros gracilis termasuk dalam golongan Bacillariophyceae yang juga sering disebut dengan golden brown algae. Mikroalga ini tergolong plankton neritik, memiliki setae dan membentuk filamen sehingga dapat melayang di permukaan, selnya tunggal dan tidak membentuk rantai, bercangkang cembung, spora di tengah sel induk, dan non motil. Chaetoceros juga digunakan sebagai pakan alami (Isnansetyo dan Kurniastuty, 1995; Sue et al. 1997). Morfologi sel C. gracilis disajikan pada Gambar 3.
Gambar 3 Morfologi sel Chaetoceros gracilis
Chaetoceros merupakan salah satu diatom yang diklasifikasikan (Isnansetyo dan Kurniastuty 1995; BBLL 2002) sebagai berikut:
Phylum : Bacillariophyta Kelas : Bacillariophyceae Ordo : Bacillariales (Centrales) Family : Chaetoceraceae
Genus : Chaetoceros
yang dominan. Pada kultur, fitoplankton ini berwarna kuning keemasan hingga coklat (BBLL 2002). Berkaitan dengan morfologi Chaetoceros, Wang (1999) menyatakan bahwa sel secara individu dari Chaetoceros berbentuk kotak, mempunyai dimensi lebar 12 sampai 14 mikron, dan panjang 15 sampai 17 mikron, dengan jarum di ujungnya. Sel ini bisa membentuk rantai sekitar 10 sampai 20 sel. Ketika dikultur dengan aerasi kuat, Chaetoceros tidak membentuk koloni. Pada skala kultur besar, alga ini berwarna coklat keemasan, sehingga disebut dengan golden brown alga.
Umumnya alga digunakan sebagai pakan untuk organisme perairan yang memiliki nilai komersial penting, termasuk diatom yang ukurannya bervariasi. Diatom yang banyak digunakan dalam marinkultur komersial adalah Skeletonema costatum, Thalassiosira pseudonana, Chaetoceros gracilis, C. calcitrans dan sebagainya (BBLL 2002).
Chaetoceros yang ditumbuhkan dalam batch pada suhu 25, 27, 30, 33 dan 35 oC memiliki kandungan karbohidrat (13,1; 12,2; 12,5; 11,3; dan 11 %), protein (57,3; 57,1; 64,1; 62,5 dan 47,3 %), serta lemak (16,8; 14,8; 12,2; 12,4 dan 12,1 %). Asam lemak jenuh golongan PUFA yang dihasilkan sebesar 19,5; 20,8; 19; 19,8 dan 20,4 % (Renaud et al. 2002). Suhu merupakan salah satu faktor yang mempengaruhi komposisi kimia Chaetoceros wighamii. Pada suhu 20 dan 25 oC, kandungan lipid dan karbohidrat lebih tinggi dibandingkan pada suhu 30 oC, sedangkan protein tidak dipengaruhi oleh perbedaan suhu tersebut (Araujo dan Garcia 2005).
Chaetoceros gracilis yang ditumbuhkan dalam medium f/2 Guillard, diberi aerasi dan penambahan karbon, menggunakan lampu 20 Watt, suhu 22±1 ºC, setelah 8 hari memiliki kepadatan sel sebesar 8,44±7.07x106sel./L. Kandungan karbohidrat terlarut 0.1±0.01 mg/L, protein terlarut 0.58±0.02 mg/L (Junior et al. 2007).
2.3 Antibakteri dari Mikroalga
patogen dan koliform mati dengan cepat, hal ini menunjukkan bahwa mikroalga memproduksi senyawa antibakteri (Fogg dan Thake 1987).
Penelitian mikroalga tentang aktivitas antibakterial, antifungal dan antiviral masih dalam perkembangan, tetapi mempunyai prospek untuk dipromosikan (Richmond 1990). Beberapa aplikasi yang potensial dari alga antara lain produksi senyawa obat-obatan untuk industri farmasi dan pertanian sebagai bahan biocontrol maupun biofertilizer.
Naviner et al. (1999) melaporkan bahwa Skeletonema costatum mempunyai aktivitas bakterisida yang dapat menghambat bakteri-bakteri patogen di bidang akuakultur seperti Vibrio mytili, Vibrio sp VRP dan Listonella anguillarum. Berkaitan dengan ini hasil penelitian Nugraheny (2001) juga menunjukkan bahwa Skeletonema mempunyai aktivitas penghambatan terhadap Vibrio.
Berkaitan dengan antibakteri, Wang (1999) melaporkan bahwa budidaya kekerangan dan moluska yang menggunakan Chaetoceros sebagai pakannya menguntungkan karena Chaetoceros memberikan efek antibiotik alami yang mana dapat membebaskan hewan air tersebut dari bakteri patogen Vibrio sehingga sea food ini aman untuk dikonsumsi. Selain itu ekstrak alga laut Chaetoceros menunjukkan aktivitas antibakteri yang dapat menghambat methicilline resistant Staphylococcus aureus (MRSA), vancomycin resistant Enterococcus (VRE), Vibrio vulnificus, Vibrio cholerae. Antibakteri ini dihasilkan oleh alga uniselular Chaetoceros dalam merespon keberadaan bakteri dan alga lain.
socialis, C. lauderi. Komponen yang mempunyai aktivitas antibakterial tersebut tergolong asam lemak (Metting dan Pyne 1986). Berkaitan dengan senyawa antimikroba, Richmond (1990) melaporkan bahwa empat jenis diatom seperti Chaetoceros lauderi, Chaetoceros pseudocurvisteus, Chaetoceros socialis dan Chaetoceros fragilaris pinnata mempunyai aktivitas antifungal. Asam lemak yang bertanggung jawab sebagai antibiotik dari diatom Asterinella japanica adalah eicosapentaenoic (20:5) (Richmond 1990).
Chaetoceros gracilis mempunyai aktivitas penghambatan terhadap bakteri B. subtilis, E. coli dan Pseudomonas sp (Pribadi 1998). Pribadi dalam laporannya menyatakan bahwa kultivasi Chaetoceros gracilis dilakukan pada suhu ruang, ekstraksi dilakukan menggunakan metanol dengan metode maserasi. Pengujian aktivitas terhadap pertumbuhan bakteri dilakukan menggunakan difusi agar. Kultur yang dipanen pada fase stasioner, dengan konsentrasi ekstrak biomas yang digunakan 9,2 % dan sebanyak 10 µl yang diteteskan pada paper disk, menghasilkan daya hambat terhadap Bacillus subtilis 30 mm (daerah hambatan tidak bening), terhadap Escherichia coli 6,5 mm, terhadap Pseudomonas sp 7,5 mm. Aktivitas antibakteri dari C. gracilis ini perlu dilakukan terhadap jenis bakteri lain.
Lailati (2007) melaporkan bahwa Chaetoceros gracilis yang ditumbuhkan dalam Guillard dan diekstraksi menggunakan pelarut heksan, etil-asetat, metanol memiliki aktivitas antibakteri terhadap Staphylococcus aureus dan Vibrio harveyi. Kultivasi C. gracilis dengan lama penyinaran 24 jam pada suhu 25 oC menghasilkan rendemen biomasa lebih besar dibanding 12 jam. Pemecahan sel untuk tahap ekstraksi dapat digunakan glass bead, selain sonikator. Masih perlu dilakukan pengujian aktivitas antibakteri terhadap mkroorganisme lain yang merugikan dan aplikasi senyawa antibakteri.
Penelitian senyawa antibakteri dari Chaetoceros juga dilakukan oleh beberapa peneliti. Lipid antibiotic yang diekstraksi dari sel utuh diatom laut Chaetoceros lauderi (Ralfs) dan telah teridentifikasi sebagai asam lemak tidak jenuh memiliki sensitivitas terhadap beberapa bakteri terestrial Gram positif dan bakteri laut Gram negatif berbentuk basil (Gauthier et al. 1978).
bakteri methicilline resistant Staphylococcus aureus (MRSA), vancomycin resistant Enterococcus (VRE), Vibrio vulnificus, Vibrio cholerae, Pseudomonas aeruginosa, Listeria monocytogenes, Shigella dysenteriae, Streptococcus faecalis, Bacillus subtilis, Bacillus cereus, Micrococcus megmatis, Streptococcus pyrogenes, Proteus vulgaris dan Salmonella typhimurium. Konsentrasi minimum penghambatan untuk ekstrak dari Chaetoceros yang memiliki respon terhadap methicillin resistant Staphylococcus aureus (MRSA) adalah 10-15 µg/disk dan 20 µg/disk untuk vancomycin resistant Enterococcus (VRE). Selain itu juga dilaporkan bahwa pada konsentrasi 100 µg/disk ekstrak dapat menghambat Pyogenes vulgaris, Carynobacter xerosis, Shigella dysenteriae Streptococcus mitis, Streptococcus faecalis, Bacillus subtilis, Bacillus cereus (Wang 1999). Akan tetapi mekanisme hambatan senyawa antibakteri ini belum diketahui. Hasil penelitian tentang pemisahan awal antimikroba dari beberapa mikroalga disajikan pada Tabel 1.
Tabel 1 Hasil pemisahan awal komponen antimikroba dari beberapa mikroalga
Spesies Mikroorganisme Zona hambatan
(mm) Desmococcus olivaceus
(324)
Staphylococcus aureus* 6.7 ± 0.3 Desmococcus olivaceus
(343)
Pseudomonas syringiae*
5.3 ± 1.1
Chlorella minutissima (357) Staphylococcus aureus* 6.3 ± 1.1 Chlorella minutissima (360) Staphylococcus aureus* 6.2 ± 0.1 Chlorella minutissima (361) Staphylococcus aureus* 8.0 ± 0.0 Chlorella sp (313) Staphylococcus aureus* 6.5 ± 0.3 Chlorella sp (381) Staphylococcus aureus* 5.7 ± 0.9 Chlorella sp (458) Staphylococcus aureus* 7.7 ± 0.8 Scenedesmus sp (469) Staphylococcus aureus* 5.0 ± 1.3
Scenedesmus sp (540) Altenaria sp* 10.0 ± 0.0
Chaetoceros gracilis Escherichia coli ** Pseudomonas sp** Bacillus subtilis**
6.5 7.5 7.0 (hambatan tidak
bening) Sumber: * Ordogs et al. (2004)
2.4 Mekanisme Kerja Senyawa Antibakteri
Senyawa aktif adalah suatu senyawa yang mempunyai aktivitas biologis terhadap organisme hidup, misalnya antimikroba, antikanker, antioksidan, dan sebagainya. Senyawa aktif ini dapat diperoleh dari bahan alam, dan sering dikenal dengan senyawa bahan alami (natural products).
Senyawa antibakteri adalah senyawa yang dapat membunuh atau menghambat pertumbuhan bakteri. Bahan kimia yang dapat membunuh organisme disebut sidal, misalnya bakterisidal, fungisidal dan algasidal. Bahan bakterisidal merupakan bahan kimia yang memiliki aktivitas membunuh bakteri, sedangkan bahan kimia yang dapat menghambat pertumbuhan organisme tetapi tidak membunuh organisme tersebut disebut statik, misalnya bakteriostatik, fungistatik (Madigan et al. 2003). Senyawa antimikrobial diproduksi secara alami oleh organisme yang mempunyai sifat toksik terhadap mikroalga, bakteri, fungi, virus ataupun protozoa (Metting dan Pyne 1986).
Berdasarkan mekanisme kerjanya, antimikroba atau antibiotik dibagi menjadi beberapa kelompok (Madigan et al. 2003), yaitu:
(1) Menghambat sintesis dinding sel mikroba
Antibiotik akan menghambat proses sintesis dinding sel. Tekanan osmotik dalam sel mikroba lebih tinggi daripada di luar sel, sehingga kerusakan dinding sel mikroba akan menyebabkan terjadinya lisis, yang merupakan dasar dari efek bakterisidal terhadap mikroba yang peka
(2) Antimikroba yang mengganggu keutuhan (fungsi) membran sel mikroba Kerusakan membran sel menyebabkan keluarnya berbagai komponen dari
dalam sel mikroba
(3) Antimikroba menghambat sintesis protein sel mikroba
(4) Antimikroba yang menghambat sintesis asam nukleat sel mikroba
Antimikroba yang memiliki mekanisme kerja seperti ini pada umumnya kurang mempunyai sifat toksisitas selektif karena bersifat sitotoksis terhadap sel tubuh manusia
Berdasarkan kekuatan membunuh bakteri, suatu antibiotik diatur oleh 3 faktor (Bintang 1993), yaitu :
(1) Kadar antibiotik
Banyaknya senyawa antibiotik yang terserap akan meningkat bila kadarnya dinaikkan
(2) Lamanya kontak
Perubahan struktur atau metabolisme sel pada mulanya dapat bersifat reversible, namun akan berubah menjadi irreversible bila perlakuannya dalam jangka waktu yang lama
(3) Kepadatan suatu sel bakteri
Makin padat sel bakteri makin banyak antibiotik yang dibutuhkan, akan tetapi tergantung pada medium penguji antibiotik tersebut
penyusun dinding sel, 2) peningkatan permeabilitas membran sel yang menyebabkan kehilangan komponen penyusun sel, 3) menginaktifkan enzim metabolik, dan 4) destruksi atau kerusakan fungsi material genetik (Parhusip 2006). Terjadinya proses tersebut karena pelekatan senyawa antimikroba pada permukaan sel mikroba atau senyawa tersebut berdifusi ke dalam sel (Kanazawa et al. 1995 diacu dalam Parhusip 2006).
Hal-hal yang mempengaruhi kerja zat antibakteri tersebut antara lain konsentrasi zat antibakteri, waktu kontak antara bahan dengan zat antibakteri, jumlah bakteri, suhu, sifat-sifat bakteri, sifat-sifat medium serta sifat-sifat zat antibakteri (Pelczar dan Chan 2005).
Penggunaan antibiotik dibatasi baik jenis maupun jumlahnya. Kloramfenikol merupakan antibiotik yang dapat menghambat bakteri Gram positif dan negatif. Penggunaan kloramfenikol terbatas karena selain dapat merusak ribosom mitokondria pada sel mamalia ( Nugraheny 2001), juga dapat merusak eritrosit pada manusia (Baticados dan Paclibare 1992).
Pengaruh komponen antibakteri terhadap sel bakteri dapat menyebabkan kerusakan sel yang berlanjut pada kematian. Kerusakan sel yang ditimbulkan komponen antibakteri dapat bersifat mikrosidal (kerusakan bersifat tetap) atau mikostatik (kerusakan yang dapat pulih kembali). Suatu komponen akan bersifat mikrosidal atau mikostatik tergantung pada konsentrasi komponen dan kultur yang digunakan (Bloomfield 1991 diacu dalam Parhusip 2006).
2.5 Bakteri Patogen
yang terkontaminasi patogen. Berkaitan dengan mikroorganisme patogen, Huss et al. (2003) menyatakan bahwa bacterial foodborne pathogens dapat digolongkan ke dalam dua kelompok, yaitu food intoxication dan foodborne bacterial infection. Penyakit yang ditularkan melalui bahan pangan (foodborne disease) terjadi di negara-negara maju seperti USA. Peristiwa ini terjadi setelah konsumen mengkonsumsi makanan dari laut (seafood).
2.5.1 Bakteri Gram positif
Bakteri patogen Gram positif yang akan digunakan pada penelitian ini meliputi Staphylococcus aureus dan Bacillus cereus. Bakteri patogen ini sering mengkontaminasi bahan pangan. Struktur dinding sel bakteri Gram positif berbeda dengan dinding sel bakteri Gram negatif. Pada bakteri Gram positif, 90% dari dinding selnya terdiri dari lapisan peptidoglikan, sedangkan lapisan tipis lainnya adalah asam teikoat. Asam teikoat mengandung unit-unit gliserol atau ribitol yang terikat satu sama lain oleh ester fosfat, dan biasanya mengandung gula lainnya serta D-alanin. Karena asam teikoat bermuatan negatif, lapisan ini juga mempengaruhi muatan negatif pada permukaan sel (Fardiaz 1989). Selain mengandung asam teikoat, dinding sel bakteri Gram positif juga mengandung asam teikuronat yang bermuatan negatif. Molekul ini bersama lipoteikoat membentuk mikrofibril yang memudahkan pelekatan (Madigan et al. 2003). (1) Staphylococcus aureus
Staphylococcus aureus merupakan bakteri yang dapat menyebabkan keracunan stapilokokus. Bakteri ini termasuk dalam famili Micrococcaceae, umumnya membentuk pigmen berwarna kuning keemasan, memproduksi koagulase, dapat memfermentasi glukosa dan manitol dengan memproduksi asam dalam keadaan anaerobik. Sel bakteri ini berbentuk bulat (kokus) dan kecil dengan ukuran 0,5-1,0 mikron, tidak membentuk spora, katalase positif, biasanya selnya terdapat dalam kelompok seperti anggur, tetapi ada juga yang terdapat secara terpisah (tunggal) atau dalam jumlah empat sel (tetrad). Staphylococcus aureus hidup sebagai saprofit di dalam saluran pengeluaran lendir dari tubuh manusia dan hewan seperti hidung, mulut, tenggorokan, dan dapat dikeluarkan pada waktu bersin atau batuk. Bakteri ini juga sering terdapat pada pori-pori dan permukaan kulit, kelenjar keringat dan saluran usus (Fardiaz 1983).
melebihi sel vegetatifnya. Beberapa galur terutama yang bersifat patogenik memproduksi koagulase (menggumpalkan plasma), bersifat proteolitik, lipolitik dan beta hemolitik. Spesies lainnya, yaitu Staphylococcus epidermidis, biasanya tidak bersifat pathogen dan merupakan flora normal yang terdapat pada kullit tangan dan hidung. Staphylococcus aureus memproduksi pigmen berwarna kuning sampai oranye. Bakteri ini membutuhkan nityrogen organic (asam amino) untuk pertumbuhannya dan bersifat anaerobic fakultatif (Fardiaz 1989).
Bakteri Staphylococcus aureus merupakan penyebab kerusakan bahan pangan karena bila tumbuh pada bahan pangan dapat memproduksi enterotoksin yang tahan panas. Enterotoksin ini akan dikeluarkan ke medium atau bahan pangan. Jika makanan yang mengandung toksin ini masuk dalam pencernaan, maka akan terjadi muntah-muntah, mual dan diare setelah 1- 6 jam (Madigan et al. 2003).
Staphylococcus aureus adalah bakteri Gram positif berbentuk kokus, namanya berasal dari warna kekuningan dari koloni yang terbentuk pada beberapa media. Secara normal S. aureus terdapat pada hidung dan kadang-kadang pada kulit, bahkan dapat menyebabkan infeksi kulit. Bakteri ini juga ditemukan dalam jumlah sedikit di saluran usus. Beberapa strain S. aureus dapat memproduksi eksotoksin yang dapat menyebabkan foodborne disease. Pertumbuhan bakteri ini dalam makanan dapat terjadi jika makanan disimpan pada suhu ruang dalam waktu yang lama (Salyers dan Whitt 1994).
Rahayu (1999) menyatakan bahwa Staphylococcus aureus merupakan mikroba flora normal yang terdapat pada permukaan tubuh, rambut, mulut, tenggorokan. S. aureus banyak mencemari pangan karena tindakan kurang higienis dalam penanganan pangan.
(2) Bacillus cereus
Bacillus cereus merupakan bakteri Gram positif berbentuk batang dan berspora, secara normal berada dalam tanah, debu dan air. Bakteri ini memproduksi berbagai toksin ekstraselular dan enzim, termasuk lecithinase,
protease, β-lactamase, toksin yang membunuh tikus, cereolycin dan hemolysin. Bakteri ini tumbuh cepat pada makanan yang disimpan pada suhu 30-40 oC (Jay 2000). Spora bakteri ini resisten terhadap pengeringan dan mudah menyebar dengan debu (Huss et al. 2003).
pada suhu 4-5 oC pertumbuhannya tidak baik. Beberapa strain yang memproduksi toksin dapat tumbuh pada suhu 4-6 oC. Bacillus cereus dapat ditekan pertumbuhannya pada suhu rendah (chilling). Bakteri ini dapat menyebabkan keracunan, toksinnya menyebabkan diare (Jay 2000).
2.5.2 Bakteri Gram negatif
Bakteri Gram negatif yang akan digunakan pada penelitian ini antara lain Escherichia coli dan Vibrio harveyi. Escherichia coli merupakan bakteri patogen pada manusia, sedangkan Vibrio harveyi merupakan bakteripatogen yang sering menyebabkan kematian pada udang.
Bakteri Gram negatif memiliki lapisan luar dinding sel yang mengandung 5-10% peptidoglikan, selebihnya terdiri dari protein, lipopolisakarida dan lipoprotein. Lipopolisakarida (LPS) tidak hanya teridiri dari fosfolipid, tetapi juga mengandung polisakarida dan protein. Dinding sel bakteri Gram negatif mengandung tiga polimer yang terletak di luar lapisan peptidoglikan, yaitu lipoprotein, porin matriks dan lipopolisakarida. Lipopolisakarida dinding sel bakteri Gram negatif terdiri atas suatu lipid kompleks yang disebut lipid A. Lipid A terdiri atas suatu rantai satuan disakarida glukosamin yang dihubungkan dengan ikatan pirofosfat, dimana merupakan tempat melekatnya sejumlah asam lemak berantai panjang (Madigan et al. 2003).
(1) Vibrio harveyi
Vibrio merupakan bakteri patogen yang bisa hidup bebas di perairan laut dan dapat menyebabkan infeksi pada manusia maupun hewan. Kontaminasi bakteri ini bisa terjadi karena lingkungan maupun makanan yang berasal dari perairan yang tercemar oleh bakteri tersebut. Dalsgaard (2001) menyatakan bahwa ada lebih dari 12 Vibrio spp yang diketahui berhubungan dengan penyakit pada manusia.
(Lavilla-Pitogo 1995) serta Vibrio albensis (Suwanto et al. 1999). Luminous vibriosis telah dilaporkan menyebabkan mortalitas udang di Philipina (Lavilla-Pitogo 1995) dan penyakit ini disebabkan oleh bakteri yang menjadi masalah pada industri udang tidak hanya di Philipina tetapi juga negara lain.
Hampir semua luminescent vibriosis mempunyai karakteristik fisiologi dan morfologi yang serupa, yaitu: Gram negatif, berbentuk batang pendek, memfermentasi glukosa, oksidase dan katalase positif, motil, memproduksi H2S dan indole, mempunyai koloni berwarna hijau pada media TCBSA dengan suhu 28-37 oC (Naviner et al. 1999). Aktivitas dan pertumbuhan Vibrio harveyi secara umum dipengaruhi oleh faktor abiotik. Faktor tersebut antara lain suhu, tekanan osmose, cahaya, dan radiasi, keasaman, salinitas, kandungan bahan organik dan zat bakteriostatik serta bakterisida (Nugraheny 2001).
(2) Escherichia coli
Escherichia coli merupakan bakteri yang umumnya menghuni pencernaan hewan. Bentuknya pendek, batang Gram negatif dan diklasifikasikan sebagai enteric bacteria. Bakteri patogen ini dapat menyebabkan penyakit diare dan infeksi saluran urin. Enterohemorrhagic E. coli (EHEC) memproduksi verotoxin, yaitu suatu enterotoksin yang juga diproduksi Shigella dysenteriae, Shiga toksin. E. coli O157:H7, tumbuh dalam usus kecil dan memproduksi verotoxin yang dapat menyebabkan diare berdarah dan gagal ginjal. Pada umumnya infeksi terjadi pada orang yang mengkonsumsi daging yang tidak dimasak atau kurang matang yang terkontaminasi bakteri ini, biasanya daging cincang. Penyakit diare sering terjadi pada anak-anak di negara berkembang. Metode yang bisa digunakan untuk mencegah infeksi bakteri ini antara lain mengkonsumsi bahan pangan yang matang. Amerika Serikat telah mengijinkan penggunaan iradiasi untuk daging cincang agar tehindar dari infeksi bakteri ini (Madigan et al. 2003).
Escherichia coli merupakan penyebab acute watery diarrhea yang sering menimpa pendatang baru atau orang asing di negara-negara tertentu. Terjadinya strain EHEC dalam daging, susu, hasil ternak dan hasil laut cukup tinggi. Strain EHEC masih mampu hidup selama 18 hari pada suhu 4 oC dalam apel cincang dengan pH 3,91 – 5,11. Bakteri ini juga termasuk tidak tahan panas,
3 METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian yang terdiri dari beberapa tahap dilakukan pada tahun 2007-2008. Tahap kultivasi Chaetoceros gracilis, pemanenan, pengeringan biomasa, dan ekstraksi komponen aktif antibakteri, analisis aktivitas antibakteri, analisis kerusakan sel bakteri, dan analisis kandungan kimia dlakukan di Laboratorium Mikrobiologi Hasil Perairan dan Laboratorium Bioteknologi Hasil Perairan, Departemen Teknologi Hasil Perairan, FPIK, IPB, Bogor dan Laboratorium di lingkungan IPB. Pengamatan morfologi sel bakteri yang menggunakan Scanning Electron Microscopy (SEM) dilakukan di Laboratorium Bidang Biologi, LIPI Cibinong, sedangkan analisis kandungan kimia seperti komposisi asam amino menggunakan HPLC dan asam lemak menggunakan GC dilakukan di Laboratorium Terpadu IPB.
3.2 Bahan dan Alat
(1) Bahan
Bahan baku yang digunakan pada penelitian ini adalah mikroalga laut jenis Chaetoceros gracilis yang merupakan koleksi dari Pusat Penelitian Oseanografi, LIPI, Jakarta. Mikroalga ini terlebih dahulu disegarkan, selanjutnya ditumbuhkan di Laboratorium Bioteknologi Hasil Perairan, Departemen Teknologi Hasil Perairan, FPIK-IPB.
Beberapa bahan lain yang digunakan pada penelitian ini meliputi bahan untuk proses kultivasi mikroalga Chaetoceros gracilis, yaitu urea, tripple super fosfat (TSP), silika, vitamin, trace element. Bahan untuk ekstraksi (metanol dan heksan), bahan untuk karakterisasi komponen aktif yang meliputi Mueller Hinton Agar (MHA), Nutrient Broth (NB), bahan untuk analisis kerusakan bakteri, serta bahan-bahan untuk analisis komposisi kimia dan fitokimia biomasa Chaetoceros gracilis.
Staphylococcus aureus ATCC 25923 dan Bacillus cereus ATCC 13091 (diperoleh dari Departemen Kesehatan Masyarakat Veteriner, Institut Pertanian Bogor). Bakteri-bakteri ini disegarkan dalam Nutrien Agar, sedangkan Vibrio harveyi disegarkan dalam medium sea water complete (SWC)
(4) Peralatan
Peralatan yang digunakan pada penelitian ini terdiri dari peralatan untuk kultivasi Chaetoceros gracilis (erlenmeyer, akuarium, pompa udara, lampu dan sebagainya), peralatan untuk pemanenan biomasa (filter keramik, pompa, freeze dryer dan sebagainya) serta alat untuk ekstraksi komponen aktif (vortex, magnetic stirrer, evaporator dan sebagainya). Selain itu juga digunakan peralatan untuk analisis aktivitas antibakteri (inkubator, clean bench, oven sterilisasi, autoklaf, refrigeraor dan sebagainya), peralatan untuk analisis kerusakan bakteri (sentrifus, refrigerator, freezer dan sebagainya), peralatan untuk analisis morfologi sel bakteri (mikroskop elektron) serta beberapa peralatan untuk analisis kandungan kimia (HPLC, GC, AAS, Gen Quant).
3.3 Tahapan Penelitian dan Analisis
Penelitian ini dibagi menjadi empat percobaan, yaitu: (1) Kultivasi Chaetoceros gracilis dalam medium NPSi
(2) Ekstraksi, uji aktivitas dan stabilitas senyawa antibakteri dari ekstrak Chaetoceros gracilis
(3) Analisis kerusakan bakteri setelah kontak dengan ekstrak Chaetoceros gracilis
(4) Analisis komposisi kimia dari biomasa Chaetoceros gracilis. 3.3.1 Kultivasi Chaetoceros gracilis dalam medium NPSia
Tahap 1 Kultivasi mikroalga C. gracilis
Mikroalga ditumbuhkan pada medium NPSi dalam flask yang dilengkapi dengan aerasi terus menerus, lampu neon 20 Watt (2500 lux) yang dinyalakan terus menerus dan dilakukan pada ruangan dengan suhu 25 -26 oC. Komposisi medium NPSi disajikan pada Lampiran 1.
Tahap 2 Pemanenan Chaetoceros gracilis
Produksi biomasa sel ditentukan dengan menghitung berat biomasa kering. Analisis rendemen biomasa Chaetoceros gracilis dilakukan dengan menghitung rendemenbiomasa dengan cara membagi berat kering tersebut dengan volume panen kultur.
Tahap 3 Penentuan kurva pertumbuhan Chaetoceros gracilis
Penghitungan sel dalam kultur dilakukan dengan cara melakukan sampling setiap hari sampai kultur mencapai fase kematian. Penghitungan atau analisis jumlah sel dilakukan dengan metode hitungan langsung menggunakan hemasitometer dan mikroskop (Hadioetomo 1993). Kurva pertumbuhan Chaetoceros gracilis ditentukan dengan melakukan penghitungan jumlah setiap hari, selanjutnya dibuat kurva pertumbuhan.
3.3.2 Ekstraksi, uji aktivitas dan stabilitas senyawa antibakteri dari ekstrak Chaetoceros gracilis
Tahap 1 Ekstraksi senyawa antibakteri dari Chaetoceros gracilis
Ekstraksi senyawa antibakteri dilakukan dengan menggunakan metanol. Metode ekstraksi mengacu pada laporan Wang (1999), Naviner et al. (1999),dan Nugraheny (2000), yang dimodifikasi. Tahap ekstraksi dilakukan dengan metode maserasi, yaitu sampel direndam dalam pelarut yang digunakan. Pada penelitian ini, metode maserasi dikombinasi dengan pengadukan (stirring) menggunakan magnetic stirrer. Sebelum tahap maserasi, biomasa Chaetoceros gracilis dipecah selnya dengan menggunakan glass beads dan vorteks Tujuan pemecahan sel ini antara lain agar komponen aktif yang ada di dalam sel mudah keluar sehingga diperoleh lebih banyak.
Tahap 2 Analisis aktivitas antibakteri dari ekstrak mikroalga Chaetoceros gracilis pada bakteri uji
Ekstrak dari Chaetoceros gracilis yang diperoleh diaplikasikan pada beberapa jenis bakteri patogen Gram negatif (Escherichia coli ATCC 25922 dan Vibrio harveyi ) serta bakteri Gram positif (Bacillus cereus ATCC 13091 dan Staphylococcus aureus ATCC 25923)
1) Persiapan media pertumbuhan bakteri uji
yang sebelumnya disiapkan dalam tabung reaksi sebanyak 20 ml. Kedua media ini disterilkan sebelum digunakan.
2) Pengujian senyawa antibakteri
Pengujian antibakteri dilakukan menggunakan metode difusi agar, dimana ekstrak diteteskan ke dalam paper disc, selanjutnya diletakkan ke dalam media MHA beku yang telah mengandung bakteri. Kemudian diinkubasi selama 18-24 jam pada suhu 37 oC, selanjutnya diukur diameter hambatan yang terbentuk. Adanya zona bening menunjukkan adanya hambatan terhadap pertumbuhan bakteri yang diuji.
Tahap 3 Analisis potensi daya hambat relatif antibakteri terhadap berbagai antibiotik komersial
Potensi antibakteri dilakukan dengan membandingkan diameter hambatan yang terbentuk di sekitar paper disc yang telah diberi ekstrak dengan paper disc lain yang mengandung antibiotik sintetis komersial (kloramfenikol, tetrasiklin, oksitetrasiklin, dan ampisilin) dengan konsentrasi sama. Masing-masing uji dilakukan 2 kali ulangan, Masing-masing-Masing-masing duplo. Potensi dapat diukur dengan rumus:
Diameter hambatan ekstrak
% Potensi daya hambat = x100 % Diameter hambatan antibiotik
Tahap 4 Analisis stabilitas senyawa antibakteri dari ekstrak Chaetoceros gracilis Stabilitas ekstrak dilakukan untuk mengetahui aktivitas antibakteri dari ekstrak C. gracilis yang disimpan sampai 6 bulan pada suhu -18 – (-20 oC). Ekstrak C. gracilis disimpan selama 1,2 3, dan 6 bulan. Ekstrak diuji aktivitas antibakterinya menggunakan metode difusi agar, seperti pada uji aktivitas antibakteri.
3.3.3 Analisis pengaruh ekstrak Chaetoceros gracilis terhadap kerusakan bakteri
Tahap 1 Analisis kebocoran sel bakteri (Bunduki et al. 1995)
Pengamatan kebocoran sel dilakukan untuk mempelajari bagaimana ekstrak mengganggu permeabilitas membran sel. Mekanisme perusakan membran sel merupakan salah satu tanda tidak normalnya sel setelah ada perlakuan ekstrak. Analisis kebocoran sel dilakukan dengan menggunakan Spektrofotometer pada panjang gelombang 280 nm dan 260 nm. Panjang gelombang 280 nm digunakan untuk mengukur protein sel yang bocor, sedangkan panjang gelombang 260 nm untuk mengukur kadar asam nukleat yang bocor.
Tahap 2 Analisis N-asetil-glukosamin (Reissig yang diacu oleh Bintang 1993) Percobaan ini dilakukan dengan tujuan untuk menentukan pengaruh antibakteri terhadap dinding sel bakteri dengan cara mengukur kadar N-asetil-glukosamin sebagai prazat mukopeptida pembentuk dinding sel.
Tahap 3 Analisis morfologi sel bakteri
Analisis morfologi sel dilakukan untuk mempelajari morfologi sel akibat penggunaan ekstrak antibakteri. Morfologi sel yang dikontakkan dengan ekstrak maupun tidak dikontakkan dengan ekstrak diamati menggunakan Scanning Electron Microscopy (SEM).
3.3.4 Analisis kandungan senyawa kimia Chaetoceros gracilis
Tahap 1 Analisis kandungan protein, lemak dan karbohidrat
Analisis kandungan protein, lemak dan karbohidrat dilakukan pada biomasa Chaetoceros gracilis menggunakan metode Lowrey et al. (1951), Blight dan Dryer (1959), dan Kochert (1978) yang diacu dalam Chrismada (1993) Tahap 2 Analisis komposisi asam amino
Analisis komposisi asam amino dilakukan pada biomasa Chaetoceros gracilis dengan menggunakan High Performance Liquid Chromatography (Shimadzu) Kondisi alat yang digunakan adalah sebagai berikut:
Kolom : Ultra techspere Laju aliran fase mobil : 1 mL/menit Detektor : Fluoresensi
Tahap 3 Analisis komposisi lemak
Analisis komposisi asam lemak dilakukan pada biomasa Chaetoceros gracilis dengan menggunakan Gas Chromatography (Shimadzu). Kondisi alat yang digunakan adalah sebagai berikut:
Kolom : Cyanopropil methyl sil (capillary column) Laju alir N2 : 20 mL/menit
Laju alir H2 : 30 mL/menit
Laju alir udara : 200 – 250 mL/menit Suhu injektor : 220 oC
Suhu detector : 240 oC Suhu kolom : 125 oC Volume injek : 1 µL Diameter kolom : 0,25 mm Tahap 4 Analisis kandungan mineral
Analisis komposisi kandungan mineral dilakukan pada biomasa Chaetoceros gracilis menggunakan Atomic Absorbtion Spectrophotometer (Hitachi Z 5000).
Tahap 5 Analisis fitokimia dan asam nukleat
4 KULTIVASI
Chaetoceros gracilis
DALAM MEDIUM NPSi
4.1 Pendahuluan
4.1.1 Latar belakang
Indonesia memiliki potensi keanekaragaman hayati perairan yang luar biasa besarnya. Sumberdaya yang tidak dapat secara langsung dikomersialkan seperti mikroflora dan fauna dengan kandungan senyawa metabolit primer dan sekundernya masih relatif kurang dijamah (Effendi 2002).
Chaetoceros adalah jenis mikroalga atau diatom laut yang mudah untuk dibudidayakan, dimana suhu optimum dan salinitas optimum untuk Chaetoceros sp masing-masing berkisar antara 25-30 oC dan antara 17-30 ppt (Isnansetyo dan Kurniastuty 1995). Spesies ini dapat hidup pada suhu 10-20 oC dan dapat dikultur masal pada air laut yang diperkaya dengan pupuk anorganik atau pupuk kandang (BBLL 2002). Genus Chaetoceros memiliki lebih dari 160 spesies dan merupakan genus terbesar dari Kelas Bacillariophyceae yang hidup di perairan dingin sampai perairan panas. Chaetoceros memiliki setae dan digunakan untuk membentuk filamen yang membuatnya terus melayang di permukaan air (Lee 2008).
Chaetoceros merupakan jenis mikroalga yang paling umum dijumpai di perairan lepas pantai Indonesia, sering disebut golden-brown algae karena kandungan pigmen kuning lebih banyak dari pigmen hijau sehingga bila padat populasinya, perairan akan terlihat coklat muda (Arinardi et al. 1997). Wang (1999) menyatakan bahwa sel secara individu dari Chaetoceros berbentuk kotak, mempunyai dimensi lebar 12 sampai 14 mikron, dan panjang 15 sampai 17 mikron, dengan jarum di ujungnya. Sel ini bisa membentuk rantai sekitar 10 sampai 20 sel, ketika dikultur dengan aerasi kuat.
Medium pertumbuhan yang biasa digunakan untuk kultivasi Chaetoceros adalah medium Guillard. Namun harga medium ini cukup mahal, sehingga perlu dicari alternatif medium yang lebih murah. Larastri (2006) menyatakan bahwa Chaetoceros sp dan beberapa diatom lain dapat ditumbuhkan dalam medium NPSi, namun belum dikembangkan. Oleh karena itu perlu dilakukan penelitian Chaetoceros gracilis yang diperoleh dari perairan Indonesia menggunakan medium pertumbuhan NPSi. Hal ini dilakukan untuk mendapatkan medium yang sesuai untuk pertumbuhan Chaetoceros gracilis dengan harga murah, sehingga pemanfaatannya lebih optimal.
4.1.2 Tujuan
Tujuan dari penelitian ini adalah mendapatkan pola pertumbuhan Chaetoceros gracilis yang ditumbuhkan dalam medium NPSi dan menentukan rendemen biomasa Chaetoceros gracilis yang ditumbuhkan dalam medium NPSi.
4.2 Bahan dan Metode
4.2.1 Bahan dan alat (1) Bahan baku
Bahan baku yang digunakan pada penelitian ini meliputi mikroalga laut jenis Chaetoceros gracilis. Mikroalga laut sebagai bahan baku pada penelitian ini dipanen pada umur 7 hari. Medium yang digunakan untuk menumbuhkan Chaetoceros gracilis adalah NPSi, yang terdiri dari urea, triple super fosfat (TSP) dan natrium silika yang dibeli di toko pertanian dan toko kimia. Selain itu juga ditambahkan vitamin B12, biotin, dan vitamin B1 yang dibeli di apotek, serta trace element seperti CuSO4 5H2O, ZnSO4 7H2O, NaMoO4 2H2O, (NH4)6Mo7O24 4H2O, CoCl2 6H2O, MnCl2 4H2O.
(2) Alat
4.2.2 Metode penelitian
(1) Kultivasi Chaetoceros gracilis dalam medium NPSi
Chaetoceros gracilis ditumbuhkan dalam flask yang dilengkapi dengan aerasi dan lampu 20 Watt (2500 lux) yang dilakukan terus menerus. Kultivasi dilakukan pada ruangan yang dilengkapi dengan AC bersuhu sekitar 25-26 oC. Hal ini mengacu pada Lailati (2007) yang melaporkan bahwa kultur Chaetoceros gracilis pada ruangan yang dilengkapi AC dengan lama penyinaran 24 jam menghasilkan rendemen biomasa sel lebih besar dibanding 12 jam, pada tempat dan kondisi sama.
Komposisi medium NPSi yang digunakan mengikuti peneliti sebelumnya, yaitu N:P:Si = 3:1:4 (Larastri 2006). Komposisi medium yang digunakan untuk pertumbuhan Chaetoceros gracilis disajikan pada Lampiran 1. Kultur Chaetoceros gracilis dibuat dengan cara menambahkan sebanyak 10 % stok kultur ke dalam wadah yang telah berisi medium NPSi.
(2) Penentuan kurva pertumbuhan
Untuk mengetahui kurva pertumbuhan C. gracilis, maka dilakukan analisis penghitungan jumlah sel dari awal kultivasi sampai akhir kultivasi (fase kematian) dengan metode hitungan langsung menggunakan haemositometer dan mikroskop.. Kurva pertumbuhan ini bertujuan untuk menentukan umur panen Chaetoceros gracilis.
Pertumbuhan mi