GAMBARAN KUALITATIF BAKTERI
PROBIOTIK (LACTOBACILLUS SP.)
DALAM SUSU FERMENTASI
Oleh:
NANDINII RAMASENDERAN
080100332
FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
MEDAN
GAMBARAN KUALITATIF BAKTERI
PROBIOTIK (LACTOBACILLUS SP.)
DALAM SUSU FERMENTASI
KARYA TULIS ILMIAH
Oleh:
NANDINII RAMASENDERAN
080100332
FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
MEDAN
LEMBAR PENGESAHAN
Judul: GAMBARAN KUALITATIF BAKTERI PROBIOTIK
(Lactobacillus sp.) DALAM SUSU FERMENTASI.
Nama: NANDINII RAMASENDERAN
NIM: 080100332
Pembimbing: Penguji I:
(dr. Yahwardiah Siregar, PhD) (dr. T. Ibnu Alferalli, Sp. PA)
Penguji II:
(dr. Isti Ilmiati Fujiati, MSc.)
Medan, Desember 2011 Dekan
Fakultas Kedokteran Universitas Sumatera Utara
( Prof. dr. Gontar Alamsyah Siregar, Sp.PD – KGEH )
NIP: 19540220 198011 1 001
ABSTRAK
Bakteri probiotik atau dikenali sebagai bakteri asam laktatsangat populer di industri susu karena manfaat terapeutiknya. Bakteri ini banyak digunakan dalam produksi makanan dan minuman fermentasi dan memberikan kontribusi baik untuk kualitas makanan dan pencegahan pembusukan. Untuk memberikan manfaat kesehatan, konsentrasi disarankan adalah 10 6 cfu (colony forming unit) /g (atau per mL) produk (Shan, 2000). Namun, penelitian telah menunjukkan
kebutuhan untuk memantau kelangsungan hidup Lactobacillus sp. dari suatu produk fermentasi sering diabaikan, dengan akibat sejumlah produk mencapai tangan konsumer mempunyai jumlah bakteri hidup di bawah tahap optimum (Saunders et. al, 2007).
Penelitian ini bertujuan untuk mengetahui secara kualitatif adanya dan kelangsungan hidup (viabilitas) bakteri probiotik (Lactobacillus sp.) dalam susu fermentasi.
Penelitian ini bersifat deskriptif eksperimental dengan pendekatan
cross-sectional, di mana dilakukan pengumpulan data pada 65 sampel produk-produk
susu fermentasi yang terdapat di Kota Medan. Sampel-sampel ini kemudian diencerkan dengan aquabidest pada tingkat pengenceran berbeda (10-3,10-4,10
-6
,10-7) dan dikultur pada media Rogosa SL agar selama 48 jam.
Hasil positif ditentukan dengan adanya pertumbuhan koloni bakteri pada medium agar. Dari penelitian ini, didapatkan pada tingkat pengenceran 10-6, sejumlah 4 sampel memberikan hasil positif. Kebanyakan produk susu fermentasi yang dipasarkan masih tidak mencapai standard yang ditetapkan dan diperlukan pengawasan ketat dari Badan Pengawas Obat dan Makanan (BPOM).
Kata kunci: probiotik, viabilitas, tingkat pengenceran, Rogosa SL agar
ABSTRACT
Probiotic bacteria, or identified as lactic acid bacteria are very popular in the dairy industry for its therapeutic benefits. These bacteria are widely used in the production of fermented foods and beverages and contribute both to the quality of food and preventing spoilage of food. To provide health benefits, recommended concentration is 106 cfu (colony forming units) / g (or per mL) product (Shan, 2000). However, research has shown the need to monitor the viability of
Lactobacillus sp. from fermented products are often overlooked, with the result
that a number of products that reaches the consumers has a total number of viable bacteria under the optimum stage (Saunders et. al, 2007).
This study aims to determine qualitatively the existence and survival (viability) of probiotic bacteria (Lactobacillus sp.) in fermented milk products.
This study is a descriptive cross-sectional approach, in which the data from the laboratory trial was provided from 65 samples of fermented milk products obtained from Medan. These samples were then diluted with distilled water at different levels of dilution (10-3, 10-4, 10-6, 10-7) and then cultured on Rogosa SL medium for 48 hours.
A positive result was determined by the growth of bacterial colonies on the agar. It was obtained, that 4 samples had positive results at their standard dilution level of 10-6. Most of the fermented milk products that are marketed have yet to reach the standards and therefore a strict supervision by the Food and Drug Supervisory Agency (BPOM) is crucial.
Key words: probiotic, viability, levels of dilution, Rogosa SL agar
Kata Pengantar
Puji syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa atas segala rahmatnya sehingga dapat menyelesaikan penyusunan Laporan Hasil Penelitian yang berjudul, “Gambaran Kualitatif Bakteri Probiotik (Lactobacillus sp.) Dalam Susu Fermentasi”.
Dalam penulisan laporan ini penulis merasa masih banyak kekurangan baik pada teknis penulisan maupun materi, mengingat akan kemampuan yang dimiliki penulis. Untuk itu kritik dan saran dari semua pihak sangat penulis harapkan demi penyempurnaan pembuatan laporan ini.
Dalam penulisan laporan ini penulis menyampaikan ucapan terima kasih yang tak terhingga kepada pihak-pihak yang membantu dalam menyelesaikan penelitian ini, khususnya kepada :
1. Dr Yahwardiah Siregar, PhD. selaku dosen pembimbing yang telah meluangkan
waktu, tenaga dan pikiran dalam pelaksanaan bimbingan, pengarahan, dan dorongan dalam rangka penyelesaian penyusunan laporan ini.
2. Tuan Andre, selaku Pengurus Besar Laboratorium Klinik Prodia, Medan, yang sudi memberi keizinan kepada peneliti menggunakan tempat, fasilitas dan peralatan laboratorium selama penelitian dilakukan.
3. Analyst Mikrobiologi Lab. Klinik Prodia, Ibu Annatia Kristin Damayanti yang telah banyak menolong serta memberi tunjuk ajar kepada peneliti selama pelaksanaan percobaan ini.
4. Semua pihak yang tidak dapat disebutkan satu persatu, yang telah memberikan bantuan dalam penulisan laporan ini.
Semoga materi ini dapat bermanfaat dan menjadi sumbangan pemikiran bagi pihak yang membutuhkan, khususnya bagi penulis sehingga tujuan yang diharapkan dapat tercapai, Amiin.
Medan, 5 Disember 2011
DAFTAR ISI
Halaman
HALAMAN PERSETUJUAN... i
ABSTRAK………..………. ii
ABSTRACT………..……….. iii
KATA PENGANTAR... iv
DAFTAR ISI... v
DAFTAR TABEL ... viii
DAFTAR GAMBAR... ix
DAFTAR LAMPIRAN... x
BAB 1 PENDAHULUAN... 1
1.1. Latar Belakang... 1
1.2. Rumusan Masalah... 3
1.3. Tujuan Penelitian... 3
1.4. Manfaat Penelitian... 4
BAB 2 TINJAUAN PUSTAKA... 5
2.1: Bakteri Probiotik... 5
2.1.1: Definisi probiotik... 5
2.1.2: Kandungan probiotik... 6
2.1.2.1:Bakteri asam laktat... 6
2.2: Bakteri probiotik untuk konsumsi manusia secara komersial... 7
2.2.1:L.acidophilus... 7
2.2.2:L.casei... 8
2.2.3:L.paracasei... 8
2.3: Faktor-faktor yang mempengaruhi viabilitas probiotik dalam
makanan/minuman... 9
2.3.1:Pilihan bakteri probiotik/ Kombinasi makanan... 9
2.3.2:Keadaan fisiologis probiotik... 11
2.3.3:Suhu... 12
2.3.4:pH... 12
2.3.5:Aktivitas dalam air... 13
2.3.6:Oksigen... 14
2.3.7:Freeze-Thawing... 14
2.4: Mekanisme kerja bakteri probiotik... 15
2.4.1:Adhesi pada mukosa usus dan epitel oleh bakteri probiotik 15 2.4.2:Adhesi dan aggregasi dari gabungan bakteri probiotik dan pathogen... 16
2.4.3:Pengaruh imun dari bakteri probiotik... 18
2.5: Peranan bakteri probiotik dalam kesehatan dan penyakit... 19
2.5.1: Pencegahan dan penatalaksanaan untuk infeksi oral dan karies dental... 19
2.5.2:Penatalaksanaan untuk irritable bowel syndrome (IBS) 19
2.5.3: Pencegahan untuk kanker usus... 20
BAB 3 KERANGKA KONSEP DAN DEFINISI OPERASIONAL.. 22
3.1. Kerangka Konsep Penelitian... 22
3.2. Definisi Operasional... 23
BAB 4 METODE PENELITIAN... 25
4.1. Jenis Penelitian... 25
4.2. Waktu dan Tempat Penelitian... 25
4.2.1. Waktu Penelitian... 25
4.2.2. Tempat Penelitian... 25
4.3. Populasi dan Sampel... 25
4.3.1 Populasi... 25
4.3.2. Sampel... 26
4.4.Metode Percobaan... 28
4.5. Teknik Pengumpulan Data... 29
4.6. Pengolahan dan Analisis Data... 29
BAB 5 HASIL PENELITIAN... 30
5.1. Hasil Penelitian... 30
5.1.1. Deskripsi Lokasi Penelitian... 30
5.1.2. Deskripsi Karakteristik Sampel... 30
5.1.3. Hasil Analisa... 31
5.2 Pembahasan... 38
BAB 6 KESIMPULAN DAN SARAN... 41
DAFTAR PUSTAKA... 43
LAMPIRAN... 50
DAFTAR TABEL
Nomor Judul Halaman
2.4.1 Faktor-faktor yang mempengaruhi adhesi
probiotik...17
5.1.3.1 Koloni yang tumbuh pada tingkat pengenceran 10-6...31
5.1.3.2 Koloni yang tumbuh pada tingkat pengenceran 10-7...32
5.1.3.3 Hasil kultur sampel No. 01024...33
5.1.3.4 Koloni yang tumbuh pada tingkat pengenceran 10-3...34
5.1.3.5 Koloni yang tumbuh pada tingkat pengenceran 10-4...35
5.1.3.6 Koloni yang tumbuh pada tingkat pengenceran 10-6...35
5.1.3.7 Koloni yang tumbuh pada tingkat pengenceran 10-7...36
5.1.3.8 Koloni yang tumbuh pada tingkat pengenceran 10-3...36
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar 2.5 Efek bermanfaat yang dipostulasi pada tubuh
manusia dengan mengkonsumsi probiotik ...20
Gambar 3.1 Kerangka konsep penelitian……….21
Gambar 5.1.3.1 Hasil kultur negatif bagi pertumbuhan Lactobacillus sp...31
Gambar 5.1.3.2 Hasil kultur positif bagi pertumbuhan Lactobacillus sp...32
Gambar 5.1.3.3 Pengenceran sampel kontrol sebanyak 7 kali...32
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lampiran 1 Daftar riwayat hidup 50
Lampiran 2 Surat Kebenaran Pengambilan Data……….51
Lampiran 3 Data sampel mengikut kategori dan masa kadaluarsa...52
ABSTRAK
Bakteri probiotik atau dikenali sebagai bakteri asam laktatsangat populer di industri susu karena manfaat terapeutiknya. Bakteri ini banyak digunakan dalam produksi makanan dan minuman fermentasi dan memberikan kontribusi baik untuk kualitas makanan dan pencegahan pembusukan. Untuk memberikan manfaat kesehatan, konsentrasi disarankan adalah 10 6 cfu (colony forming unit) /g (atau per mL) produk (Shan, 2000). Namun, penelitian telah menunjukkan
kebutuhan untuk memantau kelangsungan hidup Lactobacillus sp. dari suatu produk fermentasi sering diabaikan, dengan akibat sejumlah produk mencapai tangan konsumer mempunyai jumlah bakteri hidup di bawah tahap optimum (Saunders et. al, 2007).
Penelitian ini bertujuan untuk mengetahui secara kualitatif adanya dan kelangsungan hidup (viabilitas) bakteri probiotik (Lactobacillus sp.) dalam susu fermentasi.
Penelitian ini bersifat deskriptif eksperimental dengan pendekatan
cross-sectional, di mana dilakukan pengumpulan data pada 65 sampel produk-produk
susu fermentasi yang terdapat di Kota Medan. Sampel-sampel ini kemudian diencerkan dengan aquabidest pada tingkat pengenceran berbeda (10-3,10-4,10
-6
,10-7) dan dikultur pada media Rogosa SL agar selama 48 jam.
Hasil positif ditentukan dengan adanya pertumbuhan koloni bakteri pada medium agar. Dari penelitian ini, didapatkan pada tingkat pengenceran 10-6, sejumlah 4 sampel memberikan hasil positif. Kebanyakan produk susu fermentasi yang dipasarkan masih tidak mencapai standard yang ditetapkan dan diperlukan pengawasan ketat dari Badan Pengawas Obat dan Makanan (BPOM).
Kata kunci: probiotik, viabilitas, tingkat pengenceran, Rogosa SL agar
ABSTRACT
Probiotic bacteria, or identified as lactic acid bacteria are very popular in the dairy industry for its therapeutic benefits. These bacteria are widely used in the production of fermented foods and beverages and contribute both to the quality of food and preventing spoilage of food. To provide health benefits, recommended concentration is 106 cfu (colony forming units) / g (or per mL) product (Shan, 2000). However, research has shown the need to monitor the viability of
Lactobacillus sp. from fermented products are often overlooked, with the result
that a number of products that reaches the consumers has a total number of viable bacteria under the optimum stage (Saunders et. al, 2007).
This study aims to determine qualitatively the existence and survival (viability) of probiotic bacteria (Lactobacillus sp.) in fermented milk products.
This study is a descriptive cross-sectional approach, in which the data from the laboratory trial was provided from 65 samples of fermented milk products obtained from Medan. These samples were then diluted with distilled water at different levels of dilution (10-3, 10-4, 10-6, 10-7) and then cultured on Rogosa SL medium for 48 hours.
A positive result was determined by the growth of bacterial colonies on the agar. It was obtained, that 4 samples had positive results at their standard dilution level of 10-6. Most of the fermented milk products that are marketed have yet to reach the standards and therefore a strict supervision by the Food and Drug Supervisory Agency (BPOM) is crucial.
Key words: probiotic, viability, levels of dilution, Rogosa SL agar
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Di seluruh dunia, beragam produk probiotik sudah dipasarkan, antara lain yogurt, keju, susu fermentasi dan tidak difermentasi, jus, smoothies, sereal, bar gizi, dan susu bubuk bayi dan balita adalah contoh makanan yang telah difortifikasi dengan bakteri probiotik (Sanders, et al., 2007).
Bakteri probiotik atau lebih umum dikenali sebagai bakteri asam laktat, termasuk Lactobacillus sp. seperti Lactobacillus casei, Lactobacillus acidophilus
dan Bifidobacterium sp. Bakteri ini menjadi sangat populer di industri susu karena
manfaat terapeutiknya, seperti perbaikan dalam gangguan pencernaan dan intoleransi laktosa, kadar vitamin yang berubah dalam susu, antagonisme terhadap organisme patogen dan kegiatan antimutagenik dan anti-karsinogenik. Bakteri ini banyak digunakan dalam produksi makanan dan minuman fermentasi dan memberikan kontribusi baik untuk kualitas sensor makanan dan pencegahan pembusukan. Organisme ini telah menambahkan dimensi baru pentingnya susu fermentasi dalam nutrisi dan kesehatan manusia. Selain itu, bakteri ini hadir
dalam jumlah yang besar pada sistem gastrointestinal manusia sebagai flora normal (Sgouras, et al., 2004).
Manfaat kesehatan dari konsumsi bakteri asam laktat telah dikenal sejak Metchnikoff (1908) pertama meneliti hubungan umur panjang petani Bulgaria dengan konsumsi susu fermentasi. Istilah 'probiotik' pertama kali dijelaskan oleh Fuller (1989) dalam Lee dan Salminen (2009) sebagai a live microbial feed supplement yang menguntungkan host dengan meningkatkan keseimbangan mikroba usus manusia.
Penelitian terbaru telah membuktikan beberapa manfaat kesehatan dari organisme probiotik yang masuk ke saluran pencernaan. Ini termasuk kemampuan mereka untuk meredakan gejala intoleransi (DeVerse, et al., 1992), meningkatkan
fungsi kekebalan tubuh, menurunkan kolesterol potensial (Guandilini, et al., 2000), aktivitas antimutagenik dan pengobatan diare (Lankaputhra dan Shah, 1998).
Lokasi target utama probiotik setelah diminum adalah di usus, untuk mikroflora dan sistem kekebalan tubuh yang terkait, dan karena itu penyelidikan dan studi klinis infeksi di luar usus agak sedikit (Schrenzenmeir dan deVerse, 2001). Terapi aktivitas bakteri probiotik dapat disebabkan oleh persaingan dengan patogen untuk nutrisi, perlekatan mukosa dan produksi zat antimikroba (O'Sullivan, et al., 2005).
Manfaat kesehatan diperoleh oleh konsumsi makanan yang mengandung bakteri probiotik didokumentasikan dengan baik dan lebih dari 90 produk probiotik sudah tersedia di seluruh dunia. Untuk memberikan manfaat kesehatan, konsentrasi disarankan untuk bakteri probiotik adalah 10 6 cfu (colony forming unit) /g produk (Shah, 2000). Namun, penelitian telah menunjukkan viabilitas rendah probiotik dalam pasaran (Shah, et al., 1995). Sejumlah faktor telah diklaim untuk mempengaruhi kelangsungan hidup bakteri probiotik dalam makanan fermentasi termasuk asam dan hidrogen peroksida yang dihasilkan oleh bakteri serta kandungan oksigen dalam produk tersebut (Shah, 2000). Viabilitas bakteri probiotik menurun dalam produk fermentasi dari waktu ke waktu karena keasaman produk, suhu penyimpanan, lama penyimpanan, dan kekurangan nutrisi (Dave dan Shah, 1997(i)) yang menyebabkan produk-produk ini memiliki umur simpan yang terbatas (Dave dan Shah, 1996). Kebutuhan untuk memantau kelangsungan hidup Lactobacillus sp. dari suatu produk fermentasi sering diabaikan, dengan akibat bahwa sejumlah produk mencapai pasaran dengan jumlah bakteri hidup di bawah tahap optimum. (Sanders, et al., 2007).
Beberapa contoh dokumen studi tentang makanan dan suplemen yang baik tidak mengandung jumlah probiotik ditetapkan pada label atau tidak menggunakan tata-nama ilmiah yang benar untuk nama mikroba ini. Beberapa produk (banyak yogurt termasuk dalam kategori ini) tidak membuat klaim potensi
keselamatan hanya mengenai strain probiotik yang digunakan, bahkan, bagaimana strain yang digunakan dan siapa yang mengkonsumsinya belum dipertimbangkan (Sanders, et al., 2007). Selain itu, beberapa produk probiotik berlabel menunjukkan efek kesehatan yang belum didokumentasikan.
Sangat disayangkan bahwa produk saat ini dapat dilabel sebagai probiotik
tetapi tidak didefinisikan dengan baik atau dibuktikan dengan studi terkontrol manusia (Sanders, et al., 2007). Persyaratan di Amerika Serikat adalah bahwa produk diberi label secara benar dan tidak menyesatkan; persyaratan ini berlaku untuk kandungan serta klaim fungsinya. Banyak produk komersial mungkin tidak
memenuhi kriteria ini, sebagaimana dibuktikan oleh survei, yaitu studi derajat ketidakpatuhan label dengan angka atau jenis mikroba probiotik yang layak pulih dari produk komersial (Drisko, et al., 2005; Temmerman, et al., 2003; Yeung, et al., 2002).
Dalam beberapa produk tidak menunjukkan kuantitas probiotik pada label, tetapi pada website produk tersebut mungkin memberikan informasi tingkat dikirimkan per porsi. Beberapa produk suplemen diberi label yang menyatakan jumlah yang layak probiotik per dosis pada saat pembuatan. Beberapa suplemen menunjukkan dosis untuk mengkonsumsi sebagai fungsi dari satu gram atau jumlah kapsul tetapi tidak berhubungan dengan colony forming unit (CFU) (Sanders, et al., 2007).
1.2. Rumusan Masalah
Berdasarkan latar belakang diatas, maka masalah dalam penelitian ini
adalah “bagaimana gambaran kualitatif dari bakteri probiotik
(Lactobacillus sp.) dalam susu fermentasi?”
1.3. Tujuan Penelitian
Tujuan Umum
Tujuan Khusus
Mengetahui jenis bakteri probiotik dalam susu fermentasi.
Mengetahui aktivitas pertumbuhan bakteri probiotik pada tingkat pengenceran 10-6.
Mengetahui aktivitas pertumbuhan bakteri probiotik pada tingkat pengenceran 10-3, 10-4 dan 10-7.
Mengetahui gambaran jumlah koloni bakteri probiotik pada tingkat pengenceran yang berbeda.
Mengetahui apakah jenis kategori produk fermentasi mempengaruhi viabilitas bakteri pada tingkat pengenceran 10-6.
Mengetahui apakah tingkat pengenceran yang berbeda mempengaruhi viabilitas pertumbuhan bakteri.
Mengetahui apakah masakadaluarsa produk mempengaruhi viabilitas
bakteri probiotik.
1.4. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat bermanfaat sebagai:
Hasil penelitian diharapkan dapat dipakai sebagai data dasar untuk penelitian lebih lanjut mengenai bakteri probiotik dan selanjutnya digunakan sebagai dasar penelitian efek konsumsi bakteri probiotik.
Penelitian ini diharapkan sebagai sarana melatih berfikir secara logis dan sistematis serta mampu menyelenggarakan suatu penelitian model yang baik dan benar.
Informasi dari hasil penelitian ini dapat dimanfaatkan untuk menjadi dasar/bahan untuk penyuluhan pada masyarakat untuk mengurangkan penyalahtafsiran tentang bakteri probiotik.
BAB 2
TINJAUAN PUSTAKA
2.1: Bakteri Probiotik
2.1.1: Definisi probiotik
Probiotik berasal dari bahasa Yunani yang berarti "prolife". Ini telah di redefinisi secara berulang selama bertahun-tahun lamanya sejajar dengan penambahan pengetahuan ilmiah yang semakin berkembang dan pemahaman yang lebih mendalam tentang hubungan antara kesehatan usus dan kesejahteraan
umum. Berikut adalah definisi dari probiotik yang dicadangkan dan berubah seiring dengan peredaran masa:
Menurut Lilly (1965) dalam Lee dan Salminen (2009), mendefinisikan
probiotik sebagai faktor pencetus pertumbuhan yang dihasilkan oleh
mikroorganisme.
Parker (1974) dalam Lee dan Salminen (2009), menyarankan adanya interaksi antara mikroorganisms dengan host: Organisme dan zat-zat dengan efek yang menguntungkan bagi manusia dengan mempengaruhi mikroflora usus.
Manakala Fuller (1989) dalam Lee dan Salminen (2009),
meredefinisikannya sebagai “A live microbial supplement” yang menguntungkan dan mempengaruhi host dengan memperbaiki keseimbangan mikroba ususnya.
Menurut Huis I.V. (1992) dalam Lee dan Salminen (2009), probiotik adalah “A mono- or mixed culture of live microorganism” yang diterapkan pada hewan atau manusia, akan mempengaruhi dan menguntungkan host dengan memperbaiki aspek-aspek dari mikroflora asli.
Naidu (1999) dalam Lee dan Salminen (2009), mengatakan probiotik adalah sebuah diet adjuvant dengan mikroba yang menguntungkan dan mempengaruhi fisiologi host oleh modulasi imunitas mukosa dan sistemik, serta gizi yang dapat meningkatkan keseimbangan mikroba dalam saluran usus.
Schrezenmeir dan deVerse pada tahun 2001 mendefinisikan probiotik sebagai sebuah preparat produk siap yang mengandungi mikroorganisme yang diketahui jenisnya dan dalam jumlah viable serta memberi manfaat kepada
kesehatan konsumen dengan mengubah mikroflora (dengan implantasi atau
kolonisasi) dalam kompartemen dari penderita. Efek kesehatan yang
menguntungkan dikerah dalam sistem intestinal host.
FAO / WHO (Food and Agriculture Organization and World Health Organization) (2001) menumpukan fokus sepenuhnya pada fungsi meningkatkan tahap kesehatan. “Live microorganisme” yang bila diberikan dalam jumlah
yang cukup memberikan manfaat kesehatan pada host.
2.1.2: Kandungan probiotik
2.1.2.1:Bakteri asam laktat
Konsep bakteri asam laktat adalah nama grup yang diciptakan untuk bakteri yang
menyebabkan fermentasi dan koagulasi susu, serta dapat menghasilkan asam
laktat dari laktosa. Nama family Lactobacteriaceae diterapkan oleh
Orla-Jensen, (1919) kepada sekelompok bakteri yang menghasilkan asam
laktat sendiri atau asam asetat dan asam laktat, alkohol dan karbon dioksida.
Bakteri asam laktat adalah kelompok bakteri Gram-positif yang disatukan
mengikut karakteristik morfologi, metabolisme, dan fisiologis. Mereka adalah non-spore, fermentasi karbohidrat-produksi asam laktat, tahan asam dalam
keadaan non-aerobik dan katalase negatif.Biasanya mereka adalah non-motile dan tidak mereduksi nitrit. Mereka dibagi menjadi empat genus Streptococcus,
Leuconstoc, Pediococcus, dan Lactobacillus. Revisi taksonomi terbaru
menunjukkan bahwa bakteri asam laktat kelompok bisa terdiri dari genera
Aerococcus, Carnobacterium, Enterococcus, Lactobacillus, Lactococcus,
Leuconostoc, Pediococcus, Streptococcus, Tetragenococcus, dan Vagococcus. Awalnya, bifido termasuk dalam genus Lactobacillus dan organisme ini disebut sebagai Lactobacillus bifidus. Klasifikasi bakteri asam laktat ke dalam genus berbeda sebagian besar didasarkan pada morfologi, cara fermentasi
glukosa, pertumbuhan pada temperatur yang berbeda, dan konfigurasi dari asam laktat yang dihasilkan, kemampuan untuk tumbuh pada konsentrasi garam tinggi, toleransi pada asam atau basa (Lee dan Salminen, 2009).
2.2: Bakteri probiotik untuk konsumsi manusia secara komersial
2.2.1:L.acidophilus
Lactobacillus acidophilus (LA-5) awalnya dipilih oleh Chr.Hansen untuk produksi produk susu probiotik, telah digunakan dalam suplemen makanan dan fermentasi produk susu di seluruh dunia. LA-5 secara klinis didokumentasikan dengan baik. LA-5 tidak memiliki efek negatif pada rasa, penampilan, atau palatabilitas produk dan mampu bertahan dalam produk sampai konsumsi. LA-5 memiliki banyak ciri probiotik, dapat bertahan melintasi lambung dan bagian atas usus halus karena toleransi dan tahan terhadap enzim pencernaan (pH1-5) lambung dan asam empedu . Selain itu, LA-5 dapat menempel pada mukosa usus, dan survivability LA-5 di usus menunjukkan pemulihan yang baik dalam tinja setelah pemberian oral (Saarela, et al., 2007). Lactobacillus acidophilus adalah kelompok bakteri Gram-positif non-bersporulasi batang atau anaerobic fakultatif,
dan merupakan spesies alami pada usus. Produk akhir dari fermentasi glukosa oleh Lactobacillus adalah asam laktat, asam asetat, dan H2O2. Metabolit ini
membuat lingkungan yang kurang menguntungkan bagi pertumbuhan
mikroorganisme pathogen. Lactobacillus memainkan peran penting dalam
mengontrol pH usus melalui produksi asam yang menurunkan pH usus sehingga membatasi pertumbuhan bakteri patogen dan yang menyebabkan perbusukan berpotensi banyak. In vitro, LA- 5 menyebabkan peningkatan produksi asetat dan propionat oleh bakteri kolon ketika mikrobiota stabil belum didirikan, dan menunjukkan suplementasi LA-5 mampu memodifikasi fermentasi kolon. LA-5 juga memproduksi CH5 bakteriosin yang ditandai tidak hanya sebagai antibakteri jangkauan luas, tetapi juga mempunyai aksi penghambatan terhadap ragi tertentu (Lee dan Salminen, 2009).
2.2.2:L.casei
Lactobacillus casei juga telah digunakan sebagai produk beku-kering dalam suplemen diet. L. casei telah terbukti menguntungkan dan mempengaruhi kesehatan saluran pencernaan serta sistem kekebalan tubuh. L. casei telah ditunjukkan untuk mempengaruhi sistem kekebalan tubuh dengan fungsi modulasi seperti fagositosis, produksi antibodi, dan sitokin. Stimulasi aktivitas fagositosis pada mencit sehat telah terbukti menggunakan L.casei yang difermentasi serta dalam susu nonfermented (Lee dan Salminen, 2009), dan juga telah
menunjukkan efek fagositosis pada tikus imunosupresi. Immunoglobulin merupakan bagian dari respon sistem imun spesifik, dengan IgA terutama yang terkait dengan kekebalan mukosa usus,berfungsi sebagai mekanisme pertahanan local terhadap bakteri, virus, racun, dan alergen makanan lain, dan IgM dan IgG aktif dalam respon imun sistemik. Efek antitumor dari L.casei telah dipelajari
pada tikus dengan menunjukkan efek pada pertumbuhan tumor, yang
dapat dimediasi melalui sistem imun, sebagai peningkatan kadar TNF-a dan sel-sel memproduksi IgA diamati dalam studi yang sama. Efek cytolytic melawan sel tumor pada tikus yang diberi L. casei juga telah diperhatikan.(Bonet, et al., 2005).
2.2.3:L.paracasei
Lactobacillus paracasei ssp. F19 (F19) pada awalnya terisolasi dari mukosa kolon manusia yang sehat. Hal ini dipilih karena daya tahan dalam lingkungan usus, dalam makanan, dan sebagai kultur beku-kering dan juga karena sifat yang menguntungkan dalam makanan serta karakter probotic menjanjikan (Ohlson, et al., 2002). Lactobacillus paracasei terjadi secara alami dalam makanan dan manusia. F19 juga telah terisolasi dari keju dan beberapa manusia. Studi pada manusia menunjukkan bahwa F19 memberi pengaruh positif yang mikrobiota usus, fungsi usus orang dewasa yang sehat, anak-anak, dan lanjut usia. F19 diberikan kepada anak-anak selama penyapihan (weaning) terlihat mengurangi jumlah infeksi sekunder dan kebutuhan penggunaan antibiotic menurun.
Ketika diberikan kepada wanita dengan vaginosis gejalanya juga berkurangan. Pengaruh F19 sendiri atau dalam kombinasi dengan bakteri probiotik lain pada mikrobiota usus, kesejahteraan usus dan infeksi ditunjukkan oleh stabilisasi dari flora usus yang sehat dan frekuensi tinja (West, et al., 2008).
2.2.4:L.rhamnosus
Lactobacillus Rhamnosus GG (LGG) adalah salah satu strain probiotik yang
terkenal ,dikenal juga dengan nama Lactobacillus GG. Hidup baik dalam
jus lambung buatan dan sifat adhesi baik pada sel epitel usus adalah criteria dasar untuk mengisolasi Lactobacillus GG. Jenis ini memperlihatkan sifat adhesi yang baik pada lendir usus dan kultur berbagai sel model, dan juga pada sampel jaringan dari berbagai bagian usus manusia (Doron, et al., 2005). Lactobacillus GG diamati memiliki efek keseimbangan pada ekosistem usus, yaitu, meningkatkan tingkat laktobasilus dan bifido, pembentukan asam lemak rantai
pendek (SCFAs), menurunkan kegiatan enzim procarcinogenic, dan
meningkatkan serta normalisasi barrier mukosa. LGG telah terbukti untuk menghasilkan kapsul hidrofilik tipis, dengan aktivitas hemaglutinasi sedikit atau
tidak ada. Kapsul ini didapati pada uroepithelial, vagina, sel usus, dan
biomaterial, menggantikan dan mencegah adhesi oleh pathogen usus dan
urogenital, menghambat pertumbuhan patogen usus dan urogenital kemungkinan melalui mekanisme bakteriosin seperti produksi asam laktat (Lee dan Salminen,
2009).
2.3: Faktor-faktor yang mempengaruhi viabilitas probiotik dalam makanan / minuman.
2.3.1:Pilihan bakteri probiotik/ Kombinasi makanan
Organisme probiotik umumnya dipilih dari konstituen usus yaitu Lactobacillus dan Bifidobacteria, yang telah berevolusi untuk tumbuh dan bertahan hidup dalam kondisi lingkungan di sekitar saluran usus manusia. Di usus halus dan usus besar, pH umumnya dekat dengan netral, suhu konstan (37˚C-39˚C), pasokan gizi
kompleks terus tersedia dan bekalan oksigen yang terbatas. Kondisi ini tentu saja sangat berbeda dengan yang ditemukan dalam produk makanan dan matriks makanan. Meskipun demikian, bakteri telah menunjukkan kemampuan luar biasa untuk bertahan hidup di lingkungan yang ekstrem dan probiotik dapat bertahan hidup dalam lingkungan makanan untuk batas waktu tertentu. Bahan probiotik tidak semuanya sama. Perbedaan semakin melebar dari genus ke spesies dan bahkan hingga ke tingkat strain, dan dampak fisiologis bakteri baik pada kedua
konsumen dan teknologi yang digunakan untuk memproduksi mereka
dalam makanan (Lee dan Salminen, 2009). Semakin dekat organisme probiotik
yang terkait, biasanya efeknya juga akan lebih tertampil.
Namun, perbedaan strain-ke-strain masih terlihat secara signifikan dan dapat berdampak pada kinerja probiotik dalam makanan. Perbedaan dalam karakteristik teknologi spesies probiotik yang berbeda dan strain berarti perawatan yang harus diambil dalam memilih strain yang paling tepat untuk aplikasi makanan tertentu. Memang, langkah pertama dalam menggabungkan suatu probiotik ke dalam makanan adalah mengidentifikasi kompatibilitas antara atribut strain yang dipilih dan langkah-langkah produksi produk tersebut,
kondisi matriks makanan dan syarat penyimpanan. Hal ini mungkin
melibatkan kompromi antara atribut kesehatan yang diinginkan dan teknologi
kemampuan strain tertentu untuk aplikasi makanan tertentu. Ketika
mengembangkan produk baru beberapa penelitian mungkin diperlukan untuk memastikan bahwa strain yang dipilih mampu bertahan hidup baik dalam makanan, memberikan sifat teknologi yang sesuai (misalnya pengasaman selama fermentasi, jika diperlukan) dan yang lebih penting, bahwa menambahkan probiotik tidak mempengaruhi rasa, bau, dan tekstur makanan atau minuman. Sementara menekankan pentingnya spesifisitas strain bakteri dan atribut terhadap teknologi probiotik, beberapa generalisasi masih dapat dilakukan untuk mengukuhkan organisme probiotik. Umumnya, laktobasilus lebih kuat daripada bifidobacteria. Kumpulan probiotik Lactobacillus spesies lebih luas dan
lebih cocok untuk aplikasi teknologi makanan daripada bifidobacteria. Contoh umum meliputi L. acidophilus, L. johnsonii, L. rhamnosus, L. casei, L.paracasei,
L. fermentasi, L. reuterii dan L. plantarum. Seringkali, kelompok organisme L.acidophilus , sementara tahan terhadap pH rendah, terbukti kurang kuat disbanding jenis lactobacillus lain di aplikasi secara non-tradisional dalam makanan probiotik (Lee dan Salminen, 2009).
2.3.2:Keadaan fisiologis probiotik
Satu faktor penting dalam memastikan kelangsungan hidup bakteri probiotik adalah keadaan fisiologis bakteria apabila disiapkan, dan keadaan fisiologis bakteri dalam produk itu sendiri. Jika produk makanan kering (misalnya, susu formula bubuk) probiotik dikeringkan dan berada dalam keadaan diam (quiescent
state) selama penyimpanan maka tempoh waktu bertahan juga semakin lama.
Namun, ketika termasuk dalam produk basah seperti yogurt, bakteri akan berada dalam keadaan vegetatif dan mempunyai potensi untuk menjadi aktif secara metabolik (meskipun perlahan pada suhu pendinginan yang rendah). Keadaan fisiologis bakteri akan banyak berpengaruh pada shelf life bakteri, dengan
survival jangka panjang sel vegetatifnya hanya mungkin dilakukan pada suhu yang rendah (Matto, et al., 2006). Sebagai perbandingan, jika dalam bentuk kering, quiescent cells akan mempunyai shelf life yang lebih panjang pada suhu ambient, dan lebih stabil pada suhu rendah. Bakteri mampu merespon pada stres lingkungan melalui induksi berbagai mekanisme toleransi stres . Induksi protein stres oleh paparan sel pada stress sublethal seperti panas, kelaparan dingin, pH rendah, dan osmotic stress dapat membolehkan bakteri probiotik lebih mentolerir kondisi stres lingkungan selama produksi makanan, penyimpanan, dan transit gastrointestinal (Ross, et al., 2005). Cross-protection telah sering diamati, di mana paparan satu stress memberikan perlindungan terhadap stressor lain yang menekannya (Matto, et al., 2006). Yang harus ditekankan adalah bahwa meskipun berbeda strain probiotik namun ia memiliki toleransi intrinsik yang tersendiri dengan kondisi lingkungan, dan toleransi juga dapat dipengaruhi oleh bagaimana sediaan kultur dipersiapkan. Respon stress dapat dimanfaatkan untuk membuat strain probiotik lebih tahan dan kemungkinan untuk bertahan hidup dalam matriks makanan.
2.3.3:Suhu
Suhu di mana organisme probiotik tumbuh adalah sangat penting dalam aplikasi makanan terutama dimana proses fermentasi diperlukan. Suhu optimum untuk pertumbuhan probiotik adalah antara 37˚C hingga 43˚C (Matto, et al., 2006). Probiotik lactobacillus dapat tumbuh pada kisaran (range) suhu yang lebih lebar. Ada yang mampu tumbuh pada suhu sampai 44˚C mahupun pada suhu mesofilik yaitu ke 15˚C (Lee dan Salminen, 2009). Suhu juga merupakan faktor penting yang mempengaruhi kelangsungan hidup probiotik selama pembuatan dan penyimpanan. Dalam istilah praktis, semakin rendah suhu maka akan lebih stabil viabilitas probiotik dalam produk makanan. Selama pengolahan, suhu di atas
45-50˚C akan merugikan kelangsungan hidup probiotik.Semakin tinggi suhu, semakin pendek jangka waktu pemaparan yang diperlukan untuk mengurangi
jumlah bakteri yang viable. Hal ini jelas bahwa probiotik harus
ditambahkan secara downstream dengan pemanasan / memasak proses
pasteurisasi atau dalam pembuatan makanan. Peningkatan suhu juga
memiliki efek yang merugikan terhadap stabilitas saat produk dikirim dan disimpan. Sekali lagi, jika kedinginan produk dapat dipertahankan, lebih besar jumlah bakteri probiotik yang viable. Untuk sel probiotik vegetatif dalam produk cair, sumber pendinginan sewaktu penyimpanan biasanya penting. Dalam produk kering yang mengandung bakteri quiescent cells, viabilitas probiotik dapat dipertahankan dalam produk-produk yang disimpan pada suhu ambient selama 12 bulan atau lebih. (Matto, et al., 2006).
2.3.4:pH
Lactobacillus menghasilkan produk akhir asam organik dari metabolisme
karbohidrat. Oleh karena itu, genera ini dapat mentolerir nilai pH lebih kecil dari banyak bakteri. Memang, banyak penelitian in vitro dan in vivo menunjukkan bahwa organisme probiotik dapat menahan keasaman apabila transit di bahagian lambung (bisa serendah nilai pH 2.0), meskipun waktu pemaparan relatif pendek
(1-2jam) (Doleyres, et al., 2005). Sel vegetatif yang telah diadaptasi biasanya
mampu bertahan lebih baik dalam lingkungan asam dibandingkan dengan
quiescent cells (Rodgers, 2007). Pada produk makanan, lactobacillus mampu
tumbuh dan bertahan dalam susu fermentasi dan yogurt dengan nilai
pH antara 3,7 dan 4,3 (Savoie, 2007). Survival dalam minuman pH rendah seperti jus buah (pH 3,5-4,5) membawa tantangan yang signifikan bagi kelangsungan hidup probiotik, namun produk komersial telah sukses dihasilkan, seperti Gefilus (Valio Ltd, Finlandia), yang berisi Lactobacillus rhamnosus GG. Carriers seperti serat diet telah terbukti untuk meningkatkan kelangsungan hidup probiotik pada
pH rendah (Crittenden, 2004). Kelangsungan hidup laktobasillus dalam lingkungan
asam juga telah ditingkatkan dengan kehadiran gula metabolis yang
memungkinkan pompa membran sel proton untuk beroperasi dan mencegah
penurunan pH intraselular (Boylston, et al., 2004). Hal ini dapat meningkatkan kelangsungan hidup selama transit lambung, tetapi mungkin tidak berlaku untuk meningkatkan kelangsungan hidup probiotik selama time frames of shelf-storage.
2.3.5:Aktivitas dalam air
Untuk bakteri probiotik yang quiescent dan kering, aktivitas air (aw) adalah
penting sebagai penentu kelangsungan hidup dalam produk makanan selama
penyimpanan. Tingkat kelembaban dan aktivitas air yang tinggi akan
menyebabkan kelangsungan hidup probiotik menurun secara substansial.
Probiotik dapat bertahan dengan baik atas time frames of shelf-storage (12 bulan atau lebih) pada suhu kamar dalam produk kering asalkan tingkat kelembapan
dalam produk adalah rendah (setidaknya di bawah aw 0,2-0,3).Secara
umum, semakin rendah aktivitas air, semakin baik kelangsungan hidup bakteri.
Ada interaksi yang substantial antara aktivitas air dan suhu sehubungan dengan
dampaknya pada kelangsungan hidup probiotik quiescent. Apabila suhu
penyimpanan ditingkatkan maka dampak kelembaban diperbesar. Meskipun mekanisme yang tepat tentang kematian sel tidak jelas, namun osmotik dikatakan memainkan peran, dengan kehadiran molekul kecil sehingga kelangsungan hidup bakteri menurun. Meskipun ada bukti yang jelas bahawa kelembapan dapat
meningkatkan kelangsungan hidup probiotik mungkin ada keterbatasan teknologi untuk mengurangi aktivitas air ke tingkat yang lebih rendah. Ini termasuk biaya energi pengeringan, dampak yang merugikan pada palatabilitas makanan dan kesulitan dalam pembasahan dan penyebaran bubuk. Penghalang kelembapan mungkin ditambah pada kemasan dan diterapkan untuk mencegah egress kelembaban dari lingkungan selama penyimpanan (Corcoran, et al., 2005).
2.3.6:Oksigen
Laktobasilus dianggap strict anaerob dan oksigen dapat merusak pertumbuhan probiotik dan kelangsungan hidup. Namun, tingkat sensitivitas oksigen bervariasi antara spesies yang berbeda dan strain. Secara umum, laktobasilus, yang sebagian besarnya bersifat mikroaerofil, lebih toleran terhadap oksigen dari bifido, ke titik di mana tingkat oksigen jarang menjadi pertimbangan penting dalam mempertahankan kelangsungan hidup laktobasilus (Kawasaki, et al., 2006). Untuk strain sensitive oksigen, beberapa strategi yang tersedia untuk mencegah toksisitas oksigen dalam produk makanan. Bahan antioksidan seperti asam askorbat atau sistein telah terbukti untuk meningkatkan kelangsungan hidup probiotik,
serta penggunaan oxygen barrier atau modified atmosphere packaging (Dave dan Shah, 1997(ii)).
2.3.7:Freeze-Thawing
Pembekuan merusak sel-sel membrane bakteri probiotik dan merugikan bagi kelangsungan hidup. Protectants biasanya ditambahkan ke dalam sediaan kultur
yang akan dibekukan atau dikeringkan untuk mencegah, atau paling tidak mengurangi, cedera pada sel. Yang paling umum protectants digunakan pada skala industri adalah laktosa atau sukrosa, monosodium glutamat, susu bubuk, dan askorbat. Setelah dibeku, probiotik bisa bertahan lebih lama daripada
produk-produk seperti yogurt beku dan es krim.Penggunaan tarif slow cooling, atau pengkondisian sel dengan stress prefreezing, secara signifikan dapat meningkatkan kelangsungan hidup sel. Siklus freeze-thawing yang berulang
sangat merugikan untuk kelangsungan hidup sel dan harus dihindari. Kerusakan membrane sel yang disebabkan oleh pembekuan juga dapat membuat probiotik sel lebih rentan terhadap tekanan lingkungan. Dalam satu sampel kultur yang dibeku selama transportasi rantai pasokan dan sampel kemudian dicairkan. Sebuah sampel yang sama hanya didinginkan selama transportasi. Ini adalah bukti bahwa freeze-thawing meningkatkan sensitivitas sel dengan lingkungan asam (Lee dan Salminen, 2009).
2.4: Mekanisme kerja bakteri probiotik
2.4.1:Adhesi pada mukosa usus dan epitel oleh bakteri probiotik
Adhesi pada mukosa usus dapat mencegah sel probiotik dari dicuci keluar, dan karena itu, memungkinkan kolonisasi sementara, modulasi kekebalan tubuh, dan pengecualian pathogen secara kompetitif. Meskipun bukti adhesi probiotik untuk lendir in vivo masih terbatas, penelitian baru menunjukkan bahwa adhesi tersebut memang dapat terjadi dan mungkin berfungsi sebagai mekanisme untuk tindakan probiotik. Sejumlah metode yang berbeda telah digunakan dalam tes adhesi probiotik (Vesterlund, et al., 2005). Yang paling umum adalah tes yang menilai adhesi ke sel-sel epitel dan lendir usus. Beberapa komponen bakteri, termasuk dinding sel protein, karbohidrat, dan asam lipoteichoic, telah disarankan terlibat dalam adhesi probiotik untuk isi usus. Sifat adhesi probiotik adalah berbeda mengikut strain tertentu, dan faktor-faktor seperti sifat dinding sel dan komposisi dan mungkin juga kekhususan host adalah penentu paling penting dari sifat adhesi. Namun, beberapa faktor lain juga dilaporkan mempengaruhi
sifat adhesi (Tabel 2.4.1). Studi probiotik yang dilemahkan juga menyarankan bahwa bakteri probiotik nonviable juga mampu beradhesi. Hal ini karena sifat adhesi berkaitan dengan sifat permukaan sel tertentu, dan bukan kegiatan metabolic mahupun inaktivasi sebahagian divisi sel. Metode yang berbeda
dapat menyebabkan perubahan strain-spesifik pada properti adhesi sel. Sebagai contoh, pemanasan dapat meningkatkan adhesi strain probiotik tertentu, namun
mungkin merugikan terhadap sifat adhesif dari strain lainnya. (Gusils, et al., 2002).
2.4.2:Adhesi dan aggregasi dari gabungan bakteri probiotik dan pathogen
Adhesi sel adalah sebuah proses kompleks yang melibatkan kontak antara sel bakteri membran dan berinteraksi dengan permukaan. Kemampuan untuk menempel pada sel epitel dan permukaan mukosa telah diusulkan untuk menjadi properti yang penting dari banyak strain bakteri yang digunakan sebagai probiotik. Beberapa peneliti telah melaporkan investigasi terhadap komposisi, struktur, dan kekuatan interaksi yang berhubungan dengan adhesi bakteri pada epitel usus sel dan lendir (Ouwehand, et al., 2002). Bacterial adhesion to
hydrocarbons test (BATH) telah banyak digunakan untuk mengukur permukaan
sel hidrofobik pada bakteri asam laktat (Vinderola, et al., 2004). Affiniti untuk hidrokarbon (hidrofobik) dilaporkan sebagai adhesi sebelum dan sesudah ekstraksi dengan organic pelarut, masing-masing. Secara umum, hasil hidrofobik menunjukkan heterogenitas besar antara strain probiotik dalam adhesi untuk
hidrokarbon, meskipun secara umum strain lactobacillus menunjukkan persentase adhesi yang tertinggi (Ouwehand, et al., 2002). Banyak studi tentang kimia
permukaan sel mikroba menunjukkan bahwa keberadaan (glikol-) materi
protein pada hasil permukaan sel di hidrofobik lebih tinggi, sedangkan
pada hidrofilik permukaannya berhubungan dengan adanya polisakarida.
Agregasi bakteri berhubungan dengan penempelan sel dengan sel antara bakteri strain yang sama (autoaggregation) atau antara strain genetik yang berbeda (coaggregation) dan merupakan hal penting dalam beberapa relung ekologi terutama di usus manusia dimana probiotik harus aktif (Jankovic, et al., 2003). Agregasi bakteri dianalisis terutama di lingkungan mulut, gigi, dan biofilm tetapi hanya ada beberapa penelitian menggunakan strain probiotik dengan patogen. Coaggregation dengan patogen usus yang berpotensi dapat berkontribusi terhadap sifat probiotik yang berasal dari strain probiotik tertentu. Secara umum, strain probiotik yang spesifik menunjukkan kemampuan autoaggregasi lebih tinggi daripada strain patogen .
Tabel 2.4.1: Faktor-faktor yang mempengaruhi adhesi probiotik (Gusils, et al., 2002).
Hubungan positif kemampuan antara autoaggregasi dan adhesi telah dilaporkan untuk beberapa spesies bifidobacterial dan juga, ada korelasi antara kemampuan adhesi dan sifat hidrofobik dalam beberapa spesies laktobasilus (Collado, Meriluoto, dan Salminen, 2007).
2.4.3:Pengaruh imun dari bakteri probiotik
Pengaruh probiotik terhadap T helper (Th) dan T regulatory response spesies tertentu adalah spesifik. Beberapa strain Lactobacillus telah ditunjukkan untuk merangsang produksi sitokin Th1 sementara yang lain telah meningkatkan respon Th2 atau disebabkan campuran respon Th1/Th2 . Bakteri probiotik telah
ditunjukkan untuk meningkatkan respon kekebalan IgA terhadap vaksin
parenteral dan oral. Satu campuran bakteri probiotik diberikan kepada bayi untuk 6 bulan pertama kehidupannya, ia terbukti meningkatkan respon IgG untuk Haemophilus influenzae type B (HIB) parenteral vaksin (Kukkonen, et al., 2006). Bakteri probiotik juga telah ditunjukkan untuk mendorong regulasi produksi sitokin dan T regulatory cells in vitro pada model binatang dan pada uji klinis manusia. Beberapa strain Lactobacillus telah ditunjukkan untuk menghambat sel T proliferasi, menginduksi IL10 dan produksi Transforming growth factor-ᵝ (TGF-ᵝ), dan memodifikasi produksi in vitro sitokin Th1 dan Th2 pada berbagai model penyakit inflamasi autoimun. Pada beberapa model binatang dan uji klinis pada manusia, efek klinis menguntungkan yang berhubungan dengan pengobatan probiotik telah dikaitkan dengan peningkatan IL-10 dan atau produksi TGF-ᵝ dan
meningkatkan T regulatory cell yaitu cluster of differentiation 4 (CD4) (Rautava, et al., 2002).
2.5: Peranan bakteri probiotik dalam kesehatan dan penyakit
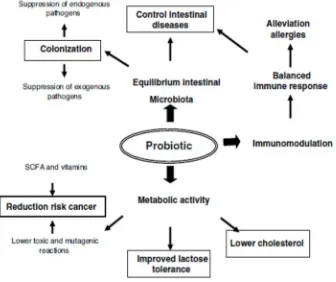
Kepentingan klinis utama dalam penerapan probiotik adalah untuk pencegahan dan pengobatan infeksi pencernaan dan penyakit (Parvez, et al., 2006)). Beberapa efek kesehatan yang diusulkan dari konsumsi probiotik diringkas dalam Gambar. 2.5. Umumnya, mekanisme yang mungkin berpengaruh dari konsumsi probiotik dapat dibagi menjadi beberapa kategori: normalisasi mikrobiota, modulasi respon imun, dan fungsi metabolisme.
2.5.1:Pencegahan dan penatalaksanaan untuk infeksi oral dan karies dental
Bakteri asidogenik oral seperti Lactobacillus berkaitan dengan keberadaan dan terjadinya karies gigi. Bakteri asam karies mengkolonisasi lingkungan, seperti pada celah dan ruang interdental, dan menghasilkan asam dari fermentasi gula. Sebaliknya ada saranan yang mengatakan bahawa kolonisasi dari bakteri gula non lactose dan yang lambat fermentasi, mampu menghambat karies patogen, serta mencegah karies pada anak-anak. Di ujung lain spectrum usia, pertumbuhan berlebihan dari ragi oral adalah masalah yang umum kalangan orang tua. Sementara kolonisasi bakteri probiotik di rongga mulut secara kompetitif dapat
mengecilkan jumlah ragi oral (Nase, et al., 2001).
2.5.2:Penatalaksanaan untuk irritable bowel syndrome (IBS)
Sekitar 5-20% dari penduduk dunia diperkirakan menderita IBS. Gejala klinis utamanya termasuk ketidaknyamanan perut atau nyeri, diare, sembelit, kembung, dan perut kembung. Terapi saat ini untuk IBS dianggap efektif secara moderat,
dan pendekatan baru dalam pengobatan sedang terus dicari. Patogenesis IBS masih belum jelas, namun tersedia bukti menunjukkan bahwa motilitas usus yang diubah, hipersensitivitas visceral, dan disregulasi dari otak-usus sumbu adalah mekanisme penting yang terkait. Ada yang mengumpulkan bukti yang
menunjukkan bahwa profil ketidakseimbangan mikroba usus dan peradangan mukosa enterik bakteri mediated mungkin terkait dengan IBS (Chadwick, et al., 2002).
2.5.3: Pencegahan untuk kanker usus
Dalam dua dekade terakhir, jumlah orang yang menderita kanker usus besar telah berangsur-angsur meningkat, khususnya di negara-negara industri. Studi telah menunjukkan bahwa diet dan antibiotik dapat menurunkan generasi karsinogen dalam usus besar dan mengurangi tumor secara kimiawi. Efek ini tampaknya
dimediasi melalui mikroflora usus. Studi tambahan menunjukkan bahwa
pengenalan Lactobacillus acidophilus ke dalam makanan menurunkan
kejadian tumor usus yang diinduksi secara kimia pada tikus. Sebuah mekanisme yang mungkin untuk efek-efek antikanker bergantung pada bakteri usus yang menghambat enzim yang mengkonversi procarcinogens untuk ke bentuk karsinogen. Teknik ini dapat dikembangkan pada masa depan dengan
menguji kemampuan probiotik untuk menghambat pertumbuhan atau organisme
yang biasanya ditemukan pada tumbuhan yang memiliki aktivitas
tinggi seperti enzim β-glucuronidase, nitroreductase, azoreductase dan β – glikosidase atau kemampuan untuk nitrososation (Lee dan Salminen, 2009).
Gambar 2.5: Efek bermanfaat yang dipostulasi pada tubuh manusia dengan mengkonsumsi probiotik (Parvez et al., 2006 ).
BAB 3
KERANGKA KONSEP DAN DEFINISI OPERASIONAL
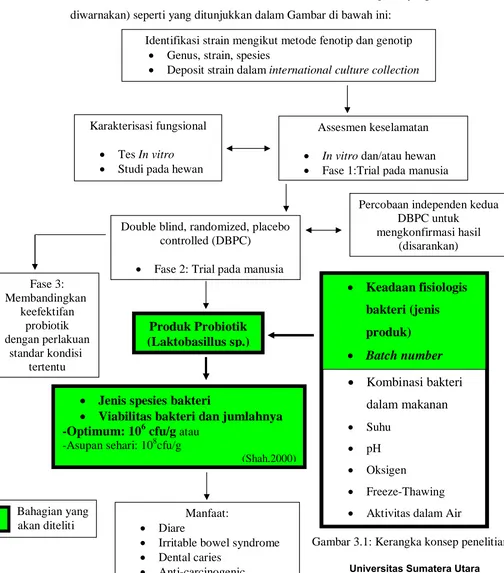
3.1. Kerangka Konsep Penelitian
Pada penelitian ini, kerangka konsep tentang gambaran kualitatif Lactobacillus sp. dalam susu fermentasi diuraikan berdasarkan variabel-variabel (petak yang
diwarnakan) seperti yang ditunjukkan dalam Gambar di bawah ini:
Identifikasi strain mengikut metode fenotip dan genotip
Genus, strain, spesies
Deposit strain dalam international culture collection
Assesmen keselamatan
Fase 2: Trial pada manusia
Variabel Definisi Cara Ukur Alat Ukur Hasil Ukur Skala
Pengukuran
Viabilitas Kemampuan dari suatu hal
BAB 4
METODE PENELITIAN
4.1. Jenis Penelitian
Penelitian ini bersifat deskriptif dengan pendekatan cross-sectional yaitu penelitian yang mendeskripsikan gambaran kualitatif bakteri probiotik (Lactobacillus sp.) dalam produk susu fermentasi.
4.2. Waktu dan Tempat Penelitian
4.2.1. Waktu Penelitian
Penelitian ini telah dilakukan pada tanggal 16 hingga 23 Juni 2011.
4.2.2. Tempat Penelitian
Penelitian ini telah dilaksanakan di Laboratorium PRODIA, Medan. Penentuan lokasi ini berdasarkan pertimbangan sesuai dengan tujuan penelitian dan peruntukkan dana. Peralatan dan sarana yang diperlukan untuk pelaksanaan eksperiment ini tersedia dan feasible pada tempat ini.
4.3. Populasi dan Sampel
4.3.1. Populasi
Populasi dalam penelitian ini adalah produk-produk probiotik (susu kultur, yoghurt, keju, dan susu asidophilus) dalam kemasan jenis susu fermentasi dengan tanggal produksi dari bulan Juni 2011 dengan merek-merek berbeda.
4.3.2 Sampel
Pemilihan sampel dengan metode acak stratifikasi (stratified randomized
sampling), di mana unit populasi dibahagikan mengikut stratum, h (h1=yogurt, h2=
keju, h3= susu kultur, h4= susu acidophilus). Subjek akan dipilih secara acak dari
setiap stratum. Jumlah populasi (N) adalah 77 dan sampel (n) yang akan diuji adalah sebanyak 65. Rumus pengiraan sampel mengikut Notoatmodjo, S., (2002) adalah seperti berikut:
Data daftar registerasi dari Badan Pengawas Obat dan Makanan (BPOM, 2010).
Jumlah produk ; 1. Yogurt (h1) = 27
2. Keju (h2) = 10
3. Susu kultur (h3) = 25
4. Susu asidophilus (h4) = 15
Jumlah populasi (N) = 77
Jumlah sampel (n) yang akan dipilih = N
Nd2 + 1
= 77
(77) (0.05)2 +1
= 64.6
n = 65 sampel produk susu fermentasi
di mana : N = jumlah populasi seluruhnya
n = jumlah sampel seluruhnya
d = kesalahan (absolute) yang dapat ditolerir
Maka, jumlah sampel yang diambil dari setiap stratum secara acak dikira dengan rumus dari Sugiyono (1999) dalam Imran dan Munif (2010) di bawah :
ni = Ni
N
di mana ; ni = jumlah sampel mengikut stratum
n = jumlah sampel seluruhnya
Ni = jumlah populasi mengikut stratum
N = jumlah populasi seluruhnya
Pengiraan jumlah sampel dari setiap stratum secara acak ;
h1: ni = 27
77
ni = 22.79
=23 ( 23 dari 27 sampel h1(yogurt) akan dipilih secara random.)
h2: ni = 10
77
= 8.44 (8 dari 10 sampel h2 akan dipilih secara random)
h3: ni = 25
77
= 21 (21 dari 25 sampel h3 akan dipilih secara random)
h4: ni = 15
77
x
nX 65
X 65
X 65
X 65
= 13 (13 dari 15 sampel h4 akan dipilih secara random)
4.4. Metode Percobaan
Alat dan Bahan:
Autoclave, Incubator, Water bath, Colony Counter, Laminar Air Flow /BSC, Vortex, Mikropipet (1000µL,100µL &10 µL), Timbangan analitik, Cawan petri (petri dish) diameter 15cm, Beaker glass, Thermometer, Pengaduk, Jarum inokulum/ose, Test tube (tabung reaksi), Rak tabung reaksi, Batang L / L-rod
(spreader), 1000 mL aquabidest, 1.32 mL glacial acetic acid, Sampel percobaan (susu kultur, keju, yogurt, dan susu acidophilus), DifcoTM Rogosa SL agar. (Kandungan dalam sediaan Rogosa termasuk; Trypton 10g/L, Ekstrak ragi 5g/L, Dextrose 10g/L, Arabinose 5g/L, Saccharose 5g/L, Polysorbate 80 1g/L,
Mono-Kalium fosfat 6g/L, Amonium sitrat 2g/L, Natrium asetat 15g/L,
Magnesium sulfat 0.57g/L, Mangan sulfat 0.12g/L, Ferrous sulfat 0.03g/L, agar 15g/L).
Metode
1. Semua peralatan yang akan digunakan telah disterilkan menggunakan autoclave selama 15 menit pada suhu 121 ˚C.
2. Rogosa SL agar dipersiapkan sesuai dengan instruksi pabrik pembuat. Sejumlah 75g Rogosa agar (bentuk bubuk) ditambahkan ke dalam 1000ml aquabidest dalam beaker glass dan dicampur secara merata. Dididihkan sediaan selama 1 menit sehingga bubuknya larut sepenuhnya. Digunakan water bath.
3. Tambahkan asam asetat glacial 1.32ml dan aduk hingga rata. Didihkan
selama 2-3 menit dengan sering mengacaunya. JANGAN
AUTOCLAVE.
4. Dibahagikan ke dalam piring petri. Agar medium diinokulasi dengan teknik pour plate dan diinkubasi pada 35 ± 2˚C selama 40-48 jam.
5. 1 gram /1mL sampel yang mengandung bakteri dimasukan ke dalam tabung pengenceran pertama yang mempunyai 9 ml aquabidest (1/10
atau 10-1) secara aseptis. Perbandingan berat sampel dengan volume tabung pertama adalah 1 : 9.
6. Setelah sampel masuk lalu dilarutkan dengan mengocoknya (diberi label tabung uji 1). Diambil 1 ml dari tabung 10-1 (tabung uji 1) dengan pipet mikro kemudian dipindahkan ke tabung 10-2 (tabung uji 2) secara aseptis kemudian dikocok. Tingkat pengenceran sebanyak 7 kali. 7. Pemindahan dilanjutkan hingga tabung pengenceran terakhir dengan
cara yang sama, hal yang perlu diingat bahwa pipet mikro yang digunakan harus selalu diganti, artinya setiap tingkat pengenceran
digunakan pipet ukur steril yang berbeda/baru.
8. Teknik penanaman pour plate.Teknik ini memerlukan agar yang belum padat (>45oC) untuk dituang bersama suspensi bakteri ke dalam cawan petri lalu kemudian dihomogenkan dan dibiarkan memadat.
9. Siapkan piring petri steril, tabung pengenceran yang akan ditanam dan media padat yang masih cair (>45oC). Teteskan 1 ml suspensi yang diencerkan kedalam piring petri kosong.
10.Tuangkan media yang masih cair ke piring petri kemudian putar piring petri untuk menghomogenkan suspensi bakteri dan media, kemudian diinkubasi.
11.Syarat koloni yang ditentukan untuk dihitung adalah sebagai berikut: - Satu koloni dihitung 1 koloni.
- Dua koloni yang bertumpuk dihitung 1 koloni.
- Beberapa koloni yang berhubungan dihitung 1 koloni.
- Dua koloni yang berhimpitan dan masih dapat dibedakan dihitung 2 koloni.
- Koloni yang terlalu besar (lebih besar dari setengah luas cawan) tidak dihitung.
- Koloni yang besarnya kurang dari setengah luas cawan dihitung 1 koloni.
(Atlas, R.M., 2010)
4.5. Teknik Pengumpulan Data
Data dalam penelitian ini merupakan data primer, dimana semua data yang diperlukan diperoleh dari hasil daripada pengiraan jumlah koloni pada kultur bakteri Lactobacillus.
Cara menghitung sel relatif / CFU’s per ml
CFU’s / ml = jumlah koloni X faktor pengenceran
Misal : penanaman dilakukan dari tabung pengenceran 10-6 dengan metode Pour Plate.
Pour plate : koloni = 50 = 50 x 106 CFU’s / 1 ml Fp = 1/10-6 = 50 000 000 CFU’s / 0,1 ml
SP = 1 ml = 5x107 CFU’s / ml
4.6. Pengolahan dan Analisis Data
Data yang diperlukan akan dikumpul setelah menjalankan eksperiment. Kemudian data disajikan dalam bentuk tabel-tabel dan grafik.
BAB 5
HASIL PENELITIAN DAN PERBAHASAN
5.1. Hasil Penelitian
Penelitian ini adalah deskriptif laboratorium secara potong lintang (cross
sectional) untuk mengetahui gambaran kualitatif bakteri Lactobacillus sp. yang
terkandung dalam produk-produk susu fermentasi yang tersedia di Kota Medan. Produk susu fermentasi yang diperoleh, diencerkan dan dikultur di Laboratorium Klinik Prodia, Jln. S. Parman, Medan dengan medium Rogosa SL- agar untuk mendapatkan hasil.
5.1.1 Deskripsi Lokasi Penelitian
Lokasi penelitian yang diambil adalah di sekitar kota Medan yaitu sampel-sampel produk susu fermentasi dari 10 buah pusat perbelanjaan di kota Medan yang telah dijelaskan (disenaraikan) oleh Dinas Kota Medan, seperti berikut:
1) Sun Plaza
Sampel yang digunakan adalah produk susu fermentasi yang mengandungi bakteri probiotik Lactobacillus sp. yang diperoleh dari 10 pusat perbelanjaan di kota Medan dengan batch number (kadaluarsa) yang berbeda. Sampel kemudiannya
diberi kode dan hanya 1mL (1000µL) dari setiap sampel yang digunakan untuk pemeriksaan.
5.1.3 Hasil Analisa
Sebanyak 65 sampel dari 10 buah pusat perbelanjaan telah dikultur dengan media Rogosa SL-agar untuk melihat pertumbuhan koloni yang terjadi dan hasilnya adalah seperti berikut:
Gambar 5.1.3.1: Hasil kultur negatif bagi pertumbuhan Lactobacillus sp.
Gambar 5.1.3.2: Hasil kultur positif bagi pertumbuhan Lactobacillus sp.
Tabel 5.1.3.1: Koloni yang tumbuh pada tingkat pengenceran 10-6.
Jenis Produk
Koloni pada tingkat pengenceran
10-6 Jumlah
Positif Negatif
Yoghurt 0 23 23
Keju 3 5 8
Susu Kultur 0 21 21
Susu Acidophilus 1 12 13
Jumlah 4 61 65
Dari segi jenis produk pada data diatas (raw data tercatat pada Lampiran 1 dan 2), hanya 4 sampel yang menunjukkan pertumbuhan positif bagi bakteri
Lactobacillus sp.. Penelitian telah diteruskan dengan tingkat pengenceran 10-7
sesuai dengan objektif penelitian dan hasilnya seperti berikut:
Tabel 5.1.3.2: Koloni yang tumbuh pada tingkat pengenceran 10-7.
Jenis Produk
Koloni pada tingkat pengenceran
10-7 Jumlah
Positif Negatif
Yoghurt 0 23 23
Keju 2 6 8
Susu Kultur 0 21 21
Susu Acidophilus 1 12 13
Jumlah 3 62 65
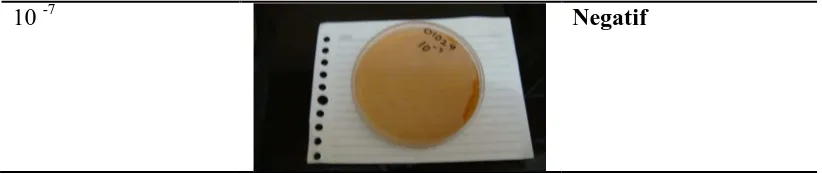
Jumlah sampel positif telah berkurang menjadi 3. Oleh karena kebanyakan sampel yang diuji memberikan hasil negatif (62 sampel), maka untuk membuktikan apakah betul-betul sampel mengandung Lactobacillus sp, terhadap satu sampel negatif tersebut (No. Kode sampel 01024) dilakukan kultur ulang dengan 7 kali pengenceran secara bertingkat. (10-1, 10-2, 10-3, 10-4, 10-5, 10-6 dan 10-7). Pengenceran sampel menggunakan aquabidest.
Gambar 5.1.3.3: Pengenceran sampel sebanyak 7 kali.
10 -7 Negatif
Hasil yang diperoleh adalah, mulai pengenceran 10-1 hingga 10-5 menunjukkan pertumbuhan positif bakteri Lactobacillus sp. Selain itu, jumlah koloni bakteri juga berkurang sejalan dengan meningkatnya tingkat pengenceran. Berdasarkan hasil yang diperoleh, maka peneliti mengambil keputusan untuk melakukan percobaan terhadap semua sampel dengan menggunakan tingkat pengenceran 10-3 dan 10-4 untuk mengetahui apakah masih ada bakteri yang viable dalam produk-produk susu fermentasi pada tingkat pengenceran tersebut. Hasil yang diperoleh adalah seperti dibawah ini.
Tabel 5.1.3.4: Koloni yang tumbuh pada tingkat pengenceran 10-3.
Jenis Produk
Koloni pada tingkat pengenceran
10-3 Jumlah
Positif Negatif
Yoghurt 5 18 23
Keju 3 5 8
Susu Kultur 6 15 21
Susu Acidophilus 1 12 13
Jumlah 15 50 65
Jelas dapat dilihat peningkatan dalam jumlah sampel positif yaitu sebanyak 15 sampel. Dapat dilihat adanya hubungan antara tingkat pengenceran dan pertumbuhan Lactobacillus sp.. Seterusnya, peneliti mengulangi percobaan pada tingkat pengenceran 10-4.
Tabel 5.1.3.5: Koloni yang tumbuh pada tingkat pengenceran 10-4.
Terjadi sedikit penurunan dalam jumlah sampel positif bagi pertumbuhan
Lactobacillus sp. dari 15 sampel menjadi 12 sampel dari tingkat pengenceran 10-3
ke 10-4. Selain itu, juga telah dianalisa apakah ada pengaruh dari lamanya produk tersebut dipasaran (dihitung jumlah hari dari tanggal percobaan terhadap sampel di laboratorium hingga tanggal kadaluarsa (luput) produk pada label) terhadap
pertumbuhan bakteri Lactobacillus sp.. Hasilnya adalah seperti berikut:
Tabel 5.1.3.6: Koloni yang tumbuh pada tingkat pengenceran 10-6.
Jumlah hari menuju mencapai tanggal luput dengan pertumbuhan bakteri pada tingkat pengenceran 10-6. Dilanjutkan dengan proses pengenceran 10-7 yang memberi hasil seperti berikut:
Tabel 5.1.3.7: Koloni yang tumbuh pada tingkat pengenceran 10-7.
Seperti sebelumnya, tidak ada makna signifikan yang dapat dilihat pada tingkat pengenceran 10-7. Namun, apabila dianalisa dengan tingkat pengenceran 10-3 dan 10-4 maka ada perbedaan yang jelas kelihatan. Hasilnya adalah seperti berikut:
Tabel 5.1.3.8: Koloni yang tumbuh pada tingkat pengenceran 10-3.
Jumlah hari menuju
Dari tabel diatas ini terlihat bahwa lamanya produk masih layak digunakan yang
diukur dengan hari sebelum produk tersebut kadaluarsa, menunjukkan hasil yang sangat bervariasi. Tampak bahwa bila produk akan kadaluarsa < 30 hari lagi dijumpai koloni pada 8 produk, sedangkan 13 produk lagi tidak ada koloni yang tumbuh. Demikian juga bila masa kadaluarsa masih lama (> 150 hari), pada 2 produk masih tumbuh koloni sedangkan pada 3 produk lagi tidak ada koloni yang tumbuh. Analisa terhadap masa kadaluarsa ini dilakukan juga untuk tingkat pengenceran 10-4 dengan hasil seperti berikut:
Tabel 5.1.3.9: Koloni yang tumbuh pada tingkat pengenceran 10-4.
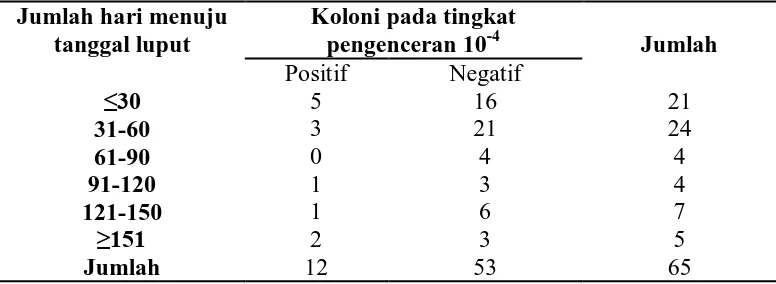
Jumlah hari menuju tanggal luput
Koloni pada tingkat
pengenceran 10-4 Jumlah
Positif Negatif
≤30 5 16 21
31-60 3 21 24
61-90 0 4 4
91-120 1 3 4
121-150 1 6 7
≥151 2 3 5
Jumlah 12 53 65
Dari tabel di atas, dapat dilihat sedikit penurunan dalam jumlah hasil positif bagi sampel dengan tanggal luput ≤ 30 hari jika dibandingkan dengan hasil dari Tabel 5.1.3.8. Jika dilihat pada sampel dengan tempoh tanggal luput yang panjang (≥ 151 hari), hasilnya lebih konsisten. Dari 2 sampel yang positif pada tingkat pengenceran 10-4, 1 sampel masih dapat bertahan hingga ke tingkat pengenceran 10-7 (lihat tabel 5.1.3.7).