ABSTRACT
METHOD VALIDATION ANALYSIS OF ANTIOXIDANT POTENTIAL β-CAROTENE FROM MICROALGAE Dunaliella sp. BY LINEAR SWEEP
VOLTAMMETRY TECHNIQUE
By
Ely Setiawati
A study of analytical methods validation of antioxidant potential β-carotene from microalgae Dunaliella sp. was conducted by linear sweep voltammetry technique, to obtain information about the performance of the method. Electrodes used in this research were :gold (Au) working electrode, platinum (Pt) auxiliary electrode, and a reference electrode of silver/silver chloride (Ag / AgCl). Potential window of oxidation of β-carotene is 0 mV - 1000 mV with a scan rate of 100 mV/s and 10 µA current range. Supporting electrolyte used in this experiment of 0.4 M NaNO3. Validation test parameters of this method include : linearity, precision, accuracy and limits of detection. The results showed that the validation of the methods have a correlation coefficient (r) 0.982; % RSD is 7.8%, the % recovery was 112%, and limit of detection was 0.6 mM. The advantage of this method is can calculate the coefficient of the antioxidant activity of β-carotene. Antioxidant activity coefficient of β-carotene has a value of 0.333.
Keywords: Validation method, linear sweep voltammetry, β-carotene, microalgae
ABSTRAK
VALIDASI METODE ANALISIS POTENSI ANTIOKSIDAN β-KAROTEN DARI MIKROALGA Dunaliella sp. DENGAN TEKNIK LINIER SWEEP
VOLTAMMETRY
Oleh
Ely Setiawati
Telah dilakukan validasi metode analisis potensi antioksidan β-karoten dari mikroalga Dunaliella sp. dengan teknik linear sweep voltammetry. Penelitian ini bertujuan untuk memperoleh metode dan informasi unjuk kerja metode analisis dengan teknik linear sweep voltammetry. Elektroda yang digunakan pada penelitian ini yaitu elektroda kerja emas (Au), elektroda bantu platina (Pt), dan elektroda
reference perak/perak klorida (Ag/AgCl). Jendela potensial dari oksidasi β-karoten adalah 0 mV – 1000 mV dengan scan rate 100 mV/s dan range arus 10 µA. Elektrolit yang digunakan adalah larutan NaNO3 0,4 M. Parameter uji validasi metode ini meliputi linieritas, presisi, akurasi, dan batas deteksi. Hasil penelitian menunjukkan bahwa validasi metode analisis memiliki nilai koefisien korelasi (r) 0,982 ; %RSD adalah 7,8% dan hasil %perolehan kembali adalah 112% serta batas deteksi metode analisis ini adalah 0,6 mM. Kelebihan dari metode ini adalah dapat menghitung koefisien aktivitas antioksidan dari β-karoten. Koefisien aktivitas antioksidan dari β-karoten memiliki nilai 0,333.
Kata kunci : Validasi metode, linear sweep voltammetry, β-karoten, mikroalga
VALIDASI METODE ANALISIS POTENSI ANTIOKSIDAN β-KAROTEN DARI MIKROALGA Dunaliella sp. DENGAN TEKNIK
LINEAR SWEEP VOLTAMMETRY
Oleh
ELY SETIAWATI
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas lampung
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
VALIDASI METODE ANALISIS POTENSI ANTIOKSIDAN β-KAROTEIN DARI MIKROALGA Dunaliella sp. DENGAN TEKNIK
LINEAR SWEEP VOLTAMMETRY
(Skripsi)
Oleh Ely Setiawati
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
DAFTAR GAMBAR
Gambar Halaman
1. Sel Voltammetri, W : Elektroda Kerja, R : Elektroda pembanding, A:
Elektroda bantu ... 7
2. Kurva Voltammogram dari elektrode kimia reversibel, memiliki puncak
arus katoda dan puncak arus anoda ... 8
3. Peningkatan linear Potensial vs waktu ... 9
4. Alat Haemocytometer ... 30 5. Voltammogram oksidasi β-karoten pada jendela potensial 0 V –
1 V ... ... 41
6. Voltammogram linearitas oksidasi β -karoten . ... 43
7. Kurva linearitas oksidasi larutan standar β -karoten ... 44
8. Voltammogram oksidasi blangko dan ekstrak mikroalga Dunaliella sp. ... ... 46
9. Voltammogram oksidasi blangko dan sampel spike ekstrak mikroalga
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
1. PENDAHULUAN A. Latar Belakang ... 1
B. Tujuan Penelitian ... 5
C. Manfaat Penelitian ... 5
D. Hipotesis Penelitian... 5
II. TINJAUAN PUSTAKA A. Voltammetri ... ... 6
B. Linier Sweep Voltammetri (LSV) ... ... 8
C. Validasi Metode ... ... 10
1. Ketepatan (accuracy) ... 11
2. Kecermatan (precision) ... 11
3. Linieritas ... 12
4. Batas Deteksi (Limit of Detection) ... 13
D. Mikroalga ... 14
a. Morfologi dan Klasifikasinya ... 14
b. Kondisi Lingkungan yang Mempengaruhi Pertumbuhan Mikroalga .. 14
1. Temperatur ... 15
2. Nutrien (Unsur Hara) ... 15
v
2. Pemanas (Dry-Heat Sterilization) ... 20
3. Sterilisasi dengan Penyaringan ... 20
4. Mikrowave Oven Sterilization ... 20
d. Pola Pertumbuhan Mikroalga ... 21
1. Fase Lag ... 21
2. Fase Eksponensial ... 21
3. Fase Penurunan Pertumbuhan (Declining Growth) ... 21
4. Fase Stasioner ... 22
5. Fase Kematian ... 22
e. Teknik Harvesting Mikroalga ... 22
E. Antioksidan ... 23
a. Pengertian Antioksidan ... 23
b. Sumber Antioksidan ... 24
c. Analisis Antioksidan ... 24
F. Vitamin A ... 25
III. METODELOGI PENELITIAN A. Waktu dan Tempat ... 27
B. Alat dan Bahan ... 27
C. Metodologi Penelitian ... 29
a. Kultivasi Mikroalga ... 29
b. Menghitung Kepadatan Mikroalga ... 29
c. Pemanenan ... 31
d. Freeze Drying ... 32
e. Ekstraksi ... 32
f. Persiapan Alat Voltammetri ... 33
vi
2. Pembuatan Larutan Blangko ... 33
3. Larutan Kerja ß-karoten ... 33
4. Preparasi ... 34
5. Voltammetri ... 34
6. Kondisi Pengukuran ... 34
7. Analisis ... 35 A. Preparasi sampel ... 39
B. Oksidasi ß-Karoten ... 40
C. Validasi Metode ... 42
1. Linearitas ... 42
2. Presisi ... 45
3. Akurasi ... 47
4. Batas Deteksi ... 50
D. Penentuan Koefisien (K) Aktivitas Antioksidan dari ß-Karoten ... 51
V. SIMPULAN DAN SARAN A. Simpulan ... 53
B. Saran ... 53
DAFTAR TABEL
Tabel Halaman
1. Formulasi media Conwy ... 28
2. Kandungan logam renik (cair) pada media Conwy ... 28
3. Kondisi pengukuran 1(reaksi oksidasi β-karoten) dan kondisi pengukuran 2 (reaksi reduksi oksigen) ………... 35
4. Arus (Ipa) Linearitas Oksidasi Larutan Standar β-Karoten ... 43
5. Data Ipa dan Epa Oksidasi Sampel Ekstrak Mikroalga Dunaliella sp. .... 45
6. Presisi Pengukuran Ekstrak Mikroalga Dunaliella sp. ... 46
7. Data Ipa dan Epa Oksidasi Spike Ekstrak Mikroalga Dunaliella sp. ... 48
8. Pengukuran Sampel Spike Ekstrak Mikroalga Dunaliella sp. ... 49
9. Pengukuran oksidasi larutan blangko dan hasil dari batas deteksi ... 51
Sesungguhnya Setelah Kesulitan Ada Kemudahan
(Q.S. Al-Insyirah:6)
Ilmu pengetahuan tanpa agama adalah cacat,
dan agama tanpa ilmu pengetahuan adalah buta
(Albert Einstein)
Barang siapa sungguh-sungguh, sesungguhnya kesungguhannya
itu adalah untuk dirinya sendiri
(Q.S. 29:6)
Selalu bersyukur membuat kita semakin menghargai hidup.
Dan kesabaran adalah obat terbaik dari segala kesulitan.
Kupersembahkan karya sederhana ini sebagai wujud tanda
cinta, kasih sayang, bakti dan tanggung jawabku
Kepada
ALLAH S.W.T
Kedua orang tuaku yang selalu menjadi motivasi utama
dalam menjalani hidup, terima kasih atas doa, perhatian dan
kasih sayang yang kau berikan secara tulus selama ini tanpa
mengharapkan imbalan sehingga mampu menguatkan diri ini
di saat-saat sulit,
Kakak-kakakku dan adikku yang selalu memberi semangat
dan dukungan yang luar biasa disetiap langkahku,
Sahabat dan Teman-yang selalu menemani dan berjuang
bersamaku,
Guru-guru ku yang senantiasa membimbing dan membagi
ilmunya untukku,
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung, pada tanggal
08 Maret 1992. Penulis merupakan anak keempat
dari lima bersaudara dan merupakan buah hati dari
pasangan (Alm) Bpk.Sukardi dan Ibu Sulastri yang
diberi nama Ely Setiawati.
Penulis menyelesaikan studi di Sekolah Dasar (SD) Negeri 1 Sepang Jaya Bandar
Lampung pada tahun 2004, Sekolah Menengah Pertama (SMP) Negeri 19 Bandar
Lampung pada tahun 2007 dan Sekolah Menengah Atas (SMA) Negeri 4 Metro
pada tahun 2010. Penulis kemudian terdaftar sebagai mahasiswa Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung melalui
jalur SNMPTN (Seleksi Nasional Masuk Perguruan Tinggi Negeri) pada tahun
2010.
Selama menjadi mahasiawa, penulis pernah mendapatkan beasiswa Peningkatan
Prestasi Akademik (PPA) pada tahun ajaran 2011/2012. Penulis dalam
penyelesaian studi, telah mengikuti Kuliah Kerja Nyata (KKN) di Labuhan
Maringgai, Lampung Timur selama 30 hari pada bulan Juli-Agustus tahun 2013.
Penulis pernah menjadi asisten praktikum kimia dasar mahasiswa Kimia angkatan
Geofisika angkatan 2014 pada tahun ajaran 2014/2015. Selain itu, penulis pernah
mengikuti beberapa organisasi mahasiswa. Berikut beberapa organisasi dan
amanah yang dipercayakan kepada penulis :
1. Kader Muda HIMAKI (KAMI) FMIPA pada tahun 2010-2011.
2. Himpunan Mahasiswa Kimia (HIMAKI) FMIPA sebagai anggota bidang
Sosial Masyarakat pada tahun 2011-2012.
3. Himpunan Mahasiswa Kimia (HIMAKI) sebagai anggota bidang Sains dan
Penalaran Ilmu Kimia pada tahun 2012-2013.
Penulis berharap masih dapat meneruskan tulisan-tulisan berikutnya dan dapat
SANWACANA
Assalamualaikum Wr. Wb.
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan
hidayah-Nya sehingga penulis dapat menyelesaikan skripsi ini. Shalawat serta
salam senantiasa penulis haturkan kepada Nabi Muhammad SAW semoga
senantiasa menjadi suri tauladan bagi penulis.
Skripsi dengan judul “Validasi Metode Analisis Potensi Antioksidan β-karoten
dari Mikroalga Dunaliella sp. dengan Teknik Linear Sweep Voltammetry” adalah
salah satu syarat yang harus dipenuhi untuk memperoleh gelar Sarjana Sains
Universitas Lampung.
Penyusunan skripsi ini tidak terlepas dari jasa baik segenap pihak baik moral
maupun spiritual, baik berupa bimbingan, motivasi dan doa yang senantiasa
berguna bagi penulis hingga saat ini dan di masa yang akan datang.
Ucapan terima kasih penulis haturkan kepada:
1. Bapak Dr. Hardoko Insan Qudus, M.S. selaku dosen pembimbing pertama
yang telah senantiasa bersedia meluangkan waktu untuk memberikan saran,
bimbingan, nasihat, serta kritik kepada penulis dalam menyelesaikan dan
2. Ibu Dian Septiani Pratama, M. Si. selaku dosen pembimbing kedua yang telah
senantiasa bersedia meluangkan waktu untuk memberikan saran, bimbingan,
nasihat, serta kritik kepada penulis dalam menyelesaikan dan pembuatan
skripsi ini.
3. Ibu Rinawati, Ph. D. selaku pembahas yang telah memberikan masukan, baik
saran maupun kritik kepada penulis untuk kesempurnaan tulisan dan penelitian
penulis.
4. Ibu Dian Septiani M.Si., selaku Pembimbing Akademik dalam menyelesaikan
masa studi penulis di Jurusan Kimia.
5. Bapak Dr. Eng. Suripto Dwi Yuwono, M.T., selaku Ketua Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam.
6. Bapak Prof. Suharso, Ph.D., selaku Dekan Fakultas Matematika dan Ilmu
Pengetahuan Alam.
7. Seluruh dosen dan karyawan Jurusan Matematika yang telah memberikan ilmu
dan pembelajaran selama masa studi penulis.
8. Kedua orangtua, (Alm) Ayah Sukardi dan Ibu Sulastri tercinta yang senantiasa
memberikan kasing sayang, cinta, doa, nasihat, air mata serta dorongan
semangat yang tulus kepada penulis.
9. Saudara kandung, Mba Leny Hastuti., Mba Novi Era Wati, Mas Agus
Sarwoko dan adik Maya Lestari tersayang yang senantiasa menemani dan
memberikan doa serta dorongan semangat kepada penulis.
10.Sahabat-sahabat, Orinawa Devi Maretta, Dewinta Mantary Putri, Sonia Elisya,
Aprianti, Sifa Kusuma Wardani atas persaudaraan, kebersamaan, kehangatan
dalam suka maupun duka yang telah dilewati bersama penulis.
11.Kakak terbaik, Yosuke Okimoto, Ph. D. yang senantiasa menjadi guru
motivasi dan memberikan perhatian, dukungan, semangat, motivasi, mimpi
serta harapan selama ini.
12.Keluarga besar kimia (HIMAKI), adik-adik, kakak-kakak serta teman-teman
kimia 2010 Chemistry Imut (Chemut), Lolita Napatilova, Surtini Karlina,
Kristi Arina, Ariyanti, Silvana Maya, Funda Elisya, Leni Astuti, Wynda Dwi
Anggraini, Faradilla Syani, Purniawati, Chintia Yolanda, Hapin Afriyani,
Sevina Silvi, Chyntia Gustianda, Putri Heriyani, Rani Anggraini, Adetia
Fatmawati, Martha Silvina, Rini Handayani, Rina Rachmawati Sutisna, Desi
Meriyanti, Fauziyah Mu’Min Shiddiq, Lailatul Hasanah, Widya Afriliani,
Rahmat Kurniawan, M. Nurul Fajri, Agung Supriyanto, M. Prasetyo Ersa,
Ruli Prayetno, serta teman kimia 2010 yang telah pindah jurusan, Putri
Rahmatika, Aditya Putra P., Ucep Saifulloh, Maria Anggraini dan Sunarmo
atas kebersamaan, kekeluargaan dan perjuangan hingga menyelesaikan studi
sarjana.
13.Keluarga besar Laboratorium Terpadu dan Sentra Inovasi Teknologi
Universitas Lampung atas pengalaman dan pembelajaran yang telah penulis
dapatkan selama ini.
14.Teman-teman VJ speaks dan teman-teman Kuliah Kerja Nyata atas
Semoga Allah SWT membalas atas kebaikan yang telah diberikan kepada penulis.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, akan tetapi
penulis berharap semoga skripsi ini dapat berguna dan bermanfaat bagi kita
semua. Amin.
Wassalamualaikum Wr. Wb.
Bandar Lampung, Oktober 2015
I. PENDAHULUAN
A. Latar Belakang
Semakin tingginya tuntutan jaman terhadap aktivitas dunia kerja cenderung akan
memaksa masyarakat untuk berpindah ke hal-hal yang bersifat cepat dan instan
termasuk dalam hal pola makan. Pola makan yang tidak tepat akan menyebabkan
akumulasi jangka panjang terhadap radikal bebas di dalam tubuh. Pengaruh gaya
hidup yang kurang baik, stress dan polusi lingkungan meningkatkan kebutuhan
tubuh akan zat gizi dan fitonutrisi sebagai pelindung dari radikal bebas
(PDPERSI, 2003).
Radikal bebas adalah atom atau molekul yang tidak stabil dan sangat reaktif
karena mengandung satu atau lebih elektron tidak berpasangan pada orbital
terluarnya. Untuk mencapai kestabilan atom atau molekul, radikal bebas akan
bereaksi dengan molekul disekitarnya untuk memperoleh pasangan elektron.
Senyawa ini terbentuk dari dalam tubuh dan dipicu oleh berbagai macam faktor.
Oleh karena itu, tubuh memerlukan suatu substansi penting yaitu antioksidan yang
mampu menangkap radikal bebas tersebut sehingga tidak dapat menginduksi
2
Antioksidan merupakan zat yang mampu memperlambat atau mencegah proses
oksidasi. Zat ini secara nyata mampu memperlambat atau menghambat oksidasi
zat yang mudah teroksidasi meskipun dalam konsentrasi rendah. Antioksidan juga
bermanfaat sebagai senyawa - senyawayang melindungi seldari efek berbahaya
radikal bebasoksigen reaktif. Jika berkaitan dengan penyakit, maka radikal bebas
ini dapat berasal dari metabolismetubuh maupun faktor eksternal lainnya.
Beberapa studi dan penelitian tentang radikal bebas menyatakan bahwa status
antioksidan dapat ditingkatkan melalui penyediaan bahan makanan tambahan
(suplemen) untuk mengurangi beberapa risiko penyakit yang terjadi akibat radikal
bebas (Ferguson et al., 2004). Di dalam tubuh manusia terdapat senyawa yang disebut antioksidan yaitu senyawa yang dapat menetralkan radikal bebas, seperti:
enzim SOD (Superoksida 2 Dismutase), gluthatione, dan katalase. Antioksidan
juga dapat diperoleh dari asupan makanan yang banyak mengandung vitamin C,
vitamin E dan β–karoten serta senyawa fenolik. Bahan pangan yang dapat menjadi sumber antioksidan alami, seperti rempah-rempah, coklat, biji-bijian,
buah-buahan, sayur-sayuran seperti buah tomat, pepaya, jeruk (Prakash, 2001).
Mikroalga Dunaliella sp. merupakan salah satu hasil laut yang memiliki
kandungan β–karoten dan merupakan agen antioksidan (Abidin dan Rondonuwo, 2009).
Mikroalga merupakan organisme tumbuhan berukuran seluler yang umumnya
dikenal dengan sebutan fitoplankton (Kawaroe et al., 2010). Dengan perairan Indonesia yang sangat luas, Indonesia memiliki potensi untuk mengembangkan
3
Mikroalga Dunaliella sp. merupakan mikroalga air laut populer sebagai produsen antioksidan terbaik (β–karoten) hingga 12 % dari berat keringnya (Ben-Amotz,
1999). Hasil penelitian yang dilakukan oleh Abd El-Baky et al. (2007), ditemukan bahwa Dunaliella sp. mengakumulasi jumlah karotenoid yang tinggi (12,6% berat kering), termasuk β–karoten (60,4% dari karotenoid total).
Pada beberapa riset sebelumnya, telah dilakukan studi tentang antioksidan
menggunakan voltammetri. Kesesuaian voltammetri untuk pengujian antioksidan
dalam matriks biologi sudah ditinjau secara ekstensif, seperti : uji aktivitas dalam
beberapa sampel yang mengandung antioksidan menggunakan differential pulse voltammetry (Korotkova et al., 2002) dan studi elektrokimia vitamin A dengan menggunakan teknik voltammetri siklik (Tan, 2010). Dari penelitian-penelitian
tersebut perlu dilakukan pengujian laboratorium.
Metode pengukuran yang dipilih harus metode yang telah diuji dan divalidasi oleh
laboratorium penguji (Garfield et al., 2000). Hal ini sesuai dengan sistem manajemen mutu standar nasional Indonesia-17025 (SNI-17025) tahun 2005
mengharuskan laboratorium pengujian dalam menganalisis bahan menggunakan
metode pengukuran yang valid. Validasi metode adalah sebuah proses yang
penting dari program jaminan mutu hasil uji dimana sifat-sifat dari sebuah metode
ditentukan dan dievaluasi secara obyektif (Garfield et al., 2000). Dengan adanya validasi ini, dapat diketahui suatu metode layak atau tidak untuk digunakan.
Tan, 2010 melakukan studi elektrokimia vitamin A dengan menggunakan teknik
4
bentuk utama vitamin A ; retinol, retinal, asam retinoat, retinil asetat, dan retinyl
palmitate. Kajian terhadap studi elektrokimia β–karoten oleh Tan, 2010 hanya dilakukan sebatas membandingkan antioksidan dari beberapa bentuk vitamin A
tersebut, studi elektrokimia ini memberikan informasi metode voltammetri yang
selektif yaitu senyawa vitamin A menunjukkan perilaku voltammetri yang sangat
berbeda meskipun perbedaan struktural hanya sedikit. Voltammetri linear
menghasilkan informasi berupa arus oksidasi, arus reduksi, luas permukaan
elektroda serta potensial oksidasi dan reduksi. Penelitian Korotkova et al., 2002 memberikan informasi bahwa potensi antioksidan dapat dinyatakan dalam
koefisien aktivitas antioksidan yang merupakan slop dari perubahan konsentrasi
berbanding densitas arus reduksi oksigen. Densitas arus reduksi merupakan hasil
bagi dari arus yang dihasilkan dengan luas permukaan eletroda pada proses
pemindaian voltammetri.
Sebagai studi awal pada penelitian ini dilakukan analisis potensi antioksidan pada
beberapa konsentrasi β–karoten. Penelitian ini merupakan penelitian lanjutan dari studi elektrokimia vitamin A dengan menggunakan teknik voltammetri siklik
(Tan, 2010) akan tetapi pada penelitian ini menggunakan sampel yang berbeda,
yaitu ekstraksi mikroalga Dunaliella sp menggunakan teknik voltammetri linear. Beberapa parameter uji diantaranya : akurasi, presisi, linearitas, dan batas deteksi
untuk mendapatkan metode analisis yang valid, cepat, sederhana, dan biaya yang
5
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk memperoleh metode dan informasi unjuk
kerja metode analisis potensi antioksidan β–karoten dari mikroalga Dunaliella sp. dengan teknik voltammetri linear.
C. Manfaat Penelitian
Manfaat dari penelitian ini adalah :
1. Memberikan informasi unjuk kerja metode analisis potensi antioksidan
β–karoten dari mikroalga Dunaliella sp.
2. Memberikan metode analisis potensi antioksidan β–karoten dari mikroalga
Dunaliella sp. menggunakan voltammetri linear yang tervalidasi.
D. Hipotesis Penelitian
Hipotesis dari penelitian ini adalah :
II. TINJAUAN PUSTAKA
A. Voltammetri
Voltametri merupakan salah satu teknik elektroanalitik dengan prinsip dasar
elektrolisis. Elektroanalisis merupakan suatu teknik yang berfokus pada
hubungan antara besaran listrik dengan reaksi kimia, yaitu menentukan
satuan-satuan listrik seperti arus, potensial, atau tegangan, dan hubungannya
dengan parameter-parameter kimia (Balazs et al., 1999).
Dalam teknik voltammetri, potensial yang diberikan dapat diatur sesuai keperluan.
Kelebihan dari teknik ini adalah sensitifitasnya yang tinggi, limit deteksi
yang rendah dan memiliki daerah linier yang lebar. Selama proses
pengukuran, konsentrasi analit praktis tidak berubah karena hanya sebagian
kecil analit yang dielektrolisis. Potensial elektroda kerja diubah selama
pengukuran, dan arus yang dihasilkan dialurkan terhadap potensial yang diberikan
pada elekroda kerja. Arus yang diukur pada analisis voltammetri terjadi
akibat adanya reaksi redoks pada permukaan elektroda. Kurva arus terhadap
potensial yang dihasilkan disebut dengan voltammogram (Burns et al., 1981). Arus yang dihasilkan sebanding dengan konsentrasi analit dalam larutan. Adapun
7
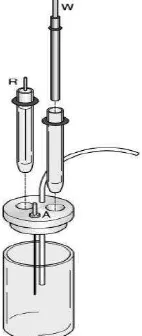
Gambar 1. Sel Voltammetri, W: Elektroda kerja, R : Elektroda pembanding, A : Elektroda bantu (Monk, 2001).
Sel voltammetri (Gambar 1) terdiri dari tiga elektroda, yaitu elektroda kerja,
elektroda pembanding, dan elektroda bantu. Metode voltammetri atau
polarography atau polarographic analysis merupakan metode elektroanalisis dimana informasi tentang analit diperoleh dari pengukuran arus fungsi
potensial. Teknik pengukurannya dilakukan dengan cara mempolarisasikan
elektroda kerja. Metode ini termasuk metode aktif karena pengukurannya
berdasarkan potensial yang terkontrol (Skoog et al., 1996). Kurva voltammogram ditunjukkan pada Gambar 2, yang merupakan pengukuran
menggunakan metode voltammetri siklik, memerlukan suatu instrumen
pengukuran yang tepat. Instrumen yang digunakan pada pengukuran ini
8
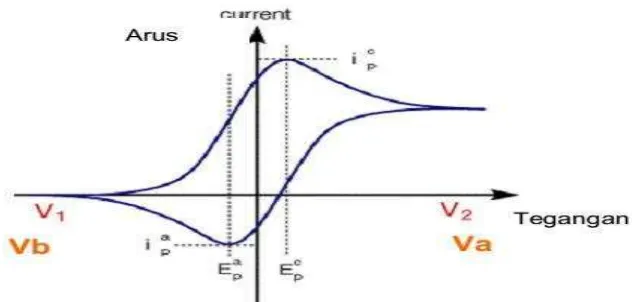
Gambar 2. Kurva voltamogram dari elektrode kimia reversibel, memiliki puncak arus katoda dan puncak arus anoda.
Pada kurva voltammogram siklik Gambar 2, memiliki puncak arus katoda Ipa dan
puncak arus anoda Ipc.
B. Linear Sweep Voltammetry (LSV)
Linear sweep voltammetry adalah istilah umum untuk suatu teknik voltammetri dimana potensial yang diberikan pada elektroda kerja dengan variasi waktu linier.
Metode ini juga mencakup polarografi, siklik voltammetri, dan voltametri disk
rotasi. Slope yang dihasilkan dari metode ini memiliki unit potensial (volt) per
satuan waktu, dan biasanya disebut laju selusur percobaan.
Nilai dari laju selusur percobaan dapat divariasi dari tingkat rendah mV/sec
(khusus untuk polarografi) sampai tingkat tinggi 1.000.000 V/sec (tercapai bila
digunakan ultra mikroelektroda sebagai elektroda kerja). Dalam voltammetri
9
tergantung pada laju reaksi transfer elektron, reaktivitas kimia dari spesi-spesi
elektroaktif dan laju pemindaian potensial (Wang, 2001).
Pada LSV, potensial dari indikator elektroda bervariasi secara linear sebagai
fungsi dari waktu. Tingkat scan yaitu 100 mV/s, yang memungkinkan waktu bagi
analit untuk sampai ke elektroda sehingga elektroda selalu dalam kesetimbangan
dengan larutan induk. LSV memberikan informasi kualitatif dan kuantitatif. Nilai
E1/2 dapat digunakan untuk mengidentifikasi spesies yang tidak diketahui,
sedangkan ketinggian dari arus dapat digunakan untuk menentukan konsentrasi.
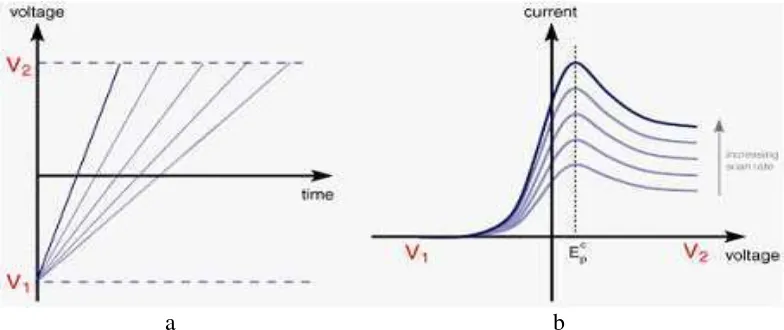
Voltammogram linear sweep terdapat dalam Gambar 3 yang tercatat pada tingkat pemindaian tunggal.
a b
Gambar 3. Peningkatan linear potensial vs waktu (Andrienko, 2008).
Gambar 3a menunjukkan laju selusur tunggal pada voltammetri linear sweep dan Gambar 3b menunjukkan voltammogram dengan teknik linear sweep.
Karakteristik voltammogram linear sweep tergantung pada 3 faktor, yaitu: 1. Laju reaksi transfer elektron (s)
10
3. Laju selusur tegangan
Dalam pengukuran LSV, respon arus diplotkan sebagai fungsi tegangan daripada
waktu, tidak seperti tahap pengukuran potensial. Pemindaian dimulai dari sisi kiri
arus / plot tegangan di mana belum adanya arus yang mengalir. Sepanjang jendela
potensial, pemindaian lebih lanjut ke arah kanan (ke nilai yang lebih reduktif) dan
arus mulai mengalir kemudian mencapai puncaknya. Untuk memberi alasan
perilaku ini, perlu dipertimbangkan pengaruh tegangan pada tetapan
keseimbangan di permukaan elektroda. Laju transfer elektron dinilai cepat dalam
perbandingan dengan laju pemindaian tegangan. Oleh karena itu, tetapan
kesetimbangan pada sebuah permukaan elektroda identik dengan prediksi
termodinamika.
C. Validasi Metode
Validasi metode adalah sebuah proses yang penting dari program jaminan mutu
hasil uji dimana sifat-sifat dari sebuah metode ditentukan dan dievaluasi secara
obyektif (Garfield et al., 2000). Hasil dari validasi metode dapat digunakan untuk menilai kualitas, tingkat kepercayaan (reliability), dan konsistensi hasil analisis,
itu semua menjadi bagian dari praktek analisis yang baik (Huber, 2001).
Pemilihan parameter validasi tergantung pada beberapa faktor seperti aplikasi,
sampel uji, tujuan metode, dan peraturan lokal atau internasional.
Parameter-parameter validasi meliputi ketepatan/akurasi, ketelitian, spesifisitas, limit deteksi,
11
1. Ketepatan (accuracy)
Akurasi atau ketepatan adalah ukuran yang menunjukan derajat kedekatan hasil
analis dengan kadar analit yang sebenarnya. Ketepatan dapat juga menyatakan
kedekatan dengan nilai yang dapat diterima, baik nilai sebenarnya maupun nilai
pembanding. Nilai benar dalam akurasi dapat diperoleh dengan beberapa cara.
Salah satu alternatifnya adalah membandingkan hasil metode dengan hasil dari
metode referensi yang sudah ditetapkan. Pendekatan ini mengasumsikan bahwa
ketidakpastian metode referensi diketahui. Kedua, akurasi dapat dinilai dengan
menganalisis sampel yang sudah diketahui konsentrasi (CRM) dan
membandingkan nilai diukur dengan nilai sebenarnya sebagai disertakan dengan
materi. Akurasi dapat ditentukan dengan nilai benar dari referensi material (µ),
rata-rata terukur referensi material (xt), nilai tabel t dengan tingkat kepercayaan
yang diinginkan, simpangan baku (SD), jumlah pengulangan (n) dan dinyatakan
dalam persamaan 1 :
µ − xt = ……….………… (1)
Jika µ − xt > , maka ada bias terbukti. Begitu sebaliknya maka tidak
ada bias hasil pengukuran (Nurhadi, 2012).
2. Kecermatan (precision)
Presisi prosedur analitis menggambarkan kedekatan kesepakatan (derajat
penyebaran) antara serangkaian pengukuran yang diperoleh dari beberapa
12
Presisi dapat dipertimbangkan pada tiga tingkatan, yaitu: pengulangan, presisi
intermediate dan reproduksibilitas. Simpangan baku, simpangan baku relatif
(koefisien variasi) dan interval kepercayaan harus dilaporkan untuk penentuan
nilai presisi (EMEA, 1995).
Dalam mengevaluasi ketelitian dari data analisis adalah dengan menghitung
simpangan baku. Simpangan baku mengukur penyebaran data-data percobaan dan
memberikan indikasi yang bagus mengenai seberapa dekat data tersebut satu sama
lain (Nielsen, 2003). Simpangan baku diperoleh dari akar pembagian hasil
penjumlahan kuadrat dengan derajat bebas (n-1) dan dinyatakan pada
persamaan 2 :
�� = √∑
………..….………(2)
Cara lain untuk mengukur ketelitian adalah dengan menghitung nilai simpangan
baku relatif (RSD). Nilai RSD ini merupakan nilai simpangan baku (SD) yang
ditentukan sebagai persentase dari rata-rata ( dan dinyatakan dalam
persamaan 3:
��
……… (3)
3. Linieritas
Linearitas merupakan kemampuan metode analisis (dalam kisaran tertentu) untuk
mendapatkan hasil uji yang berbanding lurus dengan konsentrasi dari analit dalam
13
(EMEA, 1995). Respons harus berbanding lurus dengan konsentrasi analit atau
proporsional dengan cara perhitungan matematis yang terdefinisi dengan baik.
Persamaan regresi linier diterapkan pada hasil harus memiliki nilai intercept tidak signifikan berbeda dari nol. Jika diperoleh intersep tidak signifikan nol, harus
dibuktikan bahwa ini tidak berpengaruh pada keakuratan metode (Huber, 2001).
4. Batas Deteksi (Limit Of Detection)
Batas deteksi (Limit Of Detection) merupakan jumlah terendah analit dalam sampel yang dapat dideteksi tetapi tidak harus kuantitatif sebagai nilai yang pasti.
Batas kuantifikasi prosedur analitis individu adalah jumlah terendah analit dalam
sampel yang dapat ditentukan secara kuantitatif dengan presisi dan akurasi yang
cocok. Batas kuantifikasi merupakan parameter tes kuantitatif untuk tingkat
rendah senyawa dalam matriks sampel, dan digunakan terutama untuk penentuan
kotoran dan produk terdegradasi (EMEA, 1995). Batas deteksi dapat ditentukan
melalui pengukuran larutan tanpa sampel uji atau pengukuran sampel uji dengan
konsentrasi terendah (Eurachem, 2014). Batas deteksi ditentukan dengan
perhitungan standar deviasi (SD) kemudian dikalikan 3 dan dinyatakan dalam
persamaan 4 :
14
D. Mikroalga
a. Morfologi dan Klasifikasinya
Mikroalga adalah organisme tumbuhan paling primitif berukuran seluler yang
umumnya dikenal dengan sebutan nama fitoplankton. Habitat hidupnya adalah
wilayah perairan di seluruh dunia. Habitat hidup mikroalga adalah di perairan atau
tempat-tempat lembab. Organisme ini merupakan produsen primer perairan yang
mampu berfotosintesis seperti layaknya tumbuhan tingkat tinggi lainnya.
Mikroalga yang hidup di laut dikenal dengan istilah marine microalgae atau mikroalga laut. Mikroalga yang banyak ditemukan berasal dari kelas
Bacillariophyceae (diatom), Chrysopyceae (alga coklat keemasan),
Chlarophyceae (alga hijau), dan kelas Cyanophyceae (blue green algae/alga biru-hijau). Berdasarkan pigmen yang dimiliki mikroalga dikelompokkan menjadi lima
filum, yaitu :
1. Chlorophyta (alga hijau) 2. Chrysophyta (alga keemasan) 3. Pyrhopyta (alga api)
4. Euglenophyta
5. Cyanophyta (alga biru-hijau) (Kawaroe et al., 2010).
b. Kondisi Lingkungan yang Mempengaruhi Pertumbuhan Mikroalga
Komunitas mikroalga pada suatu perairan dipengaruhi oleh kondisi lingkungan
15
mikroalga antara lain temperatur, kualitas dan kuantitas nutrien (unsur hara),
intensitas cahaya, derajat keasaman (pH), aerasi (sumber CO2), dan salinitas.
1. Temperatur
Temperatur optimal untuk kultivasi mikroalga antara 24-30oC, dan bisa
berbeda-beda bergantung lokasi, komposisi media yang digunakan serta jenis
mikroalga yang dikultivasi. Namun sebagian besar mikroalga dapat mentoleransi
temperatur antara 16-35oC. Temperatut di bawah 16oC dapat memperlambat
pertumbuhan dan temperatur diatas 35oC dapat renimbulkan kematian pada
beberapa spesies mikroalga. Sedangkan menurut Reynolds (1990), temperatur
optimal bagi pertumbuhan mikroalga adalah 25-40oC. Temperatur perairan di
Indonesia sangat mendukung pertumbuhan mikroalga yang dikultivasi pada
kolam-kolam budidaya.
2. Nutrien (Unsur Hara)
Unsur hara yang dibutuhkan mikroalga terdiri dari mikronutrien dan
makronutrien. Makronutrien antara lain C, H, N, P, K, S, Mg dan Ca. Sedangkan
mikronutrien yang dibutuhkan antara lain adalah Fe, Cu, Mn, Zn, Co, Bo, Vn, dan
Si. Di antara nutrien tersebut, N dan P sering menjadi faktor pembatas
pertumbuhan mikroalga.
Konsentrasi mikroalga yang dikultivasi secara umum lebih tinggi daripada yang di
alam, sehingga diperlukan penambahyangan nutrien untuk mencukupi kekurangan
16
Nitrat, Pospat, dan Silikat untuk memenuhi nutrien pada air laut (Lavens dan
Sorgeloos, 1996). Nutrien yang diberikan kepada mikroalga bergantung jenis
mikroalga dan kebutuhannya.
3. Intensitas Cahaya
Sama seperti layaknya semua tumbuhan, mikroalga juga melakukan proses
fotosintesis, yaitu mengasimilasi karbon anorganik untuk dikonversi menjadi
materi organik. Bersama dengan cahaya sebagai sumber energi yang sangat
berperan dalam proses fotosintesis pada alga. Oleh karena itu, intensitas cahaya
memegang peranan yang sangat penting, namun intensitas cahaya yang diperlukan
tiap-tiap alga untuk dapat tumbuh secara maksimum berbeda-beda.
Intensitas cahaya yang diperlukan bergantung volume kultivasi dan densitas
mikroalga. Makin tinggi densitas dan volume intensitas cahaya yang diperlukan
untuk kultivasi pada erlenmeyer adalah 1.000 lux, sedangkan untuk volume
kultivasi yang lebih besar diperlukan intensitas cahaya 5.000-10.000 lux
(Lavens dan Sorgeloos, 1996).
Sinar matahari di Indonesia mencukupi untuk kebutuhan kultivasi mikroalga.
Dengan kedalaman kolam 1 meter masih memungkinkan sinar matahari mencapai
dasar perairan. Bandingkan dengan kultivasi di negara-negara 4 musim, seperti
Eropa yang memiliki kedalaman kolam maksimal hanya 60 cm karena
17
4. Aerasi
Aerasi dibutuhkan untuk mencegah terjadinya sedimentasi pada sistem kultivasi
mikroalga, selain itu juga untuk memastikan bahwa semua sel mikroalga
mendapat cahaya dan nutrisi yang sama dimanapun berada, untuk menghindari
stratifikasi suhu dan tercampurnya air dengan suhu berbeda, terutama pada
kultivasi di luar laboratorium, dan untuk meningkatan pertukaran cahaya antara
medium kultivasi dan udara. Udara merupakan sumber karbon untuk fotosintesis
dalam bentuk karbon dioksida (CO2). Untuk kultivasi yang sangat padat, CO2
yang berasal dari udara (0,003% CO2) tidak mencukupi bagi pertumbuhan optimal
mikroalga, sehingga perlu ditambahkan dengan CO2 murni (rata-rata 1% dari
volume udara). Penambahan CO2 selanjutnya menjadi buffer pH sebagai hasil dari
kesetimbangan gas karbon dioksida (CO2 ) dan asam karbonat (HCO3). Gas CO2
yang masuk ke perairairan akan berubah bentuk menjadi asam karbonat (HCO3)
bergantung dari derajat keasaman (pH) air. Derajat keasaman yang optimum dapat
melarutkan CO2 adalah pada kisaran 6,5-9,5. Jika pH di bawah kisaran tersebut,
maka karbon dioksida tetap berbentuk CO2,artinya gas CO2 dapat cepat lepas ke
atmosfer, sehingga tidak terserap oleh mikroalga. Sebaliknya, apabila kondisi pH
di atas kisaran tersebut, maka CO2 menjadi bikarbonat yang tidak dapat diserap
oleh mikroalga. Perlu diperhatikan, bahwa tidak semua alga dapat mentoleransi
aerasi yang kuat karena proses pengadukan yang terlalu kencang dapat
18
5. Salinitas
Salinitas air adalah salah satu faktor yang berpengaruh terhadap organisme air
dalam mempertahankan tekanan osmotik yang baik antara protoplasma organisme
dengan air sebagai lingkungan hidupnya. Mikroalga laut mempunyai toleransi
yang besar terhadap perubahan salinitas. Salinitas 20-24% merupakan salinitas
yang optimal (Lavens dan Sorgeloos, 1996).
6. Derajat Keasaman (pH)
Proses fotosintesis merupakan proses penyerapan karbon dioksida yang terlarut di
dalam air, dan berakibat penurunan CO2 terlarut dalam air. Penurunan ini akan
meningkatkan pH. Oleh karena itu, laju fotosintesis akan terbatas oleh penurunan
karbon, dalam hal ini adalah ketersediaan karbon dioksida (CO2), perubahan
bentuk karbon yang ada di perairan dan tingginya nilai pH (Talling, 1976 dalam
Reynolds,1990).
Menurut Boyd (1990), kesetimbangan karbonat akan bertindak sebagai buffer pH.
Dalam keadaan basa, ion bikarbonat akan membentuk ion karbonat dan
melepaskan ion hidrogen yang bersifat asam, sehingga menjadi netral. Sebaliknya,
dalam keadaan terlalu asam, ion karbonat akan mengalami hidrolisis bersifat basa,
sehingga keadaan kembali menjadi netral. Reaksi tersebut dapat dilihat pada
persamaan berikut :
HCO3 H+ + CO3
19
Rata-rata pH untuk kultivasi sebagian besar spesies mikroalga adalah pH 7 sampai
pH 9, dengan pH optimum berkisar antara pH 8,2 sampai pH 8,7 (Lavens dan
Sorgeloos, 1996).
c. Sterilisasi
Sterilisasi merupakan proses yang ditujukan untuk membersihkan alat serta bahan
yang akan digunakan untuk isolasi maupun kultivasi mikroalga dari
mikroorganisme serta bahan kimia yang dapat menjadi kontaminan. Proses ini
meliputi strerilisasi wadah baru, wadah habis pakai dan sterilisasi pipet setelah
digunakan. Metode yang digunakan untuk sterilisasi alat maupun bahan yang
digunakan untuk isolasi serta kultivasi mikroalga adalah :
1. Autoclave
Autoclave adalah cara populer dan paling efektif untuk mensterilkan bahan-bahan
tahan panas dan biasanya digunakan untuk mensterilkan cairan. Tekanan uap yang
tinggi di dalamnya menghasilkan temperatur yang tinggi untuk sterilisasi
(± 121oC) tanpa mendidihkan cairan. Lama autoclave bergantung volume cairan
yang ingin disterilisasikan. Autoclave selama 10 menit pada suhu 12oC cukup
untuk mensterilkan tabung reaksi dengan diameter 18 mm, sedangkan waktu 1
20
2. Pemanas (Dry-Heat Sterilization)
Oven atau pemanas biasa digunakan untuk sterilisasi kering. Sterilisasi pemanasan
kering memerlukan suhu yang lebih tinggi serta waktu yang lebih lama
dibandingkan sterilisasi menggunakan autoclave. Metode yang sebaiknya
dilakukan menggunakan suhu hingga 250oC selama 3 sampai 5 jam, walaupun
untuk beberapa kasus memanaskan pada suhu 150oC selama 3 hingga 4 jam sudah
cukup.
3. Sterilisasi dengan Penyaringan
Sterilisasi dengan penyaringan (filtrasi) diperlukan untuk komponen yang tidak
tahan panas, misalnya vitamin, atau komponen cairan yang mudah menguap,
seperti pelarut organik dan sterilisasi media kultivasi. Filter mempunyai ukuran
pori kurang dari 0,2 mikron. Ini sangat penting mengingat virus dapat menerobos
filter tersebut. Ketika larutan (cairan) memiliki viskositas yang tinggi atau terdiri
dari partikel tersuspensi, pra penyaringan dengan filter berukuran 1 mikron sangat
diperlukan.
4. Mikrowave Oven Sterilization
Sterilisasi dengan mikrowave oven lebih cepat dibandingkan dengan steam atau sterilisasi kering. Panas yang dihasilkan oleh mikrowave terdiri dari 2 tipe, yaitu
21
dalam waktu kurang lebih 5 menit, bakteri dalam 8 menit dan jamur akan mati
dalam waktu 10 menit.
d. Pola Pertumbuhan Mikroalga
Pola pertumbuhan mikroalga pada sistem kultivasi terbagi menjadi 5 tahap, yaitu :
1. Fase Lag
Fase lag merupakan pertumbuhan fase awal dimana penambahan kelimpahan
mikroalga terjadi dalam jumlah sedikit.
2. Fase Eksponensial
Fase eksponensial merupakan tahapan pertumbuhan lanjut yang dialami
mikroalga setelah fase lag. Mikroalga yang dikultivasi akan mengalami
pertambahan biomassa secara cepat.
3. Fase Penurunan Pertumbuhan (Declining Growth)
Fase ini terjadi dengan indikasi pengurangan kecepatan pertumbuhan sampai
sama dengan fase awal pertumbuhan, yaitu kondisi yang stagnan dimana tidak
22
4. Fase Stasioner
Fase stasioner diindikasikan dengan adanya pertumbuhan mikroalga yang terjadi
secara konstan akibat dari keseimbangan katabolisme dan anabolisme di dalam
sel.
5. Fase Kematian
Fase kematian diindikasikan oleh kematian sel mikroalga yang terjadi karena
adanya perubahan kualitas air ke arah yang buruk, penurunan kandungan nutrien
dalam media kultivasi dan kemampuan metabolisme mikroalga yang menurun
akibat dari umur yang sudah tua.
e. Teknik Harvesting Mikroalga
Ada beberapa teknik yang digunakan pada proses pemanenan mikroalga atau
lebih dikenal sebagai harvesting. Teknik ini mencakup teknik mikrofiltrasi, pengendapan gravimetri, sentrifugasi, dan flokulasi (Shelef dan Sukenik, 1984).
Selain teknik tersebut, teknik lain yang digunakan untuk harvesting mikroalga adalah dengan ultrasonifikasi (Bosma, 2003). Penggunaan sentifuse sangat layak
digunakan jika kultivasi yang dilakukan pada skala laboratorium atau semi massal
23
E. Antioksidan
a. Pengertian Antioksidan
Antioksidan merupakan senyawa yang dapat menangkal radikal bebas dan
merupakan senyawa pemberi elektron atau reduktan. Senyawa ini mampu
menonaktifkan berkembangnya reaksi oksidasi, yaitu dengan cara antioksidan
membentuk radikal. Antioksidan juga merupakan senyawa yang dapat
menghambat reaksi oksidasi, dengan mengikat radikal bebas dan molekul yang
sangat reaktif, sehingga dapat menghambat kerusakan sel (Winarsi, 2007).
Radikal bebas sebenarnya berasal dari molekul oksigen yang secara kimia
strukturnya berubah akibat dari aktifitas lingkungan. Aktifitas lingkungan yang
dapat memunculkan radikal bebas antara lain radiasi, polusi, merokok dan lain
sebagainya. Radikal bebas yang beredar dalam tubuh berusaha untuk merusak
elektron yang ada pada molekul lain dalam tubuh, seperti DNA dan sel. Hal ini
akan merusak sel dan DNA tersebut. Kerusakan yang ditimbulkan dapat
menyebabkan sel tersebut menjadi tidak stabil yang berpotensi menyebabkan
proses penuaan dan kanker. Oleh karena itu, diperlukan antioksidan sebagai
senyawa pendonor elektron kepada senyawa yang bersifat oksidan sehingga
aktivitas senyawa oksidan tersebut bisa dihambat (Winarsi, 2007).
Antioksidan adalah substansi yang diperlukan tubuh untuk menetralisir radikal
bebas dan mencegah kerusakan yang ditimbulkan oleh radikal bebas terhadap sel
normal, protein, dan lemak. Antioksidan menstabilkan radikal bebas dengan
24
terjadinya reaksi berantai dari pembentukan radikal bebas yang dapat
menimbulkan stres oksidatif.
b. Sumber Antioksidan
Berdasarkan sumber perolehannya ada 2 macam antioksidan, yaitu antioksidan
alami dan antioksidan buatan (sintetik) :
1. Antiksidan alami adalah antioksidan yang diperoleh secara alami yang sudah
ada pada bahan pangan, baik yang terbentuk dari reaksi-reaksi selama proses
pengolahan maupun yang diisolasi dari sumber alami dan digunakan sebagai
bahan tambahan makanan. Contoh antioksidan alami antara lain: Vitamin A,
Vitamin C, Vitamin E, Polifenol, Glutation, asam ellagic, dan lain-lain.
2. Antioksidan Sintetis adalah antioksidan yang diperoleh dari hasil sintesis reaksi
kimia dan telah diproduksi untuk tujuan komersial. Contoh antioksidan sintetis
antara lain: Butil Hidroksi Anisol (BHA), Butil Hidroksi Toluen (BHT), Propil
galat, Tert-Butil Hidoksi Quinon (TBHQ), Tokoferol, dan lain-lain
(Dalimartha dan Soedibyo, 1999).
c. Analisis Antioksidan
Analisis voltammetri untuk studi sifat antioksidan dan penentuan aktivitas sangat
nyaman dan sensitif. Analisis komparatif aktivitas antioksidan seperti askorbat
dan asam sitrat, glukosa, senyawa larut air,dan beberapa produk makanan (ekstrak
teh hijau, cuka apel) dan farmasi (haemodesum, polyglucinum, Ringer solusi)
25
oksigen telah diteliti. Metode saat ini diketahui dari penetapan aktivitas
antioksidan terutama didasarkan pada penghambatan reaksi oksidasi dengan
antioksidan dan pencatatan sinyal kontrol dengan chemiluminescence,
kromatografi fasa gas, dan metode lainnya. Pendekatan yang efektif dan nyaman
untuk penentuan aktivitas antioksidan dengan merekam reduksi oksigen
elektrokimia pada elektroda film merkuri (atau elektroda gelas karbon).
Semua zat yang diteliti menunjukkan aktivitas antioksidan yang berbeda-beda.
Seperti yang diharapkan asam askorbat dan glukosa menunjukkan aktivitas
antioksidan lebih besar daripada antioksidan lain dalam kisaran konsentrasi yang
luas (hingga 5%) (Korotkova et al.,2001).
F. Vitamin A
Vitamin A merupakan salah satu jenis vitamin larut dalam lemak yang berperan
penting dalam pembentukan sistem penglihatan yang baik. Terdapat beberapa
senyawa yang digolongkan ke dalam kelompok vitamin A, antara lain : retinol,
retinil palmitat, dan retinil asetat. Akan tetapi, istilah vitamin A seringkali
merujuk pada senyawa retinol dibandingkan dengan senyawa lain karena senyawa
inilah yang paling banyak berperan aktif di dalam tubuh.Vitamin A banyak
ditemukan pada wortel, minyak ikan, susu, keju, dan hati.
Beta karoten, salah satu bentuk vitamin A, merupakan senyawa dengan aktivitas
antioksidan yang mampu menangkal radikal bebas.Senyawa radikal bebas ini
banyak berasal dari reaksi oksidasi di dalam tubuh maupun dari polusi di
26
mencegah kerusakan pada materi genetik (DNA dan RNA) oleh radikal bebas
sehingga laju mutasi dapat ditekan.Penurunan laju mutasi ini akan berujung pada
penurunan risiko pembentukan sel kanker. Aktivitas antioksidan juga terkait erat
dengan pencegahan proses penuaan, terutama pada sel kulit. Vitamin A memiliki
2 bentuk aktif yang dapat dicerna tubuh, yaitu retinil palmitat dan beta karoten.
Retinil palmitat berasal dari makanan hewani, seperti daging sapi, hati ayam,ikan,
susu, dan keju. Beta karoten sendiri berasal makanan nabati, seperti bayam,
brokoli, dan wortel dan mikroalga (Lee et al.,1996).
Betakaroten adalah pigmen berwarna dominan merah-jingga yang ditemukan
secara alami pada tumbuhan dan buah-buahan. Beta karoten merupakan anggota
karoten, yang merupakan tetraterpena turunan dari isoprena dan memiliki rantai
karbon berjumlah 40. Di antara semua karoten, beta karoten dicirikan dengan
keberadaan cincin beta pada kedua ujung molekulnya. Penyerapan beta karoten
oleh tubuh meningkat dengan meningkatnya asupan lemak, karena karoten larut
oleh lemak.
β-Karoten adalah senyawa yang memberikan warna jingga pada wortel, labu, dan
ubi, dan merupakan senyawa karoten yang paling umum pada tumbuhan.
Isolasi beta karoten di dalam buah-buahan umumnya menggunakan metode
kromatografi kolom. Pemisahan beta karoten dari campuran dengan senyawa
karotenoid lainnya berdasarkan polaritasnya. Beta karoten bersifat non-polar,
sehingga dapat dipisahkan dengan pelarut non-polar seperti dimetisulfoksida
27
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat
Penelitian ini dilakukan dari bulan Desember 2014 sampai dengan Juni 2015 di
Laboratorium Terpadu dan Sentra Inovasi Teknologi Fakultas Matematika dan
Ilmu pengetahuan Alam Universitas Lampung.
B. Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini antara lain Laminar Air Flow,
aerator, alat-alat gelas merk pyrex (erlenmeyer 250 mL, erlenmeyer 200 mL,
erlenmeyer 1000 mL, erlenmeyer 2000 mL, gelas ukur 5 mL, pipet tetes, labu
ukur 25 mL, labu ukur 5 mL, gelas kimia, pipet volum), botol film ukuran 10 mL,
autoklaf (merk Tomy SX-700), lampu TL 40 Watt, sentrifugasi, mikroskop
cahaya, Haemocytometer, ultrasonik, freeze dryer (merk Scanvic), neraca analitik (merk Wiggen Housser), dan 1 set alat Potentiostat (eDAQ Pty Ltd) yang terdiri
dari elektroda kerja emas, elektroda referensi Ag/AgCl, elektroda bantu platina,
dan sel elektrokimia berukuran 2,5 mL.
Bahan – bahan yang digunakan adalah ekstrak mikroalga Dunaliella sp., standar
28
aquapure water, NaNO3 0,1 M , dimetil sulfoksida (DMSO), media Conwy (Tabel 1), formula logam renik (Tabel 2), tisu, dan alumunium foil.
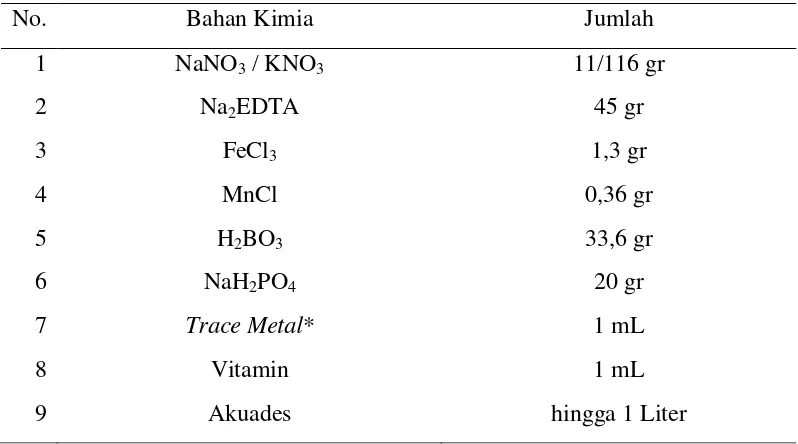
Tabel 1. Formulasi media Conwy
No. Bahan Kimia Jumlah
1 NaNO3 / KNO3 11/116 gr
2 Na2EDTA 45 gr
3 FeCl3 1,3 gr
4 MnCl 0,36 gr
5 H2BO3 33,6 gr
6 NaH2PO4 20 gr
7 Trace Metal* 1 mL
8 Vitamin 1 mL
9 Akuades hingga 1 Liter
(Sumber: Pujiastuti dkk., 2010).
Tabel 2. Kandungan logam renik (cair) pada media Conwy
No. Bahan Kimia Berat Pelarut Volume
1 ZnCl2 2,1 gram Akuades Labu ukur 100 mL
2 CuSO4.5H2O 2,0 gram Akuades Labu ukur 100 mL
3 CoCl2.6H2O 2,0 gram Akuades Labu ukur 100 mL
4 (NH4)6.Mo7O24.4H2O 0,9 gram Akuades Labu ukur 100 mL
29
C. Metode Penelitian
a. Kultivasi Mikroalga
Mikroalga Dunaliella sp. diperoleh dari Balai Besar Pengembangan Budidaya Laut (BBPBL) Lampung. Penelitian pendahuluan dilakukan untuk mengamati
fase pertumbuhan mikroalga Dunaliela sp. dengan menggunakan media kultur Conwy.
Tahapan awal penelitian dilakukan dengan mensterilisasi alat dan media kultur
yang digunakan. Sterilisasi alat dilakukan dengan autoclave dengan temperatur
121oC pada tekanan 2 atm selama 20 menit. Mikroalga dikultur pada skala
laboratorium (indoor ) dalam erlenmeyer 250 mL, 500 mL, 1000 mL dan
2000 mL. Perbandingan volum kultur mikroalga dan air laut adalah 1:4. Media
kultur yang akan digunakan berupa media cair berformula Conwy. Media kultur
diberikan pada volum yang sama dengan rasio media kultur dan air laut kultur
adalah 1:1000.
b. Menghitung Kepadatan Mikroalga
Alat yang digunakan untuk mengetahui jumlah sel yang terdapat dalam suatu
suspensi disebut dengan Counting Chamber. Perhitungan sel pada mikroalga
Dunaliella sp. ini menggunakan Hemocytometer. Perhitungan sel dilakukan dari hari ke-0 sampai dengan hari ke 16. Karena pada rentang itu diharapkan untuk
30
fase penurunan pertumbuhan (Declining Growth), fase stasioner dan fase kematian (Kawaroe, 2010).
Pada mikroalga Dunaliella sp., dengan media Conwy, ada 2 cara untuk menghitung sel dengan Haemocytometer, yaitu :
Cara I : adalah dengan pengenceran, yaitu 10 µL mikroalga Dunaliella sp. ditambah dengan 90 µL air laut dan 20 µL metanol.
Cara II : 80 µ L mikroalga Dunaliella sp. ditambah dengan 20 µL metanol.
Penghitungan secara langsung dapat dilakukan secara mikroskopis yaitu dengan
menghitung jumlah mikroalga dalam satuan isi yang sangat kecil. Alat yang
digunakan adalah Haemocytometer yang disajikan pada Gambar 4.
Gambar 4. Alat Haemocytometer
Cara kerja menggunakan Haemocytometer, yaitu :
31
2. Cover glass diletakkan di atas alat hitung.
3. Dibuat campuran 80 µl kultur dan 20 µl metanol. Didiamkan selama 15 - 30
menit. Kemudian diteteskanpada parit kaca pada alat hitung. Suspensi sel akan
menyebar karena daya kapilaritas.
4. Dibiarkan sejenak sehingga sel diam di tempat
5. Diletakkan alat hitung pada meja benda
6. Diatur fokusnya pada perbesaran 40x10.
7. Sampel dihitung sebanyak 5 kotak sedang.
c. Pemanenan
Pemanenan mikroalga dapat dilakukan dengan berbagai macam teknik dengan
tujuan memperoleh biomassa mikroalga secara optimal. Beberapa teknik yang
populer dilakukan adalah penyaringan, flokulasi, dan sentrifugasi. Pemanenan
dengan cara sentrifugasi dipilih sebagai cara pemanenan untuk mikroalga
Dunaliella sp. Pemanenan dilakukan pada fase stasioner, karena pada fase ini pertumbuhan mikroalga terjadi secara konstan akibat dari keseimbangan
katabolisme dan anabolisme di dalam sel (Kawaroe, 2010). Pada keadaan tersebut
sel akan saling berebut untuk mendapatkan makanan dan berlomba-lomba
mengeluarkan zat antibiotik untuk saling membunuh. Sehingga pada fase ini
32
ke 10. Pemanenan dengan cara sentrifugasi dilakukan pada kecepatan 85.000 rpm
selama 10 menit.
d. Freeze Drying
Dalam sintesis kimia, produk sering dikeringkan dengan tujuan produk menjadi
lebih stabil, atau mudah larut dalam pelarut yang digunakan. Dunaliella sp. hasil sentrifugasi di freeze dry sampai mendapatkan bubuk kering dari mikroalga
Dunaliella sp. Freeze dry dilakukanselama 9 jam pada suhu -106 oC sampai suhu -108oC. Selanjutnya hasil freeze dry akan diekstraksi dan dianalisis menggunakan teknik voltammetri.
e. Ekstraksi
Ekstraksi Dunaliella sp. menggunakan pelarut dimetil sulfoksida (DMSO) yang kemudian diultrasonik. Metode ultrasonik adalah metode yang menggunakan
gelombang ultrasonik yaitu gelombang akustik dengan frekuensi lebih besar dari
16-20 kHz (Suslick, 1988). Ultrasonik bersifat non-destructive dan
non-invasive,sehingga dapat dengan mudah diadaptasikan ke berbagai aplikasi (McClements, 1995).
Bubuk Dunaliella sp. hasil freeze dry dilarutkan dengan menggunakan pelarut dimetil sulfoksida (DMSO) , mengingat ß-karoten dalam mikroalga Dunaliella sp. bersifat nonpolar sehingga dipilih DMSO yang merupakan pelarut bersifat
33
kemudian hasil ekstraksi disaring. Filtrat hasil penyaringan digunakan untuk
dianalisis menggunakan voltammetri linier.
f. Persiapan Alat Voltammetri
1. Elektrolit Pendukung
Padatan NaNO3 ditimbang sebanyak 0,85 gram kemudian diencerkan dengan
aquapure dalam labu ukur 25 mL dan dihomogenkan sehingga diperoleh larutan NaNO3 0,4 M yang digunakan sebagai larutan elektrolit pendukung.
2. Pembuatan Larutan Blangko
Larutan dimetil sulfoksida (DMSO) dipipet sebanyak 2 mL kemudian ditambah
dengan elektrolit pendukung 0,5 mL NaNO3 0,4 M dan dihomogenkan sehingga
diperoleh larutan blangko.
3. Larutan Kerja ß-karoten
Padatan ß-karoten (Mr = 536,85 mol/gram) ditimbang sebanyak 0,0671 gram
kemudian dilarutkan dalam DMSO dalam labu ukur 25 mL dan dihomogenkan
sehingga diperoleh larutan stok ß-karoten 5 mM. Selanjutnya dibuat larutan kerja
karoten dari larutan stok 5 mM dengan cara pengenceran. Larutan kerja
ß-karoten yang digunakan untuk analisis adalah konsentrasi 1 mM, 2 mM, 2,5 mM,
34
4. Preparasi
Biomassa Dunaliella sp. ditimbang sebanyak 0,5 gram, kemudian dilarutkan dengan DMSO dan diekstraksi menggunakan metode ultrasonik. Kemudian hasil
ekstraksi disaring dan filtrat hasil penyaringan digunakan untuk dianalisis
menggunakan voltammetri linier sweep.
5. Voltammetri
Pada penelitian ini digunakan alat voltammetri (eDaQ Potentiostat). Alat
voltammetri dilengkapi dengan sambungan USB yang dapat terhubung pada
laptop untuk melihat grafik oksidasi dan reduksi. Alat ini juga dilengkapi dengan
tiga elektroda, diantaranya elektroda kerja emas, elektroda bantu platina dan
elektroda reference perak perak klorida. Digunakan sel elektrokimia bervolum 2,5 mL untuk larutan kerja yang akan diuji aktivitas antioksidannya.
6. Kondisi Pengukuran
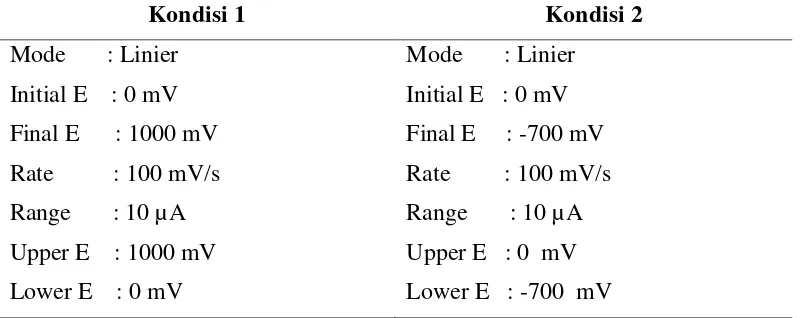
Ada dua kondisi pengukuran pada penelitian ini, yaitu kondisi 1 dan kondisi 2.
35
Tabel 3. Kondisi pengukuran 1 (reaksi oksidasi β–karoten) dan kondisi pengukuran 2 (reaksi reduksi oksigen)
Kondisi 1 Kondisi 2
Disusun sel elektrokimia yang terdiri dari tiga elektroda yaitu elektroda
pembanding (Ag/AgCl), elektroda kerja (Au) dan elektroda bantu yaitu Platina.
Dihubungkan elektroda pembanding / elektroda kerja / elektroda bantu pada
konektor potensiostat yang sesuai, yaitu elektroda kerja dihubungkan pada kabel
berwarna hijau, elektroda pembanding dihubungkan pada kabel berwarna kuning,
dan elektroda bantu yaitu Platina dihubungkan pada kabel berwarna merah.
Dihidupkan potensiostat dan komputer yang terhubung dengan alat tersebut serta
dijalankan software yang mengontrol proses analisis voltammetri.
Langkah pertama dalam penelitian ini adalah dilakukan pemindaian pada kondisi
1 untuk oksidasi larutan blangko dan larutan kerja ß-karoten serta hasil ekstraksi
mikroalga Dunaliella sp.Kemudian pemindaian kondisi 2 untuk reduksi pada larutan blangko dan larutan kerja ß-karoten serta hasil ekstraksi mikroalga
36
pada pemindaian kondisi 1 yang pertama dan pemindaian kondisi 1 yang kedua
dihasilkan nilai arus yang berbeda. Larutan pertama dalam proses ini adalah
larutan blangko yaitu pelarut DMSO 2 mL dimasukkan ke dalam sel elektrokimia
dan ditambahkan elektrolit pendukung NaNO3 sebanyak 0,5 mL.
Pada larutan blangko akan dihasilkan arus oksidasi yang dinyatakan sebagai nilai
arus residual (Ires). Kemudian perlakuan yang sama dilakukan pada larutan kerja
ß-karoten dan diberi penambahan 0,5 mL elektrolit pendukung NaNO3. Pada
larutan standar ß-karoten yang memiliki konsentrasi tertinggi akan dihasilkan arus
yang dinyatakan sebagai nilai arus tertinggi (Ior). Kemudian hasil ekstraksi
mikroalga Dunaliella sp. memiliki perlakuan yang sama dengan blangko dan larutan kerja ß-karoten dan diharapkan dihasilkan data analisis berupa arus
oksidasi ß-karoten pada larutan kerja dan hasil ekstraksi mikroalga Dunaliella sp. serta arus reduksi.
8. Validasi Metode
a. Linieritas
Linieritas ditentukan dengan pengukuran 4 larutan standar ß-karoten dan larutan
blangko. Larutan standar diurutkan dari konsentrasi terendah sampai konsentrasi
tertingi. Masing-masing larutan standar yaitu konsentrasi 1 mM, 2 mM, 2,5 mM,
dan 3 mM dilakukan pengukuran sebanyak 3 kali. Catat arus oksidasi ß-karoten
37
pengukuran larutan standar tersebut dan ditentukan koefisien regresi, kurva
konsentrasi antioksidan dan terhadap respon arus.
b. Presisi
Presisi ditentukan dengan menganalisis larutan sampel yang sama pada hari yang
sama. Larutan sampel dibagi menjadi 3 bagian. Masing-masing larutan sampel
dianalisis sebanyak satu kali. Dibuat grafik antara arus hasil pengukuran dan
konsentrasi ß-karoten. Kemudian tentukan rata-rata (mean), simpangan baku (SD) dan persen relatif simpangan baku (%RSD) yang ditentukan sebagai persentase
dari rata-rata.
c. Akurasi
Akurasi ditentukan dengan dengan menambahkan standar β-karoten 13 mM pada sampel ekstrak mikroalga Dunaliella sp.(spiking). Selanjutnya sampel ekstrak
Dunaliella sp.yang sudah ditambahkan standar β-karoten dianalisis menggunakan teknik linier sweep voltammetry. Kemudian arus hasil pengukuran diplot ke grafik dan dilakukan perhitungan %perolehan kembali.
d. Batas Deteksi
Batas deteksi ditentukan dengan pengukuran larutan blangko. Larutan sampel
blangko terdiri dari larutan DMSO 2 mL dan elektrolit pendukung NaNO3
38
Kemudian plot arus hasil pengukuran. Hitung simpangan baku (SD) hasil
V. SIMPULAN DAN SARAN
A. Simpulan
Dari hasil penelitian yang telah dilakukan, maka dapat ditarik simpulan sebagai
berikut :
1. Parameter uji linieritas, presisi dan akurasi untuk validasi metode analisis potensi
antioksidan pada β-karoten dari mikroalga Dunaliella sp. dengan teknik linier sweepvoltammetyr menunjukan hasil yang baik.
2. Limit deteksi yang dihasilkan untuk β-karoten adalah 0,604 mM. 3. Nilai koefisien aktivitas dari β-karoten yang diperoleh adalah 0,333.
B. Saran
Hal yang disarankan untuk penelitian selanjutnya adalah perlu dilakukan penelitian
DAFTAR PUSTAKA
Abd El-Baky, H. H., F. K. El-Baz., and G. S. El-Baroty. 2007. Production of Caretonoids from Marine Microalgae and its Evaluation as Safe Food Colorant and Lowering Cholesterol Agent. Am-Euras Journal Argiculture and Environment Science.
Abidin, D. dan F. Rondonuwu. 2009. Mikroalga Unik Dunaliella sp. Penghasil Agen
Antioksidan β–karoten pada Kondisi Stres. Seminar Nasional Farmasi. Semarang. Balai Besar Pengembangan Budidaya Laut. 2012. Lampung.
AOAC., 2002. Official Methods of Analysis of AOAC International. AOAC International. USA.
Balazs, Z. Chiba., P.R. Lewis., N.Nelson., and G.A, Steward.1999. Mediated
Electrochemical Oxidation of Organic Wastes Using a Co(III) Mediator in a Neutral Electrolyte, US, Pat 5,911,350 . The Regents of University of California, Oakland. Ben-Amotz , A. 1999. Dunaliella ß-carotene : from science to commerce. In : Seckbach J
(ed) Eigmatic microorganisms and life in extreme enviroments. Kluwer. Netherlands. Bosma, R., A. Wim, T. Johannes and H. Rene. 2003. Ultrasound a New Separation
Technique to Harvest Mikroalgae. Journal of Applied Technology. 15 : 143-153. Boyd, C. E. 1990. WaterQuality in Ponds for Aquaculture. Alabama Agricultural Experiment
Station. Auburn University. Auburn AL.
Burns, D.T., A.Townshend., and A. H.Carter. 1981. Inorganic Reaction Chemistry, Vol 2 Part B: a Source Book, Ellis Harwood Ltd., West Sussex-Englan.
Dalimartha, S. dan M. Soedibyo. 1999. Awet Muda dengan Tumbuhan Obat dan Diet Supleme. Trubus Agriwidya. Jakarta
EMEA., 1995. The European Agency for the Evaluation of Medicinal Products.. ICH Topic Q 2 B. Validation of Analytical Procedures:
55
Eurachem., 2014. The Fitness for Purpose of Analytical Methods: A Laboratory Guide to Method Validation and Related Topics (2nd edition). Europe.
Ferguson, J. D., A. R. Yoder., A. W Weimer and S. M. George. 2004. TiO2 atomiclayer
deposition on ZrO2 particels using alternating exposures of TiCl4 and H2O. Applied Surface Science.
Garfield, F. G., E. Klesta., and J. Hirsch. 2000. Quality Assurance Principles for Analytical Laboratories. AOAC International, USA.
Huber, L. 2001. Validation of Analytical Methods. Diakses pada tanggal 11 Juli 2014 pukul 19.02 WIB. www.labcompliance.com.
International Conference on Harmonization. 1996. Validation of Analytical Procedures and Methodology. Diakses pada tanggal 12 Juli 2014 pukul 18.55 WIB. www.ich.org Kawaroe, M., T. Prartono., A. Sunuddin, D.W. Sari., dan D. Augustine. 2010. Mikroalga
Potensi dan Pemanfaatan untuk Produksi Bio Bahan Bakar. IPB Press. Bogor.
Korotkova, E.I., Y. A. Karbanov., and A. V. Shevchuk. 2002. Study of Antioxidant Properties by Voltammetri. Journal of Electronical Chemistry.
Lavens, P. and P.Sorgeloos. 1996. Manual on the Production and Use of Live Food for Aquaculture. FAO Fisheries Technical Paper. No.361. Food and Agriculture Organization of the United Nations. Roma.
Lee, Rd., C. F. Thomas., R. G. Marietta., and W. S. Stark. 1996. Vitamin A, visual pigments, and visual receptors in Drosophila. Microscopy Research Tech 35(6):418-430 Lovric, S. K. 2010. Electrolytes Chapter III. Rudjer Boskovic Institute. Croatia.
McClements, D.J. 1995. Advances in The Application of Ultrasound in Food Analysis and rocessing. Trends Food Sci. Techn. 6, 293-299.
Mercadante, A.Z., A. Steck.,and H. Pfander. 1999. Carotenoids from Guava (Psidium guajava L): Isolation and Structure Elucidation. J. Agric. Food Chem. 47 (1): 145– 151.
Monk, P.M.S .2001. Fundamentals of Electroanalytical Chemistry. John Wiley & Sons Ltd. Chichester.156-166.
Nielsen, S. S. 2003. Introduction to Food Analysis. Di dalam Nielsen, S. S. (ed.). Food Analysis 3rd ed. Kluwer Academic/Plenum Publishers, New York.
Nurhadi, A. 2012. Materi Pelatihan Validasi Metode Uji. Unila. Bandar Lampung.
56
Pusat Data dan Informasi Perhimpunan Rumah Sakit Seluruh Indonesia. 2003.
Fitonutrisi Bisa Menjadi Pelindung Radikal Bebas. Jakarta.
Pujiastuti, A., M. Mohaemin., dan H. Wijayanti. 2010. Pertumbuhan Tetraselmis sp. di Media Kultur Berbeda dengan Penambahan Pb2+. Jurnal Ilmu Perikanan dan Sumberdaya Perairan.
Samuel, P. 1998. Kounaves Voltametric Techniques Tufts . University Department Of Chemistry,Chapter 37.
Shelef, G., and M. Sukenik. 1984. MikroalgaeHarvesting and Processing : A Literatur Review. Technion Research and Development Foundation ltd. Haifa. Israel
Skoog, D., M. Donald., F.West., and H.James.1996. Fundamentals of Analytical Chemistry. Sevent Edt., Saunders College Publishing.
Suslick, K. S. 1988. Ultrasounds: Its Chemical, Physical and Biological Effects. VHC Publishers. New York.
Takagi, M., Karseno, and Y. Toshiomi. 2006. Effect of Salt Concertation on Intracellular Accumulation of Lipids and Triacylglyceride in Marine Microalga Dunaliella Cells. Journal of Bioscience and Bioengineering. Vol. 101, No.3. The Society for
Biotechnology. Japan.
Tan,Y.S.,and R.D. Webster. 2010. Electrochemistry of Vitamin A. Journal of Mathematical Sciences Chemistry and Biological Chemistry.
Wang, J. 2001. Sensitive Electroalanysis Using Solid Electrodes. Chem. Ed. 59(8) : 691-692 hlm.