GAMBARAN JUMLAH TOTAL DAN DIFERENSIASI LEUKOSIT SEBELUM
DAN SESUDAH MASTEKTOMI DAN OVARIOHISTEREKTOMI PADA
KELINCI YANG DIINDUKSI TUMOR DAN DIOBATI DENGAN EKSTRAK
RIMPANG TEMU PUTIH (
Curcuma zedoaria
(Berg.) Roscoe)
EVA DEVARI PERMATASARI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul “Gambaran Jumlah Total dan
Diferensiasi Leukosit Sebelum dan Sesudah Mastektomi dan Ovariohisterektomi pada Kelinci yang Diinduksi Tumor dan Diobati dengan Ekstrak Rimpang Temu Putih (Curcuma zedoaria (Berg.) Roscoe)” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan
dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juli 2010
Eva Devari Permatasari
ABSTRACT
EVA DEVARI PERMATASARI. Total and Differentiation of Leucocytes Before and After Mastectomy dan Ovariohisterectomy in Rabbit Induced by Tumour and Treated by Zedoary Rhizome Extract. Undersupervision : GUNANTI and ANITA ESFANDIARI
The objective of this research is to find out the potency of zedoary rhizome extract on the total and differentiation of leucocytes of mammary glands tumor rabbit before and after surgey. Twelves females between 6-9 months old rabbit were divided into 4 groups. First group was a control, the second group was induced by n-methyl-n-nitrosourea (MNU), the third group was induced by MNU and treated by operation, and the fourth group was induced by MNU and treated by combination between operation and administration of extract of zedoary rhizome. MNU was given every week for 4 weeks and the next week was the surgery. Extract of zedoary rhizome was given every week after surgery for 5 weeks. The blood collection was done every week for 9 weeks. Blood were observe to count total and differentiation of leucocytes. The result showed that the leucocytes and lymphocytes increased in blood circulatory of group 1,2, and 4. The conclusion is the administration of zedoary rhizome extract can increased the immunity system by increasing of leucocytes and lymphocytes.
ABSTRAK
EVA DEVARI PERMATASARI. Gambaran Jumlah Total dan Diferensiasi Leukosit Sebelum dan Sesudah Mastektomi dan Ovariohisterektomi pada Kelinci yang Diinduksi Tumor dan Diobati dengan Ekstrak Rimpang Temu Putih (Curcuma zedoaria (Berg.) Roscoe). Dibimbing oleh GUNANTI dan ANITA ESFANDIARI.
Penelitian ini bertujuan untuk mengetahui pengaruh ekstrak rimpang temu putih terhadap gambaran jumlah total dan diferensiasi leukosit pada kelinci tumor kelenjar mammaria sebelum dan sesudah operasi. Dua belas ekor kelinci betina berumur 6-9 bulan dibagi ke dalam 4 kelompok perlakuan, kelompok kontrol, kelompok induksi n-metil-n-nitrosourea (MNU), kelompok induksi MNU + operasi dan kelompok induksi MNU + operasi + ekstrak temu putih. Induksi dilakukan selama 4 minggu dan minggu ke-5 kelinci dioperasi. Ekstrak temu putih diberikan selama 5 minggu sesudah operasi. Darah kelinci diambil setiap minggu selama 9 minggu. Darah diperiksa untuk dihitung jumlah total dan diferensiasi leukosit. Hasil pengamatan menunjukkan bahwa jumlah total leukosit dan limfosit meningkat di sirkulasi pada kelompok 1,2 dan 4. Dari pengamatan dapat disimpulkan bahwa pemberian ekstrak temu putih dapat meningkatkan sistem pertahanan tubuh melalui peningkatan jumlah total leukosit dan limfosit.
GAMBARAN JUMLAH TOTAL DAN DIFERENSIASI LEUKOSIT SEBELUM
DAN SESUDAH MASTEKTOMI DAN OVARIOHISTEREKTOMI PADA
KELINCI YANG DIINDUKSI TUMOR DAN DIOBATI DENGAN EKSTRAK
RIMPANG TEMU PUTIH (
Curcuma zedoaria
(Berg.) Roscoe)
EVA DEVARI PERMATASARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
© Hak Cipta Milik IPB, tahun 2010 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
HALAMAN PENGESAHAN
Judul Tugas Akhir : Gambaran Jumlah Total dan Diferensiasi Leukosit Sebelum dan Sesudah Mastektomi dan Ovarihisterektomi pada Kelinci yang Diinduksi Tumor dan Diobati Temu Putih (Curcuma zedoaria
(Berg.) Roscoe) Bentuk Tugas Akhir : Penelitian
Nama Mahasiswa : Eva Devari Permatasari NIM : B04050387
Disetujui,
Dr. Drh, Hj. Gunanti, MS Dr. Drh. Anita Esfandiari, MSi Pembimbing I Pembimbing II
Diketahui
Wakil Dekan Fakultas Kedokteran Hewan
Dr. Nastiti Kusumorini 1962 1205 1987 03 2 001
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT karena atas segala berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan tugas akhir dengan
judul “Gambaran Jumlah Total dan Diferensiasi Leukosit Sebelum dan Sesudah Mastektomi dan Ovariohisterektomi pada Kelinci yang Diinduksi Tumor dan Diobati dengan Ekstrak Rimpang Temu Putih (Curcuma zedoaria (Berg.) Roscoe)”. Skripsi ini disusun untuk mendapatkan gelar sarjana pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Penulis menyadari bahwa penyusunan skripsi ini tidak mungkin dapat diselesaikan dengan baik tanpa bantuan dan bimbingan dari berbagai pihak. Oleh karena itu, penulis menyampaikan terima kasih kepada :
1. Dr. drh. Hj. Gunanti, MS dan Dr. drh Anita Esfandiari, MSi selaku pembimbing skripsi yang dengan penuh kesabaran telah memberikan arahan, bimbingan serta evaluasi dalam
penyusunan dan penulisan skripsi ini.
2. Dr. drh. Eva Harlina, MS, Dr. drh Umi Cahyaningsih, MS dan drh Kusdianto Muhammad,MSi selaku dosen penguji dan penilai atas masukan, kritik serta sarannya.
3. Dr. drh. Upik Kesumawati, MS selaku dosen pembimbing akademik atas segala bimbingan dan motivasi yang telah diberikan selama masa perkuliahan.
4. Seluruh staf dan teknisi di Bagian Patologi, Bagian Bedah, Fakultas Kedokteran Hewan IPB yang telah membantu penulis selama penelitian.
5. Keluarga tercinta (Alm. Bapak I Sarnika, Ibu Iin Indarwati, Mas Agus Jayapurwa dan Mas Septrias Patria) atas segala doa, nasehat dan dukungan moral sehingga skripsi ini dapat terselesaikan.
6. Abang Aprialdy atas doa, kesabaran, kritik dan motivasi yang telah diberikan sampai skripsi ini dapat terselesaikan. Semoga segala yang kita cita-citakan dapat terkabul dan langkah kita selalu diridhoi Allah SWT.
7. Keluarga besar di Cirebon atas doa dan motivasinya.
8. Rekan sepenelitian Siti Sarah Ulia, Betania Suswati, Data Putra atas kerjasama, bantuan dan saran dalam penelitian serta penulisan skripsi.
10.Teman-teman kosan Pondok Putri Rahmah lantai 3 (Jijah, Icha, Putri, Aida, Etta, Cila, Achy, Ani, Nidya, Agnita) atas semua kenangan yang tidak terlupakan.
11.Teman-teman asrama (Femi, Nando, Ichay, dan Fera).
12.Satya Fahriani, Deva Putri Attikasari, Cut Desna A., Zahrotun Nuri, Rina Firantiani, Retno Wulandari, Jainuri Atun Nisa dan teman-teman Goblet „42 atas kenangan manis selama empat tahun ini.
13.Kepada semua pihak yang tidak dapat penulis sebutkan satu per satu yang turut membantu dalam penelitian dan penulisan skripsi ini.
Penulis sangat mengharapkan kritik dan saran untuk melengkapi skripsi ini. Semoga skripsi ini dapat bermanfaat bagi penulis, pembaca maupun pihak-pihak lain yang berkepentingan. Penulis menyadari masih banyak kekurangan dalam penulisan skripsi ini, namun penulis berharap tulisan ini dapat memberi manfaat sebagai sumber informasi untuk kemajuan ilmu pengetahuan.
Bogor, Juli 2010
RIWAYAT HIDUP
Penulis lahir di Jakarta pada tanggal 13 September 1986. Penulis adalah anak dari pasangan suami isteri Alm. Letkol Marinir (Purn) H. I Sarnika dan Hj. Iin Indarwati. Penulis merupakan putri ketiga dari tiga bersaudara. Pada tahun 1993 penulis bersekolah di SDN Kelapa Gading Barat 01 Pagi, kemudian melanjutkan pendidikannya di SLTP Negeri 30 Jakarta pada tahun 1999 dan selanjutnya pada tahun 2002 penulis melanjutkan pendidikannya di SMA Negeri 13 Jakarta .
DAFTAR ISI
Halaman
DAFTAR ISI i
DAFTAR GAMBAR iii
DAFTAR TABEL iv
PENDAHULUAN
Latar Belakang...……….………... 1
Tujuan Penelitian...………..……….. 2
Manfaat Penelitian...……….. 2
TINJAUAN PUSTAKA Tumor...………... 3
N-metil-n-nitrosourea(MNU)……… 5
Temu Putih.……… 5
Darah...……... 8
Leukosit...……… 8
Neutrofil... 9
Limfosit... 11
Monosit... 12
Basofil... 13
Eosinofil... 14
Kelinci... 15
METODOLOGI Waktu dan Tempat Pelaksanaan ……….. 18
Bahan dan Alat………... 18
Metode Penelitian ………... 19
Persiapan dan Pemeliharaan Kelinci..…... 19
Induksi tumor …………...…... 19
Pembuatan Ekstrak Rimpang Temu Putih... 20
Pengambilan Darah...…………... 20
Pembuatan Preparat Ulas Darah... 21
Penghitungan Jumlah Total Leukosit... 21
Penghitungan Diferensiasi Leukosit... 21
Operasi... 21
Praoperasi... 22
Ovariohisterektomi... 22
Mastektomi... 23
Post Operasi... 23
Variabel yang Diamati... 24
Analisis Data... 24
HASIL DAN PEMBAHASAN Jumlah Total Leukosit………..……… 25
Neutrofil……….………... 28
Limfosit………. 30
Monosit………. 32
Basofil………... 33
Eosinofil……… 35
KESIMPULAN DAN SARAN Simpulan…..……….. 37
Saran..………….……...………..………..………. 37
DAFTAR PUSTAKA …..………..………..………..
LAMPIRAN...
DAFTAR GAMBAR
Halaman
1 Rimpang temu putih…………...……...…..…… 7
2 Neutrofil kelinci………...……... 10
3 Limfosit kelinci………... 11
4 Monosit kelinci………... 12
5 Basofil kelinci…... 14
6 Eosinofil kelinci…... 15
7 Kelinci penelitian………... 16
8 Perbandingan rataan jumlah total leukosit sebelum dan sesudah operasi pada setiap kelompok perlakuan ………...……… 26
9 Perbandingan rataan jumlah neutrofil sebelum dan sesudah operasi pada setiap kelompok perlakuan... 28
10 Mekanisme obat anti radang………... 30
11 Perbandingan rataan jumlah limfosit sebelum dan sesudah operasi pada setiap kelompok perlakuan………..……….. 31
12 Perbandingan rataan jumlah monosit sebelum dan sesudah pada setiap kelompok perlakuan... 32
13 Perbandingan rataan jumlah basofil sebelum dan sesudah pada setiap kelompok perlakuan... 34
DAFTAR TABEL
Halaman
1 Perlakuan pada masing-masing kelompok kelinci percobaan... 19
2 Rataan jumlah total leukosit semua kelompok perlakuan (sel/µL) sebelum operasi dan setelah operasi ………... 27
3 Rataan jumlah neutrofil semua kelompok perlakuan (sel/µL) sebelum operasi dan setelah operasi………. 29
4 Rataan jumlah limfosit semua kelompok perlakuan (sel/µL) sebelum operasi
dan setelah operasi………. 31
5 Rataan jumlah monosit semua kelompok perlakuan (sel/µL) sebelum operasi dan setelah operasi………. 33
6 Rataan jumlah basofil semua kelompok perlakuan (sel/µL) sebelum operasi
dan setelah operasi………. 34
PENDAHULUAN
Latar Belakang
Tumor (neoplasma) merupakan penyakit yang sulit untuk disembuhkan. Banyak penelitian melaporkan bahwa pemicu tumor dan kanker berasal dari pengaruh dari dalam maupun luar tubuh. Pengaruh dari dalam tubuh berupa unsur genetika, sedangkan pengaruh dari lingkungan luar yaitu berupa makanan, udara, zat kimia dan faktor tekanan lingkungan. Terapi yang paling sering dilakukan adalah operasi, kemoterapi, radioterapi dan kombinasinya. Pada umumnya, beberapa jenis terapi tersebut memiliki efek samping yang membuat para penderita tidak nyaman, mual, rasa terbakar, saraf perasa tak berfungsi untuk sementara, pencernaan terganggu dan rambut rontok(Cheville 2006).
Pengobatan suatu penyakit dengan menggunakan tanaman telah digunakan oleh nenek moyang sejak zaman dahulu. Menurut Dalimarta (2005), salah satu tanaman yang banyak diteliti dan memiliki banyak khasiat adalah temu putih (Curcuma zedoaria (Berg.) Roscoe). Menurut Sumarny (2006), di Cina, temu putih sudah lama digunakan untuk pengobatan kanker serviks dan vulva. Temu putih ini dapat digunakan sebagai peredam pertumbuhan sel kanker (Syukur dan Hernani 2002). Tanaman temu putih banyak ditemukan di Indonesia dan memiliki banyak manfaat, umumnya ditanam sebagai tanaman obat, dapat ditemukan tumbuh liar pada tempat-tempat terbuka yang tanahnya lembab. Temu putih banyak ditemukan di Indonesia seperti di Jawa Barat, Jawa Tengah, Sumatera, Ambon, hingga Irian, serta dibudidayakan di India, Banglades, China, Madagaskar, Filipina dan Malaysia (Dalimartha 2005).
humoral dan imunitas selular. Menurut Girindra (1988), hasil pemeriksaan darah merupakan parameter yang baik, yang secara umum dapat menggambarkan kondisi tubuh diantaranya pemeriksaan jumlah total dan diferensiasi leukosit.
Suatu penelitian umumnya membutuhkan hewan coba. Hewan yang umumnya digunakan sebagai hewan coba adalah mencit, tikus, dan kelinci. Penelitian ini menggunakan hewan coba kelinci. Kelinci digunakan pada penelitian ini karena harganya terjangkau, mudah dipelihara, mudah ditangani, dan memiliki papilla mammari yang cukup besar.
Tujuan
Tujuan penelitian ini adalah untuk mengetahui gambaran jumlah total dan diferensiasi leukosit sebelum dan sesudah operasi mastektomi dan ovarihisterektomi pada kelinci yang diinduksi tumor dan diobati dengan ekstrak rimpang temu putih.
Manfaat
TINJAUAN PUSTAKA
Tumor
Tumor di dalam literatur memiliki arti pembengkakan yang bersifat abnormal. Menurut istilah kedokteran modern, kata tersebut memiliki arti spesifik yaitu suatu lesio yang dihasilkan dari sel yang pertumbuhannya abnormal yang terjadi setelah rangsangan yang menginisiasi terjadinya pertumbuhan tersebut telah dihilangkan; dengan kata lain sel tersebut berkembang (tumbuh) diluar dari mekanisme pengaturannya (Cheville 2006). Tumor atau neoplasma menurut Priosoeryanto dkk (2006) adalah gangguan pertumbuhan yang dicirikan oleh adanya proliferasi yang berlebihan, abnormal, dan tidak terkendali akibat transformasi atau perubahan dari satu atau lebih unsur penting di dalam tubuh hospes, dan sering terjadi pada satu atau lebih lokasi metastatik.
Definisi tumor atau neoplasia banyak diungkap oleh berbagai ilmuwan, namun menurut Rumawas (1989), definisi yang paling tepat adalah yang diungkap Willis pada tahun 1942 yaitu, neoplasia atau tumor adalah suatu massa jaringan abnormal; pertumbuhannya melebihi jaringan yang normal dan pertumbuhan ini tidak ada koordinasi serta berlangsung terus dalam keadaan yang berlebihan walaupun perangsang yang menimbulkan telah dihilangkan. Tumor terdiri dari dua jenis, tumor jinak dan tumor ganas. Menurut Cheville (2006) tumor dapat diklasifisikasikan berdasarkan aktivitas dan asal sel tumor menjadi jinak (benign) dan ganas (malignant).
Kanker (sebutan yang digunakan pada segala kasus tumor ganas
(malignant) merupakan penyakit kronis dan pertumbuhannya telah dimulai sebelum gejala klinis terlihat (Cheville 2006). Penyebab tumor dan kanker sangat beragam. Penyebab pasti dari kanker belum diketahui. Menurut Dalimartha (2003) dan Heffefinger (2006), karsinogen secara umum dapat diartikan sebagai penyebab yang dapat meningkatkan resiko terjadinya kanker, antara lain :
Banyak senyawa kimia yang dapat mempengaruhi timbulnya kanker pada berbagai macam jaringan. Misalnya sisa-sisa industri batubara, ter (jelaga), zat pewarna, zat pengawet, bahan tambahan pada makanan, arsen, kromium, benzene, kloramfenikol, fenilbutason, senyawa nitrosamine, aflatoksin B1, aflatoksin G1, asap rokok dan sitostatika (alkil).
2. Faktor fisika
Faktor fisika yang utama adalah radiasi seperti bom atom dan radioterapi agresif (radiasi sinar pengion). Radiasi sinar ultraviolet yang berasal dari matahari dapat menimbulkan kanker kulit.
3. Virus
Virus berhubungan erat dengan perubahan sel normal menjadi sel kanker. Jenis virus ini disebut virus penyebab kanker atau virus onkogenik.
4. Hormon
Hormon adalah zat yang dihasilkan oleh kelenjar tubuh yang berfungsi mengatur kegiatan alat-alat tubuh. Hormon estrogen juga terbukti memiliki peran pada kasus tumor mammari.
Secara umum, kanker dapat menyerang setiap jaringan tubuh kecuali rambut dan kuku (Wijayakusuma 2005). Menurut Madewell &Theilen (1987), diantara beberapa jenis tumor, tumor mammari merupakan salah satu jenis tumor yang sering terjadi. Tumor mammari merupakan tumor yang umum pada beberapa spesies, yaitu anjing, tikus, mencit dan manusia. Beberapa spesies anjing bahkan sangat sensitif terhadap terjadinya tumor mammari. Hal ini diduga berkaitan dengan regulasi hormon-hormon reproduksi yang memicu terjadinya neoplasma (jaringan baru) pada kelenjar mammari. Menurut Cheville (2006), tumor mammari terjadi karena pengaruh dari tiga faktor, yaitu stimulasi hormonal dari jaringan mammari, paparan karsinogen dari luar (lingkungan), dan keturunan yang rentan terhadap kanker (genetis).
biasanya dilakukan adalah : (1) Pembedahan (Operasi); (2) Penyinaran/radiasi (radioterapi); (3) Obat-obat pembunuh sel kanker / sitostatika (kemoterapi); (4) Obat yang meningkatkan daya tahan tubuh (imunoterapi); (5) Pengobatan dengan hormon dan (6) Tumbuhan obat, simplisia dari binatang dan mineral lainnya. Menurut Stone (2000), terapi yang dapat dilakukan terhadap hewan yang terkena tumor mammari, yaitu terapi operasi dan terapi medis. Terapi operasi yang dapat dilakukan meliputi operasi kelenjar mammari adalah : (1) lumpectomy, (2) simple mastectomy, (3) regional mastecctomy, serta (4) ovariohisterektomi. Terapi medis meliputi kemoterapi, terapi anti estrogen dan menggunakan biologic respons modifiers (levamisole dan bacille Calmette-Guérin/BCG). Penggunaan BCG untuk tumor belum tentu terjamin kesembuhannya. Ihle (2006) melaporkan bahwa operasi ovariohisterektomi sebelum masa estrus pertama dapat menurunkan resiko tumor mammari secara dramatis.
N-metil-n-nitrosourea (MNU)
N-metil-n-nitrosourea (MNU) merupakan salah satu karsinogen kimia yang baik dan efektif untuk digunakan sebagai bahan penginduksi tumor dan model yang sangat baik untuk mammary carcinoma (Osborne et al. 1992; Vegh dan Salamanca 2007). Karsinogenik atau zat yang dapat menimbulkan kanker, merupakan unsur yang dinilai mempengaruhi ketidaknormalan pertumbuhan sel dalam tubuh (Lu 2006).
Penggunaan MNU dalam penginduksian tumor telah dilaporkan memiliki beberapa keuntungan, antara lain kespesifikan terhadap organ yang diinduksi, tumor yang berasal dari duktus terutama yang berkarakteristik
carcinomatous, kemampuan untuk percobaan inisiasi yang baik dan meningkatkan proses terjadinya tumor. Secara umum, MNU menginduksi
(Pazos et al. 1998).
Temu Putih
Temu putih (Curcuma zedoaria (Berg.) Roscoe) adalah tanaman yang banyak ditemukan di Indonesia dan memiliki banyak manfaat. Temu putih umumnya ditanam sebagai tanaman obat, dapat ditemukan tumbuh liar pada tempat-tempat terbuka yang tanahnya lembab. Temu putih banyak ditemukan di Indonesia seperti di Jawa Barat, Jawa Tengah, Sumatera, Ambon, hingga Irian. Juga dibudidayakan di India, Banglades, China, Madagaskar, Filipina dan Malaysia (Dalimartha 2005). Dalam pengobatan China, temu putih populer sebagai e zhu . Tanaman ini telah ditanam pada masa lalu untuk diekstrak rimpangnya dan untuk memproduksi Abir (cairan pencelup yang digunakan pada saat festival Holi) (Ravindran et al. 2007).
Menurut Syukur dan Hernani (2002), jenis tanah yang sesuai untuk lahan budi daya temu putih adalah andosol dan lasotol merah cokelat. Kondisi tanah yang diperlukan untuk pertumbuhan rimpang temu putih adalah tanah yang gembur, subur, mengandung bahan organik yang tinggi dan kondisi drainase yang baik. Pada umumnya daerah pertanaman temu putih berada pada ketinggian 250-1000 meter dari permukaan laut. Walaupun demikian temu putih sangat mudah tumbuh pada berbagai ketinggian.
Klasifikasi temu putih meliputi divisi Spermatophyta, temasuk dalam subdivisi Angiospermae, kelas Monocotylodonae, bangsa Zingiberales, suku Zingiberaceae, marga Curcuma dan spesiesnya Curcuma zedoaria (Berg.) Roscoe (CCRC Farmasi UGM 2008). Sosok tanaman Curcuma zedoaria
(Berg.) Roscoe dapat mencapai tinggi 2 meter. Salah satu ciri khas spesies ini adalah adanya warna ungu di sepanjang ibu tulang daun. Helai daun berwarna hujau muda sampai hijau tua dengan punggung daun berwarna pudar dan berkilat. Panjang dan lebar daun masing-masing berkisar antara 31-75 cm dan 7-20 cm (Syukur dan Hernani 2002).
mucul dari permukaan tanah. Bunga steril berwarna merah muda dan bagian ujung bunga lebih tua dengan tangkai berwarna hijau pada permukaan tanah (Syukur dan Hernani 2002). Mahkota temu putih terdiri dari 3 daun yang berwarna putih kemerahan dengan tinggi rata-rata 4.5 cm (BPPT 2005).
Secara umum, rimpang (rhizoma) terdiri dari dua bagian, yaitu bagian sentral berbentuk seperti buah pir disebut “mother rhizome” serta cabang yang disebut sebagai “finger” (Ravindran et al. 2007). Rimpang induk berbentuk lanset-lonjong, sedangkan rimpang cabang berupa akar menggembung pada bagian ujung membentuk umbi dengan kulit rimpang berwarna putih. Terdapat bulatan-bulatan atau bintil-bintil pada ujung akar yang merupakan cadangan air. Kulit rimpang berwarna putih. Apabila diiris, daging rimpang berwarna putih ke arah kuning muda dan rasanya pahit (Syukur dan Hernani 2002).
Rimpang temu putih merupakan bahan alami yang berkhasiat untuk menghambat laju perkembangbiakan sel kanker. Rimpang ini sekaligus bermanfaat untuk mencegah kerusakan gen salah satu penyebab timbulnya kanker (Syukur dan Hernani 2002). Menurut Sumarny (2006), rimpang temu putih (Curcuma zedoria. Rosc.) secara empiris digunakan untuk mengobati kanker dan biasanya digunakan dalam jangka waktu yang lama. Bentuk rimpang temu putih dapat dilihat pada Gambar 1.
Gambar 1 Rimpang temu putih (Dalimartha 2005).
perubahan morfologi kromosom, menghentikan mitosis, mengganggu sintesis asam nukleat, dan mengganggu daur sel (Goodpasture dan Ariggi 1976). Ekstrak etanol turmeric juga menunjukkan penghambatan fase mitosis pada sel mamalia secara in vitro dengan menghambat pembentukan kromosom (Mills dan Bone 2000). Menurut penelitian Kuo ML, Huang TS, dan Lin JK dari Universitas Nasional Taiwan, kurkumin mengandung antioksidan dan antitumor promoter. Dalam laporannya disebutkan, kurkumin yang digunakan sebagai bumbu dan pewarna makanan itu memiliki zat aktif antioksidan, antiradang, dan antitumor (Wed 2004).
Menurut Syukur dan Hernani (2002), kurkuminoid yang terkandung dalam temu putih meliputi kurkumin, demetoksikurkumin, bisdemetoksikurkumin, dan 1,7-bis (4-hidroksifenil-1,4,6-heptatrien-3-on. Minyak atsiri yang terkandung dalam temu putih terdiri dari turunan guaian (kurkumol, kurkumenol, isokurmenol, prokurmenol, kurkumadiol); turunan germakram (furanodienon, isofuranodienon, zederon, furanodien, foranogermenon) dan kerangka elemen (kurserenon yang identik dengan edoaron, epikurserenon, isofuranogermakren) (BPPT 2005). Di antara zat-zat yang terkandung dalam rimpang temu putih, yang bersifat sebagai antikanker adalah kurkumol dan kurdion (PDPERSI 2006).
Darah
antibodi dan sel darah putih, (6) transpor hormon untuk mengatur metabolisme, dan (7) transpor metabolit.
Menurut Dellman dan Eurell (1998), volume total darah yang bersirkulasi bersifat konstan dan berhubungan dengan berat badan (dalam % atau ml/kg berat badan). Secara umum, volume darah pada hewan besar domestik berkisar antara 8-11% dan pada hewan laboratorium seperti tikus sampai monyet, berkisar antara 6-7% berat badan. Volume darah total yang bersirkulasi dalam tubuh berkisar antara 55-70 ml/kg berat badan (5,5-7% berat badan) (Hawk dan Laery 1995).
Leukosit
Leukosit merupakan unit aktif sistem pertahanan tubuh. Leukosit ini sebagian dibentuk di sumsum tulang. Setelah dibentuk, leukosit diangkut oleh darah menuju ke jaringan tubuh untuk digunakan. Fungsi sel darah putih yaitu untuk pertahanan tubuh yang cepat dan kuat terhadap setiap bahan infeksius yang mungkin ada dengan cara mentransportasikan secara khusus pada daerah yang terinfeksi dan yang sedang mengalami peradangan (Guyton dan Hall 1997). Menurut (Clark 2009) dan (Guyton dan Hall 1997), leukosit melindungi tubuh melalui dua mekanisme yang berbeda yaitu fagositosis yang dilakukan oleh makrofag dan neutrofil dan pembentukan antibodi. Leukosit mempergunakan medium darah sebagai sarana transportasi dari asalnya yaitu dari sumsum tulang dan sebagian terjadi di jaringan limfe ke berbagai jaringan seperti hati, limpa, ginjal, sumsum tulang.
Menurut (Campbell 2004), dalam keadaan normal, darah perifer kelinci mengandung leukosit dengan jumlah berkisar antara 6300-10060 sel /µL. Dikatakan leukositosis apabila jumlah leukosit dalam darah meningkat melebihi kisaran dalam keadaan normal, sedangkan leukopenia apabila leukosit dalam darah menurun di bawah kisaran dalam keadaan normal (Vansteenhouse 2006).
eosinofil dan basofil) dan agranulosit (monosit dan limfosit) (Harvey 2001). Neutrofil, eosinofil dan basofil termasuk ke dalam golongan polimorfonuklear. Limfosit dan monosit termasuk ke dalam golongan mononuklear (Kelly 1984).
Leukosit polimorfonuklear memiliki inti yang padat dan bersegmentasi. Neutrofil, eosinofil dan basofil disebut granulosit karena memiliki granul sitoplasma dalam jumlah banyak. Granul adalah lisosom yang mengandung enzim hidrolitik, agen antibakteri dan komponen lainnya. Sel granulosit memiliki masa hidup 4-8 jam dalam darah yang bersirkulasi setelah dilepaskan dari sumsum tulang dalam keadaan normal dan 4-5 hari berikutnya dalam jaringan (Guyton dan Hall 1997). Leukosit mononuklear juga mengandung granul tetapi dalam jumlah yang lebih sedikit dibandingkan dengan kelompok sel granulosit (Harvey 2001).
Neutrofil
Neutrofil dalam sirkulasi darah merupakan sel matang yang dapat menyerang dan menghancurkan bakteri dan virus (Guyton dan Hall 1997). Neutrofil dilepaskan dari tempat pembentukan, yaitu sumsum tulang, menuju daerah periferal kemudian bertahan hingga 6-14 jam sebelum akhirnya menuju jaringan untuk menghadapi kondisi infeksi (Jackson 2007; Dellman dan Eurell 1998). Persentase neutrofil diperkirakan berkisar antara 40-70% dari jumlah total leukosit. Neutrofil yang telah matang mempunyai bentuk inti satu sampai lima, yang disatukan oleh helai yang tipis sehingga memberikan karakteristik bentuk segmentasi. Neutrofil matang memiliki fungsi yang sangat penting yaitu sebagai pertahanan seluler yang melindungi jaringan tubuh saat menghadapi ancaman peradangan atau invasi bakteri (Kelly 1984).
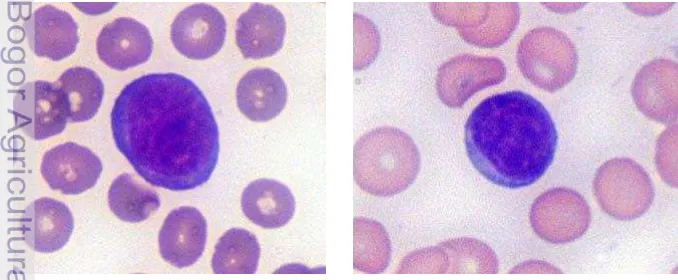
eosinofilik (Campbell 2004). Menurut Thrall (2001), neutrofil kelinci memiliki inti yang berbentuk polimorfik yang akan berwarna biru terang sampai dengan ungu dengan pewarnaan Romanowsky. Sitoplasma neutrofil kelinci memiliki sifat khas yaitu berwarna pink dan menyebar karena gabungan dari granul asidofilik yang berukuran kecil-kecil. Sel darah ini (neutrofil) sering disebut juga sebagai pseudo-eosinofil atau heterofil. Granul sitoplasmik eosinofilik yang berwarna dari pink tua hingga merah dengan pewarnaan Romanowsky. Menurut Dellman dan Eurell (1998), granul sitoplasma pada kelinci, guinea pig, dan ayam berwarna merah dan berukuran besar. Morfologi neutrofil kelinci dapat dilihat pada Gambar 2.
Gambar 2 Neutrofil kelinci (Lester et al. 2005).
Neutrofil yang telah matang ditandai dengan adanya inti yang berlobus-lobus yang dihubungkan oleh filamen dan lebih dikenal dengan nama sel yang bersegmentasi (segmented cells), sedangkan sel neutrofil yang belum matang masih memiliki satu buah lobus yang terlihat seperti pita dan disebut neutrofil muda (band neutrophyl) (Swenson dan Reece 1993). Hanya neutrofil matang yang berada dalam sirkulasi pada kondisi sehat. Sedangkan neutrofil yang belum matang secara normal tidak akan beredar, tetapi mereka dapat beredar saat terjadinya suatu penyakit. Bahan-bahan yang merangsang neutrofil adalah beberapa racun yang dikeluarkan oleh bakteri, produk degeneratif dari jaringan yang mengalami peradangan, beberapa produk
oleh pembekuan plasma dalam area yang meradang (Guyton dan Hall 1997).
Limfosit
Limfosit memiliki peranan penting dalam pertahanan imunobiologis. Limfosit terletak secara tersebar dalam nodus limfe dan jaringan limfoid seperti limfa, daerah submukosa traktus gastrointestinal dan sumsum tulang (Guyton dan Hall 1997). Menurut Harvey (2001), limfosit banyak terletak pada organ limfoid seperti limfonodus, timus, limpa, dan sumsum tulang. Selain aktif sebagai sel pertahanan yang berada di dalam sirkulasi darah, limfosit juga aktif pada beberapa jaringan setelah limfosit tersebut meninggalkan pembuluh darah.
Berdasarkan fungsi dasarnya, limfosit dapat dikategorikan menjadi tiga tipe yaitu sel limfosit B, sel limfosit T, dan natural killer (NK) (Samuelson 2007). Berdasarkan spesies dan variasi individu, sekitar 50-75% merupakan limfosit T, 20-35% merupakan limfosit B. Secara morfologi limfosit dibedakan menjadi dua, yaitu limfosit besar dan kecil (Dellmann dan Brown 1989). Limfosit besar memiliki diameter berkisar antara 10-15µm, sedangkan limfosit kecil 6-9µm (Samuelson 2007). Menurut Campbell (2004), jumlah limfosit pada kelinci yang sehat berkisar antara 3360-7000/µ L. Limfosit merupakan jenis sel leukosit yang paling dominan pada
kelinci (O‟Malley 2005 dan Hrapkiewicz dan Medina 2007). Morfologi limfosit kelinci dapat dilihat pada Gambar 3.
Limfosit kelinci memililki morfologi yang sama dengan limfosit pada spesies lainnya. Limfosit memiliki nukleus berukuran besar, sedikit melengkung, dan memiliki sitoplasma kecil berwarna biru terang. Walaupun limfosit kecil predominan, namun terdapat juga limfosit besar. Limfosit besar memiliki ukuran yang hampir sama dengan neutrofill (Lester et al.
2005).
Monosit
Leukosit mononuklear dapat diklasifikasikan sebagai limfosit dan monosit (Harvey 2001). Monosit merupakan leukosit dengan diameter berkisar antara 15-20 µm, memiliki nukleus besar dengan sitoplasma tanpa granul (Dellmann & Brown 1992). Menurut Campbell (2004), jumlah normal monosit di dalam sirkulasi darah kelinci berkisar antara 50-450/µL. Monosit pada kelinci mirip dengan monosit pada hewan domestik lain. Monosit memiliki satu nukleus, bersifat motil dan fagositik, sitoplasma lebih banyak dibandingkan dengan limfosit, berwarna abu-abu pucat dan memiliki inti berbentuk lonjong seperti ginjal dan tapal kuda (Jain 1993; Swenson & Reece 1993). Menurut Jain (1993), inti sel monosit memiliki sifat amuboid sehingga dapat ditemukan dalam bentuk yang berbeda-beda. Menurut Harvey (2001),sitoplasma berwarna biru-keabuan dan mengandung vakuola dengan berbagai ukuran. Morfologi monosit dapat dilihat pada Gambar 4.
Monosit berkembang menjadi makrofag setelah monosit meninggalkan darah dan memasuki jaringan. Monosit yang bersirkulasi dan makrofag disebut mononuclear phagocyte system (MPS). Monosit dan makrofag memproduksi berbagai zat untuk kepentingan biologis, seperti
colony stimulating factors (CSFs), sitokin (interleukin-1), interleukin-3,
tumor necrosis factor (TNF), pirogen endogen, enzim lisosomal, dan prostaglandin (Dellmann dan Eurell 1998).
Menurut Campbell (2004), monosit memiliki kemampuan untuk menelan dan mendegradasi mikroorganisme, sel yang abnormal dan sel-sel debris. Monosit juga berperan dalam regulasi respon imun dan mielopoiesis. Menurut Guyton dan Hall (1997), monosit bekerja sama dengan neutrofil di jaringan melakukan proses fagositosis untuk mengeliminasi agen infeksi
Basofil
Basofil berasal dari jaringan mieloid yang sama dengan penghasil eosinofil, dan mengikuti jalur perkembangan seperti sel granulosit lainnya (Jackson 2007). Basofil sangat jarang terdapat dalam sirkulasi darah normal, dengan persentase berkisar antara 0-1.5% dari jumlah total leukosit. Ukuran diameter basofil berkisar antara 10-15µm dan memiliki segmentasi atau inti berbentuk heterokromatik iregular (Dellman dan Eurell 1998). Sel basofil memiliki daya fagositik yang sangat rendah atau tidak ada sama sekali (Swenson dan Reece 1993). Morfologi basofil dapat dilihat pada Gambar 5.
Basofil dan sel mast memiliki granul yang serupa, tetapi inti sel basofil mengalami segmentasi, sedangkan inti sel mast berbentuk bulat atau oval (Vansteenhose 2006). Basofil memiliki granula yang homogen, rER
(rough endoplasm reticulum), mitokondria, dan kompleks Golgi (Delmann dan Eurell 1998). Inti basofil akan berubah menjadi ungu gelap dengan pewarnaan Romanowsky dan jumlah granul sangat bervariasi diantara spesies (Jackson 2007).
basofil pada kelinci relatif lebih banyak dibandingkan dengan hewan mamalia lainnya. Basofil pada spesies domestik memiliki granula yang besar, berbentuk bola atau oval, berwarna ungu kemerah-merahan dan granul biasanya akan menutupi inti (Dellmann dan Eurell 1998).
Gambar 5 Basofil Kelinci (Lester et al. 2005).
Basofil memiliki reseptor Ig E yang menyebabkan terjadinya degranulasi melalui proses eksositosis (Dellmann dan Eurell 1998). Saat terjadi peradangan, basofil akan melepaskan histamin dan sedikit bradikinin, serotonin sehingga menyebabkan reaksi jaringan dengan manifestasi alergi (Guyton dan Hall 1997).
Eosinofil
Hrapkiewicz dan Medina 2007). Morfologi eosinofil dapat dilihat pada Gambar 6.
Proses migrasi sel eosinofil ke dalam jaringan dipengaruhi oleh faktor kemotaktik lokal, seperti komplek antigen-antibodi, produk yang dilepaskan oleh sel mast seperti ECF-A (Eosinophil Chemotactic Factor of Anaphylaxis), histamin, interleukin-2, fibrinogen dan komponen yang dilepaskan oleh jaringan rusak (Jain 1993). Persentase eosinofil dalam keadaan normal berkisar antara 2-8% dari seluruh leukosit dalam darah (Guyton dan Hall 1997; Dellman dan Eurell 1998). Jumlah eosinofil dalam darah kelinci berkisar antara 100-150/µ L (Campbell 2004).
Gambar 6 Eosinofil Kelinci (Lester et al. 2005).
Kelinci
Hewan percobaan adalah setiap hewan yang digunakan dalam penelitian- penelitian biologis maupun biomedis. Untuk memperoleh hasil yang relevant dengan tujuan penelitian dan yang mempunyai nilai ulang tinggi, hewan-hewan yang dipergunakan harus memenuhi persyaratan atau standar dasar yang diperlukan sebagai hewan percobaan. Disamping itu, diperlukan juga penguasaan tentang teknik pemeliharaan, pembiakan dan penggunaan hewan dan tentang hewan yang paling cocok untuk penelitian yang bermanfaat dan efektif. Kelinci merupakan hewan yang sering digunakan sebagai hewan percobaan. Kelinci berasal dari Eropa (Smith dan Mangkoewidjojo 1989). Kelinci banyak dikembangbiakkan untuk kepentingan komersial agar dapat diambil daging, kulit, dan bulu. Kelinci juga dipelihara sebagai hewan kesayangan dan digunakan secara ekstensif dalam penelitian biomedis dan product testing (Sirois 2005). Kelinci penelitian dapat dilihat pada Gambar 7.
Gambar 7 Kelinci Penelitian.
Menurut Smith dan Mangkoewidjojo (1998), kelinci percobaan seperti bangsa New Zealand White, California, Dutch Belted dan Lops (telinga amat besar) paling sering dipakai sebagai hewan percobaan. Bobot badan kelinci jantan dewasa berkisar antara 2-5 kg sedangkan kelinci betina dewasa 2-6 kg. Volume darah total kelinci berkisar antara 55-70 ml/kgBB. Dewasa kelamin kelinci, baik jantan maupun betina, dimulai pada umur 22-52 minggu (O‟malley 2005). Umumnya kelinci dapat bertahan hidup selama 5-10 tahun bahkan hingga 12 tahun. Lama kebuntingan berkisar antara 30-31 hari, dengan jumlah kelahiran berkisar antara 4-10 ekor (Smith dan Mangkoewidjojo 1998).
METODOLOGI
Waktu dan Tempat Pelaksanaan
Penelitian ini dilaksanakan di Bagian Bedah dan Radiologi, Departemen Klinik, Reproduksi dan Patologi, Kandang Hewan Percobaaan yang dikelola oleh Unit Pelayanan Teknis Hewan Laboratorium (UPT Helab) Fakultas Kedokteran Hewan Institut Pertanian Bogor, Laboratorium Balai Penelitian Tanaman Tropis (Balitro) dan Laboratorium Lembaga Ilmu Pengetahuan Indonesia. Penelitian ini dilaksanakan dari bulan April 2008 hingga Januari 2009.
Bahan dan Alat
Hewan coba yang digunakan dalam penelitian adalah kelinci betina sebanyak 12 ekor berumur antara 6-9 bulan dan telah mencapai dewasa kelamin. Bahan pakan kelinci berupa pelet yang diberikan dua kali sehari serta air minum ad libitum. Bahan lain adalah induksan tumor yaitu n-metil-n-nitrosourea (MNU) yang dilarutkan dengan NaCl fisiologis, Ekstrak etanol rimpang temu putih, etanol 70% dan propilen glikol, cangkang kapsul ukuran 0, erosil dan SL (Sacharum Lactis).
Bahan yang digunakan untuk analisis darah adalah alkohol 70%, antikoagulan EDTA (Ethylene Diamine Acetic Acid) 10%, larutan Turk, metanol, larutan Giemsa 10%, xylol dan minyak emersi. Sedangkan bahan yang digunakan pada saat operasi adalah alkohol 70%, iodium tincture 3%, ketamin HCl 10%, xylazine 2%, antibiotik penisilin yang telah diencerkan, antibiotik umum (Novamox-G®), NaCl fisiologis, benang cat gut 4/0, benang silk 3/0, tampon, kain kasa dan plester.
Peralatan yang digunakan adalah kandang, tempat pakan dan air minum, maserator berupa tabung untuk menampung simplisia, alkohol 70%, kain katun tebal, plastik pembungkus, kandang jepit, stomach tube, syringe 1 dan 3 ml, jarum no.23, dan vacutainer tube plain (Becton-Dickinson®), hemositometer Neuenbauer, pipet leukosit, selang hisap, cover glass,
stetoskop, mistar, termometer, stopwatch, duk steril, clem, scalpel, needle holder, jarum jahit berpenampang bulat dan segitiga pinset anatomis, pinset sirurgis, gunting bedah (lancip-tumpul, bengkok, dan lancip-lancip) dan tang arteri.
Metode Penelitian
Persiapan dan Pemeliharaan kelinci
Sebanyak 12 ekor kelinci betina dibagi menjadi 4 kelompok, yaitu kelompok 1 (kontrol), kelompok 2 (induksi n-metil-n-nitrosourea (MNU)), kelompok 3 (induksi + operasi), kelompok 4 (induksi + operasi + temu putih). Sebelum perlakuan, kelinci diadaptasikan selama 3 minggu. Kelinci diberi minum dan pakan secara ad libitum. Perlakuan pada masing-masing kelompok diatas dapat dilihat pada Tabel 1 berikut :
Tabel 1 Perlakuan pada masing-masing kelompok kelinci percobaan.
Keterangan : IT = induksi tumor; TP = ekstrak temu putih; OP = operasi
Induksi Tumor
Induksi MNU dilakukan pertama kali pada minggu ke-4. Induksi zat karsinogen dilakukan setiap minggu selama 4 minggu berturut-turut. Sebelum digunakan, MNU sebanyak 1 ml dilarutkan ke dalam 10 ml NaCl
Kelomp ok
Perlakuan Minggu ke
1 2 3 4 5 6 7 8 9 1
2 IT IT IT IT
3 IT IT IT IT OP
4 IT IT IT IT OP+ TP
fisiologis (konsentrasi 100 µg/ml). Kelinci ditimbang terlebih dahulu untuk menentukan dosis MNU yang sesuai. Dosis yang digunakan yaitu 50µg/kg BB, dan dibagi menjadi 2, masing-masing untuk diaplikasikan pada kedua puting. Kelenjar mammari yang diinduksi yaitu kelenjar mammari kuartir kedua. Induksi dilakukan intra mammaria melalui papilla. Induksi ini dilakukan dengan menggunakan syringe yang posisinya tegak lurus dengan sumbu tubuh. Kemudian kelinci kelompok 3 dan 4 dioperasi ovariohisterektomi dan mastektomi pada minggu ke-5 sesudah 4 minggu berturut-turut diinduksi (sesudah tumor tumbuh pada kelenjar mammari).
Pembuatan Ekstrak Rimpang Temu Putih
Pembuatan ekstrak rimpang temu putih meliputi dua proses, yaitu maserasi dan evaporasi. Zat aktif dari simplisia diperoleh dari proses maserasi melalui perendaman menggunakan pelarut. Pelarut yang digunakan adalah etanol dengan perbandingan 1:10 pada tabung maserator. Proses ini dilakukan selama 2x24 jam. Hasil maserasi (maserat) kemudian dipisahkan. Proses selanjutnya adalah evaporasi. Evaporasi adalah suatu proses pemekatan maserat dengan cara menguapkan pelarut tanpa menjadi kering. Ekstrak hanya menjadi kental/pekat sehingga didapatkan ekstrak etanol rimpang temu putih yang kental. Ekstrak etanol dilarutkan terlebih dahulu dengan propilen glikol dengan perbandingan 1:5.
Pemberian Ekstrak Rimpang Temu Putih
Sesudah dilakukan operasi, kelinci kelompok 4 kemudian diberi ekstrak temu putih. Pemberian ekstrak temu putih dilakukan per-oral dengan dosis 250 mg/kg BB. Pemberian temu putih menggunakan stomach tube
Pengambilan Darah
Pengambilan darah dilakukan melalui vena auricularis lateralis. Pengambilan darah dilakukan setiap minggu selama 9 minggu sejak awal diinduksi MNU. Sebelum darah diambil, kulit di sekitar vena dibersihkan dengan menggunakan kapas yang telah dibasahi alkohol 70%. Darah diambil sebanyak 1.5 ml dengan menggunakan antikoagulan EDTA.
Pembuatan Preparat Ulas Darah
Pembuatan preparat ulas darah dilakukan dengan menempelkan gelas obyek pada vena auricularis lateralis. Darah tersebut diulas pada gelas obyek lainnya dan dikeringkan di udara. Kemudian preparat ulas diberi larutan methanol selama 5 menit dan dikeringkan di udara kembali. Selanjutnya preparat ulas dimasukkan ke dalam larutan pewarna Giemsa 10% selama 30 menit. Preparat dibersihkan dengan air yang mengalir kemudian dikeringkan di udara.
Penghitungan Jumlah Total Leukosit
Penghitungan jumlah total leukosit dilakukan menggunakan metode hemositometer. Sampel darah dihisap dengan pipet pengencer hingga batas tera 0.5, kemudian larutan Turk dihisap hingga batas angka 11. Selanjutnya ujung pipet ditutup dengan ibu jari dan pangkal ditutup dengan jari tengah. Pipet kemudian dihomogenkan dengan membentuk angka delapan selama 5-10 menit. Kemudian isi pipet dibuang 2-3 tetes, ujung pipet disentuhkan pada tepi cover glass-hemositometer sehingga larutan mengisi seluruh bagian kamar hitung. Penghitungan dilakukan di bawah mikroskop dengan pembesaran 40x10 pada ruang hitung untuk leukosit (lima kotak). Jumlah sel darah putih yang telah dihitung kemudian dikalikan dengan 50.
Penghitungan Diferensiasi Leukosit
jumlah 100. Hasil yang diperoleh dalam persentase (%), kemudian dilakukan penghitungan untuk mendapatkan nilai absolut untuk masing-masing jenis leukosit.
Operasi
Operasi dilakukan pada minggu ke-5 yaitu setelah tumor tumbuh pada kelenjar mammari kelinci. Operasi yang dilakukan yaitu ovariohisterektomi dan mastektomi. Tahapan operasi yang dilakukan adalah sebagai berikut :
Praoperasi
Kelinci dilakukan pemeriksaan general untuk mengetahui kondisi umum kelinci tersebut yang meliputi temperatur, frekuensi jantung, frekuensi napas dan gizi. Kemudian kelinci ditimbang untuk menentukan dosis anaestetikum yang akan diberikan yaitu xylazine 2% dengan dosis 2 mg/kg BB dan ketamin HCl dengan dosis 35 mg/kg BB secara intra muskular. Tahap yang selanjutnya adalah mencukur kelinci pada bagian abdomen dan sekitar mammae kemudian didesinfeksi dengan menggunakan
alcohol 70% dan iodium tincture 3%.
Kelinci kemudian diletakkan di atas meja operasi dengan posisi enterodorsal dan keempat kakinya diikat. Peralatan bedah juga telah tersedia dalam kondisi steril pada samping meja operasi. Operator beserta asisten I kemudian mempersiapkan diri dengan memakai tutup kepala dan masker. Tangan dicuci pada air yang mengalir dengan menggunakan sabun dan sikat sampai bersih beberapa kali. Pencucian tangan ini dikonsentrasikan pada bagian kuku dan sela-sela jari (Hickman dan Walker 1983) Setelah dikeringkan kemudian operator dibantu asisten I memakai baju operasi dan sarung tangan. Lampu operasi yang memadai harus tersedia pada ruang operasi untuk menunjang operasi.
Ovariohisterektomi
Ovariohisterektomi adalah operasi untuk menghilangkan uterus dan ovarium (Bubenik 2006). Operasi ini dilakukan dengan metode laparotomi medianus untuk menghindari terjadinya banyak perdarahan. Penyayatan dilakukan di posterior umbilikal sepanjang ± 5 cm. Secara berturut-turut mulai dari kulit, aponeuros muskulus, peritoneum, dan omentum dikuakkan untuk mempermudah dibukanya abdomen. Kemudian ditelusuri untuk menemukan ovarium yang terletak pada bagian kaudal dari abdomen. Ovarium diangkat kemudian bagian kranial dan kaudal mesometrium dijepit dengan tang arteri. Apabila di sekitar daerah tersebut terdapat pembuluh darah, maka dilakukan ligasi terlebih dahulu untuk menghindari perdarahan. Lalu jepitan pada mesometrium tersebut masing-masing diikat dengan benang cat gut 4/0 kemudian pada bagian tengahnya dipotong sampai ovarium lepas. Ovarium lainnya dilakukan perlakuan yang sama. Kemudian dari kedua uterus itu ditelusuri hingga menemukan bifurkatio. Setelah itu bifurkatio dijepit secara kuat dengan dua tang arteri kemudian di kaudal tang tersebut masing-masing diikat kuat dengan benang cat gut 4/0. Setelah diikat, pada bagian tengah ikatan tersebut dipotong sehingga uterus dapat terlepas.
Setiap bekas luka baik sayatan maupun potongan diberikan antibiotik
Mastektomi
Mastektomi adalah suatu operasi untuk menghilangkan kelenjar mammari. Sayatan mastektomi berbentuk elips mengelilingi daerah kelenjar mammari yang telah diinduksi tumor. Tumor tersebut diangkat secara perlahan dan teliti. Pembuluh darah sekitar kelenjar mammari diligasi sebelum dipotong. Antibiotik penicillin 50000 IU/ml diberikian pada bekas sayatan. Kemudian kulit dijahit dengan menggunakan benang silk 3/0 dan jarum berpenampang segitiga. Iodium tincture 3% digunakan sebagai antiseptik dan dibubuhkan diatas jahitan kulit tersebut. Luka kemudian ditutup dengan verban dan plester.
Post Operasi
Setelah selesai operasi, kelinci diberi antibiotik umum yaitu Amoxylin (Novamox-G®) secara intramuskular dengan dosis 50 mg/50 kgBB kemudian dirawat di dalam kandang. Selama masa perawatan, kelinci diberi pakan dan minum yang baik. Luka dibalut dengan verban dan diberi
iodium tincture 3% dan diganti setiap hari untuk menjaga kebersihannya. Benang dibuka setelah luka kering yaitu sekitar seminggu setelah operasi.
Variabel yang diamati
Variabel yang diamati adalah jumlah total dan diferensiasi leukosit meliputi neutrofil (heterofil), eosinofil, basofil, monosit dan limfosit.
Analisis Data
HASIL DAN PEMBAHASAN
Haryadi (2008) melaporkan bahwa induksi MNU akan menghasilkan tumor mammari dengan geljala klinis yang terlihat adalah peningkatan diameter mammari. Sifat karsinogen yang dimiliki MNU akan memberikan efek berupa pembentukan tumor. Diameter kelenjar mammari mengalami peningkatan pada minggu kedua, kembali meningkat pada minggu ketiga dan mengalami penurunan pada minggu keempat. Hal ini karena induksi hanya dilakukan sebanyak 3 kali yaitu pada minggu pertama, kedua dan ketiga. Secara umum hasil penelitian yang diperoleh adalah sebagai berikut :
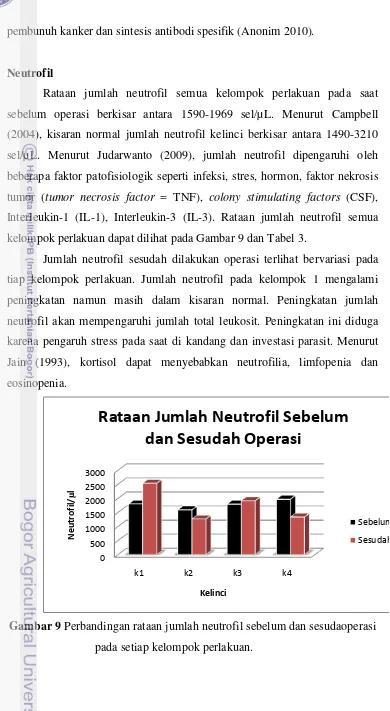
Jumlah Total Leukosit
Rataan jumlah total leukosit dapat dilihat pada Gambar 8 dan Tabel 2. Rataan jumlah total leukosit pada saat sebelum operasi berkisar antara 4871-5542sel/µ L. Menurut Campbell (2004), kisaran normal jumlah total leukosit kelinci berkisar antara 6300-10060 sel/µ L. Menurut Dharma et al.
(2006), jumlah total leukosit didalam sirkulasi dapat dipengaruhi oleh umur dan penyimpangan dari keadaan basal. Peningkatan jumlah total leukosit (leukositosis) dapat terjadi secara fisiologik maupun patologik. Leukositosis fisiologik dijumpai pada kerja fisik yang berat, gangguan emosi, kejang, takhikardi proksimal, partus dan haid. Leukositosis menurut Jain (1993) dibagi menjadi tiga yaitu fisiologi, reaktif dan proliferatif. Leukositosis fisiologis terjadi akibat respon epinefrin, neutrofil dan/atau limfosit dari
“pool” dimobilisasi untuk bersirkulasi yang akhirnya akan meningkatkan jumlah total leukosit. Induksi kortikosteroid atau “stres” leukositosis dapat
Gambar 8 Perbandingan rataan jumlah total leukosit sebelum dan sesudah operasi
pada setiap kelompok perlakuan.
Secara umum terjadi peningkatan jumlah total leukosit pada waktu sesudah operasi pada semua kelompok perlakuan kecuali pada kelompok 3. Peningkatan jumlah total leukosit pada kelompok 1 sebesar 32.76%, namun demikian peningkatan jumlah total leukosit tersebut masih berada dalam batas kisaran normal. Peningkatan ini diduga terkait dengan ditemukannya investasi ektoparasit pada hewan kelompok 1 yaitu Sarcoptes scabiei
Tabel 2 Rataan jumlah total leukosit semua kelompok perlakuan (sel/µL) sebelum dan sesudah operasi.
Kelompok Sebelum Operasi Sesudah Operasi
1* 5542 ± 957 7423 ± 2773
2* 5012 ± 1311 6173 ± 2388
3 5408 ± 1134 5278 ± 2461
4 4871 ± 1156 5103 ± 1316 Keterangan : 1 (kontrol negatif); 2 (kontrol positif); 3 (induksi tumor +
operasi); 4 (induksi tumor + operasi + temu putih). (* menunjukkan kelompok yang tidak dioperasi).
Peningkatan jumlah total leukosit sesudah operasi juga terjadi pada kelompok 2 yaitu sebesar 23.16%, namun demikian masih berada dalam batas kisaran normal. Hal ini diduga pada kelompok 2 tidak dilakukan operasi maupun pemberian ekstrak temu putih. Menurut Degenhardt et al
(2006), tumor menyebabkan apoptosis dan nekrosis serta menimbulkan peradangan. Menurut Aughey dan Frye (2001), peradangan akan memicu terjadinya peningkatan jumlah total leukosit.
pembunuh kanker dan sintesis antibodi spesifik (Anonim 2010).
Neutrofil
Rataan jumlah neutrofil semua kelompok perlakuan pada saat sebelum operasi berkisar antara 1590-1969 sel/µ L. Menurut Campbell (2004), kisaran normal jumlah neutrofil kelinci berkisar antara 1490-3210 sel/µL. Menurut Judarwanto (2009), jumlah neutrofil dipengaruhi oleh beberapa faktor patofisiologik seperti infeksi, stres, hormon, faktor nekrosis tumor (tumor necrosis factor = TNF), colony stimulating factors (CSF), Interleukin-1 (IL-1), Interleukin-3 (IL-3). Rataan jumlah neutrofil semua kelompok perlakuan dapat dilihat pada Gambar 9 dan Tabel 3.
Jumlah neutrofil sesudah dilakukan operasi terlihat bervariasi pada tiap kelompok perlakuan. Jumlah neutrofil pada kelompok 1 mengalami peningkatan namun masih dalam kisaran normal. Peningkatan jumlah neutrofil akan mempengaruhi jumlah total leukosit. Peningkatan ini diduga karena pengaruh stress pada saat di kandang dan investasi parasit. Menurut Jain (1993), kortisol dapat menyebabkan neutrofilia, limfopenia dan eosinopenia.
Jumlah neutrofil sesudah operasi pada kelompok 2 mengalami penurunan sebesar 20.4%. Hal ini diduga neutrofil telah memasuki jaringan akibat induksi MNU sehingga terjadi peradangan. Menurut Meyer et al.
(1992), stres dan peradangan akut akan menyebabkan peningkatan jumlah neutrofil yang bermigrasi ke dalam jaringan sehingga jumlah neutrofil di dalam sirkulasi darah menurun. Jumlah neutrofil kelompok 3 mengalami peningkatan sebesar 6.72%, namun demikian masih dalam kisaran normal. Peningkatan jumlah neutrofil merupakan fenomena fisiologis untuk mempertahankan homeostasis tubuh pada kondisi perlukaan akibat operasi.
Tabel 3 Rataan jumlah neutrofil semua kelompok perlakuan (sel/µL) sebelum dan sesudah operasi.
Keterangan : 1 (kontrol negatif); 2 (kontrol positif); 3 (induksi tumor + operasi); 4 (induksi tumor + operasi + temu putih). (* menunjukkan kelompok yang tidak dioperasi).
Jumlah neutrofil pada kelompok 4 mengalami penurunan sesudah operasi sebesar 32.2%. Hal ini diduga temu putih memiliki efek sebagai antiinflamasi yang mampu menurunkan neutrofil. Pemberian temu putih dapat menurunkan jumlah neutrofil (Gunanti et al. 2004). Temu putih mengandung kurkuminyang dapat merangsang pembentukan glukokortikoid (Anthony dan Kuttan 1999). Mekanisme kerja kurkumin (obat anti radang glukokortikoid) dapat dilihat pada Gambar 10 dibawah ini :
Kelompok Sebelum Operasi Sesudah Operasi
1* 1797.81 ± 192.671 2536.75 ± 774.486
2* 1590.37 ± 860.164 1266.23 ± 683.257
3 1794.04 ± 470.554 1914.63 ± 1160.919
Gambar 10 Mekanisme obat anti radang (Mutschler (1991); Hieschelmann (1991)).
Kurkumin adalah penghambat jalur siklooksigenase dan lipooksigenase (Utami 2009). Glukokortikoid selain dapat menghambat pembebasan asam arakidonat yang mengakibatkan terhambatnya sintesis prostaglandin dan leukotrien, glukokortikoid juga dapat menghambat tumor nekrosis faktor (TNF) dan interleukin-1 (IL-1). IL-1 mempunyai peranan penting pada aksi radang antara lain menstimulasi PGE2 dan kolagenase, mengaktivasi limfosit T, menstimulasi proliferasi fibroblast, kematraktan (menarik) leukosit dan menyebabkan neutrofilia (Haynes 1991).
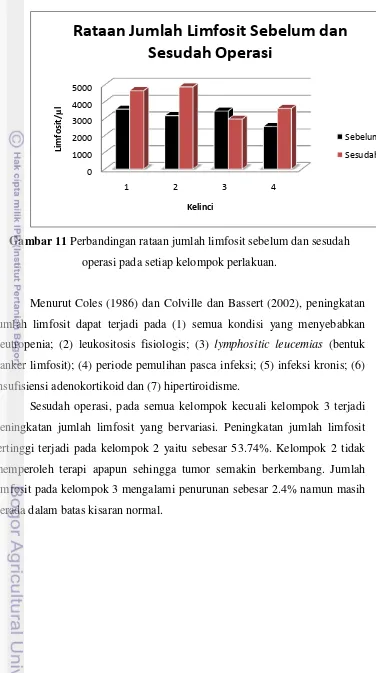
Limfosit
Gambar 11 Perbandingan rataan jumlah limfosit sebelum dan sesudah operasi pada setiap kelompok perlakuan.
Menurut Coles (1986) dan Colville dan Bassert (2002), peningkatan jumlah limfosit dapat terjadi pada (1) semua kondisi yang menyebabkan neutropenia; (2) leukositosis fisiologis; (3) lymphositic leucemias (bentuk kanker limfosit); (4) periode pemulihan pasca infeksi; (5) infeksi kronis; (6) insufisiensi adenokortikoid dan (7) hipertiroidisme.
Tabel 4 Rataan jumlah limfosit semua kelompok perlakuan (sel/µL) sebelum dan sesudah operasi.
Kelompo k
Sebelum Operasi Sesudah Operasi
1* 3543.01 ± 1003.538 4645.08 ± 2044.771
2* 3165.97 ± 990.866 4867.24 ± 1965.444
3 3434.32 ± 918.8 2956.92 ± 1619.558
4 2518.01 ± 823.283 3593.88 ± 1385.342 Keterangan : 1 (kontrol negatif); 2 (kontrol positif); 3 (induksi tumor +
operasi); 4 (induksi tumor + operasi + temu putih). (* menunjukkan kelompok yang tidak dioperasi).
Jumlah limfosit pada kelompok 4 mengalami peningkatan sebesar 42.73%. Menurut Najib (1995), kurkumin bersifat anti neoplastik. Kurkumin dapat merusak pembentukan ribosoma pada sel-sel kanker dan jaringan liar dengan cara meningkatkan pembentukan jaringan fibroblas di sekeliling jaringan kanker, lalu membentuk lapisan limfosit dalam sel-sel jaringan kanker. Jaringan fibroblas dan lapisan limfosit kemudian akan membungkus sel jaringan kanker, sehingga sel-sel jaringan kanker tersebut tidak dapat berkembang dan akhirnya akan mati, serta tidak menimbulkan bahaya lagi. Hal ini dapat disimpulkan bahwa pemberian temu putih dapat meningkatkan jumlah limfosit sehingga dapat meningkatkan pertahanan tubuh.
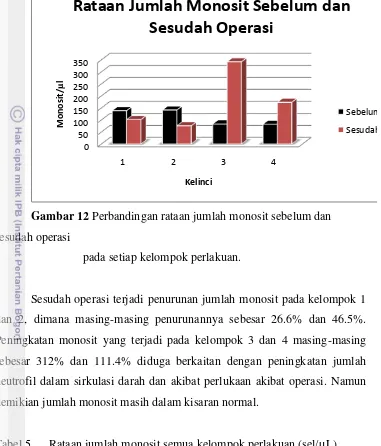
Monosit
Gambar 12 Perbandingan rataan jumlah monosit sebelum dan sesudah operasi
pada setiap kelompok perlakuan.
Sesudah operasi terjadi penurunan jumlah monosit pada kelompok 1 dan 2, dimana masing-masing penurunannya sebesar 26.6% dan 46.5%. Peningkatan monosit yang terjadi pada kelompok 3 dan 4 masing-masing sebesar 312% dan 111.4% diduga berkaitan dengan peningkatan jumlah neutrofil dalam sirkulasi darah dan akibat perlukaan akibat operasi. Namun demikian jumlah monosit masih dalam kisaran normal.
Tabel 5 Rataan jumlah monosit semua kelompok perlakuan (sel/µL) sebelum dan sesudah operasi.
Kelompok Sebelum Operasi Sesudah Operasi
1* 138.19 ± 99.818 101.37 ± 72.757
2* 141.01 ± 83.349 75.455 ± 56.801
3 82.92 ± 35.084 341.64 ± 580.890
4 81.89 ± 32.942 173.127 ± 160.922 Keterangan : 1 (normal); 2 (tumor); 3 (tumor + operasi); 4 (tumor + operasi
Proses fagositosis monosit bekerja sama dengan neutrofil di jaringan untuk mengeliminasi agen infeksi (Guyton dan Hall 1997). Kerja utama neutrofil adalah mengatasi infeksi akut sedangkan monosit bekerja pada keadaan yang kronis (Frandson 1996). Kondisi yang berkaitan dengan meningkatnya aktivitas fagositik dapat menyebabkan monositosis. Peradangan dan gangguan imun dapat terjadi tanpa adanya perubahan jumlah monosit pada peredaran darah perifer (Jackson 2007). Menurut Suparyanto (2009), kejadian monositosis menunjukan fase penyembuhan infeksi.
Basofil
Gambar 13 Perbandingan rataan jumlah basofil sebelum dan sesudahoperasi pada setiap kelompok perlakuan.
Menurut Colville dan Bassert (2002), peningkatan jumlah basofil pada sirkulasi darah dapat dihubungkan dengan adanya kejadian alergi dan hipersensitivitas pada jaringan tubuh. Kadang-kadang basofil dan eosinofil terlihat pada waktu yang bersamaan karena menurut Coles (1986), basofil mempunyai eosinophilic chemotactic factor pada granul sitoplasmanya. Tabel 6 Rataan jumlah basofil semua kelompok perlakuan (sel/µL)
sebelum dan sesudah operasi.
Kelompok Sebelum Operasi Sesudah Operasi
1* 55.42 ± 46.52 27.55 ± 20.24
kecuali pada kelompok 4. Peningkatan basofil pada kelompok 4 sesudah operasi diduga disebabkan oleh adanya reaksi penyembuhan akibat operasi. Namun demikian peningkatan basofil pada kelompok 4 ini masih dalam kisaran normal jumlah basofil kelinci. Menurut Thrall (2001), peningkatan basofil pada kelinci belum tentu menunjukkan adanya kelainan. Kelinci memiliki jumlah basofil yang relatif lebih banyak bila dibandingkan dengan spesies lainnya yaitu 5-30% dari jumlah total leukosit. Menurut Campbell (2004) dalam O‟Malley (2005), kelinci memiliki keunikan dalam hal sirkulasi basofil, yaitu dapat meningkat sampai 30% dari jumlah total leukosit dalam sirkulasi tanpa menunjukkan abnormalitas.
Eosinofil
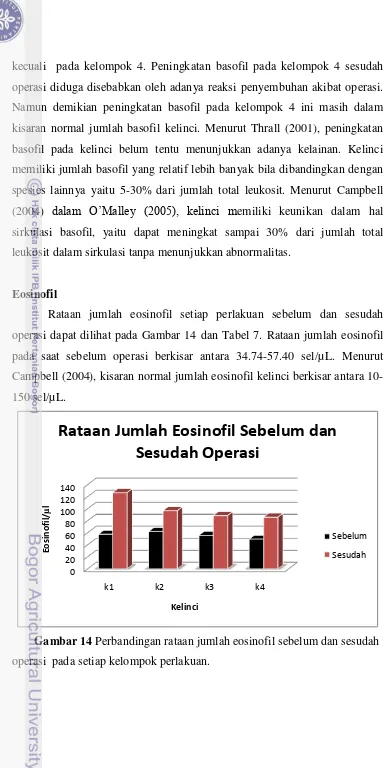
Rataan jumlah eosinofil setiap perlakuan sebelum dan sesudah operasi dapat dilihat pada Gambar 14 dan Tabel 7. Rataan jumlah eosinofil pada saat sebelum operasi berkisar antara 34.74-57.40 sel/µ L. Menurut Campbell (2004), kisaran normal jumlah eosinofil kelinci berkisar antara 10-150 sel/µL.
Rataan jumlah eosinofil sebelum operasi paling tinggi terdapat pada kelompok 1. Namun demikian, jumlah eosinofil masih dalam kisaran normal. Rataan jumlah eosinofil sesudah operasi sangat fluktuatif pada setiap kelompoknya, namun secara umum terjadi peningkatan pada semua kelompok. Kelompok 1 mengalami peningkatan paling tinggi yaitu sebesar 121.01%. Hal ini diduga akibat parasit Sarcoptes Scabiei yang menginfeksi hewan. Jumlah eosinofil sesudah operasi pada kelompok 4 mengalami peningkatan yang relatif lebih besar dibandingkan dengan kelompok 2 dan 3.
Tabel 7 Rataan jumlah eosinofil semua kelompok perlakuan (sel/µL) sebelum dan sesudah operasi.
Kelompok Sebelum Operasi Sesudah Operasi
1* 57.40 ± 23.844 126.56 ± 91.875
2* 61.93 ± 12.433 96.79 ± 53.86
3 55.60± 17.219 88.74 ± 48.059
4 49.26 ± 26.622 85.98 ± 42.164 Keterangan : 1 (kontrol negatif); 2 (kontrol positif); 3 (induksi tumor +
operasi); 4 (induksi tumor + operasi + temu putih). (* menunjukkan kelompok yang tidak dioperasi).
SIMPULAN DAN SARAN Simpulan
Dari hasil penelitian dapat disimpulkan bahwa pengobatan dengan operasi dan pemberian ekstrak temu putih dapat meningkatkan sistem pertahanan tubuh.
Saran
DAFTAR PUSTAKA
[Anonim]. 2006. Pengaruh Stres Akibat Cemas Ujian Semester Terhadap
Jumlah LeukositMahasiswa.
http://www.m3undip.org/ed2/artikel_03_full _text_03 . html. 1Mei 2010
[Anonim]. 2010. Khasiat Kunir Putih (Curcuma Zedoaria) untuk Kesehatan dan Basmi Kanker. http://cintaherbal.wordpress.com / 11 April 2010 [BPPT]. 2005. Tanaman Obat Indonesia : Temu Putih.
http://www.iptek.net.id/ind/pd_tanobat/view.php?id=259 25 April 2009
[CCRC FARMASI UGM]. 2008. Temu Putih (Curcuma zedoaria).
http://ccrcfarmasiugm.wordpress.com/ensiklopedia-tanaman-anti-kanker/t/temu-putih/20 Juli 2009
[Clark]. 2009. Leukocyte Function in Inflammation and Immunity
www.elrinajoubert-huebner.online.de/IFPDF/IF18.pdf
[Dharma R, Immanuel S, Wirawan R]. 2006. Penilaian Hasil Pemeriksaan Hematologi Rutin. Cermin Dunia Kedokteran Volume ke-30. Jakarta: Grup Kalbe Farma. Hlm.28. http://www.kalbe.co.id.htm. 11 April 2010
[Judarwanto]. 2009. Sistem fagosit.
http://childrenallergyclinic.wordpress.com/2009/04/24/sistem-fagosit/ 1 Januari 2010
[PDPERSI]. 2006. Obat Tadisional : Temu Putih.
http://www.pdpersi.co.id/?show=detailnews&kode=865&tbl=alter natif25 April 2009
[Suparyanto]. 2009. Patofisiologi Darah (Pathophysiology of Blood).
http://dr-suparyanto.blogspot.com/2009/12/patofisiologi-darah.html 11 April 2010
Antony S dan Kuttan GA. 1999. Immunomodulatorry activity of curcumin. Veterinary Technicians. Ed ke-6. Missouri : Elsevier Saunders Campbell TW. 2004. Mammalian hematology : Laboratory animals and
miscellaneous species. Di dalam : Mary Anna Thrall, Dale C Baker, Terry W Campbell, Dennis Denicola, Martin J Fettman, E. Duane Lassen, Alan Rebar, Galde Weiser, editor. Veterinary Hematology and Clinical Chemistry. Philadelphia : Lippincott Williams dan Wilkins
Cheville NF. 2006. Introduction to Veterinary Pathology (third edition).
USA-Australia : Blackwell Publishing
Coles EH. 1986. Veterinary Clinical Pathology. Ed ke-4. Philadelphia: WB Saunders Company
Colville dan Bassert. 2002. Clinical Anatomy and physiology for Veterinary Technicians. Missouri : Mosby, An Affiliate of Elsevier
Dalimartha. 2003. Atlas Tumbuhan Obat Indonesia. Jakarta : Puspa Swara Dalimartha. 2005. Tanaman Obat di Lingkungan Sekitar. Jakarta : Puspa Chandreyee Mu, Yufang S, Ce´ l, Ge´ l, Yongjun F, Deirdre A. Nelson, Shengkan J and Eileen W. 2006. Autophagy promotes tumor cell survival and restricts necrosis, inflammation, and tumorigenesis
Feldman, Zinkl dan Jain. 2000. Schalm’s Veterinary hematology 5th edition. Baltimore : Lippincott Williams & Wilkins
Frandson RD. 1996. Anatomi dan Fisiologi Ternak. Edisi ke IV. UGM Press. Hal 935-407
Girindra A. 1988. Biokimia Patologi Hewan. Bogor : PAU IPB
Gunanti, Priosoeryanto BP, Huminto H. 2004. Pendekatan pencegahan penyakit tumor melalui kajian mekanisme invasi dan metastase sel tumor serta efek anti metastase dari interferon rekombinan dan kombinasinya pada hewan [Laporan Hibah Bersaing Perguruan XI]. Bogor : Institut Pertanian Bogor
Goodpasture dan Arrigi. 1976. Effect of food seasoning on the cell cycle and chromosome morphology of mamalian cell in vitro with special reference to turmeric-food.Cosmed Toxicology 14: 9-14 Guyton dan Hall. 1997. Buku ajar Fisiologi Kedokteran. Jakarta : EGC Haryadi JD. 2008. Efek Penghambatan Tumorigenesis Kelenjar Mammari
yang Diinduksi N-Metil-N-Nitrosourea oleh Ekstrak Etanol Rimpang Temu Putih (Curcuma zedoaria (Berg.) Roscoe) Secara Makroskopis pada Kelinci [skripsi]. Fakultas Kedokteran Hewan Institut Pertanian Bogor
Harvey JW. 2001. Atlas of Veterinary Hematology : Blood and Bone Marrow of Domestic Animals. Philadelphia : WB Saunders
Hawk dan Laery. 1995. Formulatory for Laboratory Animal. Ames : Iowa State University
Haynes RC. 1991. Adrenocorticotropic Hormone. Dalam: Goodman and Gilman's The Pharmacological Basis of Therapeutics. Ed 8. Editor: Gilman, A.G. et al. New York: Pergamon Press
Heffelfinger SC. 2006. Breast Cancer. Di dalam : Warshawsky David and Landolph Jr. Joseph R. Molecular Carcinogenesis dan The Molecular Biology of Human. London : Taylor dan Francis Group Hickman J dan Walker. 1983. An Atlas of Veterinary Surgery. Bristol :