PENGHAMBAT NON-ENZIMA
FAK
TAN REAKSI PENCOKLATAN ENZIMATIS ATIS PADA PEMBUATAN TEPUNG KENTA
SKRIPSI
Eka Setyaningsih F24062630
AKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
BOGOR 2010
PENGHAMBATAN REAKSI PENCOKLATAN ENZIMATIS DAN NON-ENZIMATIS PADA PEMBUATAN TEPUNG KENTANG
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas teknologi Pertanian Institut Pertanian Bogor
Oleh Eka Setyaningsih
F24062630
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Judul skripsi : Penghambatan Reaksi Pencoklatan Enzimatis dan Non-enzimatis pada Pembuatan Tepung Kentang
Nama : Eka Setyaningsih
NIM : F24062630
Menyetujui,
Pembimbing I, Pembimbing II,
(Dr. Ir. Nurheni Sri Palupi, M. Si) (Ir. Nanan Nurjannah) NIP. 19610802.198703.2.002 NIP. 19470713.198603.2.001
Mengetahui, Ketua Departemen
(Dr. Ir. Dahrul Syah, M.Sc) NIP. 19650814.199002.1.001
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul Penghambatan Reaksi Pencoklatan Enzimatis dan Non-enzimatis pada Pembuatan Tepung Kentang adalah hasil karya saya sendiri dengan arahan Dosen pembimbing Akademik, dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang telah diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, juli 2010 Yang membuat pernyataan
© Hak cipta milik Eka Setyaningsih, tahun 2010 Hak cipta dilindungi
Dilarang mengutip atau memperbanyak tanpa izin tertulis dari
Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apapun, baik
PREVENTION OF ENZYMATIC AND NON-ENZYMATIC BROWNING REACTION IN POTATOES FLOUR PRODUCTION
Eka Setyaningsih1, Nurheni Sri Palupi1, Nanan Nurjannah2
1
Departement of Food Science and Technology, Bogor Agricultural University, Kampus IPB Darmaga Bogor 16002, Indonesia
2
Balai Besar Litbang Pascapanen Pertanian, Jl. Tentara Pelajar No. 12, Kampus Pertanian, Cimanggu, Bogor, Indonesia
ABSTRACT
Potatoes are a good source of carbohydrate that can improve the nutrient status. In the fresh condition, the potatoes will easily damaged and require further processing. During the milling process, potatoes can undergo browning process, either through enzymatis or non-enzymatis reaction. The aim of this research are (1) determine variety and thickness of potatoes slices and natrium metabisulphite concentrations to prevent browning process and (2) determine the physicochemical caracteristic of selected potatoes flour. Potatoes were used in this research was the Atlantic and Granola potatoes. This research used three treatments i.e. : (1) thickness slices (2, 3, and 4 mm); (2) natrium metabisulphite concentrations (0, 750, 1500, 2250, and 3000 ppm); and (3) blansir process. Potatoes flour from potatoes without blansir and submersion in natrium metabisulphite was used as control. Based on lightness value, index browning, sulfite residue, and organoleptic analysis the potatoes flour selected was originate from Atlantic potatoes with blansir treatment, thickness slices 2 mm, and submersion in natrium metabisulphite 750 ppm. The chemical caracteristics consist of the water, protein, starch, carbohydrate, fat, ash, fyber content and index browning of potatoes flour selected were respectively : 6.86%, 9.91%, 81.34%, 88.07%, 0.79%, 1.22%, 0.67% (dry base/db) and 0.046. The phisycal caracteristics of the potatoes flour such as bulky density and water absorpsion capacity were 725.36g/L and 3.53 g water/g flour, whereas the colour caracteristics value such as lightness (L), greenness (a), and yellowness (b) were respectively : 96.90, -3.24, and 13.37. In addition, the initial temperature gelatinitation and viscocity of the potatoes flour at 930C were 630C and 240 brabender unit (BU) and that viscocity at 930C and 500C after 20 minutes were 330 and 460 BU.
Eka Setyaningsih. F24062630. Penghambatan Reaksi Pencoklatan Enzimatis dan Non-enzimatis pada Pembuatan tepung Kentang. Di bawah bimbingan Dr. Ir. Nurheni Sri Palupi dan Ir. Nanan Nurjannah. 2010.
Ringkasan
Kentang (Solanum tuberosum L.) merupakan tanaman umbi dari suku Solanaceae yang hidup di daerah dataran tinggi. Umbi kentang merupakan sumber karbohidrat, oleh karena itu biasa dimanfaatkan sebagai bahan baku produk pangan maupun dikonsumsi langsung untuk meningkatkan status gizi masyarakat. Dalam bentuk umbi, kentang mudah mengalami penurunan mutu dan mempunyai sifat kamba. Penepungan merupakan salah satu cara untuk mengurangi penyusutan setelah panen, menjaga ketersediaannya sepanjang tahun, dan mengatasi perubahan-perubahan fisiologis dan biokimiawi.
Selama proses penepungan, kentang mengalami reaksi pencoklatan enzimatis dan non-enzimatis yang dapat menurunkan mutu tepung seperti terbentuknya warna kecoklatan, off flavor, dan penurunan nilai gizi. Salah satu cara untuk mencegah proses pencoklatan enzimatis dan non-enzimatis adalah dengan perendaman irisan kentang dalam larutan natrium metabisulfit. Tujuan penelitian ini ada dua, yaitu (1) menentukan varietas dan ketebalan irisan kentang serta konsentrasi natrium metabisulfit yang tepat untuk mencegah reaksi pencoklatan enzimatis dan non-enzimatis pada penepungan kentang dan (2) menentukan karakteristik fisikokimia tepung kentang terpilih.
Kentang yang digunakan untuk penelitian ini adalah kentang varietas Atlantik dan Granola. Penelitian ini menggunakan tiga perlakuan, yaitu : (1) ketebalan irisan kentang (2, 3, dan 4 mm): (2) konsentrasi natrium metabisulfit sebagai inhibitor pencoklatan (0, 750, 1500, 2250, dan 3000 ppm); dan (3) proses blansir. Sebagai kontrol dilakukan penepungan kentang tanpa blansir dan perendaman dalam larutan natrium metabisulfit. Tingkat pencoklatan dilihat dari warna yang diukur menggunakan kromameter, indeks browning, residu sulfit pada tepung dan uji sensori. Parameter lain yang diuji adalah kadar polifenol oksidase pada irisan dan tepung kentang.
Hasil penelitian menunjukkan bahwa semakin tinggi konsentrasi natrium metabisulfit dan semakin tipis irisan kentang, warna tepung semakin cerah, indeks browning semakin rendah, dan kadar polifenol oksidase relatif semakin rendah. Tepung kentang Atlantik memiliki warna lebih putih dari pada kentang Granola. Dari 36 jenis perlakuan didapatkan empat buah tepung kentang perlakuan terpilih, yaitu tepung kentang Atlantik dengan perlakuan ketebalan irisan 2 mm dan perendaman natrium metabisulfit 750 ppm, tepung kentang dengan perlakuan ketebalan irisan 3 mm dan perendaman larutan natrium metabisulfit 1500 ppm dan 2250 ppm, serta tepung kentang dengan perlakuan letebalan irisan 4 mm dan perendaman natrium metabisulfit 3000 ppm.
Keempat sampel tersebut selanjutnya dilakukan uji sensori terhadap warna, tekstur, aroma, dan penerimaan umum menggunakan 30 panelis dengan uji
perendaman natrium metabisulfit 3000 ppm menunjukkan penerimaan warna dan aroma antara kurang suka sampai netral. Penerimaan tekstur terhadap keempat tepung kentang tidak berbeda nyata karena penggunaan ukuran partikel yang sama dan penerimaan umum menunjukkan tingkat kesukaan antara netral hingga suka. Hasil uji ranking menunjukkan bahwa tepung kentang Atlantik dengan perlakuan ketebalan irisan 2 mm dan perendaman dalam larutan natrium metabisulfit 750 ppm merupakan pilihan panelis yang selanjutnya dilakukan analisis sifat fisikokimia.
RIWAYAT HIDUP PENULIS
Penulis bernama lengkap Eka Setyaningsih dan biasa dipanggil Eka, anak pertama dari dua bersaudara. Penulis lahir di Boyolali pada tanggal 19 Juni 1988 dari pasangan Sri Riyadi dan Sutini.
Tahun 2000 penulis menamatkan pendidikan di SD Negeri Kemiri I. Kemudian melanjutkan pendidikannya di SLTP Negeri 2 Mojosongo sampai tahun 2003. Tiga tahun kemudian penulis menamatkan pendidikannya di SMA Negeri I Boyolali. Tahun 2006 penulis melanjutkan pendidikannya di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB. Setelah satu tahun menjalani Tingkat Persiapan Bersama akhirnya pada tahun 2007 penulis diterima di mayor Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian. Selain mayor penulis juga mengambil minor perkembangan anak dari mayor Ilmu Keluarga dan Konsumen, Fakultas Ekologi Manusia.
iii KATA PENGANTAR
Puji syukur alhamdulillah penulis ucapakan kepada Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan tugas akhir ini. Penelitian ini berjudul “Penghambatan Reaksi Pencoklatan Enzimatis dan Non-enzimatis pada Pembuatan tepung Kentang” yang dilaksanakan di Balitbang Pascapanen, Cimanggu, Bogor selama sembilan bulan (Juli 2009-April 2010). Penelitian ini tidak akan berjalan lancar tanpa dukungan dan bantuan dari berbagai pihak. Oleh karena itu, penulis ingin mengucapkan terima kasih kepada :
1. Ibu Dr. Ir. Nurheni Sri Palupi M. Si yang selalu membimbing penulis sejak semester tiga.
2. Ibu Nanan Nurjannah, Ibu Hetty, dan Bapak Tatang yang selalu membimbing selama proses penelitian ini berlangsung.
3. Bapak Dr. Ir. Feri Kusnandar, M. Sc selaku dosen penguji
4. Direktorat Jendral Pendidikan Tinggi (DIKTI) selaku pemberi dana penelitian ini.
5. Ayah, Ibu, Ana adalah bagian terpenting bagi penulis. Mereka yang selalu memberi dukungan dan semangat selama ini agar penulis dapat menyelesaikan tugas akhirnya. Iwan terima kasih atas bantuan selama ini. Kus, Wawan, Fajar, Nanang, dan sepupu penulis lainnya.
6. Bapak Idris, Bapak Tri, dan Ibu Pia yang selalu ada setiap dibutuhkan walau hari libur. Mbak Wiwit, Mbak Hesti, April, Heni, Doni, Ilham, Bintang, dan teman-teman satu laboratorium dan bangsal di balai Pasca Panen.
7. Mas Didik yang selalu meminjamkan motornya dan kebersamaannya selama ini. Terima kasih pula atas segala dukungan semangat dan bantuannya.
8. Meike, Vivi, Nely, Dhedek, Fibry, Wida, Ita, Fifit, Zani, Mrs. Mizue Hara (Almh), Mr. Hara (Alm), Mbak Rosa, dan Goodwillers.
9. Kak Tomi, Kak Andri, Imam, Vita, Nida, Teguh, Eko, Eki, Lely, Furqon dan teman-teman kelembagaan lainnya. Terima
10.Teman-teman ITP 43
Bogor, Juli 2010
iv DAFTAR ISI
Halaman
KATA PENGANTAR ... iii
DAFTAR ISI ... iv
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
BAB I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Tujuan ... 3
BAB II. TINJAUAN PUSTAKA ... 4
A. Kentang ... 4
B. Reaksi Pencoklatan ... 6
C. Tepung Kentang ... 9
D. Antipencoklatan ... 10
1. Asam Karboksilat ... 10
2. Asam Askorbat ... 11
3. Sulfur ... 11
4. Kalsium ... 12
E. Blansir ... 12
BAB III. METODOLOGI PENELITIAN ... 14
A. Bahan dan Alat ... 14
B. Metode Penelitian ... 14
1. Rancangan Penelitian ... 14
2. Metode Analisis ... 15
a. Analisis Fisik ... 15
1). Warna ... 15
2). Densitas Kamba ... 15
3). Suhu Gelatinisasi dan viskositas ... 17
4). Daya serap air ... 18
b. Analisis Kimia ... 18
1). Kadar Air ... 18
2). Kadar Abu ... 18
v
4). Kadar Lemak ... 20
5). Kadar Pati ... 20
6). Kadar Serat Kasat ... 21
7). Kadar Gula Pereduksi ... 21
8). Kadar Polifenol Oksidase ... 22
9). Residu Sulfit ... 23
10). Indeks Browning ... 23
c. Uji Sensori ... 23
3. Rancangan Percobaan ... 24
BAB IV. HASIL DAN PEMBAHASAN ... 25
A. Karekteristik Kimia Umbi Kentang Atlantik dan Granola ... 25
B. Pengaruh Ketebalan Irisan dan Perendaman dalam Larutan Natrium Metabisulfit terhadap Aktivitas Antipencoklatan ... 26
1. Perubahan Kadar Polifenol Oksidase ... 26
1.1. Kentang Segar ... 26
1.2 Tepung Kentang ... 28
2. Nilai Indeks Browning ... 29
3. Hasil Pengukuran Warna Tepung Kentang Atlantik dan Granola (Kromameter) ... 31
4. Kadar Residu Sulfit ... 34
C. Tingkat Penerimaan Panelis terhadap Tepung Kentang Atlantik... 36
D. Karakteristik Fisikokimia Tepung Kantang Atlantik Terpilih ... 39
BAB V. PENUTUP ... 46
A. Kesimpulan ... 46
B. Saran ... 46
DAFTAR PUSTAKA ... 47
vi DAFTAR TABEL
Halaman
Tabel 1. Klasifikasi kentang ... 4
Tabel 2. Jumlah produksi dan luas panen kentang di Indonesia ... 5
Tabel 3. Syarat mutu kentang ... 5
Tabel 4. Komposisi dan nilai gizi umbi kentang per 100 gram ... 6
Tabel 5. Komposisi dan nilai gizi tepung kentang per 100 gram ... 10
Tabel 6. Karakteristik kimia umbi kentang Granola dan Atlantik ... 25
vii DAFTAR GAMBAR
Halaman
Gambar 1. Tahapan reaksi Maillard ... 9
Gambar 2. Rancangan penelitian ... 16
Gambar 3. Grafik amilografi ... 17
Gambar 4. Kadar polifenol oksidase pada irisan kentang Granola dan Atlantik sebelum dikeringkan ... 27
Gambar 5. Kadar polifenol oksidase pada tepung kentang Granola dan Atlantik ... 29
Gambar 6. Nilai indeks browning tepung kentang Granola dan Atlantik ... 30
Gambar 7. Nilai kecerahan (L) tepung kentang Granola dan Atlantik ... 32
Gambar 8. Nilai a (hijau-merah) tepung kentang Granola dan Atlantik ... 33
Gambar 9. Nilai b(biru-kuning) tepung kentang Granola dan Atlantik ... 34
Gambar 10. Kadar residu sulfit (ppm) tepung kentang Granola dan Atlantik ... 35
Gambar 11. Hasil uji sensori rating hedonik warna tepung kentang Atlantik ... 37
Gambar 12. Hasil uji sensori rating hedonik aroma tepung kentang Atlantik ... 38
Gambar 13. Hasil uji sensori rating hedonik penerimaan umum tepung kentang Atlantik ... 38
viii DAFTAR LAMPIRAN
Halaman Lampiran 1. Kadar air tepung kentang Atlantik dan Granola ... 52 Lampiran 2. Kurva standar polifenol oksidase ... 52 Lampiran 3. Kadar polifenol oksidase pada irisan kentang Atlantik dan
Granola ... 53 Lampiran 4. Analisis sidik ragam dan uji lanjut Duncan kadar polifenol
oksidase pada irisan kentang Atlantik dan Granola ... 54 Lampiran 5. Kadar polifenol oksidase pada tepung kentang Atlantik dan
Granola ... 57 Lampiran 6. Analisis sidik ragam dan uji lanjut Duncan kadar polifenol
oksidase pada tepung kentang Atlantik dan Granola ... 58 Lampiran 7. Nilai indek browning tepung kentang Atlantik dan Granola ... 60 Lampiran 8. Analisis sidik ragam dan uji lanjut Duncan indeks browning
pada tepung kentang Atlantik dan Granola ... 61 Lampiran 9. Hasil pengukuran warna tepung kentang Atlantik dan Granola
(Kromameter) ... 64 Lampiran 10. Analisis sidik ragam dan uji lanjut Duncan hasil pengukuran
Warna pada tepung kentang Atlantik dan Granola ... 67 Lampiran 11. Kadar residu sulfit tepung kentang Atlantik dan Granola ... 76 Lampiran 12. Analisis sidik ragam dan uji lanjut Duncan kadar residu sulfit
tepung kentang Atlantik dan Granola ... 77 Lampiran 13. Data tepung kentang perlakuan terpilih berdasarkan nilai indeks
browning, kecerahan (L), dan residu sulfit ... 80 Lampiran 14. Quisioner uji sensori tepung kentang Atlantik ... 81 Lampiran 15. Analisis sidik ragam dan uji lanjut Duncan dan Friedman test
1 BAB I
PENDAHULAUAN
A. LATAR BELAKANG
Kentang (Solanum tuberosum L.) merupakan tanaman umbi yang hidup di daerah dataran tinggi. Umbi kentang merupakan sumber karbohidrat, oleh karena itu sangat prospektif sebagai bahan baku produk pangan yang mampu meningkatkan status gizi masyarakat. Di beberapa negara, kentang digunakan sebagai bahan pangan pokok. Nilai gizi kentang dipengaruhi oleh faktor genetik (varietas), umur panen, dan kondisi lingkungan seperti iklim, tanah, dan cara budidaya (Lister dan Munro 2000).
Produk olahan kentang yang sudah diperdagangkan di pasaran dunia berupa produk setengah jadi, yaitu pati dan tepung serta produk jadi, yaitu kentang dalam kaleng, kentang kering, dan kentang goreng berupa chips atau stick. Di Indonesia, sebagian besar produksi kentang masih diperdagangkan dalam bentuk umbi segar dan banyak dimanfaatkan sebagai campuran dalam sop dan bahan baku aneka
snack. Konsumsi kentang perkapita di Indonesia terus meningkat. Pada tahun 2003 konsumsi kentang sebesar 1.61 Kg/tahun, tahun 2004 menjadi 1.82 Kg/tahun, dan pada tahun 2005 konsumsinya mencapai 1.92 Kg/tahun (Ditjen Hortikultura 2006).
Tepung merupakan salah satu bentuk hasil olahan yang berfungsi untuk mengurangi penyusutan pascapanen, menjaga ketersediaannya sepanjang tahun, dan mengatasi perubahan-perubahan fisiologis dan biokimiawi yang umum terjadi pada umbi kentang segar yang dapat mengakibatkan penurunan mutu. Bentuk tepung dapat mengurangi sifat meruah (kamba) dari bahan baku sehingga akan menurunkan kebutuhan ruang penyimpanan dan transportasi. Selain itu, bentuk tepung akan lebih mudah diolah menjadi berbagai produk pangan dibandingkan dengan bentuk umbi.
2 produk mie. Selain itu, tepung kentang banyak digunakan sebagai pengental dalam sop dan saus (Rahma dan Langkong 2006; Yadav et al. 2007), serta dapat digunakan untuk memperbaiki tekstur mie instan. Hasil penelitian Bhunpinder et al.
2006, menunjukkan bahwa tingkat subsitusi 10% tepung kentang terhadap terigu dalam pembuatan cookies dapat menghasilkan produk yang setara dengan terigu murni. Kulkarni et al. 1996 penggunaan tepung kentang sebanyak 40% dalam pembuatan pangan tradisional Mauritania (paratha) lebih baik dari pada dengan
paratha dari tepung terigu murni. Hasil penelitian Kabira dan Imungi 1991, menunjukkan bahwa tepung kentang dapat mensubtitusi tepung jagung sebanyak 40% dalam pembuatan produk pangan tradisional Kenya (uqali dan uji).
Walaupun pemanfaatan tepung kentang dalam berbagai produk pangan sudah cukup banyak, namun proses pembuatan tepung kentang sampai saat ini masih menemui kendala, yaitu warna tepung yang kurang menarik (kecoklatan). Kondisi ini menyebabkan tingkat penerimaan masyarakat rendah karena mempengaruhi mutu produk pangan yang dihasilkan. Warna coklat yang dihasilkan pada tepung kentang disebabkan oleh reaksi pencoklatan enzimatis dan non-enzimatis (reaksi Maillard) selama proses pengolahan dan penyimpanan (Tamaki et al. 2003). Gula reduksi merupakan prekursor bagi reaksi pencoklatan non-enzimatis. Reaksi pencoklatan ini selain mempengaruhi warna tepung, juga akan menghasilkan flavor
yang kurang baik (off flavor) dan menurunkan nilai gizinya. Oleh karena itu, perlu dikaji metode pembuatan tepung kentang yang dapat menghasilkan warna dan mutu tepung kentang yang baik dan memenuhi persyaratan mutu.
Pencegahan reaksi pencoklatan enzimatis dapat dilakukan dengan beberapa cara antara lain, aplikasi panas, aplikasi SO2 dan sulfit, pencegahan kontak dengan
oksigen, dan aplikasi asam (Apandi 1984). Dalam penelitian kali ini akan digunakan aplikasi panas (blansir) dan perendaman dalam larutan natrium metabisulfit yang merupakan zat antipencoklatan enzimatis dan non-enzimatis.
3 B. TUJUAN
Tujuan penelitian ini adalah sebagai berikut :
1. Menentukan varietas dan ketebalan irisan kentang serta konsentrasi natrium metabisulfit yang tepat untuk pembuatan tepung kentang berdasarkan warna (kromameter), indeks browning, residu sulfit dan uji sensori.
4 BAB II
TINJAUAN PUSTAKA
A. Kentang
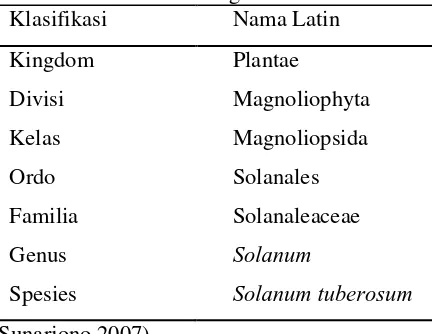
Tanaman kentang (Solanum tuberosum L.) berasal dari daerah Amerika Selatan. Varietas ini baru mengalami pembudidayaan setelah kedatangan bangsa Spanyol ke daerah tersebut, dan diperkenalkan ke Eropa pada abad ke-16. Penyebaran kentang ke Asia termasuk Indonesia dilakukan oleh orang-orang Inggris pada abad ke-17. Klasifikasi kentang dapat dilihat pada Tabel 1.
Tabel 1 Klasifikasi kentang
Kentang merupakan tanaman tahunan yang berasal dari daerah subtropika, berkeping dua (dikotil), berbatang lemah dan bercabang banyak. Perkembangbiakannya secara vegetatif dengan umbi. Daerah yang cocok untuk budidaya kentang adalah dataran tinggi atau pegunungan dengan ketinggian 1,000-1,300 meter di atas permukaan laut dengan kelembaban udara 80-90%, penyinaran matahari cukup dengan waktu penyinaran relatif pendek, rata-rata suhu harian 18-20 oC, curah hujan 1,500 mm per tahun, ditanam pada tanah subur dan bersolum dalam (1-2 m) dengan pH 5.0-7.0 serta memiliki drainase yang baik (Sunarjono 2007). Produksi kentang di Indonesia mengalami peningkatan dari tahun ke tahun seperti pada Tabel 2.
5 varietas kentang dan bentuk ini dipengaruhi oleh cara bertanam, keadaan lingkungan tumbuh, dan penyakit. Bentuk dan ukuran umbi kentang bervariasi dan pada umumnya mempunyai berat sekitar 300 gram (FAO 2008).
Tabel 2 Jumlah produksi dan luas panen kentang di Indonesia
Tahun Luas Panen (Ha) Produksi (Ton) Yield (Ton/Ha)
2000 73,068 977,349 13.4
Terdapat tiga jenis kentang yang biasa ditanam di Indonesia (Soewito 1990). Ketiga jenis kentang tersebut adalah kentang dengan daging buah dan kulitnya berwarna kuning (kentang kuning) contohnya varietas Granola, kentang dengan daging buah dan kulitnya berwana putih (kentang putih) contohnya varietas Atlantik, dan kentang dengan daging buah dan kulitnya berwarna merah (kentang merah).
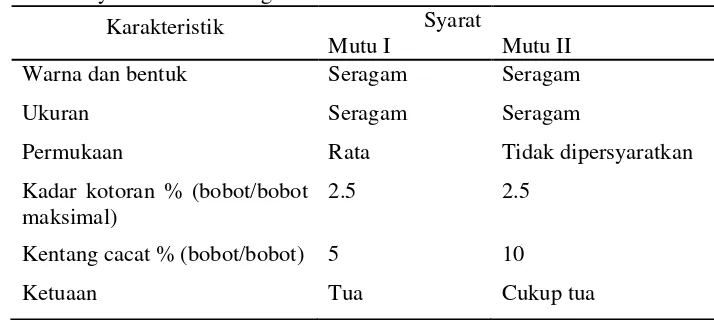
Umbi kentang digolongkan menjadi dua jenis mutu, yakni mutu I dan mutu II yang dapat dilihat pada Tabel 3.
Tabel 3 Syarat mutu kentang
6 Berdasarkan ukurannya, kentang digolongkan menjadi empat, yaitu kentang dengan berat < 50 gram per umbi (kentang kecil), kentang dengan berat 51-100 gram per umbi (kentang sedang), kentang dengan berat 101-300 gram per umbi (kentang besar), dan kentang dengan berat > 301 gram per umbi (kentang sangat besar).
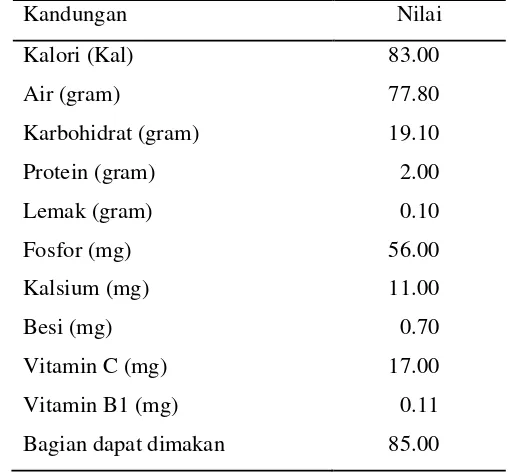
Presentase bagian kentang yang dapat dimakan adalah 85 % (BPS 2006). Komposisi utama umbi kentang adalah air 75-80%, pati 16-20%, dan protein 2.0-2.5% (FAO 2008). Komposisi ini dipengaruhi oleh varietas, keadaan tanah, pupuk, umur umbi ketika dipanen, waktu, dan suhu penyimpanan. Komposisi dan nilai gizi kentang dapat dilhat pada Tabel 4.
Tabel 4 Komposisi dan nilai gizi umbi kentang per 100 gram
Kandungan Nilai
Kalori (Kal) 83.00
Air (gram) 77.80
Karbohidrat (gram) 19.10
Protein (gram) 2.00
Lemak (gram) 0.10
Fosfor (mg) 56.00
Kalsium (mg) 11.00
Besi (mg) 0.70
Vitamin C (mg) 17.00
Vitamin B1 (mg) 0.11
Bagian dapat dimakan 85.00
( Direktorat Gizi Departemen Kesehatan 1979) B. Reaksi Pencoklatan
7 terdiri dari reaksi maillard, reaksi karamelisasi, dan reaksi pencoklatan akibat oksidasi vitamin C (Winarno 1992).
Pencoklatan enzimatis menyebabkan perubahan warna, rasa yang tidak diinginkan dan penurunan nilai gizi bahan pangan (Lamikanra 2002). Reaksi pencoklatan enzimatis terjadi pada buah-buahan dan sayuran jika jaringan buah atau sayuran itu terpotong atau terkelupas. Akibat reaksi ini akan timbul warna coklat karena konversi senyawa fenolat menjadi melanin dengan bantuan enzim polifenol oksidase.
Kontak antara jaringan yang terluka atau terpotong dengan udara akan menyebabkan pencoklatan. Hal tersebut dikarenakan senyawa fenol teroksidasi secara enzimatis menjadi o-kuinon yang secara cepat mengalami polimerisasi membentuk pigmen coklat (melanin). Senyawa fenol bersifat sangat mudah terdekomposisi pada suhu ruangan dan sangat sukar untuk diisolasi
Tingkat reaksi pencoklatan enzimatis semakin tinggi jika konsentrasi fenolik (subtrat polifenol oksidase) pada buah dan sayuran tinggi dan konsentrasi asam askorbat yang rendah (Bauernfeind dan Pinkert 1970). Menurut Winarno (1992), banyak sekali senyawa fenolik yang dapat bertindak sebagai subtrat dalam reaksi pencoklatan enzimatis pada buah dan sayuran. Senyawa-senyawa fenolik tersebut diantaranya adalah katekin dan turunannya, seperti tirosin, asam kafeat, asam klorogenat, dan leukoantosianin.
Pada umumnya reaksi oksidasi fenol dikatalisis oleh enzim kresolase dan katekolase. Kresolase mengkatilisis oksidasi monofenol (tirosin dan kresol) dengan mengubah gugus hidroksil pada posisi ortonya sehingga menjadi orto difenol. Katekolase menghilangkan dua atom hidrogen pada difenol membentuk orto-quinon (Park dan Luh 1985).
8 Faktor-faktor yang mempengaruhi tingkat reaksi pencoklatan enzimatis adalah kandungan komponen fenolik, aktivitas dari enzim polifenol oksidase, oksigen, ion logam, pH, dan suhu (Lisinska dan Leszczynski 1989). Reaksi pencoklatan enzimatis dapat dikontrol oleh inaktivasi enzim polifenol oksidase, pengeluaran oksigen, modifikasi komponen fenolik, penambahan agen pereduksi, interaksi dengan grup tembaga, mereduksi atau menjerat senyawa quinon, bahkan memindahkan produk akhir dari reaksi pencoklatan (Shahidi dan Naczk 1995).
Enzim polifenol oksidase dapat diinaktivasi dengan perlakuan panas dengan suhu 900 C. Metode lain untuk memperlambat reaksi pencoklatan enzimatis adalah dengan menurunkan pH jaringan lebih kecil daripada pH optimum enzim polifenol oksidase yang berkisarantara 4.0-7.0. Asam yang dapat ditambahkan untuk menurunkan pH adalah asam sitrat, malat, askorbat, dan asam fosfat (Shahidi dan Naczk 1995).
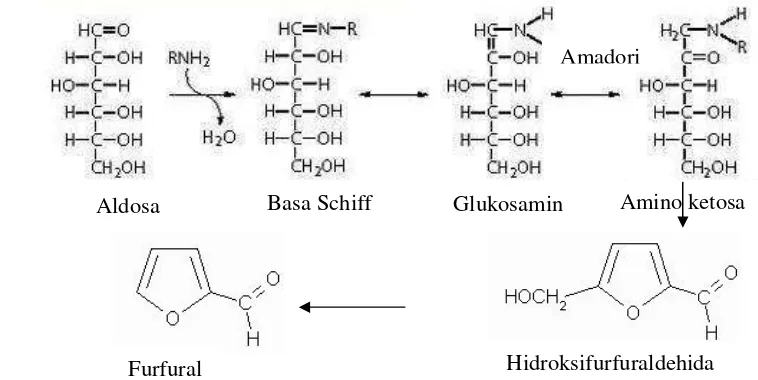
Menurut Eskin (1971) menyatakan bahwa ada 3 teori tentang reaksi pencoklatan non-enzimatis yang terjadi dalam suatu bahan makanan yaitu: karamelisasi, reaksi maillard dan oksidasi vitamin C. Karamelisasi terjadi karena bahan mengalami pemanasan pada suhu tinggi. Reaksi pencoklatan akibat oksidasi vitamin C disebabkan asam askorbat yang dikandung oleh bahan mengalami oksidasi sehingga senyawa tersebut terpecah menghasilkan furfural dan karbondioksida. Pencoklatan Maillard disebabkan terjadinya reaksi senyawa-senyawa karbonil yang berasal dari pemecahan karbohidrat atau lemak dengan senyawa amino dalam bahan. Di dalam tepung kentang sistem pencoklatan yang terjadi adalah pencoklatan yang bersifat non-enzimatis (reaksi Maillard), hal ini disebabkan oleh reaksi senyawa asam amino dengan gula reduksi yang lebih cepat antara aldehid dan keton karena pemanasan di dalam tepung.
9 perubahan komplek sehingga dihasilkan senyawa melanoidin yang merupakan pigmen yang berwarna coklat.
Menurut Winarno (1992), reaksi Maillard berlangsung melalui beberapa tahapan sebagai berikut (Gambar 1):
a) Suatu aldosa bereaksi bolak balik dengan asam amino atau dengan gugus amino dari protein sehingga menjadi amino ketosa.
b) Dehidrasi dari hasil reaksi amadori membentuk turunan-turunan furfuraldehid, misalnya heksosa diperoleh hidroksimetil furfural
c) Proses dehidrasi selanjutnya menghasilkan hasil antara metal L-dikarbonil yang diikuti penguraian menghasilkan reduktor-reduktor dan L-dikarboksil seperti metilglioksal, asetol dan diasetil.
d) Aldehid-aldehid aktif dari 3 dan 4 terpolimerisasi tanpa mengikut sertakan gugus amino (hal ini disebut kondensasi aldol) atau dengan gugusan amino membentuk senyawa berwarna coklat yang disebut melanoidin.
C. Tepung Kentang
Tepung adalah partikel padat yang berbentuk butiran halus atau sangat halus tergantung pemakaiannya. Tepung bisa berasal dari bahan nabati misalnya tepung terigu dari gandum, tapioka dari singkong, maizena dari jagung atau hewani misalnya tepung tulang dan tepung ikan. Tepung biasanya digunakan untuk keperluan penelitian, rumah tangga, dan bahan baku industri.
Aldosa Basa Schiff Glukosamin Amino ketosa
Amadori
Furfural Hidroksifurfuraldehida
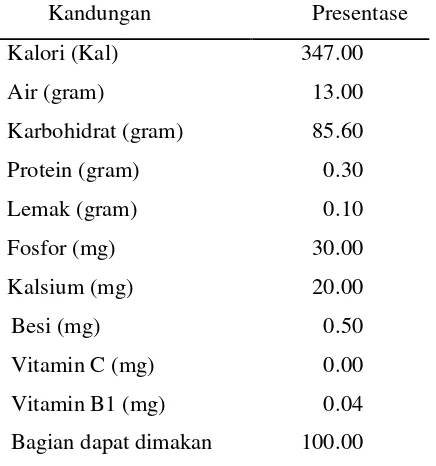
10 Tepung kentang adalah partikel padat yang berbentuk butiran halus atau sangat halus yang terbuat dari kentang. Tepung kentang memiliki kandungan gizi yang cukup tinggi seperti pada Tabel 5.
Tepung kentang biasa dimanfaatkan sebagai pengental, pengikat, pembentuk, bahan anti lengket atau bahan agar-agar. Selain itu, tepung kentang juga digunakan dalam produk-produk jadi seperti kudapan, daging olahan, makanan panggang, mie, makanan hewan piaraan, parutan keju, saus, gravies, kuah daging, dan sup. Penelitian terbaru memanfaatkan tepung kentang untuk penyaringan ragi dan bahan tambahan kosmetik dan farmasi (Kari 2010).
Tabel 5 Komposisi dan nilai gizi tepung kentang per 100 gram
Kandungan Presentase
Kalori (Kal) 347.00
Air (gram) 13.00
Karbohidrat (gram) 85.60
Protein (gram) 0.30
Lemak (gram) 0.10
Fosfor (mg) 30.00
Kalsium (mg) 20.00
Besi (mg) 0.50
Vitamin C (mg) 0.00
Vitamin B1 (mg) 0.04
Bagian dapat dimakan 100.00 ( Direktorat Gizi Departemen Kesehatan 1979)
D. Antipencoklatan
Senyawa antipencoklatan adalah senyawa yang dapat digunakan untuk mencegah pencoklatan. Senyawa tersebut antara lain, asam karboksilat, asam askorbat dan turunannya, sulfur, asam fenolik, dan kalsium (Son et al. 2001).
1. Asam karboksilat
11 dalam Pizzocaro et al. 1993). Terdapat dua belas jenis asam karboksilat yang ditemukan dalam buah dan sayur yang memiliki sifat antipencoklatan. Keduabelas asam tersebut, yaitu asam oksalat, asam oleat, asam tartarat, asam malonat, asam piruvat, asam sitrat, asam malat, asam laktat, asam asetat, asam suksinat, asam fumarat, dan asam format.
Asam sitrat biasa digunakan sebagai zat antipencoklatan secara komersial karena mampu menghambat aktivitas polifenol oksidase (Langdon 1987; Pizzocaro et al. 1993). Asam oksalat dan asam oksalasetat meliki aktivitas antipencoklatan lebih bagus dari pada asam sitrat. Hal ini diaplikasikan dalam irisan apel. Asam oksalat lebih berfungsi dalam bentuk asam bebas atau dalam bentuk garam potasium atau kalsium (Son et al. 2001).
2. Asam askorbat
Asam askorbat mencegah pencoklatan enzimatis dengan mereduksi quinon dari komponen polifenol (Walker 1977). Pada irisan apel, asam askorbat 1% efektif mencegah pencoklatan (Son et al. 2001).
3. Sulfur
Senyawa sulfit sejak lama digunakan sebagai bahan pengawet makanan. Sejarah mencatat bahwa bangsa Mesir kuno dan bangsa Romawi telah menggunakan asap hasil pembakaran belerang untuk sanitasi dalam pembuatan anggur. Penggunaannya berupa asap pembakaran belerang yang mengandung gas belerang dioksida (SO2), yang kemudian akan larut dalam air membentuk
asam sulfit. Sekarang, senyawa-senyawa sulfit yang biasa digunakan berbentuk bubuk kering, misalnya natrium atau kalium sulfit, natrium atau kalium bisulfit dan natrium atau kalium matabisulfit.
Tujuan penggunaan sulfit, yaitu untuk mengawetkan (sebagai senyawa antimikroba) dan untuk mencegah perubahan warna bahan makanan menjadi kecoklatan.
12 mengapa sulfit luas sekali pemakaiannya, misalnya untuk sayuran dan buah-buahan kering dan beku, asinan, manisan, sari buah, konsentrat, pure, sirup, anggur minuman dan bahkan untuk produk-produk daging serta ikan yang dikeringkan.
Gas belerang dioksida dan sulfit dalam tubuh akan dioksidasi menjadi senyawa sulfat yang tidak berbahaya, yang kemudian akan dikeluarkan melalui urin. Mekanisme detoksifikasi ini cukup mampu untuk menangani jumlah sulfit yang termakan. Itulah sebabnya dalam daftar bahan aditif makanan, sulfit digolongkan sebagai senyawa GRAS (generally recognized as safe) yang berarti aman untuk dikonsumsi.
Namun demikian, dosis penggunaannya dibatasi, karena pada konsentrasi lebih besar dari 500 ppm, rasa makanan akan terpengaruhi. Selain itu, pada dosis tinggi sulfit dapat menyebabkan muntah-muntah dan juga senyawa ini dapat menghancurkan vitamin B1(Muchtadi 1984). Oleh karena itu, sulfit tidak boleh digunakan pada bahan makanan yang berfungsi sebagai sumber vitamin B1. Selain itu, sulfit juga dapat asma karena adanya gas belerang oksida.
4. Kalsium
Garam kalsium dapat mencegah reaksi pencoklatan enzimatis. Hal ini dapat terjadi karena adanya reaksi ion kalsium dan asam amino. Garam kalsium yang biasa digunakan adala CaCl2, Ca-laktat, Ca-sitrat dan Ca-hidroksida
(Kusmiadi 2008). E. Blansir
Blansir adalah salah satu proses pemanasan dalam pengolahan bahan pangan. Fungsi blansir adalah untuk inaktivasi enzim, mengurangi jumlah mikroba awal, melembutkan tekstur, mengeluarkan oksigen dari jaringan bahan dan mencerahkan warna. Tujuan proses blansir bergantung pada perlakuan lanjutan terhadap bahan pangan. Contohnya pada produk yang akan dibekukan atau dikeringkan, blansir bertujuan inaktivasi enzim yang dapat merubah warna, citarasa atau nilai gizi yang tidak dikehendaki selama penyimpanan (Buckle et al. 1985).
13 termasuk enzim yang tidak tahan terhadap perlakuan panas sehingga mudah untuk inaktif. Namun, biasanya kecukupan blansir ditentukan oleh inaktifnya enzim katalase. Enzim katalase merupakan enzim yang paling tahan panas. Sehingga apabila enzim ini inaktif maka enzim lainnya dapat dipastikan inaktif (Fellows 2000).
Keefektifan proses blansir tegantung pada tipe bahan pangan, ukuran bahan pangan, suhu blansir, dan metode pemblansiran. Faktor-faktor tersebut saling mempengaruhi satu sama lain. Tipe bahan pangan yang keras, proses blansir yang efektif adalah dengan cara mereduksi ukuran sampai batas tertentu, suhu pemblansiran tinggi, dan menggunakan metode blansir air panas (Fellows 2000).
Pencegahan terjadinya warna coklat pada bahan pangan merupakan hal yang sangat penting karena warna coklat pada bahan pangan dapat menyebabkan penampakan kurang menarik dan menurunkan penerimaan konsumen. Proses blansir selain dapat mencegah terjadinya warna coklat pada bahan pangan, juga dapat menyebabkan bahan menjadi lebih cerah karena terjadi penghilangan udara dan debu pada permukaan bahan yang akan menyebabkan perubahan panjang gelombang cahay yang dipantulkan (Fellows 2000). Namun, proses blansir dapat menghilangkan zat gizi seperti vitamin, karbohidrat, protein, dan mineral. Hal ini dapat terjadi karena selama proses blansir zat gizi tersebut larut dalam air yang digunakan untuk pemblansiran.
14 BAB III
METODOLOGI PENELITIAN
A. Bahan dan Alat
Bahan yang digunakan pada penelitian ini terdiri atas : a) bahan baku berupa umbi dari 2 varietas kentang yaitu Granola dan Atlantik, b) bahan kimia untuk pengolahan tepung yaitu natrium metabisulfit, c) bahan kimia untuk analisis mutu seperti heksana, buffer phosfat, pirogalol, NaOH, H2O2, HCl.
Peralatan yang digunakan terdiri atas : a) peralatan untuk proses seperti : panci, pengiris, pisau, dan pengering, b) alat pembantu antara lain: baskom dan timbangan, c) alat untuk analisis : kromameter, termometer, oven, spektrofotometer, brabender, dan aneka alat gelas.
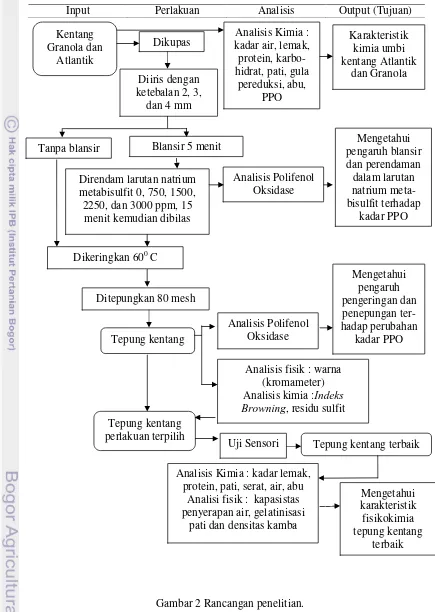
B. Metode Penelitian 1. Rancangan Penelitian
Bahan baku (umbi kentang varietas Granola dan Atlantik) dicuci, dikupas dan kemudian diiris dengan ketebalan 2, 3, dan 4 mm. Irisan umbi kentang selanjutnya langsung dikeringkan dan adapula yang diblansir dengan air panas selama 5 menit dan diberi perlakuan perendaman dalam larutan natrium metabisulfit (750, 1500, 2250, dan 3000 ppm) dan tanpa perendaman larutan natrium metabisulfit. Masing-masing perlakuan terdiri dari 2 kg irisan umbi kentang dan diulang dua kali.
Irisan kentang yang telah diberi perlakuan tersebut selanjutnya dibilas, ditiriskan dan dikeringkan dengan menggunakan alat pengering sampai kadar air ± 10%. Setelah proses pengeringan, irisan kentang tersebut ditepungkan dengan menggunakan mesin penepung tipe pin disc mill dengan kehalusan 80 mesh. Tepung kentang yang dihasilkan selanjutnya dikemas dan disimpan pada tempat yang kering. Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak lengkap faktorial.
15 parameter kimia meliputi indeks browning, polifenol oksidase dan residu sulfit. Hasil pengukuran parameter indeks browning, residu sulfit digunakan untuk menentukan tepung perlakuan terpilih. Tepung hasil perlakuan terpilih kemudian dilakukan uji sensori. Tepung terbaik hasil uji sensori selanjutnya dilakukan pengukuran parameter fisik yang terdiri dari kapasitas penyerapan air, gelatinisasi pati, dan densitas kamba serta parameter kimia yang terdiri dari kadar lemak, protein, pati, serat, air, dan abu. Diagram alir penelitian disajikan pada Gambar 1.
2. Metode Analisis a. Analisis sifat fisik
1) Warna
Pengukuran warna tepung dilakukan dengan kromameter Minolta Model CR-300. Pengukuran warna pada setiap perlakuan dilakukan sebanyak lima kali dengan menggunakan parameter warna L (kecerahan), a (kehijauan-kemerahan), dan b (kebiruan-kekuningan). Sebelum melakukan pengukuran, alat dikalibrasi dengan menggunakan standar putih. Tingkat kecerahan (nilai L) mempunyai nilai dari 0 (hitam) sampai 100 (putih), tingkat kemerahan (nilai a*) nilai positif (+) dari 0 sampai +100 menyatakan warna merah, dari 0 sampai -80 menyatakan warna hijau. Tingkat kekuningan (nilai b*), nilai positif (+) dari 0 sampai +70 menyatakan warna kuning dan nilai negatif (-) dari 0 sampai -70 menyatakan nilai biru (Kusnandar dan Andarwulan 2007).
2) Densitas kamba (Muchtadi 1984)
16
Input Perlakuan Analisis Output (Tujuan)
Kentang
Uji Sensori Tepung kentang terbaik Analisis Kimia : kadar lemak,
protein, pati, serat, air, abu Analisi fisik : kapasistas penyerapan air, gelatinisasi
pati dan densitas kamba
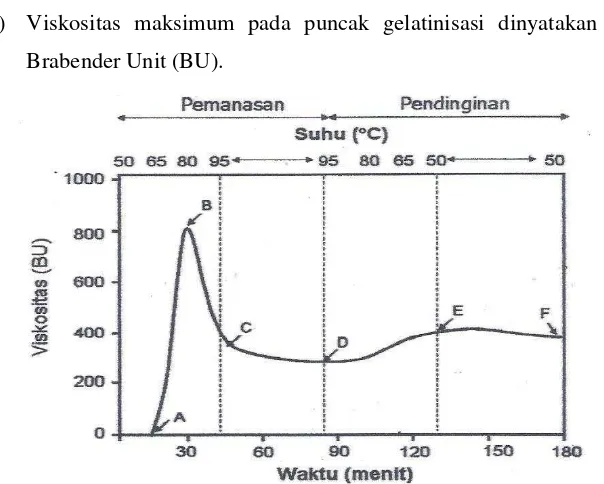
17 3) Suhu gelatinisasi dan viskositas (metode amilografi) (Faridah et al. 2010)
Sampel sebanyak 45 gram dimasukkan ke dalam gelas piala 500 ml kemudian ditambah 400 ml aquades. Kemudian diaduk selama 15 menit kemudian dipindahkan ke dalam mangkuk amilografi yang terpasang pada alat. Gelas piala dan gelas pengaduk dicuci dengan 50 ml aquades, kemudian air dituangkan ke dalam mangkuk amilograf.
Mangkuk amilograf yang berisi sampel diputar pada kecepatan 75 rpm, suhu dinaikkan mulai dari 300C sampai 900C dengan kenaikan suhu 1.50C permenit. Kemudian suhu diturunkan menjadi 500C dengan laju penurunan sama. Perubahan viskositas pasta dicatat secara otomatis pada kertas grafik dalam satuan Brabender Unit (BU).
Grafik yang diperoleh dapat diinterpretasikan menjadi tiga parameter (Gambar 3), yaitu :
1) Suhu awal gelatinisasi : suhu pada saat kurva mulai naik. Suhu awal gelatinisasi = suhu awal + (waktu (menit) х 1.5)
2) Suhu puncak gelatinisasi : suhu pada puncak maksimum viskositas yang dicapai.
Suhu puncak gelatinisasi = suhu awal + (waktu (menit) х 1.5)
3) Viskositas maksimum pada puncak gelatinisasi dinyatakan dalam Brabender Unit (BU).
18 Keterangan : A = awal proses gelatinisasi; B = viskositas maksimum;
C = viskositas pada 95oC; D = viskositas setelah diaduk 95oC, E = viskositas pada 50oC (pendinginan);
F = viskositas setelah diaduk 50oC. 4) Daya serap air (Sathe dan Salunkhe 1981)
Sebanyak satu gram sampel dicampur dengan 10 ml air destilata dan diaduk selama 30 detik. Campuran didiamkan selama 30 menit pada suhu kamar. Selanjutnya campuran tersebut disenrifuse dengan kecepatan 2000 rpm selama 30 menit. Volume supernatan diukur. Daya serap air dinyatakan dalam g/g dan dihitung dengan rumus (1):
Daya serap air = Air yang terserap (g)
berat contoh g ...(1) b. Analisis kimia
1) Kadar Air (AOAC 1995)
Pengukuran kadar air dilakukan dengan menggunakan metode oven. Prinsipnya adalah mengukur jumlah air yang menguap dengan melihat selisih bobot bahan sebelum dan sesudah dikeringkan. Langkah awal pengukuran kadar air dengan mengeringkan cawan alumunium pada suhu 100 0C selama 15 menit, kemudian dikeringkan di dalam desikator selama 10 menit. Cawan alumunium kemudian ditimbang dengan menggunakan neraca analitik (a gram). Sebanyak 2-10 gram (x gram) sampel ditimbang dalam cawan alumunium yang telah diketahui bobot kosongnya. Kemudian dikeringkan dalam desikator dan ditimbang sampai diperoleh bobot konstan.
Kadar air (% wb) =x-(y-a)
x ..... (2.1) Kadar air (% db) =x-(y-a)
y-a ... (2.2) Keterangan: %wb = kadar air per bobot basah
%db = kadar air per bobot kering 2) Kadar Abu (AOAC,1995)
19 500 0C selama satu jam, kemudian dikeringkan dalam desikator. Cawan porselen kemudian ditimbang dengan timbangan analitik (a gram). Sebanyak 2 gram sampel (w gram) ditimbang dalam cawan porselen yang telah diketahui bobot kosongnya. Sampel diarangkan di dalam hot plate
selama 30-60 menit sampai tidak berasap. Kemudian dimasukkan ke dalam tanur bersuhu 600 0C selama 2 jam, lalu didinginkan dalam desikator dan ditimbang (x gram). Kadar abu dihitung dengan rumus (3) :
Kadar abu (%bb) = x-a
w x 100 ... (3) 3) Kadar Protein (Metode Kjeldahl) (AOAC 1995)
Pengukuran kadar protein prinsipnya adalah pemecahan senyawa nitrogen dari komponen protein sehingga bereaksi dengan asam sulfat membentuk amonium sulfat. Amonium sulfat dipecah oleh NaOH menghasilkan gas amoniak. Gas amoniak bereaksi dengan asam borat menghasilkan NH4H2BO3. Kemudian NH4H2BO3 dititrasi dengan asam
klorida beraksi dengan amoniak menghasilkan amonium klorida. Asam klorida yang digunakan untuk titrasi menunjukkan jumlah N yang terukur. Jumlah protein kasar adalah jumlah N terukur dikalikan faktor konversi. Faktor konversi berbeda setiap bahan. Faktor konversi yang biasa dipakai adalah 6.25 yang menunjukkan bahwa senyawa N yang terkandung dalam protein adalah 16%.
Contoh sebanyak 0.10-0.15 gram ditimbang dan dimasukkan ke dalam labu Kjehdall, ditambahkan 1.90 gram campuran K2SO4, 40 mg
HgO, dan 2 ml H2SO4 pekat, kemudian dididihkan dalam hingga larutan
menjadi jernih. Labu didinginkan dan ditambahkan 10 ml NaOH 60%. Destilat ditampung dalam 5 ml asam borat yang telah dicampur dengan lima tetes indikator MB:MM. Destilasi dilakukan selama 15 menit atau sampai volume penampung mencapai 50 ml. Larutan dititrasi dengan HCl 0.02 N. Kadar protein dihitung dengan rumus (4) :
20 4) Kadar Lemak (Metode Hidrolisis) (AOAC 1995)
Kadar lemak diperoleh dari selisih berat antara labu kosong dengan berat labu setelah ekstraksi menunjukkan jumlah lemak dalam bahan. Contoh sebanyak 10 gram ditambahkan air panas sebanyak 45 ml, dan HCL 25% sebanyak 55 ml. Sampel dipanaskan selama 15 menit kemudian disaring dengan menggunakan kertas saring dan dikeringkan dalam oven 105 0C selama 3 jam.
Analisa dilanjutkan dengan metode soxhlet, dimana sampel dimasukkan ke labu soxhlet dan diisi dengan ± 30 ml heksana, lalu direfluks 5-6 jam. Setelah itu dipanaskan pada oven 105 0C selama 30 menit atau sampai dengan pelarut pada labu lemak menguap semua. Labu lemak didinginkan dalam desikator dan ditimbang beratnya. Kadar lemak dihitung dengan rumus (5) :
Kadar lemak (% bb) = x 100 ... (5) Keterangan: a= bobot contoh (g)
b0= bobot kosong labu lemak (g)
b1= bobot labu lemak berisi lemak (g)
5) Kadar pati SNI 01-2892-1992 (BSN 1992)
Sebanyak 0.20 g sampel halus dimasukan ke dalam tabung sentrifuse. Ditambahkan alkohol 80% 20 ml. Campuran dipanaskan dalam
waterbath suhu 100oC selama 15 menit. Campuran didiamkan sampai mengendap, kemudian larutan dituangkan ke dalam pinggan datar. Endapan dalam tabung sentrifuse diuapkan (dikeringkan) di atas
waterbath. Tambahkan aquades 2 ml panaskan lagi selama ± 3 menit. Tambahkan HCLO4 9.20 N 2 ml dan panaskan 15 menit. Kemudian angkat
21 ditambahkan hingga larutan berwarna ungu. Larutan dipanaskan dalam
waterbath ± 10 menit. Larutan dinginkan selama ± 10 menit hingga warna merah bata. Pereaksi Nelson sebanyak 2 ml ditambahkan hingga warna biru tua. Aquades ditambahkan hingga volume menjadi 20 ml. Larutan diukur absorbansinya dengan spektrofotmeter pada pajang gelombang 500 nm. Kadar pati dihitung dengan rumus (6) :
Kadar pati = x 100% ..(6)
6) Kadar serat kasar (metode gavimetri) (AOAC 1995)
Kadar serat kasar merupakan sisa hasil reaksi sampel dengan asam dan basa kuat. Sebanyak 2 gram sampel ditimbang dan diekstraksi lemaknya dengan soxhlet. Bila bahan mengandung lemak yang sangat kecil maka pemisahan lemak dapat diabaikan. Sampel dipindahkan ke dalam labu ekstraksi (500 ml) dengan pendingin tegak. Sampel dididihkan dengan 200 ml H2SO4 1.25% selama 30 menit. Kemudian disaring dengan
corong buchneer yang dihubungkan dengan penyedot vakum dan dicuci dengan air panas. Sampel dipindahkan ke dalam labu ekstraksi 500 ml dan dididihkan dengan 200 ml NaOH 3.25% selama 30 menit. Sampel disaring menggunakan kertas saring yang telah diketahui bobotnya (A). Endapan dicuci dengan H2SO4 1.25%, air panas, dan alkohol 95%. Kertas saring
dan isinya dipindahkan kemudian dimasukkan ke cawan porselin yang telah diketahui bobotnya (B). Sampel dikeringkan dalam oven pada suhu 105oC, didinginkan kemudian ditimbang sampai bobot tetap (C). Kemudian kadar serat kasar dihitung menggunakan rumus(7 :
Kadar serat kasar = C-(B-A)
Berat contoh х 100% ... (7)
7) Kadar gula pereduksi SNI 01-2892-1992, (BSN 1992)
22 putih maka penambahan Pb asetat setengah basa sudah cukup). 15 ml larutan (NH4)2HPO4 10% ditambahkan untuk menguji apakah Pb asetat
setengah basa sudah diendapkan seluruhnya. Apabila timbul endapan berarti penambahan (NH4)2HPO4 10% sudah cukup. Isi labu ukur
ditepatkan sampai tanda tera dengan air suling. Larutan dikocok 12 kali, kemudian disaring. 10 ml larutan hasil penyaringan dipipet dan dimasukkan ke dalam elenmyer 500 ml. 15 ml air suling, larutan Luff dan batu didih ditambahkan. Larutan dipanaskan 10 menit kemudian diangkat dan segera didinginkan dalam bak berisi es. Setelah dingin 10 ml larutan KI 20% dan 25 ml larutan H2SO4 25% ditambahkan. Larutan dititrasi
dengan larutan tioulfat 0.10 N dengan larutan kanji 0.5% sebagai indikator (misalkan dibutuhkan V1). Blanko yang berisi 25 ml air dan 25 larutan Luff dititrasi dengan tiosulfat 0.01 N (misal dibutuhkan V2). Gula reduksi dihitung sebagai berikut : (V2-V1) ml tiosulfat yang dibutuhkan oleh sampel dijadikan ml 0.10 N, kemudian dicari berapa mg glukosa yang tertera untuk ml tio yang digunakan (missal W1 mg). kadar gula pereduksi dihitung dengan rumus (8) :
Kadar gula reduksi (%) = ... (8) Keterangan : W1 = glukosa (mg)
Fp = faktor pengenceran
W = bobot sampel (mg)
8) Kadar Polifenol Oksidase (Lee dan Park 2005)
23 9) Residu Sulfit SNI 01-2894-1992 (BSN 1992)
Sebanyak 10 gram sampel dilarutkan dalam 50 ml aquades, 50 ml metanol, dan 15 ml buffer posphat dalam labu destilasi. Labu destilasi disambungkan dengan alat destilasi. Campuran dipanaskan hingga mendidih. Gas sulfit yang terbentuk ditampung dengan penampung destilasi. Penampung destilasi berisis 10 ml peroksida 2%, 60 ml aquades, indikator, dan NaOH 0.01 N. Sulfit yang terbentuk dititrasi dengan NaOH 0.10 N. Kadar SO2 dihitung dengan rumus (9) :
SO2 (mg/kg) =
b x c x 32 x 1000
a ... (9) Keterangan : a = bobot sampel (g)
b = volume NaOH yang dibutuhkan untuk titrasi (ml) c = normalitas NaOH
10)Indeks Browning (Leeratanarak et al. 2006)
Sebanyak 2 gram sampel dilarutkan dalam 20 ml asam asetat glasisal 2% kemudian disaring dengan kertas Whatman No. 3. Filtrat dicampur dengan dengan aseton dengan volume yang sama kemudian disaring dengan kertas Whatman no. 3. Filtrat kemudian diukur absorbansinya dengan spektrometer pada panjang gelombang 420 nm. Nilai absorbansi 0 menunjukkan warna putih dan 1 menunjukkan warna coklat.
c. Uji Sensori
Uji sensori merupakan pengukuran secara subjektif menggunakan indra manusia. Uji sensori meliputi warna, aroma, tekstur, dan penerimaan umum panelis. Uji sensori dilakukan dengan menggunakan 30 panelis tidak terlatih. Uji sensori menggunakan uji rating hedonik dengan skala 1 (sangat suka) -5 (sangat tidak suka) dan uji ranking hedonik.
24 3. Rancangan Percobaan
Rancangan percobaan digunakan adalah rancangan acak lengkap faktorial dengan dua kali ulangan, dengan model matematik. Rancangan percobaan ini digunakan untuk menentukan perlakuan pengolahan tepung kentang terbaik.
Yijk(n) = ) + Ai + Bj + Ck + (AB)ij + (AC)ik + (BC)jk + (ABC)ijk + Eijk(n)
Keterangan:
Yijk(n) = Respon percobaan karena pengaruh bersama taraf ke-i faktor A, taraf
ke-j faktor B, dan taraf ke-k faktor C ) = nilai tengah umum
Ai = pengaruh varietas pada taraf ke i
A1 = Varietas Granola
A2 = Varietas Atlantik
Bj = pengaruh ketebalan irisan (mm) pada taraf ke-j
B1 = Ketebalan irisan 2 mm
B2 = Ketebalan irisan 3 mm
B3 = Ketebalan irisan 4 mm
Ck = pengaruh konsentrasi natrium metabisulfit [NaHSO3] pada taraf ke-k
C1 = [NaHSO3] 0 ppm
C2 = [NaHSO3] 750 ppm
C3 = [NaHSO3] 1500 ppm
C4 = [NaHSO3] 2250 ppm
C5 =[NaHSO3] 3000 ppm
(AB)ij = pengaruh interaksi taraf ke-i faktor A dan taraf ke-j faktor B
(AC)ik = pengaruh interaksi taraf ke-i faktor A dan taraf ke-k faktor C
(BC)jk = pengaruh interaksi taraf ke-j faktor B dan taraf ke-k faktor C
(ABC)ijk = pengaruh interaksi taraf ke-i faktor A, taraf ke-j faktor B, dan taraf
ke-k faktor C
Eijk(n) = pengaruh kesalahan percobaan pada ulangan ke-n karena pengaruh
25 BAB IV
HASIL DAN PEMBAHASAN
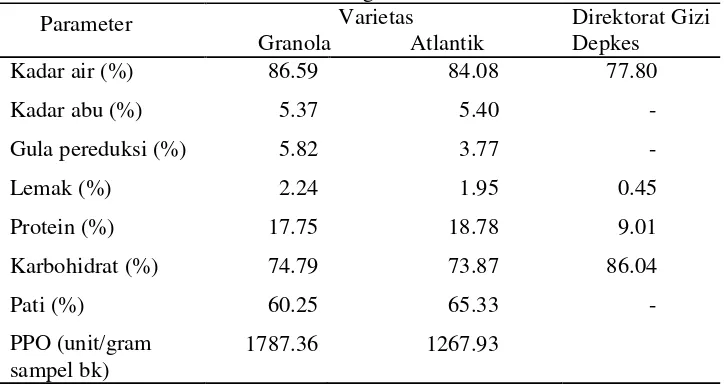
A. Karakteristik Kimia Umbi Kentang Varietas Atlantik dan Granola
Analisis proksimat berguna untuk mengetahui komposisi kimia umbi kentang Atlantik dan Granola segar yang akan mempengaruhi proses pengolahan selanjutnya. Proses pengolahan yang dipengaruhi oleh komposisi kimia umbi antara lain proses pencoklatan dan rendemen. Komposisi kimia umbi kentang Atlantik dan Granola ditunjukkan pada Tabel 6.
Tabel 6 Karakteristik kimia umbi kentang Granola dan Atlantik
Parameter Varietas dari pada umbi kentang Granola tetapi kadar air, kadar abu, gula pereduksi, lemak, dan karbohidrat lebih rendah. Apabila dibandingkan dengan data komposisi kimia umbi kentang dari Direktorat Gizi Departemen Kesehatan kadar air, lemak, dan protein kedua varietas kentang lebih tinggi, sedangkan kadar karbohidratnya lebih rendah. Perbedaan data ini disebakan oleh perbedaan varietas dan kondisi kentang yang dianalisa.
26 mengakibatkan warna tepung kentang Granola lebih kecoklatan dari pada tepung kentang Atlantik.
B. Pengaruh ketebalan irisan dan konsentrasi natrium metabisulfit pada pencegahan pencoklatan tepung kentang
1. Perubahan Kadar polifenol oksidase
Reaksi pencoklatan enzimatik terhadap senyawa fenolik banyak dikatalisis oleh enzim katekol oksigenase (dalam bentuk polifenol oksidase, EC.1.10.3.1). Pada umumnya katekol oksigenase dapat mengkatalisis dua tipe reaksi yakni hidroksilasi (aktifitas kresolase) dan dehidrogenasi (aktifitas katekolase). Tipe reaksi pertama adalah hidroksilasi monofenol menjadi o-difenol. Sedangkan tipe kedua adalah oksidasi o-difenol menjadi kuinon.
Polifenol oksidase pada apel memiliki keaktifan dua kali lebih aktif dengan asam klorogenat dibandingkan dengan katekin. Kedua kelas fenol ini berperan penting pada proses pencoklatan (Janovit-Klapp et al. 1989).
1.1. Kentang Segar
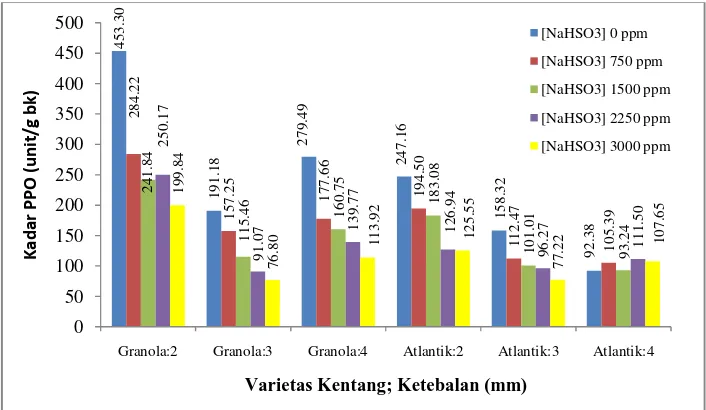
Pengukuran polifenol oksidase pada irisan kentang yang telah diberi perlakuan bertujuan melihat efektivitas blansir dan natrium metabisulfit terhadap kadar polifenol oksidase irisan kentang. Hasil pengukuran kadar polifenol oksidase pada irisan kentang dapat dilihat pada Gambar 4.
27 Gambar 4 Kadar polifenol oksidase pada irisan kentang Granola dan Atlantik
sebelum dikeringkan.
Setelah mengalami perlakuan blansir dan perendaman dalam [NaHSO3]
kadar olifenol oksidase pada irisan kentang Granola mengalami penurunan 74.64%-95.70%. Sedangkan pada kentang Atlantik terjadi penurunan kadar polifenol oksidase sebesar 80.50%-93.91%. Dari prosentase penurunan polifenol oksidase menunjukkan bahwa kentang Atlantik lebih sensitif terhadap perlakuan blansir dan perendaman dalam larutan natrium metabisulfit.
Pada Gambar 4 terlihat bahwa irisan kentang Granola memilik kadar polifenol oksidase yang lebih tinggi dari pada irisan Atlantik. Hal ini disebabkan oleh kadar polifenol oksidase awal kentang Granola lebih tinggi dari pada kentang Atlantik. Masih tingginya kadar polifenol oksidase pada irisan kentang Granola akan menyebabkan warna kecoklatan lebih besar dari pada kentang Atlantik. Sehingga tepung kentang Granola akan memiliki kecerahan (L) yang lebih rendah dari pada tepung kentang Atlantik.
Polifenol oksidase akan mengkatalis reaksi oksidasi fenol menjadi o-quinone yang akan melakukan polimerasi spontan menghasilkan melanin yang berwarna coklat (Marshall et al. 2000). Menurut Winarno (1992), banyak sekali senyawa fenolik yang dapat bertindak sebagai subtrat dalam reaksi pencoklatan enzimatis. Senyawa-senyawa fenolik tersebut diantaranya adalah katekin dan
4
Granola:2 Granola:3 Granola:4 Atlantik:2 Atlantik:3 Atlantik:4
28 turunannya, seperti tirosin, asam kafeat, asam klorogenat, dan leukoantosianin. Klorogenat merupakan senyawak fenolik pada apel (Jeong et al. 2008).
Kadar polifenol oksidase pada irisan kentang dipengaruhi oleh interaksi antara varietas, ketebalan irisan, dan [NaHSO3]. Pada Gambar 4 dapat dilihat
bahwa pada ketebalan 2 mm kadar polifenol oksidase pada kentang Atlantik dan Granola paling tinggi. Hal ini kemungkinan disebabkan oleh luas permukaan pada ketebalan 2 mm yang lebih besar sehingga banyak enzim polifenol oksidase yang terekspos dengan udara sehingga menjadi aktif. Pada ketebalan 3 mm dan 4 mm konsentrasi natrium metabisulfit tidak berpengaruh nyata terhadap kadar polifenol oksidase. Hal ini disebabkan oleh tidak terlukanya jaringan dan luas permukaan bahan yang lebih kecil yang menyebabkan polifenol tidak banyak yang teraktivasi. Semakin tinggi konsentrasi natrium metabisulfit kadar polifenol oksidase pada kentang relatif semakin kecil kecuali pada kentang Atlantik ketebalan irisan 4 mm.
1.2.Tepung Kentang
Masih adanya polifenol oksidase pada irisan kentang setelah diberi perlakuan menunjukkan bahwa proses blansir dan perendaman dalam natrium metabisulfit tidak menginaktifkan seluruh polifenol oksidase. Dampaknya adalah selama proses pengeringan, reaksi pencoklatan enzimatis masih akan terjadi. Inaktivasi polifenol oksidase pada perendaman natrium metabisulfit dipengauhi oleh pH larutan. Menurut Duangmal, (1999) natrium matebisulfit lebih efektif digunakan pada pH 4.6 dari pada pH 6.8 untuk inaktivasi polifenol oksidase. Pada pH rendah (4.6) HSO3- jumlahnya paling banyak. HSO3- adalah
komponen yang dapat merubah struktur polifenol oksidase.
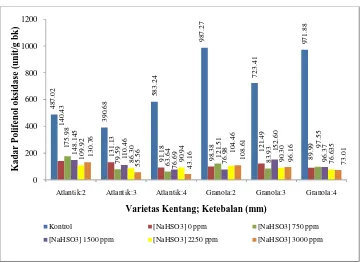
Setelah mengalami pengeringan dan penepungan, kadar polifenol oksidase masih ada tetapi jumlahnya relatif lebih kecil dari pada kadar polifenol oksidase pada irisan kentang. Suhu pengeringan yang berkisar 60oC ternyata tidak mampu menurunkan kadar polifenol oksidase secara signifikan. Kadar polifenol oksidase pada tepung kentang Granola dan Atlantik dapat dilihat pada Gambar 5.
29 pada ketebalan 2 mm dimana kadar polifenol oksidase pada tepumg kentang Atlantik lebih besar dari pada tepung kentang Granola. Pada ketebalan 3 dan mm kadar polifenol oksidase tidak berbeda nyata pada kedua varietas.
Gambar 5 Kadar polifenol oksidase pada tepung kentang Granola dan Atlantik Pada Gambar 5 menunjukkan bahwa perlakuan blansir dapat menurunkan kadar polifenol oksidase pada tepung. Setelah mengalami perlakuan variasi ketebalan dan konsentrasi larutan natrium metabisulfit tidak memberikan pengaruh yang signifikan terhadap kadar polifenol oksidase tetapi semakin tinggi [NaHSO3] dan tebal irisan kentang kadar polifenol oksidase relatif
semakin kecil.
2. Nilai Index Browning
Nilai indeks browning menunjukkan tingkat pencoklatan pada kentang. Semakin tinggi nilai indeks browning menunjukkan bahwa warna tepung semakin coklat. Pencoklatan yang terukur adalah pencoklatan enzimatis dan non-enzimatis. Nilai indeks browning berbanding terbalik dengan nilai kecerahan (L) pada pengukuran dengan kromameter. Nilai indeks browning
tepung kentang Granola dan Atlantik dapat dilihat pada Gambar 6.
4
Atlantik:2 Atlantik:3 Atlantik:4 Granola:2 Granola:3 Granola:4
K
Kontrol [NaHSO3] 0 ppm [NaHSO3] 750 ppm
30 Nilai indeks browning pada tepung kentang dipengaruhi oleh interaksi antara varietas, ketebalan irisan, dan konsentrasi larutan natrium metabisulfit. Pencoklatan enzimatis pada kentang dapat dihambat dengan proses blansir dan perendaman dalam larutan natrium metabisulfit. Blansir dapat menginaktifkan enzim polifenol oksidase, begitu pula larutan natrium metabisulfit. Blansir dapat mempengaruhi laju pengeringan, dan kualitas produk akhir (Senadeera et al. 2000 dalam Leeratanak et al. 2006).
Gambar 6 Nilai index browning tepung kentang Granola dan Atlantik.
Pada tepung kentang kontrol semua varietas dan semua ketebalan memiliki nilai indeks browning paling tinggi kecuali tepung kentang Granola ketebalan 4 mm. Selain itu, pada tepung kentang Atlantik kontrol memiliki nilai indeks browning lebih tinggi dari pada tepung kentang Granola. Kemudian nilai indeks browning menurun dengan perlakuan blansir pada semua varietas dan ketebalan kecuali pada tepung kentang Granola ketebalan 4 mm. Nilai indeks browning
pada tepung kentang Atlantik lebih besar dari pada tepung kentang Granola. Selanjutnya pada ketebalan 4 mm pada kedua varietas nilai indeks browning
relatif semakin kecil. Hal tersebut tidak terjadi pada ketebalan 2 mm dan 3 mm. Penggunaan natrium metabisulfit dalam konsentrasi tinggi (> 1500 ppm) pada
0
Atlantik:2 Atlantik:3 Atlantik:4 Granola:2 Granola:3 Granola:4
31 semua ketebalan dan varietas menunjukkan nilai indeks browning yang tidak berbeda nyata pada taraf signifikansi 5% (Lampiran 7).
Ketebalan 3 mm pada semua varietas menunjukkan nilai indeks browning
yang lebih rendah dari pada ketebalan 2 mm dan 4 mm. Pada ketebalan 3 mm kadar polifenol oksidase tepung kentang juga relatif rendah.
Berdasarkan nilai indeks browning < 0.068 maka tepung kentang terpilih adalah tepung kentang Atlantik ketebalan 2 mm perendaman NaHSO3 750 ppm,
ketebalan 3 mm perendaman NaHSO3 1500 ppm dan 2250 ppm, ketebalan 4 mm
perendaman NaHSO3 3000 ppm. Selain itu, dari varietas Granola dengan
perlakuan ketebalan 2 mm perendaman NaHSO3 750 ppm, 1500 ppm; ketebalan
3 mm perendaman NaHSO3 1500 ppm, 2250 ppm, dan 3000 ppm; ketebalan 4
mm perendaman NaHSO3 3000 ppm. Pemilihantepung kentang ini berdasarkan
uji statistik dengan SPSS 13 yaitu uji anova dan uji lanjut Duncan dengan taraf α 5% (Lampiran 8). Dimana tepung kentang terpilih memiliki nilai indeks browning paling rendah.
3. Hasil Pengukuran Warna Tepung Kentang Atlantik dan Granola (Kromameter) Pengukuran perubahan warna tepung kentang dilakukan menggunakan metode Hunter. Pengukuran warna dilakukan dengan mengukur warna dari banyaknya cahaya yang dipantulkan oleh permukaan (Hutching 1999). Kecerahan tepung kentang Atlantik dan Granola dapat dilihat pada Gambar 7.
Pada Gambar 7 terlihat bahwa tepung kentang kontrol memiliki nilai kecerahan paling rendah. Setelah mengalami perlakuan blansir kecerahan tepung meningkat pada semua varietas pada variasi ketebalan. Pada peningkatan konsentrasi natrium metabisulfit yang digunakan pada semua varietas dan ketebalan menunjukkan peningkatan kecerahan. Hal ini menunjukkan bahwa proses blansir dan perendaman dalam larutan natrium metabisulfit dapat digunakan sebagai perlakuan antipencoklatan.
32 semakin rendah dan nilai indeks browning semakin tinggi. Tetapi hal tersebut tidak berlaku pada tepung kentang yang telah mengalami blansir perendaman dalam larutan natrium metabisulfit. Secara umum kadar polifenol oksidase tepung kentang Atlantik lebih tinggi dari pada tepung kentang Granola, nilai
indeks browning pun juga lebih tinggi tetapi nilai kecerahannya juga lebih tinggi. Nilai kecerahan yang tinggi ini dipengaruhi oleh warna dasar kentang Atlantik yang berwana putih. Selain itu warna kecoklatan yang mempengaruhi kecerahan juga dipengaruhi oleh reaksi pencoklatan non-enzimatis akibat adanya reaksi gula pereduksi dan protein. Gula pereduksi pada kentang Granola lebih banyak dari pada kentang Atlantik.
Gambar 7 Nilai kecerahan (L) tepung kentang Granola dan Atlantik.
Nilai a (hijau-merah) turun drastis dari nonblansir ke perlakuan blansir dan semakin kecil pada tepung dengan perlakuan blansir dan direndam natrium metabisulfit >750 ppm tetapi tidak berbeda nyata pada taraf signifikansi 5% (Lampiran 9). Tepung kentang Granola dengan ketebalan irisan 4 mm memiliki nilai a(-) yang paling besar. Nilai a (-) menunjukkan warna hijau tetapi karena nilainya kecil maka tidak terlihat oleh mata. Pada tepung kentang Granola kontrol nilai a(+) menunjukkan bahwa warna tepung tersebut merah. Warna merah juga menjadi indikasi pencoklatan. Perendaman dalam larutan natrium metabisulfit mempengaruhi warna kripik kentang goreng dimana nilai L (+) dan
8
Atlantik:2 Atlantik:3 Atlantik:4 Granola:2 Granola:3 Granola:4
N
Kontrol [NaHSO3] 0 ppm [NaHSO3] 750 ppm
33 a (-) (Troconso et al. 2009). Nilai a tepung kentang Atlantik dan Granola dapat dilihat pada Gambar 8.
Nilai b (biru-kuning) pada pengukuran tepung kentang bernilai positif. Hal ini menunjukkan bahwa tepung kentang yang dihasilkan berwana kekuningan. Nilai b (biru-kuning) tepung kentang Atlantik dan Granola dapat dilihat pada Gambar 9 Tepung kentang Atlantik memiliki nilai b (biru-kuning) yang lebih kecil dari pada tepung kentang Granola. Apabila dihubungkan dengan nilai kecerahan (L) yang tinggi maka secara deskriptif warna tepung kentang Atlantik adalah kuning cerah dan tepung kentang Granola kuning dengan intensitas yang lebih tinggi.
Gambar 8 Nilai a (hijau-merah) tepung kentang Granola dan Atlantik.
Pada ketebalan irisan 3 mm dan 4 mm nilai b naik secara signifikan pada tepung kentang yang diberi perlakuan blansir dan perendaman dalam natrium metabisulfit. Tetapi pada ketebalan 2 mm nilai biru-kuning (b) pada tepung kontrol dan yang diblansir tidak berbeda nyata dan nilainya rendah. Hal ini menunjukkan bahwa warna kekuningan dari tepung tertutup oleh pencoklatan.
-0
Atlantik:2 Atlantik:3 Atlantik:4 Granola:2 Granola:3 Granola:4
N
Kontrol [NaHSO3] 0 ppm [NaHSO3] 750 ppm
34 Gambar 9 Nilai b (biru-kuning) tepung kentang Granola dan Atlantik.
Berdasarkan warna yang diukur dengan mempertimbangkan nilai L (kecerahan) yang > 96.45 maka tepung kentang terpilih adalah tepung kentang Atlantik dengan ketebalan irisan 2 mm dan perendaman NaHSO3 750 ppm dan
2250 ppm, ketebalan 3 mm dan perendaman NaHSO3 750 ppm, 1500 ppm, 2250
ppm, dan 3000 ppm, serta ketebalan irisan 4 mm perendaman NaHSO3 3000
ppm. Pemilihan perlakuan tersebut berdasarkan uji statistik dengan SPSS 13 yaitu uji anova dan uji lanjut Duncan dengan taraf α 5% (Lampiran 10). Dimana nilai kecerahan (L) tepung kentang perlakuan terpilih adalah > 96.45. Penggunaan parameter kecerahan (L) sebagai dasar pemilihan karena kecerahan (L) menunjukkan tingkat kecerahan dimana apabila nilainya mendekati 100 maka menunjukkan warna yang semakin putih.
4. Kadar Residu Sulfit
Sulfit adalah senyawa yang mampu mencegah reaksi pencoklatan enzimatis dan non-enzimatis sekaligus dapat mengawetkan. Selain itu, sulfit dapat digunakan sebagai antioksidan, bahan pemutih, dan efektif pada konsentrasi rendah (Lauria et al.1998). Dalam daftar bahan aditif makanan, sulfit
1
Atlantik:2 Atlantik:3 Atlantik:4 Granola:2 Granola:3 Granola:4
N
Kontrol [NaHSO3] 0 ppm [NaHSO3] 750 ppm
35 digolongkan sebagai senyawa GRAS (generally recognized as safe) yang berarti aman untuk dikonsumsi.
Gambar 10 Kadar residu sulfit (ppm) tepung kentang Atlantik dan Granola. Semakin tinggi konsentrasi sulfit yang digunakan maka semakin tinggi pula residu sulfit yang terkandung pada tepung kentang. Berdasarkan peratuan Menteri Kesehatan RI tentang bahan tambahan makanan batas residu sulfit pada tepung dihitung sebagai SO2 adalah 500mg/kg (500 ppm). Pada konsentrasi lebih
tinggi dari 500 ppm, sulfit dapat mempengaruhi rasa makanan, menyebabkan muntah, dan menghancurkan vitamin B1 (Muchtadi, 1984). Dari data pada Gambar 10 maka tepung yang tidak memenuhi standar adalah tepung kentang Atlantik adalah perendaman natrium metabisulfit 3000 ppm dan tepung kentang Granola adalah perendaman natrium metabisulfit 2250 ppm dan 3000 ppm.
Kadar residu sulfit dipengaruhi oleh interaksi antara varietas, ketebalan irisan kentang dan [NaHSO3]. Pada ketebalan dan konsentrasi perendaman yang
sama tepung kentang Atlantik memiliki kadar residu sulfit yang lebih rendah dari pada tepung kentang Granola. Perbedaan kadar residu sulfit pada tepung disebabkan oleh perbedaan ukuran kentang. Kentang dengan ukuran kecil pada bobot yang sama jumlahnya lebih banyak sehingga apabila mengalami pengirisan luas permukaannya semakin besar. Pada pengirisan yang semakin
3
Atlantik:2 Atlantik:3 Atlantik:4 Granola:2 Granola:3 Granola:4