PEMBUATAN PADUAN Mg
2Ni DAN MgNi
2DENGAN METODE
MECHANICAL ALLOYING
DAN KARAKTERISASINYA
Oleh :
RATNA PERMATA SARI
G74103020
PROGRAM STUDI FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
RATNA PERMATA SARI. Pembuatan Paduan Mg2Ni dan MgNi2 dengan Metode Mechanical Alloying dan Karakterisasinya. Dibimbing oleh MUHAMMAD NUR INDRO dan ANDON INSANI.
Dalam penelitian ini telah dibuat paduan Mg2Ni dan MgNi2 dengan metode mechanical alloying dengan lima variasi durasi milling, yaitu 0,5, 5, 10, 15 dan 20 jam. Kemudian dilakukan analisa difraksi sinar-X untuk mengidentifikasi fasa - fasa, mengetahui perubahan fraksi volume dan dimensi kristalin dari fasa - fasa yang telah terbentuk pada masing-masing paduan selama proses milling. Selain itu, dilakukan pengamatan morfologi dan pengukuran dimensi partikel. Setelah itu dilakukan perbandingan karakteristik antara paduan Mg2Ni dan MgNi2.
Setelah milling 0,5 jam, hanya terdapat fasa Mg dan Ni. Fasa Mg2Ni dan MgO pada
pembuatan paduan Mg2Ni, demikian pula fasa MgNi2 pada paduan MgNi2 muncul setelah milling
5 jam. Fraksi volume Mg, Ni, MgO dan Mg2Ni yang terbentuk pada pembuatan paduan Mg2Ni
setelah 20 jam secara berturut-turut: 0,17 %, 1,89 %, 56,05 % dan 41,89 %. Sedangkan pada pembuatan paduan MgNi2, fraksi volume Mg, Ni, MgO dan MgNi2 setelah milling 20 jam secara
brturut-turut: 4,32 %, 70,02 %, 12,75 % dan 12,91 %. Setelah milling 20 jam, dimensi kristalin Mg2Ni (6,192 nm) lebih kecil dari pada dimensi kristalin MgNi2 (15,471 nm). Dimensi partikel
paduan Mg2Ni (50 nm) pun lebih kecil dari pada MgNi2 (80 nm) setelah milling 20 jam. Dengan
demikian dapat dikatakan bahwa dimensi kristalin dan dimensi partikel Mg2Ni maupun MgNi2
PEMBUATAN PADUAN Mg
2Ni DAN MgNi
2DENGAN METODE
MECHANICHAL ALLOYING
DAN KARAKTERISASINYA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh :
RATNA PERMATA SARI
G74103020
PROGRAM STUDI FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Pembuatan Paduan Mg
2Ni dan MgNi
2dengan Metode
Mechanical Alloying
dan Karakterisasinya
Nama
: RATNA PERMATA SARI
NRP
: G74103020
Menyetujui :
Pembimbing I Pembimbing II
Drs. Muh. Nur Indro, M. Sc.
Andon Insani, M.Eng.
NIP : 131 663 022
NIP : 330 003 640
Mengetahui :
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Dr.Ir. Yonny Koesmaryono, M.S.
NIP : 131 473 999
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 28 Mei 1986 sebagai anak ke-1 dari 2 bersaudara dari pasangan Rustam Rascani dan Isnawati.
Penulis menyelesaikan pendidikan dasar di SDN Susukan 08 pagi Jakarta Timur pada tahun 1997. Pendidikan menengah pertama berhasil dilalui di SLTPN 174 Jakarta pada tahun 2000, dan pada tahun 2003 berhasil menyelesaikan pendidikan menengah tinggi dengan baik di SMUN 58 Jakarta.
Pada tahun 2003, penulis berhasil diterima di Institut pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) sebagai mahasiswa di Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam.
PRAKATA
Segala puji dan syukur kehadirat Allah SWT atas segala kemurahan dan anugerahNya, Sholawat serta salam kepada junjungan Nabi Besar Muhammad Rasulullah SAW, semoga semangat Beliau tetap membakar semangat perjuangan para penerus generasi Islam hingga akhir zaman.
Setelah mengalami berbagai macam halangan dan cobaan, akhirnya karya sederhana ini dapat terselesaikan. Skripsi ini berjudul Pembuatan Paduan Mg2Ni dan MgNi2 dengan Metode
Mechanical Alloying dan Karakterisasinya.
Karya kecil ini tidak akan dapat terselesaikan tanpa adanya bantuan dari orang-orang yang mendukung penulis selama proses penelitian maupun penulisan. Merupakan suatu kehormatan bagi penulis untuk menghaturkan rasa terima kasih kepada:
1. Bapak Drs. Muh. Nur Indro, M. Sc selaku pembimbing I dalam penelitian ini yang telah bersedia membimbing dan mendengarkan curahan hati penulis.
2. Ibu Andon Insani, M. Eng selaku pembimbing II dalam penelitian ini yang telah membimbing penulis di tengah kesibukkan beliau, memberikan banyak literatur, nasehat, saran dan penginapan selama penelitian.
3. Bapak Dr. Akhiruddin Maddu dan Ibu Mersi Kurniati, M. Si yang telah bersedia menjadi penguji pada seminar dan sidang saya.
4. Seluruh dosen di lingkungan Departemen Fisika IPB yang telah mentransfer ilmu dengan ikhlas dan penuh kesabaran dalam mendidik para mahasiswanya.
5. Seluruh karyawan Departemen Fisika IPB khususnya Bapak Firman atas bantuannya selama ini.
6. Bapak Sulistioso Giat, M.T atas bantuannya mengenai perizinan di BATAN.
7. Bapak Bambang dan Bapak Imam atas bantuannya pada saat karakterisasi difraksi sinar-X serta atas kesediaannya untuk berdiskusi dengan penulis.
8. Ibu Ari atas bantuannya pada saat karakterisasi dengan alat SEM.
9. Para pegawai PTBIN-BATAN atas segala bantuannya, terutama Bapak Andika yang telah meminjamkan komputer untuk penulis.
10. Mama dan Papa tercinta atas segala kasih sayang, perhatian, pendidikan yang telah diberikan dan atas semua pengorbanan, keikhlasan dan kesabaran dalam mendidik keluarga. Semoga semua amal dan ibadah mama dan papa diberi balasan yang setimpal oleh Allah SWT.
11. Adikku, Rian atas kasih sayang dan perhatian yang kamu berikan, kamu adalah adikku satu-satunya.
12. Ibu Tati atas bantuannya selama ini dalam memberikan beasiswa dan semangat. 13. Ibu Tuti Lampung beasiswa yang telah beliau berikan.
14. Uni Ana dan Keluarga Besar Pak Tuo Amran atas bantuan yang telah mereka berikan baik secara moril maupun materil.
15. Kak Arifku tersayang atas segala dukungan, semangat, motifasi, dan keceriaan yang telah diberikan. Semoga Allah SWT memberikan kesabaran kepada kita.
16. Rekan penulis dalam penelitian ini, Neng Nenden Mulyaningsih, atas kerja sama yang baik selama penelitian, walaupun berbeda topik penelitian.
17. Rekan-rekan seperjuangan Fisika angkatan 40: Ulis, Rika, Ijal, Hudar, Opik, Priyo, Gita, Tia, Atik, Ita, Lira, Asih, Dicky, Azis, Mardanih, Alwi, Yulia, Subhi, Kusnadi, Marwan, double Adi, Ziah, Icha, Haristinah, Irma, Awit, Tahyudi, Mada dan Meli, atas kerja samanya.
18. Teman-teman Fisika ’38, ’39, dan ’41 , atas dukungan dan bantuannya kepada penulis. Apabila penulisan ini terdapat kekurangan, penulis mengharapkan kritik dan saran yang membangun untuk memperbaiki kesalan yang terdapat dalam penulisan. Semoga penelitian ini dapat berguna dan membawa manfaat bagi masyarakat pada umumnya dan dapat menambah pengetahuan bagi para ”pencari ilmu”.
Bogor, Maret 2007
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 1
TINJAUAN PUSTAKA ... 1
Hidrida Logam ... 1
Paduan Magnesium Sebagai Penyimpan Hidrogen ... 2
Mechanical Alloying ... 3
XRD (X-Ray Diffraction) ... 4
SEM (Scanning Electron Microscopy) ... 5
BAHAN DAN METODE ... 5
Tempat dan Waktu Penelitian ... 5
Bahan ... 6
Alat ... 6
Pembuatan Paduan Mg2Ni dan MgNi2 ... 6
Karaktrisasi Paduan Mg2Ni dan MgNi2 ... 6
XRD ... 6
SEM ... 6
HASIL DAN PEMBAHASAN ... 7
Analisa XRD ... 7
Identifikasi fasa pada pembuatan paduan Mg2Ni ... 7
Identifikasi fasa pada pembuatan paduan MgNi2 ... 8
Perubahan fraksi volume pada pembuatan paduan Mg2Ni ... 10
Perubahan fraksi volume pada pembuatan paduan MgNi2... 11
Perbahan dimensi kristalin pada pembuatan paduan Mg2Ni ... 12
Perbahan dimensi kristalin pada pembuatan paduan MgNi2 ... 12
Analisa Morfologi dan Dimensi Partikel dengan SEM ... 13
Paduan Mg2Ni ... 13
Paduan Mg2Ni... 15
Pengaruh Dimensi Kristalin, Dimensi Partikel dan Pembentukan MgO apabila Diaplikasi sebagai Paduan Penyimpan Hidrogen ... 16
SIMPULAN DAN SARAN ... 18
Simpulan ... 18
Saran ... 18
DAFTAR PUSTAKA ... 18
DAFTAR TABEL
Halaman
1 Kelompok hidrida yang dapat membentuk paduan antar logam ... 2
2 Posisi atom-atom Mg2Ni ... 3
3 Posisi atom-atom MgNi2 ... 3
4 Rencana perolehan data ... 7
DAFTAR GAMBAR
Halaman 1 Struktur kristal magnesium ... 22 Struktur kristal nikel ... 2
3 Struktur Mg2Ni ... 3
4 Struktur MgNi2 ... 3
5 Serbuk yang terjepit ketika media milling bertumbukan... 4
6 Lima tahap dari mechanical alloying yang dideskripsikan oleh Benjamin dan Volin ... 4
7 Proses terjadinya difraksi oleh kisi kristal ... 4
8 Proses pemencaran elektron ... 5
9 Skema penelitian ... 6
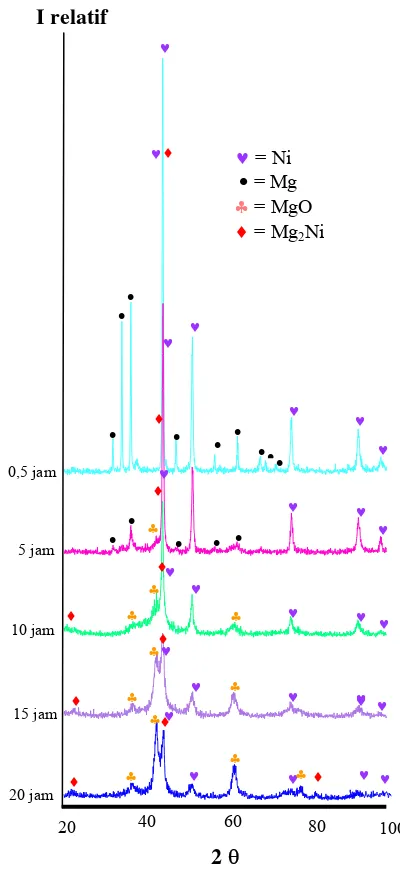
10 Pola difraksi sinar-X pada pembuatan paduan Mg2Ni ... 7
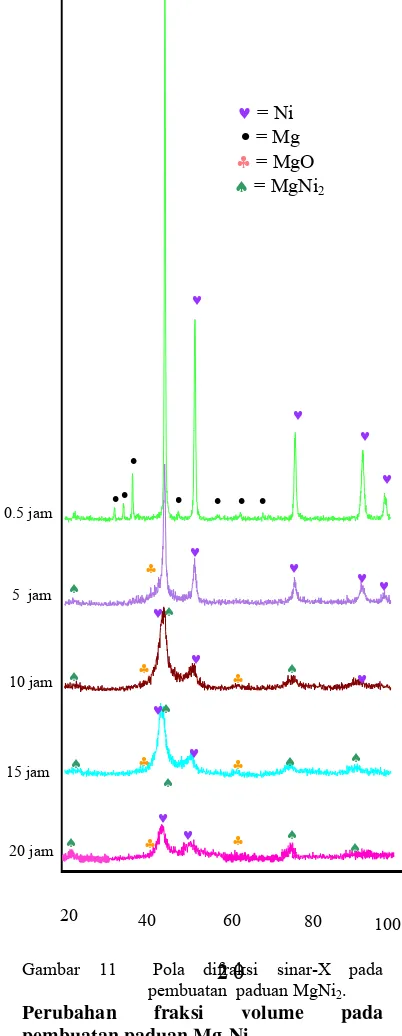
11 Pola difraksi sinar-X pada pembuatan paduan MgNi2 ... 9
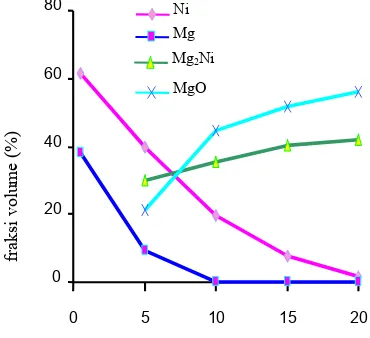
12 Perubahan fraksi volume pada pembuatan paduan Mg2Ni ... 10
13 Perubahan fraksi volume pada pembuatan paduan MgNi2 ... 11
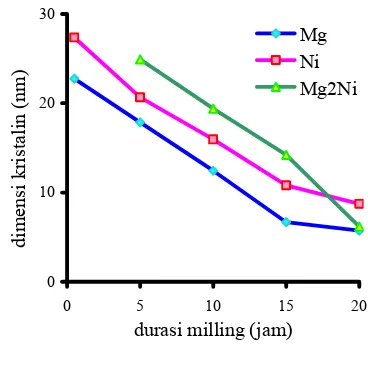
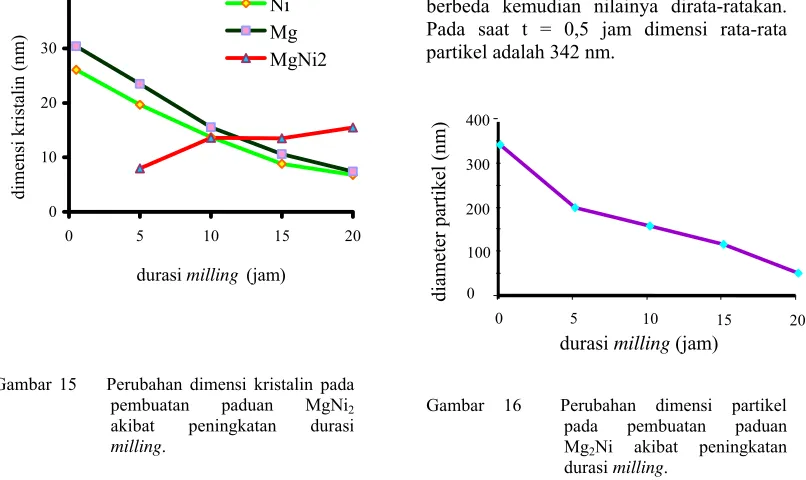
14 Perubahan dimensi kristalin pada pembuatan paduan Mg2Ni akibat peningkatan durasi milling ... 12
15 Perubahan dimensi kristalin pada pembuatan paduan MgNi2 akibat peningkatan durasi milling ... 13
16 Perubahan dimensi partikel pada pembuatan paduan Mg2Ni akibat peningkatan durasi milling ... 13
17 Hasil pengamatan SEM pada pembuatan paduan Mg2Ni pada berbagai durasi milling ... 14
18 Perubahan dimensi partikel pada pembuatan paduan MgNi2 akibat peningkatan durasi milling ... 16
DAFTAR LAMPIRAN
Halaman
1 Penghaluasan (refinement)... 21
2 Tabel perubahan fraksi volume pada pembuatan paduan Mg2Ni... 22
3 Tabel perubahan fraksi volume pada pembuatan paduan MgNi2 ... 22
4 Tabel FWHM pada pembuatan paduan Mg2Ni 0,5 jam... 23
5 Tabel FWHM pada pembuatan paduan Mg2Ni 5 jam ... 23
6 Tabel FWHM pada pembuatan paduan Mg2Ni 10 jam ... 24
7 Tabel FWHM pada pembuatan paduan Mg2Ni 15 jam ... 24
8 Tabel FWHM pada pembuatan paduan Mg2Ni 20 jam ... 25
9 Tabel FWHM pada pembuatan paduan MgNi2 0,5 jam ... 25
10 Tabel FWHM pada pembuatan paduan MgNi2 5 jam ... 26
11 Tabel FWHM pada pembuatan paduan MgNi2 10 jam ... 26
12 Tabel FWHM pada pembuatan paduan MgNi2 15 jam ... 27
13 Tabel FWHM pada pembuatan paduan MgNi2 20 jam ... 27
14 Tabel perubahan dimensi partikel pada pembuatan paduan Mg2Ni akibat peningkatan durasi milling ... 28
15 Tabel perubahan dimensi partikel pada pembuatan paduan MgNi2 akibat peningkatan durasi milling ... 30
16 Pola difraksi sinar-X pada pembuatan paduan Mg2Ni ... 32
17 Pola difraksi sinar-X pada pembuatan paduan MgNi2 ... 37
18 Data JCPDS ... 42
19 Peralatan milling ... 46
20 Peralatan Karakterisasi ... 47
PENDAHULUAN
Latar Belakang
Sebagian besar sumber energi dunia berasal dari bahan bakar berbasis fosil, seperti batu bara, minyak bumi dan gas alam. Konsumsi energi tersebut semakin lama semakin meningkat, namun ketersediaannya di alam ini semakin menurun bahkan dalam waktu dekat akan mengalami krisis [1].
Selain keterbatasan sumber energi tersebut, konsumsi berbasis fosil memberikan efek yang negatif, yaitu bertambahnya karbon dioksida di atmosfer yang merupakan penyebab peningkatan temperatur bumi [2].Oleh karena itu, kita harus mencari alternatif sumber energi baru yang lebih aman dan bersih.
Hidrogen terbukti dapat memberikan kontribusi sebagai sumber energi [3]. Hidrogen sebagai sumber energi memiliki banyak kelebihan, diantaranya ringan, tersedia melimpah di alam, ramah lingkungan dan dapat diperbaharui. Namun, karena sifat hidrogen yang mudah terbakar dan meledak maka masalah penyimpanan menjadi persoalan utama [1, 4].
Beberapa cara penyimpanan yang telah dilakukan antara lain dengan mengompres gas hidrogen ke dalam tabung (compressed hydrogen gas, CHG), hidrogen cair (liquid hydrogen, LH) dan disimpan ke dalam logam dalam bentuk hidrida logam (metal hydride, MH) [2]. Penyimpanan hidrogen dalam bentuk hidrida logam (metal hydride, MH) lebih menguntungkan dari pada cara penyimpanan yang lain, sebab paling ringkas karena padat, paling aman, tingkat kemurnian tinggi, kandungan oksigen yang rendah dan mudah dipindahkan. Namun penyimpanan hidrogen dalam bentuk hidrida logam memiliki kapasitas penyimpanan yang rendah. Dibandingkan dengan paduan yang lain, magnesium memiliki kapasitas penyimpanan yang paling tinggi, yaitu 7,6 wt %. Oleh karena itu dalam penelitian ini penulis memilih paduan berbasis magnesium, yaitu Mg2Nidan MgNi2 sebagai
penyimpan hidrogen. Teknologi seperti ini dapat diaplikasikan pada batere dan fuel cell
[4].
Akhir-akhir ini mechanical alloying
diketahui sebagai teknik baru yang menggunakan impak energi yang besar untuk mendapatkan campuran logam yang sangat halus tanpa menyebabkan paduan logam meleleh. Teknik ini sangat cocok
digunakan pada pembuatan dengan perbedaan titik leleh yang tinggi. Dalam penelitian ini akan dilakukan pembuatan dan karakterisasi paduan berbasis magnesium: Mg2Ni dan MgNi2 yang berukuran nano.
Tujuan Penelitian
1.Membuat paduan Mg2Ni dan MgNi2 yang
berukuran nano dengan metode
mechanical alloying.
2.Membandingkan karakteristik paduan Mg2Ni dan MgNi2.
TINJAUAN PUSTAKA
Hidrida Logam
Logam, paduan logam dan senyawa antar logam (intermetallic compound) secara umum dapat bereaksi dengan hidrogen untuk membentuk hidrida logam. Senyawa hidrida yang terbentuk dapat berupa ikatan ion, kovalen atau logam. Batas antara ikatan-ikatan tersebut tidak jelas, tergantung elektronegativitas dari unsur-unsur pembentuknya [3]. Elektronegativitas memberikan gambaran mengenai mudah atau sukarnya suatu atom menarik elektron. Semakin besar elekronegativitas suatu unsur, maka makin mudah unsur tersebut menarik elektron dari atom lain atau makin mudah membentuk ion negatif. Apabila dua atom yang berbeda keelektronegativitasannya berikatan, maka semakin besar perbedaan elektronegativitas antar unsur, maka semakin jauh jarak antar muatannya sehingga gaya elektrostatis semakin kecil dan senyawa lebih mudah terbentuk.
Unsur-unsur elektropositif yaitu unsur-unsur yang memiliki elektron valensi yang bermuatan positif. Unsur-unsur ini bersifat reaktif, diantaranya adalah kelompok skandium, ytrium, lantanida, aktinida, vanadium, dan titanium. Hidrida biner dari logam transisi biasa dikenal sebagai hidrida logam. Banyak dari senyawa ini (MHn) jauh
menyimpang dari stoikiometri ideal (n = 1, 2, 3) dan dapat membentuk sistem multi fasa. Atom hidrogen yang berada pada posisi interstitial logam disebut sebagai hidrida interstitial. Struktur jenis ini memiliki komposisi MH, MH2 dan MH3, dimana atom
ABXHn, menyebabkan variasi unsur-unsur
seperti ditunjukkan pada Tabel 1. Unsur A pada umumnya merupakan logam alkali dan cenderung untuk membentuk hidrida stabil. Sedangkan unsur B merupakan logam transisi dan membentuk hidrida yang tidak stabil.
Paduan Magnesium Sebagai Penyimpan Hidrogen
Magnesium dan paduan berbasis magnesium merupakan material yang atraktif sebagai penyimpan hidrogen. Magnesium dapat membentuk hidrida (MgH2) yang mengandung 7,6 wt.%
hidrogen. Namun magnesium sebenarnya tidak praktis digunakan untuk menyimpan hidrogen. Alasan utamanya adalah reaksi hidrogenasi dan dehidrogenasinya sangat lambat dan hanya dapat terjadi pada suhu sekitar 350-400 oC. Hal ini disebabkan oleh kuatnya ikatan Mg-H [3].
Ada beberapa faktor yang dapat mengurangi tingkat hidrogenasi. Salah satunya adalah oksidasi dari permukaan magnesium. Magnesium oksida dengan mudah terbentuk pada permukaan magnesium jika permukaan magnesium terkontaminasi dengan udara. Lapisan MgO ini dapat mencegah atom - atom hidrogen masuk ke dalam logam. Suatu proses yang dapat mengurangi lapisan pengganggu tersebut adalah annealing. Proses ini dapat menyebabkan keretakan pada lapisan MgO. Sedangkan faktor yang dapat meningkatkan kecepatan maupun kapasitas penyerapan hidrogen adalah penambahan unsur atau senyawa sebagai katalisator. Unsur-unsur yang sering digunakan sebagai katalisator adalah nikel dan paladium [5].
Tabel 1 Kelompok hidrida yang dapat membentuk paduan antar logam [3]
Karakteristik dari magnesium adalah sebagai berikut [8]:
Kerapatan : 1738 kg m-3 Modulus Young : 45 GPa Resistivitas lisrik : 4.4 x 10-8Ω m Titik lebur : 923 K atau 650 °C Titik didih : 1363 K atau 1090 °C Konduktivitas temal : 160 W m-1 K-1
Struktur kristal :Space group: P63/mmc
(Space group number : 194)
Struktur : hcp (hexagonal close -packed) (Gambar 1)
Parameter kisi : a = 3.209 Å α = 90.000o b = 3.209 Å = 90.000o
c = 5.211Å = 120.00o Sedangkan nikel memiliki karakteristik sebagai berikut [9]:
Kerapatan : 8908 kg m-3 Modulus Young : 200 GPa Resistivitas lisrik : 7 x 10-8Ω m
Titik lebur : 1728 K atau 1455 °C Titik didih : 3186 K atau 2913 °C Konduktivitas temal : 91 W m-1 K-1
Struktur kristal: Space group: Fm3m (Space group number : 225 ) Strukrur : ccp (cubic close-packed) (Gambar 2)
Parameter kisi : a = 3.523 Å α = 90.000 ° b = 3.523 Å = 90.000 °
c = 3.523 Å = 90.000 °
Gambar 1 Struktur kristal magnesium [8].
Gambar 3 Struktur Mg2Ni.
Gambar 4 Struktur MgNi2.
Gambar 3 menunjukkan struktur Mg2Ni
yang memiliki struktur heksagonal dengan
space group P62222, parameter kisi a = 5,21
Å dan c = 13,23 Å. Posisi atom-atomnya adalah tertulis seperti pada Tabel 2. Berdasarkan informasi tersebut terlihat bahwa pada fasa Mg2Ni jumlah
multiplisitas atom-atom Mg (12) dua kali
jumlah multiplisitas atom-atom Ni (6). Sedangkan Gambar 4 menunjukkan
struktur MgNi2 yang memiliki struktur
heksagonal dengan space group P63/mmc parameter kisi a = 4,825 Å dan c = 15,79 Å. Posisi atom-atomnya ditunjukkan pada Tabel 3. Fasa MgNi2 jumlah multiplisitas
atom-atom Ni dua (16) kali jumlah multiplisitas atom-atom Mg (8).
Gambar-gambar tersebut dibuat dengan menggunakan program MAUD (Material Analysis Using Diffraction) [4].
Tabel 2 Posisi atom-atom Mg2Ni [6]
= nikel
= magnesium
atom m x y z o Mg1 6 0.5000 0.0000 0.1149 1
Mg2 6 0.1635 0.3270 0.0000 1
Ni1 3 0.0000 0.0000 0.5000 1
Ni2 3 0.5000 0.0000 0.5000 1
Keterangan: m = multiplisitas o = okupasi
Tabel 3 Posisi atom-atom MgNi2 [6]
atom m x y z o Mg1 4 0.00000 0.00000 0.09400 1
Mg2 4 0.33333 0.66667 0.84417 1
Ni1 4 0.33333 0.66667 0.12514 1
Ni2 6 0.50000 0.00000 0.00000 1
Ni3 6 0.16429 0.32858 0.25000 1
= nikel
= magnesium Keterangan: m = multiplisitas
o = okupasi
Mechanical Alloying
Mechanical alloying (MA) mula-mula dikembangkan pada tahun 1970 di
International Nickel Co. (INCO) sebagai suatu teknik untuk mendispersi ukuran nano, termasuk di dalamnya paduan berbasis magnesium. MA pada dasarnya memiliki pendekatan yang berbeda dengan teknik pemaduan logam konvensional, karena MA didasarkan pada proses deformasi untuk mencampur bahan. Berbeda dengan teknik konvensional yang menggunakan perlakuan panas dan reaksi kimia untuk menggabungkan komponen-komponen paduan. Sifat-sifat dari paduan konvensional dapat diubah dengan menggunakan proses deformasi tetapi derajat deformasi yang dicapai lebih rendah dari pada MA.
menjadi submikrometer [7]. Pada skala ini hanya Transmission Electron Microscopy
(TEM) cara yang tepat untuk mengamati distribusi regangan dari fasa peralihan yang dihasilkan di dalam partikel atau pada permukaan paduan. Ketika waktu (durasi)
milling meningkat, fraksi volume unsur-unsur awal menurun, sedangkan fraksi volume paduan meningkat [10]. Ukuran, bentuk, densitas serbuk dan derajat kemurnian mempengaruhi hasil akhir paduan [11]. Deformasi yang dialami oleh bahan yang digiling (milled) merupakan bagian intrinsik dari proses MA.
Sebelum proses mechanical alloying, partikel awal terdiri dari partikel Mg dan Ni yang masing-masing berbentuk bulat (Gambar 6a). Kemudian Benjamin dan Volin [11] mengidentifikasikan lima tahap dalam mechanical alloying, seperti gambar pada Gambar 6 (b - f). Tahap pertama yaitu perataan partikel: partikel diratakan menjadi berbentuk pipih (flake like). Tahap selanjutnya adalah penyatuan predominan (weldingpredomonance): partikel yang telah diratakan (bentuk pipih) disatukan membentuk seperti lembaran (lamellar). Tahap ketiga adalah pembentukan partikel pada arah yang sama (equiaxed)menyerupai lembaran yang lebih pipih dan bulat. Perubahan bentuk ini disebabkan oleh pengerasan (hardening) dari serbuk. Tahap selanjutnya yaitu orientasi penyatuan acak (random welding orientation): fragmen-fragmen membentuk partikel-partikel
equiaxed kemudian disatukan dalam arah yang berbeda dan struktur seperti lembaran mulai terdegradasi. Tahap akhir yaitu proses
steady state (steady state processing): struktur bahan yang perlahan-lahan menghalus sebagai fragmen-fragmen kemudian disatukan dengan fragmen-fragmen lain dalam arah yang bebeda.
a. b. c.
a.2 bola saling mendekat (approach) b.2 bola saling bertumbukan (impact) c.2 bola saling berpisah (separation)
Gambar 5 Serbuk yang terjepit ketika media
milling betumbukan [11].
a b c
d e f
a.Partikel awal
b.Perataan partikel (tahap 1)
c.Penyatuan predominan (welding
predomonance) (tahap 2)
d.Pembentukan partikel pada arah yang sama (equiaxed) (tahap 3)
e.Orientasi penyatuan acak (random welding orientation) (tahap 4)
f. Proses steady state (steady state processing) (tahap 5)
Gambar 6 Lima tahap dari mechanical alloying
yang dideskripsikan oleh Benjamin dan Volin [9].
`
XRD (X-Ray Difraction)
d O C θ θ θ θ
2 d sin θ= n λ P1
P2
1 2 1’
2’
A B
λ
Gambar 7 Proses terjadinya difraksi oleh kisi
kristal [13].
Sinar-X merupakan gelombang elektromagnetik yang memiliki panjang gelombang (0,1-100) Å, namun yang digunakan untuk analisa kristal adalah sinar-X yang memiliki panjang gelombang (0,5-2,5) Å [10]. Gambar 7 menunjukkan berkas sinar-X dengan panjang gelombang λ, jatuh dengan sudut θ pada sekumpulan bidang kristal (P1 dan P2) yang terpisah pada jarak
tiap bidang yang saling berdekatan berinterferensi saling menguatkan (perbedaan lintasan sama dengan kelipatan bulat n untuk panjang gelombang λ). Hal ini mengakibatkan luas AOC = luas BOC, karena AC = BC dan AC + BC = 2AC = 2BC = n λ. Dari gambar terlihat AC/d = sin
θ, sehingga diperoleh persamaan hukum Bragg [12, 13, 14].
2 d sin θ = nλ (1) Berdasarkan hukum Bragg di atas, sudut difraksi dipengaruhi oleh lebar celah kisi sedangkan intensitas cahaya difraksi dipengaruhi oleh jumlah kisi kristal yang memiliki orientasi yang sama. Dengan menggunakan metode ini dapat ditentukan struktur kristal, parameter kisi dan fasa yang terdapat dalam suatu sampel [14, 15, 16, 17].
SEM (Scanning Electron Microscopy)
Ketika seberkas elektron menumbuk permukaan sampel maka akan terjadi beberapa peristiwa (Gambar 8). SEM memanfaatkan elektron hamburan balik dan elektron sekunder. Elektron hamburan balik disebabkan oleh elektron yang bertumbukan dengan atom sampel, kemudian terhambur dengan sudut 180o (Gambar 8) . Hasil dari elektron hambur balik berhubungan langsung dengan nomor atom spesimen. Nomor atom unsur yang lebih besar nampak jelas dari pada nomor atom unsur yang lebih kecil. Interaksi ini digunakan untuk membedakan bagian spesimen yang memiliki perbedaan nomor atom.
Gambar 8 Proses pemencaran elektron [12].
Sedangkan elektron sekunder adalah elektron yang dihasilkan setelah berkas elektron menumbuk material dan mengenai elektron pada kulit yang memiliki energi terendah, yaitu kulit K, kemudian terjadi ionisasi elektron. Hal ini menyebabkan sedikit energi lolos dan alur berubah dalam peristiwa elektron dan ionisasi elektron dalam spesimen atom. Elektron yang terionisasi ini kemudian meninggalkan atom dengan energi kinetik 5 eV dan kemudian dikategorikan sebagai elektron sekunder. Masing-masing elektron dapat menghasilkan beberapa elektron sekunder. Hasil dari elektron sekunder sangat berhubungan dengan topografi. Walupun energinya 5 eV, hanya elektron sekunder yang sangat mendekati permukaan (<10 nm) dapat keluar dari sampel dan diuji. Beberapa perubahan dalam topografi pada sampel yang lebih besar dari pada kedalaman sampel akan mengubah hasil dari elektron sekunder yang berkaitan dengan efisiensi koleksi. Koleksi dari elektron ini dibantu dengan menggunakan kolektor. Kolektor adalah suatu kisi atau lubang kecil dengan potensial 100V yang diberlakukan baginya yang ditempatkan di samping detektor. Tarik menarik elektron yang bermuatan negatif kemudian menerobos lubang kisi dan kemudian masuk kedalam detektor [12].
Elektron-elektron yang dihamburkan balik amat peka terhadap jumlah atom sehingga dapat menunjukkan perbedaan pada perubahan komposisi. Intensitas dari elektron yang dihamburkan balik peka terhadap orientasi berkas sinar datang relatif terhadap kristal. Efek ini menimbulkan perbedaan orientasi antara butir satu dengan butir lain dalam suatu sampel polikristal [12].
berkas datang (elektron)
elektron hambur
balik Auger Sinar-X
METODE PENELITIAN
elektron sekunder
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di PTBIN-BATAN, Kawasan Puspiptek, Serpong, Tangerang. Waktu yang dibutuhkan untuk penelitian ini adalah 10 bulan, yaitu dari Mei sampai Maret 2007 yang meliputi penelusuran literatur, penulisan proposal, penelitian dan penulisan skripsi (Gambar 9) .
sampel
elastis inelastis
Bahan
Bahan-bahan yang digunakan dalam penelitian ini antara lain :
1) Serbuk magnesium (99.8 %, 270 mesh, Aremco)
2) Serbuk nikel (99.0 %, 10 µm, MERCK) 3) Aseton
4) Aquades 5) Argon
Alat
Peralatan yang digunakan meliputi : 1) High Energy Ball milling Spex 8000 2) Vial (stainless steel (SS) 3) Bola-bola : stainless steel (SS)
diameter = 8 mm massa = 2 gram
4) Glove box
5) Neraca digital 6) Spatula
7) XRD (Shimadzu 610) 8) SEM (Philips 515) 9) Gelas kimia 50 mL : 2
Pembuatan Paduan Mg2Ni dan MgNi2 Vial yang dalam keadaan terbuka dan bola-bola yang berdiameter 8 mm sebanyak 60 buah (Lampiran 19) dimasukkan ke dalam glove box , kemudian glove box
divakumkan hingga tekanan mencapai sekitar 76 cmHg agar udara yang berada di dalamnya tersedot ke luar. Kemudian glove box diisi gas argon. Proses pemvakuman tersebut dilakukan sebanyak 3 kali untuk menghindari terjadinya oksidasi. Kemudian serbuk magnesium dan nikel ditimbang dengan perbandingan stoikiometri sehingga membentuk paduan Mg2Ni dan MgNi2.
Untuk membuat 15 gram paduan Mg2Ni
dibutuhkan 6,8 gram serbuk magnesium dan 8,2 gram sebuk nikel. Sedangkan untuk membuat 15 gram paduan MgNi2
dibutuhkan 2,57 gram serbuk magnesium dan 12,43 gram serbuk nikel. Selanjutnya sampel dipindahkan ke dalam vial yang memiliki panjang 7,6 cm dan diameter 5,1 cm, kemudian ditambahkan bola-bola. Selanjutnya vial ditutup rapat. Setelah itu vial dikeluarkan dari glove box dan selanjutnya dilakukan milling dengan menggunakan Spex 8000 high energy ball milling (HEBM) selama 20 jam secara diskrit (Lampiran 19). Langkah-langkah yang dilakukan dalam penelitian ini dapat terlihat seperti Gambar 9. Sedangkan data yang akan diharapkan terlihat seperti pada Tabel 4
Karakterisasi Paduan XRD
XRD digunakan untuk menentukan struktur paduan yang terbentuk, baik dalam bentuk serbuk maupun pellet. Selain itu alat ini juga dapat digunakan untuk menentukan fraksi volume dari fasa-fasa yang terbentuk. Mula-mula sampel sebanyak 2 gram yang berbentuk bubuk direkatkan ke dalam holder berukuran 2 cm x 2 cm. Kemudian ditekan-tekan agar padat dan setelah itu diletakkan pada alat XRD Shimadzu 610 dengan target CuKα (panjang gelombang 1,54 Å). Pada komputer dicantumkan nama sampel, sudut awal (20o), sudut akhir (100o) , step scanning 0,005o – 1o / step dan kecepatan baca 2 o per menit. Setelah itu alat XRD siap dijalankan.
SEM
Ukuran partikel dan morfologi paduan dapat diamati dengan SEM (tegangan, V = 220kV). Sebelum diamati dengan SEM, sampel harus dipreparasi terlebih dahulu. Sampel sebanyak 2 mg dimasukan ke dalam tabung yang berisi aseton. Kemudian campuran tersebut diaduk. Setelah itu diteteskan ke holder, setelah aseton menguap, sampel berikutnya diteteskan kembali. Setelah preparasi tersebut, sampel dilapisi dengan emas agar sampel bersifat lebih konduktor. Sampel siap diamati dan difoto. Dimensi partikel yang diperoleh memiliki perbesaran 20000 kali dari dimensi aslinya.
Penelusuran Literatur dan Diskusi
Gambar 9 Skema penelitian. Pembuatan Mg2Ni dan MgNi2
(Ball Millling)
Karakterisasi Sampel (XRD dan SEM)
Pengambilan dan Analisis Data Persiapan Alat dan Bahan
Tabel 4 Rencana perolehan data
sampel Durasi milling
(jam) karakterisasi 0.5
5 10 15
Mg
2Ni
20 0.5 5 10 15
MgNi
2 20 XRD dan SEMHASIL DAN PEMBAHASAN
Analisa Fasa dengan XRD
Identifikasi fasa pada pembuatan paduan Mg2Ni
Fasa yang terbentuk dalam Mg2Ni dapat
diidentifikasi dengan melakukan karakterisasi XRD. Identifikasi fasa tersebut dilakukan dengan menggunakan fitting dari analisa kualitatif dengan menggunakan program MAUD. Pola difraksi sinar-X paduan Mg2Ni dengan variasi milling 0,5, 5,
10, 15 dan 20 jam terlihat seperti pada Gambar 10.
Pada milling t = 0,5 jam hanya terdapat fasa magnesium dan nikel. Berdasarkan gambar tersebut terdapat 14 puncak tertinggi yang berada pada posisi 32,2 o; 34,38 o; 36,57 o; 47,80 o; 57,33 o; 63,10 o dan 68,57 o; 67, 314 o dan 69,996 o. Apabila posisi tersebut dibandingkan dengan data JCPDS (Joint Committee of Powder Difraction Standard) ID 35-0821 maka puncak-puncak tersebut milik fasa Mg dengan bidang (hkl): 100, 002, 101, 102, 110, 103, 200,112 dan 201. Lima puncak tertinggi yang lain berada pada posisi 44,37 o; 51,86 o; 76,37 o; 92,76 o dan 98.69 o menurut JCPDS ID 04-0850 adalah milik fasa Ni dengan bidang (hkl): 111, 200, 220, 311 dan 222.
Pada milling selanjutnya (t = 5 jam), fasa Mg2Ni sudah mulai terbentuk. Berdasarkan
analisa kuantitatif menggunakan program MAUD dan selanjutnya membandingkan dengan data JCPDS ID 35-1225, puncak Mg2Ni terdapat pada posisi 20,15 o dengan
bidang 003. Selain fasa tersebut ternyata ada fasa lain yang hadir, yaitu MgO. Fasa ini terbentuk akibat Mg yang terkontaminasi dengan udara, sehingga Mg teroksidasi membentuk MgO. Puncak MgO berada pada
posisi 42,93 o; 62,32 o dan 78,71 o. Data-data ini cocok apabila dibandingkan dengan data JCPDS ID 45-0946. Fasa Ni dan Mg masih hadir, namun jumlahnya menurun. Hal ini dapat dilihat dari intensitas Ni dan Mg yang menurun karena sebagian Ni dan Mg bergabung membentuk Mg2Ni dan sebagian
Mg yang lain berikatan dengan O membentuk MgO.
Ketika durasi milling meningkat hingga 10 jam, fasa-fasa yang hadir sama dengan fasa-fasa pada durasi milling 5 jam, yaitu Mg, Ni, Mg2Ni dan MgO. Namun, fasa
Mg2Ni dan MgO yang terbentuk mengalami
peningkatan. Sedangkan fasa Ni dan Mg mengalami penurunan, sebab Mg dan Ni yang saling berikatan semakin meningkat.
5 jam 20 jam • • • • ♥ • • ♥ ♥ ♣ ♦ ♥ ♥
10 jam ♥
♥ 15 jam
I relatif
2 θ
0,5 jam •
• • • • ♣ ♣ ♣ ♣ ♣
Gambar 10 Pola difraksi sinar-X pada pembuatan paduan Mg2Ni.
♣ ♥ ♥ ♥ ♥ ♥ ♥ ♥ • ♥ ♥ ♣ ♣ ♣ ♦ ♦ ♥ ♥♣ • 40 ♦ ♦ ♦ ♦ ♥ ♥ ♥ ♥ • ♦ ♥ ♦ ♥ ♥ = Ni
• = Mg
♣ = MgO
♦ = Mg2Ni
♦♥
♥ ♥
60 80
Seiring dengan peningkatan durasi milling
(t), fasa Mg2Ni yang terbentuk pun semakin
meningkat. Hal ini dapat dilihat dengan membandingkan data hasil XRD saat t = 15 jam dengan t = 0,5, 5 dan 10 jam. Pada saat t = 15 jam, intensitas fasa Mg2Ni lebih tinggi
dari pada t = 0.5, 5, dan 10 jam. Fasa MgO terlihat meningkat secara drastis. Hal ini menunjukkan bahwa sampel semakin mudah teroksidasi apabila ukuran partikel sampel menurun. Faktor oksidasi ini terjadi pada permukaan sampel. Oleh sebab itu luas permukaan sampel mempengaruhi tingkat oksidasi. Semakin luas permukaan suatu sampel (dimensi partikel semakin kecil) maka oksigen semakin banyak yang berreaksi di permukaan sampel atau dengan kata lain semakin kecil dimensi partikel sampel maka sampel tersebut semakin mudah teroksidasi. Sama halnya dengan t = 10 jam, fasa Ni dan Mg semakin berkurang. Intensitas fasa Ni semakin menurun. Demikian pula pada fasa Mg, seiring dengan kenaikan durasi milling, puncak Mg terkesan hilang, menggantikan fasa Mg2Ni dan MgO.
Pada tahap akhir (t = 20 jam), intensitas Mg2Ni dan MgO semakin meningkat. Hal
ini adalah suatu bukti bahwa semakin lama waktu milling, fasa Mg2Ni dan MgO yang
terbentuk semakin meningkat. Sedangkan intensitas Ni dan Mg mengalami penurunan. Keadaan ini menunjukkan bahwa komposisi Ni dan Mg semakin menurun.
Berdasarkan Gambar 10 tersebut, fasa Mg2Ni terkesan hadir hanya pada posisi
20,15 o saja, namun sebenarnya fasa tersebut banyak hadir di sekitar posisi (36 - 46) o. Pada rentang posisi tersebut hadir pula fasa Ni, Mg dan MgO. Dengan demikian puncak dari keempat fasa itu ada yang saling bertumpang tindih. Akibatnya lebih sulit untuk mengidentifikasikannya. Ada suatu cara, yaitu dengan membandingkan data eksperimen dengan data JCPDS, misalnya kita ingin mengidentifikasikan pada posisi 62,79 o terdapat puncak fasa apa. Jika melihat hasil fitting seperti pada lampiran, di sekitar posisi tersebut terdapat puncak yang saling bertumpang tindih. Jika dibandingkan dengan data JCPDS, pada posisi 63,058o adalah puncak Mg dengan intensitas relatif 16, 63,402o adalah puncak Mg2Ni dengan
intensitas relatif 9 dan pada posisi 62,304o adalah puncak MgO dengan intensitas relatif 39. Terlihat bahwa ketiga posisi pada data JCPDS tersebut hampir mendekati posisi data eksperimen. Jadi, posisi yang memiliki intensitas tertinggilah yang kita pilih.
Dengan demikian pada posisi 62,79 o diidentifikasi sebagai puncak MgO. Demikian selanjutnya jika terdapat puncak-puncak yang saling bertumpang tindih.
Selain pada posisi 20,15 o posisi Mg2Ni
berdasarkan JCPDS ID 35-1225 terdapat pada posisi 45,152 o; 39,962 o ; 37,087 o dan 39,487 o. Posisi-posisi tersebut diurut berdasarkan intensitas tertinggi.
Identifikasi fasa pada pembuatan paduan MgNi2
Sama halnya dengan Mg2Ni, identifikasi
fasa pada pembuatan paduan MgNi2 dengan
variasi milling 0,5, 5, 10, 15 dan 20 jam yang diperoleh dari difraksi sinar-X dilakukan menggunakan program MAUD. Pola difraksi tersebut terlihat seperti Gambar 11. Gambar tersebut menunjukkan bahwa pada milling t = 0,5 jam hanya terdapat fasa magnesium dan nikel, sedangkan fasa Mg2Ni dan MgO belum terbentuk.
Berdasarkan gambar tersebut terdapat 12 puncak tertinggi yang berada pada posisi yang hampir sama dengan puncak-puncak pada pembuatan paduan Mg2Ni yang telah
mengalami proses milling selama 0,5 jam, yaitu 32,.2 o; 34,38 o; 36,57 o; 47,80 o; 57,33
o
; 63,10 o dan 68,57 o. Apabila posisi tersebut dibandingkan dengan data JCPDS ID 35-0821 maka puncak-puncak tersebut milik Mg dengan bidang (hkl): 100, 002, 101, 102, 110, 103 dan 112. Terlihat bahwa pada pola difraksi sinar-X paduan ini hanya terdeteksi 7 puncak Mg, sedangkan pada pola difraksi sinar-X pada paduan Mg2Ni
terdapat 8 puncak Mg. Pada paduan MgNi2
puncak Mg pada posisi 67,314 o tidak terdeteksi sebab intensitasnya rendah. Menurut JCPDS ID 35-0821 intensitas relatif pada posisi tersebut hanya 2 cacahan (count). Lima puncak tertinggi yang lain berada pada posisi yang sama pada pembuatan paduan Mg2Ni yang telah
mengalami proses milling selama 0.5 jam, yaitu 44,37 o; 51,86 o; 76,37 o; 92,76 o dan 98,69 o. Apabila dibandingkan dengan data JCPDS ID 04-0850 maka puncak-puncak tersebut adalah fasa Ni dengan bidang (hkl): 111, 200, 220, 311 dan 222. Namun intensitas Mg pada pembuatan paduan MgNi2 lebih rendah dari pada
Mg2Ni. Hal ini terjadi karena massa Mg
pada pembuatan paduan MgNi2 (2,574
Pada milling selanjutnya (t = 5 jam), fasa MgNi2 sudah mulai terbentuk. Fasa ini dapat
jelas terlihat (tidak bertumpang tindih) berada pada posisi 22,05 o, bidang 101. Data tersebut pun cocok apabila dibandingkan dengan data JCPDS ID 25-1374. Fasa MgO juga sudah mulai terbentuk dalam pembuatan paduan ini, namun memiliki komposisi yang jauh lebih sedikit bila dibandingkan dengan fasa MgO pada pembuatan paduan Mg2Ni yang telah
dilakukan milling dengan durasi yang sama. Hal ini dapat terlihat dari intensitas puncak yang lebih rendah dari pada MgO yang terbentuk pada pembuatan paduan Mg2Ni
pada durasi milling yang sama. Puncak MgO berada pada posisi 49,97 o; 62,32 o dan 78,71 o. Data-data ini cocok apabila dibandingkan dengan data JCPDS ID 45-0946. Fasa Ni dan Mg pun masih hadir, namun jumlahnya menurun dibandingkan dengan t = 0,5 jam, sebab Mg dan Ni sudah lebih banyak bergabung menjadi MgNi2 dan
MgO. Hal ini dapat dilihat dari intensitas Ni dan Mg yang menurun.
Ketika durasi milling meningkat hingga 10 jam, fasa-fasa yang hadir sama dengan fasa-fasa pada durasi milling 5 jam, yaitu Mg, Ni, MgNi2 dan MgO. Namun, fasa
MgNi2 dan MgO yang terbentuk mengalami
peningkatan akibat bertambahnya durasi
milling. Sedangkan fasa Ni dan Mg
mengalami penurunan,bahkan sudah ada puncak Mg yang hilang.
Seiring dengan peningkatan durasi milling
(t), fasa MgNi2 yang terbentuk pun semakin
meningkat. Hal ini terbukti saat t = 15 jam, intensitas fasa MgNi2 mengalami
peningkatan dari pada t = 0.5, 5, dan 10 jam. Namun, fasa Ni dan Mg semakin berkurang sehingga intensitas fasa tersebut semakin menurun.
Pada tahap akhir (t = 20 jam), intensitas MgNi2 dan MgO semakin meningkat. Hal
ini menjadi suatu bukti pula bahwa semakin lama waktu milling, fasa MgNi2 dan MgO
yang terbentuk semakin meningkat. Sedangkan intensitas Ni dan Mg mengalami penurunan. Keadaan ini menunjukkan bahwa komposisi Ni dan Mg semakin menurun.
Berdasarkan kedua sampel di atas, yaitu Mg2Ni dan MgNi2 terlihat terdapat
perbedaan yang mencolok, yaitu intensitas MgO pada pembuatan paduan Mg2Ni lebih
tinggi dari pada intensitas MgO pada pembuatan paduan MgNi2 baik yang
dilakukan proses milling dengan durasi 5,
10, 15 dan 20 jam. Tinggi rendahnya intensitas MgO ini sebanding dengan komposisi (fraksi volume) MgO yang terbentuk pada paduan-paduan tersebut. Pembahasan mengenai fraksi volume akan dibahas secara terpisah dengan pembahasan identifikasi fasa.
♥ = Ni • = Mg
♣ = MgO
♠ = MgNi2
Gambar 11 Pola difraksi sinar-X pada pembuatan paduan MgNi2.
Perubahan fraksi volume pada pembuatan paduan Mg2Ni
10 jam
15 jam
20 jam I relatif
2 θ
♥ ♥ ♥ ♥ • ♥ • • • • • • 0.5 jam ♣ ♠ 5 jam
Sama halnya dengan identifikasi fasa, perubahan fraksi volume paduan Mg2Ni dan
MgNi2 diperoleh dari analisa pola difraksi
sinar-X dengan menggunakan program MAUD. Perubahan fraksi volume pada pembuatan paduan Mg2Ni yang terjadi
selama peningkatan durasi milling dari 0,5 sampai 20 jam ditunjukkan oleh Gambar 12. Berdasarkan gambar tersebut terlihat bahwa semakin besar durasi milling fraksi volume fasa awal, yaitu nikel dan magnesium bekurang sedangkan fraksi volume paduan yang terjadi semakin bertambah. Fasa yang terjadi saat mencampurkan 6,8 gram magnesium dan 8,2 gram nikel adalah Mg, Ni, Mg2Ni dan MgO. Fasa Mg2Ni adalah
fasa yang diharapkan sedangkan MgO tidak diharapkan, sebab fasa ini merupakan oksidasi dari magnesium dan dalam kaitannya dengan penyimpanan hidrogen, fasa ini dapat menghalangi proses hidrogenasi.
Pada awal milling (t = 0,5 jam), hanya terdapat fasa Mg dan Ni. Fasa Mg terdapat sebanyak 61,71 % dan Ni 38,29 % volume. Setelah milling selama 5 jam, fraksi volume Ni dan Mg menurun mencapai 39,65 % dan 8,99 % secara berturut-turut. Hal ini disebabkan oleh pembentukan fasa baru, yaitu Mg2Ni dan MgO. Fraksi volume
Mg2Ni dan MgO secara berturut-turut adalah
29,93 % dan 21,43 %. Setelah milling
selama 10 jam, fraksi volume Ni dan Mg semakin menurun mencapai 19,66 % dan 0,21 % secara berturut-turut. Hal ini menunjukkan semakin banyak Mg dan Ni yang bergabung membentuk fasa Mg2Ni dan
dengan peningkatan durasi milling semakin banyak Mg yang teroksidasi karena luas permukaan nya semakin besar, sehingga O lebih mudah berreaksi. Sedangkan fraksi volume Mg2Ni dan MgO mengalami
peningkatan, secara berturut-turut adalah 35,55 % dan 44,58 %. Fraksi volume Ni setelah milling selama 15 jam adalah 7,89 % dan Mg 0,18 %. Fraksi volume Mg2Ni pada
durasi ini mengalami peningkatan yang cukup tinggi, yaitu mencapai 40,89 %. Hal ini terjadi karena Mg2Ni yang telah
terdeformasi setelah milling 10 jam, menjadi lebih terdeformasi lagi akibat tekanan bola-bola setelah milling 15 jam. Demikian pula dengan MgO, mencapai 51,61 %.
Pada akhir milling (t = 20 jam) fasa Mg2Ni yang telah terbentuk tidak terlalu
banyak mengalami peningkatan, hanya mencapai 41,89 %. Sedangkan MgO 56,05
%, sisanya fasa magnesium 0,17 % dan nikel 1,89 %.
Walaupun sampel dipreparasi dalam lingkungan argon namun fasa MgO masih saja terbentuk bahkan dalam jumlah yang besar. Hal ini menunjukkan bahwa sampel mudah sekali teroksidasi. Dalam hal ini unsur Mg bersifat reaktif sehingga mudah berikatan dengan oksigen. Proses ini terjadi saat sampel terkontaminasi dengan udara dalam waktu yang agak lama saat ingin dikarakterisasi dengan XRD.
Penurunan fraksi volume Mg dan Ni yang terjadi seiring dengan peningkatan durasi
milling terjadi karena sebagian Mg dan Ni saling berikatan membentuk Mg2Ni dan sebagian Mg teroksidasi membentuk MgO. Walaupun pada pola difraksi XRD fasa Mg2Ni terkesan memiliki intensitas yang
rendah di sekitar posisi (20 - 25) o, namun fasa yang telah terbentuk memiliki fraksi volume 41,89 %. Seperti yang telah dijelaskan sebelumnya, sebenarnya fasa tersebut tidak hanya terdapat pada posisi (20 - 25) o saja, namun pada posisi antara (37 - 46) o banyak terdapat puncak milik Mg2Ni.
hanya saja puncak-puncak tersebut saling bertumpang tindih dengan fasa Ni dan MgO, sehingga tidak dapat terlihat dengan jelas peningkatan intensitasnya.
Ni Mg
Mg2Ni
MgO 0 20 40 60 80
0 5 10 15 20
durasi milling (jam)
fraksi volu
m
e (
%
)
Gambar 12 Perubahan fraksi volume pada pembuatan paduan Mg2Ni
Gambar 13 menunjukkan perubahan fraksi volume pada pembuatan paduan MgNi2
akibat pertambahan durasi milling dari 0 sampai 20 jam. Pada awal milling (t =0,5 jam), hanya terdapat fasa Mg dan Ni. Fasa Mg terdapat sebanyak 20,22 % dan Ni 79,78 % volume. Setelah milling selama 5 jam, fraksi volume Ni dan Mg menurun mencapai 73,24 % dan 10,31 % secara berturut-turut. Hal ini disebabkan oleh pembentukan fasa baru, yaitu MgNi2 dan
MgO. Fasa yang terjadi setelah mencampur 2,8 gram magnesium dan 12,6 gram nikel adalah Mg, Ni, MgNi2 dan MgO. Semakin
bertambah durasi milling, fraksi volume serbuk awal, yaitu nikel dan magnesium semakin berkurang sedangkan fraksi volume paduan yang terbentuk semakin bertambah. Hal ini disebabkan oleh semakin bertambahnya durasi milling, maka Mg dan Ni menjadi semakin terdeformasi dan secara mekanik terbentuk fasa baru, yaitu MgNi2.
Akibatnya sebagian Mg dan Ni berikatan membentuk MgNi2 dan sebagian lagi, Mg
teroksidasi menjadi MgO, dengan demikian fraksi volume Mg dan Ni semakin menurun sedangkan fraksi volume MgNi2 semakin
meningkat.
Seperti yang telah dijelaskan pada kasus oksidasi Mg pada pembuatan paduan Mg2Ni, pada pembuatan paduan MgNi2 pun
semakin bertambah durasi milling maka luas permukaan Mg semakin meningkat, sehingga fasa MgO yang terbentuk semakin meningkat. Selain terlihat dari intensitas MgO yang semakin meningkat, hal ini juga dapat terlihat dari semakin meningkatnya fraksi volume MgO.
`
Gambar 13 Perubahan fraksi volume pada pembuatan paduan MgNi2
Setelah milling selama 10 jam, fraksi volume Ni dan Mg menurun mencapai 72,09
% dan 8,87 % secara berturut-turut. Sedangkan fraksi volume MgNi2 dan MgO
mengalami peningkatan, secara berturut-turut adalah 7,49 % dan 11,55 %. Fraksi volume Ni setelah milling selama 15 jam adalah 70,95 % dan Mg 6,41 %. Fraksi volume MgNi2 pada durasi ini mengalami
sedikit peningkatan, yaitu mencapai 10,59 %. Fraksi volume MgO pun hanya mengalami sedikit peningkatan, yaitu mencapai 12,05 %.
Saat durasi milling 20 jam, fasa MgNi2
yang telah terbentuk sebanyak 12,91 % sedangkan MgO 12,75 %, sisanya 4,32 % fasa magnesium dan 70,02 % fasa nikel. Apabila dibandingkan pada pembuatan paduan Mg2Ni, fasa MgO yang terbentuk
pada pembuatan paduan MgNi2 jauh lebih
sedikit. Hal ini disebabkan pada pembuatan paduan MgNi2 mengandung magnesium
lebih sedikit dibandingkan pada pembuatan paduan Mg2Ni. Secara umum semakin tinggi
kandungan magnesium di dalam suatu sampel maka sampel tersebut akan mudah teroksidasi dengan membentuk lapisan MgO. Demikian sebaliknya semakin sedikit kandungan magnesium dalam suatu sampel maka sampel tersebut memiliki kemungkinan yang kecil untuk teroksidasi.
Selain itu fasa MgNi2 yang terbentuk jauh
lebih sedikit dibandingkan fasa Mg2Ni baik
pada durasi milling 5, 10, 15 maupun 20 jam. Hal ini dapat terlihat pada fraksi volume MgNi2 yang terbentuk jauh lebih
sedikit dari pada fraksi volume Mg2Ni yang
telah dilakukan milling pada durasi yang sama. Fenomena ini terjadi karena modulus Young Mg (45 GPa) jauh lebih kecil bila dibandingkan dengan modulus Young Ni (200 GPa). Modolus Young didefinisikan sebagai perbandingan antara tegangan dan regangan [12]. Nilai tersebut sangat berhubungan dengan kekerasan dan ketangguhan suatu bahan. Smallman R. E. [12] mendefinisikan nilai kekerasan Brinell sama dengan tegangan (P/A) dalam kg m-2 , dimana P adalah beban dan A adalah luas permukaan jejak indentor yang berbentuk cekung dan ketangguhan didefinisikan sebagai energi yang diperlukan sehingga bahan terdeformasi. Energi di sini didefinisikan sebanding dengan gaya. Berdasarkan definisi kekerasan dan ketangguhan, maka bahan yang memiliki modulus Young yang tinggi berarti bahan tersebut memiliki kekersan dan ketangguhan yang tinggi pula. Oleh sebab itu bahan tersebut sulit terdeformasi.
0 20 40 60 80
0 5 10 15 20
fraks
i volu
m
e (%)
Ni Mg MgNi2 MgOBerkaitan dengan modulus Young Mg yang jauh lebih kecil dari pada modulus Young Ni maka Mg lebih mudah terdeformasi akibat proses milling dari pada Ni. Berdasarkan stoikiometri, Mg2Ni
memiliki kandungan Mg yang lebih dominan dari pada MgNi2, maka dari itu
Mg2Ni lebih mudah terdeformasi dan lebih
mudah terbentuk dari pada MgNi2 . Hal ini
terlihat dari fraksi volume Mg2Ni yang
terbentuk jauh lebih besar dari pada MgNi2
yang dilakukan milling dengan durasi yang sama.
Perubahan dimensi kristalin pada pembuatan paduan Mg2Ni
Dimensi kristal dapat diperkirakan dengan metode Scherrer dari lebar setengah puncak maksimum (full width at half maximum, FWHM) dengan menggunakan program POWDER-X.
Hasil perhitungan FWHM dengan menggunakan program POWDER-X yaitu dalam satuan derajat. Maka dari itu hasil tersebut harus diubah terlebih dahulu dalam satuan radian dengan cara mengalikannya dengan 3,14 kemudian dibagi 180 o . selanjutnya hasil tersebut dimasukkan ke persamaan Scherrer, yaitu :
θ
λ
cos
9
,
0
×
×
=
FWHM
l
(2)
dengan l adalah dimensi kristalin (Å), λ adalah panjang gelombang sumber dan θ adalah sudut difraksi (radian).
Pada saat durasi milling 0,5 jam, hanya terdapat fasa Mg dan Ni. Dimensi kristalin Mg dan Ni pada saat tersebut secara berturut-turut adalah 22,763 nm dan 27,352 nm (Gambar 14). Setelah dilakukan proses
milling selama 5 jam, fasa Mg2Ni mulai
terbentuk. Dimensi kristalin Mg dan Ni menurun seiring dengan peningkatan durasi
milling. Dimensi Mg dan Ni pada saat tersebut secara berturut-turut adalah 17,862 nm dan 20,644 nm. Sedangakan dimensi kristalin Mg2Ni adalah 24,902 nm.
Setelah proses milling selama 10 jam, dimensi kristalin Mg dan Ni pun menurun seiring dengan peningkatan durasi milling. Ukuran dimensinya pada saat tersebut secara berturut-turut adalah 12,451 nm dan 15,933 nm. Selain itu, dimensi kristalin Mg2Ni juga
mengalami penurunan mencapai 19,396 nm.
0 10 20 30
0 5 10 15 20
durasi milling (jam)
d im en si k ristalin ( n m ) Mg Ni Mg2Ni
Gambar 14 Perubahan dimensi kristalin pada pembuatan paduan Mg2Ni akibat
peningkatan durasi milling
Setelah proses milling berlangsung selama 15 jam, dimensi kristalin Mg dan Ni tetap mengalami penurunan. Dimensinya pada saat tersebut secara berturut-turut adalah 6,675 nm dan 10,801 nm. Sedangkan dimensi kristalin Mg2Ni adalah 14,214 nm.
Setelah proses milling selama berlangsung selama 20 jam, dimensi kristalin Mg dan Ni tetap menurun seiring dengan peningkatan durasi milling. Dimensinya pada saat tersebut secara berturut-turut adalah 5,747 nm dan 8,73 nm. Sedangkan dimensi kristalin Mg2Ni adalah 6,192 nm.
Berdasarkan fenomena tersebut jelas terlihat bahwa semakin bertambah durasi
milling, maka baik dimensi kristalin Mg, Ni maupun Mg2Ni mengalami penurunan. Hal
ini disebabkan oleh tekanan yang dialami kristal-kristal tersebut pada saat terjebak diantara bola-bola, sehingga mereka terdeformasi.
Perubahan dimensi kristalin pada pembuatan paduan MgNi2
Sama halnya pada pembuatan paduan Mg2Ni, dimensi kristalin pada pembuatan
paduan MgNi2 juga dihitung menggunakan
persaman Scherrer. Pada saat durasi milling
0,5 jam, hanya terdapat fasa Mg dan Ni. Dimensi kristalin Mg dan Ni pada saat tersebut secara berturut-turut adalah 26,082 nm dan 30,402 nm (Gambar 15). Setelah dilakukan proses milling selama 5 jam, fasa MgNi2 mulai terbentuk. Dimensi kristalin
adalah 19,661 nm dan 23,472 nm. Sedangakan dimensi kristalin MgNi2 adalah
7,972 nm.
Setelah proses milling selama 10 jam, dimensi kristalin Mg dan Ni pun menurun seiring dengan peningkatan durasi milling. Ukuran dimensinya pada saat tersebut secara berturut-turut adalah 13,703 nm dan 15,518 nm. Namun, dimensi kristalin MgNi2
mengalami penurunan mencapai 13,485 nm. Setelah proses milling berlangsung selama 15 jam, dimensi kristalin Mg dan Ni tetap mengalami penurunan. Dimensinya pada saat tersebut secara berturut-turut adalah 8,821 nm dan 10,565 nm. Sedangakan dimensi kristalin MgNi2 adalah 13,485 nm.
Setelah proses milling selama berlangsung selama 20 jam, dimensi kristalin Mg dan Ni tetap menurun seiring dengan peningkatan durasi milling. Dimensinya pada saat tersebut secara berturut-turut adalah 6,773 nm dan 7.413 nm. Sedangakan dimensi kristalin MgNi2 mengalami peningkatan
mencapai 15,471 nm.
Berdasarkan fenomena tersebut terlihat bahwa dimensi kristalin mengalami peningkatan setelah milling 10 jam, kemudian setelah milling 15 jam menurun dan setelah 20 jam meningkat kembali.
0 10 20 30 40
0 5 10 15 20
durasi milling (jam)
d im en si k ris talin ( n m ) Ni Mg MgNi2
Gambar 15 Perubahan dimensi kristalin pada
pembuatan paduan MgNi2
akibat peningkatan durasi
milling.
Analisa Morfologi dan Dimensi Partikel dengan SEM
Paduan Mg2Ni
Baik pada pembuatan paduan Mg2Ni
maupun MgNi2 dilakukan karakterisasi SEM
dengan menggunakan film polaroid. Pengamatan menggunakan SEM menunjukkan bahwa morfologi partikel berbentuk bulat. Selama proses milling, partikel-partikel tersebut tercampur dan mengalami impact, kemudian terdeformasi sehingga terjadi aglomerasi. Agar dimensi partikel mudah diukur, maka diusahakan sedemikian rupa sehingga paduan terdispersi dengan cara mencampurkan paduan dengan aseton sebelum diamati dengan SEM. Dengan demikian partikel terpisah dan terlihat bulat (Gambar 17 dan 19).
Pengukuran partikel dilakukan dengan cara membandingkan dimensi partikel yang tercetak dengan skala pembesaran. Misalkan ukuran yang tercetak adalah 0,7 cm dan skala perbesaran = 2 x 104 kali atau dengan kata lain 2 cm mewakili 1 µm. Sehingga dimensi partikel yang sebenarnya adalah:
nm
m
m
cm
cm
350
35
,
0
1
2
7
,
0
=
=
×
µ
µ
(
3)Pengukuran tersebut dilakukan dengan mengukur 5 partikel dengan 8 posisi yang berbeda kemudian nilainya dirata-ratakan. Pada saat t = 0,5 jam dimensi rata-rata partikel adalah 342 nm.
Gambar 16 Perubahan dimensi partikel pada pembuatan paduan
Mg2Ni akibat peningkatan
durasi milling. 0
100 200 300 400
0 5 10 15 20
durasi milling (jam)
diameter pa
rtikel
Gambar 17 Hasil pengamatan SEM pada pembuatan paduan Mg2Ni pada berbagai durasi milling
0,5 jam
5 jam
10 jam
15 jam
Pada awal milling pada pembuatan paduan Mg2Ni, yaitu saat t = 0,5 jam, terlihat bahwa
paduan kurang terdispersi, sehingga masih terjadi aglomerasi seperti gumpalan awan. Hal ini disebabkan oleh kurangnya aseton saat preparasi. Walaupun banyak partikel yang teraglomerasi, morfologi partikel yang bulat-bulat masih nampak, sehingga masih mungkin dilakukan pengukuran dimensi partikel. Dimensi rata-rata partikel paduan tersebut adalah 342 nm (Gambar16 dan 17) . Pada tahap selanjutnya, yaitu saat t = 5 jam, terlihat bahwa paduan lebih terdispersi, namun sampel yang dilarutkan dengan aseton terlalu banyak dan berbentuk bulat. Pada tahap ini terlihat pula bahwa dimensi partikel lebih kecil dari pada dimensi partikel setelah milling 0,5 jam, karena paduan lebih terdeformasi akibat tumbukan dan tekanan yang diberikan bola-bola kepada paduan. Dimensi partikel rata-rata pada tahap ini menurun menjadi 200 nm. Pada saat t = 10 jam, paduan lebih terdispersi dari pada paduan saat t = 5 jam, namun sampel yang dilarutkan dengan aseton masih terlalu banyak, hampir sama halnya dengan saat t = 5 jam. Pada tahap ini dimensi partikel sedikit lebih kecil dari pada dimensi partikel setelah milling 5 jam. Hal ini juga disebabkan paduan semakin terdeformasi seiring dengan peningkatan durasi milling. Dimensi rata-rata partikel pada tahap ini berbeda 42 nm dari dimensi partikel rata-rata setelah milling 5 jam, yaitu 158 nm.
Setelah sampel mengalami proses milling
selama 15 jam, morfologi partikel sama dengan morfologi partikel pada tahap sebelumnya, hanya dimensinya yang berubah. Dimensi rata-rata partikel menurun menjadi 116 nm.
Pada tahap akhir, yaitu saat t = 20 jam, dimensi rata-rata partikel tereduksi menjadi 50 nm. Pada tahap ini agak sulit untuk mengukur ukuran partikel sebab ukurannya sangat kecil.
Berdasarkan data-data diatas, semakin bertambah durasi milling maka dimensi partikel semakin menurun. Untuk mempermudah mengamati perubahan dimensi rata-rata partikel seperti grafik pada Gambar16.
Paduan MgNi2
Sama halnya dengan paduan Mg2Ni,
preparasi sampel untuk mengamati morfologi dan dimensi partikel MgNi2
dilakukan dengan mencampurkan paduan
dengan aseton murni agar partikel yang diamati terdispersi. Pada awal milling
paduan MgNi2, yaitu saat t = 0,5 jam,
terlihat bahwa sampel terdispersi sempurna sehingga dimensi partikel dapat dengan mudah diukur dan morfologi partikel pun dengan mudah diamati (Gambar 18 dan 19), yaitu bulat. Nilai rata-rata dimensi partikel pada saat tersebut adalah 350 nm, sedikit lebih besar dari pada dimensi rata-rata partikel Mg2Ni dengan durasi milling yang
sama.
Pada tahap selanjutnya, yaitu saat t = 5 jam, terlihat bahwa paduan dapat dikatakan terdispersi, namun sampel yang dilarutkan dengan aseton terlalu banyak. Morfologi partikel masih tetap berbentuk bulat. Pada tahap ini terlihat pula bahwa dimensi partikel lebih kecil dari pada dimensi partikel setelah milling 0,5 jam. Dimensi partikel rata-rata pada tahap ini menurun menjadi 200 nm.
Pada saat t = 10 jam, paduan pun terdispersi. Morfologi partikel tetap sama dengan morfologi partikel pada milling 5 jam, namun pada tahap ini dimensi partikel sedikit lebih kecil dari pada dimensi partikel setelah milling 5 jam. Dimensi rata-rata partikel pada tahap ini yaitu 175 nm.
Setelah sampel mengalami proses milling
selama 15 jam, walaupun gambarnya kurang bagus, akan tetapi morfologi masih jelas teramati dan dimensinya pun dapat diukur. Morfologi partikel tidak berbeda dengan morfologi partikel pada tahap sebelumnya, hanya dimensinya yang berubah. Dimensi rata-rata partikel menurun menjadi 145 nm. Pada tahap akhir, yaitu saat t = 20 jam, dimensi rata-rata partikel tereduksi menjadi 80 nm. Pada tahap ini agak sulit untuk mengukur ukuran partikel sebab ukurannya sangat kecil.
Berdasarkan data-data tersebut maka dapat dibuat grafik seperti pada Gambar 18. Terlihat bahwa semakin bertambah durasi
milling maka dimensi partikel MgNi2
semakin tereduksi. Apabila dibandingkan secara seksama, dimensi partikel paduan Mg2Ni lebih kecil dari pada dimensi paduan
MgNi2 yang dilakukan proses milling
dengan durasi 0,5, 10, 15 dan 20 jam, kecuali saat durasi milling 5 jam, dimensi partikel Mg2Ni sama dengan dimensi
Namun apabila dianalisa berdasarkan ukuran kristalin, setelah milling 20 jam, dimensi kristalin Mg, Ni, dan Mg
Gambar 18 Perubahan dimensi partikel pada pembuatan paduan MgNi2 akibat
peningkatan durasi milling.
Berdasarkan pengamatan partikel menggunakan SEM, terlihat dengan jelas bahwa parikel-partikel pada paduan Mg2Ni
lebih kecil bila dibandingkan partikel MgNi2 yang telah dilakukan milling dengan
durasi yang sama.. Hal ini membuktikan bahwa partikel-partikel pada paduan Mg2Ni
lebih mudah terdeformasi dari pada partikel-partikel pada paduan MgNi2. Seperti yang
telah disebutkan sebelumnya, menurut Web Element Periodic Table [8], modulus Young Ni adalah 200 GPa, sedangkan modulus Young Mg hanya 45 GPa dan kekerasan Brinell Ni adalah 700 M N m-2. Berdasarkan data-data tersebut terlihat bahwa baik modulus Young maupun kekerasan Brinell Ni lebih besar dari pada Mg. Bahan yang memiliki modulus Young dan kekerasan Brinell lebih besar, maka bahan tersebut lebih sulit terdeformasi. Dengan demikian Ni lebih sulit terdeformasi dari pada Mg. Fasa Mg2Ni memiliki komponan Mg yang
lebih dominan dari pada Ni, sedangkan fasa MgNi2 memiliki komponan Ni yang lebih
dominan dari pada Mg. Berdasarkan analisa di atas maka dapat dikatakan bahwa paduan dengan stoikiometri Mg2Ni lebih mudah
terdeformasi dari pada MgNi2. Oleh sebab
itu, ukuran partikel rata-rata paduan Mg2Ni
lebih cepat menurun dari pada MgNi2.
Pengaruh Dimensi Kristalin, Dimensi Partikel dan Pembentukan MgO apabila Diaplikasikan sebagai Paduan Penyimpan Hidrogen
Seperti pada pembahasan sebelumnya, MgO terjadi akibat Mg yang teroksidasi ketika paduan terkontaminasi dengan udara.
Dalam aplikasi paduan Mg (magnesium alloy) sebagai bahan penyimpan hidrogen (H), fasa ini dapat menghambat masuknya atom H ke dalam ruang intertisi pada paduan. Apabila dibandingkan antara paduan Mg2Ni dan MgNi2, paduan Mg2Ni
sangat mudah teroksidasi dari pada paduan MgNi2. Hal ini dapt terlihat dari intensitas
dan fraksi volume MgO yang telah terbentuk dengan berbagai variasi milling. Dengan demikian, apabila hanya diamati dari kandungan MgO yang terbentuk maka dapat dikatakan MgNi2 lebih baik sebagai bahan
penyimpan H dari pada paduan Mg2Ni.
100 200 300 400
0 5 10 15 20
durasi milling (jam)
d
imensi p
artikel (n
m)
2Ni pada
paduan Mg2Ni lebih kecil dari pada dimensi
kristalin Mg, Ni dan MgNi2 pada paduan
MgNi2. Semakin kecil dimensi kristalin,
maka semakin banyak batas butir yang terbentuk, sehingga ruang interstisi yang terbentuk pun semakin banyak. Dengan demikian paduan Mg2Ni dapt menyimpan H
lebih banyak dari pada paduan MgNi2. Hal
ini dapat juga terlihat dari perbandingan dimensi partikel paduan Mg2Ni dan MgNi2.
Namun pada analisa ini, dimensi kristalin MgO baik yang berasal dari paduan Mg2Ni
maupun MgNi2 tidak dibahas, sebab H
masuk ke ruang interstisi logam melalui batas butir paduan, sedangkan MgO berada pada permukaan paduan. Jadi dalam menganalisa paduan mana yang lebih baik untuk menyimpan H hanya dilihat dari dimensi kristalin Mg, Ni dan Mg2Ni dan
MgNi2.
Hasil pengamatan SEM, menunjukkan bahwa dimensi partikel Mg2Ni maupun
MgNi2 berorde nano setelah milling selama
20 jam, namun dimensi rata-rata partikel Mg2Ni (50 nm) lebih kecil dari pada dimensi
rata-rata partikel MgNi2 (80 nm). Alasannya
adalah seperti telah dijelaskan sebelumnya. Semakin kecil dimensi partikel suatu paduan, maka luas permukaan paduan tersebut semakin kecil pula dan akan semakin banyak probabilitas atom H untuk masuk masuk ke dalam ruang interstisi logam. Dengan demikian dapat dikatakan bahwa paduan Mg2Ni dapat menampung
SIMPULAN DAN SAR
0,5 jam
10 jam
5 jam
15 jam
20 jam
SIMPULAN DAN SARAN
Simpulan
1. Pada awal milling paduan Mg2Ni, hanya
fasa Mg dan Ni yang terbentuk. Setelah 5 jam, mulai terbentuk fasa Mg2Ni dan
MgO. Demikian pula pada paduan MgNi2.
2. Pada paduan Mg2Ni, fraksi volume Mg
dan Ni semakin menurun, sedangkan fraksi volume Mg2Ni dan MgO semakin
meningkat dengan bertambahnya durasi
milling. Demikian pula pada paduan MgNi2.
3. Fraksi volume Mg2Ni lebih besar dari
pada fraksi volume MgNi2 pada durasi milling t = 20 jam. Dengan demikian dapat dikatakan paduan Mg2Ni lebih
mudah terbentuk dari pada paduan MgNi2.
4. Fraksi volume MgO yang terbentuk dari paduan Mg2Ni lebih besar dari pada
fraksi volume MgO yang terbentuk dari paduan MgNi2. Maka dari itu, paduan
Mg2Ni lebih mudah teroksidasi dari pada
paduan MgNi2.
5. Dimensi kristalin Mg2Ni lebih kecil dari
pada dimensi kristalin MgNi2 setelah milling 20 jam.
6. Dimensi partikel paduan Mg2Ni lebih
kecil dari pada dimensi prtikel paduan MgNi2.
7. Paduan Mg2Ni lebih baik diaplikasikan
menjadi paduan penympan hidrogen dari pada paduan MgNi2.
Saran
Untuk penelitian lebih lanjut dapat divariasikan perbandingan massa bola-bola terhadap massa sampel agar lebih terlihat pengaruhnya terhadap pembentukan paduan. Selain itu perlu juga dilakukan penambahan durasi milling. Analisa difraksi sinar-X lebih mendalam juga perlu dilakukan agar dapat diperoleh informasi yang lebih lengkap. Untuk melengakpi hasil difraksi sinar-X, perlu dilakukan karakterisasi DTA untuk mengetahui pada suhu berapa terjadi perbahan fasa. Karakterisasi mekanik pun perlu dilakukan pada tahap selanjutnya agar diketahui kekerasan paduan yang dihasilkan. Untuk tahap selanjutnya perlu dilakukan karakterisasi kinetika penyerapan dan pelepasan hidrogen dengan menggunakan peralatan Sievert.
DAFTAR PUSTAKA
[1] Bormann R. 2004. Hydrogen Storage Materials. http://www.hydrogen.html
[16 Pebruari 2006].
[2] Pyle W. 1997. Hydrogen Storage.
http://www.hydrogen.html [16
Pebruari 2006].
[3] Züttel A. 2003. Materials for
Hydrogen Storage.
http://www.elsevier.com [16 Pebruari 2006].
[4] Buschow KHJ, Bouten PCP Miedema AR 1983. Hydrides of Intermetalic Compounds of Two Transition Metals.
[5] Zaluska A, Zaluski L, Ostrom J. Nanocrystaline Magnesium for Hydrogen Storage. Journal of Alloys and Componds1999; 267:302-305. [6] ASM . Atlas of Crystal Structure
Types. Vol. 3A. USA.
[7] Gaffet E. 2000. Mechanosynthesis :
What does It Mean ? (Mechanical Alloyimg, Ball Milling and Attrition).
http://www.MechanosynthesisWhatd oesItMean.html [2 Maret 2006]. [8] Winter, M. 2006. Web Elements
Periodic Table : Magnesium :
Physical Properties.
http://www.webelements.com [ 11
Juli 2006].
[9] Winter, M. 2006. Web Elements Periodic Table : Nickel : Physical Properties.
http://www.webelements.com [ 11
Juli 2006].
[10] Anoname. 2001. Mechanical Alloying, Casa Study.
http://www.msm.cam.ac.uk/phase-trans/pubs/pt2.html#mechanical [2
Maret 2006].
[11] ASM. Milling of Brittle and Ductile Materials. Vol. 7. USA.
[12] Smallman R. E. 1991. Metalurgi Fisik
Modern. Arifin B, Myrna A,
penerjemah; Jakarta: PT Gramedia Pustaka Utama. Terjemahan dari:
Modern Physical Metalurgy.
[13] Arifianto. 2006. Pengaruh Atmosfer dan Suhu Sintering terhadap Komposisi Pelet Hidroksiapatit yang Dibuat dari Sintesa Kimia dengan Media Air dan SBF [skripsi]. Bogor : IPB.
[
15] Cullity, B.D dan Stock, S.R. 2001.Element of X-Ray Diffraction 3rd Edition.USA : Prentice Hall.
[16] Tipler, P.A. 1991. Fisika untuk Sain
dan Teknik. Jakarta : Erlangga.
[17] Jenkins, R. 2000. X-Ray Technique :
Overview (In Encyclopedia of
Anaylytical Chemistry). Chichester : John Willey and Sons Ltd.
[18] Suminta S, Fajar A, Raharjo HM, Santoso E. 2005. Penghalusan Struktur Fasa Standar Si,Ni dan Al2O3 dengan Metode Rietveld. Pusat
Lampiran 1 Penghalusan
refinement
)
Analisa fasa dan persen volume dapat dilakukan dengan penghalusan (refinement) parameter. Pada program MAUD penulis melakukan penghalusan pada parameter latar belakang (background), fasa dasar, mikrostruktur , struktur kristal, faktor skala dan posisi atom.
Untuk mengetahui baik atau tidaknya hasil penghalusan ditunjukkan oleh nilai reliabilitas bobot pola difraksi (Rw) dan
kualitas fitting, goodness of fitting (Sig). Nilai - nilai ini menunjukkan kesesuaian data hasil pengamatan dengan perhitungan. Semakin kecil nilai Rw dan Sig
menunjukkan kesesuaian antara hasil peengamatan dengan perhitungan semakin baik [18]. Artinya bahwa parameter profil, parameter srtuktur kristal dan persen volume yang diuji semakin mendekati nilai yang sebenarnya.
Menurut R.A. Young [18] nilai kualitas
fitting (Sig) dengan katagori diterima dan memuaskan pada Sig = 1,35 %. Sedangkan penghalusan yang dikatagorikan memiliki tingkat kepecayaan yang tinggi jika nilai tingkat kepercayaan (Rw) lebih kecil dari 20
%. Profil pola difraksi sinar-X dari hasil penghalusan MAUD pada rentang sudut (20-100) o menghasilkan nilai kualitas fitting
(Sig) dan tingkat kepercayaan (Rw) seperti
[image:30.595.325.520.85.145.2] [image:30.595.109.304.506.551.2]yang tertera pada tabel berikut.
Tabel Data kualitas fitting Mg2Ni
t (jam) Sig (%) Rw (%)
0,5 1,20 17,95
5,0 1,24 16,86
10,0 1,30 18,61
15,0 1.21 18,54 20,0 1.33 19,83
Tabel Data kualitas fitting MgNi2
t (jam) Sig (%) Rw (%)
0,5 1,18 16,78 5,0 1,23 17,93
10,0 1,22 16,36 15,0 1,30 19,61 20,0 1,19 17,61
Nilai kualitas fitting (Sig) baik pada fasa Mg2Ni maupun MgNi2 lebih kecil dari 1,35
% dan nilai tingkat kepercayaan (Rw) kedua
Durasi
milling
(jam)
Ni
(%)
Mg
(%)
Mg
2Ni
(%)
MgO
(%)
0,5 61,71
38,29
0,00 0,00
5,0 39,65
8,99
29,93
21,43
10,0 19,66
0,21
35,55
44,58
15,0 7,89
0,18
40,32
51,61
20,0 1,89
0,17
41,89
56,05
Waktu milling
(jam)
Ni
(%)
Mg
(%)
MgNi
2(%)
MgO
(%)
0,5 79,78
20,22
0,00 0,00
5,0 73,24
10,31
5,21
11,24
10,0 72,09
8,87
7,49 11,55
15,0 70,95
6,41
10,59
12,05
20,0 70,02
4,32
12,91
12,75
Lampiran 2 Tabel perubahan fraksi volume pada pembuatan paduan Mg
2Ni
Lampiran 4 Tabel FWHM pada pembuatan paduan Mg
2Ni 0,5 jam
2 teta
(derajat)
d (Å)
Height
Area
FWHM
(derajat)
FWHM
( radian)
32,136 2,78308 61,5
![Gambar 1 Struktur kristal magnesium [8].](https://thumb-ap.123doks.com/thumbv2/123dok/504276.332140/11.595.386.453.610.685/gambar-struktur-kristal-magnesium.webp)
![Gambar 8 Proses pemencaran elektron [12].](https://thumb-ap.123doks.com/thumbv2/123dok/504276.332140/14.595.118.290.527.700/gambar-proses-pemencaran-elektron.webp)