KARAKTERISASI FISIOLOGI DAN GENETIK
PSEUDOMONAS sp. SEBAGAI BIOKONTROL PENYAKIT
CENDAWAN TULAR TANAH PADA TANAMAN KEDELAI
ARI SUSILOWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi ”Karakterisasi Fisiologi dan Genetik Pseudomonas sp. sebagai Biokontrol Penyakit Cendawan Tular Tanah pada Tanaman Kedelai” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi
manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan
maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan
dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Juni 2011
Ari Susilowati
ABSTRACT
ARI SUSILOWATI.Physiology and Genetic Characterization of Pseudomonas sp.
for Biocontrol of Soilborne Fungal Pathogen in Soybean Plant. Under direction of ARIS TRI WAHYUDI, ANTONIUS SUWANTO, SURYO WIYONO and YULIN LESTARI.
Antagonist bacteria have been recognized playing important role in plant disease suppression. In Indonesia, the role and potential indigenous soybeans’ rhizobacteria such as antagonist Pseudomonas sp. as biocontrol have not many been reported. The aims of this study were to screen and characterize a number of
Pseudomonas isolates as biocontrol agent against soilborne fungal pathogens i.e.
Sclerotium rolfsii, Fusarium oxysporum or Rhizoctonia solani in soybean plants. Eleven isolates of Pseudomonas sp. CRB showed strong inhibition on the growth of the soilborne pathogenic fungi in vitro. Among of them, 7 isolates produced siderophore, 2 isolates produced chitinase, and 4 isolates produced hydrogen cyanide. Amplified rDNA restriction analysis (ARDRA) indicated high genetic diversity level since 7 ribotype groups were presented. 16S rRNA based sequences phylogenetic tree formed four clusters. There was a quite overlap among ARDRA groups and 16S rRNA clusters, suggested that in the same ARDRA group they were closely related to each other. The sequences of 16S rRNA gene confirmed that the isolates belonging to Pseudomonas sp. and similarity percentage varied to various species of Pseudomonas showed their extensive diversity. Part of antifungal biosynthesis gene encoding phenazine, phzF, phospho-2-dehydro-3-deoxyheptonate aldolase could be detected and confirmed in Pseudomonas sp. CRB-80 and CRB-102. Seed coating with the Pseudomonas
sp. CRB demonstrated disease suppression in planta at approximately 14-100% in sterile soil and 5-53% in non-sterile soil. Pseudomonas sp. CRB-16, CRB-44, CRB-86, CRB-102 and CRB-109 which maintained moderate disease suppression, more than 30% in non-sterile soil might be considered for development as biological control agents to protect soybean from the soilborne fungal disease. Population density in soybean rhizosphere of Pseudomonas sp. CRB-17, CRB-80 and CRB-102 Rifr were 102-107 cells/g fresh root weight in sterile soil, in contrast to 0-106 cells/g fresh root weight in non-sterile soil for 6 weeks observation.
RINGKASAN
ARI SUSILOWATI. Karakterisasi Fisiologi dan Genetik Pseudomonas sp.
sebagai Biokontrol Penyakit Cendawan Tular Tanah pada Tanaman Kedelai. Dibimbing oleh ARIS TRI WAHYUDI, ANTONIUS SUWANTO, SURYO WIYONO dan YULIN LESTARI.
Proteksi tanaman modern sangat bergantung pada penggunaan bahan kimia untuk mengatasi hama dan penyakit. Akan tetapi, meningkatnya perhatian terhadap kesehatan dan kerusakan lingkungan yang disebabkan oleh penggunaan bahan kimia untuk pertanian menyebabkan peningkatan tuntutan yang lebih besar terhadap pertanian yang berkelanjutan. Pada tanah yang menekan penyakit dan kompos, penekanan penyakit diperoleh tanpa penggunaan bahan kimia. Penekanan penyakit selalu berhubungan dengan keberadaan bakteri antagonis yang jumlahnya semakin meningkat di dalam tanah. Bakteri rizosfer antagonis yang bermanfaat ini dapat dikembangkan sebagai agen pengendali biologi untuk mengurangi penggunaan bahan kimia di bidang pertanian. Di Indonesia, bakteri antagonis asli rizosfer tanaman kedelai belum banyak dilaporkan dan potensinya sebagai agen biokontrol perlu diteliti lebih lanjut. Tujuan penelitian ini adalah untuk mendapatkan kandidat agen biokontrol terhadap cendawan patogen tular tanah Sclerotium rolfsii, Fusarium oxysporum atau Rhizoctonia solani untuk tanaman kedelai.
Delapan puluh satu isolat bakteri rizosfer tanaman kedelai digunakan dalam penelitian ini. Cendawan patogen tular tanah S. rolfsii, F. oxysporum
diperoleh dari Departemen Proteksi Tanaman, IPB. dan R. solani diperoleh dari Balai Penelitian Tanah Bogor. Bakteri Pseudomonas chlororaphis DF190 dan DF202 (Prof. Dr. Dilantha Fernando, University of Manitoba, Kanada);
Pseudomonas aureofaciens 30-84, Pseudomonas fluorescens Q2-87, Q8-R1 dan
Pseudomonas fluorescens Pf-5 (Dr. Linda Thomashow, Agricultural Research Service - United States Department of Agriculture (ARS-USDA), Washington State University, Amerika Serikat) disertakan dalam penelitian ini sebagai bakteri kontrol positif deteksi gen-gen anticendawan.
Uji antagonisme dilakukan dengan menggunakan metode kultur ganda. Besarnya persentase penghambatan pertumbuhan radial cendawan oleh bakteri dihitung menggunakan rumus 1-(a/b) x 100%, dengan a menunjukkan jarak antara titik pusat cendawan ke arah isolat bakteri, b menunjukkan jarak antara titik pusat cendawan ke sisi yang berlawanan tanpa bakteri. Produksi siderofor oleh isolat-isolat dideteksi dengan menggunakan media agar-agar Chrome Azurol S (CAS). Produksi kitinase ditentukan dengan menggunakan medium sintetik yang mengandung koloid kitin. Produksi hidrogen sianida diketahui dengan menggunakan indikator alkali pikrat.
Keragaman genetik berdasarkan amplified rDNA restriction analysis
Eropa). Pemotongan oleh enzim restriksi dilakukan pada suhu 37ºC semalam. Dendrogram filogenetik dibuat dengan menggunakan metode neighbour-joining
dalam software TREECON for Windows 1.3b. Identifikasi molekuler dan analisis keragaman genetik berdasarkan sekuen gen 16S rRNA dilakukan dengan pencarian kemiripan sekuen menggunakan program Basic Local Alignment Search Tool for Nucleotide (BLASTN) yang terdapat di National Center for Biotechnology Information (NCBI), http://www.ncbi.nlm.gov/BLAST. Untuk pembuatan pohon filogenetik, sekuen gen 16S rRNA disejajarkan dengan menggunakan clustalW, dan dianalisis berdasarkan metode neighbour-joining
menurut Jukes dan Cantor dalam program MEGA versi 4.
Deteksi gen yang mengkode sintesis senyawa anticendawan dilakukan dengan metode PCR. Tujuh pasang primer digunakan untuk mengamplifikasi gen
diacetylphloroglucinol (DAPG), fenazin, pioluteorin dan pirolnitrin. Amplifikasi dengan PCR (Veriti Thermal Cycler, Applied Biosystems, Amerika Serikat) dilakukan dalam 25µl campuran reaksi. Selanjutnya, produk amplifikasi dielektroforesis dengan gel agarosa 1% dalam 1x bufer Tris Boric acid EDTA
(TBE) selama 30 menit 100 V, diwarnai dengan ethidium bromida, dan difoto di atas ultraviolet transilluminator. Kloning gen penyandi senyawa anticendawan dilakukan dengan vektor pCR®4Blunt-TOPO (Invitrogen, Jepang) dan pGEM-T Easy (Promega, Amerika Serikat) menggunakan sel elektro-kompeten Escherichia coli TOP 10 dan E. coli EPI 300 sebagai sel inang. Sekuensing dikerjakan dengan ABI 3130 DNA Analyzer (Applied Biosystems, Amerika Serikat). Analisis bioinformasi pencarian kesamaan sekuen nukleotida dilakukan dengan program BLASTN dan protein dengan program BLASTX pada situs NCBI.
Perlakuan benih (seed coating) dilakukan dengan melapisi benih dengan bakteri yang telah disuspensikan ke dalam 0.5% karboksil metilselulosa dengan konsentrasi bakteri 107-108 sel/ml. Duapuluh empat benih kedelai yang telah dilapisi dengan masing-masing bakteri ditanam pada tanah yang telah diinfestasi cendawan patogen (103 cfu/g tanah). Penekanan penyakit dievaluasi setelah satu minggu kecambah muncul dengan menghitung jumlah tanaman yang sehat dan tanaman yang menunjukkan gejala karena serangan cendawan patogen pada kondisi tanah steril dan tanah non steril.
Analisis kemampuan kolonisasi rizosfer dilakukan dengan penandaan resisten antibiotik rifampisin (Rifr). Perlakuan benih dilakukan dengan cara merendam biji kedelai dalam suspensi bakteri Pseudomonas sp. CRB-Rifr selama 1 jam. Jumlah awal bakteri adalah 106 sel/benih berdasarkan penghitungan bakteri menggunakan standard plate count. Pemantauan perkembangan populasi
Pseudomonas sp. CRB-Rifr di rizosfer tanaman kedelai pada tanah steril dan non steril dilakukan selama 6 minggu. Penghitungan jumlah bakteri dilakukan dengan metode cawan sebar pada medium agar-agar King’s B yang mengandung rifampisin 100 µg/ml.
Sebelas isolat dari delapan puluh satu isolat Pseudomonas sp. CRB yang diisolasi dari rizosfer tanaman kedelai telah diseleksi mempunyai sifat-sifat yang dapat berperan sebagai biokontrol. Sifat-sifat biokontrol yang dipunyai adalah menunjukkan penghambatan pertumbuhan radial cendawan patogen akar R. solani,
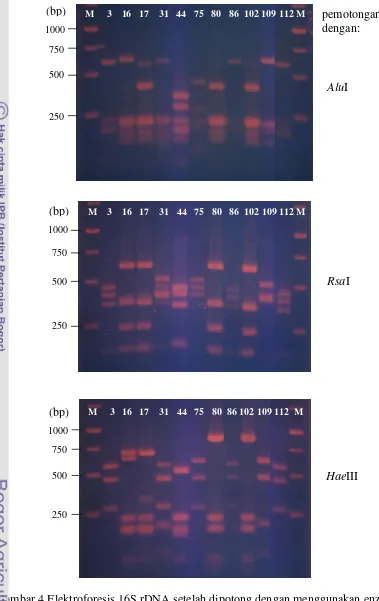
Pemotongan 16S rDNA dengan tiga enzim restriksi HaeIII, RsaI dan AluI menghasilkan 3 sampai 5 pita dengan ukuran yang berbeda untuk masing-masing perlakuan enzim restriksi. Perbedaan pola potongan pita DNA tersebut telah dapat membedakan isolat satu dengan isolat yang lain. Dendrogram berdasarkan ARDRA mengungkapkan tingkat keragaman genetik yang cukup tinggi di antara isolat-isolat Pseudomonas sp. CRB, karena berdasarkan analisis ini tujuh kelompok ribotipe dapat ditunjukkan. Identifikasi molekuler berdasarkan sekuen gen 16S rRNA (600 nukleotida) bakteri antagonis Pseudomonas sp. CRB mengarah ke spesies yang berbeda dengan identifikasi berdasarkan morfologi dan
fisiologis Microgen™ tetapi masih pada genus yang sama yaitu Pseudomonas. Isolat-isolat Pseudomonas sp. CRB mempunyai kemiripan yang tinggi antara 83-100% terhadap berbagai spesies dalam genus Pseudomonas. Tingkat kemiripan terhadap berbagai spesies Pseudomonas yang beragam juga menunjukan keragaman spesiesnya. Pohon filogenetik membentuk empat kelompok hubungan kekerabatan. Isolat-isolat yang berada dalam kelompok yang sama mempunyai hubungan kekerabatan yang dekat.
Enam pasang primer yang digunakan berhasil mengamplifikasi gen target penyandi senyawa anticendawan pada bakteri kontrol positif. Empat pasang primer menghasilkan pita tidak spesifik pada Pseudomonas sp. CRB. Selanjutnya, optimasi kondisi PCR dengan primer PHZ1/2 menghasilkan pita spesifik 1.6 kb lebih besar pada Pseudomonas sp. CRB 80 dan 102 dibandingkan dengan ukuran yang seharusnya 1.4 kb. BLASTN menunjukkan 785 bp dari sekuen lengkap tersebut paling mirip 92% dengan nukleotida phospho-2-dehydro-3-deoxyheptonate aldolase, class I dari Pseudomonas putida KT2440. BLASTX protein dari nukleotida yang ditranslasi menunjukkan kemiripan 242 asam amino dengan phospho-2-dehydro-3-deoxyheptonate aldolase, class I dari Pseudomonas putida GB-1. Phospho-2-dehydro-3-deoxyheptonate aldolase adalah gen phzF.
PhzF adalah bagian dari 7 gen penyandi biosintesis fenazin pada Pseudomonas aureofaciens 30-84. Hasil ini menunjukkan bahwa bagian gen penyandi biosintesis fenazin, phzF, dapat terdeteksi dan terkonfirmasi pada Pseudomonas
sp. CRB-80 dan CRB-102. Pada Pseudomonas sp. CRB yang lain, biosintesis senyawa anticendawan selain fenazin, pioluteorin, pirolnitrin atau diasetilfloroglusinol diperkirakan terlibat dalam antibiosis.
Hampir semua Pseudomonas sp. CRB, kecuali CRB-3 pada tanah steril, dapat mengurangi jumlah tanaman yang menunjukkan gejala penyakit karena serangan cendawan patogen tular tanah dan memberikan penekanan penyakit. Perlakuan benih dengan Pseudomonas sp. CRB memberikan penekanan penyakit
in planta sekitar 14.3-100% pada tanah steril dan 5.2-52.6% pada tanah non steril.
Pseudomonas sp. CRB-16, CRB-44, CRB-86, CRB-102 dan CRB-109 yang masih menunjukkan penekanan penyakit cukup tinggi, lebih dari 30% pada tanah non steril dapat dipertimbangkan untuk dikembangkan sebagai agen pengendalian hayati untuk aplikasi ke lapang.
© Hak cipta milik IPB, tahun 2011 Hak cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
KARAKTERISASI FISIOLOGI DAN GENETIK
PSEUDOMONAS sp. SEBAGAI BIOKONTROL PENYAKIT
CENDAWAN TULAR TANAH PADA TANAMAN KEDELAI
ARI SUSILOWATI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Biologi/Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Penelitian : Karakterisasi Fisiologi dan Genetik Pseudomonas sp. sebagai Biokontrol Penyakit Cendawan Tular Tanah
pada Tanaman Kedelai.
Nama : Ari Susilowati
NIM : G361060051
Disetujui
Komisi Pembimbing
Dr. Aris Tri Wahyudi, M.Si Ketua
Prof. Dr. Ir. Antonius Suwanto, M.Sc Anggota
Dr. Ir. Suryo Wiyono, M.Sc.Agr Anggota
Dr. Ir. Yulin Lestari Anggota
Diketahui
Ketua Program Studi Biologi
Dr. Ir. Dedy Duryadi Solihin, DEA
Dekan Sekolah Pascasarjana IPB
Dr. Ir. Dahrul Syah, M.Sc.Agr
Penguji pada Ujian Tertutup: Dr. Ir. Giyanto, M.Si
Dr. Ir. Happy Widiastuti, M.Si
Penguji pada Ujian Terbuka: Dr. Ir. Andi Khaeruni R., M.Si
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala limpahan rahmat, kasih sayang dan kemudahan-Nya sehingga disertasi yang berjudul
“Karakterisasi Fisiologis dan Genetik Pseudomonas sp. sebagai Biokontrol Penyakit Cendawan Tular Tanah pada Tanaman Kedelai”, telah berhasil diselesaikan.
Terima kasih penulis sampaikan kepada Dr. Aris Tri Wahyudi, Prof. Dr. Antonius Suwanto, Dr. Suryo Wiyono dan Dr. Yulin Lestari sebagai pembimbing atas bimbingan dan arahan yang diberikan. Penelitian ini didanai oleh Insentif Ristek Penelitian Dasar tahun 2007 atas nama Dr. Aris Tri Wahyudi, Beasiswa Program Pasca Sarjana (BPPS), Sandwich Like Program dari Direktorat Jendral Pendidikan Tinggi dan Rektor Universitas Sebelas Maret Surakarta. Oleh karena itu, penulis mengucapkan banyak terima kasih. Terima kasih kepada Kepala dan seluruh staf Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB, pengelola rumah kaca di Cikabayan atas segala bantuan, fasilitas dan penggunaan alat. Terima kasih kepada Prof. Tadashi Matsunaga, Dr. Atsushi Arakaki, Dr. Masayoshi Tanaka, Dr. Nemoto Michiko dan Dr. Yoshiaki Maeda di
Laboratory of Biotechnology, Tokyo University of Agriculture and Technology,
Japan atas bimbingan dan fasilitas laboratorium molekuler. Kepada Prof. Dr. Dilantha Fernando dan Dr. Rajesh Ramaratnam, University of Manitoba, Canada; Dr. Linda Thomashow dan Dr. Dimitri Mavrodi, Agricultural Research Service - United States Department of Agriculture (ASR-USDA), Washington State University, USA untuk pemberian bakteri referensi kontrol positif penghasil anticendawan dan saran-sarannya dalam deteksi gen penyandi senyawa anticendawan.
Terima kasih kepada Dr. Giyanto (Departemen Proteksi Tanaman, Fakultas Pertanian, IPB) dan Dr. Happy Widiastuti (Balai Penelitian Bioteknologi Perkebunan) sebagai penguji luar komisi pada ujian tertutup atas kesedian sebagai penguji dan saran perbaikan yang diberikan. Dr. Andi Khaeruni R. (Jurusan Agroteknologi, Fakultas Pertanian, Universitas Haluoleo) dan Dr. Abjad Asih Nawangsih (Departemen Proteksi Tanaman, Fakultas Pertanian, IPB) sebagai penguji pada ujian terbuka atas kesediaannya sebagai penguji.
Ucapan terima kasih juga disampaikan kepada Bapak dan Ibu serta seluruh keluarga atas segala doa, curahan kasih sayang dan dukungan yang diberikan. Terima kasih kepada Rika Indri Astuti M.Si, Jonatan Banoet S.Si, Syamsul Bahri M.E, Dr. Ratna Setyaningsih dan teman-teman lainnya di Laboratorium Mikrobiologi atas kebersamaan, suka duka, diskusi, saran-saran, dukungan dan bantuan yang diberikan selama bekerja di laboratorium.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2011
RIWAYAT HIDUP
Penulis dilahirkan di Surakarta pada tanggal 28 April 1969, sebagai anak ketiga dari Bapak Jarman Soegito dan Ibu Siti Darwati. Pendidikan Sarjana Biologi dalam bidang Botani diselesaikan di Universitas Gadjah Mada pada tahun 1996. Pendidikan Magister Sain dalam bidang Mikrobiologi diselesaikan di Institut Teknologi Bandung pada tahun 2001. Selanjutnya, penulis mendapatkan kesempatan melanjutkan sekolah S3 di Program Studi Biologi/Mikrobiologi, Sekolah Pascasarjana, Institut Pertanian Bogor pada tahun 2006 melalui program Beasiswa Program Pasca Sarjana (BPPS) Direktorat Jenderal Pendidikan Tinggi.
Penulis adalah staf pengajar di Jurusan Biologi, FMIPA Universitas Sebelas Maret, Surakarta. Selama menjadi mahasiswa S3, penulis telah mempresentasikan sebagian dari penelitian disertasi pada Seminar Nasional Pertemuan Ilmiah Tahunan, Perhimpunan Mikrobiologi Indonesia, tahun 2008 di
Purwokerto, dengan judul “Rhizobacteria Pseudomonas sp. Isolated from Rhizosphere of Soybean Plant that are Potential as Biocontrol of Phytopathogenic Fungi”. Pada bulan November 2008 - Februari 2009, mengikuti magang penelitian dalam Sandwich-LikeProgram Direktorat Jendral Pendidikan Tinggi di Laboratorium Prof. Tadashi Matsunaga, Department of Biotechnology, Tokyo University of Agriculture and Technology, Japan. Pada tahun 2010, telah mempublikasikan sebagian hasil penelitian di jurnal Microbiology Indonesia, Vol
DAFTAR ISI
Halaman
DAFTAR ISI ... xxi
DAFTAR TABEL ... xxiii
DAFTAR GAMBAR ... xxv
BAB 1. PENDAHULUAN UMUM Latar Belakang ... 1
Tujuan Penelitian ... 6
Hipotesis ... 7
Manfaat Penelitian ... 7
Novelty / Kebaruan ... 7
Kerangka Penelitian ... 8
BAB 2. IDENTIFIKASI DAN SELEKSI KARAKTER BIOKONTROL ISOLAT BAKTERI DARI RIZOSFER TANAMAN KEDELAI Pendahuluan ... 9
Bahan dan Metode Identifikasi isolat bakteri ... 10
Antagonis terhadap cendawan patogen ... 11
Produksi siderofor ... 11
Produksi kitinase ... 12
Produksi HCN dengan alkali pikrat ... 12
Hasil Identitas isolat-isolat dari rizosfer tanaman kedelai ... 13
Antagonisme Pseudomonas sp. CRB terhadap cendawan patogen tular tanah ... 17
Pembahasan ... 19
Simpulan ... 21
BAB 3. KERAGAMAN GENETIK BAKTERI ANTAGONIS PSEUDOMONAS sp. CRB Pendahuluan ... 23
Bahan dan Metode Isolasi DNA genom ... 24
Amplifikasi gen penyandi 16S rRNA ... 25
Analisis ARDRA ... 26
Analisis sekuen gen 16S rRNA ... 27
Hasil Keragaman genetik berdasarkan ARDRA ... 27
Keragaman genetik berdasarkan sekuen gen 16S rRNA ... 32
Pembahasan ... 35
BAB 4. DETEKSI DAN KARAKTERISASI GEN PENYANDI BIOSINTESIS SENYAWA ANTICENDAWAN
Pendahuluan ... 39
Bahan dan Metode Deteksi gen anticendawan dengan PCR ... 41
Kloning DNA dengan vektor pCR®4Blunt-TOPO®... 44
Kloning DNA dengan vektor pGEM-T Easy ... 47
Sekuensing DNA ... 49
Hasil Amplifikasi gen penyandi biosintesis anticendawan ... 51
Optimasi PCR gen fenazin ……….…... 55
Kloning fragmen gen fenazin ... 56
Sekuen fragmen gen fenazin ... 59
Pembahasan ... 62
Simpulan ... 64
BAB 5. PENEKANAN PENYAKIT IN PLANTA Pendahuluan ... 65
Bahan dan Metode Asai patogenisitas cendawan patogen terhadap akar tanaman kedelai ... 66
Penyiapan inokulum cendawan ... 67
Perlakuan benih ... 67
Uji penekanan penyakit in planta ... 68
Hasil Patogenisitas cendawan ... 69
Penekanan penyakit ... 74
Pembahasan ... 74
Simpulan ... 78
BAB 6. KOLONISASI RIZOSFER Pendahuluan ... 81
Bahan dan Metode Mutasi spontan resistensi antibiotik rifampisin ... 83
Pertumbuhan spesifik Pseudomonas sp. CRB Rifr ... 83
Kolonisasi rizosfer pada tanah steril dan non steril ... 83
Pengamatan kolonisasi rizosfer pada tanaman kedelai ... 84
Hasil ... 85
Pembahasan ... 89
Simpulan ... 90
BAB 7. PEMBAHASAN UMUM ... 91
SIMPULAN ... 94
SARAN ... 95
DAFTAR PUSTAKA ... 97
DAFTAR TABEL
Halaman
1 Identifikasi Pseudomonas sp. CRB yang mempunyai karakter biokontrol menggunakan kit fisiologis Microgen™. Kit Microgen™
terdiri dari 24 sumur (GNA dan GNB) yang berisi substrat biokimia
standar ……… 16
2 Karakter biokontrol Pseudomonas sp. CRB yang diisolasi dari rizosfer tanaman kedelai ……… 18
3 Fragmen 16S rDNA (bp) hasil pemotongan enzim restriksi AluI, RsaI dan HaeIII isolat Pseudomonas sp. CRB penghasil anticendawan ... 30
4 Taxon spesies dalam pusat data GenBank dengan sekuen gen 16S rRNA yang paling mirip dengan sekuen parsial (600 nukleotida) masing-masing isolat Pseudomonas sp. CRB ……… 32
5 Reaksi ligasi menggunakan Zero Blunt TOPO PCR Cloning ... 44
6 Reaksi PCR menggunakan polimerase Prime StarMax ... 45
7 Reaksi ligasi dengan vektor pGEM-T Easy ... 48
8 Campuran reaksi untuk siklus sekuensing menggunakan ABI BigDye Terminator ... 49
9 Produk amplifikasi gen penyandi biosintesis anticendawan dan primer yang digunakan pada Pseudomonas sp. CRB dan bakteri kontrol positif Pseudomonas chlororaphis DF190, DF202, Pseudomonas aureofaciens 30-84, Pseudomonas fluorescens Q2-87, Q8-R1, Pf-5 ... 51
10 Kemiripan nukleotida fragmen gen PHZ1/PHZ2 dengan pusat data di GenBank menggunakan Basic Local Alignment Search Tool for Nucleotide (BLASTN) ... 59
11 Kemiripan protein fragmen gen PHZ1/PHZ2 dengan pusat data di GenBank menggunakan Basic Local Alignment Search Tool for Protein, using translated nucleotide (BLASTX) ... 60
13 Kemiripan protein sekuen lengkap 1.6 kb fragmen gen PHZ1/PHZ2 dengan pusat data di GenBank menggunakan Basic Local Alignment Search Toolfor Protein, using translated nucleotide (BLASTX) .... 62
14 Penekanan penyakit oleh Pseudomonas sp. CRB pada tanaman kedelai umur 1 minggu yang ditumbuhkan pada tanah steril dan tanah non steril, yang diinfestasi dengan cendawan patogen
Sclerotium rolfsii, Fusarium oxysporum atau Rhizoctonia solani
DAFTAR GAMBAR
Halaman
1 Morfologi bakteri bentuk batang, Gram negatif dari 11 isolat antagonis Pseudomonas sp. CRB yang ditunjukkan dengan pewarnaan Gram. Skala 10µm ……….. 14 2 Antagonis in vitro Pseudomonas sp. CRB-80 terhadap Sclerotium
rolfsii (A), Pseudomonas sp. CRB-86 terhadap Fusarium oxysporum
(B) dan Pseudomonas sp. CRB-102 terhadap Rhizoctonia solani (C)
……….. 17
3 Elektroforesis 16S rDNA 11 isolat Pseudomonas sp. CRB penghasil senyawa anticendawan dengan nomer isolat: 3, 16, 17, 31, 44, 75, 80, 86, 102, 109 dan 112) M = Marker 1 kb DNA ladder
(Fermentas) ... 28
4 Elektroforesis 16S rDNA setelah dipotong dengan menggunakan enzim restriksi AluI, RsaI dan HaeIII dari 11 isolat Pseudomonas sp. CRB penghasil anticendawan. M = Marker 1 kb DNA ladder
(Fermentas) ... 29
5 Dendrogram pengelompokan dan elektroforegram Pseudomonas sp. CRB yang mempunyai karakter biokontrol, berdasarkan profil restriksi dengan tiga enzim endonuklease HaeIII, RsaI dan AluI. Masing-masing ribotipe ditandai dengan kurung kanan
………...……... 31
6 Pohon filogenetik di antara sebelas isolat Pseudomonas sp. CRB dengan galur referensi yang mempunyai sifat biokontrol
Pseudomonas fluorescens CHA0 (No akses AJ278812), Pf-5 (CP000076.1) dan Escherichia coli (E24377A) sebagai kelompok γ proteobacteria berdasarkan sekuen parsial (600 nukleotida) gen 16S rRNA ... 34
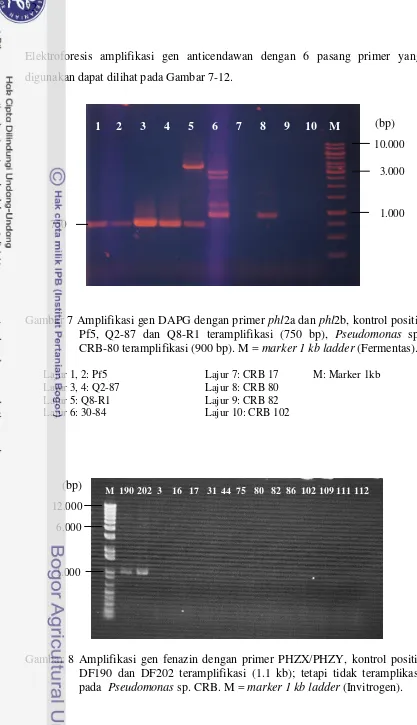
7 Amplifikasi gen DAPG dengan primer phl2a dan phl2b, kontrol positif Pf5, Q2-87, dan Q8-R1 teramplifikasi (750 bp),
Pseudomonas sp. CRB-80 teramplifikasi (900 bp). M = marker 1 kb
ladder (Fermentas) ………. 52
8 Amplifikasi gen fenazin dengan primer PHZX/PHZY, kontrol positif DF190 dan DF202 teramplifikasi (1.1 kb); tetapi tidak teramplikasi pada Pseudomonas sp. CRB. M = marker 1 kb ladder
9 Amplifikasi gen fenazin dengan primer PHZ1/PHZ2, kontrol positif DF190 dan DF202 teramplifikasi (1.4 kb), pada Pseudomonas sp. CRB (16, 17, 44, 80, 82, 102) teramplifikasi menghasilkan pita-pita yang tidak spesifik. M = marker 1 kb ladder (Invitrogen) ... 53
10 Amplifikasi gen pioluteorin dengan primer pltBf/pltBr, kontrol positif DF190 and DF202 teramplifikasi (773 bp), pada
Pseudomonas sp. CRB (16, 17, 44, 80, 82, 102) teramplifikasi menghasilkan pita-pita yang tidak spesifik. M = marker 1 kb ladder
(Invitrogen) ... 53
11 Amplifikasi gen pirolnitrin dengan primer PRND1/PRND2, kontrol positif DF190 dan DF202 teramplifikasi (800 bp); tetapi tidak teramplifikasi pada Pseudomonas sp. CRB. M = marker 1 kb ladder
(Invitrogen) ………. 54
12 Amplifikasi gen pirolnitrin dengan primer prnCf/prnCr,
Pseudomonas sp. CRB (16, 17, 80, and 102) menghasilkan pita-pita tidak spesifik. Gen target dari Pf5 teramplifikasi menghasilkan 719 bp. M = Marker 1 kb ladder(Fermentas) ……….. 54 13 Optimasi suhu penempelan primer PHZ1/PHZ2 pada 54, 55, 56, 57,
58°C untuk Pseudomonas sp. CRB 16 (A), 80 (B), dan 102 (C).
Pseudomonas sp. CRB 16 menunjukkan pita tunggal (~2000 bp) pada 56ºC, 80 (~1600 bp) pada 58ºC dan 102 pada 57ºC. M =
marker 1 kb ladder (Invitrogen) ... 55
14 Amplifikasi gen fenazin dengan primer PHZ1/PHZ2, lajur 1 bakteri kontrol positif P. aureofaciens 30-84, lajur 2 P. chlororaphis
DF190, lajur 3 DF202 masing-masing teramplifikasi (1.4 kb), lajur 4, 5 Pseudomonas sp. CRB-80, lajur 6, 7 CRB-102 teramplifikasi (1.6 kb). M = marker 1 kb ladder (Fermentas) ... 56
15 Koloni PCR langsung amplifikasi DNA sisipan PHZ1/PHZ2 (~1 kb) dan (~2 kb) pada Pseudomonas sp. CRB-16 (A). Amplifikasi DNA sisipan PHZ1/PHZ2 (1.6 kb) pada Pseudomonas sp. CRB-80 (B, lajur 1-5), pada Pseudomonas sp. CRB-102 (B, lajur 6-10) M = marker 1kb ladder (Invitrogen) ... 57
16 Koloni putih biru sel transforman EPI 300 di medium selektif LA ampisilin/IPTG/X-Gal (A). Gambar yang diperbesar (B) …………..
57
17 Koloni PCR: amplifikasi DNA sisipan PHZ1/PHZ2 (~1.6 kb) pada
18 Busuk akar yang disebabkan oleh cendawan patogen di tabung reaksi dengan medium agar-agar air. Sclerotium rolfsii (A),
Fusarium oxysporum (B), Rhizoctonia solani (C), kontrol tanpa infeksi cendawan patogen (D) ... 69
19 Gejala penyakit karena cendawan patogen tular tanah: busuk kecambah karena R. solani (1), karena S. rolfsii (2); kerusakan kotiledon dan hipokotil karena R. solani (3) karena S. rolfsii (4) dan kerusakan kotiledon karena F. oxysporum (5-6) ... 70
19 (lanjutan) Gejala penyakit karena cendawan patogen tular tanah: kerusakan kotiledon dan tunas daun karena F. oxysporum (7), karena
R. solani (8); busuk pada pangkal batang yang menyebabkan layu karena S. rolfsii (9a, 9b, 10) ... 71
19 (lanjutan) Gejala penyakit karena cendawan patogen tular tanah: beberapa tanaman yang mengalami infeksi cendawan yang berlanjut menunjukkan gejala penghambatan pertumbuhan (stunted) di antara tanaman yang sehat (11). Tanaman sehat, tidak menunjukkan adanya
gejala penyakit (12) ……… 72
19 (lanjutan) Tanaman sehat; tanaman yang bergejala busuk akar dan penghambatan pertumbuhan saat tanaman dicabut dari tanahnya, pada perlakuan asai penekanan penyakit, kecambah kedelai umur 7 hari. A. Tanah steril; B. Tanah non steril ... 73
20 Kurva pertumbuhan Pseudomonas sp. CRB-17, CRB-80, CRB-102 tipe liar dan mutan resisten rifampisin (Rifr) ... 85
21 Morfologi koloni Pseudomonas sp. CRB-17 (Rifr), biakan umur 48
jam pada medium King’s B + rifampisin 100 µg/ml (A) dan tipe
liarnya pada medium King’s B (B). Koloni bentuk bulat berwarna kuning fluoresen ... 86
22 Antagonisme Pseudomonas sp. CRB-80 Rifr (mutan resisten rifampisin) terhadap cendawan S. rolfsii (A); Pseudomonas sp. CRB-17 Rifr terhadap F. oxysporum (B) dan Pseudomonas sp.
CRB-102 Rifr terhadap R. solani (C) di cawan Petri ... 87
BAB 1
PENDAHULUAN UMUM
Latar Belakang
Proteksi tanaman modern sangat bergantung pada penggunaan bahan
kimia untuk mengatasi hama dan penyakit (Cook et al. 1996). Akan tetapi, meningkatnya perhatian terhadap kesehatan dan kerusakan lingkungan yang
disebabkan oleh penggunaan bahan kimia untuk pertanian meningkatkan
kebutuhan yang lebih besar terhadap pertanian yang berkelanjutan. Tanah yang
menekan penyakit (diasease suppressive soil) adalah tanah yang mampu menekan fitopatogen untuk bertahan lebih lama, atau fitopatogen ada tetapi gagal untuk
menginduksi gejala penyakit yang parah pada tanaman budidaya yang rentan
terhadap patogen (Schroth & Hancock 1982). Meskipun jarang, fenomena ini,
telah diketahui dengan baik dan bukti-bukti yang kuat menunjukkan bahwa
penekanan penyakit merupakan hasil dari keberadaan rizobakteria antagonis.
Mekanisme bakteri antagonis rizosfer memediasi terjadinya penekanan penyakit
telah diteliti secara luas (Cook & Baker 1996; Bloemberg & Lugtenberg 2001;
Haas & Keel 2003).
Penyakit busuk kecambah, busuk akar oleh Rhizoctonia solani, hawar batang dan layu oleh Sclerotium rolfsii masih disebut sebagai penyakit utama tanaman kedelai di Indonesia, selain penyakit karat karena Phakospora pachyrhizi, penyakit pustul bakteri Xanthomonas axonopodis pv glycines, penyakit
antrachnosa Colletotrichum dematium var truncatum dan C. destructivum atau penyakit karena mosaik virus (Puslitbang Tanaman Pangan 2009; Balai
Pengkajian Teknologi Pertanian, Sumatera Utara 2009). Wrather et al. (2001) menyatakan bahwa penyakit busuk kecambah karena Rhizoctonia dan Fusarium
spp, busuk akar karena Fusarium spp dan hawar batang karena S. rolfsii
merupakan penyakit yang menyebabkan kehilangan panen kedelai yang cukup
besar yaitu sekitar 12.5 ribu ton dari total kehilangan panen karena penyakit yang
jumlahnya 147.5 ribu ton di Indonesia pada tahun 1998. Kehilangan panen kedelai
terbesar di Indonesia disebabkan karena penyakit karat sebesar 60 ribu ton dan
2
meningkat dari waktu ke waktu, tetapi kehilangan panenan karena penyakit lain
tidak berubah. Berdasarkan luas daerah penyebaran dan tingkat serangan dapat
dikemukakan bahwa karat daun, bercak daun, downy mildew, bakteri pustul dan
S. rolfsii berstatus penting. Cendawan tular tanah R. solani juga masih menunjukkan intensitas serangan 15.5% dari total serangan penyakit (Balai
Penelitian Tanaman Kacang-kacangan dan Umbi-umbian 2005).
Pengendalian penyakit tanaman kedelai diperlukan untuk memberikan
pencegahan kehilangan panen. Pengendalian penyakit yang dilakukan di
Indonesia terutama adalah pengendalian penyakit karat daun dengan fungisida
Mancozeb (Dithane 45), penyakit busuk batang dan akar menggunakan jamur
antagonis Thrichoderma harzianum, sedangkan pengendalian virus dengan mengendalikan vektornya yaitu serangga hama kutu dengan insektisida Decis
(Balai Pengkajian Teknologi Pertanian, Sumatera Utara 2009; Balai Penelitian
Tanaman Kacang-kacangan dan Umbi-umbian 2011). Di beberapa negara lain
seperti di Amerika dan Brazil, untuk melindungi biji dan kecambah kedelai
terhadap serangan Rhizoctonia dan Fusarium dilakukan dengan menggunakan
fungisida. Produk yang mengandung carboxin, pentachloronitrobenzene (PCNB) atau fludioxonil, seperti ApronMaxx, Delta-Coat AD, Maxim 4FS atau berbagai produk Vitavax, dapat melindungi biji dan kecambah terhadap Rhizoctonia
(Bradley 2003). Beberapa fungisida yang mengandung bahan aktif carbendazim
dan carboxin serta thiram direkomendasikan sebagai perlakuan benih kedelai untuk mengurangi patogen biji dan juga serangan patogen tanah seperti R. solani
dan Fusarium spp., terutama pada kondisi kering yang dapat memperlambat munculnya kecambah. Patogen tersebut dapat mengurangi populasi tanaman
(Embrapa 2008).
Perlakukan biji kedelai dengan fungisida dapat digunakan untuk
melindungi infeksi beberapa cendawan patogen terhadap kecambah, memperbaiki
populasi tanaman dan mengurangi penyebaran penyakit yang terbawa biji. Akan
tetapi, fungisida untuk perlakuan benih pada kedelai mempunyai efek negatif
terhadap inokulan Rhizobium. Sebagian besar fungisida mengurangi viabilitas
Rhizobium (Fox et al. 2009). Fungisida Captan dan PCNB mengurangi daya hidup
3
dengan biji yang diinokulasi Rhizobium tanpa perlakuan fungisida (Bradley 2003). Fungisida carbendazim yang ditambah thiram dan carboxin yang ditambah thiram, keduanya mengurangi nodulasi oleh Bradyrhizobium elkanii. Fungisida
carbendazim dengan thiram mengurangi nodulasi sekitar 50% dan panen biji lebih dari 20% (sekitar 700 kg/ha), pada perlakuan inokulasi dengan B. elkanii galur
SEMIA 587 (Zilli et al. 2009). Oleh karenanya, perhatian harus diberikan dalam pemakaian fungisida sebagai perlakuan benih pada kedelai. Fungisida dapat
menjadi inhibitor potensial dalam nodulasi tanaman kedelai, sebagai akibatnya
adalah gangguan perkembangan tanaman dan penurunan hasil panen.
Pseudomonas, Bacillus dan Streptomyces ialah bakteri yang penting dari komunitas bakteri di rizosfer. Keberadaannya selalu berhubungan dengan
penekanan penyakit. Kemampuan kelompok Pseudomonas untuk menekan pertumbuhan mikrob patogen tanah tergantung pada kemampuannya untuk
menghasilkan antibiotik seperti pioluteorin, pirolnitrin, fenazin (Chin-A-Woeng et al. 2003) dan 2,4-diacetylphloroglucinol (DAPG) (de Souza et al. 2003). Galur-galur dari Pseudomonas fluorescens penghasil senyawa anticendawan merupakan
agen biokontrol yang penting untuk fitopatogen tular tanah. Beberapa
Pseudomonas sp. juga menghasilkan hidrogen sianida (Haas & Keel, 2003), senyawa berberat molekul rendah yang disebut siderofor (O‟Sullivan & O‟Gara
1992; Loper & Henkels 1999) atau enzim kitinase dan glukanase (Saad 2006).
Pioluteorin adalah antibiotik poliketida terklorinasi, dihasilkan oleh
rizobakteria P. fluorescens Pf-5 (Howel & Stipanovic 1980). Pioluteorin menunjukkan antagonis terhadap Pythium ultimum dan mampu menekan penyakit busuk kecambah pada benih tanaman kapas yang disebabkan oleh P. ultimum. Sepuluh gen yang terlibat dalam sintesis pioluteorin telah dideskripsikan, terdiri
dari delapan gen struktural yaitu pltLABCDEFG dan dua gen regulator transkripsi yaitu pltR dan pltM (Nowak-Thompson et al. 1999).
Pirolnitrin [3-chloro-4-(2’-nitro-3’chlorophenyl) pyrrole] dideskripsikan pertama kali pada Burkholderia pyrrocinia (Arima et al. 1964). Selanjutnya, pirolnitrin ditemukan pada Pseudomonas, Enterobacter, Myxococcus dan Serratia
4
penyakit secara alami terhadap R. solani (Garbeva et al. 2004). Bakteri endofit tanaman tebu penghasil pirolnitrin, Burkholderia cepacia, menunjukkan penghambatan terhadap cendawan patogen Fusarium moniliforme (Mendes et al. 2007). Empat gen yang terlibat dalam biosintesis pirolnitrin prnABCD telah dideskripsikan oleh Hammer et al. (1997). Fungsi masing-masing produk gen
prnABCDdijelaskan oleh Kirner et al. (1998).
Antibiotik fenazin yang dihasilkan oleh galur biokontrol P. fluorescens 2-79 dan P. aureofaciens 30-84 merupakan faktor utama dalam kemampuannya menghambat pertumbuhan cendawan patogen akar (Mazzola et al. 1992). Hampir semua jenis fenazin mempunyai spektrum luas terhadap berbagai spesies bakteri
dan cendawan. Aktivitas ini berhubungan dengan senyawa fenazin yang terlibat
dalam transformasi oksidasi-reduksi sehingga menyebabkan terjadinya akumulasi
radikal superoksida yang bersifat racun pada sel target (Hassett et al. 1995; Price-Whelan et al. 2006). Kelompok gen yang berperan dalam biosintesis fenazin dipaparkan secara lengkap oleh Mavrodi et al. (1998). Gen yang berperan dalam biosintesis fenazin pada P. fluorescens 2-79 terdiri dari 7 gen yang disebut sebagai
phzABCDEFG. Produk gen phzC, phzD dan phzE mempunyai kemiripan dengan enzim-enzim dalam metabolisme asam sikimat dan asam korismat dan bersama
dengan phzF dibutuhkan untuk produksi phenazine 1 carboxylic acid (PCA).
PhzG mirip dengan pirodoksamin-5‟-fosfat oksidase dan merupakan sumber
kofaktor enzim-enzim untuk sintesis PCA. Produk gen phzA dan phzB sangat mirip satu dengan yang lain dan diperkirakan terlibat dalam stabilisasi komplek
multienzim untuk sintesis PCA.
Beberapa penelitian telah mendemonstrasikan bahwa beberapa
Pseudomonas sp. dengan kemampuannya menghasilkan metabolit anticendawan DAPG dapat diisolasi dengan frekuensi yang tinggi dari tanah yang menekan
penyakit busuk akar hitam (black root rot) pada tanaman tembakau (Keel et al. 1992) dan penyakit take-all pada tanaman gandum (Raaijmakers et al. 1997). Produksi antibiotik DAPG dianggap sebagai metabolit anticendawan yang penting
5
untuk sintesis monoacetylphloroglucinol (MAPG) yang merupakan prekursor DAPG dari asetil-koenzim A.
Ketersediaan gen biosintesis senyawa anticendawan yang telah diklon dan
disekuen akan memudahkan untuk mengembangkan primer dan probe. Primer
dan probe spesifik dapat digunakan untuk mendeteksi adanya Pseudomonas spp. penghasil anticendawan (de Souza & Raaijmakers 2003). Dengan bantuan metode
molekuler ini dapat mempercepat deteksi galur-galur penghasil senyawa
anticendawan yang lebih teradaptasi pada kondisi tanah lokal atau pada sistem
tanaman-patogen tertentu (Raaijmakers et al. 1997). Oleh karenanya, pengembangan bakteri antagonis yang menghasilkan senyawa anticendawan
sebagai agen biokontrol sangat menjanjikan untuk aplikasinya di bidang pertanian.
Di Indonesia, bakteri antagonis dari rizosfer tanaman kedelai asli penghasil
senyawa anticendawan belum banyak dilaporkan dan potensinya sebagai agen
biokontrol perlu diteliti lebih lanjut. Meskipun tujuan utamanya ialah
mendapatkan agen biokontrol, penting juga untuk memahami secara molekuler
gen penyandi biosintesis senyawa anticendawan pada Pseudomonas sp. Informasi
tentang gen yang terlibat dalam biosintesis senyawa anticendawan dapat
digunakan untuk mengembangan sifat-sifat biokontrol secara genetik lebih lanjut
atau mentransfer gen penyandi biosintesis senyawa anticendawan ke galur
penerima.
Pemilihan kandidat agen biokontrol akan lebih leluasa jika keragaman
genetik di antara isolat-isolat bakteri antagonis tinggi. Kelompok bakteri yang
mempunyai tingkat keragaman genetik tinggi di dalam populasinya akan lebih
banyak variasi untuk dipilih di antaranya yang paling sesuai atau dikembangkan
semuanya sekaligus. Lebih jauh lagi, pengetahuan keragaman genetik di antara
kelompok bakteri antagonis dapat membantu untuk mengidentifikasi isolat yang
mempunyai kemampuan menekan cendawan patogen dan kemampuan menjaga
keberadaanya di rizosfer. Hasil penelitian yang menunjukkan sifat-sifat agen
biokontrol yang unggul yang dimiliki oleh isolat-isolat Pseudomonas sp. dari rizosfer tanaman kedelai diharapkan dapat digunakan untuk melindungi tanaman
kedelai dari serangan cendawan patogen tular tanah dan meningkatkan produksi
6
Sifat lain yang harus dimiliki oleh bakteri biokontrol ialah
kemampuannya mengkolonisasi rizosfer. Kemampuan mengkolonisasi rizosfer
telah dipertimbangkan sebagai faktor utama yang menentukan efektif dan efisien
inokulum bakteri biokontrol untuk mengendalikan penyakit dan peningkatan
produksi tanaman (Compant et al. 2005). Keberhasilan mengkolonisasi rizosfer dan bertahan hidup oleh bakteri biokontrol telah didemonstrasikan sebagai suatu
persyaratan utama jika bakteri tersebut akan diaplikasikan pada tanaman
(Chin-A-Woeng et al. 2000). Kemampuan bakteri mencapai jumlah populasi yang cukup di rizosfer sangat penting dalam memberikan pengaruh sifat-sifat bakteri yang
menguntungkan pada kesehatan tanaman.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan kandidat agen biokontrol
terhadap cendawan patogen tular tanah Sclerotium rolfsii, Fusarium oxysporum
atau Rhizoctonia solani pada tanaman kedelai. Tujuan penelitian tersebut dicapai melalui 5 tahapan penelitian sebagai berikut:
1. Identifikasi dan penapisan karakter biokontrol isolat-isolat dari rizosfer
tanaman kedelai.
2. Analisis keragaman genetik di antara isolat-isolat antagonis terhadap
cendawan patogen tular tanah S. rolfsii, F. oxysporum atau R. solani.
3. Deteksi dan karakterisasi molekuler gen penyandi senyawa anticendawan
pioluteorin, pirolnitrin, fenazin atau 2,4-diasetilfloroglusinol isolat-isolat yang mempunyai kemampuan menghambat pertumbuhan cendawan
patogen tular tanah secara in vitro.
4. Uji penekanan penyakit yang disebabkan cendawan patogen tular tanah
S. rolfsii, F. oxysporum atau R. solani oleh isolat-isolat antagonis in planta. 5. Kolonisasi rizosfer oleh isolat-isolat antagonis menggunakan penanda
7
Hipotesis
Ditemukan isolat-isolat Pseudomonas sp. dari rizosfer tanaman kedelai yang mempunyai karakter biokontrol, menunjukkan keragaman genetik tinggi,
terbukti mempunyai gen yang mengkode biosintesis senyawa anticendawan,
memberikan penekanan penyakit yang disebabkan cendawan patogen tular tanah
in planta serta mempunyai kemampuan bertahan dan sifat kompetitif di rizosfer.
Manfaat Penelitian
Tersedia isolat dan informasi mengenai karakter Pseudomonas sp. yang diisolasi dari rizosfer tanaman kedelai sebagai salah satu kelompok bakteri
berpotensi sebagai agen biokontrol terhadap cendawan patogen tular tanah.
Pseudomonas sp. yang mempunyai karakter biokontrol, menunjukkan penekanan penyakit in planta, selanjutnya dapat digunakan atau diaplikasikan sebagai agen hayati untuk menekan penyakit yang disebabkan oleh cendawan patogen tular
tanah. Pemakaian agen hayati sebagai biopestisida akan mendukung pertanian
yang berkelanjutan.
Novelty / Temuan baru
Penemuan isolat Pseudomonas sp. asli dari rizosfer tanaman kedelai
bersifat biokontrol terhadap cendawan patogen tular tanah S. rolfsii, F. oxysporum
atau R. solani untuk tanaman kedelai. Pseudomonas sp. CRB ini mempunyai sifat-sifat biokontrol antara lain adalah antagonis terhadap cendawan patogen tular
tanah in vitro, menghasilkan siderofor, kitinase atau hidrogen sianida, memberikan penekanan penyakit dengan mengurangi jumlah tanaman yang
bergejala in planta di tanah steril maupun non steril. Keragaman genetik di antara isolatnya merupakan sumbangan untuk deposit gen di koleksi kultur yang dapat
8
Kerangka Penelitian
Penapisandan bioasai sifat-sifat biokontrol
Uji penekanan penyakit
in planta
Deteksi dan karakterisasi gen biosintesis anticendawan
Melindungi tanaman kedelai dari penyakit cendawan tular tanah, meningkatkan kesehatan tanaman dan produksi tanaman
(1). PCR dengan primer spesifik (2). Kloning
(3). Sekuensing
Kolonisasi rizosfer
(1) Penandaan dengan resisten rifampisin melalui mutasi spontan
(2) Laju pertumbuhan spesifik mutan Rifr
dibanding tipe liar
(3) Jumlah bakteri di daerah perakaran
Isolat dengan sifat biokontrol dan memberikan penekanan
penyakit Analisis keragaman genetik
isolat-isolat antagonis Koleksi bakteri asli rizosfer
tanaman kedelai
(1) Uji hipersensitivitas
(2) Uji in vitro penghambatan cendawan patogen (3) Uji produksi anticendawan lain; siderofor,
kitinase, hidrogen sianida
(4) Seleksi isolat-isolat yang menunjukkan antagonis
terhadap satu atau lebih cendawan patogen target
(1). Berdasarkan ARDRA
(2). Berdasarkan sekuen gen 16S-rRNA
(1). Uji patogenitas cendawan patogen
9
BAB 2
IDENTIFIKASI DAN SELEKSI KARAKTER BIOKONTROL
ISOLAT BAKTERI DARI RIZOSFER TANAMAN KEDELAI
Pendahuluan
Galur Pseudomonas tertentu merupakan komponen biologi pada tanah pertanian yang mampu menekan penyakit yang disebabkan oleh cendawan
patogen pada tanaman budidaya. Galur Pseudomonas tertentu yang mampu
menekan penyakit adalah galur Pseudomonas yang mempunyai sifat-sifat biokontrol. Karakter biokontrol galur Pseudomonas terhadap patogen tanaman dan mikroba deleterious ditunjukkan dengan menghasilkan antibiotik seperti pioluteorin, pirolnitrin, phenazine 1-carboxylic acid (PCA) dan
2,4-diacetylphloroglucinol (DAPG) (Jayaswal et al. 1993; Raaijmakers et al. 1997; Angulló 2001), senyawa alelokimia termasuk di dalamnya adalah siderofor
pengkelat besi (Alvarez et al. 1994), enzim-enzim seperti kitinase dan glukanase (Cattelan et al. 1999; Saad 2006) yang bersifat litik terhadap dinding sel cendawan patogen dan hidrogen sianida (Haas & Keel 2003).
Pada kondisi besi terbatas, bakteri biokontrol menghasilkan senyawa
berberat molekul rendah yang disebut siderofor untuk berkompetisi mendapatkan
ion feri. Meskipun berbagai siderofor bakteri biokontrol berbeda dalam
kemampuannya untuk mengambil besi, secara umum, siderofor bakteri
menghabiskan besi bagi cendawan patogen karena siderofor bakteri mempunyai afinitas yang lebih tinggi dibandingkan dengan siderofor cendawan (O‟Sullivan & O‟Gara 1992; Loper & Henkels 1999). Pada kondisi tidak kekurangan besi, siderofor dapat berperan dalam induksi resistensi sistemik bagi tanaman
(Ramamoorthy et al. 2001).
Beberapa mikrob menghasilkan enzim yang dapat menghidrolisis dinding
sel cendawan. Kemampuan menghasilkan kitinase ekstraseluler penting bagi
Serratia marcescens dalam bertindak sebagai antagonis terhadap Sclerotium rolfsii (Ordentlich et al. 1988). Kitinase dan laminarinase ekstraseluler yang disintesis oleh Pseudomonas stutzeri mampu melisiskan miselia Fusarium solani
10
sitokrom c oksidase dan beberapa metaloenzim yang lainnya, oleh karenanya
patogen menderita karena efek merusak dari hidrogen sianida tersebut (Blumer &
Haas 2000).
Aktivitas biokontrol juga dapat ditunjukkan melalui kompetisi nutrisi dan
mikrohabitat antara bakteri biokontrol dan fitopatogen. Dengan kemampuannya
berkompetisi dapat meningkatkan secara nyata kesehatan dan pertumbuhan
tanaman yang dibuktikan dengan meningkatnya munculnya tunas, vigor dan
produksi tanaman. Detoksifikasi dan degradasi faktor-faktor virulen dan induksi
resistensi sistemik adalah mekanisme aksi tidak langsung bakteri biokontrol
(Persello-Cartieaux 2003; Compant et al. 2005).
Tantangan untuk mengembangkan bakteri sebagai agen hayati untuk
aplikasi komersial sebagai inokulan biokontrol mengharuskan adanya prosedur
seleksi dan penapisan yang efektif, sehingga kandidat mikrob yang menjanjikan
dapat ditemukan dan dikelola kemampuan lebih lanjut. Strategi efektif untuk
menyeleksi dan menapis awal sangat diperlukan, seperti pertimbangan spesifikasi
tanaman inang, adaptasi terhadap kondisi tanah tertentu, kemampuan melawan
patogen di tempat di mana mikrob tersebut diisolasi dan bagaimana bioasai untuk
seleksi dan penapisan tersebut dilakukan (Nelson 2004).
Tujuan Penelitian
1. Mengidentifikasi isolat-isolat Pseudomonas sp. dari rizosfer tanaman kedelai.
2. Menapis isolat-isolat Pseudomonas sp. dari rizosfer tanaman kedelai yang mempunyai karakter biokontrol terhadap cendawan patogen tular tanah
Sclerotium rolfsii, Fusarium oxysporum dan Rhizoctonia solani.
Bahan dan Metode
Identifikasi isolat bakteri. Bakteri diisolasi dari rizosfer tanaman kedelai di kawasan penanaman kedelai di Cirebon, Jawa Barat. Sebanyak 81 isolat yang
telah diisolasi digunakan dalam penelitian ini. Identifikasi morfologi dan
11
Bacteriology adalah Gram negatif, bentuk batang, motil, aerobik, katalase positif, oksidase positif (Holt et al. 1994). Microgen™ (GNA dan GNB) yang berisi 24 substrat biokimia standar (Microgen Bioproducts Ltd, United Kingdom) digunakan untuk melengkapi uji fisiologis isolat-isolat yang mempunyai karakter
biokontrol. Permutasi substrat yang dimetabolisme, selanjutnya diintepretasikan
menggunakan software Microgen Identification System untuk mengidentifikasi bakteri yang diuji.
Antagonisme terhadap cendawan patogen. Antagonisme bakteri terhadap cendawan patogen tular tanah S. rolfsii, F. oxysporum dan R. solani dilakukan dengan menggunakan metode kultur ganda dalam medium Potato Dextrosa Agar
(PDA). Potongan agar berbentuk bulat (diameter 4 mm) yang diambil dari kultur
cendawan yang sedang aktif tumbuh, diletakkan di tengah-tengah cawan Petri.
Selanjutnya, bakteri uji digoreskan pada salah satu sisinya berjarak 3 cm dari titik
tengah cawan Petri (Anjaiah et al. 1998). Adanya penghambatan pertumbuhan diamati selama 3 hari untuk S. rolfsii, 5 hari untuk F. oxysporum dan 2 hari untuk
R. solani. Isolat yang bersifat antagonis akan menunjukkan penghambatan pertumbuhan konsentris cendawan yang ada di cawan Petri. Besarnya persentase
penghambatan pertumbuhan radial cendawan oleh bakteri dihitung menggunakan
rumus 1-(a/b) x 100%, a menunjukan jarak antara titik pusat cendawan ke arah
isolat bakteri, b menunjukkan jarak antara titik pusat cendawan ke sisi yang
berlawanan tanpa bakteri (Dikin et al. 2006).
Produksi siderofor. Produksi siderofor oleh isolat-isolat dideteksi dengan menggunakan media agar-agar Chrome Azurol S (CAS) (Alexander & Zuberer 1991). Larutan 1 (larutan indikator Fe-CAS) mengandung 10 ml (1mM
FeCl3.6H2O di dalam 10 mM HCL), 50 ml larutan CAS (1.21 mg ml-1), dan 40 ml
larutan hexadecyl-trimetylammonium bromide (HDTMA) (1.82 mg ml-1). Larutan 2 merupakan larutan bufer, disiapkan dengan melarutkan 30.24 g peperazine-N,N’-bis 2-ethanesulfonic acid (PIPES) ke dalam 750 ml larutan garam (3 g KH2PO4, 5 g NaCl, 10 g NH4Cl, 20 mM MgSO4, 1 mM CaCl2). Akuades
12
hingga 6.8 dengan 50% KOH, kemudian 20 g agar-agar bacto ditambahkan sebelum disterilisasikan. Larutan 3 mengandung 2 g glukosa, 2 g manitol dan
mikro elemen (493 mg MgSO4.7H2O, 11 mg CaCl2, 1.17 mg MnSO4.H2O, 1.4 mg
H3BO3, 0.04 mg CuSO4.5H2O, 1.2 mg ZnSO4.7H2O dan 1.0 mg NaMoO4.2H2O) di
dalam 70 ml akuades. Larutan 4 berupa 30 ml 10% (w/v) casamino acid yang disterilkan dengan membran milipore (0.20 µm). Media ini dibuat dengan
mencampurkan larutan 2 dan 4 pada suhu 50 C setelah sterilisasi, kemudian
ditambahkan larutan 3 dan larutan 1 secara perlahan-lahan dan dilakukan
homogenisasi dengan menggunakan magnetic stirer. Isolat yang telah diremajakan terlebih dahulu, diuji dengan cara ditotol atau digores pada media
agar-agar CAS dengan dua ulangan. Isolat yang menghasilkan siderofor akan
membentuk zona berwarna oranye di sekitar koloni setelah diinkubasi semalam.
Produksi kitinase. Produksi kitinase ditentukan berdasarkan metode yang dijelaskan oleh Cattelan et al. (1999). Medium sintetik terdiri dari (gL-1): koloid kitin dari cangkang kepiting (Pusat Penelitian Sumberdaya Hayati dan
Bioteknologi [PPSHB] IPB) 0.8; NH4NO3 0.78; K2HPO4 0.20; MgSO4.7H2O
0.20; CaCl2 0.06; NaCl 0.10; Na2MoO4.2H2O 0.002; ZnSO4.7H2O 0.00024;
CuSO4.5H2O 0.00004; CoSO4.7H2O 0.010; MnSO4.4H2O 0.003; Na2FeEDTA
0.028; H3BO3 0.005 dan agar-agar 15. Magnesium sulfat dan CaCl2 disterilkan
secara terpisah dan ditambahkan ke medium. Biotin (5µgL-1) dan ρ-aminobenzoic acid (10µgL-1) disterilkan menggunakan membran milipore (0.20 µm) dan ditambahkan ke dalam medium. Zona bening yang terbentuk di sekeliling koloni
menunjukkan adanya pelarutan kitin oleh bakteri penghasil kitinase.
Produksi HCN dengan alkali pikrat. Produksi hidrogen sianida dapat diketahui dengan menggunakan indikator alkali pikrat (Alvarez et al. 1994; Angulló 2001; Ramette et al. 2003). Produksi sianida oleh isolat Pseudomonas dapat dideteksi dengan menginokulasikannya dalam medium agar miring King‟B yang ditambahkan 4.4 g/L glisin. Kultur bakteri yang berumur 24 jam dipindahkan ke
masing-masing tabung reaksi dan diberikan sepotong kertas saring Whatman No.1
13
karbonat (Na2CO3), dibagian dalam tabung reaksi. Kultur bakteri di dalam tabung
reaksi diinkubasi pada suhu 28ºC selama 3 sampai 5 hari. Pengujian dilakukan
dalam dua ulangan. Perubahan warna dari warna kuning menjadi oranye
kecoklatan pada kertas saring menunjukkan adanya produksi sianida.
Hasil
Identitas isolat-isolat dari rizosfer tanaman kedelai
Identitas total 81 isolat dari rizosfer tanaman kedelai adalah genus
Pseudomonas berdasarkan karakter morfologi dan fisiologis menurut Bergey’s
Manual of Determinative Bacteriology 9th edition (Holt et al. 1994). Berdasarkan hirarkinya isolat-isolat tersebut termasuk dalam Kategori I: Gram negatif yang
mempunyai dinding sel; Group 4: Gram negatif aerobik/mikroaerofilik batang dan
bulat; Sub Group 4A: Aerobik; Genus Pseudomonas: Gram negatif, bentuk batang, motil, aerobik, katalase positif, oksidase positif. Oleh karenanya, semua isolat
tersebut termasuk dalam genus Pseudomonas. Selanjutnya, semua isolat diberi
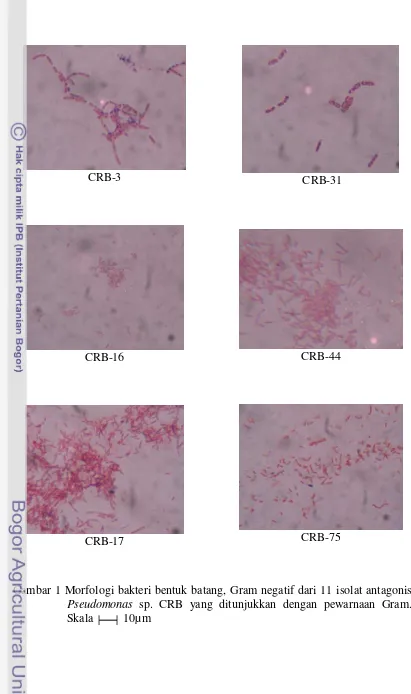
nama sebagai Pseudomonas sp. CRB, sesuai dengan nama tempat asal isolat yaitu Cirebon (CRB) dan nomer isolatnya. Sifat morfologi Gram negatif, bentuk batang
dari 11 isolat dapat dilihat pada Gambar 1.
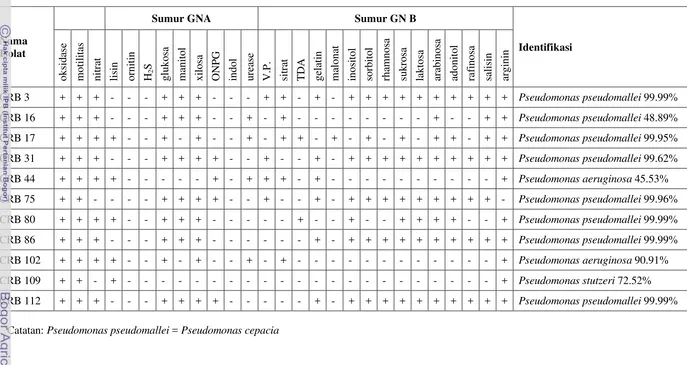
Identifikasi lebih lanjut berdasarkan sifat fisiologis menggunakan kit
Microgen™ GNA dan GNB dilakukan untuk 11 isolat yang mempunyai karakter
biokontrol. Sebelas isolat tersebut adalah Pseudomonas sp. CRB-3, CRB-16, CRB-17, CRB-31, CRB-44, CRB-75, CRB-80, CRB-86, CRB-102, CRB-109 dan
CRB-112. Identifikasi menggunakan kit Microgen™ GNA dan GNB didasarkan atas substrat biokimia yang dimetabolisme oleh masing-masing isolat. Hasilnya
CRB-3
CRB-16
CRB-17
CRB-31
CRB-44
[image:33.595.99.510.81.775.2]CRB-75
Gambar 1 Morfologi bakteri bentuk batang, Gram negatif dari 11 isolat antagonis
Pseudomonas sp. CRB yang ditunjukkan dengan pewarnaan Gram. Skala 10µm
CRB-80
CRB-86
CRB-102
CRB-109
CRB-112
Gambar 1 (lanjutan) Morfologi bakteri bentuk batang, Gram negatif dari 11 isolat antagonis Pseudomonas sp. CRB yang ditunjukkan dengan pewarnaan Gram. Skala 10µm
[image:34.595.106.511.95.815.2]Tabel 1 Identifikasi Pseudomonas sp. CRB yang mempunyai karakter biokontrol menggunakan kit fisiologis Microgen™. KitMicrogen™
terdiri dari 24 sumur (GNA dan GNB) yang berisi substrat biokimia standar.
Nama Isolat
Sumur GNA Sumur GN B
Identifikasi oksi d as e m ot il it as ni tr at li si n or ni ti n H2 S gl uko sa m an it o l xi lo sa O N PG indo l ur ea se V .P. si tr at TD A gel at in m al ona t inos it o l sor b it o l rha m nos a sukr o sa lak tosa ar ab inos a adoni to l raf inos a sa li si n ar gi ni n
CRB 3 + + + - - - + + + - - - + + - + - + + + + + + + + + + Pseudomonas pseudomallei 99.99%
CRB 16 + + + - - - + + + - - + - + - - - + - - + + Pseudomonas pseudomallei 48.89%
CRB 17 + + + + - - + - + - - + - + + - + - + - + - + + - + + Pseudomonas pseudomallei 99.95%
CRB 31 + + + - - - + + + + - - + - - + - + + + + + + + + + + Pseudomonas pseudomallei 99.62%
CRB 44 + + + + - - - + - + + + - + - - - + Pseudomonas aeruginosa 45.53%
CRB 75 + + - - - - + + + + - - + - - + - + + + + + + + + + - Pseudomonas pseudomallei 99.96%
CRB 80 + + + + - - + + + - - - + - - + - - + + + + - - + Pseudomonas pseudomallei 99.99%
CRB 86 + + + - - - + + + - - - + - + + + + + + + + + + Pseudomonas pseudomallei 99.99%
CRB 102 + + + + - - + - + - - + - + - - - + Pseudomonas aeruginosa 90.91%
CRB 109 + + - + - - - + Pseudomonas stutzeri 72.52%
CRB 112 + + + - - - + + + + - - - + - + + + + + + + + + + Pseudomonas pseudomallei 99.99%
Catatan: Pseudomonas pseudomallei = Pseudomonas cepacia
17
Antagonisme Pseudomonas sp. CRB terhadap cendawan patogen tular tanah
Sebelas isolat dari 81 isolat Pseudomonas sp. CRB yang diisolasi dari rizosfer tanaman kedelai telah diseleksi mempunyai sifat-sifat yang dapat
berperan sebagai agen biokontrol. Sifat-sifat biokontrol yang dipunyai di
antaranya adalah menunjukkan penghambatan pertumbuhan radial cendawan
patogen tular tanah S. rolfsii, F. oxysporum atau R. solani pada media PDA di cawan Petri (Gambar 2). Sebelas Pseudomonas sp. CRB menunjukkan penghambatan pertumbuhan radial terhadap cendawan patogen berkisar antara
11.1-60%, menghasilkan senyawa anticendawan lainnya seperti siderofor, enzim
kitinase dan hidrogen sianida (Tabel 2).
Gambar 2 Antagonis in vitro Pseudomonas sp. CRB-80 terhadap Sclerotium rolfsii (A), Pseudomonas sp. CRB-86 terhadap Fusarium oxysporum
(B) dan Pseudomonas sp. CRB-102 terhadap Rhizoctonia solani (C).
(A) (B)
[image:36.595.103.500.87.773.2]18
Tabel 2 Karakter biokontrol Pseudomonas sp. CRB yang diisolasi dari rizosfer tanaman kedelai.
Isolat
PIRG a
produksi siderofor
produksi
kitinase sianogen S.
rolfsii
F. oxysporum
R. solani
CRB-3 - - 56.7 + + +
CRB-16 - 24.6 - + - -
CRB-17 - 14.3 - + - -
CRB-31 - 18.7 50.0 + - +
CRB-44 - 39.2 - + - -
CRB-75 - 11.1 37.7 - - +
CRB-80 20.0 - 52.3 + + -
CRB-86 - 30.3 36.9 - - -
CRB-102 25.0 - 60.0 - - -
CRB-109 - - 36.9 - - -
CRB-112 - - 48.1 + - +
a
PIRG: percentage of inhibition radial growth
(persentase penghambatan pertumbuhan radial cendawan patogen oleh isolat bakteri)
+ : menghasilkan senyawa anticendawan dan karakter biokontrol lain
- : tidak menghasilkan senyawa anticendawan dan karakter biokontrol lain
Beberapa Pseudomonas sp. CRB yaitu CRB-31, CRB-80, CRB-86, CRB-102 menunjukkan penghambatan terhadap 2 jenis cendawan patogen. Dari
sebelas Pseudomonas sp. CRB, 7 isolat menghasilkan siderofor, 2 isolat menghasilkan kitinase dan 4 isolat menghasilkan hidrogen sianida.
Masing-masing isolat menunjukkan beberapa sifat biokontrol yang khusus. Pseudomonas
sp. CRB-3 mempunyai penghambatan terhadap R. solani, menghasilkan siderofor, kitinase dan hidrogen sianida. Pseudomonas sp. CRB-80 menunjukkan penghambatan terhadap S. rolfsii, R. solani, menghasilkan siderofor dan kitinase.
Pseudomonas sp. CRB-102 hanya menunjukkan penghambatan terhadap S. rolfsii
19
Pembahasan
Total 81 isolat yang diisolasi dari rizosfer tanaman kedelai teridentifikasi
sebagai genus Pseudomonas sesuai dengan sifat morfologi dan fisiologinya menurut Bergey’s Manual of Determinative Bacteriology 9th edition (Holt et al. 1994). Semua isolat bersifat Gram negatif, bentuk batang, motil, aerobik, katalase
positif, oksidase positif. Karakter morfologi dan fisiologi ini dapat digunakan
untuk mengidentifikasi bakteri yang mengarah ke genus Pseudomonas. Teridentifikasinya isolat-isolat dari rizosfer tanaman kedelai sebagai genus
Pseudomonas menunjukkan bahwa Pseudomonas merupakan bakteri yang secara alami ada rizosfer tanaman kedelai. Pseudomonas dapat memanfaatkan eksudat tanaman kedelai sebagai nutrisi untuk tumbuh di sekitar perakaran (Scher et al. 1985). Keberadaan Pseudomonas sebagai bagian dari bakteri antagonis rizosfer memberikan keuntungan bagi tanaman.
Identifikasi genus Pseudomonas lebih lanjut menggunakan Microgen™
GNA GNB menunjukkan sebagian besar isolat yaitu 8 isolat adalah Pseudomonas pseudomallei dengan kemiripan antara 48.89-99.99%; 2 isolat mengarah pada
Pseudomonas aeruginosa dengan kemiripan 45.53 dan 90.91%; 1 isolat mengarah kepada Pseudomonas stutzeri dengan kemiripan 72.57%. Hal ini mengindikasikan bahwa Pseudomonas sp. CRB adalah satu genus Pseudomonas dengan beberapa
spesies yang berbeda dengan dominasi terbesar sebagai spesies Pseudomonas pseudomallei. Pseudomanas sp. CRB-3, CRB-80 dan CRB-86 dan CRB-112
teridentifikasi sebagai Pseudomonas pseudomallei dengan kemiripan yang sama yaitu 99.99%, meskipun hasil uji biokimianya tidak identik.
Identifikasi fenotif dengan menggunakan kitsubstrat biokimia Microgen™
GNA GNB dapat dilakukan dengan mudah. Substrat biokimia akan berubah
warna jika dimetabolisme oleh bakteri selama inkubasi atau setelah ditambahkan
reagen tertentu. Permutasi substrat yang dimetabolisme dapat diketahui hasilnya menggunakan software Microgen Identification System untuk mengidentifikasi bakteri yang diuji. Meskipun pengartian positif dan negatif tes biokimia
menggunakan kitMicrogen™ GNA GNB dapat mengarahkan ke identifikasi pada
tingkat spesies, hasil yang diberikan masih sangat terbatas. Keterbatasan hasil
20
Microgen™ GNA GNB adalah kit untuk identifikasi bakteri famili Enterobacteriaceae dan mencakup juga secara umum non-fastidious oksidatif positif, Gram negatif bentuk batang. Untuk famili Enterobacteriaceae dapat
mengidentifikasi 28 genus akan tetapi untuk oksidatif positif hanya dapat
mengidentifikasi 12 genus, di antaranya, genus Pseudomonas hanya diwakili oleh 6 spesies. Oleh karenanya Pseudomanas sp. CRB-3, CRB-80 dan CRB-86 dan CRB-112 teridentifikasi sebagai Pseudomonas pseudomallei dengan kemiripan yang sama yaitu 99.99%, meskipun hasil uji biokimianya tidak identik.
Bakteri rizosfer yang bersifat antagonis dapat ditemukan di komunitas
mikrob rizosfer. Sebelas isolat Pseudomonas sp. CRB yang mempunyai aktivitas anticendawan dapat ditemukan dari rizosfer tanaman kedelai. Sehubungan dengan
aktivitas anticendawan, bakteri ini merupakan bakteri yang dapat berperan dalam
penekan penyakit secara alami di rizosfer. Meskipun jumlahnya tidak begitu
banyak, Pseudomonas sp. CRB penghasil senyawa anticendawan merupakan bakteri antagonis yang berpotensi untuk dikembangkan sebagai agen biokontrol.
Uji antagonis bakteri terhadap cendawan patogen yang sudah dikenal dan
banyak dilakukan adalah kultur ganda. Uji ini dapat menunjukkan apakah isolat
bakteri dapat menghambat pertumbuhan cendawan patogen atau tidak. Seperti
pada penelitian ini, evaluasi aktivitas anticendawan in vitro merupakan
persyaratan yang harus dilakukan sebelum dilakukan evaluasi aktivitas
anticendawan in planta. Adanya antagonis mengindikasikan adanya produksi senyawa anticendawan. Makin tinggi presentase penghambatan pertumbuhan
yang ditunjukkan isolat bakteri makin besar sifat antagonisnya. Isolat yang
menunjukkan persentase penghambatan lebih dari 20% merupakan kandidat
biokontrol yang baik. Pseudomonas sp. CRB-31, CRB-80, CRB-86 dan CRB-102 menghambat dua jenis cendawan. Hal ini mengindikasikan bahwa keempat isolat
tersebut menghasilkan beberapa senyawa anticendawan. Seperti pada
21
penyakit busuk kecambah pada kecambah tanaman kapas karena menghasilkan
pioluteorin (Howell & Stipanovic 1980; Nowak-Thompson et al. 1999).
Kemampuan menghasilkan enzim kitinase, siderofor dan hidrogen sianida
merupakan sifat-sifat biokontrol yang dapat berperan juga dalam penekanan
penyakit yang disebabkan cendawan patogen. Pseudomonas sp. CRB yang mempunyai satu atau lebih karakter biokontrol sangat menguntungkan, karena
mereka dapat memberikan beberapa mekanisme antibiosis sekaligus untuk
mengendalikan cendawan patogen atau dapat mengendalikan beberapa patogen.
Simpulan
1. Sebanyak 81 isolat bakteri dari rizosfer tanaman kedelai dari daerah
Cirebon teridentifikasi secara morfologi dan fisiologis sebagai genus
Pseudomonas dan diberi nama Pseudomonas sp. CRB.
2. Sebanyak 11 isolat di antara 81 Pseudomonas sp. CRB bersifat antagonis terhadap cendawan patogen tular tanah S. rolfsii, F. oxysporum atau