DETEKSI GEMINIVIRUS YANG MENGINFEKSI TANAMAN
TERUNG (
Solanum melongena
L.) DENGAN TEKNIK
POLYMERASE CHAIN REACTION
TEGA KINTASARI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul “Deteksi Geminivirus yang menginfeksi tanaman terung (Solanum melongena L.) dengan teknik Polymerase Chain Reaction” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2013
Tega Kintasari NIM A34090045
ABSTRAK
TEGA KINTASARI. Deteksi Geminivirus yang menginfeksi terung (Solanum melongena L.) dengan teknik Polymerase Chain Reaction. Dibimbing oleh SRI HENDRASTUTI HIDAYAT.
Penyakit yang disebabkan oleh Geminivirus yang ditularkan oleh kutukebul telah menjadi pembatas dalam budidaya pertanian di seluruh dunia, termasuk di Indonesia. Penyakit akibat infeksi Geminivirus yang ditularkan oleh kutukebul telah dilaporkan menyebabkan kehilangan hasil khususnya cabai dan tomat di Jawa. Penelitian bertujuan mendeteksi dan mengidentifikasi Geminivirus yang menginfeksi terung menggunakan polymerase chain reaction (PCR) dan menganalisis runutan nukleotida. Metode yang digunakan terdiri dari ekstraksi DNA menggunakan bufer CTAB, amplifikasi DNA dan analisis runutan nukleotida menggunakan program Bioedit V.7.0.5 dan Clustal W. Tiga pasang primer universal Geminivirus digunakan dalam amplifikasi DNA yaitu pAL1v1978/pAR1c715, SPG1/SPG2, dan pAV494/pAC1048. Sampel daun terung dikoleksi dari Jawa Barat (Bandung) dan Jawa Tengah (Pati, Rembang, Bantul). Primer universal Geminivirus SPG1/SPG2 berhasil mengamplifikasi fragmen DNA dengan ukuran ≈912 bp dari semua sampel daun. Analisis runutan nukleotida menunjukkan bahwa Geminivirus yang menginfeksi terung dari Jawa Barat dan Jawa Tengah memiliki hubungan kekerabatan genetik yang dekat (98.8 %) dengan Tomato yellow leaf Kanchanaburi virus (TYLCKaV) asal Thailand.
ABSTRACT
TEGA KINTASARI. Detection of Geminivirus infecting eggplant (Solanum melongena L.) using Polymerase Chain Reaction. Supervised by SRI HENDRASTUTI HIDAYAT.
Diseases caused by whitefly-transmitted Geminiviruses (WTGs) have become serious constraints for crops throughout the world, including Indonesia. WTGs has been reported to cause significant yield loss especially in chili pepper and tomato in Java. This research aims to detect and identify Geminivirus infecting eggplant using polymerase chain reaction (PCR) and nucleotide sequencing. The methods involved DNA extraction using CTAB, DNA amplification and nucleotide sequence analysis by Bioedit V 7.0.5 and ClustalW. Three pair of universal primers, i.e. pAL1v1978/pAR1c715, SPG1/SPG2, pAV494/pAC1048, was used for DNA amplification. Infection of Geminivirus was evidenced from leaves collected from West Java (Bandung) and Central Java (Pati, Rembang, Bantul). Universal primer SPG1/SPG2 was able to amplify DNA fragments of ≈912 bp from all leaf samples. Nucleotide analyses showed that Geminivirus infecting eggplant from West Java and Central Java has a close relationship (98.8%) with Tomato yellow leaf curl Kanchanaburi virus (TYLCVKaV) from Thailand.
DETEKSI GEMINIVIRUS YANG MENGINFEKSI TANAMAN
TERUNG (
Solanum melongena
L.) DENGAN TEKNIK
POLYMERASE CHAIN REACTION
TEGA KINTASARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Usulan : Deteksi Geminivirus yang menginfeksi tanaman terung (Solanum melongena L.) dengan teknik Polymerase Chain Reaction.
Nama Mahasiswa : Tega Kintasari
NIM : A34090045
Disetujui oleh
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc Dosen Pembimbing
Diketahui oleh
Dr. Ir. Abdjad Asih Nawangsih, M.Si Ketua Departemen Proteksi Tanaman
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT yang selalu melimpahkan rahmat dan karuniaNya, sehingga penulis dapat menyelesaikan penelitian dengan judul Deteksi Geminivirus yang menginfeksi terung (Solanum melongena L.) dengan teknik Polymerase Chain Reaction. Penelitian dilaksanakan sejak bulan Februari hingga Juli 2013, di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian Bogor.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Dr. Ir. Sri Hendrastuti Hidayat, M.Sc selaku pembimbing skripsi atas segala kesabaran, keikhlasan, bimbingan, arahan, kritik, saran, serta dukungan moril yang sangat besar dalam penelitian penulis. Ucapan terima kasih juga penulis haturkan kepada Prof. Dr. Ir. Aunu Rauf, M.Sc selaku dosen penguji atas masukan dan saran selama penyelesaian skripsi, dan kepada Ir. Djoko Prijono, M.Agr.Sc yang telah memberikan petunjuk dan perbaikan dalam teknik penulisan skripsi selaku pengajar mata kuliah Teknik Penyajian Ilmiah.
Penulis mengucapkan terima kasih yang tulus untuk kedua orang tua, Subawi, S.Pd dan Suprihatin, S.Pd dan adik Agi Agustian, atas doa, kasih sayang, semangat, dan nasehat. Disamping itu, ucapan terima kasih dan doa penulis sampaikan kepada bapak Supeno, Sumarno, Kasminto, Maryono, Asep, dan Kusnaedi, yang telah membantu selama pengumpulan data. Penulis mengucapkan terima kasih yang tulus atas dukungan dan semangat yang telah diberikan pada penulis, untuk teman-teman di laboratorium Virologi, Pondok Surya, Griya Pink, dan Rigatdezta.
Semoga penelitian ini memberikan manfaat bagi insan manusia dan dibidang pendidikan serta pertanian.
Bogor, Desember 2013
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
BAHAN DAN METODE 4
Tempat dan Waktu Penelitian 4
Pengambilan Sampel di Lapangan 4
Penghitungan Kejadian Penyakit 4
Deteksi Virus dengan Metode Polymerase Chain Reaction (PCR) 4
Ektraksi DNA Total 5
Amplifikisi DNA 5
Visualisasi Hasil 6
Perunutan Nukleotida dan Analisis Kekerabatan Genetik 6
HASIL DAN PEMBAHASAN 7
Gejala Infeksi Virus dan Kejadian Penyakit pada Terung di Lapangan 7 Deteksi Geminivirus pada Terung dengan Teknik PCR 11
Analisis Runutan Nukleotida 14
SIMPULAN DAN SARAN 17
DAFTAR TABEL
1 Pasangan primer yang digunakan untuk amplifikasi DNA Geminivirus 6 2 Variasi gejala infeksi virus pada daun terung di lapangan 9 3 Kondisi pertanaman terung di daerah pengambilan sampel daun 10 4 Frekuensi jumlah sampel yang teramplifikasi dengan pasangan primer
SPG1/SPG2 dan gejala pada sampel daun
14
5 Tingkat homologi sikuen gen Begomovirus asal terung di JaBar, JaTeng, dan DIY
16
DAFTAR GAMBAR
1 Gejala infeksi virus pada daun terung di lapangan, A; gejala mosaik hijau, B; gejala melepuh dan mengecil, C; gejala mengeriting, D; gejala menguning, E; gejala mosaik menguning
8
2 Amplifikasi DNA Geminivirus pada daun terung dari lapangan dengan teknik PCR, A; pasangan primer pAV494/pAC1048, B; pasangan primer SPG1/SPG2, C; pasangan primer pAL1v1978/pAR1c715, M; penanda DNA, 1; kontrol positif, 2; kontrol negatif, 3; sampel asal Bogor, 4; sampel asal Bandung, 5; sampel asal Pati, 6; sampel asal Rembang, 7; sampel asal Bantul
12
DAFTAR LAMPIRAN
1 Organisasi genom monopartit (i) dan bipartit (ii) Begomovirus 22
2 Jenis dan fungsi gen Begomovirus 22
3 Urutan basa nukleotida isolat asal Bogor 23
4 Urutan basa nukleotida isolat asal Bandung 23
5 Urutan basa nukleotida isolat asal Pati 24
6 Urutan basa nukleotida isolat asal Rembang 24
1
PENDAHULUAN
Latar Belakang
Terung, Solanum melongena L. merupakan salah satu tanaman sayur-sayuran yang dapat ditemukan tumbuh di daerah tropis maupun subtropis. Walaupun tergolong tanaman tahunan, tanaman terung secara komersial tumbuh sebagai tanaman setahun. Terung merupakan tanaman yang adaptif dan mudah ditanam, serta dapat tumbuh sepanjang tahun. Terung hampir tumbuh di semua wilayah Indonesia baik di daerah dataran rendah maupun dataran tinggi, walaupun lebih banyak dibudidayakan di dataran rendah. Tanaman terung dapat tumbuh baik pada ketinggian 1 – 1200 m di atas permukaan laut (m dpl), pada kondisi tanah yang subur dan tidak tergenang air dengan pH berkisar 5 - 6. Tanaman terung juga merupakan tanaman yang toleran terhadap tanah-tanah yang miskin unsur hara (Nazaruddin 2003).
Menurut data Badan Pusat Statistik (BPS) tahun 2012, terjadi peningkatan produktivitas dalam budidaya terung di Indonesia sebesar 31.957 ton dari tahun 1997 hingga tahun 2011. Peningkatan produktivitas terung kemungkinan terjadi karena terung merupakan tanaman sayuran yang adaptif. Tanaman terung juga tidak terlalu menuntut syarat tumbuh dan teknik budidaya yang rumit, serta bisa menghasilkan buah dalam waktu yang relatif singkat, yaitu sekitar empat bulan setelah ditanam (Nazaruddin 2003). Hal tersebut kemungkinan menjadi salah satu pertimbangan petani dalam menentukan pilihan untuk menanami lahannya dengan tanaman terung. Kemungkinan lain yang menyebabkan terjadinya peningkatan produktivitas terung di Indonesia adalah tingginya permintaan terung di pasar, karena harganya yang relatif murah sehingga mudah dijangkau oleh kalangan masyarakat menengah kebawah.
Peningkatan produktivitas terung tidak menjamin tanaman ini bebas dari serangan organisme pengganggu tanaman (OPT) khususnya patogen dari kelompok virus. Beberapa virus yang dilaporkan menginfeksi terung adalah Tomatto spotted wilt virus (TSWV) (Dikova 2011), Eggplant blister mosaic virus (EBMV) (Al-ani 2011), dan Eggplant motteld crinkle virus (EMCV) (Dombrovsky et al. 2009). Dilaporkan oleh Pratap et al. (2011) dan Green et al. (2003) bahwa tanaman terung di India dan Thailand terinfeksi oleh berturut-turut Tomato leaf curl virus (ToLCV) dan Tomato yellow leaf curl virus (TYLCV). Kedua virus tersebut termasuk anggota Begomovirus, famili Geminiviridae.
2
tanaman cabai dan tomat di Meksiko dan Amerika Serikat sejak tahun 1990 (Brown and Poulus 1990; Strenger et al. 1990). Geminivirus memiliki kisaran inang yang sangat luas, mencakup tomat, cabai, terung, singkong, jagung, mentimun, tembakau, ubi kayu, dan kacang-kacangan. Dilaporkan 13 spesies gulma yang sering dijumpai tumbuh di sekitar area pertanaman juga merupakan inang alternatifnya, seperti gulma dari famili Compositae dan Euphorbiaceae (Sudiono 2001; Meliansyah 2010).
Anggota famili Geminiviridae dikelompokkan ke dalam empat subgrup berdasarkan organisasi genom, tanamang inang, dan serangga vektor. Subgrup I (Mastrevirus) terdiri dari virus-virus dengan genom monopartit, yang biasanya menginfeksi tanaman monokotil dan hanya dapat ditularkan oleh wereng daun. Maize streak virus (MSV) dan Wheat dwarf virus (WDV) merupakan angggota dari subgrup I. Subgrup II (Curtovirus) hanya memiliki satu anggota yaitu Beet curly top virus (BCTV) yang memiliki struktur genom monopartit, hanya mampu menginfeksi tanaman dikotil dan hanya dapat ditularkan oleh wereng daun. Subgrup III (Begomovirus) terdiri dari virus-virus yang memiliki struktur genom monopartit atau bipartit, yang menginfeksi tanaman dikotil dan hanya dapat ditularkan oleh kutukebul (Bemisia tabaci). Anggota Begomovirus dibagi dalam dua kelompok berdasarkan komponen genomnya, yaitu genom monopartit dan genom bipartit. Komponen DNA monopartit dan bipartit mengkode enam open reading frame (ORF) atau kerangka baca yang menyandikan protein dengan fungsi yang spesifik (Lampiran 1). Tomato yellow leaf curl virus (TYLCV) dan Tomato golden mosaic virus (TGMV) merupakan anggota Begomovirus yang berturut-turut memiliki organisasi genom monopartit dan bipartit. Subgrup IV (Topucovirus) memiliki organisasi genom yang mirip dengan Curtovirus dan juga menginfeksi tanaman dikotil, tetapi penularannya di alam hanya dapat dilakukan oleh wereng pohon. Tomato pseudocurly top virus (ToPCTV) merupakan anggota subgrup IV (Bisaro 1994; Hull 2002).
Kutukebul (Bemisia tabaci Gennadius) merupakan serangga vektor yang sangat berperan dalam penyebaran dan penularan Begomovirus di alam. Begomovirus ditularkan secara persisten sirkulatif oleh kutukebul, artinya setelah masuk ke dalam tubuh vektor virus akan bertahan dan memperbanyak diri di dalam tubuh vektornya. Kutukebul diketahui merupakan serangga fitofag dengan kisaran inang yang sangat luas, meliputi tanaman dari famili Asteraceae, Malvaceae, Solanaceae, Cruciferaceae, Lamiaceae, Euphorbiaceae, Fabaceae, Begnoniaceae, Lythraceae, dan Zygophyllaceae (Oliveira et al. 2001; Perring 2001). Banyaknya jenis tanaman inang dari Begomovirus dan kutukebul menyebabkan virus ini dapat tersebar dengan baik di berbagai belahan dunia.
Terung merupakan salah satu tanaman yang disukai oleh B tabaci, dan diketahui merupakan salah satu tanaman inang dari Begomovirus (Sudiono 2001; Hendrival et al. 2011). Baru-baru ini di India telah dilaporkan adanya infeksi Tomato yellow leaf curl virus (TYLCV) pada tanaman terung oleh Pratap et al. (2011). Gejala akibat infeksi TYLCV pada terung di India adalah mosaik kuning dan belang pada daun. Hingga saat ini di Indonesia belum diketahui adanya laporan mengenai infeksi Begomovirus pada tanaman terung.
3
dengan menggunakan primer universal Begomovirus telah berhasil mengidentifikasi beberapa jenis virus diantaranya Pepper yellow leaf curl virus (PepYLCV) dengan primer pAV494/pAC1048 (Sulandari et al. 2005), Sweet potato leaf curl virus (SPLCV) dengan primer SPG1/SPG2 (Li et al. 2004), dan Tomato yellow leaf curl virus (TYLCV) dengan primer pAL1v1978/pAR1c715 (Salati et al. 2002).
Pada awal tahun 2013 dilaporkan munculnya gejala mosaik kuning pada tanaman terung di beberapa wilayah di Jawa Barat, Jawa Tengah, dan Daerah Istimewa Yogyakarta seperti yang diuraikan oleh Pratap et al. (2011). Oleh karena itu perlu konfirmasi adanya infeksi Geminivirus pada tanaman terung tersebut.
Tujuan Penelitian
Penelitian bertujuan mendeteksi dan mengidentifikasi Geminivirus yang menginfeksi tanaman terung di beberapa daerah di Jawa Barat, Jawa Tengah, dan Daerah Istimewa Yogyakarta dengan teknik molekuler yaitu PCR dan sikuensing.
Manfaat Penelitian
4
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Survei dan koleksi tanaman sakit dilakukan di daerah pertanaman terung di Jawa Barat, Jawa Tengah, serta Daerah Istimewa Yogyakarta. Deteksi virus dilaksanakan di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor mulai Februari sampai Juli 2013.
Metode Penelitian
Pengambilan Sampel Tanaman
Sampel tanaman diambil dari beberapa daerah pertanaman terung di Jawa Barat (Bandung, dan Bogor), Jawa Tengah (Pati, Rembang, dan Blora), dan Daerah Istimewa Yogyakarta (Bantul). Sampel yang diambil berupa daun yang menunjukkan gejala penyakit akibat infeksi virus yaitu mosaik hijau, melepuh dan mengecil, mengeriting, menguning, dan mosaik kuning.
Deskripsi gejala dan dokumentasi dengan digital camera dilakukan untuk masing-masing sampel lapangan. Sampel daun kemudian dipotong kecil-kecil dan dibungkus dalam kertas tisu, setelah itu dimasukkan dalam kantung plastik dan di dalamnya diberi silica gel. Pemberian silica gel ditujukan untuk mengikat air dari udara sehingga mengurangi kelembapan dan mengurangi kemungkinan busuknya daun.
Penghitungan Kejadian Penyakit
Pengamatan tanaman sampel dilakukan secara visual yaitu dengan melihat ada tidaknya gejala penyakit akibat infeksi virus. Metode pengamatan kejadian penyakit di lapangan dilakukan secara acak sistematis, yaitu dengan menetapkan tanaman ke-tujuh dan kelipatannya pada masing-masing baris sebagai tanaman sampel. Misalnya untuk lahan dengan luas sekitar 1000 m2 dengan 22 bedengan dan jumlah tanaman per bedengan sekitar 42 tanaman akan diambil sampel sebanyak 40 tanaman. Penghitungan kejadian penyakit di lapangan mengikuti rumus sebagai berikut :
KP = x 100 %
dengan KP, kejadian penyakit; n, jumlah tanaman yang menunjukkan gejala; N, jumlah tanaman yang diamati.
Deteksi Virus dengan Metode Polymerase Chain Reaction (PCR)
5
Ekstraksi DNA Total Tanaman. Ekstraksi DNA total dilakukan menggunakan metode CTAB (Doyle dan Doyle 1990) dengan beberapa modifikasi. Sebanyak 10 ml bufer ekstraksi (2% CTAB, 100 mM Tris pH 8, 10 mM EDTA, 5 M NaCl), dipanaskan dalam penangas air pada suhu 65 ºC. Sampel daun sebanyak 0.1 g digerus dalam 500 µl bufer yang telah dicampur dengan 5 µl merkaptoetanol (1% 2-β-merkaptoetanol), setelah itu dimasukkan dalam tabung mikro berukuran 1.5 ml. Hasil campuran selanjutnya diinkubasi dalam penangas air pada suhu 65 ºC selama 60 menit dan setiap 10 menit sekali dibolak-balik untuk membantu proses lisis. Setelah 60 menit tabung yang berisi campuran tersebut diambil dari penangas air dan didiamkan selama 2 menit pada suhu ruang, kemudian ditambahkan 500 µl campuran Chloroform:Isoamilalcohol (CI) dengan perbandingan 24:1 (v:v). Agar tercampur dengan baik tabung dibolak-balik selama 5 menit, kemudian disentrifugasi dengan kecepatan 12 000 rpm selama 15 menit dan diambil supernatannya. Supernatan yang diperoleh diambil secara hati-hati dan dipindahkan ke tabung baru, kemudian ditambahkan 0.1 volume sodium asetat dan 2.5 kali etanol absolut. Setelah diinkubasi pada suhu -20 ºC selama satu malam, tabung disentrifugasi dengan kecepatan 12 000 rpm selama 10 menit. Pelet hasil sentrifugasi dicuci dengan menambahkan etanol 70% sebanyak 500 µl, kemudian disentrifugasi kembali dengan kecepatan 8000 rpm selama 8 menit, dan pelet yang dihasilkan dikeringkan. Setelah kering, pelet yang diperoleh dilarutkan dalam 50 µl bufer TE 1x (10 mM Tris-HCl pH 8.0, 1 mM EDTA).
Amplifikasi DNA. DNA hasil ektraksi kemudian digunakan untuk amplifikasi pita DNA yang spesifik. Komposisi bahan yang digunakan dalam reaksi PCR adalah H2O (14.5 – 17.3 µl), bufer 10x yang mengandung Mg2+ (2.5
6
Tabel 1 Pasangan primer yang digunakan untuk amplifikasi DNA Geminivirus
Pasangan
5’GGATTAGAGGCATGTGTACATGGGAATC-3’ ≈550 bp
(Wyatt
5’- GATTTCTGCAGTTDATRTTYTCRTCCATCCA-3’ ≈1600 bp
(Rojas et al. 1993)
Visualisai Hasil PCR. Fragmen DNA hasil amplifikasi divisualisasi pada 1% gel agarosa dalam 0.5x bufer TBE (Tris-borate EDTA). Sebanyak 0.3 g agarosa dilarutkan dalam 30 ml bufer TBE dan dipanaskan dalam microwave selama 2 menit agar tercampur merata. Larutan agarosa tersebut didiamkan sampai hangat, kemudian dituang ke dalam cetakan dan didiamkan hingga memadat kurang lebih selama satu jam. Setelah memadat, gel agarosa dimasukkan ke dalam tangki (electrophoresis box) yang berisi bufer TBE (0,5x). Sumuran pada gel agarosa diisi dengan sampel DNA yang terdiri dari campuran DNA produk amplifikasi dan loading dye dengan perbandingan 5:1 (v:v). Elektoforesis dilakukan dengan tegangan 50 volt selama 50 menit, dilanjutkan dengan tegangan 100 volt selama 3 menit. Elektroforesis dimaksudkan untuk memisahkan molekul DNA dengan menggunakan arus listrik yang memanfaatkan prinsip perbedaan berat atau besar molekul. Migrasi posisi DNA hasil elektroforesis dideteksi dengan sistem pengecatan (staining) dengan perendaman DNA dalam larutan ethidium bromide selama 5 menit, dilanjutkan dengan perendaman dalam air selama 3 menit. DNA kemudian divisualisasi di bawah UV transiluminator.
Perunutan Nukleotida dan Analisis Kekerabatan Genetik
7
HASIL DAN PEMBAHASAN
Gejala Infeksi Virus dan Kejadian Penyakit pada Tanaman Terung di Lapangan
Infeksi virus dapat mempengaruhi proses metabolisme tanaman, sehingga menyebabkan perubahan pertumbuhan tanaman. Perubahan pertumbuhan tanaman tersebut ada yang dapat diamati secara kasat mata (gejala luar), tetapi ada pula yang tidak dapat diamati secara kasat mata (gejala dalam). Infeksi virus yang terjadi di dalam sel tanaman akan mempengaruhi sintesis protein dan asam nukleat dari sel tanaman yang terinfeksi. Infeksi virus juga akan berpengaruh terhadap jumlah dan bentuk organel sel, seperti mitokondria dan kloroplas, inti sel, dan dinding sel (Bos 1983; Walkey 1991). Gangguan fisiologis akibat infeksi virus yang terjadi secara berkelanjutan ditunjukkan dengan gejala luar berupa perubahan warna, bentuk, dan ukuran baik pada daun, batang, dan buahnya. Jenis gejala luar yang sering muncul karena infeksi virus adalah bantut (stunting), layu, mosaik, bercak bercincin (ringspot), daun mengggulung, dan daun menguning. Gejala dalam yang dapat terjadi akibat infeksi virus adalah berkurangnya ukuran sel-sel (hipotrofi), berkurangnya jumlah sel-sel (hipoplasia), bertambahnya ukuran sel-sel (hiperplasia atau proliferasi jika berlebihan), kematian sel (nekrosis), dan deviasi dalam kandungan sel (degenerasi klorofil dan pembengkakan inti) (Hull 2002). Pengamatan gejala di lapangan relatif mudah dilakukan karena tanaman sakit menunjukkan pertumbuhan abnormal dibandingkan tanaman sehat yaitu berupa perubahan bentuk, ukuran, dan warna.
8
Gambar 1 Gejala infeksi virus pada tanaman terung di lapangan. (A) gejala mosaik hijau; (B) gejala melepuh dan mengecil; (C) gejala mengeriting; (D) gejala menguning keseluruhan; dan (E) gejala mosaik kuning.
pada gejala mosaik kuning dibatasi oleh ibu dan anak tulang daun (Gambar 1E). Pada gejala mosaik kuning juga tidak terdapat perubahan ukuran dan bentuk daun, seperti pada gejala mosaik hijau, dan menguning.
Gejala-gejala seperti diuraikan di atas ditemukan pada daun-daun muda. Umumnya tanaman yang menunjukkan gejala tidak menghasilkan buah. Beberapa tanaman yang menunjukkan gejala tetap menghasilkan buah, tetapi buah yang dihasilkannya memiliki ukuran yang lebih kecil dibandingkan dengan buah yang dihasilkan dari tanaman sehat.
Kelima variasi gejala infeksi virus pada terung ditemukan tersebar secara acak di masing-masing daerah pengamatan (Tabel 2). Terdapat gejala yang hampir ditemukan di setiap daerah pengamatan, tetapi ada pula gejala yang hanya
A B
C
E
9
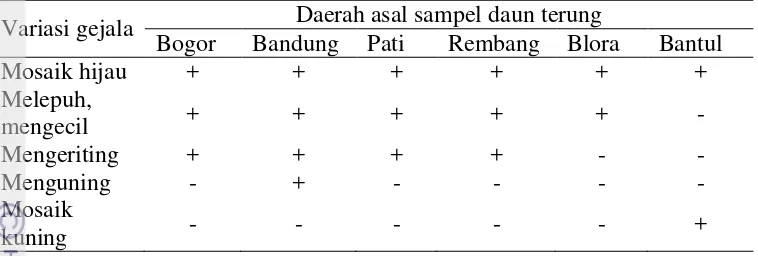
Tabel 2 Variasi gejala infeksi virus pada daun terung di lapangan
Variasi gejala Daerah asal sampel daun terung
Bogor Bandung Pati Rembang Blora Bantul
Mosaik hijau + + + + + +
Melepuh,
mengecil + + + + + -
Mengeriting + + + + - -
Menguning - + - - - -
Mosaik
kuning - - - +
(+), gejala ditemukan; (-), gejala tidak ditemukan
ditemukan di satu daerah pengamatan saja. Gejala mosaik hijau adalah gejala yang paling sering muncul dan ditemukan di seluruh daerah pengamatan. Gejala melepuh dan mengecil hampir ditemukan di semua daerah pengamatan, kecuali di Bantul (karena sampel dari Bantul merupakan sampel kiriman, dan sampel yang dikirim adalah sampel dengan gejala mosaik hijau dan mosaik kuning). Gejala mengeriting hanya ditemukan di daerah Bogor, Bandung, Pati, dan Rembang sedangkan di Blora dan Bantul tidak ditemukan. Gejala menguning adalah gejala yang hanya ditemukan di daerah Bandung. Gejala mosaik kuning juga merupakan gejala yang hanya muncul di satu tempat, yakni di Bantul. Jumlah tanaman bergejala pada masing-masing daerah pengambilan sampel dan luas lahan pengamatan menentukan persentase kejadian penyakit di lapangan. Kejadian penyakit (KP) dari paling tinggi sampai paling rendah berturut-turut adalah Rembang (23%), Bandung (21%), Pati (9.2%), Bogor (6.3%), dan Blora (5.1%).
10
dibandingkan dengan tanaman muda. Proses transportasi asimilat dan metabolisme yang terjadi pada tanaman dewasa berlangsung lebih lambat dibandingkan dengan tanaman muda, hal tersebut kemungkinan dapat mengganggu proses multiplikasi virus yang sepenuhnya bergantung pada tanaman inangnya (Walkey 1991). Kondisi lingkungan pertumbuhan tanaman yang berbeda-beda berpengaruh pada fisiologi dan proses metabolisme yang terjadi di dalam jaringan tanaman. Hal tersebut mempengaruhi proses multiplikasi dan replikasi virus di dalam jaringan tanaman yang memanfaatkan perangkat replikasi inangnya. Kondisi lingkungan yang mempengaruhi pertumbuhan tanaman diantaranya adalah penyinaran atau perolehan cahaya matahari, suhu, dan nutrisi. Intensitas penyinaran oleh cahaya matahari yang tinggi dapat menurunkan tingkat kerentanan tanaman akibat infeksi virus. Suhu yang tinggi dapat menghambat proses replikasi virus. Nutrisi yang dapat mendukung pertumbuhan tanaman juga dapat mendukung peningkatan kerentanan tanaman inang terhadap infeksi virus (Walkey 1991).
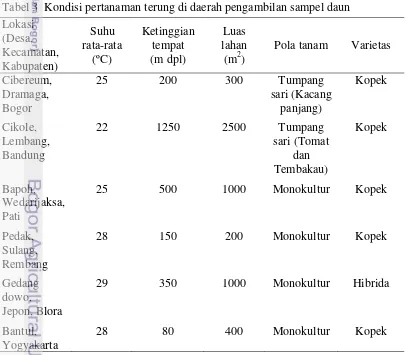
Kondisi daerah pengambilan sampel memiliki karakteristik yang berbeda satu sama lain (Tabel 3). Suhu rata-rata berkisar 22 sampai 29 ºC, ketinggian tempat berkisar 80 sampai 1250 m dpl, luas lahan berkisar 200 sampai 2500 m2, pola tanam sebagian besar monokultur terung tetapi di Bogor dan Bandung ditemukan pola tanam tumpangsari terung berturut-turut dengan kacang panjang, dan tomat serta tembakau.
Tabel 3 Kondisi pertanaman terung di daerah pengambilan sampel daun Lokasi
Pola tanam Varietas
11
Sampel terung asal Bogor, Bandung, Pati, Rembang, dan Bantul berasal dari varietas yang sama, yaitu varietas “Kopek”. Terung asal Blora secara fisik berbeda dengan kelima terung yang lainnya, karena terung ini merupakan terung hibrida asal Jepang. Keenam sampel dari masing-masing daerah berasal dari tanaman dengan kisaran umur yang berbeda, yaitu 65 hari, 90 hari, 105 hari, 70 hari, 116 hari, 30 hari, berturut-turut dari Bogor, Bandung, Pati, Rembang, Blora, dan Bantul.
Deteksi Geminivirus pada Terung dengan teknik PCR
Daun tanaman terung yang menunjukkan gejala infeksi virus digunakan untuk mendeteksi Geminivirus secara molekuler dengan teknik PCR. Gejala umum infeksi Geminivirus pada tanaman adalah penghambatan pertumbuhan tanaman, menguning, mosaik dan menggulung (keriting) pada daun serta pengerdilan tanaman (Santoso 2008). Pratap et al. (2011) melaporkan gejala infeksi Geminivirus pada tanaman terung di India adalah mosaik menguning dan belang pada daun.
Pasangan-pasangan primer yang digunakan dalam teknik PCR merupakan pasangan primer universal Geminivirus yang sudah sering digunakan untuk keperluan deteksi dan identifikasi virus dari kelompok Geminivirus. Sulandari et al. (2006) menggunakan pasangan primer pAV494/pAC1048 dan pAL1v1978/pAR1c715 untuk mendeteksi dan mengidentifikasi Peper yellow leaf curl virus, anggota Geminivirus yang menginfeksi cabai rawit di beberapa daerah di Jawa Barat, Jawa Tengah, dan DIY. Sudiono (2001) dan Santoso (2008) menggunakan pasangan primer pAL1v1978/pAR1c715 untuk mendeteksi dan mengidentifikasi Geminivirus yang menginfeksi tanaman tomat di Jawa Timur, Jawa Barat, Jawa Tengah, dan DIY. Miano (2008) menggunakan pasangan primer SPG1/SPG2 untuk mendeteksi dan mengidentifikasi Geminivirus yang menginfeksi ubi jalar di Kenya. Wyatt dan Brown (1996) menggunakan pasangan primer SPG1/SPG2 untuk mendeteksi dan mengidentifikasi beberapa virus anggota subgrup III Geminivirus.
Ketiga pasang primer universal dipilih karena ketiganya mengamplifikasi daerah genom virus yang berbeda-beda, tetapi masing-masing memiliki tingkat konservasi yang tinggi. Pasangan primer pAV494/pAC1048 dirancang untuk mendeteksi protein selubung dengan produk amplifikasi berukuran ≈550 bp (Wyatt dan Brown 1996). Pasangan primer SPG1/SPG2 yang dideskripsikan oleh Li et al. (2004) mengamplifikasi basa nukleotida ke-1490 hingga 2391 pada daerah open reading frame (ORF) AC2 dan ORF AC1. ORF AC2 mengkode transcriptional activator protein (TrAp) dan ORF AC1 mengkode r eplication-associated protein (Rep). Produk PCR yang dihasilkan oleh primer ini berukuran ≈912 bp. Pasangan primer pAL1v1978/pAR1c715 dirancang untuk mengamplifikasi daerah ORF AL1 mulai basa ke-1978 dan ORF AR1 hingga basa
ke-715, sehingga diperoleh produk sebesar ≈1600 bp. ORF AL1 mengkode gen
12
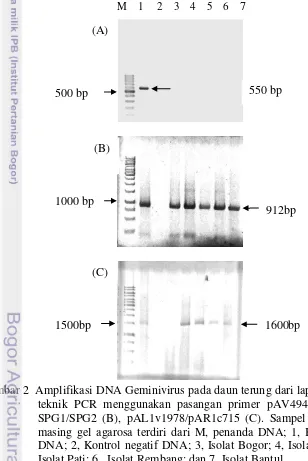
Amplifikasi menggunakan masing-masing pasangan primer universal memberikan hasil yang berbeda untuk masing-masing sampel (Gambar 2). Pasangan primer pAV494/pAC1048 tidak dapat mengamplifikasi semua sampel terpilih, walaupun kontrol positif bereaksi dengan baik (Gambar 2A). Pasangan primer pAL1v1978/pAR1c715 berhasil mengamplifikasi DNA virus dari sampel asal Bandung, Pati, Rembang, dan Bantul, tetapi tidak dapat mengamplifikasi sampel asal Bogor (Gambar 2B). Pasangan primer SPG1/SPG2 mampu mengamplifikasi kelima sampel secara konsisten dibandingkan dengan kedua pasangan primer lainnya (Gambar 2C). Keberhasilan amplifikasi kelima sampel tersebut kemungkinan karena kelima sampel memiliki daerah dengan konservasi yang tinggi pada bagian yang diamplifikasi oleh pasangan primer SPG1/SPG2.
Gambar 2 Amplifikasi DNA Geminivirus pada daun terung dari lapangan dengan teknik PCR menggunakan pasangan primer pAV494/pAC1048(A), SPG1/SPG2 (B), pAL1v1978/pAR1c715 (C). Sampel pada masing-masing gel agarosa terdiri dari M, penanda DNA; 1, Kontrol positif DNA; 2, Kontrol negatif DNA; 3, Isolat Bogor; 4, Isolat Bandung; 5, Isolat Pati; 6, Isolat Rembang; dan 7, Isolat Bantul.
M 1 2 3 4 5 6 7 (A)
(C) (B)
500 bp 550 bp
1000 bp
912bp
13
Sampel-sampel yang tidak teramplifikasi menggunakan pasangan primer universal kemungkinan disebabkan oleh beberapa hal, diantaranya adalah belum tercapainya optimasi reaksi, tidak terdapatnya kesesuaian antara basa nukleotida target dengan basa nukleotida penyusun primer, dan virus yang diamplifikasi bukan merupakan virus target. Masing-masing komponen dalam PCR membutuhkan perlakuan dan kondisi yang berbeda-beda agar dapat bekerja secara optimum. Faktor yang perlu diperhatikan ketika akan dilakukan amplifikasi DNA target adalah ketepatan konsentrasi dan volume masing-masing komponen. Kelebihan atau kekurangan pada masing-masing komponen akan berakibat pada hasil PCR. Kondisi yang perlu diperhatikan ketika melakukan amplifikasi adalah penentuan suhu pada masing-masing tahapan reaksi yang tepat. Suhu pada saat annealing merupakan suhu yang paling penting, karena pada saat annealing primer mulai menempel pada sikuen DNA target. Suhu yang dibutuhkan pada saat predenaturasi, denaturasi, elongasi, dan penyimpanan pada umumnya berkisar pada angka-angka yang relatif sama untuk beberapa reaksi dari primer yang berbeda (Jamsari 2007). Trisno et al. (2008) berhasil mengamplifikasi Pepper yellow leaf curl virus (PepYLCV) menggunakan primer pAV494/pAC1048 dengan komposisi reaksi yang telah dimodifikasi, salah satunya adalah suhu annealing 55 ºC selama 1 menit untuk 30 siklus. Wyatt dan Brown (1996) mendeskripsikan penggunaan primer pAV494/pAC1048 untuk mengamplifikasi beberapa anggota subgrup III Geminivirus dengan komposisi reaksi dan kondisi yang sudah dioptimasi. Terdiri dari 150 µM dNTPs, 2.5 mM MgCl2, 1.25 unit Taq polymerase, dan masing-masing 20 pmol primer pAV494/pAC1048. Amplifikasi DNA terdiri dari 35 siklus yang masing-masing terdiri dari denaturasi pada suhu 92 ºC selama 1 menit, annealing pada suhu 60 ºC selama 20 detik, dan elongasi pada suhu 72 ºC selama 30 detik. Runutan basa-basa penyusun primer menentukan kompatibilitas primer dengan virus target. Wyatt dan Brown (1996) menyatakan bahwa tidak teramplifikasinya sikuen DNA target disebabkan oleh primer tidak mengenali secara spesifik sikuen nukleotida sasaran.
Infeksi oleh virus non-target tidak akan menghasilkan produk PCR yang sesuai, meskipun pada kenyataannya virus non-target menginduksi gejala yang sama dengan virus target. Virus-virus yang dilaporkan menginfeksi terung diantaranya adalah Tomatto spotted wilt virus (TSWV) (Dikova 2011), Eggplant blister mosaic virus (EBMV) (Al-ani 2011), dan Eggplant motteld crinkle virus (EMCV) (Dombrovsky et al. 2009). Gejala yang muncul karena infeksi virus-virus tersebut mungkin sulit untuk dibedakan. Oleh karena itu perlu metode deteksi khusus untuk memastikan infeksi masing-masing virus. Gejala yang ditemukan di pertanaman terung di Blora adalah mosaik hijau dan melepuh mengecil. Berdasarkan hasil deteksi dengan PCR tidak terdeteksi adanya infeksi Geminivirus.
14
Tabel 4 Frekuensi jumlah sampel yang teramplifikasi dengan pasangan primer SPG1/SPG2 dan gejala pada sampel daun
Asal Sampel
Frekuensi jumlah sampel
yang teramplifikasi* Gejala pada sampel
Bogor 3/3 Mosaik hijau
Bandung 3/3 Mosaik hijau dan Menguning
Pati 1/4 Mosaik hijau
Rembang 1/5 Mosaik hijau
Bantul 2/6 Mosaik hijau dan Mosaik kuning
*Amplifikasi DNA tidak berhasil diperoleh dari 11 sampel asal Blora
melaporkan bahwa gejala akibat infeksi Geminivirus adalah menguning, mosaik, dan pengerutan daun berturut-turut pada tanaman singkong dan tomat.
Analisis Runutan Nukleotida
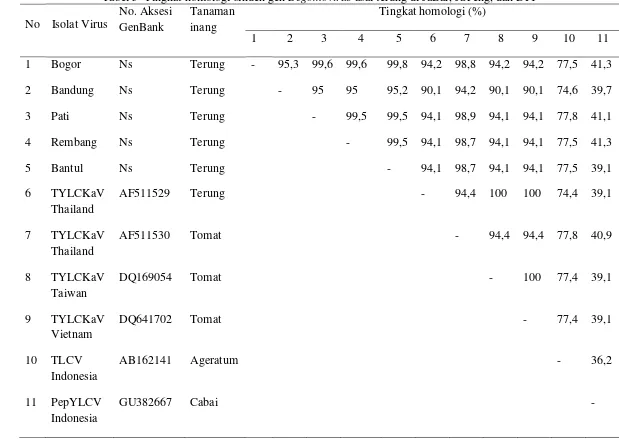
Fragmen DNA hasil amplifikasi PCR kemudian digunakan untuk perunutan basa nukleotidanya dan selanjutnya basa nukleotida yang diperoleh digunakan untuk analisis genetik menggunakan program BLAST (www.ncbi.nlm.nih.gov). Hasil BLAST menunjukkan bahwa Geminivirus asal terung memiliki kemiripan dengan Tomato yellow leaf curl Kanchanaburi virus (TYLCKaV) yang berasal dari Thailand, Taiwan, dan Vietnam yang menginfeksi tanaman terung dan tomat (Tabel 5).
Geminivirus asal Bogor, Pati, Rembang, dan Bantul menunjukkan tingkat homologi atau kemiripan nukleotida yang sangat tinggi satu sama lain yaitu berkisar 95.3% sampai 99.8%. Ketiga isolat tersebut memiliki tingkat kemiripan yang sangat tinggi (98.8%) dengan Tomato yellow leaf curl Kanchanaburi virus -[Tomato:Thailand] (AF511530). Geminivirus asal Bandung memiliki tingkat kemiripan yang lebih rendah dengan Geminivirus yang lain, yaitu berkisar 95% sampai 95.3%, walaupun demikian Geminivirus asal Bandung memiliki tingkat kemiripan yang tinggi pula dengan Tomato yellow leaf curl Kanchanaburi virus -[Tomato:Thailand] (AF511530), yaitu 94.2%.
Fauquet et al. (2006) menjelaskan bahwa apabila tingkat homologi sikuen genom A antar isolat Begomovirus mencapai lebih dari 90% maka isolat-isolat tersebut merupakan satu spesies yang sama dalam genus Begomovirus. Oleh karena itu, Geminivirus asal Bogor, Bandung, Pati, Rembang, dan Bantul merupakan satu spesies yang sama dengan Tomato yellow leaf curl Kanchanaburi virus (TYLCKaV). Kelima Geminivirus tersebut memiliki hubungan kekerabatan yang tidak terlalu dekat dengan isolat TYLCV yang menginfeksi Ageratum (77%) (Kon et al. 2007) dan isolat Pepper yellow leaf curl virus (PepYLCV) (39%) (Jamsari et al. 2009) yang menginfeksi cabai di Indonesia yang telah dilaporkan terlebih dahulu.
15
16
Tabel 5 Tingkat homologi sikuen gen Begomovirus asal terung di JaBar, JaTeng, dan DIY
No Isolat Virus
No. Aksesi GenBank
Tanaman inang
Tingkat homologi (%)
1 2 3 4 5 6 7 8 9 10 11
1 Bogor Ns Terung - 95,3 99,6 99,6 99,8 94,2 98,8 94,2 94,2 77,5 41,3
2 Bandung Ns Terung - 95 95 95,2 90,1 94,2 90,1 90,1 74,6 39,7
3 Pati Ns Terung - 99,5 99,5 94,1 98,9 94,1 94,1 77,8 41,1
4 Rembang Ns Terung - 99,5 94,1 98,7 94,1 94,1 77,5 41,3
5 Bantul Ns Terung - 94,1 98,7 94,1 94,1 77,5 39,1
6 TYLCKaV Thailand
AF511529 Terung - 94,4 100 100 74,4 39,1
7 TYLCKaV Thailand
AF511530 Tomat - 94,4 94,4 77,8 40,9
8 TYLCKaV Taiwan
DQ169054 Tomat - 100 77,4 39,1
9 TYLCKaV Vietnam
DQ641702 Tomat - 77,4 39,1
10 TLCV Indonesia
AB162141 Ageratum - 36,2
11 PepYLCV Indonesia
GU382667 Cabai -
SIMPULAN DAN SARAN
Tanaman terung (Solanum melongena L.) varietas “Kopek” asal Bogor, Bandung, Pati, Rembang, serta Bantul terbukti terinfeksi Geminivirus dengan menggunakan metode PCR. Pasangan primer universal Geminivirus SPG1/SPG2 berhasil mengamplifikasi fragmen DNA berukuran ≈912 bp. Hasil analisis perunutan nukleotida menunjukkan bahwa kelima isolat Geminivirus berkerabat dekat (98.8%) dengan Tomato yellow leaf curl Kanchanaburi virus (TYLCKaV) asal Thailand yang menginfeksi tomat. Infeksi Geminivirus pada tanaman terung menunjukkan gejala mosaik hijau, menguning, dan mosaik kuning.
18
DAFTAR PUSTAKA
Ajlan AM, Ghanem GAM, Abdulsalam KS. 2006. Tomato yellow leaf curl virus (TYLCV) in Saudi Arabia: Identification, partial characterization and virus-vector relationship. Journal of Biotechnology. 10(1):179-192.
Akin HM. 2006. Virologi Tumbuhan. Yogyakarta (ID): Kanisius.
Al-Ani RA, Adhab MA, Ismail KAH. 2001. Eggplant blister mottled virus (EBMV): A possible new potyvirus characterized from Iraq. Journal of General and Molecular Virology. 3(3):049-052.
Al-Musa A. 1982. Incidence, economic importantce and control of tomato yellow leaf curl virus in Jordan. Plant Disease. 66:361-363.
[Bakosurtanal] Badan Koordinasi Survey dan Pemetaan Nasional. 1991. Peta rupabumi digital Indonesia daerah Leuwiliang, Lembang, Wedarijaksa, Pamotan, Badong, dan Bantul.
Bisaro DM. 1994. Recombination in Geminivirus: Mechanisms for maintaining genome size and generating genome diversity. In Homologous recombination and gene silencing in plants (ed J. Paszkowski), pp. 39-60. Kluwer, Dordrecht.
Bos L. 1983. Introduction to Plant Virology. Triharso, penerjemah. Yogyakarta (ID): Gadjah Mada University Press. Terjemahan dari: Introduction to Plant Virology.
[BPS] Badan Pusat Statistik. 2012. Produksi sayuran di Indonesia, 1997-2012. Brown JK, Poulos BT. 1990. Serrano golden mosaic virus: A new whitefly
transmitted Geminivirus of pepper and tomato in U.S. Plant Disease. 74:720.
Dikova B. 2011. Tomato spotted wilt virus on some medicinal and essential oil-bearing plants in Bulgaria. Bulgarian Journal of Agriculture Science. 17:306-313.
Dombrovsky A, Pearlsman M, lachman O, Antignus Y.2009.Characterization of a new strain of Eggplant mottled crinkle virus (EMCV) infecting eggplants in Israel. Phytoparasitica. 37(5):477-483.
Faria JC, Souza JAC, Slack SA, maxwell DP. 1997. A new Geminivirus associateed with tomato in the state of Sao Paulo, Brazil. Plant Disease. 81:423.
Faquet CM, Mayo MA, Maniloff J, Desselberger U, Ball LA. 2005. Virus Taxonomy, VIIIth report of the ICTV. London (UK): Academic Press.
Green SK, Tsai WS, Shih SL. 2003. Molecular characterization of a new begomovirus associated with tomato yellow leaf curl and eggplant yellow mosaic diseases in Thailand. Plant Disease. 87 (4):446.
Guzman P, Sudarshana MR, seo YS, Rojas MR, Natwick E, Turini T, Mayberry K, Gilbertson RL. 2000. A new bipartite Geminivirus causing cucurbit leaf curl and crumpling symptoms in the Imperial Valley of California. Plant Diseases. 84:488.
19
Hidayat SH, Rusli ES, Nooraidawati. 1999. Penggunaan primer universal dalam polymerase chain reaction untuk mendeteksi virusgemini pada cabe. Di dalam: Prosiding Seminar Ilmiah dan Kongres Nasional PFI XV; Porwokerto, 6-18 Sep 1999. hlm 355-359.
Hull. 2002. Matthews Plant Virology. San Diego: Academic Press. Jamsari. 2007. Bioteknologi Pemula. Pekanbaru (ID): UNRI Press.
Jamsari J, Trisno J, Hidayat SH, Habazar TM, manti I, Nasrun, Suliansyah I. 2009. Detection and sequence diversity of begomovirus associated with yellow leaf curl disease of pepper (capsicum annuum) in West Sumatra, Indonesia. Microbiology Indonesia. 8(2):56-61.
Karkashian JP, Maxwell DP, Ramirez P. 2002. Squash yellow mottle Geminivirus; a new cucurbit-infecting Geminivirus from Costa rica. Phytopathology. 92:S125.
Kon T, Kuwabara R, Hidayat SH, Ikegami M. 2007. A begomovirus associated with Ageratum yellow vein disease in Indonesia: evidence for natural recombination between tomato leaf curl Java virus and Ageratum yellow vein virus-[Java]. Archieves of Virology. 152 (6):1147-57.
Li R, Salih S, Hurtt S. 2004. Detection of Geminiviruses in sweetpotato by polymerase chain reaction. Plant Disease. 88:1347-1351.
Maxwell P, Nakhla MK, Maxwell MD, ramirez P, Karkashian JP, Doyle de Roca MM, Roye M, McLaughlin W, faria JC. 2002. Diversity of begomovirus and their management in Latin america. Phytopathology. 92:S 127.
Meliansyah R. 2010. Peranan gulma sebagai inang alternatif Geminivirus di pertanaman cabai di Jawa [tesis]. Bogor (ID): Institut Pertanian Bogor. Miano DW. 2008. First report of a begomovirus infecting sweet potato in Kenya.
Plant Disease. 77:1-9
Morales FJ, Anderson PK. 2001. The emergences and dissemination of whitefly-transmitted Geminivirus in America Latina. Archieves of Virology. 146:2249-2253.
Nazaruddin 2003. Budi Daya dan Pengaturan Panen Sayuran Dataran Rendah. Depok (ID): Panebar Swadaya.
Ndunguru J, Legg JP, Fofana IBF, Aveling TAS, Thompson J, Fauquet CM. 2006. Identification of a defective molecule derived from DNA-A of the bipartite begomovirus of East african cassava mosaic virus. Plant Pathology. 55:2-10.
Oliveira MRV, Henneberry TJ, Anderson P. 2001. History, current status, and collaborative research projects for Bemisia tabaci. Crop Protection 20:709-723.
Pratap D, Kashikar AR, Mukherjee SK. 2011. Molekuler characterisation and infectivity of a Tomato leaf curl New Delhi virus variant assosiated with newly emerging yellow mosaic disease of eggplant in India. Journal of Virology. 8(1):305.
Perring TM. 2001. The Bemisia tabaci species complex. Crop Protection. 20:725-737.
20
Polston JE, anderson PK. 1997. The emergence of whitefly-transmitted Geminivirus in tomato in the western hemisphere. Plant Disease. 81:1358-1369.
Rojas MR, Gilbertson RL, Rusel DR, Maxwell DP. 1993. Use of degenerate primers in the polymerase chain reaction to detect whitefly transmitted Geminivirus. Plant Disease. 71:340-347.
Salati R, Nahla MK, Rojas MR, Guzman P, Jaquez J, Maxwell DP, Gilbertson RL. 2002. Tomato yellow leaf curl virus in the Dominican Republic: Characterization of an infectious clone, virus monitoring in whiteflies, and identification of reservoir hosts. Journal of Virology. 92(5):487-496.
Santoso TJ. 2008. Identifikasi Begomovirus Indonesia pada tomat dan analisis diversitas genetik gen AV1 serta pemanfaatannya untuk pengembangan tanaman tahan virus [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Strenger DC, Duffus JE, Vilalon B. 1990. Biological and genomic properties of Geminivirus isolated from pepper. Phytopathology. 80:704-709.
Sudiono. 2001. Deteksi dan identifikasi virus gemini pada tanaman tomat [tesis]. Bogor (ID): Institut Pertanian Bogor.
Sulandari S, Suseno R, Hidayat SH, Harjosudarmo J, Sosromarsono S. 2005. Deteksi dan kajian kisaran inang virus penyebab penyakit daun keriting kuning cabai. Hayati. 13(1): 1-6.
Trisno J, Hidayat SH, Jamsari, Habzar T, Manti I. 2009. Identifikasi molekuler Begomovirus penyebab penyakit keriting pada tanaman cabai (Capsicum annum) di Sumatera Barat. Jurnal Natur indonesia. 13(1):41-46.
Walkey DGA. 1991. Applied plant virology. London (UK): Chapman and Hall. Wyatt SD, Brown JK. 1996. Detection of subgroup III Geminivirus isolates in leaf
extracts by degenerate primers and Polymerase Chain Reaction. Journal of Phytopathology. (86):1288-1293.
21
22
Lampiran 1 Organisasi genom monopartit (i) dan bipartit (ii) Begomovirus. TYLCV, Tomato yellow leaf curl virus; TGMV A, DNA A Tomato yelow golden mosaic virus; TGMV B, DNA B Tomato yelow golden mosaic virus.
(i)
(ii)
Lampiran 2 Jenis dan fungsi gen Begomovirus
Monopartit Bipartit Protein yang disandikan
V1 AV1 Protein selubung (coat protein) yang berfungsi dalam penyebaran dan pergerakan virus di dalam inangnya dan untuk melindungi partikel virus (Hull 2002)
V2 AV2 Movement protein (MP), berperan dalam pergerakan virus dalam
tanaman terinfeksi (Hull 2002)
C1 AC1 Replication-associated protein (Rep) berperan dalam proses
replikasi virus (Bisaro 1994)
C2 AC2 Transcriptional activator protein (TrAp), protein yang terlibat dalam pengaktifan transkripsi dari promoter protein selubung (Bisaro 1994)
C3 AC3 Replication enhancer protein (Ren), meningkatkan akumulasi
DNA virus (Bisaro 1994)
C4 AC4 Berinteraksi dengan C1 dan V2, berperan dalam penentu gejala (Hull 2002)
BV1 Nuclear shuttle protein (NSP) dan menyandikan virion DNA B BV2 Movement protein (MP), terlibat dalam pergerakan virus di
23
Lampiran 3 Urutan basa nukleotida isolat asal Bogor
AATCCATATT
Lampiran 4 Urutan basa nukleotida isolat asal Bandung
AATCCATATT
24
Lampiran 6 Urutan basa nukleotida isolat asal Rembang
AATCCATATT
Lampiran 7 Urutan basa nukleotida isolat asal Bantul
RIWAYAT HIDUP
Penulis dilahirkan di Rembang pada tanggal 25 Mei 1991 dari ayah Subawi dan ibu Suprihatin. Penulis adalah anak pertama dari dua bersaudara. Tahun 2009 penulis lulus dari SMA Negeri 1 Rembang dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Proteksi Tanaman, Fakultas Pertanian.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Biologi Patogen Tumbuhan pada tahun ajaran 2011/2012, asisten praktikum mata kuliah Virologi Tumbuhan dan Ilmu Penyakit Tumbuhan Dasar pada tahun ajaran 2012/2013, asisten praktikum Virologi Tumbuhan dan Dasar Perlindungan Tanaman Program Diploma IPB pada tahun ajaran 2013/2014. Penulis melaksanakan magang pada Bulan Juni 2011 di Balai Karantina Tumbuhan Semarang dan pada bulan Februari tahun 2012 di Laboratorium Pengamatan Hama dan Penyakit Tumbuhan di Bantul, Yogyakarta.
Penulis juga aktif mengikuti Program Kreativitas Mahasiswa bidang
Penelitian dengan judul “Uji efektifitas nematoda Caenorhabditis elegans sebagai
bio-indikator air tercemar bakteri patogen” pada tahun 2011. Penulis juga aktif di