RESPON POHON GAHARU DAN REAKSI HIPERSENSITIF
TEMBAKAU TERHADAP ELISITOR Acremonium spp. DAN
Fusarium spp. ASAL GAHARU
SEPRIYADI RIHI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Acremonium spp. dan Fusarium spp. asal Gaharu. Dibimbing oleh GAYUH RAHAYU dan BONNY POERNOMO WAHYU SOEKARNO.
Penelitian ini dilakukan untuk mengetahui efektifitas biomassa Acremonium spp. dan Fusarium spp. dalam merangsang pembentukkan gejala gaharu dan efektifitas elisitor dinding sel (EDS), elisitor konidia (EK), dan elisitor filtrat kasar (EFK) Acremonium spp. (IPBCC 07.525, 07.526, dan 09.566) dan Fusarium spp. (IPBCC 09.568, 09.569, 09.570, dan 09.571) dalam merangsang respon hipersensitifitas daun tembakau. Biomassa Acremonium spp. dan Fusarium spp. yang ditumbuhkan pada media PDA selama 14 hari dijadikan inokulan pada cabang Gyrinops verstegii. Seluruh elisitor berasal dari kultur Acremonium spp. dan Fusarium spp. berumur 12 hari pada media PDB. Pembentukkan gaharu dinyatakan dalam sistem skor 0-10 dan diklasifikasikan dalam tiga kategori berdasarkan rataan skor pada setiap pengamatan dari tiga responden. Acremonium sp. IPBCC 07.526, 09.566, dan Fusarium sp. IPBCC 09.571 dapat menginduksi pembentukkan gaharu dengan skor berturut-turut 2,67, 2,89, dan 2,78 pada 14 hari setelah inokulasi (hsi). Gaharu ini dalam kategori 2.Reaksi hipersensitif daun tembakau (Nicotiana tabacum cv. Gewol) terhadap EDS, EK, dan EFK dari semua isolat ditunjukkan berupa bercak-bercak nekrosis dengan skor 0,33-1,33 dari sistem skor 0-3. Semua elisitor memiliki patogenitas yang berbeda. Kemampuan cendawan menginduksi pembentukkan gaharu sebanding dengan reaksi hipersensitif terhadap elisitor-elisitor tersebut. Gejala pembentukkan gaharu Acremonium sp. IPBCC 07.526, 09.566, dan Fusarium sp.IPBCC 09.571 dengan reaksi hipersensitif EDS, EK, EFK-nya berkorelasi positif, tinggi, dan signifikan dengan nilai koefisien korelasi (r) berturut-turut 0,831, 0,884, dan 0,884.
Kata kunci: Pembentukkan gaharu, reaksi hipersensitif, Acremonium, Fusarium, elisitor.
ABSTRACT
SEPRIYADI RIHI. Agarwood Tree Response and Hypersensitivity Reactions of Tobacco Due to Elicitors of Acremonium spp. and Fusarium spp. from Agarwood. Under supervision of GAYUH RAHAYU and BONNY POERNOMO WAHYU SOEKARNO.
This research was carried out to investigate the effectiveness of Acremonium spp. and Fusarium spp. biomass in inducing agarwood formation and the effectiveness of the cell wall elicitor (CWE), conidia elicitor (CE), and crude filtrate elicitor (CFE) of Acremonium spp. (IPBCC 07.525, 07.526, 07.566) and Fusarium spp. (IPBCC 09.568, 09.569, 09.570, 09.571) in inducing the hypersensitivity response of tobacco leaves. Biomass of Acremonium spp. and Fusarium spp. were grown on PDA medium for 14 days and used as inoculant on Gyrinops verstegii branch. All Elicitors were derived from the 12 days Acremonium spp. and Fusarium spp. culture in PDB medium. Agarwood formation was determined by score system (0-10) and classified into three categories based on the average score of each three respondents observation. Acremonium sp. IPBCC 07.526, 07.566, and Fusarium sp. IPBCC 09.571 induced agarwood formation with scores 2,67, 2,89, and 2,78, respectively at 14 days after inoculation (dai). These agarwood were in category 2. Hypersensitive reaction of tobacco leaves (Nicotiana tabacum cv. Gewol) caused by elicitors of all isolates were shown in the necrosis spot with score range of 0,33-1,33 from score system 0-3. All elicitors had the different pathogenicity. The ability of fungi to induce agarwood formation were comparable to hypersensitivity reaction caused by those elicitors. The correlation of agarwood formation by Acremonium sp. IPBCC 07.526, 07.566, Fusarium sp. 09.571 with hypersensitive reaction of their EDS, EK, EFK was positive, high, and significant with correlation coefficient (r) values respectively were 0,831, 0,884, 0,884.
RESPON POHON GAHARU DAN REAKSI HIPERSENSITIF
TEMBAKAU TERHADAP ELISITOR
Acremonium
spp. DAN
Fusarium
spp. ASAL GAHARU
SEPRIYADI RIHI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains di
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Nama
: Sepriyadi Rihi
NIM
: G34070012
Departemen : Biologi
Menyetujui :
Pembimbing I,
Dr. Ir. Gayuh Rahayu
NIP. 19580105 198303 2 002
Pembimbing II,
Dr. Ir. Bonny P. W. Soekarno, MS
NIP.19620618 198811 1 001
Mengetahui :
Kepala Departemen Biologi
Institut Pertanian Bogor
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
NIP. 19641002 198903 1 002
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas karunia-Nya sehingga karya ilmiah
ini dapat diselesaikan. Penelitian dengan judul “Respon Pohon Gaharu dan Reaksi Hipersensitif
Tembakau Terhadap Elisitor Acremonium spp. dan Fusarium spp. Asal Gaharu” ini dilakukan mulai Maret 2011 sampai dengan Januari 2012 di Laboratorium Mikologi dan Rumah Kaca, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor dan di Kebun pohon gaharu, Ciapus.
Terima kasih penulis ucapkan kepada Dr. Ir. Gayuh Rahayu, MS selaku pembimbing I dan pemberi dana penelitian, Dr. Ir. Bonny P. W. Soekarno, MS selaku pembimbing II atas bimbingan dan pengarahan yang telah diberikan, dan Dr. Ir. Triadiati, M.Si selaku penguji atas saran dan masukannya. Terima kasih kepada Ayah, Ibu, Adik (Fitria dan Ari Syamsudin Uwa), serta seluruh keluarga atas segala dukungan baik semangat, materil, serta doa selama penulis menempuh pendidikan hingga karya ilmiah ini terselesaikan. Ungkapan terima kasih juga ditujukan kepada Ibu Emi, Bapak Kusnadi, Bapak Dadang, Bapak Ramzi, Bapak Acing, Bapak Bahrudin, Bapak Joni, Bapak Yosi, Kak Erwin, Kak Risti, Riana M. Handayani, Rahmah Waty, Lestari, M. Arief Rohmatullah, Wawan Dinawan, Art Fudlaili F., Dean A. Ramadhan, dan teman-teman Biologi 44 untuk bantuan dan kerja samanya. Semoga karya ilmiah ini dapat bermanfaat untuk perkembangan ilmu pengetahuan.
Bogor, April 2012
Ali Uwa dan ibunda Yuliana Upa Rihi. Penulis merupakan anak pertama dari tiga bersaudara. Tahun 2007 penulis lulus dari SMA Negeri 1 Waingapu, Sumba Timur, NTT dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
BAHAN DAN METODE ... 2
Waktu dan Tempat Penelitian ... 2
Bahan dan Alat ... 2
Metode ... 2
Rancangan Percobaan ... 2
Peremajaan Biakan Acremonium spp.dan Fusarium spp. ... 2
Inokulasi Acremonium spp. dan Fusarium spp. pada Cabang G. verstegii ... 2
Penilaian Gejala Pembentukkan Gaharu ... 2
Produksi Elisitor ... 3
Uji Reaksi Hipersensitif... 3
HASIL DAN PEMBAHASAN ... 4
Gejala Pembentukkan Gaharu ... 4
Reaksi Hipersensitif ... 6
SIMPULAN ... 9
DAFTAR PUSTAKA ... 9
1 Sistem skor respon G. verstegii terhadap inokulasi Acremonium spp. dan Fusarium spp. ... 3
2 Kategori tingkat pembentukkan gaharu ... 3
3 Kategori gejala reaksi hipersensitif ... 4
4 Kategori gejala pembentukkan gaharu pada cabang G. verstegii setelah diinduksi Acremonium
spp. dan Fusarium spp... 5
DAFTAR GAMBAR
Halaman
1 Skor gejala pembentukkan gaharu pada 14 hsi setelah diinokulasi Acremonium spp. dan
Fusarium spp.. ... 5
2 Pertambahan panjang dan kedalaman zona perubahan warna pada cabang G. verstegii hasil
inokulasi Acremonium spp. dan Fusarium spp. (14 hsi). ... 6
3 Hasil uji reaksi hipersensitif EK, EFK, dan EDS Acremonium spp. dan Fusarium spp. pada
tanaman tembakau (N. tabacum cv. Gewol). ... 7
4 Hasil uji reaksi hipersensitif berupa bercak-bercak nekrosis pada tanaman tembakau (N.
tabacum cv. Gewol) menggunakan EDS, EK, dan EFK. ... 8
5 Korelasi antara gejala pembentukkan gaharu dengan reaksi hipersensitif akibat pemberian
elisitor Acremonium sp. IPBCC 07.526, 07.566, Fusarium sp. IPBCC 09.571 dan elisitor
Acremonium sp. IPBCC 07.525, Fusarium sp. 09.568, 09.569, 09.570. ... 8
DAFTAR LAMPIRAN
Halaman
1 Uji korelasi antara gejala pembentukkan gaharu dengan reaksi hipersensitif oleh isolat
pembentuk gaharu kategori 2. ... 12
1 Uji korelasi antara gejala pembentukkan gaharu dengan reaksi hipersensitif isolat pembentuk
PENDAHULUAN Latar Belakang
Gaharu merupakan sejenis kayu dengan berbagai bentuk dan warna yang khas, serta memiliki kandungan damar wangi (Dewan Standar Nasional Indonesia 1999). Sebagai salah satu hasil hutan bukan kayu, gaharu memiliki nilai ekonomis tinggi dan dimanfaatkan sebagai obat-obatan, dupa, dan parfum (Barden et al. 2000). Di Indonesia, gaharu umumnya dipanen dari pohon Aquilaria malaccensis, A. microcarpa, A. filaria, dan Gyrinops verstegii (Rahayu 2010).
Pembentukkan gaharu merupakan respon pertahanan pohon gaharu terhadap kerusakan mekanis atau infeksi cendawan. Respon pertahanan ini menghasilkan resin
berupa senyawa terpenoid yang
terakumulasi di sekitar bagian jaringan kayu yang mengalami kerusakan atau terinfeksi (Rahayu 2010). Beberapa cendawan telah diisolasi dari pohon gaharu dan memiliki kemampuan menginduksi pembentukkan gaharu, seperti Acremonuim spp. dan Fusarium spp. (Putri 2007; Wulandari 2009; Rahayu 2010). Selain cendawan, penelitian Putri (2007) menunjukkan penginduksian gaharu menggunakan bahan kimia (metil jasmonat) juga dapat menginduksi pembentukkan wangi gaharu. Penggunaan inokulan ganda (Acremonium sp. dan Fusarium sp.) dalam menginduksi gaharu juga menghasilkan tingkat wangi yang lebih tinggi dibandingkan penggunaan inokulan tunggal (Wulandari 2009).
Pemanenan gaharu yang terbentuk secara alami menimbulkan kekhawatiran terhadap kelestarian pohon gaharu. Gaharu yang berhasil dikumpulkan dari penebangan pohon penghasil gaharu tidak sebanding dengan jumlah pohon yang ditebang (Soehartono 2001). Hal ini menimbulkan kekhawatiran menyusutnya ketersediaan pohon penghasil gaharu di alam. Sehingga, semenjak tahun 1994, pohon gaharu tercatat dalam IUCN (International Union for Conservation of Nature) redlist dan Apendiks II CITES (Convention on International Trade in Endangered Species of Wild Fauna or Flora) sebagai tanaman yang dilindungi (Soehartono 2000; Rahayu 2009). Oleh karena itu, peningkatan budi daya pohon gaharu dan penyempurnaan teknik induksi gaharu buatan perlu dilakukan untuk menjaga kelestarian pohon gaharu (Rahayu 2009).
Pengembangan teknik induksi gaharu dapat dilakukan dengan mempelajari interaksi inang-patogen. Pendekatan ini dapat dilakukan dengan menganalisis interaksi elisitor-fitoaleksin. Elisitor merupakan senyawa yang dihasilkan oleh mikroorganisme patogen dan berperan menjadi molekul sinyal sistem pertahanan tubuh tanaman inang (Montesano 2003). Senyawa ini dapat berupa produk suatu mikroorganisme atau bagian dari mikroorganisme itu sendiri. Pada tumbuhan tingkat tinggi, elisitor yang dihasilkan patogen akan dikenali oleh reseptor spesifik yang mengakibatkan akumulasi senyawa fitoaleksin. Interaksi elisitor-fitoaleksin menghasilkan suatu respon pertahanan tubuh tanaman inang yang disebut respon hipersensitif (Montesano 2003; Suzuki 1999). Respon ini hanya berkembang di sekitar daerah infeksi sehingga disebut sebagai respon lokal. Pada tanaman, respon hipersensitif biasanya ditunjukkan berupa bercak nekrosis pada daun. Reaksi hipersensitif dapat menggambarkan interaksi antara ketahanan inang dengan virulensi patogen (Park 2005).
Penelitian mengenai elisitor cendawan telah banyak dilakukan. Lisker dan Kuć (1977) telah membuktikan bahwa ekstrak dinding sel beberapa Oomycetes dapat merangsang akumulasi fitoaleksin pada potongan umbi tanaman kentang. Ortega dan Perez (2001) menyatakan bahwa konidia Alternaria alternata menyebabkan reaksi hipersensitif kotiledon jeruk (Citrus lemon). Takahashi et al. (2008) juga menyatakan bahwa elisitor asal dinding sel dapat menyebabkan kematian kultur sel padi.
Elisitor dapat dibagi dalam dua kelompok yaitu elisitor umum dan spesifik ras (Montesano et al. 2003). Beberapa tanaman seperti tembakau seringkali digunakan sebagai tanaman indikator reaksi hipersensitif. Penelitian Khayrunissa (1999) menunjukkan penggunaan elisitor filtrat kasar (EFK), elisitor dinding sel (EDS), dan elisitor sitoplasma (ES) Acremonium sp. menghasilkan gumpalan harum pada kalus A. crassna. Pengujian lebih lanjut menunjukkan adanya beberapa senyawa gaharu, namun kadarnya lebih rendah dibandingkan pada gaharu alami.
cendawan. Penggunaan inokulan berupa biomassa cendawan berisiko terhadap lingkungan. Menurut Rahayu (2009), karakteristik mikroorganisme patogen dapat mengalami perubahan dalam kurun waktu tertentu, seperti kasus Oncobasidium theobromae yang menyerang tanaman cokelat di Indonesia.
Bentuk inokulan alternatif perlu diteliti dan dikembangkan untuk mengurangi resiko lingkungan. Salah satu bentuk inokulan yang mungkin dikembangkan adalah inokulan berbasis elisitor. Oleh sebab itu, penelitian awal mengenai elisitor Acremonium sp. dan Fusarium sp. termasuk virulensinya yang diukur melalui reaksi hipersensitif tanaman tembakau perlu dilakukan sebagai dasar pengembangan inokulan baru.
Tujuan
Penelitian ini bertujuan mengetahui kemampuan biomassa Acremonium spp. dan Fusarium spp. dalam menginduksi pembentukkan gejala gaharu pada G. verstegii dan korelasinya dengan kemampuan elisitor cendawan tersebut dalam menginduksi reaksi hipersensitif pada daun tembakau (Nicotiana tabacum).
BAHAN DAN METODE Waktu dan Tempat Penelitian
Penelitian dilakukan mulai bulan Mei 2011 sampai dengan Januari 2012 di laboratorium Mikologi dan rumah kaca, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam dan kebun gaharu, Ciapus.
Bahan dan Alat
Bahan yang digunakan adalah biakan Acremonium spp. (IPBCC 07.525, IPBCC 07.526, dan IPBCC 09.566) dan Fusarium spp. (IPBCC 09.568, IPBCC 09.569, IPBCC 09.570, dan IPBCC 09.571), media PDA (Potato Dextrose Agar), media PDB (Potato Dextrose Broth), Natrium Bikarbonat (NaHCO3), pohon gaharu berumur ±8 tahun (G. verstegii) dan tanaman tembakau (N. tabacum cv. Gewol) berumur ±5 bulan. Alat yang digunakan adalah polybag, tisu steril, erlenmeyer, mesin penggoyang, kertas saring, tabung reaksi, dan peralatan laboratorium lain yang umum digunakan.
Metode
Rancangan Percobaan
Rancangan percobaan yang digunakan
untuk menguji gejala pembentukkan gaharu, perubahan panjang, dan kedalaman warna zona induksi digunakan rancangan acak lengkap (RAK) dengan satu faktor (tujuh taraf) dan tiga ulangan. Sedangakan pengujian reaksi hipersensitif digunakan RAK dua faktor, yaitu jenis isolat (tujuh faktor) dan jenis elisitor (tiga taraf), dan tiga ulangan.
Peremajaan Biakan Acremonium spp.dan
Fusarium spp.
Isolat Acremonium spp. dan Fusarium spp. diremajakan pada media PDA dan diinkubasi pada suhu ruang selama 7 hari. Selanjutnya sebanyak 3 potong biakan (diameter 5 mm) Acremonium spp. dan Fusarium spp. dimasukkan ke dalam erlenmeyer (uk. 250 mL) yang telah berisi 100 mL PDB steril. Biakan kemudian diinkubasi pada suhu 37oC, di atas mesin penggoyang selama 12 hari. Biakan ini akan digunakan sebagai sumber EFK, EK, dan EDS.
Inokulasi Acremonium spp. dan Fusarium
spp. pada Cabang G. verstegii
Biakan Acremonium spp. dan Fusarium spp. berumur 7 hari diinokulasikan pada cabang pohon G. verstegii yang mempunyai diameter ±1 cm. Sebelum inokulasi, cabang dilukai sepanjang 2 cm dengan membuang kulit dan kambiumnya. Sepotong inokulum (±2 cm x 0,5 cm) Acremonium spp. dan Fusarium spp. ditempelkan pada daerah yang telah dilukai. Setelah seluruh permukaan luka ditempel dengan biakan Acremonium spp. dan Fusarium spp., kemudian luka dilapisi dengan kapas basah dan terakhir dibalut dengan selotip. Sebagai pembanding digunakan batang tanaman yang hanya dilukai sebagai kontrol positif dan tanaman yang sehat yang tidak diberi perlakuan sebagai kontrol negatif. Hasil inokulasi dipanen setelah berumur 14 hari. Masing-masing perlakuan diulang dalam 3 kelompok (3 pohon). Pengacakan dilakukan pada masing-masing kelompok percobaan.
Penilaian Gejala Pembentukkan Gaharu
3
Tabel 1 Sistem skor respon G. verstegii terhadap inokulasi Acremonium spp. dan Fusarium spp.
Skor Gejala
Daun Warna Kayu Wangi
0 tidak klorosis/klorosis putih tidak wangi
1 tidak klorosis/klorosis putih kecoklatan tidak wangi
2 tidak klorosis/klorosis coklat tidak wangi
3 klorosis putih kecoklatan agak wangi
4 tidak klorosis putih kecoklatan agak wangi
5 klorosis coklat agak wangi
6 tidak klorosis coklat agak wangi
7 klorosis putih kecoklatan wangi
8 tidak klorosis putih kecoklatan wangi
9 klorosis coklat wangi
10 tidak klorosis coklat wangi
Rataan skor = sko ∑tanaman sko n ∑tanaman n
∑tanaman
Xn : Tanaman ke–n.
Tabel 2 Kategori tingkat pembentukkan gaharu
Kategori Skor Tingkat pembentukkan gaharu
1 7-10 gaharu sudah terbentuk
2 3-6 gaharu mulai terbentuk
3 0-2 gaharu tidak terbentuk
Selain gejala pembentukkan gaharu, pertambahan panjang dan kedalaman zona perubahan warna juga diamati. Pertambahan panjang zona perubahan warna adalah panjang kayu yang mengalami pertambahan panjang perubahan warna ke arah tajuk (atas) atau ke arah akar (bawah) diluar daerah yang diinokulasi atau dilukai. Kulit kayu di sisi atas dan bawah daerah yang diinokulasi dan dilukai dikupas dan panjang perubahan warnanya diukur. Sedangkan kedalaman perubahan warna diamati pada sayatan melintang daerah yang diinokulasi atau dilukai (Putri 2011).
Produksi Elisitor
Ketiga jenis elisitor (EDS, EK, EFK) diperoleh dengan metode Yang et al. (1989) yang dimodifikasi. Biomassa cendawan berupa miselium dan spora dari biakan berumur 12 hari, dipisahkan dari filtratnya dengan menggunakan kertas saring Whatman no. 1. Supernatan disentrifugasi dua kali pada suhu 4oC selama 20 menit pada 14000 g untuk memisahkan endapan. Supernatan pekat ini mengandung suspensi konidia yang dipergunakan sebagai EK. Sebagian filtrat (EK) dibebaskan dari konidia dengan cara penyaringan
menggunakan kertas saring milipor (0,22 µm). Hasil penyaringan ini adalah EFK.
Biomassa cendawan dihaluskan dengan N2 cair pada mortar steril. Kemudian pasta ini diekstrak dengan 4 mM natrium bikarbonat (1,3 mL NaHCO3 4 mM/g massa miselium segar). Setelah disimpan semalam pada suhu 4oC, suspensi disentrifugasi selama 20 menit pada 14000 g. Endapan yang diperoleh adalah dinding sel cendawan. Endapan ini dilarutkan dalam aquades (50 kali volume EDS) dan diautoklaf selama dua jam pada suhu 121oC. Suspensi dinding sel dibekukan disebut sebagai EDS.
Uji Reaksi Hipersensitif
Setelah masa inkubasi berakhir, nekrosis yang terbentuk diamati. Derajat hipersensitif dinilai dalam skor 0-3 (Tabel 3). Virulensi dinyatakan dalam rataan skor hipersensitif (Putri 2011).
Tabel 3 Kategori gejala reaksi hipersensitif
Skor Gejala
0 tidak ada gejala nekrosis/klorosis 1 beberapa bercak kecil nekrosis 2 kurang dari setengah luasan daun
menunjukkan gejala nekrosis 3 lebih dari setengah luasan daun
mengalami nekrosis
Analisis Data
Data gejala pembentukkan gaharu, perubahan panjang, dan kedalaman warna zona induksi dianalisis menggunakan rancangan acak kelompok (RAK) satu faktor dan reaksi hipersensitif menggunakan RAK dua faktor dengan perangkat lunak SPSS versi 16 dan diuji F pada α = 5%. Bila terdapat pengaruh nyata dari perlakuan yang diamati maka setiap taraf perlakuan dibandingkan dengan menggunakan uji lanjut Duncan pada taraf 5%. Korelasi antara gejala pembentukkan gaharu dengan reaksi hipersensitif dianalisis menggunakan perangkat lunak SPSS versi 16.
HASIL DAN PEMBAHASAN Gejala Pembentukkan Gaharu
Semua cabang G. verstegii yang dilukai dan diinokulasi cendawan menunjukkan gejala pembentukkan gaharu pada 14 hsi (hari setelah induksi). Gejala pembentukkan gaharu yang ditandai dengan munculnya aroma wangi dan perubahan warna kayu dapat dinilai dengan sistem skor seperti seperti dinyatakan oleh Putri (2007) dan Rahayu (2010).
Semua perlakuan menggunakan
cendawan dan kontrol positif menunjukkan adanya gejala pembentukkan gaharu dengan nilai skor yang lebih tinggi dan berbeda nyata dibandingkan kontrol negatif. Batang yang diberi perlakuan Acremonium sp.
IPBCC 07.526 dan IPBCC 07.566
menunjukkan adanya pembentukkan gejala gaharu dengan skor relatif rendah, yaitu berturut-turut 2,67 dan 2,89 dari nilai skor maksimum 10. Nilai skor ini tidak berbeda nyata dengan nilai skor 2,78 untuk gejala pembentukkan gaharu yang disebabkan oleh Fusarium sp. IPBCC 09.571 (Gambar 1). Cabang yang diinduksi cendawan lainnya,
yaitu Acremonium sp. IPBCC 07.525 dan Fusarium sp. IPBCC 09.568, 09.569 serta Fusarium sp. IPBCC 09.570 menunjukkan gejala pembentukkan gaharu dengan nilai skor yang lebih rendah (berturut-turut 2,00, 0,78, 0,67, dan 0,67) dan berbeda nyata dari gejala pembentukkan gaharu akibat inokulasi Acremonium sp. IPBCC 07.526 dan 07.566 serta Fusarium sp. IPBCC 09.571. Batang yang hanya dilukai (kontrol positif) juga menunjukkan adanya gejala pembentukkan gaharu dengan nilai skor 0,44, sedangkan kontrol negatif (skor 0,00) tidak terlihat adanya gejala pembentukkan gaharu (Gambar 1).
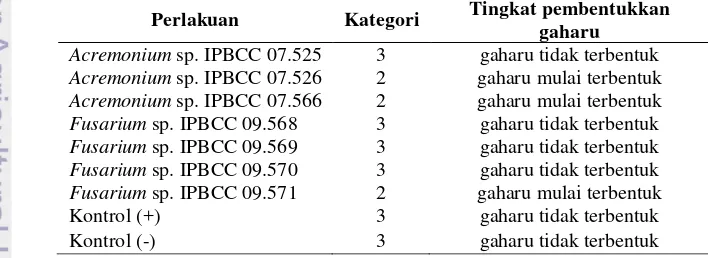
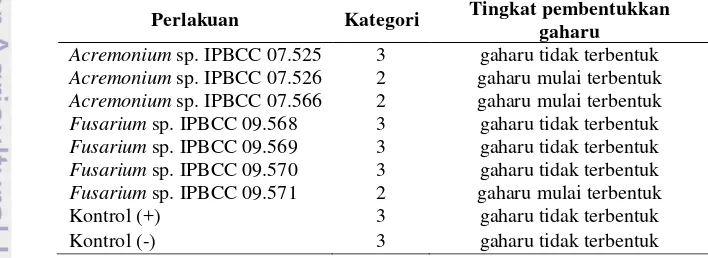
Nilai skor pembentukkan gaharu
diklasifikasikan dalam kategori
pembentukkan (Tabel 4). Gejala yang dibentuk akibat inokulasi Acremonium sp. IPBCC 07.526, 07.566 dan Fusarium sp. IPBCC 09.571 termasuk kategori 2 yang berarti gaharu mulai terbentuk. Sedangkan Acremonium sp. IPBCC 07.525 dan Fusarium sp. IPBCC 09.568, 09.569, 09.570 tidak merangsang pembentukkan gaharu (kategori 3). Demikian pula pada kontrol positif dan negatif tidak terdapat pembentukkan gaharu (kategori 3). Hasil ini juga menunjukkan hampir semua isolat Acremonium spp. dapat menginduksi pembentukkan gubal gaharu dibandingkan Fusarium sp. Pada penelitian sebelumnya, Acremonium sp. IPBCC 07.525 dinyatakan sebagai isolat yang berpotensi menginduksi pembentukkan gaharu (Rahayu et al. 1999; Wulandari 1999). Putri (2011) dan Hodijah (2011) menyatakan bahwa Fusarium sp. IPBCC 09.568, 09.569, 09.570 juga
berpotensi sebagai penginduksi
pembentukkan gaharu. Isolat Acremonium sp. IPBCC 07.566 memiliki tingkat patogenitas yang lebih tinggi dibandingkan Acremonium sp. IPBCC 07.525 dan 07.526 (Rahayu 2010). Hal ini menunjukkan tingkat patogenitas, interaksi yang stabil antara cendawan dengan tanaman inang, dan viabilitas isolat dapat menentukan keberhasilan pembentukkan gaharu (Rahayu & Situmorang 2006; Wulandari 2009; Rahayu 2010; Hodijah 2011). Kondisi
lingkungan juga mempengaruhi
pertumbuhan cendawan penginduksi gaharu pada tanaman inangnya. Aerasi yang baik akan menjaga dan meningkatkan kolonisasi gaharu di dalam tanaman gaharu (Isnaini 2004; Jensen 2010; Putri 2011).
5
perubahan warna kayu dapat berubah selama
masa pembentukkan gaharu. Zona
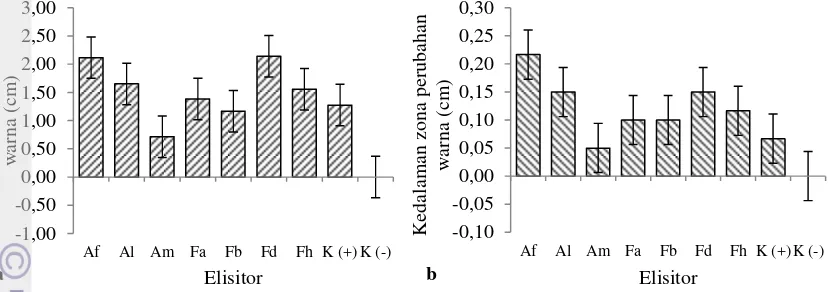
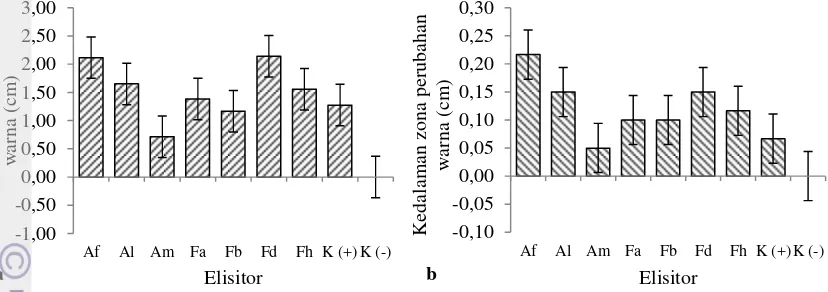
perubahan warna kayu dapat memanjang ke arah atas dan bawah dari zona induksi (Putri 2007). Panjang perubahan warna ini bervariasi pada setiap penginduksi (Gambar 2a). Zona perubahan warna terpanjang ditunjukkan oleh batang yang diinokulasi Fusarium sp. IPBCC 09.570 (2,14 cm) dan Acremonium sp. IPBCC 07.525 (2,12 cm) dan tidak berbeda nyata dengan panjang zona itu akibat inokulasi Acremonium sp. IPBCC 07.526 (1,65 cm), Fusarium sp. IPBCC 09.568 (1,38 cm) dan 09.571 (1,56 cm). Zona perubahan warna yang lebih pendek ditunjukkan oleh cabang yang diinokulasi Acremonium sp. IPBCC 07.566 (0,72 cm), dan Fusarium sp. IPBCC 09.569 (1,17 cm) yang hanya berbeda nyata dari perlakuan Acremonium sp. IPBCC 07.525 dan Fusarium sp. IPBCC 09.570. Pada kontrol positif terdapat perubahan panjang warna sebesar 1,28 cm, sedangkan kontrol negatif tidak terjadi perubahan warna (Gambar 2a).
Perubahan warna kayu juga mengarah ke dalam cabang. Cendawan yang mampu menginduksi perubahan warna kayu terpanjang (Acremonium sp. IPBCC 07.525 dan Fusarium sp. IPBCC 09.570) juga menunjukkan kemampuannya merangsang pembentukkan perubahan warna kayu yang relatif dalam. Kedalaman zona perubahan warna kayu akibat perlakuan Acremonium sp. IPBCC 07.525 (22 mm) dan Fusarium sp. IPBCC 09.570 (15 mm) tidak berbeda nyata dengan perlakuan Acremonium sp. IPBCC 07.526 (15 mm) dan Fusarium sp. IPBCC 07.571 (12 mm). Inokulasi Acremonium sp. IPBCC 07.525 menyebabkan perubahan kedalaman warna terdalam dan berbeda nyata dibandingkan dengan perlakuan Acremonium sp. IPBCC 07.566, Fusarium sp. 09.568 dan 09.569 yang kurang dari 10 mm. Acremonium sp. IPBCC 07.566 memiliki pengaruh yang sama dengan perlakuan kontrol positif (7 mm) dan kontrol negatif (0,00 mm) (Gambar 2b).
Gambar 1 Skor gejala pembentukkan gaharu setelah diinokulasi Acremonium spp. dan Fusarium spp. pada 14 hsi.
Keterangan: Af: Acremonium sp. IPBCC 07.525, Al: Acremonium sp. IPBCC 07.526, Am: Acremonium sp. IPBCC 09.566; Fa: Fusarium sp. IPBCC 09.568, Fb: Fusarium sp. IPBCC 09.569, Fd: Fusarium sp. IPBCC 09.570, Fh: Fusarium sp. IPBCC 09.571; K(+): kontrol positif, K(-): kontrol negatif.
Tabel 4 Kategori gejala pembentukkan gaharu pada cabang G. verstegii setelah diinduksi Acremonium spp. dan Fusarium spp. saat 14 hsi.
Perlakuan Kategori Tingkat pembentukkan gaharu
Acremonium sp. IPBCC 07.525 3 gaharu tidak terbentuk Acremonium sp. IPBCC 07.526 2 gaharu mulai terbentuk Acremonium sp. IPBCC 07.566 2 gaharu mulai terbentuk Fusarium sp. IPBCC 09.568 3 gaharu tidak terbentuk Fusarium sp. IPBCC 09.569 3 gaharu tidak terbentuk Fusarium sp. IPBCC 09.570 3 gaharu tidak terbentuk Fusarium sp. IPBCC 09.571 2 gaharu mulai terbentuk
Kontrol (+) 3 gaharu tidak terbentuk
Kontrol (-) 3 gaharu tidak terbentuk
-0,50 0,00 0,50 1,00 1,50 2,00 2,50 3,00 3,50
Af Al Am Fa Fb Fd Fh K (+) K (-)
Sk
o
r
g
ej
ala
p
em
b
en
tu
k
k
an
g
ah
ar
u
Gambar 2 Pertambahan panjang (a) dan kedalaman zona perubahan warna (b) pada cabang G. verstegii hasil inokulasi Acremonium spp. dan Fusarium spp. saat 14 hsi.
Keterangan: Af: Acremonium sp. IPBCC 07.525, Al: Acremonium sp. IPBCC 07.526, Am: Acremonium sp. IPBCC 09.566; Fa: Fusarium sp. IPBCC 09.568, Fb: Fusarium sp. IPBCC 09.569, Fd: Fusarium sp. IPBCC 09.570, Fh: Fusarium sp. IPBCC 09.571; K(+): kontrol positif, K(-): kontrol negatif.
Kemampuan cendawan untuk
menginduksi perubahan warna kayu dengan zona yang relatif panjang dan dalam tidak selalu diikuti oleh kemampuannya dalam merangsang pembentukkan gejala gaharu. Hal ini membuktikan bahwa kontribusi kriteria aroma wangi dalam pemeringkatan gejala pembentukkan gaharu sangat dominan. Rahayu et al. (1999) juga melaporkan perubahan warna kayu tidak selalu diikuti timbulnya aroma wangi khas gaharu. Adanya aroma wangi khas gaharu disebabkan akumulasi senyawa kimiawi yang berfungsi menghambat perkembangan patogen dan diduga merupakan bagian dari senyawa fitoaleksin. Senyawa ini memiliki aroma yang khas dan mudah menguap (Michiho 2005).
Reaksi Hipersensitif
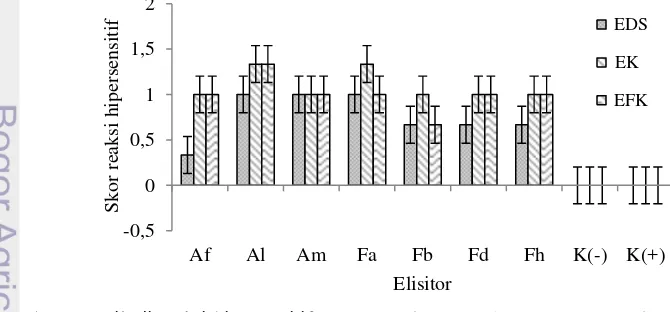
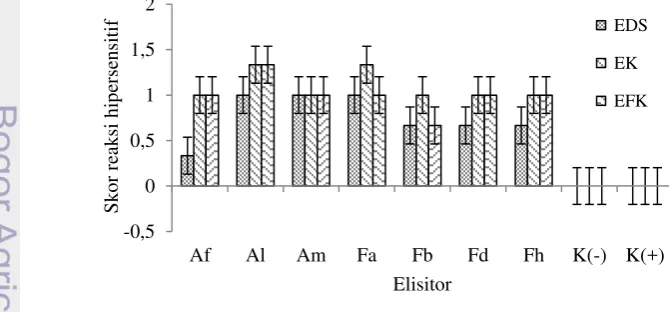
Daun tembakau menunjukkan reaksi hipersensitif terhadap pemberian semua jenis elisitor (EK, EFK, dan EDS) dari semua cendawan. Gejala yang ditunjukkan berupa bercak-becak nekrosis yang tersebar di seluruh permukaan daun. Hasil uji F menunjukkan semua isolat memberikan pengaruh yang nyata terhadap reaksi hipersensitif (F-hitung = 9,717 dan P<0,05). Semua elisitor juga berpengaruh nyata terhadap (F-hitung = 3,267 dan P<0,05) reaksi hipersensitif. Hal ini menunjukkan bahwa cendawan dan elisitor memiliki patogenisitas berbeda.
Semua perlakuan menggunakan elisitor (EDS, EK, EFK) memiliki skor reaksi hipersensitif yang lebih tinggi dibandingkan
kontrol positif dan negatif, kecuali EDS Acremonium sp. IPBCC 07.525 (Gambar 3).
Pemberian EDS Acremonium sp. IPBCC 07.526, IPBCC 07.566, dan Fusarium sp. IPBCC 09.568 merangsang daun tembakau membentuk reaksi hipersensitif dengan skor 1.00 dan berbeda nyata dibandingkan kontrol. EDS Acremonium sp. IPBCC 07.525 juga merangsang pembentukkan respon hipersensitif dengan skor terendah (0,33). Pemberian elisitor dinding sel Fusarium sp. E5 pada kultur tanaman Euphorbia pekinensis menunjukkan adanya akumulasi senyawa terpenoid (Gao et al. 2011). Khayrunnisa (1999) juga melaporkan pemberian EDS pada kalus A. crassna menghasilkan metabolit sekunder berupa gumpalan-gumpalan kecil berbau harum. Pada cendawan tingkat tinggi, dinding selnya te di i atas β-1,4-N-asetilglukosamin
kitin , α-1,3-glukan, β-1,3- dan β
-1,6-glukan, dan protein (Adams 2004). Semua komponen ini diketahui dapat berperan sebagai elisitor (Vidhyasekaran 2008). Pemberian EK juga menunjukkan reaksi hipersensitif berupa bercak-bercak nekrosis. Beberapa perlakuan EK menyebabkan reaksi hipersensitif dengan skor lebih tinggi dari EDSnya, misal EK Acremonium sp. IPBCC 07.525 dan Fusarium sp. IPBCC 09.568. Perlakuan EK isolat lain memiliki skor 1,00. Semua perlakuan EK memiliki pengaruh yang lebih tinggi dan berbeda nyata dibandingkan kontrol. Hal ini menunjukkan bahwa EK mengandung senyawa-senyawa aktif dan adanya konidia berkontribusi terhadap reaksi hipersensitif. Fujita et al. (2004) menunjukkan kontak antara konidia
a -0,10 -0,05 0,00 0,05 0,10 0,15 0,20 0,25 0,30
Af Al Am Fa Fb Fd Fh K (+) K (-)
Ked alam an zo n a p er u b ah an w ar n a (cm ) Elisitor -1,00 -0,50 0,00 0,50 1,00 1,50 2,00 2,50 3,00
Af Al Am Fa Fb Fd Fh K (+) K (-)
P an jan g zo n a p er u b ah an w ar n a (cm )
7
-0,5 0 0,5 1 1,5 2
Af Al Am Fa Fb Fd Fh K(-) K(+)
Sk
o
r
rea
k
si
h
ip
er
sen
sitif
Elisitor
EDS
EK
EFK asal cendawan non-patogenis seperti
Blumeria graminis f. sp. hordei, B. graminis f. sp. tritici, dan Erysiphe pisi dengan kultur tanaman barley menghasilkan matriks ekstraseluler yang mengandung elisitor. Matriks ini juga menghasilkan enzim seperti xilanase, kutinase, selulase, pectinase, dan enzim hidrolitik (Vidhyasekaran 2008).
Reaksi hipersensitif akibat perlakuan EFK semua isolat menunjukkan nilai skor yang sama (1,00), kecuali Acremonium sp. IPBCC 07.526 (1,33) dan Fusarium sp. IPBCC 09.569 (0,67). Semua perlakuan menunjukkan nilai skor reaksi hipersensitif yang lebih tinggi dan berbeda nyata dibandingkan kontrol (Gambar 3). Hal ini menunjukkan bahwa EFK mengandung senyawa-senyawa bersifat toksik dan hasil sekresi lainnya yang dapat merangsang respon pertahanan pada tanaman tembakau. Putri (2011) menunjukkan adanya reaksi hipersensitif berupa bercak nekrosis pada daun tembakau yang dioles dengan EFK asal Fusarium sp. Vidhyasekaran (2008) juga melaporkan adanya sintesis enzim fenilalanin ammonia-liase pada daun barley setelah diberi matriks ekstraseluler yang disekresi oleh B. graminis f. sp. hordei. Enzim ini diketahui berperan dalam biosintesis beberapa senyawa-senyawa pertahanan pada tanaman (Vidhyasekaran 2004, 2007).
Reaksi hipersensitif berupa bercak-bercak nekrosis sudah terlihat pada hari kedua setelah pengolesan elisitor pada permukaan daun tembakau. Pada hari kelima, semua perlakuan elisitor (EDS, EK,
EFK) menghasilkan bercak-bercak nekrosis (Gambar 4a). Bercak-bercak nekrosis yang terlihat umumnya berbentuk titik-titik kecil tunggal. Sedangkan pada kontrol tidak terdapat adanya bercak nekrosis (Gambar b). Pada kultur sel tembakau (N. tabacum cv. Xanthi), pemberian elisitor asal P. infestines menghasilkan respon pertahanan berupa aktivasi protein kinase, aktivasi gen-gen yang berkaitan dengan respon pertahanan, alkanisasi medium kultur, dan oxidative burst (Suzuki 1999).
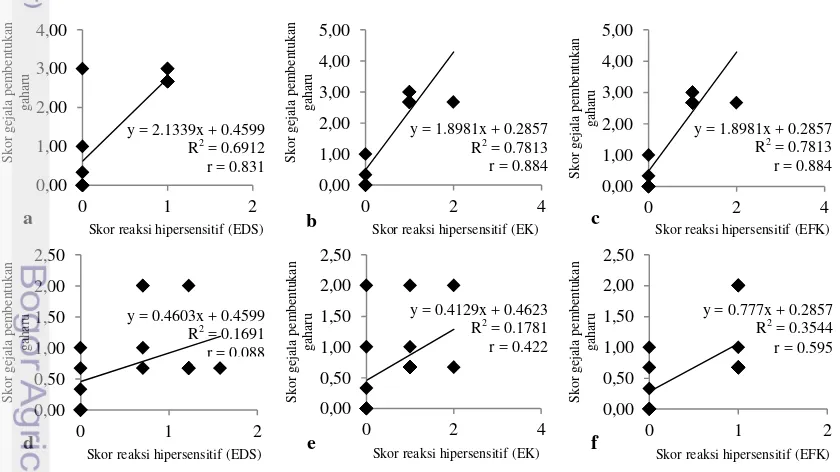
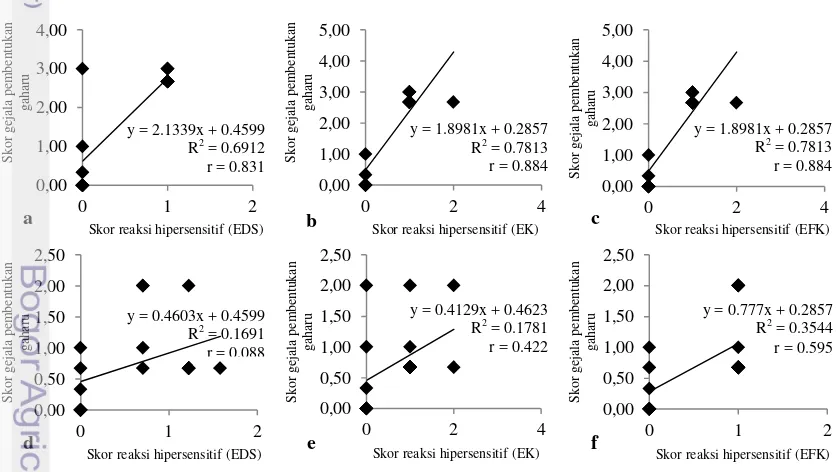
Hubungan antara gejala pembentukkan gaharu dan reaksi hipersensitif pada kelompok isolat yang menyebabkan pembentukkan gaharu (Gambar 5a-c) memiliki nilai yang lebih tinggi dibandingkan kelompok isolat yang tidak
menyebabkan pembentukkan gaharu
(Gambar 5d-f; Lampiran 1). Nilai korelasi (r) antara gejala pembentukkan gaharu kelompok isolat yang menyebabkan pembentukkan gaharu (Acremonium sp. IPBCC 07.526, 07.566, dan Fusarium sp. 09.570) dan reaksi hipersensitif akibat EDS, EK, dan EFKnya berturut-turut sebesar 0,831 (P<0,01), 0,884 (P<0,01), dan 0,884 (P<0,01). Pemberian EDS berpengaruh sebesar 69,12% terhadap pembentukkan
gaharu, sedangkan EK dan EFK
memberikan pengaruh yang sama terhadap gejala pembentukkan gaharu sebesar 78,13% (Gambar 5a-c). Hal ini menunjukkan bahwa EK dan EFK pada kelompok isolat ini memiliki pengaruh yang lebih besar dibandingkan EDS terhadap pembentukkan gaharu.
Gambar 3 Hasil uji reaksi hipersensitif EK, EFK, dan EDS Acremonium spp. dan Fusarium spp. pada tanaman tembakau (N. tabacum cv. Gewol) pada 2 hsi.
Hubungan antara gejala pembentukkan gaharu oleh Acremonium sp. IPBCC 07.525, Fusarium sp. IPBCC 09.568, 09.569, 09.570) dan reaksi hipersensitif akibat elisitornya (EDS dan EK) memiliki nilai yang rendah dan tidak signifikan terhadap pembentukkan gaharu, yaitu berturut-turut 0,088 (P>0,01) dan 0,422 (P>0,01). Sedangkan hubungan antara EFK dan gejala pembentukkan gaharu memiliki nilai yang cukup baik dan signifikan, yaitu sebesar 0,595 (P<0,01). Pengaruh EDS dan EK terhadap pembentukkan gaharu sangat rendah, yaitu berturut-turut 16,91% dan
17,81%. EFK memiliki pengaruh sebesar 35,44% terhadap pembentukkan gaharu (Gambar 5d-f).
Kemampuan cendawan menginduksi pembentukkan gaharu sebanding dengan reaksi hipersensitif akibat elisitor cendawan tersebut. Hubungan antara gejala
pembentukkan gaharu dan reaksi
hipersensitif akibat EK dan EFK selalu menunjukkan nilai yang lebih tinggi dibandingkan EDS. Hal ini mengindikasikan senyawa-senyawa toksik dan konidia mampu menginduksi reaksi pertahanan tubuh pada tanaman.
Gambar 4 Hasil uji reaksi hipersensitif berupa bercak-bercak nekrosis (anak panah) pada daun tanaman tembakau (N. tabacum cv. Gewol) menggunakan (a) elisitor dan (b) kontrol setelah dua hari infeksi pada 2 hsi.
s
Gambar 5 Hubungan antara gejala pembentukkan gaharu dan reaksi hipersensitif akibat pemberian elisitor Acremonium sp. IPBCC 07.526, 07.566, Fusarium sp. IPBCC 09.571 (a-c) dan elisitor Acremonium sp. IPBCC 07.525, Fusarium sp. 09.568, 09.569, 09.570 (d-f). 0,00
1,00 2,00 3,00 4,00
0 1 2
S kor g ejal a pe m be n tu ka n g ah ar u
Skor reaksi hipersensitif (EDS)
0,00 1,00 2,00 3,00 4,00 5,00
0 2 4
S kor g ejal a pe m be n tu ka n g ah ar u
Skor reaksi hipersensitif (EK)
0,00 1,00 2,00 3,00 4,00 5,00
0 2 4
S kor g ejal a pe m be n tu ka n g ah ar u
Skor reaksi hipersensitif (EFK)
a b c
0,00 0,50 1,00 1,50 2,00 2,50
0 1 2
S kor g ejal a pe m be n tu ka n g ah ar u
Skor reaksi hipersensitif (EDS)
0,00 0,50 1,00 1,50 2,00 2,50
0 2 4
S kor g ejal a pe m be n tu ka n g ah ar u
Skor reaksi hipersensitif (EK)
0,00 0,50 1,00 1,50 2,00 2,50
0 1 2
S kor g ejal a pe m be n tu ka n g ah ar u
Skor reaksi hipersensitif (EFK)
d e f
y = 0.777x + 0.2857 R2 = 0.3544 r = 0.595 y = 1.8981x + 0.2857
R2 = 0.7813 r = 0.884
y = 0.4603x + 0.4599 R2 = 0.1691 r = 0.088
y = 0.4129x + 0.4623 R2 = 0.1781 r = 0.422 y = 2.1339x + 0.4599
R2 = 0.6912 r = 0.831
y = 1.8981x + 0.2857 R2 = 0.7813 r = 0.884
9
SIMPULAN
Acremonium sp. IPBCC 07.526, 07.566, dan Fusarium sp. 09.570 dapat menginduksi pembentukkan gaharu pada tanaman G. verstegii. Semua elisitor (EDS, EK, EFK) menyebabkan reaksi hipersensitif pada daun tembakau dan memiliki sifat patogenitas yang berbeda. Kemampuan cendawan dalam
menginduksi pembentukkan gaharu
berkorelasi positif dan signifikan dengan reaksi hipersensitif daun tembakau terhadap elisitor cendawan itu. Kemampuan Acremonium sp. IPBCC 07.526, 07.566, dan Fusarium sp. 09.570 dalam menginduksi pembentukkan gaharu berkorelasi tinggi, positif dan signifikan dengan reaksi hipersensitif daun tembakau terhadap elisitor cendawan-cendawan itu. Sebaliknya ketidakmampuan Acremonium sp. IPBCC 07.525, dan Fusarium sp. 09.568, 09.569, 09.570 dalam menginduksi pembentukkan gaharu berkorelasi rendah, positif dan tidak signifikan dengan dengan reaksi hipersensitif daun tembakau terhadap elisitor cendawan-cendawan itu.
DAFTAR PUSTAKA
Adams DJ. 2004. Fungal cell wall chitinases and glucanases. Microbiol. 150: 2029-2035.
Barden A, Anak NA, Mulliken T, Song M. 2000. Heart of the Matter: Agarwood Use and Trade and CITES Implementation for Aquilaria malaccensis. Cambridge: Traffic Int.
Dewan Standar Nasional. 1999. SNI 02-50009. 1-1999 Gaharu. Jakarta: Dewan Standar Nasional.
Fujita K, Suzuki T, Kunoh H, Carver TLW, Thomas BJ, Gurr S, Shiraishi T. 2004. Induced inaccessibility in barley cell exposed to extracellular material released by non-pathogenic powdery mildew conidia. Physiol Mol Plant Pathol. 64:169-178.
Gao FK, Yong YH, Dai CC. 2011. Effect of endophytic fungal elicitor on two kinds of terpenoids production and physiological indexes in Euphorbia pekinensis suspension cell. Med Plants Res. 5:4418-4425.
Hodijah RS. 2011. Cendawan dan bahan kimia sebagai formula inokulan
penginduksi gaharu [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Isnaini Y. 2004. Induksi produksi gaharu melalui inokulasi cendawan dan aplikasi faktor abiotik [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Jensen A. 2010. Domestication of aquilaria spp. And rural poverty– socio-economic and genetic aspects of the
planting boom in the “wood of the
gods”. www.agarwood.org.vn. 5 Desember 2010.
Khayrunnisa S. 1999. Senyawa gaharu hasil induksi elisitor Acremonium sp. pada kalus Aquilaria crassna [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Liske N, Kuć J. 977. Elicito s of te penoid accumulation in potato tuber slices. Physiol and Biochem. 67: 1356-1359.
Michiho I. 2005. Induction of
sesquiterpenoid production by methyl jasmonate in Aquilaria sinensis cell suspension culture. Essent Oil Res 1-6.
Montesano M, Brader G, Palva ET. 2003. Pathogen derived elicitors: searching for receptor in plants. Mol Plant Pathol. 4: 73-79.
Park JM. 2005. The hypersensitive response, a cell death during disease resistance. Plant Pathol J. 21: 99-101.
Putri AL. 2007. Induksi pembentukkan wangi dan senyawa terpenoid pada pohon gaharu (Aquilaria crassna) dengan Acremonium sp. dan metil jasmonat [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
---. 2011. Studi interaksi Fusarium sp. dengan pohon gaharu (Aquilaria sp.) menggunakan pendekatan sitologi [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Purwokerto: Perhimpunan Fitopatologi Indonesia. Hlm 573-581.
Rahayu G, Situmorang J. 2006. Menuju produksi senyawa gaharu secara lestari. Laporan penelitian hibah bersaing XI. Bogor: Lembaga Penelitian Masyarakat. Institut Pertanian Bogor.
Rahayu G. 2009. Status penelitian dan pengembangan gaharu di Indonesia. Makalah Seminar Menuju Produksi Gaharu Secara Lestari di Indonesia. Bogor: IPB International Convention Center, 12 November. Hlm A1.
---. 2010. Fragrance formation in Aquilaria spp. shoot culture induced by Acremonium sp. Microbiol Indones. 2: 55-59.
Soehartono T, Newton AC. 2000. Conservation and sustainable use of tropical trees in the genus Aquilaria I. status and distribution in Indonesia. Biol Conser.96: 83-94.
---. 2001. Conservation and sustainable use of tropical trees in the genus Aquilaria II. the impact of gaharu harvesting in Indonesia. Biol Conser. 97: 29-41.
Suzuki K. 1999. Elicitor signal transduction that leads to hypersensitive reaction in cultured tobacco cell. Plant Biotechnol. 16: 343-351.
Takahashi H, Matsumura H, Yamada MK, Uchimiya. 2008. The cell death factor, cell wall elicitor of rice blast fungus (Magnoporthe grisea) causes metabolic alterations including GABA shunt in rice cultured cells. Plant Signal Behav. 3: 945-953.
Vidhayasekaran P. 2004. Encylopedia of Plant Pathology. Binghamton: Haworth Reference Press.
---. 2007. Handbook of Molecular Technologiesin Crop Disease Management. Binghamton: Haworth Reference Press.
---. 2008. Fungal Pathogenesis in Plants and Crops. Boca Raton: CRC Press.
Wulandari E. 2009. Efektivitas dan interaksi antara Acremonium sp. dan Fusarium sp. dalam pembentukkan gaharu pada Aquilaria microcarpa [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lampiran 1
Uji korelasi antara gejala pembentukkan gaharu dengan reaksi hipersensitif oleh isolat pembentuk gaharu kategori 2.
Correlations
EDS EK EFK Gejala gaharu
EDSa Pearson Correlation 1 0,822** 0,822** 0,831**
Sig. (2-tailed) 0,000 0,000 0,000
N 15 15 15 15
EKa Pearson Correlation 0,822** 1 0,812** 0,884**
Sig. (2-tailed) 0,000 0,000 0,000
N 15 15 15 15
EFKa Pearson Correlation 0,822** 0,812** 1 0,884**
Sig. (2-tailed) 0,000 0,000 0,000
N 15 15 15 15
Gejala gaharu Pearson Correlation 0,831** 0,884** 0,884** 1
Sig. (2-tailed) 0,000 0,000 0,000
N 15 15 15 15
**Correlation is significant at the 0.01 level (2-tailed).
Uji korelasi antara gejala pembentukkan gaharu dengan reaksi hipersensitif isolat pembentuk oleh gaharu kategori 3.
Correlations
EDS EK EFK gejalagahaaru
EDSb Pearson Correlation 1 0,460 0,593** 0,088
Sig. (2-tailed) 0,055 0,010 0,727
N 18 18 18 18
EKb Pearson Correlation 0,460 1 0,711** 0,422
Sig. (2-tailed) 0,055 0,001 0,081
N 18 18 18 18
EFKb Pearson Correlation 0,593** 0,711** 1 0,595**
Sig. (2-tailed) 0,010 0,001 0,009
N 18 18 18 18
Gejala gaharu Pearson Correlation 0,088 0,422 0,595** 1
Sig. (2-tailed) 0,727 0,081 0,009
N 18 18 18 18
ABSTRAK
SEPRIYADI RIHI. Respon Pohon Gaharu dan Reaksi Hipersensitif Tembakau Terhadap Elisitor Acremonium spp. dan Fusarium spp. asal Gaharu. Dibimbing oleh GAYUH RAHAYU dan BONNY POERNOMO WAHYU SOEKARNO.
Penelitian ini dilakukan untuk mengetahui efektifitas biomassa Acremonium spp. dan Fusarium spp. dalam merangsang pembentukkan gejala gaharu dan efektifitas elisitor dinding sel (EDS), elisitor konidia (EK), dan elisitor filtrat kasar (EFK) Acremonium spp. (IPBCC 07.525, 07.526, dan 09.566) dan Fusarium spp. (IPBCC 09.568, 09.569, 09.570, dan 09.571) dalam merangsang respon hipersensitifitas daun tembakau. Biomassa Acremonium spp. dan Fusarium spp. yang ditumbuhkan pada media PDA selama 14 hari dijadikan inokulan pada cabang Gyrinops verstegii. Seluruh elisitor berasal dari kultur Acremonium spp. dan Fusarium spp. berumur 12 hari pada media PDB. Pembentukkan gaharu dinyatakan dalam sistem skor 0-10 dan diklasifikasikan dalam tiga kategori berdasarkan rataan skor pada setiap pengamatan dari tiga responden. Acremonium sp. IPBCC 07.526, 09.566, dan Fusarium sp. IPBCC 09.571 dapat menginduksi pembentukkan gaharu dengan skor berturut-turut 2,67, 2,89, dan 2,78 pada 14 hari setelah inokulasi (hsi). Gaharu ini dalam kategori 2.Reaksi hipersensitif daun tembakau (Nicotiana tabacum cv. Gewol) terhadap EDS, EK, dan EFK dari semua isolat ditunjukkan berupa bercak-bercak nekrosis dengan skor 0,33-1,33 dari sistem skor 0-3. Semua elisitor memiliki patogenitas yang berbeda. Kemampuan cendawan menginduksi pembentukkan gaharu sebanding dengan reaksi hipersensitif terhadap elisitor-elisitor tersebut. Gejala pembentukkan gaharu Acremonium sp. IPBCC 07.526, 09.566, dan Fusarium sp.IPBCC 09.571 dengan reaksi hipersensitif EDS, EK, EFK-nya berkorelasi positif, tinggi, dan signifikan dengan nilai koefisien korelasi (r) berturut-turut 0,831, 0,884, dan 0,884.
Kata kunci: Pembentukkan gaharu, reaksi hipersensitif, Acremonium, Fusarium, elisitor.
ABSTRACT
SEPRIYADI RIHI. Agarwood Tree Response and Hypersensitivity Reactions of Tobacco Due to Elicitors of Acremonium spp. and Fusarium spp. from Agarwood. Under supervision of GAYUH RAHAYU and BONNY POERNOMO WAHYU SOEKARNO.
This research was carried out to investigate the effectiveness of Acremonium spp. and Fusarium spp. biomass in inducing agarwood formation and the effectiveness of the cell wall elicitor (CWE), conidia elicitor (CE), and crude filtrate elicitor (CFE) of Acremonium spp. (IPBCC 07.525, 07.526, 07.566) and Fusarium spp. (IPBCC 09.568, 09.569, 09.570, 09.571) in inducing the hypersensitivity response of tobacco leaves. Biomass of Acremonium spp. and Fusarium spp. were grown on PDA medium for 14 days and used as inoculant on Gyrinops verstegii branch. All Elicitors were derived from the 12 days Acremonium spp. and Fusarium spp. culture in PDB medium. Agarwood formation was determined by score system (0-10) and classified into three categories based on the average score of each three respondents observation. Acremonium sp. IPBCC 07.526, 07.566, and Fusarium sp. IPBCC 09.571 induced agarwood formation with scores 2,67, 2,89, and 2,78, respectively at 14 days after inoculation (dai). These agarwood were in category 2. Hypersensitive reaction of tobacco leaves (Nicotiana tabacum cv. Gewol) caused by elicitors of all isolates were shown in the necrosis spot with score range of 0,33-1,33 from score system 0-3. All elicitors had the different pathogenicity. The ability of fungi to induce agarwood formation were comparable to hypersensitivity reaction caused by those elicitors. The correlation of agarwood formation by Acremonium sp. IPBCC 07.526, 07.566, Fusarium sp. 09.571 with hypersensitive reaction of their EDS, EK, EFK was positive, high, and significant with correlation coefficient (r) values respectively were 0,831, 0,884, 0,884.
Gaharu merupakan sejenis kayu dengan berbagai bentuk dan warna yang khas, serta memiliki kandungan damar wangi (Dewan Standar Nasional Indonesia 1999). Sebagai salah satu hasil hutan bukan kayu, gaharu memiliki nilai ekonomis tinggi dan dimanfaatkan sebagai obat-obatan, dupa, dan parfum (Barden et al. 2000). Di Indonesia, gaharu umumnya dipanen dari pohon Aquilaria malaccensis, A. microcarpa, A. filaria, dan Gyrinops verstegii (Rahayu 2010).
Pembentukkan gaharu merupakan respon pertahanan pohon gaharu terhadap kerusakan mekanis atau infeksi cendawan. Respon pertahanan ini menghasilkan resin
berupa senyawa terpenoid yang
terakumulasi di sekitar bagian jaringan kayu yang mengalami kerusakan atau terinfeksi (Rahayu 2010). Beberapa cendawan telah diisolasi dari pohon gaharu dan memiliki kemampuan menginduksi pembentukkan gaharu, seperti Acremonuim spp. dan Fusarium spp. (Putri 2007; Wulandari 2009; Rahayu 2010). Selain cendawan, penelitian Putri (2007) menunjukkan penginduksian gaharu menggunakan bahan kimia (metil jasmonat) juga dapat menginduksi pembentukkan wangi gaharu. Penggunaan inokulan ganda (Acremonium sp. dan Fusarium sp.) dalam menginduksi gaharu juga menghasilkan tingkat wangi yang lebih tinggi dibandingkan penggunaan inokulan tunggal (Wulandari 2009).
Pemanenan gaharu yang terbentuk secara alami menimbulkan kekhawatiran terhadap kelestarian pohon gaharu. Gaharu yang berhasil dikumpulkan dari penebangan pohon penghasil gaharu tidak sebanding dengan jumlah pohon yang ditebang (Soehartono 2001). Hal ini menimbulkan kekhawatiran menyusutnya ketersediaan pohon penghasil gaharu di alam. Sehingga, semenjak tahun 1994, pohon gaharu tercatat dalam IUCN (International Union for Conservation of Nature) redlist dan Apendiks II CITES (Convention on International Trade in Endangered Species of Wild Fauna or Flora) sebagai tanaman yang dilindungi (Soehartono 2000; Rahayu 2009). Oleh karena itu, peningkatan budi daya pohon gaharu dan penyempurnaan teknik induksi gaharu buatan perlu dilakukan untuk menjaga kelestarian pohon gaharu (Rahayu 2009).
dapat dilakukan dengan menganalisis interaksi elisitor-fitoaleksin. Elisitor merupakan senyawa yang dihasilkan oleh mikroorganisme patogen dan berperan menjadi molekul sinyal sistem pertahanan tubuh tanaman inang (Montesano 2003). Senyawa ini dapat berupa produk suatu mikroorganisme atau bagian dari mikroorganisme itu sendiri. Pada tumbuhan tingkat tinggi, elisitor yang dihasilkan patogen akan dikenali oleh reseptor spesifik yang mengakibatkan akumulasi senyawa fitoaleksin. Interaksi elisitor-fitoaleksin menghasilkan suatu respon pertahanan tubuh tanaman inang yang disebut respon hipersensitif (Montesano 2003; Suzuki 1999). Respon ini hanya berkembang di sekitar daerah infeksi sehingga disebut sebagai respon lokal. Pada tanaman, respon hipersensitif biasanya ditunjukkan berupa bercak nekrosis pada daun. Reaksi hipersensitif dapat menggambarkan interaksi antara ketahanan inang dengan virulensi patogen (Park 2005).
Penelitian mengenai elisitor cendawan telah banyak dilakukan. Lisker dan Kuć (1977) telah membuktikan bahwa ekstrak dinding sel beberapa Oomycetes dapat merangsang akumulasi fitoaleksin pada potongan umbi tanaman kentang. Ortega dan Perez (2001) menyatakan bahwa konidia Alternaria alternata menyebabkan reaksi hipersensitif kotiledon jeruk (Citrus lemon). Takahashi et al. (2008) juga menyatakan bahwa elisitor asal dinding sel dapat menyebabkan kematian kultur sel padi.
Elisitor dapat dibagi dalam dua kelompok yaitu elisitor umum dan spesifik ras (Montesano et al. 2003). Beberapa tanaman seperti tembakau seringkali digunakan sebagai tanaman indikator reaksi hipersensitif. Penelitian Khayrunissa (1999) menunjukkan penggunaan elisitor filtrat kasar (EFK), elisitor dinding sel (EDS), dan elisitor sitoplasma (ES) Acremonium sp. menghasilkan gumpalan harum pada kalus A. crassna. Pengujian lebih lanjut menunjukkan adanya beberapa senyawa gaharu, namun kadarnya lebih rendah dibandingkan pada gaharu alami.
2
cendawan. Penggunaan inokulan berupa biomassa cendawan berisiko terhadap lingkungan. Menurut Rahayu (2009), karakteristik mikroorganisme patogen dapat mengalami perubahan dalam kurun waktu tertentu, seperti kasus Oncobasidium theobromae yang menyerang tanaman cokelat di Indonesia.
Bentuk inokulan alternatif perlu diteliti dan dikembangkan untuk mengurangi resiko lingkungan. Salah satu bentuk inokulan yang mungkin dikembangkan adalah inokulan berbasis elisitor. Oleh sebab itu, penelitian awal mengenai elisitor Acremonium sp. dan Fusarium sp. termasuk virulensinya yang diukur melalui reaksi hipersensitif tanaman tembakau perlu dilakukan sebagai dasar pengembangan inokulan baru.
Tujuan
Penelitian ini bertujuan mengetahui kemampuan biomassa Acremonium spp. dan Fusarium spp. dalam menginduksi pembentukkan gejala gaharu pada G. verstegii dan korelasinya dengan kemampuan elisitor cendawan tersebut dalam menginduksi reaksi hipersensitif pada daun tembakau (Nicotiana tabacum).
BAHAN DAN METODE Waktu dan Tempat Penelitian
Penelitian dilakukan mulai bulan Mei 2011 sampai dengan Januari 2012 di laboratorium Mikologi dan rumah kaca, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam dan kebun gaharu, Ciapus.
Bahan dan Alat
Bahan yang digunakan adalah biakan Acremonium spp. (IPBCC 07.525, IPBCC 07.526, dan IPBCC 09.566) dan Fusarium spp. (IPBCC 09.568, IPBCC 09.569, IPBCC 09.570, dan IPBCC 09.571), media PDA (Potato Dextrose Agar), media PDB (Potato Dextrose Broth), Natrium Bikarbonat (NaHCO3), pohon gaharu berumur ±8 tahun (G. verstegii) dan tanaman tembakau (N. tabacum cv. Gewol) berumur ±5 bulan. Alat yang digunakan adalah polybag, tisu steril, erlenmeyer, mesin penggoyang, kertas saring, tabung reaksi, dan peralatan laboratorium lain yang umum digunakan.
Metode
Rancangan Percobaan
Rancangan percobaan yang digunakan
untuk menguji gejala pembentukkan gaharu, perubahan panjang, dan kedalaman warna zona induksi digunakan rancangan acak lengkap (RAK) dengan satu faktor (tujuh taraf) dan tiga ulangan. Sedangakan pengujian reaksi hipersensitif digunakan RAK dua faktor, yaitu jenis isolat (tujuh faktor) dan jenis elisitor (tiga taraf), dan tiga ulangan.
Peremajaan Biakan Acremonium spp.dan
Fusarium spp.
Isolat Acremonium spp. dan Fusarium spp. diremajakan pada media PDA dan diinkubasi pada suhu ruang selama 7 hari. Selanjutnya sebanyak 3 potong biakan (diameter 5 mm) Acremonium spp. dan Fusarium spp. dimasukkan ke dalam erlenmeyer (uk. 250 mL) yang telah berisi 100 mL PDB steril. Biakan kemudian diinkubasi pada suhu 37oC, di atas mesin penggoyang selama 12 hari. Biakan ini akan digunakan sebagai sumber EFK, EK, dan EDS.
Inokulasi Acremonium spp. dan Fusarium
spp. pada Cabang G. verstegii
Biakan Acremonium spp. dan Fusarium spp. berumur 7 hari diinokulasikan pada cabang pohon G. verstegii yang mempunyai diameter ±1 cm. Sebelum inokulasi, cabang dilukai sepanjang 2 cm dengan membuang kulit dan kambiumnya. Sepotong inokulum (±2 cm x 0,5 cm) Acremonium spp. dan Fusarium spp. ditempelkan pada daerah yang telah dilukai. Setelah seluruh permukaan luka ditempel dengan biakan Acremonium spp. dan Fusarium spp., kemudian luka dilapisi dengan kapas basah dan terakhir dibalut dengan selotip. Sebagai pembanding digunakan batang tanaman yang hanya dilukai sebagai kontrol positif dan tanaman yang sehat yang tidak diberi perlakuan sebagai kontrol negatif. Hasil inokulasi dipanen setelah berumur 14 hari. Masing-masing perlakuan diulang dalam 3 kelompok (3 pohon). Pengacakan dilakukan pada masing-masing kelompok percobaan.
Penilaian Gejala Pembentukkan Gaharu
Tabel 1 Sistem skor respon G. verstegii terhadap inokulasi Acremonium spp. dan Fusarium spp.
Skor Gejala
Daun Warna Kayu Wangi
0 tidak klorosis/klorosis putih tidak wangi
1 tidak klorosis/klorosis putih kecoklatan tidak wangi
2 tidak klorosis/klorosis coklat tidak wangi
3 klorosis putih kecoklatan agak wangi
4 tidak klorosis putih kecoklatan agak wangi
5 klorosis coklat agak wangi
6 tidak klorosis coklat agak wangi
7 klorosis putih kecoklatan wangi
8 tidak klorosis putih kecoklatan wangi
9 klorosis coklat wangi
10 tidak klorosis coklat wangi
Rataan skor = sko ∑tanaman sko n ∑tanaman n
∑tanaman
Xn : Tanaman ke–n.
Tabel 2 Kategori tingkat pembentukkan gaharu
Kategori Skor Tingkat pembentukkan gaharu
1 7-10 gaharu sudah terbentuk
2 3-6 gaharu mulai terbentuk
3 0-2 gaharu tidak terbentuk
Selain gejala pembentukkan gaharu, pertambahan panjang dan kedalaman zona perubahan warna juga diamati. Pertambahan panjang zona perubahan warna adalah panjang kayu yang mengalami pertambahan panjang perubahan warna ke arah tajuk (atas) atau ke arah akar (bawah) diluar daerah yang diinokulasi atau dilukai. Kulit kayu di sisi atas dan bawah daerah yang diinokulasi dan dilukai dikupas dan panjang perubahan warnanya diukur. Sedangkan kedalaman perubahan warna diamati pada sayatan melintang daerah yang diinokulasi atau dilukai (Putri 2011).
Produksi Elisitor
Ketiga jenis elisitor (EDS, EK, EFK) diperoleh dengan metode Yang et al. (1989) yang dimodifikasi. Biomassa cendawan berupa miselium dan spora dari biakan berumur 12 hari, dipisahkan dari filtratnya dengan menggunakan kertas saring Whatman no. 1. Supernatan disentrifugasi dua kali pada suhu 4oC selama 20 menit pada 14000 g untuk memisahkan endapan. Supernatan pekat ini mengandung suspensi konidia yang dipergunakan sebagai EK. Sebagian filtrat (EK) dibebaskan dari konidia dengan cara penyaringan
menggunakan kertas saring milipor (0,22 µm). Hasil penyaringan ini adalah EFK.
Biomassa cendawan dihaluskan dengan N2 cair pada mortar steril. Kemudian pasta ini diekstrak dengan 4 mM natrium bikarbonat (1,3 mL NaHCO3 4 mM/g massa miselium segar). Setelah disimpan semalam pada suhu 4oC, suspensi disentrifugasi selama 20 menit pada 14000 g. Endapan yang diperoleh adalah dinding sel cendawan. Endapan ini dilarutkan dalam aquades (50 kali volume EDS) dan diautoklaf selama dua jam pada suhu 121oC. Suspensi dinding sel dibekukan disebut sebagai EDS.
Uji Reaksi Hipersensitif
4
Setelah masa inkubasi berakhir, nekrosis yang terbentuk diamati. Derajat hipersensitif dinilai dalam skor 0-3 (Tabel 3). Virulensi dinyatakan dalam rataan skor hipersensitif (Putri 2011).
Tabel 3 Kategori gejala reaksi hipersensitif
Skor Gejala
0 tidak ada gejala nekrosis/klorosis 1 beberapa bercak kecil nekrosis 2 kurang dari setengah luasan daun
menunjukkan gejala nekrosis 3 lebih dari setengah luasan daun
mengalami nekrosis
Analisis Data
Data gejala pembentukkan gaharu, perubahan panjang, dan kedalaman warna zona induksi dianalisis menggunakan rancangan acak kelompok (RAK) satu faktor dan reaksi hipersensitif menggunakan RAK dua faktor dengan perangkat lunak SPSS versi 16 dan diuji F pada α = 5%. Bila terdapat pengaruh nyata dari perlakuan yang diamati maka setiap taraf perlakuan dibandingkan dengan menggunakan uji lanjut Duncan pada taraf 5%. Korelasi antara gejala pembentukkan gaharu dengan reaksi hipersensitif dianalisis menggunakan perangkat lunak SPSS versi 16.
HASIL DAN PEMBAHASAN Gejala Pembentukkan Gaharu
Semua cabang G. verstegii yang dilukai dan diinokulasi cendawan menunjukkan gejala pembentukkan gaharu pada 14 hsi (hari setelah induksi). Gejala pembentukkan gaharu yang ditandai dengan munculnya aroma wangi dan perubahan warna kayu dapat dinilai dengan sistem skor seperti seperti dinyatakan oleh Putri (2007) dan Rahayu (2010).
Semua perlakuan menggunakan
cendawan dan kontrol positif menunjukkan adanya gejala pembentukkan gaharu dengan nilai skor yang lebih tinggi dan berbeda nyata dibandingkan kontrol negatif. Batang yang diberi perlakuan Acremonium sp.
IPBCC 07.526 dan IPBCC 07.566
menunjukkan adanya pembentukkan gejala gaharu dengan skor relatif rendah, yaitu berturut-turut 2,67 dan 2,89 dari nilai skor maksimum 10. Nilai skor ini tidak berbeda nyata dengan nilai skor 2,78 untuk gejala pembentukkan gaharu yang disebabkan oleh Fusarium sp. IPBCC 09.571 (Gambar 1). Cabang yang diinduksi cendawan lainnya,
yaitu Acremonium sp. IPBCC 07.525 dan Fusarium sp. IPBCC 09.568, 09.569 serta Fusarium sp. IPBCC 09.570 menunjukkan gejala pembentukkan gaharu dengan nilai skor yang lebih rendah (berturut-turut 2,00, 0,78, 0,67, dan 0,67) dan berbeda nyata dari gejala pembentukkan gaharu akibat inokulasi Acremonium sp. IPBCC 07.526 dan 07.566 serta Fusarium sp. IPBCC 09.571. Batang yang hanya dilukai (kontrol positif) juga menunjukkan adanya gejala pembentukkan gaharu dengan nilai skor 0,44, sedangkan kontrol negatif (skor 0,00) tidak terlihat adanya gejala pembentukkan gaharu (Gambar 1).
Nilai skor pembentukkan gaharu
diklasifikasikan dalam kategori
pembentukkan (Tabel 4). Gejala yang dibentuk akibat inokulasi Acremonium sp. IPBCC 07.526, 07.566 dan Fusarium sp. IPBCC 09.571 termasuk kategori 2 yang berarti gaharu mulai terbentuk. Sedangkan Acremonium sp. IPBCC 07.525 dan Fusarium sp. IPBCC 09.568, 09.569, 09.570 tidak merangsang pembentukkan gaharu (kategori 3). Demikian pula pada kontrol positif dan negatif tidak terdapat pembentukkan gaharu (kategori 3). Hasil ini juga menunjukkan hampir semua isolat Acremonium spp. dapat menginduksi pembentukkan gubal gaharu dibandingkan Fusarium sp. Pada penelitian sebelumnya, Acremonium sp. IPBCC 07.525 dinyatakan sebagai isolat yang berpotensi menginduksi pembentukkan gaharu (Rahayu et al. 1999; Wulandari 1999). Putri (2011) dan Hodijah (2011) menyatakan bahwa Fusarium sp. IPBCC 09.568, 09.569, 09.570 juga
berpotensi sebagai penginduksi
pembentukkan gaharu. Isolat Acremonium sp. IPBCC 07.566 memiliki tingkat patogenitas yang lebih tinggi dibandingkan Acremonium sp. IPBCC 07.525 dan 07.526 (Rahayu 2010). Hal ini menunjukkan tingkat patogenitas, interaksi yang stabil antara cendawan dengan tanaman inang, dan viabilitas isolat dapat menentukan keberhasilan pembentukkan gaharu (Rahayu & Situmorang 2006; Wulandari 2009; Rahayu 2010; Hodijah 2011). Kondisi
lingkungan juga mempengaruhi
pertumbuhan cendawan penginduksi gaharu pada tanaman inangnya. Aerasi yang baik akan menjaga dan meningkatkan kolonisasi gaharu di dalam tanaman gaharu (Isnaini 2004; Jensen 2010; Putri 2011).
perubahan warna kayu dapat berubah selama
masa pembentukkan gaharu. Zona
perubahan warna kayu dapat memanjang ke arah atas dan bawah dari zona induksi (Putri 2007). Panjang perubahan warna ini bervariasi pada setiap penginduksi (Gambar 2a). Zona perubahan warna terpanjang ditunjukkan oleh batang yang diinokulasi Fusarium sp. IPBCC 09.570 (2,14 cm) dan Acremonium sp. IPBCC 07.525 (2,12 cm) dan tidak berbeda nyata dengan panjang zona itu akibat inokulasi Acremonium sp. IPBCC 07.526 (1,65 cm), Fusarium sp. IPBCC 09.568 (1,38 cm) dan 09.571 (1,56 cm). Zona perubahan warna yang lebih pendek ditunjukkan oleh cabang yang diinokulasi Acremonium sp. IPBCC 07.566 (0,72 cm), dan Fusarium sp. IPBCC 09.569 (1,17 cm) yang hanya berbeda nyata dari perlakuan Acremonium sp. IPBCC 07.525 dan Fusarium sp. IPBCC 09.570. Pada kontrol positif terdapat perubahan panjang warna sebesar 1,28 cm, sedangkan kontrol negatif tidak terjadi perubahan warna (Gambar 2a).
Perubahan warna kayu juga mengarah ke dalam cabang. Cendawan yang mampu menginduksi perubahan warna kayu terpanjang (Acremonium sp. IPBCC 07.525 dan Fusarium sp. IPBCC 09.570) juga menunjukkan kemampuannya merangsang pembentukkan perubahan warna kayu yang relatif dalam. Kedalaman zona perubahan warna kayu akibat perlakuan Acremonium sp. IPBCC 07.525 (22 mm) dan Fusarium sp. IPBCC 09.570 (15 mm) tidak berbeda nyata dengan perlakuan Acremonium sp. IPBCC 07.526 (15 mm) dan Fusarium sp. IPBCC 07.571 (12 mm). Inokulasi Acremonium sp. IPBCC 07.525 menyebabkan perubahan kedalaman warna terdalam dan berbeda nyata dibandingkan dengan perlakuan Acremonium sp. IPBCC 07.566, Fusarium sp. 09.568 dan 09.569 yang kurang dari 10 mm. Acremonium sp. IPBCC 07.566 memiliki pengaruh yang sama dengan perlakuan kontrol positif (7 mm) dan kontrol negatif (0,00 mm) (Gambar 2b).
Gambar 1 Skor gejala pembentukkan gaharu setelah diinokulasi Acremonium spp. dan Fusarium spp. pada 14 hsi.
Keterangan: Af: Acremonium sp. IPBCC 07.525, Al: Acremonium sp. IPBCC 07.526, Am: Acremonium sp. IPBCC 09.566; Fa: Fusarium sp. IPBCC 09.568, Fb: Fusarium sp. IPBCC 09.569, Fd: Fusarium sp. IPBCC 09.570, Fh: Fusarium sp. IPBCC 09.571; K(+): kontrol positif, K(-): kontrol negatif.
Tabel 4 Kategori gejala pembentukkan gaharu pada cabang G. verstegii setelah diinduksi Acremonium spp. dan Fusarium spp. saat 14 hsi.
Perlakuan Kategori Tingkat pembentukkan gaharu
Acremonium sp. IPBCC 07.525 3 gaharu tidak terbentuk Acremonium sp. IPBCC 07.526 2 gaharu mulai terbentuk Acremonium sp. IPBCC 07.566 2 gaharu mulai terbentuk Fusarium sp. IPBCC 09.568 3 gaharu tidak terbentuk Fusarium sp. IPBCC 09.569 3 gaharu tidak terbentuk Fusarium sp. IPBCC 09.570 3 gaharu tidak terbentuk Fusarium sp. IPBCC 09.571 2 gaharu mulai terbentuk
Kontrol (+) 3 gaharu tidak terbentuk
Kontrol (-) 3 gaharu tidak terbentuk
-0,50 0,00 0,50 1,00 1,50 2,00 2,50 3,00 3,50
Af Al Am Fa Fb Fd Fh K (+) K (-)
Sk
o
r
g
ej
ala
p
em
b
en
tu
k
k
an
g
ah
ar
u
6
Gambar 2 Pertambahan panjang (a) dan kedalaman zona perubahan warna (b) pada cabang G. verstegii hasil inokulasi Acremonium spp. dan Fusarium spp. saat 14 hsi.
Keterangan: Af: Acremonium sp. IPBCC 07.525, Al: Acremonium sp. IPBCC 07.526, Am: Acremonium sp. IPBCC 09.566; Fa: Fusarium sp. IPBCC 09.568, Fb: Fusarium sp. IPBCC 09.569, Fd: Fusarium sp. IPBCC 09.570, Fh: Fusarium sp. IPBCC 09.571; K(+): kontrol positif, K(-): kontrol negatif.
Kemampuan cendawan untuk
menginduksi perubahan warna kayu dengan zona yang relatif panjang dan dalam tidak selalu diikuti oleh kemampuannya dalam merangsang pembentukkan gejala gaharu. Hal ini membuktikan bahwa kontribusi kriteria aroma wangi dalam pemeringkatan gejala pembentukkan gaharu sangat dominan. Rahayu et al. (1999) juga melaporkan perubahan warna kayu tidak selalu diikuti timbulnya aroma wangi khas gaharu. Adanya aroma wangi khas gaharu disebabkan akumulasi senyawa kimiawi yang berfungsi menghambat perkembangan patogen dan diduga merupakan bagian dari senyawa fitoaleksin. Senyawa ini memiliki aroma yang khas dan mudah menguap (Michiho 2005).
Reaksi Hipersensitif
Daun tembakau menunjukkan reaksi hipersensitif terhadap pemberian semua jenis elisitor (EK, EFK, dan EDS) dari semua cendawan. Gejala yang ditunjukkan berupa bercak-becak nekrosis yang tersebar di seluruh permukaan daun. Hasil uji F menunjukkan semua isolat memberikan pengaruh yang nyata terhadap reaksi hipersensitif (F-hitung = 9,717 dan P<0,05). Semua elisitor juga berpengaruh nyata terhadap (F-hitung = 3,267 dan P<0,05) reaksi hipersensitif. Hal