FORMULASI KONSORSIUM RIZOBAKTERIA PELARUT FOSFAT DENGAN Bradyrhizobium japonicum SEBAGAI PUPUK HAYATI DAN
APLIKASINYA PADA TANAMAN KEDELAI
SITI MELIAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan dengan sebenarnya bahwa tesis yang berjudul Formulasi Konsorsium Rizobakteria Pelarut Fosfat dengan Bradyrhizobium japonicum sebagai Pupuk Hayati dan Aplikasinya pada Tanaman Kedelai adalah hasil karya saya dengan arahan dari atau bersama komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2013
Siti Meliah
ABSTRAK
SITI MELIAH. The Formulation of Consortium of Phosphate Solubilizing Rhizobacteria with Bradyrhizobium japonicum as Biofertilizer and Their Application to Soybean Plant. Supervised by Aris Tri Wahyudi and Abdjad Asih Nawangsih.
Phosphate solubilizing rhizobacteria were known for their ability to convert insoluble form of phosphate to the accessible form. The use of rhizobacteria as biofertilizer is one of the most promising biotechnologies to improve plant production. This study was conducted to formulate phosphate solubilizing rhizobacteria (Bacillus sp. Cr and Pseudomonas sp. Crb) coinoculated with
Bradyrhizobium japonicum (Bj) and appliance them to soybean plant as
biofertilizer. Pikovskaya medium containing tri-calcium phosphate at concentration of 0.5% was used to measure P-solubilizing ability of tested strains. Results revealed that Crb1 is the most powerful P-solublizer using tricalcium phosphate as a P source. It was also observed decreasing in pH along with the increasing of amount of soluble P ranged from -0.96 to -0.42 from initial culture during 72 hours. Isolates of the rhizobacteria (Crb and Cr) were grown in media containing skim milk and molases prior to formulation in peat as a carrier material. The combination of three strains produced 4 packages of inoculants. Each packages was tested for their viability and effectiveness on soybeans in the field. The number of bacterial population after 9 months of storage ranged from 7.5 x 106 to 5.8 x 108 cfu gr-1 of peats. Field experiment showed that treatments designed as F1+NPK and F3+NPK were significantly increased soybean plant growth and mineral uptake compared to untreated control and better than NPK treatment. While F1+NPK and F2+NPK were able to increase soybean productivity.
Key Words: Phosphate solubilizing rhizobacteria, formulation, Bacillus sp.,
RINGKASAN
SITI MELIAH. Formulasi Konsorsium Rizobakteria Pelarut Fosfat dengan
Bradyrhizobiumjaponicum sebagai Pupuk Hayati dan Aplikasinya pada Tanaman Kedelai. Dibimbing oleh Aris Tri Wahyudi dan Abdjad Asih Nawangsih.
Rizobakteria pelarut fosfat dikenal karena kemampuannya dalam mengubah fosfat dari bentuk yang tak larut menjadi bentuk terlarut yang dapat digunakan oleh tumbuhan. Pemanfaatan bakteri-bakteri yang memiliki kemampuan tersebut sebagai pupuk hayati (biofertilizer) merupakan salah satu bioteknologi yang menjanjikan dalam meningkatkan produksi tanaman dan mulai diterapkan untuk mengurangi ketergantungan pemakaian pupuk kimia. Dibandingkan pupuk kimia, pupuk hayati tidak meninggalkan residu, mampu meningkatkan efisiensi bioremediasi, dan relatif murah. Penelitian ini dilakukan dengan tujuan untuk membuat formulasi rizobakteria pelarut fosfat (Bacillus sp dan Pseudomonas sp) yang dikoinokulasi dengan Bradyrhizobiumjaponicum sebagai pupuk hayati serta aplikasinya pada tanaman kedelai.
Uji pelarutan fosfat secara kualitatif dilakukan dengan menggoreskan isolat bakteri Bacillus sp. Cr dan Pseudomonas sp. Crb pada media agar Pikovskaya dengan trikalsium fosfat (Ca3(PO4)2) sebagai sumber P sebanyak 0.5%. Kemudian dilanjutkan dengan uji kuantitatif pelarut P di media cair Pikovskaya. Secara kualitatif, seluruh bakteri yang diuji mampu melarutkan fosfat dengan Cr 28 memiliki indeks pelarutan fosfat yang terbesar yaitu sebesar 0.50. Dengan melihat jumlah fosfat yang berhasil dilarutkan pada media cair, bakteri Crb 1 diketahui paling baik dalam melarutkan fosfat. Hasil pengukuran konsentrasi fosfat yang dilarutkan dan pH media menunjukkan kecenderungan adanya peningkatan konsentrasi fosfat yang diikuti dengan penurunan pH. Penurunan pH media yang berhasil diukur bervariasi antara -0.96 hingga -0.42 selama 72 jam masa inkubasi. Formulasi bakteri dilakukan dengan mengkombinasikan tiga jenis bakteri dan ditumbuhkan secara bersama dalam media pembawa berupa gambut. Media susu skim molase merupakan media produksi yang digunakan sebelum formulasi. Sebanyak empat formulasi dihasilkan, terdiri dari F1, F2, F3, dan F4. Keempatnya diuji viabilitasnya selama masa penyimpanan 9 bulan dalam suhu ruang. Selama masa itu, jumlah bakteri yang menyusun paket inokulan tersebut berkisar antara 7.5 x 106 hingga 5.8 x 108 cfu gr-1 gambut. Pemberian inokulan bakteri yang dikombinasikan dengan pupuk NPK mampu meningkatkan pertumbuhan dan produksi tanaman kedelai di lapang terutama F1 dan F3. Kedua perlakuan ini mampu meningkatkan berat basah dan berat kering tajuk, berat basah dan berat kering akar, serta meningkatkan serapan hara N dan P. Sementara itu perlakuan F1 dan F2 yang dikombinasikan dengan NPK dapat meningkatkan berat polong, jumlah polong isi, berat total biji, dan ukuran biji.
HAK CIPTA
© Hak Cipta milik IPB, tahun 2013 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh kaya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kitik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajarr IPB
FORMULASI KONSORSIUM RIZOBAKTERIA PELARUT FOSFAT DENGAN Bradyrhizobium japonicum SEBAGAI PUPUK HAYATI DAN
APLIKASINYA PADA TANAMAN KEDELAI
SITI MELIAH
Tesis
Sebagai salah satu syarat untuk memperolah gelar Magister Sains pada
Mayor Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR BOGOR
Judul Tesis : Formulasi Konsorsium Rizobakteria Pelarut Fosfat dengan
Bradyrhizobiumjaponicum sebagai Pupuk Hayati dan Aplikasinya pada Tanaman Kedelai
Nama : Siti Meliah NIM : G351100121 Program Studi : Mikrobiologi
Disetujui, Komisi Pembimbing
Prof. Dr. Aris Tri Wahyudi, M.Si
Ketua komisi Anggota komisi
Dr.Ir. Abdjad Asih Nawangsih, M.Si
Diketahui,
Ketua Program Studi Dekan Sekolah pascasarjana IPB Mikrobiologi
Prof. Dr. Anja Meryandini, M.S. Dr. Ir.Dahrul Syah, M.Sc.Agr
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT karena telah memberikan rahmat serta hidayah-Nya sehingga penulis dapat menyelesaikan tesis ini. Tema yang dipilih adalah Formulasi Konsorsium Rizobakteria Pelarut Fosfat dengan Bradyrhizobium japonicum sebagai Pupuk Hayati dan Aplikasinya pada Tanaman Kedelai.
Penulis mengucapkan terima kasih kepada Prof. Dr. Aris Tri Wahyudi, M.Si sebagai Ketua Komisi Pembimbing dan Dr.Ir. Abdjad Asih Nawangsih, M.Si sebagai Anggota Komisi Pembimbing yang telah memberikan banyak saran dan bimbingan kepada penulis sampai penyelesaian penulisan tesis ini. Penulis juga mengucapkan terima kasih kepada Dr. Edi Husen, M.Sc atas bantuan dan saran yang telah diberikan selama penelitian, serta kepada Dr. Rahayu Widyastuti, M.Sc selaku penguji dan Prof. Dr. Anja Meryandini, M.S selaku penjamin mutu tesis. Penelitian ini didanai oleh Dikti melalui proyek I-MHERE IPB melalui program B.2c atas nama Prof. Dr. Aris Tri Wahyudi, M.Si. Oleh karena itu penulis mengucapkan terima kasih kepada I-MHERE IPB dan pihak-pihak yang terkait. Ucapan terima kasih juga ditujukan untuk Ibu Henny, Pak Jaka selaku laboran Mikrobiologi, dan pekerja lapang pada percobaan lapang di Garut atas segala bantuan yang telah diberikan, serta kepada teman-teman di Laboratorium Mikrobiologi dan Kostan Bunda atas perhatian, bantuan, dan kerjasamanya selama penelitian. Secara khusus penulis menyampaikan ucapan terima kasih untuk ayah, ibu, kakak, adik, dan keluarga besar atas doa dan dukungannya selama ini.
Demikian tesis ini penulis buat. Semoga tidak hanya bermanfaat bagi penulis, tetapi juga dapat bermanfaat bagi pembaca.
Bogor, Januari 2013
RIWAYAT HIDUP
Penulis dilahirkan di Cirebon pada tanggal 18 Maret 1987 sebagai anak kedua dari tiga bersaudara dari ayah Sanika dan ibu Saodah. Penulis menyelesaikan pendidikan di SDN 02 Cipulir Jakarta pada 1999, SMPN 153 Jakarta pada 2002, SMAN 47 Jakarta pada 2005, dan Strata satu di Institut Pertanian Bogor (IPB) pada 2010. Penulis memperoleh gelar sarjana sains dengan Mayor Biologi dan Minor Teknik Proses/Bioproses di Departemen Biologi, FMIPA dengan judul skripsi “Telaah Awal dan Mutagenesis Transposon
Xanthomonas oryzae pv. oryzae Penyebab Hawar Daun Bakteri pada Padi”. Pada tahun yang sama penulis diterima di Sekolah Pascasarjana IPB melalui program B.2c I-MHERE IPB pada program studi Mikrobiologi.
Penulis berkesempatan mempresentasikan sebagian hasil penelitian ini pada
DAFTAR ISI
Halaman
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 2
TINJAUAN PUSTAKA Fosfor (P) dan Perannya pada Tanaman ... 3
Rhizobakteria Pemacu Pertumbuhan Tanaman ... 3
Rhizobakteria Pelarut Fosfat ... 5
Mekanisme Pelarutan Fosfat oleh Bakteri Pelarut Fosfat ... 6
Pengaruh Inokulasi Bakteri Pelarut Fosfat pada Tanaman ... 6
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 9
Bahan ... 9
Metode ... 10
Peremajaan Bakteri ... 10
Uji Kemampuan Bakteri PGPR dalam Melarutkan Fosfat ... 10
Kuantifikasi Jumlah Fosfat Terlarut pada Media Cair ... 11
Formulasi Inokulan Bakteri Pelarut Fosfat ... 11
Uji Viabilitas Inokulan Bakteri ... 12
Uji Keefektivan Inokulan terhadap Tanaman Kedelai... 13
Rancangan Percobaan dan Analisis Data ... 14
HASIL Uji Kemampuan Bakteri PGPR dalam Melarutkan Fosfat ... 15
Kuantifikasi Jumlah Fosfat Terlarut pada Media Cair ... 15
Formulasi Inokulan Bakteri Pelarut Fosfat ... 17
Uji Viabilitas Inokulan Bakteri... 18
Keefektivan Inokulan terhadap Pertumbuhan Tanaman Kedelai... 19
PEMBAHASAN ... 23
SIMPULAN ... 30
DAFTAR PUSTAKA ... 31
DAFTAR TABEL
Halaman
1 Galur bakteri yang digunakan dalam penelitian ... 9 2 Formulasi bakteri dan komposisinya yang digunakan dalam
penelitian ... 12 3 Antibiotik yang ditambahkan ke dalam media agar untuk
menumbuhkan masing-masing bakteri ... 13 4 Perlakuan tanaman untuk uji keefektifan inokulan terhadap
pertumbuhan tanaman kedelai ... 14 5 Indeks pelarutan Ca3(PO4)2 dalam media Pikovskaya Agar oleh
isolat bakteri rhizosfer asal tanaman kedelai ... 15 6 Kepadatan bakteri yang dimasukkan ke dalam bahan pembawa
gambut ... 18 7 Viabilitas sel bakteri pada gambut selama masa penyimpanan pada
suhu ruang ... 18 8 Pengaruh perlakuan pemberian inokulan terhadap pertumbuhan
pada tanaman kedelai berumur 45 hari setelah tanam ... 20 9 Pengaruh perlakuan pemberian inokulan terhadap serapan hara
pada tanaman kedelai berumur 45 hari setelah tanam ... 21 10 Pengaruh perlakuan pemberian inokulan terhadap produktivitas
DAFTAR GAMBAR
Halaman
1 Koloni bakteri Bacillus sp. Cr 22 (A) dan Pseudomonas sp. Crb 16 (B) yang digores pada media Pikovskaya Agar dan
diinkubasi pada suhu ruang selama 3-5 hari ... 15 2 Konsentrasi fosfat yang diukur pada media kultur Bacillus sp.
Cr (A) dan Pseudomonas sp. Crb (B) yang diinkubasi pada suhu
25 0C selama 72 jam ... 16 3 pH media kultur Bacillus sp. Cr (A) dan Pseudomonas sp.
Crb (B yang diukur pada berbagai interval waktu dan diinkubasi pada suhu 25 0C ... 17 4 Penampilan kemasan pupuk hayati hasil formulasi F2 (A) dan
DAFTAR LAMPIRAN
Halaman
1 Hasil kuantifikasi fosfat tersedia pada kultur bakteri dalam media Pikovskaya cair dengan penambahan trikalsium fosfat 0.5% ... 36 2 Denah rancangan acak kelompok pada percobaan lapang... 37 3 Hasil analisis hara N, P, dan K tersedia pada contoh tanah sebelum
tanam ... 38 4 Hasil analisis hara N, P, dan K tersedia pada contoh tanah setelah
tanam ... 39 5 Hasil analisis hara N, P, dan K terhadap contoh tanaman ... 40
PENDAHULUAN
Latar Belakang
Fosfor (P) merupakan unsur makro yang diperlukan untuk pertumbuhan tanaman. Fosfor terlibat dalam berbagai aktivitas biokimia dalam tumbuhan seperti sintesis asam nukleat, fotosintesis, dan sebagai komponen ATP. Kebutuhan P untuk tanaman umumnya dipenuhi melalui aplikasi pemupukan. Namun upaya tersebut menjadi kurang efisien karena mineral P yang masuk ke dalam siklus tanaman-hewan hanya kurang dari 10% (Panhwar et al. 2011). Hal ini disebabkan oleh adanya pengikatan P oleh unsur lain di dalam tanah sehingga ketersediaan unsur tersebut pada tanah menjadi terbatas. Umumnya, P akan terikat pada unsur lain seperti besi (Fe), alumunium (Al), kalsium (Ca), dan magnesium (Mg) (Widawati & Suliasih 2006). Mineral P dalam bentuk terikat ini tidak dapat digunakan secara langsung oleh tumbuhan.
Sejumlah bakteri tertentu di dalam tanah mampu memecahkan ikatan antara P dalam bentuk fosfat dengan kation pengikatnya. Bakteri ini berkoloni di wilayah perakaran (rizosfer) sehingga dikelompokkan dalam rizobakteria. Kelompok bakteri rizosfer ini telah banyak dilaporkan dapat meningkatkan pertumbuhan tanaman terkait dengan kemampuannya dalam melarutkan unsur-unsur mineral seperti fosfat (Lucas Garcia et al. 2004). Bakteri yang diketahui memiliki kemampuan melarutkan fosfat diantaranya Bacillus megaterium, Pseudomonas sp. (Widawati & Suliasih 2006), Flavobacterium sp., dan Klebsiella aerogenes (Suliasih & Rahmat 2007). Bakteri-bakteri tersebut akan melepaskan ikatan persenyawaan fosfat tersebut melalui mekanisme pembentukan kelat, reaksi pertukaran, dan produksi asam organik (Chen et al. 2006). Dengan demikian, bakteri-bakteri tersebut dapat menyediakan unsur hara yang diperlukan oleh tumbuhan sehingga dapat meningkatkan produktivitasnya.
proteinnya yang tinggi dan kandungan bahan lainnya yang bermanfaat bagi kesehatan. Kebutuhan nasional terhadap kedelai telah mencapai 2.2 juta ton per tahun, sementara produksi dalam negeri baru mampu memenuhi kebutuhan 35-40% sehingga kekurangannya dicukupi melalui impor kedelai dari negara lain (BPPP 2008). Salah satu kendala yang menyebabkan kurangnya produksi kedelai di Indonesia ialah rendahnya produktivitas kedelai (Ghulamahdi et al. 2009). Oleh karena itu perlu dilakukan beberapa upaya agar produktivitas kedelai meningkat, diantaranya ialah dengan memanfaatkan mikroorganisme yang dapat memacu pertumbuhan tanaman dan menyediakan P yang dibutuhkan oleh tanaman kedelai.
Pemanfaatan bakteri-bakteri yang memiliki kemampuan melarutkan unsur mineral sebagai pupuk hayati (biofertilizer) mulai diterapkan untuk mengurangi ketergantungan pemakaian pupuk kimia. Dibandingkan pupuk kimia, pupuk hayati dari rizobakteria tidak meninggalkan residu dan mampu meningkatkan efisiensi bioremediasi (Wu et al. 2006) sehingga ramah lingkungan. Selain ramah lingkungan, penggunaan pupuk hayati juga relatif murah (Jilani et.al 2007). Berdasarkan penelitian sebelumnya, kombinasi bakteri pelarut fosfat Bacillus sp. Cr dan Pseudomonas sp. Crb yang dikoinokulasi dengan bakteri penambat nitrogen Bradyrhizobium japoncum diketahui mampu meningkatkan pertumbuhan tanaman kedelai pada skala rumah kaca (Sari 2011). Pada penelitian ini bakteri Bacillus sp. dan Pseudomonas sp. yang telah diketahui dapat melarutkan fosfat
dalam media agar dan media cair Pikovskaya, selanjutnya diformulasikan dan diaplikasikan pada tanaman kedelai pada skala lapang untuk melihat respon pertumbuhan dan produktivitasnya.
Tujuan
Penelitian ini bertujuan untuk membuat dan menguji konsorsium rizobakteria pelarut fosfat (Bacillus sp dan Pseudomonas sp) dengan Bradyrhizobium japonicum sebagai pupuk hayati serta aplikasinya pada tanaman
3
TINJAUAN PUSTAKA
Fosfor (P) dan Perannya pada Tanaman
Fosfor merupakan unsur hara penting yang dibutuhkan oleh tanaman agar tumbuh dengan sehat. Jumlah yang diperlukan oleh tumbuhan diperkirakan mencapai 2 mg atom per liter unsur hara (Loveless 2000). Berbeda dengan nitrogen yang jumlahnya melimpah dan dapat diperoleh melalui fiksasi biokimia, ketersediaan fosfor di alam cukup terbatas. Dalam tanah, jumlahnya berada pada kisaran 400-1200 mg kg-1
Fosfor yang diserap tanaman berada dalam bentuk terikat dengan molekul-molekul lainnya dalam tumbuhan. Fosfor yang terikat pada lipid membentuk fosfolipid yang merupakan bagian dari membran plasma tumbuhan (Campbell et al. 2000). Fosfor disimpan dalam biji sebagai fitin.
tanah. Adanya fosfor pada tanah dapat diperoleh melalui pemupukan, kotoran hewan, residu tanaman, limbah industri dan domestik, disamping senyawa fosfor alami baik organik maupun anorganik yang memang telah tersedia dalam tanah (Krishnaveni 2010).
Pada tumbuhan, peran fosfor berhubungan dengan mekanisme biokimia yang menyimpan energi dan kemudian memindahkannya ke dalam sel-sel hidup diantaranya sebagai komponen ATP, asam nukleat, dan banyak substrat metabolisme, serta sebagai kofaktor enzim. Selain itu fosfor juga berpartisipasi dalam fosforilasi berbagai senyawa perantara fotosintesis dan respirasi (Loveless 2000). Kekurangan unsur P pada tanaman dapat menyebabkan gangguan dalam metabolisme salah satunya ialah hambatan dalam sintesis protein. Sintesis protein terjadi pada tahap awal pembelahan sel saat proses pertumbuhan sehingga kekurangan unsur ini dapat menyebabkan tehambatnya pertumbuhan. Kekurangan unsur ini pada tanaman dapat diamati oleh adanya perubahan pada warna daun menjadi keunguan akibat penumpukan gula.
Rizobakteria Pemacu Pertumbuhan Tanaman
terutama bakteri hidup dengan mengkolonisasi daerah perakaran ini. Keberadaan bakteri rizosfer ini memberikan keuntungan bagi tanaman dengan membantu meningkatkan pertumbuhan tanaman. Oleh karena perannya sebagai pemacu pertumbuhan tanaman, maka kelompok bakteri ini disebut rizobakteria pemacu pertumbuhan tanaman atau Plant Growth Promoting Rizobakteria (PGPR).
PGPR dapat meningkatkan pertumbuhan tanaman melalui mekanisme langsung maupun tidak langsung. PGPR secara langsung dapat meningkatkan pertumbuhan tanaman dengan menghasilkan senyawa fitohormon seperti auksin dalam bentuk IAA (Ashrafuzzaman et al. 2009), menghasilkan 1-Aminocyclopropane-1-Carboxylate (ACC) deaminase (Husen et al. 2011), dan menyediakan mineral tertentu seperti fosfat yang dibutuhkan oleh tanaman melalui mekanisme pelarutan (Ekin 2010). Burkholderia sp. merupakan salah satu kelompok bakteri PGPR yang telah dilaporkan mampu memproduksi IAA (Inui-Kishi et al. 2012). IAA diketahui dapat menstimulasi pertumbuhan akar lateral sehingga dapat mempermudah tanaman untuk menjangkau mineral dalam tanah dan menyediakan situs yang lebih jauh untuk infeksi dan nodulasi bakteri penambat nitrogen.
Sementara itu, aktivitas pemacuan pertumbuhan tanaman secara tidak langsung berkaitan dengan produksi senyawa-senyawa metabolit seperti antibiotik, siderofor, atau asam sianida. Senyawa-senyawa tersebut diketahui memiliki kemampuan dalam menghambat pertumbuhan patogen tanaman. Mekanisme pengendalian patogen oleh bakteri PGPR umumnya dilakukan dengan cara mengurangai pertumbuhan saprofitik patogen dan kemudian mengurangi frekuensi infeksi akar melalui mekanisme antagonis dan atau dengan menstimulasi resistensi sistemik yang diinduksi (ISR, Induced Systemic Resistance). Kelompok bakteri Pseudomonas merupakan contoh bakteri yang
menggunakan kedua jenis mekanisme tersebut dalam melawan serangan patogen. Pseudomonas sp. juga diketahui memproduksi siderofor yang dapat mengkelat
5
Rizobakteria Pelarut Fosfat
Mikroorganisme dari tanah telah lama diketahui merupakan bagian terpenting dari kehidupan di dunia karena mikroorganisme tersebut menjadi bagian dari sistem biologi dan kimia, serta kehidupan flora, fauna, dan kehidupan mikroorganisme itu sendiri. Salah satu perannya yang penting dalam ekosistem ialah mikroorganisme tersebut dapat menyediakan unsur-unsur yang dibutuhkan oleh tanaman. Mikroba dapat merombak bahan organik, mensintesis, dan melepaskannya kembali dalam bentuk bahan organik yang tersedia bagi tanaman (Widiawati & Suliasih 2006). Rizobakteria yang dapat melarutkan mineral seperti fosfat dinamakan bakteri pelarut fosfat.
Ketersediaan fosfat di alam dibatasi oleh banyaknya unsur tersebut yang menyatu membentuk persenyawaan dengan unsur-unsur lain. Menurut Schachtman et al. (1998), sebanyak lebih dari 80% fosfat yang dimasukkan ke tanah dalam kegiatan pemupukan menjadi tidak mobil atau hanya kurang dari 10% yang masuk ke dalam siklus tanaman-hewan (Panhwar et al. 2011). Pada tanah-tanah masam, fosfat bersenyawa dengan alumunium (Al) membentuk Al-fosfat dan besi (Fe) membentuk Fe-Al-fosfat. Sedangkan pada tanah basa, Al-fosfat akan bersenyawa dengan kalsium (Ca) membentuk Ca-fosfat (Trivedi & Pandey 2007). Bentuk terikat seperti ini tidak dapat digunakan secara langsung oleh tanaman. Tanaman menyerap fosfor dalam bentuk ion H2PO4-, HPO42-, dan PO4
2-Galur Bacillus sp. merupakan salah satu kelompok bakteri yang banyak dilaporkan memiliki kemampuan dalam melarutkan fosfat (Sugumaran & Jonarthanam 2007; Girgis et al. 2008; Kumar & Chandra 2008). Bakteri tersebut dilaporkan mampu membentuk zona bening ketika ditumbuhkan pada media agar cawan Pikovskaya yang ditambahkan fosfat dengan diamater yang berbeda-beda. Bakteri lainnya yang memiliki kemampuan melarutkan fosfat ialah Pseudomonas, Klebsiella aerogenis, Chromobacterium lividum, Flavobacterium breve (Suliasih & Rahmat 2007), Artrobacter ureafaciens, Phyllobacterium myrsinacearum, Rhodococcus erythropolis, Gordonia sp. (Chen et al. 2006), Enterobacter dan Serratia marcescens (Lu & Huang 2010).
Mekanisme Pelarutan Fosfat oleh Bakteri Pelarut Fosfat
Bakteri pelarut fosfat dapat meningkatkan ketersediaan unsur mineral tersebut dengan berbagai cara yaitu memproduksi asam organik, pembentukan kelat, dan reaksi pertukaran. Bakteri pelarut fosfat diketahui dapat menghasilkan asam organik yang ditandai dengan menurunnya pH media. Chen et al. (2006) melaporkan terdapat delapan jenis asam organik berbeda yang dihasilkan oleh bakteri pelarut fosfatnya yaitu asam citric, asam lactic, asam gluconic, asam propionic, asam succinic, dan 3 jenis asam lain yang tidak teridentifikasi. Hasil ini diperoleh melalui analisis menggunakan kromatografi cair kinerja tinggi. Hal serupa juga pernah dilaporkan oleh Rodriguez et al. (2004). Diantara sejumlah asam organik yang diketahui dapat melarutkan ikatan fosfat, asam gluconic-lah yang paling sering berperan dalam melarutkan fosfat karena dihasilkan oleh banyak bakteri pelarut fosfat diantaranya Pseudomonas sp., Erwinia herbicola, P. cepacia, dan Burkholderia cepacia (Rodriguez & Fraga 1999).
Meningkatnya asam organik pada media yang diikuti dengan penurunan pH menyebabkan larutnya kalsium-fosfat. Asam organik dapat secara langsung memicu pelarutan fosfat melalui mekanisme mediasi proton ataupun ligan (Ullman & Welch 2002). Asam-asam organik ini akan membentuk kelat dengan kation alumunium, besi, atau kalsium yang terikat pada fosfat dan sehingga membentuk ion H2PO4- yang dapat dimanfaatkan langsung oleh tanaman (Suliasih & Rahmat 2007). Mekanisme seperti ini umum terjadi pada pelarutan fosfat anorganik. Pada fosfat organik seperti asam nukleat, polifosfat, fosfolipid mekanisme pelarutannya berbeda dengan asam anorganik yaitu dengan menggunakan enzim fosfatase (Ponmurugan & Gopi 2006). Reaksi defosforilasi ini melibatkan hidrolisis ikatan fosfoester. Beberapa jenis enzim yang dikelompokkan dalam fosfatase ialah 3’-nukleotidase, 5’-nukleotidase, dan hexose fosfatase. Bakteri yang memiliki aktivitas fosfatase tinggi juga memilki kemampuan melarutkan fosfat yang tinggi.
Pengaruh Inokulasi Bakteri Pelarut Fosfat pada Tanaman
7
bakteri pelarut fosfat pada tanaman dapat meningkatkan sejumlah variabel pertumbuhan tanaman. Aplikasi Bacillus pelarut fosfat PSB 9 dan PSB 16 pada tanaman padi mampu meningkatkan jumlah klorofil dan daun yang berfotosintesis dan oleh karena itu meningkatkan produktivitas padi aerobik (Panhwar et al. 2011). Sementara itu, Noor (2003) melaporkan pemberian bakteri pelarut fosfat pada tanaman kedelai dapat meningkatkan jumlah bintil akar, bobot kering akar, dan bobot kering tanaman.
Pemberian inokulan bakteri tidak hanya dapat dilakukan oleh satu jenis bakteri dengan kemampuan tertentu. Beberapa percobaan yang mencampurkan bakteri pelarut fosfat dengan kelompok bakteri lain juga diketahui dapat meningkatkan pertumbuhan tanaman tersebut. Kombinasi bakteri pelarut fosfat dan pelarut kalium yang diinokulasikan pada benih tanaman diketahui dapat meningkatkan penyerapan mineral oleh tanaman. Han et al. (2006) melaporkan bahwa inokulasi bakteri pelarut fosfat dan kalium secara bersama-sama pada tanaman cabai dan timun dapat meningkatkan ketersediaan P dan K dalam tanah. Selain itu juga dapat meningkatkan penyerapan kedua unsur tersebut pada batang dan akar tanaman, serta meningkatkan pertumbuhan buah. Respon yang sama juga terjadi pada tanaman terung yang diberikan inokulan bakteri pelarut fosfat dan kalium (Han & Lee 2005).
Sementara itu pada tanaman kedelai, campuran rizobakteria bakteri pelarut fosfat yang terdiri atas P. fluorescens, Chryseobacterium balustinum, dan Serratia fonticola dengan bakteri penambat nitrogen Sinorhizovium fredii dilaporkan dapat
meningkatkan berat kering daun (Lucas Garcia et al. 2004). Peningkatan pada berat kering daun dapat diartikan sebagai peningkatan kualitas fotosintesis. Sebuah percobaan pemberian inokulan sejumlah mikroorganisme pelarut fosfat berbeda yaitu Bacillus sp., P. stutzeri, Penicillium vermiculatum, dan Aspergillus niger dengan B. japonicum menggunakan pot-pot tanaman terhadap tanaman
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB dan lahan pertanian Kampung Bongkor, Desa Situgede, Karang Pawitan-Wanaraja, Kabupaten Garut, Jawa Barat mulai bulan Agustus 2011 sampai Juni 2012.
Bahan
Bahan yang digunakan dalam penelitian terdiri dari 8 isolat PGPR pelarut fosfat yang diisolasi dari Cirebon, Jawa Barat dari galur Bacillus sp. Cr dan Pseudomonas sp. Crb yang dikoinokulasi dengan bakteri penambat nitrogen
Bradyrhizobium japonicum yaitu Bj 11 wt dan Bj 11 (19) (Tabel 1). Mutan Bj 11
(19) diperoleh melalui mutagenesis transposon dengan marker seleksi antibiotik rifampisin dan kanamisin. Media pertumbuhan bakteri yang digunakan terdiri dari Nutrient Agar (NA) (NB, nutrient broth 8 g l-1 dan agar 20 g l-1), King’s B agar (Bactopeptone 20 g l-1, K2HPO4 1.5 g l-1, MgSO4.7H2O 1.5 g l-1, gliserol 1.5 ml l -1
, dan agar 20 g l-1), dan Yeast Manitol Agar (YMA) (manitol 10 g l-1, K2HPO4 0.5 g l-1, MgSO4.7H2O 0.2 g l-1, NaCl 0.2 g l-1, yeast extract 1 g l-1, dan agar 20 g l-1
Tabel 1 Galur bakteri yang digunakan dalam penelitian ).
Galur bakteri Karakteristik Sumber atau referensi
Bacillus sp. Cr 22 Cr 28 Cr 68 Cr 69
Pseudomonas sp. Crb 1
Crb 16 Crb 93 Crb 94
Bradyrhizobiumjaponicum
Bj 11 wt Bj 11 (19)
Hrp-, IAA+, BPF Hrp
+
-, IAA+, BPF Hrp
+
-, IAA+, BPF Hrp
+
-, IAA+, BPF+ Hrp-, IAA+, BPF Hrp
+
-, IAA+, BPF Hrp
+
-, IAA+, BPF Hrp
+
-, IAA+, BPF+ Penambat Nitrogen Penambat Nitrogen
Wahyudi et al. 2011a Wahyudi et al. 2011a Wahyudi et al. 2011a Wahyudi et al. 2011a Wahyudi et al. 2011b Wahyudi et al. 2011b Wahyudi et al. 2011b Wahyudi et al. 2011b Wahyudi et al. 2007 Wahyudi et al. 2007 Keterangan:
Media Pikovskaya (glukosa 10 g l-1, (NH4)2SO4 0.5 g l-1, NaCl 0.2 g l-1, MgSO4.7H2O 0.1 g l-1, KCl 0.2 g l-1, ekstrak khamir 0.5 g l-1, MnSO4.H2O 0.002 g l-1, dan FeSO4.7H2O 0.002 g l-1pada pH 7 dengan penambahan sumber fosfat tri-kalsium fosfat [Ca3(PO4)2] pada konsentrasi 0.5%) digunakan untuk menguji bakteri pelarut fosfat. Pengkulturan bakteri dilakukan menggunakan media susu skim dan molase (susu skim 20 g l-1, MgSO4 1.5 g l-1, K2HPO4 1.5 g l-1, molase 15 g l-1) dan diformulasi ke dalam bahan pembawa (gambut 85%, kapur pertanian 5%, dan fosfat alam 10%). Kedelai varietas Anjasmoro digunakan sebagai tanaman model untuk aplikasi inokulan bakteri.
Metode
Peremajaan Bakteri
Peremajaan galur-galur bakteri yang digunakan dilakukan dengan menggoreskan bakteri pada media padat yang sesuai yaitu King’s B agar, nutrien agar (NA), dan yeast manitol agar (YMA) masing-masing untuk Pseudomonas sp., Bacillus sp., dan B. japonicum. Pada media YMA untuk Bj 11 ditambahkan antibiotik rifampisin (50 µg ml-1) dan pada media YMA untuk Bj 11 (19) yang merupakan mutannya hasil mutagenesis transposon, ditambahkan antibiotik rifampisin (50 µg ml-1) dan kanamisin (50 µg ml-1).
Uji Kemampuan Bakteri PGPR dalam Melarutkan Fosfat
11
Kuantifikasi Jumlah Fosfat Terlarut pada Media Cair
Kuantifikasi jumlah fosfat yang dilarutkan oleh bakteri dilakukan dengan bantuan spektrofotometer menggunakan metode asam askorbat seperti dijelaskan oleh Alam et al. (2002). Kultur starter bakteri uji berusia 24 jam dipindahkan sebanyak 2.5% volume ke dalam media Pikovskaya cair. Selanjutnya diinkubasi pada inkubator bergoyang. Untuk mengukur konsentrasi fosfat dalam media pertumbuhan tersebut, kultur bakteri disentrifugasi pada kecepatan 1500 rpm selama 15 menit hingga dihasilkan supernatan. Sebanyak 1 ml supernatan ditambahkan dengan 9 ml air destilata dan 2.5 ml reagen. Reagen tersebut terdiri dari larutan A yaitu 12 g ammonium molybdate dalam 250 ml air destilata dan 0.2908 mg antimony potassium tartrate dalam 1000 ml asam sulfat 5 N (kedua larutan ini dicampurkan dan volumenya dijadikan 2000 ml) serta larutan B yaitu 0.74 g asam askorbat dalam 140 ml larutan A. Campuran supernatan dan reagen didiamkan selama 15 menit untuk membentuk warna biru yang sempurna kemudian absorbansinya diukur pada panjang gelombang 880 nm.
Sebagai standar untuk menentukan konsentrasi fosfat pada larutan digunakan larutan H3PO4 (Titrisol) dari Merck yang diencerkan serial hingga didapatkan konsentrasi fosfat sebesar 0, 0.25, 0.5, 0.75, 1, 1.25, 1.5, 1.75, 2, dan 2.25 ppm. Larutan standar kemudian direaksikan dengan reagen yang sama selama 15 menit dan diukur pada panjang gelombang 880 nm. Pengukuran kadar fosfat pada supernatan dilakukan dengan interval waktu 0, 6, 12, 24, 48, dan 72 jam setelah inokulasi. Perubahan pH pada media juga diukur menggunakan pH meter dengan interval waktu yang sama. Media yang tidak diinokulasikan bakteri digunakan sebagai kontrol. Sumber P yang diuji yaitu Ca3(PO4)2 sebanyak 0.5%. Formulasi Inokulan Bakteri Pelarut Fosfat
disuntikkan sebanyak 15 ml menggunakan syringe steril kedalam 50 g media pembawa berupa campuran gambut 85%, fosfat alam 10%, dan kapur pertanian 5% yang telah disterilkan. Selanjutnya diinkubasi pada suhu ruang. Pemilihan komposisi bakteri penyusun paket inokulan disesuaikan dengan hasil penelitian sebelumnya dimana keempat komposisi tersebut paling efektif dalam memacu pertumbuhan tanaman kedelai pada percobaan rumah kaca (Sari 2011). Komposisi paket inokulan disajikan pada Tabel 2.
Tabel 2 Formulasi bakteri dan komposisinya yang digunakan dalam penelitian
Formulasi Isolat bakteri
Bacillus sp. Pseudomonas sp. B. japonicum F1
F2 F3 F4
Cr 22 Cr 28 Cr 68 Cr 69
Crb 1 Crb 16 Crb 93 Crb 94
Bj 11 wt Bj 11 (19) Bj 11 wt Bj 11 (19)
Uji Viabilitas Inokulan Bakteri
Uji viabilitas inokulan dilakukan untuk mengamati daya tahan bakteri tersebut di dalam bahan pembawa berupa gambut selama masa inkubasi pada suhu ruang. Pengamatan dilakukan selama 9 bulan dengan mencawankan bakteri secara berkala. Sebanyak 10 gram paket inokulan yang terdiri dari Bacillus sp. Cr, Pseudomonas sp. Crb, dan B. japonicum dilarutkan dalam 90 ml larutan NaCl
13
Tabel 3 Antibiotik yang ditambahkan ke dalam media agar untuk menumbuhkan masing-masing bakteri
Isolat bakteri Antibiotik
Cr 22 -
Cr 28 -
Cr 68 Ampisilin (20 µg ml-1
Cr 69
) -
Crb 1 Ampisilin (20 µg ml-1
Crb 16
) Ampisilin (20 µg ml-1 Crb 93
) -
Crb 94 Streptomisin (20 µg ml-1 Bj 11 (wt)
) Rifampisin (50 µg ml-1 Bj 11 (19)
)
Rifampisin (50 µg ml-1), Kanamisin (50 µg ml-1)
Uji Keefektivan Inokulan terhadap Tanaman Kedelai
Sampel tanah yang digunakan untuk aplikasi pupuk hayati juga dihitung jumlah bakteri totalnya melalui metode total plate count (TPC) menggunakan media Standard Methods Agar (SMA). Sedangkan jumlah bakteri kelompok rhizobium yang terdapat pada sampel tanah dihitung dengan menyebar hasil
pengenceran serial sampel tanah pada media YMA dengan penambahan antibiotik rifampisin 20 µg/ml dan Kongo red 0.25%. Kandungan nitrogen, fosfor, dan kalium (NPK) tersedia dalam tanah sebelum tanam dianalisis melalui jasa laboratorium Balai Penelitian Tanah, Bogor, Indonesia.
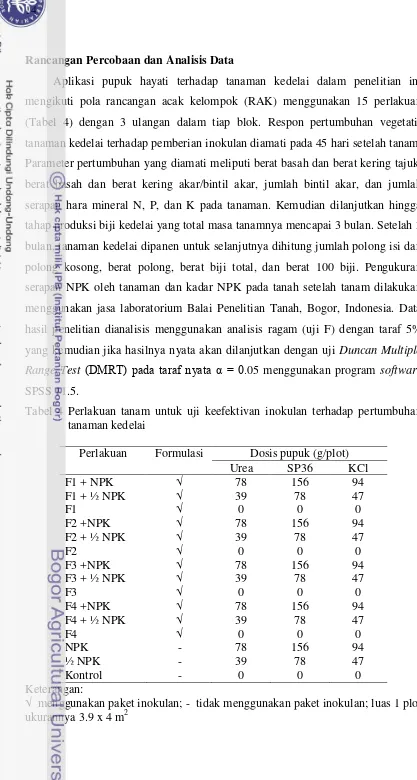
Rancangan Percobaan dan Analisis Data
Aplikasi pupuk hayati terhadap tanaman kedelai dalam penelitian ini mengikuti pola rancangan acak kelompok (RAK) menggunakan 15 perlakuan (Tabel 4) dengan 3 ulangan dalam tiap blok. Respon pertumbuhan vegetatif tanaman kedelai terhadap pemberian inokulan diamati pada 45 hari setelah tanam. Parameter pertumbuhan yang diamati meliputi berat basah dan berat kering tajuk, berat basah dan berat kering akar/bintil akar, jumlah bintil akar, dan jumlah serapan hara mineral N, P, dan K pada tanaman. Kemudian dilanjutkan hingga tahap produksi biji kedelai yang total masa tanamnya mencapai 3 bulan. Setelah 3 bulan, tanaman kedelai dipanen untuk selanjutnya dihitung jumlah polong isi dan polong kosong, berat polong, berat biji total, dan berat 100 biji. Pengukuran serapan NPK oleh tanaman dan kadar NPK pada tanah setelah tanam dilakukan menggunakan jasa laboratorium Balai Penelitian Tanah, Bogor, Indonesia. Data hasil penelitian dianalisis menggunakan analisis ragam (uji F) dengan taraf 5% yang kemudian jika hasilnya nyata akan dilanjutkan dengan uji Duncan Multiple Range Test (DMRT) pada taraf nyata α = 0.05 menggunakan program software SPSS 11.5.
Tabel 4 Perlakuan tanam untuk uji keefektivan inokulan terhadap pertumbuhan tanaman kedelai
Perlakuan Formulasi Dosis pupuk (g/plot)
Urea SP36 KCl
F1 + NPK F1 + ½ NPK F1
F2 +NPK F2 + ½ NPK F2
F3 +NPK F3 + ½ NPK F3
F4 +NPK F4 + ½ NPK F4 NPK ½ NPK Kontrol √ √ √ √ √ √ √ √ √ √ √ √ - - - 78 39 0 78 39 0 78 39 0 78 39 0 78 39 0 156 78 0 156 78 0 156 78 0 156 78 0 156 78 0 94 47 0 94 47 0 94 47 0 94 47 0 94 47 0 Keterangan:
HASIL
Kemampuan Bakteri PGPR dalam Melarutkan Fosfat
Berdasarkan uji pelarutan fosfat menggunakan media Pikovskaya dengan penambahan Ca3(PO4)2 sebagai sumber fosfat diketahui bahwa isolat-isolat bakteri baik Cr maupun Crb yang diuji dapat melarutkan fosfat. Hal ini ditunjukkan dengan adanya zona bening yang terbentuk di sekitar koloni bakteri (Gambar 1). Indeks pelarutan fosfat yang diukur berdasarkan diameter zona bening yang dibentuk oleh bakteri uji disajikan pada Tabel 5.
Gambar 1 Koloni bakteri Bacillus sp. Cr 22 (A) dan Pseudomonas sp. Crb 16 (B) yang ditumbuhkan pada media Pikovskaya agar dan dinkubasi pada suhu ruang selama 3-5 hari. Zona bening terbentuk di sekitar koloni bakteri (tanda panah).
Tabel 5 Indeks pelarutan Ca3(PO4)2 dalam media Pikovskaya Agar oleh isolat bakteri rizosfer asal tanaman kedelai
Isolat Indeks pelarutan Isolat Indeks pelarutan
Cr 22 0.44 Crb 1 0.33
Cr 28 0.50 Crb 16 0.46
Cr 68 0.39 Crb 93 0.26
Cr 69 0.31 Crb 95 0.49
Kuantifikasi Jumlah Fosfat Terlarut pada Media Cair
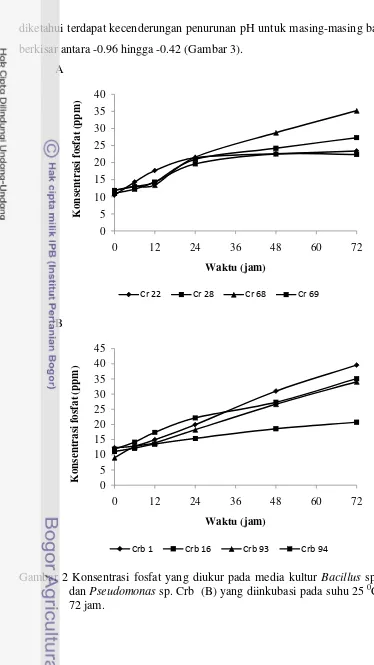
Jumlah fosfat yang dilarutkan berbeda-beda untuk setiap bakteri uji dengan masa inkubasi 72 jam. Dalam bentuk Ca3(PO4)2, jumlah fosfat yang bisa dilarutkan oleh bakteri uji berkisar 9.66- 27.22 ppm (Gambar 2). Crb 1 diketahui sebagai bakteri yang paling baik dalam melarutkan P yaitu sebesar 27.22 ppm. Berdasarkan hasil pengukuran pH pada interval waktu 0, 6, 12, 24, 48, dan 72 jam
B
A 1 cm
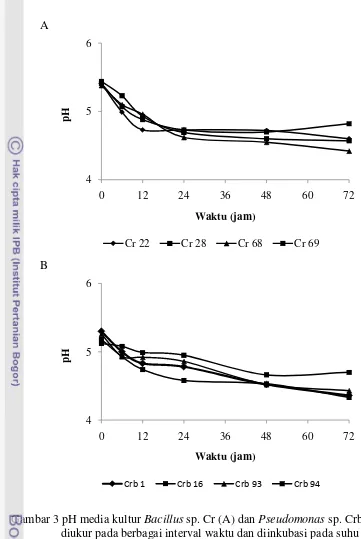
diketahui terdapat kecenderungan penurunan pH untuk masing-masing bakteri uji berkisar antara -0.96 hingga -0.42 (Gambar 3).
A
B
Gambar 2 Konsentrasi fosfat yang diukur pada media kultur Bacillus sp. Cr (A) dan Pseudomonas sp. Crb (B) yang diinkubasi pada suhu 25 0C selama 72 jam.
0 5 10 15 20 25 30 35 40
0 12 24 36 48 60 72
K
on
sen
tras
i
fos
fat
(
p
p
m
)
Waktu (jam)
Cr 22 Cr 28 Cr 68 Cr 69
0 5 10 15 20 25 30 35 40 45
0 12 24 36 48 60 72
K
on
sen
tras
i
fos
fat
(
p
p
m
)
Waktu (jam)
17
A
[image:30.595.102.463.67.606.2]B
Gambar 3 pH media kultur Bacillus sp. Cr (A) dan Pseudomonas sp. Crb (B) yang diukur pada berbagai interval waktu dan diinkubasi pada suhu 25 0C. Formulasi Inokulan Bakteri Pelarut Fosfat
Berdasarkan kegiatan pembuatan formulasi pupuk hayati diperoleh empat formulasi yang selanjutnya diberi kode F1, F2, F3, dan F4. Inokulan tersebut dikemas ke dalam bungkus plastik dan diberi label (Gambar 4). Kepadatan masing-masing bakteri yang dimasukkan kedalam gambut berkisar antara 3.5 x 109 sampai 9.4 x 1010 cfu ml-1 untuk isolat Cr dan 1.3 x 1010 sampai 3.3 x 1011
4 5 6
0 12 24 36 48 60 72
pH
Waktu (jam)
Cr 22 Cr 28 Cr 68 Cr 69
4 5 6
0 12 24 36 48 60 72
pH
Waktu (jam)
cfu ml-1 untuk isolat Crb. Sedangkan untuk isolat Bj 11 wt dan Bj 11 (19) berturut-turut sebanyak 7.0 x 1010 dan 3.0 x 1010 cfu ml-1 (Tabel 6).
Gambar 4 Penampilan kemasan pupuk hayati hasil formulasi F2 (A) dan F3 (B). Tabel 6 Kepadatan bakteri yang dimasukkan ke dalam bahan pembawa gambut Isolat Kepadatan bakteri (cfu ml-1) Isolat Kepadatan bakteri (cfu ml-1) Cr 22
Cr 28 Cr 68 Cr 69 Bj 11 wt
3.5 x 10 1.9 x 10
9
3.3 x 10 10
9.4 x 10 10
7.0 x 10 10 Crb 1 10 Crb 16 Crb 93 Crb 94 Bj 11 (19)
1.3 x 10 5.2 x 10
10
3.3 x 10 10
2.0 x 10 11
3.0 x 10 10 10
Uji Viabilitas Inokulan Bakteri
Jumlah sel bakteri pada paket inokulan selama masa penyimpanan 9 bulan pada suhu ruang diketahui berkisar antara 7.5 x 106 hingga 5.8 x 108 cfu gr-1.Hasil uji viabilitas bakteri pada paket inokulan F1 hingga F4 ditampilkan pada Tabel 7. Tabel 7 Viabilitas sel bakteri pada gambut selama masa penyimpanan pada suhu
ruang
Kode Isolat Jumlah bakteri (cfu gr-1) bulan ke-
0 1 2 3 6 9
F1 Cr 22 Crb 1 Bj 11 wt
3.5 x 10 1.3 x 10 8
7.0 x 10
9 2.8 x 10 9 4.0 x 10 10
1.1 x 10
9 4.6 x 10 9 4.0 x 10 9
5.3 x 10
7 6.0 x 10 8 1.0 x 10 9
1.4 x 10
8 6.0 x 10 8 6.6 x 10 8
4.5 x 10
8 2.9 x 10 7 1.6 x 10 7
2.0 x 10 8 7 F2 Cr 28
Crb 16 Bj 11 (19)
1.9 x 10 5.2 x 10 9
3.0 x 10
9 2.7 x 10 9 2.0 x 10 9
9.8 x 10
9 4.7 x 10 8 2.3 x 10 9
1.6 x 10
9 2.7 x 10 9 4.0 x 10 9
2.3 x 10
8 1.5 x 10 8 2.0 x 10 8
2.0 x 10
8 8.2 x 10 8 5.7 x 10 7
7.5 x 10 7 6 F3 Cr 68
Crb 93 Bj 11 wt
3.3 x 10 3.3 x 10
9
7.0 x 10
10 2.0 x 10 9 8.1 x 10 9
1.1 x 10
8 2.0 x 10 9 3.1 x 10 8
7.0 x 10
8 1.0 x 10 8 2.9 x 10 8
1.0 x 10
8 2.5 x 10 8 2.2 x 10 7
2.0 x 10
9 1.5 x 10 7 5.8 x 10 8
3.1 x 10 8 7 F4 Cr 69
Crb 94 Bj 11 (19)
9.4 x 10 2.0 x 10 9
3.0 x 10
9 1.2 x 10 9
1.3 x 10 8
9.6 x 10
9 3.2 x 10 8
1.1 x 10 10
8.7 x 10
11 3.1 x 10 8
2.3 x 10 9
9.8 x 10
10 4.7 x 10 8
2.1 x 10 9
3.5 x 10 9 7
1.3 x 10 1.1 x 10 8
2.2 x 10 8 7 B
19
Keefektivan Inokulan terhadap Pertumbuhan Tanaman Kedelai
Sampel tanah yang diambil dari areal penanaman kedelai diketahui mengandung 8.1 x 106 cfu gr-1 bakteri melalui penghitungan total pada media agar cawan Standard Methods Agar (SMA) dan mengandung sekitar 6.3 x 104 cfu gr-1
Hasil uji keefektivan inokulan di lahan pertanian terhadap beberapa parameter pertumbuhan tanaman kedelai ditunjukkan oleh Tabel 8. Respon tanaman kedelai terhadap pemberian inokulan berbeda-beda untuk setiap perlakuan yang diamati pada 45 hari setelah tanam. Untuk variabel berat basah tajuk (BBT), perlakuan F1 dengan NPK dosis penuh (FI+NPK) memberikan hasil yang lebih baik dan berbeda nyata dari kontrol yang tidak mendapat inokulan maupun pupuk bahkan terhadap perlakuan NPK dosis penuh (NPK). Perlakuan F3 dengan NPK dosis penuh (F3+NPK) dan NPK dosis setengah (F3+1/2NPK) juga diketahui menghasilkan berat basah tajuk yang lebih baik dari kontrol dan perlakuan NPK tetapi tidak secara nyata pada taraf α=0.05. Hasil yang serupa juga ditemukan pada variabel berat basah akar (BBA) dimana perlakuan F3+NPK dan F1+NPK menghasilkan berat akar yang lebih tinggi dibandingkan dengan kontrol dan perlakuan NPK.
bakteri kelompok rhizobium yang dihitung menggunakan cawan sebar YMA dengan masa inkubasi mencapai 5-7 hari. Jumlah hara mineral N, P, dan K yang tersedia pada sampel tanah kering sebelum penanaman diketahui berturut-turut sebesar 0.07%, 6.1 ppm, dan 535 ppm.
Tabel 8 Pengaruh perlakuan pemberian inokulan terhadap pertumbuhan pada tanaman kedelai berumur 45 hari setelah tanam
Perlakuan BBT BBA BKT BKA JBt BBt
F1+NPK 10.40 e 2.54 bc 4.49 e 0.81 c 29.88 d 0.074 b F2+NPK 6.60 bc 1.70 ab 2.30 bc 0.59 ab 19.71 abc 0.042 F3+NPK
a 7.74 c 3.04 c 3.20 d 0.73 bc 26.53 bcd 0.073 F4+NPK
ab 6.37 bc 1.62 ab 1.91 abc 0.60 ab 22.19 abc 0.047 F1+1/2NPK
a 5.48 ab 1.35 a 1.93 abc 0.44 a 19.83 abc 0.061 F2+1/2NPK
ab 4.54 ab 1.67 ab 1.85 abc 0.55 a 16.14 a 0.042 F3+1/2NPK
a 6.35 bc 1.73 ab 2.13 abc 0.57 ab 20.55 abc 0.052 F4+1/2NPK
a 5.25 ab 1.55 ab 1.91 abc 0.55 a 16.96 a 0.044 F1
a 5.39 ab 1.50 a 2.02 abc 0.51 a 17.72 a 0.064 F2
ab 4.75 ab 1.41 a 1.69 abc 0.54 a 22.27 abc 0.074 F3
ab 3.99 a 1.28 a 1.44 ab 0.47 a 19.98 abc 0.061 F4
ab 3.79 a 1.28 a 1.22 a 0.42 a 16.83 a 0.051 NPK
a 6.21 bc 1.69 ab 2.58 cd 0.58 ab 18.74 ab 0.049 1/2NPK
a 4.57 ab 1.40 a 2.13 abc 0.50 a 17.54 a 0.036 Kontrol
[image:33.595.49.489.61.809.2]21
Tabel 9 Pengaruh perlakuan pemberian inokulan terhadap serapan hara pada tanaman kedelai berumur 45 hari setelah tanam
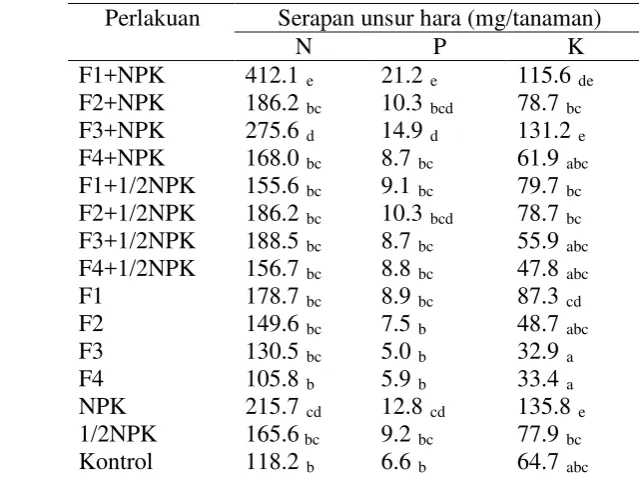
Perlakuan Serapan unsur hara (mg/tanaman)
N P K
F1+NPK 412.1 e 21.2 e 115.6 de F2+NPK 186.2 bc 10.3 bcd 78.7 F3+NPK
bc 275.6 d 14.9 d 131.2 F4+NPK
e 168.0 bc 8.7 bc 61.9 F1+1/2NPK
abc 155.6 bc 9.1 bc 79.7 F2+1/2NPK
bc 186.2 bc 10.3 bcd 78.7 F3+1/2NPK
bc 188.5 bc 8.7 bc 55.9 F4+1/2NPK
abc 156.7 bc 8.8 bc 47.8 F1
abc 178.7 bc 8.9 bc 87.3 F2
cd 149.6 bc 7.5 b 48.7 F3
abc 130.5 bc 5.0 b 32.9 F4
a 105.8 b 5.9 b 33.4 NPK
a 215.7 cd 12.8 cd 135.8 1/2NPK
e 165.6 bc 9.2 bc 77.9 Kontrol
bc 118.2 b 6.6 b 64.7 abc
Keterangan: Angka yang didampingi huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata berdasarkan uji Duncan pada taraf α=0.05.
[image:34.595.134.454.125.369.2]setelah panen disajikan pada Tabel 10. Hasil analisis kadar N dan P yang tersedia pada sampel tanah yang diambil pada akhir masa penanaman kedelai menunjukkan peningkatan konsentrasi unsur hara tersebut yaitu berturut-turut sebesar 0.093% dan 146.67 ppm. Sementara itu, konsentrasi hara K menurun dari sebelumnya yaitu menjadi sebesar 247.33 ppm.
Tabel 10 Pengaruh perlakuan pemberian inokulan terhadap produktivitas tanaman Kedelai (umur 3 bulan)
Perlakuan Berat polong/ tanaman (gr) Jumlah polong isi/ tanaman Berat biji/ tanaman (gr) Berat 100 biji (gr) Produksi (ton/ha)
F1+NPK 5.10 cd 13.50 fg 3.35 cd 14.33 ab 1.11 cd F2+NPK 5.57 d 14.64 g 3.52 d 14.25 ab 1.17 F3+NPK
d 4.17 abcd 13.04 efg 2.94 abcd 14.25 ab 0.98 F4+NPK
abcd 4.64 bcd 12.64 defg 3.00 abcd 13.47 ab 1.00 F1+1/2NPK
abcd 3.77 abc 10.20 abc 2.41 abc 12.89 ab 0.80 F2+1/2NPK
abc 3.54 ab 10.30 abc 2.27 ab 13.30 ab 0.75 F3+1/2NPK
ab 3.60 abc 9.74 ab 2.24 ab 13.90 ab 0.74 F4+1/2NPK
ab 3.74 abc 9.45 ab 2.09 a 12.49 a 0.69 F1
a 3.60 abc 9.85 abc 2.35 abc 14.05 ab 0.78 F2
abc 4.30 abcd 11.97 cdef 3.04 abcd 14.70 b 1.01 F3
abcd 3.87 abc 10.84 abcd 2.49 abc 13.68 ab 0.83 F4
abc 3.07 a 8.77 ab 2.05 a 13.10 ab 0.68 NPK
a 5.12 cd 12.46 def 3.14 bcd 14.83 b 1.05 1/2NPK
bcd 4.34 abcd 11.00 bcde 2.56 abcd 13.81 ab 0.85 Kontrol
PEMBAHASAN
Isolat bakteri rizosfer yang digunakan dalam penelitian ini baik Bacillus sp. Cr maupun Pseudomonas sp. Crb diketahui mampu melarutkan fosfat. Semua isolat menghasilkan zona bening disekitar koloninya ketika digores pada media Pikovskaya yang diberi 0.5% Ca3(PO4)2
Jumlah fosfat yang dilarutkan oleh isolat bakteri pada media kultur cair berkisar antara 9.66 ppm hingga 27.22 ppm. Crb 1 merupakan isolat yang paling baik dalam melarutkan fosfat dalam bentuk Ca
sebagai sumber P. Oleh karena itu, isolat tersebut dikelompokan dalam bakteri pelarut fosfat. Berdasarkan pengukuran indeks pelarutan mineral fosfat, dapat terlihat bahwa ukuran zona bening yang dihasilkan oleh masing-masing isolat bakteri berbeda. Suliasih dan Rahmat (2007) mengemukakan bahwa luas daerah zona bening disekitar koloni bakteri secara kualitatif menunjukkan besar kecilnya kemampuan bakteri pelarut fosfat dalam melarutkan P dari fosfat tidak larut. Isolat bakteri Cr 28 diketahui menghasilkan indeks pelarutan terbesar yaitu sebesar 0.50. Berdasarkan analisis morfologi dan sekuen gen 16S rRNA, bakteri tersebut termasuk ke dalam kelompok Bacillus sp. (Wahyudi et al. 2011a).
3(PO4)2 yaitu sebesar 27.22 ppm, diikuti oleh isolat lainnya seperti Crb 93, Cr 68, dan Crb 94 yaitu berturut-turut sebesar 24.99 ppm, 23.35 ppm, dan 23.22 ppm. Adanya fosfat yang terukur pada kontrol media yang tidak diinokulasikan dengan bakteri dan media yang diinokulasikan bakteri pada jam ke- 0 dapat disebabkan oleh pelepasan PO4
Berdasarkan analisis morfologi dan sekuen gen 16S rRNA, isolat Crb termasuk ke dalam kelompok Pseudomonas sp. (Wahyudi et al. 2011b). Sebagian besar bakteri pelarut fosfat yang diisolasi dari rizosfer merupakan kelompok Bacillus dan Pseudomonas (Widiawati & Suliasih 2006; Khrisnaveni 2010).
Pelarutan fosfat oleh mikroorganisme dapat dilakukan dengan beberapa mekanisme seperti produksi asam organik, produksi enzim, pembentukan kelat, atau reaksi pertukaran ion. Meskipun demikian, memproduksi sejumlah asam organik diketahui merupakan mekanisme yang paling umum digunakan bakteri pelarut fosfat untuk melepaskan ikatan fosfat dengan logam pengikatnya (Rodriguez & Fraga 1999). Asam organik seperti asam oksalat, asam sitrat, asam glukonat, asam suksinat, asam fumarat, dan asam asetat dilaporkan terlibat dalam pelarutan fosfat (Alam et al. 2002). Jumlah dan jenis asam organik yang diproduksi oleh mikroorganisme dipengaruhi oleh bahan genetik yang terlibat dalam pembuatan asam organik (Chen et al. 2006). Oleh karena itu, meskipun masih digolongkan dalam genus yang sama, kemampuan melarutkan fosfat antara isolat Bacillus sp. Cr atau Pseudomonas sp. Crb tidak sama sekalipun ditumbuhkan dengan nutrisi yang sama.
Produksi asam organik oleh bakteri menyebabkan menurunnya pH media. Asam organik tersebut selanjutnya mengkelat kation pengikat fosfat membentuk kompleks yang pembentukannya tergantung pada jumlah dan posisi grup fungsional karboksilik dan fenolik dari asam organik tersebut (Barroso et al. 2006). Pada penelitian ini dapat diamati kenaikan konsentrasi fosfat dalam media berbanding terbalik dengan pH (Gambar 2 dan 3). Sehingga dapat disimpulkan bahwa pelarutan fosfat dalam media disebabkan oleh produksi asam organik sehingga menyebabkan terjadinya penurunan pH. Penurunan pH media yang terukur dalam media kultur dengan penambahan Ca3(PO4)2
Isolat bakteri yang telah dikarakterisasi kemampuannya dalam melarutkan fosfat ini selanjutnya diformulasi ke dalam paket inokulan dengan bahan pembawa berupa gambut. Formulasi penting dilakukan untuk mempermudah aplikasi bakteri pelarut fosfat terhadap tanaman. Gambut dipilih karena mudah digunakan dan telah lama dikenal oleh petani sebagai bahan pembawa.
25
Keuntungan lain menggunakan gambut sebagai bahan pembawa ialah karena gambut juga mudah didegradasi di dalam tanah, merupakan bahan yang murah, tidak menyebabkan polusi pada lingkungan, dan dapat digunakan untuk menyimpan bakteri dalam waktu yang cukup lama (Bashan 1998). Pada kegiatan formulasi diperoleh 4 jenis paket inokulan yang selanjutnya ditandai dengan F1, F2, F3, dan F4 yang merupakan gabungan antara tiga bakteri yaitu bakteri pelarut fosfat Cr dan Crb, serta bakteri penambat nitrogen Bj. Pemilihan komposisi bakteri penyusun F1- F4 disesuaikan dengan hasil penelitian sebelumnya dimana keempat komposisi tersebut paling efektif dalam memacu pertumbuhan tanaman kedelai pada percobaan rumah kaca (Sari 2011). Jumlah bakteri yang dimasukkan ke dalam bahan pembawa berkisar antara 3.5 x 109 sampai 3.3 x 1011 cfu ml-1. Angka ini memenuhi jumlah sel rhizobakteri yang disarankan untuk diinokulasikan ke dalam bahan pembawa menurut Somasegaran dan Hoben (1994) yaitu sebanyak 5.0 x 108 cfu ml-1
Jumlah sel bakteri yang terdapat dalam gambut dihitung secara berkala untuk mengetahui viabilitas bakteri selama masa penyimpanan. Tinggi rendahnya viabilitas bakteri di dalam bahan pembawa selama masa penyimpanan menunjukkan kualitas inokulan bakteri yang diproduksi. Berdasarkan hasil penghitungan jumlah sel bakteri selama masa penyimpanan 9 bulan dalam suhu ruang diketahui berkisar antara 2.9 x 10
.
7
hingga 1.5 x 108 cfu gr-1 gambut untuk isolat Bacillus sp. Cr, 5.7 x 107 hingga 5.8 x 108 cfu gr-1 gambut untuk isolat Pseudomonas sp. Crb, dan 7.5 x 106 hingga 3.1 x 107 cfu gr-1 gambut untuk isolat B. japonicum. Husen et al. (2007) menyatakan bahwa standar kepadatan sel yang
Oleh karena kondisi tanah lebih kompleks dibanding kondisi in vitro, maka uji efektivitas bakteri pelarut fosfat dalam meningkatkan pertumbuhan tanaman perlu dilakukan di tanah lapang. Berdasarkan hasil uji lapang, diketahui bahwa penggunaan inokulum bakteri pelarut fosfat tanpa pupuk anorganik belum dapat memberikan hasil seperti yang diharapkan. Hasil yang lebih baik ditunjukkan oleh perlakuan inokulum yang dikombinasikan dengan pupuk anorganik terutama pemberian dosis penuh. Perlakuan F1+NPK secara signifikan meningkatkan berat basah dan berat kering tajuk, serta berat kering akar. Perlakuan ini bahkan memberikan hasil yang lebih baik dibandingkan dengan perlakuan pemberian NPK. Adanya peningkatan dalam berat tajuk didukung oleh kemampuan bakteri Crb 1 pada paket inokualan F1 dalam meningkatkan panjang batang (Wahyudi et al. 2011b). Berat kering tanaman dalam hal ini meningindikasikan kemampuan
tanaman untuk memanfaatkan fotosintat dan penyerapan mineral oleh akar dan karenanya menjadi indikator laju pertumbuhan tanaman. Hasil serupa diperoleh melalui perlakuan F3+NPK. Sejalan dengan penelitian ini, Han dan Lee (2005) juga melaporkan bahwa aplikasi inokulan bakteri pelarut fosfat secara sendiri tidak memberikan hasil yang lebih baik dibandingkan tanaman yang diberi fosfat alam.
Ketidakefektifan penggunaan inokulum bakteri dalam memacu pertumbuhan tanaman kedelai dapat juga dipengaruhi oleh keberadaan mikroorganisme lain yang jumlahnya mencapai 8.1 x 106
Pemberian inokulan dengan pupuk anorganik dosis setengah belum dapat meningkatkan berat tajuk dan akar melebihi perlakuan NPK dosis penuh, kecuali pada perlakuan F3+1/2NPK terhadap berat basah tajuk. Dalam hal ini, Jilani et al. (2007) menyatakan bahwa inokulan bakteri berpeluang dimanfaatkan menjadi pupuk hayati apabila mampu memberikan hasil lebih baik atau sama dengan perlakuan pupuk anorganik dosis penuh ketika diaplikasikan bersama pupuk anorganik dalam dosis yang lebih rendah. Dengan melihat pengaruhnya terhadap
27
beberapa parameter pertumbuhan tanaman kedelai dapat dinyatakan bahwa penggunaan pupuk hayati dari bakteri pada penelitian ini belum dapat menggantikan peran pupuk anorganik tetapi penggunaan kombinasi antara keduanya dapat memberikan hasil yang lebih baik dalam meningkatkan pertumbuhan tanaman.
Asosiasi yang terjadi antara akar tanaman kedelai dengan bintil akar diketahui berperan dalam meningkatkan pertumbuhan tanaman. Bakteri penambat nitrogen (B. japonicum) pada bintil akar dapat mengikat nitrogen yang dibutuhkan oleh tanaman untuk mendukung pertumbuhan dan perkembangan tanaman kedelai (Mubarik et al. 2011). Dalam penelitian ini, perlakuan yang diberikan terhadap tanaman kedelai secara umum tidak dapat meningkatkan jumlah dan berat bintil akar. Jumlah bintil akar tanaman kedelai paling banyak ditemukan pada tanaman yang diberi perlakuan F1+NPK. Meskipun demikian, hasil analisis serapan nitrogen terhadap jaringan tanaman kedelai menunjukkan bahwa pemberian inokulum mampu meningkatkan konsentrasi nitrogen pada tanaman dibandingkan kontrol tanpa perlakuan. Beberapa perlakuan bahkan memiliki serapan nitrogen yang lebih baik dibandingkan perlakuan NPK diantaranya perlakuan F1+NPK dan F3+NPK. Hal ini mengindikasikan bahwa penyediaan hara nitrogen untuk tanaman tidak hanya melibatkan peran B. japonicum semata tetapi diduga dipengaruhi oleh ko-inokulasi bakteri tersebut
dengan bakteri Bacillus Cr dan Pseudomonas Crb yang digunakan dalam penelitian ini. Han et al. (2006) menyatakan genus Bradyrhizobium sp. memiliki hubungan kekerabatan yang lebih dekat dengan Bacillus dibandingkan dengan kelompok rhizobia lain. Oleh karena itu, Bacillus diduga memiliki kapasitas untuk menambat nitrogen dari alam. Kumar dan Chandra (2008) melaporkan bahwa bakteri pelarut fosfat dan PGPR dapat meningkatkan kemampuan kompetisi dan efektivitas Rhizobium sp. yang diinokulasikan ke tanaman Lens culinaris sehingga meningkatkan serapan nitrogen pada tanaman.
pertumbuhan yang lebih baik dibandingkan dengan perlakuan lainnya. Kombinasi bakteri penyusun paket inokulan F1 dan F3 diduga menjadi faktor penyebab tingginya serapan P yang kemudian berdampak pada baiknya pertumbuhan tanaman kedelai. Bakteri Crb 1 yang menyusun paket inokulan F1 dan Cr 68 bersama Crb 93 yang menyusun paket inokulan F3 termasuk bakteri yang memiliki kemampuan melarutkan fosfat tinggi secara in vitro. Meskipun demikian sejumlah faktor lain juga dapat ikut mempengaruhi pertumbuhan tanaman kedelai. Richardson (2001) menyatakan bahwa peningkatan pertumbuhan tanaman tidak secara khusus berhubungan dengan pelarutan fosfat seperti yang biasa terjadi pada kondisi laboratorium. Pengaruh pemberian mikroorganisme pelarut fosfat pada tanaman juga melibatkan mekanisme produksi fitohormon, vitamin, atau asam amino. Dan seperti yang sudah diketahui, isolat Cr dan Crb yang digunakan dalam penelitian ini memiliki kemampuan dalam memproduksi IAA dan senyawa lain seperti siderofor (Wahyudi et al. 2011a, Wahyudi et al. 2011b) sehingga membantu meningkatkan pengaruh pelarutan P oleh bakteri.
29
SIMPULAN
DAFTAR PUSTAKA
Alam S, Khalil S, Ayub N, Rashid M. 2002. In vitro solubilization of inorganic phosphate by phosphate solubilizing microorganisms (PSM) from maize rhizosphere. Int J Agric Biol 4: 454-458.
Argaw A. 2012. Evaluation of co-inoculation of Bradyrhizobium japonicum and phosphate solubilizing Pseudomonas spp. Effect on soybean (Glycine max L. (Merr)) in Assossa Area. J Agr Sci Tech 14: 213-224.
Ashrafuzzaman M, Hossen FA, Ismail MR, Hoque MD, Islam MZ, Sahidullah SM, Meon S. 2009. Efficiency of plant growth promoting rizobakteria (PGPR) for the enhancement of rice growth. Afr J Biotechnol 8: 1247-1252. [BPPP] Badan Penelitian dan Pengembangan Pertanian. 2008. Ketersediaan
Teknologi dalam Mendukung Peningkatan Produksi Kedelai Menuju Swasembada. Siaran Pers BPPP. hlm: 1-4.
Barea JM, Pozo MJ, Azcon R, Azcon-Aguilar C. 2005. Microbial co-operation in the rhizosphere. J Exp Bot 56: 1761-1778.
Barroso CB, Pereira GT, Nahas E. 2006. Solubilization of CaHPO4 and AlPO4 by Aspergillus niger in culture media with different carbon and nitrogen sources. Brazil J Microbiol 37: 434-438.
Bashan Y. 1998. Inoculants of plant growth-promoting bacteria for use in agriculture. Biotechnol Adv 16: 729-770.
Buchholz DD, Brown JR. 1993. Potassium in Missouri Soil. Agricultural Publication.
Campbell NA, Reece J, Mitchell L. 2000. Biologi. Jilid-1. Jakarta: Erlangga. Chen YP, et al. 2006. Phosphate solubilizing bacteria from subtropical soil and
their tricalcium phosphate solubilizing abilities. Appl Soil Ecol 34: 33-41. Ekin Z. 2010. Performance of phosphate solubilizing bacteria for improving
growth and yield of sunflower (Helianthus annuus L.) in the presence of phosphate fertilizer. Afr J Biotechnol 9: 3794-3800.
Ghulamahdi M, Melati M, Sagala D. 2009. Production of soybean varieties under saturated soil culture on tidal swamps. J Argon Indones 37 : 226-232.
Girgis MGZ, Khalil HMA, Sharaf MS. 2008. In vitro evaluation of rock phosphate and potassium solubilizing potential of some Bacillus strains. Aust J Basic Appl Sci 2: 68-81.
Han HS, Supanjani, Lee KD. 2006. Effect of co-inoculation with phosphate and potassium solubilizing bacteria on mineral uptake and growth of pepper and cucumber. Plant Soil Environ 52: 130-136.
Husen E, Simanungkalit RDM, Saraswati R, Irawan. 2007. Characterization and quality assessment of indonesian comersial biofertilizers. Indones J Agric Sci 8: 31-36.
Husen E, Wahyudi AT, Suwanto A, Giyanto. 2011. Growth enhancement and disease reduction of soybean by 1-aminocyclopropane-1-carboxylate deaminase- producing Pseudomonas. Am J Appl Sci 8: 1073-1080.
Inui-Kishi RN, et al. 2012. Phosphorus solubilizing and IAA production activities in plant growth promoting rhizobacteria from Brazilian soil under sugarcane cultivation. APRN J Eng Appl Sci 7: 1446-1454.
Jilani G, et al.. 2007. Enhancing crop growth, nutrients availability, economics and beneficial microlora through organic and biofertilizers. Annals Microbiol 57: 177-183.
Karamoy LT. 2009. Hubungan iklim dengan pertumbuhan kedelai (Glicine max L Merrill). Soil Environ 7: 65-68.
Keneni A, Assefa F, Prabu PC. 2010. Isolation of phosphate solubilizing bacteria from the rhizosphere of faba bean of ethiophia and their abilities on solibilizing insoluble phosphates. J Agr Sci Tech 12: 79-89.
Krishnaveni MS. 2010. Studies on phosphate solubilizing bacteria (PSB) in rhizosphere and non-rhizosphere soils in different varieties of foxtail millet (Setaria italica). Inl J Agric Food Sci Tech 1: 23-39.
Kumar R, Chandra R. 2008. Influence of PGPR and PSB on Rhizobium legumminosarum Bv. viciae strain competition and symbiotic performance in lentil. World J Agric Sci 4: 297-301.
Loveless AR. 2000. Prinsip-prinsip Biologi Tumbuhan untuk Daerah Tropik. Jakarta: PT Gramedia Pustaka Utama.
Lu C, Huang B. 2010. Isolation and characerization of Azotobacteria from pine rhizosphere. Afr J Microbiol Res 4: 1299-1306.
Lucas Garcia JA, Probanza A, Ramos B, Barriuso J, Gutierrez Manero FJ. 2004. Effects of inoculation with plant growth promoting rizobakteria (PGPRs) and Sinoehizobium fredii on biological nitrogen fixation, nodulation, and growth of Glycine max cv. Osumi. Plant Soil 267: 143-153.
33
Noor A. 2003. Pengaruh fosfat alam dan kombinasi bakteri pelarut fosfat dengan pupuk kandang terhadap P tersedia dan pertumbuhan kedelai pada ultisol. Bul Agron 31:100-106.
Panhwar QA, Radziah O, Zaharah AR, Sariah M, Razi IM. 2011. Role of phosphate solubilizing bacteria on rock phosphate solubility and growth of aerobic rice. J Environ Biol 32: 607-612.
Ponmurugan P, Gopi C. 2006. In vitro production of growth regulators and phosphatase activity by phosphatase solubilizing bacteria. Afr J Biotechnol 5: 348-350.
Premono ME. 1998. Mikrob pelarut fosfat untuk mengefisienkan pupuk fosfat dan prospeknya di Indonesia. Hayati 5: 89-94.
Purwono, Purnamawati H. 2007. Budidaya 8 Jenis Tanaman Pangan Unggul. Jakarta: Penebar Swadaya.
Richardson AE. 2001. Prospects for using soil microorganisms to improve the acquisition of phosphate by plants. Aust J Plant Physiol 28: 897-906.
Rodriguez H, Fraga R. 1999. Phosphate solubilizing bacteria and their role in plant growth promotion. Biotechnol Adv 17: 319-339.
Rodriguez H, Gonzalez T, Goire I, Bashan Y. 2004. Gluconic acid production and phosphate solublization by the plant growth promoting bacterium Azospirillum spp.. Naturwissenschaften 91: 552-555.
Sandeep AR, Joseph S, Jisha MS. 2008. Yield and nutrient uptake of soybean (Glycine max (L) Merr) as influenced by phosphate solubilizing microorganisms. World J Agric Sci 4: 835-838.
Sari NR. 2011. Pemanfaatan rizobakteria pelarut fosfat untuk meningkatkan pertumbuhan tanaman kedelai [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Schachtman DP, Reid RJ, Ayling SM. 1998. Phosphorus uptake by plants: from soil to cell. Plants Physiol 116: 447-453.
Somasegaran P, Hoben HJ. 1994. Hand Book for Rhizobia. New York: Spinger Verlag.
Son TTN, Diep CN, Giang TTM. 2006. Effect of Bradyrhizobia and phosphate solubilizing bacteria application on soybean in totational system in the Mekong delta. Omanrice 14: 48-57.
Sugumaran P, Janarthanam B. 2007. Solubilization of potassium containing minerals by bacteria and their effect on plant growth. World J Agric Sci 3: 350-355.
Suliasih, Rahmat. 2007. Aktivitas fosfatase dan pelarutan kalsium fosfat oleh beberapa bakteri pelarut fosfat. Biodiversitas 8: 23-26.
Suyamto, Musalamah. 2010. Kemampuan berbunga, tingkat keguguran bunga, dan potensi hasil beberapa varietas kedelai. Buletin Plasma Nutfah 16: 38-43.
Trivedi P, Pandey A. 2007. Low temperature phosphate solubilization and plant growth promotion by psychrotrophic bacteria, isolated from Indian Himalayan region. J Microbiol 2: 454-461.
Ullman WJ, Welch SA. 2002. Organic ligands and feldspar dissolution. The Geochem Soc 7: 3-35.
Wahyudi AT, Purnawijaya A, Nurdiani D, Imas T. 2007. Characterization of acid aliminium sensitive mutants of soybeans symbiont Bradyrhizobium japonicum generated by transposon mutagenesis. Microbiol Indones 1: 81-85.
Wahyudi AT, Astuti RP, Widyawati A, Meryandini A, Nawangsih AA. 2011a. Characterization of Bacillus sp. strains isolated from rhizosphere of soybean plants for their use as potential plant growth for promoting rizobakteria. J Microbiol Antimicrob 3: 34-40.
Wahyudi AT, Astuti RI, Giyanto. 2011b. Screening of Pseudomonas sp. isolated fom rhizosphere of soybeans plant as plant growth promoter and biocontrol agent. Am J Agric Biol Sci 6: 134-141.
Widawati S, Suliasih. 2006. Populasi bakteri pelarut fosfat (BPF) di Cikaniki, Gunung Botol dan Ciptarasa, serta kemampuannya melarutkan P terikat di media Pikovskaya padat. Biodiversitas 7: 109-113.
Lampiran 1 Hasil kuantifikasi fosfat tersedia pada kultur bakteri dalam media Pikovskaya cair dengan penambahan trikalsium fosfat 0,5%
Isolat Konsentrasi fosfat pada jam ke- (ppm) ∆ konsentrasi
fosfat
pH pada jam ke-
∆pH
0 6 12 24 48 72 0 72
ABSTRAK
SITI MELIAH. The Formulation of Consortium of Phosphate Solubilizing Rhizobacteria with Bradyrhizobium japonicum as Biofertilizer and Their Application to Soybean Plant. Supervised by Aris Tri Wahyudi and Abdjad Asih Nawangsih.
Phosphate solubilizing rhizobacteria were known for their ability to convert insoluble form of phosphate to the accessible form. The use of rhizobacteria as biofertilizer is one of the most promising biotechnologies to improve plant production. This study was conducted to formulate phosphate solubilizing rhizobacteria (Bacillus sp. Cr and Pseudomonas sp. Crb) coinoculated with
Bradyrhizobium japonicum (Bj) and appliance them to soybean plant as
biofertilizer. Pikovskaya medium containing tri-calcium phosphate at concentration of 0.5% was used to measure P-solubilizing ability of tested strains. Results revealed that Crb1 is the most powerful P-solublizer using tricalcium phosphate as a P source. It was also observed decreasing in pH along with the increasing of amount of soluble P ranged from -0.96 to -0.42 from initial culture during 72 hours. Isolates of the rhizobacteria (Crb and Cr) were grown in media containing skim milk and molases prior to formulation in peat as a carrier material. The combination of three strains produced 4 packages of inoculants. Each packages was tested for their viability and effectiveness on soybeans in the field. The number of bacterial population after 9 months of storage ranged from 7.5 x 106 to 5.8 x 108 cfu gr-1 of peats. Field experiment showed that treatments designed as F1+NPK and F3+NPK were significantly increased soybean plant growth and mineral uptake compared to untreated control and better than NPK treatment. While F1+NPK and F2+NPK were able to increase soybean productivity.
RINGKASAN
SITI MELIAH. Formulasi Konsorsium Rizobakteria Pelarut Fosfat dengan Bradyrhizobium japonicum sebagai Pupuk Hayati dan Aplikasinya pada Tanaman Kedelai. Dibimbing oleh Aris Tri Wahyudi dan Abdjad Asih Nawangsih.
Rizobakteria pelarut fosfat dikenal karena kemampuannya dalam mengubah fosfat dari bentuk yang tak larut menjadi bentuk terlarut yang dapat digunakan oleh tumbuhan. Pemanfaatan bakteri-bakteri yang memiliki kemampuan tersebut sebagai pupuk hayati (biofertilizer) merupakan salah satu bioteknologi yang menjanjikan dalam meningkatkan produksi tanaman dan mulai diterapkan untuk mengurangi ketergantungan pemakaian pupuk kimia. Dibandingkan pupuk kimia, pupuk hayati tidak meninggalkan residu, mampu meningkatkan efisiensi bioremediasi, dan relatif murah. Penelitian ini dilakukan dengan tujuan untuk membuat formulasi rizobakteria pelarut fosfat (Bacillus sp dan Pseudomonas sp) yang dikoinokulasi dengan Bradyrhizobium japonicum sebagai pupuk hayati serta aplikasinya pada tanaman kedelai.
Uji pelarutan fosfat secara kualitatif dilakukan dengan menggoreskan isolat bakteri Bacillus sp. Cr dan Pseudomonas sp. Crb pada media agar Pikovskaya dengan trikalsium fosfat (Ca3(PO4)2) sebagai sumber P sebanyak 0.5%. Kemudian dilanjutkan dengan uji kuantitatif pelarut P di media cair Pikovskaya. Secara kualitatif, seluruh bakteri yang diuji mampu melarutkan fosfat dengan Cr 28 memiliki indeks pelarutan fosfat yang terbesar yaitu sebesar 0.50. Dengan melihat jumlah fosfat yang berhasil dilarutkan pada media cair, bakteri Crb 1 diketahui paling baik dalam melarutkan fosfat. Hasil pengukuran konsentrasi fosfat yang dilarutkan dan pH media menunjukkan kecenderungan adanya peningkatan konsentrasi fosfat yang diikuti dengan penurunan pH. Penurunan pH media yang berhasil diukur bervariasi antara -0.96 hingga -0.42 selama 72 jam masa inkubasi. Formulasi bakteri dilakukan dengan mengkombinasikan tiga jenis bakteri dan ditumbuhkan secara bersama dalam media pembawa berupa gambut. Media susu skim molase merupakan media produksi yang digunakan sebelum formulasi. Sebanyak empat formulasi dihasilkan, terdiri dari F1, F2, F3, dan F4. Keempatnya diuji viabilitasnya selama masa penyimpanan 9 bulan dalam suhu ruang. Selama masa itu, jumlah bakteri yang menyusun paket inokulan tersebut berkisar antara 7.5 x 106 hingga 5.8 x 108 cfu gr-1 gambut. Pemberian inokulan bakteri yang dikombinasikan dengan pupuk NPK mampu meningkatkan pertumbuhan dan produksi tanaman kedelai di lapang terutama F1 dan F3. Kedua perlakuan ini mampu meningkatkan berat basah dan berat kering tajuk, berat basah dan berat kering akar, serta meningkatkan serapan hara N dan P. Sementara itu perlakuan F1 dan F2 yang dikombinasikan dengan NPK dapat meningkatkan berat polong, jumlah polong isi, berat total biji, dan ukuran biji.
PENDAHULUAN
Latar Belakang
Fosfor (P) merupakan unsur makro yang diperlukan untuk pertumbuhan tanaman. Fosfor terlibat dalam berbagai aktivitas biokimia dalam tumbuhan seperti sintesis asam nukleat, fotosintesis, dan sebagai komponen ATP. Kebutuhan P untuk tanaman umumnya dipenuhi melalui aplikasi pemupukan. Namun upaya tersebut menjadi kurang efisien karena mineral P yang masuk ke dalam siklus tanaman-hewan hanya kurang dari 10% (Panhwar et al. 2011). Hal ini disebabkan oleh adanya pengikatan P oleh unsur lain di dalam tanah sehingga ketersediaan unsur tersebut pada tanah menjadi terbatas. Umumnya, P akan terikat pada unsur lain seperti besi (Fe), alumunium (Al), kalsium (Ca), dan magnesium (Mg) (Widawati & Suliasih 2006). Mineral P dalam bentuk terikat ini tidak dapat digunakan secara langsung oleh tumbuhan.
Sejumlah bakteri tertentu di dalam tanah mampu memecahkan ikatan antara P dalam bentuk fosfat dengan kation pengikatnya. Bakteri ini berkoloni di wilayah perakaran (rizosfer) sehingga dikelompokkan dalam rizobakteria. Kelompok bakteri rizosfer ini telah banyak dilaporkan dapat meningkatkan pertumbuhan tanaman terkait dengan kemampuannya dalam melarutkan unsur-uns