INDUKSI MUTASI DENGAN ETIL METAN SULFONAT DALAM
KULTUR ANTERA CABAI (
Capsicum annuum
L.) DAN PENGARUHNYA
TERHADAP KAPASITAS EMBRIOGENESIS
MUHAMMAD RIDHWAN
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MUHAMMAD RIDHWAN. Induksi Mutasi dengan Etil Metan Sulfonat dalam Kultur Antera Cabai (Capsicum annuum L.) dan Pengaruhnya terhadap Kapasitas Embriogenesis. Dibimbing oleh ENCE DARMO JAYA SUPENA dan HADISUNARSO.
Metode kultur antera yang efisien pada sistem media dua lapis telah dikembangkan untuk memproduksi tanaman haploid ganda (HG) cabai kultivar lokal Indonesia (Capsicum annuum L.). Untuk percepatan dalam menghasilkan variasi genetik dan perbaikan sifat dari cabai, metode kultur antera ini dikombinasikan dengan teknik mutagenesis dalam penelitian ini. Induksi mutasi dilakukan melalui perendaman antera sebagai sumber eksplan pada larutan etil metan sulfonat (EMS) konsentrasi 0.1% dan 0.5% selama 1, 3, dan 6 jam sebelum kultur. Perlakuan EMS 0.1% selama 6 jam tidak hanya dapat menginduksi mutasi, tetapi juga meningkatkan respon embriogenesis, rata-rata embrio lengkap, dan rata-rata embrio berkecambah. Mutasi yang terjadi dapat dideteksi pada tanaman yang berasal dari kultur antera pada sifat morfologi daun dan batang, serta isozim peroksidase, aspartat aminotransferase, dan esterase. Metode kultur antera yang dikombinasikan dengan teknik mutagenesis ini dapat digunakan untuk mempercepat proses pemuliaan tanaman cabai kultivar lokal Indonesia.
Kata kunci: Capsicum, Kultur antera, Haploid ganda, EMS, Mutasi.
ABSTRACT
MUHAMMAD RIDHWAN. Ethyl Methane Sulphonate Treatment Mutation Induction on Anther Cultures of Hot Pepper (Capsicum annuum L.) and Its Effect on Embryogenesis Capacity. Under supervision of ENCE DARMO JAYA SUPENA and HADISUNARSO.
An efficient anther culture method on double layers medium system has been developed for producing doubled haploid (DH) of Indonesian hot pepper (Capsicum annuum L.). In order to speed up both genetic variability and improvement of hot pepper, this anther culture method was combined with mutagenesis technique in this research. Induction of mutation was evaluated by soaking of anthers as source of explans in 0.1% and 0.5% ethyl methane sulphonate (EMS) solution during 1, 3, and 6 hours prior to culture. Anther treatment on 0.1% EMS during 6 hours was not only induce mutation, but also increase embryogenesis response, complete embryo produce, and embryo germination. The mutation could be detected on plant derived from anther culture both in morphologycal characters of leaf and stem, and isozyme of peroxidase, aspartate aminotransferase, and esterase. A combination of anther cultures method and mutagenesis technique could be used for speeding up the breeding process of Indonesian local cultivar hot pepper.
INDUKSI MUTASI DENGAN ETIL METAN SULFONAT DALAM
KULTUR ANTERA CABAI (
Capsicum annuum
L.) DAN PENGARUHNYA
TERHADAP KAPASITAS EMBRIOGENESIS
MUHAMMAD RIDHWAN
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Induksi Mutasi dengan Etil Metan Sulfonat dalam Kultur Antera
Cabai (
Capsicum annuum
L.) dan Pengaruhnya terhadap Kapasitas
Embriogenesis
Nama
: Muhammad Ridhwan
NIM
: G34070086
Menyetujui,
Pembimbing I
Pembimbing II
Dr. Ir. Ence Darmo Jaya Supena, M.Si
Ir. Hadisunarso, M.Si
NIP 19641002 198903 1 002
NIP 19550219 197903 1 002
Mengetahui,
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
Dr. Ir. Ence Darmo Jaya Supena, M.Si
NIP 19641002 198903 1 002
Dengan Nama Allah Yang Maha Pengasih lagi Maha Penyayang. Segala puji dan syukur penulis ucapkan kehadirat Allah SWT atas rahmat dan hidayah-Nya sehingga dapat menyelesaikan karya ilmiah ini. Shalawat dan salam kepada suri tauladan terbaik Nabi Muhammad SAW dan semoga terlimpahkan pula kepada keluarga dan para sahabatnya serta orang-orang yang mengikuti jejak mereka sampai hari kemudian.
Pertanian Indonesia yang terus berkembang baik dalam hal aspek produksi, teknologi dan ekonomi membutuhkan inovasi-inovasi baru. Tanaman cabai merupakan komoditas pertanian yang penting bagi masyarakat sehingga pengembangan dan penelitian tanaman ini terus dilakukan untuk memperoleh berbagai macam varietas-varietas baru yang baik dan unggul. Karya ilmiah ini berjudul “Induksi Mutasi dengan Etil Metan Sulfonat dalam Kultur Antera Cabai (Capsicum annuum L.) dan Pengaruhnya terhadap Kapasitas Embriogenesis”, dan merupakan sebuah pendekatan teknologi haploid yang dikombinasikan dengan mutagenesis dalam usaha meningkatkan produktivitas dan kualitas tanaman cabai Indonesia.
Terima kasih penulis ucapkan kepada Dr. Ir. Ence Darmo Jaya Supena, M.Si dan Ir. Hadisunarso, M.Si atas segala bimbingan dan fasilitas yang diberikan untuk menunjang penelitian penulis sampai terselesaikannya karya ilmiah ini. Terima kasih juga penulis sampaikan kepada Dr. Ir. Sulistijorini, M.Si sebagai dosen penguji atas masukan untuk perbaikan karya ilmiah ini. Terima kasih penulis sampaikan kepada dosen, staf dan karyawan Departemen Biologi: Dr. Hamim, Ir. Tri Heru W, M.Si, Pak Joni, Pak Ejen, Pak Nasir, Teh Wiwiek, Ibu Eti atas bantuan dan kerjasamanya. Terima kasih penulis sampaikan kepada staf dan rekan-rekan penelitian di PPSHB IPB: Mbak Nia, Mbak Sarah, Pak Asep, Pak Sairi, Pak Mulya, Pak Adi, Ibu Ratna, Pak Pras, Ita, Lia, Ikra N, Asri dan masih banyak rekan lainnya yang tidak dapat penulis sebutkan. Saya senang bisa mengenal dan bekerjasama selama masa-masa penelitian yang tidak terlupakan. Terima kasih penulis sampaikan kepada Syaefudin, S.Si dan Hakiim Bashaar, S.Si atas bimbingan dan ilmu yang telah diberikan yang menunjang penelitian ini. Terima kasih penulis sampaikan kepada saudara-saudaraku 97 orang mahasiswa Biologi angkatan 44 (BIOPAT), dan kakak-kakak serta adik-adik Biologi angkatan 41, 42, 43, 45, 46, dan 47. Terima kasih penulis sampaikan kepada manajemen CV. Greentech EMC, keluarga besar LDK Al Hurriyyah, dan Himabio IPB atas dukungan dan perhatian selama studi Strata 1 IPB. Terakhir, rasa terima kasih dan hormat yang sebesar-besarnya penulis sampaikan kepada keluarga tercinta, Bapak, Ibu, Achmad Muttaqiin, SE., dan adikku Anwar Fauzi atas segala doa, semangat dan kasih sayang yang membuat penulis dapat menyelesaikan karya ilmiah dan studi S1 ini.
Penulis menyadari bahwa karya ilmiah ini masih belum sempurna, namun penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi pengembangan ilmu pengetahuan dan pertanian khususnya di Indonesia.
Bogor, Mei 2012
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 14 Maret 1989 merupakan anak kedua dari tiga bersaudara, dari pasangan Eddy Sukamto dan Sunarmiyatun.
Tahun 2001 penulis lulus dari SD Islamic Village, Tangerang. Tahun 2004 penulis lulus dari SLTP Islamic Village, Tangerang. Tahun 2007 penulis lulus dari SMA Negeri 7, Kota Tangerang dan pada tahun yang sama penulis diterima masuk IPB melalui jalur seleksi USMI pada mayor Biologi, di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam dengan minor Gizi Masyarakat, Fakultas Ekologi Manusia, Institut Pertanian Bogor.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
BAHAN DAN METODE
Bahan Kimia dan Alat ... 1
Bahan Tanaman dan Sumber Antera ... 2
Praperlakuan dan Perlakuan Etil Metan Sulfonat ... 2
Prosedur Kultur Antera Cabai ... 2
Perkecambahan dan Pertumbuhan Tanaman ... 2
Analisis Isozim ... 2
HASIL
Embriogenesis Mikrospora ... 3
Morfologi dan Anatomi Tanaman Hasil Kultur ... 3
Keragaman Isozim ... 4
PEMBAHASAN ... 5
SIMPULAN ... 6
SARAN ... 6
DAFTAR PUSTAKA ... 6
DAFTAR TABEL
Halaman
1 Hasil respon embriogenesis antera cabai (C. annuum) pada metode kultur antera
yang dikombinasikan dengan mutagenesis menggunakan senyawa kimia EMS .... 3
2
Keragaman morfologi dan anatomi tanaman cabai (C. annuum) kontrol dan hasil
kultur antera yang dikombinasikan dengan mutagenesis menggunakan senyawa
kimia EMS ... 4
DAFTAR GAMBAR
Halaman
1
Embrio hasil kultur antera cabai (C. annuum) dalam media dua lapis dan
perkembangan tanaman dari embrio yang dihasilkan ... 4
2
Hasil analisis isozim: A. Peroksidase (PER); B. Aspartat Aminotransferase
(AAT); C. Esterase (EST) ... 5
DAFTAR LAMPIRAN
Halaman
1
Komposisi larutan pewarna isozim PER, AAT, EST ... 8
2
Keragaman pertumbuhan percabangan dan bentuk daun tanaman cabai (C.
annuum) pada hasil kultur antera yang dikombinasikan dengan mutagenesis
PENDAHULUAN
Cabai (Capsicum annuum L.) merupakan salah satu komoditas tanaman sayuran terpenting di Indonesia dinilai dari segi ekonomi dan produksinya. Pada tahun 2010, luas areal pertanaman cabai mencapai 237 105 ha dengan produktivitas rata-rata 5.60 ton/ha (BPS 2011). Produktivitas tersebut masih jauh lebih rendah dari potensi produktivitas cabai yang dapat mencapai 13 ton/ha (Syukur et al. 2010). Rendahnya produktivitas disebabkan oleh rendahnya penggunaan benih yang unggul, budidaya tanaman belum intensif, perubahan iklim, serangan hama/penyakit yang tinggi (Pitojo 2003). Oleh karena itu diperlukan usaha untuk meningkatkan produktivitas tanaman cabai melalui pengembangan kultivar lokal Indonesia.
Pengembangan tanaman cabai kultivar lokal dapat dilakukan melalui pemuliaan tanaman yang memerlukan galur murni dengan tingkat keseragaman genetik yang tinggi. Tanaman galur murni telah mampu dihasilkan baik melalui penyerbukan sendiri secara terkendali yang membutuhkan 7 – 8 generasi maupun melalui teknologi haploid. Teknologi haploid melalui kultur in vitro sudah dikembangkan dengan berbagai teknik seperti kultur antera/mikrospora, kultur ovari/ovul, dan eliminasi kromosom (Kothari et al. 2010). Teknik ini merupakan cara efektif dan cepat dalam menghasilkan tanaman haploid ganda (HG) hanya dalam satu generasi melalui kultur sel gamet (Ferrie et al. 1994). Tanaman HG tersebut merupakan hasil penggandaan kromosom secara spontan maupun hasil induksi menggunakan senyawa kimia kolkisin (Supena et al. 2006b).
Kultur antera pada cabai yang pertama kali berhasil adalah sistem kultur antera pada media padat yang dikembangkan oleh Sibi et al. (1979) dan selanjutnya diperbaiki oleh Dumas de Vaulx et al. (1981). Prosedur yang efisien untuk memproduksi tanaman HG cabai kultivar lokal Indonesia telah dikembangkan melalui kultur antera pada media dua lapis (media cair di atas media padat) (Supena et al. 2006a). Metode ini selanjutnya diperbaiki untuk meningkatkan kualitas embrio yang dihasilkan (Supena & Custer 2011).
Pemuliaan tanaman membutuhkan
keragaman genetik yang tinggi sebagai materi dasar. Keragaman genetik dapat diperoleh melalui induksi mutasi dengan menggunakan mutagen fisik maupun senyawa kimia. Mutagen fisik yang biasa digunakan adalah sinar-x dan sinar gamma, sedangkan mutagen
senyawa kimia diantaranya adalah kolkisin, etil metan sulfonat (EMS), dan etilen oksida. Proses perlakuan mutagenesis pada tanaman dapat dilakukan pada benih, sel somatik, dan sel gamet, secara in vivo atau in vitro (Kothari 2010). Induksi mutasi pada jaringan somatik baru akan menghasilkan mutan yang stabil pada 3 – 5 generasi (Szarejko & Forster 2007). Mutasi yang terjadi pada tanaman dapat dilihat dari perubahan sifat morfologi, anatomi, isozim atau protein, dan urutan basa DNA.
Perlakuan mutasi dengan EMS dapat menyebabkan terjadinya substitusi nukleotida pada DNA. Oleh karenanya, mutasi yang diinduksi EMS berupa mutasi titik, sehingga dapat menghasilkan keragaman hasil mutasi yang luas (Sega 1984).
Kombinasi teknologi haploid dengan mutagenesis perlu dikembangkan untuk mendapatkan keragaman genetik dan perbaikan sifat tanaman secara cepat. Kombinasi mutasi secara fisik menggunakan radiasi sinar-x atau sinar gamma dengan kultur antera telah dilakukan untuk tujuan pemuliaan pada padi (Chen 2001). Mutasi
menggunakan senyawa EMS yang
dikombinasikan dengan kultur antera juga telah dilaporkan untuk tanaman Nicotiana tabacum (Medrano et al. 1986) dan padi (Lee & Lee 2002).
Penelitian ini bertujuan untuk mengetahui pengaruh EMS terhadap kapasitas embriogenesis pada kultur antera cabai dan kemampuannya dalam menginduksi mutasi yang diamati dari keragaman sifat morfologis dan isozim tanaman haploid dan haploid ganda yang dihasilkan.
BAHAN DAN METODE
Bahan Kimia dan Alat
Bahan kimia yang digunakan diantaranya adalah bahan untuk membuat media dua lapis (Supena et al. 2006a), larutan EMS, media kultur MS (Murashige & Skoog 1962), media tanam di lapangan, AgNO3, gel pati, pewarna isozim peroksidase, esterase, dan aspartat aminotransferase. Alat yang digunakan adalah Laminar Air Flow Cabinet, inkubator, cawan petri diameter 6 cm, alat elektroforesis isozim dan peralatan umum laboratorium yang terdapat di PPSHB-IPB.
2
disterilisasi dalam NaOCl 2% selama 10 menit, kemudian dibilas 3 kali dalam akuades. Benih ditanam dalam polibag berisi media tanam berupa tanah, kasting, arang sekam (1:1:1), dengan setiap polybag berisi 2 benih cabai dengan pengaturan jarak antar benih. Perawatan tanaman dilakukan dengan penyiraman setiap pagi dan sore hari, pemberian pupuk NPK, kompos serta penyemprotan pestisida hanya ketika terjadi serangan hama. Setelah 3-4 bulan, kuncup bunga sumber antera dapat dipanen dan digunakan sebagai eksplan pada kultur antera. Penanaman cabai dan pemeliharaannya dilakukan pada lahan terbuka di Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB Darmaga, Bogor.
Praperlakuan dan Perlakuan Etil Metan Sulfonat
Kuncup bunga dengan ciri-ciri panjang mahkotanya sama dengan atau sedikit lebih panjang dari kelopaknya digunakan sebagai sumber eksplan. Sumber eksplan tersebut diberi praperlakuan berupa suhu 5–10oC selama satu hari (Supena et al. 2006a). Setelah praperlakuan, kuncup disterilisasi selama 1 menit dalam alkohol 70% dingin, kemudian dibilas 2 kali dalam akuades steril dingin. Selanjutnya disterilisasi selama 10 menit dalam NaOCl 2% dengan penambahan Tween-20 0.05% (v/v), kemudian dibilas 3 kali dalam akuades steril dingin. Kuncup bunga dibuka dengan menggunakan pinset, kemudian antera dipisahkan dari filamen, putik dan kelopak bunga. Antera yang dijadikan eksplan adalah yang terdapat warna keunguan pada ujung anteranya sebagai penciri mikrospora pada fase inti tunggal akhir (Supena et al. 2006a). Perlakuan antera adalah perendaman dalam EMS pada konsentrasi 0.1% dan 0.5% selama 1, 3, dan 6 jam, serta kontrol tanpa perlakuan.
Prosedur Kultur Antera Cabai
Antera yang telah melalui proses perlakuan maupun kontrol, dikulturkan pada media dua lapis, media cair di atas media padat dengan komposisi media Nisch (Nisch & Nisch 1969) dengan penambahan maltosa 20 g/l. Untuk media padat ditambahkan arang aktif 10 g/l dan agar-agar Gelrite 2 g/l. Antibiotik timentin 50 mg/ml dan rifampisin 5 mg/ml ditambahkan pada media cair saat kultur (Supena et al. 2006a). Kultur diinkubasi pada suhu 5–10oC selama seminggu kemudian dilanjutkan dengan suhu inkubasi 25–28oC selama 7-8 minggu,
inkubasi dilakukan dalam kondisi gelap. Embrio hasil kultur antera diamati jumlah dan kondisinya.
Perkecambahan dan Pertumbuhan Tanaman
Embrio dewasa lengkap dengan kotiledon, hipokotil dan radikula dipindahkan pada media padat MS ½ konsentrasi (Murashige & Skoog 1962), sukrosa 20 g/l dan 6-benzylaminopurin (BAP) 0.1 µM, dipadatkan dengan gelrite 2 g/l. Kultur diinkubasi pada suhu 25–280C dengan penyinaran selama 16 jam dengan intensitas 2000-3000 lux. Bibit yang telah berdaun 4-5 helai dan memiliki perakaran yang baik dipindahkan ke dalam botol plastik bening tertutup berdiameter 8 cm dan tinggi 11 cm dengan campuran tanah, kasting dan arang sekam (1:1:1). Tanaman pada stadium berdaun 5-6 helai diaklimatisasi dan ditanam dalam polybag di rumah kaca. Keragaman sifat morfologis berdasarkan IPGRI (1995), yaitu warna batang, bentuk batang pertumbuhan percabangan, dan bentuk daun diamati untuk mengetahui perubahan yang dihasilkan melalui induksi mutasi dengan EMS.
Pengamatan jumlah kloroplas per stomata dilakukan untuk mengetahui tingkat ploidi tanaman yang dihasilkan (Supena et al. 2006b). Daun kelima dari tunas lateral diambil dan dibuat irisan paradermal menggunakan silet tajam sehingga diperoleh lapisan epidermis yang tipis. Untuk mewarnai kloroplas dalam stomata sehingga mudah dihitung digunakan larutan AgNO3 1% (Qin & Rotino 1995). Preparat kemudian diamati di bawah mikroskop dan difoto.
Analisis Isozim
Sampel daun tanaman sebanyak 1 g, bufer ekstrak 1.0 ml dan pasir kuarsa digerus dalam mortar hingga halus. Ekstrak sampel diserap menggunakan kertas saring, kemudian dimasukkan dalam sumur yang ada pada gel. Cetakan gel berisi ekstrak dimasukkan dalam alat elektroforesis yang sudah ditambahkan bufer elektroda. Elektroforesis sampel dilakukan dalam ruang pendingin dengan tegangan awal 50 volt selama 1 jam, dan selanjutnya dinaikkan pada tegangan 100 volt selama 4–5 jam. Setelah elektroforesis, gel dikeluarkan dari cetakan dan dibelah secara horizontal dengan ketebalan 1.5–3.0 mm, dan selanjutnya diwarnai. Pewarna yang digunakan adalah untuk isozim peroksidase, esterase, dan aspartat aminotransferase. Setelah isozim terwarnai secara optimal, gel dicuci dengan air mengalir, dan selanjutnya diamati pola pita isozim yang terbentuk pada gel dan difoto.
HASIL Embriogenesis Mikrospora
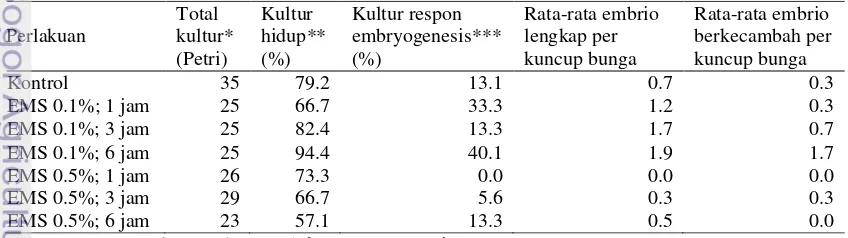
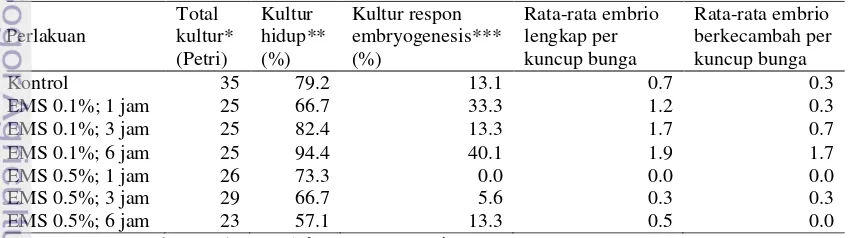
Embriogenesis mikrospora melalui kultur antera yang dikombinasikan dengan induksi mutasi menggunakan EMS berhasil dilakukan pada penelitian ini. Konsentrasi EMS dan lama perendaman antera berpengaruh terhadap respon embriogenesis dan daya kecambah embrio hasil kultur. Respon embriogenesis terbesar dimiliki pada perlakuan perendaman EMS konsentrasi 0.1% selama 6 jam sebesar 40.1%, sedangkan pada perendaman EMS konsentrasi 0.5% selama 1 jam tidak terjadi respon embriogenesis (0%) (Tabel 1).
Rata-rata embrio lengkap per kuncup bunga terbanyak yang dapat dihasilkan juga diperoleh pada perlakuan EMS 0.1% selama 6
jam yaitu 1.9 embrio, sedangkan pada perlakuan EMS 0.5% selama 6 jam tidak dihasilkan embrio (Tabel 1). Embrio yang dapat berkecambah terbanyak juga diperoleh dari perlakuan EMS 0.1% selama 6 jam. Embrio lengkap hasil kultur antera memiliki ciri yaitu terdapat kotiledon, hipokotil dan radikula (Gambar 1a) dan dapat tumbuh dengan baik pada media perkecambahan (Gambar 1b) yang selanjutnya berkembang menjadi tanaman utuh (Gambar 1c). Embrio tidak lengkap memiliki ciri mempunyai radikula dan hipokotil tetapi tidak terdapat kotiledon (Gambar 1d), sehingga tidak mampu tumbuh dan berkembang dengan baik pada media perkecambahan (Gambar 1e).
Morfologi dan Anatomi Tanaman Hasil Kultur
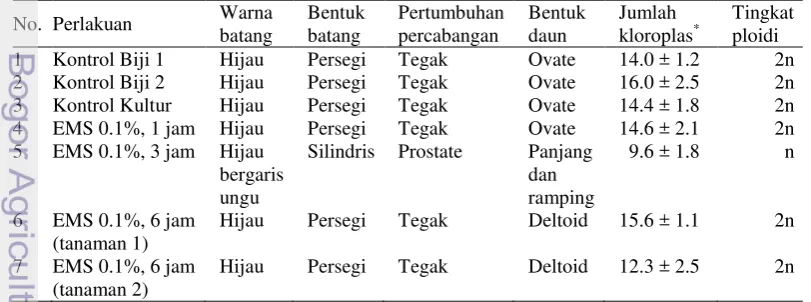
Keragaman sifat morfologi tanaman cabai hasil kultur terlihat dari warna batang, bentuk batang, pertumbuhan percabangan, dan bentuk daun (Tabel 2). Perlakuan EMS 0.1% selama 3 jam menghasilkan keragaman pada warna batang, bentuk batang, pertumbuhan percabangan, dan bentuk daun (Tabel 2). Namun keragaman tersebut ditunjukkan juga oleh perbedaan tingkat ploidi tanaman. Perlakuan EMS 0.1% selama 6 jam menghasilkan keragaman morfologi berupa bentuk daun deltoid (Tabel 2).
Jumlah kloroplas pada stomata tanaman menunjukkan tingkat ploidi yang dimiliki oleh tanaman tersebut. Tanaman pada perlakuan EMS 0.1% selama 3 jam memiliki rata-rata jumlah kloroplas sebesar 9.6 termasuk jenis tanaman haploid. Sedangkan pada tanaman lainnya termasuk jenis tanaman haploid ganda atau diploid (Tabel 2).
Tabel 1 Hasil respon embriogenesis antera cabai (C. annuum) pada metode kultur antera yang dikombinasikan dengan mutagenesis menggunakan senyawa kimia EMS
Keterangan: *= 1 kuncup bunga (5-6 antera) per Petri; **= dari jumlah Petri tidak terkontaminasi; ***= dari kultur hidup.
Perlakuan Total kultur* (Petri) Kultur hidup** (%) Kultur respon embryogenesis*** (%) Rata-rata embrio lengkap per kuncup bunga Rata-rata embrio berkecambah per kuncup bunga
Kontrol 35 79.2 13.1 0.7 0.3
EMS 0.1%; 1 jam 25 66.7 33.3 1.2 0.3
EMS 0.1%; 3 jam 25 82.4 13.3 1.7 0.7
EMS 0.1%; 6 jam 25 94.4 40.1 1.9 1.7
EMS 0.5%; 1 jam 26 73.3 0.0 0.0 0.0
EMS 0.5%; 3 jam 29 66.7 5.6 0.3 0.3
4
Gambar 1 Embrio hasil kultur antera cabai (C. annuum) dalam media dua lapis dan perkembangan tanaman dari embrio yang dihasilkan : a–b. embrio lengkap dan embrio tumbuh dan normal berkecambah; c. tanaman HG Tombak hasil kultur antera dalam media dua lapis; d–e. embrio tidak lengkap dan embrio yang tidak dapat tumbuh dan berkecambah. Garis skala: a dan d = 2 mm, b dan e = 1 cm, c = 5 cm.
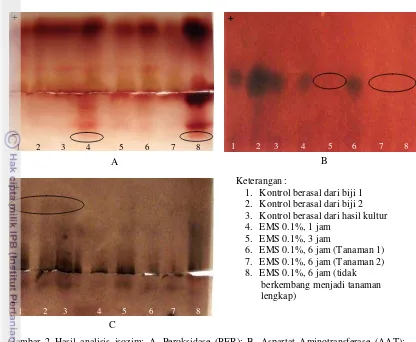
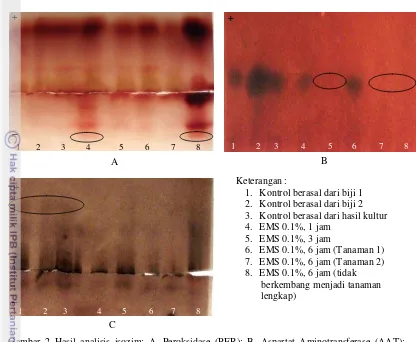
Keragaman Isozim
Hasil visualisasi pola pita isozim peroksidase terlihat adanya perbedaan di bagian negatif pada sumur ke 4 dan 8 (gambar 2A), yang masing-masing adalah perlakuan EMS 0.1% selama 1 jam dan EMS 0.1% selama 6 jam (tidak berkembang menjadi tanaman lengkap). Kedua tanaman mengalami ekspresi berlebih enzim peroksidase di bagian negatif.
Pada Isozim aspartat aminotransferase (AAT), tidak terdapat adanya pita yang terbentuk di sumur 5, 7 dan 8 (Gambar 2B), yang masing-masing adalah perlakuan EMS 0.1% selama 3 jam, EMS 0.1% selama 6 jam pada tanaman 2 dan yang tidak berkembang menjadi tanaman lengkap. Pada Isozim esterase memperlihatkan adanya 3 pita pada setiap kontrol, sedangkan pada seluruh perlakuan hanya terdapat 2 pita yang terbentuk (gambar 2C).
Tabel 2 Keragaman morfologi dan anatomi tanaman cabai (C. annuum) kontrol dan hasil kultur antera yang dikombinasikan dengan mutagenesis menggunakan senyawa kimia EMS
No. Perlakuan Warna
batang
Bentuk batang
Pertumbuhan percabangan
Bentuk daun
Jumlah kloroplas*
Tingkat ploidi
1 Kontrol Biji 1 Hijau Persegi Tegak Ovate 14.0 ± 1.2 2n
2 Kontrol Biji 2 Hijau Persegi Tegak Ovate 16.0 ± 2.5 2n
3 Kontrol Kultur Hijau Persegi Tegak Ovate 14.4 ± 1.8 2n
4 EMS 0.1%, 1 jam Hijau Persegi Tegak Ovate 14.6 ± 2.1 2n
5 EMS 0.1%, 3 jam Hijau bergaris ungu
Silindris Prostate Panjang dan ramping
9.6 ± 1.8 n
6 EMS 0.1%, 6 jam (tanaman 1)
Hijau Persegi Tegak Deltoid 15.6 ± 1.1 2n
7 EMS 0.1%, 6 jam (tanaman 2)
Hijau Persegi Tegak Deltoid 12.3 ± 2.5 2n
Keterangan:
*
Jumlah kloroplas per sel penjaga berdasarkan analisis terhadap 30 stomata dari tiga daun.a
d
b
[image:12.595.107.513.555.706.2]Keterangan :
1. Kontrol berasal dari biji 1 2. Kontrol berasal dari biji 2 3. Kontrol berasal dari hasil kultur 4. EMS 0.1%, 1 jam
5. EMS 0.1%, 3 jam
6. EMS 0.1%, 6 jam (Tanaman 1) 7. EMS 0.1%, 6 jam (Tanaman 2) 8. EMS 0.1%, 6 jam (tidak berkembang menjadi tanaman lengkap)
Gambar 2 Hasil analisis isozim: A. Peroksidase (PER); B. Aspartat Aminotransferase (AAT); C. Esterase (EST).
PEMBAHASAN
Metode kultur antera cabai haploid ganda Tombak pada media dua lapis telah berhasil dikombinasikan dengan teknik induksi mutasi menggunakan etil metan sulfonat (EMS) pada penelitian ini. Induksi mutasi menggunakan EMS pada konsentrasi 0.1% dan 0.5% dengan lama waktu perendaman 1, 3, dan 6 jam berpengaruh terhadap embrio lengkap yang dihasilkan dan embrio yang mampu berkecambah per kuncup bunga, serta keragaman morfologi dan isozim yang dihasilkan.
Perlakuan EMS konsentrasi 0.1% meningkatkan respon embriogenesis, rata-rata embrio lengkap dan embrio berkecambah yang dihasilkan, sebaliknya perlakuan EMS 0.5% menurunkan respon embriogenesis, rata-rata embrio lengkap, dan embrio berkecambah yang dihasilkan. Mikrospora sebagai target dalam kultur antera memiliki sensitifitas terhadap perlakuan mutagen (Szarejko dan Forster 2007). Konsentrasi dan lama perendaman tertentu dalam EMS dapat berpengaruh pada peningkatan dan penurunan
respon embriogenesis mikrospora. Hal ini sejalan dengan hasil penelitian Medrano (1986), yaitu semakin tinggi konsentrasi EMS yang digunakan dapat menurunkan jumlah tanaman haploid hasil kultur antera tembakau. Pengaruh EMS terhadap kultur antera cabai pada penelitian ini berhasil menginduksi terjadinya mutasi yang ditandai adanya keragaman morfologi pada tanaman yang dihasilkan. Masing-masing tanaman hasil kultur dengan perlakuan EMS memberikan keragaman morfologi yang berbeda-beda. Keragaman sifat morfologi terlihat pada bentuk daun hasil perlakuan EMS 0.1% selama 3 dan 6 jam. Hal ini sejalan dengan penelitian Jabeen & Mirza (2004) yang menyatakan bahwa EMS dapat menginduksi keragaman morfologi pada cabai.
Untuk variasi sifat bentuk daun yang panjang dan ramping hasil perlakuan EMS 0.1% selama 3 jam, dapat dimungkinkan akibat perbedaan tingkat ploidi tanaman yang dihasilkan. Menurut Supena et al. (2006b) bahwa pada tanaman cabai haploid kultivar Galaxy memiliki ciri sifat morfologi berupa ukuran tanaman lebih rendah dengan bentuk C
+
_
+
+
_
1 2 3 4 5 6 7 8
C
A B
1 2 3 4 5 6 7 8
6
daun lebih ramping dan kecil dibandingkan dengan tanaman HG maupun diploid.
Keragaman pola pita pada isozim PER, AAT, dan EST yang terlihat dari bertambah dan berkurangnya pita yang terbentuk, menunjukkan telah terjadi mutasi akibat perlakuan EMS. Pita isozim yang tidak terbentuk karena terjadi inaktivasi terhadap enzim akibat perubahan asam amino yang terbentuk pada tanaman. Keragaman pola pita isozim dapat menunjukkan perubahan pada tingkat protein yang secara tidak langsung menggambarkan telah terjadi perubahan DNA akibat mutasi oleh EMS (Medrano et al. 1986)
Perbedaan pola pita isozim EST pada tanaman kontrol dan hasil perlakuan EMS dapat dijadikan penanda pada tanaman cabai yang mengalami mutasi. Penggunaan isozim untuk mengetahui terjadi mutasi pada tingkat gen didasarkan bahwa pengujian terhadap isozim dapat menunjukkan perbedaan hingga tingkat varietas pada berbagai tanaman, antara lain kedelai (Cahyarini et al. 2004), jarak pagar (Yunus 2007), kelapa (Runtunuwu & Lengkong 2005), dan nenas (Hadiati & Sukmadjaja 2002).
Variasi tingkat ploidi dapat terjadi pada embrio dan tanaman hasil kultur antera dalam sistem media dua lapis. Tanaman dari embrio yang dihasilkan memiliki tingkat ploidi haploid dan haploid ganda. Untuk menentukan tingkat ploidi tanaman dilakukan penghitungan jumlah kloroplas per sel penjaga pada stomata daun. Hal ini sejalan dengan penelitian Supena et al. (2006a), bahwa rata-rata jumlah kloroplas per stomata pada cabai varietas Tombak untuk tanaman haploid (n) dan haploid ganda (2n) masing-masing adalah 8.9 dan 15.8.
Metode kultur antera cabai yang berhasil dikombinasikan dengan mutagenesis ini telah dapat menghasilkan tanaman haploid ganda dengan sifat tertentu yang berbeda hanya dalam satu generasi. Oleh karena itu, kombinasi teknik ini berpotensi untuk digunakan dalam perbaikan genetik dan sifat morfologi maupun sifat agronomis tertentu tanaman cabai kultivar lokal Indonesia secara cepat.
SIMPULAN
Perlakuan perendaman antera sebelum kultur dengan etil metan sulfonat (EMS) mempengaruhi respon embriogenesis dan produksi embrio lengkap pada kultur antera cabai menggunakan sistem media dua lapis. Perendaman EMS 0.1% dapat meningkatkan
kapasitas embriogenesis, sedangkan EMS 0.5% menurunkan kapasitas embriogenesis. Perlakuan EMS 0.1% selama 6 jam tidak hanya dapat menginduksi mutasi, tetapi juga meningkatkan respon embriogenesis, rata-rata embrio lengkap, dan rata-rata embrio berkecambah. Mutasi yang terjadi dapat dideteksi pada tanaman yang berasal dari kultur antera pada sifat morfologi daun dan batang, serta isozim PER, AAT, dan EST.
SARAN
Pengamatan terhadap tanaman mutan generasi ke-2 hasil kombinasi kultur antera dan EMS perlu dilakukan untuk melihat kestabilan hasil mutasi. Pengujian EMS dengan taraf konsentrasi yang lebih banyak antara 0.01 – 0.1% dengan waktu perendaman 1 – 6 jam perlu dilakukan untuk mengetahui perlakuan optimal yang dapat menginduksi mutasi tetapi juga berpengaruh positif terhadap kapasitas embriogenesis kultur antera cabai.
DAFTAR PUSTAKA
[BPS] Badan Pusat Statistik. 2011. Produksi Cabai Indonesia. Jakarta: BPS.
Cahyarini RD, Yunus A, Purwanto E. 2004. Identifikasi keragaman genetik beberapa varietas lokal kedelai di Jawa berdasarkan analisis isozim. Agrosains 6: 79-83. Chen QF, Wang CL, Lu YM, Shen M, Afza
R, Duren MV, Brunner H. 2001. Anther culture in connection with induced mutations for rice improvement. Euphytica 120: 401-408.
Dumas de Vaulx R, Chambonnet D, Pochard E. 1981. Culture in vitro d‟anthères du piment (Capsicum annuum L.): amélioration des taux d‟obtention de plantes chez différent genotypes par des traitements à +35oC. [Abstract in English]. Agronomie 1: 859–864.
Ferrie AM, Palmer CE, Keller WA. 1994. Biotechnological application of haploids. Di dalam: Shargool PD & Ngo TT, editors. Biotechnological Applications of Plant Cultures. Baca Raton: CRC Press. Hadiati S, Sukmadjaja D. 2002. Keragaman
pola pita beberapa aksesi nenas berdasarkan analisis isozim. J Bioteknol Pertan 7: 62-70.
Jabeen N, Mirza B. 2004. Ethyl methane sulfonate induces morphological mutations in Capsicum annuum. Int J Agri Biol 6:340-345.
Kothari SL, Joshi A, Kachhwaha S, Ochoa-alejo N. 2010. Chilli peppers – A review on tissue culture and transgenesis. Biotechnol Adv 28: 35-48.
Lee JH, Lee SY. 2002. Selection of stable mutants from cultured rice anthers treated with ethyl methane sulfonic acid. Plant Cell Tiss Org Cult 71: 165-171.
Medrano H, Millo EP, Guerri J. 1986. Ethyl methane sulphonate effect on anther cultures of Nicotiana tabacum. Euphytica 35: 161-168.
Murashige T, Skoog F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiol Plant 15:473-497.
Nisch JP, Nisch C. 1969. Haploid plants from pollen grains. Science 163: 85-87.
Pitojo S. 2003. Benih Cabai. Yogyakarta: Kanisius.
Qin X, Rotino GL. 1995. Anther culture of several sweet and hot pepper genotypes. Capsicum Eggplant Nwsl 12: 59-62. Runtunuwu SD, Lengkong EF. 2005.
Identifikasi penanda isozim (7, PER-8, dan RAPD OB17375) pada kelapa genjah salak (GSK) dan beberapa hasil silangannya dengan kelapa dalam. Eugenia 11: 8-17.
Sega GA. 1984. A review of the genetic effects of ethyl methanesulfonate. Mutat Researc 134: 113-142.
Sibi M, Dumas de Vaulx R, Chambonnet D. 1979. Obtention de plantes haplöides par androgenèse in vitro chez le piment (Capsicum annuum L.). [Abstract in English]. Ann Amélior Plantes 29: 583-606.
Supena EDJ, Suharsono S, Jacobsen E, Custers JBM. 2006a. Succesful development of a shed-microspore culture protocol for doubled haploid production in Indonesian hot pepper (Capsicum annuum L.). Plant Cell Rep 25: 1-10.
Supena EDJ, Muswita W, Suharsono S, Custers JBM. 2006b. Evaluation of crutial factors for implementing shed-microspore culture of Indonesian hot pepper (Capsicum annuum L.) cultivars. Sci Hortic 107: 226-232.
Supena EDJ, Custers JBM. 2011. Refinement of shed-microspore culture protocol to increase normal embryos production in hot pepper (Capsicum annuum L.). Sci Hortic 130: 769-774.
Syukur M, Sujiprihati S, Yunianti R, Kusumah DA. 2010. Evaluasi daya hasil cabai hibrida dan daya adaptasinya di empat lokasi dalam dua tahun. J Agron Indo 38: 43-51.
Szarejko I, Forster BP. 2007. Doubled haploidy and induced mutation. Euphytica 158: 359-370.
Wendel JF, Weeden NF. 1989. Visualization and intrepretation of plant isozymes. Di dalam: Soltis DE, Soltis PS (editor) Isozymes in Plant Biology, Ed ke-4, Oregon: Dioscorides Press. hlm: 5-45. Yunus A. 2007. Identifikasi keragaman
Lampiran 1 Komposisi larutan pewarna isozim PER, AAT, EST (Wendel &
Weeden 1989).
1.
Pewarna Peroksidase (PER)
Natrium asetat pH 5.0
100 ml
CaCl2
60 mg
3-amino-9 etilkarbasol
60 mg
Aseton/N,N-Dimethylformamid
5 ml
H2O2 3%
0.5 ml
2.
Pewarna Aspartat Aminotransferase (AAT)
Bufer substrat AAT pH 7.4
50 ml
H
2O
800 ml
α
-Asam ketoglutarat
292 mg
L-Asam aspartat
1.07 g
PVP-40
4.00 g
EDTA, Na2 salt
400 mg
Sodium fosfat
11.36 g
Fast blue BB salt
50 mg
3.
Pewarna Esterase (EST)
Sodium fosfat pH 7.0
100 ml
1-Naftil asetat
50 mg
2-Naftil asetat
50 mg
Aseton
5 ml
9
Lampiran 2 Keragaman pertumbuhan percabangan (a dan b) dan bentuk daun (c,
d, dan e) tanaman cabai (
C. annuum
) pada hasil kultur antera yang
dikombinasikan dengan mutagenesis menggunakan senyawa kimia EMS
Keterangan: a = Pertumbuhan percabangan tegak
b = Pertumbuhan percabangan prostate
c = Bentuk daun panjang dan ramping
d = Bentuk daun ovate
e = Bentuk daun deltoid
a
b
Cabai (Capsicum annuum L.) dan Pengaruhnya terhadap Kapasitas Embriogenesis. Dibimbing oleh ENCE DARMO JAYA SUPENA dan HADISUNARSO.
Metode kultur antera yang efisien pada sistem media dua lapis telah dikembangkan untuk memproduksi tanaman haploid ganda (HG) cabai kultivar lokal Indonesia (Capsicum annuum L.). Untuk percepatan dalam menghasilkan variasi genetik dan perbaikan sifat dari cabai, metode kultur antera ini dikombinasikan dengan teknik mutagenesis dalam penelitian ini. Induksi mutasi dilakukan melalui perendaman antera sebagai sumber eksplan pada larutan etil metan sulfonat (EMS) konsentrasi 0.1% dan 0.5% selama 1, 3, dan 6 jam sebelum kultur. Perlakuan EMS 0.1% selama 6 jam tidak hanya dapat menginduksi mutasi, tetapi juga meningkatkan respon embriogenesis, rata-rata embrio lengkap, dan rata-rata embrio berkecambah. Mutasi yang terjadi dapat dideteksi pada tanaman yang berasal dari kultur antera pada sifat morfologi daun dan batang, serta isozim peroksidase, aspartat aminotransferase, dan esterase. Metode kultur antera yang dikombinasikan dengan teknik mutagenesis ini dapat digunakan untuk mempercepat proses pemuliaan tanaman cabai kultivar lokal Indonesia.
Kata kunci: Capsicum, Kultur antera, Haploid ganda, EMS, Mutasi.
ABSTRACT
MUHAMMAD RIDHWAN. Ethyl Methane Sulphonate Treatment Mutation Induction on Anther Cultures of Hot Pepper (Capsicum annuum L.) and Its Effect on Embryogenesis Capacity. Under supervision of ENCE DARMO JAYA SUPENA and HADISUNARSO.
An efficient anther culture method on double layers medium system has been developed for producing doubled haploid (DH) of Indonesian hot pepper (Capsicum annuum L.). In order to speed up both genetic variability and improvement of hot pepper, this anther culture method was combined with mutagenesis technique in this research. Induction of mutation was evaluated by soaking of anthers as source of explans in 0.1% and 0.5% ethyl methane sulphonate (EMS) solution during 1, 3, and 6 hours prior to culture. Anther treatment on 0.1% EMS during 6 hours was not only induce mutation, but also increase embryogenesis response, complete embryo produce, and embryo germination. The mutation could be detected on plant derived from anther culture both in morphologycal characters of leaf and stem, and isozyme of peroxidase, aspartate aminotransferase, and esterase. A combination of anther cultures method and mutagenesis technique could be used for speeding up the breeding process of Indonesian local cultivar hot pepper.
1
PENDAHULUAN
Cabai (Capsicum annuum L.) merupakan salah satu komoditas tanaman sayuran terpenting di Indonesia dinilai dari segi ekonomi dan produksinya. Pada tahun 2010, luas areal pertanaman cabai mencapai 237 105 ha dengan produktivitas rata-rata 5.60 ton/ha (BPS 2011). Produktivitas tersebut masih jauh lebih rendah dari potensi produktivitas cabai yang dapat mencapai 13 ton/ha (Syukur et al. 2010). Rendahnya produktivitas disebabkan oleh rendahnya penggunaan benih yang unggul, budidaya tanaman belum intensif, perubahan iklim, serangan hama/penyakit yang tinggi (Pitojo 2003). Oleh karena itu diperlukan usaha untuk meningkatkan produktivitas tanaman cabai melalui pengembangan kultivar lokal Indonesia.
Pengembangan tanaman cabai kultivar lokal dapat dilakukan melalui pemuliaan tanaman yang memerlukan galur murni dengan tingkat keseragaman genetik yang tinggi. Tanaman galur murni telah mampu dihasilkan baik melalui penyerbukan sendiri secara terkendali yang membutuhkan 7 – 8 generasi maupun melalui teknologi haploid. Teknologi haploid melalui kultur in vitro sudah dikembangkan dengan berbagai teknik seperti kultur antera/mikrospora, kultur ovari/ovul, dan eliminasi kromosom (Kothari et al. 2010). Teknik ini merupakan cara efektif dan cepat dalam menghasilkan tanaman haploid ganda (HG) hanya dalam satu generasi melalui kultur sel gamet (Ferrie et al. 1994). Tanaman HG tersebut merupakan hasil penggandaan kromosom secara spontan maupun hasil induksi menggunakan senyawa kimia kolkisin (Supena et al. 2006b).
Kultur antera pada cabai yang pertama kali berhasil adalah sistem kultur antera pada media padat yang dikembangkan oleh Sibi et al. (1979) dan selanjutnya diperbaiki oleh Dumas de Vaulx et al. (1981). Prosedur yang efisien untuk memproduksi tanaman HG cabai kultivar lokal Indonesia telah dikembangkan melalui kultur antera pada media dua lapis (media cair di atas media padat) (Supena et al. 2006a). Metode ini selanjutnya diperbaiki untuk meningkatkan kualitas embrio yang dihasilkan (Supena & Custer 2011).
Pemuliaan tanaman membutuhkan
keragaman genetik yang tinggi sebagai materi dasar. Keragaman genetik dapat diperoleh melalui induksi mutasi dengan menggunakan mutagen fisik maupun senyawa kimia. Mutagen fisik yang biasa digunakan adalah sinar-x dan sinar gamma, sedangkan mutagen
senyawa kimia diantaranya adalah kolkisin, etil metan sulfonat (EMS), dan etilen oksida. Proses perlakuan mutagenesis pada tanaman dapat dilakukan pada benih, sel somatik, dan sel gamet, secara in vivo atau in vitro (Kothari 2010). Induksi mutasi pada jaringan somatik baru akan menghasilkan mutan yang stabil pada 3 – 5 generasi (Szarejko & Forster 2007). Mutasi yang terjadi pada tanaman dapat dilihat dari perubahan sifat morfologi, anatomi, isozim atau protein, dan urutan basa DNA.
Perlakuan mutasi dengan EMS dapat menyebabkan terjadinya substitusi nukleotida pada DNA. Oleh karenanya, mutasi yang diinduksi EMS berupa mutasi titik, sehingga dapat menghasilkan keragaman hasil mutasi yang luas (Sega 1984).
Kombinasi teknologi haploid dengan mutagenesis perlu dikembangkan untuk mendapatkan keragaman genetik dan perbaikan sifat tanaman secara cepat. Kombinasi mutasi secara fisik menggunakan radiasi sinar-x atau sinar gamma dengan kultur antera telah dilakukan untuk tujuan pemuliaan pada padi (Chen 2001). Mutasi
menggunakan senyawa EMS yang
dikombinasikan dengan kultur antera juga telah dilaporkan untuk tanaman Nicotiana tabacum (Medrano et al. 1986) dan padi (Lee & Lee 2002).
Penelitian ini bertujuan untuk mengetahui pengaruh EMS terhadap kapasitas embriogenesis pada kultur antera cabai dan kemampuannya dalam menginduksi mutasi yang diamati dari keragaman sifat morfologis dan isozim tanaman haploid dan haploid ganda yang dihasilkan.
BAHAN DAN METODE
Bahan Kimia dan Alat
Bahan kimia yang digunakan diantaranya adalah bahan untuk membuat media dua lapis (Supena et al. 2006a), larutan EMS, media kultur MS (Murashige & Skoog 1962), media tanam di lapangan, AgNO3, gel pati, pewarna isozim peroksidase, esterase, dan aspartat aminotransferase. Alat yang digunakan adalah Laminar Air Flow Cabinet, inkubator, cawan petri diameter 6 cm, alat elektroforesis isozim dan peralatan umum laboratorium yang terdapat di PPSHB-IPB.
disterilisasi dalam NaOCl 2% selama 10 menit, kemudian dibilas 3 kali dalam akuades. Benih ditanam dalam polibag berisi media tanam berupa tanah, kasting, arang sekam (1:1:1), dengan setiap polybag berisi 2 benih cabai dengan pengaturan jarak antar benih. Perawatan tanaman dilakukan dengan penyiraman setiap pagi dan sore hari, pemberian pupuk NPK, kompos serta penyemprotan pestisida hanya ketika terjadi serangan hama. Setelah 3-4 bulan, kuncup bunga sumber antera dapat dipanen dan digunakan sebagai eksplan pada kultur antera. Penanaman cabai dan pemeliharaannya dilakukan pada lahan terbuka di Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB Darmaga, Bogor.
Praperlakuan dan Perlakuan Etil Metan Sulfonat
Kuncup bunga dengan ciri-ciri panjang mahkotanya sama dengan atau sedikit lebih panjang dari kelopaknya digunakan sebagai sumber eksplan. Sumber eksplan tersebut diberi praperlakuan berupa suhu 5–10oC selama satu hari (Supena et al. 2006a). Setelah praperlakuan, kuncup disterilisasi selama 1 menit dalam alkohol 70% dingin, kemudian dibilas 2 kali dalam akuades steril dingin. Selanjutnya disterilisasi selama 10 menit dalam NaOCl 2% dengan penambahan Tween-20 0.05% (v/v), kemudian dibilas 3 kali dalam akuades steril dingin. Kuncup bunga dibuka dengan menggunakan pinset, kemudian antera dipisahkan dari filamen, putik dan kelopak bunga. Antera yang dijadikan eksplan adalah yang terdapat warna keunguan pada ujung anteranya sebagai penciri mikrospora pada fase inti tunggal akhir (Supena et al. 2006a). Perlakuan antera adalah perendaman dalam EMS pada konsentrasi 0.1% dan 0.5% selama 1, 3, dan 6 jam, serta kontrol tanpa perlakuan.
Prosedur Kultur Antera Cabai
Antera yang telah melalui proses perlakuan maupun kontrol, dikulturkan pada media dua lapis, media cair di atas media padat dengan komposisi media Nisch (Nisch & Nisch 1969) dengan penambahan maltosa 20 g/l. Untuk media padat ditambahkan arang aktif 10 g/l dan agar-agar Gelrite 2 g/l. Antibiotik timentin 50 mg/ml dan rifampisin 5 mg/ml ditambahkan pada media cair saat kultur (Supena et al. 2006a). Kultur diinkubasi pada suhu 5–10oC selama seminggu kemudian dilanjutkan dengan suhu inkubasi 25–28oC selama 7-8 minggu,
inkubasi dilakukan dalam kondisi gelap. Embrio hasil kultur antera diamati jumlah dan kondisinya.
Perkecambahan dan Pertumbuhan Tanaman
Embrio dewasa lengkap dengan kotiledon, hipokotil dan radikula dipindahkan pada media padat MS ½ konsentrasi (Murashige & Skoog 1962), sukrosa 20 g/l dan 6-benzylaminopurin (BAP) 0.1 µM, dipadatkan dengan gelrite 2 g/l. Kultur diinkubasi pada suhu 25–280C dengan penyinaran selama 16 jam dengan intensitas 2000-3000 lux. Bibit yang telah berdaun 4-5 helai dan memiliki perakaran yang baik dipindahkan ke dalam botol plastik bening tertutup berdiameter 8 cm dan tinggi 11 cm dengan campuran tanah, kasting dan arang sekam (1:1:1). Tanaman pada stadium berdaun 5-6 helai diaklimatisasi dan ditanam dalam polybag di rumah kaca. Keragaman sifat morfologis berdasarkan IPGRI (1995), yaitu warna batang, bentuk batang pertumbuhan percabangan, dan bentuk daun diamati untuk mengetahui perubahan yang dihasilkan melalui induksi mutasi dengan EMS.
Pengamatan jumlah kloroplas per stomata dilakukan untuk mengetahui tingkat ploidi tanaman yang dihasilkan (Supena et al. 2006b). Daun kelima dari tunas lateral diambil dan dibuat irisan paradermal menggunakan silet tajam sehingga diperoleh lapisan epidermis yang tipis. Untuk mewarnai kloroplas dalam stomata sehingga mudah dihitung digunakan larutan AgNO3 1% (Qin & Rotino 1995). Preparat kemudian diamati di bawah mikroskop dan difoto.
Analisis Isozim
3
Sampel daun tanaman sebanyak 1 g, bufer ekstrak 1.0 ml dan pasir kuarsa digerus dalam mortar hingga halus. Ekstrak sampel diserap menggunakan kertas saring, kemudian dimasukkan dalam sumur yang ada pada gel. Cetakan gel berisi ekstrak dimasukkan dalam alat elektroforesis yang sudah ditambahkan bufer elektroda. Elektroforesis sampel dilakukan dalam ruang pendingin dengan tegangan awal 50 volt selama 1 jam, dan selanjutnya dinaikkan pada tegangan 100 volt selama 4–5 jam. Setelah elektroforesis, gel dikeluarkan dari cetakan dan dibelah secara horizontal dengan ketebalan 1.5–3.0 mm, dan selanjutnya diwarnai. Pewarna yang digunakan adalah untuk isozim peroksidase, esterase, dan aspartat aminotransferase. Setelah isozim terwarnai secara optimal, gel dicuci dengan air mengalir, dan selanjutnya diamati pola pita isozim yang terbentuk pada gel dan difoto.
HASIL Embriogenesis Mikrospora
Embriogenesis mikrospora melalui kultur antera yang dikombinasikan dengan induksi mutasi menggunakan EMS berhasil dilakukan pada penelitian ini. Konsentrasi EMS dan lama perendaman antera berpengaruh terhadap respon embriogenesis dan daya kecambah embrio hasil kultur. Respon embriogenesis terbesar dimiliki pada perlakuan perendaman EMS konsentrasi 0.1% selama 6 jam sebesar 40.1%, sedangkan pada perendaman EMS konsentrasi 0.5% selama 1 jam tidak terjadi respon embriogenesis (0%) (Tabel 1).
Rata-rata embrio lengkap per kuncup bunga terbanyak yang dapat dihasilkan juga diperoleh pada perlakuan EMS 0.1% selama 6
jam yaitu 1.9 embrio, sedangkan pada perlakuan EMS 0.5% selama 6 jam tidak dihasilkan embrio (Tabel 1). Embrio yang dapat berkecambah terbanyak juga diperoleh dari perlakuan EMS 0.1% selama 6 jam. Embrio lengkap hasil kultur antera memiliki ciri yaitu terdapat kotiledon, hipokotil dan radikula (Gambar 1a) dan dapat tumbuh dengan baik pada media perkecambahan (Gambar 1b) yang selanjutnya berkembang menjadi tanaman utuh (Gambar 1c). Embrio tidak lengkap memiliki ciri mempunyai radikula dan hipokotil tetapi tidak terdapat kotiledon (Gambar 1d), sehingga tidak mampu tumbuh dan berkembang dengan baik pada media perkecambahan (Gambar 1e).
Morfologi dan Anatomi Tanaman Hasil Kultur
Keragaman sifat morfologi tanaman cabai hasil kultur terlihat dari warna batang, bentuk batang, pertumbuhan percabangan, dan bentuk daun (Tabel 2). Perlakuan EMS 0.1% selama 3 jam menghasilkan keragaman pada warna batang, bentuk batang, pertumbuhan percabangan, dan bentuk daun (Tabel 2). Namun keragaman tersebut ditunjukkan juga oleh perbedaan tingkat ploidi tanaman. Perlakuan EMS 0.1% selama 6 jam menghasilkan keragaman morfologi berupa bentuk daun deltoid (Tabel 2).
Jumlah kloroplas pada stomata tanaman menunjukkan tingkat ploidi yang dimiliki oleh tanaman tersebut. Tanaman pada perlakuan EMS 0.1% selama 3 jam memiliki rata-rata jumlah kloroplas sebesar 9.6 termasuk jenis tanaman haploid. Sedangkan pada tanaman lainnya termasuk jenis tanaman haploid ganda atau diploid (Tabel 2).
Tabel 1 Hasil respon embriogenesis antera cabai (C. annuum) pada metode kultur antera yang dikombinasikan dengan mutagenesis menggunakan senyawa kimia EMS
Keterangan: *= 1 kuncup bunga (5-6 antera) per Petri; **= dari jumlah Petri tidak terkontaminasi; ***= dari kultur hidup.
Perlakuan Total kultur* (Petri) Kultur hidup** (%) Kultur respon embryogenesis*** (%) Rata-rata embrio lengkap per kuncup bunga Rata-rata embrio berkecambah per kuncup bunga
Kontrol 35 79.2 13.1 0.7 0.3
EMS 0.1%; 1 jam 25 66.7 33.3 1.2 0.3
EMS 0.1%; 3 jam 25 82.4 13.3 1.7 0.7
EMS 0.1%; 6 jam 25 94.4 40.1 1.9 1.7
EMS 0.5%; 1 jam 26 73.3 0.0 0.0 0.0
EMS 0.5%; 3 jam 29 66.7 5.6 0.3 0.3
Gambar 1 Embrio hasil kultur antera cabai (C. annuum) dalam media dua lapis dan perkembangan tanaman dari embrio yang dihasilkan : a–b. embrio lengkap dan embrio tumbuh dan normal berkecambah; c. tanaman HG Tombak hasil kultur antera dalam media dua lapis; d–e. embrio tidak lengkap dan embrio yang tidak dapat tumbuh dan berkecambah. Garis skala: a dan d = 2 mm, b dan e = 1 cm, c = 5 cm.
Keragaman Isozim
Hasil visualisasi pola pita isozim peroksidase terlihat adanya perbedaan di bagian negatif pada sumur ke 4 dan 8 (gambar 2A), yang masing-masing adalah perlakuan EMS 0.1% selama 1 jam dan EMS 0.1% selama 6 jam (tidak berkembang menjadi tanaman lengkap). Kedua tanaman mengalami ekspresi berlebih enzim peroksidase di bagian negatif.
Pada Isozim aspartat aminotransferase (AAT), tidak terdapat adanya pita yang terbentuk di sumur 5, 7 dan 8 (Gambar 2B), yang masing-masing adalah perlakuan EMS 0.1% selama 3 jam, EMS 0.1% selama 6 jam pada tanaman 2 dan yang tidak berkembang menjadi tanaman lengkap. Pada Isozim esterase memperlihatkan adanya 3 pita pada setiap kontrol, sedangkan pada seluruh perlakuan hanya terdapat 2 pita yang terbentuk (gambar 2C).
Tabel 2 Keragaman morfologi dan anatomi tanaman cabai (C. annuum) kontrol dan hasil kultur antera yang dikombinasikan dengan mutagenesis menggunakan senyawa kimia EMS
No. Perlakuan Warna
batang
Bentuk batang
Pertumbuhan percabangan
Bentuk daun
Jumlah kloroplas*
Tingkat ploidi
1 Kontrol Biji 1 Hijau Persegi Tegak Ovate 14.0 ± 1.2 2n
2 Kontrol Biji 2 Hijau Persegi Tegak Ovate 16.0 ± 2.5 2n
3 Kontrol Kultur Hijau Persegi Tegak Ovate 14.4 ± 1.8 2n
4 EMS 0.1%, 1 jam Hijau Persegi Tegak Ovate 14.6 ± 2.1 2n
5 EMS 0.1%, 3 jam Hijau bergaris ungu
Silindris Prostate Panjang dan ramping
9.6 ± 1.8 n
6 EMS 0.1%, 6 jam (tanaman 1)
Hijau Persegi Tegak Deltoid 15.6 ± 1.1 2n
7 EMS 0.1%, 6 jam (tanaman 2)
Hijau Persegi Tegak Deltoid 12.3 ± 2.5 2n
Keterangan:
*
Jumlah kloroplas per sel penjaga berdasarkan analisis terhadap 30 stomata dari tiga daun.a
d
b
[image:23.595.107.513.555.706.2]5
Keterangan :
1. Kontrol berasal dari biji 1 2. Kontrol berasal dari biji 2 3. Kontrol berasal dari hasil kultur 4. EMS 0.1%, 1 jam
5. EMS 0.1%, 3 jam
6. EMS 0.1%, 6 jam (Tanaman 1) 7. EMS 0.1%, 6 jam (Tanaman 2) 8. EMS 0.1%, 6 jam (tidak berkembang menjadi tanaman lengkap)
Gambar 2 Hasil analisis isozim: A. Peroksidase (PER); B. Aspartat Aminotransferase (AAT); C. Esterase (EST).
PEMBAHASAN
Metode kultur antera cabai haploid ganda Tombak pada media dua lapis telah berhasil dikombinasikan dengan teknik induksi mutasi menggunakan etil metan sulfonat (EMS) pada penelitian ini. Induksi mutasi menggunakan EMS pada konsentrasi 0.1% dan 0.5% dengan lama waktu perendaman 1, 3, dan 6 jam berpengaruh terhadap embrio lengkap yang dihasilkan dan embrio yang mampu berkecambah per kuncup bunga, serta keragaman morfologi dan isozim yang dihasilkan.
Perlakuan EMS konsentrasi 0.1% meningkatkan respon embriogenesis, rata-rata embrio lengkap dan embrio berkecambah yang dihasilkan, sebaliknya perlakuan EMS 0.5% menurunkan respon embriogenesis, rata-rata embrio lengkap, dan embrio berkecambah yang dihasilkan. Mikrospora sebagai target dalam kultur antera memiliki sensitifitas terhadap perlakuan mutagen (Szarejko dan Forster 2007). Konsentrasi dan lama perendaman tertentu dalam EMS dapat berpengaruh pada peningkatan dan penurunan
respon embriogenesis mikrospora. Hal ini sejalan dengan hasil penelitian Medrano (1986), yaitu semakin tinggi konsentrasi EMS yang digunakan dapat menurunkan jumlah tanaman haploid hasil kultur antera tembakau. Pengaruh EMS terhadap kultur antera cabai pada penelitian ini berhasil menginduksi terjadinya mutasi yang ditandai adanya keragaman morfologi pada tanaman yang dihasilkan. Masing-masing tanaman hasil kultur dengan perlakuan EMS memberikan keragaman morfologi yang berbeda-beda. Keragaman sifat morfologi terlihat pada bentuk daun hasil perlakuan EMS 0.1% selama 3 dan 6 jam. Hal ini sejalan dengan penelitian Jabeen & Mirza (2004) yang menyatakan bahwa EMS dapat menginduksi keragaman morfologi pada cabai.
Untuk variasi sifat bentuk daun yang panjang dan ramping hasil perlakuan EMS 0.1% selama 3 jam, dapat dimungkinkan akibat perbedaan tingkat ploidi tanaman yang dihasilkan. Menurut Supena et al. (2006b) bahwa pada tanaman cabai haploid kultivar Galaxy memiliki ciri sifat morfologi berupa ukuran tanaman lebih rendah dengan bentuk C
+
_
+
+
_
1 2 3 4 5 6 7 8
C
A B
1 2 3 4 5 6 7 8
daun lebih ramping dan kecil dibandingkan dengan tanaman HG maupun diploid.
Keragaman pola pita pada isozim PER, AAT, dan EST yang terlihat dari bertambah dan berkurangnya pita yang terbentuk, menunjukkan telah terjadi mutasi akibat perlakuan EMS. Pita isozim yang tidak terbentuk karena terjadi inaktivasi terhadap enzim akibat perubahan asam amino yang terbentuk pada tanaman. Keragaman pola pita isozim dapat menunjukkan perubahan pada tingkat protein yang secara tidak langsung menggambarkan telah terjadi perubahan DNA akibat mutasi oleh EMS (Medrano et al. 1986)
Perbedaan pola pita isozim EST pada tanaman kontrol dan hasil perlakuan EMS dapat dijadikan penanda pada tanaman cabai yang mengalami mutasi. Penggunaan isozim untuk mengetahui terjadi mutasi pada tingkat gen didasarkan bahwa pengujian terhadap isozim dapat menunjukkan perbedaan hingga tingkat varietas pada berbagai tanaman, antara lain kedelai (Cahyarini et al. 2004), jarak pagar (Yunus 2007), kelapa (Runtunuwu & Lengkong 2005), dan nenas (Hadiati & Sukmadjaja 2002).
Variasi tingkat ploidi dapat terjadi pada embrio dan tanaman hasil kultur antera dalam sistem media dua lapis. Tanaman dari embrio yang dihasilkan memiliki tingkat ploidi haploid dan haploid ganda. Untuk menentukan tingkat ploidi tanaman dilakukan penghitungan jumlah kloroplas per sel penjaga pada stomata daun. Hal ini sejalan dengan penelitian Supena et al. (2006a), bahwa rata-rata jumlah kloroplas per stomata pada cabai varietas Tombak untuk tanaman haploid (n) dan haploid ganda (2n) masing-masing adalah 8.9 dan 15.8.
Metode kultur antera cabai yang berhasil dikombinasikan dengan mutagenesis ini telah dapat menghasilkan tanaman haploid ganda dengan sifat tertentu yang berbeda hanya dalam satu generasi. Oleh karena itu, kombinasi teknik ini berpotensi untuk digunakan dalam perbaikan genetik dan sifat morfologi maupun sifat agronomis tertentu tanaman cabai kultivar lokal Indonesia secara cepat.
SIMPULAN
Perlakuan perendaman antera sebelum kultur dengan etil metan sulfonat (EMS) mempengaruhi respon embriogenesis dan produksi embrio lengkap pada kultur antera cabai menggunakan sistem media dua lapis. Perendaman EMS 0.1% dapat meningkatkan
kapasitas embriogenesis, sedangkan EMS 0.5% menurunkan kapasitas embriogenesis. Perlakuan EMS 0.1% selama 6 jam tidak hanya dapat menginduksi mutasi, tetapi juga meningkatkan respon embriogenesis, rata-rata embrio lengkap, dan rata-rata embrio berkecambah. Mutasi yang terjadi dapat dideteksi pada tanaman yang berasal dari kultur antera pada sifat morfologi daun dan batang, serta isozim PER, AAT, dan EST.
SARAN
Pengamatan terhadap tanaman mutan generasi ke-2 hasil kombinasi kultur antera dan EMS perlu dilakukan untuk melihat kestabilan hasil mutasi. Pengujian EMS dengan taraf konsentrasi yang lebih banyak antara 0.01 – 0.1% dengan waktu perendaman 1 – 6 jam perlu dilakukan untuk mengetahui perlakuan optimal yang dapat menginduksi mutasi tetapi juga berpengaruh positif terhadap kapasitas embriogenesis kultur antera cabai.
DAFTAR PUSTAKA
[BPS] Badan Pusat Statistik. 2011. Produksi Cabai Indonesia. Jakarta: BPS.
Cahyarini RD, Yunus A, Purwanto E. 2004. Identifikasi keragaman genetik beberapa varietas lokal kedelai di Jawa berdasarkan analisis isozim. Agrosains 6: 79-83. Chen QF, Wang CL, Lu YM, Shen M, Afza
R, Duren MV, Brunner H. 2001. Anther culture in connection with induced mutations for rice improvement. Euphytica 120: 401-408.
Dumas de Vaulx R, Chambonnet D, Pochard E. 1981. Culture in vitro d‟anthères du piment (Capsicum annuum L.): amélioration des taux d‟obtention de plantes chez différent genotypes par des traitements à +35oC. [Abstract in English]. Agronomie 1: 859–864.
Ferrie AM, Palmer CE, Keller WA. 1994. Biotechnological application of haploids. Di dalam: Shargool PD & Ngo TT, editors. Biotechnological Applications of Plant Cultures. Baca Raton: CRC Press. Hadiati S, Sukmadjaja D. 2002. Keragaman
pola pita beberapa aksesi nenas berdasarkan analisis isozim. J Bioteknol Pertan 7: 62-70.
INDUKSI MUTASI DENGAN ETIL METAN SULFONAT DALAM
KULTUR ANTERA CABAI (
Capsicum annuum
L.) DAN PENGARUHNYA
TERHADAP KAPASITAS EMBRIOGENESIS
MUHAMMAD RIDHWAN
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Cabai (Capsicum annuum L.) dan Pengaruhnya terhadap Kapasitas Embriogenesis. Dibimbing oleh ENCE DARMO JAYA SUPENA dan HADISUNARSO.
Metode kultur antera yang efisien pada sistem media dua lapis telah dikembangkan untuk memproduksi tanaman haploid ganda (HG) cabai kultivar lokal Indonesia (Capsicum annuum L.). Untuk percepatan dalam menghasilkan variasi genetik dan perbaikan sifat dari cabai, metode kultur antera ini dikombinasikan dengan teknik mutagenesis dalam penelitian ini. Induksi mutasi dilakukan melalui perendaman antera sebagai sumber eksplan pada larutan etil metan sulfonat (EMS) konsentrasi 0.1% dan 0.5% selama 1, 3, dan 6 jam sebelum kultur. Perlakuan EMS 0.1% selama 6 jam tidak hanya dapat menginduksi mutasi, tetapi juga meningkatkan respon embriogenesis, rata-rata embrio lengkap, dan rata-rata embrio berkecambah. Mutasi yang terjadi dapat dideteksi pada tanaman yang berasal dari kultur antera pada sifat morfologi daun dan batang, serta isozim peroksidase, aspartat aminotransferase, dan esterase. Metode kultur antera yang dikombinasikan dengan teknik mutagenesis ini dapat digunakan untuk mempercepat proses pemuliaan tanaman cabai kultivar lokal Indonesia.
Kata kunci: Capsicum, Kultur antera, Haploid ganda, EMS, Mutasi.
ABSTRACT
MUHAMMAD RIDHWAN. Ethyl Methane Sulphonate Treatment Mutation Induction on Anther Cultures of Hot Pepper (Capsicum annuum L.) and Its Effect on Embryogenesis Capacity. Under supervision of ENCE DARMO JAYA SUPENA and HADISUNARSO.
An efficient anther culture method on double layers medium system has been developed for producing doubled haploid (DH) of Indonesian hot pepper (Capsicum annuum L.). In order to speed up both genetic variability and improvement of hot pepper, this anther culture method was combined with mutagenesis technique in this research. Induction of mutation was evaluated by soaking of anthers as source of explans in 0.1% and 0.5% ethyl methane sulphonate (EMS) solution during 1, 3, and 6 hours prior to culture. Anther treatment on 0.1% EMS during 6 hours was not only induce mutation, but also increase embryogenesis response, complete embryo produce, and embryo germination. The mutation could be detected on plant derived from anther culture both in morphologycal characters of leaf and stem, and isozyme of peroxidase, aspartate aminotransferase, and esterase. A combination of anther cultures method and mutagenesis technique could be used for speeding up the breeding process of Indonesian local cultivar hot pepper.
INDUKSI MUTASI DENGAN ETIL METAN SULFONAT DALAM
KULTUR ANTERA CABAI (
Capsicum annuum
L.) DAN PENGARUHNYA
TERHADAP KAPASITAS EMBRIOGENESIS
MUHAMMAD RIDHWAN
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Nama
: Muhammad Ridhwan
NIM
: G34070086
Menyetujui,
Pembimbing I
Pembimbing II
Dr. Ir. Ence Darmo Jaya Supena, M.Si
Ir. Hadisunarso, M.Si
NIP 19641002 198903 1 002
NIP 19550219 197903 1 002
Mengetahui,
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
Dr. Ir. Ence Darmo Jaya Supena, M.Si
NIP 19641002 198903 1 002
PRAKATA
Dengan Nama Allah Yang Maha Pengasih lagi Maha Penyayang. Segala puji dan syukur penulis ucapkan kehadirat Allah SWT atas rahmat dan hidayah-Nya sehingga dapat menyelesaikan karya ilmiah ini. Shalawat dan salam kepada suri tauladan terbaik Nabi Muhammad SAW dan semoga terlimpahkan pula kepada keluarga dan para sahabatnya serta orang-orang yang mengikuti jejak mereka sampai hari kemudian.
Pertanian Indonesia yang terus berkembang baik dalam hal aspek produksi, teknologi dan ekonomi membutuhkan inovasi-inovasi baru. Tanaman cabai merupakan komoditas pertanian yang penting bagi masyarakat sehingga pengembangan dan penelitian tanaman ini terus dilakukan untuk memperoleh berbagai macam varietas-varietas baru yang baik dan unggul. Karya ilmiah ini berjudul “Induksi Mutasi dengan Etil Metan Sulfonat dalam Kultur Antera Cabai (Capsicum annuum L.) dan Pengaruhnya terhadap Kapasitas Embriogenesis”, dan merupakan sebuah pendekatan teknologi haploid yang dikombinasikan dengan mutagenesis dalam usaha meningkatkan produktivitas dan kualitas tanaman cabai Indonesia.
Terima kasih penulis ucapkan kepada Dr. Ir. Ence Darmo Jaya Supena, M.Si dan Ir. Hadisunarso, M.Si atas segala bimbingan dan fasilitas yang diberikan untuk menunjang penelitian penulis sampai terselesaikannya karya ilmiah ini. Terima kasih juga penulis sampaikan kepada Dr. Ir. Sulistijorini, M.Si sebagai dosen penguji atas masukan untuk perbaikan karya ilmiah ini. Terima kasih penulis sampaikan kepada dosen, staf dan karyawan Departemen Biologi: Dr. Hamim, Ir. Tri Heru W, M.Si, Pak Joni, Pak Ejen, Pak Nasir, Teh Wiwiek, Ibu Eti atas bantuan dan kerjasamanya. Terima kasih penulis sampaikan kepada staf dan rekan-rekan penelitian di PPSHB IPB: Mbak Nia, Mbak Sarah, Pak Asep, Pak Sairi, Pak Mulya, Pak Adi, Ibu Ratna, Pak Pras, Ita, Lia, Ikra N, Asri dan masih banyak rekan lainnya yang tidak dapat penulis sebutkan. Saya senang bisa mengenal dan bekerjasama selama masa-masa penelitian yang tidak terlupakan. Terima kasih penulis sampaikan kepada Syaefudin, S.Si dan Hakiim Bashaar, S.Si atas bimbingan dan ilmu yang telah diberikan yang menunjang penelitian ini. Terima kasih penulis sampaikan kepada saudara-saudaraku 97 orang mahasiswa Biologi angkatan 44 (BIOPAT), dan kakak-kakak serta adik-adik Biologi angkatan 41, 42, 43, 45, 46, dan 47. Terima kasih penulis sampaikan kepada manajemen CV. Greentech EMC, keluarga besar LDK Al Hurriyyah, dan Himabio IPB atas dukungan dan perhatian selama studi Strata 1 IPB. Terakhir, rasa terima kasih dan hormat yang sebesar-besarnya penulis sampaikan kepada keluarga tercinta, Bapak, Ibu, Achmad Muttaqiin, SE., dan adikku Anwar Fauzi atas segala doa, semangat dan kasih sayang yang membuat penulis dapat menyelesaikan karya ilmiah dan studi S1 ini.
Penulis menyadari bahwa karya ilmiah ini masih belum sempurna, namun penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi pengembangan ilmu pengetahuan dan pertanian khususnya di Indonesia.
Bogor, Mei 2012
bersaudara, dari pasangan Eddy Sukamto dan Sunarmiyatun.
Tahun 2001 penulis lulus dari SD Islamic Village, Tangerang. Tahun 2004 penulis lulus dari SLTP Islamic Village, Tangerang. Tahun 2007 penulis lulus dari SMA Negeri 7, Kota Tangerang dan pada tahun yang sama penulis diterima masuk IPB melalui jalur seleksi USMI pada mayor Biologi, di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam dengan minor Gizi Masyarakat, Fakultas Ekologi Manusia, Institut Pertanian Bogor.
7
Jabeen N, Mirza B. 2004. Ethyl methane sulfonate induces morphological mutations in Capsicum annuum. Int J Agri Biol 6:340-345.
Kothari SL, Joshi A, Kachhwaha S, Ochoa-alejo N. 2010. Chilli peppers – A review on tissue culture and transgenesis. Biotechnol Adv 28: 35-48.
Lee JH, Lee SY. 2002. Selection of stable mutants from cultured rice anthers treated with ethyl methane sulfonic acid. Plant Cell Tiss Org Cult 71: 165-171.
Medrano H, Millo EP, Guerri J. 1986. Ethyl methane sulphonate effect on anther cultures of Nicotiana tabacum. Euphytica 35: 161-168.
Murashige T, Skoog F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiol Plant 15:473-497.
Nisch JP, Nisch C. 1969. Haploid plants from pollen grains. Science 163: 85-87.
Pitojo S. 2003. Benih Cabai. Yogyakarta: Kanisius.
Qin X, Rotino GL. 1995. Anther culture of several sweet and hot pepper genotypes. Capsicum Eggplant Nwsl 12: 59-62. Runtunuwu SD, Lengkong EF. 2005.
Identifikasi penanda isozim (7, PER-8, dan RAPD OB17375) pada kelapa genjah salak (GSK) dan beberapa hasil silangannya dengan kelapa dalam. Eugenia 11: 8-17.
Sega GA. 1984. A review of the genetic effects of ethyl methanesulfonate. Mutat Researc 134: 113-142.
Sibi M, Dumas de Vaulx R, Chambonnet D. 1979. Obtention de plantes haplöides par androgenèse in vitro chez le piment (Capsicum annuum L.). [Abstract in English]. Ann Amélior Plantes 29: 583-606.
Supena EDJ, Suharsono S, Jacobsen E, Custers JBM. 2006a. Succesful development of a shed-microspore culture protocol for doubled haploid production in Indonesian hot pepper (Capsicum annuum L.). Plant Cell Rep 25: 1-10.
Supena EDJ, Muswita W, Suharsono S, Custers JBM. 2006b. Evaluation of crutial factors for implementing shed-microspore culture of Indonesian hot pepper (Capsicum annuum L.) cultivars. Sci Hortic 107: 226-232.
Supena EDJ, Custers JBM. 2011. Refinement of shed-microspore culture protocol to increase normal embryos production in hot pepper (Capsicum annuum L.). Sci Hortic 130: 769-774.
Syukur M, Sujiprihati S, Yunianti R, Kusumah DA. 2010. Evaluasi daya hasil cabai hibrida dan daya adaptasinya di empat lokasi dalam dua tahun. J Agron Indo 38: 43-51.
Szarejko I, Forster BP. 2007. Doubled haploidy and induced mutation. Euphytica 158: 359-370.
Wendel JF, Weeden NF. 1989. Visualization and intrepretation of plant isozymes. Di dalam: Soltis DE, Soltis PS (editor) Isozymes in Plant Biology, Ed ke-4, Oregon: Dioscorides Press. hlm: 5-45. Yunus A. 2007. Identifikasi keragaman