BIOSORPSI LOGAM MERKURI (Hg)
OLEH Bacillus megaterium ASAL HILIR SUNGAI CISADANE
HAFIDH ZARKASYI
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI
SYARIF HIDAYATULLAH
BIOSORPSI LOGAM MERKURI (Hg)
OLEH Bacillus megaterium ASAL HILIR SUNGAI CISADANE
Skripsi
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Hafidh Zarkasyi 103095029764
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI
SYARIF HIDAYATULLAH
PENGESAHAN UJIAN
Skripsi berjudul ”Biosorpsi Logam Merkuri (Hg) Oleh Bacillus megaterium Asal Hilir Sungai Cisadane” yang ditulis oleh Hafidh Zarkasyi, NIM 103095029764 telah diuji dan dinyatakan lulus dalam sidang Munaqosyah Fakultas Sains dan Teknologi, Universitas Islam Negeri Syarif Hidayatullah Jakarta pada hari Jum’at tanggal 13 juni 2008. Skripsi ini telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Strata Satu (S1) Program Studi Biologi.
Menyetujui,
Penguji I Penguji II
Fahma Wijayanti, M.Si Dasumiati, M.Si
Pembimbing I Pembimbing II
Megga Ratnasari Pikoli, M.Si Drs. Muhammad Badjoeri
Mengetahui,
Dekan Fakultas Sains dan Teknologi Ketua Program Studi Biologi
PERNYATAAN
DENGAN INI SAYA MENYATAKAN KEASLIAN SKRIPSI INI BENAR-BENAR HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN.
Jakarta, Juni 2008
Ayat – Ayat Allah
⌧
☺
⌧
⌧
”Telah nampak kerusakan di darat dan di laut, karena perbuatan tangan manusia, supaya Allah merasakan kepada mereka sebahagian dari (akibat) perbuatan mereka, agar mereka
kembali (ke jalan yang benar)” (Q.S. Ar-Ruum : 41)
☺
☺
”Allah meninggikan orang-orang yang beriman diantara kamu dan orang-orang yang diberi ilmu pengetahuan beberapa derajat”. (Q.S. Al-Mujadalah :17)
☺
☺
⌧
This thesis is especially dedicated to my beloved parents
Terima kasih atas semua doa, semangat, cinta dan kasih sayang yang tiada henti yang telah kalian berikan hingga mengalir deras dalam nadi juga darah ini untuk menghadapi semua perjalanan hidupku Kasih kalian takkan bisa terbalaskan Tanpa kalian aku bukan apa-apa You ‘re my best part of my life
Pada puncak ada harap
Pada batu ada rasa
Pada darahku ada kalian
Mengalir merah dalam hatiku
Selamanya...
Untuk lautku yang tak biru lagi
Untuk sungaiku yang tak jernih lagi
Untuk hutanku yang tak lebat lagi
Untuk gunungku yang tak hijau lagi
Untuk alamku yang tak asri lagi
KATA PENGANTAR
Alhamdulillah, puji dan syukur kehadirat Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “BIOSORPSI LOGAM MERKURI (Hg) OLEH Bacillus megaterium
ASAL HILIR SUNGAI CISADANE”. Pada kesempatan ini, penulis ingin
menyampaikan ucapan terima kasih kepada :
1. Ibunda (Heryati) dan Ayahanda (H.Abdur Rosyid) yang telah mencurahkan kasih sayang dan cinta yang tidak dapat terbalaskan sampai kapanpun.
2. DR. Ir. Syopiansyah Jaya Putra, M.Sis, selaku Dekan Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta beserta jajarannya.
3. DR. Lily Surayya E.P, M. Env. Stud. selaku Ketua Program Studi Biologi sekaligus sebagai penguji I dalam seminar proposal dan seminar hasil yang telah memberikan ijin dan arahan dalam melaksanakan penelitian.
4. DR. Ir. Gadis Sri Haryani sebagai Kepala Puslit Limnologi yang telah menerima dan memberikan izin penulis untuk melakukan penelitian di puslit limnologi.
5. Megga Ratnasari Pikoli, M.Si, selaku Pembimbing I sekaligus dosen Pembimbing Akademik yang telah memberikan bimbingan dan semangat sehingga dapat menyelesaikan penulisan skripsi ini.
6. Drs. Muhammad Badjoeri selaku Pembimbing II yang telah sangat sabar dalam membimbing dan banyak membantu dan memberikan ilmunya kepada penulis dalam melakukan penelitian dan pada akhirnya dapat menyelesaikan penulisan skripsi ini.
7. Deni Zulfiana, M.Si dan Dra. Nani Radiastuti, M.Si selaku dosen penguji II pada seminar proposal dan seminar hasil.
8. Fahma Wijayanti, M.Si dan Dasumiati, M.Si, selaku dosen penguji I dan II pada sidang munaqosah.
yang telah membantu penulis dalam masa penelitian hingga penulis dapat menyelesaikan skripsi ini.
10. Ikhsan Khasani, M.Si selaku kakak seperjuangan yang telah memberikan motivasi dalam sama-sama melaksanakan penelitian di puslit limnologi.
11. Keluarga Besar Puslit limnologi dan Keluarga Besar Sekuriti Puslit Limnologi yang telah menemani penulis dalam keseharian menjalankan penelitian semoga ikatan silaturahmi yang tercipta tetap terjalin.
12. Semua mahasiswa biologi angkatan 2003, Danil, Aki Bahri, Mardiansah, Angga, Feri, Deden, Rengga, Nova, Adang, Wila, Yeni, Irul, Tutu, Maryam, Mae, Ima, Isti, Ninis, Era, Neni, Nurul, Nyai, Ida dan semua teman-teman angkatan 2003 yang terikat silaturahmi dengan penulis.
13. B 6935 EAI dan B 6498 EFG yang telah setia menemani semua perjalanan penulis dalam melaksanakan dan menyelesaikan penelitian.
14. Semua pihak yang tidak disebutkan satu per satu yang telah membantu dalam kelancaran penelitian dan penulisan skripsi ini namun tidak mengurangi rasa terimakasih dan hormat penulis.
Semoga Allah SWT, senantiasa memberikan Rahmat dan Karunia-Nya kepada orang-orang yang senantisa bersyukur atas nikmat Iman dan Islam-Nya. Atas segala Kesempurnaan-Nya yang Luhur, penulis ucapkan terima kasih
kembali kepada mereka yang telah meluangkan waktu dalam penulisan skripsi ini. Skripsi ini tentu saja masih jauh dari kesempurnaan, sehingga penulis dengan senang hati menerima kritik demi perbaikan. Akhirnya semoga Skripsi ini dapat digunakan sebaik-baiknya serta memiliki banyak manfaat bagi semua. Amin !
Wassalamu’alaikum wr.wb. Jakarta, Juni 2008
ABSTRAK
HAFIDH ZARKASYI. Biosorpsi Logam Merkuri (Hg) oleh Bacillus megaterium Asal Hilir Sungai Cisadane. Skripsi. Program Studi Biologi, Fakultas Sains dan Teknologi, Universitas Islam Negeri Syarif Hidayatullah, Jakarta. 2008.
Penurunan konsentrasi logam berat seperti merkuri dalam media dapat dilakukan dengan bioremoval melalui proses biosorpsi. Pada penelitian ini digunakan bakteri B. megaterium asal hilir Sungai Cisadane, dengan kondisi perlakuan yang terdiri dari 10, 15 dan 20 mg/L Hg dalam media Nutrient Broth (NB). Konsentrasi merkuri yang tersisa dalam media dianalisa dengan menggunakan Atomic Absorption Spectrophotometry (AAS). Pola tumbuh B. megaterium dijadikan tolak ukur di mana inokulum untuk perlakuan menggunakan kultur yang berumur 8 jam, karena merupakan kultur yang sedang memasuki fase logaritmik pertumbuhan (2,87x107 cfu/ml) dan durasinya sampai jam ke-12 merupakan fase pertumbuhan tercepat (µ= 3,102 / jam). Hasil uji statistik (α = 0,05) menunjukkan bahwa isolat B. megaterium memiliki kemampuan menyerap logam Hg dalam semua media perlakuan, yaitu pada konsentrasi Hg 10, 15 dan 20 mg/L dengan efisiensi berturut-turut sebesar 99,58, 99,13 dan 99,58%. Tingginya biosorpsi (>98%) menunjukkan potensi biosorpsi logam Hg isolat ini dalam media dengan konsentrasi Hg lebih dari 20 mg/L.
ABSTRACT
HAFIDH ZARKASYI. Mercury Biosorption by Isolate Bacillus megaterium from The Downstream of Cisadane River. Thesis. Biology Department, Faculty of Science and Technology, State Islamic University Syarif Hidayatullah, Jakarta. 2008.
Heavy metal reduction from medium can be implemented with bioremoval by biosorption process. In this research, isolate Bacillus megaterium from The Downstream of Cisadane River was cultured in Nutrient Broth (NB) medium containing 10, 15 and 20 mg/L of mercury. The rest of Mercury concentration in medium were analyzed using Atomic Absorption Spectrophotometry (AAS). The growth pattern of Bacillus megaterium was used as standard where inoculum for treatment used 8 hours incubated culture as the culture at that time was entering logarithmic growth phase (2,87x107 cfu/ml) and its duration until 12 hours incubated was the fastest growth phase (µ= 3,102 / hour). The result of statistic test (one way anova, α = 0,05) showed that B. megaterium isolate has ability to absorb of Hg in all treatment medium, that were 10, 15 and 20 mg/L Hg with efficiencies 99,58, 99,13 and 99,58% respectively. The high level of biosorption (>98%) showed that this isolate has a potency to be applied in environment with more than 20 mg/L Hg concentration.
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
ABSTRAK ... iii
ABSTRACT... iv
DAFTAR ISI ... v
DAFTAR TABEL... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
BAB I. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Perumusan Masalah ... 4
1.3. Hipotesis... 4
1.4. Tujuan Penelitian ... 5
1.5. Manfaat Penelitian ... 5
BAB II. TINJAUAN PUSTAKA... 6
2.1. Bakteri ... 6
2.2. Bacillus megaterium... 8
2.3. Bakteri Resisten Logam Merkuri (Hg) ... 9
2.4. Logam Berat... 12
2.4.1. Merkuri (Hg) ... 15
2.5. Sungai Cisadane ... 18
BAB III. METODOLOGI PENELITIAN... 24
3.1. Lokasi dan Waktu Penelitian ... 24
3.2. Bahan dan Alat... 24
3.3. Prinsip Percobaan... 25
3.4. Metode Kerja... 25
3.4.1. Persiapan Isolat Bakteri B. megaterium ... 25
3.4.2. Persiapan Media ... 25
3.4.3. Persiapan Sediaan Larutan Logam Hg... 26
3.4.4. Pembuatan Kurva Tumbuh Isolat Bakteri B. megaterium ... 27
3.4.5. Persiapan Kultur Inokulum ... 28
3.4.6. Uji Kemampuan Biosorpsi Isolat Bakteri B. megaterium... 28
3.4.7. Pengukuran Biosorpsi Logam Hg oleh Isolat Bakteri B. megaterium ... 29
3.4.8. Pengukuran Efisiensi Biosorpsi oleh Isolat Bakteri B. megaterium ... 30
3.5. Analisa Data ... 31
BAB IV. HASIL DAN PEMBAHASAN... 33
4.1. Pengamatan Pola Tumbuh Isolat Bakteri B. megaterium... 33
4.2. Biosorpsi Logam oleh IsolatBakteri B. megaterium... 37
BAB V. KESIMPULAN DAN SARAN... 43
5.2. Saran... 44 DAFTAR PUSTAKA ... 45
DAFTAR TABEL
[image:14.595.109.507.170.561.2]Halaman
DAFTAR GAMBAR
Halaman
Gambar 1. Kurva Pertumbuhan Bakteri (Pelczar dan Chan, 1986) ... 7 Gambar 2. Kultur murni B. megaterium pada permukaan medium NA ... 9 Gambar 3. Bentuk Sel B. megaterium
(Sumber: http://en.wikipedia.org/wiki/Bacillus_megaterium) ... 9 Gambar 4. Pergerakan Lokal Unsur Merkuri di Perairan Umum
(Gavis dan Ferguson, 1972 dalam Budiono, 2002) ... 18 Gambar 5. Salah Satu Ruas Bagian Hilir Sungai Cisadane Sebagai Lokasi
Eksplorasi Bakteri Agen Bioremoval Logam Berat... 20 Gambar 6. Proses passive uptake Cr pada permukaan membran sel ... 23 Gambar 7. Pola Tumbuh Bakteri B. megaterium Selama 24 Jam... 34 Gambar 8. Korelasi antara Populasi Bakteri dengan Kerapatan Optik
(OD) Bacillus megaterium pada Fase Log
[image:15.595.111.510.168.540.2](inkubasi 0 sampai 12 jam) ... 35 Gambar 9. Korelasi antara Populasi Bakteri dengan Kerapatan Optik
(OD) Bacillus megaterium secara keseluruhan
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Disain Penelitian... 50
Lampiran 2. Bagan Kerja Pembuatan Pola Tumbuh dan Pengujian Kemampuan Bakteri Menurunkan Konsentrasi Logam Hg ... 51
Lampiran 3. Data Populasi Bakteri, Kerapatan Optik (OD 600 nm) Pada Pengamatan Pola tumbuh B. megaterium selama 24 jam ... 52
Lampiran 4. Tahap Digest Sampel dan Pengukuran Instrumental dengan Hiranuma HG310 Mercury Analyzer ...53
Lampiran 5. Hasil Analisa Logam dengan AAS Hiranuma Hg 310 Mercury Analyzer ... 54
5.1. Perlakuan ... 54
5.2. Kontrol ... 54
Lampiran 6. Hasil Pengolahan dengan SPSS 11.5 ... 55
6.1. Tabel Deskriptif Perlakuan ... 55
6.1a. Penyerapan oleh Bakteri ... 55
6.1b. Penyerapan di Media ...55
6.2.Tabel Hasil Analisis Sidik Ragam (One Way Anova)... 56
6.2a. Hasil Pengolahan data korelasi, cfu/ml, OD dan Jam (Jam ke 0 sampai jam ke 12) ... 56
Pengelolaan Kualitas Air dan Pengendalian
BAB I
PENDAHULUAN
1.1. Latar Belakang
Air merupakan salah satu sumber daya alam dan komponen yang sangat penting bagi kehidupan organisme, serta modal bagi pembangunan negara. Oleh karena itu melestarikan sumberdaya air seperti sungai menjadi sangat penting dan perlu dilakukan. Pengelolaan kualitas air dan pengendalian pencemaran perairan mempunyai peran yang penting untuk kelangsungan generasi sekarang dan mendatang serta keseimbangan ekologis (PP No.82, 2001).
Semakin meningkatnya populasi dan berkembangnya industri menyebabkan limbah padat dan cair semakin banyak. Limbah dari buangan industri dapat saja mengandung logam berat yang sangat berbahaya. Menurut Asmara (1996), sasaran utama dari kontaminasi logam berat yang berasal dari limbah domestik dan industri adalah sistem perairan, yang salah satunya adalah sungai.
Sungai Cisadane merupakan sungai yang diarahkan sebagai kawasan perlindungan tata air dan sumber air baku, sekaligus sebagai kawasan wisata, preservasi, konservasi budaya dan juga diharapkan sebagai water front city. Namun berdasarkan hasil pemantauan Sarpedal yang dilakukan di 14 titik pantau menunjukkan terjadinya penurunan tingkat kesehatan sungai dan meningkatnya kandungan logam berat dari hulu ke hilir (Purwati dkk., 2003; Sarpedal, 2004).
Tangerang, serta merupakan sumber air kota Jakarta, yaitu sekitar 15 % pasokan air bersih yang dialirkan ke kota Jakarta (Anonimous, 2005). Sungai Cikaniki, salah satu anak sungai yang bermuara ke Sungai Cisadane, diketahui telah teridentifikasi tercemar logam merkuri (Syawal dan Yustiawati, 2004).
Secara umum diketahui bahwa keberadaan logam berat pada batas konsentrasi tertentu merupakan elemen yang berbahaya (toksik) bagi kehidupan organisme. Masukan logam berat ke lingkungan perairan adalah akibat dari pesatnya perkembangan industri terutama industri kertas, tekstil, baterai dan penambangan logam (Badjoeri dkk., 2006). Berdasarkan laporan USEPA (U.S. Environmental Agency) ditemukan ada 13 elemen logam berat yang merupakan elemen utama pencemar yang berbahaya, yaitu : Antimon (An), Arsen (As), Berilium (Be), Kadmium (Cd), Krom (Cr), Tembaga (Cu), Timbal (Pb), Merkuri (Hg), Nikel (Ni), Selenium (Se), Perak (Ag), Talium (Tl), Seng (Zn) (Wild, 1995). Toksisitas (daya racun) logam berat dapat berdampak negatif bahkan merugikan bagi kesehatan manusia tergantung pada bagian mana logam berat tersebut terakumulasi didalam tubuh, selain itu toksisitas logam berat juga dapat menjadi inhibitor (penghambat) proses enzimatik didalam tubuh sehingga proses metabolisme tidak dapat berlangsung. Logam berat dapat juga menjadi pemicu dan penyebab alergi, mutagen, teratogen atau karsinogen bagi manusia (Vouk, 1986).
terutama di perairan yang telah terkontaminasi (tercemar) logam berat maka proses pembersihannya akan sulit sekali dilakukan (Nordberg et al.,1986).
Berbagai jenis mikroorganisme (bakteri) diketahui dapat mengakumulasi logam berat dalam jumlah besar. Pendekatan inilah yang menjadi dasar penelitian ini untuk pengembangan proses bioremoval dengan memanfaatkan kemampuan aktivitas biosorpsi melalui metabolisme bakteri. Pemanfaatan bakteri sebagai agen bioremoval ion logam berat untuk sistem perairan tercemar perlu dikembangkan karena hal ini adalah salah satu alternatif pendekatan secara biologis yang potensial, ekonomis dan ramah lingkungan untuk pengelolaan atau pengendalian kualitas air suatu sistem perairan tercemar logam berat (Bourquin, 1990).
Bakteri merupakan salah satu organisme yang mampu memanfaatkan ion logam berat dalam aktivitas metabolismenya (Bourquin, 1990). Secara alamiah kelompok bakteri ini berkembang dan beradaptasi dengan kondisi lingkungannya. Pada lapisan dasar perairan (surface sediment) yang banyak terakumulasi logam berat akan ditumbuhi oleh berbagai kelompok bakteri atau mikroba tersebut (Atlas dan Bartha, 1993).
Salah satu upaya menangani pencemaran logam Hg di suatu perairan adalah dengan bioremoval atau biosorpsi menggunakan bakteri indigenous yang diisolasi dari perairan tersebut (Bourquin, 1990). Berdasarkan hasil penelitian Cheung dan Dong-Gu (2005) menunjukkan bahwa bakteri Bacillus megaterium strain TKW3 hasil isolasi dari sedimen permukaan air laut yang terkontaminasi berbagai jenis logam berat. Bacillus megaterium strain TKW3 dapat mereduksi logam berat seperti Cr dan resisten terhadap logam Cr, Se dan As secara in vitro.
Isolasi, karakterisasi dan uji resistensi terhadap bakteri indigenous asal Sungai Cisadane yang memiliki kemampuan resistensi terhadap logam Hg 10 mg/L secara in vitro telah dilakukan (Zarkasyi, 2007). Selanjutnya isolat bakteri tersebut berhasil diidentifikasi dan diketahui sebagai isolat bakteri B. megaterium (Badjoeri, 2007). Namun sejauh ini belum diketahui kemampuan B. megaterium dalam menyerap ion logam Hg dengan konsentrasi 10 mg/L atau lebih tinggi.
1.2. Perumusan Masalah
Agar penelitian ini lebih terarah, maka permasalahan yang akan dikaji lebih mendalam adalah :
1. Bagaimana pola pertumbuhan isolat bakteri Bacillus megaterium sehingga dapat diketahui umur yang tepat untuk pengujian biosorpsi logam Hg? 2. Bagaimana kemampuan isolat bakteri isolat Bacillus megaterium asal hilir
1.3. Hipotesis
Hipotesis yang dapat dikemukakan dari penelitian ini adalah :
1. Isolat bakteri Bacillus megaterium dapat mencapai fase aktif yang dapat digunakan sebagai inokulum untuk pengujian biosorpsi logam Hg.
2. Isolat bakteri Bacillus megaterium asal hilir Sungai Cisadane yang resisten Hg dapat menyerap logam Hg di antara konsentrasi Hg yang diuji (10, 15 dan 20 mg/L).
1.4. Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mengetahui umur inokulum isolat bakteri Bacillus megaterium yang tepat untuk pengujian biosorpsi logam Hg.
2. Mengetahui kemampuan penyerapan logam Hg oleh isolat Bacillus megaterium asal Sungai Cisadane yang resisten Hg di antara konsentrasi Hg yang diuji (10, 15 dan 20 mg/L).
1.5. Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1. Bakteri
Bakteri termasuk organisme prokariotik (tidak memiliki membran inti). Umumnya bakteri memiliki struktur sel yang relatif sederhana. Struktur sel bakteri yang paling penting adalah dinding sel. Berdasarkan sifat dan struktur dinding sel terhadap pewarnaan, bakteri digolongkan menjadi dua kelompok yaitu Gram positif dan Gram negatif. Bakteri Gram positif memiliki dinding sel yang terdiri atas lapisan peptidoglikan yang tebal dan asam teichoic. Sementara bakteri Gram negatif memiliki lapisan luar, lipopolisakarida yang terdiri atas membran dan lapisan peptidoglikan yang tipis terletak pada periplasma yaitu di antara lapisan luar dan membran sitoplasmik (Volk dan Wheeler, 1986).
Sel-sel individu bakteri dapat berbentuk seperti oval (elips), bola (coccus), batang (bacill) atau spiral (spirillum). Dari bentuknya ini dapat dijadikan ciri penting dalam mengidentifikasi suatu spesies. Sel bakteri yang berbentuk seperti bola dan elips dinamakan coccus. Sel bakteri yang berbentuk silindris atau seperti batang dinamakan bacillus. Ada banyak variasi dalam ukuran panjang dan lebar pada bakteri berbentuk bacillus. Bagian ujung sel bacillus ada yang berbentuk persegi, bundar dan meruncing (Pelczar dan Chan, 1986; Volk dan Wheeler, 1993). Bakteri berbentuk spirilum, biasanya individu-individu selnya tidak bergerombol atau saling melekat (Pelczar danChan, 1986).
pada populasi bakteri ialah pembelahan biner melintang. Pembelahan biner melintang adalah suatu proses reproduksi aseksual, setelah pembentukan dinding sel melintang maka satu sel tunggal membelah menjadi dua sel dan disebut sel anak. Beberapa spesies lainnya, bakteri dapat bereproduksi dengan proses tambahan termasuk produksi spora reproduktif, fragmentasi pertumbuhan berfilamen, dengan masing-masing fragmen menghasilkan pertumbuhan dan penguncupan (Pelczar dan Chan, 1986).
[image:24.595.111.505.238.543.2]Dengan adanya reproduksi dan terjadi pertumbuhan pada bakteri, maka ada empat fase pertumbuhan bakteri sebagaimana tampak pada kurva pertumbuhan (Gambar 1).
Gambar 1. Pola Pertumbuhan Bakteri (Pelczar dan Chan, 1986)
Dari kurva diatas dapat dilihat bahwa ada suatu periode awal tanpa pertumbuhan (fase lag) karena sel mengalami perubahan komposisi kimiawi dan ukuran serta bertambahnya subtansi intraseluler sehingga siap untuk membelah diri diikuti oleh suatu pertumbuhan cepat (fase log) yaitu sel membelah diri dengan laju yang konstan, masa menjadi dua kali lipat dan keadaan pertumbuhan seimbang. Kemudian fase mendatar (fase stasioner), yaitu terjadinya penumpukan racun akibat metabolisme sel dan kandungan nutrien mulai habis, akibatnya
Ket:
A : Fase lamban (lag) B : Fase Log (eksponensial) C : Fase Stasioner
terjadi kompetisi nutrisi sehingga beberapa sel mati dan lainnya tetap tumbuh, jumlah sel menjadi konstan. Akhirnya, terjadi suatu penurunan populasi sel-sel hidup (fase kematian) yaitu sel-sel menjadi mati akibat penumpukan racun dan habis nutrisinya, menyebabkan jumlah sel-sel yang mati lebih banyak daripada yang hidup sehingga mengalami penurunan jumlah sel secara eksponensial (Pelczar dan Chan, 1986).
2.2. Bacillus megaterium
Bacillus megaterium merupakan salah satu jenis bakteri yang termasuk genus Bacillus, divisi Firmicutes, kelas Bacilli, ordo Bacillales, dan famili Bacillaceae (Holt dkk.,1994; Turnbull, 1996). Jenis ini memiliki sel berbentuk batang dan bersifat Gram positif, bergerak dengan menggunakan flagel dan dapat membentuk endospora apabila hidup pada lingkungan yang ekstrim. B. megaterium banyak ditemukan dalam tanah dan di air (Madigan dan Martinko, 2005).
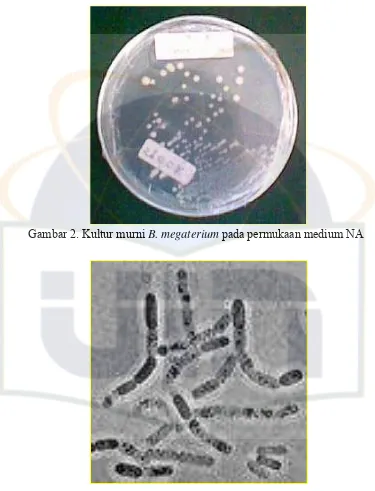
[image:25.595.110.514.191.523.2]Gambar 2. Kultur murni B. megaterium pada permukaan medium NA
Gambar 3. Bentuk Sel B. megaterium
(Sumber: http://en.wikipedia.org/wiki/Bacillus_megaterium)
2.3. Bakteri Resisten Logam Hg
ini berhubungan dengan mekanisme respon terhadap stress merkuri (Hg). Pertama, dengan cara menghambat metabolisme sel sehingga pertumbuhan sel lambat atau sel mati. Kedua, menginduksi sistem operon resisten merkuri (Hg) untuk bekerja sehingga sel tetap hidup dalam kondisi stress. Ketiga, adanya plasmid yang mengandung gen resisten merkuri (Hg) yang masuk ke dalam sel.
Bakteri yang resisten terhadap merkuri (Hg) terjadi karena bakteri resisten merkuri memiliki gen resisten merkuri (mer operon), (Silver dan Phung, 1996; De, 2004). Struktur mer operon berbeda untuk tiap jenis bakteri. Umumnya struktur mer operon terdiri dari gen metaloregulator (merR), gen transport merkuri (merT, merP, merC), gen merkuri reduktase (merA) dan organomerkuri liase (merB) (De, 2004).
De (2004) menyatakan bahwa model mekanisme resisten merkuri bakteri Gram negatif adalah sebagai berikut : Hg2+ yang masuk periplasma terikat ke pasangan residu sistem merP. Selanjutnya merP mentransfer Hg2+ ke residu sistein merT atau merC. Akhirnya ion Hg menyeberang membran sitoplasma melalui proses reaksi pertukaran ligan menuju sisi aktif flavin disulfida oksidoreduktase, merkuri reduktase (merA) mengkatalisis reduksi Hg2+ menjadi Hg0 volatil dan sedikit reaktif. Akhirnya Hg0 berdifusi di lingkungan sel untuk selanjutnya dikeluarkan dari sel.
(Smith et al., 1998). Bakteri yang memiliki kedua protein merkuri reduktase (merA) dan protein organomerkuri liase (merB) disebut dengan bakteri resisten merkuri spektrum luas (Silver dan Phung, 1996; Smith et al., 1998; De, 2004).
Dalam penggunaan mikroorganisme ada beberapa jenis bakteri yang dapat dimanfaatkan sebagai bahan untuk menyerap logam berat, di antaranya dari genus Pseudomonas, Leptotrix, Klebsiella, Citrobacter dan Bacillus (Zeroual et al., 2001 dalam De, 2004; Satchanska et al., 2005). Di antara genus bakteri tersebut hanya genus Pseudomonas dan Bacillus yang diakui paling resisten terhadap logam berat di lingkungan (Satchanska et al., 2005).
Penelitian yang dilakukan oleh Wagner-Dobler et al., (2000) menjelaskan bahwa beberapa spesies strain dari genus Pseudomonas seperti Pseudomonas putida, Pseudomonas stutzeri dan Pseudomonas fulva dapat digunakan dalam proses bioremoval logam merkuri (Hg) secara in vitro. Hal ini menegaskan bahwa beberapa genus dari Pseudomonas dapat digunakan dalam proses bioremoval untuk mereduksi beberapa senyawa logam berbahaya lainnya seperti, merkuri (Hg), kadmium (Cd) dan timbal (Cu) (Wong et al., 1993; De, 2004).
2.4. Logam Berat
Logam berat merupakan unsur-unsur kimia yang berat jenis > 5 gr/cm3, mempunyai afinitas yang tinggi terhadap unsur Sulfur (S) dan biasanya bernomor atom 22 sampai 92 dari periode 4 sampai 7, unsur-unsur ini pada sistem periodik terletak di sudut kanan bawah (Manahan, 1977). Menurut Putra dan Putra (2005) unsur logam berat memiliki sifat toksisitas pada makhluk hidup.
Logam berat merupakan komponen alami tanah dan unsur ini tidak dapat didegradasi maupun dihancurkan. Logam berat dapat masuk ke dalam tubuh manusia melalui perantara makanan, air minum atau melalui udara (Vouk, 1986). Menurut Nugroho (2001) dalam jumlah sangat kecil logam-logam berat seperti tembaga (Cu), selenium (Se) dan seng (Zn) merupakan elemen yang dibutuhkan tubuh organisme untuk membantu proses metabolisme tubuh, namun demikian logam-logam berat tersebut akan berpotensi menjadi racun (toksik) jika terdapat dalam konsentrasi tinggi terdapat didalam tubuh.
Pada beberapa dekade ini bahaya yang ditimbulkan oleh logam berat merupakan isu lingkungan yang sangat menonjol. Berbagai limbah berbahaya saat ini dihasilkan dalam kegiatan manusia dan menimbulkan masalah pada penanganannya. Hal ini terutama karena bentuk limbah bermacam-macam dan mempunyai kadar yang beragam pula (Gavrilescu, 2004).
menimbulkan pengaruh relatif lokal, tetapi apabila bentuk limbah cair atau yang dapat menguap pengaruhnya lebih luas, dan lebih sulit dicegah kontaminasinya (Badjoeri dkk., 2006).
Secara umum diketahui bahwa logam berat merupakan elemen yang berbahaya di permukaan bumi. Proses alam seperti perubahan siklus alamiah mengakibatkan batuan-batuan dan gunung berapi memberikan kontribusi yang sangat besar ke lingkungan (ATSDR, 1999). Disamping itu pula masuknya logam berat ke lingkungan berasal dari sumber-sumber lainnya, seperti pertambangan minyak, emas, batubara, pembangkit tenaga listrik, pestisida, keramik, peleburan logam, pabrik-pabrik pupuk dan kegiatan-kegiatan industri lainnya (ATSDR, 1999; Suhendrayatna, 2001).
Kontaminasi logam berat di beberapa negara Asia, telah tersebar secara meluas seperti yang dilaporkan oleh tim survey dari Asia Arsenic Network (AAN). Kontaminasi ini akan terus meningkat sejalan dengan meningkatnya usaha eksploitasi berbagai sumber alam di mana logam berat terkandung di dalamnya (Suhendrayatna, 2001).
Adanya logam berat di perairan dapat berbahaya baik secara langsung terhadap organisme maupun tidak langsung terhadap kesehatan manusia (Rai et al., 1981; Sutamihardja dkk., 1982). Hal ini berkaitan dengan sifat-sifat logam berat yaitu :
1. Sulit didegradasi, sehingga mudah terakumulasi dalam lingkungan perairan dan keberadaanya secara alami sulit terurai.
2. Dapat terakumulasi dalam organisme dan akan membahayakan kesehatan manusia yang mengkonsumsi organisme tersebut.
3. Mudah terakumulasi di sedimen, sehingga konsentrasinya selalu lebih tinggi dari konsentrasi logam dalam air. Di samping itu sedimen mudah tersuspensi oleh pergerakan massa air yang akan melarutkan kembali logam yang dikandungnya ke dalam air, sehingga sedimen menjadi sumber pencemar potensial dalam skala waktu tertentu.
baku, katalisator maupun sebagai bahan tambahan (Rai et al., 1981; Hutagalung, 1991; ATSDR, 1999).
Alasan utama logam berat menjadi bahan pencemar berbahaya karena logam berat tidak dapat didegradasi (non degradable) oleh mikroorganisme hidup di lingkungan, sehingga terakumulasi di lingkungan, terutama mengendap di dasar perairan membentuk senyawa kompleks bersama bahan organik dan anorganik secara adsorbsi dan kombinasi (Djuangsih dkk., 1982). Suhendrayatna (2001) melaporkan salah satu jenis logam berat yang merupakan polutan berbahaya adalah merkuri (Hg).
Pada dasarnya alam mempunyai mekanisme untuk mengurangi pengaruh negatif penumpukan logam berat terhadap ekosistem, melalui proses self purification (pemulihan alami), namun demikian karena terjadi akumulasi logam berat yang melebihi batas kemampuan pemulihan alami untuk memprosesnya. Hal tersebut dapat menimbulkan bahaya secara beruntun, mengingat saling ketergantungan yang terjadi antara komponen-komponen ekosistem (Nugroho, 2001). Akibat dari aktivitas manusia terjadi peningkatan mobilisasi, perpindahan dan akumulasi logam berat di lingkungan. Aktivitas industri misalnya, logam berat masuk ke atmosfer, tanah dan perairan melebihi kemampuan alamiah untuk memprosesnya. Bahan-bahan demikian dikenal sebagai bahan senobiotik atau antropogenik. Logam berat tersebut masuk ke ekosistem tanah dalam bentuk organik maupun anorganik (Badjoeri dkk., 2006).
Merkuri (Hg) merupakan senyawa pencemar terbesar dalam lingkungan pada beberapa dekade terakhir. Sejak tahun 1950 emisi merkuri ditetapkan sebagai pencemar berbahaya yang dapat mengakibatkan dampak serius terhadap kesehatan manusia dan lingkungan sekitar (USGS, 1995; Klaasen dan Watskin III, 1999). Merkuri tetap ada dalam lingkungan karena sifatnya sangat persisten baik dari bentuk merkuri organik maupun merkuri anorganik. Merkuri ditemukan dalam bijih sinabar didaerah Spanyol, Rusia, Meksiko, Kanada dan Algeria (Evanko dan Dzombak, 1997).
Logam merkuri telah ditemukan pada 714 tempat pembuangan limbah berbahaya di Amerika Serikat (ATSDR, 1999), dan diantaranya merkuri sebagai pencemar paling berbahaya. Logam merkuri (Hg) adalah salah satu trace element yang mempunyai sifat cair pada temperatur ruang dengan specific gravity dan daya hantar listrik yang tinggi. Karena sifat-sifat tersebut, merkuri banyak digunakan baik dalam kegiatan perindustrian maupun laboratorium (USGS, 1995; Budiono, 2002; NABIR, 2003).
Merkuri yang terdapat dalam limbah atau waste di perairan umum dirombak oleh mikroorganisme melalui aktivitas metabolismenya menjadi senyawa metil merkuri (CH3-Hg) yang bersifat toksik dan mempunyai daya ikat yang kuat
dapat terakumulasi pada jaringan syaraf pusat (Budiono, 2002; Klaasen dan Watskin III, 2003).
Transfer dan transformasi merkuri di perairan dapat dilakukan oleh fitoplankton, bakteri dan sea grasses (rumput laut), dimana jenis-jenis organisme tersebut relatif mendominasi badan perairan. Bakteri dapat merombak merkuri menjadi metil merkuri dan membebaskan merkuri dari air atau sedimen.
Kasus keracunan merkuri pertama kali dilaporkan terjadi di Minamata, Jepang pada tahun 1953. Sedangkan di Indonesia, kasus kontaminasi merkuri ditemukan pada sungai di Surabaya tahun 1996. Proses metilisasi merkuri biasanya terjadi di alam di bawah kondisi tertentu, membentuk satu dari sekian banyak elemen berbahaya, karena dalam bentuk ini merkuri sangat mudah terakumulasi pada rantai makanan (Suhendrayatna, 2001; Setyorini, 2003).
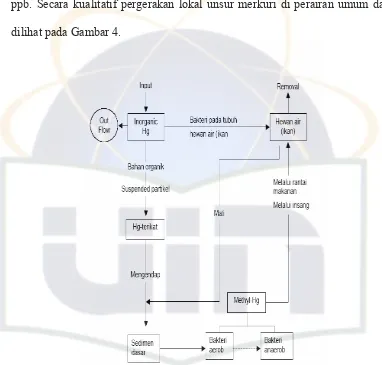
Menurut OECD (1974) dalam Budiono (2002), pencemaran merkuri di perairan akibat kegiatan alam mempunyai kisaran antara 0,00001 sampai 0,0028 mg/L, kecuali pada beberapa tempat seperti sungai-sungai di Italia dimana terdapat sumber endapan logam merkuri alamiah, kadarnya dapat mencapai 136 ppb. Secara kualitatif pergerakan lokal unsur merkuri di perairan umum dapat dilihat pada Gambar 4.
Gambar 4. Pergerakan Lokal Unsur Merkuri di Perairan Umum (Gavis dan Ferguson, 1972 dalam Budiono, 2002)
2.5. Sungai Cisadane
Bogor dan bermuara ke Laut Jawa. Panjang sungai sekitar 80 km dengan daerah tangkapan seluas 1.100 km2. Pada saat ini Sungai Cisadane merupakan sumber air yang diandalkan untuk memenuhi kebutuhan air bagi industri, irigasi dan air minum di wilayah ini (Badjoeri dkk., 2006).
Dalam 2 dasawarsa terakhir ini kasus pencemaran merkuri (Hg) ditemukan di berbagai wilayah perairan di Indonesia, seperti di perairan Teluk Buyat dan Teluk Manado di Sulawesi Utara terutama, di Sungai Kapuas dan Kahayan di Kalimantan, di Sungai Citarum dan Cisadane (daerah Pongkor) di Jawa Barat, Pantai Kenjeran di Surabaya, sungai-sungai yang melintasi DKI Jakarta hingga Teluk Jakarta, dan beberapa perairan di Sumatera Barat dan Jambi (Setyorini, 2003).
Sungai Cisadane diketahui telah tercemar oleh logam berat seperti Cu, Pb, Cd dan Hg. Pencemaran di Sungai Cisadane selain disebabkan oleh buangan limbah domestik juga oleh limbah cair industri sebanyak 60.483 m3/hari dari 63 industri yang berada disepanjang Sungai Cisadane. Hasil analisa ditemukan konsentrasi Hg mencapai 0,007 mg/L. Konsentrasi Hg ini sudah melampaui batas ketentuan baku mutu air golongan B (Djarismawati, 1991).
Mn) terutama Pb mencapai 441,15 dan 956 ng/L di C21 (Kecamatan Kelor, Tangerang) dan total logam Hg terlarut menunjukkan peningkatan di tahun 2004.
Gambar 5. Salah Satu Ruas Bagian Hilir Sungai Cisadane Sebagai Lokasi Eksplorasi Bakteri Agen Bioremoval Logam Berat
hilir sebesar 122,671 ng/g sampai 617,706 ng/g (Purwati dkk., 2003 dalam Badjoeri dkk., 2006). Pencemaran logam berat merkuri (Hg) di hilir Sungai Cisadane cukup tinggi yaitu sekitar 0,004 – 0,184 µg/L pada bulan April dan sekitar 0,737 – 2,026 µg/L pada bulan Juli, namun belum melampaui batas ambang baku mutu air untuk golongan IV (5 µg/L) (Badjoeri dkk., 2006).
2.6. Bioremoval atau Biosorpsi Logam Berat
Bioremoval didefinisikan sebagai terkonsentrasi dan terakumulasinya bahan pencemar dari suatu cairan dalam tubuh mikroorganisme atau material biologi (Suhendrayatna, 2001). Sedangkan Putra dan Putra (2005), mengartikan bioremoval sebagai terkonsentrasi dan terakumulasinya bahan penyebab polusi atau polutan dalam suatu perairan oleh material biologi, dimana material biologi tersebut dapat me-recovery polutan sehingga dapat dibuang dan ramah terhadap lingkungan.
Berdasarkan kemampuan bakteri untuk membentuk ikatan antara logam berat dengan selnya maka biosorpsi merupakan kemampuan material biologi untuk mengakumulasikan logam berat melalui proses metabolisme. Proses biosorpsi ini dapat terjadi karena adanya material biologi (biosorben) dan adanya larutan yang mengandung logam berat sehingga mudah terikat pada biosorben (Cossich et al., 2002).
bioremoval logam berat oleh mikrooganisme adalah proses pertukaran ion yang dirumuskan sebagai berikut:
Mekanisme pertukaran ion ini dibagi atas 3 cara yakni berdasarkan : 1. Metabolisme sel
• proses yang bergantung pada metabolisme
• proses yang tidak bergantung pada metabolisme sel). 2. Posisi logam berat di-remove, dapat dibagi atas;
• akumulasi ekstraseluler (presipitasi), • akumulasi intraseluler dan
• penyerapan oleh permukaan sel.
3. Absorbsi logam berat (proses biosorpsi): melalui proses passive uptake dan active uptake (Nakajama dan Sakaguchi, 1998; Cossich et al., 2002).
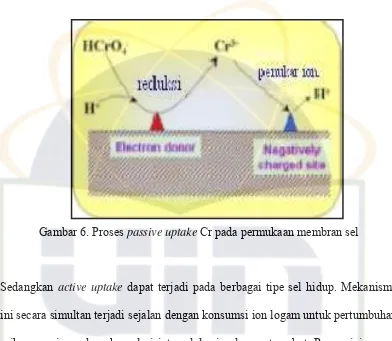
Passive uptake adalah proses yang terjadi ketika ion logam berat terikat pada dinding sel biosorben. Mekanisme passive uptake dapat dilakukan dengan dua cara, pertama dengan cara pertukaran ion di mana ion pada dinding sel digantikan oleh ion-ion logam berat; dan kedua adalah pembentukan senyawa kompleks antara ion-ion logam berat dengan gugus fungsional seperti karbonil, amino, tiol, hidroksi, posfat dan hidroksi-karboksil secara bolak balik dan cepat (Suhendrayatna, 2001; Ahalya et al., 2004). Sebagai contoh adalah pada Sargassum sp. dan Eklonia sp. di mana Cr4+ mengalami reaksi reduksi pada pH rendah menjadi Cr3+ dan Cr3+ di-remove melalui proses pertukaran kation (Gambar 6).
Gambar 6. Proses passive uptake Cr pada permukaan membran sel
BAB III
METODOLOGI PENELITIAN
3.1. Lokasi dan Waktu Penelitian
Penelitian dilaksanakan pada bulan Juli - Oktober 2007 di Laboratorium Mikrobiota dan Laboratorium Hidrokimia Pusat Penelitian Limnologi LIPI Cibinong.
3.2. Bahan dan Alat
Bahan yang digunakan adalah isolat bakteri Bacillus megaterium asal Sungai Cisadane yang diperoleh dari hasil isolasi dan telah diidentifikasi pada kegiatan penelitian sebelumnya di Laboratorium Mikrobiota Pusat Penelitian Limnologi LIPI Cibinong. Media bakteri Nutrient Agar (NA) dan Nutrient Broth (NB), akuades steril, air demin, alkohol 70%, sediaan Hg stok 1000 mg/L, H2SO4
pekat, HNO3 pekat, KMnO4 5%, KperSulfat 5%, hidroksilamin klorida 10%, dan
SnCl210%.
(Nuova), shaker, pompa vakum, timbangan analitik elektrik, autoklaf, inkubator, botol sampel steril, spektrofotometer DR/2010 dan Atomic Absorption Spectrophotometry (AAS) Hiranuma Hg-310 Mercury Analyzer.
3.3. Prinsip Percobaan
Penelitian ini merupakan studi eksperimental dengan objek isolat bakteri Bacillus megaterium. Isolat B. megaterium dengan kemampuan metabolisme yang dimilikinya akan diuji kemampuannya dalam menyerap logam berat Hg dengan konsentrasi yang berbeda (10, 15 dan 20 mg/L) dalam media secara triplo dan dibandingkan dengan kontrol masing-masing perlakuan.
3.4. Metode Kerja
3.4.1. Persiapan Isolat Bakteri B. megaterium
Peremajaan isolat bakteri B. megaterium dilakukan dengan menggunakan media Nutrient Agar. Isolat diambil sebanyak satu ose, kemudian digores pada media NA dalam cawan petri dan diinkubasi selama 24-48 jam pada suhu 28˚C. Pemurnian bakteri dilakukan sampai didapat koloni yang terpisah. Hasil pemurnian diinokulasi ke dalam beberapa media NA pada tabung miring, berfungsi sebagai working culture dan stock culture.
3.4.2. Persiapan Media
sambil diaduk sampai homogen. Media NB dibuat dengan cara yang sama namun tanpa agar, kemudian media disterilisasi di dalam autoklaf selama 15 menit pada suhu 121o C, tekanan 1 atm.
3.4.3. Persiapan Sediaan Larutan Logam Hg
Sediaan larutan logam Hg (murni) dengan konsentrasi 1000 mg/L dikonversi menjadi 10 mg/L, 15 mg/L dan 20 mg/L dengan teknik pengenceran. Untuk mendapatkan volume logam yang harus dimasukkan ke dalam media NB dalam Erlenmeyer 200 ml sampai mencapai volume total sebesar 40 ml dengan menggunakan rumus persamaan :
V1 = Volume total media dalam Erlenmeyer (40 ml) V2 = Volume larutan logam Hg yang akan digunakan (ml) N1 = Konsentrasi logam Hg yang ditentukan (mg/L) N2 = Konsentrasi logam Hg yang digunakan (1000 mg/L) Perlakuan 1 (Logam 10 mg/L)
V1 . N1 = V2 . N2 40 x 10 = V2 x 1000
V2 = 40 x 10 = 0,4 ml larutan logam sediaan 1000 mg/L 1000
Perlakuan 2 (Logam 15 mg/L)
V1 . N1 = V2 . N2 40 x 3 = V2 x 1000
V2 = 40 x 15 = 0,6 ml larutan logam sediaan 1000 mg/L 1000
Perlakuan 3 (Logam 20 mg/L)
V1 . N1 = V2 . N2 40 x 3 = V2 x 1000
V2 = 40 x 20= 0,8 ml larutan logam sediaan 1000 mg/L 1000
(Tabel 1).
Tabel 1. Perlakuan Pemberian Kultur Inokulum dan Sediaan (Volume total = 40 ml)
Perlakuan
Volume Kultur Inokulum Bakteri
yang diberikan
Volume Larutan Logam Hg (Sediaan)
1 (10mg/L) 4 ml 0,4 ml
2 (15 mg/L) 4 ml 0,6 ml
3 (20 mg/L) 4 ml 0,8 ml
Kontrol
Media NB yang ditambahkan larutan logam Hg sesuai masing-masing perlakuan, tanpa inokulum bakteri
3.4.4. Pembuatan Kurva Tumbuh Isolat Bakteri B. megaterium
Sebanyak satu ose isolat bakteri B. megaterium dalam agar miring (working culture) diinokulasi ke dalam 50 ml media NB steril dalam Erlenmeyer, lalu dihomogenkan dengan dikocok dan diinkubasi dalam suhu ruang selama 24 jam dengan shaker berkecepatan 100 rpm. Selanjutnya kultur tersebut dimasukkan sebanyak 20 ml ke dalam 180 ml NB steril kemudian diukur nilai OD (Optical Density) sel-selnya dengan panjang gelombang 600 nm menggunakan spektrofotometer. Selain itu, jumlah selnya dihitung dengan metode TPC (Total Plate Count) menggunakan spread plate dengan batang L pada cawan petri secara triplo untuk mengetahui jumlah sel per koloni/ml pada jam ke 0, 4, 8, 12, 16, 20 dan 24. Skema pembuatan pola tumbuh bakteri ditampilkan pada Lampiran 2.
yang dapat menunjukkan kecepatan pertumbuhan sel tertinggi persatuan waktu (jam) dengan menggunakan rumus kecepatan pertumbuhan (µ) (Fardiaz, 1988):
N0 = jumlah sel awal/ ml
N = jumlah sel/ml setelah waktu t t0 = waktu awal
t = waktu akhir
3.4.5. Persiapan Kultur Inokulum
Sebanyak satu ose isolat Bakteri B. megaterium berumur 24 jam dalam agar miring (working culture) diinokulasi ke dalam 50 ml media NB steril dalam Erlenmeyer, lalu dihomogenkan dengan dikocok dan dinkubasi selama 24 jam dengan shaker berkecepatan 100 rpm.
Sebanyak 20 ml inokulum tadi (10% dari volume total media) di masukkan ke dalam Erlenmeyer yang berisi media NB sehingga menjadi 200 ml, lalu diinkubasi selama “tx” terbaik atau sampai waktu saat kecepatan pertumbuhan sel bakteri tertinggi dengan shaker berkecepatan 100 rpm. Untuk selanjutnya kultur cair ini digunakan sebagai biang inokulum.
3.4.6. Uji Kemampuan Biosorpsi oleh Isolat Bakteri B. megaterium
Inokulum isolat bakteri diinokulasi ke dalam media steril NB yang berisi logam Hg dengan konsentrasi perlakuan 10, 15 dan 20 mg/L. Volume inokulum bakteri (inokulum biang) yang dimasukkan ke dalam setiap Erlenmeyer adalah
1/10 (10%) dari volume total media yang telah ditentukan (40 ml), jadi volume inokulum bakteri yang dimasukkan ke dalam tiap Erlenmeyer adalah: 1/10 x 40ml = 4 ml, dengan suhu ruang, shaker berkecepatan 100 rpm dengan waktu inkubasi setelah bakteri diinokulasikan ke dalam media perlakuan adalah setelah tercapai fase kematian. Kemudian kultur diukur konsentrasi logam Hg yang tersisa, sehingga dapat diketahui kemampuan biosorpsinya melalui konsentrasi logam Hg yang terserap.
3.4.7. Pengukuran Biosorpsi Logam Hg oleh Isolat B. megaterium
Sampel disaring dengan kertas saring Whattman menggunakan pompa vakum untuk mendapatkan filtrat sampai volume ±10 ml dalam tabung reaksi bertutup ulir, kemudian cairan filtrat dari setiap perlakuan tersebut ditambahkan 2 tetes HNO3 pekat dan siap untuk dianalisa logamnya pada AAS.
Filtrat yang diperoleh dari hasil pemisahan biomassa isolat diukur konsentrasi logam Hg-nya untuk mengetahui konsentrasi logam Hg yang tidak terserap oleh B. megaterium (yang tersisa di dalam media). Perbedaan konsentrasi logam awal dengan konsentrasi akhir merupakan konsentrasi logam Hg yang terserap oleh B. megaterium (Hancock, 1996).
Pengukuran logam berat Hg pada sampel tersebut dilakukan menggunakan Atomic Absorption Spectrophothometry (AAS) dengan nyala udara asetilen pada panjang gelombang 253,7 nm. Pengukuran konsentrasi logam Hg dilakukan setelah sampel diinkubasi sampai fase kematian.
tersebut diukur konsentrasinya pada instrumen AAS Hiranuma Hg-310 Mercury Analyzer dilakukan proses digest (Lampiran 4), dan dilution (pengenceran). Proses dilution dilakukan agar memungkinkan sampel dapat diukur dalam orde nano gram/L, dilution dilakukan dengan menggunakan automatic micropipette eppendorf 10-100 µg/L dan automatic macropipette Socorex 0-5 mL.
Dengan demikian karena sangat sensitif maka proses pemanasan yang terlalu lama (konvensional dengan hot plate ± 2 jam pada 95 ºC) akan menyebabkan hilangnya Hg yang telah didisain hanya dalam konsentrasi orde nano gram/L yaitu 0 s/d 20 nano gram/L) oleh karena itu, dilakukan modifikasi metode seperti yang disarankan Csuros dan Csuros (2002) dengan menggunakan autoklaf dengan waktu pemanasan 30 menit.
Rumus jumlah logam Hg yang terserap (biosorpsi) :
Co = konsentrasi awal logam Hg dalam larutan (mg/L) Ceq = konsentrasi akhir logam Hg dalam larutan (mg/L) Cb = jumlah logam Hg yang terserap (mg/L)
3.4.8. Pengukuran Efisiensi Biosorpsi Logam Hg oleh Isolat B. megaterium
Setelah mengetahui konsentrasi logam Hg yang tidak terserap oleh B. megaterium (yang tersisa di media perlakuan) dan konsentrasi akhir logam Hg dalam media kontrol maka dilakukan pengukuran efisiensi biosorpsi oleh bakteri (Joshi, 2003) :
CeqK = konsentrasi akhir logam Hg dalam media kontrol (mg/L) CbP = jumlah logam Hg yang tidak terserap pada perlakuan (mg/L)
Cb = Co - Ceq
3.5. Analisa Data
Data yang diperoleh pada penelitian, dianalisa secara statistik menggunakan program SPSS 11.5 dengan cara sebagai berikut :
1. Data hasil pengukuran diolah dengan metode Analisa Sidik Ragam dari Rancangan Acak Lengkap untuk mengetahui perbedaan diantara perlakuan dengan taraf uji α = 0,05. Perlakuan yang dianalisa adalah konsentrasi Hg 10 mg/L, 15 mg/L dan 20 mg/L Hg. Kontrol yang digunakan adalah media tanpa Hg. Jika hasilnya berbeda nyata atau sangat nyata, maka dilakukan uji Duncan (Gomez dan Gomez, 1984). H0 = Tidak ada perbedaan yang nyata pada efisiensi biosorpsi di antara
keempat perlakuan yang diberikan.
H1 = Ada perbedaan yang nyata pada efisiensi biosorpsi di antara keempat
[image:48.595.110.515.172.581.2]perlakuan yang diberikan.
Tabel 2. Analisa Sidik Ragam (RAL)
Keragaman Jumlah
Kuadrat db
Rata-rata
Kuadrat F Sig. Perlakuan
Ulangan Galat Total
Dasar penentuan keputusan dilakukan jika :
a. Nilai Fhitung > Ftabel atau nilai probabilitas (sig) < 0,05 = tidak signifikan,
maka H0 diterima.
b. Nilai Fhitung < Ftabel atau nilai probabilitas (sig) > 0,05 = signifikan, maka
BAB IV
HASIL DAN PEMBAHASAN
4.1. Pengamatan Pola Tumbuh Isolat Bakteri B. Megaterium
Hasil pengamatan pola pertumbuhan bakteri B. megaterium dapat dilihat pada Gambar 7. Pada awal inkubasi (0 - 8 jam) bakteri memperlihatkan kenaikan pertumbuhan yang relatif lambat (2,15 x 106 cfu/ml sampai 2,87 x 107 cfu/ml), hal ini dikarenakan bakteri masih dalam fase lag di mana pertumbuhan bakteri sangat lambat. Populasi sel bakteri meningkat tajam pada jam ke-8 sampai jam ke-12 inkubasi. Pertumbuhan sel tertinggi terjadi pada jam ke-12 inkubasi, yaitu mencapai 1,73 x 109 cfu/ml dan pertumbuhan sel mengalami penurunan setelah inkubasi melampaui 12 jam.
Pada penelitian ini fase stasioner pertumbuhan bakteri tidak teramati, karena setelah 12 jam inkubasi pertumbuhan sel bakteri sudah menurun tajam, sedangkan interval sampling adalah 4 jam, namun jika interval sampling dalam pengamatan ini dipersempit maka kemungkinan fase stasioner pertumbuhan bakteri akan dapat diamati.
Gambar 7. Pola Tumbuh Bakteri B. megaterium Selama 24 Jam
Kecepatan pertumbuhan sejak awal inkubasi sampai puncak pertumbuhan dapat dilihat pada Tabel 3. Berdasarkan pola pertumbuhan pada Gambar 7. dan kecepatan pertumbuhan sel bakteri (Tabel 3), inokulum untuk perlakuan selanjutnya digunakan kultur yang berumur 8 jam. Kultur yang berumur 8 jam merupakan kultur yang sedang memasuki fase logaritmik pertumbuhan dan durasinya sampai jam ke-12 merupakan fase pertumbuhan tercepat (µ= 3,102 / jam). Hal ini didukung oleh pernyataan Volk dan Wheeler (1993), bakteri aktif melakukan pembelahan sel secara cepat pada fase logaritmik (fase log).
Tabel 3. Kecepatan Pertumbuhan Sel Bakteri
Waktu Inkubasi (Jam) Kecepatan Pertumbuhan Sel Bakteri (µ)
0 - 4 2,564 / Jam
4 - 8 0,048 / Jam
0,215 2,79 2,87 23,1 2,38 2,35 173 0 50 100 150 200
0 4 8 12 16 20 24
Lama Inkubasi (Jam)
[image:51.595.104.517.653.737.2]8 - 12 3,102 / Jam
[image:52.595.112.506.288.642.2]Pertumbuhan populasi bakteri B. megaterium pada fase log (inkubasi pada 0 – 12 jam) dengan kerapatan optik (Optical Density, OD) sel-selnya menunjukkan kecenderungan berkorelasi positif (y = 0,0992e 6,2304x; R2 = 0,8659; r = 0,9305) (Gambar 8). Hal ini didasari oleh hasil analisa statistik dengan korelasi Pearson, yaitu terdapat hubungan korelasi antara pertumbuhan populasi bakteri dengan OD sel-selnya (Lampiran 6.2a). Hal ini berarti semakin tinggi jumlah populasi bakteri maka nilai OD sel-selnya semakin besar selama inkubasi 12 jam. Dengan demikian pembuatan inokulum untuk pengujian dapat menggunakan hasil pengukuran OD pada umur kultur dengan kecepatan pertumbuhan tertinggi (8-12 jam).
Gambar 8. Korelasi antara Populasi Bakteri dengan Kerapatan Optik (OD) Bacillus megaterium pada Fase Log (inkubasi 0 sampai 12 jam)
173
0,215 2,79 2,87
y = 0,0992e6,2304x
R2 = 0,8659 r = 0,9305
0 50 100 150 200
0 0,2 0,4 0,6 0,8 1 1,2
OD 600 nm
P opu la si b a kt e ri x 1 0
7 (c
fu
/m
l)
Pertumbuhan B. megaterium selama 24 jam inkubasi memperlihatkan kecenderungan pola eksponensial (y = 0.1038e5.2414x; R2 = 0.6815; r = 0,825), (Gambar 9).
Gambar 9. Korelasi antara Populasi Bakteri dengan Kerapatan Optik (OD) Bacillus megaterium secara keseluruhan (inkubasi 0 sampai 24 jam)
Data tersebut memperlihatkan bahwa pertumbuhan populasi bakteri sejak 0 sampai 12 jam inkubasi meningkat dan setelah memasuki lebih dari 12 jam inkubasi pertumbuhannya menurun, begitu pula dengan nilai OD sel-selnya. Hal tersebut juga berarti bahwa antara pertambahan jumlah populasi bakteri sejalan dengan nilai OD sel-selnya. Berdasarkan analisa statistik antara pertumbuhan populasi bakteri dengan OD sel-selnya selama 24 jam berkorelasi positif (Lampiran 6.2b).
Pola pertumbuhan bakteri seperti ini sesuai dengan penelitian yang dilakukan oleh Sulaksono dkk., (2002) yang mengamati pola pertumbuhan bakteri Bacillus coagulans dan Bacillus sphaericus dengan OD pada panjang gelombang
173 0,215 2,79 23,1 2,38 2,35 2,87 y = 0,1038e5,2414x
R2 = 0,6815 r = 0,825
0 20 40 60 80 100 120 140 160 180 200
0 0,2 0,4 0,6 0,8 1 1,2
OD (600 nm)
P op ul a si ba kt e ri x 10
7 (
c
fu
/m
l)
600 nm. Pertumbuhan maksimum populasi B. coagulans dan B. sphaericus terjadi sekitar 7 – 8 jam inkubasi dan setelah > 8 jam pertumbuhan populasinya menurun. Sementara itu, penelitian yang dilakukan oleh Muis (2006) yang menggunakan B. subtilis, pola pertumbuhannya telah memasuki fase log dan maksimum setelah diinkubasi selama 8 – 10 jam. Dengan demikian umumnya diketahui pola pertumbuhan dari Bacillus sp. setelah diinkubasi selama 7 – 10 jam telah mencapai maksimum.
4.2. Biosorpsi Logam Hg oleh Isolat Bakteri B. megaterium
Hasil penelitian menunjukkan bahwa isolat bakteri B. megaterium mampu menyerap logam Hg sehingga menurunkan konsentrasi logam merkuri (Hg) didalam semua media perlakuan (Gambar 10). Hasil uji kemampuan bakteri menyerap logam Hg juga menunjukkan efisiensi yang sangat baik, yaitu mencapai 99,58% (Gambar 11).
Gambar 10. Penurunan Konsentrasi Hg oleh Bakteri B. megaterium Keterangan : 1 = Perlakuan 10 mg/L Hg ; 2 = Perlakuan 15 mg/L Hg ;
3 = Perlakuan 20 mg/L Hg
1.1265; 0.017654 (3)
1.1044; 0.009561
(2)
1.0855; 0.004535 (1)
y = 0,3552Ln(x) - 0,025
R
2= 0,9911
0,004
0,006
0,008
0,01
0,012
0,014
0,016
0,018
1,08
1,1
1,12
1,14
Konsentrasi Hg Sebelum ditambahkan Bakteri (mg/L)
K o n se n tr a si H g S e te la h d it a m ba h ka n B a kt e ri ( m g/ L ) 99,13% (2) 99,58% (1) 98,43% (3)
98,2%
98,4%
98,6%
98,8%
99,0%
99,2%
99,4%
99,6%
99,8%
1,0855
1,0955
1,1055
1,1155
1,1255
Gambar 11. Efisiensi Penurunan Konsentrasi Hg oleh Bakteri B. megaterium Keterangan : 1 = Perlakuan 10 mg/L Hg ; 2 = Perlakuan 15 mg/L Hg ;
3 = Perlakuan 20 mg/L Hg
Ada beberapa peraturan yang dapat dijadikan acuan mengenai standar logam berat Hg dalam perairan. Berdasarkan Keputusan Menteri Lingkungan Hidup (KepMen LH) No. 51 tahun 1995 Lampiran C, standar baku mutu limbah cair yang mengandung Hg adalah 0,002 - 0,01 mg/L. Menurut SNI (Standar Nasional Indonesia) dalam Draft Final TKSDA (SNI M-31-1990-03) standar baku mutu kualitas air limbah di perairan adalah 0,0006 – 0,015 mg/L. Dengan demikian, mengacu pada kedua peraturan tersebut, isolat B. megaterium berpotensi untuk diterapkan pada instalasi pengolah air limbah industri atau air limbah dengan tingkat cemaran merkuri yang lebih tinggi atau melebihi standar-standar tersebut.
Proses biosorpsi logam Hg pada bakteri bisa berjalan karena bakteri mempunyai sifat resistensi terhadap Hg.. Resistensi mikroorganisme terhadap logam Hg anorganik dikarenakan bakteri resisten merkuri memiliki gen resisten merkuri, mer operon (Silver dan Phung, 1996; De, 2004). Meskipun belum diperiksa, isolat bakteri B. megaterium yang digunakan dalam penelitian ini memiliki gen tersebut yang menyebabkannya resisten terhadap Hg.
ion logam untuk pertumbuhan (metabolisme) mikroorganisme dan akumulasi intraselular ion logam tersebut (Nakajama dan Sakaguchi, 1998; Cossich et al., 2002).
Kemampuan bakteri B. megaterium sebagai penyerap logam berat di perairan didukung oleh hasil penelitian lain. Cheung dan Dong-Gu (2005) mengisolasi bakteri B. megaterium strain TKW3 dari sedimen permukaan air laut yang terkontaminasi berbagai jenis logam berat. B. megaterium strain TKW3 dapat mereduksi logam berat seperti Cr dan resisten terhadap logam krom (Cr), selenium (Se) dan arsen (As) secara in vitro.
Pada penelitian ini ditemukan adanya kemampuan media (bahan organik) mengikat senyawa logam Hg. Hal ini menyebabkan konsentrasi logam Hg yang dimasukkan ke dalam media uji menjadi menurun, sehingga konsentrasi Hg pada media kontrol yang semula mengandung Hg 10 mg/L menjadi 1,0855 mg/L, media kontrol Hg 15 mg/L menjadi 1,1044 mg/L dan media kontrol Hg 20 mg/L menjadi 1,1265 mg/L (Lampiran 5.2).
Logam Hg merupakan trace element di alam yang dapat berikatan dengan dengan senyawa S-organik atau N-organik pada konsentrasi tertentu (Sigg, 1994 dalam Buffle dan De Vitre, 1994). Menurut Zumstein dan Buffle (1989), logam Hg termasuk toxic metal group III yang apabila terdapat di kolom air mempunyai kecenderungan yang kuat untuk berikatan dengan senyawa protein dan menjadi partikel yang mengendap.
Setelah media ditambahkan bakteri dan diinkubasi selama 24 jam, terlihat isolat bakteri B. megaterium mampu menurunkan konsentrasi Hg dalam media (yang konsentrasi Hg-nya telah menurun karena adanya pengikatan oleh bahan organik dalam media) dengan sangat baik, yaitu mencapai lebih dari 98% (98,43-99,58%). Hasil analisa tersebut menunjukkan bahwa bakteri isolat B. megaterium yang merupakan bakteri indigenous asal Hilir Sungai Cisadane mempunyai kemampuan menyerap logam Hg dan beradaptasi terhadap kondisi lingkungan tercemar logam Hg.
Gaudy dan Gaudy (1981) menyatakan bakteri yang telah lama hidup di lingkungan tercemar logam berat, maka bakteri tersebut akan mampu beradaptasi terhadap cemaran logam, bahkan bakteri menjadi resisten terhadap logam tersebut. Selain itu penelitian ini didasari oleh hasil percobaan yang telah dilakukan sebelumnya (Zarkasyi, 2007) di mana isolat bakteri B. megaterium hasil isolasi dari hilir Sungai Cisadane mempunyai daya adaptasi yang relatif tinggi dan daya resistensi karena mampu hidup atau berkembang pada media yang mengandung logam Hg sampai konsentrasi 10 mg/L.
BAB V
KESIMPULAN DAN SARAN
5. 1. Kesimpulan
Kesimpulan yang dapat diambil berdasarkan hasil penelitian ini adalah : 1. Inokulum untuk perlakuan digunakan kultur yang berumur 8 jam, yaitu
kultur yang sedang memasuki fase logaritmik pertumbuhannya dengan kecepatan pertumbuhan tertinggi sampai jam ke-12 (µ= 3,102 / jam). 2. Isolat B. megaterium memiliki kemampuan menyerap logam Hg dalam
semua media perlakuan, yaitu pada konsentrasi Hg 10, 15 dan 20 mg/L dengan efisiensi berturut-turut sebesar 99,58, 99,13 dan 99,58%. Tingginya biosorpsi (>98%) menunjukkan potensi biosorpsi logam Hg isolat ini dalam media dengan konsentrasi Hg lebih dari 20 mg/L.
5. 2. Saran
bioremoval logam berat, khususnya untuk mengembangkan instalasi pengolah limbah pada perairan tercemar logam.
DAFTAR PUSTAKA
Ahalya, N., T.V., Ramachandra. and R.D., Kanamadi. 2004. Biosorption of Heavy Metals. Centre for Ecological Sciences. Indian Institute of Science. Bangalore, India.
Asmara, W. 1996. Bioakumulasi Metal Berat pada Mikroorganisme. In Symposium and Workshop Heavy Metal Bioaccumulation. IUC Biotechnology, Gadjah Mada University, Yogyakarta.
Atlas, R. M. and R. Bartha. 1993. Microbial Ecology. Fundamentals and Applications. 3 rd (Ed.). The Benjamin and Cummings Publishing Co. Inc, Redwood. 563 pp.
ATSDR (Agency for Toxic Substances and Disease Registry). 1999.
http://www.atsdr.cdc.gov. 27 Desember 2007. pkl. 19.40 WIB.
Bachofen, R. 1994. Cell Structure and Metabolism, and its Relation with the Environment. In Chemical and Biological Regulation of Aquatic Systems. J, Buffle. De Vitre.R.R. Lewis Publishers, Tokyo. p 231-233. Badjoeri, M. 2007. Hasil Identifikasi Bakteri Isolat AS1.3a. Pusat Penelitian
Limnologi-LIPI Cibinong, Bogor. belum dipublikasikan.
Badjoeri, M, S. Larashati, M.S. Syawal, Awalina, Sugiarti dan V. Indarwati. 2006. Kajian Potensi Bakteri Indigenous Sebagai Agen Bioremoval Senyawa Logam Pada Sistem Perairan Sungai Cisadane. Laporan Hasil Penelitian. Pusat Penelitian Limnologi-LIPI, Cibinong, Bogor.
Bourquin, A. W. 1990. Bioremediation of Hadzarous Waste Biofutur. p 24 – 35. BPPT. 2005. Air Bersih Bebas Bakteri dan Zat Kimia. Badan Pengkajian dan
Penerapan Teknologi (BPPT). http://www.bppt.go.id/. 24 Juni 2007. pkl. 20.15 WIB.
Brock, T.D and M.T. Mandigan. 1991. Biology of Microorganism (6th Ed). Prentice-Hall International Inc, New Jersey.
Buffle, J. and W. Stumm. 1994. General Chemistry of Aquatic Systems. In Chemical and Biological Regulation of Aquatic Systems. J, Buffle. De Vitre.R.R. Lewis Publishers, Tokyo. p 1-10.
Cappucino, J.G and Sherman, N. 1996. Microbiology : A Laboratory Manual. Fourth Edition. The Benjamin and Cumming Publishing Company Inc, California.
Cheung, K.H. and Ji-Dong Gu. 2005. Chromate Reduction by Bacillus megaterium TKW 3 Isolated From Marine Sediments.World Journal of Microbiology and Biotechnology. 21 (3) : 213-219.
Cossich, E. S., C.R.G. Tavares and T.M.K. Ravagnani. 2002. Biosorption of chromium(III) by Sargassum sp. Biomass. 5 (2).
Csuros, M. and Csuros, C. 2002 Cold Vapour AAS for Solid and Semi Solids. In Environmental Sampling and Analysis for Metals. Lewis Publishers, Tokyo. p 149.
De, Jaysankar. 2004. Mercury-resistant Marine Bacteria and Their Role in Bioremediation of Certain Toxicants. Thesis. National Institute of Oceanography Goa University, India.
Djarismawati. 1991. Tinjauan Penelitian Kadar Logam Berat pada Sungai di DKI Jakarta. Cermin Dunia Kedokteran. 70: 5-9.
Djuangsih, N., A.K. Benito, H. Salim. 1982. Aspek Toksikologi Lingkungan, Laporan Analisis Dampak Lingkungan. Lembaga Ekologi Universitas Padjadjaran, Bandung.
Evanko, C. R., and Dzombak D. A. 1997. Remediation of Metals-Contaminated Soil and Groundwater. GWRTAC. http://www.gwrtac.org. 14 Desember 2007. Pkl. 19.07 WIB.
Fardiaz, S. 1988. Fisiologi Fermentasi. Pusat Antar Universitas IPB. Bogor. p 23-24.
Gadd, G. M. 1992. Metal Tolerance. In Microbial Control Pollution. Fry, J. C., Gadd, G. M., Herbert, R. A., Jones, R. W. and Watson-Craik, I. A. (Eds). Society for General Microbiology Symposium Cambridge University Press, UK.
Gaudy, A. F. and E. T. Gaudy. 1981. Microbiology for Environmental Scientist and Engineers. International Student Edition, McGraw-Hill International Book Company, Auckland. p 176-195.
Gomez, K. A. and Gomez, A. A. 1984. Statistical Procedures for Agricultural Research. John Willey & Sons Inc. New York.
Hancock, J. C. 1996. Mechanism of Passive Sorption of Heavy Metal by Biomassa and Biologycal Product. dalam Symposium and Workshop an Heavy Metal Bioaccumulation. Prosiding IUC Biotehnology UGM. Yogyakarta.
Holt, G. J., N. R. Krieg., P. H. A. Snealth, J. T. Staley, S. T. Williams. 1994. Bergey’s Manual of Determinative Bacteriology (9th. Ed.). Williams and Wilkins. Baltimore. p 559 – 561.
Hutagalung, H. P. 1991. Pencemaran Laut oleh Logam Berat dalam Status Pencemaran Laut di Indonesia dan Teknik Pemantauan. Pusat Penelitian dan Pengembangan Oseanologi-LIPI, Jakarta.
Joshi, N. 2003. Biosorption of Heavy Metals. Thesis. Department of Biotechnology and Environmental Sciences. Thapar Institute of
Engineering Technology. Patiala.
http://www.dspace.tiet.ac.in:bitstream/123456789/280/1/91860.pdf. 27 Desember 2007. pkl. 21.35 WIB.
Keputusan Menteri Lingkungan Hidup No. 51 tahun 1995 Standar Baku Mutu Limbah Cair. Lampiran C.
Klaassen, C. D. and J. B. Watkins III. 2003. Absorption, Distribution, and Excretion of Toxicants. Essentials of Toxicology.
Madigan, M. and Martinko, J. 2005. Brock Biology of Microorganisms (11th Ed), Prentice Hall.
Manahan, S.E. 1977. Environmental Chemistry (2nd Ed.). Williand Press. Boston. Muis, A. 2006. Biomass Production and Formulation of Bacillus subtilis for
Biological Control. Indonesian Journal of Agricultural Science. 7 (21) : 51-56.
Nakajama A., and Sakaguchi T. 1998. Advances in Biosorpstion of Heavy-Metals. Trends in Biotechnology. 16 : 291-300.
Natural and Accelerated Bioremediation Research (NABIR) Program. 2003. Office of Biological and Environmental Research, Office of Science, U.S. Department of Energy. What is Bioremediation. 9 pp.
Nordberg, J.F. 1986. Factor Influencing Effect and Doses Respons Relation of Metal. dalam Vouck. 1986. General Chemistry of Metal. Elsivier. New York.
Nugroho. 2001. Ekologi Mikroba pada Tanah Terkontaminasi Logam. Institut Pertanian Bogor, Bogor. pp 13.
Pelczar, Jr. M.J. dan E.C.S. Chan. 1986. Dasar-Dasar Mikrobiologi, alih bahasa Ratna SH, dkk. Penerbit UI Press, Jakarta.
Peraturan Pemerintah RI No.82. 2001 Tentang Pengelolaan Kualitas Air dan Pengendalian Pencemaran Air. Tambahan Lembaran Negara Republik Indonesia No. 4161. http://www.ditjenphka.go.id. pdf. 14 Desember 2007. pkl. 19.37 WIB.
Pratisto, A. 2004. Cara Mudah Mengatasi Masalah Statistik dan Rancangan Percobaan dengan SPSS 12. PT Elex Media Komputindo. Jakarta.
Putra, S. E., dan Putra, J. A. 2005. Bioremediasi, Metode Alternatif untuk Menanggulangi Pencemaran Logam Berat. http://www.chem-is-try-org. 27 Juni 2007. pkl. 19.40 WIB.
Rai, L.L., J.P. Gaur and H.D. Kumar, 1981. Phyciology and Heavy Metal Pollution. In Biological Review of The Phycology Society. Cambridge University Press London.
Satchanska. G, E.N. Pentcheva, R. Atanasova., V. Groudeva, R.Trifonova and E. Golovinsky. 2005. Microbial Diversity in Heavy-Metal Polluted Waters. Environmental Biotechnolgy. 19 (3) : 61-67.
Setyorini, D. 2003. Mewaspadai Bahaya Merkuri di Sumber Air Kita. Ecological Observation And Wetlands Conservation. Gresik.
Sigg, L. 1994. Regulation of Trace Elements in Lakes: The Role of Sedimentation. In Chemical and Biological Regulation of Aquatic Systems. J, Buffle. De Vitre.R.R. Lewis Publishers, Tokyo. p 176-180. Silver, S. and Phung, L.T. 1996. Bacterial Heavy Metal Resistance: new surprises.
Annual. Rev. Mirobiol. 50: 753-789.
Smith, E.,Wolters, A. and Elsas, J.D.V. 1998. Self Transmissible Mercury Resistance Plasmids with Gene Mobilizing Capacity in Soil Bactery Populations: Influence of Wheat Roots and Mercury Addition. Appl. Environment. Microbiol. 64 : 1210-1219.
Suhendrayatna. 2001. Bioremoval Logam Berat dengan Menggunakan Mikroorganisme : Suatu Kajian Kepustakaan. Institute for Science and Technology Studies (ISTECS). Japan. http://www.mail-archive.com. 17 Maret 2007. pkl. 16.07 WIB.
Sulaksono, H., O. Komala dan I. M. Sudiana. 2002. Isolasi Bakteri Selulolitik Aerobik dan Karakteristik Enzimnya dari Tanah Gunung Botol, Kawasan Taman Nasional Gunung Halimun. Ekologia. 2 (2) : 33-41. Sutamihardja, R. T. M., Adnan, K. dan Sanusi. 1982. Perairan Teluk Jakarta
Ditinjau dari Tingkat Pencemarannya. Fakultas Pascasarjana, Jurusan PSL. IPB, Bogor.
Syawal dan Yustiawati. 2004. Kajian Pencemaran Merkuri Akibat Pengolahan Biji Emas di Sungai Cikaniki, Sub Das Cisadane, Bogor. Laporan Hasil Penelitian. Pusat Penelitian Limnologi LIPI Cibinong, Bogor.
Turnbull, P.C.B. 1996. Bacillus. In Barron's Medical Microbiology (Baron S et al, Eds.), 4th ed., Univ. of Texas Medical Branch.
USGS (United States Geological Survey). 1995. Mercury Contamination of Aquatic Ecosystems. Fact Sheet FS-216-95.
Vouck. 1986. General Chemistry of Metal. Handbook on the Toxicology of Metal. Elsivier. New York.
Volk, A. Wesley. dan M.F. Wheeler. 1986. Mikrobiologi Dasar. Edisi Kelima, Jilid 2 alih bahasa Soenartono A. Penerbit Erlangga, Jakarta.
Wagner-Dobler, I, H.V. Canstein, Y. Li, K. N. Timmis, and W.D. Deckwer. 2000. Removal of Mercury from Chemical Wastewater by Microorganisms in Technical Scale. Environmental Science. 34.
Wardoyo, S. T. H, 1981. Analisa Dampak Suatu Proyek Terhadap Kualitas Air. Training ANDAL PPLH-UNDP-PUSDI. PSL, IPB. Bogor. 30 pp.
Wild, A. 1995. Soils and The Environment : An Introduction. Cambridge University Press. Cambridge, Great Britain.
Wong, P.K., K.C. Lam, C.M. So. 1993. Removal and Recovery of Cu(II) from Industrial Effluent by Immobilization Cells of Pseudomonas putida II-11. Appl. Microbiol. Biotech. 39 : 127-131.
Lampiran 1. Disain Penelitian
Efisiensi Penyerapan oleh Bakteri yang dibandingkan dengan kontrol
Analisa secara kuantitatif penurunan konsentrasi Hg pada
t 24
Uji penurunan konsentrasi logam Hg (10,15 dan 20 mg/L) dan kontrol perlakuan dengan AAS Isolat B. megaterium
Peremajaan isolat
Pengamatan pola tumbuh bakteri pada t0, t4, t8, t12, t16, t20, t24
Analisa Data Pengukuran OD Penghitungan cfu/ml
Korelasi OD dengan cfu/ml
Pola Pertumbuhan Bakteri
Penghitungan cfu/ml
Diketahui kecepatan pertumbuhan sel tertinggi (µ)
Data penurunan konsentrasi logam Hg [Hg]t0 – [Hg]t24
Isolat diinkubasi sampai umur terbaik yang diperoleh dari pola pertumbuhan
Dilakukan uji penurunan konsentrasi logam Hg dalam medium NB dengan perlakuan masing-masing 10,15 dan 20 mg/L selama 24 jam (0 dan 24) berikut kontrol
masing-masing perlakuan
Analisa konsentrasi logam Hg dalam larutan kultur t : 24
dengan AAS Pengukuran OD (Optical Density)
dengan spektrofotometer λ 600 nm
Analisa populasi bakteri dengan TPC (Total Plate Count), triplo, T ruang, inkubasi selama 24 jam
Pola pertumbuhan bakteri dalam media NB
Media NB
Lampiran 2. Bagan Kerja Pembuatan Pola Tumbuh dan Pengujian Kemampuan Bakteri Menurunkan Konsentrasi Logam Hg
Lampiran 3. Data Po