LAMPIRAN A
Perhitungan Stoikiometri
1. Perhitungan massa bahan LTO doping Al Komposisi doping Al, x = 0,025
4LiOH.H2O + 4,975 TiO2 + 0,0125 Al2O3 Li4Ti4,975Al0,025O12
Diketahui Massa atom relative masing-masing unsur, Ar. Li = 7; Ti = 47,9982; H = 1; O = 15,9994; Al = 26,92 Mr. LiOH.H2O = 41,9988
Mr. TiO2 = 79,997 Mr. Al2O3 = 101,8182
Sehingga
���������.�2� 4 ���.����.�2�
= 10��
��.��4��4,975��0,025�12
���������.�2� =4 � 41,9988 � 10�� 459,4568
= �,������
��������2
4,975 ���.���2
= 10��
��.��4��4,975��0,025�12
��������2 =
4,975 � 79,997 � 10�� 459,4568
= �,������
�������2�3
0,0125 ���.��2�3
= 10��
��.��4��4,975��0,025�12
�������2�3 =
0,0125 � 101,8182 � 10�� 459,4568
2. Perbandingan komposisi LTO : PVDF : AB
Perbandingan komposisi yang digunakan dengan massa bahan LTO 10 gram adalah 85% : 10% : 5%
�������� = 10 ����
��������� = 10%
85%. 10 ����= 1,17 ����
������� = 5%
LAMPIRAN B
1. Perhitungan Luas Lembaran LTO doping Al
Perhitungan luas lembaran (mm) difungsikan pada penentuan massa Cu Foil yang telah dijadikan lembaran anoda, dengan rumus :
� =�+�+�+� 2
�=�(� − �)(� − �)(� − �)(� − �)
a. G 100µm
a b c d 10,17 10,27 10,47 10,37
� = 20,94
�=�(10,47)(10,37)(10,17)(10,27) �= 106,4899 ��
b. G 200 µm
a b c d 10,47 10,08 10,38 10,10
� = 20,515
�=�(10,045)(10,435)(10,135)(10,415) �= 105,1872 ��
c. G 300 µm
� = 20,94
�=�(10,58)(10,4)(10,37)(10,53) �= 109,6133��
d. G 400 µm
a b c
d
10,80
10,54
10,85 10,74
� = 21,465
�=�(10,665)(10,925)(10,615)(10,725) �= 115,1728��
2. Menghitung Nilai Konduktivitas Sel
�= �
������ �� Dimana, ������ =�� +���
• G-1 (ketebalan 100 µm)
�= 0,008
235,84 � 1,064899= 3,185 � 10
−5�/��
• G-2 (ketebalan 200 µm)
�= 0,012
263,86 � 1,051872= 4,324 � 10
−5�/��
• G-3 (ketebalan 300 µm)
�= 0,017
129,91 � 1,096133= 11,938 � 10
−5�/��
• G-4 (ketebalan 400 µm)
�= 0,028
101,51 � 1,151728= 23,95 � 10
3. Menghitung Energy Density
�������������=������������������������������ℎ����
• G-1 (ketebalan 100 µm)
�������������= 134,3 � 1,529 = 205,344 • G-2 (ketebalan 200 µm)
�������������= 103,39 � 1,526 = 157,773 • G-3 (ketebalan 300 µm)
�������������= 93,07 � 1,523 = 141,745 • G-4 (ketebalan 400 µm)
�������������= 96,09 � 1,528 = 146,825
4. Menghitung Power Density
������������= ��������������������� ������
• G-1 (ketebalan 100 µm)
������������= 0,184 � 1,57 = 1,27798 • G-2 (ketebalan 200 µm)
������������ = 0,693333 � 1,60 = 1,10933 • G-3 (ketebalan 300 µm)
������������ = 0,0501111 � 1,59 = 0,79676 • G-4 (ketebalan 400 µm)
������������ = 0,228571 � 1,598 = 0,36525
5. Menghitung Efesiensi Baterai
����������������= ������������ℎ����
�������� � 100%
• G-1 (ketebalan 100 µm)
���������������� = 134,3
137,08 � 100% = 97,971% • G-2 (ketebalan 200 µm)
���������������� = 103,39
• G-3 (ketebalan 300 µm)
���������������� =93,07
93,65 � 100% = 99,38% • G-4 (ketebalan 400 µm)
���������������� = 96,09
LAMPIRAN C
1. Gambar Peralatan
Neraca digital Neraca digital
Doctor Blade + Oven Pisau Doctor Blade
Hot Plate + Magnetic Stirrer Pipet Tetes
Piring Cawan
Cawan Beaker Glass
Sarung Tangan Cruicible
Pengukur Ketebalan Cawan Mortar
2. Gambar Bahan
LiOH.H2O Al2O3
TiO2 Aseton
Acetylene Black DMAC
DAFTAR PUSTAKA
Augus Tino Tri Widyantoro dan Diah Susanti, Pengaruh Variasi Temperatur Kalsinasi Terhadap Sifat Kapasitif Kapasitor Elektrokimia Tungsten Trioksida (Wo3) Hasil Sintesa Sol Gel, JURNAL TEKNIK POMITS Vol. 2, No. 1, (2013) ISSN: 2337-3539 (2301-9271 Print)
Cheng, F.; Liang, J.; Tao, Z.; Chen, J., Functional materials for rechargeable batteries. Advanced Materials 2011, 23 (15), 1695-1715.
C. Liu, F. Li, L. Ma, and H. Cheng. Advanced materials for energy storage. Adv. Mater., 22:E28{E62, 2010.
De Li, Yang Sun, Xizheng Liu, Ruwen Peng and Haoshen Zhou, Doping-induced memory effect in Li-ion batteries: the case of Al-doped Li4Ti5O12, Chem.
Sci., 2015, 6, 4066
Dey,A.N., Sullivan,B.P. ”he electrochemical decomposition of propylene carbonate on graphite” J. Electrochem. Soc. 117 (1970) 222-224
Hailei Zhao, Yue Li, Zhiming Zhu, Jiu Lin, Zhihong Tian, RonglinWang, Structural and electrochemical characteristics of Li4−xAlxTi5O12 as anode
material for lithium-ion batteries, Electrochimica Acta 53 (2008) 7079– 7083
Huang,S. Jeng-Yu Lina, Chao-Chia Hsua, Hsin-Ping Hoa, Wub, Sol–gel synthesis of aluminum doped lithium titanate anode material for lithium ion batteries, Electrochimica Acta 87 (2013) 126– 132
Imanishi,N.,H.Kashiwagi., T.Ichikawa., Y.Takeda., O.Yamamoto., M.Inagaki., J. Electrochem. Soc, 140, 315, (1993)
Jung Soo Park, Seong-Ho Baek, Yong-Il Jeong, Bum-Young Noh, Jae Hyun Kim, Effects of a dopant on the electrochemical properties of Li4Ti5O12 as a
Julien and Zaghib. Electrochemistry and local structure of nano-sized Li4=3Me5=3O4 (Me = Mn, Ti) spinels. Electrochim. Acta, 50:411{416,
2004.
Kamath, H.; Tarascon, J.-M., Electrical Energy Storage for the Grid: A Battery of Choices. Science 2011, 334 (6058), 928-935.
Kataoka, Y. Takahashi, N. Kijima, J. Akimoto, and K. Oshima. Single crystal growth and structure re_nement of Li4Ti5O12. J. Phys. Chem. Solids, 69:1454{1456, 2008
K. Xu, Chemical Reviews 104 (2004) 4303
Linden, D.; Reddy, T., Handbook of Batteries, 2002, McGraw-Hill. Song, J. Y.; Wang, Y. Y.; Wan, C. C., Review of gel-type polymer electrolytes for lithium-ion batteries. Journal of Power Sources 1999, 77 (2), 183-197.
Martin. W, Ralph. J, 2004. What Are Batteries, Fuel Cells, and Supercapacitors?. Chem. Rev. 2004, 104,4245-4269. American Chemical Society
Nordh. Tim, Li4Ti5O12 as an anode material for Li ion batteries in situ XRD and
XPS studies, UPTEC K 13001 Examensarbete 30 hp, Februari 2013
Ogumi,Z. Inaba,M., Siroma,Z., Kawatale,Y., Funabaki,A.,. “Electrochemical scanning tunneling microscopy analysis of the surface reaction on graphite basal plane in ethylene carbonate-based solvents and propylene carbonate” J. Power survaces 68 (1998) 221-226.
Orisaka,Y., Maeda,T., Koyama,Y., Murayama,H., Fukuda,K., Tanida,H., Arai,H., Matsubara,E., Uchimoto,Y., Ogumi,Z. “Direct Observation of a Metastable Crystal Phase of LixFePO4 Under Electrochemical Phase Transition” J. Am. Chem. Soc. 135 (2013) 5497-5500
Patil, A.; Patil, V.; Wook Shin, D.; Choi, J. W.; Paik, D. S.; Yoon, S. J., Issue and challenges facing rechargeable thin film lithium batteries. Materials Research Bulletin 2008, 43 (8-9), 1913-1942.
Battery”, The ASEAN Conference on Science and Technology 2014 (ASEAN CoSaT 2014) 18th -19th August 2014, IPB International Convention Center - IPBICC, West Java, Indonesia
Ronci.F, P. Reale, B. Scrosati, S. Panero, P.A. Moro, V.R. Albertini, P. Perfetti, T. Vergata, R.J. Horowitz, The Journal of Physical Chemistry 106 (2002) 3082.
Rouxel,J., Danot,M., Bichon,M. “Les composite intercalaires NaxTiS2. Etude generale des phases NaxTiS2 et KxTiS2.” Bull. Soc. Chim. 11 (1971) 3930-3936
Sari.S.P, pengaruh komposisi lembaran anoda lto (li4ti5o12) terhadap performa sel baterai ion lithium, departemen fisika fakultas matematika dan ilmu pengetahuan alam universitas sumatera utara medan 2015
Scrosati.B and J. Garche. Materials for next-generation lithium batteries. J. Power Sources, 195:2419{2430, 2010.
Tarascon.J.M, M.Armand, Nature, 414 (2001) 359
Wakihara, M., Recent developments in lithium ion batteries. Materials Science and Engineering: R: Reports 2001, 33 (4), 109-134. Dunn, B.
Winter.M.; Brodd, R. J., What are batteries, fuel cells, and supercapacitors? Chemical Reviews 2004, 104 (10), 4245-4270
Xiangcheng Sun, Development and Characterization of Nano-Structured LiFePO4
Cathode and Li4Ti5O12 Anode Materials for High-Performance Li-Ion
BatteryOntario, Canada, 2015 © Xiangcheng Sun 2015
Yuping WU, 2015, Electrochemical energy storage and conversion LITHIUM ION-BATTERIES Fundamentals and Application, New York, CRC pres, Taylor & Francis Group.
4Ti4.95Al0.05O12/C as anode
BAB 3
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan selama 3 bulan, dimulai dari tanggal 01 Februari 2016 sampai 04 Mei 2016 di Pusat Penelitian Fisika (PPF) Lembaga Ilmu Pengetahuan Indonesia (LIPI) Puspiptek Serpong.
3.2 Bahan dan Peralatan Penelitian 3.2.1 Bahan
1. Serbuk LiOH.H2O
Fungsi : sebagai sumber lithium untuk sintesis Li4Ti5O12
2. Serbuk TiO2
Fungsi : sebagai sumber titanium untuk sintesis Li4Ti5O12
3. Serbuk Al2O3
Fungsi : sebagai doping 4. PVDF (polyvinylidene fluoride)
Fungsi : sebagai polimer pengikat (binder).
5. AB (Acetilene Black)
Fungsi : sebagai karbon konduktif untuk memperkecil hambatan. 6. DMAC (N,N-Dimethylacetamide)
Fungsi : sebagai pelarut.
3.2.2 Peralatan Penelitian 1. Neraca digital
Fungsi : untuk mengukur massa bahan yang digunakan untuk membuat LTO doping Al (LiOH.H2O, TiO2, dan Al2O3).
2. Beaker glass
Fungsi : sebagai wadah untuk mencampurkan bahan. 3. Spatula
4. Ayakan 200 mesh
Fungsi : sebagai alat untuk menyaring bahan 5. Cruicible
Fungsi :sebagai wadah bahan untuk proses kalsinasi dan proses sintering.
6. Termolyne furnace
Fungsi : sebagai alat pemanasan (Kalsinasi) dan sintering. 7. Cawan Mortar
Fungsi : sebagai wadah untuk menumbuk bahan. 8. Kuas
Fungsi : sebagai alat untuk memudahkan bahan lolos dari saringan. 9. Piring
Fungsi : sebagai wadah untuk meletakkan hasil saringan 10. Magnetic stirrer
Fungsi : untuk menghomogenkan cmapuran bahan dengan pengadukan. 11. Hot plate
Fungsi :untuk memanaskan campuran bahan sehingga mampu mempercepat proses homogenisasi.
12. Jepitan
Fungsi : untuk menjepit lembaran. 13. XRD (X-Ray Diffraction )
Fungsi : untuk mengetahui fasa Kristal LTO. 14. WBCS 3000
Fungsi : untuk uji Kapasitas sel baterai melalui Charge Discharge.
15. Coin cell
3.3 Perhitungan Massa Bahan
Komposisi doping Al dalam penelitian ini adalah x = 0,025 untuk Li4Ti5O12
sebanyak 10 gram. Sehingga massa bahan utama yang dibutuhkan adalah seperti yang ditunjukkan oleh tabel berikut ini.
Tabel 3.1 Massa bahan baku LTO doping Al
Bahan Utama Massa (gram)
LiOH.H2O 3,65
TiO2 8,66
Al2O3 0,03
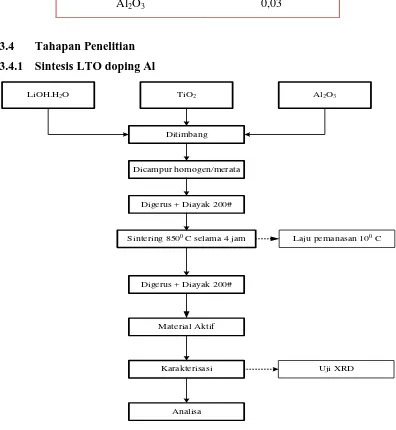
3.4 Tahapan Penelitian 3.4.1 Sintesis LTO doping Al
LiOH.H2O
Ditimbang
TiO2 Al2O3
Digerus + Diayak 200# Dicampur homogen/merata
Sintering 8500 C selama 4 jam
Digerus + Diayak 200#
Material Aktif
Karakterisasi
Analisa
Uji XRD
3.4.2 Pembuatan Lembaran LTO doping Al
Material aktif
(LTO doping Al) PVDF
AB (Acetylene Black)
Cutting Pelapisan
Slurry
Dicampur homogen/merata
Assembly sel ½ baterai dengan Coin Cell
Uji EIS, Uji CV/CD
Analisa
Kesimpulan
DMAC
Kecepatan pengaduk 300 rpm, Hot plate = 720 C
Variasi ketebalan 100µm,
200µm, 300µm, dan
3.5 Prosedur Penelitian 3.5.1 Sintesis LTO doping Al
1. Disiapkan semua bahan dan peralatan.
2. Ditimbang bahan (LiOH.H2O, TiO2, dan Al2O3) dengan massa masing-masing
3,65 gram, 8,66 gram, dan 0,03 gram.
3. Bahan LiOH.H2O, TiO2 yang telah ditimbang dicampur terlebih dahulu
kemudian ditambahkan dengan Al2O3 .
4. Bahan LiOH.H2O, TiO2, dan Al2O3 yang telah tercampur homogen kemudian
ditumbuk dan diayak 200 mesh.
5. Dilakukan proses sintering pada suhu 8500 C dengan suhu awal 270 C selama 4 jam. Kemudian dturunkan kembali pada suhu 270 C.
27º C
850º C / 4 jam
27º C
Gambar 3.1 Kurva tahapan peningkatan suhu pada proses sintering
6. Ditumbuk dan diayak kembali bahan yang sudah dilakukan proses sintering dengan ayakan 200 mesh.
7. Dilakukan karakterisasi pada bahan serbuk, yaitu uji XRD.
3.5.2 Pembuatan Lembaran LTO doping Al 3.5.2.1 Tahapan Pembuatan Slurry
1. Preparasi bahan dengan perbandingan Material aktif LTO : PVDF: Acetylene Black (AB) dengan perbandingan 85% : 10% : 5%
2. Diaduk DMAC menggunakan magnetic stirer yang telah diletakkan diatas hotplate dengan 300 rpm dengan T=72o C dan dipanaskan selama 15 menit. 3. Ditambahkan PVDF sedikit demi sedikit hingga larut, dan dipanaskan selama
30 menit.
5. Kemudian ditambahkan serbuk LTO secara perlahan sedikit demi sedikit hingga tercampur homogen.
6. Slurry siap dijadikan lembaran.
3.5.2.2 Tahapan Pelapisan (Pencetakan Lembaran)
1. Dibuat lembaran dari slurry yang sudah diproses sebelumnya. Diukur ketebalan dengan variasi 100μm, 200μm, 300μm, dan 400μm. Untuk pelapisan lembaran dengan menggunakan pisau doctor blade dengan kecepatan pelapisan 6.
2. Dikeringkan lembaran pada oven yang terdapat pada alat Doctor Blade dengan
suhu 80oC.
3. Lembaran yang sudah dilapisi kemudian dipotong berbentuk persegi dengan panjang setiap sisinya 1 cm.
BAB 4
HASIL DAN PEMBAHASAN
4.1. Lembaran Anoda LTO doping Al Variasi Ketebalan
Hasil dari lembaran elektroda yang dibuat, masing-masing memiliki daya rekat yang berbeda pada setiap variasi ketebalannya. Sampel G-1 (100µm) dan Sampel G-2 (200µm) memiliki daya rekat yang sangat baik dapat dilihat dengan tidak rontoknya material aktif dari Cu Foil dan tidak terdapat bintik-bintik pori pada lembaran. Masing-masing sampel dikeringkan dalam oven selama 20 menit dan 35 menit.
Selanjutnya untuk Sampel G-3 (300µm) memiliki daya rekat yang cukup baik dan tidak memiliki bintik-bintik pori pada lembaran. Pengeringan pada oven dilakukan selama 60 menit. Namun berbeda halnya dengan Sampel G-4 (400µm) yang memiliki daya rekat buruk, sehingga sangat mudah rontok dari Cu Foil, dan pengeringan dilakukan selama 120 menit. Setiap sampel dikeringkan dalam oven pada suhu 800 C. Setelah dilakukan pengeringan, ketebalan daripada lapisan G-1, G-2, G-3, G-4 berkurang (ketebalan real) masing-masing menjadi 80 µm, 120 µm, 170 µm, dan 280 µm. Ketebalan daripada bahan aktif (LTO doping Al) juga sangat mempengaruhi daya rekat dan lamanya waktu pengeringan slurry pada saat pembuatan lembaran anoda.
Sampel G-3 (170µm) Sampel G-4 (280µm)
Gambar 4.1 Hasil lembaran anoda LTO doping Al dengan variasi ketebalan lapisan pada sampel G-1, G-2, G-3, dan G-4.
Hasil pengujian juga memberikan informasi mengenai struktur kristal serbuk LTO yang didoping dengan Al meliputi analisa fasa, paramameter kisi, dan uji densitas dengan XRD. Analisa konduktivitas dengan EIS. Dan analisa performa elektrokimia dan kapasitas baterai dengan CV/CD.
4.2 Analisa Fasa dan Struktur dengan XRD (X-Ray Difraction)
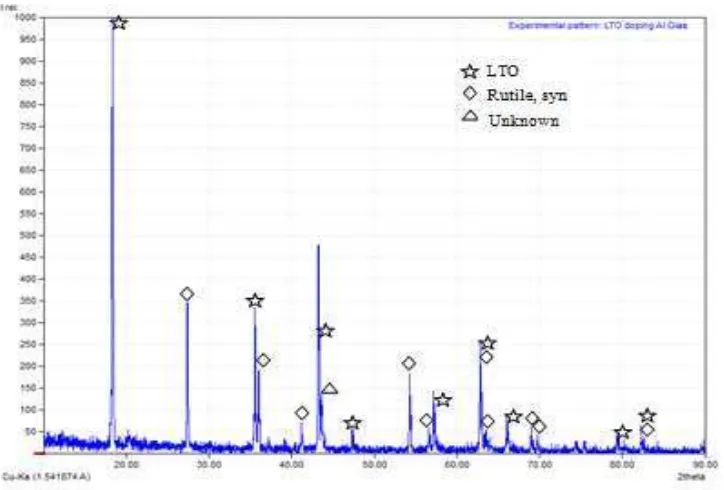
Gambar 4.2 merupakan difaktogram serbuk LTO doping Al dengan x=0,025 yang menunjukkan terbentuknya fasa Lithium Titanium Oxide (Li1.333 Ti1.667 O4) dan
Rutile,syn (TiO2). Terbentuknya dua fasa disebabkan oleh laju pemanasan yang
sangat cepat (100 C/menit) pada proses sintering. Analisa XRD dilakukan dengan metode Rietvelt dengan komposisi setiap fasa adalah 75,6% untuk fasa LTO dan 24,4% untuk fasa rutile. Hasil XRD menunjukkan bahwa puncak fasa LTO
terdapat pada sudut 2θ masing-masing 18.3180; 35.5710; 43.2450; 47.35950;
57.1970; 62.8300; 66.0450; dan 79.360. Sedangkan puncak fasa TiO2 terdapat pada
Gambar 4.2. Analisis Kualitatif XRD serbuk LTO doping Al
Tabel 4.1 Hasil analisis struktur kristal (Parameter kisi) Li4Ti5Al0,025O12
dengan metode Rietveld No Nama
Fasa
Rumus Kimia
a (Å) b (Å) c (Å) α = β =γ
1 Lithium Titanium
Oxide
Li1.333 Ti1.667 O4
8.3605 8.3605 8.3605 900
2 Rutile, syn
Ti O2 4.5925 4.5925 2.9586 900
4.3 Analisa Electrochemical Impedance Spectroscopy (EIS) 4.3.1 Uji konduktifitas listrik lembaran anoda
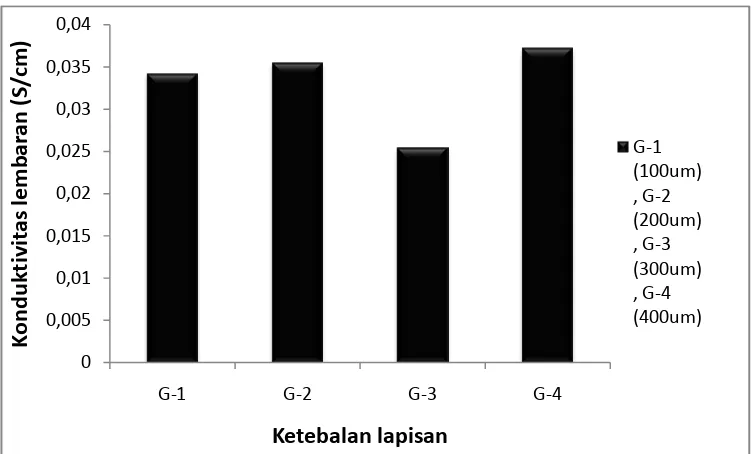
listrik menunjukkan bahwa semakin tebal lapisan maka nilai konduktifitas semakin besar. Disebabkan oleh jumlah AB (Acetylene Black) pada lembaran semakin banyak.
Gambar 4.3. Hasil pengukuran konduktifitas listrik lembaran LTO doping Al variasi ketebalan
4.3.2 Hasil Pengukuran Konduktifitas Sel Setengah Baterai
Pengujian EIS pada sel dilakukan untuk mengetahui nilai konduktifitas ionik dari material aktif lembaran anoda terhadap lithium metal (vs Li) sebagai elektroda refrensi. Dari hasil pengujian ini didapatkan data utama berupa plot impedansi real dan komplek (Augus Tino T W, 2013).
Pola EIS disusun dari semicircle pada frekuensi tinggi hingga menengah (0,1 Hz < 20 kH) dan garis miring (450) pada frekuensi rendah. Garis miring pada frekuensi rendah merupakan Warburg impedance, yang bersesuaian dengan
proses difusi ion lithium dalam partikel Li4Ti5O12. Intersection antara garis miring
dengan sumbu real menyatakan bulk resistance (Rb), yang merefleksikan
hambatan elektronik dan ionik dari dua elektroda dan elektrolit/separator.
0 0,005 0,01 0,015 0,02 0,025 0,03 0,035 0,04
G-1 G-2 G-3 G-4
Gambar 4.4. Plot impedansi hasil uji EIS pada sampel G-1, G-2, G-3 dan G-4
Dari plot pada Gambar 4.5 dapat diketahui bahwa semakin tebal lapisan material aktif maka semicircle semakin kecil menunjukkan bahwa semakin kecil hambatan
pada material aktif dan nilai konduktifitas akan semakin besar. Nilai impedansi total pada material dapat diketahui dari penjumlahan nilai hambatan elektronik (Re) dengan hambatan ionic (Rct). Secara matematis nilai konduktifitas dapat diperoleh dari persamaan:
σ= tebal Rs x A
(4.1)
dimana, �� = �� +���
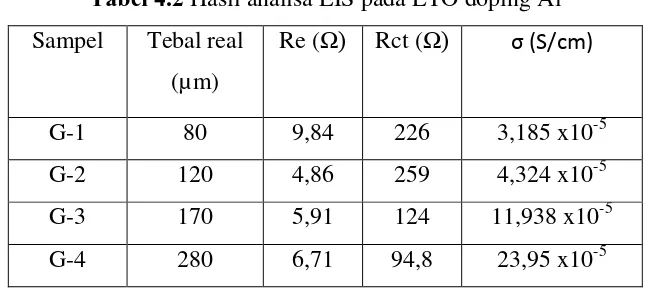
Dari hasil uji yang telah dilakukan, didapatkan nilai konduktifitas yang besar atau yang paling optimum adalah pada sampel G-4, dengan nilai Re adalah
6,71Ω dan nilai Rct adalah 94,8Ω sehingga nilai konduktifitas yang dihasilkan
adalah 23,95 x 10-5 S/cm, dapat dilihat pada Tabel 4.2. Sedangkan hasil yang
0 50 100 150 200 250 300 350 400
0 100 200 300 400
X(
Ω
)
Rs(Ω)
G4
G3
G1
menunjukkan nilai konduktifitas yang buruk adalah pada sampel G-1 yaitu 3,185 x 10-5 S/cm dengan nilai hambatan Re adalah 9,84 Ω dan Rct adalah 226 Ω.
Selanjutnya pada sampel G-2 memiliki nilai konduktifitas 4,324 x10-5 dengan hambatan Re = 4,86 dan Rct = 295. Nilai konduktifitas pada sampel G-3 adalah 11,938 x10-5 dengan hambatan Re dan Rct masing-masing adalah 5,91 dan 124.
Nilai konduktifitas sangat dipengaruhi oleh ketebalan lapisan pada sampel. Disebabkan oleh semakin banyaknya AB (Acetylene Black) yang terdapat pada sampel yang memiliki ketebalan lebih besar, sehingga AB yang berperan sebagai karbon konduktif akan lebih banyak didapat pada material aktif yang lebih tebal.
Hasil perhitungan konduktifitas sel lebih kecil daripada konduktifitas lembaran. Hal ini menunjukkan bahwa hambatan ionic (Rct) sangat berperan dalam proses elektrokimia.
Tabel 4.2 Hasil analisa EIS pada LTO doping Al Sampel Tebal real
(µm)
Re (Ω) Rct (Ω) σ (S/cm)
G-1 80 9,84 226 3,185 x10-5
G-2 120 4,86 259 4,324 x10-5
G-3 170 5,91 124 11,938 x10-5 G-4 280 6,71 94,8 23,95 x10-5
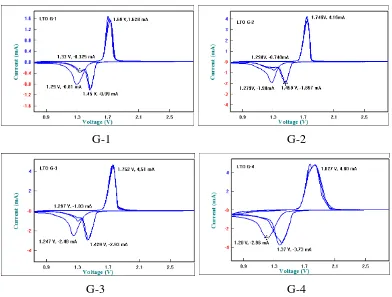
4.4. Analisa Cyclic Voltammetry (CV)
CV merupakan teknik elektroanalitik yang banyak digunakan dalam bidang kimia, pengujian ini sering digunakan untuk mempelajari proses redoks, menentukan stabilitas produksi reaksi. Dalam penelitian ini, pengujian CV dilakukan untuk menganalisa proses redoks pada sel setengah baterai anoda Li4Ti5O12 doping Al
dengan rumus kimia:
Anoda : 3Li- 3Li+ + 3e
G-1 G-2
G-3 G-4
Gambar 4.5. Voltamogram siklik LTO doping Al pada G-1, G-2, G-3, dan G-4
Pengujian CV dilakukan dengan scan rate 160 uV/s pada tegangan 0,7<CV<2,8 V dan dihasilkan puncak (peak) oksidasi-reduksi pada lembaran
material aktif dalam sel baterai sehingga memerlukan banyak energi untuk aktivasi dan disebebkan juga karena jarak difusi ion lithium semakin panjang.
Tabel 4.3 Data hasil analisa CV pada LTO doping Al Sampel Iok
(mA)
Ired (mA)
Vok (Volt)
Vred (Volt)
Vwork (Volt)
Vpolarisasi (mV)
G-1 1,628 -0,99 1,69 1,45 1,57 240 G-2 4,16 -1,897 1,476 1,459 1,60 280 G-3 4,51 -2,93 1,752 1,429 1,59 323 G-4 4,80 -3,73 1,827 1,37 1,598 457
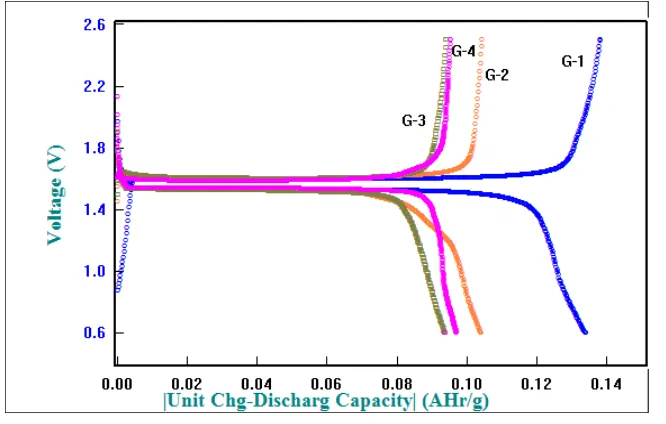
4.5. Analisa Charge -Discharge (CD)
Analisa charge-discharge dilakukan untuk mengetahui kemampuan sel baterai
untuk menyimpan kapasitas energi. Secara teori kapasitas spesifik charge-discharge sel baterai ion Litium adalah 175 mAhg-1.
Gambar 4.6. Kurva analisa Charge-Discharge pada sampel G-1, G-2, G-3
dan G-4
Hasil uji yang telah diperoleh menunjukkan bahwa sampel G-1 memiliki nilai kapasitas tertinggi dibandingkan dengan tiga sampel lainnya, yaitu memiliki kapasitas spesifik charge-discharge masing-masing adalah 137,08 mAhg-1 dan
93,65 mAhg-1 untuk charge dan 93,07 mAhg-1 untuk discharge. Pada sampel G-2
kapasitas charge-discharge adalah 103,64 mAhg-1 dan 103,39 mAhg-1.
Selanjutnya sampel G-4 memiliki nilai kapasitas spesifik charge-discharge, yaitu
94,73 mAhg-1 dan 96,09 mAhg-1. Semua sampel memiliki efisiensi yang cukup baik yaitu diatas 98%. Pada Tabel 4.4 dapat dilihat bahwa semakin tebal lapisan maka nilai kapasitas spesifik akan semakin menurun. Disebabkan oleh jumlah kandungan Al semakin besar. Adanya kandungan Al dalam LTO dapat menurunkan kapasitas spesifik.
Tabel 4.4 Data hasil analisa Charge-Discharge pada LTO doping Al variasi
ketebalan Sampel Kapasitas Spesifik
(mAh/g)
Efesiensi Coloumbic (%)
Kapasitas (mAh)
Charge Discharge Charge Discharge
G-1 137.08 134.3 98 0.3692 0,3617
G-2 103.64 103.39 99,8 0,6903 0,6886
G-3 93.65 93.07 99,4 0,8891 0,8836
G-4 94.73 96.09 101,4 2,0257 2,0548
Dari kurva charge-discharge juga dapat diperoleh tegangan polarisasi.
Tegangan polarisasi adalah selisih antara tegangan charging dengan tegangan discharging. Tegangan polarisasi muncul karena adanya proses aktivasi,
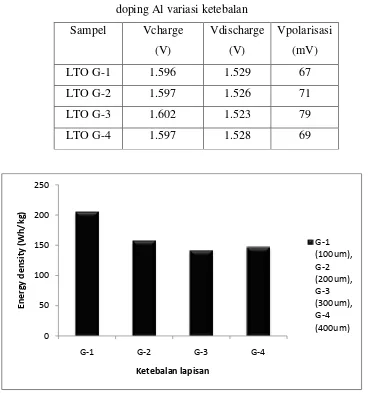
Tabel 4.5. Hasil perhitungan tegangan polarisasi sel baterai dengan Anoda LTO doping Al variasi ketebalan
Sampel Vcharge (V)
Vdischarge (V)
Vpolarisasi (mV)
LTO G-1 1.596 1.529 67
LTO G-2 1.597 1.526 71
LTO G-3 1.602 1.523 79
LTO G-4 1.597 1.528 69
Gambar 4.7. Hasil pengukuran energy density pada lembaran anoda LTO doping
Al variasi ketebalan
Energy density diperoleh dari perkalian antara kapasitas spesifik discharge dengan
tegangan discharge.
�������������= ����������������������� ℎ���� (4.2) Hasil yang diperoleh dari Gambar 4.7. menunjukkan bahwa semakin tebal lapisan maka energy density akan semakin kecil karena proses elektrokimia terjadi
pada permukaan elektroda yang bersinggungan langsung dengan elektrolit, sedangkan material aktif yang disisi dalam tidak ikut bereaksi. Semakin tebal lapisan anoda menyebabkan panjang difusi ion lithium semakin besar, sehingga ion lithium hanya berada di interfase antara anoda dan elektrolit.
0 50 100 150 200 250
G-1 G-2 G-3 G-4
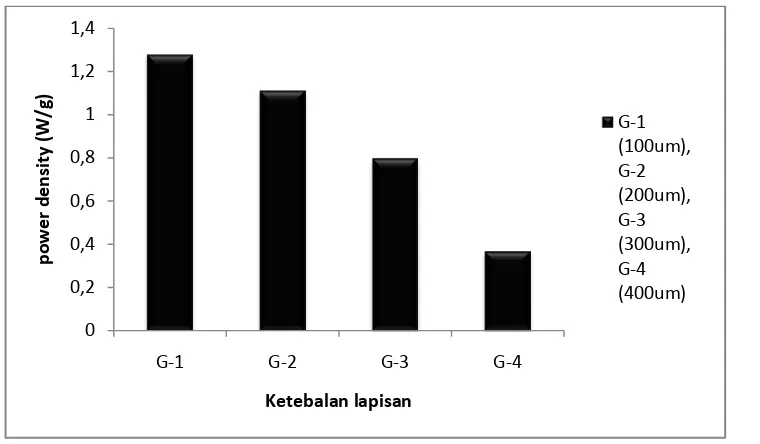
Gambar 4.8. Hasil pengukuran power density pada lembaran anoda LTO doping
Al variasi ketebalan
Power density sangat dipengaruhi oleh ketebalan lapisan lembaran. Pada Gambar
4.9 dapat dilihat bahwa power density diperoleh dari perkalian antara arus
oksidasi spesifik dengan tegangan kerja (Vwork).
������������=���� ����������������� (��/�) ������ (4.3) Hasil perhitungan menunjukkan bahwa semakin tebal lembaran maka densitas akan semakin kecil. Karena panjang difusi ion semakin besar.
0 0,2 0,4 0,6 0,8 1 1,2 1,4
G-1 G-2 G-3 G-4
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari penelitian yang telah dilakukan dapat ditarik kesimpulan sebagai berikut:
1. Telah dilakukan sintesis serbuk Li4Ti5O12 doping Al (x=0,025) berbahan
dasar LiOH.H2O, TiO2, dan Al2O3 dengan metode solid state reaction.
Sintesis yang telah berhasil dilakukan ditunjukkan pada hasil analisa XRD, yaitu terbentuknya fasa LTO dengan komposisi 75,6% dan fasa TiO2
Rutile 24,4%.
2. Pembuatan lembaran anoda dilakukan dengan variasi ketebalan coating
100µm, 200µm, 300µm dan 400µm. Lembaran anoda yang dihasilkan pada ketebalan 100µm, 200µm, dan 300µm memiliki kualitas yang cukup baik, ditandai dengan tidak rontoknya (daya rekat) material aktif dari Cu foil.
3. Pengujian konduktifitas listrik lembaran anoda LTO doping Al dan konduktifitas ionik sel setengah baterai menunjukkan bahwa nilai konduktifitas yang paling optimum adalah pada sampel G-4 dengan nilai masing-masing adalah 3,73 x 10-2 S/cm dan 23,95 x10-5 S/cm.
4. Dari kurva yang terbentuk pada cyclic voltammetry dan charge-discharge
diketahui bahwa performa elektrokimia sel baterai pada lembaran anoda LTO doping Al yang paling optimum adalah pada ketebalan lapisan 100 µm (G-1). Dilihat dari puncak redoks yang terbentuk paling tajam. Sedangkan pada kurva charge-discharge diperleh kapasitas sel baterai
masing-masing adalah 137,08 mAh/g dan 134,3 mAh/g. Energy density
dan power density yang diperoleh pada sampel G-1 juga yang paling
5.2. Saran
1. Untuk mendapatkan fasa LTO yang lebih besar, perlu dilakukan proses kalsinasi dan pengurangan laju pemanasan pada saat proses sintering. 2.Untuk mendapatkan hasil energy density dan power density yang lebih
optimum, perlu dilakukan penelitian dengan ketebalan lapisan yang lebih tipis
3. Perlu menggunakan alat pemotong lembaran elektroda yang presisi agar diperoleh perhitungan yang lebih akurat.
BAB 2
TINJAUAN PUSTAKA
2.1 Baterai
Baterai merupakan unit mandiri yang menyimpan energi kimia, dan mengubah langsung ke dalam energi listrik untuk daya berbagai aplikasi. Baterai diklasifikasikan ke dalam tiga kelompok umum: baterai primer adalah baterai yang hanya dipakai sekali dan dibuang; Baterai sekunder adalah baterai isi ulang yang dapat di pakai dan dapat dikembalikan kekeadaan semula dengan membalikkan aliran arus melalui sel, skematik dari aplikasi penggunaan baterai isi ulang diilustrasikan pada (Gambar 2.1); Baterai khusus adalah baterai yang
di-design untuk tujuan tertentu. Terutama pada militer dan medis yang tidak
menemukan penggunaan baterai komersial yang luas dengan alasan biaya, masalah lingkungan, dan aplikasi pasar yang terbatas. Mereka umumnya tidak memerlukan waktu start-up. Pada saluran air yang rendah, sampai dengan 95%
pada energi sangat mudah untuk dipakai bekerja (Martin and Ralph, 2004).
[image:33.595.195.428.513.684.2]Saat ini, teknologi baterai canggih menjadi teknologi posisi terbaik dengan upaya mengurangi dampak lingkungan yang berkelanjutan dan energi terbarukan di berbagai aplikasi dari perangkat portabel elektronik (misalnya, ponsel, komputer laptop) untuk kendaraan listrik dan penyimpanan listrik dalam skala besar di grid pintar atau cerdas (Cheng.F, 2011).
Berikut beberapa keuntungan dan kerugian dari penggunaan baterai, yaitu: a. Keuntungan
1. Beroperasi pada rentang suhu yang luas. 2. Pilihan sistem kimia dan tegangan.
3. Operasi pada beberapa orientasi tidak membutuhkan pompa, penyaring.
4. Ukuran variabel dan ukuran sel sama diseluruh dunia. 5. Dapat mengirim arus pulsa tinggi.
6. Dapat memilih baterai terbaik untuk spesifik tertentu (portable, ponsel, dan aplikasi stasioner).
b. Kerugian
1. Kandungan energi rendah dibandingkan dengan bensin dan bahan bakar yang lain.
2. Mahal dibandingkan dengan batu bara dan bensin.
Berikut definisi yang sering digunakan pada setiap rangkaian pelajaran mengenai baterai, fuel cell, dan kapasitor elektrokimia.
Baterai khusus adalah baterai primer yang diproduksi terbatas untuk penggunaan tertentu.
Anoda adalah elektroda negatif pada sel yang dihubungkan dengan reaksi kimia oksidasi yang melepaskan elektron sampai pada circuit eksternal.
Katoda adalah elektroda positif pada sel yang dihubungkan dengan reaksi kimia reduksi dimana gain elektron berasal dari circuit eksternal.
Elektrolit adalah sebuah material yang memberikan konduktifitas ionic murni antara elektroda positif dan elektroda negatif pada sebuah sel.
Separator adalah penghalang antara elektroda positif dan elektroda negatif tergabung ke dalam bentuk sel untuk mencegah korslet listrik. Separator dapat berupa gel elektrolit atau film plastic mikro atau bahan inert berpori lainnya yang diisi denga elektrolit. Separator harus dapat ditembus terhadap ion dan inert dalam lingkungan baterai.
Discharge adalah suatu operasi dimana sebuah baterai memberikan energi
Charge adalah suatu operasi dimana sebuah baterai dikembalikan ke
kondisi semula dibebankan oleh pembalikan aliran arus.
Resistansi dalam atau impedansi adalah resistansi atau impedansi dimana baterai atau sel memberikan aliran arus.
Konstanta Faraday, F, adalah jumlah muatan transfer ketika reaksi massa aktif setara 96.485,3 C/g-equiv, 26.8015 Ah/g-equiv (Martin and Ralph, 2004).
2.1.1 Cara Kerja Baterai
Banyak reaksi kimia yang melibatkan transfer elektron sehingga mengalami perubahan dalam keadaan oksidasi; disebut reaksi redoks (Ronci.F, 2002). Elektroda negatif adalah reduktor yang baik (transfer elektron) seperti lithium, zinc, atau timah. Elektroda positif adalah penerima electron seperti lithium cobalt oxide, mangan dioksida, atau timah oksida. Elektrolit adalah penghantar ion murni
yang secara fisik memisahkan anoda dari katoda (Martin and Ralph, 2004). Dalam reaksi redoks, satu spesies teroksidasi dengan memberikan elektron sehingga oksidasi naik dan spesies yang lain berkurang dengan menerima elektron maka dengan demikian akan mengurangi tingkat oksidasinya (Ronci.F, 2002). Setiap reaksi redoks memiliki tegangan tertentu. Ada nilai praktis mutlak untuk potensi ini, sehingga sistem pengukuran relative digunakan sebagai gantinya. Dalam refrensi ini, potensi kesetimbangan dari reaksi antara proton dan gas hydrogen diatur ke nol:
2H++ 2 e-H 2 (g)
Gambar 2.2 Skematik dari prinsip umum baterai
Elektrolit dapat berair atau tidak berair, dalam bentuk cair, pasta atau bentuk padat (Linden.D, 2002; Song.J.Y, 1999). Elektrolit cair lebih disukai karena memiliki konduktifitas ionic yang tinggi, tetapi cairan elektronik memiliki kekurangan stabilitas mekanik untuk mencegah kontak antara elektroda (Winter.M, 2004). Dalam praktek, listrik berpori bahan isolasi yang mengandung elektrolit sering ditempatkan di antara anoda dan katoda untuk mencegah anoda dari kontak langsung dengan katoda. Jika anoda dan katoda bersentuhan fisik, baterai akan korsleting dan energi penuh pada baterai terlepas sebagai panas baterai (Martin and Ralph, 2004).
2.2. Baterai Ion Lithium
Sejak komersialisasi baterai ion lithium yang dapat diisi ulang di awal tahun 1990-an, bahan kimia berbasis lithium telah berkembang pesat di pasar baterai global. Hal ini dikarenakan lithium memiliki banyak sifat kimia dan fisika. Pertama, lithium adalah unsur yang paling elektronegatif pada standar tekanan dan suhu (STP) memiliki potensial reduksi dengan potensial elektroda negatif sebesar -3.05 V. Hal ini memungkinkan pembuatan baterai dengan tegangan mencapai 6 V, meskipun 3-3.5 V adalah rentang tegangan yang paling umum untuk baterai lithium (K.Xu, 2004).
yang praktis. Untuk baterai skunder, sel isi ulang dikembangkan pada tahun 1970an. Penyisipan sel elektrokimia Li ke dalam sulfide berkontribusi pada pengembangan baterai sekunder (Rouxel, 1971). Dibandingkan dengan baterai sekunder lainnya, baterai isi ulang ion lithium menunjukkan kinerja elektrokimia yang sangat baik, yang mengarah pada posisi dominan dalam industri baterai. Hal ini juga menjelaskan mengapa baterai ion lithium mendapatkan perhatian yang besar pada kedua fundamental dan tingkat penerapannya. Karakteristik perbandingan kinera baterai sekunder ditunjukkan pada Tabel 2.1 (Patil.A;Patil.V, 2008).
Tabel 2.1 Karakteristik perbandingan kinerja baterai sekunder
Tipe Baterai Tegangan (V) Densitas Energi
(Wh/kg)
Densitas
Energi (Wh/L)
Ni-Cd 1.2 40 100
Ag-Zn 1.5 110 220
Ni-MH 1.2 90 245
Li-ion 3.6 155 400
Li-Polymer 3.6 180 380
Gambar 2.3 Prinsip kerja umum pengisian / proses pemakaian baterai ion lithium yang dapat diisi ulang (Wakihara.M, 2001 ; Dunn.B, 2011).
2.3 Bagian-bagian Baterai
Terdapat beberapa bagian-bagian dari baterai yaitu:
2.3.1 Elektroda Positif (Katoda)
Katoda disusun dari campuran bahan elektroda (90%), aditif konduktif (6%), bahan pengikat (4%), dan dilukis pada arus kolektor. Li-TMs dengan konduktivitas elektron yang rendah umumnya digunakan sebagai bahan elektroda, penurunan konduktivitas elektroda. Maka, beberapa karbon konduktif seperti grafit, Acethylene Black (AB), Ketjen Black (KB) kembali ditambahkan untuk meningkatkan sifat konduktif dari elektroda. Polimer fluorocarbon seperti Polytetra Fluoroethylene (PTFE), Polyvinylidene-difluoride (PVdF), dan Polyvinyl-fluoride (PVF) biasanya digunakan sebagai pengikat untuk menghubungkan setiap partikel dari bahan elektroda. Foil biasanya digunakan sebagai arus kolektor, karena harus bertahan dengan kondisi oksidasi yang tinggi (~4V vs Li+/Li).
2.3.2 Elektroda negatif (Anoda)
2.3.3 Elektrolit
Elektrolit memiliki lebar potensial yang tidak bereaksi di bawah potensial reduksi yang rendah seperti Li. Maka dari itu, elektrolit biasanya menggunakan solusi organic. Garam Li dilarutkan pada larutan karbonat dengan metode non-air. Karbonat ester dari konstanta dielektrik yang tinggi seperti elthylene carbonate (EC, m.p.36.40C) atau prophylene carbonate (PC,m.p.-54.50C) yang dipakai sebagai larutan. Meskipun sifat-sifat unggul pada daerah suhu yang besar, larutan PC tidak dapat menerima elektroda grafit untuk reaksi pengelupasan (Dey 1970 ; Inaba 1997). Garam Li seperti Lithium hexafluorophosphate (Li PF6) atau
Lithium pherclorate (LiClO4) biasanya digunakan sebagai zat terlarut pada
elektrolit. Garam Li ini tidak stabil dalam air dan mudah terurai, serta menghasilkan jenis asam seperti HF atau HCL. Karena jenis asam ini membuat bahan elektroda dan arus kolektor berkarat, maka jumlah air pada sel baterai harus di bawah level ppm.
2.3.4 Anoda konvensional (Graphite)
Salah satu elektroda negatif yang paling umum digunakan dalam baterai saat ini adalah grafit. Grafit sebagai anoda pada baterai ditunjukkan pada (Gambar 2.4). Karbon atom dalam grafit yang disusun dalam lapisan halus yang diterapkan bersama oleh ikatan van der Waals . atom lithium dapat bergerak di antara lapisan dan disimpan pada pusat cincin karbon, sehingga memungkinkan satu lithium disimpan pada setiap enam karbon; yaitu, membentuk LiC6. Bahan interkalasi
Gambar 2.4 Skematik material elektroda pada baterai ion Li, menggunakan katoda litium metal oxide dan anoda grafit
2.4 Li4Ti5O12 (LTO)
Standar sintesis solid-state secara umum membutuhkan suhu 8000 C atau suhu
yang lebih tinggi untuk mendapatkan produk yang murni. Suhu yang tinggi akan menyebabkan pertumbuhan partikel dan dengan demikian akan menurunkan tingkat kemampuan bahan aktif (Kataoka, 2008; Julien and Zaghib, 2004).
Potensial elektrokimia yang relatif lebih tinggi dengan kapasitas teoritis lebih rendah (1,55 V vs Li+/Li dengan 175 mAh g-1) dibanding dengan grafit (0,1-0,3 V vs Li+/Li dengan 372 mAh g-1), densitas energi dari sel ion Li dengan Li4Ti5O12 berdasarkan elektrodanya menurun dibandingkan pemakaian sel grafit.
Di sisi lain, elektroda Li4Ti5O12 memiliki banyak keuntungan. Beberapa
keuntungan Li4Ti5O12 adalah :
1. Stabilitas siklus hidup yang panjang
Regangan nol menyebabkan stabilitas mekanik material elektroda. 2. Penggunaan kepadatan arus besar
Potensial elektrokimia yang relatif tinggi menyebabkan tidak adanya deposisi logam Li atau pembentukan dendrit pada permukaan elektroda di bawah tingkat tinggi siklus charge-discharge.
3. Stabilitas kimia
kolektor Al, dan dapat membantu untuk merancang biaya rendah, kinerja tinggi dan keselamatan aplikasi sel dengan daya tinggi.
Dengan keuntungan ini elektroda baru yang didasarkan Li4Ti5O12 adalah yang
paling menjanjikan pada skala besar dan aplikasi daya tinggi untuk baterai ion litium.
2.5 Li4Ti5O12 (LTO) doping Al
Li4Ti5O12 memiliki nilai konduktifitas ionik yang rendah sehingga membatasi
tingkat kemampuan elektronik (Rho.Y.H, 2003 ; Amatucci 2001 ; Huang.S, 2006). Untuk meningkatkan nilai konduktifitas tersebut, beberapa cara yang efektif telah diusulkan, termasuk sintesis Li4Ti5O12 (Guerfi.A, 2003 ; Nakahara.K, 2003)
dengan doping ion logam aliovalent (V5+, Mn4+, Fe3+, Al3+, Ga3+, Co3+,Cr
3+, Ni2+,
Mg2+ dan F-) pada Li, Ti atau situs O (Kubiak.P, 2003 ; Huang.S, 2007). Dengan penambahan Al3+ terbentuklah Li4Ti5−xAlxO12 yang dapat meningkatkan
kapasitas reversibel dan stabilitas pada saat pengisian dan pemakaian doping pada Li4Ti5O12 dengan tegangan berkisar 0,5 - 2,5 V (Huang,S. 2005).
Doping Al dan Li4Ti5O12 yang tidak didoping (Al4 – xAlxTi5O12, x=0, 0,05,
0,1 dan 0,2) tersusun oleh reaksi padatan konvensional. LiOH - H2O dan TiO2,
digunakan sebagai bahan baku (Hailei Zhao, 2008). Pada penelitian stuktur dan karakterisasi elektrokimia pada L14-xAlxTi5O12 sebagai material anoda baterai ion
lithium oleh Hailei Zhao, dkk (2008) menunjukkan bahwa Li4Ti5O12 doping Al
dengan rumus kimia L14-xAlxTi5O12 (x=0, 0,05, 0,1 dan 0,2) disintesis dengan
metode reaksi padatan. Doping Al tidak merubah komposisi fasa dan morfologi partikel, tapi mudah menghasilkan distorsi kisi sehingga kristalinitas buruk pada Li4Ti5O12. Kelebihan Al menyebabkan polarisasi elektroda yang besar karena
konduktivitas ion Li yang lebih rendah, sehingga menyebabkan kapasitas yang rendah pada densitas arus tinggi.
J. Y. Lin dkk (2013) mensintesis lithium titanate doping Al dengan rumus kimia Li4-xTi5-xAlxO12 (x=0,05) melalui proses sol-gel. Hasil sintesa menunjukkan
bahwa ada peningkatan kapasitas discharge dan laju kapabilitas yang signifikan.
4TI5-xAlxO12 melalui
reaksi padatan , dan menyelidiki sifat-sifat elektrokimia dengan metode konduksi elektronik, voltametri siklik, dan tes charge-discharge pada rentang tegangan discharge yang berbeda (0-2,5 V dan 1-2,5 V). Hasil penelitian menunjukkan
bahwa doping Al3+ tidak mempengaruhi struktur spinel tapi sangat meningkatkan kapasitas dan kinerja awal. Doping Al3+ berguna bagi interkalasi reversible dan deinterkalasi dari Li+.
Jung Soo Park dkk (2013) mensintesis Li4Ti5O12 sebagai material anoda
baterai ion litium, dengan metoda reaksi padatan (Li(4-x/3)AlxTi(5-2x/3)O12),
menyatakan bahwa suhu kalsinasi optimum untuk Li4Ti5O12 doping Al ditentukan
menjadi 8500 C diantara tiga suhu yaitu, 7500 C, 8500 C, dan 9500 C, berdasarkan struktur dan karakterisasi elektrokimia. Siklus pengujian awal pada Li4Ti5O12
tanpa doping dan doping Al3+ menyatakan bahwa performa elektreokimia pada elektroda yang disiapkan pada suhu 8500 C lebih baik dari pada suhu 7500 C dan 9500 C. Rasio penyimpanan kapasitas pada Li(4-x/3)AlxTi(5-2x/3)O12 (x = 0.01, 0.05,
0.1) lebih dari 99,3% setelah 30 siklus.
Material elektroda praktis biasanya dioptimalkan dengan unsur doping. Pada penelitian yang dilakukan oleh De Li dkk (2015) yaitu efek memori induksi doping pada Li4Ti5O12 doping Al menunjukkan bahwa Li4Ti5O12 terbebas dari
efek memori, sementara efek memori yang berbeda dapat diinduksi oleh doping Al. Setelah dilakukan discharge pada potensial cutoff rendah, Li4Ti5O12 doping Al
menunjukkan kinetika elektrokimia yang buruk, memberikan kelebihan potensial yang besar pada saat proses charging. Ketergantungan atas kelebihan potensial
BAB I
PENDAHULUAN
1.1 Latar Belakang
Saat ini, meningkatnya pertumbuhan pemakaian energi dunia mengarah kepada penipisan bahan bakar fosil seperti batu bara, bensin dan gas. Kecenderungan ini telah mendorong kenaikan harga bahan bakar di pasar dan telah menciptakan ketergantungan yang kuat pada negara penghasil bahan-bahan ini (Scrosati and Garche, 2010). Selain itu, konsumsi besar-besaran dari bahan bakar fosil mengarah ke generasi gas rumah kaca CO2, dan pemanasan global lebih lanjut dan kerusakan lingkungan (Xiangcheng,2015). Untuk mengurangi emisi CO2,
sumber energi terbarukan menjadi semakin penting. Namun, untuk eksploitasi efisiensi sumber cara-cara baru ini dibutuhkan pengembangan energi yang lanjut (Liu et al., 2010).
Baterai adalah salah satu dari penyambung elektrik sel elektrokimia yang memiliki terminal/hubungan untuk memasok energi listrik (Martin and Ralph, 2004). Baterai ion lithium sekarang telah mendominasi pada aplikasi kimia, 60% dari nilai penjualan di seluruh dunia untuk baterai portabel (Tarascon, J.M,2001). Namun performa baterai ini tidak cukup untuk beberapa tuntutan di masa depan, yang meliputi kendaraan listrik, jaringan listrik meratakan beban, dan puncak cukur, yang bersama-sama menetapkan daftar baru tuntutan baterai dalam hal seumur hidup, listrik, dan kepadatan energi.
Ada dua tipe daripada baterai, yaitu baterai primer adalah sebuah sel, atau kumpulan dari sel, untuk pebangkitan energi listrik yang dimaksudkan untuk digunakan sampai habis dan dibuang. Baterai primer dirakit pada keadaan terisi;
discharge adalah proses primer pada saaat operasi.
dahulu sebelum menjalani discharge pada proses sekunder (Martin and Ralph,
2004).
Li4Ti5O12 memiliki cyclability yang sangat baik dan memiliki sifat
keselamatan, yang saat ini digunakan sebagai anoda pada baterai ion lithium untuk sebagian besar teknologi baru. Aplikasi LTO pada kendaraan listrik (EV) dan kendaraan listrik hibrida (HEV) sangat besar (Liu et al., 2010), sementara aplikasi skala besar untuk menyimpan energi, misalnya pembangkit listrik tenaga surya, berada di bawah. Baterai ion lithium bisa membantu masyarakat memperoleh manfaat dari energi yang berkelanjutan, melalui penyelamatan lingkungan dan penebusan ekonomi.
Atom Al cenderung mensubtitusi Ti pada doping rendah dan mensubtitusi Li pada doping tinggi. Doping Al pada serbuk Li4Ti5O12 tidak merubah struktur
kristal dan dikonfirmasi dari hasil XRD, dengan meningkatnya doping Al menyebabkan morfologi partikel beraglomerasi dan berpori, surface area stabil, ukuran partikel cenderung turun, konduktifitas meningkat namun kapasitas berkurang (Priyono.S, 2014).
Dalam pembuatan sel baterai, hal yang paling penting adalah membuat lembaran. Lembaran harus memiliki komposisi bahan yang tepat, memiliki daya rekat yang baik, memiliki konduktifitas tinggi dan ketebalan yang sesuai. Lembaran dibuat dengan mencampurkan material aktif dengan binder (PVDF), Super P, dan pelarut (DMAC). Dalam proses pembuatan lembaran elektroda ada beberapa parameter yang harus diperhatikan seperti komposisi bahan, lama pencampuran, suhu pemanasan, kecepatan pencampuran, viskositas slurry, ketebalan lapisan, kecepatan lapisan, suhu dan lama pengeringan (Sari.S.P, 2015).
Ketebalan lapissan akan mempengaruhi performa sel baterai karena berhubungan dengan jarak yang ditempuh elektron dari interface Anoda/elektrolit menuju current collector (Cu Foil). Semakin tebal lapisan maka jalur elektron
akan semakin panjang sehingga effisiensi sel baterai semakin menurun karena aliran elektron akan terhambat pada material aktif. Selain itu, meningkatnya ketebalan lapisan juga dapat menyebabkan hambatan dalam meningkat yang mengakibatkan self discharge semakin besar. Ilustrasi jarak tempuh elektron dari
Kerapatan daya/power spesific dan kepadatan energi spesifik dari baterai
sangat bergantung pada ketebalan lapisan material aktif pada current collector.
Ketebalan lapisan bahan elektroda memberikan energi yang tinggi karena jumlah pada bahan aktif yang besar, tetapi juga meningkatkan panjang difusi ion dalam material LTO sehingga menurunkan daya. Sebaliknya, lapisan tipis elektroda memberikan jalur difusi singkat sehingga power density lebih tinggi. Tetapi
materi aktif kurang banyak dan akibatnya energy density tersebut menurun. Selain
itu, optimasi ketebalan lapisan dapat mengefisienkan biaya produksi (Nordh, 2013).
Katoda Anoda
Cu Foil
Coating (LTO+AB+PVDF)
Elektron
Pergerakan elektron menuju Cu Foil melalui
coating
e
-e- e
-e
-Tebal coating
[image:45.595.174.452.276.496.2]Elektrolit
Gambar 1.1 Pengaruh ketebalan lapisan terhadap laju elektron
Dalam penelitian ini akan dibuat lembaran anoda dengan berbahan dasar serbuk LTO yang fokus pada pengaruh variasi ketebalan lapisan material aktif terhadap performa sel baterai.
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah dijelaskan diatas, maka permasalahan dalam penelitian ini adalah bagaimana pengaruh variasi ketebalan coating LTO doping Al terhadap performa sel baterai (energy density dan power density)
lithium dan mencari ketebalan optimum sehingga nantinya dihasilkan lembaran anoda yang dapat meningkatkan performa dari sel baterai ion lithium.
1.3 Batasan Masalah
Batasan masalah dalam penelitian ini adalah:
1. Penelitian ini difokuskan pada sintesis dan pembuatan lembaran anoda LTO dopig Al.
2. Bahan baku yang digunakan adalah serbuk LiOH.H2O, TiO2, dan Al2O3
teknis dengan metode metalurgi serbuk.
3. Pengujian dilakukan dengan Cyclic Voltametry hanya siklus pertama dan Charge-Discharge sampai siklus ketiga.
4. Penelitian ini difokuskan pada mencari hubungan ketebalan lapisan dengan kapasitas spesifik.
1.4 Tujuan Penelitian Tujuan dari penelitian ini adalah:
1. Untuk melakukan sintesis LTO doping Al sebagai material anoda.
2. Untuk membuat lembaran anoda dengan variasi ketebalan lapisan serbuk
LTO doping Al.
3. Untuk mengetahui konduktifitas listrik lembaran anoda LTO doping Al
dan konduktivitas ionik sel setengah baterai.
4. Untuk mengetahui pengaruh variasi ketebalan dalam pembuatan lembaran
anoda LTO doping Al terhadap performa elektrokimia (kapasitas spesifik)
sel baterai pada anoda LTO doping Al dari kurva cyclic-voltammetry dan
charge-discharge.
1.5 Manfaat Penelitian
1.6 Sistematika Penulisan
Adapun sistematika dalam penulisan Skripsi ini mencakup beberapa bab dan subbab seperti dijelaskan di bawah ini:
BAB 1 : Pendahuluan
Bab ini terdiri atas latar belakang penelitian, rumusan masalah, tujuan penelitian, manfaat penelitian, batasan masalah dalam penelitian, serta sistematika penulisan laporan penelitian.
BAB 2 : Tinjauan Pustaka
Bab ini berisi dasar-dasar teori yang terkait kajian dan analisa dalam penelitian, yakni teori baterai secara umum, baterai ion lithium, komponen baterai, Material Anoda, LTO doping Al, dan beberapa perbandingan baterai berbahan baku serbuk LTO dengan baterai berbahan material yang lain.
BAB 3 : Metodologi Penelitian
Bab ini berisi tempat dan waktu penelitian, metode yang digunakan dalam penelitian meliputi bahan dan peralatan yang digunakan serta diagram alir penelitian.
BAB 4 : Hasil dan Pembahasan
Bab ini mencakup pembahasan dari hasil penelitian berupa hasil Konduktivitas, cyclic voltammetry dan charge/discharge.
BAB 5 : Kesimpulan dan Saran
FABRIKASI LITHIUM TITANATE TERDOPING Al (Li4Ti4,975Al0,025O12) DAN STUDI PENGARUH KETEBALAN LEMBARAN ELEKTRODA PADA
SEL SETENGAH BATERAI ION LITHIUM
ABSTRAK
Sintesis serbuk dan pembuatan lembaran anoda Li4Ti5O12 doping Al (x=0,025)
telah berhasil dilakukan. Sintesis serbuk LTO doping Al dilakukan dengan metode solid state sedangkan pembuatan lembaran anoda dilakukan dengan metode coating doctor blade. Pembuatan lembaran dilakukan dengan memvariasi ketebalan coating 100µm, 200µm, 300µm dan 400µm. untuk mengetahui pengaruh ketebalan coating terhadap performa sel baterai. Pengujian yang dilakukan meliputi analisa fasa dengan menggunakan EIS, CV dan CD. Hasil analisa XRD menunjukkan ada dua fasa yang tebentuk, yaitu fasa Lithium Titanium Oxide (Li1.333Ti1.667O4) sebanyak 75,6 % dan fasa Rutile, syn (TiO2)
sebanyak 24,4%. Hasil EIS menunjukkan bahwa semakin tebal lapisan coating maka konduktifitas sampel semakin besar. Selanjutnya hasil CV menunjukkan bahwa sampel 100µm, 200µm dan 300µm memiliki puncak oksidasi/reduksi yang tajam sedangkan sampel 400µm memiliki puncak yang melebar. Sedangkan kapasitas sel baterai semakin menurun seiring dengan meningkatnya ketebalan coating, kapasitas sel terbaik yang diperoleh adalah kapasitas Charge sebesar
137,08 mAh/g dan kapasitas discharge sebesar 134,3 mAh/g.
Al DOPED LITHIUM TITANATE FABRICATION (Li4Ti4,975Al0,025O12) AND STUDY EFFECT OF COATING THICKNESS ELECTRODE SHEET
ON THE HALF CELL LITHIUM ION BATTERY
ABSTACT
The effect of coating thickness of Al doped Li4Ti5O12 (LTO) sheet on the
electrochemical performance of battery cells have been investigated. 0.025 mol Al doped LTO powder was synthesized by solid state reaction method, while the manufacture of the anode sheet was made by Doctor Blade coating method. Manufacture of sheet was done by varying the thickness of the coating (100um, 200um, 300um and 400um) to determine the effect of coating thickness on the electrochemical performance of the battery cell. Testing was conducted on the analysis of phase with XRD and electrochemical performance was conducted by using EIS, CV and CD. XRD analysis showed that there are two phases that were formed i.e Lithium Titanium Oxide phase (Li1.333Ti1.667O4) and rutile phase, syn
(TiO2) as much as 75.6% and 24.4% respectively. EIS results showed that the
thicker the coating layer, the conductivity of the sample become greater. Furthermore, the results indicate that the sample CV 100 um, 200 um and 300um have a sharp oxidation/reduction peak while 400um has wide redox peaks. While the specific capacity and specific power of the half cell battery decreases with the increasing of coating thickness. The best cell capacity is obtained by sample with 100 um thickness with specific charge capacity of 137.08 mAh/g and specific discharge capacity of 134.3 mAh / g.
FABRIKASI LITHIUM TITANATE TERDOPING Al (Li
4Ti
4,975Al
0,025O
12)
DAN STUDI PENGARUH KETEBALAN LEMBARAN ELEKTRODA
PADA SEL SETENGAH BATERAI ION LITHIUM
SKRIPSI
GIASSANISTYA FADILLAH MARPAUNG 120801016
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA MEDAN
FABRIKASI LITHIUM TITANATE TERDOPING Al (Li
4Ti
4,975Al
0,025O
12)
DAN STUDI PENGARUH KETEBALAN LEMBARAN ELEKTRODA
PADA SEL SETENGAH BATERAI ION LITHIUM
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
GIASSANISTYA FADILLAH MARPAUNG 120801016
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
LEMBAR PENGESAHAN
FABRIKASI LITHIUM TITANATE TERDOPING Al (Li
4Ti
4,975Al
0,025O
12)
DAN STUDI PENGARUH KETEBALAN LEMBARAN ELEKTRODA
PADA SEL SETENGAH BATERAI ION LITHIUM
OLEH:
NIM: 120810016
Giassanistya Fadillah Marpaung
Disetujui Oleh: Komisi Pembimbing
NIP : 1972111552000121001 NIP : 198610152009121004 Tua Raja Simbolon, S.Si.,M.Si. Slamet Priyono S.Si, M.T
Diketahui Oleh:
Departemen Fisika FMIPA USU Pusat Penelitian Fisika-LIPI
Ketua, Kepala,
PERSETUJUAN
Judul : Fabrikasi Lithium Titanate Terdoping Al (Li4Ti4,975Al0,025O12) dan Studi Pengaruh
Ketebalan Lembaran Elektroda pada Sel Setengah Baterai Ion Lithium
Kategori : Skripsi
Nama : Giassanistya Fadillah Marpaung Nomor Induk Mahasiswa : 120801016
Program studi : Sarjana (S1) Fisika Departemen : Fisika
Fakultas : Matematika Dan Ilmu Pengetahuan Alam
Disetujui di: Medan, Juli 2016
Disetujui Oleh
Pembimbing 1, Pembimbing 2,
NIP : 1972111552000121001 NIP : 198610152009121004 Tua Raja Simbolon, S.Si.,M.Si. Slamet Priyono S.Si, M.T
Departemen Fisika FMIPA USU Ketua,
PERNYATAAN
FABRIKASI LITHIUM TITANATE TERDOPING Al (Li
4Ti
4,975Al
0,025O
12)
DAN STUDI PENGARUH KETEBALAN LEMBARAN ELEKTRODA
PADA SEL SETENGAH BATERAI ION LITHIUM
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing- masing disebutkan sumbernya.
Medan, Juli 2016
PENGHARGAAN
Alhamdulillah, puji syukur kepada Allah SWT, Tuhan semesta alam yang telah memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan tugas akhir dengan baik. Salawat beriring salam teruntuk nabi besar Muhammad SAW yang menjadi teladan dalam menjalani kehidupan. Tugas akhir merupakan salah satu persyaratan untuk memperoleh gelar sarjana pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara Medan. Untuk memenuhi persyaratan diatas penulis mengerjakan tugas akhir dengan judul : “FABRIKASI
LITHIUM TITANATE TERDOPING Al (Li4Ti4,975Al0,025O12) DAN STUDI
PENGARUH KETEBALAN LEMBARAN ELEKTRODA PADA SEL SETENGAH BATERAI ION LITHIUM” yang dilaksanakan di Laboratorium Baterai P2F Lembaga Ilmu Pengetahuan Indonesia, Serpong, Tangerang Selatan, Banten.
Penulis menyadari bahwa selama proses hingga akhir terselesaikannya penyusunan skripsi ini bayak sekali bimbingan dan bantuan dari berbagai pihak. Dengan segala kerendahan hati, penulis ingin menyampaikan rasa terima kasih dan penghargaan yang sebesar-besarnya kepada :
1. Bapak Dr. Kerista Sebayang, Ms selaku Dekan Fakultas Matematika dan ilmu Pengetahuan Alam Universitas Sumatera Utara Medan.
2. Bapak Dr. Marhaposan Situmorang selaku ketua Departemen Fisika Fakultas Matematika dan Pengetahuan Alam Universitas Sumatera Utara, Bapak Drs. Syahrul Humaidi, M.Sc selaku sekretaris Departemen Fisika FMIPA USU, beserta seluruh bapak/ibu staf pengajar dan para pegawai administrasi di Departemen Fisika yang telah memberikan fasilitas kepada penulis selama perkuliahan.
4. Bapak Drs. Syahrul Humaidi,M.Sc, Ibu Dra. Sudiati,M.Si dan Bapak Drs. Aditia Warman,M.Si selaku dosen penguji yang telah memberikan banyak saran sehingga skripsi ini menjadi lebih baik.
5. Bapak Dr. Bambang Widyatmoko, M.Eng, selaku Kepala Laboratorium Pusat Penelitian Fisika P2F-LIPI Serpong serta seluruh staf pegawai yang telah membantu penulis dalam menyelesaikan skripsi.
6. Kedua orang tua tercinta: bapak saya Sahala Marpaung dan Ibu saya Wiyah Yanti Mala, yang tak pernah berhenti mendoakan, memberi nasihat, serta memberi dukungan moral dan finansial kepada penulis. Dan kepada adik semata wayang saya Suci Tasya Hasian Marpaung, terima kasih selalu menjadi pelangi dalam kehidupan ini.
7. Bapak Dr. Ir. Bambang Prihandoko, M.T selaku Ketua Tim Baterai di LP2F-LIPI. Bapak Nurhalis Majid, M.Sc, Bapak Achmad Subhan, M.T, Bapak Ibrahim Purwadi, M.Si dan seluruh staf Tim Baterai yang sudah sangat bersedia membantu penelitian ini sehingga dapat diselesaikan dengan baik. 8. Teman-teman Tim Baterai di LP2F-LIPI: Kana Cicik, Elisabeth, Mia yang
bersedia meluangkan waktu untuk belajar bersama.
9. Asisten Laboratorium Fisika Dasar LIDA USU yang bersedia memberi masukan terbaik pada skripsi ini.
10. Teman-teman seperjuangan di kampus, terkhusus kepada Street Fighter: Eva, Devi, Andi, Fatimah, Balyan, Iqbal, Dina, Mona, Rahmat. Terima kasih untuk perjuangan bersama selama 4 tahun
11. Sahabat-sahabat terbaik dan terkasih, M. Zamzamy Afrijal, Vivi Feronica Syifa, Dessy Meylinda, Andi Hardiansyah, dan Sri Musfika yang tak pernah bosan mendengarkan keluh kesah selama ini. Dan kepada adik-adik: Nur Rahma, Aida Nisya, Ashar Bestari, Ahmad Husein yang tak henti memberi semangat dalam pengerjaan skripsi.
12. Seluruh teman – teman angkatan 2012, Adik - adik angkatan 2013, 2014 dan 2015 Fisika – USU yang tak dapat penulis sebutkan satu persatu.
Medan, Juli 2016
FABRIKASI LITHIUM TITANATE TERDOPING Al (Li4Ti4,975Al0,025O12) DAN STUDI PENGARUH KETEBALAN LEMBARAN ELEKTRODA PADA
SEL SETENGAH BATERAI ION LITHIUM
ABSTRAK
Sintesis serbuk dan pembuatan lembaran anoda Li4Ti5O12 doping Al (x=0,025)
telah berhasil dilakukan. Sintesis serbuk LTO doping Al dilakukan dengan metode solid state sedangkan pembuatan lembaran anoda dilakukan dengan metode coating doctor blade. Pembuatan lembaran dilakukan dengan memvariasi ketebalan coating 100µm, 200µm, 300µm dan 400µm. untuk mengetahui pengaruh ketebalan coating terhadap performa sel baterai. Pengujian yang dilakukan meliputi analisa fasa dengan menggunakan EIS, CV dan CD. Hasil analisa XRD menunjukkan ada dua fasa yang tebentuk, yaitu fasa Lithium Titanium Oxide (Li1.333Ti1.667O4) sebanyak 75,6 % dan fasa Rutile, syn (TiO2)
sebanyak 24,4%. Hasil EIS menunjukkan bahwa semakin tebal lapisan coating maka konduktifitas sampel semakin besar. Selanjutnya hasil CV menunjukkan bahwa sampel 100µm, 200µm dan 300µm memiliki puncak oksidasi/reduksi yang tajam sedangkan sampel 400µm memiliki puncak yang melebar. Sedangkan kapasitas sel baterai semakin menurun seiring dengan meningkatnya ketebalan coating, kapasitas sel terbaik yang diperoleh adalah kapasitas Charge sebesar
137,08 mAh/g dan kapasitas discharge sebesar 134,3 mAh/g.
Al DOPED LITHIUM TITANATE FABRICATION (Li4Ti4,975Al0,025O12) AND STUDY EFFECT OF COATING THICKNESS ELECTRODE SHEET
ON THE HALF CELL LITHIUM ION BATTERY
ABSTACT
The effect of coating thickness of Al doped Li4Ti5O12 (LTO) sheet on the
electrochemical performance of battery cells have been investigated. 0.025 mol Al doped LTO powder was synthesized by solid state reaction method, while the manufacture of the anode sheet was made by Doctor Blade coating method. Manufacture of sheet was done by varying the thickness of the coating (100um, 200um, 300um and 400um) to determine the effect of coating thickness on the electrochemical performance of the battery cell. Testing was conducted on the analysis of phase with XRD and electrochemical performance was conducted by using EIS, CV and CD. XRD analysis showed that there are two phases that were formed i.e Lithium Titanium Oxide phase (Li1.333Ti1.667O4) and rutile phase, syn
(TiO2) as much as 75.6% and 24.4% respectively. EIS results showed that the
thicker the coating layer, the conductivity of the sample become greater. Furthermore, the results indicate that the sample CV 100 um, 200 um and 300um have a sharp oxidation/reduction peak while 400um has wide redox peaks. While the specific capacity and specific power of the half cell battery decreases with the increasing of coating thickness. The best cell capacity is obtained by sample with 100 um thickness with specific charge capacity of 137.08 mAh/g and specific discharge capacity of 134.3 mAh / g.
DAFTAR ISI
Halaman
Persetujuan i
Pernyataan ii
Penghargaan iii
Abstrak v
Abstract vi
Daftar Isi vii
Daftar Tabel ix
Daftar Gambar x
Daftar Lampiran xi
BAB I PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Rumusan Masalah 3
1.3 Batasan Masalah 4
1.4 Tujuan Penelitian 4
1.5 Manfaat Penelitian 4
1.6 Sistematika Penulisan 5
BAB II TINJAUAN PUSTAKA 6
2.1 Baterai 6
2.1.1 Cara Kerja Baterai 8
2.2 Baterai Ion Lithium 9
2.3 Bagan-Bagian Baterai 11
2.3.1 Elektroda Positif (Katoda) 11 2.3.2 Elektroda Negatif (Anoda) 11
2.3.3 Elektrolit 12
2.3.4 Anoda Konvensional (Graphite) 12
2.5 Li4Ti5O12 (LTO) Doping Al 14
BAB III METODOLOGI PENELITIAN 16
3.1 Waktu dan Tempat Penelitian 16
3.2 Bahan dan Peralatan Penelitian 16
3.2.1 Bahan 16
3.2.2 Peralatan Penelitian 16
3.3 Perhitungan Massa Bahan 18
3.4 Tahapan Penelitian 18
3.4.1 Sintesis LTO Doping Al 18
3.4.2 Pembuatan Lembaran LTO Doping Al 19
3.5 Prosedur Penelitian 20
3.5.1 Sintesis LTO Doping Al 20
3.5.2 Pembuatan Lembaran LTO Doping Al 20 3.5.2.1 Tahapan Pembuatan Slurry 20 3.5.2.2 Tahapan Pelapisan (Pencetakan Lembaran) 21
BAB IV HASIL DAN PEMBAHASAN 22
4.1 Lembaran Anoda LTO Doping Al Variasi Ketebalan 22 4.2 Analisa Fasa dan Struktur dengan XRD (X-Ray Difraction) 23 4.3 Analisa Electrochemical Impedance Spectroscopy (EIS) 24
4.3.1 Uji Konduktifitas Listrik Lembaran Anoda 24 4.3.2 Hasil Pengukuran Konduktifitas Sele Setengah Baterai 25 4.4 Analisa Cyclic Voltametry (CV) 27
4.5 Analisa Charge-Discharge (CD) 29
BAB V KESIMPULAN DAN SARAN 33
5.1 Kesimpulan 33
5.2 Saran 34
DAFTAR TABEL
Halaman
Tabel 2.1 Karakteristik Perbandingan Kinerja Baterai Sekunder 10 Tabel 3.1 Massa bahan baku LTO doping Al 18 Tabel 4.1 Hasil Analisis Struktur Kristal (Parameter Kisi) 24
Li4Ti0,025O12 dengan Metode Rietveld
Tabel 4.2 Hasil Analisa EIS pada LTO Doping Al 27 Tabel 4.3 Data Hasil Analisa CV pada LTO Doping Al 29 Tabel 4.4 Data Hasil Analisa Charge-Discharge pada 30
LTO Doping Al Variasi Ketebalan
DAFTAR GAMBAR
Halaman
Gambar 1.1 Pengaruh Ketebalan Lapisan Terhadap Laju Elektron 3 Gambar 2.1 Representasi Skematis dari Aplikasi Baterai Isi Ulang 6 Gambar 2.2 Skematik dari Prinsip Umum Baterai 9 Gambar 2.3 Prinsip Kerja Umum Pengisian/Proses Pemakaian 11
Baterai Ion Lithium yang Dapat Diisi Ulang
Gambar 2.4 Skematik Material Elektroda pada Baterai Ion Li, 13 Menggunakan Lithium Metal Oxide dan Anoda Grafit Gambar 3.1 Kurva Tahapan Peningkatan Suhu pada Proses Sintering 20 Gambar 4.1 Hasil Lembaran Anoda LTO Doping Al dengan Variasi 22
Ketebalan Lapisan pada Sampel G-1, G-2, G-3, dan G-4
Gambar 4.2 Analisis Kualitatif XRD serbuk LTO Doping Al 24 Gambar 4.3 Hasil Pengukuran Konduktifitas Listrik Lemabran LTO 25
Doping Al Variasi Ketebalan
Gambar 4.4 Plot Impedansi Hasil Uji EIS pada Sampel G-1, G-2, G-3, 26 dan G-4
Gambar 4.5 Voltamogram Siklik LTO Doping Al pada sampel 28 G-1, G-2, G-3, dan G-4
Gambar 4.6 Kurva Analisa Charge-Discharge pada Sampel G-1, G-2, 29
G-3, dan G-4
Gambar 4.7 Hasil Pengukuran Energy Density pada Lembaran 31
Anoda LTO Doping Al Variasi Ketebalan
Gambar 4.8 Hasil Pengukuran Energy Density pada Lembaran 32
DAFTAR LAMPIRAN
Lampiran A Perhitungan Stoikiometri
1. Perhitungan massa bahan LTO doping Al 2. Perbandingan komposisi LTO : PVDF : AB Lampiran B 1. Perhitungan Luas Lembaran LTO doping Al
2. Menghitung Nilai Konduktivitas Sel 3. Menghitung Energy Density
4. Menghitung Power Density 5. Menghitung Efesiensi Baterai Lampiran C 1. Gambar Pelaratan
2. Gambar Bahan