SKRIPSI
PENGARUH PEMANASAN TERHADAP KEMAMPUAN EKSTRAK GULA TALAS (Colocasia esculenta (L) Schott) UNTUK MENDUKUNG
PERTUMBUHAN BAKTERI ASAM LAKTAT DAN EVALUASI IN VIVO POTENSI PREBIOTIK
Oleh : HANA F24102074
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
Hana. F24102074. Pengaruh Pemanasan terhadap Ekstrak Gula Talas (Colocasia
esculenta (L) Schott) untuk Mendukung Pertumbuhan Bakteri Asam Laktat dan
Evaluasi In Vivo Potensi Prebiotik. Di bawah bimbingan : Dr. Ir. Feri Kusnandar, M.Sc. dan Dr. Ir. Lilis Nuraida, M.Sc.
RINGKASAN
Salah satu kelompok pangan fungsional yang sedang dikembangkan beberapa tahun terakhir ini adalah prebiotik, probiotik dan sinbiotik yang bermanfaat bagi kesehatan pencernaan manusia. Prebiotik merupakan suatu konsep untuk meningkatkan jumlah bakteri target tertentu (khususnya BAL) yang telah ada dalam kolon. Beberapa jenis prebiotik yang kini populer termasuk dalam kelompok oligosakarida, seperti rafinosa, stakhiosa, verbaskosa dan FOS (Fruktooligosakarida).
Talas merupakan salah satu jenis bahan pangan alternatif sebagai sumber karbohidrat. Ekstrak gula talas mentega diketahui mengandung rafinosa (50.88 ppm) dan dapat digunakan untuk mendukung pertumbuhan beberapa bakteri asam laktat (Lactobacillus casei Shirota, L. casei Rhamnosus, Lactobacillus G3,
Bifidobacterium longum dan B. bifidum) secara in vitro sehingga talas berpotensi
menjadi salah satu sumber prebiotik.
Tujuan penelitian ini adalah untuk mengetahui pengaruh pemanasan terhadap kandungan ekstrak oligosakarida tepung talas mentega dan mengetahui potensi prebiotik ekstrak oligosakarida umbi talas mentega dalam sistem pencernaan hewan percobaan. Percobaan dilakukan dengan membuat tepung talas melalui pengeringan dan penggilingan irisan talas mentega, kemudian tepung talas mentega yang dihasilkan dibagi dalam tiga perlakuan, yaitu pengukusan, pemanggangan dan penyangraian, hasil pengolahan tersebut kemudian ditepungkan kembali. Oligosakarida dari tepung talas mentega segar dan pengolahan diekstrak dengan menggunakan pelarut etanol 70%, dan ekstrak yang dihasilkan dipekatkan dengan evaporator vakum.
Kandungan ekstrak gula tepung talas mentega segar dan hasil pemanasan dianalisa secara kualitatif dengan kromatografi kertas. Disamping itu juga dilakukan uji pertumbuhan BAL secara in vitro. Tahap uji pertumbuhan BAL dilakukan dengan menggunakan media berbasis MRS Broth (de Mann Rogosa
Sharpe) dimana komponen gulanya disubstitusi dengan ekstrak gula talas mentega
segar dan pengolahan. Setiap media tersebut diinokulasikan dengan salah satu dari empat jenis BAL, yaitu L. casei Shirota, L.casei Rhamnosus, B. bifidum, dan B.
longum. Nilai absorbansi diukur pada hari ke-0 dan hari ke-2 setelah diinkubasi
selama 48 jam pada suhu 37oC.
Tahap in vivo dilakukan dengan menggunakan 27 ekor tikus jantan galur
Sprague Dawley berumur 2 bulan. Ekstrak gula talas mentega segar dan BAL
perlakuan (pemberian ransum standar). Kandungan total mikroba, jumlah BAL
dan E. coli serta keberadaan Salmonella secara kualitatif diuji pada feses tikus
dengan pengambilan sampel pada hari ke-0, 4 dan 10 perlakuan serta hari ke-4 dan 9 pasca perlakuan.
Tepung talas mentega segar menghasilkan rendemen sebesar 25.61%. Hasil penepungan kembali olahan tepung talas mentega menghasilkan rendemen hasil pengukusan, pemanggangan dan penyangraian berturut-turut sebesar 48.88%, 37.54% dan 95.48% (dihitung berdasarkan perbandingan jumlah tepung yang dihasilkan dengan jumlah tepung talas segar yang digunakan). Hasil analisis kromatografi kertas menunjukan ekstrak gula tepung talas mentega segar mengandung glukosa, fruktosa, sukrosa, rafinosa, oligofruktosa dan inulin. Tepung talas mentega hasil olahan juga secara kualitatif masih menunjukan kandungan gula-gula tersebut. Hal ini dapat disebabkan karena panas yang digunakan belum cukup untuk mendegradasi seluruh bagian gula pada tepung talas mentega. Pengolahan (pemanggangan dan pengukusan) juga diduga membebaskan gula sederhana dan oligosakarida melalui gelatinisasi pati dan hidrolisis fraksi karbohidrat.
Hasil uji pertumbuhan BAL (L. casei Shirota, L. casei Rhamnosus, B.
longum dan B. bifidum) menggunakan gula standar (glukosa, rafinosa,
oligofruktosa dan inulin) menunjukan glukosa dan rafinosa secara umum memiliki nilai absorbansi paling tinggi diantara dua gula lainnya. Hal ini dikarenakan BAL lebih mudah mendegradasi dan mencerna gula yang lebih sederhana. Hasil uji pertumbuhan BAL pada ekstrak gula talas menunjukan bahwa keempat BAL uji dapat menggunakan ekstrak gula tepung talas mentega baik tepung talas mentega segar maupun yang sudah mengalami perlakuan panas. Hasil uji pertumbuhan BAL menunjukan nilai absorbansi pada ekstrak gula talas hasil pengukusan dan pemanggangan lebih tinggi dari yang dicapai ekstrak gula talas mentega segar, diduga karena kandungan oligosakarida dan (terutama) kandungan gula sederhananya lebih tinggi. Kurang baiknya pertumbuhan BAL pada ekstrak gula tepung sangrai dapat terjadi karena fraksi gula tepung sangrai mengalami peleburan dan pencokelatan non enzimatis sehingga hanya sedikit gula yang dapat digunakan untuk pertumbuhan BAL.
Meskipun ekstrak gula talas mentega hasil pemanggangan dan pengukusan menunjukan nilai pertumbuhan BAL yang lebih baik, ekstrak gula yang digunakan dalam uji in vivo adalah ekstrak gula talas mentega segar. Hal tersebut didasarkan pada pertimbangan bahwa pertumbuhan BAL pada ekstrak gula tepung hasil pemanggangan dan pengukusan dapat disebabkan karena penggunaan gula sederhana yang terkandung dalam ekstrak. Sedangkan pada saluran pencernaan mamalia gula sederhana tersebut akan diserap sebelum mencapai kolon, sehingga belum tentu ekstrak gula talas pengukusan dan pemanggangan memiliki sifat prebiotik yang lebih baik dibandingkan kestrak gula talas mentega segar. BAL yang digunakan untuk uji in vivo adalah L. casei Rhamnosus karena menunjukan pertumbuhan paling tinggi pada ekstrak gula tepung talas mentega segar.
Pemberian ekstrak gula talas mentega sebagai prebiotik, L. casei
usus dengan kandungan E. coli yang cukup tinggi. Kandungan oligosakarida dalam ekstrak gula yang diberikan diduga masih belum mencukupi untuk meningkatkan populasi BAL dalam saluran pencernaan tikus. Selain itu kemungkinan bahwa E. coli dapat menggunakan prebiotik yang diberikan dapat menjadi sebab jumlah BAL sulit meningkat karena harus bersaing dengan E. coli.
Pemberian L. casei Rhamnosus tidak berhasil menurunkan jumlah E. coli
PENGARUH PEMANASAN TERHADAP KEMAMPUAN EKSTRAK GULA TALAS (Colocasia esculenta (L) Schott) UNTUK MENDUKUNG
PERTUMBUHAN BAKTERI ASAM LAKTAT DAN EVALUASI IN VIVO POTENSI PREBIOTIK
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan,
Fakultas Teknologi Pertanian, Institut Pertanian Bogor
Oleh: HANA F24102074
2007
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PENGARUH PEMANASAN TERHADAP KEMAMPUAN EKSTRAK GULA TALAS (Colocasia esculenta (L) Schott) UNTUK MENDUKUNG
PERTUMBUHAN BAKTERI ASAM LAKTAT DAN EVALUASI IN VIVO POTENSI PREBIOTIK
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan,
Fakultas Teknologi Pertanian, Institut Pertanian Bogor
Oleh: HANA F24102074
Dilahirkan pada tanggal 2 November 1983 Di Bogor
Tanggal lulus : 11 Mei 2007 Disetujui
Bogor, Juni 2007
Dr. Ir. Feri Kusnandar, M.Sc. Dr. Ir. Lilis Nuraida, M.Sc.
Dosen Pembimbing I Dosen Pembimbing II
Mengetahui,
RIWAYAT HIDUP
Penulis bernama lengkap Hana, dilahirkan di Bogor pada tanggal 2 November 1983. Penulis adalah putri ke-tiga dari empat bersaudara dari pasangan Abdul Aziz Harran dan Ratu Erna Darmiasih. Pendidikan dasarnya diselesaikan di SD Al-Irsyad Al-Islamiyah, Bogor pada tahun 1996, dilanjutkan di SLTP Negeri 1 Bogor pada tahun 1996-1999 dan di SMUN 1 Bogor pada tahun 1999-2002. Penulis melanjutkan pendidikannya di Institut Pertanian Bogor, Fakultas Teknologi Pertanian, Departemen Ilmu dan Teknologi Pangan melalui jalur USMI (Ujian Saringan Masuk IPB).
Penulis melakukan penelitian yang berjudul “Evaluasi Potensi Prebiotik Umbi Talas (Colocasia esculenta (L) Schott) In Vivo” sebagai tugas akhir dibawah bimbingan Dr. Ir. Feri Kusnandar, MSc. dan Dr. Ir. Lilis Nuraida, MSc. Penelitian tersebut terselenggara berkat program pendanaan Research Grant
Hibah Bersaing.
KATA PENGANTAR
Penulis menyampaikan puji dan syukur kepada Allah SWT, karena hanya dengan karunia-Nya penulis dapat menyelesaikan penelitian dan penulisan skripsi yang berjudul “Pengaruh Pemanasan terhadap Ekstrak Gula Talas (Colocasia
esculenta (L) Schott) untuk Mendukung Pertumbuhan Bakteri Asam Laktat dan
Evaluasi In Vivo Potensi Prebiotik”. Tulisan ini adalah salah satu persyaratan untuk memperoleh gelar Sarjana Teknologi Pertanian di Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan ucapan terimakasih yang sebesar-besarnya kepada :
1. Dr. Ir. Feri Kusnandar, M.Sc. selaku Dosen Pembimbing Akademik dan Dr. Ir. Lilis Nuraida, M.Sc. selaku Pembimbing II atas petunjuk, saran dan bimbingannya selama penulis menjadi mahasiswa S1 serta dalam penelitian hingga selesainya penulisan skripsi ini.
2. Dr. Ir. Nurheni Sri Palupi, M.Si. atas kesediaannya menjadi penguji serta atas nasehat dan saran perbaikan dalam penyusunan skripsi ini.
3. Pihak Research Grant Hibah Bersaing atas bantuan dana dalam pelaksanaan penelitian ini.
4. Ayahanda Abdul Aziz Harran, Ibunda Ratu Erna Darmiasih, Hala Nikmah, Kak Luthfi, Mbak Era, Kak Nia, dan Hani serta seluruh keluarga besar yang telah memberikan semangat, dorongan dan doa yang tulus bagi penulis selama menempuh kuliah dan menyelesaikan penelitian.
5. Para staf dan laboran di laboratorium Departemen ITP dan SEAFAST atas segala bantuan dan kerepotannya.
6. Rekan tim prebiotik; Mbak Nani, Bu Rini dan Kiky atas kerjasamanya dalam duka cita selama penelitian.
Tim RS, serta adik-adik TPG 40; Purwono, Angel, Abdy, Andal, Lilin, Noor dan Asih.
8. Dhenok, Sari, Rina, Meilina, Dian, Dikres, Vero, Mba Kiki, Kanyaka dan Eva atas segala drama yang terjadi selama empat-lima tahun ini dan semoga terus ada episode-episode baru.
9. Rekan-rekan satu bimbingan; Astri, Samsul dan Irwan.
10. Kelompok C-3; Molid, Yudhan dan Bobby atas kebersamaan dan kerusuhan dalam praktikum selama ini.
11. Golongan C atas keramaian, kebingungan dan kebersamaan selama hampir empat tahun.
12. Rekan TPG 39 atas segala warna dalam hidup.
13. Mbak Putri, Kak Manda dan Teh Novi atas bantuan dan konsultasi jarak jauhnya selama penelitian.
14. Pihak-pihak lain yang tidak dapat disebutkan satu per satu.
Semoga Allah SWT memberikan balasan atas semua bantuan dan dorongan yang telah diberikan. Penulis menyadari bahwa tulisan ini masih jauh dari sempurna. Semoga penelitian ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Mei 2007
Penulis
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PENGARUH PEMANASAN TERHADAP KEMAMPUAN EKSTRAK GULA TALAS (Colocasia esculenta (L) Schott) UNTUK MENDUKUNG
PERTUMBUHAN BAKTERI ASAM LAKTAT DAN EVALUASI IN VIVO POTENSI PREBIOTIK
JURNAL
Sebagai Salah syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan,
Fakultas Teknologi Pertanian, Institut Pertanian Bogor
Oleh: HANA F24102074
Dilahirkan pada tanggal 2 November 1983 Di Bogor
Disetujui Bogor, Mei 2007
Dr. Ir. Feri Kusnandar, M.Sc. Dr. Ir. Lilis Nuraida, M.Sc.
SKRIPSI
PENGARUH PEMANASAN TERHADAP KEMAMPUAN EKSTRAK GULA TALAS (Colocasia esculenta (L) Schott) UNTUK MENDUKUNG
PERTUMBUHAN BAKTERI ASAM LAKTAT DAN EVALUASI IN VIVO POTENSI PREBIOTIK
Oleh : HANA F24102074
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
Hana. F24102074. Pengaruh Pemanasan terhadap Ekstrak Gula Talas (Colocasia
esculenta (L) Schott) untuk Mendukung Pertumbuhan Bakteri Asam Laktat dan
Evaluasi In Vivo Potensi Prebiotik. Di bawah bimbingan : Dr. Ir. Feri Kusnandar, M.Sc. dan Dr. Ir. Lilis Nuraida, M.Sc.
RINGKASAN
Salah satu kelompok pangan fungsional yang sedang dikembangkan beberapa tahun terakhir ini adalah prebiotik, probiotik dan sinbiotik yang bermanfaat bagi kesehatan pencernaan manusia. Prebiotik merupakan suatu konsep untuk meningkatkan jumlah bakteri target tertentu (khususnya BAL) yang telah ada dalam kolon. Beberapa jenis prebiotik yang kini populer termasuk dalam kelompok oligosakarida, seperti rafinosa, stakhiosa, verbaskosa dan FOS (Fruktooligosakarida).
Talas merupakan salah satu jenis bahan pangan alternatif sebagai sumber karbohidrat. Ekstrak gula talas mentega diketahui mengandung rafinosa (50.88 ppm) dan dapat digunakan untuk mendukung pertumbuhan beberapa bakteri asam laktat (Lactobacillus casei Shirota, L. casei Rhamnosus, Lactobacillus G3,
Bifidobacterium longum dan B. bifidum) secara in vitro sehingga talas berpotensi
menjadi salah satu sumber prebiotik.
Tujuan penelitian ini adalah untuk mengetahui pengaruh pemanasan terhadap kandungan ekstrak oligosakarida tepung talas mentega dan mengetahui potensi prebiotik ekstrak oligosakarida umbi talas mentega dalam sistem pencernaan hewan percobaan. Percobaan dilakukan dengan membuat tepung talas melalui pengeringan dan penggilingan irisan talas mentega, kemudian tepung talas mentega yang dihasilkan dibagi dalam tiga perlakuan, yaitu pengukusan, pemanggangan dan penyangraian, hasil pengolahan tersebut kemudian ditepungkan kembali. Oligosakarida dari tepung talas mentega segar dan pengolahan diekstrak dengan menggunakan pelarut etanol 70%, dan ekstrak yang dihasilkan dipekatkan dengan evaporator vakum.
Kandungan ekstrak gula tepung talas mentega segar dan hasil pemanasan dianalisa secara kualitatif dengan kromatografi kertas. Disamping itu juga dilakukan uji pertumbuhan BAL secara in vitro. Tahap uji pertumbuhan BAL dilakukan dengan menggunakan media berbasis MRS Broth (de Mann Rogosa
Sharpe) dimana komponen gulanya disubstitusi dengan ekstrak gula talas mentega
segar dan pengolahan. Setiap media tersebut diinokulasikan dengan salah satu dari empat jenis BAL, yaitu L. casei Shirota, L.casei Rhamnosus, B. bifidum, dan B.
longum. Nilai absorbansi diukur pada hari ke-0 dan hari ke-2 setelah diinkubasi
selama 48 jam pada suhu 37oC.
Tahap in vivo dilakukan dengan menggunakan 27 ekor tikus jantan galur
Sprague Dawley berumur 2 bulan. Ekstrak gula talas mentega segar dan BAL
perlakuan (pemberian ransum standar). Kandungan total mikroba, jumlah BAL
dan E. coli serta keberadaan Salmonella secara kualitatif diuji pada feses tikus
dengan pengambilan sampel pada hari ke-0, 4 dan 10 perlakuan serta hari ke-4 dan 9 pasca perlakuan.
Tepung talas mentega segar menghasilkan rendemen sebesar 25.61%. Hasil penepungan kembali olahan tepung talas mentega menghasilkan rendemen hasil pengukusan, pemanggangan dan penyangraian berturut-turut sebesar 48.88%, 37.54% dan 95.48% (dihitung berdasarkan perbandingan jumlah tepung yang dihasilkan dengan jumlah tepung talas segar yang digunakan). Hasil analisis kromatografi kertas menunjukan ekstrak gula tepung talas mentega segar mengandung glukosa, fruktosa, sukrosa, rafinosa, oligofruktosa dan inulin. Tepung talas mentega hasil olahan juga secara kualitatif masih menunjukan kandungan gula-gula tersebut. Hal ini dapat disebabkan karena panas yang digunakan belum cukup untuk mendegradasi seluruh bagian gula pada tepung talas mentega. Pengolahan (pemanggangan dan pengukusan) juga diduga membebaskan gula sederhana dan oligosakarida melalui gelatinisasi pati dan hidrolisis fraksi karbohidrat.
Hasil uji pertumbuhan BAL (L. casei Shirota, L. casei Rhamnosus, B.
longum dan B. bifidum) menggunakan gula standar (glukosa, rafinosa,
oligofruktosa dan inulin) menunjukan glukosa dan rafinosa secara umum memiliki nilai absorbansi paling tinggi diantara dua gula lainnya. Hal ini dikarenakan BAL lebih mudah mendegradasi dan mencerna gula yang lebih sederhana. Hasil uji pertumbuhan BAL pada ekstrak gula talas menunjukan bahwa keempat BAL uji dapat menggunakan ekstrak gula tepung talas mentega baik tepung talas mentega segar maupun yang sudah mengalami perlakuan panas. Hasil uji pertumbuhan BAL menunjukan nilai absorbansi pada ekstrak gula talas hasil pengukusan dan pemanggangan lebih tinggi dari yang dicapai ekstrak gula talas mentega segar, diduga karena kandungan oligosakarida dan (terutama) kandungan gula sederhananya lebih tinggi. Kurang baiknya pertumbuhan BAL pada ekstrak gula tepung sangrai dapat terjadi karena fraksi gula tepung sangrai mengalami peleburan dan pencokelatan non enzimatis sehingga hanya sedikit gula yang dapat digunakan untuk pertumbuhan BAL.
Meskipun ekstrak gula talas mentega hasil pemanggangan dan pengukusan menunjukan nilai pertumbuhan BAL yang lebih baik, ekstrak gula yang digunakan dalam uji in vivo adalah ekstrak gula talas mentega segar. Hal tersebut didasarkan pada pertimbangan bahwa pertumbuhan BAL pada ekstrak gula tepung hasil pemanggangan dan pengukusan dapat disebabkan karena penggunaan gula sederhana yang terkandung dalam ekstrak. Sedangkan pada saluran pencernaan mamalia gula sederhana tersebut akan diserap sebelum mencapai kolon, sehingga belum tentu ekstrak gula talas pengukusan dan pemanggangan memiliki sifat prebiotik yang lebih baik dibandingkan kestrak gula talas mentega segar. BAL yang digunakan untuk uji in vivo adalah L. casei Rhamnosus karena menunjukan pertumbuhan paling tinggi pada ekstrak gula tepung talas mentega segar.
Pemberian ekstrak gula talas mentega sebagai prebiotik, L. casei
usus dengan kandungan E. coli yang cukup tinggi. Kandungan oligosakarida dalam ekstrak gula yang diberikan diduga masih belum mencukupi untuk meningkatkan populasi BAL dalam saluran pencernaan tikus. Selain itu kemungkinan bahwa E. coli dapat menggunakan prebiotik yang diberikan dapat menjadi sebab jumlah BAL sulit meningkat karena harus bersaing dengan E. coli.
Pemberian L. casei Rhamnosus tidak berhasil menurunkan jumlah E. coli
PENGARUH PEMANASAN TERHADAP KEMAMPUAN EKSTRAK GULA TALAS (Colocasia esculenta (L) Schott) UNTUK MENDUKUNG
PERTUMBUHAN BAKTERI ASAM LAKTAT DAN EVALUASI IN VIVO POTENSI PREBIOTIK
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan,
Fakultas Teknologi Pertanian, Institut Pertanian Bogor
Oleh: HANA F24102074
2007
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PENGARUH PEMANASAN TERHADAP KEMAMPUAN EKSTRAK GULA TALAS (Colocasia esculenta (L) Schott) UNTUK MENDUKUNG
PERTUMBUHAN BAKTERI ASAM LAKTAT DAN EVALUASI IN VIVO POTENSI PREBIOTIK
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan,
Fakultas Teknologi Pertanian, Institut Pertanian Bogor
Oleh: HANA F24102074
Dilahirkan pada tanggal 2 November 1983 Di Bogor
Tanggal lulus : 11 Mei 2007 Disetujui
Bogor, Juni 2007
Dr. Ir. Feri Kusnandar, M.Sc. Dr. Ir. Lilis Nuraida, M.Sc.
Dosen Pembimbing I Dosen Pembimbing II
Mengetahui,
RIWAYAT HIDUP
Penulis bernama lengkap Hana, dilahirkan di Bogor pada tanggal 2 November 1983. Penulis adalah putri ke-tiga dari empat bersaudara dari pasangan Abdul Aziz Harran dan Ratu Erna Darmiasih. Pendidikan dasarnya diselesaikan di SD Al-Irsyad Al-Islamiyah, Bogor pada tahun 1996, dilanjutkan di SLTP Negeri 1 Bogor pada tahun 1996-1999 dan di SMUN 1 Bogor pada tahun 1999-2002. Penulis melanjutkan pendidikannya di Institut Pertanian Bogor, Fakultas Teknologi Pertanian, Departemen Ilmu dan Teknologi Pangan melalui jalur USMI (Ujian Saringan Masuk IPB).
Penulis melakukan penelitian yang berjudul “Evaluasi Potensi Prebiotik Umbi Talas (Colocasia esculenta (L) Schott) In Vivo” sebagai tugas akhir dibawah bimbingan Dr. Ir. Feri Kusnandar, MSc. dan Dr. Ir. Lilis Nuraida, MSc. Penelitian tersebut terselenggara berkat program pendanaan Research Grant
Hibah Bersaing.
KATA PENGANTAR
Penulis menyampaikan puji dan syukur kepada Allah SWT, karena hanya dengan karunia-Nya penulis dapat menyelesaikan penelitian dan penulisan skripsi yang berjudul “Pengaruh Pemanasan terhadap Ekstrak Gula Talas (Colocasia
esculenta (L) Schott) untuk Mendukung Pertumbuhan Bakteri Asam Laktat dan
Evaluasi In Vivo Potensi Prebiotik”. Tulisan ini adalah salah satu persyaratan untuk memperoleh gelar Sarjana Teknologi Pertanian di Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan ucapan terimakasih yang sebesar-besarnya kepada :
1. Dr. Ir. Feri Kusnandar, M.Sc. selaku Dosen Pembimbing Akademik dan Dr. Ir. Lilis Nuraida, M.Sc. selaku Pembimbing II atas petunjuk, saran dan bimbingannya selama penulis menjadi mahasiswa S1 serta dalam penelitian hingga selesainya penulisan skripsi ini.
2. Dr. Ir. Nurheni Sri Palupi, M.Si. atas kesediaannya menjadi penguji serta atas nasehat dan saran perbaikan dalam penyusunan skripsi ini.
3. Pihak Research Grant Hibah Bersaing atas bantuan dana dalam pelaksanaan penelitian ini.
4. Ayahanda Abdul Aziz Harran, Ibunda Ratu Erna Darmiasih, Hala Nikmah, Kak Luthfi, Mbak Era, Kak Nia, dan Hani serta seluruh keluarga besar yang telah memberikan semangat, dorongan dan doa yang tulus bagi penulis selama menempuh kuliah dan menyelesaikan penelitian.
5. Para staf dan laboran di laboratorium Departemen ITP dan SEAFAST atas segala bantuan dan kerepotannya.
6. Rekan tim prebiotik; Mbak Nani, Bu Rini dan Kiky atas kerjasamanya dalam duka cita selama penelitian.
Tim RS, serta adik-adik TPG 40; Purwono, Angel, Abdy, Andal, Lilin, Noor dan Asih.
8. Dhenok, Sari, Rina, Meilina, Dian, Dikres, Vero, Mba Kiki, Kanyaka dan Eva atas segala drama yang terjadi selama empat-lima tahun ini dan semoga terus ada episode-episode baru.
9. Rekan-rekan satu bimbingan; Astri, Samsul dan Irwan.
10. Kelompok C-3; Molid, Yudhan dan Bobby atas kebersamaan dan kerusuhan dalam praktikum selama ini.
11. Golongan C atas keramaian, kebingungan dan kebersamaan selama hampir empat tahun.
12. Rekan TPG 39 atas segala warna dalam hidup.
13. Mbak Putri, Kak Manda dan Teh Novi atas bantuan dan konsultasi jarak jauhnya selama penelitian.
14. Pihak-pihak lain yang tidak dapat disebutkan satu per satu.
Semoga Allah SWT memberikan balasan atas semua bantuan dan dorongan yang telah diberikan. Penulis menyadari bahwa tulisan ini masih jauh dari sempurna. Semoga penelitian ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Mei 2007
Penulis
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PENGARUH PEMANASAN TERHADAP KEMAMPUAN EKSTRAK GULA TALAS (Colocasia esculenta (L) Schott) UNTUK MENDUKUNG
PERTUMBUHAN BAKTERI ASAM LAKTAT DAN EVALUASI IN VIVO POTENSI PREBIOTIK
JURNAL
Sebagai Salah syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan,
Fakultas Teknologi Pertanian, Institut Pertanian Bogor
Oleh: HANA F24102074
Dilahirkan pada tanggal 2 November 1983 Di Bogor
Disetujui Bogor, Mei 2007
Dr. Ir. Feri Kusnandar, M.Sc. Dr. Ir. Lilis Nuraida, M.Sc.
DAFTAR ISI
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... v
I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Tujuan ... 2
II. TINJAUAN PUSTAKA ... 3
A. Talas (Colocasia esculenta (L) Schott) ... 3
B. Prebiotik ... 6
C. Oligosakarida ... 7
D. Bakteri Asam Laktat ... 10
a. Lactobacillus sp. ... 12
b. Bifidobacterium sp. ... 13
E. Separasi Fraksi Karbohidrat ... 15
III. METODOLOGI ... 17
A. Bahan-bahan ... 17
B. Alat-alat penelitian ... 17
C. Metode penelitian ... 18
1. Pembuatan Tepung Talas ... 19
2. Perlakuan Pengolahan dengan Panas ... 20
3. Ekstraksi Oligosakarida ... 20
4. Uji kandungan oligosakarida dengan metode kromatografi kertas modifikasi Muchtadi (1989) ... 22
5. Uji pertumbuhan BAL pada ekstrak gula talas mentega ... 23
6. Uji potensi prebiotik in vivo ... 26
D. Metode analisis ... 30
1. Pengukuran Total Padatan Terlarut ... 30
IV. HASIL DAN PEMBAHASAN ... 33 A. Pembuatan Tepung Talas Mentega ... 33 B. Pengolahan Tepung Talas Mentega ... 34 C. Ekstraksi Oligosakarida ... 37 D. Identifikasi Fraksi Karbohidrat Ekstrak Gula Talas Mentega ... 37 E. Uji Pertumbuhan BAL ... 42 F. Pengujian In Vivo ... 48
DAFTAR TABEL
Halaman Tabel 2.1. Komposisi kimia talas per 100 gram bahan mentah ... 4 Tabel 2.2. Kandungan gula dalam talas yang telah dimasak ... 5 Tabel 3.1. Pembagian kelompok tikus percobaan uji prebiotik ekstrak
oligosakarida talas in vivo ... 27
Tabel 4.1. Rendemen penepungan kembali hasil olahan tepung talas ... 36 Tabel 4.2. Rendemen ekstrak tepung talas mentega segar dan hasil olahan .. 37 Tabel 4.3. Identifikasi komponen gula ekstrak talas mentega ... 39 Tabel 4.4. Pengaruh pemberian isolat BAL terhadap kandungan E. coli feses
tikus pada berbagai penelitian ... 58
DAFTAR GAMBAR
Halaman Gambar 2.1. Struktur kimia oligofruktosa dan inulin ... 9 Gambar 2.2 Struktur kimia rafinosa ... 10 Gambar 3.1. Diagram alir tahapan penelitian ... 18 Gambar 3.2. Diagram alir proses pembuatan tepung talas ... 19 Gambar 3.3. Diagram alir perlakuan pengolahan tepung talas ... 21 Gambar 3.4. Diagram alir ekstraksi oligosakarida tepung talas ... 22 Gambar 4.1. Talas mentega ... 33 Gambar 4.2. Tepung talas mentega ... 34 Gambar 4.3. Hasil penepungan kembali olahan tepung talas ... 35 Gambar 4.4. Migrasi standar dan sampel pada kromatogram metode
Apriyantono et al. (1989) ... 38
Gambar 4.5. Grafik pertumbuhan berbagai jenis BAL pada glukosa ... 43 Gambar 4.6. Grafik pertumbuhan berbagai jenis BAL pada rafinosa ... 43 Gambar 4.7. Grafik pertumbuhan berbagai jenis BAL pada oligofruktosa 43 Gambar 4.8. Grafik pertumbuhan berbagai BAL pada inulin... 44 Gambar 4.9. Grafik pertumbuhan berbagai BAL pada berbagai jenis
ekstrak gula tepung talas mentega... 46
Gambar 4.10. Tikus putih jantan galur Sprague Dawley berumur 2 bulan .. 49 Gambar 4.11. Perubahan berat badan tikus setiap kelompok selama
pengujian in vivo ... 49
DAFTAR LAMPIRAN
Halaman Lampiran 1. Pembuatan MRS Basic ... 71 Lampiran 2. Rendemen tepung talas mentega segar dan tepung hasil
olahan tepung talas mentega segar ... 72
Lampiran 3. Kadar air tepung talas segar dan tepung talas hasil perlakuan panas ... 73
Lampiran 4. TPT ekstrak tepung talas segar dan tepung talas hasil perlakuan panas ... 74
Lampiran 5. Rendemen ekstrak tepung talas segar dan tepung talas hasil perlakuan panas ... 75
Lampiran 6. Perhitungan Rf spot standar dan sampel ekstrak tepung talas segar dan pengolahan (konsentrasi 5.9% TPT) pada kromatogram metode Apriyantono et al. (1989) dengan waktu elusi lima jam ... 76
Lampiran 7a. Hasil perhitungan uji pertumbuhan berbagai BAL pada berbagai ekstrak gula talas mentega dan standar gula ... 77
Lampiran 7b. Hasil uji pertumbuhan Lactobacillus casei Shirota dan
Lactobacillus casei subspesies Rhamnosus pada berbagai
standar gula ... 78
Lampiran 7c. Hasil uji pertumbuhan B. longum dan B. bifidum pada berbagai standar gula ... 79
Lampiran 7d. Hasil uji pertumbuhan Lactobacillus casei Shirota dan
Lactobacillus casei Rhamnosus pada ekstrak gula talas
mentega ... 80
Lampiran 7e. Hasil uji pertumbuhan B. longum dan B. bifidum pada ekstrak gula talas mentega ... 81
Lampiran 8. Perhitungan komposisi ransum standar ... 82 Lampiran 9. Perhitungan volume ekstrak steril, kultur BAL dan
sinbiotik untuk in vivo ... 83
Lampiran 10b. Berat badan dan konsumsi ransum kelompok sinbiotik ... 86 Lampiran 10c. Berat badan dan konsumsi ransum kelompok prebiotik ... 88 Lampiran 10d. Berat badan dan konsumsi ransum kelompok probiotik ... 90 Lampiran 11. Perhitungan jumlah total mikroba feses ... 92 Lampiran 12. Perhitungan jumlah Bakteri Asam Laktat dalam feses ... 95 Lampiran 13. Perhitungan jumlah E. coli dalam feses ... 98 Lampiran 14. Hasil pengujian Salmonella feses secara kualitatif selama
I. PENDAHULUAN
A. Latar Belakang
Peningkatan kesadaran masyarakat akan pentingnya hidup sehat telah menyebabkan pergeseran tuntutan konsumen terhadap bahan pangan. Bahan pangan yang kini mulai banyak diminati konsumen bukan saja yang mempunyai komposisi gizi yang baik serta penampakan dan cita rasa yang menarik, tetapi juga memiliki fungsi fisiologis tertentu bagi tubuh. Dari sinilah lahir konsep pangan fungsional.
Salah satu kelompok pangan fungsional yang sedang dikembangkan saat ini adalah prebiotik, probiotik dan sinbiotik yang bermanfaat bagi kesehatan pencernaan manusia. Beberapa isu kesehatan yang berkaitan dengan manfaat prebiotik, probiotik dan sinbiotik adalah peningkatan toleransi laktosa (bagi penderita intoleransi laktosa), perlindungan terhadap gastroentritis, sintesis vitamin-vitamin tertentu, peningkatan fungsi saluran pencernaan, metabolisme kolesterol dalam usus dan respon alergi terhadap makanan (Gibson dan Angus, 2000). Pendekatan penggunaan prebiotik, probiotik dan sinbiotik sebagai langkah pencegahan dan penurunan resiko penyakit-penyakit tertentu menjadi semakin berarti dengan besarnya biaya dan kerugian yang dapat ditimbulkan penyakit-penyakit tersebut.
Prebiotik merupakan pangan yang dapat memacu pertumbuhan mikroflora usus, khususnya bakteri asam laktat. Beberapa jenis prebiotik yang kini populer termasuk dalam kelompok oligosakarida. Oligosakarida adalah polisakarida rantai pendek dengan struktur kimia yang unik sehingga tidak dapat dicerna oleh enzim pencernaan manusia. Oligosakarida tersebut akan menjadi media yang baik untuk pertumbuhan bakteri asam laktat yang menguntungkan di dalam kolon. Kelompok oligosakarida yang dapat dijadikan sumber prebiotik antara lain rafinosa, stakhiosa, fruktooligosakarida dan galaktooligosakarida. Senyawa rafinosa dan stakiosa juga dikenal sebagai penyebab flatulensi dalam bahan pangan.
yang dikandungnya. Sedangkan kandungan komponen-komponen potensial lainnya belum dimanfaatkan dengan optimal. Umbi talas mengandung beberapa jenis gula tertentu termasuk diantaranya oligosakarida dari jenis rafinosa (Holloway, 1988 diacu dalam FAO, 1988). Hasil penelitian Putri (2005) menunjukan bahwa ekstrak oligosakarida talas mentega mengandung rafinosa sebanyak 50.88 ppm dan dapat digunakan untuk mendukung pertumbuhan beberapa bakteri asam laktat (Lactobacillus casei galur Shirota, L. casei galur Rhamnosus, Lactobacillus G3, Bifidobacterium
longum dan B. bifidum) secara in vitro sehingga talas berpotensi menjadi
salah satu sumber prebiotik.
Melalui penelitian ini diharapkan dapat diketahui pengaruh perlakuan pemanasan (pemanggangan, pengukusan dan penyangraian) tepung talas mentega terhadap kandungan gula ekstrak oligosakarida tepung talas mentega dan terhadap daya dukung ekstrak gula tepung talas untuk pertumbuhan bakteri asam laktat secara in vitro. Selanjutnya dilakukan pula pengujian potensi prebiotik ekstrak oligosakarida umbi talas mentega segar dalam sistem pencernaan hewan percobaan terhadap peningkatan pertumbuhan bakteri asam laktat dan penurunan pertumbuhan patogen.
B. Tujuan
Tujuan penelitian ini adalah untuk :
1. Mempelajari pengaruh pemanasan terhadap komposisi gula ekstrak talas mentega dan terhadap kemampuan ekstrak tersebut dalam mendukung pertumbuhan bakteri asam laktat secara in vitro.
II. TINJAUAN PUSTAKA
A. Talas (Colocasia esculenta (L) Schott)
Talas (Colocasia esculenta (L) Schott) termasuk dalam divisi
Spermatophyta, subdivisi Angiospermae, kelas Monocotylae, famili
Araceae. Genus Colocasia dan spesies Colocasia esculenta (L) Schott
(Lingga et al., 1989). Sentrum tanaman asal talas adalah asia, mungkin dari India atau Malaysia. Dari daerah tersebut talas menyebar ke seluruh dunia (Terry, 1981).
Talas banyak dibudidayakan di dataran rendah sampai dataran dengan ketinggian 1000 m di atas permukaan laut. Tanaman ini dapat ditanam di tempet yang tergenang air dan dapat juga tumbuh di tanah kering (Lingga et al., 1989). Tanaman talas umumnya membutuhkan kelembaban cukup tinggi untuk dapat tumbuh dengan hasil yang baik, dengan curah hujan sekitar 200 cm per tahun dan suhu pertumbuhan di atas 21oC (Onwuerne, 1978). Tingkat produksi tanaman talas tergantung pada kultivarnya, umur tanaman dan kondisi lingkungan tempat tumbuh. Pada kondisi optimal, produktivitas tanaman talas dapat mencapai 30 ton per hektar (Anonim, 2004).
Umbi talas terletak di bagian bawah pokok batang talas. Umbi talas dapat mencapai berat 4 kg atau lebih dengan bentuk silinder atau bulat, berukuran 30 cm x 15 cm dengan warna kulit luar umumnya cokelat (Anonim, 2004). Ada bermacam jenis talas yang dapat dicirikan dari warna daun atau tangkainya. Selain itu tanaman talas juga dibedakan berdasarkan warna dan rasa yang tergantung dari jenis talas (Lingga et al., 1989).
yang mempunyai ciri daun dan pelepah daun berwarna kuning keunguan, umbi berwarna kuning dan besar, dan (3) talas sutera, varietas ini mempunyai ciri berdaun halus yang berwarna hijau muda, pelepah daun hijau dengan pangkal berwarna putih dan umbi berwarna putih dan mempunyai rasa yang enak.
Varietas selain talas lain yang terdapat di Bogor antara lain: (1) talas ketan, yang mempunyai ciri batang di atas umbi mengecil, pelepah daun berwarna hijau garis hitam, umbi bundar dan daging berwarna kuning, terasa gatal jika direbus, dan (2) talas bentul, mempunyai ciri batang mengecil di atas umbi, daging umbi kuning dan gatal, dipanen setelah delapan bulan, umbi bundar dengan pelepah hijau bergaris hitam keunguan (Mauw, 2000). Komposisi kimia talas bervariasi tergantung pada jenis, usia, keadaan tempat tumbuh dan tingkat kematangan. Komposisi kimia talas menurut FAO (1990) dan Departemen Kesehatan RI (1972) dapat dilihat pada Tabel 2.1.
Tabel 2.1. Komposisi kimia talas per 100 gram bahan mentah
Kandungan Gizi Jumlah
a b
Energi (Kal) 93.5 (393 KJ) 98.0
Kadar air (%) 75.4 77.5
Protein (g) 2.2 1.9
Lemak (g) 0.4 0.2
Serat (g) 0.8 -
Total karbohidrat dan serat (g) 21.0 23.7
Abu (g) 1.0 -
Ca (mg) 34 28.0
P (mg) 62 61.0
Fe (mg) 1.2 1.00
K (mg) 448 -
Na (mg) 10 -
Karoten (mg) 2.0 -
Thiamin (mg) 0.12 -
Riboflavin (mg) 0.04 -
Niacin (mg) 1.0 -
Asam askorbat (mg) 8.0 4.0
Kandungan karbohidrat umbi talas sebagian besar terdiri atas pati 77% dari seluruh total karbohidrat atau sebesar 13-29% dari berat total keseluruhan umbi talas (Onwuene, 1978). Pati umbi talas terdiri atas 17-28% amilosa sedangkan sisanya, yaitu 72-33%, adalah amilopektin. Disamping itu, karbohidrat juga disusun oleh pentosan (2.6%), serat kasar (1.4%), dekstrin (0.5%), gula pereduksi (0.5%) dan sukrosa (0.1%). Protein umbi talas kaya akan asam amino esensial, tetapi jumlah histidin, lisin, isoleusin, triptofan dan metioninnya agak rendah (Onwuerne, 1978).
Selain dikonsumsi sebagai makanan pokok talas juga dapat diolah menjadi tepung talas (bahan pembuat roti, kue, zat pengental dan makanan bayi), obat tradisional (encok, rematik, bisul, penawar racun dan obat urus-urus) dan produk fermentasi berupa pasta kental yang disebut poi (Winarno, 1990 diacu dalam Andarwulan et al., 1997).
Umbi talas mengandung oligasakarida dari jenis rafinosa, selain jenis-jenis gula lainnya. Kandungan rafinosa dan jenis gula lainnya dalam umbi talas yang telah dimasak dapat dilihat pada Tabel 2.2.
Tabel 2.2. Kandungan gula dalam talas yang telah dimasak Jenis Gula g/kg berat basah
Fruktosa 1.0 Glukosa 0.6 Sukrosa 94 Maltosa 1.0 Rafinosa 0.3 (Sumber : Bradbury & Holloway, 1988 diacu dalam FAO, 1990)
B. Prebiotik
Gibson dan Roberfroid (1995) seperti diacu dalam Fanworth (2001) mendefinisikan prebiotik sebagai bahan pangan yang tidak dapat dicerna
(nondigestible) yang menguntungkan bagi inang dengan menstimulasi
secara selektif pertumbuhan dan atau aktivitas bakteri tertentu dalam kolon inang. Salminen et al. (2004a) menyebutkan bahwa suatu ingredien pangan dapat diklasifikasikan sebagai prebiotik jika memenuhi persyaratan berikut (1) tidak terhidrolisis atau terserap pada saluran pencernaan bagian atas, (2) secara selektif dapat menstimulir pertumbuhan bakteri yang menguntungkan pada kolon, dan (3) dapat menekan pertumbuhan bakteri patogen, sehingga secara sistemik dapat meningkatkan kesehatan.
Prebiotik merupakan suatu konsep untuk meningkatkan jumlah bakteri target tertentu yang telah ada dalam kolon. Sasaran peningkatan jumlah bakteri tersebut adalah produksi asam lemak rantai pendek (SCFA
- Short Chain Fatty Acid) karena pengaruhnya terhadap lingkungan
saluran pencernaan bagian bawah, metabolisme, dan pencegahan penyakit tertentu (Fanworth, 2001).
Prebiotik pada umumnya merupakan karbohidrat dengan bobot molekul rendah yang tidak dapat diserap dan dicerna serta umumnya berbentuk oligosakarida dan serat pangan (Silalahi dan Hutagalung, 2002). Salminen et al. (2004a) menyatakan bahwa oligosakarida dalam kacang-kacangan yang terdiri atas rafinosa dan stakiosa ternyata dapat dicerna oleh Bifidobacterium spp. Konsumsi bahan prebiotik secara signifikan dapat memodulasi komposisi mikroflora kolon yang menyebabkan Bifidobacteria lebih dominan dan banyak ditemukan dalam feses (Gibson dan Robertfroid, 1995).
Pada percobaan pertumbuhan lima jenis bakteri asam laktat laktat
(Lactobacillus casei galur Shirota, L. casei galur Rhamnosus,
Lactobacillus G3, Bifidobacterium longum dan B. bifidum) secara in vitro
tersebut dapat menggunakan ektrak oligosakarida umbi talas sebagai sumber gula untuk mendukung pertumbuhannya.
C. Oligosakarida
Oligosakarida adalah gula yang mengandung 2-20 unit sakarida atau dengan kata lain, oligosakarida adalah suatu polisakarida rantai pendek. Sebagian terdapat secara alami dalam sayur-sayuran dan buah-buahan sementara sebagian lainnya dapat diproduksi secara sintetis melalui hidrolisis polisakarida atau melalui penggunaan teknologi enzim (Gibson & Angus, 2000). Berdasarkan keseragaman monosakarida penyusunnya, oligosakarida dapat diklasifikasikan menjadi dua jenis, yaitu homo-oligosakarida dan hetero-homo-oligosakarida. Homo-homo-oligosakarida adalah adalah tipe oligosakarida yang tersusun dari satu jenis sakarida saja, sedangkan hetero-oligosakarida adalah tipe oligosakarida yang tersusun atas dua jenis atau lebih monosakarida. Oligosakarida bersifat sangat mudah larut dalam air atau pelarut polar lainnya (Pazur, 1970).
Oligosakarida adalah karbohidrat sederhana, banyak dikonsumsi dalam bentuk minuman ringan, biskuit, gula-gula/bonbon, dan produk. lainnya. Oligosakarida fungsional adalah polisakarida pendek dengan struktur kimia yang unik sehingga tidak dapat dicerna oleh enzim-enzim pada percernaan manusia. Jadi oligosakarida fungsional pada akhirnya akan sampai di dalam usus besar. Dengan demikian, oligosakarida tertentu dapat menjadi media yang baik untuk pertumbuhan bakteri
Bifidobacteria yang menguntungkan di dalam usus besar (kolon). Dengan
peningkatan jumlah bakteri ini, pertumbuhan bakteri pembusuk yang merugikan dapat ditekan, yakni Escherichia coli dan Streptococcus
faecalis (Silalahi dan Hutagalung, 2002).
kemampuan untuk menghasilkan zat yang bersifat antimikroba. Hampir semua zat yang diproduksi oleh bakteri bersifat asam sebagai hasil fermentasi karbohidrat oligosakarida. Dengan terbentuknya zat-zat antibakteri dan asam maka pertumbuhan bakteri patogen seperti
Salmonella dan E. coli akan dihambat. Tomomatsu (1994) diacu dalam
Silalahi dan Hutagalung (2002) menyebutkan bahwa konsumsi oligosakarida akan mengurangi metabolit toksis dan enzim-enzim yang merugikan. Konsumsi 3-6 g oligosakarida per hari, akan mengurangi senyawa-senyawa toksis yang ada dalam usus dan enzim-enzim yang merugikan sebanyak 44,6% dan 40,9%, masing-masing selama tiga minggu. Beberapa jenis karbohidrat kandidat prebiotik lainnya selain rafinosa adalah inulin, oligosakarida kedelai, galakto-oligosakarida, isomalto-oligosakarida, gentio-oligisakarida, xylo-oligosakarida, laktulosa, stakiosa, sorbitol, xylitol, palatinosa dan laktosukrosa (Fanworth, 2001).
Fruktooligosakarida merupakan jenis oligosakarida yang tidak dapat dicerna yang tersusun atas glukosil-(fruktosil)n-1-fruktosa (GFn) dan
(fruktosil)m-1-fruktosa (Fm). Inulin (GFn) dan hidrolisat inulin (Fm)
(dikenal dengan nama oligofruktosa) terdapat secara alami dalam berbagai tanaman seperti bawang, asparagus, bawang perai, pisang dan gandum, serta terdapat dalam akar chicory sebagai sediaan energi utamanya. Inulin diproduksi secara komersial dari akar chicory melalui ekstraksi dengan air panas (aSalminen et al., 2004). Oligofruktosa selama ini dapat diperoleh dengan dua cara berbeda, yaitu melalui hidrolisis enzim parsial inulin yang berasal dari chicory, dan melalui sintesis dari sukrosa menggunakan fruktosil transferase (Franck, 2000). Fruktooligosakarida difermentasi secara selektif oleh sebagian besar BAL galur bifidobakteria. Konsumsi fruktooligosakarida 4-20 gram/hari secara selektif menstimulasi pertumbuhan bifidobakteri pada manusia (Salminen et al., 2004a).
Inulin dan oligofruktosa dalam sistem pencernaan manusia tidak
yang dimilikinya tidak dapat dihidrolisis oleh enzim pencernaan manusia. Senyawa ini akan sampai ke dalam usus besar dan difermentasi oleh mikroba (Franck, 2000). Fermentasi FOS secara spesifik dilakukan
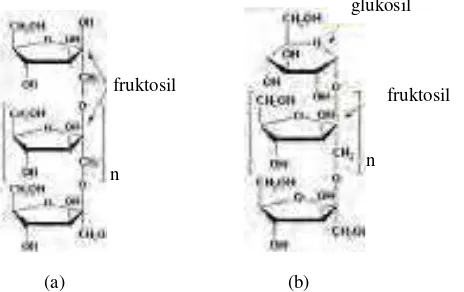
[image:35.612.229.461.199.345.2]dengan β-fruktofuranosidase yang terasosiasi dengan sel bifidobakteri (Manning dan Gibson, 2004).
Gambar 2.2. Struktur kimia (a) oligofruktosa dan (b) inulin (Anonim, 2007)
Rafinosa merupakan salah satu jenis oligosakarida yang dapat dimurnikan dari beberapa tanaman umumnya dari bit putih (Salminen et al., 2004a). Oligosakarida jenis ini merupakan trisakarida yang terdiri dari monomer fruktosa, galaktosa dan glukosa dengan titik leleh 78oC (Pazur, 1970). Menurut penelitian Benno dan rekannya (1984) di dalam Salminen
et al. (2004a), pemberian 15 gram rafinosa perhari selama 4 minggu telah
meningkatkan jumlah bifidobakteria di feses manusia secara signifikan. Rafinosa dapat dimetabolisme oleh mikroflora usus sehingga dihasilkan asam laktat, asam asetat, asam butirat, hidrogen peroksida, bakteriosin dan metabolit lainnya (Mishra dan Lambert, 1996). Rafinosa tidak dapat dicerna karena mukosa usus mamalia tidak mempunyai enzim α -galaktosidase, sehingga oligosakarida tersebut tidak dapat diserap oleh tubuh. Di dalam usus, oligosakarida ini akan difermentasi oleh bakteri-bakteri yang ada dalam usus, sehingga terbentuk gas karbondioksida,
hidrogen, dan metan. Oligosakarida yang mengandung ikatan α -fruktosil
glukosil
fruktosil
n n
galaktosida pada bahan pangan terkait dengan timbulnya flatulensi, yaitu suatu keadaan menumpuknya gas-gas dalam lambung (Muchtadi, 1989).
[image:36.612.194.484.307.391.2]Putri (2005) menyatakan bahwa kandungan maltosa, rafinosa dan sukrosa dalam ekstrak oligosakarida talas mentega masing-masing adalah sebesar 369.66 ppm, 50.88 ppm dan 103.31 ppm. Pada kromatografi kertas ekstrak oligosakarida talas mentega juga ditemukan spot gula rafinosa, fruktosa dan oligosakarida lainnya, sedangkan pada hasil kromatografi kertas ekstrak oligosakarida talas ketan tidak ditemukan spot oligosakarida, tetapi ditemukan spot gula yang mendekati spot glukosa dan sukrosa. Gambar 2.1 dibawah ini menunjukan struktur kimia rafinosa.
Gambar 2.2. Struktur kimia rafinosa [β-D-Fruktofuranosil 0-α-D Galaktopiranosil-(1-6)-α-D-Galaktopiranosida] (Anonim, 2006)
D. Bakteri Asam Laktat
dan Streptococcus. Genus Bifidobacterium dalam Bergey's Manual of
Determinative Bacteriology-1957 masuk sebagai kategori Lactobacillus
bifidum, meskipun demikian Bifidobacterium secara filogenetik lebih
terhubung dengan grup bakteri Gram positif Actinomycetaceae. Genus
Bifidobacterium memiliki jalur fermentasi gula yang unik dan berbeda,
sehingga membedakannya dari grup BAL. Taksonomi BAL selanjutnya mengalami revisi yang cukup besar pada Bergey's Manual of
Determinative Bacteriology-1986, khususnya untuk genus Streptokoki.
Genus Streptococcus pertama-tama dibagi menjadi tiga genus berbeda;
Enterococcus, Lactococcus, dan Streptococcus sensu stricto. Selanjutnya
beberapa BAL yang bersifat motil yang serupa Laktokoki, digabung dalam genus lain yang berbeda, yaitu Vagococcus. Genus Lactobacillus,
Leuconostoc dan Pediococcus umumnya tetap tidak berubah, kecuali
beberapa BAL yang berbentuk batang yang semula tergabung dalam genus Lactobacillus, sekarang membentuk genus Carnobacterium, dan spesies Pediococcus halophilus telah menjadi genus baru, yaitu
Tetragenococcus. Klaster BAL yang berbeda secara filogenetik, termasuk
beberapa spesies yang sebelumnya digabungkan dalam genus
Lactobacillus atau Leuconostoc, telah disarankan menjadi genus lain yang
berbeda, yaitu Weisella. Leuconostoc oenos telah diajukan untuk ditentukan sebagai genus baru yaitu Oenococcus. Genus baru yaitu
Alloiococcus, Dolosicoccus, Dolosigranulum, Eremococcus, Facklamia,
Globicatella, Helcoccus, Ignavigranum dan Lactosphaera, juga
mengandung beberapa galur yang bertalian dengan grup BAL, baik secara filogenetik maupun secara fisiologis (Axxelson, 2004).
Leuconostoc dan beberapa species Lactobacillus. Bakteri asam laktat yang tergolong heterofermentatif adalah Streptococcus, Pediacoccus dan beberapa spesies Lactobacillus (Fardiaz, 1989).
Organ mulut, lambung dan usus kaya akan mikroflora alami yang menghuninya, baik dari segi jenis maupun jumlahnya. Esofagus dan lambung memiliki jenis mikroflora yang hampir sama, namun variasi jumlah dan jenis mikrofloranya meningkat sepanjang saluran pencernaan dengan konsentrasi tertinggi di bagian kolon. Cairan lambung hanya mengandung sejumlah kecil bakteri dan kamir, yaitu 102-103/ml saat mencerna. Namun setelah pencernaan selesai jumlah bakterinya meningkat 100-1000 kali lipat dari jumlah awalnya. Peningkatan jumlah ini dapat disebabkan adanya mikroflora yang ikut masuk bersama makanan. (Lambert dan Hull, 1996).
Lebih lanjut Lambert dan Hull (1996) menyatakan beberapa jenis BAL yang mendominasi lambung dan usus adalah Lactococcus,
Lactobacillus spp., Leuconostoc dan Bifidobacterium. Kemampuan BAL
untuk menempel di permukaan mukosa usus dan bersaing dengan mikroflora lainnya serta produksi senyawa antibakteri menyebabkannya dapat bersaing dengan patogen lain yang tahan terhadap asam dan cairan empedu.
Beberapa jenis penyakit dan masalah kesehatan yang dapat dibantu dikurangi oleh BAL adalah intoleransi laktosa, infeksi enterik, diare, diare akibat konsumsi antibiotik, konstipasi dan kanker usus (Salminen et al, 2004b).
a. Lactobacillus sp.
Lactobacillus adalah genus BAL dengan jumlah anggota terbesar
dan pH 9.6 (Axelsson, 1998). Lactobacillus dapat tahan terhadap asam lambung dan dapat melewatinya sehingga dapat mencapai usus halus dan kolon. Bakteri jenis ini dapat bertahan pada kondisi dengan pH 4 selama beberapa minggu secara in vitro (Lambert dan Hull, 1996).
Lactobacillus casei Shirota yang lebih dikenal sebagai bakteri
Yakult, merupakan bakteri yang diisolasi pertama kali oleh Dr. Minoru Shirota, seorang ahli mikrobiologi dari Jepang. Lactobacillus casei
Shirota mempunyai morfologi bentuk batang, berada dalam koloni
tunggal maupun berantai, mempunyai panjang 1.5-5.0μm dan lebar
0.6-0.7μm, bersifat Gram positif, katalase negatif, tidak membentuk endospora maupun kapsul, tidak mempunyai flagella, anaerobik fakultatif, hidup dengan baik pada suhu optimum15-41oC dan pH 3.5 atau lebih (Selamat, 1992).
Lactobacillus casei Rhamnosus bersifat homofermentatif, gram
positif, katalase negatif, dan tidak membentuk spora (Buchanan & Gibbons, 1974). Selain itu bakteri ini termasuk dalam golongan bakteri asam laktat yang bersifat termobakterium karena bakteri ini dapat tumbuh pada suhu 45oC (Robinson, 1981). Rastal dan Vatsala (2002) menyebutkan bahwa L. casei Rhamnosus hanya dapat memfermentasi FOS oligomer trsisakarida dan tetrasakarida, dan tidak memfermentasi pentasakarida.
L. rhamnosus dan L. casei Shirota bermanfaat dalam mencegah dan
mengobati infeksi gastrointestinal tertentu, termasuk diare rotavirus pada anak-anak dan diare yang berhubungan dengan antibiotik dan perawatan radiasi panggul (Sandholm-Mattila, 2000).
b. Bifidobacterium sp.
atau X) lebih dipengaruhi komposisi medium kultur. Pertumbuhan optimum bakteri ini adalah pada kisaran pH 6.5-7.0. Untuk spesies
Bifidobacterium yang berasal dari manusia temperatur optimum
pertumbuhannya adalah 36-38oC, sedangkan untuk spesies yang berasal dari hewan suhu optimum pertumbuhannya lebih tinggi, yakni pada 41-43oC (Ballongue, 2004). Karakteristik utama Bifidobakteria menurut Greed et al. (1957) adalah bersifat Gram positif, anaerob obligat pada kultur primer dan kemudian menjadi mikroaerofilik atau anaerob fakultatif.
Bifidobacterium bifidum mempunyai efek menguntungkan bagi
tubuh seperti dapat melindungi usus dari bakteri atau khamir patogen, menghasilkan asam asetat dan asam laktat sehingga menciptakan kondisi usus yang asam dan tidak dapat dihuni oleh bakteri berbahaya, mencegah pertumbuhan bakteri yang mampu mengubah senyawa nitrat dalam usus yang berasal dari makanan dan minuman menjadi senyawa nitrit yang bersifat prokarsinogenik, menghasilkan vitamin B dan membantu fungsi hati dalam proses pencernaan makanan (Chaitow dan Trenev, 1990). Selain itu B. bifidum dapat pula menghasilkan suatu antibiotik yaitu Bifidin yang sangat efektif melawan Shigella dysentria, Salmonella
typhosa, Staphylococcus aureus, E. coli dan bakteri lainnya (Tomomatsu,
1994 diacu oleh Silalahi dan Hutagalung, 2002).
B. bifidum dapat memfermentasi fruktosa, galakatosa, sukrosa dan
E. Separasi Fraksi Karbohidrat
Kromatografi merupakan metode pemisahan yang memerlukan waktu singkat dan lebih efektif dibandingkan dengan pemisahan lainnya, dengan kromatografi dapat dilakukan pemisahan yang tidak mungkin dilakukan dengan metode lain (Nur et al., 1987). Dari beberapa jenis kromatografi yang umum digunakan untuk separasi (kromatografi kolom, kromatografi lapis tipis, kromatografi gas, dan lain-lain), metode yang digunakan dalam penelitian ini adalah metode kromatografi kertas. Woods dan Aurand (1977) menyebutkan kromatografi kertas merupakan metode yang baik untuk mengidentifikasi gula secara kualitatif, khususnya jika jumlah gula yang terdapat pada larutan relatif sedikit.
Pada dasarnya prinsip pemisahan pada kromatografi adalah perbedaan distribusi pada dua fase berbeda yaitu fase bergerak dan fase tetap. Kromatografi kertas tergolong dalam kategori kromatografi partisi, dimana zat akan terdistribusi di antara dua cairan sebagai fase bergerak dan fase tetap. Pada kromatografi partisi konvensional, fase tetap bersifat lebih polar daripada fase gerak, senyawa yang paling tidak polar akan memiliki waktu retensi yang paling rendah (atau Rf paling tinggi dalam kromatografi lapisan). Pada kromatografi kertas fase tetapnya adalah air (pelarut yang lebih polar) yang terimobilisasi dalam serat selulosa (Houghton dan Raman, 1998).
III. METODOLOGI A. Bahan-bahan
Bahan-bahan yang digunakan dalam pembuatan tepung talas kontrol dan tepung talas perlakuan yaitu umbi talas mentega dan air. Bahan-bahan kimia yang digunakan meliputi etanol 70% (v/v), aquades, Pb-asetat CICATM jenuh, propanol MerckTM, etil asetat MerckTM, difenilamin MerckTM, anilin MerckTM, asam ortofosfat MerckTM dalam aseton MerckTM, kertas Whatman No. 1, rafinosa DifcoTM, maltosa MerckTM, sukrosa FluckaTM, glukosa MerckTM, fruktosa SigmaTM, inulin MerckTM dan oligofruktosa OraftiTM (P95%). Bahan-bahan yang digunakan dalam uji pertumbuhan BAL in vitro adalah kultur BAL,
proteose peptone DifcoTM, yeast exract DifcoTM, Tween 80 MerckTM,
dipotasium hidrogen fosfat MerckTM, sodium asetat MerckTM, MgSO4.7H2O DifcoTM, dan MnSO4.4H2O MerckTM, akuades, bacto agar
DifcoTM, dan gliserol UnivarTM. Bahan-bahan untuk pengujian prebiotik umbi talas adalah tikus percobaan, kultur BAL, dan bahan-bahan pakan standar (maizena HonigTM, minyak jagung China Corn OilTM , kasein, premix vitamin FitkomTM, premix mineral, selulosa dan akuades). Bahan-bahan media yang digunakan adalah MRS (deMann Rogosa
Sharpe) Broth OxoidTM, MRS (deMann Rogosa) Agar OxoidTM, larutan
fisiologis (NaCl 0.85%), EMBA (Eosin Methylene Blue Agar) DifcoTM,
LB (Lactose Broth) DifcoTM, SCB (Selenite Cystine Broth) OxoidTM,
BSA (Bismuth Sulfite Agar) OxoidTM, HEA (Hectone Enteric Agar)
OxoidTM dan TSIA (Triple Sugar Iron Agar) OxoidTM.
B. Alat-Alat Penelitian
Alat-alat yang digunakan untuk membuat tepung talas kontrol dan perlakuan adalah pisau, neraca, oven, baskom/wadah, ayakan 60 mesh,
slicer, kukusan, Whilley mill, wajan, sodet dan kompor. Alat untuk
alat-alat gelas, spektrofotometer-SpectronicTM20D+ beserta kuvetnya, neraca analitik, otoklaf, bunsen, ose, inkubator, refrigerator, vorteks, anaerobic jar OxoidTM dan gas generating kit OxoidTM. Alat untuk analisis BAL dan bakteri patogen antara lain stomaker, otoklaf, mikropipet EpendorfTM volume 10-100μl dan 100-1000μl, tabung reaksi, label kertas, alumunium foil, kapas, inkubator, bunsen, ose, vorteks, pipet, cawan petri, erlenmeyer dan gelas piala. Alat-alat yang diperlukan untuk pemeliharaan dan perlakuan tikus adalah kandang, wadah minum, dan wadah pakan.
C. Metode Penelitian
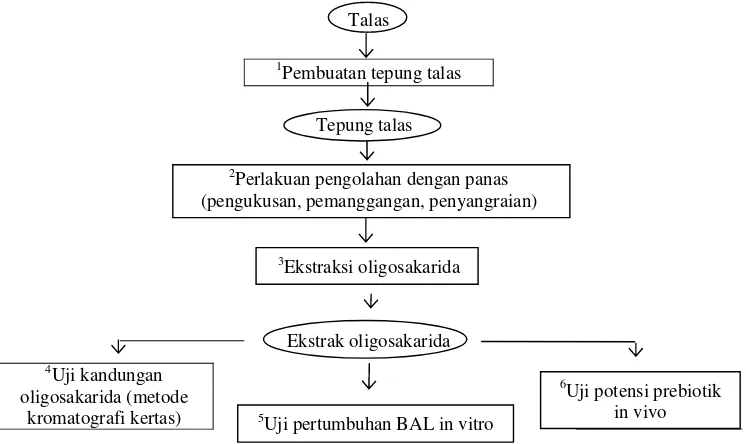
Penelitian dilakukan dalam beberapa tahap, yaitu (1) pembuatan tepung talas; (2) pengolahan dengan panas terhadap tepung talas (pemanggangan, pengukusan, dan penyangraian), (3) ekstraksi oligosakarida; (4) analisis oligosakarida tepung talas setelah perlakuan pemanasan; (5) uji pertumbuhan BAL secara in vitro; dan (6) uji potensi prebiotik secara in vivo terhadap ekstrak oligosakarida tepung talas terpilih. Diagram alir tahapan penelitian dapat dilihat pada Gambar 3.1.
Talas
1
Pembuatan tepung talas
Tepung talas
2
Perlakuan pengolahan dengan panas (pengukusan, pemanggangan, penyangraian)
3
Ekstraksi oligosakarida
Ekstrak oligosakarida
4
Uji kandungan oligosakarida (metode
[image:44.612.135.508.451.673.2]kromatografi kertas)
Gambar 3.1. Tahapan penelitian
5
Uji pertumbuhan BAL in vitro
6
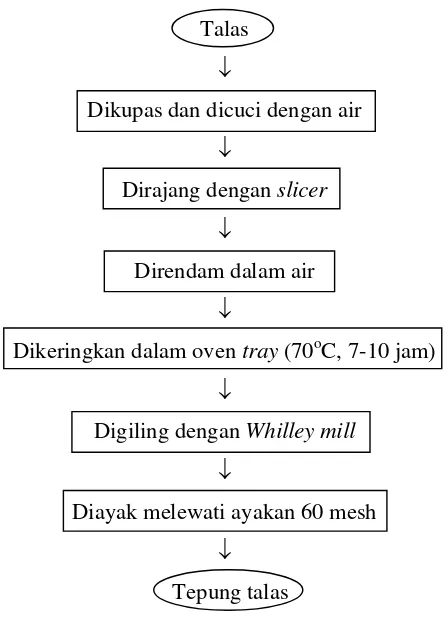
1. Pembuatan tepung talas
Pembuatan tepung talas diawali dengan pengupasan umbi segar dan pencucian yang kemudian diiris dan direndam dalam air. Perajangan umbi dilakukan dengan maksud untuk mempercepat proses pengeringan. Kemudian dilakukan pengeringan pada suhu sekitar 70oC selama 7-10 jam atau sampai kering. Hasil pengeringan berupa keripik talas kemudian digiling dan diayak untuk menghasilkan tepung talas. Tepung talas yang dihasilkan kemudian diukur kadar airnya dengan metode gravimetri. Diagram alir proses pembuatan tepung talas dapat dilihat pada Gambar 3.2.
Talas
↓
Dikupas dan dicuci dengan air
↓
Dirajang dengan slicer
↓
Direndam dalam air
↓
Dikeringkan dalam oven tray (70oC, 7-10 jam)
↓
Digiling dengan Whilley mill
↓
Diayak melewati ayakan 60 mesh
↓
[image:45.612.238.462.306.619.2]Tepung talas
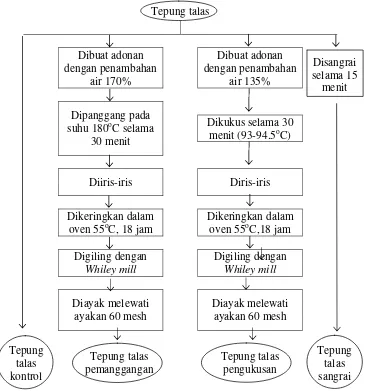
2. Perlakuan pengolahan dengan panas
Tepung talas yang dihasilkan dibagi ke dalam empat macam perlakuan yang terdiri dari tiga macam perlakuan pemanasan (pengukusan, pemanggangan dan penyangraian) dan satu kontrol untuk melihat pengaruh pemanasan tepung talas terhadap kandungan gula, oligosakarida (rafinosa) dan kandungan total padatan terlarut (TPT) tepung talas.
Pada perlakuan pertama tepung talas dibuat adonan dengan penambahan air sebanyak 170% dari berat tepung dan dipanggang pada suhu 180oC selama 30 menit, adonan hasil pemasakan kemudian ditepungkan kembali. Pada perlakuan kedua tepung talas dibuat adonan dengan ditambah air sebanyak 135% dari berat tepung kemudian adonan dikukus selama 30 menit pada suhu sekitar 93-94.5oC. Adonan hasil pengukusan juga ditepungkan kembali. Adonan hasil pemanggangan dan pengukusan ditepungkan dengan cara mengiris-iris adonan hasil pemasakan yang dihasilkan kemudian dikeringkan pada suhu 55oC dalam oven tray selama 20 jam. Pada perlakuan penyangraian tepung talas disangrai selama 15 menit. dengan menggunakan wajan. Sedangkan tepung talas kontrol tidak mengalami pengolahan dan pemanasan. Jumlah air yang ditambahkan didasarkan pada jumlah air yang ditambahkan pada pembuatan adonan untuk kue (cake) yang dipanggang atau dikukus (Maria, 2005) Diagram alir perlakuan pengolahan tepung talas dapat dilihat pada Gambar 3.3.
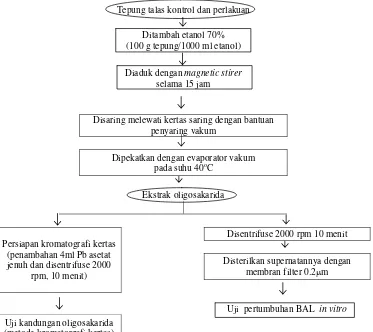
3. Ekstraksi Oligosakarida (Muchtadi, 1989)
Oligosakarida dalam setiap tepung kontrol dan tepung perlakuan diekstraksi menggunakan etanol 70% (100 gram tepung/1000 ml etanol) dengan pengadukan selama 15 jam menggunakan magnetic
stirer pada suhu ruang. Kemudian ekstrak oligosakarida tersebut
Tepung talas Dibuat adonan dengan penambahan air 170% Dibuat adonan dengan penambahan air 135% Disangrai selama 15 menit Dipanggang pada suhu 180oC selama
30 menit
Dikukus selama 30 menit (93-94.5oC)
Diiris-iris Diris-iris
Dikeringkan dalam oven 55oC, 18 jam
Dikeringkan dalam oven 55oC,18 jam
Digiling dengan
Whiley mill
Digiling dengan
Whiley mill
Diayak melewati ayakan 60 mesh
Diayak melewati ayakan 60 mesh
[image:47.612.139.505.99.490.2]Tepung talas kontrol Tepung talas pemanggangan Tepung talas pengukusan Tepung talas sangrai
Gambar 3.3. Diagram alir perlakuan pengolahan tepung talas
Ekstrak yang digunakan untuk analisis kromatografi kertas diendapkan pigmennya dengan menambahkan 4ml Pb-asetat jenuh kemudian disentrifuse (2000 rpm, 10 menit) dan disaring kembali supernatannya sehingga didapatkan ekstrak oligosakarida tanpa pigmen. Ekstrak yang digunakan untuk tahap in vivo dan in vitro
Ekstrak oligosakarida yang didapatkan kemudian dianalisis secara kualitatif dengan kromatografi kertas. Selain itu dilakukan pula pengukuran TPT (total padatan terlarut) ekstrak oligosakarida tepung talas perlakuan dan kontrol.
[image:48.612.136.509.212.544.2]Diagram alir ekstraksi oligosakarida tepung dapat dilihat pada Gambar 3.4.
Tepung talas kontrol dan perlakuan
Ditambah etanol 70% (100 g tepung/1000 ml etanol)
Diaduk dengan magnetic stirer selama 15 jam
Disaring melewati kertas saring dengan bantuan penyaring vakum
Dipekatkan dengan evaporator vakum pada suhu 40oC
Ekstrak oligosakarida
Persiapan kromatografi kertas (penambahan 4ml Pb asetat jenuh dan disentrifuse 2000
rpm, 10 menit)
Disentrifuse 2000 rpm 10 menit
Disterilkan supernatannya dengan membran filter 0.2μm
Uji pertumbuhan BAL in vitro
Uji kandungan oligosakarida (metode kromatografi kertas)
Gambar 3.4. Diagram alir ekstraksi oligosakarida tepung talas
4. Uji kandungan oligosakarida dengan metode kromatografi kertas modifikasi Muchtadi (1989)
yang digunakan untuk kromatografi kertas adalah 2-propanol, etil asetat, aquades (dengan perbandingan 7:1:2) Setiap jenis ekstrak oligosakarida tepung talas diteteskan diatas kertas Whatman No. 1 sebanyak 30 µL membentuk spot lingkaran kecil atau garis tipis. Standar rafinosa 0.5%, maltosa 0.5%, glukosa 0.5%, sukrosa 0.5% dan fruktosa 0.5% juga diteteskan masing-masing sebanyak 10 µL ke atas kertas. Kertas kromatografi yang telah diteteskan ekstrak sampel dan standar gula dimasukkan dalam bilik kromatografi sehingga sisi kertas yang terdapat spot sampel dan standar gula terendam eluen setinggi 1 cm. Setelah itu bilik kromatografi ditutup rapat dan didiamkan selama 5 jam. Area-area spot komponen oligosakarida yang telah terpisah dari ekstrak tepung talas dan standar gula disemprot dengan larutan pewarna berupa campuran difenilamin, asam ortofosfat, anilin dan aseton (4g difenilamin, 20ml asam ortofosfat 80% dan 4g anilin dalam 200ml aseton) kemudian dipanaskan dengan oven 100oC sehingga muncul spot (10 menit).
5. Uji pertumbuhan BAL pada ekstrak gula talas mentega
Tujuan tahap pengujian potensi prebiotik tepung talas secara in
vitro ini adalah untuk melihat kemampuan BAL dalam menggunakan
sumber gula asal tepung talas untuk pertumbuhannya, yang menjadi salah satu dasar pemilihan BAL yang akan digunakan dalam uji in vivo. Dalam uji ini perlu dilakukan tahapan penyegaran kultur BAL dan persiapan media fermentasi.
Penyegaran dan pengawetan kultur (Hariyadi et al., 2003)
Manik-manik yang mengandung mikroba yang akan digunakan (sebanyak + 3 biji) ditempatkan pada tabung yang mengandung MRS
Broth dan kemudian dilakukan inkubasi. Untuk kultur Lactobacillus
diinkubasi pada suhu 37oC sedangkan kultur Bifidobacterium pada
anaerobic jar pada suhu 37oC selama 2 hari. Setelah diinkubasi,
kemudian ditempatkan pada tabung berisi MRS Broth. Penyegaran hanya dilakukan pada saat analisis akan dilakukan.
Agar dapat terus digunakan, maka kultur bakteri perlu diawetkan. Pengawetan dilakukan dengan cara menusukan 1 ose kultur pada agar semisolid yang dibuat dengan cara mencampurkan MRSB dengan bacto agar sebanyak 0.5%.
Persiapan media fermentasi
Media fermentasi yang akan digunakan adalah media berbasis
MRS Broth tetapi glukosa media diganti dengan beberapa jenis gula
yang digunakan. Media fermentasi dibuat dengan mencampurkan
proteose peptone, yeast exract, Tween 80, K2HPO4, Na-asetat,
MgSO4.7H2O, dan MnSO4.4H2O. Komposisi bahan-bahan yang
digunakan dalam pembuatan MRS Basic dapat dilihat pada Lampiran 1. Sterilisasi medium dilakukan dengan pemanasan dalam otoklaf pada suhu 121oC selama 15 menit.
Empat jenis BAL yang digunakan dalam uji ini yaitu
Lactobacillus casei Rhamnosus, L. casei Shirota, Bifidobacterium
bifidum dan B. longum. Keempat jenis BAL diuji kemampuannya
dalam menggunakan sumber gula dari ekstrak oligosakarida tepung talas kontrol dan perlakuan pemanasan. Konsentrasi larutan ekstrak oligosakarida talas mentega steril yang digunakan berdasarkan TPT adalah 5%. Sebagai pembanding digunakan beberapa gula seril yaitu sukrosa, glukosa, fruktosa, rafinosa, oligofruktosa dan inulin dengan konsentrasi masing-masing sebesar 5%. Media yang digunakan adalah media berbasis MRS dimana glukosa media digantikan dengan gula-gula yang dalam analisis.
divorteks dan diinkubasi pada suhu 37oC selama 48 jam dan diukur absorbansi untuk H2 dengan spektrofotometer pada panjang
gelombang 600 nm, pengerjaan dilakukan duplo. Dibuat pula kontrol dan blanko. Blanko dibuat dengan menempatkan 9 ml larutan MRS Basis tanpa penambahan kultur BAL. Kontrol dikerjakan melalui tahapan yang sama dengan pengerjaan ekstrak gula talas perlakuan (ditambahkan 0.1 ml kultur) tetapi tidak ditambahkan sumber gula (standar gula maupun ekstrak gula talas). Blanko diperlukan dalam pengukuran absorbansi menggunakan spektrofotometer.
Pada pengujian menggunakan B. longum dan B. bifidum., media berbasis MRSB ditempatkan pada tabung reaksi sebanyak 9 ml kemudian ditambahkan 1 ml ekstrak gula talas mentega steril dengan TPT sebesar 5% sehingga konsentrasi ekstrak gula dalam medium adalah 0.5%. Kultur dari masing-masing BAL ditambahkan ke dalam media sebanyak 0.1 ml dan diinkubasi pada suhu 37oC selama 48 jam secara anaerobik menggunakan anerobic jar, kemudian diukur absorbansi untuk H2 dengan spektrofotometer pada panjang
gelombang 600 nm, pengerjaan dilakukan duplo. Dibuat pula kontrol dan blanko. Blanko dibuat dengan menempatkan 10 ml larutan MRSB perlakuan tanpa penambahan kultur pada tabung reaksi. Kontrol dikerjakan melalui tahapan yang sama dengan pengerjaan ekstrak gula talas perlakuan (ditambahkan 0.1 ml kultur) tetapi pada media tidak ditambahkan sumber gula (standar gula maupun ekstrak gula talas). Kontrol diperlukan untuk mengetahui absorbansi pada H0. Untuk
membuat kondisi yang anaerobik pada anaerobic jar digunakan Gas
Generating Kit. Pengukuran absorbansi dilakukan dengan
spektrofotometer pada panjang gelombang (λ) 600 nm.
ΔAbs = (A2 - A0) - (B2 - B0)
Keterangan:
ΔAbs = Absorbansi pertumbuhan BAL
A2 = Absorbansi media sampel hari ke-2 inkubasi
A0 = Absorbansi media sampel hari ke-0 inkubasi
B2 = Absorbansi media kontrol hari ke-2 inkubasi
B0 = Absorbansi media kontrol hari ke-0 inkubasi
6. Uji potensi prebiotik in vivo (Suryadjaja, 2005)
Uji ini bertujuan untuk melihat potensi ekstrak oligosakarida tepung talas terpilih sebagai prebiotik, L. casei Rhamnosus sebagai probiotik dan campuran BAL terpilih dan ekstrak oligosakarida tepung talas terpilih sebagai sinbiotik terhadap pertumbuhan total mikroba, BAL, E. coli, dan Samonella di saluran pencernaan makhluk hidup. Hewan percobaan yang dipergunakan adalah 27 ekor tikus putih jantan galur Sprague-Dawley berumur dua bulan. Tikus-tikus tersebut dibagi dalam 4 kelompok kelompok kontrol terdiri dari 6 ekor tikus, sedangkan kelompok sinbiotik, prebiotik dan probiotik terdiri dari 7 ekor tikus. Tabel 3.1. menunjukan pembagian kelompok perlakuan tikus percobaan.
Pemberian ransum standar dan air minum diberikan kepada setiap tikus selama 35 hari satu kali perhari setiap hari secara ad
libitum. Masa adaptasi selama 15 hari dilakukan dengan hanya
Tabel 3.1. Pembagian kelompok tikus percobaan uji prebiotik ekstrak oligosakarida talas in vivo
Kelompok
Perlakuan Perlakuan
A : Kontrol Ransum standar (Lampiran 8)
B : Prebiotik Ransum standar dan ekstrak oligosakarida (0.25g TPT/kgBBtikusrata-rataH13/hari)
C : Probiotik Ransum standar dan kultur BAL (jumlah sel bakteri 109cfu/1ml/hari)
D : Sinbiotik
Ransum standar dan campuran kultur BAL (109cfu/1ml/hari) dan ekstrak oligosakarida (0.25g TPT/kgBBtikusrata-rataH13/hari).
Masa pasca perlakuan dilakukan selama 10 hari dengan cara menghentikan pemberian ekstrak oligosakarida, kultur BAL dan sinbiotik kepada tikus. Pada masa ini tikus hanya diberikan ransum standar dan air minum.
Persiapan hewan percobaan dan pembuatan ransum standar
Hewan percobaan yang digunakan adalah tikus putih jantan galur Sprague Dawley berumur 2 bulan sebanyak 27 ekor, yang dibagi menjadi 4 kelompok. Setiap ekor tikus memiliki kandang masing-masing. Sekali sehari setiap hari selama 35 hari seluruh tikus diberikan ransum standar sebanyak 20 gram/ekor dan air minum secara ad
libitum. Berat badan tikus ditimbang dan kandang tikus dibersihkan
setiap 2 hari sekali. Ransum standar yang diberikan terdiri dari kasein, minyak jagung, campuran vitamin, campuran mineral, selulosa, aquades dan pati (maizena) (AOAC, 1984). Komposisi ransum standar yang diberikan dapat dilihat pada Lampiran 8.
Persiapan kultur bakteri asam laktat (BAL)
pada suhu 37oC selama 2 hari. Kultur BAL yang telah disegarkan sel bakterinya diendapkan dengan cara disentrifus (2000 rpm, 10 menit), diambil selnya dan diencerkan dengan larutan fisiologis NaCl 0.85% sebanyak 9ml.
Menurut WHO (1992) diacu dalam Suryadjaja (2005) konsumsi mikroorganisme hidup yang berperan sebagai prebiotik sebesar 106-108 cfu/ml atau gram dapat memberikan efek positif bagi kesehatan manusia. Untuk mengetahui banyaknya sel BAL yang d
![Gambar 2.2. Struktur kimia rafinosa [ β-D-Fruktofuranosil 0-α-D Galaktopiranosil-(1-6)-α-D-Galaktopiranosida] (Anonim, 2006)](https://thumb-ap.123doks.com/thumbv2/123dok/579127.342420/36.612.194.484.307.391/gambar-struktur-kimia-rafinosa-fruktofuranosil-galaktopiranosil-galaktopiranosida-anonim.webp)