CEKAMAN SUHU UNTUK INDUKSI PEMBELAHAN SPOROFITIK
PADA KULTUR ANTERA KEDELAI
DALAM SISTEM MEDIA DUA LAPIS
EVY AMMAY REZANY
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
EVY AMMAY REZANY. Cekaman Suhu Untuk Induksi Pembelahan Sporofitik Pada Kultur Antera Kedelai Dalam Sistem Media Dua Lapis. Dibimbing oleh ENCE DARMO JAYA SUPENA dan SUHARSONO.
Teknik androgenesis sangat berpotensi untuk mempercepat proses penelitian dan pemuliaan pada tanaman kedelai. Pengembangan teknik androgenesis pada kedelai melalui kultur antera pada media padat dan kultur isolasi mikrospora pada media cair belum dapat mengembangkan metode yang efisien. Penelitian ini bertujuan untuk mempelajari tahap awal induksi androgenesis kultur antera kedelai varietas Sindoro dan Slamet dalam sistem media dua lapis. Penanda morfologi kuncup bunga kedelai untuk sebagian besar mikrosporanya berinti tunggal akhir sampai berinti dua awal adalah ketika rasio braktea terhadap panjang kuncup 2:3. Perlakuan cekaman suhu rendah (4-9 °C) selama tiga hari dan suhu tinggi (31-33 °C) selama tujuh hari pada awal periode inkubasi dapat menginduksi pembelahan sporofitik sampai menjadi struktur multiselular pada varietas Slamet umur kultur empat minggu. Induksi pembelahan sporofitik dapat terjadi dari mikrospora berinti tunggal akhir sampai berinti dua awal. Hasil penelitian ini mengindikasikan bahwa tahap awal androgenesis telah dapat diinduksi melalui kultur antera kedelai dalam sistem media dua lapis.
ABSTRACT
EVY AMMAY REZANY. Temperature Shock for Induction of Sporophytic Division in Soybean Anther Culture with Double-Layer Medium System. Supervised by ENCE DARMO JAYA SUPENA and SUHARSONO
CEKAMAN SUHU UNTUK INDUKSI PEMBELAHAN SPOROFITIK
PADA KULTUR ANTERA KEDELAI
DALAM SISTEM MEDIA DUA LAPIS
EVY AMMAY REZANY
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Cekaman Suhu Untuk Induksi Pembelahan Sporofitik
Pada Kultur Antera Kedelai Dalam Sistem Media Dua Lapis
Nama : Evy Ammay Rezany
NIM :
G34102019
Menyetujui:
Pembimbing I,
Pembimbing II,
Dr. Ir. Ence Darmo Jaya Supena, M.Si
Dr. Ir. Suharsono, DEA
NIP 131851278
NIP 131664393
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Drh. Hasim, DEA
NIP 131578806
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Karya Ilmiah ini didasarkan pada hasil penelitian yang dilaksanakan mulai Maret 2006 sampai dengan Juni 2007 di laboratorium BIORIN dan Laboratorium Biologi Seluler dan Molekuler Tanaman, Pusat Penelitian Sumber Daya Hayati dan Bioteknologi IPB kampus IPB Darmaga, Bogor dan Laboratorium Riset di Fakultas Teknobiologi Unika Atmajaya, Jakarta. Karya Ilmiah yang diberi judul Cekaman Suhu Untuk Induksi Pembelahan Sporofitik Pada Kultur Antera Dalam Sistem Media Dua Lapis, adalah merupakan tahap awal dalam upaya mengembangkan teknik haploid pada kedelai.
Penulis menyampaikan penghargaan dan ucapan terima kasih kepada berbagai pihak yang telah membantu dalam pelaksanaan penelitian dan penyelesaian karya ilmiah ini, terutama kepada Dr. Ir. Ence Darmo Jaya Supena, M.Si. dan Dr. Ir. Suharsono, DEA. atas bimbingan, saran, ilmu, waktu dan perhatiannya selama penelitian, serta Dr. Ir. Tatik Chikmawati, M.Si. selaku penguji yang telah memberikan saran dan dalam perbaikan karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada Kepala Pusat Penelitian Sumberdaya Hayati dan Bioteknologi serta para staf atas sarana dan prasarana selama penulis melaksanakan penelitian. Terima kasih juga penulis sampaikan kepada Koordinator dan staf Laboratorium Riset Fakultas Teknobiologi Unika Atmajaya atas bantuan dan kerjasamanya.
Ungkapan terima kasih terbesar penulis sampaikan kepada Mama, Bapak, Adikku Fitri dan Faisal atas cinta, doa, perhatian dan dukungannya. Terima kasih juga penulis sampaikan untuk rekan-rekan di laboratorium Budi, Hakiim, Mbak Ulfa, Mas Firdaus, Bahrelfi, Bu Srilis, Pak Muzuni, Pak Hadi, Bu Hanum, Mas Yassier, Mbak Niken, Pak Ulung, Mbak Kiki, Mbak Muti, Mbak Rida, Usy, Jaya, Mbak Rina, Nindya, Zahroh, Donna, Mbak Ratna, Mbak Pepi dan Pak Mulya atas bantuannya. Terima kasih kepada rekan-rekan Biologi 39, 40 dan 41 serta sahabat yang selalu memberikan perhatian dan dukungan, Popi, Ninda, Bu Guru, Gema, Rina, Ayu, Apri, Ina, Rama, Bian dan Harowi.
Semoga karya ilmiah ini bermanfaat. Amin.
Bogor, Januari 2008
RIWAYAT HIDUP
Penulis dilahirkan di Tangerang pada tanggal 4 Mei 1984 dari ayah Amanu dan ibu Chunaeni. Penulis merupakan anak pertama dari tiga bersaudara.
Tahun 2002 penulis lulus dari SMU Negeri I Curug Tangerang dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
DAFTAR ISI
Halaman
DAFTAR TABEL
... vii
DAFTAR GAMBAR
...
vii
PENDAHULUAN
...
1METODE Bahan Tanaman dan Sumber Antera ... 1
Penentuan Tahap Perkembangan Mikrospora ... 2
Isolasi, Kultur Antera dan Inkubasi... 2
Komposisi media kultur ... 2
Isolasi antera dan inkubasi ... 2
Perlakuan Cekaman Suhu dan Pengamatan ... 2
Perlakuan cekaman suhu ... 2
Pengamatan ... 2
HASIL Hubungan Ciri Morfologi Kuncup Bunga dan Tahap Perkembangan Mikrospora ... 2
Respon Mikrospora Terhadap Perlakuan Cekaman Suhu ... 4
PEMBAHASAN... 6
SIMPULAN ... 6
DAFTAR PUSTAKA ... 7
DAFTAR TABEL
Halaman
1 Hubungan morfologi kuncup bunga dengan tahapan perkembangan mikrospora
pada kedelai ... 3 2 Pengaruh perlakuan cekaman suhu dan periode inkubasi terhadap tahap perkembangan
mikrospora pada kultur antera kedelai dalam sistem media dua lapis ... 5
DAFTAR GAMBAR
Halaman
PENDAHULUAN
Kebutuhan akan kedelai (Glycine max L.) di Indonesia sangat besar baik untuk dikonsumsi sebagai bahan makanan olahan maupun dimanfaatkan untuk pakan ternak. Pada tahun 2006 produksi kedelai di Indo-nesia hanya mencapai 747 611 ton dengan luas areal produksi 580 534 ha (BPS 2007), sedangkan kebutuhannya mencapai 2.2 juta ton per tahun. Untuk mengurangi ketimpang-an ini, berbagai cara untuk meningkatkketimpang-an produksi telah dan sedang dilaksanakan, salah satunya dengan pemuliaan kedelai melalui persilangan antar varietas yang dilanjutkan seleksi untuk menghasilkan varietas baru. Varietas baru ini diharapkan mempunyai kombinasi sifat baik dari tetuanya, misalnya selain berproduksi tinggi dan berumur genjah, juga toleran terhadap lahan masam dan memiliki kadar protein yang tinggi. Dengan demikian, produktivitas kedelai dapat di-tingkatkan melalui program intensifikasi dan ekstensifikasi pertanian.
Proses pemuliaan tanaman kedelai melalui persilangan yang dilanjutkan dengan seleksi membutuhkan waktu yang lama, yaitu setidaknya 7-8 generasi. Untuk itu diperlukan introduksi teknik yang dapat mempersingkat proses pemuliaan. Salah satu alternatif adalah mengembangkan dan menerapkan teknik haploid. Dengan teknik ini, sel gamet jantan yang belum matang atau mikrospora diinduksi menjadi embrio dan prosesnya disebut androgenesis. Pembentukan tanaman haploid dan haploid ganda dengan tehnik ini dapat dilakukan hanya dalam 1-2 generasi (Pierik 1987).
Tanaman haploid ganda akan memiliki keseragaman genetik karena homozigot untuk setiap lokusnya. Hal ini akan sangat bermanfaat untuk mempercepat proses seleksi hasil persilangan. Bila antera atau mikrospora dari hibrida F1 hasil persilangan dapat diinduksi menjadi embrio dan selanjutnya menjadi tanaman haploid ganda, maka proses seleksi akan segera dilakukan secara dini pada genotipe yang sudah tidak besegregasi lagi. Akhirnya proses seleksi dalam pemuliaan untuk menghasilkan varietas baru dapat dipercepat secara signifikan.
Induksi androgenesis dapat dilakukan melalui kultur antera dalam media padat atau kultur isolasi mikrospora pada media cair (Thomas & Davey 1975). Teknik kultur sebar mikrospora (KSM) seperti yang dilaporkan oleh Supena et al. (2006) merupakan kombinasi kedua teknik tersebut. Teknik
KSM adalah mengkulturkan antera pada media dua lapis, yaitu media cair di atas media padat.
Faktor-faktor penting yang perlu diketahui supaya induksi androgenesis berhasil diantaranya adalah: (1) penentuan fase perkembangan mikrospora yang responsif, (2) perlakuan cekaman suhu dan sumber karbon untuk membelokkan dari jalur perkembangan gametofitik ke pembelahan dan per-kembangan sporofitik, (3) komposisi media yang sesuai, dan (4) kondisi inkubasi yang mendukung (Thomas & Davey 1975; Collin & Edwards 1998; Reed 2000; Ferrie 2003; Touraev & Heberle-Bors 2003).
Pengembangan kultur jaringan pada tanaman kedelai umumnya dilakukan dalam upaya untuk membantu proses penelitian dan pemuliaan tanaman (Mariska & Lestari 2006). Teknik androgenesis yang juga sangat berpotensi untuk mempercepat proses penelitian dan pemuliaan tanaman telah dan sedang dikembangkan pada tanaman kedelai melalui kultur antera pada media padat yang dilakukan di beberapa negara seperti di Cina (Hu et al. 1996), Brazil (Kaltcuk-Santos et al. 1997) dan Indonesia (Zulkarnain 2005). Kultur isolasi mikrospora pada media cair juga telah dilaporkan oleh Rodrigues et al. (2006). Namun, sampai saat ini belum dapat dikembangkan metode yang efisien.
Didasarkan pada metode androgenesis yang telah dikembangkan pada tanaman lain, khususnya pada tanaman model seperti pada Brassica napus (Ferrie 2003) dan Nicotiana tabacum (Touraev & Heberle-Bors 2003), serta tanaman cabai (Supena et al. 2006), penelitian ini bertujuan untuk mempelajari tahap awal induksi androgenesis kultur antera kedelai dalam sistem media dua lapis. Hubungan antara tahap perkembangan mikrospora dan ciri morfologis kuncup bunga, serta pengaruh cekaman suhu terhadap induksi pembelahan sporofitik merupakan bagian utama yang dipelajari pada penelitian ini.
METODE
Bahan Tanaman dan Sumber Antera
2
kuncup bunga tersedia dalam waktu yang relatif kontinu. Kuncup bunga dari tanaman ini digunakan untuk penentuan tahap perkembangan mikrospora dan bahan isolasi dalam kultur antera.
Penentuan Tahap Perkembangan Mikrospora
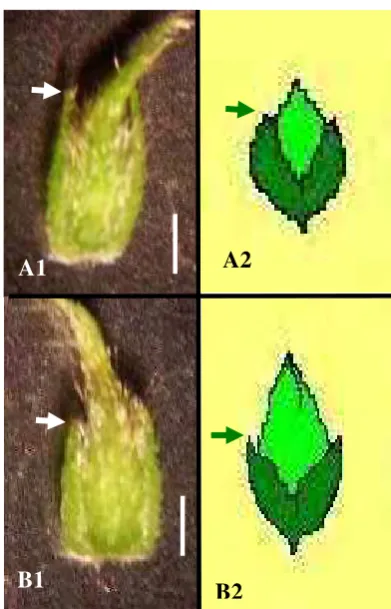
Kuncup bunga kedelai dikelompokkan menjadi empat tahap perkembangan didasarkan pada rasio panjang daun pelindung (braktea) terhadap panjang kuncup keseluruhan (Gambar lampiran 1). Kuncup bunga dibuka menggunakan pinset untuk mengisolasi antera dengan cara memisahkan-nya dari filamen dan mahkota bunga. Antera didiseksi dan dipotong dengan scalpel kemudian disuspensikan dalam media cair mannitol (55 g/l) dan disentrifuse pada kecepatan 8000 rpm (Jouan BR4i) selama 4 menit. Mikrospora diwarnai menggunakan pewarna DNA 4,6-diamidino-2-phenylindole (DAPI) dan tahapan perkembangan mikro-spora diamati di bawah mikroskop Fluoresens tipe Nikon Eclipse E-600 dengan filter UV. Tahapan perkembangan mikrospora ini dikorelasikan dengan tahapan perkembangan kuncup bunga. Mikrospora diisolasi juga dengan cara yang sama untuk menghitung densitas mikrospora pada kuncup bunga kedelai. Mikrospora dihitung menggunakan alat bantu hemasitometer dengan peng-hitungan di bawah mikroskop.
Isolasi, Kultur Antera dan Inkubasi
Komposisi media kultur. Media kultur adalah media dua lapis, media cair di atas media padat. Media padat yang digunakan adalah media SL2 (Phillips & Collins 1980) dengan penambahan sukrosa 25 g/l, arang aktif 10 g/l dan agar-agar Gelrite 2 g/l. Komposisi media cair sama dengan media padat tetapi tanpa arang aktif dan agar-agar Gelrite. Untuk tiap cawan petri diameter 6 cm yang digunakan membutuhkan media padat 3 ml dan selanjutnya akan ditambah 3 ml media cair di atasnya sesaat sebelum kultur.
Isolasi antera dan inkubasi. Kuncup bunga yang digunakan sebagai bahan eksplan adalah kuncup dengan antera yang sebagian besar mengandung mikrospora fase berinti tunggal akhir sampai berinti dua awal. Kuncup bunga dipanen pada pagi hari dan segera didesinfeksi selama 10 menit dalam 2% NaOCl dengan penambahan 0.05 % (v/v) Tween-20, kemudian dibilas tiga kali dalam akuades steril masing-masing selama 10, 5 dan 1 menit. Selanjutnya, antera dari setiap
kuncup bunga yang berjumlah 10 buah diisolasi pada kondisi steril dan dikulturkan dalam sebuah petri dish dengan media SL2 dua lapis sehingga mengapung pada permukaan cair. Perkembangan mikrospora dalam antera, khususnya jumlah dan jenis inti atau sel dari mikrospora, diamati secara sitologis dengan menggunakan pewarna DAPI mulai dari awal kultur, 1, 2, 3 dan 4 minggu setelah kultur.
Perlakuan Cekaman Suhu dan Pengamatan
Perlakuan cekaman suhu. Setiap kuncup bunga diisolasi secara acak tujuh buah antera dan dikulturkan kedalam tujuh cawan petri untuk tujuh taraf perlakuan cekaman. Kultur antera dari kuncup bunga ini diulang hingga tiap petri berjumlah 15 antera yang berasal dari 15 kuncup bunga. Setiap taraf perlakuan diulang tiga kali atau terdiri dari 21 petri. Kultur dari masing-masing varietas Sindoro dan Slamet diberi perlakuan suhu pada awal inkubasi, yaitu suhu rendah (4-9 ºC) dan suhu tinggi (31-33 ºC) dengan periode inkubasi 1, 3, dan 7 hari pada kondisi gelap, serta suhu 25-28 ºC sebagai kontrol sehingga kombinasi perlakuan cekaman suhu dan periode cekaman terdiri dari tujuh taraf perlakuan untuk masing-masing varietas. Setelah periode cekaman suhu, kultur selanjutnya diinkubasi pada suhu 25-28 °C dan selalu dalam keadaan gelap.
Pengamatan. Perkembangan mikrospora dari setiap taraf perlakuan cekaman suhu dan periode cekaman untuk masing-masing jenis varietas diamati secara periodik setiap minggunya, yaitu minggu ke 0, 1, 2, 3 dan 4. Satu buah antera diambil dari masing-masing cawan petri dalam kondisi steril setiap minggunya, kemudian didiseksi dan diwarnai dengan pewarna DAPI. Perkembangan mikrospora dan penghitungan jumlah inti atau sel setiap individu mikrospora diamati di bawah mikroskop fluoresens dengan menggunakan filter UV.
HASIL
Hubungan Ciri Morfologi Kuncup Bunga dan Tahap Perkembangan Mikrospora
3
terjadi pada saat kuncup bunga mempunyai rasio braktea terhadap panjang kuncup 1:1. Setelah fase tetrad, masing-masing sel akan menjadi individu mikrospora fase berinti tunggal awal (Gambar 1B), yang selanjutnya berkembang menjadi mikrospora fase berinti tunggal akhir (Gambar 1C). Kedua fase mikrospora ini dijumpai pada kuncup bunga dengan rasio braktea terhadap panjang kuncup 2:3 baik pada varietas Sindoro maupun varietas Slamet. Inti sel mikrospora akan mengalami pembelahan mitosis menjadi dua inti yang akan berkembang menjadi inti vegetatif dan inti generatif (Gambar 1D dan 1E). Fase tersebut sebagian besar dijumpai pada kuncup bunga Sindoro (55.5 %) dan Slamet (87.5 %) pada rasio braktea terhadap
panjang kuncup 1:2. Mikrospora berinti dua akhirnya akan berkembang menjadi sel gamet jantan atau polen matang dengan satu inti vegetatif yang besar dan tampak sirkuler dan satu inti generatif yang terkondensasi dan terlihat memanjang (Gambar 1F). Fase polen ini mulai dijumpai pada kuncup bunga dengan rasio braktea terhadap panjang kuncup 1:2 dan menjadi dominan pada rasio 1:3. Pada kuncup bunga dengan rasio 1:3 terdapat juga polen yang sudah tidak berinti (Gambar 1G) masing-masing 36.4 % dan 42.5 % untuk varietas Sindoro dan Slamet. Rata-rata densitas mikrospora kedelai adalah 19 467 sel per kuncup bunga dengan kisaran 19 200 sel sampai 22 400 sel per kuncup.
Tabel 1 Hubungan morfologi kuncup bunga dengan tahapan perkembangan mikrospora pada kedelai
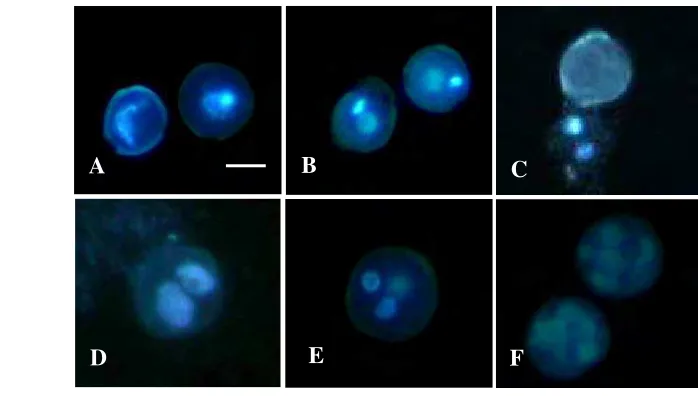
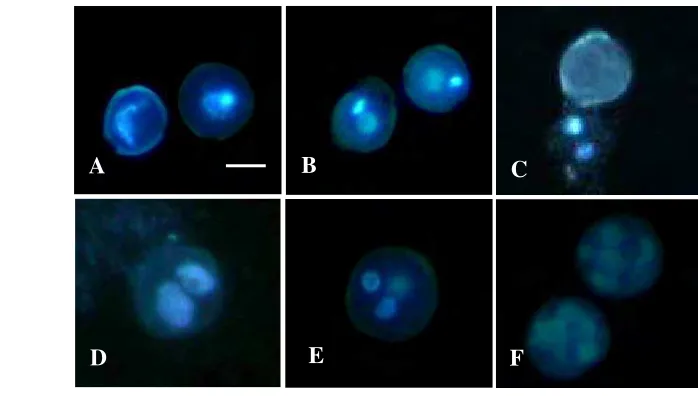
Gambar 1 Tahap perkembangan mikrospora atau polen kedelai: (A) fase tetrad; (B) fase berinti tunggal awal; (C) fase berinti tunggal akhir; (D) fase berinti dua awal; (E) fase berinti dua akhir; (F) polen matang; (G) polen yang tidak memiliki atau sudah kehilangan inti. Bar A-G= 10 µm.
Tahap perkembangan mikrospora (%)
Berinti tunggal Berinti dua Varietas
Rasio braktea: panjang kuncup
Panjang kuncup (mm)
Tetrad
awal akhir awal akhir Polen
Polen tidak berinti
1:1 2.0-2.5 mm 100 0 0 0 0 0 0
2:3 2.5-4.5 mm 0 34.2 34.2 21.8 9.8 0 0
1:2 4.5-5.5 mm 0 0 3.3 16.7 38.8 32.4 8.8 Sindoro
1:3 5.5-6.0 mm 0 0 0 0 0 63.6 36.4
1:1 2.5-3.0 mm 100 0 0 0 0 0 0
2:3 3.0-4.0 mm 0 34.7 53.6 8.8 2.9 0 0
1:2 4.0-5.0 mm 0 0 0 20.8 66.7 12.5 0
Slamet
1:3 5.0-6.0 mm 0 0 0 0 0 57.5 42.5
C
D
E
G
B
A
4
Respon Mikrospora Terhadap Perlakuan Cekaman Suhu
Sel mikrospora fase berinti tunggal akhir dan fase berinti dua awal (Gambar 2A) memperlihatkan respon yang berbeda-beda terhadap perlakuan cekaman suhu dengan periode inkubasi berbeda (Tabel 2). Pada kondisi kontrol (25-28 ºC) mikrospora berinti tunggal akan mengalami gametogenesis. Inti sel mikrospora membelah secara asimetri menghasilkan dua inti yang berbeda yaitu berkembang menjadi inti generatif dan inti vegetatif (Gambar 2B). Perkembangan selanjutnya tidak tampak menjadi polen dewasa tetapi inti dan sitoplasma keluar sehingga mikrospora menjadi tidak berinti (Gambar 2C). Proses ini terjadi mulai pada minggu pertama sampai minggu keempat setelah kultur dengan jumlah sel yang kehilangan inti tersebut terus bertambah di minggu kedua, ketiga dan keempat (Tabel 2).
Perlakuan cekaman suhu 4-9 °C dengan periode inkubasi satu dan tiga hari untuk
masing-masing varietas Slamet dan Sindoro telah mampu menginduksi inti sel mikrospora untuk membelah simetri menjadi dua inti yang sama (Gambar 2D) masing-masing 2.9 % dan 6.2 % untuk varietas Slamet dan Sindoro (Tabel 2). Sel dengan dua inti yang sama ditemukan juga di perlakuan cekaman suhu 31-33 °C dalam periode tujuh hari hanya pada varietas Slamet (1.0 %). Pada pengamatan minggu keempat, mikrospora varietas Slamet mampu menghasilkan mikrospora multiselular dengan lebih dari enam sel (Gambar 2F), yaitu masing-masing 2.3 % pada suhu rendah se-lama tiga hari dan 5.1 % pada suhu tinggi selama tujuh hari. Perlakuan cekaman suhu pada varietas Slamet mampu menghasilkan mikrospora multiselular sedangkan pada varietas Sindoro, meskipun pembelahan sporofitik (simetri) terjadi pada pengamatan minggu pertama, tetapi perkembangan sel mikrospora tidak sampai pada struktur multiselular.
B
D
C
F
A
E
Gambar 2 Perkembangan mikrospora pada kultur antera kedelai varietas Slamet: (A) mikrospora fase berinti tunggal akhir (kiri) dan fase berinti dua awal (kanan) pada awal kultur; (B) inti mikrospora yang membelah secara asimetri menjadi mikrospora pada fase berinti dua hingga polen matang; (C) inti dan sitoplasma mikrospora keluar dari dalam sel; (D) inti sel mikrospora yang membelah secara simetri; (E) mikrospora dengan satu inti generatif dan dua inti vegetatif; (F) mikrospora dengan lebih dari enam inti sel. B dan C umur satu minggu setelah kultur pada kondisi tanpa cekaman suhu atau 25-28 °C (kontrol); D dan E umur satu minggu serta F umur empat minggu pada kondisi cekaman suhu 4-9 °C. Bar=10 µm.
PEMBAHASAN
Karakter morfologi kuncup bunga kedelai, yaitu rasio braktea terhadap panjang kuncup bunga merupakan salah satu parameter yang dapat digunakan untuk menduga tahap perkembangan mikrospora dalam kuncup bunga varietas Slamet maupun Sindoro yang digunakan pada penelitian ini. Fase berinti tunggal akhir sampai fase berinti dua awal adalah ketika rasio braktea terhadap panjang kuncup 2:3. Hasil ini sesuai dengan yang telah dilaporkan oleh da Silva Lauxen et al. (2003). Dengan menggunakan penciri morfologi ini diharapkan antera yang akan dikulturkan adalah antera yang mengandung tahap perkembangan mikrospora yang diinginkan. Menurut Hu et al. (1996) antera yang memiliki mikrospora fase berinti tunggal akhir dan berinti dua awal merupakan tahap yang responsif untuk induksi androgenesis pada kedelai.
Tahapan perkembangan mikrospora berdasarkan panjang kuncup bunga kedelai berbeda pada masing-masing varietas. Fase tetrad dimiliki oleh kuncup bunga dengan panjang 2.0-2.5 mm pada varietas Sindoro dan 2.5-3.0 mm pada varietas Slamet. Kuncup bunga Sindoro dengan panjang 2.5-4.5 mm mengandung 34.2 % mikrospora fase berinti tunggal awal. Jumlah ini hampir sama dengan kuncup bunga Slamet ketika panjang kuncup 3.0-4.0 mm, yaitu 34.7 %. Namun, Slamet mengandung mikrospora fase berinti tunggal akhir yang lebih besar dibandingkan Sindoro, yaitu 53.6 %. Sehingga karakter morfologi panjang kuncup tidak dapat digunakan sebagai penanda perkembangan mikrospora karena tidak konsisten pada kedua varietas yang diamati, Sindoro dan Slamet.
Perlakuan cekaman suhu rendah (4-9 °C) dan suhu tinggi (31-33 °C) telah mampu menghasilkan struktur multiselular dari mikrospora varietas Slamet. Struktur multiselular tersebut menandakan bahwa telah terjadi pembelokkan perkembangan mikro-spora dari jalur gametofitik menjadi terinduksi untuk pembelahan sporofitik. Terjadinya pembelahan sporofitik ini merupakan tahap awal untuk terjadinya proses embriogenesis dari mikrospora atau induksi androgenesis. Struktur multiselular mikrospora ini dapat berasal dari mikrospora berinti tunggal akhir yang ditandai adanya pembelahan simetri menghasilkan dua inti yang sama (Gambar 2D), dan dapat juga berasal dari mikrospora berinti dua awal dengan menghasilkan dua inti
vegetatif yang disertai satu inti generatif (Gambar 2E). Fenomena ini sesuai dengan yang dilaporkan oleh Hu et al. (1996) dan de Moraes et al. (2004) yang menyatakan bahwa pembelahan simetri mikrospora berasal dari mikrospora fase berinti tunggal akhir dan pembelahan simetri inti vegetatif dari fase berinti dua awal akan menghasilkan struktur multiselular.
Individu mikrospora dapat melanjutkan perkembangan gametofitiknya pada kondisi tanpa cekaman suhu (25-28 °C) karena mikrospora berinti tunggal akhir dapat berkembang sampai pada tahap berinti dua akhir. Namun, mikrospora berinti dua akhir ini tidak berkembang lebih lanjut karena sel mikrospora mengalami plasmolisis sehingga tidak tampak menjadi polen matang dan berkecambah, akan tetapi inti dan seluruh sitoplasma keluar dari dinding mikrospora sehingga mikrospora menjadi tidak memiliki inti. Kehilangan inti atau kematian mikrospora ini bertambah setiap minggu pengamatan.
Penggunaan sumber karbon sukrosa diduga merupakan faktor penyebab sel mikrospora mengalami plasmolisis, karena sukrosa dapat meningkatkan tekanan osmotik larutan media. Sukrosa merupakan sumber karbon yang sangat cepat dihidrolisis dan lebih cepat dimanfaatkan, sehingga sukrosa pada kultur mikrospora kedelai dilaporkan tidak dapat digunakan untuk perkembangan mikrospora multiselular ke perkembangan selanjutnya menjadi embrio (Hu et al. 1996). Maltosa merupakan alternatif yang dapat dipilih sebagai sumber karbon tanpa meracuni sel karena dapat dimanfaatkan secara bertahap pada kultur isolasi mikrospora Barley (Kasha et al. 2003). Oleh karenanya kombinasi perlakuan cekaman suhu dengan sumber karbon maltosa dalam media kultur mungkin akan dapat memaksimalkan induksi androgenesis pada kultur antera kedelai.
SIMPULAN
7
Hasil penelitian ini mengindikasikan bahwa tahap awal androgenesis telah dapat diinduksi melalui kultur antera kedelai dalam sistem media dua lapis.
DAFTAR PUSTAKA
[BPS] Biro Pusat Statistik. 2007. Harvested Area, Yield Rate and Production of Soybean by Province. http://www.bps. go.id/sector/agri/pangan/table5.shtml [07 Agt 06].
Collin HA, Edwards S. 1998. Plant Cell Culture. United Kingdom: Bios Scientific Publisher.
da Silva Lauxen M, Kalthcuk-Santos E, Hu CY, Callegari-Jacques SM, Bonadese-Zanettini MH. 2003. Association between floral bud size and developmental stage in soybean microspores. Braz Arch Biol Technol. 46: 515-520.
de Moraes AP, Bonadese-Zanettini MH, Callegari-Jacques SM, Kalthcuk-Santos E. 2004. Effect of temperature shock on soybean microspore embryogenesis. Braz Arch Biol Technol. 47: 537-544. Ferrie A. 2003. Microspore culture of
Brassica species. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant, A Manual. Dordrecht: Kluwer Academic Publisher. hlm. 205-215.
Hu CY, Yin GC, Bonadese-Zanettini MH. 1996. Haploid of soybean. Di Dalam: Jain SM, Sopory SK, Veilleux RE, editor. In Vitro Production in Higher Plants. Dordrecht: Kluwer Academic Publisher. hlm 377-395.
Husni A, Hutami S, Kosmiatin M, Mariska I. 2003. Regenerasi massa sel embriogenik kedelai yang diseleksi dengan Polyethylen Glicol 6000 (PEG). Di dalam: Hasil Penelitian Rintisan Bioteknologi Tanaman. Prosiding Seminar; Bogor, 23-24 Sep 2003. Bogor: Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian. hlm 272-280.
Kalthcuk-Santos E, Mariath JE, Mundstock E, Hu CY, Bodanese-Zanettini MH. 1997. Cytological analysis of early microspore divisions and embryo formation in cultured soybean anther. Plant Cell Tiss Org Cult. 49: 107-115.
Kasha KJ, Simion E, Oro R, Shim YS. 2003. Barley isolated and microspore culture protocol. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant. Dordrecht: Kluwer Academic Publisher. hlm 43-47.
Mariska I, Lestari EG. 2006. Seleksi in vitro untuk toleransi terhadap faktor abiotik pada tanaman padi dan kedelai. Di dalam: Pemanfaatan Bioteknologi untuk Mengatasi Cekaman Abiotik pada Tanaman. Prosiding Seminar Nasional. Bogor: Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian. hlm 28-41.
Phillips GC, Collins GB. 1980. Somatic embryogenesis from cell suspension cultures of red clover. Crop Sci. 20: 323-326.
Pierik RLM.1987. In Vitro Culture of Higher Plants. Dordrecht : Kluwer Academic Publisher.
Reed SM. 2000. Haploid Cultures. Di dalam: Trigiano RN, Gray DJ, editor. Plant Tissue Culture Concepts and Laboratory Exercises. USA: Boca Raton. hlm 285-295.
Rodrigues LR, de Camargo Forte B, Bodanese-Zanettini MH. 2006. Isolation and culture of soybean (Glycine max L. Merrill) microspores and pollen grains. Braz Arch Biol Technol. 49: 537-545.
Supena EDJ, Suharsono S, Jacobsen E, Custers JBM. 2006. Succesfull development of a shed-microspore culture protocol for double haploid production in Indonesian hot pepper (Capsicum annuum L.). Plant Cell Rep. 25:1-10.
Thomas E, Davey MR. 1975. From Single Cells to Plants. London: Wykeham publications.
Touraev A, Heberle-Bors E. 2003. Anther and microspore culture in tobacco. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant. Dordrecht : Kluwer Academic Publisher. hlm 223-228.
9
A
Gambar lampiran 1 Pengukuran rasio braktea terhadap panjang kuncup bunga kedelai: (A1-A2) kuncup bunga dengan rasio braktea terhadap panjang kuncup 2/3; (B1-B2) kuncup bunga dengan rasio braktea terhadap panjang kuncup 1/2. Bar = 0.5 mm. Tanda panah= braktea.
A1
B1
A2
CEKAMAN SUHU UNTUK INDUKSI PEMBELAHAN SPOROFITIK
PADA KULTUR ANTERA KEDELAI
DALAM SISTEM MEDIA DUA LAPIS
EVY AMMAY REZANY
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
EVY AMMAY REZANY. Cekaman Suhu Untuk Induksi Pembelahan Sporofitik Pada Kultur Antera Kedelai Dalam Sistem Media Dua Lapis. Dibimbing oleh ENCE DARMO JAYA SUPENA dan SUHARSONO.
Teknik androgenesis sangat berpotensi untuk mempercepat proses penelitian dan pemuliaan pada tanaman kedelai. Pengembangan teknik androgenesis pada kedelai melalui kultur antera pada media padat dan kultur isolasi mikrospora pada media cair belum dapat mengembangkan metode yang efisien. Penelitian ini bertujuan untuk mempelajari tahap awal induksi androgenesis kultur antera kedelai varietas Sindoro dan Slamet dalam sistem media dua lapis. Penanda morfologi kuncup bunga kedelai untuk sebagian besar mikrosporanya berinti tunggal akhir sampai berinti dua awal adalah ketika rasio braktea terhadap panjang kuncup 2:3. Perlakuan cekaman suhu rendah (4-9 °C) selama tiga hari dan suhu tinggi (31-33 °C) selama tujuh hari pada awal periode inkubasi dapat menginduksi pembelahan sporofitik sampai menjadi struktur multiselular pada varietas Slamet umur kultur empat minggu. Induksi pembelahan sporofitik dapat terjadi dari mikrospora berinti tunggal akhir sampai berinti dua awal. Hasil penelitian ini mengindikasikan bahwa tahap awal androgenesis telah dapat diinduksi melalui kultur antera kedelai dalam sistem media dua lapis.
ABSTRACT
EVY AMMAY REZANY. Temperature Shock for Induction of Sporophytic Division in Soybean Anther Culture with Double-Layer Medium System. Supervised by ENCE DARMO JAYA SUPENA and SUHARSONO
PENDAHULUAN
Kebutuhan akan kedelai (Glycine max L.) di Indonesia sangat besar baik untuk dikonsumsi sebagai bahan makanan olahan maupun dimanfaatkan untuk pakan ternak. Pada tahun 2006 produksi kedelai di Indo-nesia hanya mencapai 747 611 ton dengan luas areal produksi 580 534 ha (BPS 2007), sedangkan kebutuhannya mencapai 2.2 juta ton per tahun. Untuk mengurangi ketimpang-an ini, berbagai cara untuk meningkatkketimpang-an produksi telah dan sedang dilaksanakan, salah satunya dengan pemuliaan kedelai melalui persilangan antar varietas yang dilanjutkan seleksi untuk menghasilkan varietas baru. Varietas baru ini diharapkan mempunyai kombinasi sifat baik dari tetuanya, misalnya selain berproduksi tinggi dan berumur genjah, juga toleran terhadap lahan masam dan memiliki kadar protein yang tinggi. Dengan demikian, produktivitas kedelai dapat di-tingkatkan melalui program intensifikasi dan ekstensifikasi pertanian.
Proses pemuliaan tanaman kedelai melalui persilangan yang dilanjutkan dengan seleksi membutuhkan waktu yang lama, yaitu setidaknya 7-8 generasi. Untuk itu diperlukan introduksi teknik yang dapat mempersingkat proses pemuliaan. Salah satu alternatif adalah mengembangkan dan menerapkan teknik haploid. Dengan teknik ini, sel gamet jantan yang belum matang atau mikrospora diinduksi menjadi embrio dan prosesnya disebut androgenesis. Pembentukan tanaman haploid dan haploid ganda dengan tehnik ini dapat dilakukan hanya dalam 1-2 generasi (Pierik 1987).
Tanaman haploid ganda akan memiliki keseragaman genetik karena homozigot untuk setiap lokusnya. Hal ini akan sangat bermanfaat untuk mempercepat proses seleksi hasil persilangan. Bila antera atau mikrospora dari hibrida F1 hasil persilangan dapat diinduksi menjadi embrio dan selanjutnya menjadi tanaman haploid ganda, maka proses seleksi akan segera dilakukan secara dini pada genotipe yang sudah tidak besegregasi lagi. Akhirnya proses seleksi dalam pemuliaan untuk menghasilkan varietas baru dapat dipercepat secara signifikan.
Induksi androgenesis dapat dilakukan melalui kultur antera dalam media padat atau kultur isolasi mikrospora pada media cair (Thomas & Davey 1975). Teknik kultur sebar mikrospora (KSM) seperti yang dilaporkan oleh Supena et al. (2006) merupakan kombinasi kedua teknik tersebut. Teknik
KSM adalah mengkulturkan antera pada media dua lapis, yaitu media cair di atas media padat.
Faktor-faktor penting yang perlu diketahui supaya induksi androgenesis berhasil diantaranya adalah: (1) penentuan fase perkembangan mikrospora yang responsif, (2) perlakuan cekaman suhu dan sumber karbon untuk membelokkan dari jalur perkembangan gametofitik ke pembelahan dan per-kembangan sporofitik, (3) komposisi media yang sesuai, dan (4) kondisi inkubasi yang mendukung (Thomas & Davey 1975; Collin & Edwards 1998; Reed 2000; Ferrie 2003; Touraev & Heberle-Bors 2003).
Pengembangan kultur jaringan pada tanaman kedelai umumnya dilakukan dalam upaya untuk membantu proses penelitian dan pemuliaan tanaman (Mariska & Lestari 2006). Teknik androgenesis yang juga sangat berpotensi untuk mempercepat proses penelitian dan pemuliaan tanaman telah dan sedang dikembangkan pada tanaman kedelai melalui kultur antera pada media padat yang dilakukan di beberapa negara seperti di Cina (Hu et al. 1996), Brazil (Kaltcuk-Santos et al. 1997) dan Indonesia (Zulkarnain 2005). Kultur isolasi mikrospora pada media cair juga telah dilaporkan oleh Rodrigues et al. (2006). Namun, sampai saat ini belum dapat dikembangkan metode yang efisien.
Didasarkan pada metode androgenesis yang telah dikembangkan pada tanaman lain, khususnya pada tanaman model seperti pada Brassica napus (Ferrie 2003) dan Nicotiana tabacum (Touraev & Heberle-Bors 2003), serta tanaman cabai (Supena et al. 2006), penelitian ini bertujuan untuk mempelajari tahap awal induksi androgenesis kultur antera kedelai dalam sistem media dua lapis. Hubungan antara tahap perkembangan mikrospora dan ciri morfologis kuncup bunga, serta pengaruh cekaman suhu terhadap induksi pembelahan sporofitik merupakan bagian utama yang dipelajari pada penelitian ini.
METODE
Bahan Tanaman dan Sumber Antera
PENDAHULUAN
Kebutuhan akan kedelai (Glycine max L.) di Indonesia sangat besar baik untuk dikonsumsi sebagai bahan makanan olahan maupun dimanfaatkan untuk pakan ternak. Pada tahun 2006 produksi kedelai di Indo-nesia hanya mencapai 747 611 ton dengan luas areal produksi 580 534 ha (BPS 2007), sedangkan kebutuhannya mencapai 2.2 juta ton per tahun. Untuk mengurangi ketimpang-an ini, berbagai cara untuk meningkatkketimpang-an produksi telah dan sedang dilaksanakan, salah satunya dengan pemuliaan kedelai melalui persilangan antar varietas yang dilanjutkan seleksi untuk menghasilkan varietas baru. Varietas baru ini diharapkan mempunyai kombinasi sifat baik dari tetuanya, misalnya selain berproduksi tinggi dan berumur genjah, juga toleran terhadap lahan masam dan memiliki kadar protein yang tinggi. Dengan demikian, produktivitas kedelai dapat di-tingkatkan melalui program intensifikasi dan ekstensifikasi pertanian.
Proses pemuliaan tanaman kedelai melalui persilangan yang dilanjutkan dengan seleksi membutuhkan waktu yang lama, yaitu setidaknya 7-8 generasi. Untuk itu diperlukan introduksi teknik yang dapat mempersingkat proses pemuliaan. Salah satu alternatif adalah mengembangkan dan menerapkan teknik haploid. Dengan teknik ini, sel gamet jantan yang belum matang atau mikrospora diinduksi menjadi embrio dan prosesnya disebut androgenesis. Pembentukan tanaman haploid dan haploid ganda dengan tehnik ini dapat dilakukan hanya dalam 1-2 generasi (Pierik 1987).
Tanaman haploid ganda akan memiliki keseragaman genetik karena homozigot untuk setiap lokusnya. Hal ini akan sangat bermanfaat untuk mempercepat proses seleksi hasil persilangan. Bila antera atau mikrospora dari hibrida F1 hasil persilangan dapat diinduksi menjadi embrio dan selanjutnya menjadi tanaman haploid ganda, maka proses seleksi akan segera dilakukan secara dini pada genotipe yang sudah tidak besegregasi lagi. Akhirnya proses seleksi dalam pemuliaan untuk menghasilkan varietas baru dapat dipercepat secara signifikan.
Induksi androgenesis dapat dilakukan melalui kultur antera dalam media padat atau kultur isolasi mikrospora pada media cair (Thomas & Davey 1975). Teknik kultur sebar mikrospora (KSM) seperti yang dilaporkan oleh Supena et al. (2006) merupakan kombinasi kedua teknik tersebut. Teknik
KSM adalah mengkulturkan antera pada media dua lapis, yaitu media cair di atas media padat.
Faktor-faktor penting yang perlu diketahui supaya induksi androgenesis berhasil diantaranya adalah: (1) penentuan fase perkembangan mikrospora yang responsif, (2) perlakuan cekaman suhu dan sumber karbon untuk membelokkan dari jalur perkembangan gametofitik ke pembelahan dan per-kembangan sporofitik, (3) komposisi media yang sesuai, dan (4) kondisi inkubasi yang mendukung (Thomas & Davey 1975; Collin & Edwards 1998; Reed 2000; Ferrie 2003; Touraev & Heberle-Bors 2003).
Pengembangan kultur jaringan pada tanaman kedelai umumnya dilakukan dalam upaya untuk membantu proses penelitian dan pemuliaan tanaman (Mariska & Lestari 2006). Teknik androgenesis yang juga sangat berpotensi untuk mempercepat proses penelitian dan pemuliaan tanaman telah dan sedang dikembangkan pada tanaman kedelai melalui kultur antera pada media padat yang dilakukan di beberapa negara seperti di Cina (Hu et al. 1996), Brazil (Kaltcuk-Santos et al. 1997) dan Indonesia (Zulkarnain 2005). Kultur isolasi mikrospora pada media cair juga telah dilaporkan oleh Rodrigues et al. (2006). Namun, sampai saat ini belum dapat dikembangkan metode yang efisien.
Didasarkan pada metode androgenesis yang telah dikembangkan pada tanaman lain, khususnya pada tanaman model seperti pada Brassica napus (Ferrie 2003) dan Nicotiana tabacum (Touraev & Heberle-Bors 2003), serta tanaman cabai (Supena et al. 2006), penelitian ini bertujuan untuk mempelajari tahap awal induksi androgenesis kultur antera kedelai dalam sistem media dua lapis. Hubungan antara tahap perkembangan mikrospora dan ciri morfologis kuncup bunga, serta pengaruh cekaman suhu terhadap induksi pembelahan sporofitik merupakan bagian utama yang dipelajari pada penelitian ini.
METODE
Bahan Tanaman dan Sumber Antera
2
kuncup bunga tersedia dalam waktu yang relatif kontinu. Kuncup bunga dari tanaman ini digunakan untuk penentuan tahap perkembangan mikrospora dan bahan isolasi dalam kultur antera.
Penentuan Tahap Perkembangan Mikrospora
Kuncup bunga kedelai dikelompokkan menjadi empat tahap perkembangan didasarkan pada rasio panjang daun pelindung (braktea) terhadap panjang kuncup keseluruhan (Gambar lampiran 1). Kuncup bunga dibuka menggunakan pinset untuk mengisolasi antera dengan cara memisahkan-nya dari filamen dan mahkota bunga. Antera didiseksi dan dipotong dengan scalpel kemudian disuspensikan dalam media cair mannitol (55 g/l) dan disentrifuse pada kecepatan 8000 rpm (Jouan BR4i) selama 4 menit. Mikrospora diwarnai menggunakan pewarna DNA 4,6-diamidino-2-phenylindole (DAPI) dan tahapan perkembangan mikro-spora diamati di bawah mikroskop Fluoresens tipe Nikon Eclipse E-600 dengan filter UV. Tahapan perkembangan mikrospora ini dikorelasikan dengan tahapan perkembangan kuncup bunga. Mikrospora diisolasi juga dengan cara yang sama untuk menghitung densitas mikrospora pada kuncup bunga kedelai. Mikrospora dihitung menggunakan alat bantu hemasitometer dengan peng-hitungan di bawah mikroskop.
Isolasi, Kultur Antera dan Inkubasi
Komposisi media kultur. Media kultur adalah media dua lapis, media cair di atas media padat. Media padat yang digunakan adalah media SL2 (Phillips & Collins 1980) dengan penambahan sukrosa 25 g/l, arang aktif 10 g/l dan agar-agar Gelrite 2 g/l. Komposisi media cair sama dengan media padat tetapi tanpa arang aktif dan agar-agar Gelrite. Untuk tiap cawan petri diameter 6 cm yang digunakan membutuhkan media padat 3 ml dan selanjutnya akan ditambah 3 ml media cair di atasnya sesaat sebelum kultur.
Isolasi antera dan inkubasi. Kuncup bunga yang digunakan sebagai bahan eksplan adalah kuncup dengan antera yang sebagian besar mengandung mikrospora fase berinti tunggal akhir sampai berinti dua awal. Kuncup bunga dipanen pada pagi hari dan segera didesinfeksi selama 10 menit dalam 2% NaOCl dengan penambahan 0.05 % (v/v) Tween-20, kemudian dibilas tiga kali dalam akuades steril masing-masing selama 10, 5 dan 1 menit. Selanjutnya, antera dari setiap
kuncup bunga yang berjumlah 10 buah diisolasi pada kondisi steril dan dikulturkan dalam sebuah petri dish dengan media SL2 dua lapis sehingga mengapung pada permukaan cair. Perkembangan mikrospora dalam antera, khususnya jumlah dan jenis inti atau sel dari mikrospora, diamati secara sitologis dengan menggunakan pewarna DAPI mulai dari awal kultur, 1, 2, 3 dan 4 minggu setelah kultur.
Perlakuan Cekaman Suhu dan Pengamatan
Perlakuan cekaman suhu. Setiap kuncup bunga diisolasi secara acak tujuh buah antera dan dikulturkan kedalam tujuh cawan petri untuk tujuh taraf perlakuan cekaman. Kultur antera dari kuncup bunga ini diulang hingga tiap petri berjumlah 15 antera yang berasal dari 15 kuncup bunga. Setiap taraf perlakuan diulang tiga kali atau terdiri dari 21 petri. Kultur dari masing-masing varietas Sindoro dan Slamet diberi perlakuan suhu pada awal inkubasi, yaitu suhu rendah (4-9 ºC) dan suhu tinggi (31-33 ºC) dengan periode inkubasi 1, 3, dan 7 hari pada kondisi gelap, serta suhu 25-28 ºC sebagai kontrol sehingga kombinasi perlakuan cekaman suhu dan periode cekaman terdiri dari tujuh taraf perlakuan untuk masing-masing varietas. Setelah periode cekaman suhu, kultur selanjutnya diinkubasi pada suhu 25-28 °C dan selalu dalam keadaan gelap.
Pengamatan. Perkembangan mikrospora dari setiap taraf perlakuan cekaman suhu dan periode cekaman untuk masing-masing jenis varietas diamati secara periodik setiap minggunya, yaitu minggu ke 0, 1, 2, 3 dan 4. Satu buah antera diambil dari masing-masing cawan petri dalam kondisi steril setiap minggunya, kemudian didiseksi dan diwarnai dengan pewarna DAPI. Perkembangan mikrospora dan penghitungan jumlah inti atau sel setiap individu mikrospora diamati di bawah mikroskop fluoresens dengan menggunakan filter UV.
HASIL
Hubungan Ciri Morfologi Kuncup Bunga dan Tahap Perkembangan Mikrospora
2
kuncup bunga tersedia dalam waktu yang relatif kontinu. Kuncup bunga dari tanaman ini digunakan untuk penentuan tahap perkembangan mikrospora dan bahan isolasi dalam kultur antera.
Penentuan Tahap Perkembangan Mikrospora
Kuncup bunga kedelai dikelompokkan menjadi empat tahap perkembangan didasarkan pada rasio panjang daun pelindung (braktea) terhadap panjang kuncup keseluruhan (Gambar lampiran 1). Kuncup bunga dibuka menggunakan pinset untuk mengisolasi antera dengan cara memisahkan-nya dari filamen dan mahkota bunga. Antera didiseksi dan dipotong dengan scalpel kemudian disuspensikan dalam media cair mannitol (55 g/l) dan disentrifuse pada kecepatan 8000 rpm (Jouan BR4i) selama 4 menit. Mikrospora diwarnai menggunakan pewarna DNA 4,6-diamidino-2-phenylindole (DAPI) dan tahapan perkembangan mikro-spora diamati di bawah mikroskop Fluoresens tipe Nikon Eclipse E-600 dengan filter UV. Tahapan perkembangan mikrospora ini dikorelasikan dengan tahapan perkembangan kuncup bunga. Mikrospora diisolasi juga dengan cara yang sama untuk menghitung densitas mikrospora pada kuncup bunga kedelai. Mikrospora dihitung menggunakan alat bantu hemasitometer dengan peng-hitungan di bawah mikroskop.
Isolasi, Kultur Antera dan Inkubasi
Komposisi media kultur. Media kultur adalah media dua lapis, media cair di atas media padat. Media padat yang digunakan adalah media SL2 (Phillips & Collins 1980) dengan penambahan sukrosa 25 g/l, arang aktif 10 g/l dan agar-agar Gelrite 2 g/l. Komposisi media cair sama dengan media padat tetapi tanpa arang aktif dan agar-agar Gelrite. Untuk tiap cawan petri diameter 6 cm yang digunakan membutuhkan media padat 3 ml dan selanjutnya akan ditambah 3 ml media cair di atasnya sesaat sebelum kultur.
Isolasi antera dan inkubasi. Kuncup bunga yang digunakan sebagai bahan eksplan adalah kuncup dengan antera yang sebagian besar mengandung mikrospora fase berinti tunggal akhir sampai berinti dua awal. Kuncup bunga dipanen pada pagi hari dan segera didesinfeksi selama 10 menit dalam 2% NaOCl dengan penambahan 0.05 % (v/v) Tween-20, kemudian dibilas tiga kali dalam akuades steril masing-masing selama 10, 5 dan 1 menit. Selanjutnya, antera dari setiap
kuncup bunga yang berjumlah 10 buah diisolasi pada kondisi steril dan dikulturkan dalam sebuah petri dish dengan media SL2 dua lapis sehingga mengapung pada permukaan cair. Perkembangan mikrospora dalam antera, khususnya jumlah dan jenis inti atau sel dari mikrospora, diamati secara sitologis dengan menggunakan pewarna DAPI mulai dari awal kultur, 1, 2, 3 dan 4 minggu setelah kultur.
Perlakuan Cekaman Suhu dan Pengamatan
Perlakuan cekaman suhu. Setiap kuncup bunga diisolasi secara acak tujuh buah antera dan dikulturkan kedalam tujuh cawan petri untuk tujuh taraf perlakuan cekaman. Kultur antera dari kuncup bunga ini diulang hingga tiap petri berjumlah 15 antera yang berasal dari 15 kuncup bunga. Setiap taraf perlakuan diulang tiga kali atau terdiri dari 21 petri. Kultur dari masing-masing varietas Sindoro dan Slamet diberi perlakuan suhu pada awal inkubasi, yaitu suhu rendah (4-9 ºC) dan suhu tinggi (31-33 ºC) dengan periode inkubasi 1, 3, dan 7 hari pada kondisi gelap, serta suhu 25-28 ºC sebagai kontrol sehingga kombinasi perlakuan cekaman suhu dan periode cekaman terdiri dari tujuh taraf perlakuan untuk masing-masing varietas. Setelah periode cekaman suhu, kultur selanjutnya diinkubasi pada suhu 25-28 °C dan selalu dalam keadaan gelap.
Pengamatan. Perkembangan mikrospora dari setiap taraf perlakuan cekaman suhu dan periode cekaman untuk masing-masing jenis varietas diamati secara periodik setiap minggunya, yaitu minggu ke 0, 1, 2, 3 dan 4. Satu buah antera diambil dari masing-masing cawan petri dalam kondisi steril setiap minggunya, kemudian didiseksi dan diwarnai dengan pewarna DAPI. Perkembangan mikrospora dan penghitungan jumlah inti atau sel setiap individu mikrospora diamati di bawah mikroskop fluoresens dengan menggunakan filter UV.
HASIL
Hubungan Ciri Morfologi Kuncup Bunga dan Tahap Perkembangan Mikrospora
3
terjadi pada saat kuncup bunga mempunyai rasio braktea terhadap panjang kuncup 1:1. Setelah fase tetrad, masing-masing sel akan menjadi individu mikrospora fase berinti tunggal awal (Gambar 1B), yang selanjutnya berkembang menjadi mikrospora fase berinti tunggal akhir (Gambar 1C). Kedua fase mikrospora ini dijumpai pada kuncup bunga dengan rasio braktea terhadap panjang kuncup 2:3 baik pada varietas Sindoro maupun varietas Slamet. Inti sel mikrospora akan mengalami pembelahan mitosis menjadi dua inti yang akan berkembang menjadi inti vegetatif dan inti generatif (Gambar 1D dan 1E). Fase tersebut sebagian besar dijumpai pada kuncup bunga Sindoro (55.5 %) dan Slamet (87.5 %) pada rasio braktea terhadap
panjang kuncup 1:2. Mikrospora berinti dua akhirnya akan berkembang menjadi sel gamet jantan atau polen matang dengan satu inti vegetatif yang besar dan tampak sirkuler dan satu inti generatif yang terkondensasi dan terlihat memanjang (Gambar 1F). Fase polen ini mulai dijumpai pada kuncup bunga dengan rasio braktea terhadap panjang kuncup 1:2 dan menjadi dominan pada rasio 1:3. Pada kuncup bunga dengan rasio 1:3 terdapat juga polen yang sudah tidak berinti (Gambar 1G) masing-masing 36.4 % dan 42.5 % untuk varietas Sindoro dan Slamet. Rata-rata densitas mikrospora kedelai adalah 19 467 sel per kuncup bunga dengan kisaran 19 200 sel sampai 22 400 sel per kuncup.
Tabel 1 Hubungan morfologi kuncup bunga dengan tahapan perkembangan mikrospora pada kedelai
Gambar 1 Tahap perkembangan mikrospora atau polen kedelai: (A) fase tetrad; (B) fase berinti tunggal awal; (C) fase berinti tunggal akhir; (D) fase berinti dua awal; (E) fase berinti dua akhir; (F) polen matang; (G) polen yang tidak memiliki atau sudah kehilangan inti. Bar A-G= 10 µm.
Tahap perkembangan mikrospora (%)
Berinti tunggal Berinti dua Varietas
Rasio braktea: panjang kuncup
Panjang kuncup (mm)
Tetrad
awal akhir awal akhir Polen
Polen tidak berinti
1:1 2.0-2.5 mm 100 0 0 0 0 0 0
2:3 2.5-4.5 mm 0 34.2 34.2 21.8 9.8 0 0
1:2 4.5-5.5 mm 0 0 3.3 16.7 38.8 32.4 8.8 Sindoro
1:3 5.5-6.0 mm 0 0 0 0 0 63.6 36.4
1:1 2.5-3.0 mm 100 0 0 0 0 0 0
2:3 3.0-4.0 mm 0 34.7 53.6 8.8 2.9 0 0
1:2 4.0-5.0 mm 0 0 0 20.8 66.7 12.5 0
Slamet
1:3 5.0-6.0 mm 0 0 0 0 0 57.5 42.5
C
D
E
G
B
A
4
Respon Mikrospora Terhadap Perlakuan Cekaman Suhu
Sel mikrospora fase berinti tunggal akhir dan fase berinti dua awal (Gambar 2A) memperlihatkan respon yang berbeda-beda terhadap perlakuan cekaman suhu dengan periode inkubasi berbeda (Tabel 2). Pada kondisi kontrol (25-28 ºC) mikrospora berinti tunggal akan mengalami gametogenesis. Inti sel mikrospora membelah secara asimetri menghasilkan dua inti yang berbeda yaitu berkembang menjadi inti generatif dan inti vegetatif (Gambar 2B). Perkembangan selanjutnya tidak tampak menjadi polen dewasa tetapi inti dan sitoplasma keluar sehingga mikrospora menjadi tidak berinti (Gambar 2C). Proses ini terjadi mulai pada minggu pertama sampai minggu keempat setelah kultur dengan jumlah sel yang kehilangan inti tersebut terus bertambah di minggu kedua, ketiga dan keempat (Tabel 2).
Perlakuan cekaman suhu 4-9 °C dengan periode inkubasi satu dan tiga hari untuk
masing-masing varietas Slamet dan Sindoro telah mampu menginduksi inti sel mikrospora untuk membelah simetri menjadi dua inti yang sama (Gambar 2D) masing-masing 2.9 % dan 6.2 % untuk varietas Slamet dan Sindoro (Tabel 2). Sel dengan dua inti yang sama ditemukan juga di perlakuan cekaman suhu 31-33 °C dalam periode tujuh hari hanya pada varietas Slamet (1.0 %). Pada pengamatan minggu keempat, mikrospora varietas Slamet mampu menghasilkan mikrospora multiselular dengan lebih dari enam sel (Gambar 2F), yaitu masing-masing 2.3 % pada suhu rendah se-lama tiga hari dan 5.1 % pada suhu tinggi selama tujuh hari. Perlakuan cekaman suhu pada varietas Slamet mampu menghasilkan mikrospora multiselular sedangkan pada varietas Sindoro, meskipun pembelahan sporofitik (simetri) terjadi pada pengamatan minggu pertama, tetapi perkembangan sel mikrospora tidak sampai pada struktur multiselular.
B
D
C
F
A
E
Gambar 2 Perkembangan mikrospora pada kultur antera kedelai varietas Slamet: (A) mikrospora fase berinti tunggal akhir (kiri) dan fase berinti dua awal (kanan) pada awal kultur; (B) inti mikrospora yang membelah secara asimetri menjadi mikrospora pada fase berinti dua hingga polen matang; (C) inti dan sitoplasma mikrospora keluar dari dalam sel; (D) inti sel mikrospora yang membelah secara simetri; (E) mikrospora dengan satu inti generatif dan dua inti vegetatif; (F) mikrospora dengan lebih dari enam inti sel. B dan C umur satu minggu setelah kultur pada kondisi tanpa cekaman suhu atau 25-28 °C (kontrol); D dan E umur satu minggu serta F umur empat minggu pada kondisi cekaman suhu 4-9 °C. Bar=10 µm.
PEMBAHASAN
Karakter morfologi kuncup bunga kedelai, yaitu rasio braktea terhadap panjang kuncup bunga merupakan salah satu parameter yang dapat digunakan untuk menduga tahap perkembangan mikrospora dalam kuncup bunga varietas Slamet maupun Sindoro yang digunakan pada penelitian ini. Fase berinti tunggal akhir sampai fase berinti dua awal adalah ketika rasio braktea terhadap panjang kuncup 2:3. Hasil ini sesuai dengan yang telah dilaporkan oleh da Silva Lauxen et al. (2003). Dengan menggunakan penciri morfologi ini diharapkan antera yang akan dikulturkan adalah antera yang mengandung tahap perkembangan mikrospora yang diinginkan. Menurut Hu et al. (1996) antera yang memiliki mikrospora fase berinti tunggal akhir dan berinti dua awal merupakan tahap yang responsif untuk induksi androgenesis pada kedelai.
Tahapan perkembangan mikrospora berdasarkan panjang kuncup bunga kedelai berbeda pada masing-masing varietas. Fase tetrad dimiliki oleh kuncup bunga dengan panjang 2.0-2.5 mm pada varietas Sindoro dan 2.5-3.0 mm pada varietas Slamet. Kuncup bunga Sindoro dengan panjang 2.5-4.5 mm mengandung 34.2 % mikrospora fase berinti tunggal awal. Jumlah ini hampir sama dengan kuncup bunga Slamet ketika panjang kuncup 3.0-4.0 mm, yaitu 34.7 %. Namun, Slamet mengandung mikrospora fase berinti tunggal akhir yang lebih besar dibandingkan Sindoro, yaitu 53.6 %. Sehingga karakter morfologi panjang kuncup tidak dapat digunakan sebagai penanda perkembangan mikrospora karena tidak konsisten pada kedua varietas yang diamati, Sindoro dan Slamet.
Perlakuan cekaman suhu rendah (4-9 °C) dan suhu tinggi (31-33 °C) telah mampu menghasilkan struktur multiselular dari mikrospora varietas Slamet. Struktur multiselular tersebut menandakan bahwa telah terjadi pembelokkan perkembangan mikro-spora dari jalur gametofitik menjadi terinduksi untuk pembelahan sporofitik. Terjadinya pembelahan sporofitik ini merupakan tahap awal untuk terjadinya proses embriogenesis dari mikrospora atau induksi androgenesis. Struktur multiselular mikrospora ini dapat berasal dari mikrospora berinti tunggal akhir yang ditandai adanya pembelahan simetri menghasilkan dua inti yang sama (Gambar 2D), dan dapat juga berasal dari mikrospora berinti dua awal dengan menghasilkan dua inti
vegetatif yang disertai satu inti generatif (Gambar 2E). Fenomena ini sesuai dengan yang dilaporkan oleh Hu et al. (1996) dan de Moraes et al. (2004) yang menyatakan bahwa pembelahan simetri mikrospora berasal dari mikrospora fase berinti tunggal akhir dan pembelahan simetri inti vegetatif dari fase berinti dua awal akan menghasilkan struktur multiselular.
Individu mikrospora dapat melanjutkan perkembangan gametofitiknya pada kondisi tanpa cekaman suhu (25-28 °C) karena mikrospora berinti tunggal akhir dapat berkembang sampai pada tahap berinti dua akhir. Namun, mikrospora berinti dua akhir ini tidak berkembang lebih lanjut karena sel mikrospora mengalami plasmolisis sehingga tidak tampak menjadi polen matang dan berkecambah, akan tetapi inti dan seluruh sitoplasma keluar dari dinding mikrospora sehingga mikrospora menjadi tidak memiliki inti. Kehilangan inti atau kematian mikrospora ini bertambah setiap minggu pengamatan.
Penggunaan sumber karbon sukrosa diduga merupakan faktor penyebab sel mikrospora mengalami plasmolisis, karena sukrosa dapat meningkatkan tekanan osmotik larutan media. Sukrosa merupakan sumber karbon yang sangat cepat dihidrolisis dan lebih cepat dimanfaatkan, sehingga sukrosa pada kultur mikrospora kedelai dilaporkan tidak dapat digunakan untuk perkembangan mikrospora multiselular ke perkembangan selanjutnya menjadi embrio (Hu et al. 1996). Maltosa merupakan alternatif yang dapat dipilih sebagai sumber karbon tanpa meracuni sel karena dapat dimanfaatkan secara bertahap pada kultur isolasi mikrospora Barley (Kasha et al. 2003). Oleh karenanya kombinasi perlakuan cekaman suhu dengan sumber karbon maltosa dalam media kultur mungkin akan dapat memaksimalkan induksi androgenesis pada kultur antera kedelai.
SIMPULAN
7
Hasil penelitian ini mengindikasikan bahwa tahap awal androgenesis telah dapat diinduksi melalui kultur antera kedelai dalam sistem media dua lapis.
DAFTAR PUSTAKA
[BPS] Biro Pusat Statistik. 2007. Harvested Area, Yield Rate and Production of Soybean by Province. http://www.bps. go.id/sector/agri/pangan/table5.shtml [07 Agt 06].
Collin HA, Edwards S. 1998. Plant Cell Culture. United Kingdom: Bios Scientific Publisher.
da Silva Lauxen M, Kalthcuk-Santos E, Hu CY, Callegari-Jacques SM, Bonadese-Zanettini MH. 2003. Association between floral bud size and developmental stage in soybean microspores. Braz Arch Biol Technol. 46: 515-520.
de Moraes AP, Bonadese-Zanettini MH, Callegari-Jacques SM, Kalthcuk-Santos E. 2004. Effect of temperature shock on soybean microspore embryogenesis. Braz Arch Biol Technol. 47: 537-544. Ferrie A. 2003. Microspore culture of
Brassica species. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant, A Manual. Dordrecht: Kluwer Academic Publisher. hlm. 205-215.
Hu CY, Yin GC, Bonadese-Zanettini MH. 1996. Haploid of soybean. Di Dalam: Jain SM, Sopory SK, Veilleux RE, editor. In Vitro Production in Higher Plants. Dordrecht: Kluwer Academic Publisher. hlm 377-395.
Husni A, Hutami S, Kosmiatin M, Mariska I. 2003. Regenerasi massa sel embriogenik kedelai yang diseleksi dengan Polyethylen Glicol 6000 (PEG). Di dalam: Hasil Penelitian Rintisan Bioteknologi Tanaman. Prosiding Seminar; Bogor, 23-24 Sep 2003. Bogor: Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian. hlm 272-280.
Kalthcuk-Santos E, Mariath JE, Mundstock E, Hu CY, Bodanese-Zanettini MH. 1997. Cytological analysis of early microspore divisions and embryo formation in cultured soybean anther. Plant Cell Tiss Org Cult. 49: 107-115.
Kasha KJ, Simion E, Oro R, Shim YS. 2003. Barley isolated and microspore culture protocol. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant. Dordrecht: Kluwer Academic Publisher. hlm 43-47.
Mariska I, Lestari EG. 2006. Seleksi in vitro untuk toleransi terhadap faktor abiotik pada tanaman padi dan kedelai. Di dalam: Pemanfaatan Bioteknologi untuk Mengatasi Cekaman Abiotik pada Tanaman. Prosiding Seminar Nasional. Bogor: Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian. hlm 28-41.
Phillips GC, Collins GB. 1980. Somatic embryogenesis from cell suspension cultures of red clover. Crop Sci. 20: 323-326.
Pierik RLM.1987. In Vitro Culture of Higher Plants. Dordrecht : Kluwer Academic Publisher.
Reed SM. 2000. Haploid Cultures. Di dalam: Trigiano RN, Gray DJ, editor. Plant Tissue Culture Concepts and Laboratory Exercises. USA: Boca Raton. hlm 285-295.
Rodrigues LR, de Camargo Forte B, Bodanese-Zanettini MH. 2006. Isolation and culture of soybean (Glycine max L. Merrill) microspores and pollen grains. Braz Arch Biol Technol. 49: 537-545.
Supena EDJ, Suharsono S, Jacobsen E, Custers JBM. 2006. Succesfull development of a shed-microspore culture protocol for double haploid production in Indonesian hot pepper (Capsicum annuum L.). Plant Cell Rep. 25:1-10.
Thomas E, Davey MR. 1975. From Single Cells to Plants. London: Wykeham publications.
Touraev A, Heberle-Bors E. 2003. Anther and microspore culture in tobacco. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant. Dordrecht : Kluwer Academic Publisher. hlm 223-228.
PEMBAHASAN
Karakter morfologi kuncup bunga kedelai, yaitu rasio braktea terhadap panjang kuncup bunga merupakan salah satu parameter yang dapat digunakan untuk menduga tahap perkembangan mikrospora dalam kuncup bunga varietas Slamet maupun Sindoro yang digunakan pada penelitian ini. Fase berinti tunggal akhir sampai fase berinti dua awal adalah ketika rasio braktea terhadap panjang kuncup 2:3. Hasil ini sesuai dengan yang telah dilaporkan oleh da Silva Lauxen et al. (2003). Dengan menggunakan penciri morfologi ini diharapkan antera yang akan dikulturkan adalah antera yang mengandung tahap perkembangan mikrospora yang diinginkan. Menurut Hu et al. (1996) antera yang memiliki mikrospora fase berinti tunggal akhir dan berinti dua awal merupakan tahap yang responsif untuk induksi androgenesis pada kedelai.
Tahapan perkembangan mikrospora berdasarkan panjang kuncup bunga kedelai berbeda pada masing-masing varietas. Fase tetrad dimiliki oleh kuncup bunga dengan panjang 2.0-2.5 mm pada varietas Sindoro dan 2.5-3.0 mm pada varietas Slamet. Kuncup bunga Sindoro dengan panjang 2.5-4.5 mm mengandung 34.2 % mikrospora fase berinti tunggal awal. Jumlah ini hampir sama dengan kuncup bunga Slamet ketika panjang kuncup 3.0-4.0 mm, yaitu 34.7 %. Namun, Slamet mengandung mikrospora fase berinti tunggal akhir yang lebih besar dibandingkan Sindoro, yaitu 53.6 %. Sehingga karakter morfologi panjang kuncup tidak dapat digunakan sebagai penanda perkembangan mikrospora karena tidak konsisten pada kedua varietas yang diamati, Sindoro dan Slamet.
Perlakuan cekaman suhu rendah (4-9 °C) dan suhu tinggi (31-33 °C) telah mampu menghasilkan struktur multiselular dari mikrospora varietas Slamet. Struktur multiselular tersebut menandakan bahwa telah terjadi pembelokkan perkembangan mikro-spora dari jalur gametofitik menjadi terinduksi untuk pembelahan sporofitik. Terjadinya pembelahan sporofitik ini merupakan tahap awal untuk terjadinya proses embriogenesis dari mikrospora atau induksi androgenesis. Struktur multiselular mikrospora ini dapat berasal dari mikrospora berinti tunggal akhir yang ditandai adanya pembelahan simetri menghasilkan dua inti yang sama (Gambar 2D), dan dapat juga berasal dari mikrospora berinti dua awal dengan menghasilkan dua inti
vegetatif yang disertai satu inti generatif (Gambar 2E). Fenomena ini sesuai dengan yang dilaporkan oleh Hu et al. (1996) dan de Moraes et al. (2004) yang menyatakan bahwa pembelahan simetri mikrospora berasal dari mikrospora fase berinti tunggal akhir dan pembelahan simetri inti vegetatif dari fase berinti dua awal akan menghasilkan struktur multiselular.
Individu mikrospora dapat melanjutkan perkembangan gametofitiknya pada kondisi tanpa cekaman suhu (25-28 °C) karena mikrospora berinti tunggal akhir dapat berkembang sampai pada tahap berinti dua akhir. Namun, mikrospora berinti dua akhir ini tidak berkembang lebih lanjut karena sel mikrospora mengalami plasmolisis sehingga tidak tampak menjadi polen matang dan berkecambah, akan tetapi inti dan seluruh sitoplasma keluar dari dinding mikrospora sehingga mikrospora menjadi tidak memiliki inti. Kehilangan inti atau kematian mikrospora ini bertambah setiap minggu pengamatan.
Penggunaan sumber karbon sukrosa diduga merupakan faktor penyebab sel mikrospora mengalami plasmolisis, karena sukrosa dapat meningkatkan tekanan osmotik larutan media. Sukrosa merupakan sumber karbon yang sangat cepat dihidrolisis dan lebih cepat dimanfaatkan, sehingga sukrosa pada kultur mikrospora kedelai dilaporkan tidak dapat digunakan untuk perkembangan mikrospora multiselular ke perkembangan selanjutnya menjadi embrio (Hu et al. 1996). Maltosa merupakan alternatif yang dapat dipilih sebagai sumber karbon tanpa meracuni sel karena dapat dimanfaatkan secara bertahap pada kultur isolasi mikrospora Barley (Kasha et al. 2003). Oleh karenanya kombinasi perlakuan cekaman suhu dengan sumber karbon maltosa dalam media kultur mungkin akan dapat memaksimalkan induksi androgenesis pada kultur antera kedelai.
SIMPULAN
7
Hasil penelitian ini mengindikasikan bahwa tahap awal androgenesis telah dapat diinduksi melalui kultur antera kedelai dalam sistem media dua lapis.
DAFTAR PUSTAKA
[BPS] Biro Pusat Statistik. 2007. Harvested Area, Yield Rate and Production of Soybean by Province. http://www.bps. go.id/sector/agri/pangan/table5.shtml [07 Agt 06].
Collin HA, Edwards S. 1998. Plant Cell Culture. United Kingdom: Bios Scientific Publisher.
da Silva Lauxen M, Kalthcuk-Santos E, Hu CY, Callegari-Jacques SM, Bonadese-Zanettini MH. 2003. Association between floral bud size and developmental stage in soybean microspores. Braz Arch Biol Technol. 46: 515-520.
de Moraes AP, Bonadese-Zanettini MH, Callegari-Jacques SM, Kalthcuk-Santos E. 2004. Effect of temperature shock on soybean microspore embryogenesis. Braz Arch Biol Technol. 47: 537-544. Ferrie A. 2003. Microspore culture of
Brassica species. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant, A Manual. Dordrecht: Kluwer Academic Publisher. hlm. 205-215.
Hu CY, Yin GC, Bonadese-Zanettini MH. 1996. Haploid of soybean. Di Dalam: Jain SM, Sopory SK, Veilleux RE, editor. In Vitro Production in Higher Plants. Dordrecht: Kluwer Academic Publisher. hlm 377-395.
Husni A, Hutami S, Kosmiatin M, Mariska I. 2003. Regenerasi massa sel embriogenik kedelai yang diseleksi dengan Polyethylen Glicol 6000 (PEG). Di dalam: Hasil Penelitian Rintisan Bioteknologi Tanaman. Prosiding Seminar; Bogor, 23-24 Sep 2003. Bogor: Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian. hlm 272-280.
Kalthcuk-Santos E, Mariath JE, Mundstock E, Hu CY, Bodanese-Zanettini MH. 1997. Cytological analysis of early microspore divisions and embryo formation in cultured soybean anther. Plant Cell Tiss Org Cult. 49: 107-115.
Kasha KJ, Simion E, Oro R, Shim YS. 2003. Barley isolated and microspore culture protocol. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant. Dordrecht: Kluwer Academic Publisher. hlm 43-47.
Mariska I, Lestari EG. 2006. Seleksi in vitro untuk toleransi terhadap faktor abiotik pada tanaman padi dan kedelai. Di dalam: Pemanfaatan Bioteknologi untuk Mengatasi Cekaman Abiotik pada Tanaman. Prosiding Seminar Nasional. Bogor: Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian. hlm 28-41.
Phillips GC, Collins GB. 1980. Somatic embryogenesis from cell suspension cultures of red clover. Crop Sci. 20: 323-326.
Pierik RLM.1987. In Vitro Culture of Higher Plants. Dordrecht : Kluwer Academic Publisher.
Reed SM. 2000. Haploid Cultures. Di dalam: Trigiano RN, Gray DJ, editor. Plant Tissue Culture Concepts and Laboratory Exercises. USA: Boca Raton. hlm 285-295.
Rodrigues LR, de Camargo Forte B, Bodanese-Zanettini MH. 2006. Isolation and culture of soybean (Glycine max L. Merrill) microspores and pollen grains. Braz Arch Biol Technol. 49: 537-545.
Supena EDJ, Suharsono S, Jacobsen E, Custers JBM. 2006. Succesfull development of a shed-microspore culture protocol for double haploid production in Indonesian hot pepper (Capsicum annuum L.). Plant Cell Rep. 25:1-10.
Thomas E, Davey MR. 1975. From Single Cells to Plants. London: Wykeham publications.
Touraev A, Heberle-Bors E. 2003. Anther and microspore culture in tobacco. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant. Dordrecht : Kluwer Academic Publisher. hlm 223-228.
7
Hasil penelitian ini mengindikasikan bahwa tahap awal androgenesis telah dapat diinduksi melalui kultur antera kedelai dalam sistem media dua lapis.
DAFTAR PUSTAKA
[BPS] Biro Pusat Statistik. 2007. Harvested Area, Yield Rate and Production of Soybean by Province. http://www.bps. go.id/sector/agri/pangan/table5.shtml [07 Agt 06].
Collin HA, Edwards S. 1998. Plant Cell Culture. United Kingdom: Bios Scientific Publisher.
da Silva Lauxen M, Kalthcuk-Santos E, Hu CY, Callegari-Jacques SM, Bonadese-Zanettini MH. 2003. Association between floral bud size and developmental stage in soybean microspores. Braz Arch Biol Technol. 46: 515-520.
de Moraes AP, Bonadese-Zanettini MH, Callegari-Jacques SM, Kalthcuk-Santos E. 2004. Effect of temperature shock on soybean microspore embryogenesis. Braz Arch Biol Technol. 47: 537-544. Ferrie A. 2003. Microspore culture of
Brassica species. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant, A Manual. Dordrecht: Kluwer Academic Publisher. hlm. 205-215.
Hu CY, Yin GC, Bonadese-Zanettini MH. 1996. Haploid of soybean. Di Dalam: Jain SM, Sopory SK, Veilleux RE, editor. In Vitro Production in Higher Plants. Dordrecht: Kluwer Academic Publisher. hlm 377-395.
Husni A, Hutami S, Kosmiatin M, Mariska I. 2003. Regenerasi massa sel embriogenik kedelai yang diseleksi dengan Polyethylen Glicol 6000 (PEG). Di dalam: Hasil Penelitian Rintisan Bioteknologi Tanaman. Prosiding Seminar; Bogor, 23-24 Sep 2003. Bogor: Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian. hlm 272-280.
Kalthcuk-Santos E, Mariath JE, Mundstock E, Hu CY, Bodanese-Zanettini MH. 1997. Cytological analysis of early microspore divisions and embryo formation in cultured soybean anther. Plant Cell Tiss Org Cult. 49: 107-115.
Kasha KJ, Simion E, Oro R, Shim YS. 2003. Barley isolated and microspore culture protocol. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant. Dordrecht: Kluwer Academic Publisher. hlm 43-47.
Mariska I, Lestari EG. 2006. Seleksi in vitro untuk toleransi terhadap faktor abiotik pada tanaman padi dan kedelai. Di dalam: Pemanfaatan Bioteknologi untuk Mengatasi Cekaman Abiotik pada Tanaman. Prosiding Seminar Nasional. Bogor: Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian. hlm 28-41.
Phillips GC, Collins GB. 1980. Somatic embryogenesis from cell suspension cultures of red clover. Crop Sci. 20: 323-326.
Pierik RLM.1987. In Vitro Culture of Higher Plants. Dordrecht : Kluwer Academic Publisher.
Reed SM. 2000. Haploid Cultures. Di dalam: Trigiano RN, Gray DJ, editor. Plant Tissue Culture Concepts and Laboratory Exercises. USA: Boca Raton. hlm 285-295.
Rodrigues LR, de Camargo Forte B, Bodanese-Zanettini MH. 2006. Isolation and culture of soybean (Glycine max L. Merrill) microspores and pollen grains. Braz Arch Biol Technol. 49: 537-545.
Supena EDJ, Suharsono S, Jacobsen E, Custers JBM. 2006. Succesfull development of a shed-microspore culture protocol for double haploid production in Indonesian hot pepper (Capsicum annuum L.). Plant Cell Rep. 25:1-10.
Thomas E, Davey MR. 1975. From Single Cells to Plants. London: Wykeham publications.
Touraev A, Heberle-Bors E. 2003. Anther and microspore culture in tobacco. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant. Dordrecht : Kluwer Academic Publisher. hlm 223-228.
9
A
Gambar lampiran 1 Pengukuran rasio braktea terhadap panjang kuncup bunga kedelai: (A1-A2) kuncup bunga dengan rasio braktea terhadap panjang kuncup 2/3; (B1-B2) kuncup bunga dengan rasio braktea terhadap panjang kuncup 1/2. Bar = 0.5 mm. Tanda panah= braktea.
A1
B1
A2