PEMBUATAN DAN KARAKTERISASI SERTA PENGUJIAN
SIFAT ANTIMIKROBA DARI EDIBLE FILM
KITOSAN – TEPUNG BIJI AREN SEBAGAI KEMASAN FILLET
IKAN SALMON
TESIS
Oleh
ANDY CANDRA
087006001/KM
PROGRAM MAGISTER KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PEMBUATAN DAN KARAKTERISASI SERTA PENGUJIAN SIFAT ANTIMIKROBA DARI EDIBLE FILM KITOSAN – TEPUNG BIJI AREN
SEBAGAI KEMASAN FILLET IKAN SALMON
TESIS
Untuk memperoleh Gelar Magister Sains dalam Program Studi Ilmu Kimia
pada Program Pascasarjana Universitas Sumatera Utara
Oleh
ANDY CANDRA
087006001/KM
PROGRAM MAGISTER KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
Judul Tesis : PEMBUATAN DAN KARAKTERISASI SERTA PENGUJIAN SIFAT ANTIMIKROBA DARI EDIBLE FILM KITOSAN – TEPUNG BIJI AREN SEBAGAI KEMASAN FILLET IKAN SALMON.
Nama Mahasiswa : Andy Candra Nomor Pokok : 087006001 Program Studi : Ilmu Kimia
Menyetujui Komisi Pembimbing
Pembimbing I Pembimbing II
(Prof. Dr. Jamaran Kaban, M.Sc ) (Dr. Mimpin Ginting, MS)
Ketua Program Studi, Dekan,
(Prof. Basuki Wirjosentono, MS, Ph.D) (Prof. Dr. Eddy Marlianto, M.Sc)
Telah diuji pada
Tanggal 30 April 2010
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Jamaran Kaban, M.Sc.
Anggota : 1. Dr. Mimpin Ginting, MS.
2. Prof. Dr. Tonel Barus.
3. Prof. Basuki Wirjosentono, MS, Ph.D
PERNYATAAN
PEMBUATAN DAN KARAKTERISASI SERTA PENGUJIAN SIFAT ANTIMIKROBA DARI EDIBLE FILM KITOSAN – TEPUNG BIJI AREN
SEBAGAI KEMASAN FILLET IKAN SALMON
TESIS
Dengan ini saya menyatakan bahwa dalam tesis ini tidak terdapat karya yang
pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi
dan sepanjang pengetahuan saya tidak terdapat karya atau pendapat yang
pernah ditulis atau diterbitkan oleh orang lain kecuali secara tertulis diacu dalam
naskah dan disebutkan sumbernya dalam daftar pustaka.
Medan, 30 April 2010
Penulis,
ABSTRAK
Karakterisasi sifat antimikroba dan sifat fisik dari edible film hasil blending antara kitosan – tepung biji aren dengan perbandingan 1 : 2 (b/b) telah dipelajari. Pengujian difusi media agar menunjukkan efek antagonis pada efisiensi edible film kitosan – tepung biji aren melawan bakteri patogen pada makanan yaitu Staphylococcus aureus,
Shigella, Salmonella, Escherechia coli dan Pseudomonas aeruginosa . Sifat mekanik
dan fisik ditentukan dan hasilnya menunjukkan nilai kekuatan tarik( 0,308 MPa), kekuatan regang ( 15,94%) dan bersifat transparan, nilai aktivitas air (0,486), laju transmisi uap air (6,3844 g/m2/jam ). Analisis FT –IR dan analisis SEM digunakan untuk mengkarakterisasi perubahan struktural dari film hasil blending. Hasil analisis FT – IR menunjukkan ikatan hidrogen intermolekuler yang kuat terjadi antara kitosan dan tepung biji aren. Pengujian pelapisan potongan ikan salmon menunjukkan bahwa ikan salmon yang dilapisi dapat diterima ( Standar SNI ) melalui penyimpanan dalam kondisi dingin , yang dapat memperpanjang kualitasnya selama 5 hari tetapi tidak untuk tanpa pelapis sebagai kontrol. Edible film kitosan – tepung biji aren mengurangi aktivitas respirasi , dimana ikan salmon yang dilapisi mempunyai laju respirasi (73,072 ml/kg.jam untuk O2 and 58,293 ml/kg.jam untuk CO2 ) yang lebih baik dibandingkan ikan tanpa pelapis (74,711 ml/kg.jam untuk O2 and 73,982 ml/kg.jam untuk CO2 ). Uji Biodegradasi dengan jamur Aspergillus niger menunjukkan adanya pengurangan berat dikarenakan penguraian dari edible film kitosan – tepung biji aren.
ABSTRACT
Characterization of antimicrobial activity and physical properties of edible film based on blends of chitosan – aren seed flour 1 : 2 (w/w) ratio had been studied. The agar well diffusion assay showed an antagonist effect of efficiency of chitosan – aren seed flour edible film against food pathogenic bacteria namely Staphylococcus aureus,
Shigella, Salmonella, Escherichia coli and Pseudomonas aeruginosa. Mechanical and
physical properties were determined and the result indicated that the maximum tensile strength ( 0.308 MPa ), Elongation at break ( 15.94%) and a good transparency, water activity (0.486), water vapour transmission rate (6. 3844 g/m2/hr), FT – IR analysis and SEM analysis were used to characterize the structural change of blend film. The result of FT –IR analysis showed that the strong intermolecular hydrogen bonds took place between chitosan and aren seed flour. A salmon slice coating assay showed that salmon slice coated by edible film remained acceptable ( SNI Standard ) throughout refrigerated storage, extending global quality to 5 – days but unacceptable for the non coated salmon slice as a control. Chitosan – aren seed flour edible film reduced respiration activity that the salmon slice coated , had a good respiration rate ( 73.072 ml/kg.hr for O2 and 58.293 ml/kg.hr for CO2) compared to the non – coated salmon slice (74.711 ml/kg.hr for O2 and 73.982 ml/kg.hr for CO2 ). Biodegrability assay against Aspergillus niger showed weight loss because of the decomposition of chitosan – aren seed flour edible film.
KATA PENGANTAR
Puji syukur kepada Tuhan Yang Maha Kuasa atas segala berkat dan kasih karunia yang dilimpahkanNya sehingga bahan seminar hasil ini dapat diselesaikan.
Dengan selesainya tugas ini, perkenankanlah kami mengucapkan terima kasih yang sebesar-besarnya kepada : Rektor Universitas Sumatera Utara Prof. Dr. dr. Syahril Pasaribu, DTM&H, M.Sc (CTM), Sp.A(K) atas kesempatan dan fasilitas yang diberikan kepada saya untuk menyelesaikan pendidikan program magister.
Direktur Program Pascasarjana Universitas Sumatera Utara yang dijabat oleh Prof. Dr. Ir. T. Chairun Nisa B., M.Sc atas kesempatan menjadi mahasiswa Program Magister pada Program Universitas Sumatera Utara.
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Prof. Dr. Eddy Marlianto, M.Sc. atas kesempatan dan fasilitas yang diberikan kepada saya untuk menyelesaikan penelitian ini.
Terima kasih yang tak terhingga dan penghargaan yang setinggi-tingginya kami ucapkan kepada :
2. Bapak Prof. Dr. Tonel Barus, Bapak Prof. Basuki Wirjosentono, MS, Ph.D, Bapak Prof. Dr. Harry Agusnar, M.Sc., M.Phil selaku penguji yang banyak memberikan masukan dan saran untuk menyelesaikan tesis ini, untuk itu penulis ucapkan terima kasih.
3. Ibu Dr. Ir. Elisa Julianti, M.Si. selaku kepala Laboratorium Analisa Pangan Fakultas Pertaniaan USU yang telah banyak membantu dan memberikan kemudahan penulis melakukan penelitian hingga selesainya tesis ini. Kepada Ibu saya ucapkan terima kasih.
4. Ibu Dr. Ir. Herla Rusmarilin, M.S. selaku kepala Laboratorium Teknologi Pangan Fakultas Pertanian USU yang telah banyak membantu dan memberikan kemudahan penulis melakukan penelitian hingga selesainya tesis ini. Kepada Ibu saya ucapkan terima kasih.
5. Bapak/Ibu Dosen Pascasarjana Ilmu Kimia yang telah membimbing dan memotivasi saya sampai selesainya tesis ini. Kepada bapak dan Ibu saya ucapkan terima kasih.
6. Bapak Wikanda di Laboratorium Geologi Kuartener (PPGL) Bandung yang telah banyak membantu dalam analisa analisa yang dilakukan.
8. Adik – adik yang saya kasihi di Laboratorium Kimia Organik FMIPA USU khususnya Maria Silvia Harlim, Imel di Laboratorium Teknologi Pangan Fakultas Pertanian USU dan adik adik di Laboratorium Mikrobiologi FMIPA USU khususnya Ria, Nikma, Ika, Siti, Ami serta murid saya Kelvin Anggara di National University of Singapore yang telah banyak menolong dan mendukung saya dalam penelitian dan tesis ini.
9. Teman-teman angkatan 2008 program reguler dan guru-guru, Kak Leli di Sekolah Pascasarjana Ilmu Kimia yang telah banyak memberikan bantuan moril dan dorongan juga kepada penulis.
Serta seluruh keluarga dan teman-teman yang tak dapat saya sebutkan satu persatu yang sudah mendoakan saya, saya ucapkan terima kasih.
Penulis menyadari bahwa tesis ini masih kurang sempurna oleh karena itu, penulis sangat mengharapkan kritik dan saran yang membangun dari pihak pembaca demi kesempurnaan tesis ini. Akhirnya semoga tesis ini bermanfaat bagi penelitian dan kemajuan ilmu pengetahuan untuk masa yang akan datang.
Hormat Penulis
RIWAYAT HIDUP
Penulis lahir tanggal 12 Juni 1985 di Tebing Tinggi Sumatera Utara, anak dari Selamat Ilham dan Ng A Han sebagai anak pertama dari tiga bersaudara.
DAFTAR ISI
Halaman
ABSTRAK...i
ABSTRACT...ii
KATA PENGANTAR...iii
RIWAYAT HIDUP ...vi
DAFTAR ISI...vii
DAFTAR TABEL...xii
DAFTAR GAMBAR ...xiii
DAFTAR LAMPIRAN ...xv
BAB I. PENDAHULUAN...1
1.1. Latar Belakang...1
1.2.Perumusan Masalah... 5
1.3.Tujuan Penelitian...5
1.4.Manfaat Penelitian...5
1.5.Lokasi Penelitian...6
1.6.Metodologi Penelitian...6
BAB II. TINJAUAN PUSTAKA...8
2.1. Tanaman Aren ( Arenga pinnata )...8
2.1.1. Pembuatan Kolang – Kaling ...10
2.1.2. Kandungan Kimia Biji Buah Aren ( Arenga pinata )...11
2.2.2. Kelarutan dari Kitosan...13
2.2.3. Mekanisme Sifat Antimikroba dari Kitosan...14
2.3. Edible Film...18
2.3.1. Edible Film dan Fungsi ...18
2.3.2. Bahan Baku Edible Film ...19
2.3.2.1. Hidrokoloid...20
2.3.2.2. Lipida...21
2.3.2.3. Komposit...22
2.3.3. Sifat – Sifat Fisik Edible Film...22
2.3.3.1. Aktivitas Air (aw)...22
2.3.3.2. Laju Transmisi Uap Air ( WVTR ) ...25
2.3.3.3. Laju Respirasi gas O2 dan gas CO2...25
2.4. Ekologi Mikroba pada Bahan Pangan ...28
2.4.1. Kerusakan Mikrobiologis...29
2.4.2. Penyakit akibat Mikroba Pangan...30
2.5. Uji Biodegradabilitas Film Biodegradable...34
BAB III. Bahan dan Metode Penelitian...36
3.1. Bahan dan Alat...36
3.2. Metode Penelitian...37
3.2.1. Pembuatan dan AnalisaTepung Biji Aren ...37
3.2.1.1. Penentuan Kadar Karbohidrat ...37
3.2.2. Pembuatan Film Pelapis Kitosan – Tepung Biji Aren...39
3.2.3. Penentuan Derajat Deasetilasi Kitosan...40
3.2.4. Karakterisasi Edible Film...41
3.2.4.1. Uji Scanning Electron Microscope (SEM)...41
3.2.4.2. Uji Kekuatan Tarik dan Kemuluran...41
3.2.4.3. Uji Ketebalan...42
3.2.4.4. Uji Aktivitas Air...42
3.2.4.5. Uji Laju Transmisi Uap Air (WVTR) dengan Metode Dessicant ...43
3.2.4.6 Uji Laju Respirasi gas O2 dan CO2...44
3.2.5. Pengujian Sifat Anti Bakteri dan Biodegradasi...45
3.2.5.1. Aktivitas Antimikroba dengan Metode Difusi Agar...45
3.2.5.2. Estimasi Kepadatan Sel Isolat Bakteri dengan Cara Standard Plate Count (SPC)...46
3.2.5.3. Uji Biodegradasi Film Spesimen terhadap Jamur Aspergillus Niger...47
3.3. Bagan penelitian...48
3.3.1. Pembuatan Tepung Biji Aren...48
3.3.2. Penentuan Kadar Karbohidrat dari Tepung Biji Aren...49
3.3.3. Penentuan Kadar Protein dari Tepung Biji Aren...50
3.3.4. Pembuatan Film Pelapis Kitosan – Tepung Biji Aren...51
3.3.6. Estimasi Kepadatan Sel Isolat Bakteri dengan Cara
Standard Plate Count (SPC)...53
3.2.7. Uji Biodegradasi Film Spesimen terhadap Jamur Aspergillus Niger...54
BAB IV. HASIL DAN PEMBAHASAN...55
4.1. Hasil Penelitian...55
4.1.1. Kandungan Karbohidrat dan Protein dari Tepung Biji Aren...55
4.1.2. Karakteristik Film Pelapis...55
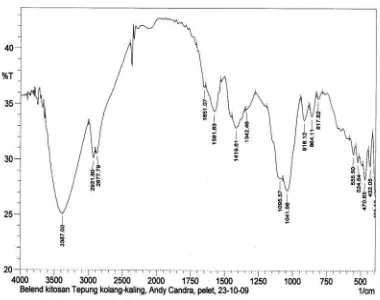
4.1.2.1. Analisis FT – IR...56
4.1.2.2. Analisis SEM ...56
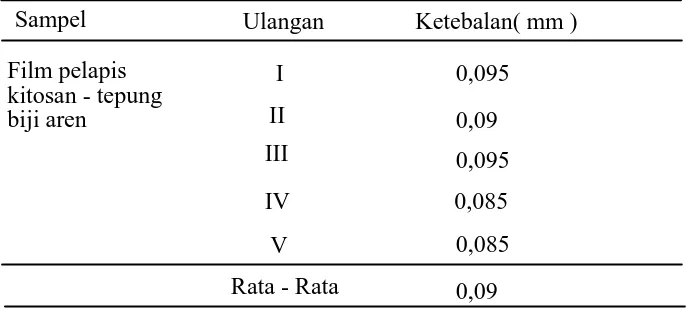
4.1.2.3. Pengukuran Ketebalan Film Pelapis...58
4.1.2.4. Uji Kekuatan Tarik dan Kekuatan Regang...58
4.1.2.5. Uji Aktivitas Air...59
4.1.2.6. Uji Laju Transmisi Uap Air ( WVTR ) ...59
4.1.2.7. Laju Respirasi Gas O2 dan Gas CO2...59
4.1.3. Pengujian Sifat Antimikroba, Biodegradasi dan Aplikasi Film Pelapis...60
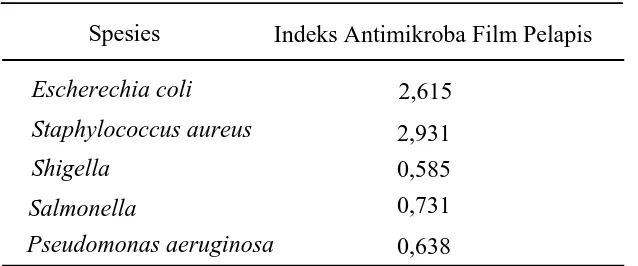
4.1.3.1. Hasil Pengujian Antimikroba Film Pelapis Kitosan – Tepung Biji Aren...60
4.1.3.2. Pengujian Aplikasi Film Pelapis sebagai Anti Mikroba....61
4.2. Pembahasan ...65
4.2.1. Kandungan Karbohidrat dan Protein dari Tepung Biji Aren...65
4.2.2. Karakteristik Film Pelapis...66
4.2.2.1. Analisis Spektrum FT – IR...66
4.2.2.2. Analisis SEM ...67
4.2.2.3. Pengukuran Ketebalan Film Pelapis...69
4.2.2.4. Uji Kekuatan Tarik dan Kekuatan Regang...70
4.2.2.5. Uji Aktivitas Air...70
4.2.2.6. Uji Transmisi Uap Air...71
4.2.2.7. Uji Laju Respirasi O2 dan CO2 ...72
4.2.3. Pengujian Sifat Antimikroba, Biodegradasi dan Aplikasi Film Pelapis...73
4.2.3.1. Hasil Pengujian Antimikroba Film Pelapis Kitosan – Tepung Biji Aren...73
4.2.3.2. Pengujian Aplikasi Film Pelapis sebagai Anti Mikroba...74
4.2.3.3. Pengujian Biodegradasi Film Pelapis dengan jamur Aspergillus niger...75
BAB V. KESIMPULAN DAN SARAN...77
5.1. Kesimpulan...77
5.2. Saran...78.
DAFTAR PUSTAKA...79
DAFTAR TABEL
Nomor Judul Halaman
Tabel 2.1. Kemungkinan Penggunaan Edible Film dan Coating...20
Tabel 4.1. Ketebalan Rata – Rata Film Pelapis ...58
Tabel 4.2. Harga Kekuatan Tarik dan Kemuluran...58
Tabel 4.3. Nilai Aktivitas Air ( aw) dari Film Pelapis...59
Tabel 4.4. Laju Rata- Rata Respirasi O2 dan CO2...60
Tabel 4.5. Indeks Antimikroba Film Pelapis...60
Tabel 4.6. Data Pertumbuhan Isolat Bakteri pada Ikan Salmon...62
Tabel 4.7. Data Kehilangan Berat dari Film yang dibiodegradasi...62
Tabel 4.8. Harga Kekuatan Tarik dan Kemuluran dari Film Alginat – Kitosan ...69
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar 2.1. Kulit Buah Aren Muda Berwarna Hijau, Buah Berisi 3 Biji,
Daging Buah Berwarna Putih Kekuning – kuningan...9
Gambar 2.2. Kulit biji Berwarna Kuning dan Tipis pada Buah Aren Muda, Endosperm Biji Lonjong dan Pipih ( disebut : kolang kaling )...9
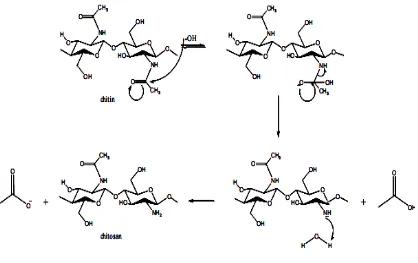
Gambar 2.3. N- Deasetilasi dari Kitin Membentuk Kitosan...12
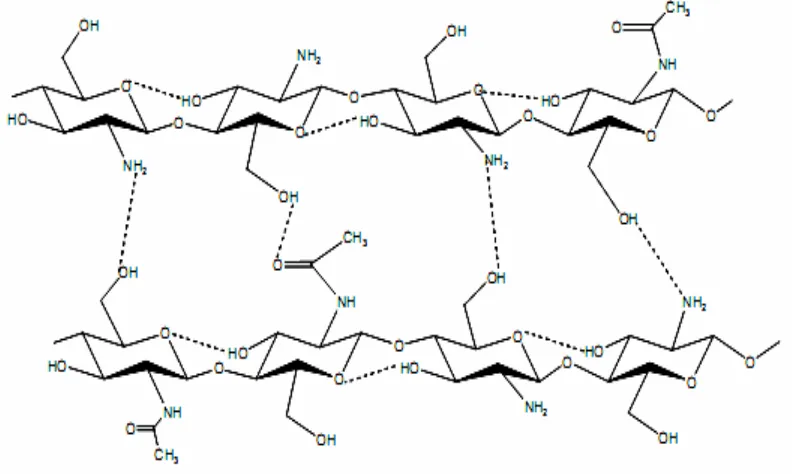
Gambar 2.4. Ikatan Hidrogen Intramolekuler dan Intermolekuler pada Kitosan...13
Gambar 2.5. Efek Penghambat dari Larutan Kitosan – Pati Melawan (a) E. coli ; (b) S.aureus; (c) B. subtilis...18
Gambar 2.6. Efek Penghambat dari Film Kitosan – Pati melawan (a) E. coli ; (b) S.aureus; (c) B. subtilis...18
Gambar 3.1. Spektrum FT – IR Kitosan untuk Menentukan Derajat Deasetilasi...40
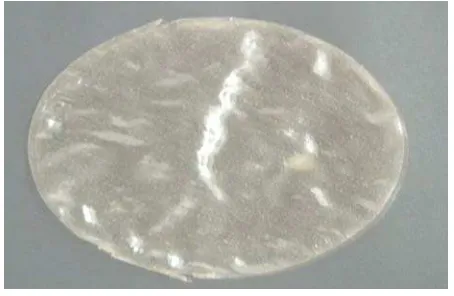
Gambar 4.1. Film Pelapis Kitosan – Tepung Biji Aren...55
Gambar 4.2. Spektrum FT – IR dari Film Pelapis Kitosan – Tepung Biji Aren...56
Gambar 4.3. Foto SEM dari Permukaan Film Kitosan – Tepung Biji Aren dengan Perbesaran 2000x...57
Gambar 4.4. Foto SEM dari Permukaan Film Kitosan – Tepung Biji Aren dengan Perbesaran 5000x...57
Gambar 4.6. Hasil Aktivitas Antimikroba dari Edible Film Kitosan –
Tepung Biji Aren terhadap Bakteri E. coli (EC), S.aureus (SA),
Shigella (SG), Salmonella (SN) dan P. aeruginosa (PD)...61
Gambar 4.7. Foto SEM dari Permukaan Film Kitosan – Tepung Biji Aren
dengan Perbesaran 2000 x ( Hasil Biodegradasi hari ke – 21 )...63 Gambar 4.8. Foto SEM dari Permukaan Film Kitosan – Tepung Biji Aren
dengan Perbesaran 5000 x ( Hasil Biodegradasi hari ke – 21 )...63 Gambar 4.9. Foto SEM Penampang Film Kitosan – Tepung Biji Aren
dengan Perbesaran 2000 x ( Hasil Biodegradasi hari ke – 21 )...64 Gambar 4.10. Spektrum FT – IR Biodegradasi Film Pelapis
Kitosan – Tepung Biji Aren...64 Gambar 4.11. Foto Edible Film : (A) yang Belum Dibiodegaradasi ;
(B) yang Telah Dibiodegradasi...65 Gambar 4.12. Foto SEM dari Film Pati – Konjac Glukomanan – Gliserol (%) ,
100-0-15; 90-10-15; 70-30-15; 50-50-15; 30-70-15;
LAMPIRAN
Nomor Judul Halaman
Lampiran 1. Tabel Gula Menurut Luff Schrool ...88
Lampiran 2. Tabel dan Perhitungan Kadar Karbohidrat dalam Tepung Biji Aren....89
Lampiran 3. Tabel dan Perhitungan Kadar Protein dalam Tepung Biji Aren...90
Lampiran 4. Grafik Hasil Uji Tarik Film Pelapis Kitosan – Tepung Biji Aren...91
Lampiran 5. (a). Perhitungan aw Film Pelapis Kitosan – Tepung Biji Aren...92
(b). Diagram Aktivitas Air Film Kitosan – Tepung Biji Aren ...93
Lampiran 6. Hasil Uji Laju Transmisi Uap Air ...94
Lampiran 7. (a). Data Laju Respirasi Daging Ikan Salmon yang Dilapisi dengan Edible Film dan tidak Dilapisi Edible film pada Suhu 100C...95
(b). Perhitungan Laju Respirasi Gas O2 dan CO2...96
(c). Grafik Laju Respirasi Gas O2 dan CO2 pada Ikan Salmon Tanpa Pelapis dan Ikan Salmon dengan Pelapis...98
Lampiran 8. Gambar Alat Cosmotektor O2 dan CO2 untuk Pengukuran Laju Respirasi ...99
Lampiran 10. (a). Gambar Estimasi Total Mikroba dari Ikan Salmon dengan Pelapis Kitosan - Tepung Biji Aren dan
Tanpa Pelapis sebagai Kontrol... 101
(b). Grafik Total Bakteri Ikan Salmon...103
Lampiran 11. (a). Gambar Hasil Biodegradasi Edible Film Kitosan Tepung Biji Aren dengan Jamur Aspergillus Niger ( media PDA ) ...104
(b) Grafik Pengurangan Berat Film Hasil Biodegradasi...105
Lampiran 12. Spektrum FT – IR dari Tepung Biji Aren ...106
Lampiran 13. Spektrum FT – IR dari Kitosan...107
ABSTRAK
Karakterisasi sifat antimikroba dan sifat fisik dari edible film hasil blending antara kitosan – tepung biji aren dengan perbandingan 1 : 2 (b/b) telah dipelajari. Pengujian difusi media agar menunjukkan efek antagonis pada efisiensi edible film kitosan – tepung biji aren melawan bakteri patogen pada makanan yaitu Staphylococcus aureus,
Shigella, Salmonella, Escherechia coli dan Pseudomonas aeruginosa . Sifat mekanik
dan fisik ditentukan dan hasilnya menunjukkan nilai kekuatan tarik( 0,308 MPa), kekuatan regang ( 15,94%) dan bersifat transparan, nilai aktivitas air (0,486), laju transmisi uap air (6,3844 g/m2/jam ). Analisis FT –IR dan analisis SEM digunakan untuk mengkarakterisasi perubahan struktural dari film hasil blending. Hasil analisis FT – IR menunjukkan ikatan hidrogen intermolekuler yang kuat terjadi antara kitosan dan tepung biji aren. Pengujian pelapisan potongan ikan salmon menunjukkan bahwa ikan salmon yang dilapisi dapat diterima ( Standar SNI ) melalui penyimpanan dalam kondisi dingin , yang dapat memperpanjang kualitasnya selama 5 hari tetapi tidak untuk tanpa pelapis sebagai kontrol. Edible film kitosan – tepung biji aren mengurangi aktivitas respirasi , dimana ikan salmon yang dilapisi mempunyai laju respirasi (73,072 ml/kg.jam untuk O2 and 58,293 ml/kg.jam untuk CO2 ) yang lebih baik dibandingkan ikan tanpa pelapis (74,711 ml/kg.jam untuk O2 and 73,982 ml/kg.jam untuk CO2 ). Uji Biodegradasi dengan jamur Aspergillus niger menunjukkan adanya pengurangan berat dikarenakan penguraian dari edible film kitosan – tepung biji aren.
ABSTRACT
Characterization of antimicrobial activity and physical properties of edible film based on blends of chitosan – aren seed flour 1 : 2 (w/w) ratio had been studied. The agar well diffusion assay showed an antagonist effect of efficiency of chitosan – aren seed flour edible film against food pathogenic bacteria namely Staphylococcus aureus,
Shigella, Salmonella, Escherichia coli and Pseudomonas aeruginosa. Mechanical and
physical properties were determined and the result indicated that the maximum tensile strength ( 0.308 MPa ), Elongation at break ( 15.94%) and a good transparency, water activity (0.486), water vapour transmission rate (6. 3844 g/m2/hr), FT – IR analysis and SEM analysis were used to characterize the structural change of blend film. The result of FT –IR analysis showed that the strong intermolecular hydrogen bonds took place between chitosan and aren seed flour. A salmon slice coating assay showed that salmon slice coated by edible film remained acceptable ( SNI Standard ) throughout refrigerated storage, extending global quality to 5 – days but unacceptable for the non coated salmon slice as a control. Chitosan – aren seed flour edible film reduced respiration activity that the salmon slice coated , had a good respiration rate ( 73.072 ml/kg.hr for O2 and 58.293 ml/kg.hr for CO2) compared to the non – coated salmon slice (74.711 ml/kg.hr for O2 and 73.982 ml/kg.hr for CO2 ). Biodegrability assay against Aspergillus niger showed weight loss because of the decomposition of chitosan – aren seed flour edible film.
BAB I
PENDAHULUAN
1.1.Latar Belakang
Aren (Arenga pinnata ) termasuk suku Arecaceae ( pinang pinangan ) , merupakan tumbuhan berbiji tertutup ( Angiospermae ) yaitu biji buahnya terbungkus daging buah. Tanaman aren banyak terdapat mulai dari pantai timur India sampai ke Asia Tenggara. Di Indonesia tanaman ini banyak terdapat hampir di seluruh wilayah Nusantara ( Sunanto, 1993).
Analisis terhadap endosperma biji aren telah menunjukkan bahwa kompisisi cadangan makanan yang dikandung endosperma tersebut berdasarkan berat keringnya adalah 5,2% protein, 0,4% lemak, 2,5% abu, 39% serat kasar dan 52,9% karbohidrat, dan dari analisis tersebut ternyata polisakarida di dalamnya adalah mannan, suatu polimer berbentuk rantai panjang dari mannosa yang bersifat hidrofobik (menolak air ) ( Nisa , 1996 ).
Film pelapis dan coating menawarkan beberapa keuntungan seperti edibilitas, biokompatibilitas, penampilan estetika, tak beracun, tidak menyebabkan polusi dan biaya yang murah ( Han , 2000 ). Biofilm dan pelapis , dapat bertindak sebagai aditif pada makanan ( seperti antioksidan, antimikroba) yang secara khusus telah dipertimbangkan dalam pengawetan makanan karena kemampuan mereka untuk memperpanjang masa penyimpanan ( Franssen and Krochta, 2003).
Film yang menggunakan bahan dasar pati secara khusus telah dipertimbangkan untuk alasan bahwa film tersebut menunjukkan karakter fisik yang mirip dengan polimer sintetik, transparan, tak berwarna, tak berasa, semi permeabel terhadap CO2 dan tahan terhadap aliran gas O2 ( Nisperos-Carriedo, 1994 ).Pati yang telah banyak digunakan dalam pembuatan edible film adalah pati tapioka (Vasconez et al., 2009 ) .Untuk memperbaiki sifat fisik dan fungsional dari film pati, blending dengan biopolimer lain, zat hidrofobik dan senyawa antimikroba lainnya telah diusulkan ( Flores et al., 2007).
bahan alami telah dilaporkan berdasarkan percobaan secara in vitro melalui aplikasi langsung pada makanan ( Ribeiro et al., 2007 ).
Naiknya permintaan terhadap kualitas makanan laut yang segar telah meningkatkan berbagai penelitian untuk memperoleh metode dan teknologi yang baru terhadap pengawetan ikan yang lebih baik. Salah satunya, yang dikembangkan adalah aplikasi film pelapis dan edible film , yang dikombinasikan dengan bahan bersifat antimikroba pada ikan segar ( Gomez-Estaca et al., 2007 ). Seperti ikan salmon yang merupakan ikan berkualitas tinggi dengan pertimbangan nilai gizi dan sisi ekonomi. Kebanyakan ikan salmon segar dijual kepada konsumen berupa ikan secara keseleruahan, tetapi jumlah yang signifikan dijual dalam bentuk potongan daging tak bertulang ( fillet ) atau dalam bentuk irisan ( Sallam ., 2007 ).
Beberapa peneliti terdahulu telah berhasil membuat edible film dari kitosan – tepung tapioka dengan pemlastis gliserol dan aditif kalium sorbat. Edible film ini memberikan aktivitas antimikroba yang positif terhadap Zygosaccharomyces bailii yang diisolasi dari daging ikan salmon tetapi memberikan aktivitas yang negatif terhadap Lactobacillus sp, dan penambahan kitosan pada pati tapioka mengurangi permeabilitas uap airnya. Vasconez juga menghitung populasi mikroba hasil dari
coating ikan salmon dengan menggunakan larutan kitosan – tepung tapioka ( 1 : 2 b/b ) selama 10 hari dengan kondisi penyimpanan 7 - 80C yang menunjukkan
Salleh et al., (2007 ) juga telah melakukan pengujian antimikroba terhadap bakteri Escherichia coli dan B. subtilis yang diperlakukan pada film kitosan – pati ubi – asam laurat yang mana film tersebut menunjukkan aktivitas antimikroba yang positif serta mempunyai fleksibilitas yang tinggi. Lie, dkk juga telah berhasil menguji sifat antimikroba dari edible film kitosan – konjac glukomanan – nisin terhadap empat bakteri patogen pada makanan yaitu E.coli, Staphylococcus aureus, Listeria
monocytogenes dan Bacillus cereus ( Lie et al., 2006 ) .
Pengukuran laju respirasi terhadap jamur merang juga telah dilakukan yang menunjukkan penggunaan film pelapis dapat menurunkan laju konsumsi O2 dan meningkatkan laju produksi CO2 ( Julianti, 1997 ).
Mempertimbangkan bahwa pengemasan edible antimikroba adalah teknologi yang baru dengan potensi dapat membantu pengawetan makanan, penelitian objektif sekarang ini mengacu pada penentuan sifat antimikroba dari edible film/ pelapisan yang didasarkan pada kitosan – tepung biji aren terhadap bakteri-bakteri patogen pada makanan diantaranya : Escherechia coli, Staphylococus aureus, Shigella , Salmonella dan Pseudomonas aeruginosa.
1.2.Perumusan Masalah
1. Berapakah kadar karbohidrat dan protein dari tepung biji aren.
2. Bagaimanakah aktivitas antimikroba dan sifat biodegrabilitas dari film pelapis kitosan – tepung biji aren.
3. Bagaimanakah sifat sifat fisik dari film pelapis yang berbahan dasar karbohidrat. 4. Berapakah estimasi kepadatan sel isolat bakteri dari ikan salmon yang dikemas dan
tidak dikemas dengan film pelapis.
1.3.Tujuan Penelitian
1. Untuk menentukan kadar karbohidrat dan protein dari tepung biji aren.
2. Untuk mengetahui aktivitas antimikroba dan sifat biodegrabilitas dari film pelapis kitosan – tepung biji aren.
3. Untuk mengetahui sifat sifat fisik dari film pelapis yang berbahan dasar karbohidrat. 4. Untuk mengetahui estimasi kepadatan sel isolat bakteri dari ikan salmon yang
dikemas dan tidak dikemas dengan film pelapis.
1.4. Manfaat Penelitian
1.5.Lokasi Penelitian
Penelitian ini dilaksanakan di Laboratorium Pascasarjana dan Laboratorium Penelitian USU, Laboratorium Kimia Organik FMIPA USU, Laboratorium Teknologi Pangan Fakultas Pertanian USU, Laboratorium Analisa Pangan Fakultas Pertanian USU, BARISTAN – Medan, Balai Besar Kimia dan Kemasan - Jakarta, Laboratorium Geologi Kuarter (PPGL) – Bandung, Laboratorium Mikrobiologi FMIPA USU Medan, Laboratorium Kimia Organik FMIPA – UGM.
1.6. Metodologi Penelitian
Penelitian ini bersifat eksperimen laboratorium, dimana objek dari penelitian ini adalah film pelapis kitosan – tepung biji aren dengan menggunakan pemlastis gliserol .
Biji Aren ( Kolang – Kaling ) diperoleh dengan cara perebusan dari Buah Aren setengah masak dan Tepung Biji Aren diperoleh dengan cara pengeringan biji aren di dalam oven vakum pada suhu 350C dengan tekanan 50 cmHg. Film pelapis diperoleh dengan mencampurkan larutan kitosan 1% (b/b) dalam asam asetat 1% dan larutan tepung biji aren 2% (b/b) dengan penambahan gliserol 0,64% (b/b) selanjutnya divakum untuk menghilangkan airnya dan dicetak pada plat kaca, dikeringkan dalam oven blower terkontrol pada 250C selama 48 jam kemudian di simpan di dalam desikator sebelum pengujian sifat sifat - sifat fisik , antimikroba dan biodegradasi.
dan CO2 terhadap ikan salmon yang dikemas maupun tidak dikemas , Analisis FT – IR, Ketebalan film, Uji aktivitas antimikroba terhadap bakteri Staphylococus aureus,
Shigella, Escherichia coli, Salmonella dan Pseudomonas aeruginosa , Uji
BAB II
TINJAUAN PUSTAKA
2.1. Tanaman Aren ( Arenga pinnata )
Aren (Arenga pinnata ) termasuk suku Arecaceae ( pinang pinangan ) , merupakan tumbuhan berbiji tertutup ( Angiospermae ) yaitu biji buahnya terbungkus daging buah. Lain halnya dengan buah melinjo misalnya, yang biji buahnya hanya
terbungkus oleh kulit buah sehingga disebut dengan tumbuhan berbiji terbuka ( Gymnospermae ). Tanaman aren banyak terdapat mulai dari pantai timur India
sampai ke Asia Tenggara. Di Indonesia tanaman ini banyak terdapat hampir di seluruh wilayah Nusantara ( Sunanto, 1993 ).
Buah aren terbentuk setelah terjadinya proses penyerbukan dengan perantaraan angin atau serangga. Buah aren berbentuk bulat berdiameter 4 – 5 cm, di dalamnya berisi biji 3 buah, masing masing terbentuk seperti satu siung bawang putih. Bagian – bagian dari buah aren terdiri dari :
1. Kulit luar, halus berwarna hijau pada waktu masih muda, dan menjadi kuning setelah tua ( masak ).
2. Daging buah, berwarna putih kekuning – kuningan.
4. Endosperm, berbentuk lonjong agak pipih berwarna putih agak bening dan lunak pada waktu buah masih muda; dan berwarna putih, padat atau agak keras pada waktu buah sudah masak.
Gambar 2.1. Kulit buah aren muda berwarna hijau, buah berisi 3 biji, daging buah berwarna putih kekuning – kuningan
Gambar 2.2. Kulit biji berwarna kuning dan tipis pada buah aren muda, endosperm biji lonjong dan pipih ( disebut : kolang kaling )
karena lendir ini mengandung asam oksalat. Buah yang setengah masak dapat dibuat kolang kaling. Kolang kaling adalah endosperm biji buah aren yang berumur setengah masak setelah melalui proses pengolahan . Setelah diolah menjadi kolang kaling, maka benda ini mejadi lunak, kenyal, dan berwarna putih agak bening ( Sunanto, 1993).
2.1.1. Pembuatan Kolang Kaling
Diawali dengan pemilihan buah aren yang masih berada pada pohon aren, yaitu satu tandan buah aren yang masih setengah masak ( tak terlalu muda dan belum tua ), yang ditandai dengan warna kulit buah yang masih hijau segar. Ada 2 cara untuk membuat kolang kaling, yaitu dengan membakar buah aren atau merebus buah aren. Tujuan utama pembakaran atau perebusan itu adalah untuk menghilangkan lendir buah yang menyebabkan rasa gatal. Dengan dibakar , maka daging buah menjadi agak hangus, namun bijinya tidak hangus.
2.1.2. Kandungan Kimia Biji Buah Aren ( Arenga pinata )
Analisis terhadap endosperma biji aren telah menunjukkan bahwa komposisi cadangan makanan yang dikandung endosperma tersebut berdasarkan berat keringnya adalah 5,2% protein, 0,4% lemak, 2,5% abu, 39% serat kasar dan 52.9% karbohidrat ( Nisa, 1996 ). Karbohidrat di dalam biji aren (Arenga pinata ) pada umumnya adalah galaktomannan yang mana molekul tersebut mempunyai rantai utama yang terdiri dari residu ( 1 Æ 4 ) -β- D- mannosa , dengan rantai samping yang berbeda yaitu residu α -D- galaktosa yang terikat dengan rantai utama dengan ikatan ( 1 Æ 6). Berat
molekul ditemukan beragam dari 6000 sampai dengan 17000 (Kooiman, 1971).
Galaktomannan dipisahkan dari ekstraks NaOH gelatin biji aren dengan pengendapan menggunakan etanol setelah diasamkan. Crude yang dihasilkan berupa polisakarida larut air dimurnikan lebih lanjut dengan kompleks tembaga memberikan galaktomannan ( ~ 5% dari endosperma basah ) dengan
[ ]
α D+ 500
( dalam air ) dan
[ ]
α D+ 350
( dalam 1M NaOH ) . Perbandingan mannosa terhadap galaktosa , yang mana tidak berubah selama pemurnian adalah 2,26 : 1 . Estimasi dari berat molekulnya memberikan nilai sebesar 17000 yang mana menandakan polisakarida yang ada dalam biji aren adalah 73 residu mannosa dan 32 residu galaktosa ( Kooiman, 1971).
2.2 Kitosan
33
Gambar 2.3. N- deasetilasi dari kitin membentuk kitosan
2.2.1. Kelarutan dari Kitosan
Kitosan adalah biomaterial yang diperoleh melalui N – deasetilasi kitin dalam suasana basa, yang mana baru baru ini mendapat perhatian yang khusus bagi ilmuan di seluruh dunia. Kitosan merupakan kopolimer yang terdiri dari unit β(1Æ4) -2-amino-2-deoksi-D-glukopiranosa dan residu unit 2-asetamido--2-amino-2-deoksi-D-glukopiranosa. Walaupun rantai polimer tersebut terdiri dari gugus fungsi hidrofilik tetapi bersifat hidrofobik di alam, kitosan tidak larut di dalam air dan pelarut pelarut organik pada umumnya ( seperti DMSO, DMF, NMP, alkohol, piridin ). Tidak larutnya kitosan dalam pelarut pelarut organik dikarenakan struktur kristalinnya, yang terikat berupa ikatan hidrogen intramolekuler dan intermolekuler diantara rantai dan lapisannya seperti terlihat pada Gambar 2.4 (Champagne, 2008).
2.2.2. Mekanisme Sifat Antimikroba dari Kitosan
Dikarenakan muatan positif dari C2 dari monomer glukosamin pada pH 6, kitosan lebih mudah larut dan memiliki aktivitas antimikroba yang lebih bagus dari kitin ( Chen, 1998 ) . Mekanisme yang tepat dari sifat antimikroba dari kitin, kitosan dan turunannya belum diketahui secara sempurna , tetapi mekanisme yang berbeda telah dikemukakan ( Rabea et al., 2003 ). Salah satu alasan dari karakter antimikroba kitosan adalah muatan positif dari gugus amino yang berinteraksi dengan muatan negatif dari membran sel dari mikroba, sehingga menyebabkan hilangnya protein dan konstituen intraseluler lain dari mikroorganisme ( Shahidi et al., 1999 ). Kitosan bertindak pada permukaan luar bakteri. Pada konsentrasi rendah ( 0,2 mg/ml) , kitosan polikationik dapat berikatan dengan permukaan bakteri yang bermuatan negatif yang menyebabkan aglutinasi , pada saat konsentrasi tinggi , muatan positif dalam jumlah yang cukup besar mungkin telah memberikan muatan positif pada permukaan bakteri untuk menjaga mereka berada dalam suspensi ( Papineau et al., 1991 ; Sudarshan et al., 1992 ).
Studi berdasarkan absorpsi UV menandakan bahwa kitosan menyebabkan
hilangnya material proteinik terhadap Pythium oaroechandrum pada pH 5,8 ( Liu et al., 2004 ). Kitosan juga bertindak sebagai bahan pengkelat yang secara
selektif mengikat logam dan menghambat pertumbuhan toksin dan mikroba ( Cuero et al., 1991 ). Kitosan juga mengaktivasi beberapa proses dalam jaringan
sintesis mRNA terjadi melalui penetrasi kitosan terhadap inti sel dari mikroorganisme dan turut serta dalam sintesis mRNA dan protein ( Sudarshan et al., 1992 ).
Mekanisme dari aktivitas antimikroba kitosan berbeda untuk bakteri Gram positif dan Gram negatif ( Zheng and Zhu, 2003 ). Zheng dan Zhu membedakan pengaruh kitosan pada S. Aureus ( Gram positif ) dan Escherichia coli ( Gram negatif). Aktivitas antimikroba meningkat dengan meningkatnya berat molekul dari kitosan. Berbeda dengan gram negatif, aktivitas antimikroba meningkat dengan turunnya berat molekul dari kitosan. Yang mana dari hal ini dapat disimpulkan dua perbedaan mekanisme dari aktivitas antimikroba : (1) dalam hal S.aureus, kitosan pada permukaan sel dapat membentuk membran polimer , yang mana menghambat nutrient dari masuknya ke sel, (2) Untuk E. coli, kitosan dengan berat molekul rendah memasuki sel melalui cara yang tak wajar.
Pengaruh dari berat molekul dari beberapa aktivitas antibakteri dan antijamur telah diselidiki ( Chen, 1998 ). Kitosan dengan berat molekul dari 10.000 sampai dengan 100.000 telah ditemukan berguna dalam menghambat pertumbuhan bakteri, kitosan dengan berat molekul rata rata 9300 secara efektif menghambat bakteri
E. coli, dimana dengan berat molekul 2200 dapat mempercepat pertumbuhan bakteri
Aktivitas antimikroba dari kitosan diamati terhadap berbagai jenis mikroorganisme termasuk jamur dan beberapa bakteri. Aktivitas antimikroba dipengaruhi oleh faktor intrinsik seperti jenis kitosan, derajad polimerisasi kitosan, konstituen nutrien , komposisi kimia atau nutrien dari substrat dan kondisi lingkungan ( contoh aktivitas air dari substrat atau kelembabannya ). Pengembangan dari metode baru untuk menghambat pertumbuhan bakteri patogen seperti bahan pengemas yang
ditambah bahan antimikroba telah dikembangkan baru baru ini ( Coma et al., 2002). Diantara polimer lain, kitosan telah diterima sebagai bahan
pembentuk film yang bersifat antimikroba untuk pengawetan makanan dikarenakan biodegrabilitasnya, biokompabilitasnya, toksisitasnya dan aktivitas antimikrobanya. Film kitosan mudah dibuat dengan penguapan dari larutan asam encernya ( Park et al., 2002 ).
Kitosan telah dipelajari dalam bentuk aktivitas bakterisidal untuk mengontrol pertumbuhan berbagai macam bakteri. Dalam bakteri gram positif, konstituen utama dari dinding selnya adalah peptidoglikan dan sejumlah protein. Dinding sel dari gram negatif dilain pihak lebih halus tetapi kompleks dan mengandung berbagai macam polisakarida, protein dan lemak disamping peptidoglikan. Juga, dinding sel bakteri gram negatif mempunyai membran bagian luar yang terdiri dari permukaan luar dari dinding sel ( Black, 1996 ).
coli, Staphylococcus aureus, Listeria monocytogenes, dan Bacillus cereus. Uji
aktivitas antimikroba telah dilakukan menggunakan metode difusi agar.
Aktivitas antimikroba dari film kitosan telah dipertinggi dengan inkorporasi minyak bawang putih, kalium sorbat dan nisin ( Pranoto et al., 2005 ). Aktivitas antimikroba telah diuji melawan bakteri patogenik pada makanan diantaranya E. coli,
Staphylcocus aureus, Salmonella typhimurium, L. Monocytogenes dan B. cereus . Uji
antimikroba telah dilakukan dengan metode difusi agar . Metode difusi agar adalah metode yang secara umum digunakan untuk memeriksa aktivitas antimikroba berkenaan dengan difusi dari senyawa yang diuji melalui air yang terkandung pada agar. Inkorporasi bahan antimikroba pada edible film kitosan memperbaiki kemanjuran antimikroba dari kitosan, dikarenakan aktivitas antimikroba yang terdifusi akan ditambahkan pada potensi antimikroba yang tak berpindah dari kitosan. Telah disimpulkan minyak bawang putih yang ditambahkan ke film kitosan menyebabkan meningkatnya sifat antimikroba dan memiliki pengaruh yang kecil terhadap sifat fisik dan mekanik dari film kitosan.
Gambar 2.5. Efek penghambat dari larutan kitosan – pati melawan (a) E. coli ; (b) S.aureus; (c) B. subtilis ( Tripathi et al., 2008 )
Gambar 2.6. Efek penghambat dari film kitosan – pati melawan (a) E. coli ; (b) S.aureus; (c) B. subtilis ( Tripathi et al., 2008 )
2.3. Edible film
2.3.1. Edible Film dan Fungsi
dapat dimakan yang di tempatkan di atas atau di antara komponen makanan ( Hui , 2006 ) .
Edible film dapat bergabung dengan bahan tambahan makanan dan substansi lain untuk mempertinggi kualitas warna, aroma dan tekstur produk, untuk mengontrol pertumbuhan mikroba. Asam benzoat, natrium benzoat , asam sorbat, kalium sorbat dan asam propanoat merupakan beberapa antimikroba yang ditambahkan pada edible film untuk menghambat pertumbuhan mikroba. Asam sitrat , asam askorbat, dan ester lainnya , Butylated Hydroxyanisole (BHA), Buthylated Hydroxytoluen (BHT), Teritary Butylated Hydroxyquinone (TBHQ) merupakan beberapa antioksidan yang ditambahkan pada edible film untuk meningkatkan kestabilan dan mempertahankan komposisi gizi dan warna makanan dengan mencegah oksidasi ketengikan, degradasi, dan pemudaran warna ( Krochta et al ., 1994 ).
2.3.2. Bahan Baku Edible Film
Komponen penyusun edible film dapat dibagi menjadi tiga macam yaitu : hidrokoloid, lipida dan komposit. Hidrokoloid yang cocok antara lain senyawa protein, turunan selulosa, alginat, pektin, pati dan polisakarida lainnya. Lipida yang biasa digunakan waxes, asilgliserol, dan asam lemak. Sedangkan komposit merupakan gabungan lipida dengan hidrokoloid ( Krochta et. al., 1994 )
Edible film dan coating dapat diklasifikasikan berdasarkan kemungkinan penggunaannya dan jenis film yang sesuai , yang dapat dilihat pada Tabel 2.1.
Tabel 2.1. Kemungkinan Penggunaan Edible Film dan Coating
Menghambat penyerapan zat zat larut Meningkatkan kekuatan struktur atau memberi kemudahan penanganan Menahan zat - zat volatil
Pembawa bahan tambahan makanan
Polisakarida sebagai bahan dasar edible film dapat dimanfaatkan untuk mengatur udara sekitarnya dan memberikan ketebalan atau kekentalan pada larutan edible film. Pemanfaatan dari senyawa berantai panjang ini sangat penting karena
tersedia dalam jumlah yang banyak, harganya murah , dan bersifat nontoksik ( Nisperos-Carriedo, 1994 dalam Krochta et al., 1994 ).
Beberapa jenis protein yang berasal dari protein tanaman dan hewan dapat membentuk film seperti zein jagung, gluten gandum, protein kedelai, protein kacang, keratin, kolagen, gelatin, kasein, dan protein dari whey susu, karena sifat dari protein tersebut yang mudah membentuk film. Albumin telur dapat digunakan sebagai bahan pembentuk film yang baik yang dikombinasikan dengan gluten gandum, dan protein kedelai ( Krochta et al., 1994 ) .
2.3.2.2. Lipida
Alasan mengapa lipida ditambahkan dalam edible film adalah untuk memberi sifat hidrofobik (Krochta et al., 1994 ).
2.3.2.3. Komposit
Komposit film terdiri dari komponen lipida dan hidrokoloid. Aplikasi dari komposit film dapat dalam lapisan satu-satu ( bilayer ), di mana satu lapisan merupakan hidrokoloid dan satu lapisan lain merupakan lipida, atau dapat berupa gabungan lipida dan hidrokoloid dalam satu kesatuan film. Gabungan dari hidrokoloid dan lemak digunakan dengan mengambil keuntungan dari komponen lipida dan hidrokoloid. Lipida dapat meningkatkan ketahanan terhadap penguapan air dan hidrokoloid dapat memberikan daya tahan terhadap gas . Film gabungan antara lipida dan hidrokoloid ini dapat digunakan untuk melapisi buah buahan dan sayuran yang telah diolah ( Krochta et al., 1994 ).
2.3.3. Sifat – Sifat Fisik Edible Film.
2.3.3.1. Aktivitas Air (aw)
tepat untuk mengukur aktivitas mikroba pada bahan pangan ( Nurwantoro dan Abbas , 1997; Purnomo, 1995 ).
Dengan demikian, pengetahuan tentang aw suatu bahan pangan mempunyai nilai praktis untuk meramalkan populasi mikroba yang berperan dalam kerusakan bahan pangan sehingga tipe dan bentuk kerusakan yang terjadi dapat diketahui. Selain itu, aw suatu bahan pangan juga dapat digunakan sebagai indikator dalam usaha pengawetan bahan pangan, antara lain dehidrasi ( pengeringan ) , penggaraman dan penggulaan ( Nurwantoro dan Abbas , 1997 ).
Berdasarkan hukum Raoult, aw berbanding lurus dengan jumlah mol pelarut (solvent) dan berbanding terbalik dengan jumlah mol larutan (solute), dan dirumuskan sebagai berikut :
Aktivitas air berkaitan dengan Equilibrium Relative Humidity ( ERH), yaitu perbandingan antara tekanan uap larutan dengan air murni dan dinyatakan dalam persentase. Kaitan antara ERH dengan aw dirumuskan sebagai berikut :
ERH = aw x 100%
maka akan terjadi penurunan aw. Nilai maksimum aw = 1. Nilai ini diperoleh pada air murni. Semakin pekat larutan atau semakin berkurang kadar air bahan pangan, nilai aw semakin rendah.
Sebagian besar mikroba ( terutama bakteri ) tumbuh baik pada bahan pangan yang mempunyai aw 0,9 – 0,97; khamir membutuhkan aw 0,87 – 0,91 dan kapang membutuhkan aw 0,8 – 0,91. Bakteri halofilik adalah bakteri yang toleran terhadap kadar garam tinggi, dapat tumbuh pada bahan pangan yang mempunyai nilai aw 0,75. Khamir osmofilik merupakan khamir yang toleran terhadap tekanan osmotik tinggi ( misalnya gula ), dapat tumbuh pada bahan pangan yang mempunyai nilai aw 0,60. Kapang xerofilik merupakan kapang yang mampu tumbuh pada bahan pangan yang kering ( nilai aw 0,65 ) ( Nurwantoro dan Abbas , 1997 ).
Pengukuran aktivitas air terhadap suatu bahan pangan sampai saat ini masih berdasarkan pengukuran kelembaban relatif berimbang dari bahan tersebut terhadap lingkungannya. Oleh karena itu ekstrapolasi menjadi cara pengukuran yang lebih penting dari pada tekniknya.
2.3.3.2. Laju Transmisi Uap Air ( WVTR )
Laju Transmisi Uap air adalah massa dari uap air yang terbawa melalui suatu luas tertentu dalam satuan waktu yang dikondisikan dalam temperatur dan kelembaban yang spesifik. Myllareinen et al., 2002 melaporkan bahwa laju respirasi dari film polisakarida bergantung pada ketebalan dari film tersebut. Laju respirasi uap air sangat berpengaruh besar terhadap masa simpan dari makanan.
Meningkatnya jumlah kitosan dalam pembuatan film glukomanan – kitosan – nisin dapat menurunkan laju respirasi uap air ( WVTR ) , sebaliknya dengan meningkatnya glukomanan meningkatkan WVTR , hal ini mungkin diakibatkan meningkatnya interaksi intermolekuler dan menurunnya pergerakan dari glukomanan dan kitosan ( Li et al., 2006 ).
Laju respirasi uap air bergantung pada jumlah gliserol yang digunakan. Arvanitoyannis dan Biliaderis (1999) menyatakan bahwa dikarenakan sifat hidrofilik dari gliserol dapat mengurangi sifat penahan uap air dalam film pelapis kitosan. Peranan gliserol yang lain adalah mengurangi densitas pengemasan , sehingga meningkatkan permeabilitas film pati terhadap uap air, sehingga meningkatkan kemampuan difusi uap air.
2.3.3.3. Laju Respirasi Gas O2 dan Gas CO2
menyebabkan terjadinya perubahan mutu dan kondisi bahan pangan tersebut. Proses tersebut akan terus berlangsung dan selalu mengakibatkan perubahan yang akhirnya menyebabkan kerusakan ( Winarno dan Aman , 1981 ).
Metabolisme ditujukan untuk memenuhi keperluan-keperluan yang dibutuhkan oleh bahan tersebut agar dapat melangsungkan kehidupannya. Keperluan tersebut terutama dalam bentuk energi. Dalam sistem biologi, energi dapat diperoleh dengan
beberapa cara, yaitu dapat dengan cara fotosintesa, respirasi atau fermentasi ( Winarno dan Aman , 1981 ).
Respirasi merupakan pemecahan bahan-bahan kompleks dalam sel seperti pati, gula dan asam asam organik menjadi molekul sederhana seperti karbon dioksida dan air, bersamaan dengan terbentuknya energi dan molekul lain yang dapat digunakan sel untuk reaksi sintesa ( Willis et al., 1981 ).
Perubahan laju respirasi dapat diketahui dengan mengukur perubahan kandungan gula, jumlah ATP dan jumlah CO2 yang dihasilkan ( Winarno dan Aman, 1981 ). Biasanya respirasi ditentukan dengan pengukuran laju konsumsi O2 atau dengan penentuan laju produksi CO2 (Pantastico, 1993 ).
Laju produksi produk segar merupakan indikator yang baik terhadap aktivitas metabolisme jaringan dan merupakan pedoman potensi masa simpan produk segar ( Wilis et al., 1981 ).
respirasi meningkat 2 kali lipat, tetapi pada suhu diatas 350C laju respirasi menurun karenan aktivitas enzim terganggu yang mengakibatkan difusi oksigen terhambat.
MAP ( Modified Atmosphere Packaging ) dari makanan segar mengandalkan modifikasi atmosfer di dalam pengemas, yang diperoleh dengan sifat saling mempengaruhi antara dua proses, yaitu respirasi dari produk dan transfer dari gas melalui pengemas, yang menimbulkan suatu keadaan atmosfer yang lebih kaya akan CO2 dan lebih sedikit akan O2. Atmosfer ini secara potensial mengurangi laju respirasi produk dan sensitivitas etilena , pembusukan, perubahan fisiologis dan oksidasi ( Kader et al., 1989; Saltveit, 1993 ). MAP dapat didefenisikan sebagai kondisi dimana menciptakan suatu atmosfer yang paling cocok untuk memperpanjang penyimpanan dari makanan dengan mengurangi waktu yang diperlukan untuk mencapai atmosfer ini. Ini dapat dilakukan dengan cara mencocokkan laju
permeabilitas O2 dan CO2 dengan laju respirasi dari produk yang dikemas ( Jacxsens et al., 2000 ).
penyimpanan , distribusi dan pemasaran bahan mentah dan produk-produk yang telah diolah dengan permintaan para konsumen. Sistem MAP dan VP dapat memberikan perbaikan yang baik dalam memperpanjang masa simpan dari makanan laut (Church, 1998 ).
Masa simpan dari produk-produk ikan dalam MAP dapat diperpanjang, bergantung dari bahan mentahnya, suhu, campuran gas dan bahan pengemas ( Farber, 1991 ). Ikan yang mengandung konsentrasi histamin yang cukup tinggi dapat menyebabkan keracunan dan reaksi alergi bagi konsumen. Histamin dihasilkan dari dekarboksilasi mikrobial dari asam amino histidin. Pentingnya mengestimasi konsentrasi histamin dalam ikan dan produk-produk ikan dihubungkan dengan pengaruh pada kesehatan manusia dan kualitas dari makanan. Pembentukan histamin dalam MAP lebih rendah dibandingkan dengan dalam udara ( Ozogul et al., 2002 ; Watts and Brown , 1982 ).
2.4. Ekologi Mikroba pada Bahan Pangan
dan cara penyimpanannya. Dalam batas batas tertentu kandungan mikroba pada bahan pangan tidak banyak bergantung pada ketahanan bahan pangan tersebut. Akan tetapi, apabila kondisi lingkungan memungkinkan mikroba untuk tumbuh dan berkembang lebih cepat, maka bahan pangan akan rusak karenanya. Contoh, susu yang mengandung bakteri asam laktat akan dirusak oleh bakteri tersebut. Daging dirusak oleh bakteri gram negatif dan lain lain ( Nurwantoro dan Abbas , 1997 ) .
2.4.1. Kerusakan Mikrobiologis
Kerusakan mikrobiologis bahan pangan hewani merupakan bentuk kerusakan yang paling merugikan. Terkadang kerusakan mikrobiologis ini dapat membahayakan kesehatan konsumen, karena racun yang dihasilkan oleh mikroba dapat terkonsumsi pula.
Pencemaran oleh Clostridium aerofoeticum; C. histolyticum dan C. welchii akan menghasilkan bau busuk. Bakteri – bakteri fakultatif anaerob seperti
Pseudomonas putrefaciens, Flavobacterium elastolyticum atau Proteus vulgaris juga dapat menyebabkan dekomposisi protein yang akan menghasilkan campuran berbagai metabolit berbau busuk , seperti indol, kadaverin dan skatol. Metabolit yang berbau busuk ini berasal dari pemecahan bahan bahan organik yang mengandung senyawa senyawa nitrogen yang mempunyai bobot molekul rendah seperti peptida dan asam amino. Hidrolisis protein oleh mikroba proteolitik menyebabkan perubahan tekstur pada produk. Hal ini disebabkan koagulasi dan likuifikasi protein struktural seperti kolagen dan elastin.
Pada umumnya pangan hewani mengandung protein yang cukup, dalam bentuk berbagai asam amino. Selain itu juga mengandung karbohidrat, asam laktat dan vitamin. Komponen – komponen tersebut dengan cepat digunakan oleh mikroba dalam metabolismenya. Salah satu hasil dari proses metabolisme tersebut adalah pembentukan bau busuk ( pembusukan ) ( Nurwantoro dan Abbas , 1997 ).
2.4.2. Penyakit Akibat Mikroba Pangan
mungkin terdapat secara alamiah dalam tanaman atau hewan atau dihasilkan oleh mikroba.
1. Escherichia coli
Bakteri Escherichia coli berbentuk batang dengan panjang 1 – 3 μm dan lebar 0,4 – 0,7 μm. Bersifat Gram Negatif, tidak berkapsul dan dapat ber erak aktif.
Escherichia coli umumnya diketahui terdapat secara normal dalam alat pencernaaan manusia dan hewan. Pangan yang sering terkontaminasi bakteri ini adalah susu, air minum, daging, keju , dan lain lain. Pencegahannya antara lain pangan perlu didinginkan dengan baik, menjaga higine, mencegah air dari kontaminasi oleh tinja/kotoran atau air perlu diberi perlakuan klorinasi.
2. Shigella
Bakteri shiglla berbentuk batang dengan panjang 2 – 3
g
μm dan lebar 0,5 – 0,7
μm. Termasuk bakteri Gram Negatif, bersifat fakultatif anaerob , tidak membentuk
3. Staphylococcus Aureus
Bakteri ini berbentuk bola dengan garis tengah ±1 μm tersusun dalam kelompok kelompok tidak teratur ( menyerupai buah anggur ) . Dapat pula tersusun empat empat ( tetrad ) , membentuk rantai ( 3-4 sel ), berpasangan atau satu-satu. Bersifat Gram Positif, tidak dapat bergerak , tidak membentuk spora, aerob dan ada yang fakultatif anaerob serta tidak membentuk kapsul. Staphylococcus aureus menghasilkan tujuh tipe enterotoksin ( A, B, C, C1, C2, D dan E ). Keracunan pangan biasanya disebabkan oleh tipe A dan D. Kisaran suhu untuk produksi toksin adalah 4 – 460C. Pada keadaan aerob, aw minimum untuk pertumbuhan adalah 0,86. Sedangkan pada keadaan anaerob adalah 0,90. Pangan yang sering tercemar oleh Staphylococcus
aureus adalah daging unggas, daging merah dan produknya, ikan dan produknya, serta susu dan produknya. Pencegahannya adalah dengan sanitasi, pemasakan, pendinginan pangan secukupnya atau menurunkan pH pangan ( Nurwantoro dan Abbas , 1997 ).
4. Salmonella
Bakteri Salmonella berbentuk batang dengan panjang 1 – 3 μm dan lebar 0,5 – 0,7 μm. Sebagian bakteri ini dapat bergerak karena memiliki fl itrik. Bakteri ini bersifat gram negatif, tidak membentuk spora. Tumbuh optimum pada suhu 370C. Pada suhu kurang dari 6,70C dan lebih dari 46,60C pertumbuhannya terhenti, tetapi hidup pada air yang membeku. Bakteri ini mati pada pemanasan 600C selama 30 menit. Salmonella tumbuh baik pada pangan berasam rendah dengan aw 0,93 – 0,94.
Unggas dikenal sebagai pembawa alami bakteri Salmonella. Apabila unggas terinfeksi oleh Salmonella, maka dalam kotoran , daging dan telurnya akan ditemukan bakteri ini. Pangan lainnya yang sering tercemar Salmonella adalah sosis, ikan asap, susu segar, es krim, coklat susu dan pangan yang dibuat dari telur. Ada dua jenis penyakit yang ditimbulkan oleh Salmonella , yaitu Salmonellosis dan Demam Tifus ( Nurwantoro dan Abbas , 1997 ).
5. Pseudomonas aeruginosa
Pseudomonas aeruginosa adalah gram negatif ( 0,5 – 0,8 x 1,5 – 8 μm ), yang bergerak dengan flagella dan ditemukan tunggal, berpasangan atau dalam rantai pendek . Pertumbuhan optimum dari Psedomonas aeruginosa adalah 370C. Pertumbuhan terjadi pada temperatur di atas 420C, tetapi tidak pada suhu 40C. Bakteri ini tidak memerlukan material organik dan mampu menggandakan diri pada pada jangkauan substrat yang lebar ( lebih dari 82 senyawa organik ). Organisme ini juga mampu menghasilkan enzim ektraseluler dan lapisan kotoran yang luas, yang dapat memberi daya tahan terhadap berbagai bahan antimikroba (Bennik, 1999 ).
manusia, Bakteri ini dapat meningkatkan kelangsungan hidup dari spesies patogen lain di dalam campuran kultur biofilm (Bennik, 1999 ).
2.5. Uji Biodegradabilitas Film Biodegradable
Proses biodegradable ini diperlukan untuk mempelajari tingkat ketahanan film yang dihasilkan kaitannya dengan pengaruh mikroba pengurai, kelembaban tanah dan suhu bahkan faktor fisik yang lain. Secara kimiawi , film yang dihasilkan jelas bersifat biodegradable, hal itu disebabkan oleh bahan baku yang digunakan adalah bahan baku organik dan alamiah yang mudah berinteraksi dengan air dan mikroorganisme lain bahkan sensitif terhadap pengaruh fisik/kimia lingkungan.
Beberapa faktor yang mempengaruhi tingkat biodegradabilitas kemasan setelah kontak dengan mikroorganisme , yakni : sifat hidrofobik, zat aditif, proses produksi, struktur polimer, morfologi dan berat molekul bahan kemasan. Proses terjadinya biodegradasi film kemasan pada lingkungan alam dimulai dengan tahap degradasi kimia dengan proses oksidasi, menghasilkan polimer dengan berat molekul yang rendah. Proses berikutnya ( secondary process ) adalah serangan mikroorganisme ( bakteri, jamur dan alga ) dan aktivitas enzim ( intraseluler, ekstrseluler ). Contoh mikroorganisme di antaranya bakteri fototrof ( Rhodospirillium, Rhodopseudomonas,
Chromatium, Thiocystis), pembentuk endospora ( Bacillus, Clostrididum ) , gram negatif aerob ( Pseudomonas, Zoogloa, Azotobacter, Rhizobium ) , jamur ( Aspergillus
Uji biodegradasi dapat dilakukan dalam cawan petri yang berisi jamur atau bakteri. Cawan petri ditutup dan diinkubasi pada temperatur konstan antara 21 dan 28 hari. Hilangnya berat, uji mekanik dan elektrik dapat dilakukan untuk uji material setelah dilakukan biodegradasi ( Chandra and Rustgi , 1998 ) .
BAB III
BAHAN DAN METODA
3.1. Bahan dan Alat
Bahan kimia yang digunakan dalam penelitian ini adalah gliserol , asam asetat glasial, kalsium klorida anhidrat, kitosan dengan derajad deasetilasi 79,96% , aquadest, tepung biji aren , asam borat, asam klorida, asam sulfat (p), katalis selen , natrium hidroksida, indikator PP, larutan Luff – Schoorl, Mueler Hinton Agar, Plate Count Agar, Pereaksi Mc Farland, alkohol 70%, Media PDA. Demikian juga bahan untuk pengujian aktivitas air (aw) seperti kalium dikromat, kalium sulfat dan silika gel semuanya berasal dari bahan p.a.
3.2. Metode Penelitian
3.2.1. Pembuatan dan Analisa Tepung Biji Aren
Ditimbang buah aren yang masih setengah masak, buah tersebut direbus kemudian dibelah daging buahnya dan dilepaskan kulit biji yang tipis. Biji buah aren tersebut kemudian dicuci dengan air dan direndam dengan air kapur selama 2 – 3 hari. Setelah perendaman ditimbang 500 g sampel basah dari biji aren ( disebut dengan ‘ kolang – kaling ‘ ) yang telah dihaluskan, kemudian dikeringkan di dalam oven vakum pada 350C pada tekanan 50 cmHg . Sampel yang telah kering kemudian ditimbang massanya.
3.2.1.1. Penentuan Kadar Karbohidrat ( SNI 01-2892-1992 )
%
% karbohidrat = 0,90 x kadar glukosa
dimana, W = glukosa yang terkandung untuk ml natrium tiosulfat yang digunakan, dalam mg, dari daftar tabel Luff Schrool Lampiran 1.
W1 = bobot contoh ( mg ) fp = faktor pengenceran
3.2.1.2. Penentuan Kadar Protein
Ditimbang 1,9997 g sampel kering kemudian sampel dimasukkan ke dalam labu Kjeldahl , ditambahkan katalis selen ( Na2SO4 + CuSO4 + Se ) dan 25 ml H2SO4 (p) dan didestruksi pada suhu 3750C selama 1,5 jam . Larutan dibiarkan dingin kemudian diencerkan dengan aquadest sampai volume 250 ml. Larutan hasil pengenceran kemudian dipipet 50 ml larutan dan dimasukkan ke dalam alat penyuling , ditambahkan 120 ml NaOH 30% dan 50 ml H2O, didestilasi selama 10 menit, sebagai larutan penampung digunakan 25 ml asam borat 4% yang telah dicampur dengan indikator mengsel, setelah proses destilasi selesai larutan kemudian dititrasi dengan larutan standard HCl 0,01 N hingga berubah warna dari hijau kebiruan menjadi merah lembayung. Kadar protein dapat dihitung sebagai berikut :
dimana , fp = faktor pengenceran V = volume titer
N = normalitas HCl w = bobot cuplikan
fk = faktor konversi untuk protein dari makanan secara umum = 6,25
3.2.2. Pembuatan Film Pelapis Kitosan – Tepung Biji Aren
Ditimbang 1 g kitosan , kemudian didispersikan ke dalam 100 ml asam asetat 1% (b/b) dan diaduk menggunakan magnetik stirrer untuk menghasilkan campuran homogen, kemudian ditambahkan dengan 100 ml gliserol 0,64% (b/b). Ditimbang 2 g tepung biji aren , kemudian didispersikan ke dalam 100 ml larutan gliserol 0,64% (b/b) , larutan tersebut kemudian dipanaskan sambil diaduk sampai 700C selama 30 menit untuk menyempurnakan proses gelatinisasi.
Larutan Kitosan 1% dan larutan tepung biji aren 2% dihomogenkan dengan menggunakan mixer selama 5 menit, kemudian divakumkan untuk menghilangkan airnya hingga terbentuk larutan polimer yang kental.
3.2.3. Penentuan Derajat Deasetilasi Kitosan
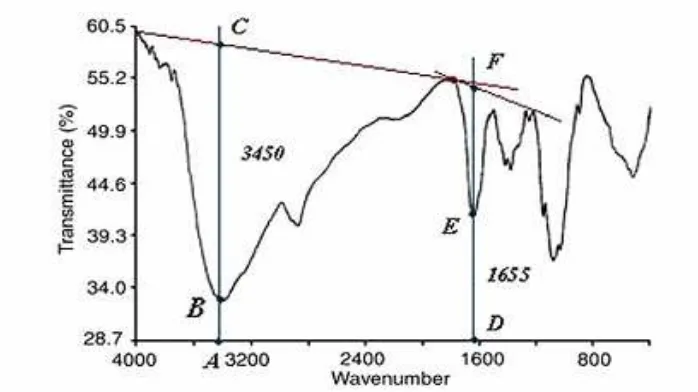
Untuk penentuan derajat deasetilasi kitosan digunakan metode spektroskopi infra merah. Cuplikan dibuat pelet dengan 1% KBr, kemudian dilakukan scanning pada daerah frekuensi antara 4.000 cm-1 sampai dengan 400 cm-1. Derajad deasetilasi ditentukan dengan metode “ base line “ menurut gambar 3.1 berikut :
Gambar 3.1. Spektrum FT – IR kitosan untuk menentukan derajat deasetilasi
Puncak tertinggi dicatat dan diukur dari garis dasar yang dipilih. Nilai absorbansi dapat dihitung dengan menggunakan rumus :
(A1655) amida = log10
DE DF
(A3450) hidroksil = log10
AB AC
Perbandingan antara absorbansi pada υ = 1.655 cm-1 ( serapan pita amida I ) dengan absorbansi pada υ= 3.450 cm-1 ( serapan gugus hidroksil ) diitung. Untuk N – deasetilasi kitin yang sempurna (100%) diperoleh nilai A1655 = 1,33.
Pengukuran nilai absorbansi pada puncak yang terkait, derajat N-deasetilasi
dapat dihitung dengan cara : % N – deasetilasi = 100 -
3.2.4. Karakterisasi Edible Film
.3.2.4.1. Uji Scanning Electron Microscope (SEM)
Film pelapis kitosan – tepung biji aren dan film hasil biodegradasi ditentukan morfologi permukaannya dengan alat SEM ( JEOL JSM 6360LA ) dengan perbesaran 2000 x dan 5000 x serta penampangnya dengan perbesaran 2000 x.
3.2.4.2. Uji Kekuatan Tarik dan Kemuluran
tegangan maksimum (Fmaks) dan regangannya. Data pengukuran regangan diubah menjadi kuat tarik (δt) dan kemuluran (ε ).
Harga kemuluran (%) bahan dihitung dengan menggunakan rumus di bawah ini :
Kemuluran (ε ) = x100%
lo lo l−
dimana : l – lo = Harga stroke ; lo = panjang awal Nilai kekuatan tarik bahan dihitung dengan persamaan :
Kekuatan tarik ( kgf/mm2) =
dimana : A = luas permukaan yang mendapat beban .
3.2.4.3. Uji Ketebalan
Ketebalan Film pelapis diuji dengan alat mikrometer sekrup pada 5 sisi yang berbeda. Rata – rata dari ke lima sisi merupakan ketebalan sisi yang dihasilkan.
3.2.4.4. Uji Aktivitas Air
3.2.4.5. Uji Laju Transmisi Uap Air (WVTR ) dengan Metode Dessicant
Uji laju transmisi uap air ditentukan dengan metode ASTM E 96/E 96 M – 05 yaitu : tempat dish diisi dengan dessicant dengan ketebalan 6 mm dari spesimen dan diberikan ruang yang cukup sehingga dish dapat digoyangkan setiap kali penimbangan untuk mencampur dessicant, kemudian ditimbang berat awal dessicant yang diperlukan. Sampel diletakkan pada cawan dengan permukaan contoh uji yang berhadapan dengan udara yang lebih lembab dalam penggunaanya menghadap ke atas. Tutup cawan diletakkan menghadap ke atas lalu diletakkan cincin logam sedemikian rupa sehingga bagian yang teralur menghadap ke atas. Sampel diletakkan ke dalam tutup sehingga contoh uji tersebut duduk pada cincin logam, selanjutnya cincin karet diletakkan untuk sealing ke dalam tutup, sehingga cincin karet tersebut menekan contoh uji pada tempatnya. Tutup cawan secara perlahan disekrup kemudian cawan ditimbang untuk mengetahui keadaan awal contoh uji. Contoh uji dimasukkan ke dalam humidity chamber dan ditimbang cawan setiap jam dan pengujian dihentikan sebelum penyerapan air oleh dessicant melebihi 10% berat awal.
WVTR = G/tA = (G/t)/A
dimana : WVTR = Laju transmisi uap air, g/jam.m2. G = Perubahan berat ( dari garis lurus ) , g.
t = Waktu, jam
3.2.4.6. Uji Laju Respirasi Gas O2 dan CO2
Pengukuran laju respirasi dilakukan pada ikan salmon segar yang dilapisi dan tidak dilapisi edible film. Dimasukkan masing masing sampel ke dalam stoples sebanyak 0,2533 kg ( yang dilapisi ) dan 0,3032 kg ( untuk yang tidak dilapisi ) , Stoples ditutup rapat dengan penyumbat karet dan pada celah antara tutup dan ulir stoples dilapisi dengan lilin untuk mencegah keluar masuknya gas O2 dan CO2.
Stoples disimpan ditempat penyimpanan pada suhu 100C , Untuk pengukuran konsentrasi gas O2 dan CO2 dalam stoples, dibuat dua lubang dihubungkan dengan pipa plastik. Pengukuran O2 dan CO2 dilakukan dengan selang waktu 6 jam menggunakan alat cosmotektor. Menurut Sutrisno (1994) dikutip Julianti (1997) perhitungan laju respirasi dapat dilakukan dengan menggunakan rumus sebagai berikut
Rr =
= perbedaan konsentrasi O2 atau CO2 (%) antara dua pengukuran. V = volume kemasan (l)
R = konstanta gas ( 0,0821 dm3.atm/K/mol) W = berat contoh (kg)
C
σ = kerapatan jenis contoh ( kg/l)
to = suhu penyimpanan (0C)
T
Δ = interval pengamatan ( jam )
3.2.5. Pengujian Sifat Anti Bakteri dan Biodegradasi
Sifat anti bakteri dan biodegradasi dari film pelapis kitosan – tepung biji aren dilakukan dengan prosedur sebagai berikut :
3.2.5.1. Aktivitas Antimikroba dengan Metode Difusi Agar
Kelima biakan mikroba ( Escherechia coli, Staphylococcus aureus , Shigella,
Salmonella dan Pseudomonas aeruginosa ) masing masing diambil beberapa ose dan
dimasukkan ke dalam tabung yang telah berisi NaCl fisiologis , divorteks hingga kekeruhannya sama dengan standard Mc Farland 108 , kemudian masing masing sebanyak 1 ml suspensi mikroba diinokulasikan ke dalam cawan petri berdiameter 9 cm , kemudian dituang 10 ml media Meuller Hinton Agar ke dalam cawan petri tersebut , setelah memadat cakram dengan ukuran 0,52 cm diletakkan di atas media. Kemudian setiap cawan petri uji berisi mikroba uji Escherechia coli, Staphylococcus
aureus , Shigella, Salmonella dan Pseudomonas aeruginosa diinkubasikan di dalam
3.2.5.2. Estimasi kepadatan sel isolat baketri dengan cara Standard Plate Count
(SPC)
Potongan ikan salmon dibeli pada pasar lokal. Potongan dari ikan dengan berat masing masing 10 g kemudian dibungkus pada film pelapis kitosan – tepung biji aren . Potongan ikan ditempatkan dalam talam polistiren dibungkus dengan film PVC dan disimpan pada 5 - 100C selama 20 hari . Potongan salmon tanpa pembungkus digunakan sebagai sistem kontrol.
Kepadatan sel isolat bakteri masing masing perlakuan dihitung dengan cara SPC dengan menggunakan koloni counter pada hari ke 0, 1, 2, 3, 5, 10, 15, 16 dan 20 hari dengan metode cawan tuang dimana sampel hasil perlakuan diambil 1 g dan dimasukkan ke dalam tabung reaksi dan ditambah aquadest steril sehingga volume menjadi 10 ml. Perlakuan ini disebut sebagai kultur awal. Lalu kultur awal tersebut diencerkan sampai 10.000 kali kemudian dituang 10 ml media PCA ke dalam tabung reaksi dan 1 ml dari hasil pengenceran kultur awal dimasukkan ke dalam tabung reaksi berisi media lalu divorteks , kemudian dituang ke dalam cawan petri lalu dihomogenkan dengan cara digoyang membentuk angka delapan. Selanjutnya diinkubasi selama 24 jam pada suhu 370C dan dihitung kepadatan sel bakterinya dengan cara :
Jumlah koloni x
n pengencera
1
3.2.5.3. Uji Biodegradasi Film Spesimen terhadap Jamur Aspergillus Niger
3.3. Bagan Penelitian
3.3.1. Pembuatan Tepung Biji Aren
Buah aren setengah masak
direbus
dibelah daging buahnya
kolang - kaling
dihaluskan
dikeringkan dalam oven vakum pada 350C pada tekanan 50 cmHg
Hasil Biji Aren
dilepaskan kulit bijinya dicuci dengan air
direndam dengan air kapur selama 2 – 3 hari.
3.3.2. Penentuan Kadar Karbohidrat dari Tepung Biji Aren
3 g sampel kering
ditambah HCl 3%
dipanaskan dengan pendingin tegak selama 3 jam
didinginkan Larutan berwarna mera jambu
dinetralkan dengan NaOH sampai pH 6 dipindahkan ke dalam labu ukur 500 ml disaring
Residu Filtrat
dipipet 5 ml
ditambah 20 ml aqudest
dipanaskan selama 10 menit
ditambah 25 ml larutan Luff Schrool
didinginkan
ditambah 15 ml larutan KI 20% dan H2SO4 25%
dititrasi dengan larutan standar Na2S2O3 0,1 N dengan menggunakan indikator kanji pada akhir titrasi
Larutan putih susu
3.3.3. Penentuan Kadar Protein dari Tepung Biji Aren
1,9997 g sampel kering
dimasukkan ke dalam labu Kjeldahl 100 ml ditambah katalis Selen ( Na2SO4 + CuSO4 + Se ) dan 25 ml H2SO4 (p)
didekstruksi pada suhu 3750C selama 1,5 jam Larutan jernih kehijauan
dibiarkan dingin kemudian diencerkan dalam labu takar 250 ml hingga garis batas.
dipipet 50 ml larutan dan dimasukkan ke dalam alat destilasi
ditambah 120 ml NaOH 30% dan 50 ml H2O didestilasi selama 10 menit
ditampung dalam labu erlenmeyer yang berisi 25 ml H3BO3 dan indikator mengsel
Destilat
bilasi ujung pendingin dengan air suling
dititrasi destilat tersebut dengan HCl 0,1 N
Larutan ungu
dihitung % N dan kadar proteinnya