OPTIMASI PRODUKSI DAN KARAKTERISASI ENZIM
MICROBIAL TRANSGLUTAMINASE (MTGase) DARI
Streptomyces sp. GALUR TTA 02 SDS 14
HANA NURULLITA PRESTISIA
P051130161
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Optimasi Produksi dan Karakterisasi Enzim Microbial Transglutaminase (MTGase) dari Streptomyces sp. Galur TTA 02 SDS 14” adalah benar karya saya dan dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2016
Hana Nurullita Prestisia
RINGKASAN
HANA NURULLITA PRESTISIA. Optimasi Produksi dan Karakterisasi Enzim
Microbial Transglutamminase (MTGase) dari Streptomyces sp. Galur TTA 02 SDS 14. Dibimbing oleh NISA RACHMANIA MUBARIK dan DEWI
SESWITA ZILDA.
Transglutaminase (TGase) adalah enzim yang mengkatalisis reaksi perpindahan gugus asil antara residu glutamin (Gln) dan lisin (Lys) yang membentuk ikatan silang (crosslinking) ε-(γ-glutamyl)lisin (Motoki dan Seguro 1998). Enzim transglutaminase bekerja secara intra- dan interseluler menghasilkan ikatan silang antar protein. Transglutaminase mengkatalisis reaksi antara suatu peptida terikat residu glutamin dan amina primer. Beberapa potensi aplikasi transglutaminase antara lain untuk meningkatkan mutu protein pangan, memperbaiki sifat edibel film, memperbaiki sifat pembuihan protein, memperbaiki sifat gel, memperbaiki sifat adonan roti, dan peningkatan stabilitas penyimpanan bahan pangan kering. Tujuan penelitian ini yaitu mengukur kondisi optimum produksi MTGase yang dihasilkan oleh Streptomyces sp. galur TTA 02 SDS 14 dan mendapatkan karakteristik enzim.
Penelitian ini dilakukan beberapa tahapan yaitu, optimasi produksi enzim MTGase dan karakterisasi enzim MTGase (menentukan pH dan suhu optimum, ketahanan enzim terhadap panas, serta pengaruh ion logam dan inhibitor terhadap aktivitas enzim).
Hasil penelitian ini menunjukkan bahwa Streptomyces sp. galur TTA 02 SDS 14 menghasilkan enzim transglutaminase secara optimum pada pH media 6 dan suhu 25 ºC. Pengujian enam jenis media yang berbeda untuk memproduksi enzim transglutaminase diperoleh bahwa media yang digunakan oleh Bahrim et al. dengan komposisi pepton 1,5%, MgSO4.7H2O 0,1%, KH2PO4 0,2%, Na2HPO4
0,5%, tepung kedelai 2%, tepung kentang 2% dan glukosa 1,5% menghasilkan enzim dengan aktivitas tertinggi setelah fermentasi selama 4 hari (108 jam). Hasil karakterisasi enzim diketahui bahwa enzim yang dihasilkan mempunyai pH optimum 6,0 dan suhu optimum 45-50 ºC. Pengujian stabilitas enzim pada suhu 40 ºC, 45 ºC, dan 50 ºC selama 4 jam masih menunjukkan aktivitas di atas 50%. Penambahan ion logam Na+, K+, Ca2+, Mg2+ meningkatkan aktivitas MTGase, sebaliknya ion logam Li+, Cu+, Zn2+, Fe3+ menurunkan aktivitas MTGase. Penambahan IAA (iodoacetamide) 1 mM dapat meningkatkan aktivitas enzim MTGase sedangkan EDTA (ethylendiamine tetraacetic acid), PMSF (phenyl methyl sulfonyl flouride), dan DPB (dibromoacetophenone) dapat menghambat aktivitas MTGase.
SUMMARY
HANA NURULLITA PRESTISIA. Optimization of Production and Characterization of Microbial Transglutaminase (MTGase) from Streptomyces sp. Strain TTA 02 SDS 14. Supervised by NISA RACHMANIA MUBARIK and DEWI SESWITA ZILDA.
Transglutaminase (TGase) is an enzyme that catalyses an acyl transfer reaction between bond glutaminyl (Gln) residue and lysin (Lys), and catalyses the crosslinking through the formation of an ε-(γ-glutamyl) lysine bond. Transglutaminase catalyses reaction between the carboxyamide group of peptide-bound glutamine residues and a variety of primary amines. Preparations containing TGase has potentially wide range of applications such as improve amino acid for low protein, to produce edible film, foaming properties, and gelation and manufacture bakery product. The aim of this study was to determinate optimization of production and characterization of a microorganism like Streptomyces sp. TTA 02 SDS 14 strain that product enzyme MTGase.
This research was conducted several stages such as optimize to produce enzyme and characterization of MTGase (determined optimal pH and temperature, thermal stability of enzyme, as well as the influence of metal ions and inhibitors of the enzyme activity).
These research showed transglutaminase could produced by
Streptomyces sp. strain TTA 02 SDS 14 in medium optimum pH 6.0 and temperature 25 ºC. Screening with six type of medium to produce transglutaminase was obtained that the media used by Bahrim et al. with a composition of peptone 1.5%, MgSO4.7H2O 0.1 %, KH2PO4 0.2 %, Na2HPO4 0.5 % , soybean flour 2 %, potato starch 2 %, and glucose 1.5 % could produce an enzyme with the highest activity after fermentation for 4 days (108 hours). Results of enzyme characterization known that the enzyme produced has optimum pH 6.0 and optimum temperature 45-50 ºC. Enzyme stable at temperature of 40 ºC, 45 ºC, and 50 ºC with activity above 50 % for up to four hours of incubation time. The partial purified MTGase’s activity was increased with Na+
, K+, Ca2+,and Mg2+, IAA (iodoacetamide) 1mM, but it was activated by the presence Li+, Cu+, Zn2+, and Fe3+, EDTA (ethylendiamine tetraacetic acid), PMSF (phenyl methyl sulfonyl flouride), IAA (iodoacetamide) 5mM, and DPB (dibromoacetophenone).
©
Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
OPTIMASI PRODUKSI DAN KARAKTERISASI ENZIM
MICROBIAL TRANSGLUTAMINASE (MTGase) DARI
Streptomyces sp. GALUR TTA 02 SDS 14
HANA NURULLITA PRESTISIA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Optimasi Produksi dan Karakterisasi Enzim Microbial
Transglutaminase (MTGase) dari Steptomyces sp. Galur
TTA 02 SDS 14
Nama : Hana Nurullita Prestisia NIM : P051130161
Disetujui oleh
Komisi Pembimbing
Dr Nisa Rachmania Mubarik, MSi Dr Dewi Seswita Zilda, MSi
Ketua Anggota
Diketahui
Ketua Program Studi Dekan SekolahPascasarjana
Bioteknologi
Prof Dr Ir Suharsono, DEA Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-NYA sehingga tesis ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2015 sampai September 2015 ini ialah enzim transglutaminase, dengan judul Optimasi Produksi dan Karakterisasi Enzim
Microbial Transglutaminase (MTGase) dari Streptomyces sp. Galur TTA 02 SDS 14.
Terima kasih penulis ucapkan kepada Dr Nisa Rachmania Mubarik, MSi selaku ketua komisi pembimbing dan Dr Dewi Seswita Zilda selaku anggota komisi pembimbing yang telah membimbing dan memberikan saran serta kritikan selama menyusun tesis ini. Selain itu penulis juga mengucapkan terima kasih kepada penguji luar komisi Prof Dr Anja Meryandini, MS yang telah memberikan masukan pada saat ujian sidang tesis, serta kepada Prof Dr Ir Suharsono, DEA selaku ketua Program Studi Bioteknologi IPB yang telah memberikan motivasi kepada penulis. Penulis mengucapkan terima kasih kepada Dr Kustiariyah Tarman SPi, MSi selaku dosen Teknologi Hasil Perairan, FPIK IPB yang selalu memberikan motivasi kepada penulis selama menempuh pendidikan pascasarjana di IPB. Penulis mengucapkan terima kasih kepada Balai Besar Penelitian dan Pengembangan Pengolahan Produk dan Bioteknologi Kementrian Kelautan dan Perikanan (BBRP2B) yang telah membiayai penelitian ini serta DIKTI melalui Beasiswa BPPDN 2013 selama menempuh pendidikan pascasarjana di IPB.
Penulis juga mengucapkan terima kasih kepada Dr Ir Ekowati Chasanah, MSi dan Ir Yusro Nuri Fawzya, MSi yang telah banyak memberikan bimbingan dan arahan di Laboratorium. Penulis mengucapkan terimakasih kepada Mbak Dewi Rahmi, Pak Pujo, Pak Nursyid, Bu Umi, Mas Gintung, Mas Agus, Mbak Maya, Mbak Hana, Yudi, Benget, Zul, Bang Sepri, Habib, Mbak Lia dan Ayu atas bantuannnya selama penulis melakukan penelitian di Laboratorium. Rekan-rekan Pascasarjana Bioteknologi 2013-2014 atas segala bantuan dan kerjasamanya. Ucapan terima kasih tak terhingga untuk seluruh keluarga besar penulis terutama suami tercinta Rizky Fachru Rozy dan ananda Muhammad Tara Luvian Akbar yang tiada putus-putusnya atas dukungan baik material, moral maupun spiritual. Terima kasih untuk seluruh pihak yang telah membantu penulis selama penulisan dan penyusunan tesis yang tidak dapat penulis sebutkan satu persatu.
Semoga karya ilmiah ini bermanfaat.
Bogor, Maret 2016
DAFTAR ISI
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xi
1 PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Manfaat Penelitian ... 2
2 TINJAUAN PUSTAKA... 3
Enzim Transglutaminase ... 3
Streptomyces sp. ... 5
Media Pertumbuhan Mikrob ... 5
Karakterisasi Biokmia Enzim ... 7
Ultrafiltrasi ... 9
Teknik Pemisahan dengan Membran Ultrafiltrasi ... 10
3 METODE ... 11
Bahan ... 11
Waktu dan Tempat ... 11
Tahapan Penelitian ... 11
Optimasi Produksi Enzim MTGase ... 12
Karakterisasi enzim ... 14
4 HASIL DAN PEMBAHASAN ... 16
Hasil ... 16
Pembahasan ... 23
5 SIMPULAN DAN SARAN ... 28
Simpulan ... 28
Saran ... 28
DAFTAR PUSTAKA ... 29
LAMPIRAN ... 33
RIWAYAT HIDUP ... 35
DAFTAR TABEL
1 Sifat biokimia dari lima jenis mammalian transglutaminase ... 4
2 Kebutuhan nutrien bagi mikroba dan bentuk yang dimanfaatkan ... 6
3 Komposisi media produksi enzim ... 12
DAFTAR GAMBAR 1 Transglutaminase mengkatalisis reaksi ... 3
2 Kisaran ukuran pori membran ... 9
3 Prinsip proses pemisahan dengan membran ultrafiltasi ... 10
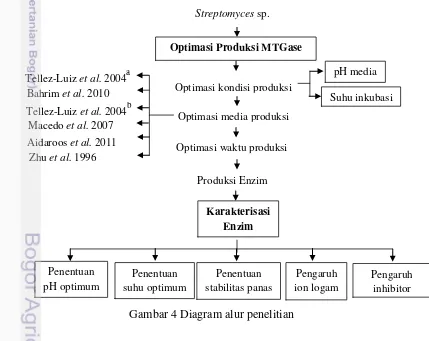
4 Diagram alur penelitian ... 11
5 Isolat Streptomyces sp. galur TTA 02 SDS 14 ... 16
6 Optimasi kondisi produksi enzim MTGase Streptomyces sp. galur TTA 02 SDS 14 . ... 17
7 Optimasi media produksi enzim MTGase Streptomyces sp. galur TTA 02 SDS 14 ... 18
8 Optimasi waktu produksi enzim MTGase Streptomyces sp. galur TTA 02 SDS 14 ... 20
9 Pengaruh pH terhadap aktivitas MTGase ... 21
10 Pengaruh suhu terhadap aktivitas MTGase . ... 21
11 Pengaruh ketahanan panas terhadap aktivitas MTGase . ... 22
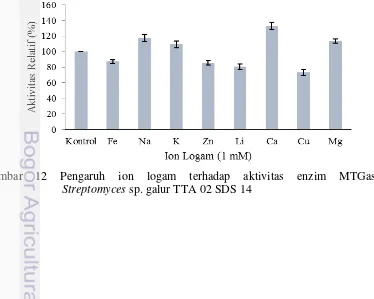
12 Pengaruh ion logam terhadap aktivitas MTGase . ... 22
13 Pengaruh inhibitor terhadap aktivitas MTGase . ... 23
DAFTAR LAMPIRAN 1 Pembuatan kurva standar L-asam glutamat γ-monohidroksamat ... 33
1
1 PENDAHULUAN
Latar Belakang
Enzim merupakan salah satu produk industri yang memiliki nilai ekonomis cukup tinggi di pasar dunia saat ini. Penggunaan enzim di Indonesia semakin meningkat dari tahun ke tahun. Hal ini sejalan dengan semakin berkembangnya industri pangan dan nonpangan yang memanfaatkan enzim sebagai katalisator berbagai reaksi kimia. Beberapa pengamatan yang telah dilakukan membuktikan bahwa penggunaan enzim di Indonesia setiap tahunnya mengalami peningkatan hingga 9,1% per tahun. Berbagai industri tersebut menggunakan enzim dalam jumlah yang sangat besar. Pada tahun 2014, besarnya
impor enzim ekstrak kasar di Indonesia mencapai 2.500 ton dengan harga Rp 187,5 milyar (BPPT 2014). Enzim memiliki sifat-sifat spesifik yang sangat
menguntungkan yaitu, efisien, selektif, mengalami reaksi tanpa efek samping, dan ramah lingkungan (Muffarikha et al. 2014).
Produk enzim yang memiliki prospek baik untuk dikembangkan adalah protease, amilase, xilanase dan transglutaminase karena dipandang cukup luas penggunaannya dalam berbagai industri. Transglutaminase merupakan salah satu enzim yang digunakan dalam industri pangan untuk modifikasi protein. Enzim transglutaminase telah diproduksi secara komersial dari hati marmut dengan harga tinggi sekitar US$ 80/unit (Bahrim et al. 2010).
Transglutaminase (TGase) adalah enzim yang mengkatalisis reaksi perpindahan gugus asil antara residu glutamin (Gln) dan lisin (Lys) yang
membentuk ikatan silang (crosslinking) ε-(γ-glutamyl)lisin (Motoki dan Seguro 1998). Enzim transglutaminase bekerja secara intra- dan
interseluler menghasilkan ikatan silang antar protein. Transglutaminase mengkatalisis reaksi antara suatu peptida terikat residu glutamin dan amina primer (Mayashopha et al. 2015).
Transglutaminase pada awalnya dikenal sebagai Faktor XIIIa di bidang kedokteran, yang berperan pada proses penggumpalan darah. Transglutaminase dapat ditemukan pada berbagai organ, jaringan, cairan tubuh hewan (darat maupun air), dan tanaman. Enzim ini terlibat pada berbagai fungsi biologis mulai dari penggumpalan darah sampai diferensiasi sel. Transglutaminase juga dapat ditemukan pula pada beberapa mikroorganisme (Srianta 2000).
2
Mikrob merupakan sumber enzim yang paling banyak digunakan dari pada hewan dan tumbuhan, karena mikrob memiliki pertumbuhan yang cepat dan dapat tumbuh pada berbagai jenis substrat (Muffarikha et al. 2014). Penghasil TGase dari kelompok Actinomycetes banyak ditemukan dari genus Streptoverticillium
atau Streptomyces. Produk transglutaminase asal mikrob sering disebut dengan
microbial transglutaminase (MTGase) (Ando et al. 1989).
Microbial transglutaminase (MTGase) dapat dihasilkan secara ekstraseluler dan intraseluler. Transglutaminase ekstraseluler dihasilkan dari mikrob jenis Sacharomyces cerrevisiae, Streptoverticillium ladakanum,
Streptoverticillium mobaraensis, Streptoverticillium sp., Streptoverticillium lydicus, dan Aspergillus sp. Transglutaminase intraseluler ditemukan pada
Bacillus subtilis dan Physarium olycephalum (Haard dan Simpson 2000).
Pada penelitian ini telah dilakukan penelitian pendahuluan yaitu penapisan isolat lokal Streptomyces sp. untuk menghasilkan enzim transglutaminase. Hasil penelitian pendahuluan tersebut menunjukkan bahwa dari 108 isolat lokal
Streptomyces sp. yang diisolasi dari tanah di Bima, Nusa Tenggara Barat, Indonesia menghasilkan 10 isolat yang berpotensi menghasikan enzim transglutaminase. Salah satu isolat lokal yang memiliki aktivitas enzim transglutaminase ekstraseluler yaitu isolat Streptomyces sp. galur SDS-LU. Paparan ini jelas menunjukkan bahwa Streptoyces sp. isolat lokal memiliki potensi tinggi untuk dilakukan penelitian lebih lanjut untuk menghasilkan enzim transglutaminase beserta karakterisasinya.
Tujuan
Penelitian ini bertujuan untuk mengukur kondisi optimum produksi MTGase yang dihasilkan oleh Streptomyces sp. galur TTA 02 SDS 14 (meliputi pH media dan suhu inkubasi) dan mendapatkan karakteristik enzim MTGase,
meliputi stabilitas panas, pH, suhu, ion logam, dan pengujian inhibitor).
Manfaat Penelitian
3
2 TINJAUAN PUSTAKA
Enzim Transglutaminase
Transglutaminase termasuk ke dalam kelompok enzim transferase dan
mempunyai nama sistematis, yaitu protein glutamin γ-glutamyltransferase (EC 2.3.2.13). Transglutaminase merupakan enzim yang mengkatalisis reaksi
perpindahan gugus asil antara kelompok γ-carboxyamide residu glutamin pada protein, peptida dan berbagai amina primer (Gambar 1). Apabila kelompok
ε-amino residu lisin aktif sebagai aseptor asil, maka akan menghasilkan proses polimerisasi dan interaksi silang inter- atau intra-molekul protein melalui
pembentukan ikatan ε-(γ-glutamyl) lisin. Pada proses ini terjadi pertukaran
amonia dari kelompok ε-amino residu lisin ke kelompok carboxyamide residu glutamin pada molekul protein. Apabila amin primer tidak ada, maka air dapat
berperan sebagai aseptor asil dan menghasilkan proses deamidasi kelompok
γ-carboxyamide glutamin untuk membentuk asam glutamat (Haard dan Simpson 2000).
Gambar 1 Transglutaminase mengkatalisis reaksi: a) Reaksi umum transfer asil dengan TGase b) reaksi ikatan antara asam amino glutamin dan lisin dengan TGase c) deamidasi dengan amin primer dari air pada reaksi dikatalis TGase (Marapana dan Jiang 2004)
Istilah “transglutaminase” pertama kali diperkenalkan oleh Clarke et al. (1959) yang menjelaskan aktivitas transamidasi pada hati marmut.
4
kalsium telah ditemukan pada bakteri jenis aktinomiset termasuk Streptomyces cinnamoneus dan Streptomyces mobaraense (Yokoyama et al. 2004)
Transglutaminase tersebar secara luas pada organisme eukariot dan prokariot. Akan tetapi karakteristik transglutaminase yang paling banyak dilakukan, yaitu berasal dari mamalia. Berdasarkan sumbernya, enzim transglutaminase dibagi ke dalam dua golongan, yaitu:
a). Mammalian Transglutaminase
Aktivitas transglutaminase ditemukan dan tersebar secara luas dalam plasma, jaringan, dan cairan ekstraseluler dari beberapa mamalia. Transglutaminase yang mengubah protein seluruhnya ada dalam tubuh. Enzim transglutaminase tersebut dapat digolongkan ke dalam lima golongan, yaitu faktor XIII (plasma dan plasenta), transglutaminase jaringan, keratinosit, epidermis, dan prostat (Dvorcakova et al. 2002; Esposito dan Caputo 2004). Perbedaan dari kelima jenis transglutaminase mamalia terletak pada berat molekul, struktur subunit dan aktivitas protease, tetapi semuanya memiliki ketergantungan yang sama pada kalsium (Tabel 1).
Tabel 1 Sifat biokimia dari lima jenis transglutaminase mamalia
TGase Bobot molekul
Sumber : Dvorcakova et al. (2002); Esposito dan Caputo (2004)
b). Varietas Transglutaminase lainnya
Enzim yang mengkatalisis pembentukan ikatan ε-(γ-glutamyl) lisin ditemukan pada berbagai organisme. Aktivitas transglutaminase yang ditemukan pada ikan (Worratao dan Yongsawatdigul 2005), tiram (Kumazawa et al. 1997), kepiting sepatu kuda (Tachypleus tridentatus) (Tokunaga et al. 1993) serta yeast
Candida albicans (Ruizherrer et al. 1995). Transglutaminase ekstraseluler dihasilkan dari mikrob jenis Sacharomyces
cerrevisiae, Streptoverticillum sp., Streptoverticillium ladakanum, Streptoverticillium mobaraensis, Streptomyces lydicus, dan Aspergillus sp.
Transglutaminase intraseluler ditemukan pada Bacillus subtilis dan sporula
Physarium polychephalum. Enzim ini dihasilkan dari fermentasi aerob (Haard dan Simpson 2000).
5
membebaskan sebagian besar enzim degradatifnya ke dalam medium. Enzim ini berada secara berdekatan sehingga produk hasil degradasinya mudah diangkut ke dalam sel oleh mekanisme transport pada dinding sel. Pada keadaan ini resiko kehilangan produk nutrien atau makanan karena faktor difusi ke media fermentasi dapat dikurangi (Ryszka et al. 2009).
Kebutuhan media fermentasi untuk media fermentasi mikrob penghasil MTGase cukup tinggi mencapai 30% dari total biaya produksi. Alternatif penggunaan media dari sumber nonekonomis untuk produksi MTGase terus diteliti dan dikembangkan. Aktivitas transglutaminase yang dihasilkan oleh seluruh organisme tersebut tergantung pada Ca2+, kecuali bakteri dan tumbuhan (Portilla-Rivera et al. 2009).
Streptomyces sp.
Streptomyces memiliki ukuran besar dengan diameter antara 0,5-1,0 m. Ciri pemersatu ialah pleomorfisme sel-selnya dan kecenderungan membentuk filamen (hifa) bercabang. Pada beberapa spesies, hifa-hifa itu bersatu membentuk miselium. Streptomyces bersifat aerobik, yaitu tumbuh pada kondisi lingkungan yang banyak oksigen atau konsentrasi karbondioksida sedikit. Bakteri ini juga bersifat kemoorganotrof dan mesopilik. Streptomyces mampu tumbuh optimum pada temperatur 25 ˚C dan pH 6,5-8,0. Bakteri ini kebanyakan hidup saprofit pada tanah, bakteri ini juga dapat ditemukan pada tumbuhan yang membusuk.
Streptomyces sp. dapat memproduksi senyawa volatil yaitu geosmin yang memiliki bau khas pada tanah. Reproduksi bakteri yang termasuk
Streptoverticillium terjadi dari salah satu miselium aerial atau dari germinasi
spora. Spora tersebut memiliki permukaan yang halus sampai sedikit kasar (Madigan et al. 2012).
Setiap cabang vertisil memiliki puncak cabang (umbel) yang terdiri atas dua atau beberapa rantai spora yang berbentuk bola dan spiral. Beberapa spesies menghasilkan pigmen yang dapat larut, substrat berwarna dan aerial mycelium. Bakteri ini resisten pada lysozyme dan neomycin serta mampu menghasilkan komponen yang menunjukkan aktivitas seperti antifungi, antibakteri, antiprotozoa dan antitumor serta sensitif terhadap agen antibakteri dan actinophage.
Streptomyces termasuk ke dalam kelompok bakteri Gram-positif. Dinding selnya mengandung L-diaminopimelic acid (L-DAP). Kandungan utama sel bakteri ini adalah saturated, iso- dan anteiso-fatty acid,
MK-9 (H6) dan MK-MK-9 (H8) menaquinone serta phospholipid (diphosphatidylglycerol,
phosphatidylethanolamine, phosphatidylinositol dan phosphatidylinositol mannoside) (Holt et al.1994).
Media Pertumbuhan Mikrob
6
pasti. Media sintetik mempunyai keuntungan, antara lain setiap komponen dapat diubah, disamping kesalahan atau kelainan yang mungkin terjadi selama fermentasi akibat komposisi media dapat dicegah.
Mikrob memerlukan nutrien dengan komposisi tertentu untuk tumbuh dan membelah diri. Komposisi nutrien untuk pertumbuhan mikrob tergantung dari jenis mikrob. Sejumlah mineral dan unsur hara terdapat di dalam tubuh mikrob untuk menjalankan fungsi khusus, misanya K, Na, Ca, Mg, Fe, Co, Cu, Zn, dan Mo. Kandungan kimiawi ini mempengaruhi kebutuhan nutrien untuk menunjang penggandaan sel dan pertumbuhannya (Madigan et al. 2012).
Gula sederhana, yaitu glukosa, merupakan sumber karbon yang mudah dicerna dan digunakan mikrob sebagai sumber energi. Penggunaan glukosa dalam media harus dibatasi, karena selain pertimbangan ekonomis juga untuk menghindari efek represi produksi enzim (Suhartono 1989). Bakteri akan melakukan hidrolisis secara perlahan pada media yang mengandung senyawa karbon dan sumber nitrogen untuk mencegah proses yang menyebabkan fase lag menjadi berkepanjangan sehingga mempengaruhi sifat pertumbuhan dan
pembentukan produk yang menyebabkan penurunan aktivitas enzim (Bierbaum et al. 1994). Pemilihan sumber nutrien untuk menumbuhkan mikrob
yang diinginkan dalam memproduksi enzim tergantung jenis mikrob dan kebutuhannya, ketersediaan di lingkungan industri fermentasi dan faktor biaya. Zat nutrien utama bagi pertumbuhan mikrob adalah sumber karbon, nitrogen dan mineral terutama fosfat (Tabel 2).
Tabel 2 Kebutuhan utama zat nutrien bagi mikrob dan bentuk yang dimanfaatkan
Zat Nutrien Bentuk yang dimanfaatkan Sumber karbon
1. Glukosa/sukrosa Glukosa/sukrosa murni
Glukosa/sukrosa sebagai hasil penguraian maltosa, pati dan selulosa
2. Lemak Minyak, lemak tumbuhan, lemak hewan, golongan hidrokarbon
Sumber nitrogen
1. N-Anorganik Garam nitrat, amonium
2. N-Organik Teung kedelai, pepton, ekstrak khamir, cairan jagung, limbah
Sumber mineral Garam-garam anorganik
Sumber: Suhartono (1989)
7
amino atau nitrogen dan vitamin B untuk pertumbuhannya, yaitu vitamin B1 (thiamin), B2 (riboflavin), B6 (piridoksin), dan B12 (kobalamin). Vitamin B digunakan dalam pembentukan koenzim yang akan berikatan dengan enzim dengan ikatan yang tidak begitu kuat (Suhartono 1989).
Kebutuhan nutrisi mikrob terlihat dalam unsur-unsur yang tersusun dalam selnya. Susunan kimia sel mikrob relatif tetap, baik unsur kimia maupun senyawa yang terkandung di dalam sel. Komponen utama yang menyusun sel bakteri adalah C, H, O, P, dan S yang jumlahnya 95% dari berat kering sel, sedangkan sisanya tersususn dari unsur-unsur lain (Madigan et al. 2012).
Karakterisasi Biokimia Enzim
Aktivitas enzim dipengaruhi oleh beberapa faktor tertentu yang menentukan efektivitas kerja suatu enzim. Apabila faktor pendukung tersebut berada pada kondisi yang optimum, maka kerja enzim juga akan optimal. Hasil karakterisasi enzim walaupun masih bersifat ekstrak kasar, namun dapat menggambarkan karakter enzim di dalamnya. Kondisi lingkungan harus menunjang kondisi yang dibutuhkan enzim untuk dapat berfungsi sebagai katalis reaksi.
Suhu
Reaksi enzim umumnya terdiri atas beberapa tahapan reaksi dan respon terhadap suhu dari masing-masing tahap berbeda. Setiap enzim memiliki aktivitas pada suhu tertentu. Aktivitas enzim akan meningkat dengan peningkatan suhu, akan tetapi setelah suhu optimum tercapai maka yang terjadi adalah sebaliknya, yaitu akan menurun dengan peningkatan suhu. Hal ini disebabkan telah terdenaturasinya protein enzim (Lehninger 2008).
8
pH
Enzim memiliki pH optimum dimana enzim mempunyai aktivitas maksimal. Enzin dengan pH rendah atau pH tinggi dapat pula menyebabkan terjadinya proses denaturasi dan ini akan mengakibatkan menurunnya aktivitas enzim (Hames dan Hoper 2005). Nilai pH optimum tidak perlu sama dengan pH lingkungan normalnya, dengan pH yang mungkin sedikit berada di atas atau di bawah pH optimum. Aktivitas katalitik enzim di dalam sel mungkin diatur sebagian oleh perubahan pada pH medium lingkungan (Lehninger 2008).
Pada umumnya, enzim bersifat ampolitik, yang berarti enzim mempunyai konstanta disosiasi pada gugus asam maupun gugus basanya terutama pada gugus residu terminal karboksil dan gugus terminal aminonya. Diperkirakan perubahan keaktifan enzim ini adalah akibat perubahan pH lingkungan. Perubahan pH lingkungan ini terjadi karena adanya perubahan ionisasi pada gugus ionik enzim pada sisi aktifnya atau sisi lain yang secara tidak langsung mempengaruhi sisi aktif. Gugus ionik berperan dalam menjaga konformasi sisi aktif dalam meningkatkan substrat menjadi produk. Perubahan ionisasi juga dapat dialami oleh substrat atau kompleks enzim-substrat, yang juga berperan terhadap aktivitas enzim (Lehninger 2008).
Ion logam
Banyak enzim yang memerlukan tambahan komponen kimia bagi aktivitasnya. Komponen ini disebut dengan kofaktor. Kofaktor bisa berupa molekul anorganik, seperti ion Fe2+, Mn2+, Zn2+, atau mungkin juga suatu molekul organik kompleks yang disebut koenzim, seperti thiamin pirofosfat, FAD, serta koenzim A. Beberapa enzim membutuhkan baik koenzim maupun satu atau lebih ion logam bagi aktivitasnya. Pada beberapa enzim, koenzim atau ion logam
lainnya hanya terikat secara lemah atau dalam waktu sementara (Hames dan Hoper 2005). Akan tetapi pada enzim lain senyawa ini terikat secara
kuat dan permanen, dalam hal ini disebut gugus protetik. Enzim yang strukturnya sempurna dan aktif mengkatalisis bersama-sama dengan koenzim atau gugus logamnya disebut haloenzim. Koenzim dan ion logam bersifat stabil selama pemanasan, sedangkan bagian protein enzim disebut apoenzim akan terdenaturasi oleh pemanasan (Lehninger 2008).
Ion logam mempunyai peranan penting dalam menjaga kestabilan enzim. Logam biasanya berperan sebagai pengatur aktivitas enzim (Lehninger 2008). Ion
logam dapat mengaktifkan enzim melalui berbagai kemungkinan seperti: (a) menjaga bagain internal enzim, (b) menghubungkan enzim dengan substrat,
(c) mengubah konstanta keseimbangan reaksi enzim, (d) merubah tegangan permukaan protein enzim, (e) menghilangkan inhibitor, (f) menggantikan ion logam yang tidak efektif pada sisi aktif enzim maupun substrat, dan (g) merubah konformasi enzim menjadi konformasi yang lebih aktif (Belitz et al. 2009.).
9
Senyawa inhibitor
Inhibitor merupakan senyawa yang cenderung menurunkan kecepatan reaksi yang dikatalisis oleh enzim. Inhibitor dapat bereaksi dengan substrat, kofaktor atau dengan enzim langsung. Microbial transglutaminase tidak dipengaruhi ion logam Ca2+, sehingga adanya senyawa pengkelat logam, seperti
ethylenediamine tetraacetic acid (EDTA) tidak menghambat aktivitasnya (Lin et al.2008). Sebaliknya, transglutaminase yang dipengaruhi ion logam Ca2+
dapat dihambat oleh EDTA, misalnya tilapia transglutaminase. Aktivitas
microbial transglutaminase dapat dihambat kuat oleh (p-Chloromercuribenzoate) PCMB serta sedikit dihambat oleh (N-ethylmaleimide) NEM dan (Phenyl methyl sulfonyl fluoride) PMSF (Worratao dan Yongsawatdigul 2005).
Ultrafiltrasi
Berdasarkan ukuran pori, membran dapat dibagi menjadi empat macam, yaitu membran mikrofiltrasi, ultrafiltrasi (UF), nanofiltrasi, dan reverse osmosis
(RO) (Gambar 2). Membran UF adalah membran yang berada di antara membran mikrofiltrasi dan nanofiltrasi. Ukuran pori membran berkisar antara 5 nm sampai
dengan 0,1 m (Gutman 1λ87). Membran UF digunakan untuk memisahkan
makromolekul dan koloid dari larutannya. Membran UF dan mikrofiltrasi merupakan membran porous dimana rejeksi zat terlarut sangat dipengaruhi oleh ukuran dan berat zat terlarut relatif terhadap ukuran pori membran. Membran UF memiliki struktur yang asimetris dengan lapisan atas yang lebih dense (ukuran pori lebih kecil dan porositas permukaan lebih rendah) sehingga tahanan hidrodinamiknya akan lebih besar (Mulder 1996).
Gambar 2 Kisaran ukuran pori membran (Gutman 1987)
Fraksinasi protein dengan cepat menjadi lebih selektif melalui kemajuan rancangan membran dan modul. Teknik separasi dengan membran membutuhkan biaya yang lebih rendah dan dapat digunakan dalam skala besar untuk produksi secara komersial. Teknik membran memiliki kekurangan, antara lain selektivitas membran dan fouling yang disebabkan absorpsi protein selama proses filtrasi yang dapat menjadi penghalang pada aplikasi UF selanjutnya (Larive et al. 1999). Oleh karena itu dibutuhkan pretreatment yang sesuai sebelum proses UF. Pretreatment
10
menyediakan permeat yang bersih sebagai umpan untuk mendapatkan komponen
yang diinginkan dengan proses UF sehingga dapat mereduksi fouling
(Li et al. 2008).
Teknik Pemisahan dengan Membran Ultrafiltrasi
Proses pemisahan dengan membran telah berkembang dan digunakan di dalam berbagai bidang, diantaranya ialah pada proses produksi air minum. Hal utama yang membedakan proses pemisahan membran dengan proses pemisahan konvensional lainnya ialah digunakannya suatu membran sebagai media pemisahan. Membran dalam bentuk padatan maupun cairan dapat memisahkan suatu permukaan antarmuka antara dua fasa. Membran ini berfungsi sebagai lapisan permselektif yang mengatur laju perpindahan suatu komponen dari campurannya. Membran tersebut dapat bersifat netral atau memiliki muatan listrik, dapat berpori (porous) atau tidak berpori (non-porous) (Gambar 3) .
Gambar 3 Prinsip proses pemisahan dengan membran
Aliran umpan (feed) dimasukkan ke dalam modul membran. Pada modul ini, aliran umpan dipisahkan menjadi dua aliran, yaitu aliran permeat dan aliran retetntat. Aliran permeat adalah aliran komponen yang dapat melewati membran, sedangkan aliran retentat adalah aliran komponen yang tidak dapat melewati membran. Proses pemisahan dengan membran terjadi akibat adanya gaya dorong (driving dorce) yang memungkinkan terjadinya perpindahan masa dari satu fasa ke fasa yang lain melalui membran. Gaya dorong tersebut dapat berupa gradien
atau perbedaan konsentrasi, tekanan, potensial elektrik, atau temperatur (Mulder 1996).
Modul Membran
Retentat Umpan
11
3 METODE
Bahan
Bahan utama yang digunakan pada penelitian ini yaitu isolat
Streptomyces sp. TTA 02 SDS 14 yang diperoleh dari koleksi Puslit Bioteknologi LIPI. Isolat ini berasal dari Bima, Nusa Tenggara Barat dan diisolasi dari tanah.
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari 2015 sampai bulan September 2015 dan bertempat di Laboratorium Bioteknologi, Balai Besar Penelitian dan Pengembangan Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan (BBP4BKP), Kementrian Kelautan dan Perikanan.
Tahapan Penelitian
12
Optimasi Produksi Enzim MTGase
Penyegaran Isolat Streptomyces sp. Galur SDS 14/LU
Stok kultur dari liofilisasi dilakukan penyegaran dalam media
International Streptomyces Project (ISP-2). Media terdiri atas ekstrak khamir 0,4%, ekstrak malt 1%, dan glukosa 0,4% selanjutnya diinkubasi pada suhu 30 ˚C dengan kecepatan agitasi 125 rpm selama 5 hari. Selanjutnya penyegaran kultur
Streptomyces dilakukan pada media ISP agar-agar. Media tersebut dibuat dari media penyegaran ISP-2 dan ditambahkan agar-agar sebanyak 2% (b/v), isolat
Streptomyces disebar pada media agar-agar selanjutnya diinkubasi pada suhu
30 ˚C selama 5 hari. Penyegaran dilakukan berulang-ulang sebelum digunakan.
Optimasi Kondisi Produksi Enzim MTGase
Optimasi kondisi produksi enzim MTGase dilakukan untuk mendapatkan suhu dan pH optimum dalam memproduksi enzim oleh Streptomyces sp. Kegiatan dilakukan dengan cara memvariasikan pH media (6-8) dan suhu inkubasi (25 ˚C, 30 ˚C, 35 ˚C). Inkubasi dilakukan pada inkubator bergoyang dengan kecepatan agitasi 125 rpm selama 5 hari. Optimasi media dilakukan dengan menggunakan media Tellez-luiz et al. 2004.
Optimasi Media Produksi enzim MTGase
Optimasi media produksi dilakukan untuk mendapatkan media produksi terbaik dari beberapa literatur, sehingga didapatkan media produksi yang menghasilkan aktivitas enzim yang tinggi. Komposisi media produksi disajikan pada Tabel 3.
Tabel 3 Komposisi media produksi enzim
13
Pembuatan starter menggunakan media cair dengan berbagai komposisi media produksi yang berbeda. Sebanyak 10% starter dimasukkan secara aseptik
pada masing-masing media produksi berisi 50 ml menggunakan erlenmeyer 200 ml. Starter ditumbuhkan pada kondisi produksi optimum dan diinkubasi pada
inkubator bergoyang dengan kecepatan agitasi 125 rpm selama 5 hari. Setiap hari dilakukan pengambilan sampel kultur setiap 24 jam sebanyak 1,5 ml. Kultur sampel disentrifugasi dengan kecepatan 8.000 g pada suhu 4 ˚C selama 15 menit untuk memperoleh ekstrak kasar enzim. Ekstrak kasar enzim lalu diukur aktivitasnya.
Optimasi Waktu Produksi Enzim MTGase
Optimasi waktu produksi dilakukan untuk mengetahui waktu optimum dalam memproduksi enzim dengan aktivitas yang tinggi. Optimasi waktu produksi ini dimulai dengan menyegarkan isolat Streptomyces sp. pada media yang mengandung agar-agar selanjutnya diinkubasi pada suhu 25 ˚C selama 5 hari kemudian sebanyak 0,05 g (b/b) isolat Streptomyces sp. dipindahkan pada media starter cair lalu diinkubasi pada suhu 25 ˚C selama 3 hari. Sebanyak 10% (v/v)
starter dimasukkan secara aseptik ke dalam media hasil optimasi produksi (Tabel 1) berisi 15 ml dalam beberapa erlenmeyer 50 ml. Kultur bakteri
diinkubasi dengan kecepatan agitasi 125 rpm dan suhu suhu 25 ˚C selama 6 hari. Pengamatan dilakukan setiap 12 jam dengan mengambil sampel sebanyak 2 ml dan menyentrifugasinya dengan kecepatan 8000 g pada suhu 4 ˚C selama 15 menit. Parameter yang diukur pada kegiatan ini yaitu biomassa mikrob dan aktivitas enzim.
Tujuan pengukuran biomassa yaitu untuk mengetahui waktu yang tepat untuk mengetahui pola pertumbuhan dari Streptomyces sp. galur SDS 14/LU. Pengukuran biomassa dilakukan dengan mengukur bobot biomassa sel kering menggunakan timbangan digital. Endapan yang diperoleh dari hasil sentrifugasi
dikeringkan dalam oven (105 ˚C) selama 24 jam kemudian ditimbang bobotnya. Biomassa sel tersebut selanjutnya diplotkan untuk memperoleh kurva pertumbuhan. Penentuan biomassa ditentukan berdasarkan bentuk kurva yang dihasilkan. Persamaan dicantumkan untuk memperoleh biomassa bakteri:
Biomassa = (bobot biomassa bakteri+bobot tabung mikro) – bobot tabung mikro
Produksi Enzim MTGase
Produksi enzim MTGase dilakukan dengan menyegarkan isolat
Streptomyces sp. pada media yang mengandung agar-agar selanjutnya diinkubasi
pada suhu 30 ˚C selama 5 hari kemudian sebanyak satu ose isolat
Streptomyces sp. dipindahkan pada media starter cair lalu diinkubasi pada pada inkubator bergoyangdengan kecepatan agitasi 125 rpm pada suhu 30 ˚C selama 4 hari.
14
dari hasil pengukuran produksi enzim. Kultur sampel disentrifugasi dengan kecepatan 8.000 g pada suhu 4 ˚C selama 15 menit. Supernatan yang diperoleh merupakan enzim ekstrak kasar yang akan dipekatkan dengan ultrafiltrasi. Enzim ekstrak kasar dilakukan filtrasi menggunakan alat ultrafiltrasi Watson Marlow 323
dengan ukuran filter membran 10.000 MWCO dengan luas permukaan filter 110 cm2.
Uji Aktivitas MTGase
Aktivitas MTGase diukur berdasarkan pembentukan hidroksimat dari
N-carbobenzoxyl-L-glutaminilglycine (CBZ) (Ho et al. 2000). Sebanyak 100 µl sampel supernatan direaksikan dengan substrat (25 µl 0,1 M Glutation, 25 µl 2,0 M Hydroxylamine dan 75 µl 0,1 M N-carbobenzoxyl-L-glutaminilglycine/CBZ)
dan 200 µl 0,1 M bufer Tris asetat pH 6, kemudian diinkubasi pada suhu 37 ˚C
selama 1 jam dan dihentikan dengan penambahan 425 µL FeCl3 5% (15% TCA
yang mengandung 5% FeCl3). Selanjutnya hasil reaksi diinkubasi kembali pada
suhu 37 ˚C selama 30 menit. Lalu supernatan diukur absorbansinya dengan
spektrofotometer pada panjang gelombang 525 nm. Kurva standar dibuat
dengan menggunakan L-glutamic acid-γ-monohydroxamic acid sebagai standar (Lampiran 1). Satu unit aktivitas MTGase didefinisikan sebagai jumlah pembentukan 1 µmol hikdroksamat dalam waktu 1 menit pada suhu 37 ˚C.
Karakterisasi Enzim
Penentuan pH Optimum terhadap Aktivitas Enzim
Pengaruh pH terhadap aktivitas enzim diuji dengan menambahkan 100 µL ekstrak enzim ultrafiltrasi yang direaksikan dengan 125 µL substrat dan 200 µL bufer dengan berbagai variasi pH (pH 4-9). Bufer yang digunakan dalam penentuan pH optimum ialah 200 mM bufer sitrat (pH 4-6), 200 mM bufer fosfat (pH 6-8), dan 200 mM bufer Tris-HCl (pH 8-9) (El-Hofi et al. 2014). Aktivitas enzim transglutaminase diukur sesuai dengan prosedur pengujian sebelumnya.
Penentuan Suhu Optimum terhadap Aktivitas Enzim
Pengaruh suhu terhadap aktivitas enzim dilakukan dengan mereaksikan 100 µL ekstrak enzim ultrafiltrasi dengan 125 µL substrat dan 200 µL bufer pada pH optimum. Enzim yang telah dicampurkan dengan substrat dan bufer kemudian diinkubasi pada tingkatan suhu 25, 30, 35, 37, 40, 45, 50, 55, 60, 65 dan 70 ˚C selama 1 jam waktu inkubasi (El-Hofi et al. 2014). Aktivitas enzim transglutaminase diukur sesuai dengan prosedur pengujian sebelumnya.
Penentuan Ketahanan Enzim terhadap Panas
15
persentase penurunan aktivitas relatif dari aktivitas relatif tertinggi (100%) yaitu
pada suhu dan pH optimumnya di kondisi pengujian sebelumnya (El-Hofi et al. 2014). Aktivitas enzim transglutaminase diukur sesuai dengan
prosedur pengujian sebelumnya.
Pengaruh Ion Logam terhadap Aktivitas Enzim
Pengaruh ion logam terhadap aktivitas enzim transglutaminase diketahui dengan menggunakan 1 mM ion logam. Aktivitas diukur pada kondisi optimum enzim, dan dibandingkan dengan kontrol, yaitu enzim tanpa penambahan ion logam. Ion logam yang diujikan meliputi kation: Na+, K+, Li+, Cu+, Ca2+, Mg2+, Zn2+, dan Fe3+ dalam bentuk larutan garam klorida (Lin et al. 2008). Setiap kation disiapkan 1000 mL dengan konsentrasi 500 mM sebagai larutan stok.
Pengaruh Inhibitor terhadap Aktivitas Enzim
16
4 HASIL DAN PEMBAHASAN
Hasil
Peremajaan Isolat Streptomyces sp. Galur TTA 02 SDS 14
Isolat TTA 02 SDS 14 yang digunakan pada penelitian ini diperoleh dari koleksi Puslit Bioteknologi LIPI, isolat ini berasal dari Bima, Nusa Tenggara Barat yang diisolasi dari tanah (Gambar 5). Isolat TTA 02 SDS 14 yang tumbuh pada media International Streptomyces Project (ISP-2) merupakan bakteri
Streptomyces sp. yang mampu menghasilkan enzim transglutaminase setelah dilakukan penapisan dan pengujian enzim. Karakter isolat TTA 02 SDS 14 setelah dilakukan penapisan secara umum memiliki koloni yang menyerupai hifa dan berfilamen, serta mampu menghasilkan warna merah. Bakteri ini termasuk Gram positif.
(a) (b)
Gambar 5 Isolat Streptomyces sp. galur TTA 02 SDS 14. (a) koloni; (b) sel (perbesaran 100x)
Optimasi Kondisi Produksi Enzim MTGase
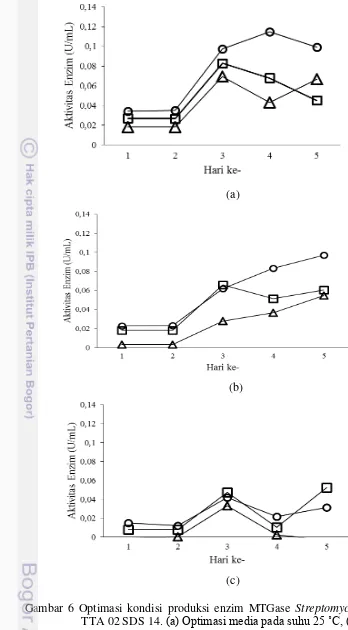
Isolat Streptomyces sp. galur TTA 02 SDS 14 mampu memproduksi enzim MTGase dari hari pertama hingga hari keempat namun pada hari kelima
mengalami penurunan pada kondisi produksi suhu 25 ˚C dengan pH 6,0 (Gambar 6a). Produksi enzim pada hari keempat pada pH 6,0 ditunjukkan dengan
17
(a)
(b)
(c)
Gambar 6 Optimasi kondisi produksi enzim MTGase Streptomyces sp. galur TTA 02 SDS 14. (a) Optimasi media pada suhu 25 ˚C, (b) Optimasi
media pada suhu 30 ˚C, (c) Optimasi media pada suhu 35 ˚C,
18
Enzim MTGase mampu diproduksi pada kondisi produksi suhu 30 ˚C dengan pH 6,0 dan pH 8,0. Produksi enzim MTGase dari hari pertama hingga hari kelima menunjukkan nilai aktivitas tertinggi pada hari kelima yaitu sebesar 0,0972 U/mL pada pH 6,0 dan sebesar 0,0547 U/mL pada pH 8,0 (Gambar 6b). Produksi enzim MTGase pada pH 6,0 memiliki nilai aktivitas lebih tinggi dibandingkan dengan pH 8,0. Pada pH 7,0 enzim mampu diproduksi dari hari pertama hingga hari ketiga dan pada hari keempat produksi enzim MTGase mulai menurun hingga hari kelima. Nilai aktivitas enzim pada hari ketiga dengan pH 7,0 yaitu sebesar 0,0658 U/mL.
Isolat Streptomyces sp. galur TTA 02 SDS 14 pada kondisi produksi suhu
35 ˚C dengan pH 6,0, 7,0, dan 8,0 memiliki pola kurva yang sama dalam memproduksi enzim MTGase (Gambar 6c). Pada hari pertama hingga hari ketiga produksi enzim meningkat dan pada hari keempat mengalami penurunan hingga hari kelima. Kondisi produksi enzim MTGase pada suhu 35 ˚C memiliki nilai aktivitas tertinggi pada pH 7,0 yaitu sebesar 0,0476 U/mL.
Hasil optimasi kondisi produksi menggunakan suhu inkubasi dan pH media yang berbeda dapat disimpulkan bahwa Streptomyces sp. galur TTA 02 SDS 14 mampu memproduksi enzim MTGase pada suhu 25 ºC dengan pH media 6,0 di hari keempat dengan nilai aktivitas tertinggi sebesar 0,1148 U/mL. Pada
kondisi produksi dengan suhu inkubasi 30 ˚C dan 35 ˚C memiliki nilai aktivitas
yang lebih rendah dibandingkan dengan suhu inkubasi 25 ˚C dalam memproduksi enzim MTGase.
Optimasi Media Produksi Enzim MTGase
Pengujian keenam jenis media untuk produksi enzim MTGase terdiri atas komponen utama, yaitu: sumber karbon, sumber nitrogen, vitamin, dan mineral. Komposisi tersebut merupakan sumber nutrien yang diperlukan mikrob untuk tumbuh dan membelah diri dari media pertumbuhannya.
Gambar 7 Optimasi media produksi enzim MTGase Streptomyces sp. galur TTA 02 SDS 14. Tellez – Luiz et al. 2004a,
19
Media Tellez-Luiz et al. (2004a) dan (2004b) menggunakan pepton dan ekstrak khamir sebagai sumber nitrogen serta menggunakan gliserol sebagai sumber karbon. Pada media Telez-Luiz et al. (2004a) produksi enzim meningkat dari hari pertama hingga hari ketiga selanjutnya produksi enzim MTGase mengalami penurunan secara bertahap hingga hari kelima. Produksi enzim pada hari ketiga ditunjukkan dengan nilai aktivitas sebesar 0,0658 U/mL. Produksi
enzim pada media Tellez-Luiz et al. (2004b) berbeda dengan media Telez-Luiz et al. (2004a) yaitu enzim MTGase membutuhkan waktu yang lebih
lama, dilihat dari peningkatan produksi enzim MTGase dari hari pertama hingga hari keempat, selanjutnya aktivitas enzim menurun pada hari kelima. Produksi enzim pada hari keempat pada media Telez-Luiz et al. (2004b) ditunjukkan dengan nilai aktivitas sebesar 0,1294 U/mL. Produksi enzim MTGase pada media Tellez-Luiz et al. (2004b) memiliki nilai aktivitas yang lebih tinggi dibandingkan dengan media Tellez-Luiz et al. (2004a), meskipun waktu produksi enzim MTGase pada media Telez-Luiz et al. (2004b) lebih lama.
Media Bahrim et al. (2010) menggunakan tepung kedelai, tepung jagung, dan pepton sebagai sumber nitrogen serta menggunakan glukosa sebagai sumber karbon. Pada media ini produksi enzim MTGase meningkat dari hari pertama hingga hari keempat selanjutnya produksi enzim mengalami penurunan pada hari kelima. Produksi enzim MTGase pada hari keempat memiliki nilai aktivitas sebesar 0,1454 U/mL.
Media Macedo et al. (2007) menggunakan tepung kedelai, tepung jagung, pepton, dan ekstrak khamir sebagai sumber nitrogen serta menggunakan pati terlarut dan glukosa sebagai sumber karbon. Produksi enzim pada media ini mengalami peningkatan dari hari pertama hingga hari keempat dan produksi enzim mulai menurun pada hari kelima. Nilai aktivitas enzim dalam memproduksi enzim pada hari keempat sebesar 0,049 U/mL (Gambar 7).
Produksi enzim menggunakan media Aidaross et al. (2011) menggunakan pepton dan ekstrak khamir sebagai sumber nitrogen serta menggunakan pati terlarut sebagai sumber karbonnya. Pada media inienzim MTGase diproduksi dari hari pertama hingga hari keempat selanjutnya produksi enzim mengalami penurunan aktivitas. Produksi enzim pada hari keempat memiliki nilai aktivitas sebesar 0,054 U/mL.
Media Zhu et al. (1996) menggunakan pepton dan ekstrak khamir serta menggunakan glukosa sebagai sumber karbon. Produksi enzim MTGase meningkat dari hari pertama hingga hari ketiga, namun pada hari keempat produksi enzim mulai menurun hingga hari kelima. Aktivitas tertinggi dalam produksi enzim yaitu sebesar 0,083 U/mL pada hari ketiga.
20
Optimasi Waktu Produksi Enzim MTGase
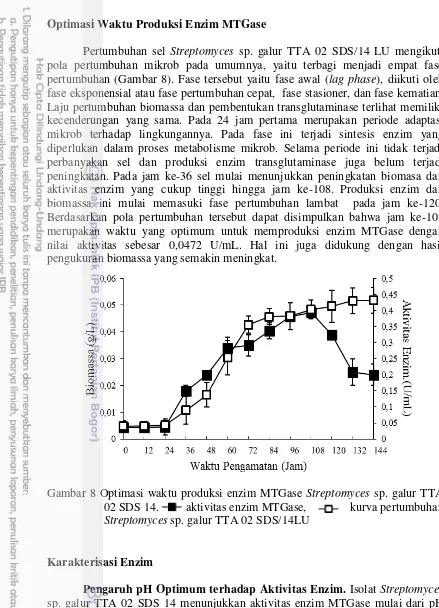
Pertumbuhan sel Streptomyces sp. galur TTA 02 SDS/14 LU mengikuti pola pertumbuhan mikrob pada umumnya, yaitu terbagi menjadi empat fase pertumbuhan (Gambar 8). Fase tersebut yaitu fase awal (lag phase), diikuti oleh fase eksponensial atau fase pertumbuhan cepat, fase stasioner, dan fase kematian. Laju pertumbuhan biomassa dan pembentukan transglutaminase terlihat memiliki kecenderungan yang sama. Pada 24 jam pertama merupakan periode adaptasi mikrob terhadap lingkungannya. Pada fase ini terjadi sintesis enzim yang diperlukan dalam proses metabolisme mikrob. Selama periode ini tidak terjadi perbanyakan sel dan produksi enzim transglutaminase juga belum terjadi peningkatan. Pada jam ke-36 sel mulai menunjukkan peningkatan biomasa dan aktivitas enzim yang cukup tinggi hingga jam ke-108. Produksi enzim dan biomassa ini mulai memasuki fase pertumbuhan lambat pada jam ke-120. Berdasarkan pola pertumbuhan tersebut dapat disimpulkan bahwa jam ke-108 merupakan waktu yang optimum untuk memproduksi enzim MTGase dengan nilai aktivitas sebesar 0,0472 U/mL. Hal ini juga didukung dengan hasil pengukuran biomassa yang semakin meningkat.
Gambar 8 Optimasi waktu produksi enzim MTGase Streptomyces sp. galur TTA 02 SDS 14. aktivitas enzim MTGase, kurva pertumbuhan
Streptomyces sp. galur TTA 02 SDS/14LU
Karakterisasi Enzim
Pengaruh pH Optimum terhadap Aktivitas Enzim. Isolat Streptomyces
21
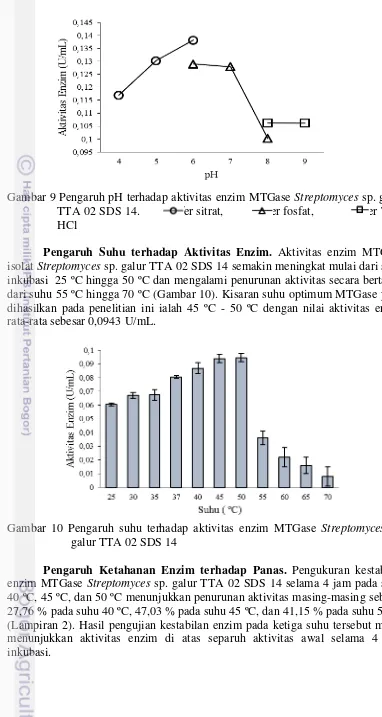
Gambar 9 Pengaruh pH terhadap aktivitas enzim MTGase Streptomyces sp. galur TTA 02 SDS 14. bufer sitrat, bufer fosfat, bufer Tris-HCl
Pengaruh Suhu terhadap Aktivitas Enzim. Aktivitas enzim MTGase isolat Streptomyces sp. galur TTA 02 SDS 14 semakin meningkat mulai dari suhu inkubasi 25 ºC hingga 50 ºC dan mengalami penurunan aktivitas secara bertahap dari suhu 55 ºC hingga 70 ºC (Gambar 10). Kisaran suhu optimum MTGase yang dihasilkan pada penelitian ini ialah 45 ºC - 50 ºC dengan nilai aktivitas enzim rata-rata sebesar 0,0943 U/mL.
Gambar 10 Pengaruh suhu terhadap aktivitas enzim MTGase Streptomyces sp. galur TTA 02 SDS 14
22
Gambar 11 Pengaruh ketahanan panas terhadap aktivitas enzim MTGase
Streptomyces sp. galur TTA 02 SDS 14/LU suhu 40 ºC, suhu 45 ºC, suhu 50 ºC.
Pengaruh Ion Logam terhadap Aktivitas Enzim. Setiap enzim membutuhkan ion logam yang berbeda dalam jenis dan jumlah yang bersifat spesifik. Pengaruh ion logam terhadap aktivitas enzim menunjukkan bahwa aktivitas relatif enzim MTGase terhadap pengaruh ion logam yang dibandingkan dengan kontrol akan meningkat aktivitasnya oleh ion Na+, K+, Ca2+, dan Mg2+, sedangkan ion logam Li+, Cu+, Zn2+ dan Fe3+ tidak meningkatkan aktivitas MTGase (Gambar 12). Ion logam Cu+ mampu menurunkan aktivitas relatif MTGase sekitar 80,41% dari aktivitas awal. Berdasarkan hasil pengujian diketahui bahwa aktivitas enzim tertinggi terdapat pada penambahan ion logam Ca+ sebesar 0,194 U/mL dengan peningkatan aktivitas relatif 32,9%. Sementara itu, penambahan ion logam lainnya seperti K+, Mg2+, dan Na+ memberikan peningkatan aktivitas relatif hampir sama sekitar 9-17% (Lampira 2).
Gambar 12 Pengaruh ion logam terhadap aktivitas enzim MTGase
23
Pengaruh Inhibitor terhadap Aktivitas Enzim. Enzim sangat peka terhadap senyawa yang diikatnya. Apabila aktivitas enzim menjadi turun akibatnya bereaksi dengan antar senyawa maka senyawa ini disebut inhibitor. Aktivitas relatif MTGase isolat Streptomyces sp. galur TTA 02 SDS 14 terhadap pengaruh inhibitor menunjukkan peningkatkan aktivitas MTGase oleh IAA dengan konsentrasi 1mM (Gambar 13). PMSF 1 mM dan 5 mM menurunkan aktivitas MTGase, sedangkan penambahan EDTA dan DPB konsentrasi 1 mM tidak menunjukkan pengaruh dibandingkan kontrol tanpa perlakuan. Semakin besar kadar inhibitor yang ditambahkan, maka semakin besar pula hambatannya. Penambahan EDTA, PMSF, dan IAA masing-masing pada konsentrasi 5 mM menunjukkan penurunan aktivitas sebesar 18,39 % hingga 25,3%. Penambahan DPB 5 mM menunjukkan aktivitas enzim yang sedikit (9,23%) dibandingkan kontrol (Lampiran 2).
Gambar 13 Pengaruh inhibitor terhadap aktivitas enzim MTGase Streptomyces sp. galur TTA 02 SDS 14. 1 mM, 5 mM.
Pembahasan
Streptomyces sp. galur TTA 02 SDS/14 LU mampu menghasilkan enzim transglutaminase secara ektraseluler pada suhu 25 ºC dengan pH media 6,0 selama 4 hari (108 jam). Menurut Ando et al. (1989), Streptomyces sp. tidak toleran terhadap asam dan jumlahnya menurun pada keadaan lingkungan di bawah pH 5,0. Rentang pH yang paling cocok untuk perkembangbiakan Streptomyces sp. antara 6,0-8,0. Muffarika et al. (2014) menyatakan bahwa kondisi pH lingkungan medium yang optimum akan mendukung produksi enzim yang lebih maksimum.
Suhu optimum yang cocok untuk pertumbuhan aktinomiset yaitu 25-30 ˚C (Rao 2001; Madigan et al. 2012). Muffarika et al. (2014) menyatakan bahwa suhu
minimum dan suhu di atas maksimum akan menghentikan enzim untuk berproduksi. Sel tidak dapat tumbuh dengan baik sehingga mengalami kematian bahkan pada suhu yang terlalu tinggi akan terjadi denaturasi enzim.
24
produksi dengan media Bahrim et al. menghasilkan aktivitas tertinggi dibandingkan dengan ke lima media produksi lainnya. Menurut Kieliszek dan Misiewicz (2014), sumber nutrisi pada media Bahrim et al. digunakan untuk biosintesis enzim transglutaminase. Biosintesis enzim ini biasanya dipengaruhi oleh katabolit yang terdapat pada media fermentasi. Beberapa sumber karbon merupakan sumber energi yang dapat menimbulkan pengaruh induktif bagi sintesis enzim. Nitrogen dan mineral juga diperlukan untuk pertumbuhan mirob selama sintesis dalam memproduksi enzim transglutamninase.
Pada optimasi waktu produksi enzim transglutaminase, Streptomyces sp. memiliki fase eksponensial lebih lama karena bakteri tersebut termasuk ordo Aktinomiset (bakteri tingkat tinggi) yang melakukan produksi dengan spora. Reproduksi bakteri yang termasuk genus Streptoverticillium atau Streptomyces
terjadi dari salah satu miselium aerial atau dari germinasi spora. Spora tersebut memiliki permukaan yang halus sampai sedikit kasar (Holt et al. 1994).
Bobot kering sel maksimum diperoleh sebesar 0,4032 g/L pada jam ke-108 dengan aktivitas transglutaminase 0,0472 U/mL. Waktu optimum kultivasi transglutaminase pada penelitian ini lebih lama dibandingkan dengan hasil penelitian Ando et al. (1989) yang menunjukkan aktivitas transglutaminase yang diproduksi dari Streptoverticillium sp. S-8112 sebesar 2,5 U/mL pada jam ke-70 dan semakin menurun seiring dengan lamanya waktu kultivasi. Waktu kultivasi optimum ini sama dengan waktu kultivasi optimum produksi tansglutaminase dari
Streptoverticillium ladakanum dengan menggunakan xylose 10 g/L sebagai media pertumbuhan (Tellez-Luiz et al. 2004a) dicapai pada jam ke-72 dengan aktivitas transglutaminase yang lebih kecil 0,170 U/mL.
Aktivitas enzim dipengaruhi oleh beberapa faktor tertentu yang menentukan efektivitas kerja suatu enzim. Apabila faktor pendukung tersebut berada pada kondisi yang optimum, maka kerja enzim juga akan optimum. Hasil karakterisasi enzim walaupun masih bersifat ekstrak kasar, namun dapat menggambarkan karakter enzim di dalamnya. Kondisi lingkungan harus menunjang kondisi yang dibutuhkan enzim untuk dapat berfungsi sebagai katalis reaksi.
Semua reaksi enzim sangat dipengaruhi oleh pH, sehingga diperlukan bufer dengan pH yang tepat supaya reaksi dapat berjalan secara optimum. Transglutaminase yang merupakan enzim dan tentu saja mengikuti sifat-sifat protein pada umumnya, yaitu mempunyai konstanta disosiasi pada gugus asam maupun basa terutama pada gugus residu terminal karboksil dan terminal aminonya. Perubahan keaktifan enzim transglutaminase akibat adanya perubahan gugus ionik enzim baik pada sisi aktifnya maupun sisi lain yang secara tidak langsung mempengaruhi sisi aktif. Gugus ionik berperan dalam menjaga konformasi sisi aktif dalam mengikat substrat (Lehninger 2008).
25
Warratao dan Yongsawatdigul (2005) melaporkan bahwa pH optimum pada mama1lia dan ikan nila (Oreochromis niloticus) yaitu 7-7,5.
Penurunan aktivitas enzim karena perubahan pH disebabkan oleh berubahnya keadaan ion enzim dan seringkali juga ion substrat. Perubahan ini dapat terjadi pada residu asam amino yang berfungsi katalitik pengikat substrat maupun pada residu asam amino yang berfungsi untuk mempertahankan struktur tersier dan kuartener enzim yang aktif. Pada pH tertentu perubahan muatan ion pada rantai samping dapat terionisasi dari residu asam amino enzim sehingga mengakibatkan denaturasi enzim yang disertai dengan hilangnya aktifitas katalitik enzim (Lehninger 2008).
Suhu merupakan salah satu faktor lingkungan yang mempengaruhi kerja enzim. Setiap enzim memiliki aktivitas pada suhu tertentu. Aktivitas akan meningkat dengan meningkatnya suhu, akan tetapi setelah suhu optimum tercapai maka yang terjadi adalah sebaliknya, yaitu akan menurun dengan peningkatan suhu (Madigan et al. 2012).
Enzim transglutaminase Streptomyces sp. galur TTA 02 SDS/14 LU bekerja optimum pada kisaran suhu 45-50 ºC dengan nilai aktivitas enzim rata-rata sebesar 0,0943 U/mL (Gambar 10). Ando et al. (1989) melaporkan bahwa suhu optimum untuk aktivitas transglutaminase yaitu antara 45-55 ˚C, tergantung pada spesies Streptoverticillium. Transglutaminase dari Streptomyces mobaraense memiliki aktivitas optimum pada suhu 55 ˚C sedangkan suhu optimum untuk
transglutaminase dari Streptoverticillium griseocarneum dan Streptomyces cinnamoneus adalah 45 ˚C. Stabilitas enzim akan menurun dengan meningkatnya suhu. Aktivitas transglutaminase dari Streptomyces mobaraense bertahan lama pada suhu 40 ˚C sedangkan pada suhu di atas 50 ˚C aktivitasnya menurun. Suhu sangat mempengaruhi aktivitas enzim untuk bekerja secara optimal, setiap enzim memiliki suhu optimum yang berbeda-beda. Motoki dan Seguro (1998) bahwa suhu optimum untuk enzim MTGase berkisar antara 50 ºC dan aktivitasnya akan hilang jika suhu diatas 70ºC.
Suhu di bawah 50 ºC menunjukkan peningkatan aktivitas enzim karena terjadinya peningkatan energi kinetik yang mempercepat gerak vibrasi, translasi serta rotasi enzim dan substrat, sehingga memperbesar peluang keduanya untuk berinteraksi (Suhartono 1989). Ando et al. (1989) melaporkan bahwa aktivitas optimum enzim transglutaminase terjadi pada suhu 50 ºC. Sedangkan enzim transglutaminase yang diisolasi dari bakteri rekombinan Streptoverticillium platentis memiliki suhu optimum 55 ºC (Lin et al. 2008).
Peningkatan suhu diatas 50 ºC menyebabkan putusnya ikatan hidrogen dan hidrofobik lemah yang mempertahankan struktur sekunder-tersier dari enzim, sehingga enzim mengalami denaturasi (Suhartono 1989). Denaturasi adalah rusaknya bentuk tiga dimensi enzim yang menyebabkan enzim tidak dapat lagi berikatan dengan substrat. Denaturasi menyebabkan aktivitas enzim menurun. Jika suhu dibawah suhu optimum maka enzim tidak dapat bekerja dengan baik atau energi aktivasinya juga akan menurun.
26
(Lehninger 2008). Kestabilan molekul protein dipengaruhi oleh kestabilan ikatan-ikatan pada molekul enzim. Kestabilan molekul enzim ini mempengaruhi pengikatan enzim dengan substrat, baik secara langsung ataupun tidak langsung.
Dari uji ketahanan panas diketahui bahwa enzim transglutaminase yang dihasilkan ini memiliki ketahanan suhu yang relatif lebih rendah dibandingkan transglutaminase yang dihasilkan dari filarial nematode Brugia malayi yang mempunyai suhu optimum 55-60 ˚C, tetapi menunjukkan kestabilan pada suhu
60 ˚C dengan aktivitas 100% sampai dengan 60 menit inkubasi (Singh dan Mehta 1994). Sebaliknya, enzim tersebut relatif tahan panas
dibandingkan transglutaminase yang diisolasi dari Streptomyces hygroscopicus
yang mempunyai suhu optimum 37-45 ˚C dan stabil pada suhu 20 ˚C dengan aktivitas relatif 100% sampai dengan 30 menit inkubasi (Li Ciu et al. 2007).
Ikatan inhibitor atau aktivator dengan enzim dapat mengubah kemampuan daya katalis enzim dalam mengikat substratnya. Interaksi ion dengan residu asam amino yang terdapat pada sisi aktif dapat mengakibatkan berubahnya konformasi enzim menjadi lebih aktif atau nonaktif. Ion logam yang digunakan dalam penelitian ini, yaitu Na+, K+, Li+ ,Cu+, Ca2+, Mg2+, Zn2+, dan Fe3+ (Gambar 12). Ion logam seperti Na+, K+, Ca2+, dan Mg2+ memberikan peningkatan terhadap aktivitas enzim. Hal ini diduga enzim tersebut memiliki kebutuhan ion logam yang masih terpenuhi dari lingkungannya. Selain itu, enzim transglutaminase yang berasal dari bakteri tidak dipengaruhi ion logam khususnya Ca2+. Microbial transglutaminase tidak dipengaruhi ion logam Ca2+, sehingga adanya senyawa pengkelat logam, seperti diamine tetraacetic acid (EDTA) tidak menghambat aktivitasnya (Lin et al.2008).
Ion logam Cu2+, Zn2+, dan Li+ dapat menghambat aktivitas MTGase. Pengujian ion logam terhadap aktivitas MTGase pada penelitian ini sama dengan hasil penelitian Motoki dan Seguro (1998) dan Yokoyama et al. (2004) yang melaporkan bahwa ion logam, seperti Cu2+, Zn2+, dan Li+ dapat menghambat aktivitas enzim MTGase. Ion logam ini dapat mengikat gugus tiol dari residu sitein, hal ini dapat mendukung gagasan bahwa residu sistein merupakan bagian dari sisi aktif MTGase.
Li Cui et al. (2007) melaporkan bahwa aktivitas relatif enzim transglutaminase yang diisolasi dari Streptomyces hygroscopicus dapat meningkat sekitar 5-8% setelah ditambah beberapa ion logam seperti Na+, K+ dan Ca2+ dengan konsentrasi 1 mM. Selain itu, penambahan ion logam Ca2+ pada enzim transglutaminase yang dihasilkan dari bakteri rekombinan Streptoverticillium platensis memberikan peningkatan aktivitas relatif hanya 1,9% (Lin et al. 2008).
Perubahan daya katalisator pada penambahan senyawa inhibitor disebabkan karena struktur enzim yang mengalami perubahan fisik dan kimiawi
sedemikian rupa sehingga aktivitas hayatinya menjadi berubah (Hames dan Hoper 2005). Senyawa inhibitor seperti EDTA, PMSF, IAA dan DPB
merupakan inhibitor spesifik dan dapat digunakan untuk menentukan jenis enzim tertentu. EDTA (ethylenediamine tetraacetic acid) termasuk dalam inhibitor
27
phenyl methyl sulfonyl yang menyebabkan penurunan aktivitas katalitik enzim (Susanti 2003). IAA (Iodoacetamide) berfungsi sebagai inhibitor ireversible pada sistein. Mekanisme penghambatan terjadi pada alkilasi residu sistein yang menempel pada sisi aktif suatu enzim (Chalker et al. 2009). DPB (dibromoacetophenone) merupakan inhibitor irreversible yang digunakan untuk menonaktifkan histidin pada sisi aktif suatu enzim (Tauber et al. 2014).
Sebagai perbandingan, penelitian yang dilakukan Lin et al. (2008) menunjukkan bahwa enzim transglutaminase murni yang dihasilkan dari bakteri rekombinan Streptoverticillium platensis yang ditambah inhibitor EDTA 5 mM memiliki aktivitas relatif cukup besar (96,3%). Microbial transglutaminase tidak dipengaruhi ion logam Ca2+, sehingga adanya senyawa pengkelat logam, seperti
diamine tetraacetic acid (EDTA) tidak menghambat aktivitasnya (Lin et al.2008). Sebaliknya, transglutaminase yang dipengaruhi ion logam Ca2+
dapat dihambat oleh EDTA, misalnya tilapia transglutaminase
(Worratao dan Yongsawatdigul 2005). Sedangkan Suzuki et al. (2000) menjelaskan bahwa enzim transglutaminase murni yang dihasilkan dari spora bakteri Bacillus subtilis mengalami penurunan aktivitas relatif sebesar 26% setelah dihambat PMSF dengan konsentrasi 5 mM. Ho et al. (2000) juga melaporkan bahwa enzim transglutaminase dari Streptoverticillium ladakanum
28
5 SIMPULAN SARAN
Simpulan
Streptomyces sp. galur TTA 02 SDS 14 menghasilkan enzim transglutaminase secara optimum pada pH media 6,0 dan suhu 25 ºC. Penggunaan media Bahrim et al. diproduksi enzim transglutaminase setelah fermentasi selama dengan aktivitas tertinggi setelah fermentasi selama 4 hari (108 jam).
Hasil karakterisasi enzim diketahui bahwa enzim yang dihasilkan mempunyai pH optimum 6,0 dan suhu optimum 45-50 ºC. Pengujian stabilitas enzim pada suhu 40 ºC, 45 ºC, dan 50 ºC selama 4 jam masih menunjukkan aktivitas di atas 50% dari aktivitas awal. Penambahan ion logam Na+, K+, Ca2+, dan Mg2+ meningkatkan aktivitas MTGase, sebaliknya ion logam Li+, Cu+, Zn2+, Fe3+ menurunkan aktivitas MTGase. Penambahan inhibitor PMSF 1 mM dapat menurunkan aktivitas MTGase sebesar 11,31%
.
Saran
Perlu dilakukan pengukuran pertumbuhan sel berdasarkan biomassa
29
DAFTAR PUSTAKA
Aidaroos HI, Du G, Chen J. 2011. Microbial fed-batch production of transglutaminase using ammonium sulphate and calcium chloride by
Streptomyces hygroscopicus. Biotechnol Bioinforment Bioeng. 1(2):173–178.
Ando H, Adachi M, Umeda K, Matsuura A, Nonaka M, Uchio R, Tanaka H, Motoki M. 1989. Purification and characteristics a novel transglutaminase deriverd from Microorganisms. Agric Biol Chem. 53(10):2613-2617. Bahrim G, Iancu C, Butu N, Negoita TG. 2010. Production of a novel microbial
transglutaminase using Streptomyces sp. polar strains. Romanian Biotechnol Lett. 15(2): 5197-5203.
Belitz HD, Grosch W, Schieberle P. 2009. Food Chemistry. Ed ke-4. Heidelberg (DE): Springer-Verlag.
Bierbaum G. Karutz M, Botz DW, Wondrey C. 1994. Production of protease with B. Licheniformis mutans insentive to reppresion of exoenzim biosynthesis.
Appl Microbial Biotechnol. 40(5):611-617.
BPPT [Badan Pengkajian dan Penerapan Teknologi]. 2014. Menuju kemandirian enzim nasional. http://inspektorat.bppt.go.id/ [3 Desember 2015].
Chalker JM, Bernardes GJM, Lin YA, Davis BG. 2009. Chemical modification of proteins at cystein: opportunities in chemistry and bology. Chem Asian J.
4(1): 630-640.
Clarke DD, Mycek MM, Neidle A, Waelsch H. 1959. The incorporation of amines into proteins. Arch Biochem Biophys. 79:338-354.
Dvorcakova M, Macejova M, Pallet V, Higueret P, Vasson MP, Rock E, Brtko J. 2002. Transglutaminases and endocrine system. Endocr Regul. 36: 31-36. El-Hofi M, Ismail A, Nour M, Ibrahim O. 2014. Isolation, purification and
charachterisation of transglutaminase from rosemary (Rosmarinus officinalis L.) leaves. Acta Sci Pol Technol Aliment. 13(3):267-278.
Esposito C, Caputo I. 2004. Identification of substrates as a key to physiological function and physiopathological relevance. Federation European Biochem Soc J. 272: 615-631.
Folk JE. 1980. Transglutaminase. Annu Rev Biochem. 49: 517-531.
Gutman RG. 1987. Membran filtration, The Rheological of Pressure Driven Crossflow Process. Bristol (GB) : IOP Publishing Ltd.
Haard NF, Simpson BK. 2000. Seafood Enzymes: Utilization and Influence on Postharvest Seafood Quality. New York (US): Marcel Dekker, Inc.
Hames D, Hooper N. 2005. Biochemistry: Bios Instant Notes. Ed ke-3. New York (US): Taylor and Francis Group.
Ho ML, Leu SZ, Hsieh JF, Jiang S-T. 2000. Technical approach to simplify the purification method and characterization of microbial transglutaminase produced from Streptoverticillium ladakanum. J JFS: Food Chem Toxic.
65(1): 76-80.
Holt GJ, Krieg NR, Sneath PHA, Staley JT, Williams ST. 1994. Bergey’s Manual