ANATOMI SALURAN PENCERNAAN IKAN SIDAT
(Anguilla bicolor bicolor McClelland 1844) DARI MUARA
SUNGAI CIMANDIRI PELABUHAN RATU JAWA BARAT
SRI MURTINI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis dengan judul Makanan Alami dan Perkembangan Anatomi Saluran Pencernaan Ikan Sidat (Anguilla bicolor bicolor McClelland 1844) dari Muara Sungai Cimandiri Pelabuhan Ratu Jawa Barat adalah benar karya saya dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apa pun, di perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulisan ini telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2015
RINGKASAN
SRI MURTINI. Studi Makanan Alami dan Perkembangan Anatomi saluran Pencernaan Ikan Sidat (Anguilla bicolor bicolor McClelland 1844) dari Muara Sungai Cimandiri Pelabuhan Ratu Jawa Barat. Dibimbing oleh RIDWAN AFFANDI dan NURHIDAYAT.
Ikan sidat (Anguilla sp.) merupakan ikan katadromus yaitu ikan yang selama masa pertumbuhannya berada di perairan tawar dan beruaya ke laut dalam untuk melakukan pemijahan. Salah satu muara sungai di pantai selatan Jawa Barat yang merupakan jalur ruaya anadromus ikan sidat adalah Muara Sungai Cimandiri, Pelabuhan Ratu, Jawa Barat. Salah satu permasalahan pada pemeliharaan ikan sidat terutama pada pemeliharaan glass eel dan elver adalah masih tingginya tingkat kematiannya. Penelitian mengenai jenis-jenis makanan alami ikan sidat dari fase glass eel sampai dengan yellow eel belum banyak dilakukan. Oleh karena itu, diperlukan informasi makanan alami, untuk menyediakan pakan yang tepat agar dapat mengurangi mortalitas pada stadia glass eel dan elver dalam kegiatan budidaya pembesaran maka penelitian ini penting untuk diketahui.
Pengambilan sampel dilakukan pada bulan Oktober 2013 hingga Juli 2014 di Muara Sungai Cimandiri Pelabuhan Ratu, penelitian ini bertujuan untuk mengkaji makanan alami ikan sidat terkait dengan perkembangan anatomi saluran pencernaannya, sehingga dapat digunakan sebagai dasar untuk manajemen pakan, serta menjadi informasi dasar untuk menentukan strategi pengelolaan habitat ikan sidat di perairan, dan dapat menetapkan kebijakan untuk pelestarian ikan sidat khususnya di Muara Sungai Cimandiri.
Hasil analisis makanan alami berdasarkan stadia hidup ikan sidat fase glass eel, elver dan yellow eel, jenis makanan yang dikonsumsi merupakan kelompok dari fitoplankton, zooplankton, dan nekton. Makanan dominan yang dikonsumsi ikan sidat pada stadia glass eel (5-8 cm) adalah kelompok fitoplankton jenis Chlorella sp. sebesar 72 %, pada stadia elver (10-14 cm) makanan alami yang dominan adalah zooplankton jenis (Nauplius sp. 41%) sebesar 41%. Sedangkan stadia yellow eel (15-20 cm) makanan yang banyak ditemukan dalam saluran pencernaan ikan sidat kelompok nekton jenis crustacean 48%.
Karakteristik struktur makroskopis saluran pencernaan ikan sidat terdiri dari esofagus, lambung, pilorik, dan usus. Hasil penelitian menunjukkan bahwa pertambahan panjang esofagus selama masa pertumbuhan relatif lambat. Pertambahan panjang relatif dari lambung lebih cepat dari esofagus. pengukuran panjang usus bertambah hampir dua kali lipat dari panjang esofagus dan lambung. Secara mikroskopis dinding saluran pencernaan ikan sidat terdiri dari tunika mukosa, tunika submukosa, tunika muskularis, dan tunika serosa. Disetiap tunika terdapat beberapa jaringan dan kelenjar yang berperan dalam proses kecernaan makanan didalam saluran pencernaan. Susunan jaringan semakin sempurna sejalan dengan bertambahnya panjang tubuh dan fungsi dari saluran pencernaan ikan sidat
Tract of Eel (Anguilla bicolor bicolor McClelland 1844) in Cimandiri River Estuary, Pelabuhan Ratu, West Java. Supervised by RIDWAN AFFANDI and NURHIDAYAT.
The eel is katadromus fish that fish during infancy were in freshwater and migratory into the deep sea to spawning. On of the estuary of the river on the south coast of west java which in the path anadromus migration eel in Cimandiri estuary, Pelabuhan Ratu, West Java. One of the problems in the maintenance of eel mainly on maintenance and elver, glass eel is still high death rate. Research on the type of natural food eel from glass eel phase to the yellow eel was not been done. Therefore, natural food information is required, to provide proper feed in order to reduce mortality in stadia glass eel and elver in cultivation enlargement, this research is important to note.
Sampling was conducted in October 2013 to July 2014. This research aimed to study the natural foods of Indonesian shortfin eel associated with the development of its digestive tract, thus the result of this research can be used as a basis for feed management, provide basic information to determine habitat management strategies of Indonesian shortfin eel in the waterbody, thus a policy for the preservation of Indonesian shortfin eel, particulartly in Cimandiri River estuary, can be established.
Results of analysis of natural food based on life stage phase glass eel, elver, and yellow eel, the type of food consumed is a group phytoplankton, zooplankton, zooplankton, and nekton. The dominan food consumed at stadia glass eel (5-8 cm) is a group of phytoplankton types Chlorella sp. by 72 % in stadia elver (10- 14 cm) natural food is the dominant zooplankton type (Nauplius sp. 41%) while the yellow eel stage (15-20 cm) of food which are found in the digestive tract eel nekton types of crustacean group 48%.
The characteristics of the makroscopis structure of the digestive tract eel consist of the esophagus, stomach, pyloric, and intestine. result showed that the lenghtof the esophagus during the relatively slow growth. Added relative length of the stomach faster than the esophagus. Measuring the length of intestine increased almost two fold from the length of the esophagus and stomach. Are microscopic eel digestive tract wall consist of the tunica mucosa, tunica submucosa, tunica muscularis, and the tunica serosa, each tunica there are several network and glands that play are role in the process of digestion of food in the digestive tract. The composition of the network improved as the increased length of the body and the fuction of the digestive tract eels.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya, pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
SALURAN PENCERNAAN IKAN SIDAT
(Anguilla bicolor bicolor McClelland 1844)
DARI MUARA SUNGAI CIMANDIRI
PELABUHAN RATU JAWA BARAT
SRI MURTINI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pengelolaan Sumberdaya Perairan
SEKOLAH PASCA SARJANA
ISTITUT PERTANIAN BOGOR
Nama : Sri Murtini NRP : C251120071
Disetujui oleh
Komisi Pembimbing
Prof Dr Ir Ridwan Affandi, DEA Dr Drh Nurhidayat, MS, PAVet
Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana
Pengelolaan Sumberdaya Perairan
Dr Ir Sigid Hariyadi, MSc Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji syukur kami panjatkan kehadirat Alloh SWT atas nikmat iman dan ilmu, sehingga atas izinya penulis dapat menyelesaikan penelitian sejak Oktober 2013. Karya ilmiah ini merupakan pengembangan ilmu dari fisiologi hewan air dengan judul Makanan Alami dan Perkembangan Anatomi Saluran Pencernaan Ikan Sidat (Anguilla bicolor bicolor McClelland 1844) dari Muara Sungai Cimandiri Pelabuhan Ratu Jawa Barat.
Pelaksanaan penelitian dan karya ilmiah ini tak lepas dari bantuan dan dukungan dari banyak pihak. Penulis mengucapkan terima kasih kepada :
1. Prof Dr Ir Ridwan Affandi, DEA dan Dr Drh Nurhidayat, MS, PAVet selaku dosen pembimbing yang telah memberikan arahan dan masukkan kepada penulis dari tahap awal penelitian hingga tahap akhir penyelesaian karya ilmiah ini.
2. Beni Putra STP selaku pemimpin dalam hidupku terimakasih atas cinta, doa, dan motivasinya selama ini hingga akhirnya penulis dapat menyelesaikan karya ilmiah ini.
3. Institut Pertanian Bogor (IPB) yang menyediakan fasilitas sehingga penelitian ini dapat di selesaikan
4. Dr Ir Sigid Haryadi, MSc selaku ketua program studi SDP untuk tahun studi 2014 – 2017 , yang telah membantu tahapan penyelesaian studi. 5. Dr Ir Tatag Budiardi, MSi selaku dosen penguji luar komisi pembimbing
pada ujian tesis yang telah banyak membantu dan memberikan masukan dan saran dalam penyempurnaan karya ilmiah ini.
6. Bapak Misdi dan ibu Sunarti (Lubuk linggau) bapak Nurlis dan ibu Baidar (Bukittinggi) selaku orang tua penulis terimakasih atas doa dan kasih sayangnya.
7. Nadhira Fauzaturrahma Saifa dan Muhammad Umar Albakka Saifa terimakasih ananda atas cinta, doa dan kesabarannya.
8. Seluruh keluarga besar di Lubuk Linggau, Pariaman, dan Bengkulu terimakasih atas doanya sehingga tulisan ini dapat diselesaikan.
9. Seluruh staf Laboratorium Biomikro I MSP Fakultas Perikanan dan Ilmu Kelautan dan staf Laboratorium Anatomi Fakultas Kedokteran Hewan Institut Pertanian Bogor terimakasih atas dukungan dan kerjasamanya. 10.Seluruh rekan-rekan SDP 2012, 2013, dan teman-teman Puri Hapsara
terimakasih atas semangat persaudaraannya
Semoga karya ilmiah ini bermanfaat
Bogor, Mei 2015
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 METODE Waktu dan Tempat 4
Stasiun Pengambilan Sampel 4
Teknik Pengambilan Sampel 4
Pengukuran Parameter Air 5
2.1 Studi Makanan Alami Ikan Sidat 5
2.2 Studi Anatomi Saluran Pencernaan 7
3 HASIL DAN PEMBAHASAN Hasil 3.1. Parameter Fisika-kimia Muara Sungai Cimandiri 8
3.2. Studi Makanan Alami Ikan Sidat 9
3.3. Perkembangan Struktur Alat Pencernaan Ikan Sidat 12
Pembahasan 3.1. Kualitas Perairan Muara Sungai Cimandiri 21
3.2. Makanan Alami Ikan Sidat 22
3.3. Perkembangan Makroskopis dan Mikroskopis 23
4 KESIMPULAN DAN SARAN Kesimpulan 26
Saran 26
DAFTAR PUSTAKA 26
LAMPIRAN 29
DAFTAR TABEL
1 Parameter Fisika-kimia air di masing-masing stasiun 8
2 Ukuran makanan alami yang dikonsumsi oleh ikan sidat 11
DAFTAR GAMBAR
1 Kerangka Pemikiran 32 Lokasi penelitian di Muara Sungai Cimandiri 4
3 Morfologi tubuh ikan sidat 8
4 Distribusi ikan sidat berdasarkan stasiun pengamatan 9
5 Komposisi makanan alami Ikan Sidat 9
6 Komposisi makanan berdasarkan lokasi 10
7 Panjang usus relatif ikan sidat 11
8 Lebar bukaan mulut ikan sidat 12
9 Morfologi saluran pencernaan ikan sidat 12
10 Perbandingan Panjang Saluran Pencernaan 13
11 Gambaran mikroskopis esofagus ikan sidat 14
12 Gambaran mikroskopis lambung ikan sidat 16
13 Gambaran mikroanatomis PAS dan MT lambung 20
14 Gambaran mikroskopis pilorik 18
15 Gambaran mikroskopis usus 20
DAFTAR LAMPIRAN
1 Prosedur pewarnaan Hematoksilin Eosin(HE) 292 Prosedur pewarnaan MassonTrichome (MT) 30
3 Prosedur pewarnaan periodicacidSchiff (PAS) 31
4 Prosedur pewarnaan alcianblue (AB) 32
5 Stasiun pengambilan sampel 33
6 Alat tangkap ikan sidat 35
7 Jenis makanan alami ikan sidat 36
1 PENDAHULUAN
Latar BelakangIkan sidat (Anguilla sp.) merupakan ikan katadromus yaitu ikan yang selama masa pertumbuhannya berada di perairan tawar dan beruaya ke laut dalam untuk melakukan pemijahan. Larvanya setelah mengalami metamorfosis dari fase leptochepali berkembang menjadi glass eel, dengan morfologi tubuh berbentuk batang yang transparan dan belum mengalami pigmentasi, akan beruaya anadromus ke perairan tawar melalui muara sungai (Aoyama 2009; Aarestrup et al 2010). Salah satu muara sungai di pantai selatan Jawa Barat yang merupakan jalur ruaya anadromus ikan sidat adalah Muara Sungai Cimandiri, Pelabuhan Ratu, Jawa Barat.
Muara Sungai Cimandiri memiliki potensi besar sebagai sumber ikan sidat. Ikan sidat yang ditangkap di Muara Sungai Cimandiri didominasi oleh Anguilla bicolor-bicolor (Chino dan Arai 2010). Jenis ikan sidat hasil penangkapan ini dimanfaatkan sebagai sumber benih pada kegiatan budidaya pembesaran dan untuk kegiatan restoking di perairan umum (Kearney 2011). Eksploitasi terjadi karena ikan ini memiliki nilai ekonomis yang cukup tinggi (Chino dan Arai 2010). Jika hal ini berlangsung terus menerus akan berakibat terhadap berkurangnya populasi ikan sidat di perairan. Over fishing, perubahan iklim, hilangnya habitat, serta parasit adalah penyebab berkurangnya populasi ikan di perairan (Aarestrup et al. 2010). Genus Anguilla ini terdiri dari 18 spesies yang tersebar di dunia, dengan siklus hidup terdiri atas beberapa fase, yaitu leptocephali, glass eel, elver, yellow eel, dan silver eel. Ikan ini memiliki fase-fase perkembangan yang relatif lama dibandingkan dengan jenis ikan lainnya (Aoyama 2009). Ikan sidat memiliki struktur saluran pencernaan yang unik, yaitu lambung yang berukuran relatif kecil, berbentuk kerucut dan berupa kantung buntu, bersama-sama dengan usus membentuk seperti huruf Y (Tesch 1976). Di dalam ruang perut, lambung ikan ini terletak sejajar dengan usus. Usus ikan sidat ini berukuran relatif pendek dimulai dari pertautannya dengan lambung sampai rektum, sehingga berdasarkan ukuran usus ini, ikan sidat digolongkan sebagai ikan karnivora, dibandingkan dengan ikan herbivora yang memiliki ukuran saluran pencernaan yang lebih panjang (Raji dan Norouzi 2010).
2
tekstur makanannya (Murray et al. 1996). Sehubungan dengan pentingnya informasi makanan alami, untuk menyediakan pakan yang tepat agar dapat mengurangi mortalitas pada stadia glass eel dan elver dalam kegiatan budidaya pembesaran maka penelitian ini penting untuk diketahui.
Perumusan Masalah
Muara Sungai Cimandiri merupakan salah satu daerah yang potensial untuk penangkapan ikan sidat. Penangkapan ikan ini, telah menjadi mata pencaharian bagi masyarakat setempat. Eksploitasi ikan yang berlangsung terus menerus dapat mengganggu keseimbangan habitat ikan sidat, sehingga akan mengalami penurunan jumlah ikan ini di perairan. Budidaya ini terhalang dengan tingginya kematian ikan karena pemberian pakan yang tidak tepat. Oleh karena itu diperlukan data tentang jenis makanan alami dan kaitannya dengan perkembangan anatomi saluran pencernaan.
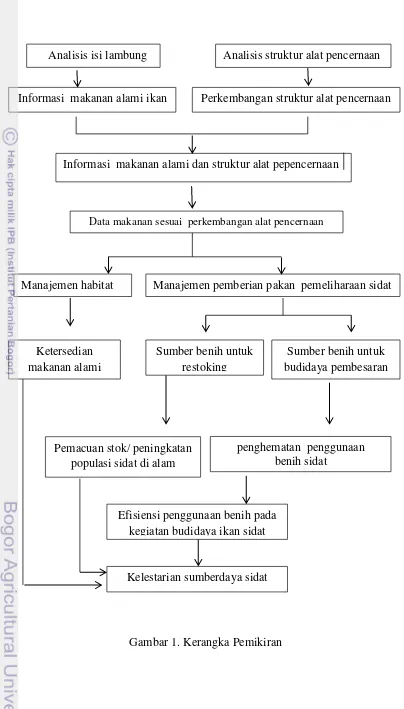
Habitat ikan sidat perlu dipertahankan dengan menjaga kualitas lingkungannya agar tetap terjaga, baik dari kualitas perairan, maupun kelimpahan plankton yang menjadi makanan bagi ikan sidat. Kondisi perairan dan kesuburan sangat berpengaruh terhadap siklus rantai makanan (food chain) terutama bagi organisme yang ada didalamnya, Sehingga diperlukan upaya pemeliharaan larva dengan tujuan bisa menjadi sumber benih pada budidaya pembesaran, dan tidak terputusnya ketersediaan benih dari alam, dengan pengelolaan seperti ini diharapkan dapat menjaga kelestarian sumberdaya perairan. Kegiatan dari penelitian tertuang dalam kerangka pemikiran (Gambar 1).
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengkaji makanan alami ikan sidat pada stadia glass eel, elver, dan yellow eel dan keterkaitannya dengan perkembangan anatomi saluran pencernaan.
Manfaat Penelitian
Gambar 1. Kerangka Pemikiran
Analisis isi lambung Analisis struktur alat pencernaan
Informasi makanan alami ikan
sidat
Perkembangan struktur alat pencernaan
Informasi makanan alami dan struktur alat pepencernaan
Data makanan sesuai perkembangan alat pencernaan
Manajemen habitat Manajemen pemberian pakan pemeliharaan sidat
Ketersedian makanan alami
Sumber benih untuk restoking
Sumber benih untuk budidaya pembesaran
Pemacuan stok/ peningkatan populasi sidat di alam
penghematan penggunaan benih sidat
Efisiensi penggunaan benih pada kegiatan budidaya ikan sidat
4
2 METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Oktober hingga Desember 2013. Pengambilan sampel ikan dan pengukuran kualitas air dilakukan di Muara Sungai Cimandiri, Pelabuhan Ratu, Jawa Barat. Analisis makanan dilakukan di Laboratorium Biologi Mikro, Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan dan pembuatan preparat histologi dilakukan di Laboratorium Anatomi Fisiologi dan Farmakologi Fakultas Kedokteran hewan Institut Pertanian Bogor.
Stasiun Pengambilan Sampel
Penentuan stasiun untuk pengambilan sampel dilakukan berdasarkan pada penyebaran distribusi ikan sidat di Muara Sungai Cimandiri. Ada 3 stasiun yang digunakan untuk mewakili kondisi perairan.Jarak antara masing masing stasiun pengambilan sampel yaitu 1,5 km. Lokasi pengambilan sampel (Gambar 2) adalah sebagai berikut :
Stasiun I : Merupakan daerah yang dipengaruhi oleh adanya pasang surut air laut
Stasiun II : Merupakan daerah genangan (talanca) bersubstrat pasir dengan arus lemah dan relatif dangkal
Stasiun III : Merupakan kawasan aliran Sungai Cimandiri dengan arus tenang
Gambar 2 Lokasi Penelitian di Muara Sungai Cimandiri
Teknik Pengambilan Sampel
Sampel yang diperoleh dari Muara Sungai Cimandiri untuk ikan pada stadia glass eel menggunakan alat tangkap berupa jaring sirib (jaring anco) ukuran 1x1 m dengan ukuran mata jaring 0,05 – 0,10 mm, sedangkan ikan sidat ukuran elver menggunakan bubu. Pengambilan sampel dilakukan secara sensus untuk semua
I II
ukuran. Sampel ikan yang diperoleh dikelompokkan berdasarkan stasiun. Ada dua tahap yang dilakukan setelah ikan diperoleh dari setiap stasiun yaitu pengukuran panjang berat dan pembedahan ikan, hal ini dilakukan agar lebih efektif dalam menganalisis sampel dan data yang diperoleh lebih akurat.
Ikan diperoleh dari lapangan diukur panjangnya dengan menggunakan penggaris yang dilapisi kertas milimeter yang telah dilaminating. pengukuran panjang mulai dari mulut sampai ke sirip ekor. Berat ikan diukur dengan menggunakan timbangan digital dengan ketelitian 0,01 gram. Data yang diperoleh untuk mengetahui hubungan panjang berat ikan sidat.
Pembedahan ikan dilakukan pada bagian abdomen tubuh ikan sidat untuk melihat organ pencernaannya dengan menggunakan alat bedah, kemudian diambil organ saluran alat pencernaan yang akan digunakan untuk menganalisis jenis makanan alami dari ikan sidat. Setelah dikeluarkan dari dalam tubuh ikan, saluran pencernaan usus dan lambung, diawetkan dalam kantung plastik dengan menggunakan formalin 10 % dan diberi label tanggal, nomor sampel, dan stasiun.
2.1. Pengukuran Parameter Fisika-kimia Air
Pengukuran parameter lingkungan terkait dengan kualitas fisika-kimia air dilakukan setiap bulan di tiga stasiun. Pengambilan dan pegamatan kualitas air (Tabel 1) yaitu dengan mengukur parameter fisika (suhu, kedalaman, kekeruhan, kecepatan arus) dan kimia (pH, DO, dan salinitas). Pengukuran parameter fisika-kimia di stasiun pengamatan
Parameter Satuan Metode dan Alat Lokasi Fisika
Suhu °C Termometer Insitu
Kecerahan cm Secchi disc Insitu
Kedalaman m Tongkat berskala Insitu
Kecepatan arus m/det Lagrangian Insitu
Kekeruhan NTU Turbidimeter Exsitu
Kimia
DO mg/L DO meter Insitu
Salinitas ppt Refraktometer exitu
pH pH meter insitu
2.2. Studi Makanan Alami Ikan Sidat Pengukuran Panjang Usus
Saluran pencernaan ikan sidat yang akan diamati secara morfologi dan anatomi mulai dari esofagus, lambung, pilorik dan usus. Pengukuran panjang usus menggunakan penggaris dengan ketelitian 1 mm. Pengukuran panjang usus bertujuan untuk mengetahui panjang total dari usus ikan sidat.
Pengukuran Berat Isi Lambung
6
Analisis Makanan Alami Metode Analisis Isi Lambung
Sampel ikan yang diperoleh dari lapangan dianalisis menggunakan metode frekuensi kejadian dan volumetrik (Index of Preponderance). Isi saluran pencernaan dari ikan dikeringkan dengan tisu, lalu ditimbang terlebih dahulu berat lambung berisi dan lambung kosongnya, kemudian dimasukkan kedalam cawan petri, kemudian dicairkan dengan akuades, agar memudahkan dalam menganalisis jenis makanannya. Sampel diambil dengan pipet tetes kemudian dianalisis di bawah mikroskop dengan pembesaran 10 x 10 diamati dengan lima lapang pandang dari setiap tetesnya dengan menggunakan ulangan tiga tetes dari setiap sampel. Identifikasi organisme makanan dilakukan dengan menggunakan buku identifikasi organisme makanan yaitu Ilustration of freshwater plankton (Yamaji 1979) dan illustration of marine plankton (Mizuno 1979). Hasil yang diperoleh dari analisis akan disajikan dalam bentuk diagram pie.
Analisis Data Hubungan Panjang Berat
Untuk analisis hubungan panjang berat ikan menggunakan uji regresi dengan rumus :
W = aLb
Keterangan : W = Berat tubuh ikan
L = Panjang ikan (mm) a dan b konstanta
Uji t dilakukan terhadap nilai b untuk mengetahui apakah b = 3 (isometrik)
atau b ≠ 3 (alometrik)
Panjang Usus Relatif
panjang usus relatif (%) = Keterangan PU = Panjang usus ikan (cm)
PT = Panjang total ikan (cm)
Lebar Bukaan Mulut
Lebar bukaan mulut (LBMr) = Keterangan : LBMr = Lebar bukaan mulut (cm)
Komposisi Makanan
Analisis makanan alami dalam lambung dilakukan dengan menggunakan indeks bagian terbesar (index of preponderance) oleh Natarajan dan Jhingran
Studi perkembangan struktur alat pencernaan merupakan upaya untuk mengkaji struktur jaringan dari saluran pencernaan ikan sidat kaitanya dengan makanan alami, ini bertujuan untuk mengetahui fase perkembangan saluran pencernaan ikan sidat dari alam.
Pengamatan Makro dan Mikroskopis Saluran Pencernaan
Penelitian ini menggunakan ikan sidat yang diperoleh dari hasil tangkapan nelayan di Muara Sungai Cimandiri, Pelabuhan Ratu, Jawa Barat. Ikan sidat yang digunakan dalam penelitian ini berjumlah 56 ekor, dibagi menjadi tujuh kelompok berdasarkan panjang ikan sidat yaitu 6, 8, 10, 12, 14, 16, dan 20 cm, yang masing kelompok berjumlah 8 ekor. Seluruh sampel ikan sidat dari masing-masing kelompok dibuka ruang perutnya, dan alat pencernaannya dikeluarkan untuk diukur bagian-bagian dari saluran pencernaan. Selanjutnya, lima sampel diawetkan dalam formalin 10% untuk pengamatan makroskopis, sedangkan tiga sampel difiksasi dalam Neutral Buffered Formalin 10% untuk pengamatan mikroskopis. Seluruh saluran pencernaan diukur dengan penggaris (ketelitian : 1 mm) meliputi panjang esofagus, lambung dan usus.
8
Analisis Data Struktur Perkembangan Alat Pencerrnaan
Pengamatan hasil pewarnaan dilakukan dengan mikroskop cahaya (Nikon® ) Eclipse E600, dan selanjutnya dilakukan pemotretan dengan alat mikro fotografi digital Canon® EOS 700D). Data hasil pengamatan anatomi dan histologi dari saluran pencernaan dianalisis secara deskriptif.
3 HASIL DAN PEMBAHASAN
Hasil
3.1 Parameter Fisika-kimia Air di Muara Sungai Cimandiri
Hasil pengukuran kualitas air terkait dengan parameter fisika-kimia dari tiga stasiun selama di lapangan disajikan pada (Tabel 1) di bawah ini.
Tabel 1 Parameter Fisika-kimia air di masing-masing stasiun
Parameter Satuan Stasiun
Keterangan 1)Andriana 2001 ,2)Sriati 1998, 3)Widigyo 2001 4) Sriati 1998
Morfologi Ikan Sidat
Ikan sidat (Anguilla bicolor bicolor) memiliki bentuk tubuh seperti ular, berwarna hitam di bagian dorsal, sedangkan di ventral berwarna putih keabuan. Ikan ini dilengkapi dengan sirip pektoral, sirip dorsal, dan sirip kaudal yang berfungsi menggerakkan dan menjaga keseimbangan tubuh. Sirip pektoral terletak tepat di kaudal operkulum menyerupai daun telinga, sedangkan sirip dorsal dan sirip kaudal menyatu di sepanjang dorsal tubuh, ekor, dan ventral tubuh. Garis linea lateralis memanjang di lateral tubuh dari kaudal operkulum sampai ke ekor. Hewan ini mempunyai bentuk mulut relatif runcing ke arah depan, dan sudut mulutnya sejajar dengan bola mata (Gambar 3).
Gambar 3 Morfologi tubuh ikan sidat
a. Sirip pektoral; b.Sirip dorsal; c.Sirip kaudal ; d. Sirip anal Bar = 1 mm
b
c
a
Distribusi Ikan Sidat Berdasarkan Stasiun Pengamatan
Ikan sidat merupakan jenis ikan yang paling dominan ditangkap oleh nelayan di Muara Sungai Cimandiri. Alat tangkap yang digunakan yaitu jaring sirib (jaring anco) berukuran 1x1 m dengan ukuran mata jaring 0,05 – 0,10 mm dan menggunakan bubu. Hasil penangkapan ikan berdasarkan stasiun pengamatan selama tiga bulan pengambilan sampel, didapatkan ikan sebanyak 211 ekor dengan ukuran yang bervariasi, stasiun I (73 ekor) stasiun II (70 ekor) dan stasiun III (68 ekor).
Gambar 4 Distribusi ikan sidat berdasarkan stasiun pengamatan
3.2. Studi Makanan Alami Ikan Sidat Makanan Alami Ikan Sidat Berdasarkan Stadia Hidup
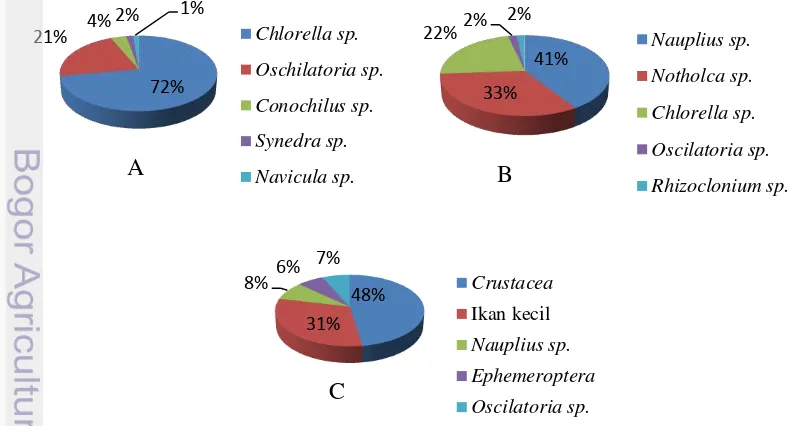
Hasil analisis makanan alami berdasarkan stadia hidup ikan sidat fase glass eel, elver dan yellow eel, jenis makanan yang dikonsumsi merupakan kelompok dari fitoplankton, zooplankton, dan nekton (Gambar 5).
10
Komposisi makanan yang dikonsumsi ikan sidat pada stadia glass eel (5-8 cm) kelompok fitoplankton jenis Chlorella sp. mendominasi sebesar 72 %, pada stadia elver (10-14 cm) lebih dominan zooplankton jenis (Nauplius sp. 41%) sebesar 41%, sedangkan pada stadia yellow eel (15-20 cm) banyak ditemukan kelompok nekton jenis crustacean 48%.
Makanan Alami Ikan Sidat Berdasarkan Lokasi
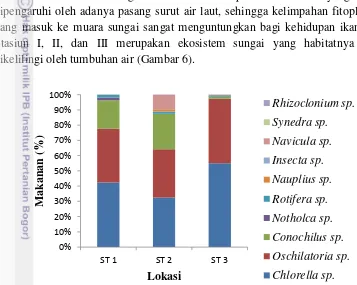
Habitat Muara Sungai Cimandiri merupakan kawasan yang sangat dipengaruhi oleh adanya pasang surut air laut, sehingga kelimpahan fitoplankton yang masuk ke muara sungai sangat menguntungkan bagi kehidupan ikan sidat. Stasiun I, II, dan III merupakan ekosistem sungai yang habitatnya masih dikelilingi oleh tumbuhan air (Gambar 6).
Gambar 6 Komposisi makanan ikan sidat berdasarkan lokasi
Hubungan Panjang dan Berat
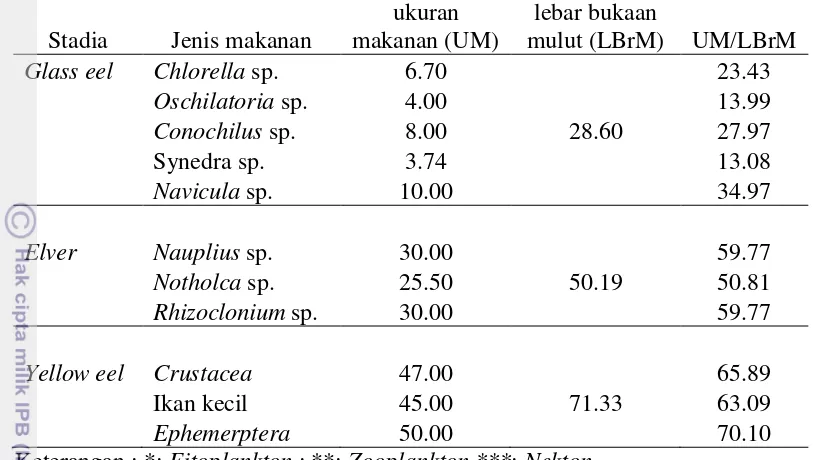
Tabel 2 Ukuran makanan alami yang dikonsumsi oleh ikan sidat
Yellow eel Crustacea 47.00 65.89
Ikan kecil 45.00 71.33 63.09 ukuran usus yang relatif pendek bila dibandingkan dengan ikan lainnya. Ukuran panjang usus dapat menggambarkan kebiasaan makan ikan. Panjang usus relatif dapat menggambarkan hubungan antara panjang ikan dengan panjang usus relatif, Panjang usus relatif pada glass eel yaitu 0.25, elver 0.26- 0.28, dan yellow eel 0.29-0.38 (Gambar 7).
12
Ukuran Lebar Bukaan Mulut Ikan Sidat
Setiap ikan juga memiliki ukuran bukaan mulut yang berbeda tergantung pada ukuran atau umur ikan. Bukaan mulut ikan sidat ditu jukkan pada . Ukuran makanan yang dapat dimakan oleh suatu jenis ikan ditentukan oleh ukuran bukaan mulutnya (Affandi et al 2009). Berdasarkan nilai R2 = 0,8046 dapat disimpulkan bahwa ada korelasi antara ukuran panjang ikan dengan ukuran bukaan mulut ikan sidat Dalam manajemen pemberian pakan ukuran pakan alami yang harus diberikan seyogyanya memperhatikan ukuran bukaan mulut ikan sidat tersebut agar pakan yang diberikan dapat ditelan (ingesti).
Gambar 8 Hubungan antara panjang tubuh dan lebar bukaan mulut ikan sidat
3.3. Perkembangan Struktur Alat Pencernaan Ikan Sidat
Struktur Alat Pencernaan
Gambar 9 Struktur morfologi saluran pencernaan ikan sidat
a.Esofagus b. Lambung c. Pilorik d1. Usus depan d2. Usus tengah d3. Usus belakang Bar = 1 mm
Karakteristik Struktur Makroskopis Saluran pencernaan Ikan Sidat
Berdasarkan hasil pengukuran panjang ikan sidat dan esofagus, di peroleh hasil perhitungan regresi yaitu Y= 0,0879x + 0,0914. Pertambahan setiap 1 cm panjang tubuh ikan sidat, diikuti oleh pertambahan panjang esofagus sebesar 0,1793 cm. Nilai regresi yang diperoleh dari pengukuran panjang lambung terhadap panjang tubuh ikan adalah Y = 0,4579x + 0,0314. Lambung ikan sidat bertambah 0,4893 cm, untuk pertambahan setiap 1 cm panjang tubuh. Pertambahan panjang relatif dari lambung lebih cepat dibandingkan pada esofagus, tetapi lebih lambat dari pertambahan panjang tubuh. Peningkatan panjang lambung tampak pada ikan sidat ukuran 16 cm sampai dengan 20 cm. Hasil yang berbeda diperoleh dari pengukuran panjang usus dengan nilai regresi yang bertambah hampir dua kali lipat yaitu sebesar 0,8267 cm, dibandingkan dengan pertambahan panjang lambung. Peningkatan panjang usus ikat sidat dari ukuran 16 cm hingga 20 cm yang relatif cepat, seperti yang ditemukan pada lambung (Gambar 10).
14
Gambaran Struktur Mikroskopis Saluran Pencernaan Esofagus
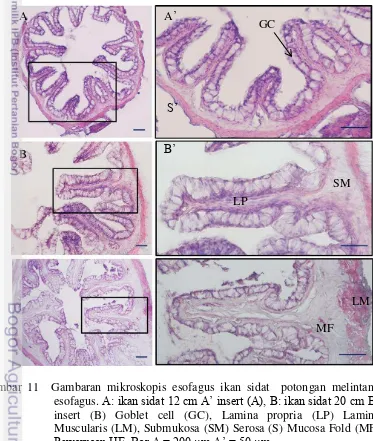
Esofagus ikan sidat memiliki mukosa yang terdiri dari epitel silindris- sebaris, diantara sel-sel mukosa tersebut banyak ditemukan sel-sel goblet. Pada ikan 12 cm, lapisan mukosa esofagus tersusun secara dominan oleh sel-sel goblet yang berbentuk silindris bulat dengan ukuran relatif kecil. Ikan berukuran 20 cm, lapisan mukosa ditutupi sel-sel goblet yang berukuran lebih besar, dengan sel-sel epitel pipih silindris sebaris, berukuran lebih besar dengan sel-sel epitel pipih silindris sebaris, berukuran besar, hampir menutupi lapisan mukosa esofagus (Gambar 11). Lamina propria esofagus ikan sidat terdiri atas jaringan ikat longgar dan jaringan lemak.
Gambar 11 Gambaran mikroskopis esofagus ikan sidat potongan melintang esofagus. A: ikan sidat 12 cm A’ insert (A), B: ikan sidat 20 cm B’ insert (B) Goblet cell (GC), Lamina propria (LP) Lamina Muscularis (LM), Submukosa (SM) Serosa (S) Mucosa Fold (MF)
Pewarnaan HE. Bar A = 200 µm A’ = 50 µm.
A A’
B B’
GC
LP
’ S’
SM
LM
’
Jaringan ikat longgar ditemukan pada mukosa ikan sidat berukuran 20 cm, sedangkan pada ikan yang berukuran lebih kecil, lapisan ini tidak ditemukan. Di profundal tunika mukosa terdapat lamina propria dan tunika submukosa. Pada kedua lapisan ini ditemukan jaringan ikat longgar dan buluh darah. Tunika submukosa esofagus pada ikan sidat yang berukuran 12 cm terdiri dari jaringan ikat longgar dan buluh darah dengan ukuran yang relatif kecil, sedangkan pada ukuran ikan yang lebih panjang, bertambah tebal sejalan dengan pertambahan panjang ikan. Tunika muskularis ikan sidat terletak di superfisial dari tunika submukosa, dan terdiri atas dua lapis otot yaitu otot sirkular (internal), dan lapis otot longitudinal (eksternal). Otot sirkular mengelilingi esofagus secara kontinu, sedangkan otot longitudinal terdapat beberapa bundel otot di superfisial otot sirkular. Pada ikan yang berukuran 12 cm, ditemukan lapisan otot sirkular dan longitudinal yang relatif tipis, sedangkan pada ikan yang berukuran 20 cm, memiliki otot sirkular yang relatif tebal dengan beberapa bundel otot longitudinal di superfisial-nya. Di lapisan terluar esofagus terdapat tunika serosa berupa jaringan ikat serosa, yang melapisi seluruh permukaan luar esofagus (Gambar 11).
Lambung
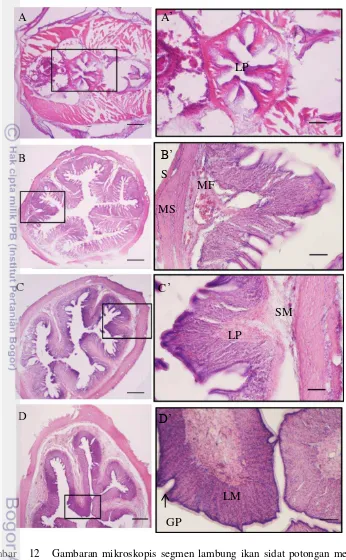
Lambung ikan sidat berbentuk seperti kerucut, dan terdiri atas tiga bagian yaitu kardia, fundus, dan pilorus. Tunika mukosa lambung ikan sidat 6 cm memiliki epitel yang bentuknya masih bervariasi yang terdiri dari selapis sampai beberapa lapis epitel, sedangkan pada ikan 14 cm, 16 cm, dan 20 cm tunika ini terdiri atas epitel silindris sebaris dan sel goblet yang dilapisi oleh mukus. Pada ikan yang berukuran 14 cm dan 16 cm gastric pit belum terbentuk sempurna di bagian mukosa, sedangkan pada ikan sidat yang berukuran 20 cm, gastric pit telah terbentuk sempurna diantara jaringan epitel dan mukus (Gambar 12D).
Di profundal epitel mukosa terdapat matrik dari mukosa lambung. Pada bagian ini ditemukan sel-sel chief dan sel parietal. Pada ikan sidat yang berukuran 14 cm sel chief yang ditemukan berjumlah sedikit dan berukuran relatif kecil, sedangkan pada ukuran 16 cm dan 20 cm sel chief jumlahnya lebih banyak berukuran lebih besar dengan inti relatif besar di tengah-tengah sel. Pada ikan 14 cm ditemukan sel parietal dengan jumlah sedikit, sedangkan pada ikan 16 cm dan 20 cm jumlah sel parietal lebih banyak dan menyebar di seluruh bagian mukosa lambung (Gambar 12D’). Pada tunika mukosa lambung bagian kardia ditemukan kelenjar kardia.. Kelenjar lain pada lambung, adalah kelenjar fundus. Lamina propria pada lambung ikan sidat memiliki jaringan ikat longgar. Jaringan ini ditemukan pada ikan yang berukuran 14 cm, 16 cm, dan 20 cm.
16
Gambar 12 Gambaran mikroskopis segmen lambung ikan sidat potongan melintang
lambung A: ikan sidat 6 cm A’ insert (A) B: ikan sidat 14 cm B’ insert (B) C: ikan sidat 16 cm C’insert (C) D:ikan sidat 20 cm D’ insert (D), Lamina Muscularis (LM), Gastric Pit (GP), Lamina Mucosa (LM), Lamina Propria (LP), Mucosa Fold (MF), Submucosa (SM), Serosa (S). Pewarnaan HE.
Bar A =200 µm dan A’= 50 µm.
Secara umum, tunika muskularis lambung mirip pada esofagus, lapisan ini terdiri dari dua lapisan otot yaitu lapisan otot sirkular (internal) longitudinal (eksternal). Pada ikan sidat 6 cm otot lambung masih sangat sederhana dan belum
LP
A A’
B B’
C C’
D D’
LP
MS
GP
LM
SM S
dapat dibedakan antara otot sirkular dan longitudinal, sedangkan ikan sidat yang berukuran yang berukuran lebih dari 14 cm memiliki otot sirkular lebih tebal dibandingkan dengan otot longitudinal. Sel-sel epitelium mukosa lambung terwarnai positif oleh perwarnaan PAS, karena mukusnya mengandung senyawa karbohidrat dan tidak untuk pewarnaan AB yang hanya menggambarkan adanya asam lambung netral di dalamnya (Gambar 13 A).
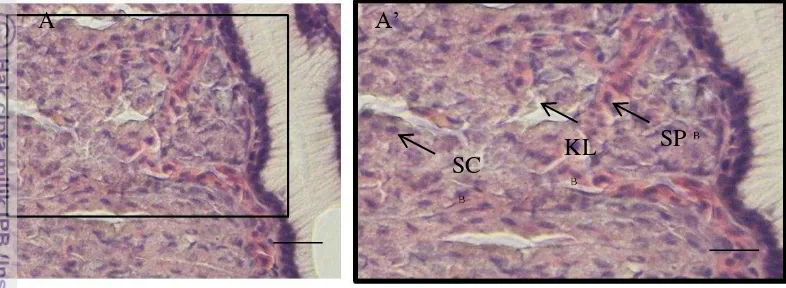
Gambar 13 Gambaran mikroskopis segmen lambung ikan sidat Sel Parietal (SP), Sel Chief (SC) Kelenjar Lambung (KL) pewarnaan HE Bar A = 200 µm
dan A’= 50µm
Gambar 14 Gambaran mikroskopis segmen lambung ikan sidat ), Gastric pit (GP), Lamina Propria (LP), Submucosa (SM), Lamina Muscularis (LM). Lamina Mucosa (LM), Serosa (S) Pewarnaan (PAS) Priodic Acid Shiff (A) dan pewarnaan (MT) Masson Trichrome (B) Bar = 200 µm
Pilorik
Pilorik adalah bagian perbatasan antara lambung dan usus. Pilorik ikan sidat memiliki tunika mukosa dengan vili-vili, masing-masing vili mencabangkan beberapa mikrovili. Pada ikan sidat yang berukuran 8 sampai 20 cm memiliki bentuk vili yang relatif mirip, tetapi ukuran vili tersebut bertambah besar dan bentuknya lebih komplek pada ikan yang berukuran lebih besar. Pada tunika mukosa dari pilorik tidak ditemukan kelenjar pencernaan. Tunika muskularis pada pilorik relatif tebal. dibentuk oleh dua lapisan otot, dengan otot sirkular yang sangat tebal (Gambar 14).
B
SM
LM SM
GP
LP
LM S
A
A A’
SP
18
Gambar 14 Gambaran mikroskopis segmen pilorik, A: ikan sidat 8 cm A’ insert
(A) B: ikan sidat 20 cm B’ insert (B) potongan melintang pilorik A dan A’(pembesaran A) Serosa (S), Lamina Muscularis (LM) Sub mucosa (SM), Lamina Propria (LP). Perwarnaan HE.
Bar A = 200 µm dan A’ = 50 µm.
Usus
Usus adalah bagian terpanjang dari saluran pencernaan. Usus ikan sidat terdiri atas usus depan, usus tengah, dan usus belakang. Pada tunika mukosa usus, terdapat penjuluran-penjuluran yang ditutupi oleh sel-sel epitel silindris sebaris, diantara sel-sel epitel tersebut ditemukan banyak sel goblet (Gambar 15). Usus ikan sidat sel goblet dibagian epitelium terwarnai positif dengan pewarnaan AB (Acian Blue) Karena sel ini mengsekresikan mucus pada lipatan mukosa pada permukaan vili berwarna biru muda pada sel-sel goblet (Gambar 16A). Pada ikan sidat yang berukuran 8 cm, vili-vili mukosa mempunyai bentuk sederhana, ukuran vili relatif pendek, dengan jumlah sel goblet yang relatif sedikit. Ikan yang berukuran 16 cm memiliki vili yang bentuknya yang juga sederhana tetapi ukurannya relatif panjang, dan sel goblet tampak lebih banyak, dan berukuran lebih besar. Ukuran vili bertambah panjang dan jumlahnya lebih banyak, dengan bentuk yang lebih komplek ditemukan pada ikan sidat yang berukuran 20 cm, sedangkan sel-sel goblet ditemukan banyak dan merata disepanjang epitel mukosa usus (Gambar 15).
Lamina propria usus ikan sidat terletak di profundal dari epitel mukosa yang terdiri atas jaringan ikat longgar, lemak dan buluh darah. Lapisan ini pada ikan yang lebih kecil dari 16 cm tampak tipis didalam setiap vili, sedangkan pada ikan sidat yang berukuran lebih besar dari 16 cm lamina propria ini lebih tebal berupa
S
MS
SM LP
A A’
lapisan yang cukup tebal dan kuat untuk menopang vili mukosa yang semakin panjang. Di basal vili mukosa dan di superfisial muskularis mukosa ditemukan kelenjar lieberkuhn, dengan bentuk lumen yang dikelilingi oleh sel-sel yang berbentuk bulat berwarna merah muda dan berukuran besar. Kelenjar ini ditemukan pada ikan yang berukuran lebih besar dari 16 cm,tetapi tidak ditemukan pada ikan yang lebih kecil dari ukuran tersebut. Tunika submukosa ikan sidat terdapat jaringan ikat longgar dan buluh darah. Seperti pada lamina propria lapisan ini berukuran relatif tebal pada ikan dengan ukuran lebih besar dari 16 cm, dan sangat tipis pada ikan yang lebih kecil dari ukuran tersebut tersebut. Secara umum tunika muskularis usus ikan sidat mirip pada lambung, lapisan ini terdiri atas otot sirkular (internal) dan otot longitudinal (eksternal). Pada ikan berukuran 8 cm otot sikular dan longitudinal masih sangat tipis, sedangkan pada ikan 16 dan 20 cm otot sirkular lebih tebal dari otot longitudinal. Lapisan muskularis akan berkontraksi dalam proses penyerapan makanan , dan mendorong makanan didalam usus. Sedangkan tunika serosa memiliki jaringan ikat yang membungkus keseluruhan permukaan superfisial usus.
20
Gambar 15 Gambaran mikroskopis segmen usus A: ikan sidat 8 cm A’ insert (A)
B: ikan sidat 16 cm B’ insert (B) C: ikan sidat 20 cm C: insert (C) potongan melintang usus (A) dan A’pembesaran (A) Serosa (S)
Crypt of lieberkuhn (CL), Submucosa (SM), Lamina Muscularis (LM) Villus (V) Goblet cell (GC) Pewarnaan HE. Bar A= 200 µm dan B = 50 µm
A A’
B B’
C C
’
A
D D
’
GC
’
S
SM
V CL
Gambar 16 Gambaran mikroskopis usus ikan sidat, Goblet Cel (GC), Lamina Muscularis (LM), Villus (V), Serosa (S). (A) pewarnaan AB, (B) pewarnaan Masson Trichome ( MT) Bar = 200 µm
Pembahasan
Kualitas Perairan Muara Sungai CimandiriKualitas air merupakan parameter penting bagi organisme yang hidup di perairan, sebagai indikator untuk keberlangsungan hidupnya. Pengukuran kualitas air selama penelitian diperoleh suhu berkisar 26 – 28 oC, sedangkan suhu optimum perairan untuk pertumbuhan ikan berkisar antara 25 – 30 oC (Boyd 1979). Suhu di perairan Muara Sungai Cimandiri relatif stabil setiap bulannya. Makanan alami yang ditemukan pada ikan sidat berupa plankton, hal ini sesuai dengan kisaran suhu untuk pertumbuhan hidup plankton di perairan antara 20- 30 oC (Effendi 2003). Kedalaman setiap stasiun pengamatan berbeda dan berkisar antara 1– 4 m, karena adanya faktor tingkat ketelitian alat (kemiringan tali) terbawa arus, dan adanya pengaruh pasang surut air laut. Kekeruhan menggambarkan kondisi kejernihan dari suatu perairan, ini dapat dilihat dari berapa banyaknya cahaya yang diserap oleh bahan-bahan yang terdapat di perairan. Nilai kekeruhan berkisar antara 12 - 48 NTU, kekeruhannya tidak tinggi berdasarkan baku mutu. Nilai kekeruhan yang tertinggi ditemukan pada stasiun II. Faktor penyebab kekeruhan ini adanya bahan tersuspensi seperti pasir halus dan lumpur yang masuk ke perairan (APHA 1979).
Tingginya kecepatan arus permukaan di sungai dipengaruhi oleh aliran sungai yang ada, sedangkan di muara lebih dipengaruhi oleh adanya aliran sungai dan pasang surut air laut. Kecepatan arus berkisar antara 0,07 – 0,95 m/dtk. Berdasarkan data pengukuran kualitas air dari estuaria pengukuran menunjukkan bahwa kondisi perairan masih sesuai untuk pertumbuhan ikan sidat (Chino 2010).
Oksigen terlarut yang diperoleh selama penelitian berkisar antara 5,1 – 6,4 mg/l, nilai ini mendukung bagi ikan sidat untuk melakukan aktifitas fisiologi di perairan. Organisme aquatik menyukai perairan dengan nilai oksigen terlarut > 5,0 mg/l dan memiliki peranan penting bagi kelangsungan hidup organisme didalamnya (Swingle dalam Effendi 2003).
Muara sungai Cimandiri merupakan kawasan pasang surut air laut. Stasiun I salinitas perairannya berkisar antara 15-17 %0 salinitas perairan dikategorikan
22
Makanan Alami Ikan Sidat
Ikan sidat bersifat nokturnal (mencari makan pada malam hari). Keberadaan ikan sidat di perairan Muara Sungai Cimandiri banyak ditemukan pada stasiun I dikarenakan stasiun ini merupakan daerah muara yang dipengaruhi oleh adanya pasang surut, banyak mengandung unsur hara dan masukan bahan organik dan anorganik dari laut dan daratan. Hal tersebut sesuai dengan pernyataan Manengkey (2010) daerah muara sungai merupakan kawasan yang kaya unsur hara karena menerima masukan bahan organik dan anorganik dari daratan seperti limbah pertanian, limbah rumah tangga yang dibuang melalui sungai atau laut. Sedangkan stasiun II dan III merupakan kawasan yang masih dikelilingi oleh daratan dan adanya aktivitas pertanian.
Ikan sidat fase pertumbuhannya berkembang pesat setelah masuk ke perairan tawar melalui muara sungai. Pola pertumbuhan ikan sidat di Muara Sungai Cimandiri bersifat alometrik positif yaitu pertambahan berat lebih cepat dari pertambahan panjang ikan. Faktor yang menyebabkan nilai b yaitu faktor lingkungan, dan tahap perkembangan ikan. Kharat et al. (2008) menyatakan faktor yang menyebabkan nilai b yaitu jumlah ikan, ukuran panjang ikan, kondisi lingkungan, adanya parasit dan penyakit. Hubungan panjang dan berat ikan dapat digunakan sebagai indeks pertumbuhan untuk mengetahui panjang dan berat rata-rata ikan (Abowie dan Devies 2009). Genus Anguilla, perubahan morfologi tubuhnya mulai berkembang setelah masuk ke perairan tawar (Miller 2009). Makanan alami yang ada di perairan merupakan sumber energi bagi ikan sidat untuk dapat mempertahankan hidupnya. Ikan sidat memakan apa saja yang ditemukan di perairan, sesuai dengan fase hidupnya.
Jenis makanan yang paling dominan di dalam saluran pencernaan glass eel adalah Chlorella sp. (72%), Oschilatoria sp. (21%), Navicula sp. (4%), Synedra sp. (2%), dan Nauplius sp. (1%). Berdasarkan data tersebut, diketahui bahwa benih ikan sidat pada fase glass eel mengonsumsi lebih banyak fitoplankton dari pada zooplankton sebagai sumber makanan untuk menopang kehidupannya, dan menjadi makanan yang ideal bagi larva ikan sidat (Fukusho 1989; Kabir et al 2010). Sedangkan ikan sidat pada stadia elver jenis zooplankton lebih didominasi oleh Nauplius sp. (41%), dan Notholca sp. (33%) sedangkan makanan berupa fitoplankton terdiri atas Chlorella sp. (22%), Oscilatoria sp. (2%) dan Rhizoclonium sp (2%). Berbeda dengan fase yellow eel persentase makanan yang dikonsumsi lebih didominasi oleh jenis zooplankton yang didominasi oleh jenis crustacea (48%), ikan kecil (31%), Nauplius sp. (8%), Ephemeroptera (6%), dan Oscilatoria (7%). Dari persentase makanan yang dikonsumsi pada fase elver dan yellow eel lebih dominan zooplankton sedangkan glass eel lebih dominan fitoplankton, perubahan makanan yang dkonsumsi oleh ikan sidat seiring dengan perubahan morfologi, ukuran bukaan mulut, dan perkembangan saluran pencernaannya. Bertambahnya ukuran tubuh dapat meningkatkan proporsi makanan pada ikan (Affandi et al.2009).
didominasi oleh Chlorella sp., dan Oschilatoria sp., hal ini diduga karena kondisi stasiun III yang pinggirannya dikelilingi oleh pepohonan. Fitoplankton yang dikonsumsi glass eel di masing-masing stasiun menjadi sumber nutrisi dan energi bagi glass eel untuk hidup.
Panjang usus relatif berkolerasi cukup erat dengan panjang total tubuh R2= 0,7996 namun berkolerasi sangat erat. Semakin panjang ukuran ikan sidat semakin panjang ususnya. Dari hasil pengukuran (Gambar 7) menunjukkan pertambahan panjang usus sejalan dengan pertambahan panjang tubuh ikan sidat, data tersebut sejalan dengan Kangur et al, (2000) yang menyatakan bahwa pertambahan panjang usus ikan sejalan dengan meningkatnya panjang total tubuh. Data hubungan antara panjang usus relatif dengan panjang total ikan yang relatif tetap nilainya, menunjukkan bahwa ikan sidat bersifat karnivora dengan ukuran usus yang relatif pendek, bila dibandingkan dengan ikan herbivora yang ususnya jauh lebih panjang dari panjang tubuhnya. Sehingga dalam manajemen pemberian pakan sebaiknya glass eel di beri pakan berupa zooplankton berukuran mikro sejak fase glass eel, meskipun data hasil analisis makanan menunjukkan bahwa glass eel mengonsumsi fitoplankton dalam persentase yang tinggi.
Hasil pengukuran hubungan antara ukuran bukaan mulut terhadap panjang ikan sidat memperlihatkan hubungan yang sangat tinggi untuk kedua parameter tersebut ( R2= 0,8046). Ini mengindikasikan bahwa ada korelasi antara ukuran bukaan mulut dengan ukuran panjang ikan sidat. Konsekuensi dari data tersebut adalah bahwa ukuran makanan alami yang dapat dikonsumsi oleh glass eel relatif sama selama fase tersebut. Lebar bukaan mulut ikan sidat berkisar 363,60 – 727,20 µm akan menentukan ukuran makanan yang dimakannya (Affandi et al, 2009). Dalam manajemen pemberian pakan, ukuran pakan yang diberikan perlu memperhatikan ukuran lebar bukaan mulut ikan sidat, agar makanan yang diberikan dapat dimanfaatkan secara maksimal.
Panjang usus relatif ikan sidat ditemukan adanya hubungan yang erat antara ukuran panjang ikan sidat dengan panjang ususnya. Semakin besar ukuran ikan sidat semakin panjang ususnya. Hal ini menunjukkan bahwa ada pertumbuhan panjang usus selama stadia glass eel, hingga menjadi sidat dewasa data tersebut sejalan dengan Kangur et al (2000) yang menyatakan bahwa pertambahan panjang tubuh sejalan dengan meningkatnya panjang usus
Ketidaksingkronan antara data komposisi makanan dalam saluran pencernaan dengan panjang usus relatif ikan sidat menunjukkan adanya dua kemungkinan yakni 1) fitoplankton dikonsumsi atau termakan oleh glass eel tetapi sulit dicerna sehingga pada saat analisis kondisinya masih utuh, 2) zooplankton yang dimakan atau termakan oleh glass eel mengalami pencernaan secara cepat setelah dikonsumsi, sehingga pada saat analisis makanan kondisinya sudah tercerna dengan sempurna sehingga zooplankton tidak ditemukan dalam bentuk utuh bahkan sudah menjadi partikel halus.
Perkembangan Makro dan Mikroskopis
24
bermuara langsung ke lambung. Lambung ikan sidat yang berbentuk kerucut, dengan bagian apeks yang buntu dan mengecil, ukuran piloriknya yang relatif pendek berada diantara lambung dan usus. Usus ikan sidat yang berukuran relatif pendek dan sederhana dibandingkan pada jenis ikan karnivora lainnya.
Hasil pengukuran makroskopis saluran pencernaan ikan sidat menunjukkan adanya pertambahan panjang esofagus selama masa pertumbuhan yang relatif lambat, hal ini mengindikasikan bahwa peranan esofagus dalam proses pencernaan lebih dominan sebagai organ yang membawa makanan ke lambung (Awaad dan Moawaad 2014). Lambung ikan sidat mengalami pertumbuhan relatif lebih cepat, dibandingkan dengan esofagus, hal ini sesuai dengan jenis makanan yang dikonsumsi ikan sidat didominasi oleh zooplankton (Murtini et al 2015). Lambung ikan sidat secara fungsional, pertambahan ukuran lambung ikan disertai dengan pertambahan diameter lambung yang dipengaruhi jenis dan jumlah makanan yang dikonsumsi (Naguib et al 2011). Esofagus dengan ukuran yang relatif panjang juga ditemukan pada ikan belut (Monopterus albus) (Affandi 2009). Ikan sidat dengan ukuran lebih besar dari 16 cm, telah mengkonsumsi makanan dengan ukuran dan jenis yang lebih bervariasi berupa fitoplankton dan zooplankton, sehingga ukuran usus berpengaruh terhadap optimalisasi penyerapan makanan. Pada pertumbuhan panjang usus pada ikan karnivora yang dipengaruhi oleh jenis dan ukuran makanannya (Khojasteh 2012).
Ikan sidat mengonsumsi makanan di perairan dengan bantuan indera penciuman. Mulut yang berfungsi sebagai tempat proses awal pencernaan secara kimiawi dan hasilnya akan diteruskan ke esofagus yang menjadi pangkal muara saluran pencernaan. Esofagus ini berfungsi sebagai jalan masuknya makanan ke dalam lambung, pada lapisan epitel esofagus terdapat banyak sel goblet yang menghasilkan mukus. Mukus berfungsi untuk melapisi mukosa esofagus agar makanan mudah melalui lumen esofagus dan dapat mencegah kerusakan epitel mukosa esofagus sewaktu makanan menuju ke lambung (Raji dan Norouzi 2010). Di profundal lamina propria di tunika mucosa esofagus ikan sidat terdapat lamina propria dan tunika submukosa. Diantara lapisan inilah terdapat jaringan ikat longgar dan buluh darah. Buluh darahnya berfungsi untuk memvaskularisasi jaringan dan sel di sekitarnya (Abdulhadi 2005). Tunika mukosa esofagus dari ikan sidat memiliki sel goblet yang sangat banyak, yang berfungsi untuk memperlancar jalannya makanan masuk ke dalam lambung. Hal ini ditemukan juga pada struktur esofagus belut (Monopterus albus) dengan jumlah sel goblet yang sangat banyak di sepanjang epitelnya (Dai et al. 2007).
diantara sel-sel epitel tersebut ditemukan sel-sel goblet yang berwarna lebih cerah. Permukaan mukosa lambung terdapat vili dengan ukuran yang relatif panjang, dan pada setiap vili ikan sidat terdapat mikrovili bercabang, vili ini berfungsi untuk memperluas permukaan mukosa lambung dalam mengoptimalkan penyerapan makanan. Lipatan pada mukosa lambung berfungsi untuk memperluas area pencernaan dan meningkatkan efisiensi proses pencernaan (Osman 1991).
Mikrovili ini menembus lamina propria membentuk alur mikroskopis yang bermuara ke gastric pit. Gastric pit ini berfungsi sebagai pintu keluar dari saluran kelenjar lambung, yang terbentuk sempurna diantara epitel dan mukus. Mukus berfungsi melindungi epitel mukosa dari pengaruh asam khlorida dan enzim pepsin (Petrinec et al. 2005). Sel chief pada ikan sidat berbentuk kuboid dengan inti selnya terletak di bagian tepi, dengan sitoplasma yang berwarna ungu muda, sedangkan sel parietal berbentuk oval, inti selnya terletak di tengah sitoplasma berwarna merah muda (Gambar 13 A’). Sel chief ini memproduksi pepsinogen sebagai proenzim dari pepsin. Enzim pepsin ini berfungsi untuk mengubah protein menjadi molekul yang lebih kecil. Sel parietal berfungsi menghasilkan asam khlorida lambung yang berfungsi membunuh kuman dan bakteri pada makanan serta mengubah pepsinogen menjadi pepsin.
Kelenjar kardia memiliki lumen yang berwarna putih, dengan bentuk bervariasi, terdapat sel-sel epitel kelenjar berbentuk bulat yang mengelilinginya, distribusi kelenjar kardia ini terutama di lamina propria mukosa lambung. Kelenjar fundus terdapat di bagian fundus dengan ciri-ciri sel-sel epitel kelenjar berwarna ungu tua, distribusi kelenjar ini berada di daerah mukosa lambung (Gambar 13 ). Di bagian lamina propria terdapat jaringan ikat longgar berfungsi untuk mengikat jaringan dan sel yang ada disekitarnya (Abdulhadi 2005).
Tunika muskularis lambung mirip pada esofagus, lapisan ini terdiri dari dua lapisan otot yaitu lapisan otot sirkular (internal) longitudinal (eksternal). Tunika muskularis lambung ikan sidat berfungsi untuk membantu proses pencernaan makanan di lambung secara optimal (Nasruddin et al. 2014). Hal yang sama ditemukan pada ikan karnivora Schible mystus yang terdiri dari otot melingkar (internal) dan otot memanjang (eksternal) (Naguib 2012).
Pilorik merupakan bagian dari saluran pencernaan yang terletak diantara lambung dan usus depan, dengan ukuran kecil dan menyempit. Pilorik ikan sidat memiliki tunika mukosa membentuk vili-vili, masing-masing vili mencabangkan beberapa mikrovili. Otot ini berfungsi sebagai otot spingter untuk mencegah masuknya kembali makanan dari usus ke pilorik. Hal ini sesuai dengan penelitian Canan et al. (2012) yang menyatakan bahwa pilorik adalah regio lambung ikan Stegastes fuscus tidak memiliki kelenjar.
Usus menjadi komponen terpanjang dari saluran pencernaan, memiliki bentuk dan diameter usus yang relatif sama. Usus ikan sidat terdiri atas usus depan, tengah dan belakang, pada bagian depan dan tengah memiliki jumlah vili yang lebih banyak, sedangkan pada usus belakang jumlah vili yang ditemukan lebih sedikit. Pada ikan Rainbow trout, dan Sparus aurata memiliki usus dengan vili yang panjang dengan fungsi utama penyerapan nutrisi dengan mengoptimalkan permukaan usus (Khojasteh 2012)
26
penyerapan makanan. Fungsi kelenjar lieberkuhn yang terdapat pada mukosa menghasilkan cairan kental dalam bentuk karbohidrat (Genten et al. 2009).
Lapisan muskularis akan berkontraksi dalam proses penyerapan makanan, dan mendorong makanan di dalam usus. Sedangkan tunika serosa memiliki jaringan ikat yang membungkus keseluruhan permukaan usus. Pada ikan Rainbow trout, dan Sparus aurata memiliki usus dengan vili yang panjang dengan fungsi utama penyerapan nutrisi dengan mengoptimalkan permukaan usus (Khojasteh 2012). Makanan alami yang dikonsumsi oleh ikan sidat terdiri atas fitoplankton, zooplankton, dan nekton. Jenis makanan yang dikonsumsi ikan sidat pada fase glass eel, elver dan yellow eel sesuai dengan ukuran bukaan mulut, pertambahan panjang tubuh, perkembangan struktur makroskopis dan mikroskopis serta fungsi saluran pencernaan.
5 KESIMPULAN DAN SARAN
Kesimpulan
Berdasarkan hasil penelitian dapat disimpulkan ikan sidat merupakan ikan karnivora. Makan alaminya mengalami perubahan seiring dengan perkembangan stadia hidup, dengan pertumbuhan yang alometrik positif. Secara mikroskopis saluran pencernaan ikan sidat terdiri atas esofagus, lambung, pilorik dan usus, yang dilengkapi dengan tunika mukosa, tunika submukosa, tunika muskularis, tunika serosa. Perkembangan mikroskopis saluran pencernaan seiring dengan makanan yang dikonsumsi dari stadia perkembangan hidup ikan sidat.
Saran
Perlu dilakukan kajian lanjutan terkait dengan kelenjar yang berperan di masing-masing segmen organ saluran pencernaan ikan sidat, dengan pengamatan yang lebih mendalam sehingga dapat diketahui fungsi nya secara lebih spesifik.
DAFTAR PUSTAKA
Aarestrup K, Thorstad E, Koed A. 2010 Survival and progression rates of large european Silver eel Anguilla anguilla in late freswater and early marine phases. Technical University of Denmark. 9: 263-270.
Abowei JF. Davies AO Some population parameters of clarotes laticeps from the freshwater reaches of the lower river Niger Delta, Nigeria. Am. J. Sci. Res. 2009. 2: 15-19.
Abdulhadi HA. 2005. Some comperative histological studi on alimentary tract of tilapia fish (Tilapia spirulus) and sea bream (Mylio cuvieri). Egyptian J. Aqu Res. Vol.3.
Albrecht MP, Ferreira FN, Caramaschi EP. Anatomical features and histology of the digestive tract of two related neotropical omnivorous fishes (Characiformes; Anostomidae). J. Fish.Biol. Vol 58.2 (419-430).
Andriana R. 2001. Distribusi spasial temporal gastropoda berdasarkan siklus hidup di Muara Sungai Cimandiri Pelabuhan Ratu Jawa Barat. (Skripsi). Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. 75 hal. Aoyama J. 2009. Life history and evolution of migration in catadromous eels
(Genus Anguilla). Ocean Research Institute. The University of Tokyo. Aqua Biosci Monogr. 2(1): 1-42.
APHA (American Public Health Association) Standard methods for the examination of water and washwater. Public Health Association. Washington DC.
Awaad AS, Moawad UK, 2014. Comparative histomorphological and histochemical studies on the oesophagus of Nila tilapia (Orechromis niloticus and African Cathfish (Clarias gariepinus). J Histol.2(1). 1-11 p. Barros B. Sakai Y. Hashimoto H. Gushima K. 2011 Effect of prey density on
nocturnal zooplankton predation throughout the ontogeny of Juvenile Platax orbicularis. Environ Biol Fish. 91: 177-183.
Boyd CE 1979. Water quality manajement in pond fish culture for aquaculture experimental. Auburn University Alabama.
Canan B, do Nascimento WS, da Silva MB, Chellappa S. 2012. Morphohistology of the digestive tract of the damsel fish stegastes fuscus (Osteichthyes: Pomacentridae). Sci World J. Vol. 2012, 1-9.
Chino N, Arai T. 2010 Habitat use and habitat transitions in the tropical eel Anguillabicolor. Environ Biol Fish. 89(10) : 571 – 578.
Dai X. Fang W. Shu M. 2007. Histological and ultrastructural study of digesttive tract of rice field eel Monopterus albus. J. Ichtiol. 23(2):177-183.
Effendi H.2003. Telaah kualitas air bagi pengelolaan sumberdaya dan lingkungan perairan. Yogyakarta. Penerbit Kanisius.
Ghalambor CK, Mckay JK, Carroll SP. And Reznick DN. Adaptive versus non adaptive phenotypic plasticity and the potential for contemporary adaptation in new environment. Fuctional Ecology. 2007. 121 : 394-407.
Ikpegbu, E. Morphology of the digestive tract of the farmed African catfish. M.Sc. Disertation, University of Nigeria, 2012.
Johnson RI, Coghlan SM, Harmon T. 2007. Spatial and temporal variation in prey selection of brown trout in a cold Arkansas tailwater. Ecology of freshwater fish. 16: 373-384.
Kabir KA, Baby RL, Hasan I. 2010. High density rotifer culture as live food for larva rearing in carp hatcheries. J. Zoology. 110– 114.
Kangur K, Kangur A, Kangur P. 2000. A Comparative study on the feeding of eel. Institute of Zoology and Botang of the Estonian Agricultural University, Estonia. Hidrobiologia 408/409: 65-72.
Kharat SS, Khillare YK, Dahanukar N. 2008. Allometric scalling in growth and reproduction of a freshwater loach Nemacheilus mooreh (Sykes, 1839). J. Ichtiol. (1): 8-17.
28
Khojasteh B. 2012. The Morphology of the post gastric alimantary canal in teleost fish. Int.J Aqu Sci. 3(2):71-88.
Kiernan JA.1990. Histological and histochemical methods : Theory and Practice. Ed ke-2. Oxford (GB) : Pergamon Pr.
Machut SL. 2006. Population Dynamics, Anguillicola crassus infection, and feeding selectivity of American Eel (AnguillaRostrata) in Tributaries of the Hudson River, New York.176 p.
Manengkey HWK. 2010. Kandungan bahan organik pada sedimen di perairan teluk dan sekitarnya. JurnalPerikanandanKelautanTropis. Vol 1-3.
Miller JM. 2009. Ecology of Anguilliform leptocephali remarkable transparent fish larvae of the ocean surface layer. Aqua-BioSci. Monogr. Vol 2:4 : 1-94. Mizuno T 1979. Illustrations of Freshwater Plankton of Japan. Hoikusha
Publishing. Co. Ltd 456.p
Murray HM, Wright GM, Goff GP. 1996. A comperative histological and histochemical study of the post-gastric alimentary canal from three species of pleuronectid, the atlantic halibut, the yellowtail flounder and the winter flounder. J. Fish Biol.48; 187-206.
Murtini S, Affandi R, Nurhidayat. 2015. Makanan alami benih ikan sidat (glass
Olsson J, Quevedo M, Colson C, and Svanback R. 2007. Gut length plasticity in perch into the bowels of resouse polymorphisms. Biological Journal of the Linnean Society. 90 : 517- 523.
Osman AH, Caceci T. 1991. Histology of stomach of Tilapia nilotica (Linnaeus, 1758) from the river Nile. J.Fish Biol. 38: 211-223.
Petrinec Z, Nejedli.S, Kuir S, 2005. Mucosubstances of the digestive tract mucosa in northern pike (Esox Lucius L.) and European catfish (Silurus glanis L.). J Vet Res. 75 (4) :317-327.
Raji AR. Norouzi E. 2010 Histological and histochemical study on the allimentary canal in walking catfish (Clarias batracus) and piranha (Serrasalmus nattereri). J Vet Res. 11(1): 1-10
Widigyo B. 2001. Rumusan Kriteria Ekobiologis dalam Menentukan Potensi Kawasan Pesisir PS-SPL IPB. 156 hal.
Lampiran 1 Prosedur pewarnaan Hematoksilin Eosin (HE)
Tahapan pewarnaan hematoksilin eosinadalah sebagai berikut:
1. Proses deparafinisasi dengan menggunakan larutan xylol I, II dan III masingmasing selama 3-5 menit.
2. Proses rehidrasi dengan menggunakan alkohol bertingkat konsentrasi 100%, 95%, 90%, 80%, dan 70% masing-masing selama 3-5 menit.
3. Preparat direndam dalam air keran selama 10 menit kemudian direndam dalam akuades selama 5 menit.
4. Preparat diwarnai dengan hematoksilin selama 30-45 detik, kemudian direndam di dalam air keran selama beberapa detik.
5. Warna yang dihasilkan dikontrol di bawah mikroskop. Jika warna ungu yang dihasilkan kurang kontras, maka preparat dicelupkan kembali ke dalam pewarna hematoksilin selama 3-5 detik. Namun jika warnanya terlalu ungu, maka preparat dapat dicelupkan dalam larutan pemucat hematoksilin 1-2 kali (0,5% HCl dalam alkohol 70%).
6. Preparat kembali direndam di dalam air keran selama 10 menit lalu, direndam di dalam akuades slema 5 menit.
7. Preparat diwarnai dengan eosin selama 30-45 detik, kemudian direndam kembali dalam akuades selama 5 menit.
8. Preparat didehidrasi dengan alkohol konsentrasi bertingkat dimulai dengan 70%, 80%, 90%, 95%, dan 100% (I, II, dan III), masing-masing 2-4 kali celup.
9. Preparat dijernihkan dengan larutan xylol I, II dan III masing-masing selama 5 menit.
10. Proses mounting dilakukan dengan penutupan preparat dengan cover glass menggunakan entelan®.
30
Lampiran 2 Prosedur pewarnaan Masson Trichome (MT)
Tahapan pewarnaan masson trichomeadalah sebagai berikut:
1. Deparafinisasi, air mengalir, DW sesuai dengan prosedur.
2. Preparat diwarnai dengan hematoksilin selama 5 menit, kemudian direndam di dalam air keran selama 5 menit.
3. Warna yang dihasilkan dikontrol di bawah mikroskop. Jika warna ungu yang dihasilkan kurang kontras, maka preparat dicelupkan kembali ke dalam pewarna hematoksilin selama 3-5 detik. Namun jika warnanya terlalu ungu, maka preparat dapat dicelupkan dalam larutan pemucat hematoksilin 1-2 kali (0,5% HCl dalam alkohol 70%).
4. Preparat kembali direndam di dalam DW selama 5 menit.
5. Preparat diwarnai dengan Acid Fuchsin + Ponceau 2R selama 10-15 menit. 6. Dicuci/direndam dalam 1% acetic acid (in DW) dan di kontrol di bawah
mikroskop.
7. Preparat diwarnai dengan Orange G + Phosphotungstic selama 5 menit. 8. Dicuci/direndam dalam 1% acetic acid (in DW) dan di kontrol di bawah
mikroskop.
9. Preparat diwarnai dengan Light green selama detik-menit.
10. Dicuci/direndam dalam 1% acetic acid (in DW) dan di kontrol di bawah mikroskop (sampai warna hijau kontras dengan warna lainnya).
11. Preparat didehidrasi dengan alkohol absolut masing-masing 5 menit. 12. Preparat diclearing dan dimounting.
Lampiran 3 Prosedur pewarnaan periodic acid Schiff (PAS)
Prosedur pewarnaan PAS adalah sebagai berikut:
1. Proses deparafinisasi dengan menggunakan larutan xylol I, II dan III masing-masing selama 3-5 menit.
2. Proses rehidrasi dengan menggunakan alkohol bertingkat konsentrasi 100%, 95%, 90%, 80%, dan 70% masing-masing selama 3-5 menit.
3. Preparat direndam dalam air keran selama 10 menit kemudian dibersihkan dengan cara direndam dalam akuades selama 5 menit.
4. Preparat dioksidasi di dalam larutan 0,5% periodic acid selama 5 menit pada suhu kamar. Kemudian dibilas dengan akuades selama 3x @ 5 menit. 5. Preparat direndam di dalam Schiff reagent selama 15-30 menit.
6. Preparat direndam dalam air sulfit selama 3 x @ 5 menit, dan kemudian dibilas dengan akuades selama 3 x @ 5 menit.
7. Preparat dicelupkan dalam counterstain (mayer hematoksilin). Intensitas warna dikontrol di bawah mikroskop.
8. Preparat dicuci dengan air mengalir selama 10 menit lalu dibilas dengan akuades selama 2 x @ 5 menit.
9. Preparat didehidrasi dan clearing pada rak khusus pewarnaan AB-PAS serta mounting sesuai prosedur standar.
32
Lampiran 4 Prosedur pewarnaan alcian blue (AB) pH 2.5
Prosedur pewarnaan AB adalah sebagai berikut:
1. Proses deparafinisasi dengan menggunakan larutan xylol I, II dan III masing-masing selama 3-5 menit.
2. Proses rehidrasi dengan menggunakan alkohol bertingkat konsentrasi 100%, 95%, 90%, 80%, dan 70% masing-masing selama 3-5 menit.
3. Preparat direndam dalam air keran selama 10 menit kemudian direndam dalam akuades selama 5 menit.
4. Penurunan pH dengan merendamkan preparat ke dalam larutan asam asetat 3% pada suhu kamar selama 5 menit.
5. Preparat diwarnai dengan alcian blue pH 2.5 selama 30 menit. 6. Preparat dicuci dengan asam asetat 3% selama 3 x @ 5 menit.
7. Preparat dicelupkan dalam counterstain (nuclear fast red). Intensitas warna dikontrol di bawah mikroskop.
8. Preparat dicuci dengan akuades pada suhu kamar selama 3 x @ 5 menit. 9. Preparat didehidrasi dan clearing pada rak khusus pewarnaan AB-PAS serta
mounting dengan prosedur standar.
Lampiran 5 Stasiun pengambilan sampel
Stasiun 1
34
36
Lampiran 7 Jenis makanan alami ikan sidat
Pleurosigma sp. Oscilatoria sp. Notholca sp.
Chlorella sp. Diatom sp. Coscinodiscus sp.
larva gastropoda Nauplius sp. Navicula sp.