1 DEPARTEMEN BIOLOGI FMIPA USU
OPTIMASI pH DAN PENAMBAHAN NaCl TERHADAP
AKTIVITAS SENYAWA ANTIMIKROBA Bacillus cereus DA
5.2.3 DALAM MENGHAMBAT BIOFILM BAKTERI
PATOGEN OPORTUNISTIK TAMBAK UDANG
SKRIPSI
INA TUTURINA SITEPU 080805067
Skripsi ini diajukan sebagai salah satu syarat untuk mendapatkan Gelar Sarjana Sains Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara Medan
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
DEPARTEMEN BIOLOGI FMIPA USU
PERSETUJUAN
Judul : OPTIMASI pH DAN PENAMBAHAN NaCl
TERHADAP AKTIVITAS SENYAWA ANTIMIKROBA Bacillus cereus DA 5.2.3
DALAM MENGHAMBAT BIOFILM BAKTERI PATOGEN OPORTUNISTIK TAMBAK
UDANG
Kategori : SKRIPSI
Nama : INA TUTURINA SITEPU
Nomor Induk Mahasiswa
: 080805067
Program Studi : SARJANA (S-1) BIOLOGI
Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di Medan, Januari 2015
Komisi Pembimbing:
Pembimbing 2 Pembimbing 1
Dra. Nunuk Priyani, M.Sc Dr.It Jamilah, M.Sc
NIP. 19640428 199603 2 001 NIP. 19631210 199103 2 003
Diketahui/Disetujui Oleh Departemen Biologi FMIPA USU
Ketua,
ii
DEPARTEMEN BIOLOGI FMIPA USU
PERNYATAAN
OPTIMASI pH DAN PENAMBAHAN NaCl TERHADAP AKTIVITAS SENYAWA ANTIMIKROBA Bacillus cereus DA 5.2.3 DALAM MENGHAMBAT BIOFILM BAKTERI PATOGEN OPORTUNISTIK
TAMBAK UDANG
SKRIPSI
Saya mengakui bahwa skripi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Januari 2015
DEPARTEMEN BIOLOGI FMIPA USU
ABSTRAK
Produktivitas tambak udang dalam beberapa tahun terakhir mengalami penurunan yang antara lain disebabkan oleh adanya bakteri patogen oportunis pada tambak udang sepertiE. coli,Salmonellasp. dan Staphylococcusaureus. Tujuan dari penelitian ini adalah untuk mengetahui daya hambat senyawa antimikroba
Bacillus cereus DA 5.2.3 yang diproduksi pada pH optimum dan penambahan konsentrasi NaCl terhadap pertumbuhan biofilm bakteri patogen oportunistik tambak udang.Penelitian ini menggunakan bakteri Bacillus cereus DA 5.2.3 sebagai penghasil senyawa antimikroba dan bakteri patogen yang digunakan adalah bakteri patogen oportunistik pada tambak udang yaitu E. coli, Salmonella sp., dan Staphylococcus aureus.Bacillus cereus DA 5.2.3 dikultur dalam media SWC cair pada pH 5, 6, 7, 8, dan 9 dengan penambahan NaCl 0, 1, 2, dan 3 % untuk menghasilkan senyawa antimikroba. Kultur disentrifugasi dengan kecepatan 10000 rpm selama 15 menit. Senyawa antimikroba diujikan terhadap bakteri patogen dengan metode kertas cakram. Senyawa antimikroba tersebut juga diujikan terhadap sel biofilm bakteri patogen. Senyawa antimikroba yang diproduksi pada pH 5 dan penambahan NaCl 2 % dapat menghambat pertumbuhan ketiga bakteri patogen. Penghambatan senyawa antimikroba terhadap petumbuhan sel biofilm umur 1 hari sebesar hampir 100 % terhadap ketiga bakteri patogen oportunistik yang diujikan.Pada sel biofilm yang berumur 3 hari terjadi penghambatan sebesar 96% terhadap Salmonella sp., 95% terhadap
E.coli, dan sebesar hampir100 % terhadap Staphylococcus aureus.
iv
DEPARTEMEN BIOLOGI FMIPA USU
ABSTRACT
Shrimp farm productivity in recent years has decreased partly due to the presence of opportunistic pathogenic bacteria in shrimp ponds such as E. coli, Salmonella sp. and Staphylococcus aureus. This study wants to know the ability of Bacillus cereus DA 5.2.3 antimicrobial compounds which is produced in optimum pH and adding of NaCl concentration to inhibit growth of the cell biofilm of opportunistic pathogen bacteria in shrimp ponds. This study uses the bacteria Bacillus cereus
DA 5.2.3 as a producer of antimicrobial compounds and pathogenic bacteria used are opportunistic pathogens bacteria in shrimp ponds are E. coli, Salmonella sp., and Staphylococcus aureus. Bacillus cereus DA 5.2.3 was cultured in liquid medium SWC at pH 5, 6, 7, 8, and 9 with the addition of NaCl 0, 1, 2, and 3% to produce antimicrobial compounds. Culture was centrifuged at 10,000 rpm for 15 minutes. Antimicrobial compounds were tested against pathogens by disc diffusion method. The antimicrobial compound was also tested against biofilm cells of pathogenic bacteria. Antimicrobial compounds were produced at pH 5 and the addition of 2% NaCl can inhibit the growth of third opportunistic pathogenic bacteria.Inhibition of antimicrobial compounds on the growth of one day old biofilm cell was almost 100% of the third opportunistic pathogen bacteria which are tested. The three days old biofilm cell was reduced as much as 96 % of
Salmonella sp., 95 % of E.coli, and almost 100 % of Staphylococcus aureus.
DEPARTEMEN BIOLOGI FMIPA USU
PENGHARGAAN
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa yang telah memberikan kasih dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini. Skripsi yang berjudul “Optimasi pHdan Penambahan NaCl Terhadap Aktivitas Senyawa Antimikroba Bacillus cereus DA 5.2.3 Dalam Menghambat Biofilm Bakteri Patogen Oportunistik Tambak Udang”, dibuat sebagai salah satu syarat untuk meraih gelar sarjana Biologi FMIPA USU, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Ibu Dr. It Jamilah, M.Sc selaku pembimbing I dan Ibu Dra. Nunuk Priyani, M.Sc selaku pembimbing II yang telah banyak memberi bimbingan dan saran kepada penulis dalam penyelesaian skripsi ini. Penulis juga mengucapkan terima kasih kepada Bapak Prof. Dr. Erman Munir, M.Sc selaku dosen penguji I dan Bapak Dr. Miswar Budi Mulya, M.Si selaku dosen penguji II yang telah banyak memberikan saran serta masukan demi kesempurnaan penulisan skripsi ini.
Penulis juga mengucapkan terima kasih kepada Ibu Dra. Nunuk Priyani, M.Sc selaku Dosen Pembimbing Akademik serta Kepala Laboratorium Mikrobiologi, Ibu Dr. Nursahara Pasaribu, M.Sc selaku Ketua Departemen Biologi FMIPA USU dan Ibu Dr. Saleha Hanum, M.Sc selaku sekretaris Departemen Biologi FMIPA USU, seluruh staff pengajar Departemen Biologi FMIPA USU, Ibu Nurhasni Muluk, Bang Erwin dan Kak Rosalina Ginting selaku staf pegawai Departemen Biologi FMIPA USU.
Ucapan terima kasih yang sebesar-besarnya penulis sampaikan kepada kedua orangtua penulis, B. Sitepu dan R. Hasibuan untuk segala dukungan yang telah diberikan kepada penulis baik itu doa, materi, semangat serta kasih sayang yang tak ada habis-habisnya. Kalian adalah sumber inspirasi terbesar saya dalam menempuh pendidikan ini. Terima kasih juga penulis ucapkan untuk kedua adik laki-laki saya, Raymond Sitepu dan Brian Gamaliel Sitepu. Kalian berdualah pemicu api semangat saya untuk segera menyelesaikan pendidikan ini. Kasih sayang kalian lah yang membuat saya kuat hingga sampai saat ini.
Terima kasih penulis sampaikan kepada keluarga besar Hasibuan dan Sitepu. Setiap dukungan, semangat dan doa yang kalian berikan sangat berarti banyak bagi saya. Takkan pernah bisa saya membalas setiap kebaikan kalian. Tuhan lah yang sekiranya akan membalaskannya.
vi
DEPARTEMEN BIOLOGI FMIPA USU
Ucapan terima kasih penulis sampaikan kepada Dhana H.S Hutagaol, lelaki yang telah hadir membawa warna baru di setiap sisi kehidupan saya. Lelaki yang membuat penulis mampu berdiri setegar karang dalam segala keadaan dan memandang segalanya dari sisi yang berbeda. Lelaki yang kuat dan penuh kesabaran untuk mengerti akan segala kekuranganku.
Penulis menyadari sepenuhnya bahwa dalam pembuatan skripsi ini masih banyak kekurangan. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan skripsi ini. Akhir kata, penulis mengucapkan terima kasih.
Medan, Januari 2015
DEPARTEMEN BIOLOGI FMIPA USU
2.1 Perkembangan Ekspor Udang 4
2.2 Bakteri Patogen Oportunis pada Udang 5
2.2.1 Escherichia coli 5
2.2.2 Salmonella 6
2.2.3Staphylococcus aureus 7
2.3 Biofilm 8
2.4 Bacillus Sebagai Penghasil Bakteriosin 8
BAB 3. BAHAN DAN METODE
3.1Waktu dan Tempat 10
3.2Alat dan Bahan 10
3.3Peremajaan Isolat Bakteri Patogen dan Bacillus 10 3.4 Optimasi pH dan Penambahan NaCl dalam
Pengendalian Sel Bakteri Patogen dengan Senyawa
Antimikroba Bacillus cereus DA 5.2.3 11
3.4.1 Optimasi pH dan PenambahNaCl 11
3.5 Pembentukan Sel Biofilm 11
3.6 Pengendalian Sel Biofilm Patogen Dengan
Senyawa Antimikroba Bacillus cereus DA 5.2.3 12 3.6.1 Produksi Senyawa Antimikroba Bacillus cereus
DA 5.2.3 12
3.6.2 Uji Aktivitas Senyawa Antimikroba Bacillus cereus DA 5.2.3 Terhadap Biofilm Bakteri Patogen
viii
DEPARTEMEN BIOLOGI FMIPA USU
BAB 4. HASIL DAN PEMBAHASAN
4.1 Optimasi pH dan Penambahan NaCl Pada Media Produksi Terhadap Aktivitas Senyawa Antimikroba
Bacillus cereus DA 5.2.3
13
4.1.1 Daya Hambat Senyawa Antimikroba Bacillus cereus DA 5.2.3 Tehadap Bakteri Patogen
Salmonella sp.
13
4.1.2 Daya Hambat Senyawa Antimikroba Bacillus cereus DA 5.2.3 Tehadap Bakteri Patogen E. coli
14
4.1.3 Daya Hambat Senyawa Antimikroba Bacillus cereus DA 5.2.3 Tehadap Bakteri Patogen
Staphylococcus aureus
14
4.2 Pengendalian Sel Biofilm Bakteri Patogen Dengan
Senyawa Antimikroba Bacillus cereus DA 5.2.3 17
BAB 5. KESIMPULAN DAN SARAN
5.1 Kesimpulan 19
5.2 Saran 19
DEPARTEMEN BIOLOGI FMIPA USU
DAFTAR TABEL
Halaman
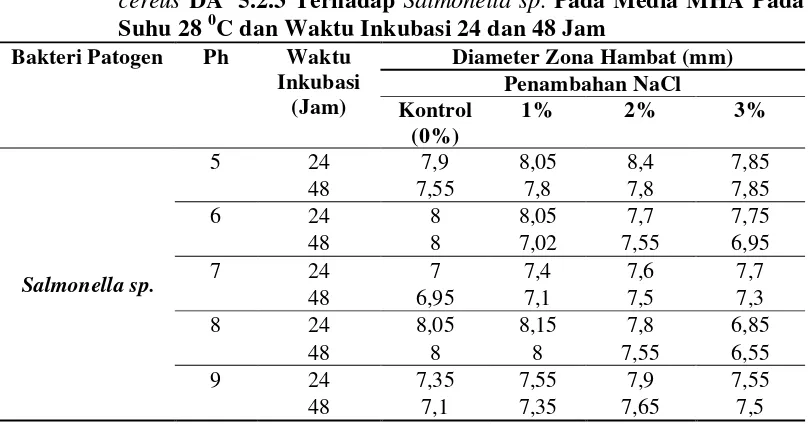
Tabel 1. Rata-rata besar zona hambat senyawa antimikroba
Bacillus cereus DA 5.2.3 terhadapSalmonellasp. pada media MHA pada suhu 280C danwaktu inkubasi 24 dan
48 jam 13
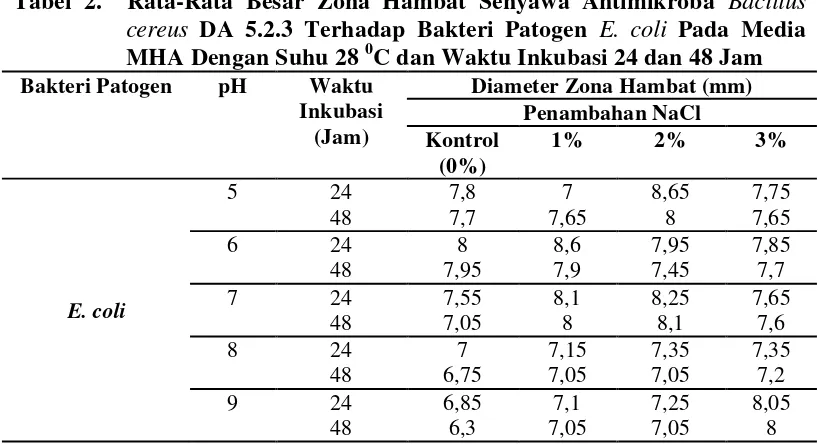
Tabel 2. Rata-rata besar zona hambat senyawa antimikroba
Bacillus cereus DA 5.2.3 terhadapE. coli pada media
MHA pada suhu 280C danwaktu inkubasi 24 dan 48 jam 14 Tabel 3. Rata-rata besar zona hambat senyawa antimikroba
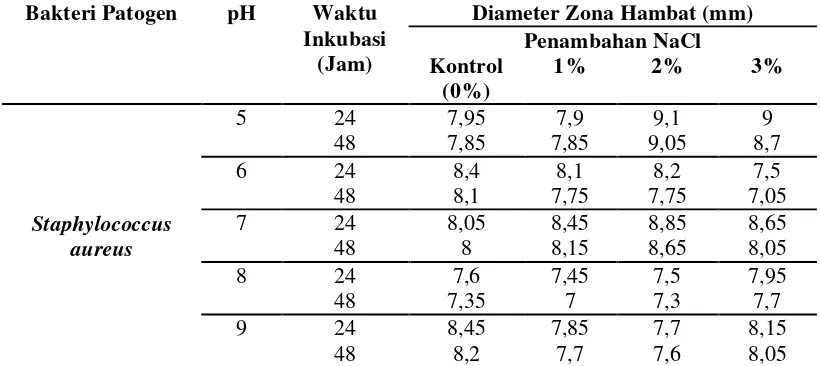
Bacillus cereus DA 5.2.3 terhadapStaphylococcus aureus. pada media MHA pada suhu 280Cdan waktu
inkubasi 24 dan 48 jam 15
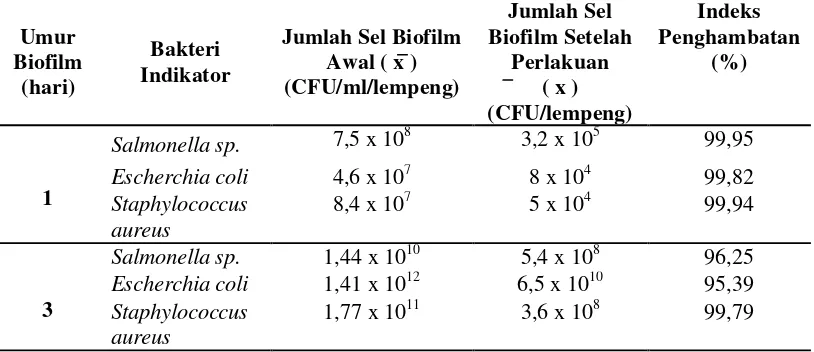
Tabel 4. Jumlah Sel Biofilm Bakteri Uji sebelum dan setelah kontak dengan senyawa antimikroba bakteri Bacillus
x
DEPARTEMEN BIOLOGI FMIPA USU
DAFTAR GAMBAR
Halaman
Gambar 1. Zona hambat senyawa antimikrobaBacillus cereus DA 5.2.3pada pH 5 dan NaCl 2% terhadap (a)Staphylococcusaureus; (b) Salmonella sp.; (c) E.coli
DEPARTEMEN BIOLOGI FMIPA USU
DAFTAR LAMPIRAN
Halaman
iii
DEPARTEMEN BIOLOGI FMIPA USU
ABSTRAK
Produktivitas tambak udang dalam beberapa tahun terakhir mengalami penurunan yang antara lain disebabkan oleh adanya bakteri patogen oportunis pada tambak udang sepertiE. coli,Salmonellasp. dan Staphylococcusaureus. Tujuan dari penelitian ini adalah untuk mengetahui daya hambat senyawa antimikroba
Bacillus cereus DA 5.2.3 yang diproduksi pada pH optimum dan penambahan konsentrasi NaCl terhadap pertumbuhan biofilm bakteri patogen oportunistik tambak udang.Penelitian ini menggunakan bakteri Bacillus cereus DA 5.2.3 sebagai penghasil senyawa antimikroba dan bakteri patogen yang digunakan adalah bakteri patogen oportunistik pada tambak udang yaitu E. coli, Salmonella sp., dan Staphylococcus aureus.Bacillus cereus DA 5.2.3 dikultur dalam media SWC cair pada pH 5, 6, 7, 8, dan 9 dengan penambahan NaCl 0, 1, 2, dan 3 % untuk menghasilkan senyawa antimikroba. Kultur disentrifugasi dengan kecepatan 10000 rpm selama 15 menit. Senyawa antimikroba diujikan terhadap bakteri patogen dengan metode kertas cakram. Senyawa antimikroba tersebut juga diujikan terhadap sel biofilm bakteri patogen. Senyawa antimikroba yang diproduksi pada pH 5 dan penambahan NaCl 2 % dapat menghambat pertumbuhan ketiga bakteri patogen. Penghambatan senyawa antimikroba terhadap petumbuhan sel biofilm umur 1 hari sebesar hampir 100 % terhadap ketiga bakteri patogen oportunistik yang diujikan.Pada sel biofilm yang berumur 3 hari terjadi penghambatan sebesar 96% terhadap Salmonella sp., 95% terhadap
E.coli, dan sebesar hampir100 % terhadap Staphylococcus aureus.
DEPARTEMEN BIOLOGI FMIPA USU
ABSTRACT
Shrimp farm productivity in recent years has decreased partly due to the presence of opportunistic pathogenic bacteria in shrimp ponds such as E. coli, Salmonella sp. and Staphylococcus aureus. This study wants to know the ability of Bacillus cereus DA 5.2.3 antimicrobial compounds which is produced in optimum pH and adding of NaCl concentration to inhibit growth of the cell biofilm of opportunistic pathogen bacteria in shrimp ponds. This study uses the bacteria Bacillus cereus
DA 5.2.3 as a producer of antimicrobial compounds and pathogenic bacteria used are opportunistic pathogens bacteria in shrimp ponds are E. coli, Salmonella sp., and Staphylococcus aureus. Bacillus cereus DA 5.2.3 was cultured in liquid medium SWC at pH 5, 6, 7, 8, and 9 with the addition of NaCl 0, 1, 2, and 3% to produce antimicrobial compounds. Culture was centrifuged at 10,000 rpm for 15 minutes. Antimicrobial compounds were tested against pathogens by disc diffusion method. The antimicrobial compound was also tested against biofilm cells of pathogenic bacteria. Antimicrobial compounds were produced at pH 5 and the addition of 2% NaCl can inhibit the growth of third opportunistic pathogenic bacteria.Inhibition of antimicrobial compounds on the growth of one day old biofilm cell was almost 100% of the third opportunistic pathogen bacteria which are tested. The three days old biofilm cell was reduced as much as 96 % of
Salmonella sp., 95 % of E.coli, and almost 100 % of Staphylococcus aureus.
DEPARTEMEN BIOLOGI FMIPA USU
BAB 1
PENDAHULUAN
1.1Latar Belakang
Indonesia merupakan negara yang mempunyai potensi sumber daya perikanan
yang sangat besar. Ekspor produk hasil perikanan telah memberikan kontribusi
yang cukup besar bagi devisa negara. Menurut data Departemen Kelautan dan
Perikanan (2005), selama tahun 2002-2004, nilai ekspor dari sektor ini rata-rata
mencapai US$ 1,6 miliar setiap tahun. Komoditas yang menjadi penyumbang
devisa terbesar adalah udang dengan nilai ekspor sekitar US$ 800 juta, atau 50%
dari total nilai ekspor produk perikanan. Kesempatan untuk mengembangkan
perikanan budi daya udang guna memenuhi kebutuhan pasar dunia masih sangat
besar.
Beberapa tahun terakhir ini produktivitas tambak udang mengalami
penurunan antara lain disebabkan oleh munculnya berbagai macam penyakit.
Kendala lain yang harus dihadapi dalam pasar dunia bagi komoditi ekspor
perikanan budi daya tidak hanya kuantitas saja, akan tetapi juga kualitas atau
mutu udang. Tingkat kualitas dan keamanan makanan yang diuji berdasarkan ada
tidaknya residu antibiotik, bakteri patogen, racun hayati laut dan residu pestisida
juga harus mendapatkan perhatian yang serius. Bakteri indikator uji mutu kualitas
dan makanan antara lain Coliform, Escherichia coli, Salmonella sp.,
Staphylococcus aureus, dan Vibrio (Djazuli, 2002).
Menurut Verschuere et al. (2000) penggunaan antibiotik untuk
menanggulangi penyakit dapat menimbulkan masalah baru, yaitu terakumulasinya
antibiotik pada lingkungan dan spesies yang dibudi daya serta timbulnya resistensi
mikroba patogen. Resistensi mikroba terhadap antibiotik semakin meningkat
karena resistensi dapat ditransfer dari satu mikroba ke mikroba lainnya. Selama
ini dalam budi daya tambak atau akuakultur, pengendalian penyakit masih
2
DEPARTEMEN BIOLOGI FMIPA USU
termasuk tidak bijaksana, karena selain dapat menyebabkan resistensi
pada bakteri yang merugikan. Pada umumnya antibiotik menimbulkan residu yang
nantinya akan mencemari tambak itu sendiri. Hal ini disebabkan karena
penggunaan dalam dosis tinggi, jenis yang sangat beragam, penggunaan dalam
jangka waktu lama dan penggunaan jenis yang tidak dapat diurai secara biologis
(non biodegradable).
Dari hasil penelitian yang dilakukan oleh Lestari (2007), diketahui
Bacillus sp. memiliki kemampuan untuk menghambat pertumbuhan bakteri
patogen pada udang. Bacillus sp. mampu menghasilkan berbagai jenis zat
antimikroba, diantaranya adalah bakteriosin. Zat antimikroba ini mempunyai efek
bakteriosida atau bakteriostatik. Karakterisasi zat antimikroba isolat Bacillus sp.
yang dilakukan oleh Bintarti (2008), menunjukkan adanya aktivitas
penghambatan terhadap V. harveyi, E. coli, dan Staphylococcus aureus.
Bakteri patogen oportunis pada tambak udang dapat membentuk biofilm
(Koonse et al. 2005). Silitonga, et al. (2012), telah mengisolasi bakteri patogen
E.coli,Staphylococcus sp., dan Salmonella sp. dari tambak udang yang mampu
membentuk biofilm pada permukaan lempeng Stainless steel. Pengendalian sel
biofilm bakteri patogen tersebut dilakukan dengan pemanasan pada suhu 100 0C
serta pemberian klorin dengan konsentrasi 225 ppm. Simanullang (2014), telah
menguji zat antimikroba yang dihasilkan oleh bakteri Bacillus cereus DA 5.2.3
yang mampu menghambat pertumbuhan biofilm bakteri patogen oportunistik asal
tambak udang yakni: E.coli, Staphylococcus sp. dan Salmonella sp. secara in
vitro. Sejauh ini belum dilakukan optimasi faktor lingkungan maupun faktor
fisiologis aktivitas senyawa antimikroba tersebut, sehingga diperlukan penelitian
lebih lanjut tentang optimasi pH dan pengaruh penambahan NaCl dalam
menghasilkan senyawa antimikroba yang mampu menghambat bakteri patogen.
1.2Perumusan Masalah
Peningkatan permintaan konsumen terhadap udang di pasar dunia memacu
3
DEPARTEMEN BIOLOGI FMIPA USU
menanggulangi masalah penyakit pada udang yang disebabkan oleh bakteri
patogen maupun lingkungannya, sehingga dilakukan penelitian untuk
menggunakan mikroba yang aktivitasnya dapat menghambat pertumbuhan bakteri
patogen tersebut. Salah satunya ialah senyawa antimikroba dari bakteri Bacillus
cereus DA 5.2.3. Penelitian sebelumnya menunjukkan kemampuan dari bakteri ini
dalam menghambat pertumbuhan bakteri patogen seperti E. coli, Salmonella, dan
Staphylococcus aureus asal tambak udang. Namun, belum diketahui kondisi
optimum bakteri Bacillus ini dalam memproduksi senyawa antimikroba tersebut.
Penelitian ini bertujuan untuk mengetahui pH optimum, serta melihat pengaruh
penambahan NaCl dalam memproduksi senyawa antimikroba Bacillus cereus DA
5.2.3 untuk mengendalikan pertumbuhan biofilm bakteri patogen yang berasal
dari tambak udang.
1.3Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui daya hambat senyawa antimikroba
Bacillus cereus DA 5.2.3 yang diproduksi pada pH optimum dan penambahan
konsentrasi NaCl terhadap pertumbuhan biofilm bakteri patogen oportunistik
tambak udang.
1.4Manfaat Penelitian
Melalui penelitian ini diharapkan dapat menghasilkan senyawa antimikroba dari
Bacillus cereus DA 5.2.3 yang mampu mengendalikan pertumbuhan biofilm
bakteri patogen seperti E.coli, Salmonella, dan Staphylococcus. Penelitian ini juga
bermanfaat bagi masyarakat sebagai sumber informasi dalam upaya menghadapi
masalah pada tambak udang. Hasil dari penelitian ini dapat dijadikan sebagai
DEPARTEMEN BIOLOGI FMIPA USU
BAB 2
TINJAUAN PUSTAKA
2.1 Perkembangan Ekspor Udang
Di Indonesia produksi udang sangat berkembang dengan pesat. Hal ini dapat
dilihat dari jumlah permintaan pasar internasional akan hasil produksi udang
Indonesia. Saat ini udang menyumbang lebih dari 62 % dari total nilai ekspor
produk perikanan Indonesia. Pasar utama ekspor udang Indonesia adalah Jepang
(52 %), Amerika Serikat (18 %), dan Eropa (15 %) (Putro, 2004). Dalam upaya
meningkatkan produksi udang telah dilakukan upaya budi daya dengan
pendayagunaan tambak kolam dan danau. Usaha budi daya udang di daerah padat
nelayan umumnya sudah tinggi (over exploited), seperti yang banyak dijumpai di
perairan paparan Sunda (Rukyani, 2000).
Permintaan yang meningkat tidak sejalan dengan produksi biomassa udang
dalam tahun terakhir ini. Data Kementerian Kelautan dan Perikanan mencatat
produksi udang pada 2011 tidak mencapai target yaitu hanya 381.288 ton atau
90,78 % dari target yang ditetapkan yaitu 410.000 ton. Beberapa kajian diketahui
penyebab penurunan produksi budi daya udang adalah merosotnya kualitas
lingkungan perikanan budi daya yang memicu munculnya serangan penyakit
(Rukyani, 2000). Pencemaran bahan organik di tambak merangsang timbulnya
penyakit udang yang disebabkan bakteri patogen dan virus. Salah satu penyakit
pada budi daya udang adalah penyakit bakterial yang disebabkan oleh
bakteri-bakteri yang bersifat oportunis patogen. Udang yang telah terkontaminasi bakteri-bakteri
patogen jelas tidak memenuhi persyaratan untuk dikonsumsi. Usaha yang
dilakukan untuk menanggulangi penyakit pada budi daya udang adalah dengan
menggunakan obat-obatan kimia dan antibiotik. Namun, penanggulangan dengan
cara tersebut membawa dampak buruk karena adanya residu bahan antibiotik pada
udang (Muliani et al, 2003).
5
DEPARTEMEN BIOLOGI FMIPA USU
Sejak tahun 2004, pemerintah Jepang mengikuti jejak Uni Eropa dengan
menetapkan zero tolerance terhadap residu kloramfenikol dan nitrofuran pada
udang impor. Akibatnya beberapa kontainer udang yang diekspor dari Indonesia,
ditahan atau ditolak di pelabuhan masuk karena dicurigai mengandung antibiotik
tersebut. Seperti diketahui bahwa pemeriksaan terhadap residu antibiotik di
Jepang selama ini hanya difokuskan pada tetrasiklin termasuk OTC
(oxytetracycline) dan CTC (chlortetracycline) (Putro, 2004).
2.2 Bakteri Patogen Oportunis Pada Udang
Salah satu penyebab turunnya volume produksi udang Indonesia adalah
munculnya berbagai macam penyakit yang disebabkan oleh bakteri patogen
oportunis. Penyakit dapat bermula dari kondisi pemeliharaan dan air yang buruk
yang dapat memperlemah daya tahan udang dan membuatnya rentan terhadap
penyakit yang disebabkan oleh patogen oportunis. Bakteri patogen oportunis pada
tambak udang ialah bakteri yang bukan ada secara alamiah pada perairan tambak,
tetapi masuk ke tambak akibat tercemarnya lingkungan dengan limbah buangan
manusia. Beberapa diantara bakteri ini ialah coliform, E. coli, Salmonella sp.,
Staphylococcuss aureus, dan Vibrio (Harish et al. 2003; Hattha et al. 2003).
Sebagian bakteri patogen oportunistik yang ada pada tambak udang
tersebut diduga dapat membentuk biofilm pada udang, tempat pemrosesan,
maupun dipermukaan substrat pada tambak. Mikroorganisme merupakan agen
utama yang mengambil tempat di permukaan untuk menghasilkan biofilm
(Bishop, 2007). Biofilm memiliki bentuk yang beragam dan terdapat pada
permukaan jaringan hidup dan dapat merusak peralatan kesehatan, industri, pipa
saluran air dan saluran mata air (Donlan, 2002; Callow & Callow, 2008). Menurut
Lens et al. (2003), terungkap bahwa biofilm memiliki ketahanan terhadap
antibakteri, biosida, dan temperatur yang tinggi.
2.2.1 Escherichia coli
Bakteri Escherichia coli (E. coli) termasuk dalam famili Enterobacteriaceae.
Bakteri ini bersifat oksidase negatif, termasuk dalam golongan bakteri Gram
6
DEPARTEMEN BIOLOGI FMIPA USU
motil karena adanya flagella. Bakteri ini memiliki rentangan suhu pertumbuhan
yang sangat luas yaitu 15-45 oC dengan suhu optimum 37 oC. Bakteri ini resisten
pada pemanasan suhu 550 C selama 60 menit atau pada suhu 60 0C selama 15
menit. Menurut Pelczar & Chan (1993) Struktur dinding sel bakteri Escherichia
coli berlapis-lapis yang terdiri dari lipopolisakarida, peptidoglikan, dan protein.
Lipopolisakarida ini mengandung antigen O dan enterotoksin yang dapat
melindungi sel dari perubahan lingkungan. Menurut Holt et al. (1986) ciri
biokimia dari bakteri ini ialah memiliki kemampuan memfermentasi laktosa,
reaksi indol positif, metil positif, uji VP (Voges- Proskauer) negatif dan tidak
dapat menggunakan sitrat sebagai sumber karbon satu-satunya. Pada media EMB
(Eosin Metilen Blue) bakteri ini menunjukan warna hijau metalik.
Bakteri ini merupakan mikroflora normal yang terdapat pada usus besar
manusia dan hewan berdarah panas lainnya yang dalam keadaan tertentu dapat
bersifat sebagai patogen. Kemampuan suatu bakteri patogen untuk menyebabkan
infeksi dipengaruhi oleh faktor virulensi yang dimilikinya. Faktor virulensi
merupakan kemampuan yang dimiliki oleh bakteri untuk dapat bertindak sebagai
bakteri patogen (Inglis,1996). Spesies ini dapat dijadikan sebagai indikator
buruknya sanitasi, dikarenakan tercemarnya lingkungan tambak udang oleh
limbah manusia. Oleh karena itu, salah satu syarat mutu udang ialah bebas
cemaran mikroba seperti E.coli (Kanduri, 2002).
2.2.2 Salmonella
Kelompok ini adalah bakteri Gram negatif yang dapat dibedakan dari flora normal
usus dengan cara kriteria biokimia dan antigen. Salmonella tidak
memfermentasikan laktosa, tetapi kebanyakan membentuk H2S dan gas dari
karbohidrat dan akan mendekarboksilasi lisin. Beberapa sifat Salmonella adalah
bersifat motil dengan flagella ataupun jika tidak motil termasuk Gram negatif,
positif pada uji Metyl Red, memproduksi nitrit dan nitrat, mampu menggunakan
amonium sitrat dan tidak menghidrolisa urea. Akan tetapi, tidak seperti organisme
saluran pencernaan, Salmonella selalu dianggap sebagai patogen potensial,
7
DEPARTEMEN BIOLOGI FMIPA USU
merupakan bakteri patogen dan menyebabkan masalah kesehatan yang serius
(D’Aoust & Maurer,2007).
Penyakit yang disebabkan oleh bakteri ini disebut sebagai Salmonellosis.
Pada udang maupun biota lain yang dikonsumsi oleh manusia, tidak
diperbolehkan terdapat bakteri ini. Berkaitan dengan hal tersebut, maka pada
lingkungan perairan budi daya biota laut harus diupayakan bebas dari bakteri
Salmonella sp. Jika suatu perairan telah terkontaminasi oleh Salmonella sp.,
menunjukkan danya penurunan kualitas air (Hatmanti, 2003).
2.2.3 Staphylococcuss aureus
Bakteri ini merupakan bakteri Gram positif yang termasuk dalam famili
Micrococcaceae. Beberapa galur membentuk pigmen kuning keemasan dan tidak
larut dalam air. Sifat koagulase positif dari galur bakteri ini dapat memproduksi
bermacam-macam toksin sehingga memiliki potensi patogenik yang tinggi dan
dapat menyebabkan keracunan makanan. Bakteri ini bersifat anaerobik fakultatif
tetapi pada keadaan anaerobik pertumbuhannya sangat lambat. Suhu optimum
untuk pertumbuhan S. aureus adalah 35-37 0C dengan suhu minimum 6-7 0C dan
suhu maksimal 45,5 0C. Bakteri ini sering terdapat pada pori-pori dan permukaan
kulit, kelenjar keringat dan saluran usus. S. aureus dapat menyebabkan intoksikasi
dan infeksi, di dalam makanan yang dapat menyebabkan timbulnya gejala
intoksikasi biasanya mencapai 106 sel/g makanan (Fardiaz,1981).
Pertumbuhan bakteri S. aureus pada pangan dan olahannya dapat
mengancam kesehatan masyarakat karena beberapa galur S. aureus memproduksi
enterotoksin yang dapat menyebabkan kasus keracunan pangan (food poisoning).
Pangan yang tercemar atau mengandung S. aureus enterotoksigenik sangat
berbahaya bagi kesehatan konsumen karena tidak adanya mikroorganisme pesaing
lainnya yang biasanya dapat menghambat pertumbuhan S. aureus dan
pembentukan toksin dari S. aureus. Enterotoksin yang diproduksi S. aureus lebih
8
DEPARTEMEN BIOLOGI FMIPA USU
2.3 Biofilm
Biofilm merupakan sekumpulan mikroba yang hidup berkoloni dan menempel
pada permukaan padat. Mikroba tersebut menghasilkan senyawa ekstraseluler,
sehingga membentuk matriks eksopolimer yang luas, yang sebagian besar terdiri
dari polisakarida. Penempelan bakteri ini didefinisikan sebagai sel-sel
mikroorganisme yang termobilisasi pada substrat dan terperangkap di dalam
polimer ekstraseluler yang diproduksi oleh mikroorganisme tersebut. Komunitas
biofilm ini umumnya terbentuk diantara fase padat dan fase cair (Yunus, 2000).
Di alam mikroorganisme lebih banyak terdapat dalam keadaan menempel
pada permukaan dari pada yang tersuspensi dalam fase cairan. Sel yang menempel
pada permukaan padat ini kemudian berkembang menjadi biofilm yang stabil
yang merupakan komunitas mikroorganisme. Biofilm di alam banyak berperan
positif dalam kehidupan, misalnya akumulasi biofilm pada dasar sungai atau
lautan berperan dalam menguraikan polutan terlarut (Brierly, 1984).
Sel biofilm bakteri memiliki karakteristik fisiologi yang khas, dimana
dalam kondisi tersebut biasanya sel lebih tahan terhadap kondisi-kondisi yang
tidak sesuai bagi pertumbuhannya seperti keberadaan senyawa antimikroba, suhu
dan pH dibandingkan dengan sel yang hidup bebas (planktonik). Umumnya
bakteri patogen oportunis di tambak udang seperti E. coli, Salmonella, Vibrio,
Psedomonas dapat membentuk biofilm (Koonse et al. 2005). Hal ini lah yang
menjadi perhatian khusus dalam menanggulangi penyakit pada udang.
2.4 Bacillus Sebagai Penghasil Bakteriosin
Definisi probiotik pada akuakultur adalah mikroba hidup yang memiliki efek
menguntungkan pada inang dengan cara memodifikasi asosiasi inang atau ambang
batas komunitas mikroba dengan meningkatkan penggunaan pakan atau nilai
nutrisi, meningkatkan ketahanan inang terhadap penyakit atau meningkatkan
kualitas lingkungan. Berdasarkan definisi tersebut, maka probiotik termasuk juga
mikroba yang mencegah proliferasi patogen dalam saluran pencernaan, pada
permukaan tubuh inang, dan pada lingkungan, mikroba yang dapat meningkatkan
9
DEPARTEMEN BIOLOGI FMIPA USU
Bakteriosin merupakan zat antimikroba yang berupa polipeptida pendek.
Bakteriosin disintesis di ribosom oleh bakteri selama masa pertumbuhannya dan
umumnya hanya menghambat galur-galur bakteri yang berkerabat dekat dengan
bakteri penghasil bakteriosin (Jack et al. 1995, Kone & Fung 1992). Kriteria yang
merupakan ciri-ciri bakteriosin adalah (1) memiliki spektra aktivitas yang sempit,
(2) senyawa aktif merupakan polipeptida atau protein, (3) bersifat bakterisida, (4)
mempunyai reseptor spesifik pada sel sasaran, dan (5) gen determinan terdapat
pada plasmid, plasmid rekombinan atau episom, kromosom atau transposon yang
berperan pada produksi dan imunitas (Tagg et al. 1976).
Salah satu mikroorganisme probiotik yang telah banyak diteliti ialah
bakteri dari genus Bacillus. Bacillus merupakan bakteri Gram positif, berbentuk
batang, memiliki endospora, bersifat motil, dan tergolong dalam bakteri aerob
atau anaerob fakultatif (Holt et al, 1994). Genus Bacillus merupakan kandidat
pengendali hayati yang baik, karena dapat menghasilkan beberapa metabolit aktif
seperti antibiotik, proteinase, dan bakteriosin (Torkar &Matijasic, 2003).
Beberapa peneliti telah berhasil mengisolasi dan memurnikan bakteriosin
yang diproduksi oleh Bacillus sp. Diantaranya Subtilin dihasilkan oleh B. subtilis
(Klein et al. 1993), Megacin oleh B. megaterium (Tagg et al. 1976), Coagulin
oleh B. coagulans I4 (Hyronimus 1998), Cerein oleh B. cereus (Oscariz &
Pisabarro 2000), dan Tochicin oleh B. thuringiensis (Paik et al. 1997). Pada tahun
1939, Rene Dubos telah mengisolasi dari New Jersey suatu kultur Bacillus brevis
yang membentuk suatu substansi yang mampu mematikan banyak bakteri
Gram-positif. Ekstrak bebas sel yang diperoleh dari B. brevis ditemukan mengandung
dua bahan aktif, yang sekarang dikenal dengan nama gramisidin dan tirosidin
(Pelczar & Chan, 2005).
Hasil penelitian Isramilda (2007) menunjukkan bahwa bakteri Bacillus sp.
Lts 40 dapat menghasilkan zat antimikroba yang memiliki persentase
penghambatan 3% - 7% terhadap V. harveyi dan E. coli. Persentase penghambatan
Bacillus sp. Lts 40 terhadap V. harveyi dan E. coli masing-masing sebesar 81,8%
dan 85,5%. Bacillus sp. Lts 40 menghasilkan 2 jenis bakteriosin dengan berat
molekul 47,38 kDa yang lebih efektif dalam menghambat pertumbuhan V.
DEPARTEMEN BIOLOGI FMIPA USU
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan April 2014 sampai dengan Oktober
bertempat di Laboratorium Mikrobiologi Departemen Biologi Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara Medan.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah cawan petri, tabung reaksi, rak
tabung reaksi, gelas beaker, gelas ukur, pipet serologi, karet penghisap, spatula,
cutton bud, pipet tetes, autoklaf, oven, mikroskop, erlenmeyer, sentrifus, kertas
cakram, pH meter, water bath shaker, inkubator.
Bahan-bahan yang digunakan dalam penelitian ini adalah isolat bakteri
patogen tambak udang E.coli, Salmonella sp., dan Staphylococcus aureus, isolat
bakteri Bacillus cereus DA 5.2.3 koleksi Laboratorium Mikrobiologi, media
MHA (Mueller-Hinton Agar), media SWC (Sea Water Complete) cair, media
SWC padat, HCl 0,1N, NaOH 0,1N dan NaCl. Sedangkan alat yang digunakan
yaitu lempeng Stainless steel (SS), manik-manik kaca (glass bead), akuades steril,
larutan garam fisiologis.
3.3 Peremajaan Isolat Bakteri Patogen dan Bacillus
Preparasi alat dilakukan sebagai tahap awal dalam penelitian ini. Alat-alat yang
diperlukan dalam penelitian ini dipersiapkan dan disterilisasi menggunakan
autoklaf maupun oven. Selanjutnya, dilakukan peremajaan bakteri Bacillus cereus
DA 5.2.3 dan bakteri patogen E. coli, Salmonella sp., dan Staphylococcus aureus
11
DEPARTEMEN BIOLOGI FMIPA USU
3.4 Optimasi pH dan Penambahan NaCl dalam Pengendalian Sel Bakteri Patogen dengan Senyawa Antimikroba Bacillus cereus DA 5.2.3
3.4.1 Optimasi pH dan Penambahan NaCl
Pengoptimasian pH produksi senyawa antimikroba dilakukan dengan preparasi
media SWC cair. Disediakan erlenmeyer sebanyak 5 buah. Ke dalam erlenmeyer
dimasukkan media SWC cair sebanyak 40 ml. Ke dalam media ditetesi HCl 0,1 N
dan NaOH 0,1 N untuk mendapatkan pH 5, 6, 7, 8, dan 9 yang diukur dengan
pHmeter. Dari masing-masing Erlenmeyer dipipet sebanyak 9 ml dimasukkan ke
dalam tabung reaksi steril, kemudian dimasukkan NaCl sebanyak 0,1 g, 0,2 g, 0,3
g, kemudian ditsreilkan. Satu tabung tidak ditambahkan NaCl sebagai kontrol.
Sebanyak 1 ml suspensi bakteri Bacillus cereus DA 5.2.3 dengan konsentrasi 108
CFU/ml diinokulasikan ke dalam masing-masing tabung reaksi yang berisi media
SWC steril. Kemudian digoyang pada waterbath shaker 120 rpm pada suhu 28 oC
selama 21 jam. Kultur Bacillus cereus DA 5.2.3 dimasukkan ke dalam tabung
sentrifugasi, kemudian disentrifugasi dengan kecepatan 10.000 rpm pada suhu
4 oC selama 15 menit. Selanjutnya dilakukan penyaringan senyawa antimikroba
dengan kertas saring 0,22 µm sehingga diperoleh senyawa antimikroba Bacillus
cereus DA 5.2.3. Kertas cakram ditetesi masing-masing dengan senyawa
antimikroba sebanyak 30µ L, kemudian kertas cakram diletakkan pada media
MHA pada masing-masing cawan petri yang telah diinokulasi kultur bakteri
patogen E.coli, Salmonella sp., Staphylococcus aureus dengan kepadatan 108
CFU/ml. Pengamatan aktivitas senyawa antimikroba dilakukan setelah diinkubasi
pada suhu 28oC selama 24 jam dengan menghitung diameter zona hambat yang
terbentuk.
3.5 Pembentukan Sel Biofilm
Lempeng Stainless Stell (SS) dipotong seluas 1 cm2, dicuci dengan deterjen Rinso
pada bak sonikator kemudian dibilas dengan akuades lalu disterilkan dengan
autoklaf selama 15 menit, tekanan 1 atm, suhu 121 ºC. Lempeng ini digunakan
untuk bahan pelekatan biofilm. Masing-masing isolat bakteri patogen
ditumbuhkan pada 100 ml media SWC cair dengan konsentrasi sel 106 CFU/ml
pada pH 7, dalam labu erlenmeyer 500 ml kemudian digoyang pada kecepatan
12
DEPARTEMEN BIOLOGI FMIPA USU
lempeng SS dimasukkan ke masing-masing media pengkulturan tersebut.
Pembentukan biofilm dilihat pada hari ke 1 dan 3 hari
3.6 Pengendalian Sel Biofilm Patogen dengan Senyawa Antimikroba Bacillus cereus DA 5.2.3
3.6.1 Produksi Senyawa Antimikroba Bacillus cereus DA 5.2.3
Kultur Bacillus cereus DA 5.2.3 murni berumur 24 jam diinokulasikan ke dalam
100 ml media SWC cair dengan kondisi pH dan penambahan NaCl yang optimum
dari perlakuan sebelumnya dan diinkubasi di atas water bath shaker dengan
kecepatan 120 rpm. Pengambilan sampel dilakukan setelah 21 jam (dengan
mengambil 10 ml kultur kemudian dimasukkan ke tabung sentrifus). Suspensi
bakteri tersebut disentrifus dengan kecepatan 10000 rpm dengan suhu 4 oC selama
15 menit. Supernatan bebas sel yang diduga mengandung senyawa antimikroba
diambil untuk perlakuan selanjutnya.
3.6.2 Uji Aktivitas Senyawa Antimikroba Terhadap Biofilm Bakteri Patogen
Supernatan bebas sel dari media produksi diambil, kemudian dilakukan uji
terhadap biofilm bakteri patogen. Sebanyak 5 ml supernatan bebas sel
dimasukkan ke dalam erlenmeyer 50 ml steril. Sebanyak 2 buah lempeng SS
bakteri uji dimasukkan ke dalam erlenmeyer dan dibiarkan selama 1 jam sambil
digoyang diatas water bath shaker. Lempeng diangkat kemudian dibilas dengan
akuades steril sebanyak 3 kali. Dimasukkan ke dalam 9 ml larutan garam
fisiologis yang ditambah dengan 0,5 gram manik-manik kaca (glass bead)
kemudian dihomogenkan dengan vortek selama 2 menit untuk melepas biofilm.
Diambil 1 ml suspensi biofilm kemudian dimasukkan ke dalam tabung reaksi
yang berisi larutan garam fisiologis steril untuk pengenceran berseri. Sebanyak 1
DEPARTEMEN BIOLOGI FMIPA USU
BAB 4
HASIL DAN PEMBAHASAN
4.1 Optimasi pH dan Penambahan NaCl pada Media Produksi terhadap Aktivitas Senyawa Antimikroba Bacillus cereus DA 5.2.3
4.1.1 Daya Hambat Senyawa Antimikroba Bacillus cereus DA 5.2.3 Terhadap Bakteri Patogen Salmonellasp.
Hasil uji aktivitas senyawa antimikroba yang diproduksi dengan rentang pH
5, 6, 7, 8, 9 dan penambahan NaCl dengan konsentrasi 0, 1, 2, dan 3% dapat
menghambat pertumbuhan bakteri Salmonella sp. Diameter zona bening terbesar
terdapat pada pH 5 dan konsentrasi NaCl 2% yaitu sebesar 8,4 mm pada inkubasi
24 jam dan 7,8 mm pada inkubasi 48 jam (Tabel 1). Hal ini mungkin karena sel
bakteri Salmonella sp. mengalami kerusakan dinding sel karena adanya senyawa
antimikroba. Menurut D’Aoust & Maurer (2007), senyawa antimikroba dapat
masuk ke dalam lapisan fosfolipid membran sel Salmonella sp. dan akan
menyebabkan terjadinya lisis sel dan denaturasi protein dinding sel yang dapat
mengakibatkan kebocoran materi intraseluler.
Tabel 1. Rata-Rata Besar Zona Hambat Senyawa Antimikroba Bacillus cereus DA 5.2.3 Terhadap Salmonellasp. Pada Media MHA Pada Suhu 28 0C dan Waktu Inkubasi 24 dan 48 Jam
Bakteri Patogen Ph Waktu
14
DEPARTEMEN BIOLOGI FMIPA USU
4.1.2 Daya Hambat Senyawa Antimikroba Bacillus cereus DA 5.2.3 Terhadap Bakteri Patogen Oportunistic E. coli
Hasil uji aktivitas senyawa antimikroba yang diproduksi dengan rentang
pH 5, 6, 7, 8, 9 dan penambahan NaCl dengan konsentrasi 0, 1, 2, dan 3% dapat
menghambat pertumbuhan bakteri E. coli. Hal ini ditunjukkan dengan
terbentuknya zona bening. Diameter zona bening terbesar terdapat pada pH 5 dan
konsentrasi NaCl 2% didapatkan sebesar 8,65 mm pada inkubasi 24 jam dan
sebesar 8 mm pada inkubasi 48 jam (Tabel 2). Hal ini mungkin karena aktivitas
sel bakteri E.coli terganggu oleh adanya senyawa antimikroba. Senyawa
antimikroba dapat merusak komponen-komponen dinding sel bakteri seperti
peptidoglikan, lipopolisakarida, dan lipoprotein. Menurut Kanduri (2002),
terjadinya akumulasi senyawa antimikroba dapat mengikat daerah hidrofobik
membran membran protein, dan dapat melarut baik pada fase lipid dari membran bakteri.
Tabel 2. Rata-Rata Besar Zona Hambat Senyawa Antimikroba Bacillus cereus DA 5.2.3 Terhadap Bakteri Patogen E. coli Pada Media MHA Dengan Suhu 28 0C dan Waktu Inkubasi 24 dan 48 Jam
Bakteri Patogen pH Waktu
Inkubasi
Hasil uji aktivitas senyawa antimikroba yang diproduksi dengan rentang
pH 5, 6, 7, 8, 9 dan penambahan NaCl dengan konsentrasi 0, 1, 2, dan 3% dapat
menghambat pertumbuhan bakteri Staphylococcus aureus. Hal ini ditunjukkan
dengan terbentuknya zona bening. Diameter zona bening terbesar terdapat pada
15
DEPARTEMEN BIOLOGI FMIPA USU
diujikan, zona hambat terhadap bakteri Staphylococcus aureus merupakan zona
hambat terbesar. Hal ini mungkin disebabkan karena bakteri Staphylococcus
aureus dan Bacillus cereus merupakan sama-sama bakteri Gram positif. Menurut
Jack et al. (1995), senyawa antimikroba ataupun bakteriosin pada umumnya
menghambat bakteri yang berkerabat dekat dengan bakteri penghasil senyawa
antimikroba tersebut.
Tabel 3. Rata-Rata Besar Zona Hambat Senyawa Antimikroba Bacillus cereus DA 5.2.3 Terhadap Staphylococcus aureus Pada Media MHA Pada Suhu 280C dan Waktu Inkubasi 24 dan 48 Jam
Bakteri Patogen pH Waktu
Inkubasi
NaCl merupakan salah satu faktor pertumbuhan bakteri Bacillus cereus DA 5.2.3
dalam memproduksi senyawa antimikroba yang dapat menghambat pertumbuhan
bakteri patogen Salmonella sp., E.coli, dan Staphylococcus aureus. Jika
dibandingkan dari keseluruhan data, pH 5 dan penambahan NaCl 2 % merupakan
kondisi yang optimum bagi bakteri Bacillus cereus DA 5.2.3 dalam memproduksi
senyawa antimikroba. Menurut Naufalin et al (2007), senyawa antimikroba akan
lebih aktif pada pH rendah karena diduga terjadi sinergi antara komponen
antimikroba dengan komponen pengatur keasaman. Jika pH rendah maka proton
yang terdapat dalam jumlah tinggi dalam medium akan masuk ke dalam
sitoplasma sel sehingga terjadi penurunan pH sitoplasma. Penurunan pH
sitoplasma menyebabkan sel akan bekerja untuk mengembalikan pH internal sel
menjadi normal. Aktivitas ini akan membutuhkan energi dalam jumlah yang
16
DEPARTEMEN BIOLOGI FMIPA USU
menghasilkan senyawa antmikroba. Okanlawon (2010), melaporkan bahwa
Bacillus cereus mampu tumbuh dan bertahan hidup pada kisaran pH 3-10. Bakteri
ini dilaporkan dapat tumbuh pada media dengan kondisi pemberian NaCl 1-9 %.
Penelitian ini menunjukkan bahwa penambahan konsentrasi NaCl menyebabkan
pertumbuhan bakteri menurun.
Senyawa antimikroba merupakan salah satu faktor penting sebagai agensia
pengendali hayati. Secara umum kondisi optimum produksi bakteriosin
dipengaruhi oleh fase pertumbuhan, pH media, suhu inkubasi, jenis sumber
karbon, jenis sumber nitrogen, dan konsentrasi NaCl (Kim & Ahn, 2000).
Diameter zona hambat inkubasi 48 jam mengalami penurunan bila
dibandingkan dengan diameter zona hambat inkubasi 24 jam. Hal ini mungkin
pada inkubasi 48 jam bakteri patogen tumbuh kembali di sekitar zona bening
sehingga menyebabkan penurunan besar diameter zona hambat, selain itu
mungkin disebabkan karena penurunan kemampuan senyawa antimikroba dalam
menghambat pertumbuhan bakteri patogen. Menurut Rachmaniar (1997), faktor
yang mempengaruhi besar kecilnya zona hambat zat antimikroba antara lain
akivitas zat antimikroba, resistensi bakteri uji terhadap substansi zat antimikroba,
kadar substansi aktif serta jumlah inokulum bakteri dan kepadatan bakteri uji.
Zona hambat yang terbentuk memperlihatkan zona hambat yang kabur dan
yang bening. Zona hambat yang kabur diduga merupakan senyawa antimikroba
yang bersifat menghambat pertumbuhan sel bakteri patogen. Sementara itu zona
hambat yang tegas merupakan senyawa antimikroba yang bersifat bakterisidal,
dimana senyawa tersebut dapat membunuh sel bakteri patogen seperti yang
terlihat pada gambar 1 dibawah ini.
Gambar 1. Zona Hambat Senyawa Antimikroba Bacillus cereus DA 5.2.3 Pada pH 5 dan NaCl 2% Terhadap (a) Staphylococcus aureus; (b) Salmonella sp.; (c) E.coli
c
b
17
DEPARTEMEN BIOLOGI FMIPA USU
4.2Pengendalian Sel Biofilm Bakteri Patogen dengan Senyawa Antimikroba
Senyawa antimikroba yang dihasilkan oleh Bacillus cereus DA 5.2.3 mampu
menghambat pertumbuhan sel biofilm pada Salmonella sp., E.coli, dan
Staphylococcus aureus. Pada masa inkubasi 1 hari terjadi penurunan jumlah sel
sebesar 3 log CFU/lempeng pada ketiga bakteri patogen tersebut, sedangkan pada
masa inkubasi 3 hari terjadi penurunan sel sebesar 2 log CFU/lempeng sel
biofilm pada Salmonella sp., dan E.coli dan sebesar 3 log CFU/lempeng pada sel
biofilm Staphylococcus aureus. (Tabel 4)
Tabel 4. Jumlah Sel Biofilm Bakteri Uji Sebelum dan Setelah Kontak Dengan Senyawa Antimikroba Bakteri Bacillus cereus DA 5.2.3
Umur
bakteri patogen setelah dilakukan kontak dengan senyawa antimikroba yang
dihasilkan oleh Bacillus cereus DA 5.2.3 pada inkubasi 1 hari maupun 3 hari.
Penurunan jumlah sel biofilm tersebut mungkin disebabkan rusaknya dinding sel
biofilm yang mengandung polisakarida yang menyebabkan pengurangan
sperlekatan pada permukaan padat. Namun tidak seluruhnya sel biofilm dapat
dibunuh oleh senyawa antimikroba tersebut. Hal ini mungkin terjadi karena
adanya ketahanan biofilm terhadap senyawa antimikroba yang diberikan.
Menurut Dewanti (1997), polisakarida ekstraseluler (PE) yang dihasilkan
oleh bakteri yang membentuk biofilm berperan dalam meningkatkan ketahanan
bakteri biofilm terhadap kondisi lingkungan yang tidak menguntungkan dimana
lapisan PE diasumsikan sebagai pelindung sel.
Menurut Yunus (2000), laju pertumbuhan dan umur koloni sel biofilm
18
DEPARTEMEN BIOLOGI FMIPA USU
senyawa kimia. Sel biofilm mensintesis matriks polimer terhidrasi yang
disintesisnya untuk membentuk biofilm dan terakumulasi di dalamnya. Apabila
kondisi ini terbentuk, maka sel sangat sukar untuk dilepaskan oleh senyawa
DEPARTEMEN BIOLOGI FMIPA USU
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian maka dapat disimpulkan bahwa senyawa
antimikroba dari bakteri Bacillus cereus DA 5.2.3 yang diproduksi pada kondisi
pH 5 dan penambahan NaCl 2 % mampu menghambat ketiga bakteri patogen
oportunistik yang diujikan, yakni Salmonella sp., Staphylococcus aureus, dan E.
coli. Penghambatan senyawa antimikroba terhadap petumbuhan sel biofilm umur
1 hari sebesar hampir 100 % terhadap ketiga bakteri patogen oportunistik yang
diujikan. Pada sel biofilm yang berumur 3 hari terjadi penghambatan sebesar 96
% terhadap Salmonella sp., 95 % terhadap E.coli, dan sebesar hampir 100 %
terhadap Staphylococcus aureus.
5.2 Saran
Berdasarkan penelitian yang telah dilakukan maka dinilai perlu melakukan
penelitian lebih lanjut terhadap senyawa antimikroba Bacillus cereus A 5.2.3
dalam hal pemurnian, pengkarakterisasian, serta perlu dilakukan uji
penghambatan pada bakteri patogen yang berbeda. Perlu diperhatikan pula hal-hal
DEPARTEMEN BIOLOGI FMIPA USU
DAFTAR PUSTAKA
Bintarti, A. 2008. Karakteristik Antimikroba-Polipeptida dari Isolat Bacillus sp. LTW 54 Asal Tambak Udang. Skripsi. FMIPA. Bogor: Institut Pertanian Bogor.
Bishop, LM. 2007. The Role of Biofilm in Water Reclamation and Reuse. J Water Sci Technol. 55(1-2): 19-26.
Brierly, C.L. 1982. Microbial Mining. Sci. Am. 247: 44
Callow, JA dan Callow, ME. 2008. Biofilms. School of Biosciences. Birmingham: The University of Birmingham. hlm: 30.
Characklis, W.G, Marshall K.C. 1990. Biofilms. New York: John Willey & Sons. hlm: 47.
D’Aoust, J. and Maurer, J. 2007. Salmonella species. In Doyle, M. P. and Beuchat, L. R. (Eds). Food microbiology: Fundamentals and frontiers, p. 187-219. Washington, D. C: ASM Press.
Departemen Kelautan dan Perikanan, 2005. Tabel Ekspor Hasil Perikanan Indonesia Menurut Komoditi, Berat, dan Nilai Tahun 2002-2004.
http://www.dkp.go.id/content.php?c=2068. [21 September 2007].
Dewanti & Hariadi, R. 1997. Pembentukan Biofilm pada Permukaan Rapat. J Teknol Ind Pangan. 8 (1): 1-7.
Djazuli, V. 2002. Penanganan dan Pengolahan Produk Perikanan Budidaya dalam Menghadapi Pasar Global: Peluang dan Tantangan. Bogor: Perikanan dan Ilmu Kelautan IPB. Hlm: 52
Donlan, RM. 2002. Biofilms: Microbial Life on Surfaces. Emerging Infectious Diseases. 8(9): 881-890.
Fardiaz S, S. Betty, dan L. Jenie. 1981. Masalah keamanan pangan dalam hubungannya dengan mikrobilogi veterineri. Kumpulan makalah Kongres Nasional Mikrobiologi ke III. Jakarta, 26-28 November 1981: 307-310.
21
DEPARTEMEN BIOLOGI FMIPA USU
Hatha, AA. Maqbool TK. dan Kumar, SS. 2003. Microbial quality of shrimp product of export trade produced from aquacultures. J Food Microbial.82: 2113-2122
Holt JG, Kreig NR, Sneath HA, Staley JT, William ST. 1986. Bergey’s Manual of
Determinative Bacteriology. Ed ke-9. Baltimore: A Waverly Company. hlm: 77.
Hyronimous B, Le Marrec C, Urdaci MC. 1998. Coagulin, a bacteriocin-like inhibitory substance produced by Bacillus coagulan 14. J APP Microbiol.
85: 42-50.
Inglis TJ. 1996. Microbiology and Infection a Clinically-Orientated Core Text with Self-Asserments. New York: Churchill Livingstone. hlm: 154.
Isramilda. 2007. Karakterisasi Zat Antimikrob Penghambat Pertumbuhan Vibrio harveyi dan Escherichia coli dari Bacillus sp. Asal Tambak Udang. Tesis. FMIPA. Bogor: Institut Pertanian Bogor.
Jack RW, Tagg JR, Ray B. 1995. Bacteriocin of Gram Positive Bacteria. J Microbiol Rev 59: 171-200.
Jamilah, I dan Priyani, N. 2012. Efektifitas Bacillus sp. Penghasil Senyawa Antimikroba dalam Membunuh Sel Biofilm Patogen Opurtunis pada Budidaya Udang. Laporan Akhir Penelitian Desentralisasi Skim Hibah Bersaing. Lembaga Penelitian Universitas Sumatera Utara.
Kanduri L, Eckhardt RA. 2002. Food Safety in Shrimp Processing. New York: Fishing New Books.
Kim CHGE Ji dan C Ahn. 2000. Purification and Moleculer Characterization of a Bacteriocin from Pediococcus sp KCA 1202-10 Isolated from fermented Flatfish. J Food Sci Biotechnol. 9 : 270-276.
Klein C, Kaletta C, Entian KD. 2003. Biosynthesis of the lantibiotic subtilin is regulated by a histidin kinase/response regulator system. J Appl Environ Microbiol. 59: 296-303.
Kone K & Fung YC. 1992. Undertanding Bacterions and their usus in food. J Food Environ Sanit. 12: 282-285.
Koonse B, Burkhadt W3rd, Hoskin GP. 2005. Salmonella in the sanitary quality of aquaculture shrimp. J Food Prot. 68: 2527-2532.
Lens, P. Morgan AP. Moran. Mahony, T. Stoodley, P. & O’flaherty, V. 2003.
22
DEPARTEMEN BIOLOGI FMIPA USU
Lestari, D. 2007. Isolasi dan Seleksi Bacillus sp. untuk biokontrol pada tambak udang. Skripsi. FMIPA. Bogor: Institut Pertanian Bogor.
Muliani, A. suwanto dan Lala, H. 2003. Isolasi dn Karakterisasi Bakteri Asal Laut Sulawesi Untuk Biokontrol Penyakit Vibriosis pada Udang Windu (Panaeus monodon Fab). Hayati. J Biosains. 6 (12)
Naufailn, R. Betti, S.L.J. Feri, K. Minarwati.Herastuti, S.R. 2007. Pengaruh pH, NaCl dan Pemanasan Terhadap Stabilitas Antibakteri Bunga Kecambang dan Aplikasinya Pada Daging Sapi Giling. J Teknol Ind Pangan. 17 (3)
Okanlawon, B.M. S.T. Ogonbanwo, A.O. Okunlola. 2010. Growth Of Bacillus cereus Isolated From Some Traditional Condiments Under Different Regimens. J Biotechnol. 8(14)
Oscariz JC, Pisabarro AG. 2000. Characterization and Mechanism of Action of Cerein 7, a Bacteriocin Produced by Bacillus cereus Bc 7. J Appl Microbial 89: 361-369.
Paik HD, Bae SS, Park SH, Pan JG. 1997. Identification and Partial Characterization of Tochicin a Bacterion Produced by Bacillus thuringiensis subsp. Tochingiensis. J Indust Microbial Biotechnol 19: 294-298.
Pelczar & Chan, ECS. 1993. Dasar-dasar Mikrobiologi. Jakarta: UI Press. Hal: 513.
Putro. 2004. Indonesian Shrimp Industry Outlook-2004 and Beyond. Global Shrimp Outlook Conference, Los Cabos, Mexico. hlm: 56-57.
Rachmaniar, R. 1997. Potensi Spons Asala Kepulauan Spermonde Sebagai Anti Mikroba. Seminar Perikanan Indonesia II. Ujung Pandang 2-3 Desembe 1997.
Rukyani, A. 2000. Masalah penyakit udang dan harapan solusinya. Makalah. Sarasehan AkuakulturNasional 2000. Bogor: Institut Pertanian Bogor. 7.
Slamet. 2000. Cemaran Mikrobiologis Udang Tambak Segar di Jawa Barat. [Skripsi]. Bogor: IPB. Hlm. 24-35.
Silitonga YW, It J, Dwi S. 2012. Pengenalian Sel Biofilm Bakteri Patogen Oportunistik Dengan Panas dan Klorin. J Saintia Biologi. 1:4.
23
DEPARTEMEN BIOLOGI FMIPA USU
Torkar KG, Matijasic & Matijusic. 2003. Partial Characterization of Bacteriocins Produced by Bacillus cereus Isolates from Milk and Milk Product. J Food Technol Biotechnol 41: 121-129.
Verschuere L, Rombaut G, Sorgeloos P, Verstraete W. 2000. Probiotic Bacteria as Control Agent in Aquaculture. J Mol Biol Biotechnol 64(4): 655-671.
Yunus, L. 2000. Pembentukan Biofilm Oleh Salmonella blockey Pada Permukaan
DEPARTEMEN BIOLOGI FMIPA USU
LAMPIRAN: BAGAN KERJA
PEREMAJAAN BAKTERI PATOGEN (E.coli, Staphylococcus, Salmonella)
PEREMAJAAN BAKTERI Bacillus
cereus DA 5.2.3
OPTIMASI pH dan PENAMBAHAN
NaCl
PENGENDALIAN BIOFILM BAKTERI PATOGEN PADA PERMUKAAN
STAINLESS STEEL PRODUKSI SENYAWA ANTIMIKROBA EKSTRAK
KASAR PEMBENTUKAN