PERKEMBANGAN MIKROSPORA DAN INDUKSI PEMBELAHAN
SPOROFITIK PADA KULTUR ANTERA KELAPA SAWIT
(Elaeis guineensis Jacq.)
POPI SEPTIANI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
POPI SEPTIANI. Perkembangan Mikrospora dan Induksi Pembelahan Sprofitik pada Kultur Antera Kelapa Sawit (Elaeis guineensis Jacq.). Dibimbing oleh ENCE DARMO JAYA SUPENA dan JULIARNI.
Pengembangan varietas hibrida kelapa sawit membutuhkan ketersediaan galur-galur murni untuk dijadikan tetua. Teknologi haploid dapat dikembangkan untuk menghasilkan galur-galur murni (tanaman haploid ganda) secara efisien hanya dalam 1-2 generasi. Penelitian ini bertujuan menginduksi pembelahan sporofitik pada kultur antera dalam media dua lapis yang merupakan langkah awal pengembangan kultur haploid pada kelapa sawit. Pangkal spikelet dari spikelet yang terdapat pada pangkal malai dari malai jantan yang memiliki ¼ bagian pangkal malai berwarna kuning dan ¾ bagian ujung malai berwarna coklat mengandung mikrospora tahap uninukleat akhir. Sedangkan ujung spikelet dari spikelet yang terdapat pada ujung malai dari malai jantan berwarna coklat dan sebagian seludang telah terbuka mengandung mikrospora tahap biselular awal. Mikrospora tahap uninukleat akhir yang dikulturkan pada media standar embriogenesis somatik kelapa sawit, memperlihatkan perkembangan gametofitik sampai tahap biselular pada umur 6 sampai 10 hari setelah kultur (HSK). Pemberian cekaman suhu tinggi (32-33ºC) dalam periode 0, 1, 3 dan 7 hari yang dikombinasikan dengan perlakuan sumber karbon berupa sukrosa, maltosa ataupun manitol tidak dapat menginduksi pembelahan sporofitik dalam antera pada kutur
in vitro. Namun perlakuan cekaman suhu tinggi selama satu hari yang dikombinasikan dengan sumber karbon maltosa 40 g/l dapat mempertahankan persentase mikrospora hidup sebesar 74.5% sampai 28 HSK.
ABSTRACT
POPI SEPTIANI. Microspore Development and Induction of Sporophytic Division in Anther Culture of Oil Palm (Elaeis guineensis Jacq.). Supervised by ENCE DARMO JAYA SUPENA and JULIARNI.
Development of oil palm hybrid varieties needs availability of pure lines as parents. Haploid culture can be developed to produce pure lines (double haploid plants) efficiently in 1-2 generations. The aim of this research was to induce sporophytic division in anther culture with double-layer medium system as the first step in developing of haploid technology in oil palm. Basal part of spikelet from spikelet which was located in basal part of male inflorescence having ¼ yellow basal part and ¾ brown upper part contained late uninucleate microspores. Whereas upper part of spikelet from spikelet which was located in upper part of male inflorescence having brown male flower inflorescence with partly opened spathe contained early bicellular microspores. Late uninucleate microspores which were cultured in oil palm somatic embryogenesis medium showed gametophytic development until bicellular stage after 6 to 10 days in culture (DAC). Heat shock treatment (32-33ºC) for 0, 1, 3 and 7 days in combination with carbon source treatment i.e. sucrose, maltose or mannitol were not able to induce sporophytic division in in vitro anther culture. However, heat shock treatment for one day combined with 40 g/l maltose as carbon source can sustain percentage of living microspore up to 74.5 % in 28 DAC.
PERKEMBANGAN MIKROSPORA DAN INDUKSI PEMBELAHAN
SPOROFITIK PADA KULTUR ANTERA KELAPA SAWIT
(Elaeis guineensis Jacq.)
POPI SEPTIANI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Perkembangan Mikrospora dan Induksi Pembelahan Sporofitik pada
Kultur Antera Kelapa Sawit (
Elaeis guineensis
Jacq.)
Nama : Popi Septiani
NIM : G34102065
Menyetujui :
Pembimbing I,
Pembimbing II,
Dr. Ir. Ence Darmo Jaya Supena, M.Si
Dr. Ir. Juliarni, M.Agr
NIP 131851278
NIP 132216226
Mengetahui :
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Drh. Hasim, DEA
NIP 131578806
PRAKATA
Alhamdulillah, puji dan syukur penulis panjatkan kepada Allah SWT, atas segala karunia yang telah dilimpahkan-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul Perkembangan Mikrospora dan Induksi Pembelahan Sporofitik pada Kultur Antera Kelapa Sawit (Elaeis guineensis Jacq.)
Penelitian dilakukan mulai bulan Maret 2006 sampai dengan Juli 2007, di Laboratorium Biologi Seluler dan Molekuler Tanaman, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB dan Laboratorium Riset, Fakultas Teknobiologi Unika Atmajaya, Jakarta.
Terima kasih penulis ucapkan kepada Dr. Ir. Ence Darmo Jaya Supena, M.Si dan Dr.Ir. Juliarni, M.Agr selaku pembimbing yang telah memberikan saran, bimbingan dan motivasi serta kepada Ir. Dorly, M. Si selaku penguji yang telah memberikan saran dan kritik dalam penyusunan karya ilmiah ini. Terima kasih kepada Kepala Pusat Penelitian Sumberdaya Hayati dan Bioteknologi beserta seluruh staf dan laboran atas sarana, prasarana serta bantuan selama penulis melakukan penelitian. Terima kasih juga penulis sampaikan kepada Koordinator dan staf Laboratorium Riset Fakultas Teknobiologi Unika Atmajaya Jakarta, atas bantuan dan kerjasamanya.
Ucapan terima kasih yang mendalam penulis sampaikan kepada Papa, Mama, Bang Ali dan Adikku Rika atas doa, kasih sayang dan dukungannya. Terima kasih juga penulis sampaikan kepada rekan-rekan di lab, Budi, Mbah, Usy, Tuti, Lulut, Jaya, Hakiim, Mas Firdaus, Mba Kiki, Mba Wiwid, Mba Muti, Mba Agust, Mba Zendi, Mba Rina, Mba Ratna, Pak Muzuni, Bu Hanum, Bu Srilis, Pak Hadi, Pak Ulung, Bang Yassier, Mba Ulfa, Mba Rida, Nindya, Zahroh, Dona, Sari atas segala bantuannya. Kepada rekan-rekan Biologi 39 dan sahabat yang selalu memberi semangat: Ammay, Ninda, Awi, Mia, Nirli, Venti, Dina, Ambar, Bian, Buly, Rama, Lia, Yeviza, Yuni, dan Zantri.
Semoga karya ilmiah ini bermanfaat bagi kemajuan ilmu pengetahuan. Amin.
Bogor, Januari 2008
RIWAYAT HIDUP
Penulis dilahirkan di Kotabumi, Lampung Utara pada tanggal 24 September 1984 dari ayah H. Ir. Kahfi dan ibu Hj. Nani Sukarni. Penulis merupakan anak kedua dari tiga bersaudara. Pada tahun 2002 penulis lulus dari SMU 9 Bandar Lampung dan diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB).
DAFTAR ISI
Halaman
DAFTAR GAMBAR... vii
PENDAHULUAN... 1
BAHAN DAN METODE ... 1
Sumber Antera. ... 1
Pengamatan Morfologi Malai Jantan dan Tahap Perkembangan Mikrospora... 1
Metode Kultur Sebar Mikrospora ... 2
Komposisi Media Kultur... 2
Isolasi Antera dan Inkubasi... 2
Perlakuan Cekaman untuk Induksi Androgenesis... 2
HASIL ... ... 2
Hubungan antara Ciri Morfologi Malai Jantan dengan Tahap Perkembangan Mikrospora 2
Perkembangan Mikrospora dalam Antera pada Kultur in vitro... 4
Perlakuan Cekaman untuk Induksi Androgenesis... 4
PEMBAHASAN... 6
SIMPULAN... 7
DAFTAR GAMBAR
Halaman
1 Hubungan antara ciri morfologi malai jantan dan tahap perkembangan mikrospora kelapa sawit ... 3 2 Perkembangan mikrospora dalam antera pada kultur in vitro... 4 3 Persentase mikrospora hidup dalam media dengan sumber karbon berbeda dan
PENDAHULUAN
Kelapa sawit (Elaeis guineensis Jacq.) merupakan komoditas perkebunan andalan yang banyak diminati oleh investor karena nilai ekonominya cukup tinggi. Luas area pertanaman maupun produksi kelapa sawit di Indonesia setiap tahunnya selalu meningkat dengan produksi per satuan luas yang berpotensi untuk dapat ditingkatkan. Menurut Deptan (2007) luas pertanaman kelapa sawit pada tahun 2005 adalah 5 453 817 ha. Luas areal produksi sebesar 4 120 000 ha dan total produksi mencapai 64 255 300 ton sehingga rata-rata produkti-vitas adalah 17.4 ton/ha. Produktiprodukti-vitas kelapa sawit di Indonesia masih lebih rendah jika dibandingkan dengan Malaysia yang telah mencapai 20.8 ton/ha dengan luas areal produksi sebesar 3 620 000 ha (FAO 2007).
Peningkatan produksi kelapa sawit erat kaitannya dengan pengadaan dan ketersedia-an bibit berkualitas. Salah satu kendala yketersedia-ang dihadapi hingga saat ini adalah keterbatasan pengadaan bibit berkualitas tersebut. Hal ini menimbulkan masalah baru yaitu beredarnya bibit kelapa sawit palsu. Bibit unggul kelapa sawit umumnya berupa varietas hibrida hasil persilangan antara dua induk atau tetua. Varietas-varietas hibrida baru diperoleh dari calon tetua-tetua baru yang merupakan galur-galur murni. Untuk memperoleh galur murni dibutuhkan waktu yang lama sekitar 5-7 generasi melalui penyerbukan sendiri terkendali, dengan satu generasi membutuh-kan waktu 3-4 tahun. Oleh karena itu, diperlukan introduksi teknologi untuk menghasilkan galur murni dalam waktu yang relatif singkat. Kultur haploid adalah salah satu alternatif yang dapat meng-hasilkan tanaman haploid dan haploid ganda hanya dalam satu generasi (Collin & Edwards 1998).
Tanaman haploid adalah tanaman dengan jumlah kromosom sama dengan sel gamet. Hasil penggandaan kromosom tanaman haploid adalah tanaman haploid ganda yang merupakan galur murni karena homozigot untuk keseluruhan lokusnya. Metode yang paling banyak digunakan untuk memperoleh tanaman haploid ganda secara in vitro adalah kultur antera dan kultur mikrospora melalui proses androgenesis yaitu proses perkembangan embrio dari mikrospora (Ferrie et al. 1994). Induksi androgenesis dapat dilakukan antara lain dengan cekaman suhu tinggi (32-330C)
seperti pada Brassica napus (Ferrie 2003), penggunaan sumber karbon pada media yang sesuai yaitu mengganti sukrosa dengan maltosa pada media kultur mikrospora
Hordeum vulgare (Kasha et al. 2003) maupun kombinasi perlakuan cekaman suhu tinggi (32-33ºC) dan starvasi sumber karbon dengan menggunakan manitol pada
Nicotiana tabacum (Touraev & Heberle-Bors 2003).
Sampai saat ini belum ada yang melaporkan keberhasilan teknik androgene-sis in vitro pada kelapa sawit. Namun keberhasilan teknik embriogenesis somatik pada kelapa sawit telah banyak dilaporkan (Gorret et al. 2004; Rival et al. 1997; Teixeira et al. 1993, 1995). Didasarkan pada tahapan-tahapan induksi androgenesis pada tanaman model dan keberhasilan embriogenesis somatik pada kelapa sawit serta dikombinasikan dengan teknik kultur antera pada media dua lapis yang dikembangkan oleh Supena et al. (2006), diharapkan pembelahan sporofitik pada kultur antera kelapa sawit dapat diinduksi untuk selanjutnya akan dijadikan tahap awal induksi androgenesis dan pengembangan teknologi haploid pada kelapa sawit.
BAHAN DAN METODE
Sumber Antera
Antera yang digunakan berasal dari malai jantan pada berbagai tahap perkemba-ngan dari pohon kelapa sawit yang terdapat di kampus IPB Darmaga, Bogor.
Pengamatan Morfologi Malai Jantan dan Tahap Perkembangan Mikrospora
Bunga jantan pada berbagai tahap perkembangan diamati morfologi malai maupun bunganya. Antera kuncup bunga diisolasi menggunakan pinset selanjutnya didiseksi di dalam larutan manitol. Mikrospora atau polen yang terlarut di dalam larutan manitol diisolasi dengan cara disentrifugasi dan selanjutnya DNA atau inti sel diwarnai dengan 1.25 µg/ml pewarna 4,6-diamidino-2-phenylindole (DAPI). Fase perkembangan mikrospora diamati meng-gunakan mikroskop fluoresens dengan UV
2
dengan hemasitometer menggunakan mikroskop cahaya (Nikon Labophot-2) dengan perbesaran 40x10.
Metode Kultur Sebar Mikrospora
Komposisi Media Kultur. Media kultur yang digunakan adalah media dua lapis yaitu media cair di atas media padat (Supena et al. 2006). Kandungan media cair dan media padat sama, namun pada media padat ditambahkan 10 g/l arang aktif dan 2 g/l agar pemadat gelrite. Komposisi media yang digunakan ialah media kultur embriogenesis somatik kelapa sawit menurut Teixeira et al.
(1995) yang mengandung nutrisi makro dan mikro Y3, 267.5 mg/l NH4Cl, 500 mg/l sistein, 10 mg/l asam nikotianat, 2.5 mg/l tiamin, 0.8 mg/l piridoksin, vitamin Kao dan Michayluk (vitamin KM), 100 mg inositol, 250 mg/l asam askorbat, 1.5 % sukrosa dan 0.5% glukosa. Cawan petri yang digunakan berdiameter 6 cm yang mengandung 3 ml media padat di bagian bawah dan 3 ml media cair yang akan ditambahkan di atasnya menjelang kultur.
Isolasi Antera dan Inkubasi Kultur.
Proses isolasi antera dilakukan pada kondisi steril. Kuncup bunga kelapa sawit yang mengandung mikrospora tahap uninukleat akhir sampai biselular awal didesinfeksi selama satu menit dalam alkohol 70%, kemudian dibilas dua kali dalam akuades steril. Kuncup bunga selanjutnya didesinfeksi dalam 2% NaOCl dengan penambahan 0.05% (v/v) Tween-20 selama 10 menit, kemudian dibilas tiga kali dalam akuades steril masing-masing selama 1, 5 dan 10 menit.
Kuncup bunga dibuka menggunakan pinset, kemudian antera dipisahkan dari filamen dan kelopak bunga. Antera diletakkan pada media dua lapis sehingga mengapung pada permukaan media cair. Kemudian diberi 0.1% (v/v) PPMTM (Plant Preservative Mixture) sebagai biosida yang berfungsi untuk mencegah kontaminasi pada kultur (Paul et al. 2001). Pada cawan petri dikulturkan enam buah antera yang berasal dari satu kuncup bunga. Kultur diinkubasi pada suhu 25-28ºC selama 15 hari pada kondisi gelap. Kemudian antera dalam kultur yang berjumlah enam diambil satu persatu secara berurutan pada 0, 1, 3, 6, 10 dan 15 hari setelah kultur (HSK) untuk pengamatan perkembangan mikrospora. Pengamatan dilakukan dari satu seri kultur yang lengkap dan tidak terkontaminasi.
Perlakuan Cekaman untuk Induksi Androgenesis
Perlakuan cekaman yang digunakan yaitu cekaman suhu tinggi dan sumber karbon pada media kultur. Perlakuan cekaman suhu tinggi dilakukan dengan menginkubasi kultur pada suhu 32-33ºC dengan lama inkubasi 1, 3, dan 7 hari dalam keadaan gelap secara kontinu. Setelah perlakuan cekaman suhu tinggi, kultur diinkubasi pada suhu 25-28ºC dan tetap dalam keadaan gelap. Sedangkan untuk kontrol, dari awal kultur diinkubasi pada suhu 25-28ºC (Ferrie 2003). Perlakuan sumber karbon pada media kultur dilakukan dengan mengganti sumber karbon pada media kultur standar kelapa sawit yaitu 20 g/l sukrosa (kontrol) menjadi 40 g/l maltosa (Kasha et al. 2003) atau 55 g/l manitol (Touraev dan Herbele-Bors 2003). Manitol digunakan untuk membuat kondisi miskin sumber karbon (starvasi). Perlakuan starvasi dilakukan selama tujuh hari. Kemudian pada hari ke-8, semua antera dipindahkan ke media baru yang bersumber karbon sukrosa.
Kombinasi perlakuan yang dilakukan adalah perlakuan cekaman suhu tinggi (32-33ºC) dengan empat taraf periode inkubasi (0, 1, 3 dan 7 hari) dan tiga jenis sumber karbon (sukrosa, maltosa dan manitol) sehingga diperoleh 12 unit percobaan. Percobaan dilakukan 10 ulangan, kemudian dipilih satu ulangan terbaik yaitu ulangan yang tiap perlakuannya lengkap dan tidak terkontaminasi sampai umur 28 HSK.
Masing-masing antera diambil untuk diisolasi mikrosporanya kemudian diwarnai dengan pewarna DAPI dan diamati tahap perkembangannya pada 7, 14, 21, 28 HSK. Penghitungan persentase mikrospora hidup dilakukan dengan menggunakan mikroskop flouresens dengan perbesaran 200x sebanyak dua bidang pandang dengan jumlah total mikrospora yang diamati lebih kurang 50 sel.
HASIL
Hubungan antara Ciri Morfologi Malai Jantan dengan Tahap Perkembangan Mikrospora
3
tahap tetrad pada pangkal spikelet dari spikelet yang terdapat pada pangkal malai. Kromosom mengalami kondensasi di bagian tengah sel pada tahap sel induk polen (Gambar 1A2), kemudian sel induk polen mengalami pembelahan meiosis membentuk tetrad (Gambar 1A3).
Tahap perkembangan selanjutnya dijumpai pada malai jantan yang ¼ bagian pangkalnya berwarna kuning dan ¾ bagian ujung malai berwarna coklat (Gambar 1B1). Ujung spikelet dari spikelet yang terdapat pada ujung malai mengandung mikrospora tahap uninukleat awal dan pangkal spikelet dari spikelet yang terdapat pada pangkal malai mengandung mikrospora tahap uninukleat akhir. Tahap uninukleat awal ditandai oleh kromosom yang mulai mengalami kondensasi (Gambar 1B2). Berikutnya, inti terlihat kompak pada bagian tepi sel karena terdorong oleh vakuola yang membesar atau disebut mikrospora uninukleat akhir (Gambar 1B3).
Malai jantan tahap berikutnya berwarna coklat dan sebagian seludangnya telah
terbuka (Gambar 1C1). Ujung spikelet dari spikelet yang terdapat pada ujung malai mengandung mikrospora tahap biselular awal dan pangkal spikelet dari spikelet yang terdapat pada pangkal malai mengandung mikrospora tahap biselular tengah. Kedua tahapan ini telah mengalami pembelahan mitosis membentuk dua inti asimetri yaitu inti vegetatif dan generatif. Mikrospora tahap biselular awal ditandai oleh letak inti vegetatif dan generatif yang terlihat bertumpuk (Gambar 1C2), sedangkan pada tahap biselular tengah kedua inti tampak terpisah (Gambar 1C3).
Selanjutnya malai yang berwarna coklat dan mulai mekar karena seludang malai telah terbuka (Gambar 1D1), mengandung tahap biselular akhir pada ujung spikelet dari spikelet yang terdapat pada ujung malai dan polen matang pada pangkal spikelet dari spikelet yang terdapat pada pangkal malai. Tahap biselular akhir ditandai oleh inti vegetatif yang bergerak mendekati dinding sel (Gambar 1D2).
D1 10 cm
A1 B1 C1
B2
B3 C3 D3
C2
A3
30 µm
D2
ig iv
[image:11.595.102.519.182.767.2]A2
Gambar 1 Hubungan antara ciri morfologi malai jantan dan tahap perkembangan mikrospora kelapa sawit. Tahapan perkembangan malai (A1-D1); Tahapan perkembangan mikrospora (A2-D3). Malai A1 mengandung mikrospora tahap sel induk polen (A2) sampai mikrospora tahap tetrad (A3); Malai B1 mengandung mikrospora tahap uninukleat awal (B2) sampai mikrospora tahap uninukleat akhir (BB3); Malai C1
4
Kemudian mikrospora berkembang hingga pada akhirnya menjadi polen. Polen matang kelapa sawit adalah biselular dengan sel berinti generatif berada di dalam sitoplasma sel berinti vegetatif (Gambar 1D3). Jumlah rata-rata mikrospora per bunga adalah 443 200 dengan kisaran 288 000 sampai 672 000 sel mikrospora per kuncup bunga.
Perkembangan Mikrospora dalam Antera pada Kultur in vitro
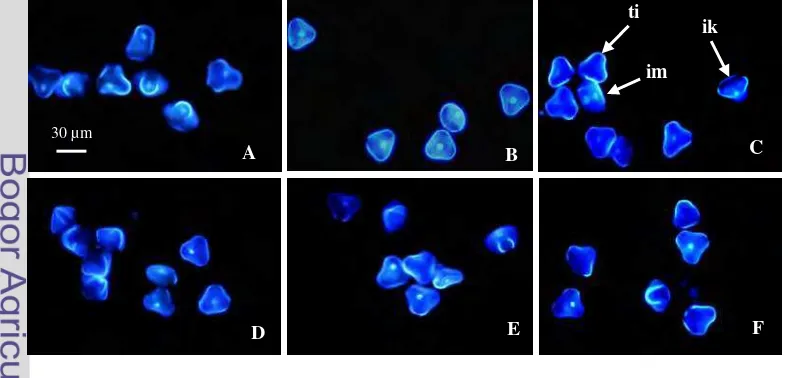
Mikrospora tahap uninukleat akhir (Gambar 2A) yang dikulturkan pada media standar embriogenesis somatik kelapa sawit dengan sistem kultur antera pada media dua lapis dapat berkembang melalui proses gametofitik tetapi tidak sampai pada tahap akhir yaitu polen matang. Perkembangan mikrospora hanya sampai pada tahap biselular, karena sel mikrospora pada tahap selanjutnya mengalami kematian yang didahului dengan keluarnya inti dan sitoplasma dari dinding sel (Gambar 2C-ik). Selama satu hari kultur, mikrospora masih tetap dalam tahap uninukleat akhir (Gambar 2B). Proses pembelahan inti mikrospora mulai teramati pada 3 HSK (Gambar 2C-im). Namun, sebagian besar mikrospora mulai mati yang ditandai dengan hilang atau keluarnya inti setelah 3 HSK (Gambar 2C-ik dan ti) dan kematian terus bertambah sampai 15 HSK (Gambar 2F). Perbedaan antara inti vegetatif dan inti generatif terlihat jelas pada kultur umur 10
dan 15 HSK. Kedua inti sudah terpisah, inti generatif terlihat lebih kompak dan lebih terang sedangkan inti vegetatif terlihat sebaliknya.
Pengaruh Perlakuan Cekaman untuk Induksi Androgenesis
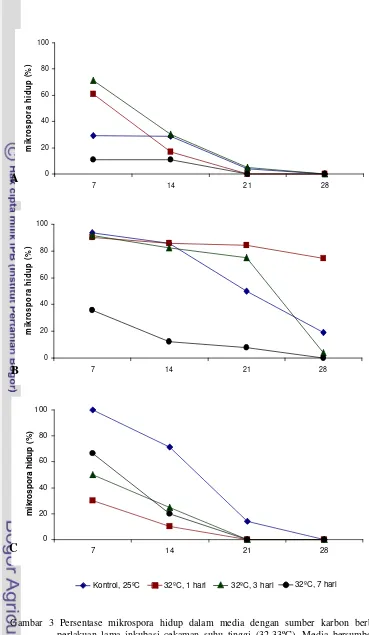
Mikrospora yang dikulturkan pada media bersumber karbon sukrosa, maltosa dan manitol dengan cekaman suhu tinggi (32-33ºC) maupun kontrol, mengalami kematian sel secara bertahap dan pembelahan sporofitik tidak terinduksi. Persentase mikrospora yang hidup menurun tajam pada media bersumber karbon sukrosa dan manitol dari 7 sampai 21 HSK. Hampir semua mikrospora telah mati pada 21 HSK (Gambar 3A dan 3C). Tetapi apabila dibandingkan dengan sumber karbon sukrosa, persentase sel hidup pada media bersumber karbon manitol tanpa perlakuan suhu tinggi (kontrol) masih lebih tinggi khususnya pada 7 sampai 21 HSK (Gambar 3C).
Persentase mikrospora hidup yang lebih tinggi diperoleh pada media bersumber karbon maltosa. Persentase sel mikrospora hidup tidak menurun drastis sampai 21 HSK, bahkan pada cekaman suhu tinggi selama satu hari, persentase mikrospora hidup sampai 28 HSK sebesar 74.5%. Sedangkan perlakuan cekaman suhu tinggi selama tiga dan tujuh hari mengakibatkan jumlah sel mikrospora mati semakin tinggi (Gambar 3B).
C im
ik ti
F E
B
D A
[image:12.595.109.503.505.694.2]30 µm
5
0 20 40 60 80 100
7 14 21 28
m
ik
ro
s
po
ra
hi
dup
(
%
)
A
0 20 40 60 80 100
7 14 21 28
m
ik
ros
po
ra
hi
d
up (
%
)
B
0 20 40 60 80 100
7 14 21 28
m
ik
ros
por
a
hi
du
p (
%
)
C
[image:13.595.103.472.61.696.2]Kontrol, 25ºC 32ºC, 1 hari 32ºC, 3 hari 32ºC, 7 hari
PEMBAHASAN
Penentuan tahap perkembangan mikro-spora dalam antera yang akan dijadikan eksplan pada induksi androgenesis melalui kultur antera maupun kultur isolasi mikrospora merupakan faktor penting. Tahap paling responsif untuk induksi androgenesis adalah saat pembelahan mitosis pertama yaitu tahap uninukleat akhir sampai biselular awal (Maraschin et al.
2005). Fase uninukleat akhir pada kelapa sawit diperoleh dari pangkal spikelet dari spikelet yang terdapat pada pangkal malai pada malai yang memiliki ¼ bagian pangkal malai berwarna kuning dan ¾ bagian ujung malai berwarna coklat. Sedangkan tahap biselular awal diperoleh pada ujung spikelet dari spikelet yang terdapat pada ujung malai dari malai yang berwarna coklat dan sebagian seludangnya telah terbuka. Berdasarkan hasil tersebut, ciri morfologi malai dapat digunakan sebagai penanda tahapan perkembangan mikrospora. Hasil penelitian Supena et al. (2006) menunjukkan adanya warna ungu pada ujung antera cabai (Capsicum annuum) dapat digunakan sebagai penanda fase perkembangan mikrospora, tetapi hal ini tidak dijumpai pada antera kelapa sawit.
Keberhasilan induksi androgenesis dipengaruhi juga oleh densitas mikrospora. Densitas optimum kultur isolasi mikrospora pada media cair bervariasi antara 104 hingga 105 sel per ml. Jumlah sel mikrospora yang terlalu sedikit atau terlalu banyak akan semakin memperkecil keberhasilan andro-genesis (Rodrigues et al. 2006). Kelapa sawit dengan jumlah 443 200 sel mikrospora per bunga dikategorikan tinggi apabila dibandingkan dengan spesies lain seperti
Brassica napus dengan jumlah 124 600 sel mikrospora per bunga (Pertl et al.
2002) dan kedelai dengan jumlah 310 000 sel mikrospora per bunga (Rodrigues et al. 2006). Oleh karena itu kemungkinan keberhasilan androgenesis pada kelapa sawit diharapkan cukup besar. Perkembangan mikrospora in vitro
dalam teknik kultur antera pada media dua lapis dengan media standar embriogenesis somatik kelapa sawit hanya dapat mendukung perkembangan mikrospora dari tahap uninukleat akhir hingga biselular tengah. Hal ini menunjukkan bahwa jalur gametofitik tetap terjadi tetapi tidak sampai pada pematangan polen karena mikrospora banyak yang mati akibat terjadi plasmolisis
mulai 3 HSK. Hal ini diduga karena sumber karbon sukrosa dan glukosa tidak cocok apabila diberikan ke dalam media kultur antera kelapa sawit. Dugaan ketidakcocokan penggunaan sukrosa sebagai sumber karbon dalam kultur antera kelapa sawit didukung oleh hasil percobaan pengaruh sumber karbon maltosa yang dapat menurunkan laju kematian mikrospora (Gambar 3B).
Dalam kultur in vitro tanaman, sukrosa memang merupakan sumber karbon yang paling banyak digunakan, tetapi pada beberapa spesies seperti Barley (Hordeum vulgare) dan Snapdragon (Antirrhinum majus) (Scott & Lyne 1995; Scott & Lyne 1994; Barinova et al. 2002), sukrosa justru menyebabkan kematian sel karena memberi efek toksik. Hal ini disebabkan karena hidrolisis sukrosa sangat cepat sehingga dapat mengakibatkan metabolisme sel juga berjalan cepat. Pada akhirnya sel mengakumulasi etanol dalam jumlah besar sehingga memberi efek toksik pada sel yang menyebabkan kematian sel. Sedangkan hidrolisis maltosa berjalan lebih lambat, oksigen untuk respirasi menjadi lebih tercukupi dan energi dapat dimanfaatkan secara bertahap oleh sel, akibatnya sel dapat bertahan hidup pada media kultur (Scott & Lyne 1995). Hidrolisis pada sukrosa berjalan lebih cepat diduga karena enzim pemecah sukrosa menjadi monosakaridanya bekerja lebih cepat dibandingkan pada maltosa. Hidrolisis yang cepat ini menyebabkan sel mengalami defisiensi oksigen dan berada dalam kondisi anaerob. Pada kondisi ini, untuk memperoleh energi, sel akan memasuki jalur fermentasi dengan hasil akhir berupa etanol yang bersifat toksik pada sel.
7
mikrospora hidup pada 7 HSK dengan perlakuan cekaman suhu tinggi lebih rendah daripada kontrol. Sedangkan penurunan persentase mikrospora hidup pada 14 sampai dengan 28 HSK terutama disebabkan oleh efek keracunan sukrosa karena kultur pada hari ke-8 dipindahkan pada media dengan sumber karbon sukrosa. Cekaman suhu tinggi (32-33ºC) untuk kultur antera atau mikrospora pada beberapa spesies seperti Brassica napus
(Ferrie 2003) dan Nicotiana tabacum (Touraev & Heberle-Bors 2003), dapat membelokkan jalur gametofitik ke sporofitik. Menurut Maraschin et al. (2005) senyawa yang berperan dalam pembelokkan jalur gametofitik ke sporofitik adalah heat shock protein yang terinduksi oleh adanya suhu tinggi. Pada penelitian ini perlakuan cekaman dengan suhu tinggi yang dikombinasikan dengan sumber karbon sukrosa, maltosa dan manitol tidak dapat menginduksi pembelahan sporofitik yang merupakan langkah awal induksi androgenesis kelapa sawit. Perlakuan cekaman suhu rendah (4-9ºC) yang dikombinasikan dengan sumber karbon maltosa seperti pada penelitian cabai (Supena et al. 2006) ataupun praperlakuan suhu dingin (4ºC) pada kuncup bunga seperti pada Barley (Kruczkowska et al. 2002) kemungkinan dapat dijadikan alternatif dalam induksi androgenesis kelapa sawit.
SIMPULAN
Pangkal spikelet dari spikelet yang terdapat pada pangkal malai dari malai jantan yang memiliki ¼ bagian pangkal berwarna kuning dan ¾ bagian ujung berwarna coklat, mengandung mikrospora tahap uninukleat akhir. Sedangkan ujung spikelet dari spikelet yang terdapat pada ujung malai dari malai jantan yang berwarna coklat dan sebagian seludang telah terbuka mengandung mikrospora tahap biselular awal. Mikrospora tahap uninukleat akhir yang dikulturkan pada media standar embriogenesis somatik pada kelapa sawit dengan suhu inkubasi 25-28ºC, memper-lihatkan perkembangan gametofitik sampai tahap biselular pada umur 6 sampai 10 HSK.
Pemberian cekaman suhu tinggi (32-33ºC) yang dikombinasikan dengan perlakuan sumber karbon berupa sukrosa, maltosa ataupun manitol ternyata tidak dapat menginduksi pembelahan sporofitik dalam antera pada kutur in vitro. Namun perlakuan
cekaman suhu tinggi selama satu hari yang dikombinasikan dengan sumber karbon 40 g/l maltosa terbukti dapat mempertahankan persentase mikrospora hidup sebesar 74.5% sampai 28 HSK.
DAFTAR PUSTAKA
Barinova I, Zhexembekova M, Barsova E, Lukyanov S, Heberle-Bors E, Touraev A. 2002. Antirrhinum majus microspore maturation and transient transformation
in vitro. J Expt Bot 53: 1119-1129. Collin HA, Edwards S. 1998. Plant Cell
Culture. Singapore: Springer-Verlag Singapore Pte Ltd. hlm 59-60.
Ferrie AMR, Palmer CE, Keller WA. 1994. Biotechnological applications of haploids. Di dalam: Shargool PD, Ngo TT, editor. Biotechnological Aplication of Plant Cultures. Boca Raton: CRC Press. hlm 77-109.
Ferrie A. 2003. Microspore culture of
Brassica species. Di Dalam:
Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant, A Manual. Dordrecht: Kluwer Academic Publisher. hlm. 205-215.
Gorret N, Rosli SK, Oppenheim SF, Willis LB, Lessard PA, Cho KR, Sinskey AJ. 2004. Bioreactor culture of oil palm (Elaeis guineensis Jacq.) and effects of nitrogen source, inoculum size, and conditioned medium on biomass production. J Biotechnol 108: 253-263. Harada H, Imamura J. 1983. Factors that
stimulate pollen embryogenesis. Di dalam: Cell and Tissue Culture Techniques for Cereal Crop Improvement. Proceedings of Workshop on Potential of Cell and Tissue Culture Techniques in the Improvement of Cereal Crops; Beijing, 19-23 Okt 1981. Beijing: Science Press and International Rice Research Institute. hlm 145-158. Kasha KJ, Simion E, Oro R, Shim YS. 2003.
Barley isolated and microspore culture protocol. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor.
Double Haploid Production in Crop Plant. Dordrecht: Kluwer Academic Publisher. hlm 43-47.
Kruczkowska H, Pawlowska H, Skuncinska B. 2002. Influence of anther pretreatment on the efficiency of androgenesis in barley. J Appl Genet
8
Maraschin SF, Priester W, Spaink HP, Wang M. 2005. Androgenic switch: an example of plant embryogenesis from male gametophyte perspective. J Expt Bot 56: 1711-1726.
Paul A-L, Semer C, Kucharek T, Ferl RJ. 2001. The fungicidal and phytotoxic properties of benomyl and PPM in suplemented agar media supporting transgenic Arabidopsis plants for a space shuttle flight experiment. J Appl Microbiol Biotech 55 : 480-485.
Pertl M, Houser TP, Damgard C, Jorgensen RB. 2002. Male fitness of oilseed rape (Brassica napus), weedy B. rapa and their F1 hybrids when pollinating B. rapa seeds. Heredity 89: 212-218. Rival A, Berlenc FA, Morcillo F, Tregear J,
Verdeil JL, Duval Y. 1997. Scalling-up
in vitro clonal propagation through somatic embryogenesis: the case of oil palm (Elaeis guineensis Jacq.). Plant Tiss Cult Biotechnol 3: 74-83.
Rodrigues LR, de Camargo FB, Bodanese-Zanettini MH. 2006. Isolation and culture of soybean (Glycine max L. Merrill) microspore and pollen grains.
Braz Arch Biol Technol 49: 537-545. Scott P, Lyne LR. 1994. Initiation of
embryogenesis from cultured barley microspore: a further investigation into the toxic effects of sucrose and glucose.
Plant Cell Tiss Org Cult 37: 61-65.
Scott P, Lyne RL, Ap Rees T. 1995. Metabolism of maltose and sucrose by microspore isolated from barley (Hordeum vulgare L.). Planta 197: 435-441.
Supena EDJ, Suharsono S, Jacobsen E, Custers JBM. 2006. Succesfull development of a shed-microspore culture protocol for double haploid production in Indonesia hot pepper (Capsicum annuum L.). Plant Cell Rep
25 : 1-10.
Teixeira JB, Sondahl MR, Kirby EG. 1993. Somatic embryogenesis from immature zygotic embryos of oil palm. Plant Cell Tiss Org Cult 40: 227-233.
Teixeira JB, Sondahl MR, Nakamura T, Kirby EG. 1995. Establishment of oil palm cell suspensions and plant regeneration. Plant Cell Tiss Org Cult
40: 105-111.
PERKEMBANGAN MIKROSPORA DAN INDUKSI PEMBELAHAN
SPOROFITIK PADA KULTUR ANTERA KELAPA SAWIT
(Elaeis guineensis Jacq.)
POPI SEPTIANI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
POPI SEPTIANI. Perkembangan Mikrospora dan Induksi Pembelahan Sprofitik pada Kultur Antera Kelapa Sawit (Elaeis guineensis Jacq.). Dibimbing oleh ENCE DARMO JAYA SUPENA dan JULIARNI.
Pengembangan varietas hibrida kelapa sawit membutuhkan ketersediaan galur-galur murni untuk dijadikan tetua. Teknologi haploid dapat dikembangkan untuk menghasilkan galur-galur murni (tanaman haploid ganda) secara efisien hanya dalam 1-2 generasi. Penelitian ini bertujuan menginduksi pembelahan sporofitik pada kultur antera dalam media dua lapis yang merupakan langkah awal pengembangan kultur haploid pada kelapa sawit. Pangkal spikelet dari spikelet yang terdapat pada pangkal malai dari malai jantan yang memiliki ¼ bagian pangkal malai berwarna kuning dan ¾ bagian ujung malai berwarna coklat mengandung mikrospora tahap uninukleat akhir. Sedangkan ujung spikelet dari spikelet yang terdapat pada ujung malai dari malai jantan berwarna coklat dan sebagian seludang telah terbuka mengandung mikrospora tahap biselular awal. Mikrospora tahap uninukleat akhir yang dikulturkan pada media standar embriogenesis somatik kelapa sawit, memperlihatkan perkembangan gametofitik sampai tahap biselular pada umur 6 sampai 10 hari setelah kultur (HSK). Pemberian cekaman suhu tinggi (32-33ºC) dalam periode 0, 1, 3 dan 7 hari yang dikombinasikan dengan perlakuan sumber karbon berupa sukrosa, maltosa ataupun manitol tidak dapat menginduksi pembelahan sporofitik dalam antera pada kutur
in vitro. Namun perlakuan cekaman suhu tinggi selama satu hari yang dikombinasikan dengan sumber karbon maltosa 40 g/l dapat mempertahankan persentase mikrospora hidup sebesar 74.5% sampai 28 HSK.
ABSTRACT
POPI SEPTIANI. Microspore Development and Induction of Sporophytic Division in Anther Culture of Oil Palm (Elaeis guineensis Jacq.). Supervised by ENCE DARMO JAYA SUPENA and JULIARNI.
PENDAHULUAN
Kelapa sawit (Elaeis guineensis Jacq.) merupakan komoditas perkebunan andalan yang banyak diminati oleh investor karena nilai ekonominya cukup tinggi. Luas area pertanaman maupun produksi kelapa sawit di Indonesia setiap tahunnya selalu meningkat dengan produksi per satuan luas yang berpotensi untuk dapat ditingkatkan. Menurut Deptan (2007) luas pertanaman kelapa sawit pada tahun 2005 adalah 5 453 817 ha. Luas areal produksi sebesar 4 120 000 ha dan total produksi mencapai 64 255 300 ton sehingga rata-rata produkti-vitas adalah 17.4 ton/ha. Produktiprodukti-vitas kelapa sawit di Indonesia masih lebih rendah jika dibandingkan dengan Malaysia yang telah mencapai 20.8 ton/ha dengan luas areal produksi sebesar 3 620 000 ha (FAO 2007).
Peningkatan produksi kelapa sawit erat kaitannya dengan pengadaan dan ketersedia-an bibit berkualitas. Salah satu kendala yketersedia-ang dihadapi hingga saat ini adalah keterbatasan pengadaan bibit berkualitas tersebut. Hal ini menimbulkan masalah baru yaitu beredarnya bibit kelapa sawit palsu. Bibit unggul kelapa sawit umumnya berupa varietas hibrida hasil persilangan antara dua induk atau tetua. Varietas-varietas hibrida baru diperoleh dari calon tetua-tetua baru yang merupakan galur-galur murni. Untuk memperoleh galur murni dibutuhkan waktu yang lama sekitar 5-7 generasi melalui penyerbukan sendiri terkendali, dengan satu generasi membutuh-kan waktu 3-4 tahun. Oleh karena itu, diperlukan introduksi teknologi untuk menghasilkan galur murni dalam waktu yang relatif singkat. Kultur haploid adalah salah satu alternatif yang dapat meng-hasilkan tanaman haploid dan haploid ganda hanya dalam satu generasi (Collin & Edwards 1998).
Tanaman haploid adalah tanaman dengan jumlah kromosom sama dengan sel gamet. Hasil penggandaan kromosom tanaman haploid adalah tanaman haploid ganda yang merupakan galur murni karena homozigot untuk keseluruhan lokusnya. Metode yang paling banyak digunakan untuk memperoleh tanaman haploid ganda secara in vitro adalah kultur antera dan kultur mikrospora melalui proses androgenesis yaitu proses perkembangan embrio dari mikrospora (Ferrie et al. 1994). Induksi androgenesis dapat dilakukan antara lain dengan cekaman suhu tinggi (32-330C)
seperti pada Brassica napus (Ferrie 2003), penggunaan sumber karbon pada media yang sesuai yaitu mengganti sukrosa dengan maltosa pada media kultur mikrospora
Hordeum vulgare (Kasha et al. 2003) maupun kombinasi perlakuan cekaman suhu tinggi (32-33ºC) dan starvasi sumber karbon dengan menggunakan manitol pada
Nicotiana tabacum (Touraev & Heberle-Bors 2003).
Sampai saat ini belum ada yang melaporkan keberhasilan teknik androgene-sis in vitro pada kelapa sawit. Namun keberhasilan teknik embriogenesis somatik pada kelapa sawit telah banyak dilaporkan (Gorret et al. 2004; Rival et al. 1997; Teixeira et al. 1993, 1995). Didasarkan pada tahapan-tahapan induksi androgenesis pada tanaman model dan keberhasilan embriogenesis somatik pada kelapa sawit serta dikombinasikan dengan teknik kultur antera pada media dua lapis yang dikembangkan oleh Supena et al. (2006), diharapkan pembelahan sporofitik pada kultur antera kelapa sawit dapat diinduksi untuk selanjutnya akan dijadikan tahap awal induksi androgenesis dan pengembangan teknologi haploid pada kelapa sawit.
BAHAN DAN METODE
Sumber Antera
Antera yang digunakan berasal dari malai jantan pada berbagai tahap perkemba-ngan dari pohon kelapa sawit yang terdapat di kampus IPB Darmaga, Bogor.
Pengamatan Morfologi Malai Jantan dan Tahap Perkembangan Mikrospora
Bunga jantan pada berbagai tahap perkembangan diamati morfologi malai maupun bunganya. Antera kuncup bunga diisolasi menggunakan pinset selanjutnya didiseksi di dalam larutan manitol. Mikrospora atau polen yang terlarut di dalam larutan manitol diisolasi dengan cara disentrifugasi dan selanjutnya DNA atau inti sel diwarnai dengan 1.25 µg/ml pewarna 4,6-diamidino-2-phenylindole (DAPI). Fase perkembangan mikrospora diamati meng-gunakan mikroskop fluoresens dengan UV
PENDAHULUAN
Kelapa sawit (Elaeis guineensis Jacq.) merupakan komoditas perkebunan andalan yang banyak diminati oleh investor karena nilai ekonominya cukup tinggi. Luas area pertanaman maupun produksi kelapa sawit di Indonesia setiap tahunnya selalu meningkat dengan produksi per satuan luas yang berpotensi untuk dapat ditingkatkan. Menurut Deptan (2007) luas pertanaman kelapa sawit pada tahun 2005 adalah 5 453 817 ha. Luas areal produksi sebesar 4 120 000 ha dan total produksi mencapai 64 255 300 ton sehingga rata-rata produkti-vitas adalah 17.4 ton/ha. Produktiprodukti-vitas kelapa sawit di Indonesia masih lebih rendah jika dibandingkan dengan Malaysia yang telah mencapai 20.8 ton/ha dengan luas areal produksi sebesar 3 620 000 ha (FAO 2007).
Peningkatan produksi kelapa sawit erat kaitannya dengan pengadaan dan ketersedia-an bibit berkualitas. Salah satu kendala yketersedia-ang dihadapi hingga saat ini adalah keterbatasan pengadaan bibit berkualitas tersebut. Hal ini menimbulkan masalah baru yaitu beredarnya bibit kelapa sawit palsu. Bibit unggul kelapa sawit umumnya berupa varietas hibrida hasil persilangan antara dua induk atau tetua. Varietas-varietas hibrida baru diperoleh dari calon tetua-tetua baru yang merupakan galur-galur murni. Untuk memperoleh galur murni dibutuhkan waktu yang lama sekitar 5-7 generasi melalui penyerbukan sendiri terkendali, dengan satu generasi membutuh-kan waktu 3-4 tahun. Oleh karena itu, diperlukan introduksi teknologi untuk menghasilkan galur murni dalam waktu yang relatif singkat. Kultur haploid adalah salah satu alternatif yang dapat meng-hasilkan tanaman haploid dan haploid ganda hanya dalam satu generasi (Collin & Edwards 1998).
Tanaman haploid adalah tanaman dengan jumlah kromosom sama dengan sel gamet. Hasil penggandaan kromosom tanaman haploid adalah tanaman haploid ganda yang merupakan galur murni karena homozigot untuk keseluruhan lokusnya. Metode yang paling banyak digunakan untuk memperoleh tanaman haploid ganda secara in vitro adalah kultur antera dan kultur mikrospora melalui proses androgenesis yaitu proses perkembangan embrio dari mikrospora (Ferrie et al. 1994). Induksi androgenesis dapat dilakukan antara lain dengan cekaman suhu tinggi (32-330C)
seperti pada Brassica napus (Ferrie 2003), penggunaan sumber karbon pada media yang sesuai yaitu mengganti sukrosa dengan maltosa pada media kultur mikrospora
Hordeum vulgare (Kasha et al. 2003) maupun kombinasi perlakuan cekaman suhu tinggi (32-33ºC) dan starvasi sumber karbon dengan menggunakan manitol pada
Nicotiana tabacum (Touraev & Heberle-Bors 2003).
Sampai saat ini belum ada yang melaporkan keberhasilan teknik androgene-sis in vitro pada kelapa sawit. Namun keberhasilan teknik embriogenesis somatik pada kelapa sawit telah banyak dilaporkan (Gorret et al. 2004; Rival et al. 1997; Teixeira et al. 1993, 1995). Didasarkan pada tahapan-tahapan induksi androgenesis pada tanaman model dan keberhasilan embriogenesis somatik pada kelapa sawit serta dikombinasikan dengan teknik kultur antera pada media dua lapis yang dikembangkan oleh Supena et al. (2006), diharapkan pembelahan sporofitik pada kultur antera kelapa sawit dapat diinduksi untuk selanjutnya akan dijadikan tahap awal induksi androgenesis dan pengembangan teknologi haploid pada kelapa sawit.
BAHAN DAN METODE
Sumber Antera
Antera yang digunakan berasal dari malai jantan pada berbagai tahap perkemba-ngan dari pohon kelapa sawit yang terdapat di kampus IPB Darmaga, Bogor.
Pengamatan Morfologi Malai Jantan dan Tahap Perkembangan Mikrospora
Bunga jantan pada berbagai tahap perkembangan diamati morfologi malai maupun bunganya. Antera kuncup bunga diisolasi menggunakan pinset selanjutnya didiseksi di dalam larutan manitol. Mikrospora atau polen yang terlarut di dalam larutan manitol diisolasi dengan cara disentrifugasi dan selanjutnya DNA atau inti sel diwarnai dengan 1.25 µg/ml pewarna 4,6-diamidino-2-phenylindole (DAPI). Fase perkembangan mikrospora diamati meng-gunakan mikroskop fluoresens dengan UV
2
dengan hemasitometer menggunakan mikroskop cahaya (Nikon Labophot-2) dengan perbesaran 40x10.
Metode Kultur Sebar Mikrospora
Komposisi Media Kultur. Media kultur yang digunakan adalah media dua lapis yaitu media cair di atas media padat (Supena et al. 2006). Kandungan media cair dan media padat sama, namun pada media padat ditambahkan 10 g/l arang aktif dan 2 g/l agar pemadat gelrite. Komposisi media yang digunakan ialah media kultur embriogenesis somatik kelapa sawit menurut Teixeira et al.
(1995) yang mengandung nutrisi makro dan mikro Y3, 267.5 mg/l NH4Cl, 500 mg/l sistein, 10 mg/l asam nikotianat, 2.5 mg/l tiamin, 0.8 mg/l piridoksin, vitamin Kao dan Michayluk (vitamin KM), 100 mg inositol, 250 mg/l asam askorbat, 1.5 % sukrosa dan 0.5% glukosa. Cawan petri yang digunakan berdiameter 6 cm yang mengandung 3 ml media padat di bagian bawah dan 3 ml media cair yang akan ditambahkan di atasnya menjelang kultur.
Isolasi Antera dan Inkubasi Kultur.
Proses isolasi antera dilakukan pada kondisi steril. Kuncup bunga kelapa sawit yang mengandung mikrospora tahap uninukleat akhir sampai biselular awal didesinfeksi selama satu menit dalam alkohol 70%, kemudian dibilas dua kali dalam akuades steril. Kuncup bunga selanjutnya didesinfeksi dalam 2% NaOCl dengan penambahan 0.05% (v/v) Tween-20 selama 10 menit, kemudian dibilas tiga kali dalam akuades steril masing-masing selama 1, 5 dan 10 menit.
Kuncup bunga dibuka menggunakan pinset, kemudian antera dipisahkan dari filamen dan kelopak bunga. Antera diletakkan pada media dua lapis sehingga mengapung pada permukaan media cair. Kemudian diberi 0.1% (v/v) PPMTM (Plant Preservative Mixture) sebagai biosida yang berfungsi untuk mencegah kontaminasi pada kultur (Paul et al. 2001). Pada cawan petri dikulturkan enam buah antera yang berasal dari satu kuncup bunga. Kultur diinkubasi pada suhu 25-28ºC selama 15 hari pada kondisi gelap. Kemudian antera dalam kultur yang berjumlah enam diambil satu persatu secara berurutan pada 0, 1, 3, 6, 10 dan 15 hari setelah kultur (HSK) untuk pengamatan perkembangan mikrospora. Pengamatan dilakukan dari satu seri kultur yang lengkap dan tidak terkontaminasi.
Perlakuan Cekaman untuk Induksi Androgenesis
Perlakuan cekaman yang digunakan yaitu cekaman suhu tinggi dan sumber karbon pada media kultur. Perlakuan cekaman suhu tinggi dilakukan dengan menginkubasi kultur pada suhu 32-33ºC dengan lama inkubasi 1, 3, dan 7 hari dalam keadaan gelap secara kontinu. Setelah perlakuan cekaman suhu tinggi, kultur diinkubasi pada suhu 25-28ºC dan tetap dalam keadaan gelap. Sedangkan untuk kontrol, dari awal kultur diinkubasi pada suhu 25-28ºC (Ferrie 2003). Perlakuan sumber karbon pada media kultur dilakukan dengan mengganti sumber karbon pada media kultur standar kelapa sawit yaitu 20 g/l sukrosa (kontrol) menjadi 40 g/l maltosa (Kasha et al. 2003) atau 55 g/l manitol (Touraev dan Herbele-Bors 2003). Manitol digunakan untuk membuat kondisi miskin sumber karbon (starvasi). Perlakuan starvasi dilakukan selama tujuh hari. Kemudian pada hari ke-8, semua antera dipindahkan ke media baru yang bersumber karbon sukrosa.
Kombinasi perlakuan yang dilakukan adalah perlakuan cekaman suhu tinggi (32-33ºC) dengan empat taraf periode inkubasi (0, 1, 3 dan 7 hari) dan tiga jenis sumber karbon (sukrosa, maltosa dan manitol) sehingga diperoleh 12 unit percobaan. Percobaan dilakukan 10 ulangan, kemudian dipilih satu ulangan terbaik yaitu ulangan yang tiap perlakuannya lengkap dan tidak terkontaminasi sampai umur 28 HSK.
Masing-masing antera diambil untuk diisolasi mikrosporanya kemudian diwarnai dengan pewarna DAPI dan diamati tahap perkembangannya pada 7, 14, 21, 28 HSK. Penghitungan persentase mikrospora hidup dilakukan dengan menggunakan mikroskop flouresens dengan perbesaran 200x sebanyak dua bidang pandang dengan jumlah total mikrospora yang diamati lebih kurang 50 sel.
HASIL
Hubungan antara Ciri Morfologi Malai Jantan dengan Tahap Perkembangan Mikrospora
2
dengan hemasitometer menggunakan mikroskop cahaya (Nikon Labophot-2) dengan perbesaran 40x10.
Metode Kultur Sebar Mikrospora
Komposisi Media Kultur. Media kultur yang digunakan adalah media dua lapis yaitu media cair di atas media padat (Supena et al. 2006). Kandungan media cair dan media padat sama, namun pada media padat ditambahkan 10 g/l arang aktif dan 2 g/l agar pemadat gelrite. Komposisi media yang digunakan ialah media kultur embriogenesis somatik kelapa sawit menurut Teixeira et al.
(1995) yang mengandung nutrisi makro dan mikro Y3, 267.5 mg/l NH4Cl, 500 mg/l sistein, 10 mg/l asam nikotianat, 2.5 mg/l tiamin, 0.8 mg/l piridoksin, vitamin Kao dan Michayluk (vitamin KM), 100 mg inositol, 250 mg/l asam askorbat, 1.5 % sukrosa dan 0.5% glukosa. Cawan petri yang digunakan berdiameter 6 cm yang mengandung 3 ml media padat di bagian bawah dan 3 ml media cair yang akan ditambahkan di atasnya menjelang kultur.
Isolasi Antera dan Inkubasi Kultur.
Proses isolasi antera dilakukan pada kondisi steril. Kuncup bunga kelapa sawit yang mengandung mikrospora tahap uninukleat akhir sampai biselular awal didesinfeksi selama satu menit dalam alkohol 70%, kemudian dibilas dua kali dalam akuades steril. Kuncup bunga selanjutnya didesinfeksi dalam 2% NaOCl dengan penambahan 0.05% (v/v) Tween-20 selama 10 menit, kemudian dibilas tiga kali dalam akuades steril masing-masing selama 1, 5 dan 10 menit.
Kuncup bunga dibuka menggunakan pinset, kemudian antera dipisahkan dari filamen dan kelopak bunga. Antera diletakkan pada media dua lapis sehingga mengapung pada permukaan media cair. Kemudian diberi 0.1% (v/v) PPMTM (Plant Preservative Mixture) sebagai biosida yang berfungsi untuk mencegah kontaminasi pada kultur (Paul et al. 2001). Pada cawan petri dikulturkan enam buah antera yang berasal dari satu kuncup bunga. Kultur diinkubasi pada suhu 25-28ºC selama 15 hari pada kondisi gelap. Kemudian antera dalam kultur yang berjumlah enam diambil satu persatu secara berurutan pada 0, 1, 3, 6, 10 dan 15 hari setelah kultur (HSK) untuk pengamatan perkembangan mikrospora. Pengamatan dilakukan dari satu seri kultur yang lengkap dan tidak terkontaminasi.
Perlakuan Cekaman untuk Induksi Androgenesis
Perlakuan cekaman yang digunakan yaitu cekaman suhu tinggi dan sumber karbon pada media kultur. Perlakuan cekaman suhu tinggi dilakukan dengan menginkubasi kultur pada suhu 32-33ºC dengan lama inkubasi 1, 3, dan 7 hari dalam keadaan gelap secara kontinu. Setelah perlakuan cekaman suhu tinggi, kultur diinkubasi pada suhu 25-28ºC dan tetap dalam keadaan gelap. Sedangkan untuk kontrol, dari awal kultur diinkubasi pada suhu 25-28ºC (Ferrie 2003). Perlakuan sumber karbon pada media kultur dilakukan dengan mengganti sumber karbon pada media kultur standar kelapa sawit yaitu 20 g/l sukrosa (kontrol) menjadi 40 g/l maltosa (Kasha et al. 2003) atau 55 g/l manitol (Touraev dan Herbele-Bors 2003). Manitol digunakan untuk membuat kondisi miskin sumber karbon (starvasi). Perlakuan starvasi dilakukan selama tujuh hari. Kemudian pada hari ke-8, semua antera dipindahkan ke media baru yang bersumber karbon sukrosa.
Kombinasi perlakuan yang dilakukan adalah perlakuan cekaman suhu tinggi (32-33ºC) dengan empat taraf periode inkubasi (0, 1, 3 dan 7 hari) dan tiga jenis sumber karbon (sukrosa, maltosa dan manitol) sehingga diperoleh 12 unit percobaan. Percobaan dilakukan 10 ulangan, kemudian dipilih satu ulangan terbaik yaitu ulangan yang tiap perlakuannya lengkap dan tidak terkontaminasi sampai umur 28 HSK.
Masing-masing antera diambil untuk diisolasi mikrosporanya kemudian diwarnai dengan pewarna DAPI dan diamati tahap perkembangannya pada 7, 14, 21, 28 HSK. Penghitungan persentase mikrospora hidup dilakukan dengan menggunakan mikroskop flouresens dengan perbesaran 200x sebanyak dua bidang pandang dengan jumlah total mikrospora yang diamati lebih kurang 50 sel.
HASIL
Hubungan antara Ciri Morfologi Malai Jantan dengan Tahap Perkembangan Mikrospora
4
Kemudian mikrospora berkembang hingga pada akhirnya menjadi polen. Polen matang kelapa sawit adalah biselular dengan sel berinti generatif berada di dalam sitoplasma sel berinti vegetatif (Gambar 1D3). Jumlah rata-rata mikrospora per bunga adalah 443 200 dengan kisaran 288 000 sampai 672 000 sel mikrospora per kuncup bunga.
Perkembangan Mikrospora dalam Antera pada Kultur in vitro
Mikrospora tahap uninukleat akhir (Gambar 2A) yang dikulturkan pada media standar embriogenesis somatik kelapa sawit dengan sistem kultur antera pada media dua lapis dapat berkembang melalui proses gametofitik tetapi tidak sampai pada tahap akhir yaitu polen matang. Perkembangan mikrospora hanya sampai pada tahap biselular, karena sel mikrospora pada tahap selanjutnya mengalami kematian yang didahului dengan keluarnya inti dan sitoplasma dari dinding sel (Gambar 2C-ik). Selama satu hari kultur, mikrospora masih tetap dalam tahap uninukleat akhir (Gambar 2B). Proses pembelahan inti mikrospora mulai teramati pada 3 HSK (Gambar 2C-im). Namun, sebagian besar mikrospora mulai mati yang ditandai dengan hilang atau keluarnya inti setelah 3 HSK (Gambar 2C-ik dan ti) dan kematian terus bertambah sampai 15 HSK (Gambar 2F). Perbedaan antara inti vegetatif dan inti generatif terlihat jelas pada kultur umur 10
dan 15 HSK. Kedua inti sudah terpisah, inti generatif terlihat lebih kompak dan lebih terang sedangkan inti vegetatif terlihat sebaliknya.
Pengaruh Perlakuan Cekaman untuk Induksi Androgenesis
Mikrospora yang dikulturkan pada media bersumber karbon sukrosa, maltosa dan manitol dengan cekaman suhu tinggi (32-33ºC) maupun kontrol, mengalami kematian sel secara bertahap dan pembelahan sporofitik tidak terinduksi. Persentase mikrospora yang hidup menurun tajam pada media bersumber karbon sukrosa dan manitol dari 7 sampai 21 HSK. Hampir semua mikrospora telah mati pada 21 HSK (Gambar 3A dan 3C). Tetapi apabila dibandingkan dengan sumber karbon sukrosa, persentase sel hidup pada media bersumber karbon manitol tanpa perlakuan suhu tinggi (kontrol) masih lebih tinggi khususnya pada 7 sampai 21 HSK (Gambar 3C).
Persentase mikrospora hidup yang lebih tinggi diperoleh pada media bersumber karbon maltosa. Persentase sel mikrospora hidup tidak menurun drastis sampai 21 HSK, bahkan pada cekaman suhu tinggi selama satu hari, persentase mikrospora hidup sampai 28 HSK sebesar 74.5%. Sedangkan perlakuan cekaman suhu tinggi selama tiga dan tujuh hari mengakibatkan jumlah sel mikrospora mati semakin tinggi (Gambar 3B).
C im
ik ti
F E
B
D A
[image:24.595.109.503.505.694.2]30 µm
3
tahap tetrad pada pangkal spikelet dari spikelet yang terdapat pada pangkal malai. Kromosom mengalami kondensasi di bagian tengah sel pada tahap sel induk polen (Gambar 1A2), kemudian sel induk polen mengalami pembelahan meiosis membentuk tetrad (Gambar 1A3).
Tahap perkembangan selanjutnya dijumpai pada malai jantan yang ¼ bagian pangkalnya berwarna kuning dan ¾ bagian ujung malai berwarna coklat (Gambar 1B1). Ujung spikelet dari spikelet yang terdapat pada ujung malai mengandung mikrospora tahap uninukleat awal dan pangkal spikelet dari spikelet yang terdapat pada pangkal malai mengandung mikrospora tahap uninukleat akhir. Tahap uninukleat awal ditandai oleh kromosom yang mulai mengalami kondensasi (Gambar 1B2). Berikutnya, inti terlihat kompak pada bagian tepi sel karena terdorong oleh vakuola yang membesar atau disebut mikrospora uninukleat akhir (Gambar 1B3).
Malai jantan tahap berikutnya berwarna coklat dan sebagian seludangnya telah
terbuka (Gambar 1C1). Ujung spikelet dari spikelet yang terdapat pada ujung malai mengandung mikrospora tahap biselular awal dan pangkal spikelet dari spikelet yang terdapat pada pangkal malai mengandung mikrospora tahap biselular tengah. Kedua tahapan ini telah mengalami pembelahan mitosis membentuk dua inti asimetri yaitu inti vegetatif dan generatif. Mikrospora tahap biselular awal ditandai oleh letak inti vegetatif dan generatif yang terlihat bertumpuk (Gambar 1C2), sedangkan pada tahap biselular tengah kedua inti tampak terpisah (Gambar 1C3).
Selanjutnya malai yang berwarna coklat dan mulai mekar karena seludang malai telah terbuka (Gambar 1D1), mengandung tahap biselular akhir pada ujung spikelet dari spikelet yang terdapat pada ujung malai dan polen matang pada pangkal spikelet dari spikelet yang terdapat pada pangkal malai. Tahap biselular akhir ditandai oleh inti vegetatif yang bergerak mendekati dinding sel (Gambar 1D2).
D1 10 cm
A1 B1 C1
B2
B3 C3 D3
C2
A3
30 µm
D2
ig iv
[image:25.595.102.519.182.767.2]A2
Gambar 1 Hubungan antara ciri morfologi malai jantan dan tahap perkembangan mikrospora kelapa sawit. Tahapan perkembangan malai (A1-D1); Tahapan perkembangan mikrospora (A2-D3). Malai A1 mengandung mikrospora tahap sel induk polen (A2) sampai mikrospora tahap tetrad (A3); Malai B1 mengandung mikrospora tahap uninukleat awal (B2) sampai mikrospora tahap uninukleat akhir (BB3); Malai C1
5
0 20 40 60 80 100
7 14 21 28
m
ik
ro
s
po
ra
hi
dup
(
%
)
A
0 20 40 60 80 100
7 14 21 28
m
ik
ros
po
ra
hi
d
up (
%
)
B
0 20 40 60 80 100
7 14 21 28
m
ik
ros
por
a
hi
du
p (
%
)
C
[image:26.595.103.472.61.696.2]Kontrol, 25ºC 32ºC, 1 hari 32ºC, 3 hari 32ºC, 7 hari
PEMBAHASAN
Penentuan tahap perkembangan mikro-spora dalam antera yang akan dijadikan eksplan pada induksi androgenesis melalui kultur antera maupun kultur isolasi mikrospora merupakan faktor penting. Tahap paling responsif untuk induksi androgenesis adalah saat pembelahan mitosis pertama yaitu tahap uninukleat akhir sampai biselular awal (Maraschin et al.
2005). Fase uninukleat akhir pada kelapa sawit diperoleh dari pangkal spikelet dari spikelet yang terdapat pada pangkal malai pada malai yang memiliki ¼ bagian pangkal malai berwarna kuning dan ¾ bagian ujung malai berwarna coklat. Sedangkan tahap biselular awal diperoleh pada ujung spikelet dari spikelet yang terdapat pada ujung malai dari malai yang berwarna coklat dan sebagian seludangnya telah terbuka. Berdasarkan hasil tersebut, ciri morfologi malai dapat digunakan sebagai penanda tahapan perkembangan mikrospora. Hasil penelitian Supena et al. (2006) menunjukkan adanya warna ungu pada ujung antera cabai (Capsicum annuum) dapat digunakan sebagai penanda fase perkembangan mikrospora, tetapi hal ini tidak dijumpai pada antera kelapa sawit.
Keberhasilan induksi androgenesis dipengaruhi juga oleh densitas mikrospora. Densitas optimum kultur isolasi mikrospora pada media cair bervariasi antara 104 hingga 105 sel per ml. Jumlah sel mikrospora yang terlalu sedikit atau terlalu banyak akan semakin memperkecil keberhasilan andro-genesis (Rodrigues et al. 2006). Kelapa sawit dengan jumlah 443 200 sel mikrospora per bunga dikategorikan tinggi apabila dibandingkan dengan spesies lain seperti
Brassica napus dengan jumlah 124 600 sel mikrospora per bunga (Pertl et al.
2002) dan kedelai dengan jumlah 310 000 sel mikrospora per bunga (Rodrigues et al. 2006). Oleh karena itu kemungkinan keberhasilan androgenesis pada kelapa sawit diharapkan cukup besar. Perkembangan mikrospora in vitro
dalam teknik kultur antera pada media dua lapis dengan media standar embriogenesis somatik kelapa sawit hanya dapat mendukung perkembangan mikrospora dari tahap uninukleat akhir hingga biselular tengah. Hal ini menunjukkan bahwa jalur gametofitik tetap terjadi tetapi tidak sampai pada pematangan polen karena mikrospora banyak yang mati akibat terjadi plasmolisis
mulai 3 HSK. Hal ini diduga karena sumber karbon sukrosa dan glukosa tidak cocok apabila diberikan ke dalam media kultur antera kelapa sawit. Dugaan ketidakcocokan penggunaan sukrosa sebagai sumber karbon dalam kultur antera kelapa sawit didukung oleh hasil percobaan pengaruh sumber karbon maltosa yang dapat menurunkan laju kematian mikrospora (Gambar 3B).
Dalam kultur in vitro tanaman, sukrosa memang merupakan sumber karbon yang paling banyak digunakan, tetapi pada beberapa spesies seperti Barley (Hordeum vulgare) dan Snapdragon (Antirrhinum majus) (Scott & Lyne 1995; Scott & Lyne 1994; Barinova et al. 2002), sukrosa justru menyebabkan kematian sel karena memberi efek toksik. Hal ini disebabkan karena hidrolisis sukrosa sangat cepat sehingga dapat mengakibatkan metabolisme sel juga berjalan cepat. Pada akhirnya sel mengakumulasi etanol dalam jumlah besar sehingga memberi efek toksik pada sel yang menyebabkan kematian sel. Sedangkan hidrolisis maltosa berjalan lebih lambat, oksigen untuk respirasi menjadi lebih tercukupi dan energi dapat dimanfaatkan secara bertahap oleh sel, akibatnya sel dapat bertahan hidup pada media kultur (Scott & Lyne 1995). Hidrolisis pada sukrosa berjalan lebih cepat diduga karena enzim pemecah sukrosa menjadi monosakaridanya bekerja lebih cepat dibandingkan pada maltosa. Hidrolisis yang cepat ini menyebabkan sel mengalami defisiensi oksigen dan berada dalam kondisi anaerob. Pada kondisi ini, untuk memperoleh energi, sel akan memasuki jalur fermentasi dengan hasil akhir berupa etanol yang bersifat toksik pada sel.
7
mikrospora hidup pada 7 HSK dengan perlakuan cekaman suhu tinggi lebih rendah daripada kontrol. Sedangkan penurunan persentase mikrospora hidup pada 14 sampai dengan 28 HSK terutama disebabkan oleh efek keracunan sukrosa karena kultur pada hari ke-8 dipindahkan pada media dengan sumber karbon sukrosa. Cekaman suhu tinggi (32-33ºC) untuk kultur antera atau mikrospora pada beberapa spesies seperti Brassica napus
(Ferrie 2003) dan Nicotiana tabacum (Touraev & Heberle-Bors 2003), dapat membelokkan jalur gametofitik ke sporofitik. Menurut Maraschin et al. (2005) senyawa yang berperan dalam pembelokkan jalur gametofitik ke sporofitik adalah heat shock protein yang terinduksi oleh adanya suhu tinggi. Pada penelitian ini perlakuan cekaman dengan suhu tinggi yang dikombinasikan dengan sumber karbon sukrosa, maltosa dan manitol tidak dapat menginduksi pembelahan sporofitik yang merupakan langkah awal induksi androgenesis kelapa sawit. Perlakuan cekaman suhu rendah (4-9ºC) yang dikombinasikan dengan sumber karbon maltosa seperti pada penelitian cabai (Supena et al. 2006) ataupun praperlakuan suhu dingin (4ºC) pada kuncup bunga seperti pada Barley (Kruczkowska et al. 2002) kemungkinan dapat dijadikan alternatif dalam induksi androgenesis kelapa sawit.
SIMPULAN
Pangkal spikelet dari spikelet yang terdapat pada pangkal malai dari malai jantan yang memiliki ¼ bagian pangkal berwarna kuning dan ¾ bagian ujung berwarna coklat, mengandung mikrospora tahap uninukleat akhir. Sedangkan ujung spikelet dari spikelet yang terdapat pada ujung malai dari malai jantan yang berwarna coklat dan sebagian seludang telah terbuka mengandung mikrospora tahap biselular awal. Mikrospora tahap uninukleat akhir yang dikulturkan pada media standar embriogenesis somatik pada kelapa sawit dengan suhu inkubasi 25-28ºC, memper-lihatkan perkembangan gametofitik sampai tahap biselular pada umur 6 sampai 10 HSK.
Pemberian cekaman suhu tinggi (32-33ºC) yang dikombinasikan dengan perlakuan sumber karbon berupa sukrosa, maltosa ataupun manitol ternyata tidak dapat menginduksi pembelahan sporofitik dalam antera pada kutur in vitro. Namun perlakuan
cekaman suhu tinggi selama satu hari yang dikombinasikan dengan sumber karbon 40 g/l maltosa terbukti dapat mempertahankan persentase mikrospora hidup sebesar 74.5% sampai 28 HSK.
DAFTAR PUSTAKA
Barinova I, Zhexembekova M, Barsova E, Lukyanov S, Heberle-Bors E, Touraev A. 2002. Antirrhinum majus microspore maturation and transient transformation
in vitro. J Expt Bot 53: 1119-1129. Collin HA, Edwards S. 1998. Plant Cell
Culture. Singapore: Springer-Verlag Singapore Pte Ltd. hlm 59-60.
Ferrie AMR, Palmer CE, Keller WA. 1994. Biotechnological applications of haploids. Di dalam: Shargool PD, Ngo TT, editor. Biotechnological Aplication of Plant Cultures. Boca Raton: CRC Press. hlm 77-109.
Ferrie A. 2003. Microspore culture of
Brassica species. Di Dalam:
Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant, A Manual. Dordrecht: Kluwer Academic Publisher. hlm. 205-215.
Gorret N, Rosli SK, Oppenheim SF, Willis LB, Lessard PA, Cho KR, Sinskey AJ. 2004. Bioreactor culture of oil palm (Elaeis guineensis Jacq.) and effects of nitrogen source, inoculum size, and conditioned medium on biomass production. J Biotechnol 108: 253-263. Harada H, Imamura J. 1983. Factors that
stimulate pollen embryogenesis. Di dalam: Cell and Tissue Culture Techniques for Cereal Crop Improvement. Proceedings of Workshop on Potential of Cell and Tissue Culture Techniques in the Improvement of Cereal Crops; Beijing, 19-23 Okt 1981. Beijing: Science Press and International Rice Research Institute. hlm 145-158. Kasha KJ, Simion E, Oro R, Shim YS. 2003.
Barley isolated and microspore culture protocol. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor.
Double Haploid Production in Crop Plant. Dordrecht: Kluwer Academic Publisher. hlm 43-47.
Kruczkowska H, Pawlowska H, Skuncinska B. 2002. Influence of anther pretreatment on the efficiency of androgenesis in barley. J Appl Genet
7
mikrospora hidup pada 7 HSK dengan perlakuan cekaman suhu tinggi lebih rendah daripada kontrol. Sedangkan penurunan persentase mikrospora hidup pada 14 sampai dengan 28 HSK terutama disebabkan oleh efek keracunan sukrosa karena kultur pada hari ke-8 dipindahkan pada media dengan sumber karbon sukrosa. Cekaman suhu tinggi (32-33ºC) untuk kultur antera atau mikrospora pada beberapa spesies seperti Brassica napus
(Ferrie 2003) dan Nicotiana tabacum (Touraev & Heberle-Bors 2003), dapat membelokkan jalur gametofitik ke sporofitik. Menurut Maraschin et al. (2005) senyawa yang berperan dalam pembelokkan jalur gametofitik ke sporofitik adalah heat shock protein yang terinduksi oleh adanya suhu tinggi. Pada penelitian ini perlakuan cekaman dengan suhu tinggi yang dikombinasikan dengan sumber karbon sukrosa, maltosa dan manitol tidak dapat menginduksi pembelahan sporofitik yang merupakan langkah awal induksi androgenesis kelapa sawit. Perlakuan cekaman suhu rendah (4-9ºC) yang dikombinasikan dengan sumber karbon maltosa seperti pada penelitian cabai (Supena et al. 2006) ataupun praperlakuan suhu dingin (4ºC) pada kuncup bunga seperti pada Barley (Kruczkowska et al. 2002) kemungkinan dapat dijadikan alternatif dalam induksi androgenesis kelapa sawit.
SIMPULAN
Pangkal spikelet dari spikelet yang terdapat pada pangkal malai dari malai jantan yang memiliki ¼ bagian pangkal berwarna kuning dan ¾ bagian ujung berwarna coklat, mengandung mikrospora tahap uninukleat akhir. Sedangkan ujung spikelet dari spikelet yang terdapat pada ujung malai dari malai jantan yang berwarna coklat dan sebagian seludang telah terbuka mengandung mikrospora tahap biselular awal. Mikrospora tahap uninukleat akhir yang dikulturkan pada media standar embriogenesis somatik pada kelapa sawit dengan suhu inkubasi 25-28ºC, memper-lihatkan perkembangan gametofitik sampai tahap biselular pada umur 6 sampai 10 HSK.
Pemberian cekaman suhu tinggi (32-33ºC) yang dikombinasikan dengan perlakuan sumber karbon berupa sukrosa, maltosa ataupun manitol ternyata tidak dapat menginduksi pembelahan sporofitik dalam antera pada kutur in vitro. Namun perlakuan
cekaman suhu tinggi selama satu hari yang dikombinasikan dengan sumber karbon 40 g/l maltosa terbukti dapat mempertahankan persentase mikrospora hidup sebesar 74.5% sampai 28 HSK.
DAFTAR PUSTAKA
Barinova I, Zhexembekova M, Barsova E, Lukyanov S, Heberle-Bors E, Touraev A. 2002. Antirrhinum majus microspore maturation and transient transformation
in vitro. J Expt Bot 53: 1119-1129. Collin HA, Edwards S. 1998. Plant Cell
Culture. Singapore: Springer-Verlag Singapore Pte Ltd. hlm 59-60.
Ferrie AMR, Palmer CE, Keller WA. 1994. Biotechnological applications of haploids. Di dalam: Shargool PD, Ngo TT, editor. Biotechnological Aplication of Plant Cultures. Boca Raton: CRC Press. hlm 77-109.
Ferrie A. 2003. Microspore culture of
Brassica species. Di Dalam:
Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant, A Manual. Dordrecht: Kluwer Academic Publisher. hlm. 205-215.
Gorret N, Rosli SK, Oppenheim SF, Willis LB, Lessard PA, Cho KR, Sinskey AJ. 2004. Bioreactor culture of oil palm (Elaeis guineensis Jacq.) and effects of nitrogen source, inoculum size, and conditioned medium on biomass production. J Biotechnol 108: 253-263. Harada H, Imamura J. 1983. Factors that
stimulate pollen embryogenesis. Di dalam: Cell and Tissue Culture Techniques for Cereal Crop Improvement. Proceedings of Workshop on Potential of Cell and Tissue Culture Techniques in the Improvement of Cereal Crops; Beijing, 19-23 Okt 1981. Beijing: Science Press and International Rice Research Institute. hlm 145-158. Kasha KJ, Simion E, Oro R, Shim YS. 2003.
Barley isolated and microspore culture protocol. Di Dalam: Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor.
Double Haploid Production in Crop Plant. Dordrecht: Kluwer Academic Publisher. hlm 43-47.
Kruczkowska H, Pawlowska H, Skuncinska B. 2002. Influence of anther pretreatment on the efficiency of androgenesis in barley. J Appl Genet
7
mikrospora hidup pada 7 HSK dengan perlakuan cekaman suhu tinggi lebih rendah daripada kontrol. Sedangkan penurunan persentase mikrospora hidup pada 14 sampai dengan 28 HSK terutama disebabkan oleh efek keracunan sukrosa karena kultur pada hari ke-8 dipindahkan pada media dengan sumber karbon sukrosa. Cekaman suhu tinggi (32-33ºC) untuk kultur antera atau mikrospora pada beberapa spesies seperti Brassica napus
(Ferrie 2003) dan Nicotiana tabacum (Touraev & Heberle-Bors 2003), dapat membelokkan jalur gametofitik ke sporofitik. Menurut Maraschin et al. (2005) senyawa yang berperan dalam pembelokkan jalur gametofitik ke sporofitik adalah heat shock protein yang terinduksi oleh adanya suhu tinggi. Pada penelitian ini perlakuan cekaman dengan suhu tinggi yang dikombinasikan dengan sumber karbon sukrosa, maltosa dan manitol tidak dapat menginduksi pembelahan sporofitik yang merupakan langkah awal induksi androgenesis kelapa sawit. Perlakuan cekaman suhu rendah (4-9ºC) yang dikombinasikan dengan sumber karbon maltosa seperti pada penelitian cabai (Supena et al. 2006) ataupun praperlakuan suhu dingin (4ºC) pada kuncup bunga seperti pada Barley (Kruczkowska et al. 2002) kemungkinan dapat dijadikan alternatif dalam induksi androgenesis kelapa sawit.
SIMPULAN
Pangkal spikelet dari spikelet yang terdapat pada pangkal malai dari malai jantan yang memiliki ¼ bagian pangkal berwarna kuning dan ¾ bagian ujung berwarna coklat, mengandung mikrospora tahap uninukleat akhir. Sedangkan ujung spikelet dari spikelet yang terdapat pada ujung malai dari malai jantan yang berwarna coklat dan sebagian seludang telah terbuka mengandung mikrospora tahap biselular awal. Mikrospora tahap uninukleat akhir yang dikulturkan pada media standar embriogenesis somatik pada kelapa sawit dengan suhu inkubasi 25-28ºC, memper-lihatkan perkembangan gametofitik sampai tahap biselular pada umur 6 sampai 10 HSK.
Pemberian cekaman suhu tinggi (32-33ºC) yang dikombinasikan dengan perlakuan sumber karbon berupa sukrosa, maltosa ataupun manitol ternyata tidak dapat menginduksi pembelahan sporofitik dalam antera pada kutur in vitro. Namun perlakuan
cekaman suhu tinggi selama satu hari yang dikombinasikan dengan sumber karbon 40 g/l maltosa terbukti dapat mempertahankan persentase mikrospora hidup sebesar 74.5% sampai 28 HSK.
DAFTAR PUSTAKA
Barinova I, Zhexembekova M, Barsova E, Lukyanov S, Heberle-Bors E, Touraev A. 2002. Antirrhinum majus microspore maturation and transient transformation
in vitro. J Expt Bot 53: 1119-1129. Collin HA, Edwards S. 1998. Plant Cell
Culture. Singapore: Springer-Verlag Singapore Pte Ltd. hlm 59-60.
Ferrie AMR, Palmer CE, Keller WA. 1994. Biotechnological applications of haploids. Di dalam: Shargool PD, Ngo TT, editor. Biotechnological Aplication of Plant Cultures. Boca Raton: CRC Press. hlm 77-109.
Ferrie A. 2003. Microspore culture of
Brassica species. Di Dalam:
Maluszynki M, Kasha KJ, Foster BP, Szarejko I, editor. Double Haploid Production in Crop Plant, A Manual. Dordrecht: Kluwer Ac