PEMANFAATAN ZEOLIT ALAM SEBAGAI
CARRIER
UNSUR HARA MIKRO (Cu dan Zn) DALAM FORMULASI
PUPUK LAMBAT TERSEDIA
EVI MUTIARA DEWI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pemanfaatan Zeolit Alam sebagai Carrier Unsur Hara Mikro (Cu dan Zn ) dalam Formulasi Pupuk Lambat Tersedia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2017 Evi Mutiara Dewi NIM A152120061
RINGKASAN
EVI MUTIARA DEWI. Pemanfaatan Zeolit Alam sebagai Carrier Unsur Hara Mikro (Cu dan Zn ) dalam Formulasi Pupuk Lambat Tersedia. Pembimbing SUWARDI, DYAH TJAHYANDARI S and SYAIFUL ANWAR.
Meningkatkan ketersediaan unsur mikro dalam tanah dapat dilakukan melalui pemupukan yang efisien. Hal ini salahsatunya dapat diatasi dengan membuat pupuk lambat tersedia (slow release fertilizer). Slow release fertilizer (SRF) dapat dibuat dengan memasukan unsur mikro tersebut kedalam suatu bahan sebagai carrier. Bahan alami yang dapat digunakan sebagai carrier ialah zeolit alam. Penelitian ini bertujuan untuk 1) mengidentifikasi karakteristik fisik dan kimia zeolit alam Lampung, Bayah, dan Tasikmalaya, 2) menghitung daya adsorpsi zeolit terhadap unsur hara mikro Cu dan Zn, Serta 3) menguji kelarutan/ekstraksi dan pencucian unsur hara dari produk SRF. Penelitian dilakukan dengan analisis karakteristik zeolit seperti jenis dan morfologi mineral, pH, kapasitas tukar kation (KTK), kejenuhan basa (KB), kadar Cu dan Zn dalam zeolit. Selanjutnya dilakukan pengukuran kapasitas jerapan zeolit terhadap bahan humat dan unsur mikro. Pengukuran kapasitas jerapan zeolit terhadap bahan humat dilakukan menggunakan metode gravimetri. Sedangkan pengukuran kapasitas jerapan zeolit terhadap unsur mikro dilakukan dengan sistem batch. Interpretasi data adsorpsi tersebut menggunakan persamaan jerapan isotermal Langmuir, Freundlich dan BET (Brunauer–Emmett–Teller). Pembuatan pupuk lambat tersedia dilakukan dengan teknik granulasi. Pupuk lambat tersedia yang dihasilkan diuji kelarutan/ekstraksi dan uji pencucian hara dengan metode perkolasi. Hasil analisis karakteristik menunjukkan bahwa zeolit Bayah dan Tasikmalaya merupakan jenis mordenit, sedangkan zeolit Lampung merupakan jenis klinoptilolit. Kapasitas tukar kation zeolit mordenit berkisar 96.75 me 100 g-1 - 137.58 me 100 g-1 lebih besar
dibandingkan dengan zeolit klinoptilolit yaitu 87.72 me 100 g-1. Perbedaan nilai
KTK tersebut berpengaruh terhadap perbedaan kapasitas jerapan zeolit terhadap unsur mikro menurut persamaan Langmuir dan BET. Kapasitas jerapan Cu (II) zeolit mordenit sekitar 28.6 mg. g-1 - 47.6 mg. g-1 sedangkan zeolit klinoptilolit
sebesar 33.3 mg. g-1. Jerapan efektif terhadap Zn (II) zeolit mordenit sebesar 1.4
mg. g-1 - 19.4 mg. g-1 lebih besar dibandingkan zeolit klinoptilolit (16.9 mg.g-1).
Berdasarkan uji pelarutan dan pencucian unsur hara di dalam zeolit dilepaskan secara perlahan dan tidak mudah tercuci.
SUMMARY
EVI MUTIARA DEWI. The Utilization of The Natural Zeolites as Carrier of Cu and Zn Micronutrients in Slow Release Fertilizer Formulation. Supervised by SUWARDI, DYAH TJAHYANDARI S and SYAIFUL ANWAR.
Increasing of micronutrients availability in soils can be achieved by application of slow release fertilizer (SRF). SRF can be formulated by filling micronutrients into a substance as carrier. A natural substance that can be used as a carrier is zeolite. This study was aimed to: 1) identify the physical and chemical characteristics of natural zeolites of Lampung, Bayah, and Tasikmalaya, 2) investigate zeolite adsorption capacity of micronutrients, and 3) obtain the dissolution and releasing rate of nutrients from the formulated SRF. This research was carried out by analyzing zeolites characterization included some variables i.e. mineral types and morphology, pH, cation exchange capacity (CEC), base saturation (BS), Cu and Zn content of zeolites. Measurement of zeolite adsorption capacity of humic substance were also carried out by gravimetric method. Measurement of zeolite adsorption capacity of micronutrients were carried out by batch method. Data interpretation were carried out by using the isothermal adsorption equations of Langmuir, Freundlich and Brunauer-Emmett-Teller (BET). SRF was made by granulating technique. SRF was analysed by measuring of the dissolution and releasing rate of nutrients by percolation method. The characterization analysis showed that Bayah and Tasikmalaya zeolites are mordenite type while Lampung zeolite is clinoptilolite type. CEC of mordenite about 96.75 me.100g-1 - 137.58 me.100g-1 were higher than that of clinoptilolite
zeolite (87.72 me.100g-1). The differences in zeolites CEC related to difference in
adsorpstion capacity according to Langmuir and BET ishothermal equations. Mordenite zeolite had higher adsorption capability of Cu (II) than clinoptilolite zeolite. Mordenite adsorption on Cu (II) was about 28.6 mg. g-1 - 47.6 mg. g-1, while
that of clinoptilolite was 33.3 mg. g-1. Effective adsorption of mordenite on Zn (II)
(1.4 mg.g-1 - 19.4 mg. g-1) was higher than that of clinoptilolite (16.9 mg.g-1).
Micronutrients in the natural zeolites could be released slowly and could not easily be leached out.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Agroteknologi Tanah
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2017
PEMANFAATAN ZEOLIT ALAM SEBAGAI
CARRIER
UNSUR HARA MIKRO (Cu dan Zn) DALAM FORMULASI
PUPUK LAMBAT TERSEDIA
NIM : A152120061
Disetujui Oleh :
Komisi Pembimbing
Dr Ir
Ketua
Dr Ir A
Anggota
Ketua Program Studi
Agroteknologi Tanah
Diketahui
Tanggal Ujian: t" NOV.MB£� O,
(tanggal pelaksanaan ujian tesis)
Sc Anggota
Tanggal Lulus:
0 8
FEB 2017
(tanggal penandatanganan tesis oleh Dekan SekolahPRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah dengan judul Pemanfaatan Zeolit Alam sebagai Carrier Pupuk Mikro Cu dan Zn. Tesis ini disusun sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Agroteknologi Tanah, Sekolah Pascasarjana, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Ibu Dr Ir RA Dyah Tjahyandari S, MAppl.Sc selaku Ketua Program Studi Agroteknologi Tanah sekaligus sebagai pembimbing, Bapak Dr Ir Suwardi, MAgr dan Bapak Dr Ir Syaiful Anwar, MSc selaku pembimbing atas segala bimbingan, saran, motivasi, dan bantuannya selama penelitian dan penyusunan tesis ini. Terima kasih dan penghargaan yang sebesar-besarnya juga penulis sampaikan kepada Dr Ir Atang Sutandi, MSi selaku selaku penguji yang telah memberikan saran dan masukan sehingga membantu tesis ini menjadi lebih baik. Ungkapan terima kasih juga disampaikan kepada kedua orangtua, mertua, suami, serta buah hati tercinta atas segala doa, kasih sayang, pengorbanan, bimbingan, kepercayaan, kesabaran, serta perjuangan yang tulus dan tiada hentinya, sehingga penulis dapat menyelesaikan pendidikan hingga ke jenjang S2.
Ucapan terima kasih juga penulis sampaikan kepada teknisi/laboran di Laboratorium Sumberdaya Lahan, sahabat-sahabat penulis, teman-teman Departemen Ilmu Tanah dan Sumberdaya Lahan, Laboratorium Agroteknologi Tanah, serta semua pihak yang namanya tidak dapat tertulis satu persatu, tanpa bermaksud mengecilkan arti bantuan dan kebaikan yang telah diberikan. SemAllah memberikan balasan amal baik kepada mereka dengan pahala yang tidak terhingga. Penulis berharap semoga karya ilmiah ini bermanfaat dan dapat memberikan kontribusi positif bagi kalangan ilmu pengetahuan dan teknologi di bidang pertanian.
Bogor, Februari 2017
DAFTAR ISI
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
2 TINJAUAN PUSTAKA 2
Zeolit 2
Bahan Humat 8
Unsur Hara Mikro 12
Adsorpsi Isoterm 13
Pupuk Lambat Tersedia 15
3 METODE 17
Waktu dan Tempat 17
Bahan dan Alat 17
Tahapan Penelitian 17
Analisis Data 19
4 HASIL DAN PEMBAHASAN 22
Analisis Pendahuluan 22
Hasil Formulasi Pupuk Lambat Tersedia dan Karakteristik Fisiknya 30 Pengujian Kelarutan/Ekstraksi dan Pencucian SRF 33
5 SIMPULAN DAN SARAN 36
Simpulan 36
Saran 36
DAFTAR PUSTAKA 37
LAMPIRAN 41
DAFTAR TABEL
1 Contoh jenis mineral zeolit (Barer 1992) 4
2 Unit bangun primer dan sekunder struktur zeolit (Breck 1974) 4 3 Karakterisasi fisik dan kimia zeolit alam Lampung, Bayah, dan
Tasikmalaya 18
4 Karakterisasi bahan humat 18
5 Karakteristik kimia zeolit 24
6 Kadar unsur mikro Cu dan Zn dalam pupuk 26
7 Sifat-sifat kimia tanah Latosol 26
8 Adsorpsi zeolit terhadap bahan humat 26
9 Nilai parameter jerapan terhadap Cu (II) menurut persamaan isotermal
Langmuir, Freundlich dan BET 28
10 Nilai parameter jerapan terhadap Zn (II) menurutpersamaan isotermal
Langmuir, Freundlich dan BET 29
11 Uji pelepasan unsur hara Cu melalui perkolasi 34 12 Uji pelepasan unsur hara Zn melalui perkolasi 34 13 Perbandingan serapan dan pelepasan unsur Cu dan Zn selama 4 minggu 35
DAFTAR GAMBAR
1 Kerangka dasar struktur zeolit (Smart and Elaine 1992) 3 2 Struktur umum kerangka zeolit (Smart and Elaine 1992) 3
3 Struktur stereotip klinoptilolit 5
4 Struktur stereotip mordenit 5
5 Diagram alur pemisahan senyawa humat menjadiberbagai fraksi humat
(Tan 1993) 10
6 Model interaksi ion logam dengan bahan humat dan fulvat
(Schnitzer 1986) 11
7 Proses adsorpsi 13
8 Pola berbagai jenis adsorpsi 14
9 Ilustrasi adsorpsi pada persamaan Langmuir 14
10 Ilustrasi adsorpsi pada persamaan BET 15
11 Formulasi pupuk lambat tersedia 20
12 Uji pencucian/pelepasan hara dengan metode perkolasi 21 13 Foto kristal yang terbentuk menggunakan SEM zeolit Lampung (a),
zeolit Bayah(b) dan zeolit Tasikmalaya (c) dengan perbesaran 10.000x. zeolit Lampung (d), zeolit Bayah (e) dan zeolit Tasikmalaya (f) dengan
perbesaran 20.000x 23
14 Adsorpsi zeolit terhadap bahan humat 27 15 Topografi permukaan zeolit Lampung (a), formulasi zeolit Lampung +
unsur mikro = P1 (b) dan formulasi zeolit Lampung + unsur mikro +
16 Topografi permukaan zeolit Bayah (a), formulasi zeolit Bayah + unsur mikro = P3 (b) dan formulasi zeolit Bayah + unsur mikro +
bahan humat = P4 (c) dengan pembesaran 20.000x 30
17 Topografi permukaan zeolit Tasikmalaya (a), formulasi zeolit Tasikmalaya + unsur mikro = P3 (b) dan formulasi zeolit Tasikmalaya + unsur mikro + bahan humat = P4 (c) dengan pembesaran 20.000x 31
18 Grafik uji pelarutan terhadap unsur Cu dan Zn 33
19 Grafik uji perkolasi terhadap unsur Cu 34
20 Grafik uji perkolasi terhadap unsur Zn 34
DAFTAR LAMPIRAN
1 Diagram alir proses pembuatan SRF 43
2 Gambar tahap formulasi SRF 44
3 Grafik difraksi zeolit Lampung (a), Bayah (b), Tasikmalaya(c), dan
(d) Grafik difraksi gabungan ketiga zeolit alam 45 4 Gambar uji pencucian pupuk dengan metode perkolasi 46
5 Gambar difraktogram P1 (Zeolit Lampung=ZA +unsur mikro) 46 6 Gambar difraktogram P2 (Zeolit Lampung=ZA +unsur mikro+ Bahan
humat) 47
7 Gambar difraktogram P3 (Zeolit Bayah=ZB +unsur mikro) 47 8 Gambar difraktogram P4 (Zeolit Bayah=ZB +unsur mikro+ Bahan
humat) 48
9 Gambar difraktogram P5 (Zeolit Tasikmalaya=ZC +unsur
mikro) 48
10 Gambar difraktogram P6 (Zeolit Tasikmalaya=ZC +unsur mikro+ Bahan
humat) 49
11 Linearisasi Cu Persamaan Langmuir (a), Freudlich (b), dan BET (c) 50 12 Linearisasi Zn Persamaan Langmuir (a), Freudlich (b), dan BET (c) 51
13 Karakteristik bahan humat 52
1
PENDAHULUAN
Latar Belakang
Pengembangan pertanian berkelanjutan salahsatunya berdasarkan pada peningkatan efisiensi pemupukan. Pemupukan merupakan salah satu usaha untuk menambah kekurangan unsur hara yang diperlukan tanaman hingga mencapai pertumbuhan dan hasil maksimal. Efisiensi pemupukan menunjukkan hubungan antara biaya (bahan pupuk, alat kerja, dan upah) dengan tingkat produksi yang dihasilkan. Di perkebunan biasanya menerapkan teknik pemupukan dengan dosis yang cukup tinggi dan dilakukan beberapa kali selama masa tanam. Kegiatan pemupukan berkali-kali tentu dapat memperbesar biaya produksi, sehingga fungsi biaya lebih besar dibandingkan tingkat produksinya (efisiensi rendah). Selain itu, unsur hara yang dilepaskan dari pupuk tidak semuanya dapat diserap oleh tanaman. Berbagai reaksi tanah dapat mempengaruhi serapan hara oleh tanaman. Sebagai contoh kekurangan unsur mikro seperti Cu dan Zn sering terjadi pada tanah masam berpasir akibat pencucian. Pada tanah alkalin kekurangan Cu dan Zn biasanya terjadi karena adanya ikatan logam tersebut dengan ion OH membentuk hidroksida yang lebih sukar larut. Pada tanah masam biasanya Zn banyak tercuci. Pada tanah gambut, kadar bahan organik tinggi menjadi penyebab ketidaktersediaan unsur mikro. Hal ini terjadi karena adanya ikatan logam-organik (khelat) yg relatif sukar lepas. Teknik pemupukan tersebut sebenarnya belum tepat apalagi diterapkan untuk pemupukan unsur mikro. Unsur mikro dibutuhkan sedikit demi sedikit dan perlahan sesuai yang diserap tanaman. Hal ini dapat diatasi dengan pembuatan pupuk lambat tersedia.
dalam formulasi SRF. Bahan tersebut ialah bahan humat yang merupakan fraksi utama dari bahan organik tanah dalam memperbaiki kesuburan tanah (Bama et al. 2003). Bahan tersebut mempunyai sifat yang spesifik antara lain memiliki muatan negatif yang tinggi (500-700 me/100g), kemampuan khelat yang tinggi dan memiliki sifat buffer yang tinggi. Sifat-sifat tersebut memungkinkan bahan humat digunakan sebagai bahan pembuatan pupuk lambat tersedia. Penelitian Nainggolan et al. (2009) memanfaatkan zeolit dan bahan humat pada pembuatan pupuk lambat tersedia urea. Penambahan unsur mikro (Cu dan Zn) dan bahan humat dengan carrier zeolit diharapkan dapat memenuhi kebutuhan tanaman akan unsur-unsur tersebut secara efisien.
Tujuan Penelitian Penelitian ini bertujuan untuk :
1. Mengidentifikasi karakteristik fisik dan kimia zeolit alam Lampung, Bayah, dan Tasikmalaya.
2. Mengukur daya adsorpsi zeolit terhadap unsur hara mikro Cu dan Zn. 3. Menguji kelarutan/ekstraksi dan pencucian unsur hara dari produk slow
release fertilizer (SRF) hasil formulasi zeolit dan unsur hara mikro Cu dan Zn.
2
TINJAUAN PUSTAKA
Zeolit
Zeolit pertama kali ditemukan oleh ahli mineral Swedia yaitu Freiher Axel Fredrick Cronsted pada tahun 1756. Nama Zeolit berasal dari bahasa Yunani, yaitu dari kata zein dan lithos yang artinya batu mendidih. Disebut demikian karena mineral ini mempunyai sifat mendidih atau mengembang apabila dipanaskan. Dimana air dalam rongga-rongga zeolit akan mendidih bila dipanaskan pada suhu 100oC. Zeolit alam terbentuk karena adanya proses kimia dan fisika yang kompleks
danau atau laut tersebut (Setyawan 2002). Jenis zeolit alam dibedakan menjadi 2 kelompok, yaitu:
a. Zeolit yang terdapat di antara celah-celah batuan atau di antara lapisan batuan zeolit jenis ini biasanya terdiri dari beberapa jenis mineral zeolit bersama-sama dengan mineral lain seperti kalsit, kwarsa, klorit, fluorit dan mineral sulfida. b. Zeolit yang berupa batuan; hanya sedikit jenis zeolit yang berbentuk batuan,
diantaranya adalah: klinoptilolit, analsim, laumontit, mordenit, filipsit, erionit, kabasit dan heulandit.Zeolit alam adalah zeolit yang ditambang langsung dari alam. Dengan demikian harganya jauh lebih murah daripada zeolit sintetis. Zeolit alam merupakan mineral yang jumlahnya banyak tetapi distribusinya tidak merata, seperti klinoptilolit, mordenit, phillipsit, chabazit dan laumontit. Namun zeolit alam memiliki beberapa kelemahan, diantaranya mengandung banyak pengotor seperti Na, K, Ca, Mg dan Fe serta kristalinitasnya kurang baik. Keberadaan pengotor-pengotor tersebut dapat mengurangi aktivitas dari zeolit. Upaya memperbaiki karakter zeolit alam sehingga dapat digunakan sebagai katalis, absorben, atau aplikasi lainnya, biasanya dilakukan aktivasi dan modifikasi terlebih dahulu. Selain untuk menghilangkan pengotor-pengotor yang terdapat pada zeolit alam, proses aktivasi zeolit juga ditujukan untuk memodifikasi sifat-sifat dari zeolit, seperti luas permukaan dan keasaman. Luas permukaan dan keasaman yang meningkat akan menyebabkan aktivitas katalitik dari zeolit meningkat. Salah satu kelebihan dari zeolit adalah memiliki luas permukaan dan keasaman yang mudah dimodifikasi (Yuanita 2010).
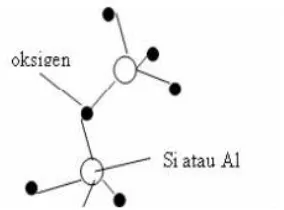
Zeolit merupakan kristal aluminosilikat terhidrasi yang mengandung kation alkali atau alkali tanah dalam kerangka tiga dimensi. Kerangka dasar struktur zeolit terdiri dari unit tetrahedral AlO2 dan SiO2 yang saling berhubungan melalui atom
O seperti pada Gambar 1 atau diilustrasikan pada Gambar 2.
Gambar 1 Kerangka dasar struktur zeolit (Smart and Elaine 1992)
Unit pembangun utama yaitu SiO2 dan Al2O3 membentuk tetrahedral,
dimana setiap atom oksigen menempati/berada pada keempat sudutnya. Struktur yang terbetuk adalah jaringan tiga dimensi dengan setiap atom oksigen digunakan bersama oleh dua tetrahidral seperti dalam gambar 2.
Struktur rangka utama zeolit ditempati oleh atom silikon atau aluminium dengan empat atom oksigen di setiap sudutnya. Ini merupakan sisi aktis zeolit yang menyebabkan zeolit memiliki kemapuan sebagai penukar ion, adsorben dan katalis. Atom oksigen yang terdapat dalam struktur zeolit terbagi antara dua tetrahedral, sehingga membentuk suatu rangka yang bersambung. Penggantian Si4+ dengan Al3+
dalam kerangka zeolit menyebabkan kerangka bermuatan negatif. Zeolit mempunyai rumus empiris sebagai berikut: Mx/n[(AlO2)x.(SiO2)y]⋅zH2O.
Komponen pertama, M adalah kation logam alkali atau alkali tanah, n = valensi dari kation M, z = jumlah melukul air per unit sel, X dan y = jumlah tetrahedron per unit
sel. Menurut Minato (1988), pembentukan deposit mineral zeolit di alam berlangsung pada jutaan tahun yang lalu, dalam lebih dari 1.000 macam cara yaitu di dalam gunung berapi dan batuan sedimen.
Sumber zeolit alam di Indonesia pada umumnya mengandung topologi zeolit Mordenit dan klinoptilolit (Suminta 2005). Lestari (2010) menyatakan zeolit alam dari Turki dan Slovenia mayoritas kandungannya klinoptilolit sedangkan zeolit alam Indonesia (Malang dan Wonosari) banyak mengandung mordenit dan klinoptilolit. Kemurnian yang rendah dari zeolit alam menyebabkan pemanfaatannya yang tidak optimal dibandingkan dengan zeolit sintetik (Barrer 1982). Beberapa contoh jenis mineral zeolit beserta rumus kimianya:
Tabel 2 Unit bangun primer dan sekunder struktur zeolit (Breck 1974)
Unit bangun struktur Keterangan
Unit bangun primer (TO4) Tetrahedra dari 4 atom oksigen dengan pusat atom Si atau Al
Unit bangun sekunder (SBU) Lingkar tunggal: S4R, S6R, S8R Lingkar ganda: D4R, D6R dan D8R Kompleks T5O10(4-1), T8O16b(5-1) dan
T10O20 (4-4-1)
Nama mineral Rumus kimia unit sel
Analsim Na16(Al16Si32O96).16H2O
Breck (1974) mengklasifikasi zeolit berdasarkan ikatan lingkar tunggal 4, 6, 8 dan ikatan lingkar ganda 4, 6 dan 8 dan kompleks tetrahedra yang disebut dengan unit bangun sekunder (UBS) yang merupakan konfigurasi beberapa tetrahedra Si dan Al atau (TO4) sebagai unit bangun primer sebagaimana terlihat pada Tabel 2.
Pada tahun 1923, Schaller menemukan mineral di Hoodoo Mountain Wyoming, Amerika Serikat, dan menamakannya dengan klinoptilolit. Klinoptilolit mempunyai struktur complex 4-4-1 (T10O20), dengan dua ukuran saluran 0,35 x 0,79 nm dan 0,44x0,30 nm (Gambar 3). Mordernit dikenal dari tahun 1858, ketika How menemukan mineral di Morden, Kings County, Nova Scotia. Mordenit mempunyai struktur kompleks 5-1 (T8O16) dengan ukuran saluran 0,67 x 0,70 nm dan 0,29 x 0,57 nm (Gambar 4). Rasio Si/Al klinoptilolit adalah 4,0-5,1 dan mempunyai kandungan ion K>Na>Ca>Mg. Modernit mempunyai rasio Si/Al antara 4,3-5,3 dan mengandung ion Na>K>Ca>Mg. Keduanya diklasifikasi sebagai zeolit dengan kandungan silika tinggi, sedangkan mordenit juga dikenal dengan jenis “large pore” atau “small pore” disebabkan perbedaan posisi atom alkali (K dan Na) dalam struktur kristal, sedangkan semua mordenit alam adalah “small pore”.
Gambar 3 Struktur stereotip klinoptilolit
Gambar 4 Struktur stereotip mordenit
Klinoptilolit dan mordenit terdapat pada beberapa jenis batuan yang tesebar di daerah dengan kebasaan yang tinggi (saline, alkaline soil), permukaan tanah, endapan lautan dalam (deep-sediment), sistim hidrologi terbuka (open hydrologic system), daerah alterasi panas bumi (hydrothermal alteration zones) dan di daerah dengan batuan metamorfosa (Las dan Husen 2002).
Pengaplikasian zeolit di sektor pertanian dapat meningkatkan produksi tanaman, mengurangi jumlah penggunaan pupuk, dan serapan hara (Castaldi et al. 2005), oleh karena itu zeolit dapat digunakan sebagai pupuk, selain itu zeolit juga dapat digunakan sebagai carrier, stabilizer, dan khelator tanpa mengubah struktur kristalnya (Perez-Caballero et al.2008).
Mineral zeolit merupakan suatu alternatif baru yang berdasarkan sifat-sifat dimilikinya mempunyai prospek untuk dipergunakan dalam sektor pertanian. Sifat pertukaran kation, kapasitas pertukaran kation (KTK) yang tinggi, kemampuan menahan air atau unsur hara yang tinggi memungkinkan zeolit alam dapat dipergunakan untuk memperbaiki sifat-sifat kimia dan fisik yang kurang baik dari sebagian besar lahan pertanian di Indonesia.
Mineral ini memiliki sifat-sifat unik meliputi dehidrasi, adsorben dan penyaring molekul, katalisator, dan penukar ion. Zeolit mempunyai sifat dehidrasi (melepaskan molekul H2O) apabila dipanaskan. Pada umumnya struktur kerangka
zeolit akan menyusut. Tetapi kerangka dasarnya tidak mengalami perubahan secara nyata. Disini molekul H2O seolah-olah mempunyai posisi yang spesifik dandapat
dikeluarkan secara reversibel. Sifat zeolit sebagai adsorben dan penyaring molekul, dimungkinkan karena struktur zeolit yang berongga, sehingga zeolit mampu menyerap sejumlah besar molekul yang berukuran lebih kecil atau sesuai dengan ukuran rongganya. Selain itu kristal zeolit yang telah terdehidrasi merupakan adsorben yang selektif dan mempunyai efektivitas adsorpsi yang tinggi.
Adsorpsi Zeolit terhadap Logam (Cu dan Zn)
Adsorpsi adalah proses dimana satu atau lebih unsur-unsur pokok dari suatu larutan fluida akan lebih terkonsentrasi pada permukaan suatu padatan tertentu (adsorbent). Adsorpsi melibatkan perpindahan massa dan menghasilkan kesetimbangan distribusi dari satu atau lebih larutan antara fasa cair dan partikel. Permukaan adsorben pada umumnya secara fisika maupun kimia heterogen dan energi ikatan sangat mungkin berbeda antara satu titik dengan titik lainnya.
Salah satu metode yang digunakan untuk menghilangkan zat pencemar dari air limbah adalah adsorpsi. Zat yang teradsorpsi merupakan fase teradsorpsi (adsorbat) dan zat yang mengadsorpsi disebut adsorben. Adsorben pada umumnya adalah zat padat yang berongga, seperti zeolit (Agustiningtyas 2012). Dua metode adsorpsi yaitu batch dan fixed bed. Pada metode batch larutan contoh dicampurkan dan dikocok dengan bahan penyerap sampai tercapai kesetimbangan. Metode fixed bed merupakan metode adsorpsi dengan menempatkan adsorben dalam kolom sebagai lapik dan adsorbat dialirkan ke dalam kolom tersebut sebagai influen. Larutan yang keluar dari kolom merupakan sisa larutan yang tidak teradsorpsi yang disebut efluen (Agustiningtyas 2012).
Peningkatan mutu zeolit alam melalui proses aktivasi dan modifikasi dimaksudkan untuk memperbesar kemampuan zeolit baik dari segi daya katalis, adsorben, maupun pertukaran kation. Proses aktivasi zeolit alam dapat dikelompokkan ke dalam dua cara, yaitu aktivasi secara fisika dan aktivasi secara kimia (Fatimah dan Lenny 2003). Pada zeolit alam, adanya molekul air dalam pori dan oksida bebas di permukaan seperti Al2O3, SiO2, CaO, MgO, Na2O, K2O dapat
alam perlu diaktivasi terlebih dahulu sebelum digunakan. Aktivasi secara fisika dapat dilakukan dengan pemanasan pada suhu 300 - 400oC dengan udara panas atau
dengan sistem vakum untuk melepaskan molekul air. Sedangkan aktivasi secara kimia dilakukan melalui pencucian zeolit dengan larutan asam-asam organik seperti HF, HCl dan H2SO4 atau Na2EDTA untuk menghilangkan oksida-oksida pengotor
yang menutupi permukaan pori. Aktivasi dengan perlakuan asam menyebabkan terjadinya dealuminasi dan dekationasi. Aktivasi dengan HCl menyebabkan keluarnya Al dan kation-kation (Mn+) dalam kerangka menjadi Al dan kation-kation
non kerangka. Begitu pula dengan HNO3, H2SO4, dan H3PO4 juga mengalami
dealuminasi dan dekationisasi pada kerangka zeolit. Zeolit dapat terdealuminasi dengan perlakuan asam menggunakan HCl pada konsentrasi 0,1 N sampai 11 N, sedangkan asam nitrat memberikan dealuminasi terbesar pada konsentrasi 4-10 N dengan berkurangnya sebagian besar alumunium kerangka. Terjadinya proses dealuminasi akan menyebabkan bertambahnya luas permukaan zeolit karena berkurangnya logam pengotor yang menutupi pori-pori zeolit. Bertambahnya luas permukaan tersebut maka akan mengakibatkan proses penyerapan yang terjadi semakin besar (Heraldy 2003). Penelitian yang dilakukan oleh Heraldy (2003) juga menunjukkan bahwa aktivasi zeolit alam yang paling efektif sebagai adsorben logam Zn dalam limbah elektroplating adalah dengan penambahan HCl. Dimana aktivasi dengan perlakuan asam akan meningkatkan karakter rasio Si/Al, keasaman, luas permukaan, dan pengurangan sebagian komposisi logamnya. Tingkat keasaman dari suatu adsorben akan menunjukkan banyaknya H+yang terikat pada
struktur zeolit. Hasil analisis keasaaman menunjukkan bahwa pengaruh aktivasi dengan perlakuan asam akan meningkatkan keasaman dari zeolit alam. Semakin besar keasaman akan meningkatkan situs aktif dari adsorpsi. Hal ini dibuktikan dengan bertambahnya konsentrasi Zn yang teradsorpsi oleh zeolit alam aktif.
Zeolit terutama terdiri dari SiO2, Al2O3, K2O, CaO, Na2O, MnO, Fe2O3, dan
MgO. Zeolit dari Indonesia kaya akan K2O dan CaO. Sifat kimia zeolit terpenting
yang dimanfaatkan di bidang pertanian adalah sifat adsorpsi dan sifat pertukaran kation. Adsorpsi dapat diartikan sebagai suatu proses melekatnya molekul-molekul atau zat pada permukaan zat yang lain atau terkonsentrasinya berbagai substansi terlarut dalam larutan antara dua buah permukaan. Zeolit memiliki kemampuan dalam mengikat sejumlah molekul dan ion yang terdapat dalam larutan maupun gas. Adsorpsi molekul oleh zeolit dapat terjadi bila air dihilangkan dari kristal zeolit melalui pemanasan dengan suhu antara 350-4000C (Mumpton 1984). Dalam hal ini,
mungkin zeolit digunakan sebagai adsorben unsur mikro seperti Cu dan Zn dalam keperluan pembuatan pupuk lambat tersedia.
Zeolit sebagai Campuran Pupuk
Salah satu aspek penggunaan zeolit dalam bidang pertanian adalah sebagai bahan campuran pupuk, khususnya pupuk nitrogen. Hal ini berdasarkan pada selektivitas adsorpsi zeolit yang tinggi terhadap ion amonium yang mampu mengefisiensikan penggunaan pupuk kimia nitrogen sehingga penyerapan pupuk menjadi lebih efisien. Oleh karena itu zeolit dapat digunakan sebagai bahan pupuk tersedia lambat (slow release fertilizer = SRF). Penambahan zeolit pada pupuk nitrogen akan menjerap amonium yang dikeluarkan oleh pupuk. Jika konsentrasi nitrat dalam tanah menurun, amonium yang telah dijerap oleh zeolit akan dilepaskan kembali kedalam larutan tanah, dengan cara demikian N yang diberikan kedalam tanah dapat tersedia dalam waktu yang lama. Pupuk dalam bentuk, dapat mengoptimalkan penyerapan hara oleh tanaman dan mempertahankan keberadaan hara dalam tanah, karena SRF dapat mengendalikan pelepasan unsur sesuai dengan waktu dan jumlah yang dibutuhkan tanaman. Melalui cara ini, pemupukan tanaman, yang biasanya dilakukan petani tiga kali dalam satu kali musim tanam, cukup dilakukan sekali sehingga menghemat penggunaan pupuk dan tenaga kerja (Suwardi 1991). Zeolit dapat mencegah terjadinya nitrifikasi karena mineral zeolit dapat menjerap NH4+pada kisi-kisinya (diameter rongga klinoptilotit 3.9-5.4 Ao
sedangkan diameter NH4+ 1.4 Ao), sehingga bakteri nitrifikasi tidak dapat masuk
karena ukuran tubuh dari bakteri tersebut 1000 kali lebih besar dari diameter rongga zeolit (Alexander 1997).
Bahan Humat
Bahan organik tanah sering dibedakan menjadi bahan terhumifikasi dan tak terhumifikasi. Bahan-bahan tak terhumifikasi adalah senyawa-senyawa dalam tanaman dan organisme lain yang memiliki ciri khas seperti karbohidrat, asam amino, protein, lipid, asam nukleat, dan lignin. Sedangkan fraksi terhumifikasi dikenal sebagai humus ataupun bahan humat, yang dianggap sebagai hasil akhir dekomposisi bahan tanaman di dalam tanah (Tan 1993).
Istilah senyawa humat pertama kali dikemukakan oleh Berzelius pada tahun 1830. Senyawa humat merupakan senyawa makromolekul dengan berat molekul tinggi sebagai hasil peruraian bahan organik tanaman dan berperan penting dalam mempengaruhi sifat-sifat tanah dan spesies kimia dalam tanah dan perairan. Senyawa humat didefinisikan oleh Aiken et al. (1985) sebagai kategori umum dari bahan organik tanah heterogen yang terjadi secara alami. Secara umum, senyawa humat dikarakterisasikan berwarna kuning hingga hitam dengan berat molekul besar dan bersifat refraktori. Struktur kimianya tidak dapat digambarkan sebagai satu bentuk tunggal karena merupakan campuran yang kompleks dari polielektrolit fenol dan karbohidrat yang bervariasi dari satu molekul ke molekul yang lain (Hayes dan Himes 1986).
Stevenson (1982), bahan humat adalah senyawa organik hasil proses penguraian dan modifikasi sisa organisme yang berasal dari tanaman dan hewan dalam tanah. Bahan humat bersifat amorf, berwarna gelap dan tahan terhadap degradasi mikroba.
Bahan humat adalah hasil akhir dari proses dekomposisi bahan organik, merupakan fraksi yang larut dalam basa (Kononova 1966). Bahan humat merupakan bahan koloid terdispersi bersifat amorf, berwarna kuning hingga coklat kehitaman dan mempunyai berat molekul relatif tinggi (Tan 1993). Karakteristik lainnya adalah memiliki beban elektrositas yang tinggi, kapasitas tukar yang tinggi, menjadi hidrofil dan asam secara alami (Orlov 1985). Asam humat bukanlah pupuk, tetapi merupakan bagian dari pupuk. Pupuk adalah sumber hara untuk tanaman dan mikto-nutrien dari tanah ke tanaman (Sahala et al. 2006).
Senyawa humat terdiri atas kerangka karbon dengan karakter aromatis yang tinggi dan memiliki gugus-gugus fungsional yang sebagian besar mengandung atom oksigen (Manahan 2000). Karakteristik terpenting dari senyawa humat adalah kualitas dan kuantitas gugus fungsionalnya, ukuran molekulnya serta aromatisnya, karena parameter-parameter ini akan menentukan sifat-sifat kimia dan biologi senyawa humat.
Bahan humat biasanya kaya akan karbon, yang berkisar antara 41 dan 57%. bahan humat mengandung kadar oksigen yang tinggi, sedangkan kadar hidrogennya rendah serta mengandung nitrogen. Kadar oksigen sekitar 33-46% dan mengandung 2-5% N. Kemasaman total atau kapasitas tukar senyawa-senyawa humat tanah dikarenakan oleh kehadiran proton yang dapat terdisosiasi atau ion-ion H pada gugus-gugus karboksil dan alifatik dan gugus hidroksil fenolik. Bahan humat dicirikan oleh kemasaman total dan kadar karboksil yang lebih rendah daripada asam fulvat (Tan 1993).
Gugus karboksil asam humat pada umumnya lebih rendah daripada asam fulvat. Selain gugus karboksil, asam humat juga mengandung sejumlah ragam gugus hidroksil, namun untuk karakterisasi asam humat umumnya hanya tiga jenis gugus OH yang dibedakan yaitu: (1) hidroksil total adalah gugus OH yang berkaitan dengan semua gugus fungsional seperti fenol, alkohol, etanol, dan hidrokuinon. Akan tetapi, dalam banyak kasus hidroksil total mengacu hanya pada jumlah gugus OH-fenolik dan alkoholik. (2) gugus OH-fenolik adalah OH yang terikat pada lingkar benzena. (3) gugus OH-alkoholik adalah OH yang berkaitan dengan gugus alkoholik. Adapun prosedur yang paling umum untuk pemisahan asam humat dari bahan asalnya didasarkan atas kelarutannya dalam alkali dan asam. Diagram alur untuk pemisahan senyawa-senyawa humat ke dalam fraksi-fraksi humat yang berbeda terdapat pada Gambar 5 berikut.
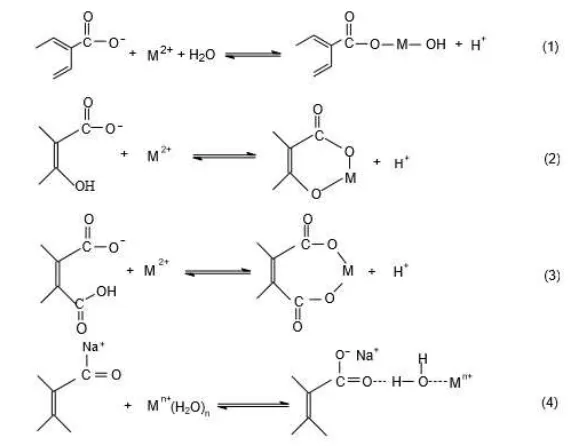
Senyawa humat memiliki kemampuan berinteraksi dengan logam. Kemampuan senyawa humat berinteraksi dengan kation logam disebabkan oleh sebagian besar gugus-gugus fungsional bahan humat mengandung atom oksigen seperti –COOH, fenolat, enolat, -OH alkoholat dan –C=O. Berdasarkan keberadaan senyawa humat yang heterogen, interaksi kation logam dengan senyawa humat terjadi pada sejumlah besar sisi aktif, dengan afinitas yang berbeda. Interaksi ion logam divalen maupun trivalen dengan asam humat atau asam fulvat dalam medium air pada pH mendekati 7, dapat berlangsung melalui pembentukan ikatan hidrogen atau jembatan air, interaksi elektrostatik atau pertukaran ion, ikatan koordinasi dan melalui struktur cincin khelat, seperti dimodelkan pada Gambar 6. Mekanisme interaksi yang terjadi dapat melalui salah satu atau lebih dari keempat model tersebut, bahkan kemungkinan melibatkan keempat model mekanisme tersebut secara simultan (Schnitzer 1986). Menurut reaksi (1), salah satu gugus –COOH bereaksi dengan ion logam membentuk suatu garam anorganik atau kompleks monodentat. Persamaan reaksi (2) menggambarkan suatu reaksi dimana satu gugus –COOH dan satu gugus –OH bereaksi secara simultan dengan ion logam membentuk kompleks bidentat atau khelat. Pada persamaan reaksi (3) dua gugus – COOH terdekat bereaksi secara simultan dengan ion logam untuk membentuk kelat bidentat. Persamaan (4) menunjukkan suatu situasi dimana ion logam terikat dengan asam fulvat melalui pengikatan elektrostatik dan juga melalui molekul air dalam bungkus hidrasi primernya lewat suatu ikatan hidrogen ke gugus C=O. Interaksi jenis ini sangat penting jika kation memiliki energi pemecahan yang tinggi, dengan demikian dapat mempertahankan bungkus hidrasi primernya.
Humus dan bahan humat merupakan komponen tanah yang sangat penting. Berdasarkan kemampuannya berinteraksi dengan logam, tak jarang bahan humat digunakan sebagai adsorben unsur mikro. Penelitian Rahmawati dan Sri (2012) berhasil mengadsorpsi logam Pb(II) sebesar 1,66x10-3 mol/g dan Cd(II) 3,83x10-3
mol/g oleh bahan humat hasil isolasi tanah gambut yang berasal dari Desa Sambutan, Kalimantan Timur.
Bahan humat dengan klei tanah berperan atas sejumlah aktivitas kimia dalam tanah yang dapat mempengaruhi pertumbuhan tanaman secara langsung maupun tidak langsung. Pengaruhnya secara tidak langsung diketahui dapat memperbaiki kesuburan tanah dengan mengubah kondisi fisik, kimia, dan biologi dalam tanah. Secara langsung, bahan-bahan humat dapat merangsang pertumbuhan tanaman melalui pengaruhnya terhadap metabolisme dan proses fisiologi lainnya. Senyawa humat dan sejenisnya dapat memperbaiki pertumbuhan tanaman secara langsung dengan mempercepat proses respirasi, dengan meningkatkan permeabilitas sel, atau melalui kegiatan hormon pertumbuhan. Senyawa humat juga berperan serta dalam pembentukan tanah dan berperan penting dalam translokasi atau metabolisme lempung, alumunium, dan besi yang menghasilkan horizon spodik dan horizon argilik (Tan 1993). Brady dan Weil (2002) menyatakan bahwa asam humat berpengaruh langsung pada pertumbuhan tanaman, diantaranya mempercepat perkecambahan benih, merangsang pertumbuhan akar, mempercepat pemanjangan sel akar, dan mempercepat pertumbuhan tunas dan akar tanaman jika diberikan dalam jumlah yang tepat. Hasil penelitian sebelumnya, bahan humat yang diaplikasikan pada tanaman padi dengan dosis 15 l/ha dapat meningkatkan produksi padi (Ihdaryanti 2011). Melalui kemampuannya tersebut diharapkan bahan humat dapat memberikan pengaruh terhadap pelepasan hara lambat tersedia pada pembuatan pupuk lambat tersedia.
Unsur Hara Mikro
Unsur hara mikro (Fe, Zn, Cu, Mo, Cl dan B) termasuk unsur hara esensial sehingga harus selalu tersedia bagi tanaman meskipun dibutuhkan oleh tanaman dalam jumlah sedikit. Karena unsur hara mikro mempunyai fungsi yang spesifik dalam pertumbuhan dan perkembangan tanaman serta fungsinya tidak dapat digantikan secara sempurna oleh unsur hara lain. Oleh karena itu untuk menjaga pertumbuhan tanaman secara normal supaya tidak mengganggu produksi dan mutu, maka dalam budidaya tanaman selain ditambahkan unsur hara makro (pupuk N, P, K) juga perlu ditambahkan unsur hara mikro, terutama pada keadaan-keadaan dimana unsur hara mikro dapat membatasi pertumbuhan tanaman.
Tembaga (Cu)
Unsur tembaga (Cu) seperti juga unsur-unsur mikro lainnya bersumber dari hasil pelapukan/pelarutan mineral-mineral yang terkandung dalam bebatuan. Alloway (1995) mengemukakan bahwa ada 10 jenis bebatuan dan 19 mineral utama yang mengandung Cu. Kandungan Cu dalam bebatuan berkisar 2-200 ppm (Adriano 1986). Unsur tembaga diserap oleh akar tanaman dalam bentuk Cu2+.
Tembaga sangat diperlukan dalam pembentukan enzim-enzim dan juga pembentukan hijau daun (klorofil). Pada umumnya tanah jarang sekali kekurangan Cu, apabila terjadi maka akan berpengaruh pada daun yaitu daun bercoreng-coreng (belang), ujung daun memutih, dan juga pada pertumbuhan tanaman menjadi tidak normal (pelayuan cepat disertai batang-batang tanaman melemah). Gejala khusus yaitu tumbuhan kerdil, ruas memendek, dan dedaunan yang berwarna kekuningan, mudah remuk dan mengeriting. Tanaman yang tumbuh pada tanah mineral dengan kadar Cu kurang dari 4 mg/kg, atau pada tanah organik dengan kadar Cu kurang dari 20 – 30 mg/kg akan mengalami kekurangan Cu. Konsentrasi Cu pada tanaman yang mengalami defisiensi bervariasi tetapi umumnya ditemukan pada konsentrasi di bawah 2 – 3 mg/kg bahan kering (Stevenson dan Cole 1999). Pemupukan Cu pada umumnya berkisar antara 2 – 7 kg/ha/th.
Seng (Zn)
Seng (Zn) merupakan unsur mikro esensial bagi manusia, hewan, dan tumbuh-tumbuhan tingkat tingkat tinggi. Kandungan Zn total rataan pada litosfir sekitar 80 mg/kg. Mineral-mineral sebagai sumber utama yang kaya Zn dalam tanah adalah sphalerite dan wurtzite (ZnS), dan sumber yang sangat kecil dari mineral-mineral smithsonites (ZnCO3), willemite (Zn2SiO4), zincite (ZnO), zinkosite
(ZnSO4), franklinite (ZnFe2O4), dan hopeite (Zn3(PO4)2.4H2O (Lindsay 1972).
Pada batuan magnetik Zn terdistribusi merata, dan kandungannya berbeda pada batuan asam dan basik yaitu dari 40 mg/kg dalam batuan granit dan 100 mg/kg dalam batuan basaltik. Pelarutan mineral-mineral tersebut dapat terjadi secara alami sehingga unsur-unsur yang terkandung di dalamnya terbebas dalam bentuk ion. Ion Zn2+ yang terbebas mengalami proses lebih lanjut, terkait dengan matriks tanah atau
larut, serta dalam bentuk mineral primer (Alloway 1995). Endapan Zn dapat terbentuk dengan senyawa-senyawa hidroksida, karbonat, fosfat, sulfide, molibdat, dan asam-asam organik yang terdiri dari humat, fulvat, dan ligand organik. Asam-asam organik berasal dari dekomposisi senyawa-senyawa organik yang terdapat dalam bahan organik. Adsorpsi Zn2+ yang kuat dalam tanah dapat terjadi dengan
adanya bagan organik dan mineral liat, dan hal ini berhubungan dengan kapasitas kation tanah dan keasaman tanah (Warneke and Stanley 1973).
Dalam keadaan yang sedikit Zn sudah cukup untuk tanaman dan apabila kelebihan dapat menjadi racun bagi tanaman. Kekurangan Zn terjadi pada tanah-tanah yang asam sampai sedikit netral. Defisiensi Zn dapat menyebabkan pertumbuhan vegetatif terhambat selain juga dapat menghambat pertumbuhan biji. Keracunaan Zn menyebabkan berkurangnya pertumbuhan akar tanaman dan pelebaran daun diikuti klorosis atau bercak-bercak. Kadar Zn yang tinggi menekan serapan P dan Fe oleh tanaman. Di dalam tanah, seng terdapat dalam bentuk terlarut, dapat dipertukarkan dan kompleks yang segera tersedia bagi tanaman. Kadar Zn dalam tanah bervariasi dari 10 – 300 ppm dengan titik kritis bagi tanaman antara 15 – 20 ppm.
Adsorpsi Isotermal
Adsorpsi adalah proses akumulasi suatu zat dipermukaan. Dalam prosesnya adsorpsi yang terjadi pada kondisi suhu konstan. Adsorpsi yang terjadi harus dalam keadaan setimbang, yaitu laju adsorpsi dan desorpsi berlangsung relatif sama. Ilustrasi proses adsorpsi terlihat pada Gambar 7.
Dalam menentukan persamaan yang digunakan, harus terlebih dahulu mengetahui pola yang dihasilkan terhadap jenis konsentrasinya. Berikut adalah pola jenis adsorbsi yang dilakukan oleh adsorben disajikan pada Gambar 8. Terdapat beberapa jenis persamaan yang sering digunakan dalam menentukan kapasitas adsorpsi zeolit.
Gambar 8 Pola berbagai jenis adsorpsi Persamaan Langmuir
Pada tahun 1918, Langmuir menurunkan teori isoterm adsorpsi dengan menggunakan model sederhana berupa padatan yang mengadsorpsi gas pada permukaannya. Model ini mendefinisikan bahwa kapasitas adsorpsi maksimum terjadi akibat adanya lapisan tunggal (monolayer) jenuh dari adsorbat pada dinding adsorben.
Gambar 9 Ilustrasi adsorpsi pada persamaan Langmuir Persamaan Langmuir ditulis sebagai berikut
Langmuir :q = qe K Ce
1+K Ce
Bentuk Linear : Ce
q = 1 K qe+
1 qeC
Dimana (q) merupakan jumlah kapasitas adsorpsi, (Ce) Konsentrasi larutan
saat setimbang. (qe) jumlah kapasitas adsorpsi saat setimbang yang dihasilkan
secara matematis dan (K) merupakan konstanta keseimbangan larutan dimana kapasitas adsorpsi berbanding lurus dengan kemampuan desorpsinya.
Persamaan Freundlich
Menurut Metcalf (2003), model jerapan Freundlich menggunakan asumsi bahwa jerapan berjalan secara fisika (tergantung pada jenis adsorben dan suhu). Freundlich menyebutkan, jika y adalah berat zat terlarut per gram adsorben (q) dan (c) adalah konsentrasi zat terlarut dalam larutan. Dari konsep tersebut dapat diturunkan persamaan sebagai berikut :
Adsorben
Freundlich :q = K Ce1n
Bentuk Linear : log q = log K +1n log C
Dari persamaan linear dapat dibuat kurva linear jerapan isoterm freundlich yang dapat diketahui nilai konstanta Freundlich dengan pendekatan dan plot nilai log (q) merupakan log dari jumlah kapasitas adsorbsi, (Ce) Konsentrasi larutan saat
setimbang. dengan log (Ce) sehingga akan didapatkan kemiringan 1/n dan intercept log (K).
Persamaan BET (Brunauer–Emmett–Teller)
Model adsorpsi isoterm BET menggunakan asumsi bahwa terdapat pengaruh dalam jenis adsorben dan bentuk yang dihasilkan dalam serapan tidak hanya satu layer melainkan banyak. Dalam penentuannya dapat diketahui jumlah yang terjerap pada monolayer.
Gambar 10 Ilustrasi adsorpsi pada persamaan BET
Secara umum persamaan BET ditulis sebagai berikut
BET : q q = 1−Ce K
Dimana (q) merupakan jumlah kapasitas adsorbsi, (Cs) Konsentrasi larutan yang digunakan dan ditambahkan kedalam adsorben, (Ce) Konsentrasi larutan saat setimbang. Nilai (K) merupakan konstanta BET dan (qmono) merupakan jumlah adsorben yang terjerap pada monolayer. Persaamaan ini digunakan karena jerapan antar logam sangat kompleks dan tidak hanya membentuk satu layer saja, sehingga persamaan ini lebih tepat digunakan untuk mendapatkan jerapan pada lapisan pertama.
Pupuk Lambat Tersedia
Penundaan ini dapat dilakukan dengan beberapa cara, seperti mengendalikan kelarutan bahan di dalam air (melalui pelapisan semipermeabel, oklusi, bahan protein, polimer, atau dalam bentuk senyawa kimia lainnya), hidrolisis lambat, dan sebagainya (UNIDO dan IFDC 1998). Beberapa istilah yang berkaitan dengan pupuk lambat tersedia diantaranya yaitu:
1. Coated Slow-Release Fertilizer
Pupuk merupakan sumber hara larut air yang pelepasannya dalam tanah terkendali melalui pelapisan pupuk.
2. Polymer-coated Fertilizer
Partikel pupuk dilapisi dengan resin polimer (plastik), sehingga menjadi sumber hara lambat tersedia.
3. Controlled-release fertilizer
Pupuk yang memiliki satu atau lebih unsur yang memiliki kelarutan yang terbatas di dalam larutan tanah, sehingga menjadi tersedia selama masa pertumbuhan tanaman dalam periode yang terkendali.
4. Nitrogen stabilizer
Bahan ditambahkan ke dalam pupuk untuk memperlama waktu komponen nitrogen dalam pupuk tetap berada di tanah dalam bentuk amoniak.
5. Nitrification inhibitor
Bahan kimia kompleks yang mampu membunuh atau sementara mereduksi aktivitas bakteri tanah Nitrosomonas yang berperan dalam mengubah N-NH4 dalam proses nitrifikasi. Efek ini mirip seperti pupuk lambat tersedia. Penghambat nitrifikasi ditambahkan ke dalam produk nitrogen sebelum aplikasi.
6. Urease inhibitor
Bahan kimia kompleks yang memberikan efek sementara mencegah aktivitas enzim urease dalam tanah.
Akan tetapi, pupuk cepat tersedia mudah hilang karena penguapan atau terbawa aliran permukaan. Walaupun pupuk lambat tersedia lebih mahal, tetapi pemupukan jarang dilakukan sehingga dapat menghemat biaya tenaga kerja. Adapun sumber pupuk lambat tersedia yang dapat digunakan diantaranya yaitu bahan organik (pupuk kandang, dsb), urea metilena, urea dilapisi sulfur, atau polymer-coated urea isobutylidene diurea.
Troeh dan Thompson (2005) menggolongkan pupuk lambat tersedia ke dalam tiga tipe, yaitu: 1. Pupuk mineral dengan kelarutan rendah, seperti beberapa senyawa fosfor. 2. Pupuk nitrogen organik yang terdekomposisi secara perlahan, seperti urea formaldehida. 3. Pupuk granul yang ditutup dengan lapisan pelindung, seperti sulfur coated urea.
3 METODE
Waktu dan Tempat
Penelitian ini akan dilaksanakan pada bulan Agustus 2015 sampai dengan Januari 2016 di Laboratorium Sumberdaya Fisik Lahan, Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor.
Bahan dan Alat
Bahan yang akan digunakan dalam penelitian ini terdiri atas: (1) zeolit, berasal dari lokasi deposit yang berbeda yaitu zeolit Lampung (ZA) , zeolit Bayah (ZB), dan zeolit Tasikmalaya (ZC), (2) bahan humat hasil ekstrak batu bara, (3) bahan kimia sumber hara mikro Cu dan Zn, (4) filler dan (5) tanah Latosol untuk uji perkolasi. Alat yang digunakan Atomic absorption spectrofotometer (AAS), Scanning Electron Microscope (SEM), X-Ray Diffractrometer (XRD), perkolator, granulator dan mikroburet untuk analisis kualitatif.
Tahapan Penelitian Analisis Pendahuluan
Karakterisasi Mineral Zeolit
Parameter karakterisasi zeolit yang dianalisis meliputi:
Tabel 3 Karakterisasi fisik dan kimia zeolit alam Lampung, Bayah, dan Tasikmalaya
Karakterisasi Bahan Humat
Karakterisasi bahan humat yang akan dianalisis seperti pada Tabel 4: Tabel 4 Karakterisasi bahan humat
Selain itu, dilakukan pula analisis kadar Cu pada garam CuSO4.5H2O, dan Zn
pada garam ZnSO4.7H2O sebelum formulasi. Analisis sifat kimia tanah yang
digunakan untuk uji perkolasi meliputi analisis pH, kadar air, kapasitas tukar kation (KTK), kejenuhan basa (KB), kadar Cu, dan kadar Zn.
Karakteristik Adsorpsi Zeolit terhadap Bahan Humat dan Unsur Mikro Percobaan ini dilakukan untuk mengetahui kemampuan maksimum zeolit dalam mengadsorb bahan humat dan unsur hara mikro sehingga akan diperoleh informasi/data sebagai acuan jumlah optimum untuk diformulasikan sebagai SRF. Tahap ini dilakukan melalui serangkaian eksperimen yaitu adsorpsi zeolit terhadap bahan humat, dan adsorpsi zeolit terhadap unsur hara mikro.
Karakteristik Adsorpsi Zeolit terhadap Bahan Humat
Adsorpsi zeolit terhadap bahan humat dilakukan dengan metode gravimetri, yaitu humat yang teradsorp ditentukan dari kehilangan bobot. pada tahap ini zeolit 100 mesh sebanyak 10 gram diinkubasi dengan bahan humat dosis 0.5, 1, 5, dan 10 ml (masing-masing dosis humat diencerkan menjadi 100 ml) selama 24 jam. Kocok campuran zeolit dan bahan humat tersebut, kemudian dimasukkan ke dalam sentrifuse dengan kecepatan 2500 rpm selama 30 menit, oven selama 24 jam. Hasilnya dilakukan pemisahan antara padatan dan larutan. Lakukan analisis bahan humat yang tersisa. Kadar bahan
Karakteristik Fisik Satuan Metode/Alat Ukur
humat yang teradsorp sama dengan kadar bahan humat sebelum adsorpsi dikurangi kadar bahan humat setelah adsorpsi.
Karakteristik Adsorpsi Zeolit terhadap Unsur Hara Mikro (Cu dan Zn) Adsorpsi zeolit terhadap unsur hara mikro dilakukan dengan metode batch yaitu menjenuhi 0.02 gram zeolit dengan larutan Cu dan Zn masing-masing sebanyak 20 ml. Konsentrasi larutan yang digunakan ialah 20 ppm, 40 ppm, 60 ppm, 80 ppm, dan 100 ppm larutan Cu dan Zn dengan waktu pengocokan 45 menit. Setelah dikocok, saring ekstrak tersebut di gelas penampung dengan menggunakan kertas saring Whatmann No.42.
Analisis Data
Analisis data dilakukan dengan menggunakan persamaan isotherm Langmuir, Freudlich dan BET (Brunauer–Emmett–Teller). Data sebelumnya yang terukur AAS dihitung terlebih dahulu konsentrasi larutan saat setimbang (Ce) untuk selanjutnya mengetahui kapasitas adsorpsinya (q) dalam milligram ion per gram adsorben.
Ce (mg g-1) = [Ci]− [C ]
w
x v
Dimana Ci adalah konsentrasi ion awal (ppm), Cf adalah konsentrasi ion setelah adsorpsi (ppm), V volume larutan (L), dan w jumlah zeolit (g). Data hasil adsorpsi kemudian dianalisis dengan persamaan model yang paling sering digunakan yaitu teori keseimbangan isotherm Langmuir (untuk variabel konsentrasi), persamaan
Persamaan Langmuir :
q =
q a .KC1+K.C
Bentuk linear Langmuir : 1q
=
q a1+
q a .K.C1Dimana (q) jumlah adsorbat yang terserap per unit masa adsorban, qsat,qmax jumlah adsorbat maksimum teoritis dan K konstanta, t adalah waktu.
Freundlich : q = K Ce1
Bentuk Linear : log q = log K +n1 log C
Dari persamaan linear dapat dibuat kurva linear jerapan isoterm freundlich yang dapat diketahui nilai konstanta Freundlich dengan pendekatan dan plot nilai log (q) dengan log (Ce) sehingga akan didapatkan kemiringan 1/n dan intercept log (K).
Secara umum persamaan BET ditulis sebagai berikut
BET :q q = 1−Ce K
setimbang. Nilai (K) merupakan konstanta BET dan (qmono) merupakan jumlah adsorben yang terjerap pada monolayer.
Formulasi Pupuk Lambat Tersedia dan Analisis Sifat Fisik Zeolit
Proses pembuatan pupuk dilakukan dengan metode blending yaitu mencampurkan seluruh bahan SRF dengan cara mengaduk bahan-bahan tersebut hingga tercampur rata. Formulasi SRF terdiri atas 2 formulasi utama. Pertama SRF dari bahan zeolit dan unsur hara mikro Cu dan Zn. Sebanyak 399.97 gram ZA, ZB dan ZC masing-masing dicampur 20 ppm CuSO4.5H2O, ZnSO4.7H2O 10 ppm, dan
filler untuk menghasilkan 500 g SRF. Kedua, SRF yang terdiri atas bahan zeolit, bahan humat, dan unsur hara mikro Cu dan Zn. Zeolit A, B dan C masing-masing sebanyak 349.80 g dicampur dengan 50 ml humat pekat diaduk sedikit demi sedikit, kemudian ditambahkan bahan sumber unsur CuSO4.5H2O konsentrasi 20 ppm,
ZnSO4.7H2O 10 ppm, dan filler untuk menjadi 500 gram SRF. Hasil blending berupa pasta yang selanjutnya digranulasi dengan alat granulator (skala kecil/laboratorium). Kemudian dikeringkan dengan dryer dan oven.
Formulasi SRF menghasilkan 6 jenis pupuk dari hasil kombinasi perlakuan seperti pada Gambar 11. Keenam SRF tersebut disebut P1, P2, P3, P4, P5, P6 yang akan dilakukan pengujian lanjut dengan tiga kali ulangan. Proses pembuatan pupuk lebih singkat dijelaskan melalui diagram alir pada Lampiran 1.
Pupuk yang telah dihasilkan selanjutnya dianalisis sifat-sifat fisiknya untuk melihat adakah perubahan yang terjadi setelah zeolit diformulasikan. Sifat-sifat yang dianalisis meliputi: analisis morfologi menggunakan SEM, perubahan intensitas puncak difraksi zeolit menggunakan XRD.
Pengujian Kelarutan/Ekstraksi dan Pencucian Unsur Cu dan Zn dari SRF Percobaan ini bertujuan untuk mengetahui pelepasan Cu2+ dan Zn2+ yang
terdapat dalam pupuk.
Pengujian Pelarutan/Ekstraksi SRF
Percobaan untuk menguji kelarutan/ekstraksi pupuk dilakukan dengan pengocokan dari dua pengekstrak. 1) pengocokan dengan pengekstrak akuades dan 2) pengocokan dengan pengekstrak DTPA selama 2 jam. Kecepatan pengocokan 2500 rpm. Setelah dikocok saring dengan kertas saring Whatman No.42 kemudian lakukan analisis kadar hara terlarut.
Ket:
Pengujian Pencucian SRF dengan Metode Perkolasi
Gambar 12 menunjukkan uji pencucian/pelepasan hara dengan metode perkolasi.
Perkolasi adalah peristiwa bergeraknya air di dalam penampang tanah ke lapisan tanah yang lebih dalam. Peristiwa tersebut berlangsung secara gravitasi, dalam serangkaian masuknya air hujan atau pemberian air irigasi melalui permukaan tanah (infiltrasi) ke dalam tanah, dan bergeraknya air di dalam penampang tanah (permeabilitas). Istilah perkolasi juga biasa disebut kehilangan air. Kadang-kadang perkolasi juga digunakan untuk menunjukkan perkolasi di bawah zona perakaran tanaman yang normal.
Bahan yang digunakan ialah air, tanah Latosol kering udara lolos ayakan 2 mm, pupuk yang akan diuji, glass wool, pasir, dan selang plastik. Sedangkan alat yang digunakan untuk perkolasi ini yaitu percolation rate apparatus, sprayer, gelas ukur, dan penampung air.
Prosedur yang dilakukan pada metode perkolasi ini, terlebih dahulu masukkan sedikit glass wool ke dalam tabung perkolasi berdiameter 50.8 mm sampai ke dasar gelas tabung tersebut. Masukkan pasir kasar berdiameter 12 mm ke dalam tabung gelas. Selanjutnya masukkan contoh tanah kering udara dan pupuk menggunakan corong sampai setinggi 99 mm dari permukaan pasir. Sebelum contoh tanah dan pupuk percobaan dimasukkan ke dalam tabung, tanah dan pupuk diaduk dahulu. Ketuk-ketuk tabung gelas 10 kali sampai permukaan tanah turun 9 mm, sehingga panjang kolom tanah dan pupuk dalam tabung menjadi 90 mm atau 9 cm. Masukkan pasir kasar berdiameter 6 mm, sehingga pasir tersebut menumpang di atas tanah. Tempatkan tabung perkolasi tersebut, kemudian tempatkan penampung air di bawah tabung gelas. Hubungkan alat penampung air dengan menggunakan selang plastik ke setiap tabung. Sebelum pengukuran, air harus sudah dialirkan ke alat dengan kecepatan aliran sebesar 940 ml/minggu. Pengukuran dilakukan setiap minggu dengan menganalisis perkloratnya. Uji pencucian/pelepasan hara melalui perkolasi dilakukan selama satu bulan, dalam
setiap minggunya dilakukan penyiraman dengan akuades setara nilai curah hujan rata-rata per minggu. Kemudian dilakukan pengukuran hara terlarut.
4 HASIL DAN PEMBAHASAN
Analisis Pendahuluan Karakteristik Mineral Zeolit
Hasil analisis terhadap karakteristik zeolit alam Lampung, Bayah dan Tasikmalaya meliputi karakteristik fisik dan kimia. Analisis sifat-sifat zeolit tersebut dilakukan untuk melihatsifat/kondisi awal zeolit sebelum diformulasikan serta mengetahui perbedaan sifat antara ketiga zeolit yang digunakan. Hasil analisis SEM menunjukkan struktur dan morfologi kristal zeolit. Gambar 13 terlihat adanya perbedaan struktur kristal dari ketiga zeolit alam. Struktur ketiga zeolit alam termasuk kedalam bentuk seperti lembaran (sheet-like structure), tetapi zeolit Lampung termasuk sheet-like structure dengan bentuk tabular sedangkan zeolit Bayah dan Tasikmalaya berbentuk platy. Hasil SEM ini menunjukkan kristal yang terbentuk perlu dilakukan pemurnian untuk mendapatkan kristal zeolit yang lebih baik dan homogen. Hasil tersebut diperkuat dengan hasil analisis sifat fisik lainnya yaitu XRD. Hasil analisis XRD menunjukkan intensitas kristal yang terbentuk disajikan pada Lampiran 3d. Hasil analisis ini penting diketahui untuk menentukan jenis zeolit. Perbedaan jenis zeolit menentukan kation utama yang dipertukarkan yang terdapat dalam zeolit tersebut. Hal ini bertujuan agar penggunaannya dilakukan dengan tepat. Eddy (2000) menyatakan jenis kation yang berbeda dalam mineral zeolit yang sama akan memberikan sifat fisika dan kimia yang berbeda dan yang pada akhirnya akan berpengaruh terhadap penggunaannya. Sebagai contoh bila kation utama yang dapat dipertukarkan dalam zeolit adalah jenis Na, maka zeolit ini akan bersifat racun terhadap tanaman. Zeolit dari jenis yang miskin K dan Ca bila digunakan dalam tanah yang kekurangan hara tersebut akan menghambat pertumbuhan tanaman karena K+ dan Ca2+ yang terkandung dalam tanah akan
diserap. Lampiran 4 menunjukkan pola puncak difraktogram dari ketiga zeolit alam yang berbeda pada sudut difraksi 2θ. Zeolit Lampung merupakan jenis mineral
klinoptilolit, zeolit Bayah dan Tasikmalaya termasuk jenis mineral mordenit. Hasil tersebut sesuai dengan penelitian terdahulu yang menyatakan zeolit Bayah yang merupakan mordenit tuff, hasil proses diagenesis dari gelas, terdiri dari mordenit (Na,Ca)4Al8Si40O96.28H2O, erionit (K2Na2CaMg)4Al8Si28O73.28H2O, klinoptilolit
(K2Na2Ca)3Al6Si30O72.21H2O, kwarsa (SiO2), kalium feldspar (KAlSi3O8) dan
komponen gelas vulkanik (Purawiardi 1999). Pada zeolit Lampung terlihat tiga puncak yang dihasilkan, yaitu pada nilai 2θ = 9.794o, 22.727o,dan 30.031o dengan
score tertinggi 60 yaitu klinoptilolit-Ca (Lampiran 3a). Zeolit Bayah memiliki tiga puncak pada nilai 2θ = 22.237o, 25.560o,dan 28.039o denganscore tertinggi 37 yaitu
23
Gambar 13 Foto kristal yang terbentuk menggunakan SEM. Zeolit Lampung (a), Zeolit Bayah(b) dan Zeolit Tasikmalaya (c) dengan perbesaran 10.000x. Zeolit Lampung (d), zeolit Bayah (e) dan zeolit Tasikmalaya (f) dengan perbesaran 20.000x
Lembaran (platy) Tabular
Puncak difraksi zeolit Tasikmalaya pada nilai 2θ yaitu 22.291o, 25.668o,dan
27.756o denganscore tertinggi 58 yaitu mordenit (Lampiran 3c). Hasil tersebut
diperkuat oleh penelitian sebelumnya yang menyatakan bahwa zeolit Lampung mempunyai 3 peak terkuat pada nilai 2θ = 27.9583o, 22.3963o, and 9.8631o. Berdasarkan data perpustakaan ICDD 47-1870 peak terkuat tersebut mengindikasikan bahwa mineral yang terkandung mendekati/diprediksi sebagai klinoptilolit. Sedangkan zeolit bayah memiliki tiga peak terkuat berada pada nilai 2θ of 25.6897o, 27.3619o and 26.6704o . Nilai tersebut diasumsikan bahwa zeolit
bayah termasuk ke dalam grup mordenit (Razzak et al. 2013).
Hasil XRD sejalan dengan hasil SEM yaitu bentuk kristal dan jenis mineral zeolit Lampung berbeda dengan Zeolit Bayah dan Tasikmalaya. Hasil tersebut juga sesuai dengan literatur yang menyatakan zeolit pada dasarnya memiliki tiga variasi struktur yang berbeda yaitu: a) struktur seperti rantai (chain-like structure), dengan bentuk kristal acicular dan prismatic, contoh: natrolit, b) struktur seperti lembaran (sheet-like structure), dengan bentuk kristal platy atau tabular biasanya dengan basal cleavage baik, contoh: heulandit, c) struktur rangka, dimana kristal yang ada memiliki dimensi yang hampir sama, contoh: kabasit (Sapoetra 2006).
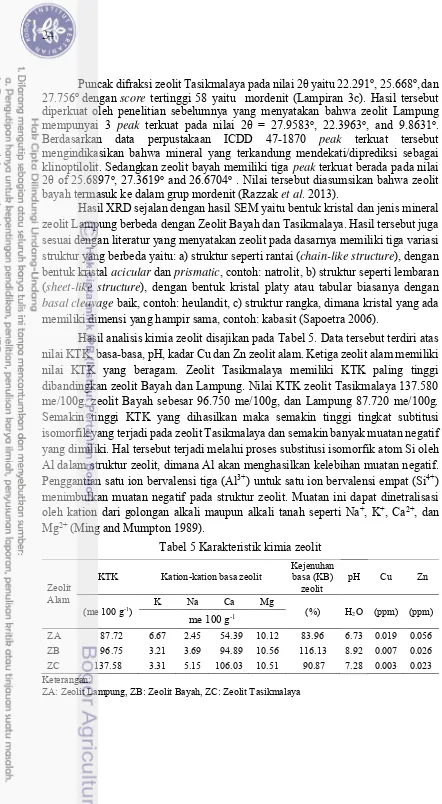
Hasil analisis kimia zeolit disajikan pada Tabel 5. Data tersebut terdiri atas nilai KTK, basa-basa, pH, kadar Cu dan Zn zeolit alam. Ketiga zeolit alam memiliki nilai KTK yang beragam. Zeolit Tasikmalaya memiliki KTK paling tinggi dibandingkan zeolit Bayah dan Lampung. Nilai KTK zeolit Tasikmalaya 137.580 me/100g, zeolit Bayah sebesar 96.750 me/100g, dan Lampung 87.720 me/100g. Semakin tinggi KTK yang dihasilkan maka semakin tinggi tingkat subtitusi isomorfik yang terjadi pada zeolit Tasikmalaya dan semakin banyak muatan negatif yang dimiliki. Hal tersebut terjadi melalui proses substitusi isomorfik atom Si oleh Al dalam struktur zeolit, dimana Al akan menghasilkan kelebihan muatan negatif. Penggantian satu ion bervalensi tiga (Al3+) untuk satu ion bervalensi empat (Si4+)
menimbulkan muatan negatif pada struktur zeolit. Muatan ini dapat dinetralisasi oleh kation dari golongan alkali maupun alkali tanah seperti Na+, K+, Ca2+, dan
Mg2+ (Ming and Mumpton 1989).
Tabel 5 Karakteristik kimia zeolit
Zeolit Alam
KTK Kation-kation basa zeolit Kejenuhan basa (KB)
zeolit pH Cu Zn
Zeolit Bayah dan Tasikmalaya memiliki KTK lebih tinggi dibandingkan dengan zeolit lampung mungkin dipengaruhi oleh jenis mineral zeolit tersebut. Zeolit mordenit (ZB dan ZC) memiliki KTK lebih tinggi dibandingkan zeolit klinoptilolit (ZA). Sebagaimana hasil XRD diatas zeolit Bayah dan Tasikmalaya merupakan zeolit jenis mordenit yang pada umumnya memiliki KTK lebih besar dibandingkan zeolit klinoptilolit (Lampung). Menurut Kismolo et al. (2012), Las dan Husen (2002) faktor jenis mineral zeolit dapat memengaruhi nilai KTK, dimana nilai KTK zeolit jenis klinoptilolit pada umumnya antara 150-200 me 100 g-1 dan
jenis mordenit antara 229-279 me 100 g-1.
Selain itu, zeolit Tasikmalaya dan Bayah juga cenderung lebih banyak mempertukarkan kation Cadibandingkan dengan kation lainnya (K, Nadan Mg). Hal ini karena zeolit Tasikmalaya dan Bayah merupakan jenis zeolit mordenit. Zeolit yang termasuk pada jenis mineral mordenit memiliki persentase Ca lebih besar, sehingga memungkinkan kation Ca pada zeolit Tasikmalaya dan Bayah lebih banyak dipertukarkan dilarutan kontak. Pada zeolit Tasikmalaya yang terutama terdapat mineral modernit exchange-Ca cenderung tinggi sebagaimana tertera pada hasil analisis XRD. Zeolit Bayah memiliki kejenuhan basa (KB) lebih tinggi (116.13%) dibandingkan dengan zeolit Tasikmalaya (90.87%) dan Lampung (83.96%). KB merupakan persentase jumlah kation-kation alkali/ basa yang terkandung dalam zeolit berbanding kapasitas tukar kation zeolit tersebut. Kejenuhan basa yang meningkat disebabkan oleh kecenderungan meningkatnya kation yang dapat dipertukarkan seperti Ca-dd, Mg-dd, K-dd, Na-dd. Pada penelitian ini peningkatan kejenuhan basa diduga disebabkan oleh zeolit yang digunakan merupakan zeolit penyumpang Ca-dd, terutama zeolit tipe mordenit seperti zeolit Bayah dan Tasikmalaya yang kaya akan kandungan Ca. Faktor lain yang memengaruhi besar kecilnya nilai kejenuhan basa pada zeolit alam yaitu pada tingkat kemurniannya. Zeolit memiliki tingkat kemurnian yang rendah ketika masih terdapat pengotor, berupa mineral lain. Mineral lain yang terkandung dalam zeolit diantaranya heulandite, Albite, dan Cristobalite. Menurut Ginting et al. (2007) umumnya pembentukan zeolit alam di lingkungan bersifat alkali, sehingga diduga mineral tersebut bersifat basa yang mungkin dapat meningkatkan nilai kejenuhan basa zeolit alam. Asosiasi dengan mineral-mineral tersebut dipengaruhi oleh kondisi lingkungan pembentuknya.
Presentase kejenuhan basa ini juga berbanding lurus dengan pH dari ketiga zeolit alam. Sesuai dengan pernyataan Soepardi (1983), persentase kation basa dan pH terdapat korelasi yang nyata. Secara umum jika nilai kadar basa tinggi maka pH nya juga tinggi. Hal ini karena kejenuhan basa mencerminkan perbandingan kation basa dengan kation masam (H, Al dan Fe). Jika semakin besar konsentrasi kation basa maka konsentrasi kation masam semakin rendah atau pH-nya semakin tinggi.
*Sumber: Hasil analisis Febrianti (2016)
Kadar Cu dan Zn pada bahan humat berturut-turut 10.19 ppm dan 16.22 ppm. Kadar Cu dalam CuSO4.5H2O dan Zn pada ZnSO4.7H2O dengan pengekstrak
HCl 25% lebih besar dibandingkan pengekstrak akuades. Hal ini tentu karena kelarutan menggunakan HCl 25% lebih besar dibandingkan akuades.
Adsorpsi Zeolit terhadap Bahan Humat dan Unsur Hara Mikro Kemampuan Adsorpsi Zeolit terhadap Bahan Humat
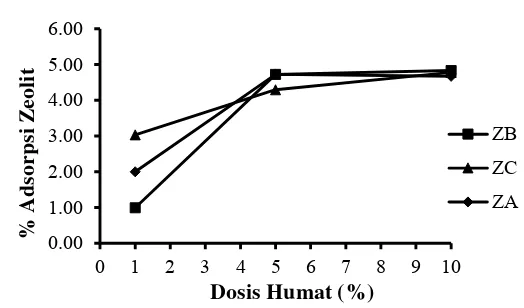
Pada penelitian ini dilakukan analisis adsorpsi zeolit terhadap bahan humat untuk mengetahui terlebih dahulu besarnya kemampuan zeolit menjerap bahan humat sebelum digunakan sebagai carrier bahan humat dalam pembuatan slow release fertilizer. Kemampuan zeolit alam menjerap bahan humat pada berbagai dosis disajikan pada Tabel 8. Hasil analisis menunjukkan bahwa daya jerap ketiga zeolit alam cenderung meningkat seiring peningkatan jumlah bahan humat (ml) per 10 gram zeolit. Peningkatan terjadi saat jumlah bahan humat meningkat dari 1 ml/10 g zeolit menjadi 5 ml/10 gram zeolit, kemudian sedikit meningkat ketika penambahan bahan humat meningkat 10 ml/10 gram zeolit. Hal ini berarti, kemampuan adsorpsi optimum ketiga zeolit terhadap bahan humat yaitu pada jumlah 5 ml bahan humat/10 gram zeolit (Gambar 14). Ketiga zeolit alam ini tidak menunjukkan perbedaan kemampuan adsorpsi yang nyata terhadap bahan humat. Hal ini dapat dipengaruhi karena ketiga zeolit alam memiliki afinitas yang sangat kecil dalam menjerap bahan humat. Wang et al. (2008) menyatakan zeolit alam memiliki afinitas yang sangat kecil terhadap bahan humat karena interaksi dipol antara zeolit alam lebih kuat dengan air.
Tabel 8 Adsorpsi zeolit terhadap bahan humat
Keterangan:
ZA: Zeolit Lampung, ZB: Zeolit Bayah, ZC: Zeolit Tasikmalaya
Pengekstrak Kadar Cu (ppm) pada Kadar Zn (ppm) pada CuSO4.5H2O ZnSO4.7H2O
Tabel 6 Kadar unsur mikro Cu dan Zn dalam pupuk
Pada proses penjerapan ini dipengaruhi oleh muatan baik dari adsorben maupun adsorbat. Pada saat bahan humat bergabung dengan zeolit yang memiliki pH cenderung tinggi ( Tabel 5), maka akan berpengaruh terhadap disosiasi gugus yang bersifat asam pada bahan humat. Disosiasi proton dari gugus fungsional yang bersifat asam tersebut melemahkan ikatan hidrogen dan meningkatkan muatan gugus fungsional bahan humat tersebut. Swift (1989) dalam Alimin et al.(2005) menyatakan bahwa deprotonasi gugus-gugus fungsional bahan humat akan menurunkan kemampuan pembentukan ikatan hydrogen baik antar molekul maupun sesama molekul dan meningkatkan jumlah muatan negatif gugus fungsional bahan humat, sehingga akan meningkatkan gaya tolak menolak antar gugus dalam molekul bahan humat. Pada kondisi ini permukaan partikel-partikel koloid bahan humat akan bermuatan negatif sehingga sulit berikatan dengan zeolit yg bermuatan negatif permanen. Zhang et al (2010) menyatakan pada dasarnya zeolit alam memiliki afinitas rendah terhadap bahan humat, kemampuan adsorpsi bahan humat lebih efektif oleh zeolit termodifikasi (42.5 mg/g). Pada penelitian ini diduga adsorpsi zeolit terhadap bahan humat terjadi secara fisik. Partikel bahan humat masuk pada rongga zeolit atau sekedar menempel pada permukaan zeolit sehingga memungkinkan kekuatan/energi ikatannya lemah. Hal tersebut menyebabkan daya adsorpsi zeolit terhadap bahan humat juga terhitung rendah.
Kemampuan Adsorpsi Zeolit terhadap Unsur Hara Mikro
Besaran nilai jerapan zeolit terhadap Cu (II) dan Zn (II) pada berbagai konsentrasi dianalisis lebih lanjut dengan beberapa model isotherm. Model isothermal adsorpsi digunakan untuk mengetahui interaksi antara larutan dengan adsorben. Model ini juga menunjukkan kemampuan optimum yang dapat dicapai oleh adsorben. Model isoterm merupakan parameter yang sangat penting dalam adsorpsi karena ikut berperan dalam menentukan kondisi maksimum untuk menghasilkan adsorpsi yang optimal. Isoterm adsorpsi dapat dikaji dengan beberapa persamaa yang ada untuk mengetahui model adsorpsi isoterm yang sesuai. Pada penelitian digunakan tiga model isothermal adsorpsi yang umum digunakan yaitu persamaan Langmuir, Freundlich dan BET. Isoterm Langmuir berdasar bahwa permukaan adsorben mempunyai permukaan yang homogen (Chunfeng 2009). Menurut Sembodo-Bregas (2005) asumsi yang digunakan pada persamaan Langmuir adalah