ABSTRAK
HAIRUL ANWAR. Pola Sidik Jari Kromatogram KLT untuk Identifikasi
Keragaman Kualitas Jahe Merah. Dibimbing oleh MARIA BINTANG dan EDY
DJAUHARI PK
1
PENDAHULUAN
Bangsa Indonesia kaya akan
keanekaragaman obat tradisional. Lebih dari 30.000 spesies tanaman di Indonesia dan 940 spesies di antaranya diketahui berkhasiat sebagai obat atau digunakan sebagai bahan obat (Paimin & Murhananto 1999). Setiap tanaman obat memiliki khasiat yang berbeda-beda dan bergantung pada komponen kimia yang terkandung dalam tanaman obat tersebut. Kuantitas dan mutu komponen kimia yang terkandung dalam tanaman obat sangat dipengaruhi oleh beberapa faktor, yaitu letak geografis (lokasi), waktu tanam, waktu panen, iklim, dan curah hujan (Liang et al. 2004). Jahe (Zingiber officinale Rosc) merupakan salah satu tanaman obat yang sering digunakan dalam industri jamu. Terdapat tiga jenis jahe berdasarkan aroma, warna dan ukuran rimpangnya, yaitu jahe gajah, jahe emprit, dan jahe merah. Jahe merah lebih sering digunakan sebagai bahan baku obat karena memiliki kandungan senyawa kimia seperti gingerol, oleoresin, dan minyak atsiri yang lebih tinggi dibanding dengan jahe gajah dan jahe emprit (Tim Lentera 2004).
Jahe merah yang digunakan dalam industri jamu umumnya berasal dari sentra produksi di berbagai daerah di Jawa Tengah dan Jawa Timur. Perbedaan lokasi ini dapat menyebabkan kandungan komponen kimia (metabolit sekunder) yang terkandung dalam jahe merah juga dapat berbeda. Adanya
perbedaan metabolit sekunder yang
dihasilkan juga berpengaruh terhadap kualitas dan khasiat jahe merah tersebut. Oleh karena itu untuk menjamin kualitas dan khasiat pada jahe merah tersebut perlu dilakukan identifikasi dan diferensiasi. Identifikasi dan diferensiasi juga dilakukan untuk menghindari adanya pemalsuan bahan baku mengingat jahe merah yang di jual di pasaran umumnya sudah dalam bentuk rajangan kering atau serbuk/simplisia, sehingga sulit dibedakan baik terhadap jenis
jahe lainnya maupun dengan suku
Zingiberaceae lainnya seperti bangle dan lengkuas. selain itu juga harga jual rimpang jahe merah 2 sampai 3 kali lebih mahal dibanding jahe gajah, jahe emprit, dan lengkuas. sehingga hal inilah yang memungkinkan dari semua jenis tanaman ini dapat menjadi bahan pemalsu satu sama lainnya.
Terdapat dua pendekatan dalam
mengevaluasi kualitas tanaman obat, yaitu
melalui penetapan kadar senyawa penciri
dan memprofilkan senyawa secara
keseluruhan (Zeng 2008). Dalam Monografi Ekstrak Tumbuhan Obat Indonesia Volume 1 oleh Badan Pengawas Obat dan Makanan (BPOM), gingerol ditetapkan sebagai senyawa penciri pada tanaman jahe untuk evaluasi kualitas bahan baku maupun ekstrak sebelum dikonversi menjadi obat herbal komersial. Saat ini pendekatan memprofilkan senyawa secara keseluruhan (metabolic profiling) lebih sering digunakan
karena dapat mempresentasikan
kompleksitas senyawa yang ada dalam tanaman obat tersebut.
Analisis yang sering digunakan untuk memprofilkan senyawa keseluruhan adalah analisis pola sidik jari kromatografi. Salah satu teknik kromatografi yang dapat digunakan yaitu dengan kromatografi lapis tipis (KLT). Pemilihan teknik KLT pada penelitian ini didasarkan pada beberapa keunggulan dari KLT tersebut, diantaranya
mudah dalam preparasi sampel,
kesederhanaan dalam prosedur kerja, biaya relatif murah karena sampel dan standar dapat diujikan dalam waktu yang sama, volume pelarut yang digunakan sedikit, selektif, dan sensitif, serta kromatogramnya dapat diamati secara visual (Kimura et al. 2008).
Keberhasilan proses pemisahan pada KLT sangat bergantung pada fase gerak yang digunakan. Oleh karena itu, perlu dicari fase gerak yang optimum sehingga didapatkan hasil pemisahan yang baik. Suatu metode percobaan yang tepat diperlukan untuk menggambarkan fase gerak yang optimum. Beberapa rancangan yang sering
digunakan untuk menentukan kondisi
optimum antara lain rancangan faktorial (factorial design), metode respon permukaan (respon surface methodology), dan mixture design (Nutan 2004). Pada penelitian ini digunakan metode central composite design untuk optimasi ekstraksi dengan sonikasi dan simplex centroid design untuk optimasi fase gerak. Kedua metode ini dipilih karena memiliki keunggulan, diantaranya biaya relatif murah, cepat, mudah, dan menitikberatkan pada nilai yang konstan dari penjumlahan tingkatan faktor untuk tiap-tiap kombinasi. Berdasarkan metode tersebut kondisi optimum dari fase gerak dapat dilihat secara kualitatif maupun kuantitatif.
Secara kualitatif dengan melihat
2
persamaan regresi yang dihasilkan
(Anderson & Mclean 1974).
Penelitian ini bertujuan membandingkan pola kromatogram jahe merah dari metode ekstraksi yang berbeda, yaitu maserasi dan sonikasi. Ekstraksi yang menghasilkan pemisahan terbaik kemudian diujikan pada jahe merah dari berbagai daerah untuk melihat perbedaan pola sidik jarinya. Manfaat dari penelitian ini adalah dapat memberikan informasi pola kromatogram sidik jari KLT jahe merah dari berbagai sentra produksi di Pulau Jawa.
TINJAUAN PUSTAKA
Jahe Merah
Jahe merah diklasifikasikan kedalam
divisi Spermatophyta, subdivisi
Angiospermae, kelas Monokotyledonae, ordo Zingiberales, family Zingiberaceae, genus Zingiber, dan spesies Zingiber officinale Rosc (Muhlisah 1999). Setiap jenis jahe memiliki perbedaan fungsi yang disesuaikan dengan karakteristik masing-masing varietas. Jahe gajah lebih banyak digunakan untuk produk minuman, permen dan asinan. Jahe emprit banyak digunakan sebagai penyedap rasa makanan. Jahe merah
mempunyai keunggulan dari jumlah
kandungan senyawa kimianya sehingga lebih sering digunakan sebagai bahan baku obat (Herlina et al. 2002). Bagian jahe yang banyak digunakan adalah rimpangnya.
Rimpang jahe yang biasa digunakan
berumur antara 9 sampai 11 bulan. Rimpang jahe bercabang-cabang tidak teratur dengan daging berwarna merah atau jingga muda, berukuran kecil dan memiliki serat yang kasar (Koswara 1995).
Jahe (Zingiber officinale Rosc) adalah tanaman yang tumbuh tegak dengan tinggi 30–60 cm. Daun tanaman jahe berupa daun tunggal, berbentuk lanset dan berujung runcing. Mahkota bunga berwarna ungu, berbentuk corong dengan panjang 2 – 2.5 cm. Sedangkan buah berbentuk bulat panjang berwarna cokelat dengan biji
berwarna hitam (Matondang, 2005).
Guzman dan Siemonsma (1999),
menyatakan bahwa jahe merah sama seperti varietas jahe yang lain yaitu merupakan tanaman berbatang semu yang tumbuh tegak tidak bercabang dengan tinggi tanaman dapat mencapai 1.25 meter. Tanaman ini tersusun atas pelepah daun berbentuk bulat berwarna hijau pucat dengan warna pangkal
batang kemerahan dan bentuk daun
memanjang (Gambar 1).
Berdasarkan aroma, warna, bentuk, dan ukuran rimpangnya, jahe dibedakan menjadi tiga jenis, yaitu jahe besar atau jahe badak, jahe kecil atau jahe emprit dan jahe merah atau jahe sunti (Sastroamidjojo 1997). Herlina et al (2002) menambahkan bahwa jahe gajah berwarna hijau muda, berbentuk
bulat, beraroma kurang tajam dan
mempunyai rasa kurang pedas, jahe emprit memiliki ukuran rimpang kecil, berbentuk sedikit pipih, berwarna putih beraroma agak
tajam dan mempunyai rasa pedas.
Sedangkan jahe merah berwarna kuning kemerahan, berserat kasar, mempunyai rasa sangat pedas dan beraroma tajam.
Jahe merah mempunyai banyak
keunggulan dibandingkan dengan jenis jahe lainnya. Terutama ditinjau dari segi kandungan senyawa kimianya yang terdiri atas zat gingerol, oleoresin, dan minyak atsiri yang tinggi sehingga lebih banyak digunakan sebagai obat (Tim Lentera 2004).
Rimpang jahe mengandung beberapa
komponen kimia lain seperti air, pati, serat kasar dan abu, komposisi setiap komponen berbeda-beda berdasarkan varietas, iklim, curah hujan, dan topografi atau kondisi lahan (Koswara 1995). Kandungan kimia jahe merah antara lain gingerol, sineol, geraniol, zingiberan, zingeron, zingiberol, shagol, farnesol, d-borneol, linalool, kavikol, metilzingediol, dan resin (Wijayakusuma 2006).
Senyawa metabolit sekunder yang
dihasilkan tumbuhan Suku Zingiberaceae umumnya dapat menghambat pertumbuhan mikroorganisme patogen yang merugikan kehidupan manusia (Nursal 2006). Ekstrak air jahe yang berasal dari jahe segar maupun jahe bubuk dan ekstrak diklrometana jahe mempunyai aktivitas antioksidan terhadap asam linoleat (Septiana et al. 2002). Ekstrak
air jahe dapat menurunkan kadar
2
persamaan regresi yang dihasilkan
(Anderson & Mclean 1974).
Penelitian ini bertujuan membandingkan pola kromatogram jahe merah dari metode ekstraksi yang berbeda, yaitu maserasi dan sonikasi. Ekstraksi yang menghasilkan pemisahan terbaik kemudian diujikan pada jahe merah dari berbagai daerah untuk melihat perbedaan pola sidik jarinya. Manfaat dari penelitian ini adalah dapat memberikan informasi pola kromatogram sidik jari KLT jahe merah dari berbagai sentra produksi di Pulau Jawa.
TINJAUAN PUSTAKA
Jahe Merah
Jahe merah diklasifikasikan kedalam
divisi Spermatophyta, subdivisi
Angiospermae, kelas Monokotyledonae, ordo Zingiberales, family Zingiberaceae, genus Zingiber, dan spesies Zingiber officinale Rosc (Muhlisah 1999). Setiap jenis jahe memiliki perbedaan fungsi yang disesuaikan dengan karakteristik masing-masing varietas. Jahe gajah lebih banyak digunakan untuk produk minuman, permen dan asinan. Jahe emprit banyak digunakan sebagai penyedap rasa makanan. Jahe merah
mempunyai keunggulan dari jumlah
kandungan senyawa kimianya sehingga lebih sering digunakan sebagai bahan baku obat (Herlina et al. 2002). Bagian jahe yang banyak digunakan adalah rimpangnya.
Rimpang jahe yang biasa digunakan
berumur antara 9 sampai 11 bulan. Rimpang jahe bercabang-cabang tidak teratur dengan daging berwarna merah atau jingga muda, berukuran kecil dan memiliki serat yang kasar (Koswara 1995).
Jahe (Zingiber officinale Rosc) adalah tanaman yang tumbuh tegak dengan tinggi 30–60 cm. Daun tanaman jahe berupa daun tunggal, berbentuk lanset dan berujung runcing. Mahkota bunga berwarna ungu, berbentuk corong dengan panjang 2 – 2.5 cm. Sedangkan buah berbentuk bulat panjang berwarna cokelat dengan biji
berwarna hitam (Matondang, 2005).
Guzman dan Siemonsma (1999),
menyatakan bahwa jahe merah sama seperti varietas jahe yang lain yaitu merupakan tanaman berbatang semu yang tumbuh tegak tidak bercabang dengan tinggi tanaman dapat mencapai 1.25 meter. Tanaman ini tersusun atas pelepah daun berbentuk bulat berwarna hijau pucat dengan warna pangkal
batang kemerahan dan bentuk daun
memanjang (Gambar 1).
Berdasarkan aroma, warna, bentuk, dan ukuran rimpangnya, jahe dibedakan menjadi tiga jenis, yaitu jahe besar atau jahe badak, jahe kecil atau jahe emprit dan jahe merah atau jahe sunti (Sastroamidjojo 1997). Herlina et al (2002) menambahkan bahwa jahe gajah berwarna hijau muda, berbentuk
bulat, beraroma kurang tajam dan
mempunyai rasa kurang pedas, jahe emprit memiliki ukuran rimpang kecil, berbentuk sedikit pipih, berwarna putih beraroma agak
tajam dan mempunyai rasa pedas.
Sedangkan jahe merah berwarna kuning kemerahan, berserat kasar, mempunyai rasa sangat pedas dan beraroma tajam.
Jahe merah mempunyai banyak
keunggulan dibandingkan dengan jenis jahe lainnya. Terutama ditinjau dari segi kandungan senyawa kimianya yang terdiri atas zat gingerol, oleoresin, dan minyak atsiri yang tinggi sehingga lebih banyak digunakan sebagai obat (Tim Lentera 2004).
Rimpang jahe mengandung beberapa
komponen kimia lain seperti air, pati, serat kasar dan abu, komposisi setiap komponen berbeda-beda berdasarkan varietas, iklim, curah hujan, dan topografi atau kondisi lahan (Koswara 1995). Kandungan kimia jahe merah antara lain gingerol, sineol, geraniol, zingiberan, zingeron, zingiberol, shagol, farnesol, d-borneol, linalool, kavikol, metilzingediol, dan resin (Wijayakusuma 2006).
Senyawa metabolit sekunder yang
dihasilkan tumbuhan Suku Zingiberaceae umumnya dapat menghambat pertumbuhan mikroorganisme patogen yang merugikan kehidupan manusia (Nursal 2006). Ekstrak air jahe yang berasal dari jahe segar maupun jahe bubuk dan ekstrak diklrometana jahe mempunyai aktivitas antioksidan terhadap asam linoleat (Septiana et al. 2002). Ekstrak
air jahe dapat menurunkan kadar
3
Gambar1 Tanaman dan rimpang jahe merah
Kromatografi Lapis Tipis (KLT)
Kromatografi merupakan suatu metode yang digunakan untuk pemisahan campuran komponen berdasarkan distribusi komponen tersebut diantara dua fase, yaitu fase diam dan fase gerak (Stoenoiu et al. 2006). Teknik ini ditemukan pertama kali pada tahun 1903 oleh Mikhail Tswett seorang berkebangsaan Rusia yang mencoba memisahkan pigmen-pigmen daun (klorofil) dengan menggunakan suatu kolom yang berisi kapur (CaSO4). Salah satu teknik
kromatografi diantaranya kromaotgrafi lapis tipis (KLT) yang dikembangkan tahun 1938 oleh Ismailoff dan Schraiber. Prinsip KLT adalah sampel diteteskan pada lapisan tipis kemudian dimasukkan ke dalam wadah yang berisi fase gerak sehingga sampel tersebut terpisah menjadi komponen-komponennya (Gambar 2). Setiap komponen akan bergerak dengan laju tertentu yang dinyatakan dengan faktor retensi (Rf), yaitu perbandingan antara jarak yang ditempuh komponen terhadap jarak yang ditempuh fase gerak. Komponen yang mempunyai afinitas lebih besar dari fase gerak atau afinitasnya lebih kecil dari fase diam akan bergerak lebih cepat dari pada komponen yang mempunyai sifat sebaliknya (Gritter et al. 1991).
Sistem KLT meliputi fase gerak (eluen), fase diam (lapisan penjerap), dan deteksi kromatogram. Fase diam yang umum digunakan adalah silika gel, alumunium dan selulosa (Stahl 1985). Dari ketiga fase diam diatas, Silika gel adalah penjerap yang sering digunakan karena silika gel
mempunyai kekuatan pemisahan yang
sangat baik (Nyiredy 2002). Fase gerak adalah medium angkut yang terdiri atas satu atau beberapa pelarut. Fase gerak bergerak dalam fase diam karena adanya gaya kapiler (Stahl 1985). Pelarut yang digunakan sebagai fase gerak hanyalah pelarut bertingkat mutu analitik dan bila diperlukan sistem pelarut multi komponen ini harus berupa suatu campuran yang sesederhana
mungkin yang terdiri atas maksimum tiga pelarut. Fase gerak yang terdiri atas beberapa campuran pelarut mempunyai perbandingan volume total 100 (Stahl 1985). Pada KLT sistem pengembangan yang digunakan berdasarkan prinsip like dissolves like, yaitu memisahkan komponen bersifat polar menggunakan sistem pelarut yang bersifat polar juga ataupun sebaliknya. Deteksi hasil kromatogram dilakukan di bawah sinar UV pada panjang gelombang 254 nm dan 366 nm, serta dapat dilakukan juga dengan pereaksi semprot, yaitu dengan vanillin dan anisaldehida dalam asam sulfat untuk mendeteksi keberadaan senyawa-senyawa terpenoid termasuk minyak atsiri (Santosa & Hertiani 2005).
Gambar 2 Bejana kromatografi berisi pelat KLT dan larutan pengembang
Rancangan Percobaan
Rancangan percobaan adalah aturan yang digunakan untuk mendapatkan data dalam suatu percobaan. Rancangan percobaan
digunakan untuk membatasi atau
mengontrol pengaruh parameter perlakuan
dalam percobaan sehingga dapat
mengurangi jumlah, bahan, waktu dan galat percobaan (Yitnosumaro 1993). Rancangan yang digunakan pada penelitian ini adalah simplex centroid design dan central composite design yang merupakan bagian dari metode permukaan respon. Metode permukaan respon merupakan sekumpulan teknik matematika dan statistika yang berguna untuk menganalisis permasalahan dimana beberapa variabel independen mempengaruhi variabel respon dan tujuan akhirnya adalah mengoptimalkan respon (Montgomery 2005).
4
komponen dan penjumlahan dari tingkatan faktor untuk tiap kombinasi perlakuan konstan dan tetap, serta penjumlahan semua faktor harus sama dengan satu (Montgomery 2005). Simplex centroid design digunakan untuk memberikan ulasan percobaan di bagian tengah bidang. Salah satu cara untuk menggambarkan model adalah mempertimbangkan struktur dari percobaan tiga faktor. Rancangan simplex centroid digambarkan dengan segitiga sama sisi dalam dua dimensi.
Central composite design adalah metode yang menjelaskan hubungan antara faktor
yang bebas dengan respon. Central
composite design digunakan pada sistem dengan banyak faktor yang memerlukan minimal dua faktor yang divariasikan (Zhang et al. 2007). Titik faktorial merupakan kombinasi faktor-faktor yang divariasikan. Titik faktorial menunjukkan level-level eksperimen pada masing-masing faktor bebas yang dikodekan, dimana level rendah dinyatakan dengan kode -1 dan level tinggi dikodekan +1.
Validasi Metode
Validasi metode analisis merupakan suatu tindakan penilaian terhadap metode tertentu yang sesuai dan cepat untuk pengukuran sampel tertentu, berdasarkan
percobaan laboratorium, untuk
membuktikan bahwa metode tersebut
memenuhi persyaratan penggunaannya pada analisis rutin kendali mutu. Beberapa
parameter analisis yang harus
dipertimbangkan dalam validasi metode analisis, yaitu ketelitian (presisi) yang
terbagi menjadi keterulangan
(repeatabilitas), presisi menengah dan keterulangan (reprodusibilitas), spesifitas, robustness (ketangguhan), dan kestabilan analat baik selama kromatografi, pada pelat, dalam larutan, maupun visualisasi (Reich & Schibli 2008).
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan dalam
penelitian adalah neraca analitik XT 220A, peralatan gelas, vial, oven Memmert, Buchi rotary evaporator R-114, Camag bejana kromatografi, botol penyemprot, Camag Linomat 5, microsyringe 100 µL, Camag Reprostar 3 dibantu program winCAT 1.2.3, dan sonikator Branson 1510,
Bahan-bahan yang digunakan dalam penelitian adalah sampel rimpang jahe merah (Zingiber officinale Rosc) dari berbagai daerah yaitu Bogor, Kulonprogo, Wonogiri, Ponorogo, Purwokerto, Pacitan dan Semarang, pelat KLT silika gel Merck 60 F254 (Darmstadt, Jerman)
,
kertas saringWhatman , etanol 96%, pelarut untuk fase gerak dengan tingkat analitis dari PT.Merck seperti n-heksana, dietil eter, n-butanol, etanol, metanol, tetrahidrofuran, asam asetat, diklorometana, etil asetat, aseton, asetonitril, anisaldehida.
Metode Penelitian
Ekstraksi dengan Maserasi
Sebanyak 100 gram serbuk kering rimpang jahe merah dimasukkan ke dalam
Erlenmeyer 1000 mL, kemudian
ditambahkan 500 mL etanol 96%. Pada sampel dilakukan perendaman selama 6 jam, selanjutnya didiamkan selama 24 jam. Maserat dipisahkan dan dipindahkan ke
Erlenmeyer lain, sedangkan ampas
diperlakukan sama sebanyak 2 kali maserasi. Maserat yang diperoleh dipekatkan
dengan
rotary evaporator hingga diperoleh ekstrak kental (BPOM 2004). Ekstrak kental yang diperoleh dilarutkan dengan etanol 96% secukupnya sehingga didapatkan ekstrak dengan konsentrasi 10 g/L.
Ekstraksi dengan Sonikasi
Simplisia jahe merah dimasukan ke dalam vial dan diekstraksi dengan etanol 96% dalam ultrasonik cleaning bath pada frekuensi 42 kHz. Variasi perlakuan ekstraksi yaitu bobot, volume pelarut, dan
waktu ekstraksi ditentukan dengan
rancangan central composite design
(Melecchi et al. 2006) (Lampiran 3). Ekstrak yang diperoleh kemudian disaring dengan kertas saring Whatman 4. Selanjutnya filtrat yang diperoleh diujikan pada pelat KLT.
Penotolan Sampel
Penotolan ekstrak dari maserasi, ekstrak dari sonikasi dan larutan standar. Larutan standar diperoleh dari senyawa 6-gingerol yang dilarutkan dalam etanol p.a sampai diperoleh konsentrasi 0.1 g/L. Penotolan sampel pada pelat silika gel 60 F254
4
komponen dan penjumlahan dari tingkatan faktor untuk tiap kombinasi perlakuan konstan dan tetap, serta penjumlahan semua faktor harus sama dengan satu (Montgomery 2005). Simplex centroid design digunakan untuk memberikan ulasan percobaan di bagian tengah bidang. Salah satu cara untuk menggambarkan model adalah mempertimbangkan struktur dari percobaan tiga faktor. Rancangan simplex centroid digambarkan dengan segitiga sama sisi dalam dua dimensi.
Central composite design adalah metode yang menjelaskan hubungan antara faktor
yang bebas dengan respon. Central
composite design digunakan pada sistem dengan banyak faktor yang memerlukan minimal dua faktor yang divariasikan (Zhang et al. 2007). Titik faktorial merupakan kombinasi faktor-faktor yang divariasikan. Titik faktorial menunjukkan level-level eksperimen pada masing-masing faktor bebas yang dikodekan, dimana level rendah dinyatakan dengan kode -1 dan level tinggi dikodekan +1.
Validasi Metode
Validasi metode analisis merupakan suatu tindakan penilaian terhadap metode tertentu yang sesuai dan cepat untuk pengukuran sampel tertentu, berdasarkan
percobaan laboratorium, untuk
membuktikan bahwa metode tersebut
memenuhi persyaratan penggunaannya pada analisis rutin kendali mutu. Beberapa
parameter analisis yang harus
dipertimbangkan dalam validasi metode analisis, yaitu ketelitian (presisi) yang
terbagi menjadi keterulangan
(repeatabilitas), presisi menengah dan keterulangan (reprodusibilitas), spesifitas, robustness (ketangguhan), dan kestabilan analat baik selama kromatografi, pada pelat, dalam larutan, maupun visualisasi (Reich & Schibli 2008).
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan dalam
penelitian adalah neraca analitik XT 220A, peralatan gelas, vial, oven Memmert, Buchi rotary evaporator R-114, Camag bejana kromatografi, botol penyemprot, Camag Linomat 5, microsyringe 100 µL, Camag Reprostar 3 dibantu program winCAT 1.2.3, dan sonikator Branson 1510,
Bahan-bahan yang digunakan dalam penelitian adalah sampel rimpang jahe merah (Zingiber officinale Rosc) dari berbagai daerah yaitu Bogor, Kulonprogo, Wonogiri, Ponorogo, Purwokerto, Pacitan dan Semarang, pelat KLT silika gel Merck 60 F254 (Darmstadt, Jerman)
,
kertas saringWhatman , etanol 96%, pelarut untuk fase gerak dengan tingkat analitis dari PT.Merck seperti n-heksana, dietil eter, n-butanol, etanol, metanol, tetrahidrofuran, asam asetat, diklorometana, etil asetat, aseton, asetonitril, anisaldehida.
Metode Penelitian
Ekstraksi dengan Maserasi
Sebanyak 100 gram serbuk kering rimpang jahe merah dimasukkan ke dalam
Erlenmeyer 1000 mL, kemudian
ditambahkan 500 mL etanol 96%. Pada sampel dilakukan perendaman selama 6 jam, selanjutnya didiamkan selama 24 jam. Maserat dipisahkan dan dipindahkan ke
Erlenmeyer lain, sedangkan ampas
diperlakukan sama sebanyak 2 kali maserasi. Maserat yang diperoleh dipekatkan
dengan
rotary evaporator hingga diperoleh ekstrak kental (BPOM 2004). Ekstrak kental yang diperoleh dilarutkan dengan etanol 96% secukupnya sehingga didapatkan ekstrak dengan konsentrasi 10 g/L.
Ekstraksi dengan Sonikasi
Simplisia jahe merah dimasukan ke dalam vial dan diekstraksi dengan etanol 96% dalam ultrasonik cleaning bath pada frekuensi 42 kHz. Variasi perlakuan ekstraksi yaitu bobot, volume pelarut, dan
waktu ekstraksi ditentukan dengan
rancangan central composite design
(Melecchi et al. 2006) (Lampiran 3). Ekstrak yang diperoleh kemudian disaring dengan kertas saring Whatman 4. Selanjutnya filtrat yang diperoleh diujikan pada pelat KLT.
Penotolan Sampel
Penotolan ekstrak dari maserasi, ekstrak dari sonikasi dan larutan standar. Larutan standar diperoleh dari senyawa 6-gingerol yang dilarutkan dalam etanol p.a sampai diperoleh konsentrasi 0.1 g/L. Penotolan sampel pada pelat silika gel 60 F254
5
bagian kiri bawah pelat. Pelat terlebih dahulu dikondisikan sebelum penotolan dengan memasukkan ke dalam oven 105oC selama 20 menit.
Pemilihan Fase Gerak (Almeida & Scarminio 2007)
Pemilihan fase gerak diawali dengan menggunakan dua belas pelarut tunggal yaitu n-heksana, dietil eter, etanol, n -butanol, metanol, tetrahidrofuran, asam asetat,etil asetat, diklorometana, aseton, asetonitril, dan kloroform. Sebanyak 5 mL dari dua belas pelarut tersebut dimasukkan kedalam bejana kromatografi kemudian dijenuhkan selama 20 menit. Pelat yang telah berisi sampel dimasukkan ke dalam bejana kromatografi dan dipisahkan hingga fase gerak mencapai jarak ± 0.5 cm dari tepi atas pelat. Pelat diangkat dan dikeringkan. Identifikasi dilakukan untuk melihat pita atau bercak yang muncul pada pelat. Dari dua belas pelarut tunggal yang diujikan, selanjutnya dipilih tiga pelarut yang memberikan penampakan pita terbanyak dan memiliki jarak pita yang jelas. Ketiga pelarut tunggal yang terpilih yaitu sebagai titik A, B, dan C. Titik A dimisalkan pelarut A, titik B pelarut B, dan titik C pelarut C. ketiga titik itu kemudian dikombinasikan berdasarkan simplex centroid seperti terlihat pada Gambar 3. Kesepuluh titik pelarut tersebut dinyatakan pada Tabel 1. Kesepuluh titik tersebut menyatakan perbandingan jumlah eluen yang digunakan. Misalkan pada titik 4, yaitu saat perbandingan A; B; C sebesar 1/2: 0: 1/2, jika jumlah eluen yang digunakan 5 mL, maka pelarut A yang digunakan 2.5 mL, pelarut B 0 mL, dan pelarut C 2.5 mL.
Tabel 1 Rancangan komposisi fase gerak
Fase Gerak
Komposisi Fase Gerak
A B C
1 1 0 0
2 0 0 1
3 0 1 0
4 1/2 0 1/2
5 0 1/2 1/2
6 1/2 1/2 0
7 1/3 1/3 1/3
8 1/6 2/3 1/6
9 1/6 1/6 2/3
10 2/3 1/6 1/6
Gambar 3 Titik selektivitas simplex centroid (Almeida & Scarminio 2007).
Selanjutnya dilakukan pemisahan
komponen sampel dengan menggunakan sepuluh perbandingan komposisi pelarut tersebut. Setelah itu dilakukan pengeringan pelat, pendeteksian komponen, dan jumlah pita yang dihasilkan untuk menyusun komposisi fase gerak yang optimum. Data yang diperoleh diolah dengan peranti lunak Minitab 14.
Deteksi komponen dilakukan dengan dua
cara. Pertama, setelah pelat
dikeringudarakan selama 5-10 menit, pelat disinari dengan UV 254 nm dan 366 nm menggunakan Camag Reprostar 3 (Fernand 2003). Kedua pada pelat yang telah dikeringudarakan disemprot dengan larutan anisaldehida. Larutan anisaldehida dibuat dengan memasukkan 0.100 mL anisaldehida ke dalam labu takar 20 mL dan ditambahkan dengan alkohol asam sampai tanda tera. Larutan disemprotkan pada pelat dan dikeringkan. Setelah dikeringkan, pelat
dipanaskan di dalam oven dengan
temperatur 105°C selama 5-10 menit (Tripathi et al. 2006).
Rf = Jarak komponen dari garis start Jarak eluen dari garis start
Validasi Metode (Reich & Schibli 2008)
Stabilitas Sampel selama
6
pengembang yang masih segar. Pelat dideteksi dengan UV 366 nm.
Stabilitas Analat pada Pelat dan dalam Larutan. Ekstrak ditotolkan pada pelat 10 x 10 cm. Ekstrak dibuat sebanyak tiga buah. Ekstrak satu ditotolkan 1 cm dari bagian bawah kiri pelat selama 3 jam sebelum kromatografi. Setelah 3 jam kemudian ditotolkan ekstrak segar (ekstrak dua dan tiga), Sampel dari ekstrak satu ditotolkan kembali pada pelat, dan standar 6-gingerol. Jarak penotolan antara sampel yang satu dengan sampel yang lainnya berjarak 1 cm. Pelat dikembangkan dan dikeringkan kemudian dideteksi dengan UV 366 nm.
Stabilitas Visualisasi. Pelat berukuran 3 x 10 cm ditotolkan ekstrak jahe merah pada sudut kiri bawah (1 cm dari tepi pelat). Pelat dikembangkan dan dikeringkan. Pelat diamati selama 1 jam dibawah UV 366 nm. Gambar diambil setelah 2, 5, 10, 20, dan 30 menit serta 1 jam.
Keterulangan. Tiga larutan ekstrak sampel yang berbeda dan larutan standar 6-gingerol ditotolkan pada tiga pelat berbeda dengan ukuran pelat 8 x 10 cm. Sampel ditotolkan 1 cm dari bagian kiri bawah pelat. Jarak penotolan sampel yang satu dengan sampel yang lainnya berjarak 1 cm. Pelat dikembangkan menggunakan chamber yang sama. Pelat dideteksi dengan UV 366 nm.
Penotolan dan pendeteksian sampel
dilakukan pada hari yang sama.
Presisi Menengah. Tiga larutan ekstrak sampel yang berbeda dan larutan standar 6-gingerol ditotolkan pada tiga pelat dengan ukuran pelat 8 x 10 cm. Sampel ditotolkan 1 cm dari bagian kiri bawah pelat. Jarak penotolan sampel yang satu dengan sampel yang lainnya berjarak 1 cm. Pelat dikembangkan menggunakan chamber yang sama. Pelat dideteksi dengan UV 366 nm.
Penotolan dan pendeteksian sampel
dilakukan pada hari yang berbeda, yaitu hari ke-1, hari ke-2 dan hari ke-3.
Spesifisitas. Ekstrak dari jahe merah, jahe gajah, jahe emprit dan lengkuas ditotolkan pada pelat 10 x 10 cm dan dibandingkan dengan larutan standar 6-gingerol. Sampel ditotolkan 1 cm dari bagian kiri bawah pelat. Jarak penotolan sampel yang satu dengan sampel yang lainnya berjarak 1 cm. kemudian Pelat dideteksi dengan UV 366 nm.
Ketangguhan. Dua larutan ekstrak sampel yang berbeda dan larutan standar ditotolkan pada pelat dengan ukuran 6 x 10
cm. Sampel ditotolkan 1 cm dari bagian kiri bawah pelat. Jarak penotolan sampel yang satu dengan sampel yang lainnya berjarak 1 cm. Pelat dikembangkan menggunakan twin trough chamber dan flat bottom chamber dan dideteksi dengan UV 366 nm. Hasil kromatogram dengan twin trough chamber dan flat bottom chamber kemudian dibandingkan.
(a)
(b)
Gambar 4 Twin troughchamber (a) dan flat bottom chamber (b)
HASIL DAN PEMBAHASAN
Pemilihan Fase Gerak
Pemilihan fase gerak diawali dengan pemisahan menggunakan 12 pelarut tunggal. Ekstrak yang digunakan yaitu ekstrak yang diperoleh dari maserasi. Jumlah pita yang dihasilkan seperti ditunjukkan pada Gambar 5. Pelarut yang menghasilkan pita terbanyak dan pemisahan terbaik adalah kloroform, diklorometana, dan dietil eter. Kloroform dan diklorometana menghasilkan pemisahan jumlah pita yang sama. Oleh karena itu dipilih salah satu, pada penelitian ini yang dipilih adalah kloroform, karena kloroform lebih menunjukkan keterpisahan yang lebih baik dibanding diklorometana (Lampiran 5). Diklorometana digantikan etil asetat agar pita lebih tertarik ke atas sehingga didapatkan pemisahan yang baik. Sebelum pemilihan tiga pelarut, dilakukan pengujian awal dengan kloroform: etil asetat: dietil eter dengan perbandingan 50: 10: 40.
6
pengembang yang masih segar. Pelat dideteksi dengan UV 366 nm.
Stabilitas Analat pada Pelat dan dalam Larutan. Ekstrak ditotolkan pada pelat 10 x 10 cm. Ekstrak dibuat sebanyak tiga buah. Ekstrak satu ditotolkan 1 cm dari bagian bawah kiri pelat selama 3 jam sebelum kromatografi. Setelah 3 jam kemudian ditotolkan ekstrak segar (ekstrak dua dan tiga), Sampel dari ekstrak satu ditotolkan kembali pada pelat, dan standar 6-gingerol. Jarak penotolan antara sampel yang satu dengan sampel yang lainnya berjarak 1 cm. Pelat dikembangkan dan dikeringkan kemudian dideteksi dengan UV 366 nm.
Stabilitas Visualisasi. Pelat berukuran 3 x 10 cm ditotolkan ekstrak jahe merah pada sudut kiri bawah (1 cm dari tepi pelat). Pelat dikembangkan dan dikeringkan. Pelat diamati selama 1 jam dibawah UV 366 nm. Gambar diambil setelah 2, 5, 10, 20, dan 30 menit serta 1 jam.
Keterulangan. Tiga larutan ekstrak sampel yang berbeda dan larutan standar 6-gingerol ditotolkan pada tiga pelat berbeda dengan ukuran pelat 8 x 10 cm. Sampel ditotolkan 1 cm dari bagian kiri bawah pelat. Jarak penotolan sampel yang satu dengan sampel yang lainnya berjarak 1 cm. Pelat dikembangkan menggunakan chamber yang sama. Pelat dideteksi dengan UV 366 nm.
Penotolan dan pendeteksian sampel
dilakukan pada hari yang sama.
Presisi Menengah. Tiga larutan ekstrak sampel yang berbeda dan larutan standar 6-gingerol ditotolkan pada tiga pelat dengan ukuran pelat 8 x 10 cm. Sampel ditotolkan 1 cm dari bagian kiri bawah pelat. Jarak penotolan sampel yang satu dengan sampel yang lainnya berjarak 1 cm. Pelat dikembangkan menggunakan chamber yang sama. Pelat dideteksi dengan UV 366 nm.
Penotolan dan pendeteksian sampel
dilakukan pada hari yang berbeda, yaitu hari ke-1, hari ke-2 dan hari ke-3.
Spesifisitas. Ekstrak dari jahe merah, jahe gajah, jahe emprit dan lengkuas ditotolkan pada pelat 10 x 10 cm dan dibandingkan dengan larutan standar 6-gingerol. Sampel ditotolkan 1 cm dari bagian kiri bawah pelat. Jarak penotolan sampel yang satu dengan sampel yang lainnya berjarak 1 cm. kemudian Pelat dideteksi dengan UV 366 nm.
Ketangguhan. Dua larutan ekstrak sampel yang berbeda dan larutan standar ditotolkan pada pelat dengan ukuran 6 x 10
cm. Sampel ditotolkan 1 cm dari bagian kiri bawah pelat. Jarak penotolan sampel yang satu dengan sampel yang lainnya berjarak 1 cm. Pelat dikembangkan menggunakan twin trough chamber dan flat bottom chamber dan dideteksi dengan UV 366 nm. Hasil kromatogram dengan twin trough chamber dan flat bottom chamber kemudian dibandingkan.
(a)
(b)
Gambar 4 Twin troughchamber (a) dan flat bottom chamber (b)
HASIL DAN PEMBAHASAN
Pemilihan Fase Gerak
Pemilihan fase gerak diawali dengan pemisahan menggunakan 12 pelarut tunggal. Ekstrak yang digunakan yaitu ekstrak yang diperoleh dari maserasi. Jumlah pita yang dihasilkan seperti ditunjukkan pada Gambar 5. Pelarut yang menghasilkan pita terbanyak dan pemisahan terbaik adalah kloroform, diklorometana, dan dietil eter. Kloroform dan diklorometana menghasilkan pemisahan jumlah pita yang sama. Oleh karena itu dipilih salah satu, pada penelitian ini yang dipilih adalah kloroform, karena kloroform lebih menunjukkan keterpisahan yang lebih baik dibanding diklorometana (Lampiran 5). Diklorometana digantikan etil asetat agar pita lebih tertarik ke atas sehingga didapatkan pemisahan yang baik. Sebelum pemilihan tiga pelarut, dilakukan pengujian awal dengan kloroform: etil asetat: dietil eter dengan perbandingan 50: 10: 40.
7
terpisah ke atas semua, maka digunakan pelarut yang dapat menahan laju pita yaitu n-heksana. Jadi dilakukan pengujian kembali dengan kloroform: etil asetat: n-heksan dan klorform: dietil eter: n-heksana dengan perbandingan yang sama 50: 10: 40. Pemisahan dengan pelarut kloroform: dietil eter: n-heksana menghasilkan pita yang banyak namun masih saling berdekatan (Gambar 6c), sedangkan pada pelarut
kloroform: etil asetat: n-heksana
menghasilkan jumlah pita yang banyak dan memiliki keterpisahan yang baik (Gambar 6b). Jadi tiga pelarut yang dipilih berdasarkan jumlah pita terbanyak dan keterpisahan yang baik adalah kloroform, etil asetat, dan n-heksana.
Pendeteksian dengan UV 254, UV 366 nm dan anisaldehida menghasilkan jumlah pita yang berbeda-beda, hal ini disebabkan karena setiap deteksi memunculkan senyawa yang berbeda. Pendeteksian dengan sinar UV digunakan untuk memunculkan senyawa
yang memiliki gugus kromofor
(berkonjugasi). Pada UV 254 nm komponen atau pita yang muncul akan terlihat berwarna gelap, sedangkan pelat akan berpendar warna hijau. Pada UV 366 nm pelat akan terlihat gelap, sedangkan komponen akan berpendar sehingga pita akan terlihat lebih jelas. UV 254 nm
digunakan untuk mendeteksi senyawa
golongan alkaloid, flavonoid, triterpenoid. Sedangkan UV 366 nm digunakan untuk mendeteksi senyawa golongan lignan, alkaloid, flavonoid, triterpenoid (Fernand 2003). Anisaldehida untuk mendeteksi senyawa sterol, terpenoid dan minyak atsiri (Santosa & Hertiani 2005).
Gambar 5 Hubungan antara jumlah pita yang dihasilkan dengan 12 eluen tunggal yang dideteksi oleh UV
254 nm, 366 nm, dan
anisaldehida.
a b c
Gambar 6 Hasil pemisahan dengan pelarut kloroform: etil asetat: dietil eter (a), kloroform: etil asetat: n- heksana (b), kloroform: dietil eter: n-heksana (c). Ketiga hasil pemisahan tersebut dideteksi dengan UV 366 nm.
Penentuan Titik Optimum dari Tiga Pelarut Menggunakan Simplex Centroid
Design
Ketiga pelarut yang terpilih, yaitu kloroform, etil asetat, dan n-heksana masing-masing sebagai titik A, B, C
dikombinasikan berdasarkan simplex
centroid. Hubungan interaksi antara jumlah pita dengan deteksi UV 366 nm dan anisaldehida pada 10 jenis komposisi fase
gerak ditunjukkan pada Gambar 7.
Komposisi pelarut yang menghasilkan pita terbanyak pada UV 366 nm yaitu kloroform: etil asetat: n-heksana pada perbandingan komposisi pelarut 1/6: 1/6: 2/3, sedangkan pada deteksi dengan anisaldehida, komposisi pelarut yang menghasilkan jumlah terbanyak yaitu kloroform: etil asetat: n-heksana pada saat perbandingan komposisi pelarut 1/3: 1/3: 1/3 (Gambar 7). Daerah optimum ditentukan dengan menggunakan peranti lunak Minitab 14 dengan jumlah pita sebagai responnya sehingga didapatkan daerah optimum untuk deteksi UV 366 nm (Gambar 8a) dan daerah optimum untuk deteksi anisaldehida (Gambar 8b) daerah optimum dinyatakan dengan warna hijau tua.
8
10). Sedangkan pemisahan dengan deteksi anisaldehida menunjukkan daerah optimum berada diantara titik A, B, dan titik C, sehingga komposisi fase gerak optimumnya terdiri atas kloroform, etil asetat, dan n-heksana. Daerah optimumnya tercapai saat perbandingan komposisi kloroform : etil asetat : n-heksana yaitu 0.33333 : 0.37995 : 0.28671 (Lampiran 11). Hasil Minitab 14 terhadap hubungan komposisi fase gerak dan jumlah pita menghasilkan persamaan regresi untuk menduga model dari kedua deteksi tersebut, untuk deteksi UV 366 nm didapat persamaan y = 5.474A + 0.747B + 1.474C – 9.263AB + 8.192AC +14.737 BC sedangkan untuk deteksi anisaldehida dihasilkan persamaan y = 5.7492A + 0.9310B – 0.0690C + 13.4343AB + 7.4343AC + 29.7980BC dimana A = kloroform, B = etil asetat dan C = n-heksana. Nilai koefisien determinasi (R2) yang dihasilkan pada deteksi UV 366 nm sebesar 48.50 % sedangkan pada deteksi anisladehida dihasilkan R2 sebesar 95.07%. koefisien korelasi yang dihasilkan pada deteksi UV 366 nm lebih kecil dibandingkan pada deteksi anisaldehida, hal ini disebabkan karena titik optimum yang diperoleh pada deteksi UV 366 nm tidak berada di pusat titik simplex centroid (segitiga) sedangkan pada deteksi anisaldehida titik optimum yang diperoleh berada di pusat titik simplex centroid. Dari hasil elusi sepuluh komposisi rancangan simplex centroid ini dipilih pelarut yang menghasilkan jumlah pita terbanyak dan pemisahan terbaik yaitu pada titik 9 saat perbandingan klroroform: etil asetat: n-heksana; 1/6 : 1/6 : 2/3 yang menghasilkan 9 pita (Gambar 9).
Gambar 7 Hubungan antara jumlah pita yang dihasilkan menggunakan
deteksi UV 366 nm dan
anisaldehida pada jenis komposisi fase gerak.
a b
Gambar 8 Daerah optimum untuk deteksi UV 366 nm (a) dan deteksi anisaldehida (b)
Gambar 9 Hasil pemisahan dari ekstrak maserasi dengan fase gerak optimum (titik 9) rancangan simplex centroid deteksi dengan UV 366 nm
Pemisahan Komponen dari Ekstraksi Sonikasi dengan Central Composite
Design
Pemisahan komponen dari hasil ekstrasi sonikasi dilakukan setelah fase gerak
dioptimumkan. Ekstraksi sonikasi
menggunakan rancangan central composite design dengan 20 variasi perlakuan (Lampiran 3). Hasil ekstraksi kemudian dielusi menggunakan fase gerak optimum yaitu kloroform: etil asetat: n-heksana dengan perbandingan 1/6 : 1/6 : 2/3. Hasil pemisahan 20 variasi ekstraksi sonikasi
menggunakan fase gerak optimum
9
0.25000AB + 0.00000AC + 0.00000BC dengan R2 sebesar 55.1%, dimana A = bobot sampel, B = volume larutan, dan C = waktu
ekstraksi. Persamaan regresi ini
menunjukkan hubungan jumlah pita dengan variasi ekstraksi. Jika dillihat berdasarkan selang kepercayaan, jumlah pita yang dihasilkan baik deteksi dengan UV 366 nm
maupun deteksi anisaldehida sangat
dipengaruhi oleh bobot sampel dimana nilai p bobot sampel lebih kecil dar = 0.05 (p < 0.05), sedangkan volume pelarut dan waktu
ekstrasi tidak mempengaruhi secara
signifikan dengan nilai p > 0.05 (Lampiran 13). Gambar 10 menunjukkan pemisahan komponen dengan ekstraksi sonikasi dapat terlihat secara visualisasi. Pemisahan yang menghasilkan jumlah pita terbanyak dan keterpisahan yang baik terdapat pada variasi ekstraksi nomor 6 pada saat bobot sampel = 1.5 g, volume pelarut 5 mL, dan waktu ekstraksi 15 menit (Lampiran 13) pemisahan ini menghasilkan 9 pita. Proses pemisahan baik dari ekstraksi maserasi maupun sonikasi menggunakan fase gerak optimum menghasilkan jumlah pita yang sama yaitu 9 pita. Namun dari pendeteksian dengan UV 366 nm hasil keterpisahan dan kecerahan pita yang dihasilkan ekstraksi sonikasi lebih baik dibanding ekstrak maserasi (Gambar 9 & 10).
Ekstrasi maserasi digunakan untuk mengekstraksi sampel yang relatif tidak tahan panas sehingga dapat menghindari
kerusakan komponen, kelemahan dari
ekstraksi maserasi ini adalah penggunaan
pelarut yang relatif banyak dan
membutuhkan waktu yang lama sekitar 72 jam (Meloan 1999). Berbeda halnya dengan ekstraksi sonikasi yang lebih efisien dari segi penggunaan pelarut dan waktu ekstraksi yang tidak lebih dari 30 menit. Teknik ekstraksi sonikasi ini mengandalkan energi
gelombang yang menyebabkan proses
kavitasi, yaitu suatu proses pembentukan gelembung-gelembung kecil akibat adanya transmisi gelombang ultrasonik. Ketika mengenai suatu larutan, energi ultrasonik menyebabkan timbulnya rongga akustik,
dengan struktur bergelembung yang
kemudian pecah. Proses tersebut membantu difusi pelarut ke dalam dinding sel tanaman (Ashley et al. 2001). ekstraksi dengan sonikasi dipilih untuk proses selanjutnya yaitu pemisahan komponen jahe merah dari berbagai daerah, karena lebih efisien dari segi pelarut, waktu, dan juga menghasilkan
keterpisahan yang lebih baik dibanding dari ekstraksi maserasi.
Gambar 10 Hasil pemisahan 20 variasi
ekstrasi sonikasi
menggunakan rancangan
central composite, dielusi
menggunakan fase gerak
optimum, dan dideteksi
dengan UV 366 nm.
Validasi Metode
Stabilitas Analat Selama Krmatografi
10
Gambar 11 Stabilitas analat selama
kromatografi dengan
deteksi UV 366 nm.
Stabilitas Analat pada Pelat dan dalam Larutan
Kestabilan analat pada pelat dan dalam larutan ini ditunjukkan pada Gambar 12. Metode untuk stabilitas analat pada pelat dan larutan dapat diterima karena tidak ada perbedaan jumlah pita pada analat 3 jam sebelum kromatografi dengan analat yang masih segar dan perbedaan Rf pada masing-masing larutan tidak lebih dari 0.05 (Lampiran 17).
a b c d e
Gambar 12 Stabilitas analat pada pelat
selama 3 jam sebelum
kromatografi (a), sampel segar diaplikasikan segera sebelum kromatografi (b dan c), sampel disiapkan selama 3 jam sebelum kromatografi (dalam larutan) (d), dan standar 6-gingerol (e) dengan visualisasi UV 366 nm.
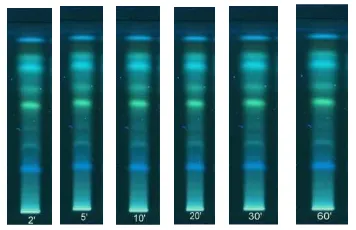
Stabilitas Visualisasi
Gambar 13 menunjukan bahwa Analat stabil karena tidak menunjukkan penurunan intensitas warna maupun perubahan secara signifikan selama selang waktu pengamatan yaitu salama menit ke-2, ke-5, ke-10, ke-20, ke-30, dan menit ke-60. Sehingga metode ini dapat diterima dan perbedaan Rf pada masing-masing larutan tidak lebih dari 0.05 (Lampiran 17).
Gambar 13 Stabilitas visualisasi deteksi UV 366 nm.
Keterulangan
Keterulangan ditunjukkan pada Gambar 14. Metode keterulangan dapat diterima karena tidak ada perbedaan jumlah, posisi, warna, dan intensitas pita pada tiga pelat berbeda, dan nilai Rf pada masing-masing pelat tidak lebih dari 0.05 (Lampiran 17).
a b c
Gambar 14 Keterulangan pada pelat ke-1 (a), pelat ke-2 (b), pelat ke-3 (c) deteksi dengan UV 366 nm.
Presisi Menengah
Validasi metode KLT untuk presisi menengah dapat diterima jika semua pola sidik jari (pita) pada ketiga pelat menunjukkan jumlah, posisi, warna, dan intensitas pita yang identik. Masing - masing pita pada pelat menunjukkan komponen yang sama, membentuk garis paralel dengan tidak adanya gangguan seperti membelok serta nilai Rf untuk masing – masing pita
pada ketiga pelat tidak berbeda lebih dari
0.05 (Lampiran 17). Gambar 15
11
diduga adanya perbedaan tingkat kejenuhan bejana kromatografi pada hari ke-1 dengan hari ke-2 dan ke-3, dan juga dipengaruhi faktor suhu dan kelembaban yang berbeda-beda pada masing-masing hari.
a b c
Gambar 15 Presisi menengah pada hari ke-1 (a), hari ke-2 (b), dan hari ke-3 (c) deteksi dengan UV 366 nm.
Ketangguhan
Gambar 16 menunjukkan bahwa pola kromatogram sidik jari (pita) pada jahe merah mengunakan Flat Bottom Chamber (a) maupun Twin Trough Chamber (b) menunjukkan pola kromatogram yang hampir sama dan perbedaan nilai Rf masing-masing pelat tidak lebih dari 0.05. metode untuk ketangguhan dapat diterima dan digunakan pada analisis rutin kendali mutu.
a b
Gambar 16 Pola Kromatogram jahe merah hasil pemisahan dengan Flat Bottom Chamber (a) dan Twin Trough Chamber (b) dengan deteksi UV 366 nm.
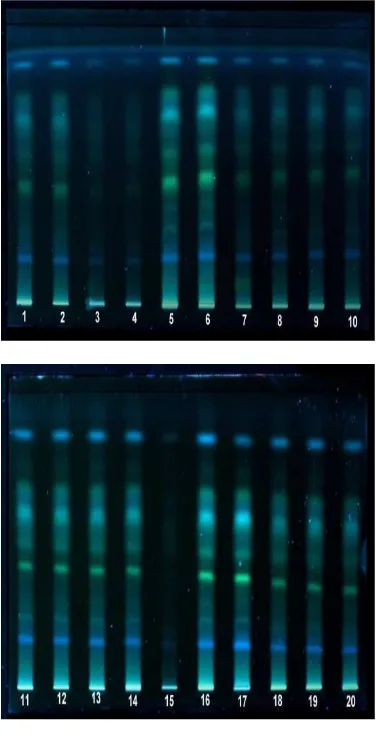
Pemisahan Komponen Jahe Merah dari Berbagai daerah
Setelah pemilihan fase gerak optimum, dan teknik ekstraksi sudah ditentukan, serta
validasi metode sudah dilakukan,
selanjutnya dilakukan pemisahan komponen jahe merah dari lokasi yang berbeda. Hasil pemisahannya dari lokasi yang berbeda
ditunjukkan seperti ditunjukkan pada Gambar 17.
(a)
(b)
Gambar 17 Hasil pemisahan komponen jahe merah dari berbagai daerah dan
standar 6-gingerol dengan
deteksi UV 366 nm (a) dan deteksi anisaldehida (b).
6-gingerol
6-gingerol
Standar JM10 JM11 JM12 JM13 JM14 JM15 JM16 JM17 JM18
Standar JM10 JM11 JM12 JM13 JM14 JM15 JM16 JM17 JM18 Standar JM1 JM2 JM3 JM4 JM5 JM6 JM7 JM8 JM9
12
Sampel jahe merah yang digunakan berasal dari 7 daerah yang berbeda, yaitu JM1 berasal dari Bogor, JM2, dan JM3 berasal dari Purwokerto, JM4, JM5, JM6, dan JM15 berasal dari Pacitan, JM7 dan JM8 dari Kulonprogo, JM9, JM10, dan JM11 dari Ponorogo, JM12, JM13, JM14, dan JM16 dari Wonogiri, sedangkan JM17 dan JM18 dari Semarang. Hasil pemisahan KLT jahe merah dari lokasi yang berbeda
ini menghasilkan pola sidik jari
(kromatogram) yang hampir mirip satu sama lain (Gambar 17).
Hasil pola sidik jari ini dibandingkan dengan senyawa penciri yaitu gingerol. 6-gingerol digunakan sebagai senyawa penciri karena senyawa ini merupakan komponen penyusun terbesar dari jahe. Hasil elusi menunjukkan hampir semua sampel jahe dari berbagai daerah ini memiliki senyawa 6-gingerol. Perbedaan hanya terdapat pada JM4, JM5 (pacitan) dan JM16 (Wonogiri) yang tidak memiliki senyawa 6-gingerol (Gambar 7). Perbedaan pola kromatogram ini diduga karena faktor perbedaan lokasi. Adanya perbedaan lokasi berkaitan dengan unsur hara yang dikandung dalam tanah. Setiap daerah memiliki kandungan unsur hara yang berbeda-beda, sehingga metabolit sekunder yang dihasilkan pun juga berbeda. Karena metabolit sekunder yang dihasilkan berbeda-beda maka pola kromatogram KLT yang dihasilkan juga dapat berbeda. Selain faktor perbedaan lokasi. Faktor iklim, curah hujan, dan intensitas cahaya matahari juga dapat mempengaruhi metabolit sekunder yang dihasilkan dari jahe merah tersebut (Okoh 2007).
JM6 memliki pola sidik jari
(kromatogram) yang berbeda dengan JM4 dan JM5 meskipun berasal dari daerah yang sama (Pacitan), hal ini mungkin disebabkan waktu tanam atau waktu panen yang berbeda. Waktu tanam dan waktu panen
juga dapat menyebabkan perbedaan
metabolit yang dihasilkan (Okoh 2007). Waktu panen yang terbaik pada jahe merah itu pada saat berumur 7 bulan, karena pada umur tersebut kandungan minyak atsiri dan oleoresinnya optimum (Nurliana 2007).
Spesifisitas
Pengujian spesifitas dilakukan dengan melakukan pemisahan komponen dari suatu
tanaman obat dengan cara
membandingkannya dengan senyawa
penciri. Pada peneltian ini komponen yang diuji yaitu dari jahe merah, jahe gajah, dan
jahe emprit, dan lengkuas. untuk
mengetahui ada tidaknya senyawa yang terdapat pada jahe, maka digunakan senyawa penciri untuk pembanding, yaitu 6-gingerol. Gambar 18 menunjukan bahwa senyawa 6-gingerol itu hanya terdapat pada sampel jahe merah, jahe gajah, dan jahe emprit dengan nilai Rf sebesar 0.24 (Lampiran 19). Sedangkan pada lengkuas tidak terdapat senyawa 6-gingerol. Lengkuas memiliki pola sidik jari kromatogram yang berbeda dari ketiga jenis jahe ini, sehingga ketika ada pemalsuan bahan baku jamu jahe langsung dapat terlihat perbedaannya dengan menggunakan KLT. Berbeda dengan Pola sidik jari kromatogram yang dihasilkan antara jahe merah, jahe gajah dan jahe emprit. Pola sidik jari yang dihasilkan
belum bisa dibedakan karena pola
kromatogram yang dihasilkan sama.
kemungkinan ketiga jenis jahe ini
mempunyai komponen kimia yang sama, dan yang membedakan hanya jumlah kandungannya saja. Perlu dilakukannya analisis lebih lanjut yaitu analisis kuantitatif dengan kromatografi cair kinerja tinggi (KCKT) atau kromatografi gas sehingga dapat terlihat jumlah kandungan komponen kimia yang berbeda dari ketiga jenis jahe tersebut.
Std JM JG JE LK std JM JG JE LK
(a) (b)
Gambar 18 Pola kromatogram standar (std), jahe merah (JM), jahe gajah (JG), jahe emprit (JE), dan lengkuas (LK) dengan deteksi UV 366 nm (a), dan deteksi anisaldehida (b).
SIMPULAN DAN SARAN
Simpulan
Pelarut yang terpilih sebagai penyusun fase gerak optimum adalah kloroform : etil asetat : n-heksana dengan perbandingan 1/6 : 1/6 : 2/3. Teknik ekstraksi terbaik untuk
12
Sampel jahe merah yang digunakan berasal dari 7 daerah yang berbeda, yaitu JM1 berasal dari Bogor, JM2, dan JM3 berasal dari Purwokerto, JM4, JM5, JM6, dan JM15 berasal dari Pacitan, JM7 dan JM8 dari Kulonprogo, JM9, JM10, dan JM11 dari Ponorogo, JM12, JM13, JM14, dan JM16 dari Wonogiri, sedangkan JM17 dan JM18 dari Semarang. Hasil pemisahan KLT jahe merah dari lokasi yang berbeda
ini menghasilkan pola sidik jari
(kromatogram) yang hampir mirip satu sama lain (Gambar 17).
Hasil pola sidik jari ini dibandingkan dengan senyawa penciri yaitu gingerol. 6-gingerol digunakan sebagai senyawa penciri karena senyawa ini merupakan komponen penyusun terbesar dari jahe. Hasil elusi menunjukkan hampir semua sampel jahe dari berbagai daerah ini memiliki senyawa 6-gingerol. Perbedaan hanya terdapat pada JM4, JM5 (pacitan) dan JM16 (Wonogiri) yang tidak memiliki senyawa 6-gingerol (Gambar 7). Perbedaan pola kromatogram ini diduga karena faktor perbedaan lokasi. Adanya perbedaan lokasi berkaitan dengan unsur hara yang dikandung dalam tanah. Setiap daerah memiliki kandungan unsur hara yang berbeda-beda, sehingga metabolit sekunder yang dihasilkan pun juga berbeda. Karena metabolit sekunder yang dihasilkan berbeda-beda maka pola kromatogram KLT yang dihasilkan juga dapat berbeda. Selain faktor perbedaan lokasi. Faktor iklim, curah hujan, dan intensitas cahaya matahari juga dapat mempengaruhi metabolit sekunder yang dihasilkan dari jahe merah tersebut (Okoh 2007).
JM6 memliki pola sidik jari
(kromatogram) yang berbeda dengan JM4 dan JM5 meskipun berasal dari daerah yang sama (Pacitan), hal ini mungkin disebabkan waktu tanam atau waktu panen yang berbeda. Waktu tanam dan waktu panen
juga dapat menyebabkan perbedaan
metabolit yang dihasilkan (Okoh 2007). Waktu panen yang terbaik pada jahe merah itu pada saat berumur 7 bulan, karena pada umur tersebut kandungan minyak atsiri dan oleoresinnya optimum (Nurliana 2007).
Spesifisitas
Pengujian spesifitas dilakukan dengan melakukan pemisahan komponen dari suatu
tanaman obat dengan cara
membandingkannya dengan senyawa
penciri. Pada peneltian ini komponen yang diuji yaitu dari jahe merah, jahe gajah, dan
jahe emprit, dan lengkuas. untuk
mengetahui ada tidaknya senyawa yang terdapat pada jahe, maka digunakan senyawa penciri untuk pembanding, yaitu 6-gingerol. Gambar 18 menunjukan bahwa senyawa 6-gingerol itu hanya terdapat pada sampel jahe merah, jahe gajah, dan jahe emprit dengan nilai Rf sebesar 0.24 (Lampiran 19). Sedangkan pada lengkuas tidak terdapat senyawa 6-gingerol. Lengkuas memiliki pola sidik jari kromatogram yang berbeda dari ketiga jenis jahe ini, sehingga ketika ada pemalsuan bahan baku jamu jahe langsung dapat terlihat perbedaannya dengan menggunakan KLT. Berbeda dengan Pola sidik jari kromatogram yang dihasilkan antara jahe merah, jahe gajah dan jahe emprit. Pola sidik jari yang dihasilkan
belum bisa dibedakan karena pola
kromatogram yang dihasilkan sama.
kemungkinan ketiga jenis jahe ini
mempunyai komponen kimia yang sama, dan yang membedakan hanya jumlah kandungannya saja. Perlu dilakukannya analisis lebih lanjut yaitu analisis kuantitatif dengan kromatografi cair kinerja tinggi (KCKT) atau kromatografi gas sehingga dapat terlihat jumlah kandungan komponen kimia yang berbeda dari ketiga jenis jahe tersebut.
Std JM JG JE LK std JM JG JE LK
(a) (b)
Gambar 18 Pola kromatogram standar (std), jahe merah (JM), jahe gajah (JG), jahe emprit (JE), dan lengkuas (LK) dengan deteksi UV 366 nm (a), dan deteksi anisaldehida (b).
SIMPULAN DAN SARAN
Simpulan
Pelarut yang terpilih sebagai penyusun fase gerak optimum adalah kloroform : etil asetat : n-heksana dengan perbandingan 1/6 : 1/6 : 2/3. Teknik ekstraksi terbaik untuk
13
mengisolasi komponen kimia pada jahe merah yaitu ekstraksi sonikasi pada saat bobot 1.5 g, volume pelarut 5 mL, dan waktu ekstraksi 15 menit. Hasil elusi pada jahe merah dari lokasi yang berbeda menunjukkan pola kromatogram yang mirip satu sama lain dan hampir semua sampel jahe merah memiliki senyawa 6-gingerol, dari 18 jahe merah (JM) yang diuji, hanya jahe JM4, JM5 (Pacitan), dan JM16 (Wonogiri) yang tidak memiliki senyawa 6-gingerol.
Saran
Sebaiknya titik optimum dijadikan titik tengah pada segitiga simplex centroid sehingga diharapkan titik optimum berada di bagian tengah bidang. Selain itu, faktor yang harus diperhatikan saat proses elusi yaitu tingkat kejenuhan bejana, suhu dan kelembaban laboratorium yang diusahakan setiap hari sama tingkat kestabilannya. Perlu dilakukan penelusuran senyawa dengan pemisahan KLT yang dihubungkan dengan waktu tanam atau waktu panen jahe yang berbeda.
DAFTAR PUSTAKA
[BPOM] Badan Pengawas Obat dan
Makanan RI. 2005. Monografi Ekstrak Tumbuhan Obat Indonesia Volume 1. Jakarta: BPOM RI.
Almeide AA, Scarminio IS. 2007.
Statistical mixture design of
optimization of extraction media and mobile phase compositions for the characterization of green tea. J Sep Sci 30: 414-420.
Anderson VL, McLean RA. 1974. Design of Experiments. New York: Marcel Dekker.
Ashley K, Andrews RN, Cavazosa L,
Demange M. 2001. Ultrasonic
extraction as a sample preparation technique for elemental analysis by atomic spectrometry. J Anal At Spectrom 16:1147-1153.
Borges et al. 2007. Mixture design for the
fingerprint optimization of
chromatographic mobile phases and extraction solutions for Camellia sinensis. Anal Chim Acta 595: 28-37.
Delaroza F, Scarminio IS. 2008. Mixture design optimization of extraction and mobile phase media for fingerprint analysis of Bauhinia variegate L. J Sep Sci 31: 1034-1041.
Fernand VE. 2003. Initial characterization of crude extracts from Phyllanthus amarus Schum. and Thonn. and Quassia amara L. using normal phase thin layer chromatography [tesis].
Lousiana: Program Pascasarjana,
University of Suriname.
Gritter RJ, JM Bobbitt, AE Schwarting. 1991. Pengantar Kromatografi. Ed
ke-2. Padmawinata K, penerjemah.
Bandung: Institut Teknologi Bandung.
Guzman CC, JS Siemonsma. 1999. Plant resources of South-East Asia, No.13, Spices. Prosea. Bogor
.
Harborne JB. 1987. Metode Fitokimia.
Padmawinata K, Soediro I,
penerjemah; Niksolihin S, editor. Bandung: Penerbit ITB. Terjemahan dari: Phytochemical Method.
Herlina R, Murhananto J, Endah, Listiyani & ST Pribadi. 2002. Khasiat Manfaat Jahe Merah Si Rimpang Ajaib. Agro Media Pustaka: Jakarta.
Kikuzaki H, Nakatani N. 1993. Antioxidant effects of some ginger constituents. Journal of Food Sci 58: 1407-1410.
Kimura M, Fujimura M, Yoshida M, Takeshi T, Naoko TA. 2008. An easy
method to identify
8-keto-15-hidroxytrichothecenes by thin layer chromatography. Mycotoxins 58:115-117.
Koswara S. 1995. Jahe dan Hasil
Olahannya. Pustaka Sinar Harapan. Jakarta.
Koll et al. 2003. Validation of standardized
high-performance thin-layer
chromatographic methods for quality control and stability testing of herbals. Journal of AOAC International 86: 909-915.
POLA SIDIK JARI KROMATOGRAM KLT UNTUK
IDENTIFIKASI KERAGAMAN KUALITAS
JAHE MERAH
HAIRUL ANWAR
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITIT PERTANIAN BOGOR
13
mengisolasi komponen kimia pada jahe merah yaitu ekstraksi sonikasi pada saat bobot 1.5 g, volume pelarut 5 mL, dan waktu ekstraksi 15 menit. Hasil elusi pada jahe merah dari lokasi yang berbeda menunjukkan pola kromatogram yang mirip satu sama lain dan hampir semua sampel jahe merah memiliki senyawa 6-gingerol, dari 18 jahe merah (JM) yang diuji, hanya jahe JM4, JM5 (Pacitan), dan JM16 (Wonogiri) yang tidak memiliki senyawa 6-gingerol.
Saran
Sebaiknya titik optimum dijadikan titik tengah pada segitiga simplex centroid sehingga diharapkan titik optimum berada di bagian tengah bidang. Selain itu, faktor yang harus diperhatikan saat proses elusi yaitu tingkat kejenuhan bejana, suhu dan kelembaban laboratorium yang diusahakan setiap hari sama tingkat kestabilannya. Perlu dilakukan penelusuran senyawa dengan pemisahan KLT yang dihubungkan dengan waktu tanam atau waktu panen jahe yang berbeda.
DAFTAR PUSTAKA
[BPOM] Badan Pengawas Obat dan
Makanan RI. 2005. Monografi Ekstrak Tumbuhan Obat Indonesia Volume 1. Jakarta: BPOM RI.
Almeide AA, Scarminio IS. 2007.
Statistical mixture design of
optimization of extraction media and mobile phase compositions for the characterization of green tea. J Sep Sci 30: 414-420.
Anderson VL, McLean RA. 1974. Design of Experiments. New York: Marcel Dekker.
Ashley K, Andrews RN, Cavazosa L,
Demange M. 2001. Ultrasonic
extraction as a sample preparation technique for elemental analysis by atomic spectrometry. J Anal At Spectrom 16:1147-1153.
Borges et al. 2007. Mixture design for the
fingerprint optimization of
chromatographic mobile phases and extraction solutions for Camellia sinensis. Anal Chim Acta 595: 28-37.
Delaroza F, Scarminio IS. 2008. Mixture design optimization of extraction and mobile phase media for fingerprint analysis of Bauhinia variegate L. J Sep Sci 31: 1034-1041.
Fernand VE. 2003. Initial characterization of crude extracts from Phyllanthus amarus Schum. and Thonn. and Quassia amara L. using normal phase thin layer chromatography [tesis].
Lousiana: Program Pascasarjana,
University of Suriname.
Gritter RJ, JM Bobbitt, AE Schwarting. 1991. Pengantar Kromatografi. Ed
ke-2. Padmawinata K, penerjemah.
Bandung: Institut Teknologi Bandung.
Guzman CC, JS Siemonsma. 1999. Plant resources of South-East Asia, No.13, Spices. Prosea. Bogor
.
Harborne JB. 1987. Metode Fitokimia.
Padmawinata K, Soediro I,
penerjemah; Niksolihin S, editor. Bandung: Penerbit ITB. Terjemahan dari: Phytochemical Method.
Herlina R, Murhananto J, Endah, Listiyani & ST Pribadi. 2002. Khasiat Manfaat Jahe Merah Si Rimpang Ajaib. Agro Media Pustaka: Jakarta.
Kikuzaki H, Nakatani N. 1993. Antioxidant effects of some ginger constituents. Journal of Food Sci 58: 1407-1410.
Kimura M, Fujimura M, Yoshida M, Takeshi T, Naoko TA. 2008. An easy
method to identify
8-keto-15-hidroxytrichothecenes by thin layer chromatography. Mycotoxins 58:115-117.
Koswara S. 1995. Jahe dan Hasil
Olahannya. Pustaka Sinar Harapan. Jakarta.
Koll et al. 2003. Validation of standardized
high-performance thin-layer
chromatographic methods for quality control and stability testing of herbals. Journal of AOAC International 86: 909-915.
14
zingiber officinale and synthesis of its analogues for recognition of effective antioxidant and antithyrosinase agents. Arch Pharm Res 28:518-528.
Liang et al. 2004. Quality control of herbal medicines. Journal of Chromatography B 812: 53–70.
Melecchi et al. 2006. Optimization of the sonication extraction method of Hibiscus tiliaceus L. flowers. Ultrasonics Sonochemistry 13: 242-250.
Meloan CE. 1999. Chemical Separation. New York: J Willey.
Montgomery DC. 2005. Design and
Analysis of Experiments. Ed ke-5. New York: John Willey & sons.
Muhlisah F. 1999. Temu-temuan dan
Empon-Empon, Budi Daya dan Manfaatnya. Yogyakarta: Penerbit Kanisius.
Nurliana D, Bambang C, Rini BH. 2007. Analisis kuantitatif dan kualitatif minyak atsiri dari rimpang jahe merah (Zingiber officinale var. Rubrum)
dengan variasi waktu panen.
Procceding seminar nasional, Jurusan Kima, Fakultas Matematika dan Ilmu Pengetahuan Alam–UNDIP Semarang.
Nursal, Wulandari S, Wilda SJ. 2006. Bioaktivitas ekstrak jahe (Zingiber officinale Roxb.) dalam menghambat
pertumbuhan koloni bakteri
Escherichia coli dan Bacillus subtilis. J Biogenesis 2: 64-66.
Nutan. 2004. Starch acetate as a film forming excipient in controlled drug delivery [disertasi]. Texas: Program
Pascasarjana, University Health
Science Center.
Nyiredy Sz. 2002. Planar chromatographic method development using the prisma optimization system and flow charts. J Chromatogr Sci 40: 1-10.
Okoh O, AA Sadimenko, AJ Afolayan. 2007. The effects of age on the yield and composition of the essential oil
of Calendula officinalis. Journal of Applied Sciences 7: 3806-3810
Paimin FB, Murhananto. 1991. Budidaya, Pengolahan, Perdagangan Jahe. Edisi Revisi. Penebar Swadaya.
Reich E, Schibli A. 2008. Validation of
high-performance thin layer
chromatographic methods for the identification of botanicals in a cGMP
environment. Journal of AOAC
International 91: 13-19.
Santosa CM, Hertiani T. 2005. Kandungan senyawa kimia dan efek ekstrak daun bangun-bangun (Coleus ambonicus, L.) pada aktivitas fagositosis netrofil tikus putih (Rattus nervogicus). Majalah Farmasi Indonesia 16: 141-148.
Sastroamidjojo AS.1997. Obat Asli
Indonesia. Dian Rakyat: Jakarta.
Septiana AT, Deddy M, Fransiska RZ. 2002.
Aktivitas antioksidan ekstrak
diklorometana dan air jahe (Zingiber officinale Rosc.) pada asam linoleat. J Teknologi dan Industri Pangan 2: 105-110.
Sidik. 1997. Acuan Sedian Herbal. Yogyakarta: Penerbit UGM.
Stahl E. 1985. Analisis Obat Secara Kromatografi dan Mikroskopi. Padmawinata K, penerjemah. Bandung:
Institut Teknologi Bandung.
Terjemahan dari: Drug Analysis by Chromatography.
Stoenoiu CE. Bolboaca AD, Jantschi L. 2006. Mobile phase optimization for steroid separation. Medical Informatics 18: 17-24.
Suharyono, Rozak, A. 1997. Masalah dan Peluang Pengembangan Tanaman Jahe Spesifik Lokasi di Propinsi Bengkulu. IPPTP Bengkulu.
Tim Lentera. 2004. Khasiat dan Manfaat Jahe Merah si Rimpang Ajaib. Jakarta: Agromedia Pustaka.
15
determination of phyllanthin and hypophyllanthin in phyllantus species by high performance thin layer chromatography. Phytochem Anal 17: 394-397.
Wijayakusuma H. 2006. Atasi Asam Urat dan Rematik Ala Hembing. Jakarta: Puspa Swara.
Yitnosumarto S. 1993. Percobaan
Perancangan, Analisis dan Interpretasinya. Jakarta: Gramedia Pustaka Utama.
Zakaria FR, Hari S, Arif H. 2000. Pengaruh konsumsi jahe (Zingiber officinale Roscoe) terhadap kadar malonaldehida dan vitamin E plasma pada mahasiswa Pesantren Ulil Albab Kedung Badak Bogor. J Teknologi dan Industri Pangan 11:36-40.
Zhang et al. 2007. Central composite experiment design applied to the catalytic aromatization of isophorone to 3,5-xylenol. Chemometrics and Intelligent Laboratory Systems 89: 45– 50.
POLA SIDIK JARI KROMATOGRAM KLT UNTUK
IDENTIFIKASI KERAGAMAN KUALITAS
JAHE MERAH
HAIRUL ANWAR
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITIT PERTANIAN BOGOR
POLA SIDIK JARI KROMATOGRAM KLT UNTUK
IDENTIFIKASI KERAGAMAN KUALITAS
JAHE MERAH
HAIRUL ANWAR
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITIT PERTANIAN BOGOR
Judul Skripsi : Pola Sidik Jari Kromatogram KLT untuk Identifikasi Keragaman
Kualitas Jahe Merah
Nama
: Hairul Anwar
NIM
: G84050511
Disetujui
Komisi Pembimbing
Prof. Dr. drh.Maria Bintang, MS. Drs. Edy Djauhari Purwakusumah MS.
Ketua
Anggota
Diketahui
Dr. Ir. I Made Artika, M.App. Sc
Ketua Departemen Biokimia
PRAKATA
Alhamdulillah, puji dan syukur penulis panjat