POTENSI ENZIM
-GALAKTOSIDASE DARI
Lactobacillus
plantarum
STRAIN B123
INDIGENOUS
UNTUK HIDROLISIS LAKTOSA PADA SUSU
UHT
NENY MARIYANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Potensi Enzim -Galaktosidase dari Lactobacillus plantarum Strain B123 Indigenous untuk Hidrolisis Laktosa pada Susu UHT adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Penelitian ini didanai oleh Proyek Peningkatan Kemampuan Peneliti dan Perekayasa (PKPP), Pusat Penelitian Biologi, LIPI, Tahun 2012, beserta Program Bantuan dari Program Diploma IPB, Tahun 2013. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
NENY MARIYANI. Potensi Enzim -Galaktosidase dari Lactobacillus plantarum Strain B123 indigenous untuk Hidrolisis Laktosa pada Susu UHT. Dibimbing oleh HANIFAH NURYANI LIOE, TATIK KHUSNIATI, dan DIDAH NUR FARIDAH.
Konsentrasi laktosa dalam susu cair rata-rata 4.6% b/b (Walstra 2006). Konsentrasi laktosa yang lebih rendah dari 1% b/b di produk akhir masih dapat diterima oleh penderita lactose intolerance (Tuure dan Corpella 2004). Hidrolisis laktosa secara enzimatik merupakan proses bioteknologi yang penting di industri susu dengan beberapa keuntungan diantaranya mengurangi laktosa pada susu untuk penderita lactose intolerance, mencegah kristalisasi laktosa dan dapat meningkatkan kemanisan produk akhir (Jurado et al. 2002).
Enzim -galaktosidase dapat dihasilkan diantaranya oleh bakteri asam laktat. Dalam penelitian ini -galaktosidase dihasilkan dari Lactobacillus plantarum strain B123 indigenous yang diisolasi dari makanan fermentasi sayuran yang diharapkan dapat meningkatkan potensi lokal dalam memberikan nilai tambah pada produk susu cair yakni susu UHT rendah laktosa. Di Indonesia susu UHT rendah laktosa ini belum ada di pasaran.
Penelitian ini bertujuan untuk: (1) menentukan kondisi pertumbuhan Lb. plantarum strain B123 indigenous untuk memproduksi β-galaktosidase (2) menentukan kondisi produksi β-galaktosidase dari Lb. plantarum strain B123 indigenous melalui purifikasi parsial dan (3) menentukan potensi β-galaktosidase dari Lb. plantarum strain B123 indigenous untuk menghidrolisis laktosa secara batch pada susu UHT berlemak (total lemak 3.5% b/v) dan rendah lemak (total lemak 1.0% b/v).
Hasil penelitian menunjukkan kondisi terbaik bagi pertumbuhan Lb. plantarum strain B123 indigenous untuk menghasilkan β-galaktosidase dengan aktivitas tertinggi adalah pada jumlah inokulum 2%, kandungan laktosa 1%, pH medium 8, waktu inkubasi 24 jam dan suhu 37C. Karakteristik suhu dan pH optimum untuk aktivitas -galaktosidase dalam menghidrolisis substrat oNPG adalah 50C dan pH 6.5. Aktivitas spesifik β-galaktosidase mengalami peningkatan selama purifikasi parsial, yakni 15.05 U/mg pada enzim kasar menjadi 109.58 U/mg pada enzim hasil dialisis (hasil produksi ke-1) dan dari 87.09 U/mg pada enzim kasar menjadi 169.98 U/mg pada enzim hasil dialisis (hasil produksi ke-2).
-Galaktosidase hasil purifikasi parsial dari Lb. plantarum strain B123 indigenous sebanyak 7.2 U/mL susu selama 9 jam pada suhu 50°C berpotensi menurunkan laktosa pada susu UHT berlemak sebanyak 60.0% (konsentrasi laktosa dari 3.82% b/v menjadi 1.52% b/v) dan pada susu UHT rendah lemak sebanyak 81.1% (konsentrasi laktosa dari 4.44% b/v menjadi 0.84% b/v). Konsentrasi enzim, waktu hidrolisis dan kandungan lemak pada susu UHT berpengaruh secara signifikan terhadap laktosa yang terhidrolisis (p<0.05). Pengukuran konsentrasi glukosa pada susu UHT berlemak menggunakan kit GOD-POD berkorelasi positif dengan HPLC dengan nilai r = 0.923.
SUMMARY
NENY MARIYANI. The Potential of -Galactosidase Enzyme from Indigenous Lactobacillus plantarum B123 Strain for Lactose Hydrolysis of UHT Milk. Supervised by HANIFAH NURYANI LIOE, TATIK KHUSNIATI, and DIDAH NUR FARIDAH.
Lactose concentration in milk is 4.6% (w/w) in average (Walstra 2006). The content of lactose with less than 1% (w/w) of final product is acceptable for people with lactose intolerance problem (Tuure and Corpela 2004). Enzymatic hydrolysis of lactose is one of the important biotechnological processes in the milk industry because of some beneficial effects including the elimination of lactose in milk for people with lactose intolerance, prevention of lactose crystallization and contribution to the product sweetness (Jurado et al, 2002).
-Galactosidase enzyme can be produced by lactic acid bacteria. In this study, indigenous Lactobacillus plantarum strain B123 was isolated from Indonesian traditional fermented vegetable product. The use of this local potential strain was to increase its role to the added value products such as low lactose UHT milk. Even though low lactose UHT milk product has not been commercially marketed yet in Indonesia, however the need of low lactose milk for people with lactose intolerance was already present.
This research was aimed to: (1) determine the growth condition of indigenous Lb. plantarum strain B123 to produce β-galactosidase (2) determine the production condition of -galactosidase from Lb. plantarum B123 strain with partial purification and (3) determine the potential of β-galactosidase from indigenous Lb. plantarum B123 strain to hydrolyze lactose of full cream and low fat-UHT milks, containing total fat 3.5 and 1.0% (w/v) respectively, in batch process.
The result showed that the growth condition of indigenous Lb. plantarum B123 in MRSB to produce β-galactosidase were 2% inoculum, 1% of lactose, medium pH 8, and 24 h incubation time at 37°C. The enzyme showed an optimum activity to hydrolyzed oNPG substrate at pH 6.5 and temperature 50°C . Specific activity of -galactosidase has increased during the partial purification given 15.05 U/mg in crude enzyme to 109.58 U/mg in dialysed enzyme (at first production) and 87.09 U/mg in crude enzyme to 109.58 U/mg in dialysed enzyme (at second production).
Lactose in full cream-UHT milk was hydrolyzed at a maximum rate of 60.0% (lactose concentration from 3.82% w/v to 1.52% w/v) and in low fat-UHT milk 81.1% (lactose concentration from 4.44% w/v to 0.84% w/v) by 7.2 U β -galactosidase/mL milk for 9 h at 50°C. Enzyme concentration, hydrolysis time and total fat concentration had a significant influence on the hydrolysis of lactose in UHT milk (p<0.05). According to the different analytical methods to monitor the lactose hydrolysis, a correlation between the results of glucose concentrations in full cream-UHT milk analyzed by GOD-POD kit and HPLC was observed. There was a positive correlation between analysis of glucose concentrations in full cream-UHT milk with GOD-POD kit and HPLC (r = 0.923).
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
POTENSI ENZIM
-GALAKTOSIDASE DARI
Lactobacillus
plantarum
STRAIN B123
INDIGENOUS
UNTUK HIDROLISIS LAKTOSA PADA SUSU
UHT
NENY MARIYANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis Potensi Enzim セMg。ャ。ォエッウゥ、。ウ・@ dari Lactobacillus plantarum
Strain B 123 Indigenous untuk Hidrolisis Laktosa pada Susu
UHT
Nama Neny Mariyani
NIM F251110381
Disetujui oleh Komisi Pembimbing
Dr Ir Hanifah Nuryani Lioe, MSi Ketua
;;fiJC,
Dr Ir Tatik Khusniati, MAppSc Dr Didah Nur Faridah, STP, MSi
Anggota Anggota
Diketahui oleh
Ketua Program Studi Ilmu Pangan
Dr Ir Ratih Dewanti Hariyadi, MSc
Tanggal Ujian:
08
JUL
2013
Tanggal Lulus:Judul Tesis : Potensi Enzim -Galaktosidase dari Lactobacillus plantarum Strain B123 Indigenous untuk Hidrolisis Laktosa pada Susu UHT
Nama : Neny Mariyani
NIM : F251110381
Disetujui oleh Komisi Pembimbing
Dr Ir Hanifah Nuryani Lioe, MSi Ketua
Dr Ir Tatik Khusniati, MAppSc Dr Didah Nur Faridah, STP, MSi Anggota Anggota
Diketahui oleh
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Dr Ir Ratih Dewanti Hariyadi, MSc Dr Ir Dahrul Syah, MScAgr
PRAKATA
Alhamdulillahi robbil aalamiin, puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah yang berjudul “Potensi Enzim -Galaktosidase dari Lactobacillus plantarum Strain B123 Indigenous untuk Hidrolisis Laktosa pada Susu UHT” ini berhasil diselesaikan. Karya ilmiah ini disusun dalam rangka menyelesaikan studi pada Program Studi Ilmu Pangan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih dan penghargaan sebesar-besarnya kepada Ibu Dr Ir Hanifah Nuryani Lioe, MSi sebagai ketua komisi pembimbing, Ibu Dr Ir Tatik Khusniati, MAppSc dan Ibu Dr Didah Nur Faridah, STP, MSi selaku anggota komisi pembimbing yang telah memberikan arahan, bimbingan dan support yang luar biasa sehingga penulis dapat menyelesaikan penelitian dan tesis ini dengan sebaik-baiknya. Penulis juga mengucapkan terima kasih kepada Ibu Prof Dr Ir Sedarnawati Yasni, MAgr yang telah bersedia menjadi penguji luar komisi dan Ibu Dr Ir Endang Prangdimurti, MSi sebagai penguji dari Program Studi, terima kasih atas saran dan masukan yang telah diberikan.
Penulis mengucapkan terima kasih kepada Proyek Peningkatan dan Kemampuan Peneliti dan Perekayasa (PKPP), LIPI dan Program Diploma IPB yang telah memberikan dana bagi berjalannya penelitian ini. Terima kasih penulis ucapkan juga kepada tim dari Laboratorium Biokimia Mikroba, Bidang Mikrobiologi, Pusat Penelitian Biologi LIPI, Cibinong: Bapak Abdul Choliq, SPd Ibu Sulistiani, MKes, dan Teh Neneng Karimayati, AMdAL, dan lain-lain atas segala bantuan dan dukungan selama penulis melakukan penelitian di sana. Penghargaan penulis sampaikan juga Mbak Ririn Anggraeni atas bantuannya selama penulis melakukan penelitian di laboratorium LDITP. Penulis mengucapkan terima kasih kepada tim dosen program keahlian Supervisor Jaminan Mutu Pangan, Program Diploma IPB; Bu Nurwitri, Bu Dwi, Bu Wien, Bu Dewi, Bu Lucky, Bu Rina, Bu Mira dan dosen-dosen lainnya yang telah memberikan support kepada penulis selama melakukan penelitian.
Terima kasih penulis ucapkan juga kepada Pak Taufik, Mba Arie dan Teh Yayam atas bantuannya selama ini, dan teman-teman seperjuangan Ria, Becky, Sanny, Santi, Maya, Gina dan lain-lain, crew laboratorium mikrobiologi-kimia SEAFAST-PAU Nadia, Fenny dan lain-lain, serta teman-teman IPN 2011 lainnya yang tidak dapat penulis sebutkan satu persatu, terima kasih atas support, semangat dan kebersamaan yang terjalin selama ini.
Ungkapan terima kasih juga disampaikan kepada suami dan anak-anakku tercinta Naila Hayfa Shakira dan Ghania Fayyaza Safwa, Mamah, Bapak, serta seluruh keluarga, atas segala doa, dukungan dan kasih sayangnya. Akhirnya kepada semua pihak yang telah membantu dan memberi dukungan yang tidak dapat penulis sebutkan satu persatu, penulis ucapkan terima kasih.
Penulis menyadari, tesis ini masih jauh dari kesempurnaan. Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xiv
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN xv
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 3
2 TINJAUAN PUSTAKA 3
Susu 3
Susu UHT 5
Susu UHT Rendah Laktosa 7
Enzim -Galaktosidase (-D-Galactoside galactohydrolase, EC:3.2.1.23) 8 Bakteri Asam Laktat Penghasil Enzim -Galaktosidase 9
Lactobacillus plantarum 11
3 METODE 11
Waktu dan Tempat Penelitian 11
Alat 12
Prosedur Percobaan 13
Analisis Data 19
4 HASIL DAN PEMBAHASAN 20
Penentuan Kondisi Pertumbuhan Lactobacillusplantarum Strain B123
Indigenous 20
Produksi β-Galaktosidase dari Lactobacillus plantarum Strain B123
Indigenous dengan Purifikasi Parsial 24
Aplikasi β-Galaktosidase untuk Hidrolisis Laktosa pada Susu UHT 29
5 SIMPULAN DAN SARAN 39
Simpulan 39
Saran 40
DAFTAR PUSTAKA 40
DAFTAR TABEL
1 Komposisi rata-rata dan kisaran normal susu sapi 3 2 Komposisi proksimat (%b/v) pada susu sapi, susu manusia, susu
kambing dan susu domba 4
3 Perkiraan komposisi susu cair 4
4 Komposisi kimia beberapa jenis susu dan produk susu cair 6 5 Studi hidrolisis laktosa oleh -galaktosidase pada susu cair 7 6 Beberapa bakteri Lactobacillus yang tergolong homofermentatif obligat,
dan heterofermentatif fakultatif dan obligat 10
7 Tahapan purifikasi parsial β-galaktosidase dari Lb. plantarum strain
B123 indigenous (Tahap produksi ke-1) 26
8 Studi produksi -galaktosidase dari beberapa mikroba 27 9 Karakteristik fisik β-galaktosidase dari beberapa sumber mikroba 31 10 Tahapan purifikasi parsial β-galaktosidase dari Lb. plantarum strain
B123 indigenous(Tahap produksi ke-2) 32
DAFTAR GAMBAR
1 Proses pembuatan susu sterilisasi UHT (pemanasan langsung dan tidak langsung dengan pengemasan aseptik (Walstra et al. 2006) 5 2 Struktur kimia -laktosa (Walstra et al. 2006) 8
3 Diagram alir tahapan penelitian 13
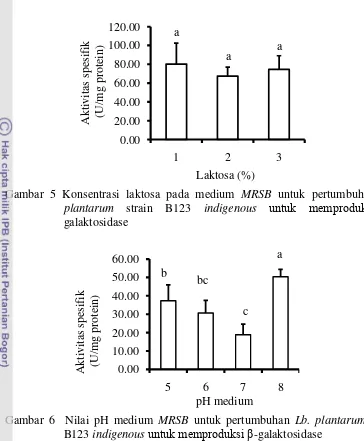
4 Jumlah inokulum yang diperlukan bagi pertumbuhan Lb. plantarum strain B123 indigenousuntuk memproduksi β-galaktosidase 20 5 Konsentrasi laktosa pada medium MRSB untuk pertumbuhan Lb.
plantarum strain B123 indigenousuntuk memproduksi β-galaktosidase 21 6 Nilai pH medium MRSB untuk pertumbuhan Lb.plantarum strain B123
indigenousuntuk memproduksi β-galaktosidase 21
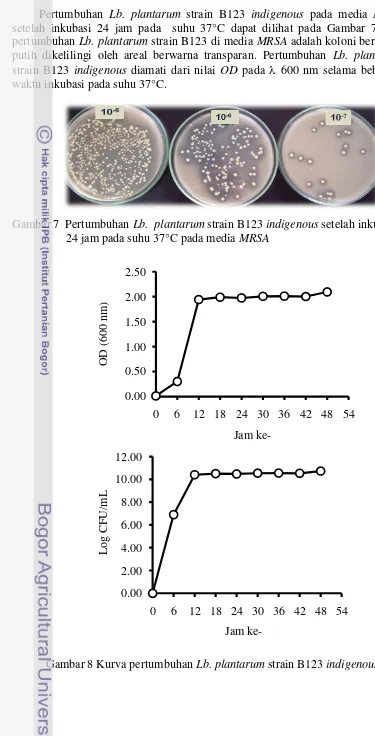
7 Pertumbuhan Lb. plantarum strain B123 indigenous setelah inkubasi
24 jam pada suhu 37°C pada media MRSA 22
8 Kurva pertumbuhan Lb. plantarum strain B123 indigenous 22 9 Kurva produksi β-galaktosidase dari Lb. plantarum strain B123
indigenous 23
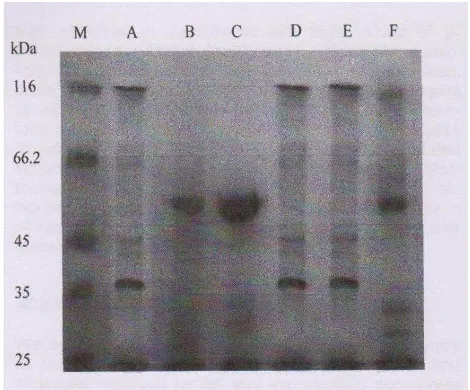
10 Pita protein dari strain Lactobacillus dengan SDS-PAGE . Pita protein dengan BM 116 kDa dimiliki oleh Lb. delbrueckii subsp. bulgaricus (A), Lb. delbrueckii subsp lactis (D), Lb. casei subsp. casei (E) mengandung β-galaktosidase tertinggi; molecular weight marker dari β-galaktosidase
(M) (Gheytanchi et al. 2010) 25
11 Pengendapan crude enzyme β-galaktosidase dari Lb. plantarum strain
B123 indigenous dengan ammonium sulfat 25
12 Aktivitas β-galaktosidase dari Lb. splantarum strain B123 indigenous
pada berbagai pH 27
13 Aktivitas β-galaktosidase dari Lb. splantarum strain B123 indigenous
DAFTAR GAMBAR (Lanjutan)
14 Stabilitas crude enzymeβ-galaktosidase dari Lb. plantarum strain B123 indigenous yang diinkubasi selama 1 jam pada berbagai pH 28 15 Stabilitas crude enzyme β-galaktosidase dari Lb. plantarum strain B123
indigenous yang diinkubasi selama 1 jam pada berbagai suhu 29 16 Kenaikan glukosa (a) dan penurunan laktosa yang tidak terhidrolisis (b)
pada susu UHT berlemak dengan penambahan 4.8 U β- galaktosidase/
mL susu (analisis menggunakan kit GOD-POD) 30
17 Mekanisme retaining hidrolisis ikatan glikosidik secara enzimatik
(Kosland 1953 dalam David dan Bernard 1995) 31
18 Kromatogram laktosa (1), glukosa (2) dan galaktosa (3) pada susu UHT berlemak menggunakan HPLC dengan detektor RI. Kontrol (a), penambahan enzim 4.8 U/mL susu (b), 7.2 U/mL susu (c), waktu proses pada suhu 50°C: 1 jam (i), 3 jam (ii), 5 jam (iii), 7 jam (iv) dan 9 jam (v) 34 19 Kromatogram laktosa (1), glukosa (2) dan galaktosa (3) pada susu UHT
rendah lemak menggunakan HPLC dengan detektor RI. Kontrol (a), penambahan enzim 4.8 U/mL susu (b), 7.2 U/mL susu (c), waktu proses pada suhu 50°C: 1 jam (i), 3 jam (ii), 5 jam (iii), 7 jam (iv) dan 9 jam (v) 35 20 Konsentrasi laktosa, glukosa, dan galaktosa pada susu UHT berlemak
sebelum dan setelah dihidrolisis laktosanya oleh β-galaktosidase pada suhu 50°C dengan konsentrasi enzim: 4.8 U/mL susu (a), 7.2 U/mL
susu (b) 36
21 Konsentrasi laktosa, glukosa, dan galaktosa pada susu UHT rendah lemak sebelum dan setelah dihidrolisis laktosanya oleh β-galaktosidase pada suhu 50°C dengan konsentrasi enzim: 4.8 U/mL susu (a), 7.2
U/mL susu (b) 37
22 Laktosa terhidrolisis pada susu UHT berlemak (a) dan rendah lemak (b) dengan penambahan β-galaktosidase dari Lb. plantarum strain B123
indigenous 38
DAFTAR LAMPIRAN
1 SNI No. 3141:2011 tentang syarat mutu susu segar 43 2 SNI No. 01-3950-1998 tentang syarat mutu susu UHT 44 3 Kurva standar oNP dalam analisis aktivitas -galaktosidase dengan
metode Lu et al. modifikasi (2009) 45
4 Kurva standar protein 1 dalam analisis protein dengan metode Bradford (1976) dan penggunaan larutan standar bovine serum albumin (BSA) 46 5 Kurva standar protein 2 dalam analisis protein dengan metode Bradford
(1976) dan penggunaan larutan standar bovine serum albumin (BSA) 46 6 Perhitungan aktivitas -galaktosidase yang diukur dengan metode Lu et
al. modifikasi (2009) 47
7 Jumlah inokulum yang diperlukan bagi pertumbuhan Lb.plantarum
DAFTAR LAMPIRAN (Lanjutan)
8 Konsentrasi laktosa pada medium MRSB untuk pertumbuhan Lb.
plantarum strain B123 indigenous untuk memproduksi -galaktosidase 49 9 Nilai pH medium MRSB untuk pertumbuhan Lb.plantarum strain B123
indigenous untuk memproduksi -galaktosidase 50
10 Kurva standar pertumbuhan Lb.plantarum strain B123 indigenous 51 11 Optical density pada pertumbuhan Lb. plantarum strainB123
indigenous 52
12 Produksi -galaktosidase dari Lb. plantarum strain B123 indigenous 53 13 Hasil pengendapan -galaktosidase dengan ammonium sulfat 54 14 Aktivitas crude enzymeβ-galaktosidase dari Lb. plantarum strain B123
indigenous pada berbagai pH 55
15 Aktivitas β-galaktosidase hasil dialisis dari Lb. plantarum strain B123
indigenous pada berbagai pH 56
16 Aktivitas crude enzymeβ-galaktosidase dari Lb. plantarum strain B123
indigenous pada berbagai suhu 57
17 Aktivitas β-galaktosidase hasil dialisis dari Lb. plantarum strain B123
indigenous pada berbagai suhu 58
18 Stabilitas crude enzymeβ-galaktosidase dari Lb. plantarum strainB123
indigenous pada berbagai pH 59
19 Stabilitas crude enzymeβ-galaktosidase dari Lb. plantarum strainB123
indigenous pada berbagai suhu 60
20 Rekapitulasi hasil purifikasi parsial -galaktosidase dari Lb. plantarum
strainB123 indigenous 61
21 Hasil analisis glukosa dari hasil hidrolisis laktosa dengan -galaktosidase
yang diukur dengan kit enzimatik GOD-POD 62
22 Kurva standar laktosa, glukosa dan galaktosa (analisis dengan HPLC) 63 23 Hasil analisis HPLC pada susu UHT berlemak 64 24 Hasil analisis HPLC pada susu UHT rendah lemak 65 25 Rekapitulasi konsentrasi laktosa, glukosa dan galaktosa serta laktosa
terhidrolisis pada susu UHT berlemak 66
26 Rekapitulasi konsentrasi laktosa, glukosa dan galaktosa serta laktosa
terhidrolisis pada susu UHT rendah lemak 67
27 Korelasi pengukuran konsentrasi glukosa pada susu UHT berlemak antara hasil hidrolisis laktosa dengan penambahan -galaktosidase 4.8 U/mL susu yang diukur dengan kit kt enzimatik GOD-POD dengan
HPLC 68
28 Hasil uji sidik ragam untuk jumlah inokulum yang diperlukan bagi
pertumbuhan Lb.plantarum strain B123 indigenous 69 29 Hasil uji sidik ragam untuk konsentrasi laktosa pada medium MRSB
untuk pertumbuhan Lb.plantarum strain B123 indigenous 69 30 Hasil uji sidik ragam untuk nilai pH medium MRSB untuk pertumbuhan
Lb.plantarum strain B123 indigenous 70
DAFTAR LAMPIRAN (Lanjutan)
32 Hasil uji sidik ragam kurva produksi dalam satuan aktivitas spesifik
(U/mg protein) 72
33 Hasil uji sidik ragam pengendapan dengan ammonium sulfat 73 34 Hasil uji sidik ragam aktivitas crude enzymeβ-galaktosidase pada
berbagai pH 74
35 Hasil uji sidik ragam aktivitas β-galaktosidase hasil dialisis pada
berbagai pH 75
36 Hasil uji sidik ragam aktivitas crude enzymeβ-galaktosidase pada
berbagai suhu 76
37 Hasil uji sidik ragam aktivitas β-galaktosidase hasil dialisis pada
berbagai suhu 77
38 Hasil uji sidik ragam stabilitas crude enzymeβ-galaktosidase pada
berbagai pH 78
39 Hasil uji sidik ragam stabilitas crude enzymeβ-galaktosidase pada
berbagai suhu 79
40 Hasil uji sidik ragam laktosa terhidrolisis pada susu UHT berlemak 80 41 Hasil uji sidik ragam laktosa terhidrolisis pada susu UHT rendah lemak 81 42 Hasil uji sidik ragam hidrolisis laktosa pada susu UHT (berlemak dan
rendah lemak) 82
43 Hasil uji sidik ragam konsentrasi laktosa, glukosa, dan galaktosa pada susu UHT berlemak dengan penambahan β-galaktosidase 4.8 U/mL
susu pada suhu 50°C 83
44 Hasil uji sidik ragam konsentrasi laktosa, glukosa, dan galaktosa pada susu UHT berlemak dengan penambahan β-galaktosidase 7.2 U/mL
susu pada suhu 50°C 85
45 Hasil uji sidik ragam konsentrasi laktosa, glukosa, dan galaktosa pada susu UHTrendah lemak dengan penambahan β-galaktosidase 4.8 U/mL
susu pada suhu 50°C 87
46 Hasil uji sidik ragam konsentrasi laktosa, glukosa, dan galaktosa pada susu UHT rendah lemak dengan penambahan β-galaktosidase 7.2 U/mL
susu pada suhu 50°C 89
47 Hasil uji korelasi pengukuran kit GOD-POD dan HPLC pada susu UHT
berlemak dengan konsentrasi enzim 4.8 U/mL 91
48 Hasil uji korelasi pengukuran kit GOD-POD dan HPLC pada susu UHT berlemak dengan konsentrasi enzim 4.8 U/mL (waktu hidrolisis 0 jam) 91 49 Hasil uji korelasi pengukuran kit GOD-POD dan HPLC pada susu UHT
berlemak dengan konsentrasi enzim 4.8 U/mL (waktu hidrolisis 1 jam) 92 50 Hasil uji korelasi pengukuran kit GOD-POD dan HPLC pada susu UHT
berlemak dengan konsentrasi enzim 4.8 U/mL (waktu hidrolisis 3 jam) 92 51 Hasil uji korelasi pengukuran kit GOD-POD dan HPLC pada susu UHT
berlemak dengan konsentrasi enzim 4.8 U/mL (waktu hidrolisis 5 jam) 93 52 Hasil uji korelasi pengukuran kit GOD-POD dan HPLC pada susu UHT
berlemak dengan konsentrasi enzim 4.8 U/mL (waktu hidrolisis 7 jam) 93 53 Hasil uji korelasi pengukuran kit GOD-POD dan HPLC pada susu UHT
1
PENDAHULUAN
Latar Belakang
Susu merupakan salah satu bahan pangan yang mengandung zat gizi lengkap dengan fungsi penting pada metabolisme tubuh. Laktosa merupakan karbohidrat utama pada susu, dengan kandungan rata-rata pada susu cair adalah 4.6% b/b (Walstra et al. 2006). Tidak semua orang dapat mencerna laktosa dalam susu. Laktosa harus dihidrolisis menjadi glukosa dan galaktosa supaya dapat memberikan manfaat bagi tubuh.
Enzim yang berperan dalam pemecahan laktosa menjadi glukosa dan galaktosa adalah β-galaktosidase (-D-Galactoside galactohydrolase, EC:3.2.1.23). Produksi enzim β-galaktosidase pada setiap individu berbeda-beda. Ketidakmampuan tubuh dalam memproduksi enzim yang akan memecah laktosa ini akan menyebabkan gangguan lactose intolerance. Pada individu yang mampu memproduksi β-galaktosidase, laktosa akan dihidrolisis menjadi glukosa dan galaktosa dan langsung diserap usus, ini ditandai dengan kondisi feses yang normal. Pada penderita lactose intolerance, laktosa akan langsung menuju ke usus besar sehingga akan menyebabkan dehidrasi, ketidakseimbangan elektrolit dan feses menjadi berair. Seseorang yang menderita lactose intolerance memiliki gejala-gejala seperti kembung, flatulensi, sakit perut dan diare (Montalto et al., 2006).
Kandungan laktosa yang rendah yakni kurang dari 1% b/b (Tuure and Corpela 2004) merupakan salah satu alternatif yang dapat dipilih bagi penderita lactose intolerance. Dalam Jokar dan Karbassi (2011), beberapa pilihan yang disarankan ilmuwan bagi penderita lactose intolerance diantaranya: (1) mengkonsumsi β-galaktosidase secara terpisah selama mengkonsumsi makanan yang mengandung laktosa, (2) mengkonsumsi susu dan produk susu dalam jumlah sedikit, (3) mengkonsumsi makanan/minuman dengan kandungan laktosa yang rendah, dimana laktosa telah dihidrolisis oleh β-galaktosidase, dan (4) mengkonsumsi produk susu yang mengandung bakteri hidup yang mampu memproduksi β-galaktosidase dalam usus konsumen.
Beberapa cara yang dapat digunakan untuk membuat susu rendah laktosa diantaranya adalah dengan ultrafiltrasi, fermentasi dan enzimatis. Teknik ultrafiltrasi telah banyak digunakan dalam pembuatan susu bubuk rendah laktosa. Teknik ini menggunakan membran ultrafiltrasi dengan ukuran pori 3-300 nm untuk memisahkan makromolekul dari larutan. Penggunaan suhu di atas 55C pada teknik ini akan menyebabkan denaturasi protein yang akan menurunkan tingkat kelarutan dari susu (Walstra et al. 2006). Penggunaan teknik fermentasi biasanya akan mengubah cita rasa dari produk susu yang dihasilkan.
2
Aplikasi β-galaktosidase pada susu UHT di Indonesia masih rendah atau tidak ada, karena hingga saat ini produk susu UHT (cair) di Indonesia belum tersedia di pasaran, padahal penggunaan enzim tersebut memiliki prospek pemasaran yang baik khususnya di industri susu,
-Galaktosidase dapat dihasilkan oleh bakteri asam laktat (BAL). BAL telah dikenal secara luas sebagai mikroba yang aman, sehingga enzim -galaktosidase yang dihasilkan oleh BAL dapat digunakan secara langsung dalam makanan (Jokar dan Karbassi 2011). Lactobacillus plantarum merupakan salah satu BAL penghasil -galaktosidase, diantaranya telah dilaporkan oleh Fernandez et al. (1999) dan Iqbal et al. (2010). Lactobacillus plantarum strain B123 indigenous yang diisolasi dari produk fermentasi (sayuran) tradisional Indonesia oleh Sulistiani (komunikasi pribadi pada tahun 2013) digunakan pada penelitian ini. Hasil dari penelitian ini diharapkan dapat meningkatkan potensi lokal dalam memberikan nilai tambah pada produk susu cair yakni susu UHT rendah laktosa.
Perumusan Masalah
Potensi -galaktosidase dari Lb. plantarum strain B123 indigenous dalam menurunkan konsentrasi laktosa pada susu UHT belum pernah diteliti di Indonesia. Dari perumusan masalah tersebut, maka hipotesis dari penelitian ini yaitu: (1) Lactobacillus plantarum strain B123 indigenous dapat menghasilkan enzim -galaktosidase melalui purifikasi parsial dan (2) -Galaktosidase dari Lactobacillus plantarum strain B123 indigenous dapat berpotensi untuk menghidrolisis laktosa secara batch pada susu UHT berlemak (total lemak 3.5% b/v) dan rendah lemak (total lemak 1.0% b/v).
Tujuan Penelitian
Penelitian ini bertujuan untuk: (1) menentukan kondisi pertumbuhan Lb. plantarum strain B123 indigenous untuk memproduksi β-galaktosidase (2) menentukan kondisi produksi β-galaktosidase dari Lb. plantarum strain B123 indigenous melalui purifikasi parsial dan (3) menentukan potensi β-galaktosidase dari Lb. plantarum strain B123 indigenous untuk menghidrolisis laktosa secara batch pada susu UHT berlemak (total lemak 3.5% b/v) dan rendah lemak (total lemak 1.0% b/v).
Manfaat Penelitian
3
Ruang Lingkup Penelitian
Ruang lingkup penelitian mencakup produksi β-galaktosidase dari Lb. plantarum strain B123 indigenous melalui purifikasi parsial, karakterisasi β -galaktosidase (uji aktivitas dan stabilitas pada berbagai suhu dan pH) dan aplikasinya pada hidrolisis laktosa dalam susu UHT (berlemak dan rendah lemak).
2
TINJAUAN PUSTAKA
Susu
Susu merupakan emulsi lemak dalam air yang mengandung garam-garam mineral, gula dan protein. Komposisi rata-rata dan kisaran normal susu sapi dapat dilihat pada Tabel 1, sedangkan komposisi proksimat (%) pada susu sapi, susu manusia, susu kambing dan susu domba dapat dilihat pada Tabel 2 (Muchtadi et al. 2010).
Tabel 1 Komposisi rata-rata dan kisaran normal susu sapia Komposisi Rata-rata Kisaran Normal(%)
Air 87.25 84.00-89.50
Lemak 3.80 2.60-6.00
Protein 3.50 2.80-4.00
Laktosa 4.80 4.50-5.20
Mineral 0.65 0.60-0.80
a
Sumber: Muchtadi et al. (2010)
Berdasarkan definisi SNI No. 3141:2011 tentang susu segar, definisi susu segar adalah cairan yang berasal dari ambing sapi sehat dan bersih, yang diperoleh dengan cara pemerahan yang benar, yang kandungan alaminya tidak dikurangi atau ditambah sesuatu apapun dan belum mendapat perlakuan apapun kecuali pendinginan (BSN 2011). Persyaratan mutu susu segar berdasarkan SNI tersebut dapat dilihat pada Lampiran 1.
4
Tabel 2 Komposisi proksimat (%b/v) pada susu sapi, susu manusia, susu kambing dan susu dombaa
Komponen Susu sapi Susu manusia Susu kambing Susu domba
Protein 3.4 1.0 2.9 5.5
Kasein 2.8 0.4 2.5 4.6
Lemak 3.7 3.8 4.5 7.4
Laktosa 4.6 7.0 4.2 4.8
Mineral 0.7 0.2 0.8 1.0
a
Sumber: Muchtadi et al. (2010)
Menurut Walstra et al. (2006), susu secara alami mengandung nutrisi yang lengkap, empat komponen utama dalam susu adalah lemak, protein, karbohidrat dan mineral, perkiraan komposisi susu cair terdapat dalam Tabel 3. Air dalam susu berfungsi sebagai pelarut dan membentuk emulsi. Flavor pada susu sangat ditentukan oleh lemak susu. Lemak susu dalam butir-butir yang amat kecil disebut globula, berada dalam fase disperse. Masing-masing butir lemak dikelilingi oleh selaput protein yang sangat tipis atau serum susu yang terkumpul pada permukaan, akibat absorbsi inilah faktor yang menentukan atau membantu dan mempertahankan kestabilan lemak dalam susu. Protein susu terdiri dari kasein 80%, laktalbumin 18% dan laktoglobulin 0.05-0.07%. Pada Tabel 4 dapat dilihat komposisi kimia beberapa jenis susu dan produk susu cair (Walstra et al. (2006).
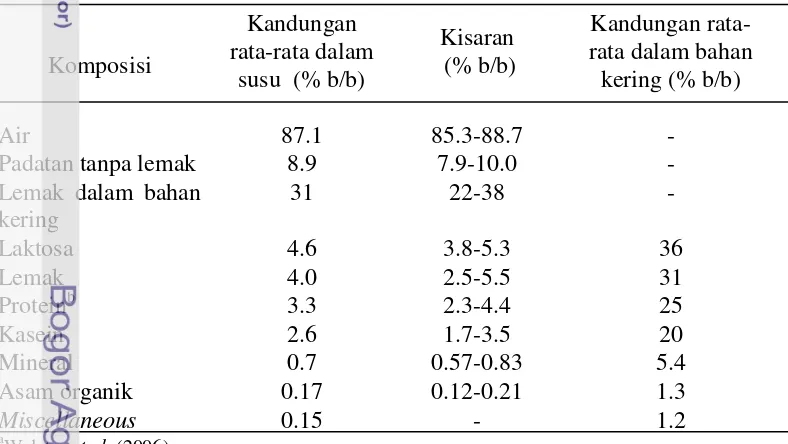
Tabel 3 Perkiraan komposisi susu caira
Komposisi
Kandungan rata-rata dalam
susu (% b/b)
Kisaran (% b/b)
Kandungan rata-rata dalam bahan
kering (% b/b)
Air 87.1 85.3-88.7 -
Padatan tanpa lemak 8.9 7.9-10.0 -
Lemak dalam bahan kering
31 22-38 -
Laktosa 4.6 3.8-5.3 36
Lemak 4.0 2.5-5.5 31
Proteinb 3.3 2.3-4.4 25
Kasein 2.6 1.7-3.5 20
Mineral 0.7 0.57-0.83 5.4
Asam organik 0.17 0.12-0.21 1.3
Miscellaneous 0.15 - 1.2
a
Walstra et al. (2006)
b
Tidak termasuk komponen nitrogen bukan protein
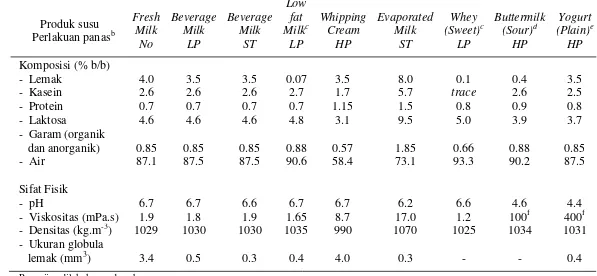
5 (2006), susu rendah lemak termasuk ke dalam kategori susu (plain) dan merupakan produk susu cair yang sebagian lemaknya telah dihilangkan, hingga kandungan lemak susunya berkisar antara 1.25-3.00%.
Susu UHT
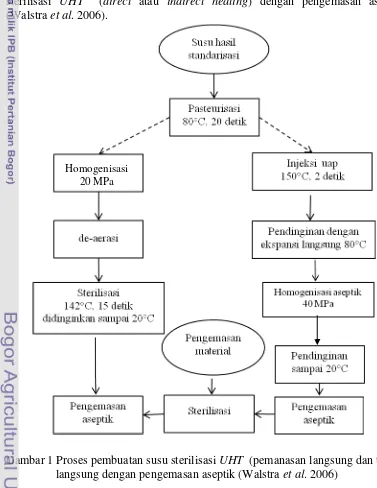
[image:30.595.107.484.269.757.2]Berdasarkan SNI No. 01-3959-1999 tentang susu UHT (Ultra High Temperature), definisi susu UHT adalah susu yang diperoleh dengan cara mensterilkan susu minimal pada suhu 135C selama 2 detik, dengan atau tanpa penambahan bahan makanan dan bahan tambahan makanan yang diijinkan, serta dikemas secara aseptik (BSN 1999). Persyaratan mutu dari susu UHT dapat dilihat pada Lampiran 2. Pada Gambar 1 dapat dilihat proses pembuatan susu sterilisasi UHT (direct atau indirect heating) dengan pengemasan aseptik (Walstra et al. 2006).
Gambar 1 Proses pembuatan susu sterilisasi UHT (pemanasan langsung dan tidak langsung dengan pengemasan aseptik (Walstra et al. 2006)
6 Tabel 4 Komposisi kimia beberapa jenis susu dan produk susu caira
Produk susu Perlakuan panasb
Fresh Beverage Beverage
Low
fat Whipping Evaporated Whey Buttermilk Yogurt Milk Milk Milk Milkc Cream Milk (Sweet)c (Sour)d (Plain)e
No LP ST LP HP ST LP HP HP
Komposisi (% b/b)
- Lemak 4.0 3.5 3.5 0.07 3.5 8.0 0.1 0.4 3.5
- Kasein 2.6 2.6 2.6 2.7 1.7 5.7 trace 2.6 2.5
- Protein 0.7 0.7 0.7 0.7 1.15 1.5 0.8 0.9 0.8
- Laktosa 4.6 4.6 4.6 4.8 3.1 9.5 5.0 3.9 3.7
- Garam (organik
dan anorganik) 0.85 0.85 0.85 0.88 0.57 1.85 0.66 0.88 0.85
- Air 87.1 87.5 87.5 90.6 58.4 73.1 93.3 90.2 87.5
Sifat Fisik
- pH 6.7 6.7 6.6 6.7 6.7 6.2 6.6 4.6 4.4
- Viskositas (mPa.s) 1.9 1.8 1.9 1.65 8.7 17.0 1.2 100f 400f
- Densitas (kg.m-3) 1029 1030 1030 1035 990 1070 1025 1034 1031
- Ukuran globula
lemak (mm3) 3.4 0.5 0.3 0.4 4.0 0.3 - - 0.4
Pengujian dilakukan pada suhu ruang
a
Sumber:Walstra et al. (2006)
b
LP = low-pasteurized, HP = high-pasteurized, S= sterilized.
c
Centrifuged.
d
Undiluted.
e
Stirred yogurt.
f
7 Dalam Britz dan Robinson (2008), UHT merupakan proses termal yang terutama ditujukan untuk sterilisasi komersial dengan reduksi Clostridium botulinum sebanyak 12D. Pada proses ini tidak ada lagi mikroorganisme (sel vegetatif) hidup, akan tetapi masih mungkin terdapat spora bakteri yang setelah proses sterilisasi bersifat dorman. Proses UHT biasanya dilakukan pada suhu 135-150C dan dikombinasikan dengan waktu holding untuk mencapai sterilisasi komersial. Produk yang dihasilkan stabil pada suhu ruang.
Dalam Muchtadi et al. (2010), susu UHT dihasilkan dari proses pemanasan susu sampai 125C selama 15 detik atau 131C selama 0.5 detik. Pemanasan dilakukan di bawah tekanan tinggi untuk menghasilkan perputaran (turbulence) dan mencegah terjadinya pembakaran susu pada lempeng-lempeng alat pemanas. Susu yang dihasilkan dapat dikatakan steril ditambah dengan pengemasan secara aseptik, maka susu dapat disimpan pada suhu kamar sampai beberapa bulan.
Selama proses pemanasan, susu memiliki berbagai sistem reaksi yang kompleks. Reaksi yang terjadi diantaranya reaksi kimia, fisik maupun biokimia. Perubahan komposisi kimia, fisik maupun biokimia dapat mempengaruhi karakteristik susu itu sendiri. Perubahan lainnya dapat berupa penurunan nilai gizi dan bertambahnya biological safety dari susu (Britz dan Robinson 2008).
Susu UHT Rendah Laktosa
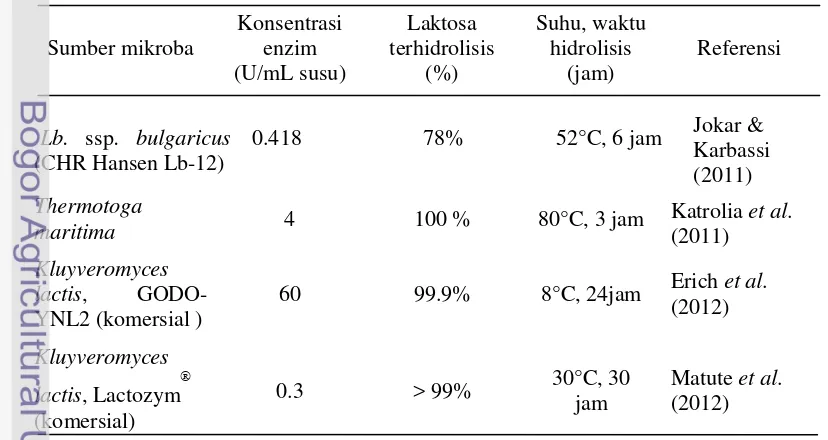
[image:32.595.101.515.531.751.2]Menurut Tuure (2007) definisi susu rendah laktosa yaitu susu dengan kandungan laktosa kurang dari 1%. Hasil studi Guzek et al. (2008) mengenai toleransi susu rendah laktosa dan suplementasi laktase dari Aspergillus oryzae pada penderita lactose intolerance menunjukkan bahwa pada umumnya penderita lactose intolerance memiliki toleransi dalam hal kesehatan yang lebih baik terhadap susu rendah laktosa dibandingkan dengan normal milk dengan suplementasi laktase dari Aspergillus oryzae. Beberapa penelitian mengenai hidrolisis laktosa pada susu cair dapat dilihat pada Tabel 5.
Tabel 5 Studi hidrolisis laktosa oleh -galaktosidase pada susu cair
Sumber mikroba Konsentrasi enzim (U/mL susu) Laktosa terhidrolisis (%) Suhu, waktu hidrolisis (jam) Referensi
Lb. ssp. bulgaricus
(CHR Hansen Lb-12)
0.418 78% 52°C, 6 jam Jokar &
Karbassi (2011)
Thermotoga
maritima 4 100 % 80°C, 3 jam Katrolia (2011) et al. Kluyveromyces
lactis, GODO-YNL2 (komersial )
60 99.9% 8°C, 24jam Erich et al.
(2012)
Kluyveromyces lactis, Lactozym
(komersial)
0.3 > 99% 30°C, 30
jam
8
Hasil penelitian Jokar dan Karbassi (2011) menunjukkan kemampuan Lb.
ssp. bulgaricus (CHR Hansen Lb-12) dalam menghasilkan -galaktosidase. Bakteri ini merupakan salah satu bakteri yang mempunyai ketahanan yang tinggi terhadap asam dan suhu, karenanya enzim ini dapat diaplikasikan pada suhu tinggi. Aplikasi Crude Enzyme (-galactosidase) Extract (CEE) yang dihasilkan oleh Lactobacillus sp. bulgaricus pada susu UHT menunjukkan hasil yang tidak berbeda nyata dengan kontrol (susu UHT tanpa penambahan enzim -galactosidase) dalam hal sweetness, aftertaste, rasa, dan warna. Jumlah laktosa terhidrolisis setelah penambahan -galaktosidase dari Lb. ssp. bulgaricus (CHR Hansen Lb-12) dengan konsentrasi 0.418 U/mL susu pada suhu 52°C adalah 78% (Tabel 5). Adanya variasi laktosa terhidrolisis yang dipengaruhi oleh sumber mikroba, konsentrasi enzim, suhu dan waktu hidrolisis lainnya dapat dilihat pada Tabel 5.
Enzim -Galaktosidase (-D-Galactoside galactohydrolase, EC:3.2.1.23)
Glycosidase merupakan enzim yang dapat menghidrolisis ikatan glikosidik dalam oligo atau polisakarida dan heteroglikosida. Salah satu enzim yang tergolong Glycosidase adalah -galaktosidase. Enzim -galaktosidase banyak digunakan di industri susu. Enzim ini memberikan keuntungan bagi industri susu, yakni dalam pembuatan lactose free milk dan biosintesis galactooligosaccharide (Karasova et al. 2002).
Dalam Panesar et al. (2010), diungkapkan bahwa enzim -galaktosidase sering dikenal sebagai laktase, yang akan menghidrolisis laktosa menjadi monomer glukosa dan galaktosa. Aplikasi enzim ini sangat potensial dikembangkan di industri pangan. Rendahnya level enzim ini di usus akan menyebabkan lactose intolerance, yang menyebabkan seseorang kesulitan dalam mengkonsumsi susu dan produk olahan susu. Penelitian Shen et al. (2012) menunjukkan bahwa kondisi optimal β-galaktosidase dari K. lactis adalah pH 6,6-7 dan suhu 35-40 C.
Laktosa (o-4-D-galactopyranosyl-(1,4)-glucopyranose) merupakan karbohidrat utama dalam susu. Karbohidrat lainnya yang terdapat dalam jumlah sedikit dalam susu adalah glukosa dan galaktosa. Laktosa merupakan disakarida yang tersusun dari D-glukosa dan D-galaktosa. Grup aldehid dari galaktosa dihubungkan dengan C-4 grup dari glukosa dengan ikatan -glikosidik. Struktur kimia -laktosa dapat dilihat pada Gambar 2 (Walstra et al. 2006). Laktosa dapat dihidrolisis oleh -galaktosidase dalam usus.
9 Lactose intolerance yaitu penyakit yang disebabkan oleh rendahnya level -galaktosidase dalam usus. Dalam Panesar et al. (2010) diungkapkan bahwa laktosa memiliki kemanisan dan kelarutan yang relatif rendah. Laktosa juga merupakan gula yang bersifat higroskopis dan memiliki kecenderungan yang kuat untuk menyerap flavor dan bau serta menyebabkan kerusakan pada produk refrigerasi seperti reaksi kristalisasi pada produk susu dan pembentukan tekstur berpasir dan terbentuknya deposit. Kelebihan laktosa dalam usus akan menyebabkan dehidrasi jaringan yang mengakibatkan efek osmotik, dan rendahnya penyerapan kalsium karena rendahnya keasaman, serta terjadinya fermentasi laktosa oleh mikroflora dalam usus yang menyebabkan fermentative diarrhea, kembung, flatulensi, kram dan diare berair.
Bakteri Asam Laktat Penghasil Enzim -Galaktosidase
Bakteri asam laktat (BAL) merupakan bakteri yang bersifat Gram positif, tidak membentuk spora dan dapat berbentuk koki, koko basili atau batang, katalase negatif, non motil atau sedikit motil, mikroaerofilik sampai anaerob, toleran terhadap asam, kemoorganotrofik dan membutuhkan suhu mesofilik. BAL dibagi menjadi beberapa genus diantaranya Streptococcus, Lactococcus, Vagococcus, Leuconostoc, Pediococcus, Tetragenococcus, Aerococcus, Lactobacillus dan Carnobacterium (Salminen dan von Wright 1993).
Ditinjau dari hasil metabolisme glukosa, BAL terbagi menjadi dua golongan yaitu homofermentatif dan heterofermentatif. BAL homofermentatif memfermentasi glukosa sebagian besar menjadi asam laktat. BAL heterofermentatif memfermentasi glukosa menjadi asam laktat, asam asetat, etanol dan CO2.
Menurut Holt et al. (1994), Lactobacillus sp bersifat katalase negatif, anaerob fakultatif atau mikroaerofilik, berbentuk batang dengan diameter 0.5-1.6 µm. Beberapa spesies Lactobacillus sp dapat digolongkan sebagai homofermentatif dan heterofermentatif. Genus Lactobacillus dibagi ke dalam tiga sub genera yaitu Betabacterium, Streptobacterium, dan Thermobacterium. Lb. casei dan Lb. plantarum yang tergolong Streptobacterium menghasilkan 1.5% asam laktat dengan suhu optimum pertumbuhan 30C. Subgenera Thermobacterium seperti Lb. acidophilus, dan Lb. delbrueckii subsp. bulgaricus dapat menghasilkan asam laktat dan sampai 3% dan suhu optimum pertumbuhan 40C.
10
Dalam Panesar et al. (2010), beberapa mikroba yang tergolong BAL yang merupakan sumber penghasil enzim β-galaktosidase diantaranya: Lactobacillus acidophilus, Lactobacillus bulgaricus, Lactobacillus helveticus, Lactobacillus kefiranofaciens, Lactobacillus lactis, Lactobacillus sporogenes, Lactobacillus thermophillus, Lactobacillus delbrueckii, Leuconostoc citrovorum, Pediococcus acidilacti, Pediococcus pento, Streptococcus cremoris, Streptococcus lactis dan Streptococcus thermophillus.
Tabel 6 Beberapa bakteri Lactobacillus yang tergolong homofermentatif obligat, dan heterofermentatif fakultatif dan obligata
Homofermentatif Obligat Heterofermentatif Fakultatif Heterofermentatif Obligat Lactobacillus acidophilus Lb. acetotolerans Lb. brevis
Lb. amylophilus Lb. agilis Lb. buchneri
Lb. amylovorus Lb. alimentarius Lb. collinoides Lb. aviarius
subsp. araffinosus subsp. aviarius
Lb. bifermentans Lb. fermentum
Lb. crispatus Lb. casei Lb. fructivorans
Lb. delbrueckii subsp. bulgaricus subsp. delbrueckii subsp. lactis
Lb. coryniformis subsp. coryniformis subsp. torquens
Lb. fructosus b
Lb. farciminis Lb. curvatus Lb. hilgardii
Lb. gallinarum Lb. graminis Lb. kefir
Lb. gasseri Lb. hamsteri Lb. malefermentans
Lb. helveticus Lb. homohiochii Lb. oris
Lb. jensenii Lb. intestinalis Lb. panis
Lb. johnsonii Lb. murinus Lb. parabuchneri Lb. kefiranofaciens Lb. paracasei
subsp. paracasei subsp. tolerans
Lb. parakefir
Lb. kefirgranum Lb. paraplantarum Lb. pontis
Lb. mali Lb. plantarum Lb.reuteri
Lb. ruminis Lb. pentosus Lb. sanfransisco
Lb. salivarus subsp. salicinus subsp. salivarius
Lb. rhamnosus Lb. suebicus
Lb. sharpeae Lb. sake Lb. vaccinostercus
Lb. vaginalis
a
Stiles dan Holzapfel (1997) dalam Kara (2004)
b
Lb. fructosus diklasifikasikan ke dalam grup Leuconostoc
Huruf yang ditebalkan menunjukkan Lactobacillus yang berperan penting dalam pangan dan sebagai probiotik
[image:35.595.57.480.198.677.2]11 β-galaktosidase yang dihasilkan oleh Lb. lactis mampu menghasilkan glukosa dari substrat laktosa dengan konsentrasi protein tertinggi yaitu 17.25 mg/mL. Aktivitas enzim tertinggi ditunjukkan oleh Lb. bulgaricus yaitu 850.69 U dengan specific activity 50.04 U/mg protein. Komposisi kimia dan fisik diobservasi pada pH 6 dengan specific activity 43.98 U/mg protein dan pada suhu 70C dengan specific gravity 111.11 U/mg protein. Schwab et al. (2010) melaporkan beberapa bakteri asam laktat penghasil β-galaktosidase diantaranya Lb. acidophilus, Lb. plantarum, Streptococus thermophilus, Leuconostoc mesenteroides subsp. cremoris dan Lactococcus lactis.
Lactobacillus plantarum
Lactobacillus plantarum tergolong bakteri Gram-positif, berbentuk batang, non motil, biasanya berukuran diameter 0.6-0.8 m dan panjang 1.2-6 m, berantai tunggal atau pendek (Jay, 1996). Bakteri ini bersifat anaerob fakultatif dan tumbuh secara optimum pada suhu 30-35C, tetapi tidak tumbuh pada suhu 7 atau 45C (Gilliland 1986). Lb. plantarum tergolong bakteri asam laktat yang bersifat heterofermentatif fakultatif dan sering ditemukan pada produk fermentasi sayuran (Adam dan Moss 2005). Lb. plantarum merupakan salah satu BAL penghasil β-galaktosidase. β-Galaktosidasedari Lb. plantarum dan aktif pada pH 6.0, 6.5, 6.8 dan 7.2 pada suhu 37°C, dengan aktivitas hidrolisis optimal pada pH 7.2. Suhu optimum β-galaktosidase dari Lb. plantarum adalah antara 30°C dan 56°C pada pH 6.8 (Schwab et al. 2010).
3
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Februari sampai Juni 2013. Penelitian ini dilaksanakan di Laboratorium Biokimia Mikroba, Bidang Mikrobiologi, Pusat Penelitian Biologi, LIPI, Cibinong Science Center, Cibinong; Laboratorium Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, IPB; dan Laboratorium Kimia dan Mikrobiologi, PAU, SEAFAST Center IPB.
Bahan
12
Germany), triamonium sitrat 2 g/L (Sigma Aldrich Chemie GmbH, Germany), magnesium sulfat (MgSO4.7 H2O) 0.2 g/L (Merck, Germany), mangan sulfat (MnSO4.4H2O) 0.05 g/L (Merck, Germany) dan dinatrium hidrogen fosfat (Na2HPO4. 2H2O) 2 g/L (Merck, Germany). Untuk membuat MRS agar ditambahkan CaCO3 5 g/L (Merck, Germany) dan bacto agar 18g/L (Merck, Germany). Bahan untuk produksi dan karakterisasi enzim diantaranya buffer fosfat 0.05 M pH 6.5, buffer fosfat 0.01 M pH 6.5, buffer fosfat 0.1 M pH 6.0; 6.5; dan 7.0, buffer asetat 0.1 M pH 4.5; 5.0; dan 5.5, buffer tris-HCl 0.1 M pH 7.5; 8.0; dan 8.5 (Merck, Germany) dan ammonium sulfat (Merck, Germany).
Bahan untuk uji aktivitas enzim diantaranya enzim β-galaktosidase, o -nitrofenol atau oNP (Sigma Aldrich Chemie GmbH, Germany), o -nitrofenil--D-galaktopiranosida atau oNPG (Fluka, Switzerland), buffer fosfat 0.1 M pH 7.0 (Merck, Germany) dan Na2CO3 1 M (Merck, Germany). Bahan untuk penentuan kadar protein metode Bradford diantaranya enzim β-galaktosidase, bovine serum albumin atau BSA (Merck, Germany), pereaksi Bradford yang dibuat dari 1 mg coomassie brilliant blue (Merck, Germany) dalam 50 mL etanol 95% (Merck, Germany) kemudian ditambahkan 100 mL H3PO3 85% (Merck, Germany) lalu ditera dengan akuades hingga 1 liter.
Bahan untuk aplikasi β-galaktosidase untuk hidrolisis laktosa pada susu UHT adalah susu UHT komersial (berlemak dan rendah lemak) yang diperoleh dari supermarket di daerah Bogor. Bahan untuk penentuan konsentrasi glukosa adalah kit enzimatik analisis glukosa GOD-POD atau Glucose Oxidase -Peroxidase (Cypress Diagnostics, Belgium) dan NaCl 0.9% b/v (Merck, Germany). Bahan untuk analisis konsentrasi laktosa, glukosa dan galaktosa dengan metode HPLC diantaranya standar: glukosa (Merck, Germany), galaktosa (Sigma Aldrich Chemie GmbH, Germany), dan laktosa (Sigma Aldrich Chemie GmbH, Germany) dengan kemurnian > 98%, asetonitril HPLC grade (Merck, Germany), H2SO4 5 mM (Merck, Germany), etanol absolute (Merck, Germany), akuabides, regenerated selulosa membrane 0.45 µm (Sartorius Stedim Biotech Co, USA) dan membran filter 0.2 m (Minisart, Belgium). Semua bahan kimia yang digunakan untuk pembuatan media maupun analisa memiliki kualitas pro analysis (p.a).
Alat
13
Prosedur Percobaan
Penelitian dilakukan dalam 3 tahap yaitu: (1) penentuan kondisi pertumbuhan Lb.plantarum strain B123 indigenous (2) produksi β-galaktosidase dari Lb. plantarum strain B123 indigenous dengan purifikasi parsial dan (3) aplikasi β-galaktosidase untuk hidrolisis laktosa pada susu UHT. Diagram alir tahapan penelitian dapat dilihat pada Gambar 3.
[image:38.595.102.516.129.840.2].
Gambar 3 Diagram alir tahapan penelitian
Penentuan Kondisi Pertumbuhan Lactobacillus plantarum Strain B123
Indigenous
Penentuan jumlah sel inokulum, konsentrasi laktosa dan pH medium.
Kondisi pertumbuhan Lb. plantarum strain B123 indigenous pada media MRSB yang dilakukan meliputi jumlah inokulum (dengan range: 1, 2 dan 3%), konsentrasi laktosa (dengan range: 1, 2 dan 3%) dan pH medium (dengan range pH 5-8). Masing-masing perlakuan dilakukan sebanyak 3 ulangan. Dari kondisi tersebut, data yang menunjukkan aktivitas spesifik tertinggi kemudian dipilih sebagai kondisi terbaik bagi tahap produksi selanjutnya. Pada umumnya jumlah inokulum yang diperlukan untuk menumbuhkan bakteri asam laktat adalah 1% dengan konsentrasi laktosa pada medium 2% dan pH medium 7.
Penentuan jumlah inokulum dilakukan sebagai berikut: sebanyak 1,2 dan 3% inokulum Lb.plantarum strain B123 indigenous dengan kerapatan optik atau
(1) Penentuan kondisi pertumbuhan Lb.plantarum strain B123 indigenous - Penentuan jumlah sel inokulum, konsentrasi laktosa dan pH medium - Penentuan kurva pertumbuhan dan kurva produksi -galaktosidase
dari Lb.plantarum Strain B123 Indigenous
-(2) Produksi β-galaktosidase dari Lb. plantarum strain B123 indigenous dengan purifikasi parsial
- Ekstraksi enzim, pengendapan dengan ammonium sulfat dan dialisis - Uji aktivitas β-galaktosidase dan kadar protein
- Uji aktivitas dan stabilitas β-galaktosidase pada berbagai pH - Uji aktivitas dan stabilitas β-galaktosidase pada berbagai suhu
(3) Aplikasi β-galaktosidase untuk hidrolisis laktosa pada susu UHT
- Hidrolisis laktosa pada susu UHT berlemak dievaluasi dengan kit enzimatik GOD-POD
14
optical density (OD) 0.7 (pengukuran pada 600 nm), diinokulasikan masing-masing ke dalam 20 mL media MRSB yang telah steril (pH media 7 dan kandungan laktosa 2%), diinkubasi selama 24 jam pada suhu 37C. Sel kemudian dipanen. Ekstraksi enzim β-galaktosidase mengikuti metode Wang dan Sakakibara modifikasi (1997). Ekstrak kasar (crude enzyme) β-galaktosidase yang diperoleh kemudian dilakukan pengujian aktivitas β-galaktosidase (Lu et al. modifikasi 2009) dan penentuan kadar protein (Bradford 1976). Jumlah inokulum yang memberikan aktivitas spesifik tertinggi digunakan dalam tahap penentuan konsentrasi laktosa dalam medium MRSB.
Penentuan konsentrasi laktosa dalam medium MRSB dilakukan sebagai berikut: sebanyak 2% inokulum (hasil penentuan jumlah inokulum, yang menghasilkan aktivitas spesifik tertinggi) Lactobacillus plantarum strain B123 indigenous dengan OD 0.7 diinokulasikan ke dalam 20 mL media MRSB yang telah steril (pH media 7 dan kandungan laktosa bervariasi 1, 2 dan 3%), diinkubasi selama 24 jam pada suhu 37C. Sel kemudian dipanen dan diuji aktivitas β-galaktosidase dan kadar proteinnya. Kandungan laktosa pada medium yang memberikan aktivitas spesifik tertinggi digunakan dalam tahap optimasi pH.
Penentuan pH medium MRSB dilakukan sebagai berikut: sebanyak 2% inokulum Lb. plantarum strain B123 indigenous dengan OD 0.7 diinokulasikan ke dalam 20 mL media MRSB yang telah steril (dengan kandungan laktosa 1%, yang merupakan hasil penentuan laktosa) dengan variasi pH medium 5, 6, 7 dan 8, diinkubasi selama 24 jam pada suhu 37C. Sel kemudian dipanen, diuji aktivitas β-galaktosidase dan kadar proteinnya. Nilai pH medium yang memberikan aktivitas spesifik tertinggi digunakan dalam tahap produksi selanjutnya.
Penentuan kurva pertumbuhan dan kurva produksi -galaktosidase dari Lb. plantarum Strain B123 Indigenous. Penentuan kurva pertumbuhan dilakukan dengan cara sebagai berikut: sebanyak 2% inokulum Lb. plantarum strain B123 indigenous dengan kerapatan optik 0.7 diinokulasikan ke dalam 200 mL media MRSB yang telah steril (hasil penentuan sebelumnya), kemudian diinkubasi pada suhu 37C. Pengukuran OD dilakukan dari jam ke 0 sampai jam ke 48, dengan selang waktu 6 jam. Untuk mengetahui jumlah koloni dalam satuan CFU/mL, digunakan kurva standar OD dengan range OD 0.1-0.7. Suspensi dengan masing-masing OD kemudian dilakukan pengenceran dan plating (dengan waktu inkubasi 24 jam dan pada suhu 37C) menggunakan metode hitungan cawan dengan spread plate. Koloni berwarna putih dikelilingi oleh areal bening di sekitarnya merupakan BAL penghasil β-galaktosidase, koloni tersebut kemudian dihitung dan dinyatakan dalam CFU/mL.
15
Produksi β-Galaktosidase dari Lactobacillus plantarum Strain B123
Indigenous dengan Purifikasi Parsial
Produksi β-Galaktosidase dari Lactobacillus plantarum Strain B123 indigenous dilakukan dengan purifikasi parsial yakni dimulai dari ekstraksi enzim, pengendapan dengan ammonium sulfat dan dialisis. Purifikasi hanya dilakukan secara parsial karena Lactobacillus plantarum yang tergolong bakteri asam laktat (BAL) dikenal sebagai bakteri yang aman dan untuk melihat kemampuan β-galaktosidase hasil dialisis dalam menghidrolisis laktosa pada susu UHT.
Ekstraksi Enzim (Wang dan Sakakibara modifikasi 1997). Modifikasi dari Wang dan Sakakibara (1997) dilakukan diantaranya pada jenis media, jumlah inokulum, waktu inkubasi, kecepatan dan waktu sentrifugasi, frekuensi sonikasi, dan konsentrasi buffer fosfat. Pada penelitian ini, sebanyak 2% inokulum Lactobacillusplantarum strain B123 indigenous dengan OD 0.7 (5.00 × 107 CFU/mL) diinokulasikan ke dalam media produksi (MRSB dengan kandungan laktosa 1% dan pH medium 8) yang telah steril, diinkubasi pada suhu 37C (inkubator dilengkapi dengan pengatur suhu dan tanpa shaker). Sel dipanen setelah waktu inkubasi 24 jam. Cairan kemudian disentrifugasi dengan kecepatan 9500 rpm (14330 × g) selama 15 menit pada suhu 4C. Pencucian pelet dilakukan sebanyak dua kali dengan buffer fosfat 0.05 M pH 6.5. Pelet yang diperoleh dilarutkan dalam buffer fosfat 0.05 M pH 6.5 dan dilakukan pemecahan sel dengan sonikator 50 kHz selama 15 menit pada suhu 4C. Suspensi sel lalu disentrifugasi dengan kecepatan 9500 rpm selama 15 menit pada suhu 4C. Suspensi sel kemudian disonikasi dan disentrifugasi kembali. Supernatan yang diperoleh merupakan ekstrak kasar (crude enzyme) β-galaktosidase. Uji aktivitas β-galaktosidase dilakukan dengan metode Lu et al. modifikasi (2009) dan kadar protein dengan metode Bradford (1976).
Pengendapan dengan Ammonium Sulfat. Proses pengendapan enzim dilakukan berdasarkan prinsip salting out. Pada tahap ini dilakukan terlebih dahulu penentuan fraksi pengendapan dengan aktivitas spesifik tertinggi. Ekstrak kasar β-galaktosidase ditambahkan ammonium sulfat sedikit demi sedikit hingga konsentrasi 10% (0-10%) sambil diaduk sampai larut semua dengan pengaduk bermagnet dengan kecepatan 60 rpm pada suhu 4C. Setelah semua ammonium sulfat larut, pengadukan dilanjutkan selama 20 menit. Campuran kemudian didiamkan selama 1 jam pada suhu 4C dan disentrifugasi dengan kecepatan 9500 rpm selama 15 menit dengan suhu 4C. Supernatan yang dihasilkan kemudian ditambahkan ammonium sulfat kembali seperti prosedur di atas untuk fraksi pengendapan 20, 30, 40, 50, 60 dan 70%. Endapan enzim dipisahkan dan dilarutkan dalam buffer fosfat 0.05 M pH 6.5, lalu disentrifugasi kembali 9500 rpm selama 15 menit dengan suhu 4C. Supernatan dari masing-masing fraksi pengendapan kemudian diukur aktivitas β-galaktosidase dan kadar proteinnya. Fraksi pengendapan yang menghasilkan aktivitas spesifik tertinggi kemudian dipilih untuk percobaan selanjutnya yang memerlukan pengendapan dengan ammonium sulfat.
16
galaktosidase ditambahkan ammonium sulfat sedikit demi sedikit hingga konsentrasi 50% (0-50%) sambil diaduk sampai larut semua dengan pengaduk bermagnet dengan kecepatan 60 rpm pada suhu 4C. Setelah semua ammonium sulfat larut, pengadukan dilanjutkan selama 20 menit. Campuran kemudian didiamkan selama 1 jam pada suhu 4C dan disentrifugasi dengan kecepatan 9500 rpm selama 15 menit dengan suhu 4C. Supernatan yang dihasilkan kemudian ditambahkan ammonium sulfat kembali seperti prosedur di atas untuk fraksi pengendapan selanjutnya (50-60%). Endapan enzim dipisahkan dan dilarutkan dalam buffer fosfat 0.05 M pH 6.5, lalu disentrifugasi kembali 9500 rpm selama 15 menit dengan suhu 4C, dan supernatan yang dihasilkan merupakan larutan enzim dari fraksi pengendapan 0-50%. Larutan enzim dari fraksi pengendapan 0-50% digabung dengan larutan enzim dari fraksi pengendapan 50-60%, kemudian diukur aktivitas β-galaktosidase dan kadar proteinnya.
Jumlah ammonium sulfat (dalam satuan gram) yang digunakan untuk melarutkan 1 liter larutan enzim menggunakan rumus di bawah ini dengan S1 merupakan konsentrasi awal ammonium sulfat, sedangkan S2 merupakan konsentrasi akhir ammonium sulfat. Angka 533 merupakan jumlah gram ammonium sulfat yang dibutuhkan per liter larutan untuk membuat larutan jenuh 100%. Aktivitas spesifik β-galaktosidase yang tertinggi dan kadar protein yang tertinggi yang akan dipilih untuk digunakan dalam purifikasi parsial selanjutnya.
Jumlah ammonium sulfat (g/L) = 533 (S2-S1) 100-0.3S2
Dialisis. Larutan enzim hasil pengendapan dengan ammonium sulfat kemudian didialisis menggunakan buffer fosfat 0.01 M pH 6.5 sambil digoyang dengan pengaduk bermagnet dengan kecepatan 100 rpm. Dialisis dilakukan pada suhu 4C selama 24 jam menggunakan membran dialisis selofan. Buffer fosfat 0.01 M pH 6.5 diganti sebanyak 3 kali selama waktu dialisis. Aktivitas spesifik dan kadar protein β-galaktosidase hasil dialisis diuji kembali. β-galaktosidase hasil dialisis disimpan pada suhu 4C sebelum digunakan pada tahap hidrolisis laktosa pada susu UHT (berlemak dan rendah lemak).
Uji Aktivitas β-Galaktosidase (Lu et al. modifikasi 2009). Modifikasi dari metode Lu et al. (2009) dilakukan diantaranya pada jumlah enzim, jumlah substrat oNPG, waktu dan suhu inkubasi, serta konsentrasi Na2CO3. Pada penelitian ini uji aktivitas β-galaktosidase dilakukan dengan cara sebanyak 1000 µL buffer fosfat 0.1 M pH 7 dan 100 µL enzim dimasukkan ke dalam tabung reaksi lalu diinkubasi pada suhu 37C selama 5 menit. Kemudian ditambahkan 200 µL oNPG 2 mg/mL dan diinkubasi pada suhu 37C selama 5 menit. Pada menit ke-10 ditambahkan 1000 µL Na2CO3 1 M untuk menghentikan reaksi. Larutan dianalisis menggunakan spektrofotometer UV Vis pada 420 nm. Cara perhitungan aktivitas β-galaktosidase dapat dilihat pada Lampiran 6.
17 tabung reaksi kemudian ditambahkan 200 µL oNP berbagai konsentrasi. Inkubasi dilakukan pada suhu 35C selama 5 menit. Selanjutnya campuran ditambahkan 1000 µL Na2CO3 1 M. Larutan divorteks dan intensitas warna kuning yang terbentuk diukur absorbansinya pada λ 420 nm. Hasil pembacaan aktivitas β -galaktosidase sampel akan diplotkan pada hasil kurva standar. Satu unit aktivitas β-galaktosidase dinyatakan sebagai banyaknya enzim yang diperlukan untuk menghasilkan 1 µmol oNP dari subsrat oNPG per menit pada kondisi percobaan.
Penentuan Kadar Protein (Bradford 1976). Enzim β-galaktosidase sebanyak 20 µL ditambahkan 1 mL pereaksi Bradford. Larutan divorteks dan didiamkan selama 5 menit lalu diukur absorbansinya pada λ 595 nm. Pembuatan kurva standar protein yang digunakan adalah bovine serum albumin (BSA), dengan berbagai konsentrasi dari 0.00-0.60 mg/mL. Kurva standar protein terdapat pada Lampiran 4 dan 5. Kurva standar protein 1 digunakan pada perhitungan protein sampai tahap produksi β-galaktosidase dari Lb. plantarum strain B123 indigenous dengan purifikasi parsial. Kurva standar protein 2 digunakan pada perhitungan protein pada tahap hidrolisis laktosa pada susu UHT.
Uji Aktivitas dan Stabilitas β-Galaktosidase pada Berbagai pH. Uji aktivitas β-galaktosidase pada berbagai pH dilakukan dengan cara sebagai berikut; sebanyak 100 µL crude enzyme dimasukkan ke dalam 1 mL buffer 0.1 M variasi pH 4.5–8.5 (dengan selang pH 0.5), selanjutnya uji aktivitas β -galaktosidase dilakukan dengan metode Lu et al. modifikasi (2009). Aktivitas enzim kemudian dinyatakan sebagai aktivitas relatif (%) dengan cara perhitungan pada Lampiran 6. Nilai pH yang memberikan aktivitas relatif terbesar menunjukkan pH optimum β-galaktosidase. Uji stabilitas β-galaktosidase pada berbagai pH dilakukan dengan cara sebagai berikut; 50 µL crude enzyme dimasukkan ke dalam 50 µL buffer 0.1 M variasi pH 4.5–8.5 (dengan selang pH 0.5). Campuran enzim dan buffer tersebut kemudian disimpan di suhu 37C selama 1 jam, lalu didinginkan di dalam cool room dan ditambahkan 1 mL buffer 0.1 M pH optimum, selanjutnya uji aktivitas β-galaktosidase dilakukan dengan metode Lu et al. modifikasi (2009). Aktivitas enzim kemudian dinyatakan dalam U/mL.
18
t1/2 = 0.693/k
Aplikasi β-Galaktosidase untuk Hidrolisis Laktosa pada Susu UHT
Hidrolisis Laktosa pada Susu UHT Berlemak Dievaluasi dengan Kit Enzimatik GOD-POD). β-Galaktosidase hasil dialisis dimasukkan ke dalam susu UHT berlemak sebanyak 4.8 U/mL susu. Sampel diinkubasi pada suhu optimum dengan waktu inkubasi optimum. Kontrol adalah susu UHT berlemak tanpa penambahan β-galaktosidase atau dinyatakan sebagai perlakuan jam ke-0. Setiap jam (jam ke-0 sampai jam ke-12) dilakukan pengambilan sampel sebanyak 250 L, kemudian dilakukan analisis glukosa menggunakan kit enzimatik GOD-POD. Pada tahap ini akan dilihat pengaruh penambahan β -galaktosidase terhadap kenaikan konsentrasi glukosa sampel dengan perlakuan β -galaktosidase. Perhitungan konsentrasi glukosa terdapat pada Lampiran 21.
Analisis Laktosa Menggunakan Kit Enzimatik GOD-POD. Sebanyak 1 ml reagen GOD-POD di pre-warm selama 5 menit pada suhu 37C. Sampel susu UHT berlemak (kontrol dan perlakuan β-galaktosidase) sebanyak 10 L ditambahkan ke dalam reagen GOD-POD tersebut dan kemudian diinkubasi selama 10 menit pada suhu 37C. Larutan dianalisis menggunakan spektrofotometer UV-Vis pada 505 nm. Absorbansi yang diperoleh dibandingkan dengan absorbansi standar glukosa 100 mg/dL. Kemudian jumlah glukosa yang terbentuk pada kondisi percobaan dinyatakan dalam satuan mg/dL kemudian diubah ke dalam %(b/v).
Perhitungan jumlah laktosa yang tidak terhidrolisis (Kishore dan Kayastha 2012). Jumlah laktosa yang tidak terhidrolisis dihitung dengan cara sebagai berikut:
% laktosa yang tidak terhidrolisis = glukosa (tanpa treatment enzim) × 100 glukosa (dengan treatment enzim)
Buat grafik hubungan antara log % laktosa yang tidak terhidrolisis (sumbu y) dan waktu (sumbu x).
Laju reaksi (k) = 2.303 log 100 t 100-x x = laktosa yang tidak terhidrolisis
t1/2 = waktu yang diperlukan untuk menghidrolisis laktosa sebanyak 50%
k = konstanta laju reaksi
19 dengan membran filter berukuran 0.2 µm dan dilakukan pengujian aktivitas enzim dan kadar protein.
Prosedur sampling yang dilakukan adalah sebagai berikut: sebanyak 12 mL susu UHT (berlemak dan rendah lemak) dimasukkan ke dalam shaking waterbath dengan suhu 50C selama 10 menit dan 70 rpm. β-Galaktosidase hasil dialisis sebanyak 4.8 U/mL susu dan 7.2 U/mL susu ditambahkan ke dalam susu UHT, kemudian dilakukan inkubasi pada suhu 50C. Sampling sebanyak 2.25 mL dilakukan pada jam ke 0, 1, 3, 5, 7, dan 9, lalu dilakukan inaktivasi enzim pada suhu 80C selama 15 menit. Sampling dilakukan sebanyak 2 ulangan.
Persiapan sampel sebelum dianalisis dengan HPLC adalah sebagai berikut: Sebanyak 1 mL sampel susu yang telah diberi perlakuan ditambahkan 9 mL etanol absolut dan disentrifugasi pada 3500 rpm (2270 × g) pada suhu 4C selama 60 menit. Supernatan dipipet ke dalam labu takar dan ditera dengan akuabides sampai volumenya 10 mL. Larutan standar gula campuran (laktosa, glukosa dan galaktosa) dilarutkan dengan akuabides sehingga memiliki deret konsentrasi 62.5, 125, 250, 500 dan 1000 µg/mL. Sampel dan standar gula disaring dengan regenerated selulose membrane 0.45 µm.
Laktosa, glukosa dan galaktosa pada standar dan sampel dianalisis dengan HPLC. Instrumen yang digunakan adalah HPLC 1200 series (Agilent Technologies, Amerika Serikat) dengan kolom Aminex HPX-87H ion exclusion column (300 mm × 7.8 mm) dan detektor Refractive Index 1200 series (Agilent Technologies, Amerika Serikat). Fase gerak yang digunakan adalah asetonitril 5% dalam H2SO4 5 mM. Laju alir yang digunakan adalah 0.6 mL/menit dengan manual sample loop 20 µL. Larutan standar gula campuran dan sampel ke