FRAKSI NONPOLAR EKSTRAK METANOL
BUAH SINYO NAKAL (
Duranta repens
)
RIZKI AMILIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Fraksi Nonpolar Ekstrak Metanol Buah Sinyo Nakal (Duranta repens) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2013
Rizki Amilia
i
ABSTRAK
RIZKI AMILIA. Fraksi Nonpolar Ekstrak Metanol Buah Sinyo Nakal (Duranta repens). Dibimbing oleh PURWANTININGSIH SUGITA dan BUDI ARIFIN.
Simplisia kering-udara buah sinyo nakal asal Jombang, Jawa Timur diekstraksi secara maserasi dengan pelarut n-heksana kemudian fraksi tak-tersabunkan diekstraksi kembali dengan pelarut metanol. Berdasarkan hasil uji fitokimia, ekstrak n-heksana tak-tersabunkan hanya mengandung metabolit sekunder steroid, sedangkan ekstrak metanol mengandung alkaloid, flavonoid, tanin, dan steroid. Kromatogram gas-spektrum massa dari ekstrak n-heksana tak-tersabunkan didominasi oleh kelompok senyawa alkana dengan kelimpahan tertinggi pada senyawa eikosana. Ekstrak metanol bebas-tanin menghasilkan 10 fraksi dengan menggunakan kromatografi cair vakum. Fraksi B difraksionasi lebih lanjut menggunakan kromatografi radial dan menghasilkan 6 fraksi. Pemisahan fraksi B2 dengan kromatografi lapis tipis preparatif mendapatkan fraksi B21 dan
B22 yang memiliki noda tunggal. Namun, kromatogram gas-spektrum massa
kedua fraksi tersebut masih menunjukkan banyak senyawa yang didominasi berturut-turut oleh golongan asam karboksilat dan keton.
Kata kunci: Duranta repens, fraksionasi, nonpolar, sinyo nakal
ABSTRACT
RIZKI AMILIA. Nonpolar Fractions of Duranta repens Fruit’s Methanol Extract. Supervised by PURWANTININGSIH SUGITA and BUDI ARIFIN.
Air-dried simplicia of Duranta repens from Jombang, East Java was extracted by maceration with n-hexane followed by re-extraction of the unsaponifialbe n-hexane ectract with methanol. Based on phytochemical test results, the unsaponifiable n-hexane extract contained only steroids as the secondary metabolite, wheres the methanol extract contained alkaloids, flavonoids, tannins, and steroids. Gas chromatogram-mass spectrum of the unsaponifiable n-hexane extract was dominated by alkanes with eicosane as the most abundant compound. Tannin-free methanol extract resulted 10 fractions by using vacuum liquid chromatography. Fraction B was further fractionated by radial chromatography yielding 6 fractions. Fractionation of fraction B2 using
preparative thin layer chromatography obtained B21 and B22 fractions which
showed single spot. The gas chromatogram-mass spectrum, however, still showed many compounds dominated by carboxylic acids and ketones, respectively.
FRAKSI NONPOLAR EKSTRAK METANOL
BUAH SINYO NAKAL (
Duranta repens
)
RIZKI AMILIA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Fraksi Nonpolar Ekstrak Metanol Buah Sinyo Nakal (Duranta repens)
Nama : Rizki Amilia
NIM : G44080058
Disetujui oleh
Diketahui oleh
Dr Eti Rohaeti, MS Plt. Ketua Departemen
Tanggal lulus:
Prof Dr Purwantiningsih Sugita, MS Pembimbing I
PRAKATA
Assalamu’alaikum wr. wb.
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah dengan judul “Fraksi Nonpolar Ekstrak Metanol Buah Sinyo Nakal (Duranta repens)”. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan April 2012 hingga Mei 2013 di Laboratorium Kimia Organik, Departemen Kimia, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih atas semua bimbingan, dukungan, dan kerja sama yang telah diberikan oleh Ibu Prof Dr Purwantiningsih Sugita, MS selaku pembimbing I dan Bapak Budi Arifin, SSi, MSi selaku pembimbing II. Terima kasih juga kepada Bapak Sabur dan Ibu Yenni Karmila atas bantuannya selama penelitian. Ungkapan terima kasih juga disampaikan kepada Ayah, Ibu, serta keluarga atas doa, nasihat, bantuan materi, dan kasih sayangnya. Ucapan terima kasih pula kepada Indra Bayu, Sigit, Kartika, Amin, Taufik, Junaenah, serta Rivai yang telah membantu memberi masukan, saran, kebersamaan, dukungan, dan semangat kepada penulis selama menjalankan penelitian.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2013
DAFTAR ISI
DAFTAR TABEL ivii
DAFTAR GAMBAR ivii
DAFTAR LAMPIRAN ivii
PENDAHULUAN 1
BAHAN DAN METODE 2
Alat dan Bahan 2
Metode Penelitian 2
HASIL DAN PEMBAHASAN 4
Kadar Air dan Hasil Ekstraksi 4
Kandungan Fitokimia Ekstrak 5
Hasil Isolasi Komponen Kimia 6
Identitas Komponen Kimia Berdasarkan Analisis GC-MS
Ekstrak n-heksana 10
Identitas Komponen Kimia Berdasarkan Analisis GC-MS
Fraksi B21 dan B22 11
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
DAFTAR TABEL
1 Kandungan fitokimia D. repens 5
2 Bobot fraksi hasil KCV ekstrak metanol bebas-tanin 8 3 Nilai Rfdan bobot fraksi hasil KR fraksi B 9 4 Komponen ekstrak fraksi tak-tersabunkan ekstrak n-heksana D. repens
dari Kabupaten Jombang, Jawa Timur 10
5 Hasil GLC fraksi tak-tersabunkan seluruh bagian tanaman
D. repens dari Giza, Mesir 11
DAFTAR GAMBAR
1 Batang, daun, buah, dan bunga sinyo nakal 1 2 Reaksi penyabunan trigliserida dengan basa kuat 5 3 Kromatogram ekstrak metanol bebas-tanin dan endapan tanin
di bawah sinar UV (λ = 254 nm) 5
4 Kromatogram ekstrak metanol bebas-tanin pada berbagai eluen 7 5 Kromatogram ekstrak metanol bebas-tanin pada berbagai komposisi
eluen n-heksana-etil asetat 7
6 Kromatogram hasil KCV metanol bebas-tanin dalam eluen
n-heksana-etil asetat (7:3) 8
7 Kromatogram fraksi B dan C dengan eluen n-heksana-etil asetat (11:3) 8
8 Kromatogram fraksi B pada berbagai eluen 9
9 Kromatogram fraksi B setelah KR 9
10 Kromatogram fraksi B21 dan B22 dengan eluen aseton (A),
diklorometana (B), dan n-heksana (C) 10
DAFTAR LAMPIRAN
1 Diagram alir penelitian 15
2 Kadar air dan rendemen 16
3 Hasil uji fitokimia 17
4 Kromatogram GC-MS fraksi tak-tersabunkan ekstrak n-heksana 18
5 Kromatogram GC-MS fraksi B21 20
PENDAHULUAN
Sinyo nakal (Duranta repens) (Gambar 1) adalah sejenis tanaman hias famili Verbenaceae yang biasa ditanam sebagai pagar hidup. Genus Duranta
terdiri atas 35 spesies, salah satunya adalah D. repens (sinonim: D. plumieri, D. erecta, D. microphylla) (Wiart 2011 dan Andreu et al. 2010). Tanaman ini banyak ditemukan di daerah tropis seperti wilayah barat India, Pakistan, tengah dan selatan Amerika. D. repens dapat tumbuh pada berbagai jenis tanah dari dataran rendah dekat pantai sampai pegunungan pada ketinggian 5–2000 m di atas permukaan laut. Sinyo nakal dibudidayakan hampir di seluruh wilayah Indonesia (Anonim tt).
Gambar 1 Batang, daun, buah, dan bunga sinyo nakal (Jacqueline 2007).
D. repens banyak dibudidayakan sebagai tanaman hias di daerah tropis dan subtropis di seluruh dunia (Ahmed et al. 2009). Buahnya secara tradisional dimanfaatkan sebagai obat malaria dan cacingan (Whistler 2000, diacu dalam Nikkon et al. 2008a), dan daunnya sebagai obat abses, penurun panas, diuretik, malaria, dan cacingan (Jayalakshmi et al. 2011).
Penelitian untuk menguji khasiat dan komponen aktif yang terkandung dalam D. repens telah banyak dilakukan. Beberapa khasiat yang telah dilaporkan antara lain buah dan batang D. repens memiliki aktivitas antijamur, antibakteri, sitotoksisitas, dan aktivitas larvasida terhadap larva Culex quinquefascitatus
(Nikkon et al. 2008b, 2009). Daun D. repens menunjukkan aktivitas antibakteri (Jayalakshmi et al. 2011), antioksidan (Adu et al. 2010), larvasida terhadap larva
C. quinquefascitatus (Serena et al. 2010), dan sebagai inhibitor pertumbuhan tanaman (Hiradate et al. 1999). Seluruh bagian tanaman ini juga memiliki aktivitas antioksidan, antivirus (Abou-Setta et al. 2007), antipakan, aktivitas insektisida melawan Aedes aegypti dan Attagenus piceus (Grainge dan Ahmad 1998, diacu dalam Ahmad et al. 2009), serta sebagai inhibitor enzim α -glukosidase, trombin, dan prolil endopeptidase (Anis et al. 2001; Iqbal et al.
2004).
2
Ahmed et al. 2009), iridiod glikosida (Takeda et al. 1995; Kuo et al. 1996),
kumarin dan kumarinolignoid (Anis et al. 2002; Ahmad et al. 2009), dan feniletanoid glikosida (Ahmed et al. 2009).
Belum banyak penelitian mengenai komponen kimia dalam D. repens asal Indonesia. Secara khusus, buah D. repens juga belum banyak diteliti. Oleh sebab itu, penelitian ini dilakukan untuk mencirikan komponen kimia dalam buah D. repens yang terdapat di Indonesia khususnya yang tumbuh di Kabupaten Jombang, Jawa Timur. Isolasi dan pencirian senyawa kimia dilakukan pada fraksi nonpolar dari ekstrak metanol buah.
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan antara lain penguap putar, alat distilasi, kolom untuk kromatografi cair vakum (KCV), alat kromatografi radial (KR), dan kromatografi gas-spektrometer massa (GC-MS). Kromatografi gas GC-17A (Shimadzu) ditandem dengan spektrometer massa MS QP 5050A yang menggunakan metode ionisasi serangan elektron (EI).
Bahan-bahan yang dipakai adalah sampel buah sinyo nakal (D. repens) yang berasal dari Kabupaten Jombang, Jawa Timur, metanol, etil asetat, dan n-heksana, asam sulfat p.a, pereaksi Wagner, Mayer, Dragendorf, dan Lieberman-Buchard, NaOH 10%, dan FeCl3 1%. Silika gel yang digunakan meliputi silika gel Merck
60 G, silika gel Merck 60 PF254, dan pelat kromatografi lapis tipis (KLT) Merck
60 Kiesel GF254.
Metode Penelitian
Penelitian ini terdiri atas tahap preparasi sampel, ekstraksi maserasi dengan pelarut metanol, uji fitokimia (Harborne 1987), serta isolasi (Hermawati 2009) dan pencirian komponen kimia. Diagram alir penelitian dapat dilihat pada Lampiran 1.
Preparasi Simplisia
Sampel buah D. repens sebanyak 2.278 kg dikeringudarakan kemudian dihaluskan menggunakan blender. Simplisia dimaserasi dalam pelarut n-heksana selama 24 jam sebanyak 3 kali ulangan. Filtrat (ekstrak n-heksana) disaponifikasi dengan NaOH 0.5 N hingga terbentuk 2 lapisan. Lapisan atas (fraksi tak-tersabunkan) dipisahkan dan dipekatkan dengan penguap putar. Residu hasil maserasi dengan n-heksana dimaserasi kembali dengan metanol selama 24 jam sebanyak 3 kali ulangan. Filtrat (ekstrak metanol) dikumpulkan dan dipekatkan dengan penguap putar.
Penentuan Kadar Air (AOAC 950.46 (B) 2007)
3
dipanaskan di dalam oven bersuhu 105 oC selama 3 jam, lalu didinginkan di dalam eksikator dan ditimbang. Pemanasan kembali dilakukan di dalam oven hingga diperoleh bobot konstan. Kadar air contoh ditentukan dengan persamaan
Kadar air (%) =
× 100% Keterangan: A = bobot contoh basah (g)
B = bobot contoh kering (g) Uji Fitokimia (Harborne 1987)
Uji alkaloid dilakukan dengan mencampurkan 0.25 g ekstrak dengan 2.5 mL kloroform-amonia kemudian disaring. Filtrat yang diperoleh ditambah H2SO4
2 M beberapa tetes, kemudian dikocok hingga terbentuk 2 lapisan. Lapisan asam (tidak berwarna) dibagi 3 ke dalam tabung reaksi, lalu ditambahkan beberapa tetes pereaksi Mayer, Wagner, dan Dragendorf. Uji positif alkaloid apabila berturut-turut terbentuk endapan putih, cokelat, dan merah jingga.
Uji triterpenoid dan steroid dilakukan dengan mencampurkan 0.1 g ekstrak dengan 5 mL etanol kemudian dipanaskan pada 50 °C dan disaring. Filtrat diuapkan hingga kering kemudian dilarutkan dengan eter. Lapisan eter diteteskan di atas pelat tetes, dikeringudarakan, lalu ditambahkan pereaksi Lieberman-Buchard. Uji positif triterpenoid jika terbentuk warna merah, dan positif steroid jika terbentuk warna hijau atau biru.
Uji saponin dan tanin dilakukan dengan mencampurkan 0.1 g ekstrak dengan 10 mL akuades kemudian dipanaskan hingga mendidih selama 5 menit. Larutan disaring dan dibagi 2. Sebagian filtrat didinginkan, lalu dikocok hingga berbusa. Hasil uji positif saponin jika busa tidak menghilang setelah 10 menit. Sebagian lagi ditambahkan larutan FeCl3 1%. Hasil uji positif tanin ditandai
dengan terbentuknya warna biru tua atau hijau kehitaman.
Uji fenol dan flavonoid dilakukan dengan mencampurkan 0.1 g ekstrak dengan 15 mL air, kemudian dididihkan selama 2 menit dan disaring. Untuk uji fenol, 5 mL filtrat ditambahkan NaOH 10% beberapa tetes. Terbentuknya warna merah menunjukkan adanya senyawa fenolik. Untuk uji flavonoid, 2 mL filtrat ditambahkan 0.1 g serbuk Mg, 1 mL alkohol klorhidrat (campuran HCl 37% dan etanol 95% dengan volume yang sama), dan 5 mL amil alkohol. Tabung dikocok kuat. Hasil uji positif flavonoid ditunjukkan oleh terbentuknya warna merah, kuning, atau jingga pada lapisan amil alkohol. .
Pemisahan Komponen Kimia Ekstrak Metanol
Jumlah komponen dalam ekstrak metanol ditentukan dengan KLT, menggunakan pelat silika gel G60F254 sebagai fase diam dan berbagai pelarut,
4
Isolasi (Hermawati 2009)
Proses isolasi dilakukan dalam 2 tahapan, yaitu fraksionasi dan pemurnian. Ekstrak metanol ditambahkan pelarut aseton dan didiamkan sesaat. Endapan tanin dipisahkan dengan cara dekantasi dan filtrat difraksionasi menggunakan metode kromatografi cair vakum (KCV).
Sebelum difraksionasi dengan KCV, dilakukan dulu pencarian eluen terbaik untuk KCV. Metodenya sama seperti penentuan jumlah komponen kimia, tetapi eluen terbaik ditentukan dari campuran eluen yang menahan pergerakan sampel dengan eluen yang menggerakkan sampel hingga mendekati garis batas pelarut. Eluen yang terpilih untuk KCV adalah n-heksana-etil asetat yang ditingkatkan kepolarannya dengan silika gel GF254 sebagai fase diam.
Pemurnian fraksi KCV lebih lanjut menggunakan kromatografi radial (KR). Berdasarkan hasil pencarian eluen terbaik, eluen n-heksana digunakan untuk KR. Fraksi terpilih dilarutkan dalam etil asetat, kemudian dielusi dengan n-heksana sampai noda pertama terelusi semua. Noda berikutnya dielusi dengan meningkatkan kepolaran eluen dengan menambahkan etil asetat.
Pencirian komponen kimia
Komponen kimia buah D. repens hasil fraksionasi dan pemurnian dianalisis menggunakan GC-MS dengan kolom kapiler DB-5 ms (J&W) (silika 30 m × 250 µm × 0.25 µm) digunakan pada suhu kolom 50 °C (0 menit) hingga 290 °C dengan laju 15 °C/menit menggunakan gas pembawa helium pada tekanan tetap 7.6411 psi. Pangkalan data MS yang digunakan adalah Wiley 9N tahun 2010.
HASIL DAN PEMBAHASAN
Kadar Air dan Hasil Ekstraksi
Kadar air menunjukkan banyaknya air yang terkandung dalam suatu bahan, dinyatakan dalam persen. Dalam analisis bahan, kadar air digunakan sebagai faktor koreksi bobot dalam menghitung rendemen ekstrak dan untuk memperkirakan ketahanan selama penyimpanan. Buah D. repens segar setelah dikeringudarakan dan dihaluskan memiliki kadar air 11.97% (Lampiran 2).
Sampel diekstraksi dengan metode maserasi secara seri menggunakan 2 jenis pelarut yang berbeda kepolarannya, yaitu n-heksana dan metanol. Maserasi dalam n-heksana digunakan untuk mengekstraksi senyawa nonpolar, sedangkan pelarut metanol akan mengekstraksi senyawa polarnya. Ekstrak n-heksana dan metanol diuapkan dengan penguap putar dan didapatkan ekstrak n-heksana pekat berwarna kuning sebanyak 45.20 g dan ekstrak metanol pekat berwarna cokelat sebanyak 465.7 g. Rendemen yang diperoleh berturut-turut adalah 2.25% dan 23.21% (Lampiran 2).
5
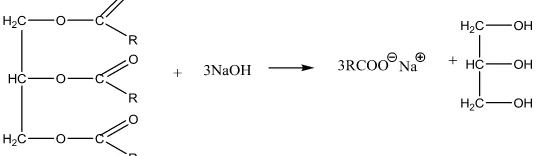
Gambar 2 Reaksi penyabunan trigiserida dengan NaOH
Ekstrak metanol sebanyak 114 g dilarutkan dengan aseton untuk dipisahkan taninnya. Tanin yang bersifat sangat polar akan mengendap dan menyisakan fraksi bebas-tanin sebanyak 78.64 g. Ekstrak metanol bebas-tanin dan tanin dianalisis profil KLT-nya dengan eluen n-heksana-etil asetat (7:3). Gambar 3 memperlihatkan bahwa tanin berhasil dipisahkan dari ekstrak metanol kasar (noda B), tetapi ekstrak metanol bebas-tanin masih mengandung sisa tanin (noda A).
Gambar 3 Kromatogram ekstrak metanol bebas-tanin (A) dan endapan tanin (B) di bawah sinar UV (λ = 254 nm)
Kandungan Fitokimia Ekstrak
Uji fitokimia dilakukan untuk menentukan golongan senyawa metabolit sekunder yang terkandung dalam ekstrak buah D. repens. Hasil uji fitokimia pada Tabel 1 menunjukkan bahwa ekstrak kasar metanol mengandung tanin, saponin, alkaloid, flavonoid, dan steroid, sedangkan ekstrak n-heksana tak-tersabunkan mengandung steroid. Banyaknya jenis metabolit sekunder yang dapat diidentifikasi menunjukkan bahwa proses pengeringan sampel tidak merusak metabolit sekunder dalam buah D. repens.
Tabel 1 Kandungan fitokimia D. repens
Metabolit Sekunder Ekstrak Metanol
Ekstrak
n-Heksana Tak-tersabunkan
Tanin + -
Saponin + -
Alkaloid + -
Flavonoid + -
Steroid + +
Triterpenoid - -
Keterangan: – : Hasil negatif + : Hasil positif
6
Senyawa steroid hampir semuanya bersifat nonpolar sehingga terekstraksi oleh n-heksana. Ekstrak kasar metanol mengandung lebih banyak jenis metabolit sekunder karena pelarut metanol dapat melarutkan hampir semua senyawa organik baik polar maupun nonpolar. Metanol memiliki tetapan dielektrik yang tinggi dan struktur molekulnya kecil sehingga mampu menembus jaringan tanaman dan mengekstraksi senyawa organik. Gambar hasil uji fitokimia ditampilkan pada Lampiran 3.
Uji fitokimia sebelumnya pernah dilakukan pada daun D. repens. Menurut Jayalaksmi et al. (2011), terkandung tanin, saponin, flavonoid, steroid, dan terpenoid, sedangkan menurut Serena et al. (2010), terkandung tanin, saponin, alkaloid, flavonoid, dan terpenoid. Senyawa terpenoid yang teridentifikasi pada daun tidak ditemui pada buah D. repens. Hal ini dapat disebabkan oleh tidak meratanya penyebaran metabolit sekunder pada setiap bagian tanaman D. repens.
Berbagai penelitian juga telah dilakukan untuk mengisolasi senyawa metabolit sekunder dari seluruh bagian D. repens. Ahmad et al. (1998) telah berhasil mengisolasi senyawa steroid (22E,24 )-24-etil-3-oksokolesta-4,22(23)-dien-25-ol dari ekstrak kloroform D. repens. Anis et al. (2002) berhasil mengisolasi 5α,8α-epidioksiergosta-6,22-dien-3β-ol dan -6,9,22-trien-3β-ol dari fraksi larut-kloroform ekstrak etanol seluruh bagian D. repens asal Pakistan. Abou-Setta et al. (2007) mengisolasi β-sitosterol dari ekstrak metanol bagian aerial tanaman D. repens dari Giza, Mesir, sementara Kuo et al. (1996) mengisolasi turunnya, yaitu β-sitosterol-3-O--D-glukopiranosida.
Kelompok senyawa flavonoid yang diisolasi sebagian besar merupakan golongan flavon dan flavonol. Ahmed et al. (2009) mengisolasi senyawa flavon (akasetin, diosmetin, apigenin, luteolin) dan flavonol kuersetin pada daun D. repens dari Giza, Mesir. Dari Pakistan, Anis et al. (2001) berhasil mengisolasi flavonol terakilasi-C3,7,4'-trihidroksi-3'-(4-hidroksi-3-metilbutil)-5,6-dimetoksi-flavon; 3,7-dihidroksi-3'-(4-hidroksi-3-metilbutil)-5,6,4’-trimetoksiflavon; dan 3,5,4’-trihidroksi-6,7-dimetoksiflavon pada seluruh bagian tanaman D. repens. Penelitian lanjutan berhasil mengisolasi flavonoid terisoprenilasi, 5,7-dihidroksi-3’-(2-hidroksi-3-metil-3-butenil)-3,6,4’-trimetoksiflavon; 3,7-dihidroksi-3’ -(2-hidroksi-3-metil-3-butenil)-5,6,4’trimetoksiflavon; dan 5-hidroksi-3,6,7,4’ -tetrametoksiflavon (Anis et al. 2002). Peneliti yang lain juga melaporkan flavonol glikosida, 7-O-α-D-glukopiranosil-3,4-dihidroksi-3’-(4”-asetoksil-3” -metilbutil)-6,4’-dimetoksiflavon dan 5,6-dimetoksiflavon; serta flavonol aglikon 3,7,4’ -trihidroksi-3’-(8”-asetoksil-7”-metiloktil)-6,6-dimetoksiflavon (Iqbal et al. 2004). Hanya satu flavanon telah diisolasi dari ekstrak metanol D. repens dari Giza (Mesir), yaitu naringenin (Abou-Setta et al. 2007).
Hasil Isolasi Komponen Kimia
7
Sebelum ekstrak metanol bebas-tanin difraksionasi dengan KCV, terlebih dulu ditentukan campuran eluen yang akan digunakan. Kromatogram KLT pada Gambar 4 menunjukkan bahwa eluen n-heksana dan kloroform tidak cukup polar untuk menggerakkan komponen dalam sampel. Aseton menghasilkan noda yang berekor dan hanya terelusi hingga setengah lintasan ke garis batas elusi, sedangkan metanol menghasilkan noda yang berekor juga, tetapi noda terelusi hingga garis batas elusi, yang menunjukkan bahwa metanol terlalu polar. Eluen etil asetat dan dietil eter memberikan lebih banyak noda daripada eluen-eluen sebelumnya. Eluen dietil eter memberikan 3 noda, etil asetat memberikan 4 noda yang terpisah dengan baik.
Gambar 4 Kromatogram ekstrak metanol bebas-tanin pada berbagai eluen Dengan eluen etil asetat, masih terdapat noda yang belum memisah sempurna, maka dibuat komposisi campuran etil asetat dengan eluen yang tidak memisahkan komponen, yaitu n-heksana, hasilnya ditunjukkan pada Gambar 5. Berdasarkan hasil tersebut, deret eluen heksana-etil asetat digunakan secara gradien berundak (step gradient) mengikuti peningkatan kepolaran, yaitu 200 mL
n-heksana, 2×200 mL n-heksana-etil asetat 8:2, 2×200 mL 6:4, 4×200 mL 1:1, 2×200 mL 4:6, 2×200 mL 3:7, dan 2×200 mL etil asetat. Setelah dielusi dengan etil asetat, pita yang belum terelusi dibilas dengan metanol. Pemilihan ini didasarkan atas kemunculan noda yang terlihat jelas dan terpisah dengan cukup baik dengan campuran eluen tersebut.
Keterangan:
Gambar 5 Kromatogram ekstrak metanol bebas-tanin pada berbagai komposisi perbandingan eluen n-heksana-etil asetat
Eluat KCV kemudian diperiksa pola pemisahannya dengan KLT menggunakan eluen n-heksana-etil asetat 7:3. Berdasarkan kesamaan pola
8
pemisahan pada KLT (Gambar 6), didapatkan 10 fraksi hasil KCV. Bobot tiap fraksi ditunjukkan pada Tabel 2.
Gambar 6 Kromatogram eluat hasil KCV ekstrak metanol bebas-tanin dalam eluen n-heksana-etil asetat (7:3)
Tabel 2 Bobot fraksi hasil KCV ekstrak metanol bebas-tanin Fraksi Bobot (mg) Jumlah Noda
A 2.70 1
B 283.4 2
C 181.6 3
D 114 2
E 209.6 1
F 431.3 2
G 409.6 3
H 359.8 2
I 220 2
J 11854 2
Pemilihan fraksi yang akan dimurnikan lebih lanjut didasarkan pada bobot yang besar dengan noda paling sedikit dan kepolaran fraksi. Fraksi A memiliki noda tunggal, tetapi bobotnya hanya 2.70 mg sehingga tidak dapat dianalisis lebih lanjut. Fraksi B dan C cukup besar bobotnya dan dipilih untuk dianalisis. Sementara fraksi D−J tidak dipilih karena bukan fraksi nonpolar.
Analisis fraksi B dan C dengan eluen n-heksana-etil asetat 11:3 menunjukkan 5 noda pada fraksi B dengan Rf berturut-turut 0.90, 0.78, 0.62, 0.55, dan 0.19 serta 9 noda pada fraksi C (Gambar 7). Oleh karena fraksi B memiliki jumlah noda lebih sedikit, fraksi ini dianalisis kembali dengan eluen n- heksana-etil asetat 7:3 dan terbentuk 3 noda dengan Rf berturut-turut 0.97, 0.91, dan 0.86. Hal ini membuktikan bahwa fraksi B bersifat nonpolar.
9
Fraksionasi lanjutan fraksi B dilakukan dengan menggunakan kromatografi radial (KR). Sebelumnya, eluen untuk KR ditentukan terlebih dahulu. Berdasarkan Gambar 8, eluen n-heksana digunakan untuk KR karena memberikan 2 noda dengan pemisahan yang baik (Rf berturut-turut 0.64 dan 0.22). Eluen diklorometana juga memberikan pemisahan yang baik, namun jarak antarnoda terlalu dekat sehingga eluen ini tidak digunakan.
Keterangan: A = n-heksana B = kloroform C = diklorometana D = dietil eter E = etil asetat F = aseton G = metanol H = etanol
Gambar 8 Kromatogram fraksi B pada berbagai eluen
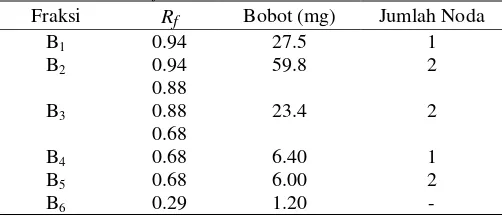
Fraksi B dilarutkan dalam etil asetat kemudian dielusi dengan n-heksana sampai noda pertama terelusi semua. Noda kedua selanjutnya dielusi dengan meningkatkan kepolaran eluen dengan menambahkan etil asetat, berturut-turut 3×30 mL n-heksana-etil asetat 7:0.5, 2×32 mL 7:1, 4×34 mL 7:1.5, 2×36 mL 7:2, 2×50 mL etil asetat, dan 2×50 mL metanol. Berdasarkan kesamaan pola kromatogramnya (Gambar 9), diperoleh 6 fraksi KR. Nilai Rfdan bobot tiap fraksi ditunjukan pada Tabel 3.
Gambar 9 Kromatogram fraksi B setelah KR Tabel 3 Nilai Rfdan bobot fraksi hasil KR fraksi B Fraksi Rf Bobot (mg) Jumlah Noda
B1 0.94 27.5 1
B2 0.94
0.88
59.8 2
B3 0.88
0.68
23.4 2
B4 0.68 6.40 1
B5 0.68 6.00 2
B6 0.29 1.20 -
Fraksi B1 dan B2 memiliki bobot yang cukup besar sehingga dapat dianalisis
lebih lanjut. Noda pertama pada fraksi B2 memiliki Rf yang sama dengan noda tunggal pada B1 maka diduga merupakan senyawa yang sama. Fraksi B2
10
memisahkan 2 noda yang berdekatan. Diperoleh 2 fraksi, yaitu B21 dan B22 (B21 =
13.5 mg dan B22 = 10.1 mg). Kedua fraksi tersebut kemudian diuji menggunakan
KLT dengan eluen tunggal, yaitu n-heksana, diklorometana, dan aseton menghasilkan noda tunggal (Gambar 10) sehingga dapat dianalisis lebih lanjut dengan GC-MS.
Keterangan: 1 = fraksi B21
2 = fraksi B22
Gambar 10 Kromatogram fraksi B21 dan B22 dengan eluen aseton (A),
diklorometana (B), n-heksana (C)
Identitas Komponen Kimia Berdasarkan Analisis GC-MS Ekstrak n-Heksana
Ekstrak n-heksana tak-tersabunkan dianalisis menggunakan GC-MS dan menghasilkan kromatogram pada Lampiran 4. Berdasarkan hasil GC-MS, fraksi tak-tersabunkan masih mengandung kelompok senyawa lipid (Tabel 4). Proses penyabunan yang dilakukan tanpa pemanasan ternyata belum berjalan dengan sempurna. Reaksi penyabunan berjalan lambat tanpa bantuan katalis atau kondisi lingkungan seperti proses pemanasan (Destryana 2011).
Tabel 4 Komponen fraksi tak-tersabunkan ekstrak n-heksana D. repens dari Kabupaten Jombang, Jawa Timur
Nama senyawa tR %Area
Tridekana 13.936 0.36
Tetradekana 14.859 3.03
Nonadekana 17.317 0.40
1-Oktadekena 18.038 4.96
Asam heksadekanoat 19.590 3.92
Asam 9,12-oktadekadienoat 20.899 3.71
Asam linoleat 21.117 3.28
7-Pentadekuna 24.833 7.13
2,6,10,15,19,23-Heksametil-2,6,10,14,18,22-tetrakosaheksaena 32.249 4.79
Vitamin E 45.369 4.66
Eikosana 54.848 20.40
Senyawa-senyawa dalam fraksi tak-tersabunkan telah dilaporkan oleh Abou-Setta et al. (2007) dari seluruh bagian tanaman D. repens asal Giza, Mesir.
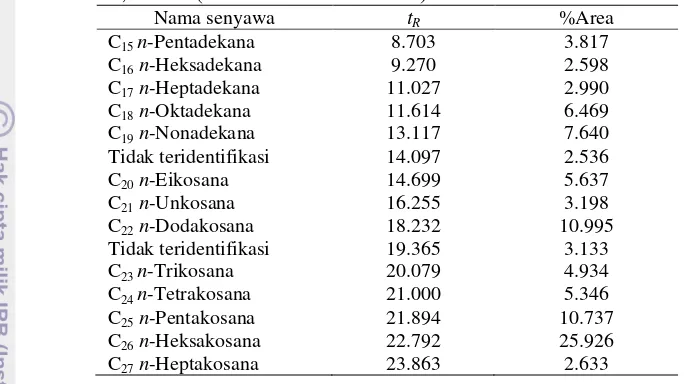
Senyawa yang terisolasi merupakan senyawa nonpolar kelompok hidrokarbon (Tabel 5). Hasil GC-MS ekstrak n-heksana tak-tersabunkan dari buah D. repens
11
seluruh bagian tanaman. Kondisi pengukuran GC-MS yang berbeda juga dapat berpengaruh.
Tabel 5 Komponen fraksi tak-tersabunkan dari seluruh bagian tanaman D. repens
Giza, Mesir (Abou-Setta et al. 2007)
Tidak teridentifikasi 14.097 2.536
C20n-Eikosana 14.699 5.637
C21n-Unkosana 16.255 3.198
C22n-Dodakosana 18.232 10.995
Tidak teridentifikasi 19.365 3.133
C23 n-Trikosana 20.079 4.934
C24 n-Tetrakosana 21.000 5.346
C25n-Pentakosana 21.894 10.737
C26n-Heksakosana 22.792 25.926
C27n-Heptakosana 23.863 2.633
Senyawa yang teridentifikasi oleh GCMS berasal dari golongan alkana dan lipid. Senyawa yang memiliki kelimpahan terbesar ialah eikosana dengan persentase area 20.40% dan waktu retensi 54.848 menit. Senyawa-senyawa yang memiliki puncak dengan intensitas tinggi adalah tetradekana, oktadekana, asam heksadekanoat, asam 9,12-oktadekadienoat, asam linoleat, 7-pentadekuna, 2,6,10,15,19,23-heksametil-2,6,10,14,18,22-tetrakosaheksaena, dan vitamin E.
Identitas Komponen Kimia Berdasarkan Analisis GC-MS Fraksi B21 dan B22
Fraksi B21 dan B22 juga dianalisis dengan GC-MS dan didapati belum murni.
Pada fraksi B21 teridentifikasi 40 senyawa (Lampiran 5), sedangkan pada fraksi
B22 terdapat 13 senyawa (Lampiran 6).
Fraksi B21 didominasi oleh kelompok senyawa lipid, asam karboksilat, dan
ester dengan puncak tertinggi ialah mono(2-etilheksil)-1,2-benzenedikarboksilat dengan persentase area 20.68% dan waktu retensi 20.968 menit. Senyawa-senyawa lain yang memiliki puncak yang tinggi adalah asam 1,2-benzenadikarboksilat dan asam bis(2-etilheksil) heksanoat dengan persentase area berturut-turut 7.65% dan 11% dengan waktu retensi 14.671 menit dan 18.712 menit. Fraksi B22 didominasi oleh senyawa keton dengan puncak tertinggi berasal
dari 4-hidroksi-4-metil-2-pentanon dengan persentase area sebesar 37.09% dan waktu retensi 6.081 menit. Senyawa-senyawa yang juga memiliki puncak yang tinggi adalah 2,2'-oksibis-etanol dengan persentase area sebesar 22.58% dan waktu retensi 6.778 menit.
12
Fraksi larut n-butanol dari ekstrak metanol daun D. repens dari Bangkok, Thailand mengandung durantanin I−III (Hiradate et al. 1999). Fraksi larut CHCl3
dari ekstrak metanol dari Giza, Mesir mengandung β-sitoserol, sedangkan fraksi larut etil asetat dari ekstrak metanol mengandung naringenin, lamiida, akteosida, pseudo-ginsenosida-RT1. Fraksi larut etil asetat-metanol 1:1 mengandung
asetosida, fraksi larut kloroform-metanol 90:10 mengandung lamiida, dan fraksi larut CHCl3-MeOH 80:20 mengandung sukrosa dan rafinosa (Abou-Setta et al.
2007).
Senyawa-senyawa yang telah diisolasi umumnya merupakan senyawa terpenoid dan flavonoid, sedangkan hasil GC-MS fraksi B21 didominasi oleh
senyawa golongan asam karboksilat dan ester, sementara fraksi B22 didominasi
oleh senyawa keton, alkohol, dan ester. Tidak ditemukan senyawa kelompok terpenoid dan flavonoid pada kedua fraksi tersebut. Hal ini mungkin disebabkan oleh perbedaan metabolit sekunder berdasarkan tempat tumbuh dan bagian tanaman yang dianalisis. Senyawa-senyawa hasil GC-MS yang diperoleh pada fraksi B21 dan B22 belum pernah dilaporkan sebelumnya sehingga tidak dapat
dibandingkan dengan literatur.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil uji fitokimia, ekstrak kasar buah D. repens mengandung metabolit sekunder flavonoid, alkaloid, steroid, dan tanin. Hasil analisis dengan GC-MS menunjukkan bahwa ekstrak n-heksansa tak-tersabunkan didominasi dengan senyawa alkana, terutama senyawa eikosana. Hasil GC-MS pada fraksi B21 dan B22 hasil pemisahan ekstrak metanol bebas-tanin masih belum merupakan
senyawa murni dengan didominasi oleh senyawa asam karboksilat, ester, keton, dan alkohol.
Saran
Perlu ditelusuri lebih lanjut eluen pengembang yang mampu memisahkan senyawa-senyawa yang terdapat dalam setiap fraksi agar dapat diketahui secara spesifik senyawa dalam buah D. repens yang bersifat bioaktif.
DAFTAR PUSTAKA
[Anonim]. tt. Duranta repens Auct. Non Jacq [Internet]. [diunduh 2012 Mar 26]. Tersedia pada: ftp://komo.padinet.com/free/v12/ artikel/ttg_tanaman_obat/-depkes/buku5/5-028.pdf
13
Abou-Setta LM, Nazif NM, Shahat AA. 2007. Phytochemical investigation and activity of Duranta repens. J Appl Sci Res. 3:1426-1433.
Adu F, Gbedema SY, Brown P, Annan K, Boamah VE. 2011. Antibacterial and free radical scavenging activity of Duranta plumieri Linn. J Pharm Sci Res.
2:282-287.
Ahmad S, Nizami TA, Nawaz HR, Malik A, Afza N. 1998. A new steroid from
Duranta repens [abstrak]. Fitoterapia. 69:448-450.
Ahmad N, Zeb F, Ahmad I, Wang F. 2009. Repenins A–D, four new antioxidative coumarinolignoids from Duranta repens Linn. Bioorg Med Chem Lett.
19:3521-3524.
Ahmed WS, Mohamed MA, El-Dib RA, Hamed MM. 2009. New triterpene saponins from Duranta repens Linn. and their cytotoxic activity. Molecules.
14:1952-1965.
Andreu MG, Friedman MH, McKenzie M, Quintana HV, Northrop RJ. 2010.
Duranta erecta, Golden Dewdrop. Florida (US): University of Florida IFAS Extension.
Anis I, Ahmed S, Malik A, Yasin A, Iqbal M. 2002. Enzyme inhibitory constituents from Duranta repens. Chem Pharm Bull. 50:515-518.
Anis I, Anis E, Ahmed S, Mustafa G, Malik A, Amtul Z, Atta-ur-Rahman. 2001. Thrombin inhibitory constituents from Duranta repens. Helv Chim Acta.
84:649-655.
Destryana RA. 2011. Optimasi kondisi ekstraksi saponifikasi satu tahap untuk mendapatkan minyak kaya asam lemak tak jenuh majemuk kaya asam lenoleat dan asam α-linolenat dari kedelai varietas unggul [skripsi]. Malang (ID): Universitas Brawijaya.
Harborne JB. 1987. Metode Fitokimia. Padmawinata K, Soediro I, penerjemah; Niksolihin S, editor. Bandung (ID): ITB. Terjemahan dari: Phytochemical Methods.
Hermawati E. 2009. Metabolit sekunder dari salah satu tumbuhan obat Indonesia: daun Desmodium triquentrum Linn. (Fabaceae) [skripsi]. Bandung (ID): Institut Teknologi Bandung.
Hiradate S, Yada H, Ishii T, Nakajima N, Ohnishi-Kameyama M, Sugie H, Zungsontiporn S, Fujii Y. 1999. Three plant growth inhibiting saponins from Duranta repens. Phytochemistry. 52: 1223-1228.
Iqbal K, Malik A, Mukhtar N, Anis I, Khan SN, Iqbal M. 2004. α-glucosidase inhibitory constituents from Duranta repens. Chem Pharm Bull. 52:785-789.
Jayalakshmi B, Raveesha KA, Amruthesh KN. 2011. Phytochemical investigations and antibacterial activity of some medicinal plants againts pathogenic bacteria. J Appl Pharm Sci. 1:124-128.
Jacqueline. 2007. Duranta erecta / repens‘Sweet Memories’ – attracts butterflies, bees and birds [Internet]. [diunduh 2012 Mar 10]. Tersedia pada: http://www.jaycjayc.com/duranta-erecta-repens-sweet-memories/
Kuo YH, Chen ZS, Lin YL. 1996. Chemical compenents of the leaves of Duranta repens Linn. Chem Pharm Bull. 44:429-436.
Nikkon F, Habib MR, Karim MR, Hossain MS, Mosaddik MA, Haque ME.
14
Nikkon F, Hasan S, Rahman MH, Hoque MA, Mosaddik MA, Haque ME. 2008b. Biochemical, hematological and histiphatological effects of Duranta repens
stem on rats. Asian J Biochem. 2:366-372.
Nikkon F, Saud ZA, Hossain K, Parvin MS, Haque ME. 2009. Larvicidal effects of stem and fruits of Duranta repens against the mosquito Culex quinquefasciatus. J Pharm Tech Res. 4:1709-1713.
Serena MM, Balasubraman M, Rajan K, Gerald IAJ. 2010. Evaluation of the larvicidal activity of the leaf extracts of Duranta erecta Linn. (Verbenaceae) on the larvae of Culex quinquefascitatus (Say) (Culicidae). J Biopesticides. 3:582-585.
Shahat AA, Nazif NM, Abou-Setta LM, Ibrahim NA, Cos P, Miert SV, Pieter L, Vlietinck AJ. 2005. Phytochemical investigation and antioxidant activity of
Duranta repens. Phytother Res. 19:1071-1073.
Takeda Y, Morimoto Y, Matsumoto T, Ogimi C, Hirata E, Takushi A,Otsuka H. 1995. Iridoid glucosides from the leaves and stems of Duranta erecta.
Phytochemistry. 39:829-833.
Wiart C. 2011. Medicinal Plants of Asia and The Pacific. Boca Raton (US): Taylor & Francis.
Zulhipri, Kartika IR, Sumaji I. 2007. Uji fitokimia dan aktivitas antidiabetes ekstrak biji rambutan (Nephelium lappaceum L.) dengan berbagai pelarut.
15
Lampiran 1 Diagram alir penelitian
diambil 114 g Simplisia sampel kering
(2.278 kg)
Maserasi dengan n-heksana (9L)
16
Lampiran 2 Kadar air dan rendemen
17
Lampiran 3 Hasil uji fitokimia
Uji alkaloid Uji saponin
n-heksana metanol n-heksana metanol
Uji terpenoid/steroid Uji tannin
n-heksana metanol n-heksana metanol
Uji flavonoid
18
Lampiran 4 Kromatogram GC-MS fraksi tak-tersabunkanekstrak n-heksana
Pk# RT Qual Library/ID
1 13.936 95 n-Tridekana
2 13.987 87 2,4-Dekadienal
3 14.104 98 5-(2-Propenil)-1,3-benzodioksol 4 14.222 97 2,4-Dekadienal
5 14.792 97 3-Tetradekena
6 14.859 98 Tetradekana
7 15.656 97 Asam 3-fenil-2-propenat
8 16.495 93 1-Heksadekena
9 17.376 47 2-Metil-5H-dibenz[b,f]azepin 10 17.560 46 Isomer nonilfenol
11 17.644 72 Asam 3-(p-metoksibenzoil)propionat 12 17.669 93 Isomer nonilfenol
13 17.728 64 2-Asetil-1-vinilpirola
14 17.812 30 2-Metil-6-(1,1,3,3-tetrametilbutil)fenol
15 18.038 97 1-Oktadekena
16 18.089 64 5,5-Dimetil-1,2-dipropil-1,3-siklopentadiena
17 19.070 99 Heksadekanoat
18 19.406 37 1,2,3,4-Tetrahidro-1,1,4,4,6-pentametil-5,7-dinitronaftalena
19 20.454 60 Nonadekana
19
lanjutan Lampiran 4
20 20.530 64 (Z)-8-Pentadeken-1-ol asetat 21 20.714 47 2-Metil-5H-dibenz[b,f]azepin 22 20.899 93 Asam 9,12-oktadekadienoat 23 21.117 99 Asam linoleat
24 21.201 22 -
25 21.318 83 1-Dokosena
26 22.375 50 4-Metoksi-3-(3-metoksifenil)-4-metilpentan-1-ol 27 22.484 50 2-Metil-5H-dibenz[b,f]azepin
28 23.499 50 13-Sianotrisiklo[7.4.1.0(2,8)]tetradeka-2,4,6,10,12-pentaena 29 24.615 58 Siklotrisiloksana
30 24.833 89 7-Pentadekuna
31 25.135 43 1-(1',2'-bis(1''-isopropil)etanilazo]-[1,2,3-tris(t -butil)-2-siklopropena
32 26.083 49 Bis(2-etilheksil) ftalat 33 26.502 47 2-Metil-5H-dibenz[b,f]azepin
34 30.907 47 13-sianotrisiklo[7.4.1.0(2,8)]tetradeka-2,4,6,10,12-pentaena 35 32.249 99
2,6,10,15,19,23-Heksametil-2,6,10,14,18,22-tetrakosaheksaena
36 33.952 60 1-Hidroksi-2-o-fluorofenil-4-nitroimidazol-3-oksida 37 43.045 43 2-Metil-5H-dibenz[b,f]azepin
38 45.369 98 Vitamin E
39 47.768 70 2-(p-Nitrofenil)-1,3,4-oksadiazol-5-on 40 54.848 97 Eikosana
20
Lampiran 5 Kromatogram GC-MS fraksi B21
No RT Area Nama Senyawa Qual
10.00 15.00 20.00 25.00 30.00 35.00
21
lanjutan Lampiran 5
28 15.847 1.12 Asam 9,12,15-oktadekatrienoat 99
29 15.960 0.69 Asam 12-metiltetradekanoat 95
30 16.344 0.90 Fluorantena 86
31 16.544 2.77 (Z)-6-Etilidena-6H-dibenzo[b,d]tiopiran-5-oksida 90
32 16.674 0.97 2-Metil-9,10-antrasenadion 94
33 17.258 0.81 N ,N-Dimetilpalmitamida 91
34 18.085 0.54 2-Etilheksil 3-(4-metoksifenil)-2-Propenoat 96 35 18.425 0.40 4,8,12,16-Tetrametilheptadekan-4-olida 95 36 18.712 11.00 bis(2-etilheksil)-heksanadioat 98 37 19.940 1.02 Asam 9,10-dihidroksioktadekanoat 90 38 20.289 1.05 2-Hidroksi-1-(hidroksimetil)-heksadekanoat 83 39 20.968 20.68 mono(2-etilheksil)-1,2-benzenedikarboksilat 91
22
Lampiran 6 Kromatogram GC-MS fraksi B22
No RT Area% Library/ID Qual
1 6.081 37.09 4-Hidroksi-4-metil-2-pentanon 83
2 6.778 22.58 2,2'-Oksibis-etanol 83
3 7.039 4.87 Ribitol 59
4 7.135 3.83 1,1'-Oksibis-2-propanol 47
5 7.291 2.75 1-Propanol,2-(2-hidroksipropoksi) 64
6 9.599 4.72 Heksametilfosforamida 97
7 12.029 4.02 N,N-dietil-3-metilbenzamida 86
8 13.361 4.11 N-(1,1-dimetiletil)-3-metoksibenzamida 64
9 13.779 3.56 Asam heksadekanoat 97
10 15.504 2.06 2-[(tert -Butildimetilsilil)oksi]-1-isopropil-4-metilbenzena
50
11 15.608 1.23 Asam 10-Oktadekanoat 56
12 20.894 2.53 (1S*,2R*,5R*,7S *)-2,4-Dimetil-7-etil-6,8-dioksabisiklo[3.2.1]-okta-3-ena
42
13 20.981 2.55 1-Isotiosianat-3-metiladamantana 52
6.00 8.00 10.00 12.00 14.00 16.00 18.00 20.00 22.00 24.00 26.00
100000 200000 300000 400000 500000 600000 700000 800000 900000
Waktu Kelimpahan
6.084
6.774
7.043 7.139 7.290
RIWAYAT HIDUP
Penulis dilahirkan di Tanjungpandan, pada tanggal 11 Juli 1991 dari pasangan Drs. Haziarto dan Ernawati. Penulis merupakan anak pertama dari 2 bersaudara. Penulis menyelesaikan pendidikannya di Sekolah Menengah Atas (SMAN) 2 Pangkalpinang tahun 2008, kemudian melanjutkan pendidikan pada tahun 2008–2013 di Program Sarjana Departemen Kimia, IPB.
Selama menjadi mahasiswa, penulis aktif dalam kegiatan kepanitiaan seperti