UIN SYARIF HIDAYATULLAH JAKARTA
ANALISIS RESIDU PESTISIDA PADA TOMAT
MENGGUNAKAN METODE
QuEChERS
DENGAN
PERLAKUAN SEBELUM DAN SETELAH DICUCI
SKRIPSI
SILKY NAZMATULLAILA
1110102000078
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
ANALISIS RESIDU PESTISIDA PADA TOMAT
MENGGUNAKAN METODE
QuEChERS
DENGAN
PERLAKUAN SEBELUM DAN SETELAH DICUCI
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
SILKY NAZMATULLAILA
1110102000078
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ABSTRAK
Nama : Silky Nazmatullaila
NIM : 1110102000078
Program Studi : Farmasi
Judul : Analisis Residu Pestisida pada Tomat Menggunakan Metode QuEChERS dengan Perlakuan Sebelum dan Setelah Dicuci
Salah satu sayuran yang sering dikonsumsi masyarakat Indonesia adalah tomat. Tomat merupakan sayuran yang dapat dimakan tanpa dimasak sehingga kemungkinan residu pestisida yang tertinggal di permukaan lebih besar. Pada penelitian ini dilakukan berbagai perlakuan terhadap tomat yang direndam pada larutan pestisida yang mengandung deltametrin dan profenofos untuk melihat pengaruh pencucian terhadap kadar residu pestisida deltametrin dan profenofos. Perlakuan yang dilakukan yaitu tidak dicuci, pencucian dengan air mengalir, perendaman dengan larutan NaCl 0.9%, 5% dan 10%. Setelah dilakukan berbagai perlakuan, residu pestisida pada tomat diekstraksi dengan menggunakan metode QuEChERS dan dianalisis dengan menggunakan kromatografi gas. Hasilnya, perendaman dengan NaCl 10% memiliki efektivitas paling baik untuk menghilangkan deltametrin (70.798%) dan pencucian dengan air mengalir memiliki efektivitas paling rendah (53.491%). Sedangkan pada profenofos, penurunan kadar residu pestisida pada tomat hasilnya mengalami fluktuasi sehingga tidak dapat disimpulkan bahwa perendaman dengan NaCl efektif dalam mengurangi residu pestisida profenofos.
ABSTRACT
Name : Silky Nazmatullaila Program Study : Pharmacy
Title : Analysis of Pesticide Residues In Tomato Using the QuEChERS Method with Treatment Before and After Washed
One of the commonly consumed vegetables for Indonesian society is tomato. Tomato are vegetable that can be eaten without cooking, so the possibility of pesticide residues left on the surface is greater. In order to find an effective method of removing pesticide residues in vegetables, tomato soaked in a solution containing pesticides deltamethrin and profenofos then performed a variety of treatments that are not washed, washing with tap water, soaking with a solution of NaCl 0.9%, 5% and 10%. After 5 minutes the washing process, extraction of pesticide residues using the method QuEChERS. Extraction results were analyzed by gas chromatography. The results showed, soaking tomato with NaCl 10 % has the best effects (70.798%) and washing with tap water has the worse effects to remove residue deltamethrin pesticide (53 491%). While on profenofos pesticide, the result on residue reduction in tomato is fluctuating. So it can not be concluded that soaking with NaCl effective in reducing pesticide residues profenofos.
KATA PENGANTAR
Bismillahirahmaanirrahiim alhamdulillahirobbil’alamin, segala puji bagi Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penelitian dan menyusun skripsi berjudul “Analisis Residu Pestisida pada Tomat Menggunakan Metode QuEChERS dengan Perlakuan Sebelum dan
Setelah Dicuci” dengan baik sebagai salah satu syarat untuk menyelesaikan program pendidikan tingkat Strata 1 (S1) pada Program Studi Farmasi. Shalawat serta salam senantiasa penulis curahkan kepada Nabi Besar Muhammad SAW beserta keluarga, para sahabat serta para pengikut di jalan yang diridhoi-Nya.
Penulis menyadari bahwa dalam penelitian sampai penyusunan skripsi ini tidak akan terwujud tanpa adanya bantuan, bimbingan, dan dukungan dari berbagai pihak. Oleh karena itu dalam kesempatan ini penulis tidak lupa mengucapkan terimakasih kepada:
1. Ibu Irmayani dan Pak Jemmy Muharman selaku analis laboratorium Balai Pengujian Mutu Hasil Tanaman Pangan Holtikultura Provinsi DKI Jakarta (BPMHTPH) yang dengan sabar memberikan bimbingan, masukan, dukungan, dan semangat kepada penulis.
2. Ibu Lina Elfita, M.Si, Apt. dan Ibu Eka Putri, M.Si, Apt. selaku pembimbing saya, yang dengan sabar memberikan bimbingan dan saran kepada penulis. 3. Bapak Drs. Umar Mansur, M.Sc., Apt selaku Ketua Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta. 4. Kedua orang tua tercinta Ibu Nurjanah dan Bapak Nanang Asep Supriyatna yang
senantiasa memberikan kasih sayang, dukungan baik moril maupun materil, serta doa tanpa henti yang menyertai setiap langkah penulis.
6. Bapak dan Ibu Dosen yang telah memberikan ilmu dan pengetahuan hingga penulis dapat menyelesaikan studi di jurusan Farmasi FKIK UIN Syarif Hidayatullah Jakarta.
7. Temanku Deisy, Khalida, dan Farah yang telah memberi dukungan, motivasi, serta masukan kepada penulis selama pengerjaan skripsi dan selama di bangku perkuliahan.
8. Teman-teman Farmasi 2010 “Andalusia” atas persaudaraan dan kebersamaan yang telah banyak membantu dan memotivasi penulis baik selama pengerjaan skripsi ini maupun selama di bangku perkuliahan.
9. Semua pihak yang telah membantu selama penelitian dan penyelesaian naskah skripsi baik secara langsung maupun tidak langsung yang namanya tidak dapat penulis sebutkan satu persatu.
Semoga Allah SWT memberikan balasan yang berlipat ganda atas semua bantuan, dan dukungan yang diberikan. Akhir kata dengan segala kerendahan hati, penulis menyadari bahwa penyusunan skripsi ini masih belum sempurna dan banyak kekurangan. Oleh karena itu saran serta kritik yang membangun sangat diharapkan. Semoga skripsi ini dapat bermanfaat bagi penulis pada khususnya dan bagi pembaca pada umumnya. Amin Ya Robbal’alamin.
Jakarta, Februari 2015
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xvii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Tujuan Penelitian ... 4
1.4 Manfaat Penelitian ... 4
BAB 2 TINJAUAN PUSTAKA ... 5
2.1 Tomat ... 5
2.1.1 Morfologi Tomat ... 5
2.1.2 Klasifikasi Tanaman Tomat ... 6
2.1.3 Jenis Tomat ... 6
2.1.4 Kandungan Gizi ... 7
2.1.5 Hama dan Penyakit Tanaman Tomat ... 7
2.2 Pestisida ... 10
2.2.1 Definisi Pestisida ... 10
2.2.2 Penggolongan Pestisida ... 12
2.3 Insektisida ... 13
2.3.2 Penggolongan Insektisida Berdasarkan Susunan Kimia ... 14
2.4 Organofosfat ... 15
2.4.1 Profenofos ... 16
2.5 Piretroid ... 17
2.5.1 Deltametrin ... 17
2.6 Residu Pestisida dalam Tanaman ... 18
2.7 Metode QuEChERS ... 19
2.8Kromatografi Gas ... 20
2.8.1 Gas Pembawa ... 20
2.8.2 Sistem Penginjeksian Sampel ... 20
2.8.3 Kolom ... 20
2.8.4 Termostat... 21
2.8.5 Detektor ... 21
2.8.6 Rekorder ... 22
2.9Validasi Metode Analisis... 22
2.9.1 Liniearitas ... 22
2.9.2 Batas Deteksi (Limit Of Detection, LOD) ... 22
2.9.3 Batas Kuantifikasi (Limit Of Quantification, LOQ) ... 23
2.9.4 Akurasi (Ketetapan) ... 23
2.9.5 Presisi ... 24
BAB 3 METODOLOGI PENELITIAN ... 25
3.1 Alat dan Bahan ... 25
3.2 Waktu dan Tempat Penelitian ... 25
3.3 Prosedur Penelitian ... 25
3.3.1 Pengambilan Sampel ... 25
3.3.2 Determinasi Tanaman ... 25
3.3.3 Validasi Metode QuEChERS ... 26
3.3.3.1 Uji Liniearitas... 26
3.3.3.2 Uji Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) ... 28
3.3.3.3 UJi Perolehan Kembali ... 28
3.3.4 Analisis Kualitatif Residu Pestisida Deltametrin dan
Profenofos Sebelum Perendaman dengan Larutan Pestisida 29
3.3.5 Analisis Kuantitatif Residu Pestisida Deltametrin dan Profenofos Setelah Perendaman dengan Larutan Pestisida .. 29
3.3.6 Uji F (One-Way Anova)... 30
BAB 4 HASIL DAN PEMBAHASAN ... 31
4.1 Determinasi Tanaman ... 31
4.2 Validasi Metode QuEChERS ... 31
4.2.1 Uji Liniearitas... 31
4.2.2 Uji Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) ... 32
4.2.3 Uji Perolehan Kembali ... 33
4.2.4 Penentuan Standar Deviasi ... 34
4.3 Analisis Kualitatif Residu Pestisida Deltametrin dan Profenofos Sebelum Perendaman dengan Larutan Pestisida ... 35
4.3.1 Persiapan Sampel ... 35
4.3.2 Ekstraksi Residu Pestisida ... 35
4.3.3 Analisis dengan Kromatografi Gas ... 35
4.2.5 Hasil Analisis Kualitatif Residu Pestisida Deltametrin dan Profenofos Sebelum Perendaman dengan Larutan Pestisida 36
4.4Analisis Kuantitatif Residu Pestisida Deltametrin dan Profenofos Pada Tomat Sebelum dan Setelah Dicuci ... 36
4.4.1 Persiapan Sampel ... 36
4.4.2 Perlakuan Terhadap Sampel ... 36
4.4.3 Hasil Analisis Kuantitatif Residu Pestisida Deltametrin Dan Profenofos pada Tomat Sebelum dan Setelah Dicuci ... 37
4.5Uji Statistik ... 38
BAB 5 KESIMPULAN DAN SARAN ... 40
5.1 Kesimpulan ... 40
DAFTAR PUSTAKA ... 42
DAFTAR TABEL
Tabel 1. Kandungan Gizi dalam 100 gram Tomat ... 7 Tabel 2. Rata-Rata % Uji Perolehan Kembali untuk Pestisida Deltametrin
dan Profenofos Pada Tomat ... 33 Tabel 3. Rata-Rata Perolehan Kembali yang Dapat Diterima Sesuai
dengan Konsentrasi Analit ... 33 Tabel 4. Nilai % RSD untuk Pestisida Deltametrin dan Profenofos pada
Tomat ... 34 Tabel 5. Rekomendasi Nilai RSD untuk Konsentrasi Analit Berbeda ... 34 Tabel 6. Rata-Rata Kadar Residu Pestisida Deltametrin dan Profenofos
pada Tomat ... 37 Tabel 7. Rata-Rata Persentase Penurunan Pestisida Deltametrin dan
DAFTAR GAMBAR
Gambar 1. Tomat ... 5
Gambar 2. Ulat Tanah (A. ipsilon) ... 8
Gambar 3. Kutu Kebul ( B. Tabaci) ... 9
Gambar 4. Gejala Serangan Penyakit Alternaria ... 9
Gambar 5. Tanaman Tomat Terserang Penyakit Layu Fusarium ... 10
Gambar 6. Gejala Serangan Penyakit Busuk Daun ... 10
Gambar 7. Struktur Profenofos ... 16
Gambar 8. Struktur Deltametrin ... 17
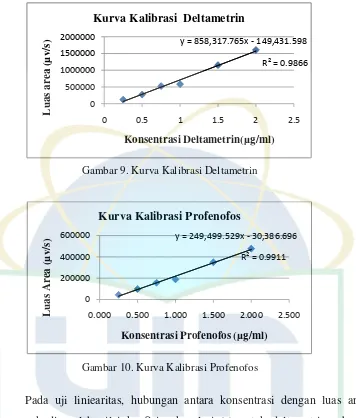
Gambar 9. Kurva Kalibrasi Deltametrin ... 32
Gambar 10. Kurva Kalibrasi Profenofos ... 32
DAFTAR LAMPIRAN
Lampiran 1 Alur Penelitian ... 45
Lampiran 2 Perhitungan Penimbangan Larutan Pestisida ... 46
Lampiran 3 Perhitungan Larutan Baku Pestisida ... 47
Lampiran 4 Perhitungan Deret Konsentrasi Pestisida ... 48
Lampiran 5 Perhitungan LOD dan LOQ ... 49
Lampiran 6 Uji Perolehan Kembali ... 53
Lampiran 7 Perhitungan RSD Deltametrin... 54
Lampiran 8 Perhitungan RSD Profenofos ... 56
Lampiran 9 Perhitungan Kadar Residu Deltamterin ... 58
Lampiran 10 Perhitungan Kadar Residu Profenofos ... 60
Lampiran 11 Perhitungan % Penurunan Pestisida Deltametrin ... 62
Lampiran 12 Perhitungan % Penurunan Pestisida Profenofos ... 63
Lampiran 13 Uji F (One-Way anova) % Pengurangan Pestisida Deltametrin Pada Tomat... 64
Lampiran 14 Uji F (One-Way anova) % Pengurangan Pestisida Deltametrin Pada Tomat... 69
Lampiran 15 Hasil Kromatogram Pada Sampel Tomat Sebelum Perendaman dengan Larutan Pestisida ... 74
Lampiran 16 Hasil Kromatogram Deret Deltametrin dan Profenofos ... 75
Lampiran 17 Hasil Kromatogram Deltametrin dan Profenofos Pada Tomat Sebelum dan Setelah Dicuci ... 79
Lampiran 18 Hasil Kromatogram Larutan Standar deltametrin ... 82
Lampiran 19 Hasil Kromatogram Larutan Standar Profenofos ... 84
Lampiran 20 Determinasi Tomat ... 86
Lampiran 21 Sertifikat Analisis Deltametrin ... 87
BAB I
PENDAHULUAN
1.1 Latar Belakang
Sayur merupakan salah satu komoditas hortikultura yang banyak mengandung vitamin dan mineral. Beberapa vitamin penting yang terkandung di dalam sayuran seperti vitamin A yang berasal dari karotin berguna untuk kesehatan mata. Lalu ada mineral penting, seperti zat besi yang berguna untuk
menjaga kadar haemoglobin darah. Sayuran juga merupakan sumber serat yang sangat dibutuhkan bagi pencernaan serta berpotensi sebagai sumber pendapatan petani dan devisa negara.
Salah satu sayuran yang sering dikonsumsi masyarakat Indonesia adalah tomat. Tomat adalah sayuran yang dapat dimakan tanpa dimasak dan hanya dicuci dengan air. Sayuran ini juga dapat dimakan seperti lalapan, salad dan lain-lain, selain itu, tomat digunakan sebagai sari buah (juice). Tomat mengandung vitamin A, vitamin C, mineral, kalsium, phosphor, zat besi, dan hidrat arang yang sangat penting untuk tubuh manusia (Dewanti et al., 2010)
Tanaman tomat dapat tumbuh di dataran rendah sampai dataran tinggi. Lahan yang dapat dimanfaatkan untuk penanaman tomat meliputi lahan kering dan lahan bekas sawah. Temperatur yang baik untuk 1pertumbuhan tomat adalah 21-28°C di siang hari dan 15-20°C di malam hari. Derajat keasaman tanah (pH tanah) yang diperlukan berkisar antara 5,5 sampai 6,5 (Adiyoga et al., 2004).
kelabu (Cercospora sp.), busuk lunak (Erwinia carotovora), becak bakteri (Xanthomonas campestris) (Semangun, 2000), ulat buah tomat (Helicoverpa armigera Hubn dan Meloidogyne spp). Menurut laporan Setiawati (1991), kehilangan hasil panen tomat karena serangan hama H. armigera mencapai 52%. Dalam upaya untuk memperkecil kerugian
ekonomi usaha tani tomat karena serangan hama dan penyakit, pada umumnya para petani tomat menggunakan pestisida secara intensif. Pestisida dianggap sebagai teknologi yang mudah diterapkan, hasilnya efektif, tersedia dengan mudah di tingkat petani, dan yang penting secara ekonomis masih menguntungkan apalagi dengan harga pestisida yang sebagian besar disubsidi oleh Pemerintah. Pestisida dianggap sebagai jaminan bagi keselamatan dan keberhasilan tanaman bagi petani, sehingga dapat dikatakan bahwa pestisida tidak dapat dilepaskan dari petani sayuran.
Berdasarkan peraturan Menteri Pertanian tahun 2009 yang ditetapkan oleh Depertemen Pertanian (Deptan), salah satu pestisida yang digunakan pada tomat adalah profenofos dan deltametrin. Curacron (profenofos) dan decis (deltametrin) merupakan salah satu produk pestisida yang digunakan untuk mengendalikan hama dan penyakit pada tomat. Golongan organofosfat dan piretroid merupakan jumlah pestisida terbesar yang beredar di pasar dan banyak digunakan dalam bidang pertanian.
kultur limfosit darah perifer manusia, menginduksi kelainan kromosom dalam sel somatic pada mencit jantan (Fahmy dan Abdalla, 1998), dan memberikan efek genotoksik dan histopatologik pada tikus. (Fatma et al., 2007), bertindak sebagai disruptor endokrin enzim sitokrom dan mempengaruhi konsentrasi testosteron pada tikus jantan yang diberikan profenofos secara oral 17.8 mg/kg BB (Gihan et al., 2008)
Deltametrin merupakan pestisida golongan piretroid (Nollet & Rathore, 2010). Batas maksimum residu deltametrin pada tomat berdasarkan Standar Nasional Indonesia adalah 0,3 mg/kg. Deltametrin dilaporkan dapat menimbulkan kejang, ataksia, dermatitis, diare, tremor, dan muntah. Reaksi alergi terhadap senyawa ini melalui eksposur kulit juga umum di antara pekerja pertanian. Keracunan oral terjadi pada manusia dengan dosis 2-250 mg/kg, sedangkan konsumsi 100-250 mg/kg dapat menginduksi koma. Selain itu, menimbulkan efek genotoksik pada studi villarini et al - menggunakan leukosit darah perifer manusia, menurunkan sebagian besar organ genital dan motilitas sperma pada tikus dengan dosis 1 dan 2 mg/kg BB (Abd el - Aziz et al., 1994), menyebabkan terhambatnya pertumbuhan, hipoplasia paru-paru, dan dilatasi pelvis ginjal pada janin pada tikus betina yang diberikan deltametrin dengan dosis 1, 2,5 atau 5 mg / kg BB (Abdel-Khalik et al., 1993).
Pestisida digunakan berkali-kali selama waktu pertumbuhan dan kadang tetap digunakan pada saat menjelang panen untuk meningkatkan hasil panen dan meningkatkan kualitas (Randhawa et al., 2006). Penggunaan pestisida yang berlebihan menjadi sumber pencemaran pada bahan pangan, air, dan lingkungan hidup. Akibatnya, residu yang ditinggalkan secara langsung maupun tidak langsung sampai ke tubuh manusia.
garam. Ada beberapa studi yang membuktikan efektivitas air garam dalam menghilangkan pestisida dari permukaan buah dan sayur. Dalam studi Radwan et al., air garam 1% dapat mengurangi sekitar 7 - 97% profenofos pada komoditas paprika, cabai dan terong (Radwan et al., 2005). Pada studi Klinhom et al., air garam 0.9% dapat mengurangi 39% methomil dan 91% carbaryl pada kubis (Klinhom et al., 2008) dan pada studi Satpathy et al. air garam 0.9% dapat mengurangi sekitar 50 % klorpirifos pada komoditas okra, tomat, kacang, kembang kol sedangkan pada terong dapat mengurangi 84% klorpirifos (Satpathy et al. 2012).
Berdasarkan hal di atas penulis tertarik untuk membandingkan kadar residu pestisida pada tomat yang mengalami pencucian dan tidak mengalami pencucian.
1.2 Perumusan Masalah
Bagaimana pengaruh pencucian terhadap kadar residu pestisida deltametrin dan profenofos pada tomat ?
1.3 Tujuan Penelitian
1. Melakukan validasi metode analisis residu pestisida deltametrin dan profenofos pada tomat dengan menggunakan kromatografi gas.
2. Melakukan analisis residu pestisida deltametrin dan profenofos pada tomat menggunakan metode QuEChERS dengan perlakuan sebelum dan setelah dicuci dengan instrumen kromatografi gas.
3. Melihat pengaruh pencucian terhadap kadar residu pestisida deltametrin dan profenofos pada tomat
1.4 Manfaat Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1 Tomat
2.1.1 Morfologi Tomat
Tomat mempunyai akar tunggang yang tumbuh menembus kedua tanah dan akar serabut yang tumbuh menyebar kearah samping. Tetapi dangkal. Batang tanaman tomat berbentuk persegi empat hingga bulat, berbatang lunak tetapi cukup kuat, berbulu atau berambut halus dan diantara bulu-bulu tersebut terdapat rambut kelenjar. Batang tanaman berwarna hijau. Pada ruas batang mengalami penebalan dan pada ruas bagian bawah tumbuh akar-akar pendek. Selain itu batang tanaman tomat dapat bercabang dan diameter cabang lebih besar jika dibanding dengan jenis tanaman sayur lainnya. Daun tanaman tomat berbentuk oval bagian tepi daun bergerigi dan membentuk celah-celah menyirip serta agak melengkung ke dalam. Bunga tomat berukuran kecil, diameternya sekitar 2 cm dan berwarna kuning cerah, kelopak bunga berjumlah 5 buah dan berwarna hijau terdapat pada bagian terindah dari bunga tomat warnanya kuning cerah berjumlah 6 buah.. Bentuk buah tomat bervariasi,tergantung varietasnya ada yang berbentuk bulat, agak bulat, agak lonjong dan bulat telur (oval) ukuran buahnya juga bervariasi, yang paling kecil memiliki berat 8 gram dan yang besar memiliki berat 180 gram. Buah yang masih muda berwarna hijau muda, bila telah matang menjadi merah (Cahyono, 1998).
2.1.2 Klasifikasi Tanaman Tomat
Tanaman tomat diklasifikasikan ke dalam golongan sebagai berikut:
Kingdom : Plantae
Divisio : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledoneae Ordo : Tubiflorae Famili : Solanaceae Genus : Lycopersicum
Spesies : Solanum licopersicum Mill. (Redaksi Agromedia, 2007).
2.1.3 Jenis Tomat
Tanaman tomat memiliki beberapa jenis, yaitu ; A. Tomat biasa (L. commune)
Bentuk buahnya bulat pipih, bentuknya tidak teratur. Jenis tomat ini sangat cocok ditanam di daerah dataran rendah
B. Tomat apel (L. pyriforme)
Bentuk buahnya bulat, kuat, sedikit keras menyerupai buah apel. Tanaman ini sangat cocok ditanam di daerah pegunungan. Kedua jenis tomat inilah yang sering ditemukan di pasar-pasar.
C. Tomat kentang (L. grandiforlum)
Buahnya berbentuk bulat, besar, padat, menyerupai buah apel, tetapi agak kecil, dan daunnya lebar-lebar.
D. Tomat keriting (L. validum)
2.1.4 Kandungan Gizi
Berikut ini adalah kandungan gizi dalam 100 gram tomat :
Komponen Jumlah
Vitamin A (SI) 1500 Vitamin B1 (mg) 0,06
Vitamin C (mg) 40
Karbohidrat (g) 4,2
Lemak (g) 0,3
Protein (g) 1
Kalsium (mg) 5
Fosfor (mg) 2,7
Besi (mg) 0,5
Sumber : Susanto dan saneto, 1994 Tabel 1. Kandungan gizi dalam 100 gram tomat 2.1.5 Hama dan Penyakit Tanaman Tomat
Hama dan penyakit penting yang sering menyerang tanaman tomat dapat dilihat pada tabel berikut :
a. Ulat tanah (Agrotis ipsilon Hufn.)
adalah 5-6 hari. Tanaman inangnya adalah sayuran muda seperti kentang, kubis, tomat, cabai, jagung dan lain-lain. Gejala serangan ditandai dengan terpotongnya tanaman pada pangkal batang. Akibatnya, tanaman menjadi roboh. Kerusakan semacam ini dapat mengakibatkan kerugian yang berarti, yaitu matinya tanaman muda sebesar 75-90% dari seluruh bibit yang ditanam (Sastrodihardjo, 1982).
Gambar 2. Ulat Tanah ( A. ipsilon) b. Kutu Kebul (Bemisia tabaci Genn.)
pertumbuhan tanaman tomat. Embun madu yang dikeluarkan dapat menimbulkan serangan jamur jelaga yang berwarna hitam.
Gambar 3. Kutu Kebul (B.tabaci) c. Penyakit Bercak Kering Alternaria
Penyakit ini disebabkan oleh patogen cendawan Alternaria solani. Patogen ini dapat menyerang bibit dan tanaman muda. Pada bibit, bercak gelap terbentuk pada daun hipokotil, batang dan daun. Hipokotil dapat mati dan batang yang terserang akan terkulai. Pada tanaman yang dewasa, gejala serangannya berupa bercak cokelat dengan garis-garis yang melingkar berwarna lebih gelap. Bercak pada batang dan tangkai tanaman tampak lonjong memanjang dan membesar, yang dikenal dengan nama “busuk leher”. Buah yang terserang penyakit ini menunjukkan gejala permukaan buah menjadi sedikit kentot dan pecah-pecah serta ukurannya dapat bertambah besar.
Gambar 4. Gejala serangan penyakit alternaria d. Penyakit Layu
pembuluh yang menjadi kecoklat-coklatan karena terserang cendawan Fusarium spp. Patogen ini merupakan patogen tanah yang tanaman inangnya cukup banyak dari berbagai famili.
Gambar 5. Tanaman tomat terserang penyakit layu fusarium e. Penyakit Busuk Daun
Penyakit ini disebabkan oleh cendawan Phytophthora infestans. Patogen ini sering menyerang daun, batang dan buah, sehingga sering menggagalkan panen. Gejalanya adalah bercak basah berwarna abu-abu dengan bentuk yang tidak beraturan. Bercak berkembang cepat pada keadaan lembab, dan kapang putih nampak pada pinggiran bercak. Perkembangan penyakit dipacu oleh kondisi yang basah dan dingin dan biasanya terjadi di dataran tinggi. Tanaman inangnya yang lain adalah kentang.
Gambar 6. Gejala serangan penyakit busuk daun 2.2 Pestisida
2.2.1 Definisi Pestisida
pest (hama) dan secara langsung maupun tidak langsung merugikan kepentingan manusia.
Pestisida juga didefinisikan sebagai zat atau senyawa kimia, zat pengatur tubuh atau perangsang tumbuh, bahan lain, serta mikroorganisme atau virus yang digunakan untuk perlindungan tanaman (PP RI No.6 tahun 1995). USEPA menyatakan pestisida sebagai zat atau campuran zat yang digunakan untuk mencegah, memusnahkan, menolak, atau memusuhi hama dalam bentuk hewan, tanaman, dan mikroorganisme penggangu (Soemirat, 2003).
Menurut Peraturan Pemerintah No. 7 tahun 1973 tentang pengawasan atas peredaran, penyimpanan dan penggunaan pestisida, pestisida adalah semua zat kimia dan bahan lain serta jasad renik dan virus yang dipergunakan untuk :
a. Memberantas atau mencegah hama dan penyakit yang merusak tanaman, bagian tanaman atau hasil pertanian
b. Memberantas rerumputan
c. Mematikan daun dan mencegah pertumbuhan yang tidak diinginkan d. Mengatur atau merangsang pertumbuhan tanaman atau bagian tanaman e. Memberantas atau mencegah hama luar pada hewan piaraan atau
ternak
f. Memberantas atau mencegah hama air
g. Memberantas atau mencegah hewan dan jasad renik dalam rumah tangga, bangunan dan dalam alat pengangkutan.
h. Memberantas atau mencegah hewan yang dapat menyebabkan penyakit pada manusia atau binatang yang perlu dilindungi dengan penggunaan pada tanaman, tanah atau air
Menurut The United States Environmental Pesticide Control Act, pestisida adalah sebagai berikut.
terdapat pada manusia dan hewan.
b. Semua zat atau campuran zat yang digunakan untuk mengatur pertumbuhan tanaman atau pengering tanaman (Djojosumarto, 2004).
2.2.2 Penggolongan Pestisida
Penggolongan pestisida menurut Djojosumarto, 2008. dibagi
menjadi 3 yaitu :
a. Berdasarkan bahan aktifnya :
Berdasarkan asal bahan yang digunakan untuk membuat pestisida, maka pestisida dapat dibedakan menjadi empat golongan yaitu :
1) Pestisida Sintetik, yaitu pestisida yang diperoleh dari hasil sintetis kimia, contohnya organoklorin, organofosfat, dan karbamat.
2) Pestisida Nabati, yaitu pestisida yang berasal dari tumbuh-tumbuhan.
3) Pestisida Biologi, yaitu pestisida yagn berasal dari jasad renik atau mikroba yaitu jamur, bakteri atau virus.
4) Pestisida Alami, yaitu pestisida yang berasal dari bahan alami. b. Berdasarkan Cara Kerjanya
Berdasarkan cara kerjanya, pestisida dapat dibedakan kedalam beberapa golongan yaitu
1) Pestisida Kontak
Yaitu pestisida yang dapat membunuh OPT (organisme pengganggu tanaman) bila OPT tersebut terkena pestisida secara kontak langsung atau bersinggungan dengan residu yang terdapat di permukaan tanaman
2) Pestisida Sistemik
Yaitu pestisida yang dapat ditranslokasikan ke seluruh bagian tanaman. OPT akan mati setelah menghisap/memakan tanaman atau dapat membunuh gulma sampai ke akarnya.
3) Pestisida Lambung
Yaitu pestisida yang mempunyai daya bunuh setelah OPT memakan pestisida.
Dapat membunuh hama yang menghisap gas yang berasal dari pestisida.
c. Berdasarkan sasaran yang akan dikendalikan, yaitu :
1) Insektisida adalah bahan yang mengandung senyawa kimia beracun yang bisa mematikan semua jenis serangga. Golongan insektisida antara lain : organofosfat, organoklorin, piretroid dan karbamat.
2) Fungisida adalah bahan yang mengandung senyawa kimia beracun dan digunakan untuk memberantas dan mencegah fungi.
3) Bakterisida, disebut bakterisida karena senyawa ini mengandung bahan aktif beracun yang bisa membunuh bakteri.
4) Nematisida, digunakan untuk mengendalikan nematoda/cacing 5) Akarisida adalah bahan yang mengandung senyawa kimia beracun
yang digunakan untuk membunuh laba-laba.
6) Rodentisida adalah bahan yang mengandung senyawa kimia beracun yang digunakan untuk mematikan berbagai jenis hewan pengerat misalnya tikus.
7) Moluskisida adalah pestisida untuk membunuh moluska yaitu siput, bekicot, serta trispan yang banyak terdapat di tambak.
8) Herbisida adalah bahan senyawa beracun yang dapat dimanfaatkan untuk membunuh tumbuhan pengganggu yang disebut gulma.
2.3 Insektisida
2.3.1 Definisi Insektisida
2.3.2 Penggolongan Insektisida berdasarkan Susunan Kimia
Banyak penggolongan/jenis pestisida yang beredar di pasaran, baik yang ditujukan pada hewan, tumbuhan maupun jasad renik. Untuk mengendalikan jenis serangga maupun hewan yang berpotensi sebagai organisme pengganggu tanaman adalah insektisida. Penggolongan insektisida berdasarkan susunan kimia dibedakan menjadi :
a. Insektisida inorganik adalah senyawa insektisida yang tidak mengandung unsur karbon, contoh : arsenikum, merkurium, boron, tembaga, sulfur, asam borat, kalsium sianida, arsen, timbal dan lain-lain.
b. Insektisida organik alamiah adalah senyawa insektisida yang mengandung unsur karbon, insektisida organik alamiah merupakan insektisida yang terbuat dari tanaman (botani) dan bahan alami lainnya.
c. Insektisida organik sintetik:
1) Organoklorin, insektisida ini sedikit digunakan di Negara berkembang karena insektisida organoklor adalah senyawa yang tidak reaktif, memiliki sifat yang sangat tahan, baik dalam tubuh maupun dalam lingkungan. Memiliki kelarutan sangat tinggi dalam lemak dan memiliki kemampuan tergradasi yang lambat.
3) Karbamat dikenalkan pada tahun 1951 oleh Geology Chemical Company di Switzerland dan dipasarkan pada tahun 1965. Cara kerjanya sama seperti golongan organofosfat, yaitu menghambat aktivitas enzim kolinesterase.
4) Piretroid digunakan sejak tahun 1970-an. Keunggulannya karena memiliki pengaruh knock down atau menjatuhkan serangga
dengan cepat, dan tingkat toksisitasnya rendah bagi manusia. Tetapi perkembangan hama yang baru dapat tahan terhadap insektisida piretroid.
5) Fumigan, contoh : metilbromida, etilen dibromida, karbon disulfide, fosfin dan naftalin.
6) Minyak-minyak mineral adalah minyak parafin yang dihaluskan dan dibuat emulsi yang diaplikasikan secara ringan pada tanaman untuk mengendalikan tungau dan kutu tanaman. Contoh : dinitrokresol.
7) Zat –zat pengatur tumbuh serangga.
8) Senyawa-senyawa mikroba contoh : bacillus thuringiensis. Senyawa tersebut banyak dipergunakan untuk mengendalikan hama Lepidoptera, bacilus piliae dan bacillus lentimorphus untuk mengendalikan kumbang jepang.
2.4 Organofosfat
Senyawa ini menghambat asetilkolinesterase yang mengakibatkan akumulasi asetilkolin sehingga terjadi peningkatan aktifitas syaraf dengan gejala seperti sakit kepala, mual, muntah, sesak nafas, kejang otot dan dapat mengakibatkan kelumpuhan. Umumnya organofosfat digunakan sebagai racun pembasmi serangga.
Faktor-faktor yang mempengaruhi keracunan pestisida organofosfat adalah
a. Dosis
Cara kerja organofosfat adalah menghambat penyaluran impuls saraf dengan cara mengikat kolinesterase sehingga tidak terjadi hidrolisis asetilkolin. Tanda-tanda keracunan organofosfat ialah sakit kepala, lemah anggota badan, pusing, mual, muntah, berkeringat banyak, keluar air liur yang banyak, sakit perut pandangan menjadi kabur, pingsan, dan susah bernafas. Tanda-tanda ini akan hilang setelah 12 jam. Keracunan akut dapat terjadi bila terhirup racun organofosfat dengan gejala yang ditimbulkan seperti radang saluran atas pernafasan, radang paru-paru dan selaput mukosa. Sedangkan gejala keracunan kronik dapat terjadi bila terpapar dalam waktu yang lama dengan gejala sukar bernafas dan batuk-batuk. Sewaktu insektsida organofosfat terpajan kepada seseorang, asetilkolinesterase dihambat sehingga terjadi akumulasi asetilkolin, asetilkolin yang ditimbun dalam susunan syaraf pusat akan mengakibatkan tremor, inkoordinasi, kejang kejang, dan lain-lain. Dalam sistem syaraf autonom akumulasi ini akan menyebabkan diare, urinisasi tanpa sadar, bronkokonstriksi, miosis. (Alegantina., dkk., 2005).
2.4.1 Profenofos
Sifat fisika kimia a. Rumus bangun :
Gambar 7. Struktur Profenofos b. Rumus molekul : C11H15BrClO3PS
c. Berat molekul relatife : 373,6 d. Nama umum : Profenofos
e. Nama Kimia : O-(4bromo-2-chloro phenyl)O-ethyl S-propyl phosphorothioate
f. Nama dagang : Curacron ; Sanofos
g. Pemerian cairan kuning dengan aroma seperti garlic
i. Stabilitas : relatif stabil pada kondisi netral dan agak asam, tidak stabil dalam kondisi alkali
j. BMR : 2 mg/kg
Studi Bhinder et al. menunjukkan bahwa profenofos dapat menyebabkan mutasi DNA pada Nyamuk Culex quinquefasciatus menggunakan PCR assay. Profenofos dilaporkan dapat menyebabkan kerusakan genetik pada studi jamil et al. menggunakan kultur limfosit darah perifer manusia, menginduksi kelainan kromosom dalam sel somatic pada mencit jantan (Fahmy dan Abdalla, 1998), dan memberikan efek genotoksik dan histopatologik pada tikus (Fatma et. al., 2007), bertindak sebagai disruptor endokrin enzim sitokrom dan mempengaruhi konsentrasi testosteron pada tikus jantan yang diberikan profenofos secara oral 17.8 mg/kg BB (Gihan et al., 2008)
2.5 Piretroid
Insektisida dari kelompok piretroid merupakan analog dari piretrum yang menunjukan efikasi yang lebih tinggi terhadap serangga dan pada umumnya toksisitasnya terhadap mamalia lebih rendah dibandingkan dengan insektisida lainnya. Namun toksik terhadap ikan, tawon madu, dan serangga berguna lainnya. Berkerja secara kontak dan tidak sistemik. Cara kerja piretroid adalah mempengaruhi sistem saraf serangga atau mamalia dengan merangsang sel-sel saraf untuk menghasilkan efek pengulangan (repetitive) yang berakhir dengan kelumpuhan dan kematian. Efek ini disebabkan rendahnya penutupan saluran natrium dalam akson saraf, sehingga natrium bergerak cepat dalam sel-sel dan merubah fungsi akson saraf.
2.5.1 Deltametrin
a. Rumus Bangun :
b. Nama Umum : Deltametrin
c. Nama Kimia : (S)-Cyano(3-phenoxyphenyl)methyl (1R,3R)-3-(2,2-dibromovinyl)-2,2-dimethylcyclopropanecarboxylate
d. Nama Dagang : Decis
e. Pemerian : cairan kuning dengan bau aromatik f. Rumus Molekul : C22H19Br2NO3
g. Berat Molekul relative : 505,2 g/mol h. Titik Didih : 98-101°C
i. Massa Jenis: 1,5 g/cm3
j. Kelarutan : larut dalam aseton, etanol dan dioxan. k. BMR : 0,3 mg/kg
Deltametrin dilaporkan dapat menimbulkan kejang, ataksia, dermatitis, diare, tremor, dan muntah. Reaksi alergi terhadap senyawa ini melalui eksposur kulit juga umum di antara pekerja pertanian. Keracunan oral terjadi pada manusia pada dosis 2-250 mg/kg, sedangkan konsumsi 100-250 mg/kg dapat menginduksi koma selain itu menimbulkan efek genotoksik pada studi villarini et al. menggunakan leukosit darah perifer manusia, menurunkan sebagian besar organ genital dan motilitas sperma pada tikus dengan dosis 1 dan 2 mg/kg BB (Abd el - Aziz et al., 1994), menyebabkan terhambatnya pertumbuhan, hipoplasia paru-paru, dan dilatasi pelvis ginjal pada janin pada tikus betina yang diberikan deltametrin dengan dosis 1, 2,5 atau 5 mg / kg BB (Abdel-Khalik et al., 1993).
2.6 Residu Pestisida dalam Tanaman
Menurut Sutamihardja et al., (1982) tidak hanya gulma yang dipengaruhi oleh pestisida, tetapi juga beberapa jenis tumbuhan seperti tanaman sayur-sayuran, buah-buahan dan tanaman makanan lainnnya. Hal ini disebabkan pada waktu aplikasi pestisida terhadap hama dan penyakit tanaman, terjadi deposit pestisida dan akhirnya menjadi residu pada tanaman terseut.
Residu pestisida adalah sisa pestisida, termasuk hasil perubahannya yang terdapat pada atau dalam jaringan manusia, hewan, tumbuhan, air, udara atau tanah (Deptan, 2007). Beberapa yang mengindikasikan batas residu, digunakan untuk memprediksi pemasukan residu pestisida. Batas maksimum residu (BMR) adalah salah satu indeks konsentrasi maksimum dari residu pestisida (ditetapkan dalam mg/kg) yang direkomendasikan sebagai batasan yang diijinkan secara legal pada komoditas makanan dan daging hewan.
2.7 Metode QuEChERS
QuEChERS berasal dari kata Quick (Cepat); Easy (Mudah); Cheap (Murah); Effective (EFektif); Rugged (stabil); Safe (aman). Metode ini merupakan metode yang diperkenalkan untuk menganalisis berbagai macam residu pestisida dalam makanan dengan menghancurkan sampel (buah-buahan, sayuran, daging, dan jenis makanan lainnya) dalam blender. Metode QuEChERS memiliki beberapa keunggulan dibandingkan metode tradisional, diantaranya sebagai berikut:
a) Recovery tinggi (>85%), dicapai untuk polaritas yang luas dan volatilitas berbagai pestisida, termasuk analit yang sulit
b) Sangat akurat (benar dan tepat) hasil yang dicapai
c) Throughput/ kualitas pengerjaan sampel tinggi, sekitar 10 sampel dimungkinkan selesai sekitar 30-40 menit
d) Penggunanan hanya sedikit pelarut
e) Dapat melakukannya tanpa banyak pelatihan atau keterampilan teknis f) Metodenya sangat baik karena pembersihan ekstrak dilakukan utnuk
menghilangkan asam organik
h) Hanya sedikit perangkat yang diperlukan untuk persiapan sampel
2.8 Kromatografi Gas
2.8.1 Gas Pembawa
Gas pembawa digunakan sebagai fase gerak, gas yang lazim dipakai adalah helium, hidrogen, atau nitrogen (DAY dan UNDERWOOD, 2002). Adapun persyaratan-persyaratan yang harus dipenuhi oleh gas pembawa adalah :
a) Inert b) Murni
c) Cocok untuk detector yang digunakan
2.8.2 Sistem Penginjeksian Sampel
Injektor merupakan tempat injeksi yang digunakan sebagai tempat untuk menyuntikkan sejumlah volume tertentu dari cuplikan sampel. Dalam kromatograf gas, sampel yang masuk ke dalam kolom harus dalam bentuk fase gas. Oleh karena itu, senyawa yang berbentuk padatan atau cairan harus dapat diuapkan terlebih dahulu di dalam injector sebelum masuk ke dalam kolom. Penguapan dilakukan dengan cara pemanasan, karena itu pada bagian injector ini selalu dipanaskan.
Syringe digunakan untuk menyuntikkan sampel ke dalam injector. Jarum suntik mikro ini dibuat dari bahan lembam dan tidak menyerap komponen-komponen dalam sampel uji. Bahan yang paling cocok adalah baja tahan karat (stainless steel). Untuk tembaga, kuningan, dan aliasi logam tembaga yang lainnya tidak dapat digunakan. Alat ini ditusukkan melalui septum yang terdapat pada tempat injeksi. Fungsi septum pada tempat injeksi yaitu untuk mencegah kebocoran gas pada kolom (KHOPKAR, 1990)
2.8.3 Kolom
namum waktu analisisnya lebih lama. Semakin kecil diameter dalam, semakin baik pemisahannya. Kolom dibuat spiral untuk menghemat tempat. Kolom berisi fase diam dan tempat fase gerak akan lewat di dalamnya sambil membawa sampel. Secara umum terdapat 2 jenis kolom yaitu kolom terpaket (pcked column) umumnya terbuat dari glass atau stainless steel coil dengan panjang 1-5 m dan diameter kira-kira 5 mm. kolom kapiler, lebih menyerupai pipa dengan ruang yang sempit serta memiliki diameter dalam sebesar 0.3-0.5 mm.
2.8.4 Termostat
Thermostat memiliki 3 macam fungsi yaitu : mengatur suhu secara terpisah pada injection port, kolom dan detektor. Pengaturan suhu sangat penting karena pemisahan sangat dipengaruhi suhu dalam kolom sehinga suhu dalam kolom diatur oleh thermostat agar tidak menganggu pemisahan.
Ada dua cara mengatur suhu kolom:
a) Isotermal dimana suhu diatur selama analisis
b) Temperatur program dimana suhu diatur selama rentang waktu analisis
2.8.5 Detektor
Detektor adalah alat untuk menunjukkan dan mengukur jumlah komponen yang dipisahkan oleh gas pembawa. Alat ini akan mengubah analit yang telah terpisahkan dan dibawa oleh gas pembawa menjadi sinyal listrik yang proporsional. Oleh karena itu, alat ini tidak boleh memberikan respon terhadap gas pembawa yang mengalir pada waktu yang bersamaan. Kuat lemahnya sinyal bergantung pada laju aliran massa sampel dan bukan pada konsentrasi sampel gas penunjang. Range suatu detector dinyatakan sebagai sinyal terbesar yang teramati dibagi sinyal terlemah yang masih terdeteksi dan masih memberikan respon yang linear. Detektor harus terletak dekat kolom baik untuk menghindarkan kondensasi cairan maupun dekomposisi sampel sebelum mencapai detector (KHOPKAR, 1990)
b) TCD (Thermal Conductivity Detector) c) MS (Mass spectrophotometer)
d) ECD (Electron Capture Detector) e) FPD (Flame Photomeric Detector)
2.8.6 Rekorder
Rekorder berfungsi sebagai pengubah sinyal dari detector menjadi bentuk kromatogram. Dari kromatogram yang diperoleh dapat dilakukan analisis kualitatif dan kuantitatif.
2.9 Validasi Metode Analisis
Validasi metode analisis adalah proses dimana suatu metode ditetapkan melalui serangkaian uji laboratorium untuk menjelaskan bahwa karakter penampilan metode tersebut memenuhi persyaratan untuk penerapan metode yang dimaksud. (Gandjar dan Rohman., 2007).
Validasi metode menurut United states Pharmacopoeia (USP, 2004) dilakukan untuk menjamin bahwa metode analisis akurat, spesifik, reprodusibel, dan tahan pada kisaran analit yang akan dianalisis. Suatu metode analisis harus divalidasi untuk melakukan verifikasi bahwa parameter-parameter kinerjanya cukup mampu untuk mengatasi problem analisis.
2.9.1 Liniearitas
Linieritas merupakan kemampuan suatu metode untuk memperoleh hasil uji secara langsung proporsional dengan konsentrasi analit pada kisaran yang diberikan (gandjar dkk., 2007). Linieritas yang dapat diterima harus memenuhi persyaratan regresi linier yaitu pada nilai ≥ 0.98.
2.9.2 Batas Deteksi (Limit Of Detection, LOD)
atau di bawah nilai tertentu. Nilai LOD dapat dihitung berdasarkan (Rumus 1). (Gandjar dkk., 2007).
Rumus 1 : Cara menghitung nilai batas deteksi
LOD =3 ×sb b Dimana:
Sb : Simpangan baku
b : Slope/Kemiringan (Garis linier dari kurva kalibrasi)
2.9.3 Batas Kuantifikasi (Limit Of Quantification, LOQ)
Batas kuantifikasi didefiniskan sebagai konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan. LOQ diekspresikan sebagai konsentrasi yang dapat memberikan respon memenuhi kriteria cermat dan seksama. LOQ dapat dihitung berdasarkan (Rumus 2). (Gandjar dan Rohman 2007)
Rumus 2 : Cara menghitung nilai batas kuantifikasi
LOQ=10 ×sb b
Dimana:
Sb : Simpangan baku
b : Slope/Kemiringan (Garis linier dari kurva kalibrasi)
2.9.4 Akurasi (ketetapan)
Akurasi merupakan ketelitian metode analisis atau kedekatan antara nilai terukur dengan nilai yang diterima baik nilai konvensi, nilai sebenarnya atau nilai rujukan. Akurasi diukur sebagai banyaknya pestisida yang diperoleh kembali pada suatu pengukuran dengan melakukan spiking pada suatu sampel. Kriteria cermat diberikan jika hasil analisis memberikan rasio antara 80-120%. Nilai akurasi dapat diperoleh berdasarkan perhitungan pada (Rumus 3). (Gandjar, dkk.,2007)
Rumus 3 : Cara menghitung nilai perolehan kembali
% Perolehan Kembali= Kadar Hasil Analisis
2.9.5 Presisi
Presisi merupakan ukuran keterulangan metode analisis dan biasanya diekspresikan sebagai simpangan baku relatif dari sejumlah sampel yang berbeda signifikan secara statisitk. Presisi seringkali diekspresikan Standar Deviasi Relatif (RSD) dari serangkaian data (Gandjar dkk.,2007). Presisi dapat dihitung berdasarkan (Rumus 4).
Rumus 4. Cara menghitung nilai RSD
RSD= SD X
×100 %
Dimana:
X : Rata-rata data
SD : standar deviasi yang diperoleh berdasarkan (rumus 5)
Rumus 5 : Cara menghitung nilai SD
SD= (x –X ) 2
N ̶ 1 Dimana :
X : Rata-rata data
BAB 3
METODOLOGI PENELITIAN
3.1 Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah Kromatografi gas (Thermo Scientific TRACE 1300 Series GC) dan sentrifus (Hettich EBA 21). Sedangkan, alat gelas yang digunakan adalah labu ukur (Pyrex), gelas ukur (Pyrex), tabung sentrifus 50 ml, tabung disque 2 ml, vial, kaca arloji, tabung reaksi, batang pengaduk, spatula, pipet, syringe (Thermo), mikropipet, timbangan analitik (Mettler Teledo), blender (Phillips).
Bahan yang digunakan dalam penelitian ini adalah tomat, asetonitril, aquades, magnesium sulfat, CH3COONa, n-Heksan, aseton, NaCl, PSA (kombinasi amin primer dan sekunder), baku pestisida (profenofos dan deltametrin), Curacron 500 EC, serta Decis 25 EC.
3.2 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan April - Juli 2014 di Balai Pengujian Mutu Hasil Tanaman Pangan Holtikultura Provinsi DKI Jakarta (BPMHTPH).
3.3 Prosedur Penelitian
3.3.1 Pengambilan Sampel
Pengambilan sampel tomat sebanyak ± 10 kg dengan berat masing masing tomat sekitar 45 - 100 gram. Lokasi pengambilan sampel tersebut yaitu di pasar induk Kramat Jati. Sampel yang telah diambil, dimasukkan ke dalam plastik kemudian disimpan ke dalam pendingin.
3.3.2 Determinasi Tanaman
3.3.3 Validasi Metode QuEChERS
3.3.3.1 Uji Linearitas
A. Pembuatan larutan standar pestisida
1. Larutan Induk Profenofos 1007.44 ppm
Profenofos ditimbang sebanyak 10,0744 mg, dimasukkan ke dalam labu ukur 10 ml, lalu ditambahkan pelarut n-heksan aseton (9:1) sampai tanda batas dan dikocok hingga homogen.
2. Larutan Profenofos 100.744 ppm
Dipipet profenofos sebanyak 1 ml dari larutan induk profenofos, dimasukkan ke dalam labu ukur 10 ml, lalu ditambahkan pelarut n-heksan aseton (9:1) sampai tanda batas dan dikocok hingga homogen.
3. Larutan Profenofos 1.00744 ppm
Dipipet profenofos sebanyak 0.1 ml dari larutan profenofos 100.744 ppm, dimasukkan ke dalam labu ukur 10 ml, lalu ditambahkan pelarut n-heksan aseton (9:1) sampai tanda batas dan dikocok hingga homogen.
4. Larutan Induk Deltametrin 1006.94 ppm
Deltametrin ditimbang sebanyak 10,0694 mg, dimasukkan ke dalam labu ukur 10 ml, lalu ditambahkan pelarut n-heksan aseton (9:1) sampai tanda batas dan dikocok hingga homogen.
5. Larutan Deltametrin 100.694 ppm
Dipipet deltametrin sebanyak 1 ml dari larutan induk deltametrin, dimasukkan ke dalam labu ukur 10 ml, lalu ditambahkan pelarut n-heksan aseton (9:1) sampai tanda batas dan dikocok hingga homogen.
6. Larutan Deltametrin 1.00694 ppm
B. Persiapan Sampel
1. Masing-masing tomat disuntik deltametrin sebanyak 128 µl
(deltametrin 0.25 ppm), 257 µl (deltametrin 0.5 ppm), 375 µl
(deltametrin 0.75 ppm), 485 µl (deltametrin 1 ppm), 725 µl
(deltametrin 1.5 ppm), 945 µl (deltametrin 2 ppm) dari larutan
deltametrin 100.694 ppm, kemudian didiamkan selama 24 jam. Selanjutnya tomat dipotong-potong dan dimasukkan ke dalam blender lalu ditimbang dengan seksama ± 10 gram.
2. Masing-masing tomat disuntik profenofos sebanyak 128 µl
(profenofos 0.25 ppm), 257 µl (profenofos 0.5 ppm), 375 µl
(profenofos 0.75 ppm), 485 µl (profenofos 1 ppm), 725 µl
(profenofos 1.5 ppm), 945 µl (profenofos 2 ppm) dari larutan profenofos 100.744 ppm, kemudian didiamkan selama 24 jam. Selanjutnya tomat dipotong-potong dan dimasukkan ke dalam blender lalu ditimbang dengan seksama ± 10 gram.
C. Ekstraksi residu pestisida pada sampel
Sampel sebanyak ± 10 g dimasukkan ke dalam tabung sentrifus 50 ml, kemudian ditambahkan 10 ml asetonitril lalu tabung ditutup. Setelah itu, dikocok kuat selama 45 detik lalu ditambahkan 6 g MgSO4 dan 1,5 g CH3COONa kemudian dikocok kembali selama 45 detik. Selanjutnya, disentrifugasi selama 2 menit dengan kecepatan 4000 rpm lalu diambil bagian supernatan dan dimasukkan ke dalam tabung sentrifus. Kemudian, ditambahkan 50 mg PSA (Primary Secondary Amine) dan 150 mg MgSO4. Selanjutnya tabung ditutup, dan dikocok selama 20 detik lalu disentrifugasi selama 2 menit dengan kecepatan 4000 rpm. Setelah itu, 0.5 ml supernatan dipindahkan ke vial untuk kromatografi gas lalu diinjeksi ke dalam kromatografi gas.
D. Analisis dengan Kromatografi Gas
Kolom : Rtx-5 Panjang kolom : 30 cm Diameter kolom : 0,25 mm
Gas Pembawa : Nitrogen dalam 1.5 ml / menit Detektor : ECD (Electron Capture Detector) Suhu Detektor : 320°C
Suhu Injektor : 250°C
Mode : Splitless
Oven : Temperature awal 210°C ditahan selama 1 menit, lalu mengalami kenaikan 14°C per menit sampai 280°C (ditahan selama 8 menit)
Kondisi kromatografi gas untuk deteksi Profenofos :
Kolom : Rtx-5
Panjang kolom : 30 cm Diameter kolom : 0,25 mm
Gas Pembawa : Nitrogen dalam 1.5 ml / menit Detektor : FPD (Flame Photomeric Detector) Suhu Detektor : 280°C
Suhu Injektor : 230°C
Mode : Splitless
Oven : Temperature awal 120°C ditahan selama 1 menit, lalu mengalami kenaikan 10°C per menit sampai 260°C (ditahan selama 2 menit)
3.3.3.2 Uji Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ)
Penetapan batas deteksi (LOD) dan batas kuantitasi (LOQ) dapat dihitung secara statistik mengunakan data yang diperoleh pada uji linearitas. Jumlah data yang diambil sebanyak 6 data yang diperoleh dari uji linearitas.
3.3.3.3 Uji Perolehan Kembali
konsentrasi 0.5, 1, dan 2 ppm, didiamkan selama 24 jam lalu dilakukan ekstraksi residu pestisida pada sampel, dan diinjeksi ke dalam kromatografi gas.
3.3.3.4 Penentuan Standar Deviasi
Penentuan standar deviasi dapat dihitung menggunakan data yang diperoleh pada uji perolehan kembali
3.3.4 Analisis Kualitatif Residu Pestisida Deltametrin dan Profenofos
Sebelum Perendaman dengan Larutan Pestisida
Tomat sebanyak ± 250 g dipotong-potong dan dimasukkan ke dalam blender lalu ditimbang dengan seksama ± 10 gram. Setelah itu, dilakukan ekstraksi residu pestisida pada sampel dan dianalisis dengan kromatografi gas.
3.3.5 Analisis Kuantitatif Residu Pestisida Deltametrin dan Profenofos
pada Tomat Setelah Perendaman dengan Larutan Pestisida
A. Pembuatan Larutan Pestisida Deltametrin dan Profenofos
Konsentrasi 20 ppm : Ditimbang ± 200 mg curacron 500 EC dan ± 4000 mg decis 25 EC kemudian dilarutkan dalam 5 L air. (Perhitungan di lampiran 2) Setelah itu, tomat sebanyak ± 5 kg direndam dalam larutan tersebut selama 24 jam. Kemudian, dikering-anginkan selama ±1 jam.
B. Pembuatan Larutan NaCl
1. Larutan NaCl 0.9%
Ditimbang NaCl sebanyak 9 gram kemudian dilarutkan dalam 1 L air kemudian diaduk hingga homogen.
2. Larutan NaCl 5%
Ditimbang NaCl sebanyak 50 gram kemudian dilarutkan dalam 1 L air kemudian diaduk hingga homogen.
3. Larutan NaCl 10%
C. Persiapan sampel
Tomat sebanyak ± 5 kg (berat kisaran tomat 45-75 g) yang telah
direndam dengan pestisida dibagi menjadi 5 bagian, masing-masing bagian sebanyak ± 1 kg, kemudian dari masing-masing bagian diambil
sampel sebanyak ± 250 gram
D. Perlakuan terhadap sampel
Untuk masing-masing bagian sampel dilakukan perlakuan sebagai berikut:
1. ±250 gram tomat tidak dicuci (kontrol)
2. ±250 gram tomat dicuci dengan air mengalir sambil digosok (5 menit)
3. ±250 gram tomat direndam dengan NaCl 0.9 % sambil digosok (5 menit)
4. ±250 gram tomat direndam dengan NaCl 5 % sambil digosok (5 menit)
5. ±250 gram tomat direndam dengan NaCl 10 % sambil digosok (5 menit)
Setelah itu sampel dipotong kecil-kecil dan diblender, dilakukan ekstraksi residu dan dianalisis dengan kromatografi gas.
3.3.6 UJi F (One-Way Anova)
BAB 4
HASIL DAN PEMBAHASAN
4.1 Determinasi Tanaman
Sampel tomat sebanyak ±10 kg diambil dari pasar induk Kramat Jati dengan berat masing-masing tomat berada di kisaran 45-100 gram. Kemudian, dilakukan determinasi tanaman di LIPI Bogor. Hasil determinasi menunjukkan bahwa tomat yang digunakan dalam penelitian ini adalah Solanum Lycopersicum Lam. (Lampiran 20) berdasarkan jenisnya, tomat ini merupakan jenis tomat apel (L. pyriforme) dimana bentuk buahnya bulat, kuat, sedikit keras menyerupai buah apel.
4.2 Validasi Metode QuEChERS
Pada penelitian ini telah dilakukan analisis residu pestisida pada tomat dengan melakukan prosedur validasi terlebih dahulu untuk penentuan kadar residu pestisida deltametrin dan profenofos dengan perlakuan sebelum dan setelah dicuci.
4.2.1 Uji Liniearitas
Gambar 9. Kurva Kalibrasi Deltametrin
Gambar 10. Kurva Kalibrasi Profenofos
Pada uji liniearitas, hubungan antara konsentrasi dengan luas area puncak diperoleh nilai koefisien korelasi (r) untuk deltametrin sebesar 0.9866 dan profenofos sebesar 0.9911. Dari kedua kurva tersebut menunjukkan koefisien korelasi mendekati satu, hal ini menandakan kedua kurva tersebut memenuhi syarat sehingga dapat digunakan untuk menghitung konsentrasi deltametrin dan profenofos pada sampel tomat.
4.2.2 Uji Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ)
Batas deteksi adalah konsentrasi analit terendah dalam sampel yang masih dapat dideteksi, meskipun tidak selalu dikuantitasi. Sedangkan batas kuantitasi merupakan kuantitas terkecil analit dalam sampel yang masih dapat ditentukan dengan metode yang digunakan dan memenuhi criteria cermat dan seksama (Harmita, 2006). Pada penelitian ini diperoleh nilai LOD dan LOQ deltametrin sebesar 0.254 µg/ml dan 0.848 µg/ml.
y = 249,499.529x - 30,386.696
R² = 0.9911
0 200000 400000 600000
0.000 0.500 1.000 1.500 2.000 2.500
L
y = 858,317.765x - 149,431.598
sedangkan untuk profenofos diperoleh nilai LOD dan LOQ sebesar 0.207 µg/ml dan 0.690 µg/ml. (Perhitungan dapat dilihat pada lampiran 5).
4.2.3 Uji Perolehan Kembali
Akurasi adalah kedekatan hasil penetapan yang diperoleh dengan hasil sebenarnya. Uji akurasi dinyatakan dalam persen perolehan kembali dari tiga konsentrasi yaitu 0.5, 1 dan 2 ppm yang diulang sebanyak 3 kali.
Dari tabel 4 dapat dilihat hasil uji perolehan kembali pada deltametrin dan profenofos. Hasil % uji perolehan kembali deltametrin adalah sebagai berikut : kadar 0.5 ppm sebesar 97.067%) ; kadar 1 ppm sebesar 81.367% ; kadar 2 ppm sebesar 97.383% dan untuk hasil % uji perolehan kembali profenofos adalah sebagai berikut : kadar 0.5 ppm sebesar 106% ; kadar 1 ppm sebesar 85%) ; kadar 2 ppm sebesar 97.95%. (Perhitungan dapat dilihat pada lampiran 6). Berdasarkan AOAC, 2002 nilai % uji perolehan kembali untuk konsentrasi analit 1 ppm – 10 ppm adalah 80 - 110%. Hasil uii perolehan kembali yang didapatkan berada di kisaran yang masih dapat diterima yaitu berada di rentang 80-110 %. Dari hasil yang diperoleh dapat disimpulkan bahwa data uji akurasi telah memenuhi persyaratan.
Tabel 4. Rata-rata % uji perolehan kembali untuk pestisida deltametrin dan profenofos pada tomat
Pestisida Kadar (ppm) X % Perolehan Kembali Deltametrin
Tabel 5. Rata-rata perolehan kembali yang dapat diterima sesuai dengan konsentrasi analit (AOAC, 2002)
Analit Satuan Perolehan Kembali (%)
0.01 100 ppm 90-107
0.001 10 ppm 80-110
0.0001 1 ppm 80-110
4.2.4 Penentuan Standar Deviasi
Uji Presisi merupakan ukuran derajat kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil individual dari rata-rata jika prosedur diterapkan secara berulang pada sampel-sampel yang diambil dari campuran yang homogen (Harmita, 2006). Uji keseksamaan diperoleh dengan cara mengukur larutan deltametrin dan profenofos pada tiga konsentrasi yaitu 0.5, 1 dan 2 ppm sebanyak 3 kali pengulangan.
Nilai presisi (ketelitian) pengujian dapat diketahui berdasarkan nilai % RSD pada tabel 2 . Nilai RSD deltametrin adalah sebagai berikut : kadar 0.5 ppm sebesar 3.313% ; kadar 1 ppm sebesar 4.203% ; kadar 2 ppm sebesar 4.597% dan untuk nilai % RSD profenofos adalah sebagai berikut : kadar 0.5 ppm sebesar 5.882% ; kadar 1 ppm sebesar 5.325% ; kadar 2 ppm sebesar 4.699%. (Perhitungan dapat dilihat pada lampiran 7 dan 8). Berdasarkan M. Thompson dan Roger Wood, 1993 nilai % RSD untuk konsentrasi analit 1 mg/kg ˗ 10 mg/kg < 7 %. Hal ini menunjukkan bahwa pengukuran presisi yang dilakukan memenuhi kriteria seksama atau dengan kata lain presisi pengukurannya baik.
Tabel 2. Nilai % RSD untuk pestisida deltametrin dan profenofos pada tomat
Tabel 3. Rekomendasi nilai RSD untuk konsentrasi analit berbeda ( M. Thompson dan Roger Wood, 1993)
Konsentrasi Analit pada Matriks sampel % RSD
100 mg/kg 5
10 mg/kg 7
1 mg/kg 11
100 µg/kg 15
4.3 Analisis Kualitatif Residu Pestisida Deltametrin dan Profenofos
Sebelum Perendaman dengan Larutan Pestisida
4.3.1 Persiapan Sampel
Tomat yang telah diambil dari pasar induk kramat jati kemudian dilakukan Analisis Kualitatif untuk mengetahui ada atau tidaknya pestisida deltametrin dan profenfos pada sampel. Dari ± 10 kg tomat diambil sampel sebanyak ±250 gram kemudian tomat dipotong kecil-kecil dan diblender hingga halus setelah itu dilakukan ekstraksi residu pestisida dengan metode QuEChERS.
4.3.2 Ekstrasi residu pestisida
Metode QuEChERS “Quick Easy Cheap Effective Rugged and Safe” adalah metode persiapan sampel untuk analisis multiresidu pestisida yang pertama kali dilaporkan pada tahun 2003 (Anasttasiades, et al., 2003). Pada metode ekstraksi QuEChERS dilakukan proses ekstraksi dengan menambahkan 10 g sampel ke dalam tabung disque 50 ml kemudian ditambahkan 10 ml asetonitril. Asetonitril digunakan sebagai pelarut organik yang memberikan karakteristik terbaik untuk mengekstraksi berbagai macam jenis pestisida yang berbeda. Kemudian setelah tabung dikocok selama 45 detik ditambahkan 6 g magnesium sulfat dan 1.5 g natrium asetat. Natrium asetat digunakan sebagai buffer dan magnesium sulfat digunakan untuk menarik air dari fase organik. Setelah itu tabung kembali dikocok dan kemudian disentrifugasi. Setelah disentrifugasi dilakukan proses clean-up dengan memipet 1 ml supernatan kemudian dimasukkan ke dalam tabung disque 2 ml yang di dalamnya berisi 50 mg PSA (Primary Secondary Amine) dan 150 mg magnesium sulfat. PSA (Primary Secondary Amine) disini berfungsi untuk menghilangkan gula dan asam
lemak, asam organik, lipid dan beberapa pigmen.
4.3.3. Analisis dengan Kromatografi Gas
deltametrin adalah ECD (Electron Capture Detector). ECD merupakan detektor yang spesifik digunakan untuk pengujian pestisida golongan piretroid karena dapat mendeteksi senyawa-senyawa yang memiliki gugus ester. Sedangkan untuk pengujian profenofos digunakan detektor FPD (Flame Photomeric Detector). FPD merupakan detektor yang spesifik digunakan untuk pengujian pestisida golongan organofosfat karena dapat mendeteksi senyawa-senyawa yang mengandung gugus phosfat.
4.3.4 Hasil Analisis Kualitatif Residu Pestisida Deltametrin dan Profenofos
Sebelum Perendaman dengan Larutan Pestisida
Larutan standar deltametrin dan profenofos (1ppm) diinjeksi ke dalam kromatografi gas. Hasilnya peak deltametrin berada pada waktu retensi 10.15 menit dan profenofos 9.7 menit. (Lampiran 17 dan 18). Data larutan standar dibandingkan dengan data dari sampel tomat. Hasilnya menunjukkan pada sampel tomat tidak ditemukan peak pada waktu retensi 10.15 dan 9.7 menit (Lampiran 14). Hal ini menandakkan bahwa sampel tomat yang diambil dari pasar induk kramat jati tidak mengandung residu pestisida deltametrin dan profenofos.
4.4 Analisis Kuantitatif Residu Pestisida Deltametrin dan Profenofos
Pada Tomat Sebelum dan Setelah Dicuci
4.4.1 Persiapan Sampel
Sampel Tomat sebanyak ±5 kg (berat kisaran tomat 45-75 g) direndam dalam larutan pestisida (Deltametrin dan profenofos 20 ppm) selama 24 jam. Kemudian dikering-anginkan selama ±1 jam. Selanjutnya sampel dibagi menjadi 5 bagian, masing-masing bagian ditimbang ± 1 kg. lalu dari tiap-tiap bagian diambil ±250 gram tomat.
4.4.2 Perlakuan Terhadap Sampel
Untuk masing-masing bagian sampel dilakukan perlakuan sebagai berikut:
2. ±250 gram tomat dicuci dengan air mengalir sambil digosok (5 menit)
3. ±250 gram tomat direndam dengan NaCl 0.9 % sambil digosok (5 menit)
4. ±250 gram tomat direndam dengan NaCl 5 % sambil digosok (5 menit)
5. ±250 gram tomat direndam dengan NaCl 10 % sambil digosok (5 menit)
Setelah itu sampel dipotong kecil-kecil dan diblender, dilakukan ekstraksi residu dan dianalisis dengan kromatografi gas.
4.4.3 Hasil Analisis Kuantitatif Residu Pestisida Deltametrin dan
Profenofos Pada Tomat Sebelum dan Setelah Dicuci
Hasil penelitian kadar residu pestisida deltametrin dan profenofos secara kromatografi gas dalam sampel tomat dengan perlakuan sebelum dan setelah dicuci dapat dilihat dalam tabel 6.
Tabel 6. Rata-rata kadar residu pestisida deltametrin dan profenofos pada tomat 2 Pencucian dengan
air mengalir 0.672 ± 0.152 1.439 ± 0.138
pencucian dengan air mengalir sebesar 1.439 mg/kg ; perendaman dengan NaCl 0.9% sebesar 1.943 mg/kg ; perendaman dengan NaCl 5% sebesar 1.084 mg/kg ; perendaman dengan NaCl 10% sebesar 1.731 mg/kg. (Perhitungan dapat dilihat pada lampiran 9 dan 10)
4.5 Uji Statistik
Uji F (One-way Anova) dilakukan untuk membandingkan efektivitas perlakuan dalam menghilangkan residu pestisida pada tomat.
Tabel 7. Rata-rata persentase penurunan pestisida deltametrin dan profenofos pada tomat
Pestisida
Gambar 11. Grafik Perbandingan Rata-Rata Penurunan Pestisida Deltametrin Dan Profenofos Pada Tomat Sebelum Dan Setelah Dicuci
Dibandingkan dengan kontrol (tidak dicuci), dari 4 perlakuan yang dilakukan untuk mengurangi pestisida deltametrin dan profenofos didapatkan hasil P<0.05. Jika P<0.05 dapat disimpulkan bahwa ada
0
Penurunan Pestisida Deltametrin dan Profenofos pada Tomat
Deltametrin
perbedaan yang signifikan di antara 4 perlakuan yang dilakukan. (Lampiran 13 dan 14).
Dari grafik tersebut menunjukkan bahwa tidak adanya konsistensi antara konsentrasi NaCl dengan hasil penurunan kadar residu pestisida profenofos pada tomat (Fluktuasi). Hal ini bisa disebabkan oleh :
1. Pengambilan berat sampel tomat yang tidak merata 2. Penggosokan yang tidak merata.
Sehingga tidak dapat dikatakan bahwa perendaman dengan NaCl efektif dalam mengurangi residu pestisida profenofos pada tomat.
Pada deltametrin, dari grafik dapat dilihat adanya konsistensi antara konsentrasi NaCl dengan hasil penurunan kadar residu pestisida deltametrin pada tomat. Perendaman dengan NaCl 10% memiliki efektivitas yang paling baik (70.798%) dan pencucian dengan air mengalir memiliki efektivitas yang paling rendah untuk menghilangkan deltametrin (53.491%). Efektivitas dalam menghilangkan residu deltametrin dapat ditunjukkan sebagai berikut : Perendaman dengan NaCl 10% > Perendaman dengan NaCl 5% > Perendaman dengan NaCl 0.9% > Pencucian dengan air mengalir. (Perhitungan dapat dilihat pada lampiran 11 dan 12).
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian yang telah dilakukan, maka dapat diperoleh kesimpulan sebagai berikut:
1. Validasi analisis residu pestisida deltametrin dan profenofos yang telah dilakukan telah memenuhi syarat dengan nilai % RSD < 7 %, Uji perolehan kembali berada di kisaran 80 - 110 %, LOD dan LOQ deltametrin sebesar 0.254 µg/ml dan 0.848 µg/ml, dan profenofos sebesar 0.207 µg/ml dan 0.690 µg/ml.
2. Dari penelitian didapatkan hasil % penurunan kadar residu pestisida deltametrin adalah sebagai berikut : Pencucian dengan air mengalir sebesar 53.491% ; Perendaman dengan NaCl 0.9% sebesar 56.818% ; Perendaman dengan NaCl 5% sebesar 68.849% ; dan Perendaman dengan NaCl 10% sebesar 70.798%. Hasil tersebut menunjukkan bahwa perlakuan yang memiliki efektivitas paling baik untuk menghilangkan residu pestisida deltametrin adalah perendaman dengan NaCl 10% dan yang memiliki efektivitas paling rendah adalah pencucian dengan air mengalir.
3. Penurunan kadar residu pestisida profenofos pada tomat hasilnya berfluktuasi sehingga tidak dapat disimpulkan bahwa perendaman dengan NaCl efektif dalam mengurangi residu pestisida profenofos. 4. Berdasarkan hasil uji statistik, perbandingan % penurunan pestisida
deltametrin dan profenofos pada tomat dari sampel dengan kontrol (tidak dicuci) dan dicuci didapatkan hasil P<0.05 sehingga dapat disimpulkan bahwa ada perbedaan yang signifikan dari perlakuan yang yang dilakukan.
5.2 Saran
2. Dilakukan analisis residu pada pestisida selain deltametrin dan profenofos.
DAFTAR PUSTAKA
Abdelaziz et al. 2010. Genotocicity of Chlorpyrifos and the Antimutagenic Role of Lettuce Leaves in Male Mice. Comunicata scientiae, 1(2): 137-145 Adisarwanto T, Wudianto R. 1999. Meningkatkan hasil panen kedelai. Jakarta.
Penebar swadaya, Hal 40-60
AOAC International. 2007. AOAC Official Method 2007.01. pesticide residue in food by acetoniril extraction and partitioning with magnesium sulfate. A world compendium the pesticide manual. 1997. British Crop Protection
Council, Edisi XI. UK: Hal. 186-8, 729-30
Balai Besar Pengkajian dan Pengembangan Teknologi Pertanian. 2010. Budidaya Tanaman Sayuran. Badan Penelitian dan Pengembangan Pertanian, Kementerian Pertanian. Jambi.
Bhinder P, Chaundhry A. 2013. Genotoxicity of Acephate and Profenofos Assessed by PCR Assay. IJPRBS, volume 2 (4): 280-290
Budiman, A., M. Thamrin, S. Asikin, and Mukhlis. 2011. Potensi Ekstrak Flora Lahan Rawa Sebagai Pestisida Nabati. Laporan Penelitian. Balai Penelitian Pertanian Lahan Rawa.
Djojosumarto, Panut. Pestisida & aplikasinya. 2008. Jakarta. PT. Agromedia Pustaka, H. 87-96: 104-110: 253
Edi, S., dan J. Bobihoe, 2010. Budidaya Tanaman Sayuran. Balai Pengkajian Teknologi Pertanian. Jambi.
Harmita. 2004. Petunjuk Pelaksanaan Validasi metode dan Cara Perhitungannya. Majalah Ilmu Kefarmasian, vol.1 no. 3 : 117-135
Haryantyo Eko, Suhartini Tina, Rahyayu Estu, 1995, Sawi dan Selada, Penerbit Penebar Swadaya, Jakarta, hlm 15-23
Haryanto, E, T. Suhartini, E. Rahayu, dan H. Sunarjono. 2007. Sawi dan Selada. Penebar Swadaya. Jakarta.