VIABILITAS DAN KERIAP Bacillus sp. BK17 DAN
Enterobacter sp. BK15 PADA SUMBER KARBON DAN
NITROGEN YANG BERBEDA
SKRIPSI
SIRMA NOVITA NASRAH
080805002
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
2012
VIABILITAS DAN KERIAP Bacillus sp. BK17 DAN
Enterobacter sp. BK15 PADA SUMBER KARBON DAN NITROGEN YANG
BERBEDA
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
SIRMA NOVITA NASRAH 080805002
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2012
iii
PERSETUJUAN
Judul : VIABILITAS DAN KERIAP Bacillus sp. BK17 DAN Enterobacter sp. BK15 PADA SUMBER KARBON DAN NITROGEN YANG BERBEDA
Kategori : SKRIPSI
Nama : SIRMA NOVITA NASRAH
Nomor Induk Mahasiswa : 080805002
Program Studi : SARJANA (S-1) BIOLOGI Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA NIP. 19631012 199103 2 003 NIP. 19640409 199403 1 003
PERNYATAAN
VIABILITAS DAN KERIAP Bacillus sp. BK17 DAN Enterobacter sp. BK15 PADA SUMBER KARBON DAN NITROGEN YANG BERBEDA
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Desember 2012
SIRMA NOVITA NASRAH 080805002
v
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Allah SWT Yang Maha Pengasih Lagi Maha Penyayang atas limpahan rahmat kekuatan dan kemudahan sehingga penulis dapat menyelesaikan hasil penelitian yang berjudul “VIABILITAS DAN KERIAP Bacillus sp. BK17 DAN Enterobacter sp. BK15 PADA SUMBER KARBON DAN NITROGEN YANG BERBEDA” yang merupakan syarat untuk melengkapi dan memenuhi syarat mencapai gelar Sarjana Sains di Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Ucapan terima kasih penulis sampaikan kepada Bapak Prof. Dr. Dwi Suryanto, M.Sc selaku Dosen Pembimbing I dan Ibu Dr. It Jamilah M.Sc selaku Dosen Pembimbing II yang telah banyak memberikan bimbingan dan arahan dalam pembuatan skripsi ini. Ucapan terima kasih juga penulis ucapkan kepada Bapak Drs. Kiki Nurtjahja M.Sc dan Bapak Prof. Dr. Ing. Ternala A.T. Barus, M.Sc selaku Dosen Penguji yang telah banyak memberikan arahan dan saran dalam Kesempurnaan skripsi ini.
Ucapkan terima kasih juga penulis sampaikan kepada Bapak Prof. Dr. Dwi Suryanto, M.Sc selaku Dosen Pembimbing Akademik. Ibu Dr. Nursahara pasaribu, M.Sc selaku Ketua Departemen Biologi FMIPA USU dan Bapak Drs. Kiki Nurtjahja, M.Sc selaku Sekretaris Departemen Biologi FMIPA USU. Ibu Dra. Nunuk Priyani, M.Sc selaku kepala laboratorium Mikrobiologi. Seluruh staf Pengajar Departemen Biologi FMIPA USU. Ibu Mizarwati S.Si selaku Ketua Panitia Seminar Departemen Biologi FMIPA USU, Ibu Nurhasni Muluk, Abang Erwin, dan Ibu Rosalina Ginting selaku staf pegawai Departemen Biologi FMIPA USU.
Teristimewa penulis sampaikan rasa terima kasih yang sebesar-besarnya kepada Ayahanda tercinta Muhammad Nasir dan Ibunda tercinta Siti Sarah yang dengan sabar dan tiada mengenal lelah untuk mendukung pendidikan penulis mulai dari kecil hingga penulis bisa menyelesaikan skripsi ini. Terima kasih juga penulis ucapkan kepada saudara-saudari penulis tersayang, kakakku Tiswanti Ayu Nasrah, abang iparku Rizal Adam, dan adikku Reza Fahlevi Nasrah dan Rizal Chandra Jumariska Nasrah atas semua motivasi dan dukungannya dan buat Dianz Hapriyanto Nasution yang telah baik, sabar, tulus memberikan motivasi, perhatian dan kasih sayangnya kepada penulis.
Terima kasih juga penulis ucapkan kepada para sahabatku yaitu Yuni, Rildah, Riana, Maya, Santi, Nanin, Ahri, Ummi, Zulfi, Netty, Dame, Ira, Eka, Igun, Asmi, Arta, Indri, Sister, Agnes, Pesta, Mela, Sarah, Riana, Nanin, Ummi, Pinta, Oppy, Intan, Rini, Yanti, Dini, Novi, Ayu, Dewi, Diah, Nina, Frans, Albert, Jeckmal,Ina, Desy dan Sari yang saling mendukung dan saling pengertian dari mulai penelitian hingga akhir penyusunan skripsi ini. Kepada kakak dan abang senior stambuk 2007: bg Affan, bg Asril, bg Mirza, Kak Ria Umeda. Kepada kakak asuhku kak Ika Wahyuni yang telah banyak dukungan dan motivasi kepada penulis. Kepada adik
junior 2009, 2010 dan 2011. Kepada teman-teman sekosku wulan, kak retno dan Yunita yang turut mendukung dan memotivasi.
Akhirnya, dengan segala kerendahan hati penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran demi kesempurnaan skripsi ini. Penulis berharap karya yang sederhana ini dapat bermanfaat bagi kita semua.
Medan, Desember 2012
Penulis
vii
VIABILITAS DAN KERIAP BAKTERI Bacillus sp. BK17 DAN
Enterobacter sp. BK15 PADA SUMBER KARBON DAN NITROGEN YANG
BERBEDA
ABSTRAK
Pertumbuhan bakteri kitinolitik dipengaruhi oleh nutrisi. Nutrisi yang penting untuk menunjang pertumbuhan bakteri adalah karbon dan nitrogen. Penelitian ini bertujuan untuk mengetahui pertumbuhan serta kemampuan keriap bakteri kitinolitik terbaik pada sumber karbon dan nitrogen yang berbeda. Bakteri kitinolitik ditumbuhkan pada media cair yang telah divariasikan sumber karbon dan nitrogenya. Pertumbuhan bakteri tertinggi (3.7x108 CFU/ml) didapatkan pada media molase-sodium nitrat (MS), dan pertumbuhan yang terendah (2.4x108 CFU/ml) didapatkan pada media cangkang kepiting-sodium nitrat (CS) dengan waktu inkubasi 25 hari. Bakteri kitinolitik memiliki kemampuan keriap tertinggi sebesar 51mm pada sumber karbon dan nitrogen molase-urea dengan konsentrasi agar 2% pada hari ke-5. Dalam penelitian ini sumber karbon dan nitrogen yang terbaik bagi pertumbuhan Bacillus sp. BK17 and Enterobacter sp. BK15 ialah molase-sodium nitrat (MS), sementara itu pergerakan terbesar dari kedua bakteri pada media molase-urea dengan konsentrasi agar 2%.
Kata kunci: Bacillus, Enterobacter, keriap, sumber karbon dan nitrogen, viabilitas
VIABILITY AND SWARMING of Bacillus sp. BK17 AND Enterobacter sp. BK15 BACTERIA AT DIFFERENT CARBON AND NITROGEN SOURCES
ABSTRACT
To propagate bacterial cell for biocontrol purpose, suitable nutrient have to be determined in which carbon and nitrogen source was often as limited factor of bacterial growth. Proper storage of biocontrol agent such as bacterial cell should also be considered in order to keep the cell viable when used. The aim of this study is to find out suitable carbon and nitrogen sources for viability and swarming activity of chitinolitic bacterial Bacillus sp. BK17 and Enterobacter sp. BK15. The highest population of bacterial growth (3.7x108 cfu/ml) was found in molases-sodium nitrate (MS) medium and the lowest population growth (2.4x108 cfu/ml) was found in crab shell-sodium nitrate (CS) after 25 days of incubation. The swarming activity of the isolates were varied to some extent with the highest was 51 mm in 2% agar molases-urea after 5 days of incubation. Molases-sodium nitrate (MS) medium is suitable carbon and nitrogen source for the viability of Bacillus sp. and Enterobacter sp. Meanwhile, agar molases-urea medium with 2% agar is suitable medium for swarming for both bacteria.
Keywords : Bacillus, carbon and nitrogen source, Enterobacter, swarming, viability
ix
BAB 4 HASIL DAN PEMBAHASAN 14
4.1 Viabilitas sel bakteri kitinolitik pada suhu ruang 14 4.2 Viabilitas sel bakteri kitinolitik pada suhu 40C 16
4.3 Asai keriap 19
BAB 5 KESIMPULAN DAN SARAN 21
5.1 Kesimpulan 21
5.2 Saran 21
DAFTAR PUSTAKA 22
xi
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur kitin 5
Gambar 2. Hubungan antara nutrisi dan produk yang dihasilkan 9 Gambar 3. Grafik jumlah sel bakteri kitinolitik Enterobacter sp.
BK15 pada suhu kamar 15
Gambar 4. Grafik jumlah sel bakteri kitinolitik Bacillus sp.
BK17 pada suhu kamar 15
Gambar 5. Grafik jumlah sel bakteri Kitinolitik Enterobacter sp.
BK15 pada suhu 40C 17
Gambar 6. Grafik jumlah sel Bakteri Kitinolitik Bacillus sp.
BK17 pada suhu 40C 17
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Pembuatan koloidal khitin dengan cara hidrolisis parsial 26 Lampiran 2. Perbanyakan dan pembuatan suspensi bakteri kitinolitik 27
Lampiran 3. Alur asai keriap 28
Lampiran 4. Komposisi media dengan variasi sumber karbon dan nitrogen 29 Lampiran 5.
Lampiran 6.
Bakteri pada media TPC kitin
Isolat bakteripada media cair dengan variasi sumber karbon dan nitrogen
30 31
vii
VIABILITAS DAN KERIAP BAKTERI Bacillus sp. BK17 DAN
Enterobacter sp. BK15 PADA SUMBER KARBON DAN NITROGEN YANG
BERBEDA
ABSTRAK
Pertumbuhan bakteri kitinolitik dipengaruhi oleh nutrisi. Nutrisi yang penting untuk menunjang pertumbuhan bakteri adalah karbon dan nitrogen. Penelitian ini bertujuan untuk mengetahui pertumbuhan serta kemampuan keriap bakteri kitinolitik terbaik pada sumber karbon dan nitrogen yang berbeda. Bakteri kitinolitik ditumbuhkan pada media cair yang telah divariasikan sumber karbon dan nitrogenya. Pertumbuhan bakteri tertinggi (3.7x108 CFU/ml) didapatkan pada media molase-sodium nitrat (MS), dan pertumbuhan yang terendah (2.4x108 CFU/ml) didapatkan pada media cangkang kepiting-sodium nitrat (CS) dengan waktu inkubasi 25 hari. Bakteri kitinolitik memiliki kemampuan keriap tertinggi sebesar 51mm pada sumber karbon dan nitrogen molase-urea dengan konsentrasi agar 2% pada hari ke-5. Dalam penelitian ini sumber karbon dan nitrogen yang terbaik bagi pertumbuhan Bacillus sp. BK17 and Enterobacter sp. BK15 ialah molase-sodium nitrat (MS), sementara itu pergerakan terbesar dari kedua bakteri pada media molase-urea dengan konsentrasi agar 2%.
Kata kunci: Bacillus, Enterobacter, keriap, sumber karbon dan nitrogen, viabilitas
VIABILITY AND SWARMING of Bacillus sp. BK17 AND Enterobacter sp. BK15 BACTERIA AT DIFFERENT CARBON AND NITROGEN SOURCES
ABSTRACT
To propagate bacterial cell for biocontrol purpose, suitable nutrient have to be determined in which carbon and nitrogen source was often as limited factor of bacterial growth. Proper storage of biocontrol agent such as bacterial cell should also be considered in order to keep the cell viable when used. The aim of this study is to find out suitable carbon and nitrogen sources for viability and swarming activity of chitinolitic bacterial Bacillus sp. BK17 and Enterobacter sp. BK15. The highest population of bacterial growth (3.7x108 cfu/ml) was found in molases-sodium nitrate (MS) medium and the lowest population growth (2.4x108 cfu/ml) was found in crab shell-sodium nitrate (CS) after 25 days of incubation. The swarming activity of the isolates were varied to some extent with the highest was 51 mm in 2% agar molases-urea after 5 days of incubation. Molases-sodium nitrate (MS) medium is suitable carbon and nitrogen source for the viability of Bacillus sp. and Enterobacter sp. Meanwhile, agar molases-urea medium with 2% agar is suitable medium for swarming for both bacteria.
Keywords : Bacillus, carbon and nitrogen source, Enterobacter, swarming, viability
BAB 1
PENDAHULUAN
1.1Latar Belakang
Pada dasarnya mikroorganisme dapat memanfaatkan berbagai komponen organik sebagai sumber karbon dan energi yang digunakan untuk pertumbuhannya (Volkering et al., 1998). Hal ini terjadi apabila subtrat yang terkandung dalam media telah memenuhi syarat media yang dapat dimanfaatkan untuk pertumbuhan bagi mikroba (Pitt dan Hocking, 1997). Media merupakan sumber nutrisi bagi mikroorganisme. Nutrisi tersebut digunakan untuk menghasilkan energi yang baik dalam melakukan berbagai aktivitas seperti pertumbuhan, pembentukan zat, serta hasil akhir dari biosintesis mikroorganisme tersebut (Abou-Zeid, 1980).
Seperti halnya bakteri lain, biomassa pertumbuhan bakteri kitinolitik sangat bergantung pada kandungan nutrisi yang ada pada media yang dikonsumsi oleh mikroorganisme (Volkering et al., 1998). Nutrisi yang sangat penting dalam penunjang pertumbuhan bakteri kitinolitik ini ialah sumber karbon dan nitrogen (Horowitz et al., 2005). Menurut Muharni (2007) penggunaan sumber karbon dan nitrogen yang baik dalam media dapat meningkatkan pertumbuhan dan perkembangan pada mikroorganisme.
Pertumbuhan dan pergerakan bakteri kitinolitik pada medium biasanya dipengaruhi oleh substrat yang terkandung dalam media seperti kitin. Pergerakan yang dilakukan ini dapat membantu bakteri kitinolitik tersebut dalam memanfaatkan substrat dari media untuk pertumbuhannya dan juga dalam hal menghasilkan enzim kitinase yang dapat digunakan untuk mendegradasi kitin pada jamur (Hirano, 1990). Disamping itu untuk keperluan misalnya biokontrol diperlukan perbanyakan jumlah sel bakteri yang memadai. Pengujian kemampuan bakteri kitinolitik dalam pengendalian hayati jamur Fusarium oxysporum penyebab penyakit layu Fusarium,
dan jamur Ganoderma boninense penyebab busuk pangkal batang serta jamur Phytium citrinum penyebab busuk pasca panen pada sejumlah buah-buahan dan hasil tanaman lainnya telah dilakukan (Suryanto dan Munir,2008).
Dalam penelitian ini dilakukan pengujian variasi sumber karbon dan nitrogen untuk menumbuhkan bakteri kitinolitik dari sumber karbon dan nitrogen yang murah, seperti cangkang kepiting, molase, tubuh buah jamur Ganoderma dan koloidal kitin. Sumber karbon dan nitrogen merupakan komponen nutrisi yang penting bagi pertumbuhan dan perbanyakan sel bakteri (Suryanto et al., 2011).
1.2Permasalahan
Umumnya sumber karbon dan nitrogen yang digunakan dalam media pertumbuhan dan pergerakan bakteri kitinolitk Bacillus sp. BK17 dan Enterobacter sp. BK15 merupakan media alternatif yang biasa digunakan seperti media garam minimum dengan koloidal kitin sebagai sumber karbon (MGMK), sehingga perlu dicari variasi sumber karbon dan nitrogen yang dapat memacu produksi biomassa pertumbuhan sel bakteri tersebut sebagai bakteri biokontrol sehingga perlu dicari media yang lebih baik lagi dari media yang biasa digunakan dan dengan media yang lebih murah sebagai media pembawa.
3
1.3Tujuan
Memperoleh sumber karbon dan sumber nitrogen yang baik untuk pertumbuhan dan viabilitas bakteri kitinolitik selama penyimpanan dan pengujian sebagai agen biokontrol serta untuk pergerakan bakteri.
1.4 Hipotesis
Jenis sumber karbon, nitrogen serta suhu yang berbeda berpengaruh terhadap viabilitas dan keriap bakteri kitinolitik
1.5Manfaat
1. Sebagai bahan informasi untuk penyediaan sumber karbon dan nitrogen yang baik untuk pertumbuhan dan keriap bakteri kitinolitik
2. Media yang baik dari hasil penelitian dapat diaplikasikan sebagai media pembawa bakteri pengendali hayati
3. Sebagai bahan informasi untuk penelitian lebih lanjut mengenai media yang baik dalam keriap bakteri
BAB 2
TINJAUAN PUSTAKA
2.1Sumber karbon
Media kultur harus mengandung semua elemen yang dibutuhkan untuk pertumbuhan mikroba, dalam proporsi yang serupa dengan yang ada pada sel mikroba (Hidayat et al., 2006). Sumber karbon yang biasa digunakan adalah karbohidrat berupa glukosa, hidrokarbon dan minyak sayuran seperti minyak kacang kedelai yang digunakan oleh bakteri dalam pertumbuhannya. Salah satu jenis sumber karbon dari limbah yang dapat digunakan adalah molase dan limbah kedelai (Kosaric, 1992).
Menurut Hidayat et al., (2006), sumber karbon dan nitrogen merupakan komponen yang utama dalam suatu media kultur, karena sel-sel mikroba dan fermentasi sebagian besar memerlukan sumber karbon dan nitrogen dalam prosesnya. Peningkatan produksi pertumbuhan sel-sel memerlukan nutrisi yang optimum. Selain itu jumlah mikroorganisme yang terbentuk juga dipengaruhi pula oleh jenis sumber karbon, temperatur, pH dan aerasi (Kosaric et al.,1983).
2.2Kitin
Kitin merupakan polisakarida terbesar kedua setelah selulosa dan mempunyai rumus kimia poli (2-asetamida-2-dioksi-β-D-Glukosa) dengan ikatan β-glikosidik (1,4) yang menghubungkan 1 ikatan dengan ikatan kimia lainnya (Gambar 1). Kitin tidak mudah larut dalam air, sehingga penggunaannya terbatas (Srijanto, 2003). Kitin mempunyai rumus empiris (C6H9O4.NHCOOCH3)n, merupakan zat padat yang tidak larut dalam
air, pelarut organik alkali pekat, asam mineral lemah, tetapi larut dalam asam-asam pekat (Alexander, 1997).
5
Koloidal kitin adalah kitin yang dilarutkan dalam asam klorida pekat (Hsu dan Lockwood, 1975). Koloidal kitin merupakan salah satu substrat yang dapat digunakan untuk menginduksi produksi enzim hidrolitik pada jamur, bakteri, dan actinomycetes. Jenis enzim hidrolitik yang diinduksi seperti N-asetilglukosaminidase, endokitinase dan kitobiosidase pada Acetobacter caviae (Inbar dan Chet, 1991), Enterobacter agglomerans (Chernin et al., 1998) dan Bacillus cereus (Pleban et al., 1997). Suspensi koloidal kitin digunakan dalam media agar kitin nutrien untuk isolasi bakteri. Koloidal kitin ini merupakan suatu media selektif untuk mendapatkan mikroorganisme kitinolitik dari tanah (Hsu dan Lockwood,1975).
Gambar1. Struktur kitin (Alexander, 1997)
Mikroorganisme kitinolitik dapat diseleksi keberadaannya dengan menumbuhkannya pada media agar kitin yang dapat diketahui dengan adanya zona bening disekitar bakteri tersebut (Ulrike et al., 2000). Media konvensional yang menggunakan koloidal kitin sebagai substrat ditentukan sangat efektif dalam mendeteksi aktivitas kitinase (Guo et al., 2004). Bakteri kitinolitik menggunakan kitin sebagai sumber karbon dan nitrogen untuk pertumbuhan. Penggunaan sumber karbon dan nitrogen dapat mendukung kecepatan bakteri dalam menghasilkan enzim kitinase (Oku, 1994). Selain sebagai sumber karbon dan nitrogen, kitin juga digunakan dalam produksi enzim kitinase dari bakteri kitinolitik dalam pertumbuhannya (Graham, 1994).
2.2.1 Cangkang kepiting
Kepiting merupakan salah satu organisme yang memiliki sejumlah besar kitin pada cangkangnya. Salah satu bentuk pemanfaatan limbah kepiting ialah diolah menjadi kitin dan kitosan. Kadar kitin yang terkandung dalam cangkang Crustaceae berada
dalam kadar yang cukup tinggi berkisar 20-60% tergantung spesies, sedangkan cangkang kepiting mengandung 14-35% kitin. Limbah cangkang kepiting yang mengandung kitin di Indonesia berjumlah sekitar 56.200 ton/tahun. Cangkang kepiting secara umum mengandung protein 15,60-23,90%, kalsium karbonat 53,70-78,40%, dan kitin 18,70-32,20% yang juga tergantung pada jenis kepiting dan tempat hidupnya (Wibowo, 2006).
Kitin dapat dihasilkan dari kulit kepiting secara enzimatik, kimiawi, dan gabungan dari enzimatik dan kimiawi. Proses kimiawi diperoleh dengan menghilangkan mineral menggunakan asam dan dilanjutkan penghilangan protein menggunakan alkali yang dipanaskan. Proses enzimatik yaitu dilakukan menggunakan reaksi enzimatik. Proses ini merupakan pilihan yang ideal karena ramah lingkungan dan prosesnya mudah dikontrol. Sedangkan proses kimiawi dan enzimatik biasanya digunakan untuk mengkonversi kitin menjadi kitosan (Alexander, 1997)
2.2.2 Ganoderma
Menurut Alexopoulos et al., (1996) Ganoderma termasuk salah satu kelompok jamur
kayu kelas Basidiomycetes, ordo Polyporales, famili Polyporaceae, divisi Eumycophyta.
Pada umumnya famili Polyporaceae memiliki tubuh buah berbentuk seperti kipas dan
kertas, papan atau payung. Tubuh buah Ganoderma dapat ditemukan di bagian batang
kelapa sawit, merupakan jamur tular tanah, berwarna putih, semakin tua badan buah akan
bertambah besar ukurannya dan warnanya menjadi lebih gelap. Tubuh buah pada
Ganoderma mempunyai lapisan kutis (lapisan atas) yang tebalnya sampai 0,1 mm, terdiri atas benang-benang rapat yang sel-selnya berukuran 20-30 x 4-10 μm. Pori bergaris tengah 150-400 μm. Basidiospora berbentuk bulat atau oval, berwarna keemasan, dinding basidiospora berduri jelas, kadang-kadang mempunyai vakuola yang jelas (Semangun,
2000).
Ganoderma memiliki dinding sel yang tersusun atas lapisan kitin semi kristalin dan b-glukan. Kitin tersebut mengandung 80-90% polisakarida, 1-15% protein dan 2-10% lipid (Boh, et al., 2000). Berbagai senyawa aktif terkandung dalam jamur
7
Ganoderma. Senyawa aktif tersebut antara lain: ganoderik 33%, lusiderik, ganodermik, ganolusidik, asam aplanosidik 26%, asam amino, nukleotida, alkaloid, steroid, lakton 3%, asam lemak, dan enzim Pada umumnya tubuh buah Ganoderma dapat dijadikan sebagai bahan baku industri, karena mengandung senyawa bioaktif yang berasal dari hasil metabolisme primer seperti polisakarida, protein, dan lipid, maupun dari metabolisme sekunder seperti flavonoid dan terpenoid (Akhdiya, 2003).
2.2.3 Molase
Molase adalah limbah industri gula. Molase tebu kaya biotin, asam pantotenat, tiamin, fosfor dan sulfur. Kandungan nitrogen organik sedikit. Molase mengandung 62% gula yang terdiri dari sukrosa 32%, glukosa 14% dan fruktosa 16%. Karbohidrat dalam molase telah siap difermentasi tanpa perlakuan pendahuluan karena berbentuk gula (Hidayat et al., 2006). Molase yang mengandung nutrisi cukup tinggi untuk kebutuhan bakteri, telah dijadikan bahan alternatif untuk pengganti glukosa sebagai sumber karbon dalam media pertumbuhan mikroorganisme (Paturau, 1969). Molase tebu mengandung kurang lebih 39% sellulosa dan 27,5% hemisellulosa. Kedua bahan polisakarida ini dapat dihidrolisa menjadi gula sederhana yang selanjutnya dapat difermentasi menjadi bioetanol (Gusmailina, 2010).
2.3Sumber nitrogen
Nitrogen adalah salah satu dari beberapa unsur nutrisi yang mampu dimanfaatkan oleh mikroorganisme untuk kebutuhannya. Nitrogen ini terdapat dalam dua bentuk senyawa kimia yaitu N-organik dan N-anorganik. Senyawa N-organik merupakan senyawa utama yang paling dibutuhkan oleh mikroorganisme (Muharni, 2007). Senyawa N-organik yang dibutuhkan oleh mikroorganisme biasanya digunakan sebagai sumber nitrogen bagi pertumbuhan seperti sulfur (Alexander, 1997). Salah satu contoh N-anorganik adalah urea dan asam-asam amino, dimana nitrogen juga dapat menjadi faktor pembatas karena dibutuhkan dalam jumlah yang besar (Hidayat, et al., 2006). Sumber nitrogen yang biasa digunakan adalah amonium nitrat
(NH4NO3), urea, KNO3, NH4Cl, dan NaNO3 (Yataghene et al., 2007; Abouseoud et
al., 2008). Selain itu senyawa nitrogen yang lain dapat juga dimanfaatkan oleh mikroorganisme untuk perkembangannya adalah senyawa nitrogen anorganik yang meliputi nitrat, nitrit, ammonium (Ramsen, 1971). Berbagai penelitian telah dilakukan untuk mendapatkan rasio yang terbaik antara karbon, nitrogen, fosfor dan besi yang dibutuhkan untuk mendapatkan produksi yang tinggi (Huang., 2005).
2.3Bakteri kitinolitik
Bakteri kitinolitik bisa dilihat dengan pembentukan zona bening pada medium kitin atau dengan melihat kemampuan hidrolisis pada subtrat flurogenik analog kitin (Cotrell et al., 1999). Selain itu aktivitas kitinase secara kualitatif juga dapat diuji dengan penentuan zona bening di sekitar pertumbuhan koloni pada media agar yang mengandung kitin (Herdiyastuti et al., 2009). Organisme pendegradasi kitin umumnya berasal dari kelompok mikroorganisme diantaranya adalah dari kelompok bakteri. Bakteri yang dilaporkan memiliki aktivitas kitinolitik adalah seperti, Vibrio furnissi, Serratia marcescens, Bacillus circulans dan Pseudomonas aeruginosa (Muharni, 2009). Mikroba ini dapat diisolasi dari tanah dengan menggunakan medium garam koloidal kitin selalu disesuaikan dengan kondisi lingkungan dari mana isolat tersebut berasal (Srijanto, 2003).
2.4Pertumbuhan bakteri kitinolitik pada media
Mikroorganisme memanfaatkan berbagai komponen organik sebagai sumber karbon dan energi untuk pertumbuhannya. Pertumbuhan mikroba dapat dibagi dalam beberapa tahap. Setelah inokulasi kultur di dalam medium nutrisi tidak tampak adanya pertumbuhan. Periode ini disebut fase adaptasi. Sel kemudian terus bertambah dengan kecepatan maksimum. Periode ini disebut fase eksponensial. Setelah sel mencapai kecepatan tumbuh maksimum pada akhirnya jumlah sel akan tetap, disebut sebagai fase stasioner. Fase ini diikuti dengan penurunan jumlah sel, yang disebut dengan fase kematian. Kinetika pertumbuhan ini diikuti dengan produk yang dihasilkan, yang
9
terutama adalah sel, termasuk juga asam amino, nukleotida, protein, asam nukleat, lipida, karbohidrat, dan sebagainya. Produk-produk ini disebut produk metabolit utama dan fase produksi disebut tropofase. Selama fase stasioner, beberapa strain mikroba menyintesis senyawa yang tidak dihasilkan selama tropofase dan fungsinya dalam sel tidak jelas. Senyawa ini disebut produk metabolit sekunder dan fasenya disebut idiofase (Hidayat et al., 2006).
Hubungan antara pertumbuhan sel, pemanfaatan substrat (Ruzniza, 2005), dijelaskan seperti pada Gambar 2 berikut ini
Gambar 2. Hubungan antara nutrisi dan produk yang dihasilkan
Untuk produksi metabolit sekunder diperlukan media yang antara lain mengandung sumber karbon dan sumber nitrogen. Selain mengandung senyawa karbon dan nitrogen, media ini juga harus mengandung garam-garam anorganik, vitamin dan zat penumbuh lain. Komposisi media mempengaruhi hasil metabolit dari mikroorganisme. Pemilihan media yang baik sama pentingnya dengan pemilihan mikroorganisme yang mempengaruhi kecepatan fermentasi dan dapat menghasilkan produk yang dikehendaki (Linar et al., 1991). Menurut Muharni (2009) kitin sebagai substrat juga menginduksi aktivitas enzim kitinase, enzim juga diatur melalui pengendalian genetis yang melibatkan induksi sintesis enzim pada taraf genetis. Untuk terjadinya sintesis enzim dibutuhkan suatu induser yakni berupa substrat atau senyawa yang sekerabat dengan substrat dari reaksi yang dikatalis oleh enzim tersebut. Wang dan Chang (1997), menyatakan, bakteri menghasilkan kitinase untuk menghidrolisis kitin yang akan dimanfaatkan oleh mikroorganisme sebagai sumber karbon.
Menurut Chernin et al., (1995) bakteri ktitinolitik dalam pertumbuhannya, biasanya menghidrolisis koloidal kitin setelah 72-96 jam yang telah ditumbuhkan pada media campuran agar dan nutrient broth dengan perbandingan 3:1, yang dicampur
Sumber C + Sumber N + O2 + Mikroorganisme + Bahan tambahan lain
Biomassa + produk + CO2 + H2O + panas
denagan koloidal kitin sebagai sumber karbon. Pleban et al., (1997), melaporkan bahwa zona bening yang terbentuk di sekitar pertumbuhan bakteri kitinolitik di medium pertumbuhan. Besarnya nilai perbandingan zona bening dengan zona pertumbuhan koloni bakteri menunjukkan aktivitas dari enzim yang dihasilkan (Wang and Chan, 1997).
2.5Keriap bakteri kitinolitik pada media
Bacillus dan Enterobacter merupakan genus dari bakteri kitinolitik yang kompeten dalam memproduksi enzim kitinase. Kitinase digunakan untuk asimilasi kitin sebagai sumber karbon dan nitrogen (Wu et al., 2001). Bakteri ini memilki kemampuan dalam keriap yang baik dalam parasitisme jamur. Pemanfaatan enzim kitinase yang dimiliki oleh bakteri ini telah banyak dilakukan dalam pengendalian hayati karena kemampuan pergerakan yang cepat. Kemampuan pergerakan dari beberapa spesies bakteri kitinolitik ini sebagai mikroorganisme biokontrol yang sangat efektif untuk menghambat pertumbuhan jamur patogen tanaman (Hirano, 1990).
2.6Kebutuhan sumber karbon dan nitrogen bagi pertumbuhan bakteri Kitinolitik
Menurut Zajic et al., (1997) kebutuhan nutrisi untuk pertumbuhan mikroorganisme berbeda-beda. Optimasi dan kebutuhan nutrisi yang berbeda menjadi hal yang penting dalam pertumbuhan, dimana sumber karbon dan nitrogen yang ada pada nutrisi memiliki konsentrasi yang baik dapat mempercepat produksi metabolit dari bakteri. Adapun kebutuhan sumber karbon yang baik adalah 2% dari media yang ada. Menurut Copper et al., (1983), produksi jumlah sel bakteri akan optimal apabila sumber karbon dan nitrogen yang dimiliki seimbang, sehingga dapat digunakan sebagai substrat bagi pertumbuhan bakteri. Pertumbuhan bakteri memerlukan waktu dalam memutuskan ikatan siklis pada subtrat yang nantinya akan digunakan sebagai sumber energi dalam pertumbuhan, perkembangan serta motilitas bakteri tersebut dalam pertambahan jumlah biomassa sel dari bakteri tersebut (Neuman et al., 2001).
BAB 3
BAHAN DAN METODE
3.1 Waktu dan tempat
Penelitian ini telah dilakukan pada bulan Maret 2012 sampai Juni 2012 bertempat di Laboratorium Mikrobiologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2 Alat dan bahan
Alat yang digunakan dalam penelitian ini ialah: tabung reaksi, cawan Petri, pro-pipet, pipet serologi, spatula, jarum ose, autoclave, oven, botol vial, mikro pipet, Erlenmeyer, hot-plate, botol duran, dan colony counter, spatula, vortex, sedangkan bahan-bahan yang digunakan dalam penelitian ini antara lain aquades, alkohol 75%, nutrient agar (NA), nutrient broth (NB), variasi sumber karbon yaitu serbuk cangkang udang, tubuh buah jamur Ganoderma, dan sumber nitrogen yaitu urea dan sodium nitrat, larutan Mac Farland, agar, media garam minimum koloidal kitin (MGMK) (Suryanto, 2001).
3.3 Isolat bakteri
Isolat bakteri yang digunakan ialah koleksi Laboratorium Mikrobiologi Departemen Biologi, FMIPA USU. Isolat ini merupakan bakteri tanah yang berasal dari daerah bangka yaitu Bacillus sp. BK17 dan Enterobacter sp. BK15 yang telah diketahui berpotensi menghasilkan enzim kitinase dalam aktivitas menghambat pertumbuhan jamur patogen (Suryanto et al., 2008).
3.4 Perbanyakan dan pembuatan suspensi bakteri
Biakan bakteri disubkultur dalam media nutrient agar (NA) dan media garam minimum kitin (MGMK) dan diinkubasi pada suhu ruang dengan pH 6,5-7 selama ± 2 hari. Hasil subkultur biakan bakteri diambil dengan jarum ose dan dimasukkan ke dalam tabung reaksi yang berisi 10 ml akuades steril. Setelah itu dihomogenkan dengan cara divorteks dan disamakan kekeruhannya dengan standart Mac Farland sehingga diperoleh suspensi bakteri dengan kerapatan sel ~108 cfu/ml.
3.5 Sumber karbon dan sumber nitrogen
Sumber karbon yang digunakan adalah molase dari tetes tebu, serbuk cangkang kepiting, serbuk tubuh buah Ganoderma kering masing-masing sebanyak 2% dan koloidal kitin sebanyak 2%. Sumber nitrogen yang digunakan adalah urea dan sodium nitrat dengan konsentrasi 0,3%. Media divariasi sebagai berikut: koloidal kitin-urea (KU), koloidal kitin-sodium nitrat (KS), molase-urea (MU), molase-sodium nitrat (MS), cangkang kepiting urea (CU), cangkang kepiting-sodium nitrat (CS), tubuh buah jamur ganoderma-urea (JU), tubuh buah jamur ganoderma-sodium nitrat (JS), dan natrium broth (NB). Masing-masing variasi sumber karbon dan nitrogen dimasukkan ke dalam Erlenmeyer yang telah berisi MGMK, dikocok. Nilai pH disesuaikan menjadi 6,5-7. Media dipanaskan di atas penangas dan disterilkan dengan otoklaf selama 15 menit pada suhu 1210C pada tekanan 15 psi.
3.6 Viabilitas jumlah sel bakteri kitinolitik
Untuk mengetahui jumlah sel, bakteri ditumbuhkan pada masing-masing media dengan sumber karbon dan sumber nitrogen yang bervariasi, dengan pH 6,8 dan media NB. Sebanyak 10% inokulum cair isolat bakteri yang setara dengan kekeruhan larutan Mc-Farland (≈ 108 sel/ml), diinokulasikan ke dalam media secara aseptis. Kultur bakteri diinkubasi pada suhu kamar. Pertumbuhan sel pada media biakan diamati jumlah koloni sel pada hari ke 0, 5, 10, 15, 20, 25, 30, 35, 40, dan 45 hari. Kultur bakteri dikocok setiap hari. Hal yang sama dilakukan pada kultur bakteri yang ditumbuhkan pada media cair yang diinkubasi pada suhu 40C selama 60 hari.
13
Pengamatan penelitian ini dilakukan pada hari ke 0, 15, 30, 45 dan ke 60. Perhitungan jumlah sel dilakukan dengan menggunakan media agar MGMK.
3.7Asai keriap
Kemampuan gerak bakteri diuji dengan menggunakan metode asai keriap (Suryanto et al., 2006). Pengamatan ini dilakukan untuk mengetahui kemampuan bakteri dalam kolonisasi di lingkungan dengan mengukur panjangnya pergerakan bakteri tersebut dalam kolonisasi dengan menggunakan mikrometer. Asai keriap dilakukan dengan menginokulasikan isolat bakteri sebanyak 30 μl pada media agar (MGMK) dan dengan media NA sebagai pembanding dengan masing-masing konsentrasi agar yang digunakan 0,25, 0,5, 1 dan 2%. Hal yang sama juga dilakukan dengan memvariasikan sumber karbon dan nitrogen pada media. Kultur tersebut diinkubasi pada suhu 27 – 300 C selama lima hari. Asai keriap diukur sebagai jarak dari titik awal bakteri diinokulasi sampai jarak koloni keluar.
BAB 4
HASIL DAN PEMBAHASAN
4.1. Viabilitas sel bakteri kitinolitik pada suhu ruang
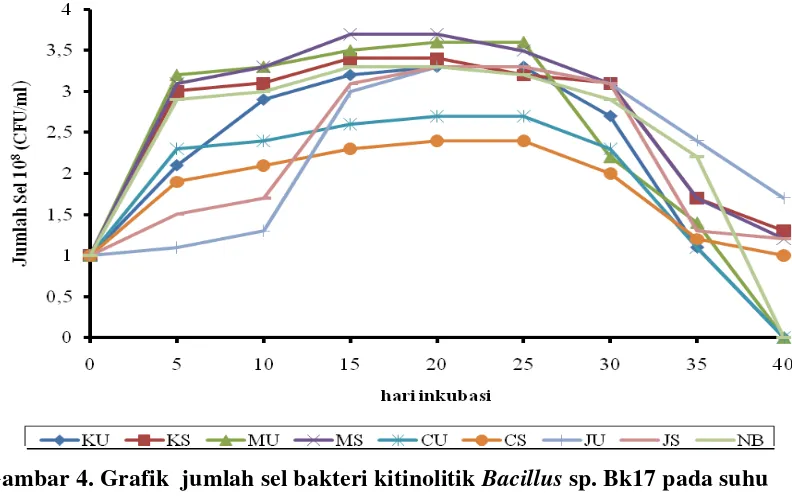
Viabilitas dari kedua isolat bakteri Bacillus sp. BK17 dan Enterobacter sp. BK15 pada suhu ruang menunjukkan pertumbuhan yang fluktuatif dari hari 0 sampai hari ke-40 (Gambar 3 dan 4). Pada media dengan sumber karbon molase dengan sumber nitrogen sodium nitrat media (MS) dan media molase dengan sumber nitrogen urea (MU), pertumbuhan kedua bakteri lebih baik dibandingkan pada jenis media lainnya. Pertumbuhan yang paling rendah terjadi pada media dengan sumber karbon cangkang kepiting (CS) dan serbuk tubuh buah jamur Ganoderma dengan sumber nitrogen sodium nitrat (JS). Selain itu jumlah sel bakteri pada suhu kamar dan suhu 40C juga mengalami perbedaan jumlah sel. Dimana pada suhu ruang jumlah sel yang optimum sebesar 3,7x108 cfu/ml pada hari ke-25 inkubasi sedangkan pada suhu 40C jumlah sel 3,3x108 cfu/ml setelah hari ke-45 inkubasi. Hal ini dikarenakan suhu juga berpengaruh terhadap jumlah sel bakteri.
Pertumbuhan Bacillus sp. BK17 dan Enterobacter sp. BK15 dari beberapa jenis media yang divariasikan sumber karbon dan nitrogen pada suhu ruang menunjukkan jumlah sel yang bervariasi. (Gambar 3 dan 4) menunjukan bahwa jumlah sel yang optimum pada Bacillus sp BK17 didapatkan pada media MU sebesar 3.6x108 cfu/ml dan Enterobacter sp. BK15 didapatkan pada MS sebesar 3.7x108 cfu/ml. Sedangkan jumlah sel kedua bakteri pada hari ke-0 sebesar 1x108, hal ini karena kandungan molase kaya akan polisakarida yang baik bagi pertumbuhan. Sedangkan jumlah sel terendah pada Enterobacter sp. BK15 didapatkan pada media JS sebesar 3x108 cfu/ml, sedangkan pada Bacillus sp. BK17 didapatkan pada media CS sebesar 2.4x108 cfu/ml dengan waktu inkubasi pada hari ke-25, penurunan jumlah sel ini terjadi karena isolat bakteri yang ditumbuhkan tidak di aerasi secara terus menerus melainkan hanya dikocok saja, maka pertubuhan bakteri akan terhambat.
15
Gambar 3. Grafik jumlah sel bakteri kitinolitik Enterobacter sp. BK15pada suhu ruang
Gambar 4. Grafik jumlah sel bakteri kitinolitik Bacillus sp. Bk17 pada suhu ruang
4.2 Viabilitas sel bakteri kitinolitik pada suhu 40C
Viabilitas dari kedua isolat Bacillus sp. BK17 dan Enterobacter sp. BK15 pada suhu
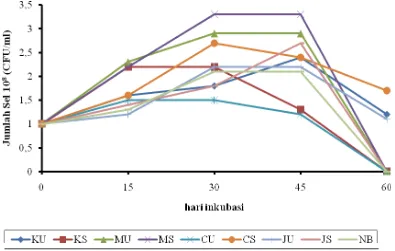
40C menunjukkan jumlah sel yang bervariasi. Dari data yang diperoleh (Gambar 5 dan 6), pertumbuhan kedua isolat bakteri pada suhu 40C menunjukkan pertumbuhan yang fluktuatif pada awal inkubasi sampai hari ke-60 inkubasi dengan media yang terlah divariasikan sumber karbon dan nitrogennya. Kedua isolat bakteri ini ditumbuhkan pada suhu 40C untuk mengetahui viabilitas dan ketahanan tumbuh bakteri pada media pembawa, yang nantinya kedua isolat ini dapat digunakan sebagai bakteri agen pengandali hayati jamur patogen dengan media pembawa yang baik.
Pertumbuhan Bacillus sp. BK17 dan Enterobacter sp. BK15 dari beberapa jenis media yang telah divariasikan sumber karbon dan nitrogennya yang ditumbuhkan pada suhu menunjukkan pertumbuhan yang jumlah selnya bervariasi, seperti pada (Gambar 5 dan 6) jumlah sel Enterobacter sp. BK15 yang optimum didapatkan pada media NB sebesar 3,3x108 cfu/ml sedangkan pada Bacillus sp. BK17 juga sebesar 3.3x108 cfu/ml pada media MS hal ini terjadi karena media NB merupakan media cair yang biasa digunakan untuk media pertumbuhan bakteri. Sedangkan media MS mengandung polisakarida sebagai sumber karbon dan juga mengandung fosfor dan sulfur sebagai sumber nitrogen. Sedangkan jumlah sel terendah pada Enterobacter sp. BK15 didapatkan pada media media CU sebesar 1.3x108 cfu/ml, sedangkan untuk Bacillus sp. BK17 pertumbuhan terendah ditemukan pada media CU sebesar 1.2x108 cfu/ml pada hari ke-45 inkubasi. Hal ini mungkin karena pada serbuk cangkang kepiting yang digunakan belum terlalu halus, sehingga kitin yang digunakan sebagai sumber karbon sulit digunakan dan membutuhkan waktu yang lama dalam mendegradasi kitin sebagai sumber karbon bagi pertumbuhan bakteri dalam memperbanyak jumlah sel. Pada pH 6,5-7, pertumbuhan sel bakteri Bacillus sp. BK17 dan Enterobacter sp. BK15 akan baik, karena kedua isolat adalah bakteri mesofil yang menyukai lingkungan yang dengan tingkat pH optimal yaitu 6,8-8 untuk pertumbuhan (Hirano, 1990).
17
Gambar 5. Grafik jumlah sel bakteri kitinolitik Enterobacter sp. BK15 pada suhu 40C
Gambar 6. Grafik jumlah sel bakteri kitinolitik Bacillus sp. BK17 pada suhu 4oC
Pada penelitian yang di lakukan oleh Kaushish et al., (2009) menggunakan sumber karbon minyak mentah bagi pertumbuhan Bacillus subtilis strain BMT4i yang diinkubasi pada suhu 300C selama 10 hari jumlah sel sangat tinggi sebesar 5x1010 cfu/ml, hal ini terjadi karena isolat bakteri digoyang pada 200 rpm setiap hari sebelum menumbuhkan pada media plate count.
Pertumbuhan yang optimum apabila kandungan nutrisi yang ada pada media terpenuhi, seperti adanya sumber karbon dan nitrogen. Nutrisi yang ada apada media tersebut akan digunakan sebagai energi, dan apabila jika sumber karbon dan nitrogen terpenuhi maka pembentukkan dinding sel bakteri akan lebih baik dan komposisi media harus mengandung polisakarida (Paturau, 1996). Bacillus sp. dan Enterobacter sp. merupakan bakteri yang menghasilkan enzim kitinase dan kitin digunakan sebagai sumber karbon, bakteri ini nantinya akan menghasilkan kitinase yang digunakan untuk menghidrolisis kitin menjadi sumber karbon bagi pertumbuhan dan memperbanyak jumlah sel (wang dan Chang, 1997). Kitin merupakan polisakarida yang tidak larut di dalam air (Suryanto et al ., 2008).
Perbedaan pertumbuhan pada tiap media dimungkinkan karena adanya perbedaan dari kemampuan masing-masing jenis bakteri dalam menggunakan nutrisi pada media untuk proses pertumbuhan dan metabolismenya (Rodriques et al.,2006 )., Menurut Lay (1994), perbedaan laju pertumbuhan disebabkan oleh banyak faktor antara lain tipe dan jenis bakteri itu sendiri maupun kemampuan bakteri tersebut dalam menggunakan nutrisi yang ada pada media serta aktivitas enzim yang dihasilkan. Menurut penelitian Ridha (2010), pertumbuhan juga dipengaruhi oleh faktor lingkungan, salah satunya adalah pH. Menurut Imas et al ., (1989) bakteri kitinolitik tidak dapat tumbuh pada pH 4-5,5 karena aktivitas pertumbuhannya menurun dan terhambat, karena bakteri ini hanya dapat hidup dengan baik pada pH yang netral yaitu pH 6,8-8, karena apabila pH yang rendah, maka membran sel menjadi jenuh oleh ion hidrogen sehingga membatasi transport membran sehinnga dapat menyebabkan keracunan (Ambarsari, 1999).
19
4.3. Asai Keriap
Kemampuan gerak mikroorganisme dapat dilihat pada pertumbuhan koloni yang ditanam pada media padat dan media semi solid. Hasil pengamatan asai keriap dapat dilihat pada Tabel.1 di bawah ini:
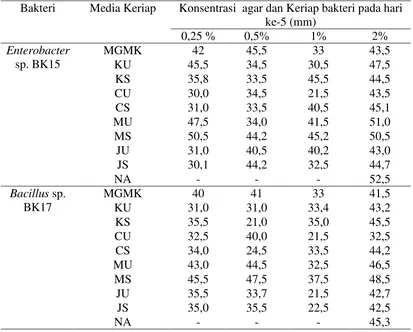
Tabel 1. Asai keriap bakteri kitinolitik Bacillus sp. BK17 dan Enterobacter sp. padamedia MGMK, NA dan Variasi sumber C dan N
Bakteri Media Keriap Konsentrasi agar dan Keriap bakteri pada hari ke-5 (mm)
Setelah pengamatan 5 hari kemampuan keriap bakteri Bacillus sp. BK17 sebesar 51,5 mm dan Enterobacter sp. BK15 sebesar 45,3 mm pada media NA, sedangkan kemampuan keriap bakteri terendah pada Bacillus sp. BK17 dan Enterobacter sp. BK15 sebesar 33 mm pada media MGMK dengan konsentrasi agar 1%. Keriap Bacillus sp. BK17 pada media MS, pada konsentrasi agar 0,25% keriap sejauh 45,5 mm, pada konsentrasi agar 0,5% mencapai 47,5 mm, pada konsentrasi agar 1% mencapai 3,72 mm, sedangkan pada konsentrasi agar 2% mencapai 48,5 mm pada pengamatan ke-5. Keriap terendah pada media KU dengan konsentrasi agar 0,25% berkeriap sejauh 31 mm, pada konsentrasi agar 0,5% sejauh 31 mm, pada
konsentrasi agar 1% sejauh 33,4 mm, sedangkan pada konsentrasi agar 2% sejauh 43,2 mm pada pengamatan ke-5.
Pada Enterobacter sp. BK15 kemampuan keriap bakteri terjauh pada media MS pada konsentrasi agar 0,25% sejauh 50,5 mm, pada konsentrasi agar 0,5% mencapai 44,2 mm, dan pada konsentrasi agar 1% mencapai 45,2 mm, sedangkan pada konsentrasi agar 2% mencapai 50,5 mm pada pengamatan ke-5. Keriap terendah terjadi pada media CU, pada konsentrasi agar 0,25% sejauh 3 mm, pada konsentrasi agar 0,5% mencapai 34 mm, dan pada konsentrasi agar 1% mencapai 21,5 mm, sedangkan pada konsentrasi agar 2% mencapai 43,5%. Keriap bakteri terjadi jika bakteri ingin menjauhi atau mendekati rangsangan. Dalam hal bakteri mengambil nutrisi, bakteri tersebut bergerak mendekat substrat yang nantinya digunakan sebagai sumber energi dan karbon bagi pertumbuhan. Kemampuan gerak mikroorganisme dapat dilihat pada pertumbuhan koloni yang ditanam pada media padat dan media semi solid dengan memvariasikan sumber karbon dan nitrogen.
Menurut Prihatna (2000), keriap bakteri dapat berperan penting dalam pengendalian hayati karena sifat berkeriap dari bakteri digunakan untuk menguasai (mengkolonisasi) relung ekologi tertentu. Keriap yang baik pada bakteri menunjukkan bahwa aktivitas keriap dapat memberikan sumbangan yang baik terhadap kemampuan bakteri dalam menghambat pertumbuhan jamur patogen dan untuk mendapatkan sumber energi untuk aktivitas gerak pada lingkungan sekitarnya dalam menggunakan subtrat media untuk menghasilkan metabolit sekunder pada mikroorganisme tersebut Selain untuk pertumbuhan sumber karbon juga digunakan sebagai sumber energi dalam aktivitas gerak pada lingkungan sekitarnya dalam menggunakan subtrat media untuk menghasilkan metabolit sekunder pada mikroorganisme tersebut (Suryanto et al., 2011).
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian yang telah dilakukan dapat diambil beberapa kesimpulan sebagai berikut:
1. Pertumbuhan bakteri terbaik didapatkan pada media dengan sumber karbon molase dan sumber nitrogen sodium nitrat yaitu sebesar 3.7x108 CFU/ml, sedangkan pertumbuhan terendah didapatkan pada media sumber karbondan nitrogen cangkang kepiting-sodium nitrat (CU) sebesar 2.4x108 CFU/ml dengan waktu inkubasi 25 hari. Sumber karbon dan nitrogen yang terbaik bagi pertumbuhan Bacillus sp. BK17 and Enterobacter sp. BK15 ialah molase-sodium nitrat (MS).
2. Kedua bakteri kitinolitik yang digunakan pada penelitian ini memiliki kemampuan motilitas yang baik, dan jarak pergerakan terbesar dari kedua bakteri didapatkan pada media molase-urea (MU) dengan konsentrasi agarnya 2%, dengan keriap bakteri sebesar 51 mm dengan waktu inkubasi selama 5 hari.
5.2 Saran
Perlu adanya penelitian lanjutan mengenai kemampuan aktivitas enzim kitinase bakteri yang ditumbuhkam dalam variasi sumber karbon dan nitrogennya berbeda untuk pengujian bakteri pengendali hayati.
DAFTAR PUSTAKA
Abou-zeid, M. R. 1980. Production of the microorganims communicating current research and educational topics and trends. J. App. Microbiol. 7(2) : 340-347. Akhdiya, A. 2003. Isolasi bakteri penghasil enzim protease pada alkalin termostabil. J.
Buletin Plasma Nutfah. 9(7): 37.
Alexander, M. 1997. Introduction to soil microbiology. 2nded. John Wiley & Sons, Inc. New York. hlm. 196-201.
Alexopoulos, C. J., C. W. Mims, W. Black. W. 1996. Introductory Mycology. Eds 4th. John Wiley&Sons.Inc. New York. hlm. 869.
Ambarsari, H. 1999. Karakteristik dan peran bakteri penitrifikasi dalam usaha minimisasi amonia yang terakumulasi di dalam sistem akuakultur. J. Sains dan Teknologi Indonesia 1 (2): 43-52.
Asril, M. 2011. Kemampuan bakteri kitinolitik tanah dalam menghambat pertumbuhan jamur patogen secara in vitro dan penyakit layu Fusarium pada benih cabai merah. Skripsi. USU. Medan. hlm . 24.
Boh, B., D. Hodzar, D. Dolnicar, M. Berovic, F. Pohleven. 2000. Isolation and quantification of triterpenoid acids from Ganoderma applanatum of istrian origin. J. Food Technol. Biotechnol. 3(8): 11–18.
Chernin, LS., KW. Michael, MT. Jacquelyn, H. Shoshan, WB. Barrie, W. Cheat, SAB. Gordon, J. Stewart. 1998. Chitinolytic activity in Chromobacterium violaceum. J. Bacteriol. 18 (1) : 25-37.
Copper, D.G., B.A Ramsay, A. Margaris, J. E. Zajic. 1983. Rhodococcus bacteria biosurfactant production and remulsifying ability. Penn-Well Publishing. USA. hlm. 61-63.
Cottrel, MT., JA. Moore, DL. Kirchman. 1999. Chitinase from uncultured marine microorganims. App. Environ. J. Microbial.65 (3) : 2553-2557.
Graham L.S., dan Stiklen,M. B. 1994. Plant Chitinases. J. Botany. 72(2) : 1057-1083. Guo, S,H., J. K. Chen, W.C. Lee. 2004. Enzyme and microbiol tech. J. Ind of
Bacteriol. 3(5) : 550-556.
Gusmailina. 2010. Prospek Bioethanol Sebagai Pengganti Minyak Tanah. http://www.indobioetanol.com. Diakses pada tanggal 6 Januari 2011.
23
Herdyastuti, N., JT. Raharjo, Mudasir, M. Matsjeh. 2009. Kitinase mikroorganisme kitinolitik : isolasi, karakterisasi dan manfaatnya. J. Chem. 9(1): 37-38.
Hidayat, N., M. C. Padaga, S. Suhartini. 2006. Mikrobiologi industri. Penerbit ANDI. Yogyakarta. hlm 33.
Hirano, S. 1990. Chitin biotechnology applications. J. Biotechnol. 2(1) : 237.
Horowitz, A., D. Gutnick, E. Rosenberg. 2005. Sequential growth of bacteria on crude oil. J. App. Microbiol. 30(1): 10-19.
Hsu, C. S., dan Lockwood, J.L. 1975. Degradation enzyme from bacteria thermofil. J. App. Microbiol. 29 (3): 422-426.
Huang, J. H. dan J. J. Chen. 2005. The rool of lacase in lignin biodegradation. J. Ind Microbiol and Biotech. 2(1):443.
Imas, T., R. S. Hadioetomo, A. G. Gunawan, Y. Setiadi. 1989. Mikrobiologi Tanah II. PAU IPB. Bogor. hlm 68.
Inbar, J. dan I. Chet. 1991. Evidence that chitinase produced by Aeromonas caviae is involved in the biological control of soil-borne plant pathogens by the bacterium soil. J. Biochem.23 (1): 973-97.
Indarwan, A. 2011. Penghambatan layu Fusarium pada benih cabai merah (Capsicum anuum. L) yang berkapsulasi alginat-kitosan dan tapioka dengan bakteri kitinolitik. Skripsi. USU. Medan. hlm 30.
Kaushish, M, . L., A. Bahyana, D. Dangwal, K. Garg. 2009. Degradation of benzopyrene by a norel strain Bacillus subtilis BMT4i (MT CC9447). Brazilian J. Microbiology. 40(1): 884-892.
Kosaric, N. 1992. Biosurfactants in Industry. J. Pure and App .Chem. 64 (1): 1731. Kosaric, N., C. C. Neil, D. Gray, W. L. Cairns. 1983. Microbial emulsifiers and
de-emulsifiers. J. Biotech. 2(3) : 562.
Lay, B.W. 1994. Analisis Mikroba di Laboratorium. Penerbit Rajawali Press. Jakarta. hlm 75..
Linar, Z. U., B. Budiwati, A. T. Karossi. 1991. Pemanfaatan sukrosa sebagai sumber karbon Streptomyces rimosus pada produksi oksitetrasiklina. J. Teknologi Indonesia. 14(2): 1-8.
Muharni. 2009. Isolasi dan identifikasi bakteri penghasil kitinase dari sumber air panas danau ranau Sumatera Selatan. J. Penelitian Sains. 9(1) :12-15.
Muharni, E dan Nurnawati, 2007. Pengujian aktivitas kitinase Bacillus circulans untuk dikembangkan sebagai agen biokontrol pada penyakit tanaman, J. Penelitian Sains, 1(2):144 – 150.
Neumann, H. J., B. D. Paczynska-Lahme, D. Severin. 2001. Composition and proporties of petroleum. Haisted Press. New York. hlm. 1-17, 28-29.
Oku, H. 1994. Plant pathogenesis and disease control. Lewis Pul. London. hlm. 245, 402.
Paturau, M .J. 1969. Products of the cane sugar industry, and introduction utilization. Elsevier Publ. Com, Amsterdam. London. hlm. 33-53.
Pelczar, M. J. dan E. C. S. Chan. 2005. Dasar-dasar Mikrobiologi. Jilid 1. Penerbit. Universitas Indonesia Press. Jakarta. hlm. 511.
Pitt, J. L dan A. D. Hocking. 1997. Fungi and Food Spoilage. Second Edition. Blackie Academic and Professional. New York. hlm. 252-254.
Pleban, S., L. Chernin, I. Chet. 1997. Chitinolytic activity of endophitic strain of Bacillus cereus. J. Apll. Microbiol 3 (2): 284-288.
Prihatna, C. 2003. Antagonisme Serratia marcescens DS-8 dan Aeromonas caviae WS7b terhadap Fusarium oxysporum. Skripsi. IPB. Bogor. hlm 12.
Remsen, C. C. 1971. Thedistribution or urea in coastal and ocegonic water. J. Limnol. Oceanogr. 16 (2): 732-740.
Ridha, N. B. 2010. Optimasi produksi biosurfaktan Oleh Pseudomonas auriginosa dengan variasi sumber karbon dan nitrogen . Skripsi. USU. Medan. hlm 27 Rodrigues, L., J. R. Teixeira, Oliveira, H. J. Van Der. 2006. Response surface
optimization of the medium components for the production of biosurfactants by probiotic bacteria. J. Process Biochemistry. 41(1) : 1–10.
Rodriquez-Kabana, R., G. Godoy, Morgan-Jones, R. A. Shelby. 1983. The determination of soil chitinase activity and condition for assay and ecological studies. J.Plant - Soil. 75(1) : 95-106.
Semangun, H. 2000. Pengantar ilmu penyakit tumbuhan. Cetakan Pertama. Gajah Mada University Press. Yogyakarta. hlm. 562.
Srijanto, B. 2003. Kajian pengembangan teknologi proses produksi kitin dan kitosan
secara kimiawi. J
Farmasi dan Medika-BPPT. Jakarta.
Suryanto D., dan E. Munir. 2008. Potensi pemanfaatan isolat kitinolitik lokal untuk pengedalian hayati jamur. Prosiding Seminar Hasil-hasil Penelitian. Medan: FMIPA USU.
, 2001. Selection and Characterization of Bacterial isolates for Monocyclic Aromatic Degradation. Disertasi. IPB. Bogor.
25
, 2006. Isolation and characterization of chitinolitic bacteria and their potential to inhibit plant pathogenis fungi. Hayati J. of bioscience.5 (3): 120. Ulrike, K dan B. Elkin. 2000, Isolation of native and bacterial antaginis against plant
Deseases. Rev Dark. Swedia. hlm. 377
Volkering, D., G. Cooper, N. Koric. 1998. Effect of nitrogen sources on surfactans production by Microorganims ATCC 19558. J. Microbiol Enhanced Oil Recovery. 16 (3): 66-71.
Wang, S. L dan W. T. Chang. 1997. Purification and characterization of two bifungsional chitinases/lysozymes extracellularly produced by pseudomonas aeruginosa K-187 in a shrimp and crab shell powder medium. J. Microbiol, 63 (2) : 380 – 386.
Wibowo, R. H. 2006. Isolasi dan uji antagonis fungi endofit akar kelapa sawit (Elaeis guineensis Jacq.) terhadap Ganoderma boninense Pat. Skripsi. USU. Medan Wu, J. Y., K. L Yeh, W. B. Lu, C. L. Lin, J. S. Chang. 2008. Rhamnolipid production
with indigenous Pseudomonas aeruginosa EM1 isolated from oil-contaminated site. J. Bioresources Technology. 99(3): 1157-1164.
Wu, M. L., Y. C. Chuang, J. P. Chen, C. S. Chen, M. C. Chang. 2001. Identification and characterization of the three chitin-binding domains within the multidomain chitinase chi92 from Aeromonas hydrophila jp 101. J. Microbiol.
67(4): 5100-5106.
Yataghene, A., M. Abouseoud, R. Maachi, A. Amrane. 2008. Effect of the carbon and nitrogen sources on biosurfactant production by Pseudomonas fluorescen- biosurfactan of the characterization.
Zajic, J. E., H. Guignard, D. F. Gerson. 1997. Emulsifying and surface active agent from corybacterium hydrocarboclaclus. J. Biotech and Bioenginer. 10(1): 123-129.
LAMPIRAN
Diagram Alir
Lampiran 1: Pembuatan koloidal kitin Ddengan cara hidrolisis parsial
Dihaluskan
Dilarutkan dalam 180 ml 10N HCl sambil Diaduk dengan pengaduk magnetik selama 1,5-2 jam.
Dituang ke dalam Erlenmeyer yang berisi 2 liter air.
Dibiarkan semalam kemudian bagian yang bening dipisahkan dari endapannya.
Dicuci sampai pH suspensi khitin antara 5,5-6
Diambil 10 ml kemudian dikeringkan pada suhu 80oC. Dihitung berat keringnya.
(Rodriquez-Kabana et al. 1983)
20 g cangkang udang atau kepiting
Suspensi Kitin
Hasil
Endapan Dibuang
bagian bening
27
Lampiran 2: Perbanyakan dan pembuatan suspensi bakteri kitinolitik
DiKultur dalam media NA dan media MGMK selama 2 hari pada suhu yang setara dengan kekeruhan larutan Mc-Farland (= 108 sel/ml)
Lampiran 3: Alur asai keriap
Diinokulasikan pada media Nutrient Agar (NA) tanpa penambahan kitin dan dengan penambahan kitin pada media MGMC dengan konsentrasi agar 0,25 %, 0,5 %, 1 % dan 2 %
Diinkubasi pada suhu ruang kisaran (270 C - 300C) Dilakukan pengamatan pada hari ke 2, 4 dan 5 dan 6 Diukur besarnya pergerakan koloni biakan bakteri tersebut.
Hal yang sama dilakukan dengan memvariasikan sumber karbon dan nitrogennya (Lampiran 4).
30 µl suspensi bakteri kitinolitik
(108 cfu/ml)
Pergerakan bakteri
29
Lampiran 4: Komposisi media dengan variasi sumber karbon dan nitrogen
a. Komposisi Media dengan Variasi Sumber Karbon dan Nitrogen per 1000 ml
1. KH2PO4 = 0,3 g
Sumber karbon yang digunakan per 100 ml
1. Molase dari tetes tebu = 2 % b/v = 2 g 2. Jamur Kering = 2 % b/v = 2 g 3.Cangkang Kepiting = 2 % b/v = 2 g 4. Koloidal Kitin = 11,89 b/v (Asril, 2011)
Sumber karbon yang digunakan per 100 ml 1. Amonium Nitrat (NH4NO3) = 0, 3 g
2. Sodium Nitrat (NaNO3) = 0, 3 g (Ridha, 2010)
Variasi sumber karbon dan nitrogen : 1. Koloidal kitin dan Urea (KU)
2. Koloidal kitin dan Sodium Nitrat (KS) 3. Molase dan Urea (MU)
4. Molase dan Sodium Nitrat (MS) 5. Cangkang Kepiting dan Urea (CU)
6. Cangkang Kepiting dan Sodium Nitrat (CS) 7. Tubuh buah jamur ganoderma dan Urea (JU)
8. Tubuh uah Jamur ganoderma dan Sodium Nitrat (MS) 9. Nutrient Broth (NB)
Kemudian komposisi ini dimasukan ke dalam erlenmeyer yang berisi media MGMK dan dilarutkan dengan aquadest sebanyak 100 ml dan disterilkan dengan autoclave Yamato SN 210 (pada suhu 1210C dengan tekanan 2 atm selama 15 menit).
Lampiran 5: Bakteri pada media TPC kitin
(A dan B ) Bacillus sp. BK17 dan (C dan D) Enterobacter sp. BK15 yang ditumbuhkan pada suhu ruang.
Bakteri pada media tpc kitin yang ditumbuhkan pada suhu 40C (A) Bacillus sp. BK17 dan (B)
Enterobacter sp. BK15
31
Lampiran 6. Isolat bakteripada media cair dengan variasi sumber karbon dan nitrogen (A) Koloidal kitin, (B) Cangkang kepiting, (C) Molase, (D) Serbuk Ganoderma, (E) NB.