EVALUASI WAKTU PEMBERIAN PAKAN BUATAN
PADA LARVA IKAN BETOK (
Anabas testudineus
Bloch)
ARTIN INDRAYATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Evaluasi Waktu Pemberian Pakan Buatan pada Larva Ikan Betok (Anabas testudineus Bloch) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2015
RINGKASAN
ARTIN INDRAYATI. Evaluasi Waktu Pemberian Pakan Buatan pada Larva Ikan Betok (Anabas testudineus Bloch). Dibimbing oleh MIA SETIAWATI dan MUHAMMAD AGUS SUPRAYUDI.
Pakan alami biasanya diberikan paling awal sejak mulut larva ikan mulai terbuka sampai larva dapat beradaptasi dengan pakan buatan. Pakan alami ini diberikan sejak awal, karena pakan alami memiliki enzim yang membantu pencernaan bagi larva yang belum sempurna proses pencernaannya. Peralihan sumber pakan pada larva, dari memakan pakan alami menjadi pakan buatan memerlukan adaptasi terlebih dahulu (weaning) agar larva mau memakan pakan buatan dan dapat mencerna dengan baik. Oleh karena itu perlu dilakukan penelitian untuk menentukan waktu yang tepat memulai pemberian pakan buatan pada larva betok, sehingga dapat meningkatkan efisiensi usaha pembenihan dan tidak terjadi lagi pemberian pakan buatan terlalu dini yang dapat menghambat pertumbuhan.
Ikan uji yang digunakan adalah larva ikan betok berumur 10 hari setelah menetas yang berasal dari pemijahan semi buatan dengan penyuntikan hormon ovaprim. Pemeliharaan ikan uji dilakukan sampai larva ikan betok berumur 35 hari, dengan kepadatan 10 ekor L-1. Wadah penelitian berupa akuarium berukuran 30x20x20 cm3 yang diisi air dengan volume total 10 liter. Pakan uji yang digunakan berupa artemia dan pakan buatan mikrodiet dengan ukuran 200-400μ. Artemia diberikan dengan secara ad libitum dengan kepadatan 5 ekor mL-1 dan mikrodiet secara ad satiation dengan frekuensi pemberian pakan 4 kali sehari yaitu pukul 08.00, 12.00, 16.00 dan 20.00 WIB. Untuk menjaga kualitas air supaya tidak mempengaruhi kualitas penelitian, maka dilakukan pergantian air sebanyak 10% dari volume air media. Rancangan percobaan yang digunakan adalah Rancangan Acak lengkap (RAL) dengan 3 kali ulangan. Perlakuan pemberian pakan yang sama diberikan pada larva dengan perbedaan awal waktu pemberian pakan buatan yaitu pada hari ke-15 setelah menetas (W15), hari ke-20 setelah menetas (W20) dan hari ke-25 (W25) setelah menetas. Pada perlakuan kontrol larva diberi pakan alami berupa artemia (AR) dan pakan buatan saja (MD) sampai pada akhir penelitian (hari ke-35 setelah menetas).
Hasil penelitian menunjukkan bahwa waktu memulai pemberian pakan buatan yang tepat pada larva ikan betok adalah pada hari ke-20 setelah menetas karena memiliki faktor kondisi serta konsentrasi RNA dan DNA tertinggi. Hasil ini didukung dengan perkembangan enzim pencernaan dan rasio tripsin/kimotripsin.
SUMMARY
ARTIN INDRAYATI. Evaluation of the optimal weaning time in betok fish larvae (Anabas testudineus Bloch). Supervised by MIA SETIAWATI and MUHAMMAD AGUS SUPRAYUDI.
Live feed is usually given the earliest since the mouth of the fish larvae begin to open until the larvae can adapt to the artificial diets. This live feed is given from the beginning, because it has enzymes that help larvae digestion for the larvae rudimentary digestive process. Transitional source of feed on the larvae of eating live feed into artificial diets requires prior adaptation (weaning) so that the larvae can ingest artificial diets and digest properly. Therefore, research is needed to determine the right time start giving artificial diets (weaning) on climbing perch (Anabas testudineus Bloch) larval in order to increase the efficiency of the hatchery operations and does not happen again early weaning that can decrease the growth rate.
The fish larvae samples was 10 days post hatching coming from semi artificial spawning with ovaprim hormone injections. The test fish raising was conducted until 35 days post hatching, with a density of 10 fish L-1. The container used in this study was an aquarium measuring 30x20x20 cm-3, the total water volume for each aquarium was 10 litres. Feed samples used in the form of Artemia and artificial diets/microdiets with 200-400 size. Artemia provided with ad libitum with a density of 5 individu mL-1 and microdiets ad satiation with the frequency of feeding four times a day were 08.00 am, 12:00am, 04.00 pm and 08:00 pm. To maintain the quality of water so as not to affect the quality of the research, then conducted change of water as much as 10% of the water volume of the aquarium. The experimental design used was a complete randomized design (CRD) with three replications. The same weaning regime started at live different days post hatching (dph) namely 15 dph (W15), 20 dph (W25), 25 dph (W25). The larvae in control treatment were fed with live prey/Artemia (AR) and only artificial diets/microdiet (MD) to the end of the experiment (35 dph).
This study showed that weaning of betok fish larvae should be obtained after 20 dph because this treatment have the higest condition factor and RNA/DNA concentrations. These results are supported by digestive enzymes and trypsin/chymotrypsin ratio.
Keywords: Anabas testudineus, condition factor, digestive enzyme, growth, RNA:DNA ratio, weaning
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
EVALUASI WAKTU PEMBERIAN PAKAN BUATAN
PADA LARVA IKAN BETOK (
Anabas testudineus
Bloch)
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul
penelitian “Evaluasi Waktu Pemberian Pakan Buatan pada Larva Ikan Betok (Anabas testudineus Bloch)”, yang dilaksanakan pada bulan Februari sampai Maret 2015.
Terima kasih penulis ucapkan kepada Ibu Dr Mia Setiawati dan Bapak Dr Muhammad Agus Suprayudi selaku pembimbing atas segala arahan dan ilmu yang diberikan sehingga penelitian dan penulisan tesis ini dapat diselesaikan dengan baik. Di samping itu, penghargaan penulis sampaikan atas bantuan dana pendidikan magister yang diperoleh dari Beasiswa Tugas Belajar PUSDIK KP. Ungkapan terima kasih juga disampaikan kepada bapak, ibu, suami, putriku
beserta seluruh keluarga, atas segala do’a dan kasih sayangnya. Selanjutnya
penulis juga menyampaikan ungkapan terima kasih dan penghargaan kepada staf Laboratorium Nutrisi Ikan Departemen Budidaya Perairan, FPIK IPB dan teman-teman mahasiswa Program Studi Ilmu Akuakultur IPB khususnya angkatan 2013.
Semoga karya ilmiah ini bermanfaat.
Bogor, November 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
2 METODE 3
Bahan 3
Pemeliharaan dan Pengamatan Larva 4
Parameter Uji 4
Analisis Data 5
3 HASIL DAN PEMBAHASAN 5
Hasil 5
Pembahasan 8
4 SIMPULAN 10
DAFTAR PUSTAKA 10
LAMPIRAN 13
DAFTAR TABEL
1 Hasil proksimat pakan uji 3
2 Rerata panjang (L), berat akhir (W), faktor kondisi (K), konsentrasi RNA, konsentrasi DNA dan rasio DNA:RNA larva ikan betok pada perlakuan pemberian pakan buatan pada hari yang berbeda 6 3 Rasio tripsin/kimotripsin larva ikan betok pada perlakuan
pemberian pakan buatan pada hari yang berbeda 8
DAFTAR LAMPIRAN
1 Analisis statistik panjang akhir (L) larva ikan betok yang diberi perlakuan pemberian pakan buatan pada umur yang berbeda menggunakan Rancangan Acak Lengkap (RAL) pada selang kepercayaan 95%
14 2 Analisis statistik faktor kondisi larva ikan betok menurut rumus
Fulton (K) yang diberi perlakuan pemberian pakan buatan pada umur yang berbeda menggunakan Rancangan Acak Lengkap (RAL) pada
selang kepercayaan 95% 14
3 Analisis statistik berat akhir (W) larva ikan betok yang diberi perlakuan pemberian pakan buatan pada umur yang berbeda menggunakan Rancangan Acak Lengkap (RAL) pada selang
kepercayaan 95% 14
4 Analisis statistik konsentrasi RNA larva ikan betok yang diberi perlakuan pemberian pakan buatan pada umur yang berbeda menggunakan Rancangan Acak Lengkap (RAL) pada selang
kepercayaan 95% 14
5 Analisis statistik konsentrasi DNA larva ikan betok yang diberi perlakuan pemberian pakan buatan pada umur yang berbeda menggunakan Rancangan Acak Lengkap (RAL) pada selang
kepercayaan 95% 15
6 Analisis statistik rasio RNA:DNA (RD) larva ikan betok yang diberi perlakuan pemberian pakan buatan pada umur yang berbeda menggunakan Rancangan Acak Lengkap (RAL) pada selang
kepercayaan 95% 15
7 Prosedur analisis enzim amilase, pepsin, kimotripsin, tripsin dan
lipase 15
8 Prosedur ekstraksi RNA/DNA dan pengukuran konsentrasi
1 PENDAHULUAN
Latar Belakang
Budidaya ikan betok (Anabas testudineus Bloch) di Indonesia semakin berkembang setelah resmi dilepas sebagai salah satu ikan yang sudah berhasil didomestikasi. Daerah penyebaran ikan betok di Indonesia meliputi Sumatera, Jawa, Madura, Kalimantan, Sulawesi namun ikan ini lebih banyak dibudidayakan di daerah Kalimantan Tengah dan Kalimantan Selatan. Harga ikan betok (papuyu) di Kalimantan (kecuali Kalimantan Barat) relatif mahal mencapai rata-rata Rp. 65.000 kg-1 (DISPERINDAGKOP 2013). Selain di Indonesia, ikan betok juga sudah lebih dahulu dikembangkan di Bangladesh, Thailand, Laos, Vietnam, Thailand, Filipina dan India (Mahmood et al. 2004; Amornsakun et al. 2005; Sarkar et al. 2005; Morioka et al. 2009). Beberapa penelitian telah dilakukan pada kegiatan pembenihan, pembesaran dengan pemberian pakan ikan betok pada berbagai stadia. Studi tentang pemijahan induk betok telah dilakukan oleh Trieu dan Long (2001) serta Sarkar et al. (2005) dengan tingkat keberhasilan penetasan mencapai 80 -100%. Amornsakun et al. (2005) dan Morioka et al. (2009) meneliti tentang pertumbuhan dan perkembangan stadia awal larva dan juvenil ikan betok, saat menetas larva ikan ini berukuran 1.9+0.1 mm saja dan pada hari ke-35 panjangnya mencapai 18.4+2.1 mm. Mahmood et al. (2004) melakukan penelitian tentang pemberian pakan alami yang berbeda pada larva ikan betok berupa artemia dan tubifek dalam sediaan kering dan basah. Yulintine et al. (2012) meneliti perkembangan enzim pencernaan pada larva ikan betok, dimana aktivitas semua enzim relatif stabil pada hari ke-25 setelah menetas yang bersamaan dengan terdeteksinya pilorik kaeka dan sejak itu direkomendasikan untuk diberi pakan buatan. Penelitian tentang formulasi pakan dan kegiatan pembesaran ikan betok juga sudah banyak diteliti pada berbagai media dan wadah budidaya (Widodo et al. 2007; Van dan Hoan 2009; Alam et al. 2010). Berdasarkan beberapa penelitian tersebut belum ada informasi tentang weaning time pada larva ikan betok yaitu waktu yang dibutuhkan larva beralih dari memakan pakan alami menjadi pakan buatan.
2
buatan mikrodiet dengan kandungan protein sebesar 60.39% (Rp.300.000 kg-1).
Peralihan sumber pakan pada larva, dari memakan pakan alami menjadi pakan buatan memerlukan adaptasi terlebih dahulu (weaning) agar larva mau memakan pakan buatan dan dapat mencerna dengan baik. Kesulitan larva untuk menerima dan mencerna pakan buatan biasanya dikarenakan belum matangnya sistem pencernaan dan rendahnya kapasitas enzim (Ma et al. 2014a) bahkan jika pakan buatan diberikan terlalu dini dapat mengakibatkan menurunnya jumlah dan ketinggian enterosit dan epitelium usus yang menyebabkan menurunnya kemampuan cerna dari larva ikan tersebut (Hamza et al. 2007 ). Pada larva ikan betok, Amornsakun et al. (2005) dan Morioka et al. (2009) menyebutkan bahwa larva ikan betok mulai memakan pakan buatan pada umur 14-16 hari setelah menetas dan Yulintine et al. (2012) merekomendasikan pemberian pakan buatan untuk larva ikan betok pada hari ke-25 setelah menetas berdasarkan perkembangan saluran pencernaanya, sedangkan pembenih ikan betok di Kalimantan mulai memberikan pakan buatan pada larva pada hari ke-7 setelah menetas. Pengkajian tentang weaning time pada beberapa spesies ikan menunjukkan pemberian pakan yang terlalu dini dapat menyebabkan kesulitan mencerna, terhambatnya perkembangan organ pencernaan atau menunjukkan tanda-tanda kekurangan nutrien(Nguyen et al. 2011, Liu et al. 2012, Ma et al. 2014a). Ikan memiliki laju pertumbuhan tertinggi pada stadia larva yaitu mencapai 20-50% hari-1, setelah itu laju pertumbuhan menurun pada stadia
juvenile sebesar 5-10% hari-1 dan pada stadia dewasa hanya mencapai 1-3% hari-1. Jika pada stadia larva mengalami gangguan/tekanan pertumbuhan maka dapat mengakibatkan semakin besar energi yang digunakan untuk metabolisme selanjutnya sebagai bentuk kompensasi mengejar laju pertumbuhan yang terhambat saat kondisi lingkungan sudah membaik (Holt 2011).
Berdasarkan informasi diatas maka perlu dilakukan penelitian untuk menentukan waktu yang tepat memulai weaning pada larva betok pada umur 15, 20 dan 25 hari setelah menetas, karena komposisi pakan dapat mempengaruhi perkembangan sistem pencernaan dengan memicu aktivitas beberapa enzim pencernaan (Hamza et al. 2007; Zambonino-Infante et al. 2008). Jika larva mampu beradaptasi pada pemberian pakan buatan lebih awal maka dapat mengurangi jumlah pakan alami yang diberikan sehingga dapat meningkatkan efisiensi dan mengoptimalkan pertumbuhan pada usaha pembenihan.
Perumusan Masalah
Pada kegiatan pembenihan ikan, weaning pada larva biasanya dilakukan sejak dini jika memungkinkan untuk mengurangi biaya dan keterbatasan dari penggunaan pakan alami. Penelitian ini mencoba menentukan penerapan waktu pemberian pakan buatan yang tepat (weaning) pada larva ikan betok melalui evaluasi pertumbuhan dan perkembangan enzim pencernaan.
Tujuan Penelitian
3
ikan betok (Anabas testudineus Bloch) melalui evaluasi pertumbuhan dan perkembangan enzim pencernaan.
Manfaat Penelitian
Hasil dari penelitian ini dapat memberikan informasi waktu yang tepat untuk memulai memberikan pakan buatan pada larva ikan betok.
2 METODE
Bahan
Larva ikan betok yang digunakan diperoleh dari pemijahan semi buatan di Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Induk ikan betok berasal dari BBAT Mandiangin yang sudah diadaptasikan terlebih dahulu selama 6 bulan dengan perbandingan induk betina dan jantan adalah 1:4. Stok larva dipelihara dalam satu wadah dengan kepadatan 100 ekor L-1 dan diberi pakan alami berupa rotifera pada hari ke-2 setelah menetas dan pada hari ke-7 diberikan artemia sebagai pakan lanjutan. Benih berumur 10 hari dipindahkan dalam wadah perlakuan dengan kepadatan 10 ekor l-1 dengan
ukuran 2.02+0.16 mm. Wadah yang digunakan untuk perlakuan adalah akuarium dengan ukuran 30x25x25 cm sebanyak 18 buah dan pada saat perlakuan diisi air dengan volume 10 l. Untuk mempertahankan suhu media agar tetap stabil, semua wadah percobaan ditempatkan dalam water bath yang diberi termostat sehingga mudah dilakukan pengontrolan suhu. Pakan buatan yang digunakan pada penelitian ini menggunakan pakan alami artemia dan pakan mikrodiet berukuran 200-400 dengan kandungan nutrient pakan seperti diperlihatkan pada Tabel 1. Tabel 1. Hasil proksimat pakan uji (% bobot kering)
Komposisi Nutrien (%)
Jenis Pakan Artemia Mikrodiet
Protein 65.06 60.93
Lemak 14.45 12.84
Abu 5.06 7.36
Serat Kasar 3.42 2.52
BETN 12.01 16.62
Ket :
4
Pemeliharaan dan Pengamatan Larva
Penyediaan benih dilakukan 2 minggu sebelum perlakuan, yaitu dengan memijahkan induk ikan betok yang disuntik ovaprim dengan dosis 0.1 mL kg-1 berat badan. Larva hasil pemijahan dipelihara dalam wadah stok dengan kepadatan 100 ekor L-1 dengan diberi pakan rotifer pada hari ke-2 dan dilanjutkan dengan artemia pada hari ke-7, setelah berumur 10 hari maka larva dipindahkan ke akurium perlakuan dengan kepadatan 10 ekor L-1 sebanyak 18 akuarium
dengan volume air 10 liter yang digunakan dalam pengamatan pertumbuhan dan sintasan larva. Pakan alami berupa artemia diberikan secara adlibitum dengan kepadatan 5 ekor mL-1. Frekuensi pemberian pakan buatan sebanyak 4 kali sehari secara at satiation, dengan perlakuan yaitu:
a. Perlakuan W15 pemberian pakan buatan dimulai pada hari ke-15 setelah
d. Perlakuan AR pemberian pakan alami artemia e. Perlakuan MD pemberian pakan buatan mikrodiet
Pemeliharaan dan pengamatan larva dilakukan sampai larva berumur 35 hari setelah menetas. Pengambilan sampel untuk pengukuran panjang, berat, konsentrasi RNA/DNA dan aktivitas enzim pencernaan juga dilakukan pada akhir masa perlakuan. Sepanjang masa pemeliharaan, kualitas air dipertahankan dengan penyiponan setiap hari dan pergantian air sebanyak 10% dari volume air media. Kualitas air pada akuarium selama penelitian ini berada pada kisaran suhu 26-27.5
0C, DO 5.2-7.2 mg L-1, pH 6.5-7.4 dan NH3 0.001-0.005 mg L-1, nilai ini masih
berada dalam kisaran yang dibutuhkan pada budidaya ikan betok (Bunasir et al. 2013).
Parameter Uji 1. Pertumbuhan Larva
Pengukuran pertumbuhan larva dilakukan dengan menimbang berat badan dan mengukur panjang larva pada akhir masa perlakuan. Berat larva ditimbang menggunakan timbangan analitik dengan ketelitian 0.01 dan panjang larva diukur dengan bantuan kertas millimeter. Data berat dan panjang larva selanjutnya digunakan juga dalam perhitungan untuk menentukan indeks faktor kondisi dengan rumus: K = 100 x (W/L3), dimana W adalah berat badan larva (g) dan L
adalah panjang larva (cm) (Froese 2006).
2. Enzim pencernaan
Enzim pencernaan yang diukur pada penelitian ini meliputi amilase, pepsin, tripsin, kimotripsin dan lipase. Berat sampel larva yang digunakan untuk pengujian enzim berkisar antara 1.5 – 2.5 gram dan dihomogenisasi (1 g 10 mL-1)
-5
80 0C untuk dapat digunakan selanjutnya dalam pengukuran aktivitas enzim.
Enzim pencernaan yang diukur dinyatakan dalam satuan mU/mg protein (Bradford 1976). Pengujian amilase dan pepsin menggunakan metode Worthington (1993), uji tripsin dan kimotripsin menggunakan metode Erlanger et al. (1961) dan uji lipase menggunakan menggunakan metode Borlongan (1990). Prosedur analisis aktivitas enzim dan protein selengkapnya dapat dilihat pada Lampiran 7. Pada tripsin dan kimotripsin lebih lanjut dilakukan perhitungan rasio tripsin/kimotripsin untuk melihat laju sintesis protein dan sintesis pertumbuhan (Holt 2011).
3. Rasio RNA:DNA
Selain pengukuran panjang dan berat akhir larva, pertumbuhan dan kondisi nutrisi pada stadia larva dan juvenil dapat diestimasi dengan menghitung rasio RNA:DNA pada jaringan (Caldarone et al. 2006). Estimasi kandungan asam nukleat (RNA dan DNA) dilakukan melalui dua tahapan yaitu ekstraksi asam nukleat dan pengukuran kandungan asam nukleat. Ekstraksi RNA menggunakan pereaksi Genezol dan untuk mengekstraksi DNA digunakan Ultra Clean Wash Buffer. Selanjutnya kandungan RNA dan DNA hasil ekstraksi diukur menggunakan GENE Quant pada 630 nm dan hasilnya digunakan dalam perhitungan perbandingan rasio RNA:DNA. Prosedur ekstraksi dan pengukuran RNA dan DNA selengkapnya dapat dilihat pada Lampiran 8.
Analisis Data
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan 5 perlakuan dan 3 ulangan. Uji statistika dilakukan pada parameter pertumbuhan larva sedangkan pada aktivitas enzim pencernaan dilakukan analisa secara deskriptif. Data yang diperoleh ditabulasi dengan program MS. Office Excel 2013 dan untuk uji ANOVA dianalisis dengan menggunakan program SPSS 18. Perlakuan yang berbeda nyata diuji lanjut dengan uji lanjut Duncan.
3 HASIL DAN PEMBAHASAN
Hasil
6
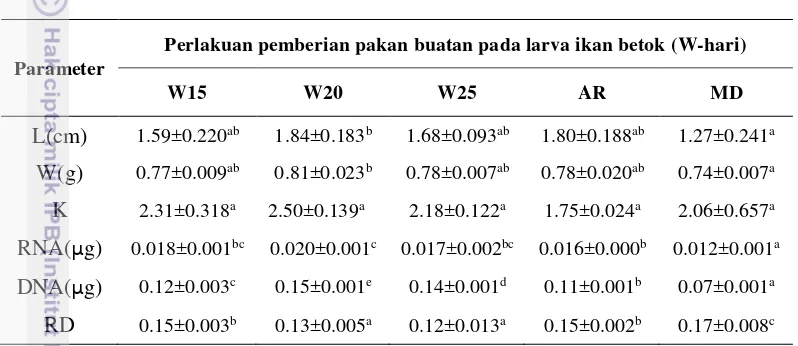
konsentrasi RNA dan DNA memiliki kecenderungan peningkatan selaras dengan pertumbuhan panjang dan berat dengan nilai terendah dimiliki oleh perlakuan MD dan tertinggi pada perlakuan W20. Demikian juga pada hasil perhitungan rasio RNA:DNA (RD) mengalami peningkatan selaras dengan nilai faktor kondisi pada perlakuan W15, W20 dan W25, kecuali pada perlakuan AR dan MD yang memiliki nilai RD lebih tinggi dikarenakan nilai konsentrasi DNA sebagai nilai pembagi lebih tinggi dari pada konsentrasi RNA-nya.
Tabel 2 Rerata panjang (L), berat akhir (W), faktor kondisi (K), konsentrasi RNA, konsentrasi DNA dan rasio RNA:DNA (RD) larva ikan betok pada perlakuan pemberian pakan buatan pada hari yang berbeda
Parameter
Perlakuan pemberian pakan buatan pada larva ikan betok (W-hari)
W15 W20 W25 AR MD
L(cm) 1.59±0.220ab 1.84±0.183b 1.68±0.093ab 1.80±0.188ab 1.27±0.241a
W(g) 0.77±0.009ab 0.81±0.023b 0.78±0.007ab 0.78±0.020ab 0.74±0.007a
K 2.31±0.318a 2.50±0.139a 2.18±0.122a 1.75±0.024a 2.06±0.657a
RNA(μg) 0.018±0.001bc 0.020±0.001c 0.017±0.002bc 0.016±0.000b 0.012±0.001a
DNA(μg) 0.12±0.003c 0.15±0.001e 0.14±0.001d 0.11±0.001b 0.07±0.001a
RD 0.15±0.003b 0.13±0.005a 0.12±0.013a 0.15±0.002b 0.17±0.008c Ket: Huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (p<0.05). Nilai yang tertera merupakan nilai rerata simpangan baku.
7
(a) (d)
(b) (e)
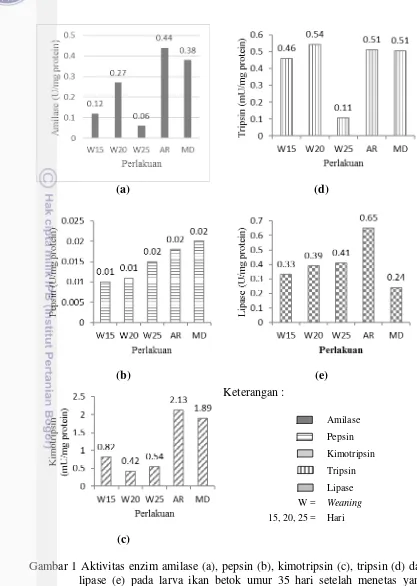
Keterangan :
Amilase
Pepsin
Kimotripsin
Tripsin
Lipase
W = Weaning
15, 20, 25 = Hari
(c)
Gambar 1 Aktivitas enzim amilase (a), pepsin (b), kimotripsin (c), tripsin (d) dan lipase (e) pada larva ikan betok umur 35 hari setelah menetas yang diberi pakan buatan pada hari yang berbeda
8
Tabel 3 Rasio tripsin/kimotripsin larva ikan betok pada larva ikan betok umur 35 hari setelah menetas yang diberi pakan buatan pada hari yang berbeda
9
diakibatkan stres fisiologi karena terlalu dini diberi pakan buatan yang dapat menimbulkan cekaman kekurangan nutrisi selama masa pemeliharaan dari hari ke-10 sampai ke-35 setelah menetas. Sebagai bentuk respons stres ini, sel akan berusaha mempertahankan homeostasis dengan cara apoptosis (penghancuran sel secara terencana) yang membutuhkan sintesis aktif RNA dan protein dan merupakan proses yang memerlukan energi tinggi(Kumar et al. 2015) yang dapat mengakibatkan berkurangnya konsentrasi DNA pada perlakuan MD. Bertolak belakang dengan konsentrasi DNA yang rendah, konsentrasi RNA pada perlakuan MD yang masih lebih tinggi menunjukkan kondisi sel yang masih berusaha mempertahankan metabolisme dalam menjaga homeostasis sel, walaupun dalam kondisi mal nutrisi karena terlalu dini diberi pakan buatan yang diduga menghambat perkembangan organ pencernaan sejak awal (Nguyen et al. 2011). Hasil penelitian Hamza et al. (2007) pada ikan Pike Perch juga menunjukkan bahwa waktu pengadaptasian pakan buatan (weaning) yang tidak tepat dapat menghambat perkembangan lambung atau merusak sel epitel sehingga menurunkan kemampuan cerna dari larva.
Perkembangan enzim pencernaan larva dapat dilihat dari hasil pengukuran enzim pada hari ke-35 yang bervariasi aktivitasnya antar perlakuan. Perlakuan W15, W20 dan W25 memiliki aktivitas enzim pencernaan yang cenderung lebih rendah dibandingkan perlakuan AR dan MD, kecuali pada aktivitas tripsin. Variasi nilai aktivitas spesifik enzim ini mencakup periode diferensiasi morfologi dari saluran pencernaan dan berhubungan dengan perkembangan kelenjar pencernaan (Ma et al 2014b). Perkembangan pola aktivitas enzim menjadi relatif stabil pada stadia akhir larva diduga berkaitan dengan perubahan struktur dan morfologi selama metamorphosis (Chen et al. 2006). Kecenderungan aktivitas enzim yang rendah ini terkait perkembangan organ pencernaan yang diduga sudah mulai berkembang baik sehingga pola enzimnya menurun menuju kestabilan. Lebih lanjut Liu et al. (2012) menjelaskan bahwa pada Chinese longsnout catfish yang mulai diberikan pakan buatan menunjukkan larva dengan enzim pencernaan yang tinggi tidak memiliki laju pertumbuhan yang baik. Pendapat lain diduga adalah kapasitas absorbsi dan asimilasi dari larva ikan tidak sesuai dengan kebutuhan nutrient yang dibutuhkan ikan sehingga menimbulkan kelaparan yang kronis (Liu et al. 2012). Sedangkan Engrola et al. (2007) menemukan bahwa larva ikan memiliki masa periode adaptasi pada pakan buatan dengan timbulnya fluktuasi sekresi enzim dan masa adaptasi ini berbanding terbalik dengan periode post larva (juvenil).
10
hasil akhir dari pencernaan, yang berupa peptida kecil dan asam amino bebas yang dapat diserap usus. Selama metamorfosis, lambung terbentuk dan berfungsi secara bertahap dan pencernaan protein dimulai di sini. Pankreas mensekresi pepsinogen yang aktif menjadi pepsin pada suasana lambung yang asam karena sekresi HCl. Pepsin menggantikan peran tripsin dan kimotripsin saat lambung belum terbentuk, menghidrolisis protein pada ikatan antara aromatik dan asam dari asam amino. Hasil pencernaan pepsin berupa polipeptida dengan ukuran sangat beragam tetapi hanya sedikit menghasilkan asam amino bebas, sehingga masih memerlukan kerja tripsin dan kimotripsin pada usus untuk mencerna protein lebih lanjut menjadi asam amino (Holt 2011).
Sintesis dan sekresi enzim pankreatik sangat dipengaruhi oleh asupan pakan dan komposisi nutrien pakan (Ronnestad dan Morais 2007). Tripsin dan kimotripsin dapat dijadikan indikator status nutrisi suatu organisme, karena menunjukkan level aktivitas enzim proteolitik dalam mensintesis protein sebagai salah satu komponen terbesar dalam pakan (Holt 2011). Penggunaan rasio tripsin/kimotripsin merupakan indikator yang lebih baik untuk melihat status nutrisi larva yang mengindikasikan potensi pertumbuhan (Cara et al. 2007). Semakin tinggi rasio tripsin/kimotripsin menunjukkan semakin tinggi pula laju absorpsi asam amino esensial dalam sintesis protein dan potensi pertumbuhan. Hal ini tampak pada hasil perhitungan rasio tripsin/kimotripsin yang tertinggi pada perlakuan W20 juga memiliki konsentrasi RNA dan DNA tertinggi yang menunjukkan potensi pertumbuhan pada perlakuan tersebut paling tinggi.
4 SIMPULAN
growth performance, survival rate and biomass of the fry of climbing perch, Anabas testudineus Bloch. Nature and Science Journal 8(2):36-42.Amornsakun T, Sriwatana W, Promkaew P. 2005. Some aspect in early stage of climbing perch, Anabas testudineus larvae. Songklanakarin Journal Science Technology: Aquatic Science 27(1):403-418.
11
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analitic Biochemical 72:248–254.
Bunasir, Ilmi A, Haryadi A, Helmiansyah, Gunayan, Sunarto. 2013. Perbaikan sistem pembesaran melalui pola pemberian pakan untuk meningkatkan produksi dan mengetahui dominasi sex ratio ikan papuyu (Anabas testudineus Bloch). Banjarbaru, Indonesia: Balai Perikanan Budidaya Air Tawar Mandiangin Direktorat Jendral Perikanan Budidaya Kementerian Kelautan dan Perikanan.
Caldarone EM, Clemessen CM, Berdalet E, Miller TJ, Folkvord A, Holt GJ, Olivar MP dan Suthers M. 2006. Intercalibration of four spectrofluorometric protocols for measuring RNA/DNA ratios in larval and juvenile fish. Limnology and Oceanography: Methods 4:153–163.
Cara B, Moyano FJ, Zambonino-Infante JL. 2007. Trypsin and chymotrypsin as indicator of nutritional status of post-weaned sea bass larvae. Journal of Fish Biology 70(6):1798-1808.
Chen BN, Qin JG, Kumar MS, Hutchinson WG and Clarke SM. 2006. Ontogenetic development of digestive enzymes in yellowtail kingfish Seriola lalandi larvae. Aquaculture 260:264-271.
Chicharo MA, Chicharo L. 2008. RNA:DNA ratio and other nucleic acid derived indices in marine ecology. International Journal of Molecular Science 9:1453-1471.
[DISPERINDAGKOP] Dinas Perindustrian Perdagangan Koperasi Dan Usaha Kecil Menengah Pemerintahan Kabupaten Tanah Bumbu. 2013. Monitoring
Harga Pasar. Kalimantan Selatan (ID).
http://disperindagkop.tanahbumbukab.go.id/index.php?option=com_content& view=article&id=123:monitoring-harga-pasar-juli-2013&catid=35:berita-terkini&Itemid=28. [10Juni 2014]
Engrola S, Coenceicao LEC, Dias L, Pereira R, Ribeiro I, Dinis MT. 2007. Improving weaning strategies for Senegalese sole: effect of body weight and digestive capacity. Aquaculture Research 38(7): 697-707.
Erlanger BF, Kokorsky N and Cohen W. 1961. The preparation and properties of two new chromogenic substrates of trypsin. Archives Of Biochemistry And Biophysics 96:271-278.
Froese R. 2006. Cube law, condition factor and weight-length relationship: history, meta-analysis and recomendations. Journal Applied Ichtyology 22:241-263.
Hamza N, Mhetli M, Kestemont P. 2007. Effects of weaning age and diets on ontogeny of digestive activities and structures of pikeperch (Sander lucioperca) larvae. Fish Physiology and Biochemistry 33:121–133.
Holt GJ. 2011. Larva fish nutrition. Oxford (UK). John Willey & Sons Ltd.
Kerambrun E, Henry F, Perrichon P, Courcot L, Meziane T, Spilmont N, Amara R. 2012. Growth and condition indices of juvenile turbot, Scophthalmus maximus, exposed to contaminated sediments: Effects of metallic and organic compounds. Aquatic Toxicology 108:130-140.
12
Laflamme S, Cote C, Gagnaire PA, Castonguay M. Bernatchez L. 2012. RNA/DNA ratios in American glass eels (Anguilla rostrata): evidence for latitudinal variation in physiological status and constraints to oceanic migration? Ecology and Evolution 2(5):875-884.
Liu B, Zhu X, Lei W, Yang Y, Han D, Jin J, Xie S. 2012. Effect of different weaning strategies on survival and growth in Chinese longsnout catfish (Leiocassis longirostris Gunther) larvae. Aquaculture Journal 364-365:13-18. Ma Z, Qin JG, Hutchinson W, Chen BN, Song L. 2014a. Response of digestive enzyme and body lipid to weaning times in yellowtail kingfish (Seriola lalandi) larvae. Aquaculture Research 45:078-982.
Ma Z, Zhen P, Guo H, Zheng P, Wang L, Jiang S, Qin JG, Zhang D. 2014b. Ontogenic development of digestive functionality in golden pompano (Trachionotus ovatus). Fish Physiology and Biochemistry 40(4):1-9.
Mahmood SU, Ali MS, Ul-Haque MA. 2004. Effect of different feed on larva/fry rearing of climbing perch in Bangladesh. Pakistan Journal Zoology 36(1):13-19.
Mata-Sotres JA, Lazo JP, Baron-Sevilla B. 2015. Effect of age on weaning success in totoaba (Totoaba macdonaldi) larval culture. Aquaculture 437:292-296.
Morioka S, Ito S, Kitamura S, Vongvichith B. 2009. Growth and morphological development of laboratory-reared larval and juvenile climbing perch Anabas testudineus. Ichtyological Research 56(2):162-171.
Nguyen HQ, Reinertsen H, Wold PA, Tran TM, Kjorsvik E. 2011. Effect of early weaning strategies on growth, survival and digestive enzyme activities in cobia (Rachycentron canadum) larvae. Aquaculture International. 19:63-78
Raedemaeker FD, Brophy D, O’Connor I, O’Neil B. 2011. Dependence of
RNA:DNA ratios and Fulton’s K condition indices on environmental characteristics of plaice and dab nursery grounds. Estuarine, Coastal and Shelf Science 98:60-70
Ronnestad I dan Morais S. 2007. Digestion. In: Fin, RN dan Kapoor, BG (eds.) Fish Larva Physiology. Science Publisher, Enfield. NH. pp. 201-262
Sarkar UK, Deepak PK, Kapoor D, Negi RS, Paul SK, Singh S. 2005. Captive breeding of climbing perch with WOFA-FH for conservation and aquaculture. Aquaculture Research 36:941-945.
13
Walther BD, Elsdon TS, Gillanders BM. 2010. Interactive effects of food quality, temperature and rearing time on condition of juvenile black bream Acanthopagrus butcheri. Journal of Fish Biology 76:2455-2468.
Widodo P, Bunasir, Fauzan G, Syafrudin. 2007. Kaji terap pembesaran ikan papuyu (Anabas testudineus Bloch) dengan pemberian kombinasi pakan pelet dan keong emas dalam jaring tancap di perairan rawa. Balai Budidaya Air Tawar Mandiangin. Banjarmasin: Direktorat Jenderal Perikanan Budidaya. Departemen Kelautan dan Perikanan.
Worthington V. 1993. Worthington Enzyme Manual. Enzymes and Related Biochemicals. New Jersey (US): Worthington Chemical.
Yulintine, Harris E, Jusadi D, Affandi R, Alimuddin. 2012. Perkembangan Aktivitas Enzim pada Saluran Pencernaan Larva Ikan Betok (Anabas Testudineus Bloch). Bionatura-Jurnal Ilmu Hayati dan Fisik 14(1):59–67. Zambonino-Infante JL, Gisbert E, Sarasquete C, Navvaro I, Guttierrez J, Cahu
14
Lampiran 1 Analisis statistik panjang akhir (L) larva ikan betok yang diberi perlakuan pemberian pakan buatan pada umur yang berbeda menggunakan Rancangan Acak Lengkap (RAL) pada selang kepercayaan 95%
ANOVA
SK DB JK KT F Sig.
Perlakuan 4 0.557 0.139 4.857 0.028
Galat 8 0.229 0.029
Total 12 0.787
Lampiran 2 Analisis statistik berat akhir (W) larva ikan betok yang diberi perlakuan pemberian pakan buatan pada umur yang berbeda menggunakan Rancangan Acak Lengkap (RAL) pada selang kepercayaan 95%
ANOVA
SK DB JK KT F Sig.
Perlakuan 4 0.023 0.006 11.211 0.002
Galat 8 0.004 0.001
Total 12 0.028
Lampiran 3 Analisis statistik faktor kondisi larva ikan betok menurut rumus Fulton (K) yang diberi perlakuan pemberian pakan buatan pada umur yang berbeda menggunakan Rancangan Acak Lengkap (RAL) pada selang kepercayaan 95%
ANOVA
SK DB JK KT F Sig.
Perlakuan 4 0.815 0.204 1.479 0.295
Galat 8 1.102 0.138
Total 12 1.917
15
ANOVA
SK DB JK KT F Sig.
Perlakuan 4 0.000 0.000 25.185 0.000
Galat 8 0.000 0.000
Total 12 0.000
Lampiran 5 Analisis statistik konsentrasi DNA larva ikan betok yang diberi perlakuan pemberian pakan buatan pada umur yang berbeda menggunakan Rancangan Acak Lengkap (RAL) pada selang kepercayaan 95%
ANOVA
SK DB JK KT F Sig.
Perlakuan 4 0.010 0.002 1181.705 0.000
Galat 8 0.000 0.000
Total 12 0.010
Lampiran 6 Analisis statistic rasio RNA:DNA (RD) larva ikan betok yang diberi perlakuan pemberian pakan buatan pada umur yang berbeda menggunakan Rancangan Acak Lengkap (RAL) pada selang kepercayaan 95%
ANOVA
SK DB JK KT F Sig.
Perlakuan 4 0.004 0.001 23.337 0.000
Galat 8 0.000 0.000
Total 12 0.004
Lampiran 7 Prosedur analisis enzim amilase, pepsin, kimotripsin, tripsin dan lipase
Preparasi sampel:
Larva ikan segar ditimbang, kemudian ditambahkan larutan buffer Tris (20 mM Tris HCl, 1 mM EDTA, 10 mM CaCl2, pH 7.5) dengan perbandingan 10%. Lalu dimasukkan kedalam tabung effendorf dan disentrifuge selama 10 menit 12.000 rpm suhu 4˚C. Diambil supernatantnya dan dilakukan berbagai analisis enzim terhadap supernatant tersebut.
a. Enzim α amilase menggunakan metode Worthington (1993)
16
2. Kemudian dipipet larutan pati diatas sebanyak 0.5 mL, dimasukkan kedalam tabung reaksi.
3. Lalu ditambahkan 0.5 mL sampel/contoh dan diinkubasi selama 3 menit pada suhu 95ºC (waterbath).
4. Ditambahkan larutan DNS sebanyak 0.5 mL, kemudian diinkubasikan kembali pada suhu 95ºC selama 5 menit.
5. Lalu dibaca absorbansnya pada spektrofotometer dengan panjang gelombang
π 540 nm.
Perhitungan:
ENZIM α AMILASE =µmol maltosa yang dihasilkan
mg enzim dlm campuran reaksi x 3 menit b. Enzim pepsin menggunakan metode Worthington (1993)
1. Pipet sebanyak 500µL 2% haemoglobin dalam HCl 0.06 N (sebagai substrat) kedalam tabung reaksi
2. Tambahkan ekstrak enzim atau sampel yang sudah dipreparasi diatas sebanyak 100µL
3. Diinkubasi pada suhu 37˚C selama 10 menit
4. Tambahkan 1mL TCA 5%, divortex dan dibiarkan selama 5 menit
5. Disentrifuge selama 5 menit dengan kecepatan 12.000 rpm, lalu diukur
absorbansinya dengan spektrofotometer pada 280 nm.
6. Dilakukan uji blanko
c. Enzim kimotripsin menggunakan metode Erlanger (1961)
Buat larutan SAPNA 0.1 mM (Succinyl-(Ala)2-Prophe-ρ-nitroanilide) (C30H36N6O9, BM= 624,7). Timbang SAPNA 6.247 mg, lalu dilarutkan dengan Tris HCl 50 mM yang mengandung CaCl2.2H2O 20 mM, sampai volume 100mL dengan pH 8,5.
1. Pipet 0.59mL larutan SAPNA kedalam tabung reaksi lalu ditambahkan 10µL contoh
2. Inkubasi pada suhu 25˚C selama 10 menit.
3. Ukur absorbansi contoh pada spektrofotometer dengan 410 nm, pengukuran dilakukan selama 5 menit, dicatat setiap menitnya data absorbansi contohnya.
d. Enzim tripsin menggunakan metode Erlanger (1961)
Buat larutan BAPNA (Benzoyl-DL-arginin-ρ-nitroanilide). Timbang BAPNA 43,5 mg + 1 mL Dimethyl Sulfoxide (DMSO), kemudian dilarutkan dengan Tris HCl 0.05M yang mengandung CaCl2.2H2O 0.02M sampai volume 100 mL.
1. Pipet 25µL contoh kedalam tabung reaksi, kemudian ditambah larutan BAPNA sebanyak 1.25mL.
2. Kemudian diinkubasi pada suhu 37˚C selama 10 menit.
3. Tambah larutan asam asetat 30% sebanyak 0.5mL, lalu diinkubasi lagi
selama 10 menit pada suhu 37˚C.
17
e. Enzim lipase menggunakan metode Borlongan (1990)
1. Dipipet 1.5 mL substrat lipase murni (minyak zaitun murni), dan dimasukkan kedalam erlenmeyer ukuran 100-125 mL.
2. Kemudian ditambahkan 1 mL Tris-HCl 0.1 M pH 8.0 kedalam erlenmeyer tersebut, dan 1 mL contoh.
3. Dihomogenkan lalu diinkubasi pada suhu 37ºC selama 6 jam.
4. Ditambahkan 3 mL etil alkohol 95% (untuk memberhentikan proses hidrolisis), dan dititrasi segera dengan NaOH 0.01 N (dengan menggunakan indikator Thymolphtalein 0.9%).
Perhitungan:
Lipase (Unit/mg protein) = (Volume titrasi contoh - Blanko) x mg Protein
f. Analisis protein terlarut metode Bradfort (1976)
1. Timbang contoh sebanyak ± 0.5 gram, lalu digerus dengan 5 mL larutan Tris HCl 0.05 M (pH 6.5)
2. Sentrifuge dengan kecepatan 10.000 rpm selama 20 menit
3. Supernatant dipipet sebanyak 0.5mL dan dimasukkan kedalam tabung, lalu ditambah 2.5mL larutan Bradford
4. Inkubasi pada suhu 30˚C selama 10 menit
5. Ukur absorbansi contoh dengan spektrofotometer pada 5λ5 nm
Lampiran 8 Prosedur ekstraksi RNA/DNA dan pengukuran konsentrasi RNA/DNA
a. Prosedur Ekstraksi RNA
Sampel larva ditimbang seberat 50 g kemudian ditambahkan Genezol Reagent sebanyak 200 L dan ditumbuk sampai halus.
Genezol Reagent ditambahkan lagi sebanyak 800 L dan divortek, selanjutnya diinkubasi pada suhu ruang selama 5 menit.
Larutan disentrifuse 10 menit pada 12.000rpm
Bagian atas/supernatant yang bening (mengandung RNA) diambil sebanyak 400 L, bagian tengah berisi kotoran dibuang dan bagian bawah berisi DNA&protein digunakan selanjutnya pada ekstraksi DNA.
Supernatan diberi isopropanol 400 L (1:1) kemudian divortek dan diinkubasi selama 10 menit pada suhu ruang.
Larutan disentrifuse 10 menit pada 12.000rpm
Cairan bening dibuang dan sisa pellet ditambahkan 100 L etanol 75%
Larutan disentrifuse 10 menit pada 12.000rpm
Cairan bening dibuang dan tube berisi RNA ditiriskan sampai kering.
b.Prosedur Ekstraksi DNA
400 L endapan dari ekstraksi RNA ditambahkan etanol absolut 400 L (1μ1)
Larutan di vortek dan diinkubasi selama 5 menit
18
Cairan bening dibuang kemudian pellet diberi 1 LUltra Clean Wash Buffer
dan dinkubasi selama 15 menit
Larutan disentrifuse selama 10 menit pada 12.000rpm
Cairan bening dibuang dan pellet dicuci dengan 100 L etanol 75%
Larutan disentrifuse selama 10 menit pada 12.000rpm
Cairan bening dibuang dan tube berisi DNA ditiriskan hingga kering
c. Prosedur Pengukuran konsentrasi RNA/DNA
Larutan DNA diencerkan terlebih dahulu 80 kali dengan IEW (7λ L IEW + 1 L DNA), sedangkan RNA menggunakan DEPC.
Alat Gene Quant dinyalakan (630nm), dan kuvet dikeluarkan dari tempat penyimpanan lalu dibilas dengan akuades.
Kalibrasi dilakukan dengan mengukur absorbansi pelarut (IEW untuk DNA dan DEPC untuk RNA), dengan memasukkan 80 µl pelarut tersebut ke dalam kuvet. Kemudian kuvet dimasukkan ke dalam alat, lalu tekan tombol
“set ref”, hasil pembacaan menunjukkan nilai absorbansi 0.000. Dilanjutkan dengan pengukuran konsentrasi DNA atau RNA.
Kuvet yang digunakan, dibilas terlebih dahulu dengan akudes. Setelah itu RNA atau DNA yang diukur dimasukkan ke dalam kuvet sebanyak 80 µl dan kuvet ditempatkan di dalam alat.
Setelah tombol “sample” ditekan dan konsentrasi larutan sudah terbaca,
19