STABILITAS PROTEIN REKOMBINAN INTERFERON ALFA-2B
MANUSIA PADA Pichia pastoris
SYUBBANUL WATHON
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Stabilitas Protein Rekombinan Interferon Alfa-2b Manusia pada Pichia pastoris adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
SYUBBANUL WATHON. Stabilitas Protein Rekombinan Interferon Alfa-2b Manusia pada Pichia pastoris. Dibimbing oleh SRI BUDIARTI dan RATIH ASMANA NINGRUM.
Protein rekombinan interferon alfa-2b manusia (rhIFNα-2b) merupakan protein terapeutik yang diaplikasikan untuk penanganan hepatitis dan kanker. Pengembangan bentuk sediaan rhIFNα-2b yang stabil tetap menjadi tantangan. Penelitian ini bertujuan untuk mempelajari stabilitas rhIFNα-2b pada tiga parameter, yaitu suhu, pH dan kondisi lama penyimpanan.
Overproduksi rhIFNα-2b dilakukan menggunakan sistem ekspresi Pichia pastoris (P. pastoris) yang ditumbuhkan pada media Buffered Methanol Complex (BMMY) pada suhu 30 °C selama 48 jam dan 2% metanol sebagai induser. MinimateTM tangensial flow filtration system dengan molecular weight cut off (MWCO) 5 kDa digunakan pada proses filtrasi protein. Protein yang telah difiltrasi kemudian dipurifikasi dengan AKTA purifier 10 system menggunakan kolom His-trap. Kuantifikasi protein menggunakan bicinchoninic acid assay menunjukkan bahwa yield rhIFNα-2b hasil purifikasi sebesar 10.92 mg/L (OD600 = 2.3). Karakterisasi bobot molekul menggunakan analisis Sodium Dodecyl Sulphate-Polyacrylamide Gel Electrophoresis (SDS-PAGE) dan Western Blot menunjukkan bahwa protein tersebut merupakan rhIFNα-2b dengan bobot molekul sekitar 24 kDa. Karakterisasi identitas protein berbasis spektrometri massa Matrix Assisted Laser Desorption Ionization-Time Of Flight/ Time Of Flight (MALDI-TOF/ TOF) menginformasikan bahwa protein tersebut teridentifikasi sebagai hIFNα-2b dengan urutan asam amino yang mewakili 22% dari sekuen secara keseluruhan. Analisis SDS-PAGE non reducing dan software Image J menunjukkan bahwa peningkatan suhu, kondisi pH asam dan basa serta kondisi lama penyimpanan telah memacu terjadinya aggregasi dan degradasi rhIFNα-2b. Uji 3-[4.5-dimethyltiazol-2il]-2.5-diphenylltetrazolium bromide (MTT) menunjukkan bahwa aggregasi dan degradasi menurunkan aktivitas antiproliferasi rhIFNα-2b terhadap sel MCF-7.
Kondisi kenaikan suhu, pH asam dan basa serta lama penyimpanan dapat mempengaruhi stabilitas rhIFNα-2b. Kondisi stabil rhIFNα-2b dicapai pada suhu 4 °C, pH 7 selama 2 hari waktu inkubasi. Data tersebut dapat digunakan untuk mengembangkan formulasi rhIFNα-2b sebagai protein terapeutik.
SUMMARY
SYUBBANUL WATHON. Stability of Human Recombinant Interferon Alpha-2b in Pichia pastoris. Supervised by SRI BUDIARTI and RATIH ASMANA NINGRUM.
Recombinant human interferon alpha-βb (rhIFNα-2b) is therapeutic protein used in hepatitis and cancer treatments. The development of stable dosage forms of rhIFNα-2b remains a great challenge. This research was aimed to study the stability of rhIFNα-2b in three parameters: temperature, pH and storage time.
The rhIFNα-2b was overproduced in Pichia pastoris (P. pastoris) by using buffered methanol complex medium (BMMY) at 30 °C for 48 h with 2% of methanol as inducer. MinimateTM tangensial flow filtration system with molecular weight cut off (MWCO) 5 kDa was used on protein filtration. Purification of rhIFNα-2b was performed by immobilized affinity chromatography column using AKTA purifier system. Colorimetric bicinchoninic acid assay informed that the yield of purified rhIFNα-2b was 10.92 mg/L (OD600 = 2.3). Sodium dodecyl sulphate-polyacrylamide gel electrophoresis (SDS-PAGE) and Western Blot analysis confirmed that the protein was rhIFNα-2b with 24 kDa in size. Matrix assisted laser desorption ionization-time of flight/ time of flight (MALDI-TOF/TOF) mass spectrometry identified the protein as hIFNα-2b with 22% of amino acid coverage. Non reducing SDS-PAGE and Image J software analysis showed that temperature increment, acidic and basic pH, as well as storage time length had caused aggregation and degradation. 3-[4.5-dimethylthiazol-2il]-2.5-diphenyltetrazolium bromide (MTT) assay informed that the aggregation and degradation reduced the antiproliferative activity of rhIFNα-2b on human breast cancer MCF-7 cell line.
Temperature increment, acidic and basic pH as well as storage time prolongation affect rhIFNα-2b stability. The highest stability of rhIFNα-2b can be achieved at 4 °C and pH 7 for two days. These data can be used to develop rhIFNα-2b formulations as therapeutic protein.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
STABILITAS PROTEIN REKOMBINAN INTERFERON ALFA-2B
MANUSIA PADA Pichia pastoris
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Stabilitas Protein Rekombinan Interferon Alfa-2b Manusia pada Pichia pastoris
Nama : Syubbanul Wathon NIM : P051130131
Disetujui oleh Komisi Pembimbing
Dr dr Sri Budiarti Ketua
Dr Ratih Asmana Ningrum Anggota
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof Dr Ir Suharsono, DEA
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 19 Agustus 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan penelitian dengan judul Stabilitas Protein Rekombinan Interferon Alfa-2b Manusia pada Pichia pastoris. Peran serta yang sangat besar telah diberikan oleh berbagai pihak kepada penulis dalam menyelesaikan penulisan tesis ini.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan terima kasih dan rasa hormat kepada Ibu Dr dr Sri Budiarti dan Ibu Dr Ratih Asmana Ningrum sebagai komisi pembimbing yang telah banyak memberi ide, saran dan nasehatnya pada penulis sejak awal hingga akhir penyusunan tesis ini. Ucapan terima kasih juga penulis disampaikan kepada ayahanda, ibunda, saudara beserta seluruh keluarga besar, atas segala doa, kasih sayang dan motivasinya.
Penulis memberikan penghargaan kepada segenap staf pengajar, karyawan dan rekan-rekan seperjuangan angkatan 2013 di program studi Bioteknologi Pascasarjana Institut Pertanian Bogor yang telah berbagi ilmu dan nasehat kepada penulis selama menjalankan studi. Penulis juga mengucapkan terima kasih kepada seluruh staf peneliti di Laboratorium Protein Terapeutik dan Vaksin, Pusat Penelitian Bioteknologi LIPI Cibinong Bogor yang telah membantu selama penelitian berlangsung.
Penulis mengharapkan masukan yang sifatnya membangun demi kesempurnaan tesis ini sehingga dapat bermanfaat bagi semua pihak.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 2
Protein Terapeutik 2
Produksi Protein Rekombinan pada Pichia pastoris 3
Interferon 4
Aktifitas Anti Virus 5
Aktifitas Imunomodulator 6
Aktifitas Anti Proliferasi 6
Stabilitas Protein Terapeutik dan Faktor yang Mempengaruhi 9
3 METODE 10
Waktu dan Tempat Penelitian 10
Prosedur Kerja 10
Overproduksi rhIFNα-2b pada P. pastoris 10 Filtrasi, Purifikasi dan Kuantifikasi rhIFN-αβb 11
Karakterisasi rhIFN-αβb 11
Uji Stabilitas rhIFN-αβb 11
Uji Aktifitas Anti Proliferasi rhIFNα-2b pada Sel MCF-7 11
Analisis Statistik 12
4 HASIL DAN PEMBAHASAN 12
Overproduksi rhIFNα-2b pada P. pastoris 12
Filtrasi, Purifikasi dan Kuantifikasi rhIFN-αβb 14
Karakterisasi rhIFN-αβb 15
Uji Stabilitas rhIFN-αβb 16
Uji Aktifitas Anti Proliferasi rhIFNα-2b pada Sel MCF-7 19
5 SIMPULAN DAN SARAN 21
Simpulan 21
Saran 21
DAFTAR PUSTAKA 21
LAMPIRAN 27
DAFTAR GAMBAR
1 Penghantaran sinyal hIFN-α melalui jalur JAK-STAT 7
2 Mekanisme molekuler hIFN-α sebagai anti kanker 7
3 Model struktur molekuler protein hIFNα-2b 8
4 Visualisasi dari SDS-PAGE supernatan bebas sel, SDS-PAGE supernatan hasil filtrasi dan purifikasi, Western Blot supernatan hasil
filtrasi dan purifikasi 15
5 Hasil penentuan sekuen asam amino rhIFNα-2b menggunakan analisis
MALDI-TOF/ TOF spektrometri massa 16
6 Profil rhIFNα-2b pada kondisi peningkatan temperatur dan variasi pH 17 7 Analisis luas area pita utama rhIFNα-2b menggunakan software Image
J pada kondisi peningkatan temperatur dan variasi pH 18 8 Profil rhIFNα-2b pada kondisi sampling hari ke-2 dan sampling hari
ke-20 19
9 Analisis luas area pita utama rhIFNα-2b menggunakan software Image J pada kondisi sampling hari ke-2 dan sampling hari ke-20 19 10 Persentase penghambatan rhIFNα-2b terhadap sel MCF-7 pada
pengujian peningkatan temperatur, variasi pH dan kondisi lama
penyimpanan 20
DAFTAR LAMPIRAN
1 Media 27
2 Larutan 28
3 Komposisi Gel Poliakrilamid 29
4 Kurva Standar BSA 29
5 Isolat P. pastoris X-33 Rekombinan 30
6 Kromatogram Purifikasi rhIFNα-2b 30
7 Kultur Sel MCF-7 31
8 Analisis ragam pengaruh kondisi peningkatan temperatur, variasi pH dan lama penyimpanan pada persentase penghambatan rhIFNα-2b
1
PENDAHULUAN
Latar Belakang
Interferon (IFN) merupakan sitokin yang disekresikan oleh sel eukariot sebagai respon adanya infeksi virus, bakteri, protozoa atau senyawa lainnya. IFN dapat dibedakan menjadi tiga jenis berdasarkan sel yang menghasilkannya, yaitu IFN α (dihasilkan oleh sel leukosit), IFN (dihasilkan oleh sel fibroblast) dan IFN (dihasilkan oleh sel limfosit T helper) (Kontsek & Konssekova 1997). Human interferon alfa (hIFN-α) merupakan famili protein yang memiliki aktifitas biologis yang cukup luas yaitu sebagai anti kanker, anti virus dan imunomodulator (Cherbi-Alix & Wietzerbin 2007). Hifnα-2 terdiri atas tiga subtipe, yaitu hifnα-2a, hIFNα-2b dan hifnα-2c (Ceaglio et al. 2010). hIFNα-2b menjadi alel dominan dibandingkan dengan subtipe yang lain (Lee et al. 1995). hIFNα-2b merupakan protein yang tersusun atas 188 asam amino (23 asam amino merupakan signal peptide dan 165 asam amino adalah mature protein) dan mengalami O-glikosilasi pada asam amino treonin di posisi ke-106 (Ningrum et al. 2013).
Tubuh manusia secara alami dapat menghasilkan IFN, namun terkadang jumlahnya tidak mencukupi untuk melawan agen penyakit yang berkembang cepat di dalam tubuh. Pada kondisi tersebut manusia memerlukan penambahan IFN dari luar tubuh. Kebutuhan IFN dari luar tubuh dapat dipenuhi melalui produksi protein rekombinan IFN (Gow & Mutimer 2001; Dingermann 2008). Produksi beberapa jenis protein rekombinan IFN terus dilakukan, salah satunya adalah protein rekombinan IFNα-2b manusia (rhIFNα-2b). Protein tersebut telah direkomendasikan oleh United States Food and Drug Administration (US FDA) pada tahun 1986 sebagai protein terapeutik untuk penanganan hepatitis dan beberapa kanker seperti multiple myeloma, chronic myeloid leukemia, renal cell carcinoma, epidermoid cervical cancer, melanoma dan medullary thyroid carcinoma (Tagliaferri et al. 2005).
Produksi rhIFNα-2b dapat menggunakan beberapa macam sistem ekspresi, diantaranya adalah sistem ekspresi sel tembakau BY2 (Xu et al. 2007), Escherichia coli (E. coli) (Srivastava et al. 2005), Saccharomyces cerevisiae (S. cerevisiae) (Tuite et al. 1982), Streptomyces lividans (S. lividans) (Pimienta et al. 2002), sel telur unggas (Rapp et al. 2003; Patel et al. 2007), P. pastoris (Shi et al. 2007; Li et al. 2007; Ghosalkar et al. 2008), dan sel mamalia (Rossmann et al. 1996; Loigon et al. 2008). Setiap sistem ekspresi tersebut memiliki kelebihan dan keterbatasan. Penelitian terdahulu yang dilakukan Ningrum et al. (2013) telah berhasil mengkonstruksi kerangka baca terbuka gen pengkode hIFNα-2b dan memproduksi rhIFNα-2b dengan menggunakan sistem ekspresi P. pastoris. Bobot molekul rhIFNα-2b tersebut 24 kDa dan terdapat polyhistidine tag pada ujung C-terminalnya. Uji aktivitas biologis menunjukkan bahwa rhIFNα-2b tersebut memiliki aktivitas dalam menghambat proliferasi sel kanker payudara manusia MCF-7 (Ningrum et al. 2015).
2
memanipulasi pada tingkat molekuler, tingkat sekresi dan ekspresi protein rekombinan yang sangat tinggi, kemudahan teknik transformasi dan seleksi sel transforman, biaya produksi lebih murah dibandingkan sistem ekspresi sel eukariot lainnya. P. pastoris dapat tumbuh pada media sederhana hingga mencapai kerapatan sel yang tinggi. P. pastoris juga mampu melakukan modifikasi pasca translasi, misalnya proses glikosilasi dan pelipatan protein yang sangat menentukan aktifitas biologis suatu protein terapeutik (Cregg et al. 2000; Balamurugan et al. 2007).
Usaha produksi protein terapeutik pada umumnya masih mengalami permasalahan pada tahap stabilisasi protein. Salmannejad et al. (2014) menyatakan bahwa rhIFNα-2b memiliki kestabilan yang rendah terhadap degradasi fisik dan kimia. Ketidakstabilan rhIFNα-2b dapat terjadi selama proses preparasi, formulasi dan penyimpanan (Diress et al. 2010). Ketidakstabilan protein terapeutik dapat menurunkan aktifitas biologis, efek imunogenik dan perubahan dosis selama terapi (Ruiz et al. 2006). Stabilitas protein terapeutik sangat penting diketahui untuk meningkatkan aktifitas, kelayakan dan keefektifan suatu protein terapeutik hingga pada tahap komersialisasi.
Tujuan Penelitian
Penelitian ini bertujuan mempelajari stabilitas rhIFNα-2b pada beberapa perlakuan, meliputi kenaikan suhu, variasi pH dan kondisi lama penyimpanan.
Manfaat Penelitian
Penelitian ini bermanfaat dalam menyediakan informasi mengenai stabilitas rhIFNα-2b yang diproduksi pada P. pastoris. Data mengenai stabilitas protein sangat diperlukan untuk menentukan kondisi preparasi, formulasi dan penyimpanan yang tepat agar aktivitas dan keefektifan protein terapeutik dapat mencapai kondisi yang optimal.
2
TINJAUAN PUSTAKA
Protein Terapeutik
3 Protein terapeutik memiliki beberapa keunggulan dibandingkan obat dengan ukuran molekul yang lebih kecil. Protein terapeutik pada umumnya memiliki spesifitas tinggi dan fungsi kompleks yang tidak bisa ditiru dengan senyawa kimia sederhana. Reaksi protein terapeutik bersifat sangat spesifik dan jarang mengganggu proses biologis yang normal sehingga tidak menimbulkan efek samping. Tubuh manusia umumnya memberikan toleransi yang baik terhadap protein terapeutik dibandingkan dengan senyawa kimia. Protein terapeutik dapat menjadi pengganti pada penanganan penyakit yang disebabkan karena suatu mutasi tanpa harus melakukan terapi gen. Terapi gen saat ini masih belum tersedia pada sebagian besar penyakit yang disebabkan oleh gangguan genetik. Protein terapeutik bersifat unik dalam hal bentuk dan fungsinya. Perusahaan biofarmasetika dapat memperoleh perlindungan hak paten untuk pengembangan dan produksi suatu protein terapeutik (Leader et al. 2008).
Beberapa jenis protein terapeutik diproduksi secara konvensional melalui proses pemurnian dari sumber alaminya (native), misalnya enzim pankreas yang diperoleh dari pankreas babi (Brown et al. 1997) dan α-1-proteinase inhibitor yang dikumpulkan dari plasma darah manusia (Dirksen 1999). Saat ini sistem produksi protein terapeutik telah berkembang melalui teknik rekayasa genetika dan teknologi DNA rekombinan dengan menggunakan sistem ekspresi bakteri, yeast, sel serangga, sel mamalia, hewan dan tumbuhan transgenik (Brannigan & Wilkinson 2002). Pemilihan sistem ekspresi umumnya berdasarkan pertimbangan biaya produksi dan modifikasi protein (misalnya glikosilasi, fosforilasi, dan pelipatan protein) yang dibutuhkan untuk aktivitas biologis protein terapeutik (Leader et al. 2008).
Produksi protein rekombinan memiliki beberapa keuntungan dibandingkan produksi protein non rekombinan. Proses transkripsi dan translasi suatu gen manusia menyebabkan aktivitas spesifik yang lebih tinggi dan dapat menurunkan penolakan imunologis. Produksi protein rekombinan lebih efisien dan dapat dilakukan dalam skala produksi yang lebih besar dibandingkan protein non rekombinan. Produksi protein rekombinan dapat menurunkan resiko penularan penyakit pada hewan atau manusia. Produksi protein rekombinan dapat memungkinkan untuk melakukan modifikasi protein dan pemilihan varian gen tertentu untuk meningkatkan fungsi atau spesifitas protein (Leader et al. 2008). Lembaga US FDAtelah merekomendasi lebih dari 130 protein atau peptida untuk digunakan dalam kepentingan klinis dan 95 protein diantaranya diproduksi menggunakan teknologi DNA rekombinan. Peningkatan teknologi produksi dan pemahaman ilmu biofarmasetika akan mengikuti perkembangan produksi protein terapeutik sebagai langkah penting dalam penanganan berbagai macam penyakit, misalnya penanganan penyakit diabetes (insulin), stadium akhir penyakit ginjal (eritropoetin), gangguan pembekuan darah (faktor VII, VIII, IX), hepatitis dan beberapa jenis kanker (interferon) (Dingermann 2008).
Produksi Protein Rekombinan pada P. pastoris
4
kemudahan dalam hal manipulasi pada tingkat molekuler, modifikasi pasca translasi, pelipatan protein, dan sekresi protein secara ekstraseluler (Cereghino & Cregg 2000). Proses produksi yang mudah, peralatan produksi yang relatif murah dan kemudahan dalam proses scale up membuat sistem ekspresi P. pastoris lebih diminati untuk memproduksi protein rekombinan, termasuk untuk memproduksi protein terapeutik (Balamurugan et al. 2007). Proses scale up sistem ekspresi P. pastoris dapat lebih besar dibandingkan sistem ekspresi E. coli (Vozza et al. 1996). Sistem ekspresi P. pastoris pada kasus tertentu dapat mengekspresikan protein rekombinan lebih tinggi dibandingkan sistem ekspresi yeast konvensional, yaitu S. cereviceae (Fickers 2014).
Kesuksesan sistem ekspresi P. pastoris untuk memproduksi protein rekombinan karena beberapa faktor, salah satunya adalah adanya promoter alcohol oxidase 1 (aox1). Promoter aox1 merupakan promoter kuat, mudah diregulasi dan dapat mengintegrasikan vektor ekspresi pada genom P. pastoris dengan satu atau beberapa situs tertentu (Li et al. 2007). Promoter aox1 mengontrol ekspresi 30% dari keseluruhan protein solubel yang dihasilkan P. pastoris, sehingga promoter tersebut umumnya digunakan untuk menjalankan dan mengatur ekspresi suatu protein rekombinan (Cregg et al. 2000). Transformasi pada P. pastoris dapat dilakukan dengan mudah melalui metode elektroporasi atau metode speroplasting (Balamurugan et al. 2007).
Ekspresi protein rekombinan pada P. pastoris dapat terjadi secara intraseluler maupun ekstraseluler. Sekresi protein rekombinan keluar sel memerlukan sinyal sekuen untuk mengarahkan protein pada jalur sekretori. Beberapa sinyal sekuen telah dicoba pada sistem ekspresi P. pastoris, termasuk native sinyal sekuennya. Sinyal sekuen yang paling efektif digunakan yaitu faktor α-prepo yang berasal dari S. cereviceae (Ghosalkar et al. 2008). P. pastoris mensekresikan native protein lebih rendah dibandingkan dengan protein rekombinan sehingga kondisi tersebut dapat mempermudah purifikasi protein (Balamurugan et al. 2007).
Sistem ekspresi P. pastoris memiliki keuntungan dalam proses glikosilasi protein, khususnya pada protein rekombinan yang diaplikasikan sebagai protein terapeutik. Proses glikosilasi yang terjadi pada P. pastoris bukan termasuk tipe hiperglikosilasi. Hiperglikosilasi dapat memacu respon imun yang berlebihan, hal ini dapat menimbulkan efek negatif dalam tubuh manusia (Macauley-Patrick et al 2005). Glikosilasi pada sistem ekspresi P. pastoris umumnya merupakan gabungan 8 sampai 14 residu manosa pada tiap rantai peptida dan lebih pendek dibandingkan dengan glikosilasi pada S. cereviceae, yaitu 50-150 residu manosa (Balamurugan et al. 2007). P. pastoris juga dilaporkan telah sukses memproduksi protein rekombinan dengan pola ikatan disulfida tertentu (Cregg et al. 2000). Aktifitas biologis pada beberapa protein rekombinan sangat ditentukan dari formasi ikatan disulfidanya (Diress et al. 2010).
Interferon
5 yang serupa ketika melakukan pengamatan pada sel ayam yang diinkubasi dengan virus influenza. Hasil pengamatannya menunjukkan adanya suatu faktor yang dapat melindungi sel dari infeksi virus. Fenomena ini dinamakan fenomena interferensi dan substansi aktif yang dihasilkan kemudian dinamakan interferon (Chelbi-Alix & Wiedzerbin 2007).
Pada dasarnya IFN merupakan kelompok protein dari famili sitokin yang disekresikan oleh sel vertebrata karena adanya rangsangan yang berasal dari virus, bakteri, protozoa dan senyawa lainnya (Ningrum et al. 2013). IFN dapat dibedakan menjadi 3 kelompok berdasarkan jenis sel yang menghasilkannya. Kelompok yang pertama yaitu IFN-α dihasilkan oleh sel leukosit. Kelompok kedua yaitu IFN- yang dihasilkan oleh fibroblast dan dapat bekerja pada hampir semua sel di dalam tubuh manusia. Kelompok ketiga yaitu IFN- yang dihasilkan oleh limfosit sel T helper dan hanya bekerja pada sel-sel tertentu seperti: makrofag, sel endotelial, fibroblast, sel T sitotoksik dan sel limfosit B (Konstek & Konssekova 2002).
IFN bertindak sebagai messenger intraseluler yang memicu terjadinya aktifitas biologi setelah berikatan dengan reseptor sel target (Barr et al. 2008). IFN akan berikatan dengan reseptor spesifik pada membran sel target. Berdasarkan lokasi reseptor di permukaan sel, IFN dibagi menjadi dua tipe. IFN tipe 1 terdiri atas IFN α, , ω dan τ. IFN tipe β hanya terdiri atas IFN (Takaoka & Yanai 2006). IFN tipe 1 adalah keluarga sitokin yang khusus untuk mengkoordinasikan kekebalan terhadap virus dan infeksi intraseluler. Identifikasi reseptor dan jalur sinyal deteksi patogen untuk menginduksi IFN tipe 1 telah banyak dilakukan (Stetson & Metzitov 2006). Reseptor yang dikenali oleh IFN tipe 1 dibedakan menjadi dua subunit, yaitu IFNAR-1 dan IFNAR-2 (Honda et al. 2005).
IFN memiliki aktivitas anti virus dan anti kanker yang berpengaruh pada metabolisme dan diferensiasi sel serta dapat memodulasi sistem imun (Jonash & Haluska 2001). Kompleksitas fungsi IFN pada sistem imun tubuh manusia dapat melalui jalur pengaktifan fungsi khusus suatu sel yang meliputi diferensiasi, pertumbuhan, pengekspresian antigen permukaan dan imunoregulasi sel (Meager 2006). Peran IFN selanjutnya dalam sistem imun tubuh manusia dapat melalui beberapa mekanisme sebagai berikut:
Aktivitas Anti Virus
6
pada reseptor spesifik yang terletak di permukaan sel yang tidak terinfeksi. Ikatan tersebut mengaktifkan 2 macam enzim, yaitu: protein kinase yang membantu fosforilasi dua macam protein alfa 1 dan alfa 2. Kedua protein tersebut yang menghambat sintesis protein virus. Enzim kedua adalah β’,5’oligoadenylate (β’, 5’ A)sintetase yang membentuk oligonukleotida rantai pendek. Oligonukleotida ini selanjutnya merangsang enzim yang dapat mendegradasi materi genetik virus, misalnya ribonuklease yang menyebabkan degradasi RNA virus (Sangfelt et al. 2000).
Aktivitas Imunomodulator
IFN terlibat dalam sistem imun tubuh melalui beberapa mekanisme, yaitu: 1). meningkatkan fagositosis makrofag dan daya sitotoksik sel Natural Killer (NK). 2). meningkatkan ekspresi Human Leukocyte Antigen (HLA) pada permukaan sel yang terinfeksi oleh virus, sehingga memungkinkan sel limfosit T sitotoksik dan sel NK lebih mudah mengenali dan menghancurkan sel yang terinfeksi. HLA merupakan istilah yang digunakan bagi Major Histocompatibility Complex (MHC) pada manusia. 3). terlibat dalam lymphokine cascade dan produksi interleukin 1 dan 2 (Highleyman 2007).
Aktivitas Anti Proliferasi
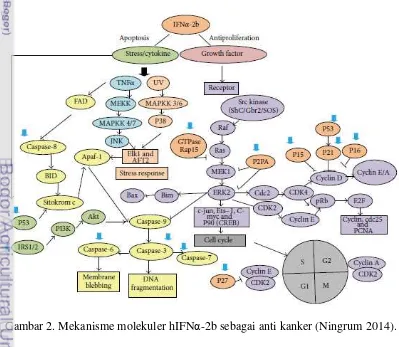
Aktivitas antiproliferasi IFN terjadi secara langsung dan tidak langsung. Aktivitas anti proliferasi secara langsung terjadi melalui penghambatan pertumbuhan sel kanker dengan cara cell cycle arrest, apoptosis atau diferensiasi. Aktivitas antiproliferasi secara tidak langsung terjadi melalui aktivasi sel-sel imun, misalnya sel T, sel NK, inhibisi vaskularisasi (antiangiogenesis) dan induksi sitokin. Aktivitas antiproliferasi adalah hasil dari regulasi ekspresi gen yang dimulai dengan jalur transduksi sinyal dan aktivasi transkripsi JAK-STAT (Barr et al. 2008). Jalur JAK-STAT diawali dengan pengikatan IFN pada reseptor di permukaan sel. JAK merupakan enzim tirosin kinase dan mengaktifkan STAT yang merupakan enzim tirosin fosforilasi. Famili STAT terdiri atas tujuh protein, yaitu STAT-1, STAT-2, STAT-3, STAT-4, STAT-5a, STAT-5b dan STAT-6. Sedangkan famili JAK terdiri atas empat protein, yaitu JAK-1, JAK-2, JAK-3 dan tirosin kinase-2 (TYK-2). JAK-1 dan TYK-2 diaktivasi oleh IFN-α yang menyebabkan reaksi fosforilasi dan dimerisasi. STAT-1 (P91) dan STAT-2 (P113) ditranslokasikan oleh Interferon Regulating Factor-9 (IRF-9) ke dalam inti sel (Gambar 1). Protein kompleks yang diketahui sebagai Interferon Stimulated Gene Factor-3 (ISGE-3) dapat mengaktifkan Interferon Stimulating Respone Element (ISRE). Fosforilasi 2 subunit STAT-1 membentuk faktor aktivasi-α yang akan berikatan dengan Gamma Activator Sequence (GAS). Kondisi ini akan menginduksi ratusan Interferon Stimulating Genes (ISG) yang berperan dalam mekanisme antiproliferasi (Samuel2001; Gao et al. 2004; Ningrum2014).
7 juga menginduksi Tumor Necrosis Factor-α (TNF-α) dan melepaskan sitokrom c dari mitokondria (Gambar 2). Jalur tersebut mengaktifkan sinyal caspase-cascade yang menyebabkan fragmentasi DNA dan kematian sel (Steelman et al. 2004; Ningrum2014).
Gambar 1. Penghantaran sinyal hIFNα-2b melalui jalur JAK-STAT (Ningrum 2014).
8
Gen ifn dari beberapa spesies (tikus, sapi dan manusia) telah dikloning namun hanya gen ifn dari manusia (hifn) yang telah banyak diketahui. Pada genom manusia terdapat 13 gen hifn-α dan 6 pseudogen dengan homologi sekuen nukleotidanya berkisar antara 85-95% (Lawn et al. 1981). Gen hifn-α berkelompok pada kromosom manusia nomor 9 dan tidak mengandung sekuen intron. Lokus gen hifn-αβ terdiri atas tiga allelik, yaitu hifn-αβa, hIFNα-2b dan hifn-αβc. Hasil dari ekspresi gen hifn-α adalah suatu polipeptida yang tersusun atas 166 asam amino (kecuali IFN-αβ, mempunyai 165 asam amino karena mengalami delesi pada posisi asam amino 44) dan 23 asam amino peptida signal yang bersifat hidrofobik (Ceaglio et al. 2010).
Protein IFN-α merupakan bentuk monomer dan termasuk kelompok IFN tipe 1. Protein tersebut mempunyai berat molekul antara 19-26 kDa. Kelompok protein IFN-α merupakan kelas yang paling dominan dari IFN lain yang dihasilkan oleh leukosit darah yang terstimulasi. Pada umumnya IFN-α tidak memiliki rantai samping karbohidrat, namun ada beberapa kelompok yang merupakan golongan glikoprotein dengan derajat glikosilasi berbeda. hIFN-αβ merupakan salah satu contoh glikoprotein yang memiliki glikosilasi O pada asam amino treonin posisi ke-106 (Gunther et al. 1991; Ningrum 2014).
Gambar 3. Model struktur molekuler protein hIFNα-2b (Wang et al. 2002).
9 Stabilitas Protein Terapeutik dan Faktor yang Mempengaruhi
Protein merupakan makromolekul penyusun tubuh terbesar kedua setelah air. Fakta ini menunjukkan bahwa protein merupakan molekul penting yang menompang seluruh proses kehidupan dalam tubuh (Witarto 2001). Sifat-sifat penting protein dalam kehidupan telah mendorong aplikasi protein dalam berbagai sektor seperti industri, lingkungan, dunia kedokteran dan farmasi. Eksplorasi protein dalam dunia kedokteran dan farmasi salah satunya berkenaan dengan produksi berbagai jenis protein terapeutik (Morrow 2010). Namun dalam pengembangan protein terapeutik masih menghadapi beberapa kendala, diantaranya adalah kualitas protein yang tersedia secara alami cukup rendah serta karakter yang dimiliki protein hanya bertahan pada kondisi normal (Wang 1999). Keadaan tersebut mendorong upaya untuk meningkatkan sifat protein sesuai dengan kebutuhan. Salah satu sifat protein yang paling banyak mendapat perhatian adalah stabilitas protein. Studi mengenai stabilitas protein terapeutik umumnya diutamakan pada fenomena ketidakstabilan fisik dan kimia (Chi et al. 2003).
Ketidakstabilan fisik umumnya meliputi reaksi denaturasi, aggregasi, presipitasi, dan tegangan permukaan. Fenomena denaturasi ditandai dengan berubahnya stuktur globular atau struktur tiga dimensi suatu protein. Struktur globular umumnya merupakan struktur native protein. Denaturasi dapat merubah bentuk fisik protein, tetapi komposisi kimianya tetap sama. Denaturasi dapat melibatkan perubahan struktur sekunder dan tersier protein (atau keduanya). Denaturasi dapat terjadi karena pemanasan protein pada suhu yang tinggi dan umumnya bersifat irreversible. Fenomena aggregasi dapat terjadi karena adanya perubahan pelipatan protein selama proses preparasi, formulasi, freeze-thawing, transportasi dan penyimpanan. Perubahan pelipatan protein dapat memungkinkan gugus hidrofobik protein terbuka dan dapat berinteraksi dengan lingkungan sekitar. Gugus hidrofobik yang terbuka dapat berinteraksi dengan gugus hidrofobik protein lain atau sesamanya (Diress et al. 2010). Faktor lingkungan yang dapat memacu terjadinya aggregasi meliputi proses dehidrasi, perubahan kondisi pH lingkungan, perubahan atau kenaikan suhu lingkungan serta penyimpanan protein dalam jangka panjang. Presipitasi atau pembentukan endapan protein merupakan salah satu faktor penyebab ketidakstabilan fisik protein. Presipitasi dapat terjadi karena protein dalam keadaan unfolded sehingga tidak mudah larut. Kondisi tersebut menyebabkan protein cenderung membentuk endapan dan umumnya bersifat irreversible. Tegangan permukan protein juga berpengaruh pada kestabilan fisik protein. Ketika protein dalam kondisi unfolded, maka tegangan permukaan protein semakin besar. Kondisi tersebut semakin memacu terbentuknya aggregat-aggregat protein (Manning et al. 2010).
10
reaksi hidrolisis atau dikenal sebagai reaksi deaminasi hidrolitik. Reaksi oksidasi juga merupakan penyebab ketidakstabilan kimia suatu protein. Beberapa protein yang tersusun atas asam amino histidin, metionin, sistein, tirosin dan triptofan dapat mengalami kerusakan karena bereaksi dengan reactive oxygen species (ROS) (Davies 2005). Reaksi oksidasi pada gugus reaktif protein dapat terjadi selama proses produksi protein, purifikasi, formulasi dan penyimpanan (Bertolotti-Chiarlet et al 2009). Asam amino sistein berperan signifikan pada proses terjadinya aggregat protein melalui pembentukan ikatan kovalen. Degradasi sistein berpengaruh pada perubahan konformasi protein, terutama ketika pembentukan atau perubahan ikatan disulfida protein. Isomerisasi asam amino juga merupakan faktor penyebab ketidakstabilan kimia suatu protein. Perubahan suatu asam amino menjadi bentuk isomernya dapat menyebabkan ketidakstabilan protein. Beberapa isomer asam amino cenderung tidak stabil dan mudah mengalami hidrolisis. Protein dapat membentuk dimer atau polimer melalui ikatan non disulfida. Pembentukan ikatan non disulfida tersebut terjadi melalui proses transaminasi dan sangat dipengaruhi kondisi pH lingkungan. Pembentukan ikatan non disufida secara signifikan dapat memacu terjadinya aggregasi protein (Wang 1999).
3
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada Oktober 2014 hingga April 2015 yang bertempat di laboraturium Protein Terapeutik dan Vaksin Pusat Penelitian Bioteknologi Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong Science Center (CSC).
Prosedur Kerja
Overproduksi rhIFNα-2b pada Sel P. pastoris
11 selama 5 menit pada suhu ruang. Supernatan ditambahkan dengan 1 mM Phenyl Methyl Sulfonyl Fluoride (PMSF)(Sigma, USA) lalu disimpan pada suhu -20 °C. Filtrasi, Purifikasi dan Kuantifikasi rhIFN-α2b
MinimateTM tangensial flow filtration system (Pall, USA) dengan Molecular Weight Cut Off (MWCO) 5 kDa digunakan pada proses filtrasi protein. Supernatan dipekatkan dari volume 100 mL menjadi 10 mL. Fraksi yang telah dipekatkan kemudian dipurifikasi dengan AKTA purifier 10 system (GE Healthcare, Swedia) menggunakan kolom His-trap. Larutan yang mengandung 20 mM sodium fosfat, 20 mM imidazol dan 500 mM sodium klorida digunakan sebagai binding buffer sedangkan 20 mM sodium fosfat, 500 mM imidazol dan 500 mM sodium klorida digunakan sebagai elution buffer (Merck, Jerman). Protein hasil purifikasi dihitung konsentrasinya menggunakan bicinchoninic acid assay (BCAprotein assay kit) (Pierce, USA) dengan berbagai konsentrasi bovin serum albumin (25-2000 µg/ml) sebagai standar. Absorbansi sampel protein diukur pada panjang gelombang 562 nm.
Karakterisasi rhIFN-α2b
Gel poliakrilamid (Bio-Rad, USA) yang tersusun atas separating gel (12%) dan stacking gel (4%) digunakan pada analisis SDS-PAGE. Coomassie brilliant blue (Bio-Rad, USA) digunakan sebagai pewarna gel poliakrilamid. Antibodi primer (anti interferon-α mouse mAb) (Calbiochem, USA) dengan nisbah 1:100, antibodi sekunder (anti-mouse IgG alkaline phosphatase conjugate) (Promega, USA) dengan nisbah 1:7500 dan reagen nitro blue tetrazolium-( 5-bromo-4-chloro-3-indolyl-phosphate) (NBT-BCIP) (Invitrogen, USA) digunakan pada analisis Western Blot. Karakterisasi identitas protein dilakukan melalui penentuan urutan asam amino berbasis analisis spektrometri massa MALDI-TOF/ TOF (Proteomic International, Australia).
Uji Stabilitas rhIFN-α2b
Uji stabilitas protein dilakukan pada 3 parameter, yaitu kenaikan suhu, variasi pH dan kondisi lama penyimpanan. Stok rhIFNα-2b tanpa perlakuan digunakan sebagai kontrol. Pengujian kenaikan suhu dilakukan melalui proses inkubasi sampel protein selama 3 hari pada suhu 30 °C, 40 °C, 50 °C, 60 °C dan 70 °C. Pengujian variasi pH dilakukan melalui proses inkubasi sampel protein selama 3 hari dalam 50 mM dapar fosfat (Merck, Jerman) pada pH 4, 5, 6, 7 dan 8. Pengujian kondisi lama penyimpanan dilakukan melalui proses inkubasi sampel protein dalam dapar fosfat (pH 7) (Merck, Jerman) pada suhu 4 °C, 25 °C, dan 37 °C selama 20 hari dengan titik sampling setiap 2 hari. Fraksi-fraksi protein hasil pengujian stabilitas diamati profil protein menggunakan analisis SDS-PAGE non reducing serta aktifitas anti proliferasinya menggunakan uji MTT. Stabilitas profil protein juga ditentukan berdasarkan luas area pita utama rhIFNα-2b menggunakan software Image J.
Uji Aktifitas Anti Proliferasi rhIFNα-2b pada Sel MCF-7
12
dengan 100 µL Phosphate Buffer Saline (PBS) (Merck, Jerman). Media komplit 100 µL (95% Dulbecco’s Modified Eagle Medium [DMEM] [Gibco, USA], 5% Fetal Bovine Serum [FBS] [Gibco, USA] dan 1% penisilin/streptomisin [Sigma, USA]) yang mengandung 1 µM tamoxifen (Merck, Jerman) ditambahkan pada tiap sumuran kecuali blanko dan kontrol negatif. Kultur kemudian diinkubasi selama semalam. Kultur selanjutnya dicuci dengan 100 µL PBS. Media komplit 100 µL yang mengandung fraksi rhIFNα-2b (4 µg/mL) hasil pengujian stabilitas ditambahkan pada sumuran perlakuan. Stok rhIFNα-2b tanpa perlakuan digunakan sebagai kontrol. Kultur kemudian diinkubasi 5 hari. Kultur selanjutnya dicuci dengan 100 µL PBS. Media komplit 100 µL yang mengandung 5 mg/mL MTT (Invitrogen, USA) ditambahkan pada tiap sumuran. Kultur selanjutnya diinkubasi 3 jam. Penghentian reaksi dilakukan dengan penambahan 100 µl SDS 10% dalam 0.01 M HCl (Merck, Jerman) pada tiap sumuran lalu suspensi diinkubasi selama semalam (Ningrum et al. 2015). Formazan yang terlarut diukur pada panjang gelombang 570 nm.
Nilai viabilitas sel dan persentase penghambatan dihitung dengan menggunakan rumus sebagai berikut:
Viabilitas Sel (%) = rata-rata absorbansi sel uji - rata-rata absorbansi blanko x 100% rata-rata absorbansi kontrol negatif - rata-rata absorbansi blanko
Persentase Penghambatan (%) = 100% - Viabilitas Sel (%)
Analisis Statistik
Analisis ragam (analysis of variance) data pengujian aktivitas anti proliferasi pada semua perlakuan diolah menggunakan aplikasi SPSS versi 21.
4
HASIL DAN PEMBAHASAN
Overproduksi rhIFNα-2b pada P. pastoris
Proses overproduksi rhIFNα-2b menggunakan sistem ekspresi P. pastoris terdiri atas dua tahapan utama yaitu diawali dengan peningkatan biomassa P. pastoris kemudian dilanjutkan dengan sistem induksi ekspresi rhIFN-αβb. Peningkatan biomassa P. pastoris dilakukan pada media BMGY. Sumber karbon utama pada media tersebut adalah gliserol. Gliserol merupakan sumber karbon yang bersifat represi terhadap kerja promoter aox1 yang meregulasi proses ekspresi protein, sehingga aliran karbon akan terakumulasi untuk peningkatan biomassa saja (Cereghino & Cregg 2000; Fickers 2014).
13 tinggi (Kim et al. 2009). P. pastoris sangat responsif terhadap metanol namun sensitif pada konsentrasi tinggi. Konsentrasi metanol yang tinggi bersifat toksik dan menghambat pertumbuhan P. pastoris sedangkan konsentrasi metanol yang rendah tidak mampu menginisiasi proses transkripsi (Poutou-Pinales et al. 2010), sehingga regulasi penambahan metanol ke dalam media ekspresi menentukan efisiensi produksi protein rekombinan. Herawati et al. (2014) menyebutkan bahwa metanol dengan konsentrasi 2% merupakan konsentrasi terbaik untuk menginduksi overproduksi rhIFNα-2b pada P. pastoris X-33.
Sistem induksi pada proses overproduksi rhIFNα-2b berkaitan dengan biosintesis enzim alcohol oxidase (AOX) di dalam sel P. pastoris. P. pastoris memproduksi AOX sebagai respon terhadap keberadaan metanol pada media pertumbuhan. AOX merupakan enzim pertama yang bekerja pada jalur oksidasi metanol (Jin et al. 2011). Metanol tidak hanya sebagai sumber karbon dan energi namun juga bertindak sebagai induser kerja dari promoter aox1. Keberadaan metanol dalam media pertumbuhan menyebabkan akumulasi enzim AOX meningkat (Cos et al. 2006). Kerangka baca terbuka gen pengkode hIFNα-2b diletakkan pada sisi downstream dari promoter aox1 sehingga dapat mengekspresikan rhIFNα-2b dengan yield yang meningkat.
Ekspresi rhIFNα-2b pada sel P. pastoris menggunakan promoter aox1 (Ningrum et al. 2013). Promoter aox1 dipakai sebagai regulator dalam proses ekspresi rhIFNα-2b karena memiliki beberapa kelebihan. Penggunaan promoter aox1 menunjukkan tingkat ekspresi protein rekombinan dalam jumlah yang tinggi. Promoter aox1 merupakan promoter indusibel yang mudah diregulasi melalui sistem induksi metanol (Hartner et al. 2008). Metanol adalah induser dengan struktur kimia sederhana dan mudah dimetabolisme oleh P. pastoris. Selain itu metanol merupakan induser yang relatif murah. Beberapa promoter alternatif telah digunakan dalam sistem ekspresi protein rekombinan yang diproduksi pada P. pastoris, misalnya promoter gap, fld1, pex8 dan ypt1. Promoter gap merupakan promoter konstitutif yang meregulasi secara kontinu ekspresi protein rekombinan. Pada kasus tertentu promoter gap bukan merupakan pilihan yang tepat terutama ketika memproduksi protein rekombinan yang bersifat toksin bagi P. pastoris. Promoter fld1, pex8 dan ypt1 merupakan promoter indusibel yang memerlukan induser lebih kompleks dibandingkan dengan promoter aox (Cereghino & Cregg 2000).
P. pastoris mampu mengekspresikan protein secara intraseluler maupun ekstraseluler. Ekspresi rhIFNα-2b pada penelitian ini terjadi secara ekstraseluler. Hal ini karena pada sekuen asam amino rhIFNα-2b terdapat sinyal peptida faktor α-prepo yang mengarahkan rhIFNα-2b disekresikan keluar sel P. pastoris (Ningrum et al. 2013). Beberapa penelitian memakai sinyal peptida yang berbeda untuk mensekresikan protein rekombinan ke luar sel P. pastoris. Ghosalkar et al. (β008) menyebutkan bahwa faktor α-prepo merupakan sinyal peptida yang efisien membantu sekresi rhIFNα-2b keluar sel P. pastoris.
14
rhIFNα-2b adalah O-glikosilasi pada treonin di posisi ke-106 (Ningrum et al. 2013). Kemampuan P. pastoris membentuk O-glikosilasi dapat meningkatkan waktu paruh aktivitas rhIFN-αβb. Berbeda dengan sistem ekspresi lain yang memiliki kekurangan dalam pembentukan pola glikosilasi, misalnya pada E. coli dan S. cerevisiae. Sistem ekspresi E. coli tidak mampu membentuk pola glikosilasi sehingga menyebabkan waktu paruh aktivitas protein terapeutik menjadi lebih singkat. S. sereviceae mengekspresikan protein rekombinan dengan pola hiperglikosilasi. Hal ini dapat memacu efek imunogenik yang berlebihan (Cereghino & Cregg 2000). Macauley-Patrick et al. (2005) juga menyebutkan bahwa sistem eskpresi P. pastoris telah sukses memproduksi protein dengan pola ikatan disulfida. Pola ikatan disulfida rhIFNα-2b terjadi pada sistein 29 ke sistein 138 dan sistein 1 ke sistein 98 (Bae et al. 1995). Ikatan disulfida pada sistein 29 ke sistein 138 penting untuk aktivitas biologi rhIFN-αβb, sedangkan ikatan pada sistein 1 ke sistein 98 tidak berpengaruh pada aktivitas biologinya (Morehead et al. 1984).
Filtrasi, Purifikasi dan Kuantifikasi rhIFN-α2b
Filtrasi supernatan bebas sel dilakukan menggunakan prinsip kerja Tangensial Flow Filtration (TFF). Supernatan digerakkan oleh pompa peristaltik melewati membran filter 5 MWCO. Sampel yang dapat melewati membran filter (disebut fraksi filtrate) merupakan protein dan senyawa lain dengan bobot molekul dibawah ukuran 5 MWCO, sedangkan protein yang tidak lolos dan tertampung dalam kontainer (disebut fraksi retentate) merupakan sampel yang mengandung protein dan senyawa lain dengan bobot molekul diatas ukuran 5 MWCO sehingga supernatan semakin pekat. Fraksi retentate kemudian dipurifikasi menggunakan kolom Ni-NTA yang berbasis interaksi antara ion nikel dengan polihistidin tag yang ada pada ujung C-terminal rhIFN-αβb. Sejumlah histidin bertindak sebagai donor elektron dan dapat berikatan dengan ion logam seperti ion tembaga, nikel, seng dan kobalt. Metode purifikasi ini disebut sebagai Metal-Chelate Affinity Chromatography atau Immobilized Metal Affinity Chromatography (Porath 1988).
15 menghasilkan yield 200 mg/L (Loigon et al 2008) dan sel myeloma NSo menghasilkan yield 120 mg/L (Rossmann et al. 1996), namun sistem ekspresi sel mamalia memerlukan biaya produksi yang mahal, waktu produksi yang lama serta kesulitan pada proses scale up dan purifikasi protein (Li et al. 2012).
Karakterisasi rhIFN-α2b
Analisis profil protein supernatan bebas sel menunjukkan beberapa pita protein dengan bobot molekul yang berbeda-beda (Gambar 4 A). Pita protein yang nampak tersebut merupakan protein-protein yang disekresikan P. pastoris selama proses overproduksi berlangsung. Karakterisasi bobot molekul protein hasil filtrasi dan purifikasi dilakukan dengan analisis SDS-PAGE dan Western Blot. Hasil karakterisasi tersebut menujukkan bahwa rhIFNα-2b memiliki bobot molekul sekitar 24 kDa (Gambar 4 B dan 4 C) sedangkan bobot molekul native hIFNα-2b adalah 21.5 kDa. Perbedaan bobot molekul tersebut disebabkan karena tambahan fragmen His-tag dan epitop c-myc yang terletak pada ujung C-terminal rhIFNα-2b (Ningrum et al. 2013). Fragmen His-tag membantu proses purifikasi fusi protein rekombinan pada resin pengikat yang mengandung logam. Fragmen epitop c-myc membantu proses deteksi fusi protein rekombinan spesifik dengan menggunakan antibodi Anti-myc atau antibodi Anti-myc-HRP (Invitrogen 2001).
Gambar 4. Visualisasi (A) SDS-PAGE supernatan bebas sel, (B) SDS-PAGE supernatan hasil filtrasi dan purifikasi (C) Western Blot supernatan hasil filtrasi dan purifikasi menggunakan antibodi anti interferon-α mouse; M = marka standar protein (Thermo Scientific, USA).
16
CDLPQTHSLGSRRTLMLLAQMRKISLFSCLKDRHDFGFPQEEF
GNQFQKAETIVLHEMIQQIFNLFSTKDSSAAWDETLLDKFYTE
LYQQLNDLEACVIQGVGVTETPLMKEDSILAVRKYFQRITLYL
KEKKYSPCAWEVVRAEIMRSFSLSTNLQESLRSKE
Gambar 5. Hasil penentuan sekuen asam amino rhIFNα-2b menggunakan analisis MALDI-TOF/ TOF spektrometri massa (Proteomic International, Australia).
Uji Stabilitas rhIFN-α2b
Uji stabilitas dilakukan untuk mengetahui rentang suhu, pH dan lama penyimpanan yang memungkinkan rhIFNα-2b pada keadaan stabil. Kondisi stres lingkungan, misalnya kenaikan suhu, variasi pH dan lama penyimpanan dapat memberikan informasi mengenai stabilitas suatu produk biofarmasetika (Diress et al. 2010). Kestabilan rhIFNα-2b dievaluasi berdasarkan profil protein dan aktifitas anti proliferasinya terhadap sel MCF-7. Analisis profil protein pada penelitian ini berbasis SDS-PAGE non reducing. Kondisi non reducing dinilai lebih representatif dalam menunjukkan laju aggregasi dan degradasi suatu protein. Ruiz et al. (2006) juga menyebutkan bahwa penentuan laju aggregasi rhIFNα-2b dibawah kondisi reducing lebih rendah dibandingkan dengan kondisi non reducing.
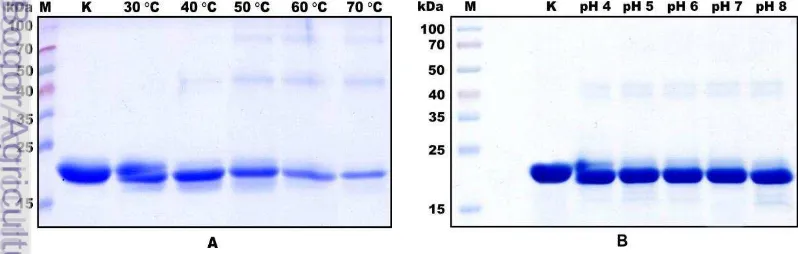
Gambar 6 A menunjukkan bahwa jika dibandingkan dengan kontrol, profil rhIFNα-2b pada kondisi suhu inkubasi 40 °C, 50 °C, 60 °C dan 70 °C terlihat mengalami aggregasi. Kenaikan suhu dapat menyebabkan protein dalam kondisi unfolding sehingga gugus hidrofobiknya terbuka bebas dan berinteraksi dengan lingkungan sekitar. Kondisi tersebut dapat memacu terbentuknya aggregat-aggregat protein (Diress et al. 2010). Wang et al. (2010) juga menyebutkan bahwa terbentuknya aggregat protein pada kondisi kenaikan suhu karena adanya peningkatan tumbukan dan interaksi antara gugus-gugus hidrofobik suatu protein. Gambar 6 A juga menunjukkan bahwa profil rhIFNα-2b pada suhu inkubasi 30 °C terlihat mengalami degradasi. Hal ini dapat terjadi karena aktifitas protease yang memutus sekuen asam amino. Protease tersebut kemungkinan merupakan native protease yang disekresikan P. pastoris, misalnya aminopeptidase yang aktif pada suhu 25 °C sampai 30 °C (Sinha et al. 2004). Degradasi dapat terjadi ketika aminopeptidase yang disekresikan P.pastoris bercampur bersama rhIFNα-2b pada media ekspresi. Adanya aggregasi dan degradasi pada kondisi kenaikan suhu didukung dengan analisis software Image J (Gambar 7 A). Grafik tersebut menunjukkan bahwa terjadi penurunan luas area pita utama rhIFNα-2b pada kondisi kenaikan suhu jika dibandingkan dengan kontrol. Hasil analisis software Image J mengindikasikan bahwa kenaikan suhu dapat mempengaruhi stabilitas rhIFN-αβb.
17 memiliki kemiripan sifat fisikokimia dan karekteristik afinitas dengan suatu protein rekombinan sehingga menjadi kontaminan (Macauley-Patrick et al. 2005). P. pastoris dapat menghasilkan beberapa jenis protease, diantaranya adalah proteinase A, proteinase B, karboksil peptidasedan amino peptidase (Sinha et al., 2004). Degradasi rhIFNα-2b pada pH 4, 5 dan 6 dapat disebabkan karena aktivitas acidic protease yang aktif pada pH asam, misalnya proteinase A. Degradasi rhIFNα-2b pada pH 8 dapat disebabkan karena aktivitas alkaline protease yang aktif bekerja pada pH basa, misalnya proteinase B (Zhang et al. 2007). Kedua jenis protease tersebut juga disekresikan oleh P. pastoris ke media ekspresi dan bercampur dengan rhIFN-αβb. Hal ini dapat memungkinkan terjadinya degradasi rhIFNα-2b akibat adanya aktivitas protease tersebut.
Aggregasi dapat terjadi karena pengaruh sistem dapar yang digunakan pada proses preservasi protein (Ruiz et al. 2006). Kestabilan protein terjadi ketika muatan negatif pada sistem dapar berinteraksi dengan kelompok asam amino bermuatan positif, begitu juga sebaliknya. Dapar sodium fosfat mengandung ion-ion fosfat bermuatan negatif yang seharusnya dapat menstabilkan konformasi rhIFN-αβb. Hasil penelitian ini menunjukkan bahwa jika dibandingkan dengan kontrol, profil rhIFNα-2b pada kondisi pH yang bervariasi terlihat mengalami aggregasi (Gambar 6 B). Hal ini dapat disebabkan karena kontaminasi ion-ion metal (Fe2+, Ca2+, Cu2+, Mg2+ dan Zn2+) dari dapar garam yang dipakai sebagai eluate buffer pada proses purifikasi protein. Ion-ion metal dapat memacu terbentuknya reducing agent. Ion metal, oksigen bersama reducing agent dapat membentuk Reactive Oxygen Species (ROS) yang memacu terjadinya oksidasi protein. Oksidasi protein terutama terjadi pada residu labil asam amino, misalnya sistein, histidin, triptofan, tirosin, prolin, arginin, lisin dan treonin (Wang 1999; Ruiz et al. 2006). Reaksi oksidasi dapat menyebabkan perubahan konformasi protein, misalnya pemutusan ikatan disulfida antar asam amino sistein. Kondisi ini menyebabkan konformasi protein menjadi tidak stabil dan cenderung membentuk aggregat protein (Hermeling et al. 2006). Analisis software Image J digunakan untuk mengkonfirmasi adanya aggregasi dan degradasi pada kondisi pH yang bervariasi (Gambar 7 B). Grafik tersebut menunjukkan bahwa terjadi penurunan luas area pita utama rhIFNα-2b pada kondisi pH yang bervariasi jika dibandingkan dengan kontrol. Hasil analisis software Image J mengindikasikan bahwa kontaminasi ion logam pada sistem dapar fosfat dan adanya aktivitas protease mempengaruhi stabilitas rhIFN-αβb.
18
Gambar 7. Analisis luas area pita utama rhIFNα-2b menggunakan software Image J pada kondisi; (A) kenaikan suhu; (B) variasi pH; K = kontrol.
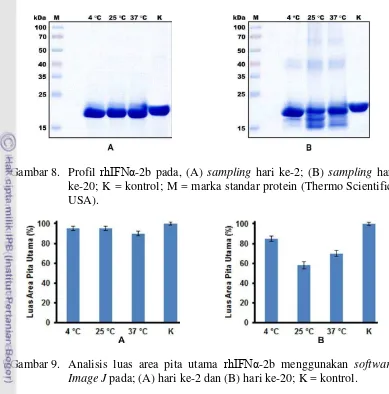
Periode uji lama penyimpanan dilakukan selama 20 hari mengacu pada waktu paruh aktivitas IFN-α yaitu selama 19 hari (Ruiz et al. 2006). Suhu 4 °C, 25 °C dan 37 °C dipakai pada uji stabilitas rhIFNα-2b terhadap lama penyimpanan. Hal ini dilakukan untuk mengetahui kondisi rhIFNα-2b selama periode penyimpanan pada beberapa suhu yang umumnya dipakai dalam proses preservasi dan formulasi protein terapeutik. Suhu penyimpanan yang tepat sangat penting untuk menjaga stabilitas formulasi protein terapeutik selama periode penyimpanan (Ruiz et al. 2006).
19
Gambar 8. Profil rhIFNα-2b pada, (A) sampling hari ke-2; (B) sampling hari ke-20; K = kontrol; M = marka standar protein (Thermo Scientific, USA).
Gambar 9. Analisis luas area pita utama rhIFNα-2b menggunakan software Image J pada; (A) hari ke-2 dan (B) hari ke-20; K = kontrol.
Uji Aktifitas Anti Proliferasi rhIFNα-2b pada Sel MCF-7
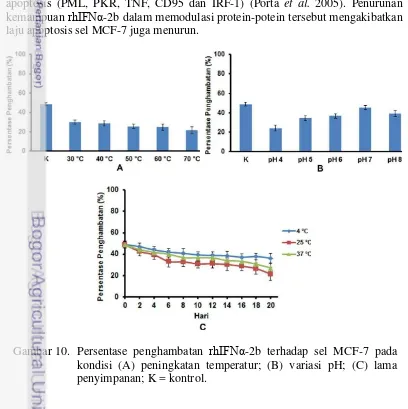
Fraksi-fraksi protein hasil pengujian pada parameter kenaikan suhu, variasi pH dan kondisi lama penyimpanan kemudian diuji aktivitasnya terhadap proliferasi sel MCF-7. MCF-7 dipilih sebagai model uji invitro karena IFN-α bersifat responsif dalam menghambat proliferasi sel MCF-7 (Lindner & Borden 1997). Uji aktifitas anti proliferasi rhIFNα-2b pada penelitian ini menggunakan tamoxifen, yaitu obat anti kanker yang bekerja secara sinergis bersama dengan rhIFNα-2b sebagai agen anti proliferasi sel kanker (Jonash & Haluska 2001). Ningrum et al. (2015) menyebutkan bahwa titik Inhibitory Consentration 50% (IC50) dicapai ketika 1 µM tamoxifen dikombinasikan dengan 4 µg/mL rhIFNα -2b pada pengujian antiproliferasi sel MCF-7.
20
dari titik IC50 pada kondisi pH yang bervariasi (Gambar 10 B). Hal ini juga menandakan bahwa aktifitas anti proliferasi rhIFNα-2b tehadap sel MCF-7 menurun, terutama pada pH asam dan basa. Persentase penghambatan terhadap sel MCF-7 semakin menurun dari titik IC50 selama pengujian lama penyimpanan atau aktifitas anti proliferasi rhIFNα-2b terhadap sel MCF-7 semakin menurun (Gambar 10 C). Aktifitas anti proliferasi yang stabil dicapai pada suhu penyimpanan 4 °C. Laju aggregasi dan degradasi protein pada suhu 4 °C berjalan lebih lambat dibandingkan pada suhu 25 °C dan 37 °C. Hasil ini menunjukkan bahwa aggregasi dan degradasi protein telah menurunkan aktifitas anti proliferasi rhIFNα-2b terhadap sel MCF-7.
Sisi aktif dan konformasi rhIFNα-2b bersifat unik dan mudah mengalami perubahan selama preparasi, formulasi dan penyimpanan (Ruiz et al. 2006). Fenomena aggregasi dan degradasi dapat menurunkan jumlah rhIFNα-2b yang aktif. Sejumlah rhIFNα-2b yang tidak aktif diduga karena mengalami perubahan pada sisi aktif dan konformasi rhIFNα-2b akibat adanya aggregasi dan degradasi. Ikatan disulfida merupakan karakteristik khusus yang berperan penting pada sisi aktif dan aktifitas biologis rhIFNα-2b (Diress et al. 2010). Perubahan formasi ikatan disulfida pada sisi aktif dan perubahan konformasi protein menyebabkan penurunan kemampuan biologis rhIFN-αβb, misalnya kemampuan rhIFNα-2b memodulasi pembentukan protein-protein yang berperan dalam mediasi terjadinya apoptosis (PML, PKR, TNF, CD95 dan IRF-1) (Porta et al. 2005). Penurunan kemampuan rhIFNα-2b dalam memodulasi protein-potein tersebut mengakibatkan laju apoptosis sel MCF-7 juga menurun.
21
5 SIMPULAN DAN SARAN
Simpulan
Kondisi kenaikan suhu, variasi pH dan lama penyimpanan memacu terjadinya aggregasi dan degradasi rhIFN-αβb. Aggregasi dan degradasi protein dapat menurunkan aktifitas anti proliferasi rhIFNα-2b terhadap sel MCF-7. Kondisi stabil dicapai pada suhu 4 °C, pH 7 selama 2 hari waktu inkubasi.
Saran
Perlu adanya penelitian lebih lanjut dalam hal konformasi protein dan analisis ekspresi gen.
DAFTAR PUSTAKA
Bae Tae-Ok, Chang Ho-Jin, Kim JH, Park SJ. 1995. Purification and characterization of recombinant human interferon alpha 2a produced from Saccharomyces cerevisiae. J Biochem Mol Biol. 28(6): 477-483.
Balamurugan V, Reddy GR, Suryanarayana VVS. 2007. P. pastoris: a notable heterologous expression system for the production of foreign proteins-vaccines. Indian J Biotechnol. 6: 175-186.
Barr SD, Smiley JR, Bushman FD. 2008. The interferon response inhibit HIV particle production by induction of TRIM22. PLoS Pathogen. 4(2): 1-11.
Bertolotti-Ciarlet A, Wang W, Lownes R, Pristatsky P, Fang Y, McKelvey T. 2009. Impact of methionine oxidation on the binding of human IgG1 to
FcRn and Fcy receptors. Mol Immunol. 46: 1878–82.
Brannigan JA, Wilkinson AJ. 2002. Protein engineering 20 years on. Nature Rev. Mol. Cell Biol. 3: 964–970.
Brown A, Hughes M, Tenner S, Banks PA. 1997. Does pancreatic enzyme supplementation reduce pain in patients with chronic pancreatitis: a metaanalysis. Am. J. Gastroenterol. 92: 2032–2035.
Ceaglio N, Etcheverrigaray M, Conradt HS, Grammel N, Kratje R, Oggero M. 2010. Highly glycosylated Human alpha Interferon: an isight into a new therapeutic candidate. J Biotech. 146: 74-83.
Cereghino JL, Cregg JM. 2000. Heterologous protein expression in methylotrophic yeast Pichia pastoris. FEMS Microbiol Rev. 24: 45-66. Cherbi-Alix, MK, Wietzerbin J. 2007. Interferon, a growing cytokine: 50 years of
interferon research. Biochimie. 89: 713-718.
22
Cos O, Ramon R, Montesinos JL and Valero F. 2006. Operational strategies, monitoring and control of heterologous protein production in the methylotropic yeast Pichia pastoris under different promoters: a review. Microbial Cell Factories. 5: 17.
Cregg JM, Cereghino L, Shi J, Higgins DR. 2000. Recombinant protein expression in Pichia pastoris. Biotechnol. 11: 905-910.
Davies MJ. 2005. The oxidative environment and protein damage. Biochim
Biophys Acta. 1703: 93–109.
Dimitrov DS. 2012. Therapeutic Protein: Method and Protocols, Methods in Molecular Biology. Springer Sciences. 889: 1-26.
Dingermann T. 2008. Recombinant therapeutic proteins: production and challenges. J Biotechnology. 3: 90-97.
Diress A, Lorbetskie B, Larocque L, Li X, Alteen M, Isbrucker R, Girard M. 2010. Study of aggregation, denaturation and reduction of interferon alpha-2 products by size-exclusion high-performance liquid chromatography with fluorescence detection and biological assays. J Chromatograph A. 1217: 3297-3306.
Dirksen A. 1999. A randomized clinical trial of α (1)-antitrypsin augmentation therapy. Am. J. Respir.Crit. Care Med. 160: 1468–1472.
Egelhofer V, Gobom J, Seitz H, Giavalisco P, Lehrach H, Nordhoff E. 2002. Protein identification by MALDI-TOF-MS peptide mapping: a new strategy. Analytical Chemistry. 74: 1760-1771.
Fickers P. 2014. Pichia pastoris: a workhorse for recombinant protein production. Curr Res Microbiol Biotechnol. 2(3): 354-363.
Gao B, Hong F, and S, Radaeva. 2004. Host factors and failure of interferon-α treatment in hepatitis C virus. Hepatology. 39(4): 880-890.
Ghosalkar A, Sahai V, Srivastava A. 2008. Secretory expression of interferon-alpha 2b in recombinant P. pastoris using three different secretion signals. Protein Expression and Purification. 60: 103-109.
Gow P, Mutimer DJ. 2001. Treatment of chronic hepatitis. Biomedical J. 323: 1164-1167.
Gunther RA, Kalsner I, Ahorn H, Fogy IM dan Cantell K. 1991. Natural human interferon-αβ is O-glycosylated. J Biochem. 276: 511-518.
Hartner FS, Ruth C, Langenegger D, Johnson SN, Hyka P, Lin-Cereghino GP, Lin-Cereghino J, Kovar K, Cregg JM, Glieder A. 2008. Promoter library designed for fine-tuned gene expression in Pichia pastoris. Nucleic Acid Res. 36(12): 1-15.
Herawati N, Santoso A, Ningrum RA. 2014. The effect of non-nutritional factors of culture condition on human interferon alpha-2b production in methilotropic yeast Pichia pastoris. Journal Pharmaceutical and Bioanalysis Science. 3(1): 1-5.
Hermeling S, Schellekens H, Maas C, Gebbink MFBG, Crommelin DJA, Jiskoot W. 2006. Antibody response to aggregated human interferon alpha 2b in wild-type and transgenic immune tolerant mice depends on type and level of aggregation. Journal of Pharmaceutical Sciences. 95(5): 1084-1096.
23 Honda K, Yanai H, Takaoka A, Taniguchi T. 2005. Regulation of the type 1 IFN
induction: a current view. Int Imunology. 17(11): 1367-1378.
Invitrogen. 2001. Easy selectTM pichia expression kit: user manual. Carlsbad (CA USA): Corporate Headquarters.
Jin H, Liu G, Dai K, Wang H. 2011. Improvement of porcine interferon-α production by recombinant Pichia pastoris via induction at low methanol concentration and low temperature. Applied Biochemistry and Biotechnology. 165 (2): 559-571.
Jonasch E, Halusca FG. 2001. Interferon in oncological practice, review of interferon biology, clinical application and toxicities. The Oncologist. 6: 34-55.
Kim SJ, Lee JA, Kim YH, Song BH. 2009. Optimization of the fungtional expression of Coprinus cinereus peroxidase in Pichia pastoris by varying the host and promoter. J Microbiol Biotechnol. 19: 966-971.
Klaus W, Gsell B, Labhardt AM, Wipf B and Senn H. 1997. The Threedimensional High Resolution Structure of Human Interferon α-2a Determined by Heteronuclear NMR Spectroscopy in solution. J Mol Biol. 274: 661-675.
Kobayashi K, Kuwae S, Ohya T, Ohda O, Ohyama M, Ohi H, Tomomitsu K, Ohmura T. 2000. High-level expression of recombinant human serum albumin from the methylotrophic yeast Pichia pastoris with minimal protease production and activation. J. Bioscience and Bioengineering. 89(1): 55-61.
Kontsek P, Kontsekova E. 1997. Forty years of Interferon. Octa virologica. 41: 349-353.
Krainer FW, Dietzsch C, Hajek T, Herwig C, Spadiut O, Glieder A. 2012. Recombinant protein expression in Pichia pastoris strains with an engineered methanol utilization pathway. Microbial Cell Factories. 11: 22. Lawn RM, Gross CM, Houck AE, Franke PV, Gray, Goeddel DV. 1981. DNA
Sequence of a Major Human Leukocyte Interferon Gene. Proc Natl Acad Sci USA.78: 5435-5439.
Leader B, Baca QJ, Galan DE. 2008. Protein therapeutics: a summary and pharmacological classification. Perspectives. 7: 21-39.
Lee N, Ni D, Brissette R, Chou M, Hussain M, Gill DS, Liao Mei-June, and Testa D. 1995. Interferon-alpha 2 variants in the human genome. Journal of Interferon and Cytokine Research. 15: 341-349.
Li P, Anumanthan A, Gao X, Ilangovan K, Suzara VV, Duzgunes N, Renugopalakrishnan V. 2007. Expression of recombinant proteins in Pichia pastoris. Appl Biochem Biotechnol. 142: 105-124.
Li H, D’Anjou. β009. Pharmacological significance of glycocylation in therapeutic proteins. Current Opinion in Biotechnology. 20: 678-684.
Li H, Liu Q, Cui K, Liu J, Ren Y, Shi D. 2012. Expression of biologically active human interferon alpha 2b in the milk of transgenic mice. Transgenic Research. 22(1): 168-178.
24
Loigon M, Perret S, Kelly J, Boulais D, Cass B, Bisson L, Afkhamizarreh F, Durocher Y. 2008. Stable high volumetric production of glycosylated human recombinant IFN alpha-2b in HEK293 cells. BMC Biotechnology. 8: 65.
Macauley-Patrick S, Fazenda ML, McNeil B, Harvey LM. 2005. Heterologous protein production using the Pichia pastoris expression system. Yeast. 22: 249-270.
Manning MC, Chou DK, Murphy BM, Payne RW, Katamaya DS. 2010. Stability of protein pharmaceuticals. Pharmaceutical Research. 27(4): 544-575. Meager A. 2006. The Interferons. Characterization and Aplication. Germany:
Wiley-VCH.
Morehead H, Johnston PD, Wetzel R. 1984. Roles of the 29-138 disulfide bond of subtype A of human alpha interferon in its antiviral activity and conformational stability. Biochemistry. 23: 2500-2507.
Morrow KJ. 2010. Therapeutic Protein Production: A Changing Landscape. London: Cambridge Healthtech Institution.
Ningrum RA, Santoso A, Herawati N. 2013. Secretory expression of recombinant human interferon-alpha2b in methilotropic yeast Pichia pastoris. Int. J. Res. in Pharm. Sci. 4(2): 207-210.
Ningrum RA. 2014. Human interferon alpha-2b: a therapeutic protein for cancer treatment. Scientifica.Artikel ID: 970315.
Ningrum RA, Wisnuwardhani PH, Santoso A, Herawati N. 2015. Antiproliferative actifity of recombinant human interferon alpha-2b on estrogen positive human breast cancer MCF-7 cell line. Indonesian Journal of Pharmacy. 26(2): 86-93.
Patel TB, Pequignot E, Parker SH, Leavitt M, Greenberg HE, Kraf WK. 2007. Transgenic avian-derived recombinant human interferon-alpha2b (AVI-005) in healthy subjects: an open-label, single-dose, controlled study. Int. J. Cli. Pharm. Ther. 45: 161-168.
Pimienta E, Fando R, Sanchez JC, Vallin C. 2002. Secretion of human interferon alpha 2b by Streptomyces lividans. Appl Microbiol Biotechnol. 58: 198-194. Porath J. 1988. Immobilized metal ion affinity based chromatography. Trens Anal
Chem. 7(7): 254-259.
Porta C, Hadj-Slimane R, Nejmeddine M, Pampin M, Tovey MG, Espert L, Alvarez S, Chelbi-Alix MK. 2005. Interferons α and induce p5γ -dependent and p53-in-dependent apoptosis, respectively. Oncogene. 24: 605-615.
Poutou-Pinales RA, Cordoba-Ruiz HA, Barrera-Avellaneda LA, Delgado-Boada JM. 2010. Carbon source feeding strategies for recombinant protein expression in Pichia pastoris and Pichia methanolica. African J Biotechnol. 9(15): 2173-2184.
Rader RA. 2008. (Re) definiting Biopharmaceutical. Commentary. Nature Biotechnology. 26: 743-751.